 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2012, Lebensmittel EU, Bund
 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2012, Lebensmittel EU, Bund |
Durchführungsbeschluss 2012/726/EU der Kommission vom 22. November 2012 zur Genehmigung des Inverkehrbringens von Dihydrocapsiat als neuartige Lebensmittelzutat im Sinne der Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates
(Bekanntgegeben unter Aktenzeichen C(2012) 8391)
(Nur der englische Text ist verbindlich)
(ABl. Nr. L 327 vom 27.11.2012 S. 49)
Liste über neuartige Lebensmittel /neuartige Lebensmittelzutaten
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates vom 27. Januar 1997 über neuartige Lebensmittel und neuartige Lebensmittelzutaten 1, insbesondere auf Artikel 7,
in Erwägung nachstehender Gründe:
(1) Am 6. August 2010 stellte das Unternehmen Ajinomoto Co. Inc., Japan, bei den zuständigen Behörden des Vereinigten Königreichs einen Antrag auf Genehmigung des Inverkehrbringens von Dihydrocapsiat als neuartige Lebensmittelzutat.
(2) Am 10. März 2011 legte die zuständige Lebensmittelprüfstelle des Vereinigten Königreichs ihren Bericht über die Erstprüfung vor. In diesem Bericht kam sie zu dem Schluss, dass Dihydrocapsiat kein Gesundheitsrisiko für Verbraucher darstellt.
(3) Die Kommission leitete den Bericht über die Erstprüfung am 13. April 2011 an alle Mitgliedstaaten weiter.
(4) Innerhalb der in Artikel 6 Absatz 4 der Verordnung (EG) Nr. 258/97 festgelegten Frist von 60 Tagen wurden begründete Einwände erhoben.
(5) Deshalb wurde am 9. November 2011 die Europäische Behörde für Lebensmittelsicherheit (EFSA) konsultiert.
(6) Am 28. Juni 2012 zog die EFSa in ihrem wissenschaftlichen Gutachten zu Dihydrocapsiat ("Scientific Opinion on Dihydrocapsiate") 2 den Schluss, dass Dihydrocapsiat unter den beantragten Verwendungsbedingungen und in den beantragten Verwendungsmengen sicher ist.
(7) Dihydrocapsiat erfüllt die in Artikel 3 Absatz 1 der Verordnung (EG) Nr. 258/97 festgelegten Kriterien.
(8) Die in diesem Beschluss vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit
- hat folgenden Beschluss erlassen:
Dihydrocapsiat gemäß den Spezifikationen in Anhang I darf für die in Anhang II genannten Verwendungen und bis zu den dort aufgeführten Höchstmengen und unbeschadet der Bestimmungen der Verordnung (EG) Nr. 1925/2006 des Europäischen Parlaments und des Rates 3, der Richtlinie 2009/39/EG des Europäischen Parlaments und des Rates 4 und der Richtlinie 2009/54/EG des Europäischen Parlaments und des Rates 5 als neuartige Lebensmittelzutat in Verkehr gebracht werden.
Die Bezeichnung in der Kennzeichnung der Lebensmittel, die gemäß diesem Beschluss zugelassenes Dihydrocapsiat enthalten, lautet "Dihydrocapsiat".
Dieser Beschluss ist an das Unternehmen Ajinomoto Co. Inc., 15-1, Kyobashi, Chuoku, 1-choume, 104-8315, Tokyo, Japan, gerichtet.
Brüssel, den 22. November 2012
2) EFSa Journal 2012;10(7):2812.
3) ABl. Nr. L 404 vom 30.12.2006 S. 26.
4) ABl. Nr. L 124 vom 20.05.2009 S. 21.
5) ABl. Nr. L 164 vom 26.06.2009 S. 45.
| Spezifikationen von Dihydrocapsiat | Anhang I |
Begriffsbestimmung
Dihydrocapsiat wird durch enzymkatalysierte Veresterung von Vanillylalkohol und 8-Methylnonansäure hergestellt. Nach der Veresterung wird Dihydrocapsiat mit n-Hexan extrahiert.
Das Enzym Lipozyme 435 wurde von der dänischen Veterinär- und Lebensmittelbehörde zugelassen.
Beschreibung: Viskose, farblose bis gelbe Flüssigkeit
Chemische Formel: C18H28O4
Strukturformel:
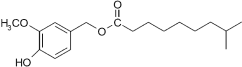
CAS-Nr.: 205687-03-2
Physikalisch-chemische Eigenschaften von Dihydrocapsiat
| Dihydrocapsiat | mehr als 94 % |
| 8-Methylnonansäure | weniger als 6 % |
| Vanillylalkohol | weniger als 1 % |
| Synthesebedingte Stoffe | weniger als 2 % |
| Verwendung von Dihydrocapsiat | Anhang II |
| Lebensmittelkategorie | Verwendungshöchstmengen |
| Getreideriegel | 9 mg/100 g |
| Kekse und Kräcker | 9 mg/100 g |
| Knabberartikel auf Reisbasis | 12 mg/100 g |
(Stand: 11.03.2019)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: 90.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion