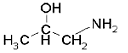
| zurück |
Begründung zu 1-Aminopropan-2-ol (MIPA)
(CAS-Nr.: 78-96-6)
Ausgabe: Januar 2006 zuletzt geändert und ergänzt: März 2007
Stand: August 2006
Zur Frage eines Kurzzeitwerts für
1-Aminopropan-2-ol (MIPA)
MIPa muss als lokaler Reizstoff betrachtet werden. Bei lokal wirkenden Stoffen ist üblicherweise ein Überschreitungsfaktor von 2 vorzusehen. Zudem zeigt eine vergleichende Betrachtung mit anderen Aminen, dass für diese in der Regel ebenfalls ein Überschreitungsfaktor von 2 berücksichtigt ist, jedoch meist als Momentanwert (vgl. Tabelle unten). Angesichts des niedrigen AGW (2 ppm im Vergleich zu 2-5 ppm bei den meisten anderen Aminen) und da keine stoffspezifischen einschränkenden Informationen vorliegen, ist für MIPa keine Eingrenzung auf einen Momentanwert erforderlich.
Folglich ist für MIPA
ein Überschreitungsfaktor 2 (I)
vorzusehen.
| TRGS 900 (2006) | Überschreitungsfaktoren / Spitzenbegrenzungen | |
| 2-Aminopropan | 5 ppm | =2=(I) |
| Dimethylamin | 2 ppm | 2(I) |
| Methylamin | 10 ppm | =1=(I) |
| Diethylamin | 5 ppm | =2=(I) |
| Ethylamin | 5 ppm | =2=(I) |
| 1 -Ami nopropan-2-ol | 2 ppm | 2(I) vorgeschlagen (August 2006) |
1 Zusammenfassung
Gegenstand des vorliegenden Gutachtens ist die Ableitung eines Arbeitsplatzrichtwerts (ARW) für 1-Aminopropan-2-ol (Monoisopropanolamin, MIPA).
MIPa dient als Korrosionsinhibitor in Kühlschmierstoffen und als Emulgatorkomponente in der Kosmetik, außerdem als Neutralisationsmittel ebenfalls in der Kosmetik sowie als Zwischenprodukt für Wasch- und Reinigungsmittel, in der pharmazeutischen Industrie und zur Herstellung von Pflanzenschutzmitteln.
Es liegen kaum Daten zur Wirkung von MIPa beim Menschen vor. Auch an Versuchstieren wurden nur wenige Untersuchungen durchgeführt.
Hinsichtlich Toxikokinetik und Metabolismus ist lediglich bekannt, dass MIPa als physiologisches Abbauprodukt der essentiellen Aminosäure Threonin im Urin auftritt.
Bei der Prüfung auf akute letale Wirkungen im Tierversuch erweist sich die Substanz als wenig toxisch.
Bei dermaler Applikation und am Auge wirkt MIPa im Tierversuch stark reizend. Nach inhalativer Exposition von Ratten gegenüber Dampf-Aerosolgemischen wurden pulmonale Reizungserscheinungen beobachtet und ein RD50P 1 von 440 mg/m3 ermittelt.
Eine Sensibilisierung wurde in einem Fallbericht beschrieben, in einer klinischen Studie aber nicht beobachtet. Befunde aus Studien an Versuchstieren liegen nicht vor.
Zur Wirkung nach wiederholter Exposition wurde nur eine Inhalationsstudie mit subakuter Exposition von Ratten und Mäusen nachgewiesen (Dow Chemical, 1982). Die Bewertung der Befunde wird dadurch erschwert, dass zum einen eine zusätzliche dermale und orale Aufnahme nicht ausgeschlossen werden kann, zum anderen die Versuchstiere offenbar an einer viralen Infektion der Atemwege mit Entzündungen im Nasenraum und Pneumonie litten. Bei Ratten wurden bei der niedrigsten eingesetzten Konzentration von 25 ppm (75 mg/m3) verminderte Gewichtszunahme sowie histologische Veränderungen mit unklarer Dosis-/Wirkungsbeziehung beobachtet. Da auch in der Kontrollgruppe entsprechende Wirkungen beobachtet wurden und wegen eines möglichen Einfluss der Infektion wurde dieser Effekt jedoch nicht als expositionsbedingt gewertet. Bei Mäusen wurden keine substanzbedingten Effekte beobachtet. Die höchste getestete Konzentration lag bei 75 ppm (234 mg/m3; keine lokalen und systemischen Effekte). Nach Umrechnung auf 8h Expositionsdauer/Tag ergibt sich daraus ein NOAEL von 175 mg/m3.
In Sekundärquellen beschriebene Befunde subchronischer und chronischer Studien mit oraler Verabreichung sind wegen des Fehlens wesentlicher Angaben nicht bewertbar. Das gilt auch für Daten zur Entwicklungstoxizität.
Daten zur Kanzerogenität liegen nicht vor. In Untersuchungen zur Mutagenität wurde im Ames-Test an einem Salmonella-Stamm eine fragliche mutagene Wirkung beobachtet, Tests an anderen Stämmen und in einer zweiten Untersuchung verliefen negativ, ebenso an E. coli und in einem SLRL-Test an Drosophila. In vitro oder in vivo Studien an Säugern sind nicht bekannt.
Die Datenlage erlaubt - mit Unsicherheiten - die Ableitung eines ARW-Werts anhand von Daten zu möglichen atemwegsreizenden Effekten bei subakuter Exposition bei Mäusen (Dow Chemical, 1982). Nach ARW-Konzept ist ein Faktor von 30 auf den vorliegenden NOAEL von 175 mg/m3 anzuwenden (Zeitextrapolation: Faktor 6; Inter- und Intraspeziesvariabilität: 5), so dass sich ein ARW von 5,8 mg/m3 entsprechend 2 ppm (gerundet) ergibt. Dieser Wert wird durch Daten zur Atemwegsreizung bei Mäusen (RD50P) von 440 mg/m3 gestützt. Bei Anwendung eines in der Literatur vorgeschlagenen Extrapolationsfaktors von 60 zur Abschätzung einer tolerablen Raumluft, der jedoch ebenfalls Unsicherheiten beinhaltet, ergibt sich auf dieser Basis ein nur marginal abweichender Wert. Obgleich nicht als Wert ausgewiesen ist abzuschätzen, dass der RD50 für sensorische Reizung nicht niedriger als 150 mg/m3 liegt. Ein üblicher in der Literatur genannter Faktor zur Extrapolation auf eine tolerierbare Raumluftkonzentration am Arbeitsplatz auf Basis des RD50S liegt bei 30. Es ist demnach zu vermuten, dass beim ARW auch ein hinreichender Schutz vor sensorischer Reizung gewährleistet ist.
2 Toxikologisches Profil
2.1 Physikalischchemische Eigenschaften
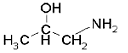
| Substanz: | 1-Aminopropan-2-ol Monoisopropanolamin MIPA 2-Hydroxypropylamin |
| CAS-Nr.: | 78-96-6 |
| Summenformel: | C3H9NO |
| Molmasse: | 75,11 g/mol |
| Siedepunkt: | 160 °C (1013 hPa) |
| Schmelzpunkt: | 1,4 °C |
| spezifische Dichte: | 0,9619 (20 °C) |
| Dampfdruck: | 1,9 hPa (20 °C) |
| pks: | 9,68 |
| pH (5 % in Wasser): | 11,7 (berechnet) |
| Löslichkeit: | löslich in Wasser, Ethanol, Benzol |
| Flammpunkt: | 77 °C |
| Umrechnungsfaktor: | 1 mg/m3 / 0,32 ml/m3 (ppm)
1 ppm / 3,12 mg/m3 |
| Aggregatzustand: | flüssig (20 °C) |
| Stabilität: | stabil bei Raumtemperatur, Reaktion mit Säuren unter Salzbildung |
| Farbe: | farblos, bei längerem Kontakt mit Luft oder Eisen Braunfärbung |
| Geruch: | schwach ammoniakalisch |
| Quelle: | Davis und Carpenter, 1997; o.V., 1987 |
Anmerkung:
MIPa weist ein chirales C-Atom auf. Bei der im Handel befindlichen Substanz dürfte es sich um das Razemat handeln; toxikologische Daten zu den beiden Einzelisomeren liegen nicht vor.
Bildung von Nitrosaminen:
Nach unveröffentlichten Befunden kann MIPa unter geeigneten, nicht näher ausgeführten Bedingungen Nitrosamine bilden. Weiterhin wird berichtet, dass in wässrigen Lösungen von MIPa bei Anwesenheit von Formaldehyd und Nitrat [Nitrit?] unter alkalischen Bedingungen bei Raumtemperatur eine langsame Reaktion mit Bildung des Nitrosamins N-Nitroso-5-methyl-1,3-oxazolidin (NMO) abläuft (o.V., 1987). In einer ausführlichen Stellungnahme von Hübner wird jedoch dargelegt, dass eine entsprechende Nitrosaminbildung im Kühlschmierstoff nicht zu erwarten ist (vgl. Anlage 1).
2.2 Metabolismus und Kinetik
Untersuchungen zur Aufnahme, Verteilung und Ausscheidung von MIPa liegen uns nicht vor. MIPa wurde im Urin von Menschen und Ratten nachgewiesen. Es entsteht als physiologisches Abbauprodukt der essentiellen Aminosäure L-Threonin, vermutlich über das Zwischenprodukt Aminoaceton (o.V., 1987).
2.3 Akute toxische Wirkung
2.3.1 Mensch
Es liegen uns keine Angaben vor.
2.3.2 Tier
Die akute Toxizität (Letalität) von MIPa ist gering (Tabelle 1). 3-stündige Einwirkung von Aerosolkonzentrationen bis zu 1005 mg/m3 auf Mäuse hatte keine letale Wirkung (LD, z.B. als LD50: letale Dosis für 50% der Versuchstiere) während und bis 72 Stunden nach der Exposition (Schaper und Detwiler-Okabayashi, 1995).
Tabelle 1: Akute Toxizität von MIPA
| Spezies | Exposition | Parameter | Wert | Symptome | Quelle |
| Ratte | inhalativ, 8 h | bei 20 °C gesättigte Atmosphäre * | keine Symptome | Smyth et al., 1949; BASF, 1965 |
|
| Maus | inhalativ, 3 h, Aerosol |
230 - 1005 mg/m3 | keine Letalität, sensorische und pulmonale Reizung | Detwiler-Okabayashi and Schaper, 1996 | |
| Ratte | oral, k.A. | LD50 | 1715 mg/kg | Somnolenz, Diarrhoe, verminderte Körpertemperatur | Burkatskaya et al., 1986 |
| Ratte | oral, Schlundsonde; 10 % in Maisöl |
LD50 | 2098 mg/kg | Lethargie, Diarrhoe, raues Fell | o.V., 1987 |
| Ratte | oral, k.A. | LD50 | 4000 mg/kg | k.A. | Toropkov, 1980c |
| Ratte | oral, Schlundsonde; 50 % in Wasser |
LD50 | 4260 mg/kg | k.A. | Smyth et al., 1949 |
| Maus | oral, k.A. | LD50 | 2200 mg/kg | k.A. | Toropkov, 1980b |
| Kaninchen | oral, k.A. | LD50 | 3200 mg/kg | k.A. | Toropkov, 1980b |
| Meerschweinchen | oral, k.A. | LD50 | 2700 mg/kg | k.A. | Toropkov, 1980b |
| Kaninchen | dermal, 12 h okkl. |
LD50 | 1560 mg/kg | lokale Rötung | Smyth et al., 1949 |
| Kaninchen | dermal, k.A. | LD50 | 1640 mg/kg | k.A. | Union Carbide, 1971 |
| Kaninchen | dermal, k.A. | LD50 | 1851 mg/kg | lokale Rötung, Schwellung, Nekrose; Lethargie | o.V., 1987 |
| Maus | i.p. | LD | 480 mg/kg 240 mg/kg |
Tod von 4/5 Tieren (1 : h) Tod von 1/3 Tieren (Tag 3) |
BIBRA, 1999 |
| Maus | i.p., k.A. | LD | 192 mg/kg | BASF, 1965 |
k.A.: keine Angaben
*: eine gesättigte Atmosphäre entspräche rein rechnerisch einer Konzentration von 1875 ppm (5850 mg/m3).
Nach den Einstufungskriterien der EU (EWG, 2002; Anhang VI der RL 67/548/EWG) erfordern diese Letalitätsdosen bzw. -konzentrationen keine Einstufung als gesundheitsschädlich.
2.4 Reizung
2.4.1 Mensch
Hervin and Lucas, 1974 berichten, dass ein Arbeiter beim Umgang mit MIPa über Kopf-, Magen- und Halsschmerzen sowie Augenreizungen klagte; nähere Angaben liegen nicht vor. Weiterhin berichten die Autoren ohne nähere Angaben über 5 Fälle von Dermatitis bei Arbeitern mit direktem Hautkontakt gegenüber MIPA.
Die Testung von MIPa (1 % in Wasser) an 22 Freiwilligen führte bei einer Person zu einer leichten Hautreizung (keine näheren Angaben) (Cooper and Shaw, 1999).
2.4.2 Tier
Atemtrakt:
In einer Studie wurde die Reizwirkung (RD) von MIPa auf den Atemtrakt von Mäusen (Swiss-Webster, männlich, 4 Tiere/Gruppe) untersucht (Detwiler-Okabayashi und Schaper, 1996; Schaper und Detwiler-Okabayashi, 1995). Für die Untersuchungen wurden vier Plethysmographen mit jeweils einer darin befindlichen Maus mit der Testkammer verbunden und die Tiere "nose only" exponiert. Die Testsubstanz wurde mit Hilfe eines Aerosolgenerators vernebelt und in die Testkammer geleitet (2,5 1; Durchstrom 20 I/min). Der MMAD des Aerosols lag im Bereich von 1-2 µm (GSD ca. 2).
Die Aerosolkonzentration wurde gravimetrisch bestimmt, die vier eingesetzten MIPA-Aerosolkonzentrationen lagen zwischen 230 und 1005 mg/m3. Die Autoren weisen daraufhin, dass bei der gravimetrischen Bestimmung nur der nicht gasförmige Anteil erfasst wird, machen aber keine Angaben darüber, inwieweit neben dem Aerosol auch dampfförmiges MIPa auftrat.
Während der 3-stündigen Exposition wurden Atemfrequenz und Veränderungen der Atemweise aufgezeichnet, anhand der zwischen einer sensorischen Reizung der oberen Atemwege (RD-S) und einer pulmonalen Reizung (RD-P) unterschieden wurde. Beobachtet wurden sensorische Reizung über den gesamten Zeitraum sowie eine pulmonale Reizung, beginnend nach 2 Stunden, bis zum Ende des Versuchs. Eine Plateauphase wurde nach 2 Stunden erreicht. Binnen 20 Minuten nach Ende des Versuchs erholten sich die Tiere, gemessen an der Atemfrequenz, mäßig bis gut (keine nähere Angabe). Histopathologische Untersuchungen wurden nicht vorgenommen.
Insgesamt lag die beobachtete Verminderung der Atemfrequenz zwischen ca. 25 % und 85 %. Ein RD50S wurde nicht angegeben. Die aus den Daten für MIPa errechnete RD50P betrug 440 mg/m3 (95 % Konfidenzintervall 277 - 593 mg/m3).
Haut:
Es liegen mehrere Untersuchungen an Kaninchen vor. Unverdünntes MIPa erzeugte unter Okklusion ein starkes Erythem. In weiteren Versuchen mit unverdünntem MIPa traten nach 5-minütiger Einwirkung Rötungen auf, nach einer Einwirkungszeit von 15 Minuten oder länger Verätzungen oder Nekrosen. Nach 7-maliger Applikation auf die rasierte Bauchhaut traten ebenfalls mäßige Verätzungen auf. Dagegen führten 0,5 ml einer 1 %ige wässrigen Lösung auf der rasierten Rückenhaut im okklusiven Patch-Test nach 4-stündiger Einwirkung zu keiner Hautreaktion ((IV., 1987; Greim, 1994).
Auge:
In mehreren Studien wurden am Auge von Kaninchen nach Einbringen von unverdünntem MIPa oder konzentrierten Lösungen ([ ] 15 %) starke Reizungserscheinungen wie konjunktivale Rötung und Schwellung, Rötung der Iris und Corneatrübung bis hin zu Verätzungen beobachtet; Hornhauttrübungen und Kataraktbildung waren z.T. noch 21 bis 32 Tage nach der Applikation nachweisbar. Eine 1 %ige Lösung (100 µl) führte nach Instillation in den Bindehautsack am Kaninchenauge noch zu leichten bis mäßigen, binnen 72 Stunden reversiblen Bindehautreizungen ((IV., 1987; Greim, 1994).
2.5 Sensibilisierung
2.5.1 Mensch Fallberichte:
Cooper and Shaw, 1999 berichten von einer 79-jährigen Frau, die seit längerer Zeit an Geschwüren an den Beinen und Osteoarthritis litt. Nach mehrwöchiger topischer Applikation eines NSAR-Gels, das u.a. MIPa enthielt, auf die Knie traten dort Erytheme und Hautreizungserscheinungen auf. Patch-Tests ergaben eine positive Reaktion auf MIPA, die von den Autoren eher einem allergischen als einem irritativen Geschehen zugeschrieben werden. Zusätzliche Testung von 22 Freiwilligen mit MIPa (1 % in Wasser) ergab bei einer Person eine leichte Reizung.
Klinische Studien:
In einer Studie an 150 Freiwilligen wurden nach dermaler Applikation 2%iger wässriger Lösungen (3-mal/Woche, 3 Wochen) und nachfolgender Testung keine Anzeichen einer Sensibilisierung beobachtet. In der selben Studie wurden bei 50 Freiwilligen nach dermaler Applikation (wie oben) und zusätzlicher UV-Bestrahlung keine Hinweise auf photoallergische Reaktionen festgestellt (Maibach, 1986).
2.5.2 Tier
Es liegen uns keine Angaben vor.
2.6 Toxizität nach wiederholter Verabreichung
2.6.1 Mensch
Hervin and Lucas, 1974 berichten ohne nähere Angaben, dass ein Arbeiter beim Umgang mit MIPa über Kopf- und Magenschmerzen klagte. Weitere Angaben liegen nicht vor. Weitere Angaben liegen uns nicht vor.
2.6.2 Tier Inhalativ:
Es liegt eine Studie mit subakuter Exposition von F344-Ratten (5 weibliche und 5 männliche Tiere/Gruppe) sowie B6C3F1-Mäusen (4-5 weibliche und 4-6 männliche Tiere/Gruppe) vor (Dow Chemical Company, 1982). Die Tiere wurden binnen 11 Tagen 9-mal jeweils 6 h/d gegenüber nominalen von 0; 25; 50 bzw. 75 ppm (0; 75; 155 bzw. 233 mg/m3) exponiert. Die mit Hilfe eines polarografischen Verfahrens gemessenen Konzentrationen während der Exposition lagen bei 0; 24,3; 49 bzw. 70 ppm, jedoch erfolgte bei der mittleren und höchsten Konzentration eine starke Ablagerung an Oberflächen, sodass das Fell der Versuchstiere gründlich durchfeuchtet wurde.
MIPa hatte keinen Einfluss auf Körpergewicht und Organgewichte. Die Gewichtszunahme bei Mäusen war im Vergleich zur Kontrolle unverändert. Bei Ratten zeigte sich eine Tendenz, jedoch ohne klare Konzentrations-Wirkungs-Beziehung, zu verzögerter Gewichtszunahme, die ebenso wie eine Verminderung des Lebergewichts mit einer wahrscheinlichen Infektion der Tiere (s.u.) in Verbindung gebracht wurde. Die Gewichtszunahme exponierter Tiere betrug 38 - 76 % der Kontrolltiere, nur der ausgeprägteste Effekt (bei männliche Ratten, Exposition mit 75 ppm) war statistisch signifikant. Hämatologische, klinisch-chemische und Parameter im Harn (letzteres nur bei Ratten untersucht) waren unverändert. Histopathologisch fanden sich in Kontroll- und exponierten Tieren Anzeichen einer Lungenentzündung und Rhinitis mit Riechepithel- und Schleimhautdegeneration und -entzündung sowie Metaplasie im Nasenraum, die auf eine Infektion mit Sendaiviren hindeuten. Während bei Mäusen keine Unterschiede zwischen Kontroll- und exponierten Gruppen festgestellt werden konnte, war die Inzidenz dieser Effekte bei exponierten Ratten höher als bei Kontrolltieren, allerdings ohne durchgängig konsistente Konzentrations-Wirkungs-Beziehung (siehe Tabelle 2). In anderen Organen zeigten sich keine substanzbedingten Veränderungen.
Tabelle 2: Histologische Veränderungen im Atemtrakt von Ratten nach subakuter Exposition gegenüber MIPa (Daten aus Dow Chemical Company, 1982)
| Beobachtung | männl. Ratten | weibl. Ratten | |||||||
| 0 ppm | 25 ppm | 50 ppm | 75 ppm | 0 ppm | 25 ppm | 50 ppm | 75 ppm | ||
| Nasenraum: Degeneration des Riechepithels, beidseitig, multifokal | leicht | 3 | 2 | 2 | 5 | 3 | 2 | 5 | 1 |
| Nasenraum: Entzündung, subakut, multifokal | sehr leicht
leicht |
3 1 |
2 3 |
0 5 |
0 5 |
0 1 |
0 5 |
0 3 |
0 3 |
| Nasenraum: Metaplasie des respiratorischen Epithels, multifokal | sehr leicht | 0 | 2 | 2 | 3 | 1 | 3 | 3 | 3 |
| Lunge: Bronchopneumonie, subakut, multifokal | leicht | 0 | 3 | 4 | 4 | 0 | 3 | 3 | 0 |
Oral:
Nach 90-tägiger Verabreichung von 140-2200 mg/(kg KG x d) MIPa mit dem Futter an je 10 Ratten traten bei der höchsten Dosis Gewichtsveränderungen von Leber oder Niere auf, als NOEL wurden 600 mg/(kg KG x d) angegeben (Smyth et al., 1951).
Nach bis zu 4-monatiger Verabreichung an Kaninchen und Ratten von 320 bzw. 400 mg/ (kg KG x d) wurden Veränderungen im EEG sowie im Gehalt von Serum- und Urinelektrolyten und der a-Ketogruppen in der Nebennierenrinde gefunden (Toropkov, 1980b). Wegen des Fehlens relevanter Angaben sind diese Befunde nicht bewertbar. Dies gilt auch für weitere Befunde derselben Arbeitsgruppe, nach der bei chronischer Verabreichung an Ratten reduzierte Gewichtszunahme, Veränderungen der Reizschwelle im ZNS, der Sorbitdehydrogenaseaktivität in der Leber, reduzierte Monoaminoxidaseaktivität sowie Veränderungen im Histamingehalt und Störungen der Nierenfunktion gefunden wurden. Als 'threshold effectA-Konzentration werden 0,28 mg/(kg KG x d) bei Ratten und 0,17 mg/(kg KG x d) für Meerschweinchen genannt (Toropkov, 1980c).
2.7 Kanzerogenität
Es liegen uns keine Untersuchungen vor.
Unter bestimmten Bedingungen kann aus MIPa das Nitrosamin N-Nitroso-5-methyl-1,3-oxazolidin (NMO) gebildet werden (siehe oben ' Bildung von Nitrosaminen). Verabreichung von NMO über 50 Wochen an weibliche F344-Ratten mit dem Trinkwasser sowie an männliche Syrische Goldhamster mit der Schlundsonde führte in beiden Spezies zur Entstehung von Tumoren in der Leber (Lijinsky und Reuber, 1982; Lijinsky et al., 1984).
2.8 Gentoxizität
MIPa zeigte im Ames-Test an den Stämmen TA98, TA100, und TA1537 von Salmonella typhimurium in An- und Abwesenheit von metabolisierendem System keine mutagene Wirkung. Bei TA1535 wurde in An-, nicht in Abwesenheit metabolischer Aktivierung eine fragliche Erhöhung der Mutationsfrequenz knapp unterhalb einer als zytotoxisch eingestuften Konzentration beobachtet (Zeiger et al., 1987). In einem weiteren Ames-Test an fünf Stämmen (TA98, TA100, TA1535, TA1537, TA1538) wurde in An- und Abwesenheit von metabolisierendem System bis hin zu zytotoxischen Konzentrationen keine mutagene Wirkung beobachtet (Shimizu et al., 1985). In E. coli (WP2uvrA) wirkte MIPa weder mit noch ohne metabolisierendes System mutagen (Shimizu et al., 1985). Ein SLRL-Test an der Fruchtfliege Drosophila melanogaster erbrachte ebenfalls keine Hinweise auf mutagene Wirkungen nach Verfütterung oder Injektion von MIPa (Foureman et al., 1994).
Das Nitrosamin NMO (siehe oben Bildung von Nitrosaminen) wirkt im Ames-Test mutagen ((IV., 1987).
2.9 Reproduktionstoxizität
Bei (vermutlich oraler) Verabreichung von 0,28 mg/(kg KG x d) an Ratten über die gesamt Dauer der Trächtigkeit bis zum 21. Tag wurde eine erhöhte pränatale Mortalität sowie Vergrößerung von Kopf und Herz beobachtet; bei 0,028 mg/(kg KG x d) wurde kein pränataler Effekt gefunden (Toropkov, 1980d). Wegen des Fehlens wesentlicher Angaben sind die Befunde nicht bewertbar.
3 Ableitung eines Arbeitsplatzrichtwertes (ARW)
3.1 Vorgehen bei der Ableitung eines Arbeitsplatzrichtwertes (ARW)
Bei der Ableitung des ARW für MIPa wurden die folgenden (Tabelle 3) angegebenen Standardextrapolationsfaktoren bei der Zeitextrapolation und zur Berücksichtigung der Speziesvariabilität verwendet, da keine Untersuchungen vorliegen, die erlauben, substanzspezifische Faktoren zu wählen. Ein Allometriefaktor ist nicht erforderlich, weil die Dosis nicht als Körperdosis sondern als Luftkonzentration angegeben war.
Tabelle 3: Übersicht über bei der ARW-Ableitung verwendeten Extrapolationsfaktoren
| Extrapolationsschritt | Extrapolationsfaktor | ||
| Allometriefaktor | Verschlucken (oral) | Ratte
Maus |
4
7 |
| Einatmen (inhalativ) | 1 | ||
| Speziesvariabilität | Tier | 5 | |
| Zeitextrapolationsfaktor | Systemische und lokale Effekte | subakut - chronisch
subchronisch - chronisch subakut - subchronisch |
6
2 2 |
3.2 Prüfung der Ableitung eines ARW für MIPA
3.2.1 Ableitung eines ARW Wertes auf Basis von Humandaten
Aus der Literatur liegen uns keine für die Ableitung verwertbaren Daten beim Menschen vor.
3.2.2 Ableitung eines ARW Wertes auf Basis von Tierdaten
Drei Ansätze können verfolgt werden, um bei der bestehenden schlechten Datenlage, die Höhe eines möglichen ARW-Werts einzugrenzen:
| Zeit | subakut | `P chronisch | 6 |
| Spezies Allometrie | Tier | 'P Mensch | 5
1 |
| Gesamt | 30 | ||
| ergäbe sich ein ARW von 5,8 mg/m3 (1,86 ppm, gerundet auf 2 ppm). | |||
| MAK | Spitzenbegrenzung | |
| Ethylamin | 5 ppm | 10 ppm |
| Diethylamin | 5 ppm | 10 ppm |
| 2-Aminopropan | 5 ppm | 10 ppm |
| Aminobutan (alle Isomere) | 5 ppm | 10 ppm |
| 2-Aminoethanol | 2 ppm | 4 ppm |
Eine Analogiebetrachtung zu diesen MAK-Werten würde für MIPa zu einem Arbeitsplatzrichtwert zwischen 6,3 mg/m3 (2 ppm) bzw. 15,6 mg/m3 (5 ppm) führen.
Der Vergleich mit diesen MAK-Begründungen ist jedoch nur begrenzt aussagefähig, da nur zu Diethylamin direkte Daten vorliegen. Die Werte für Ethylamin, Aminobutan und 2-Aminoethanol wurden ebenfalls über Analogiebetrachtungen bzw. über eine Grobabschätzung mittels RD50 ermittelt.
Dennoch ist auf Basis der Höhe des RD50P, der Schätzungen zur Untergrenze des RD50S und der Daten zu Diethylamin zu vermuten, dass der auf Basis der subakuten Inhalationsstudie abgeleitete ARW-Wert vor lokalen Wirkungen im Respirationstrakt schützt.
In einem Nachtrag zur MAK-Begründung für 2-Aminoethanol wird darauf hingewiesen: Im Tierversuch sind offenbar systemischtoxische Wirkungen von wesentlicherer Bedeutung als irritative Wirkungen. Beim Menschen wird die Reizwirkung als kritischer Effekt angesehen. (Greim, 2000). Im Falle von MIPa wurden in der einzigen tierexperimentellen Studie mit subakuter Exposition lokale Effekte, nicht systemische substanzbedingte beobachtet. Weitere Untersuchungen fehlen.
Fazit: Die Subakutstudie (Dow Chemical, 1982) ist als kritische Studie für die Festlegung eines ARW heranzuziehen. Der resultierende ARW-Wert liegt bei 5,8 mg/m3 entsprechend (aufgerundet) 2 ppm.
3.2.3 Vergleich mit anderen Grenzwerten
Vergleichbare Werte zu MIPa (Konzentrationsbegrenzungen bei Exposition über den Luftpfad) im internationalen oder nationalen Bereich sind uns nicht bekannt.
4 Analysenmethode
Serbin and Birkholz, 1995 beschreiben ein Verfahren zum Nachweis von primären und sekundären Alkanolaminen. Dazu wird mit Hilfe einer Pumpe ein definiertes Luftvolumen durch ein Röhrchen mit Silikagel gesaugt. Nach Desorption mit Methanol/Wasser, gegebenenfalls unter Zusatz von Salzsäure, erfolgt Derivatisierung mit 9-Fluorenylmethylchlorformiat und Bestimmung mit Hilfe von reverse phase HPLC. Als Nachweisgrenze wird 1 µg pro Probe angegeben. Das Verfahren wurde für 2-Ethanolamin, Diethanolamin und Diisopropylamin beschrieben; für MIPa liegen bisher keine Erfahrungen vor.
Die Autoren führen außerdem zwei von NIOSH beschriebene Methoden an (NIOSH 2007: Sorption in Silikagel, Gaschromatografie mit alkalischer Carbowax 20M-Säule und FID oder anderem Detektor; NIOSH 3509: Sorption in Hexansulfonsäure, lonenpaarchromatografie).
5 Literatur
[1] AAMA, 1996 Symposium Proceedings: The Industrial Metalworking Environment. Assessment and Control, Nov 13-16, Dearborn, Ml (1996), Seite:90
[2] BASF, 1965 Monoisopropanolamin, rein, gewerbetoxikologische Vorprüfung. Unveröffentlicht Bericht XV/238, BASF AG, Ludwigshafen, 07.12.1965, zitiert nach Greim, 1994
[3] BAuA, Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, 2001 Bekanntmachung der Liste der gefährlichen Stoffe und Zubereitungen nach § 4a der Gefahrstoffverordnung. Rw 23 Diskettenversion, Version 9/01, Wirtschaftsverlag NW, Bremerhaven, 2001
[4] BIBRA, The British Industrial Biological Research Association, 1999Toxicity Profile Monoisopropanolamine BIBRa Toxicology International, Great Britain, 1999
[5] Bos, P. M. J., Zwart, A., Reuzel, P. G. J., Bragt, P. C., 1992Evaluation of the sensory irritation test for the assessment of occupational health risk CRC Critical Reviews in Toxicology, Vol. 21, 1992, S. 423-450
[6] Buckley, L. A., Jiang, X. Z., James, R. A., Morgan, K. T., Barrow, C. S., 1984Respiratory tract lesions induced by sensory irritants at the RD50 concentration Toxicology and Applied Pharmacology, Vol. 74, 1984, S. 417-429
[7] Burkatskaya, E. N., Karpenko, V. N., Pokrovskaya, T. N., Ivanova, Z. V., Medved', I. L., Verich, G. E., Olefir, A. 1., 1986Materials an the substantiation of the maximum allowable concentrations of monosiopropanolamine and diisopropanolamine and triisopropanolamine in the air of a work area Gigiena Truda i Professional nye Zabolevarija, Vol. 30, 1986, S. 46-48
[8] CIR, 1987 Journal of the American College of Toxicology, Vol. 6, 1987, S. 53, zitiert nach BIBRA, 1999
[9] Cooper, S. M., Shaw, S., 1999Contact allergy to isopropanolamine in Traxam gel Contact Dermatitis, Vol. 41, 1999, S. 233-234
[10] Davis, J. W., Carpenter, C. L., 1997Environmental assessment of the alkanolamines Reviews of Environmental Contamination and Toxicology, Vol. 149, 1997, S. 87-137
[11] Detwiler-Okabayashi, K. A., Schaper, M. M., 1996Respiratory effects of a synthetic metalworking fluid and its components Archives of Toxicology, Vol. 70, 1996, S. 195-201
[12] DFG, Deutsche Forschungsgemeinschaft, 2002MAK- und BAT-Werte-Liste 2002. Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe. Mitteilung 38WILEY-VCH Verlag GmbH, Weinheim, 2002
[13] Dow Chemical Company, 1982Monoisopropanolamine: 2 Week Inhalation study with Rats and Mice. UnveröffentlichtCTFa Code No. 2-30-16, Dow Chemical Company, 1982
[14] EWG, Europäische Wirtschaftsgemeinschaft, 2002Richtlinie 67/548/EWG des Rates zur Angleichung der Rechts- und Verwaltungsvorschriften für die Einstufung, Verpackung und Kennzeichnung gefährlicher Stoffe vom 27. Juni 1967 (EG-Amtsblatt Nr. L 196 S. 1)Richtlinie 67/548/EWG (inkl. B. Änderung und 27. Anpassung), Artikel 1-6 und 22-27, Anhänge II, III, IV, VI und IX, Anhang 1: (28. Anpassung), 2002
[15] Foureman, P., et al., 1994 Environmental Molecular Mutagenesis, Vol. 23, 1994, S. 51, zitiert nach BIBRA, 1999
[16] Greim, H., 1994 1-Aminopropan-2-olGesundheitsschädliche Arbeitsstoffe, Toxikologischarbeitsmedizinische Begründungen von MAK-Werten, Loseblattsammlung, 20. Lfg.DFG, Deutsche Forschungsgemeinschaft, VCH Verlag Weinheim, 1994
[17] Greim, H., 1996 2-Aminoethanol und die Nachträge der Jahre 1999, 2000, 2001 Gesundheitsschädliche Arbeitsstoffe, Toxikologischarbeitsmedizinische Begründungen von MAK-Werten, Loseblattsammlung, 23. Lfg.DFG, Deutsche Forschungsgemeinschaft, VCH Verlag Weinheim, 1996
[18] Greim, H., 2000 2-Aminoethanol, Nachtrag 2000 Gesundheitsschädliche Arbeitsstoffe, Toxikologisch-arbeitsmedizinische Begründungen von MAK-Werten, Loseblattsammlung, 30. Lfg.DFG, Deutsche Forschungsgemeinschaft, VCH Verlag Weinheim, 2000
[19] Greim, H., 2001 Gesundheitsschädliche Arbeitsstoffe, Toxikologisch-arbeitsmedizinische Begründungen von MAK-Werten, Loseblattsammlung, 32. Lfg.DFG, Deutsche Forschungsgemeinschaft, WILEY-VCH Verlag, Weinheim, 2001
[20] Hervin, R. L., Lucas, J. B., 1974Occupational health case report - No. 8, Monoisopropanolamine Journal of Occupational Medicine, Vol. 16, 1974, S. 355-357
[21] Kalberlah, F., Schneider, K., Schuhmacher, U. S., Voss, J.-U., loannidis, 1., Oltmanns, J., 1999 Zeitextrapolation und Interspeziesextrapolation bei lokal wirksamen Stoffen mit begrenzter Datenlage Schriftenreihe der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Fb 862Wirtschaftsverlag NW, Bremerhaven, 1999
[22] Lijinsky, W, Reuber, M. D., 1982 Comparative carcinogenesis by nitrosomorpholines, nitrosooxazolidines and nitrosotetrahydrooxazine in rats, Carcinogenesis, Vol. 3, S. 911-915, 1982, zitiert nach MEDLINE: http://gateway.nlm.nih.gov/gw/Cmd
[23] Lijinsky, W., Kovatch, R. M., Knutsen, G. L., 1984 Carcinogenesis by nitrosomorpholines, nitrosooxazolidines and nitrosoazetidine given by gavage to Syrian golden hamsters, Carcinogenesis, Vol. 5, S. 875-878, 1984, zitiert nach MEDLINE: http://gateway.nlm.nih.gov/gw/Cmd
[24] Maibach, H.1., 1986 Human sensitization and photosensitization evaluation for monoisopropanolamine and photosensitization evaluation of diisopropanolamine Unpublished data, 4 January (cited in CIR, 1987), zitiert nach BIBRA, 1999
[25] o.V., 1987Final report an the safety assessment of diisopropanolamine, triisopropanolamine, isopropanolamine and mixed isopropanolamine Journal of the American College of Toxicology, Vol. 6, 1987, S. 53-76
[26] o.V., 1998Kriterien für die Ableitung von gesundheitsbasierten Luftgrenzwerten bei limitierter Datenlage Bundesarbeitsblatt, Vol. 10, 1998, S. 74-76
[27] Schaper, M. M., Detwiler-Okabayashi, K. A., 1995 Use of a Bioassay to Evaluate the Respiratory Irritancy of Metalworking Fluids and Their Components.
[28] AAMa Metalworking Fluids Symposium: The Industrial Metalworking Environment: Assessment and Control. Epidemiology/Toxicology Plenary Session. November 13-16, 1995, Dearborn, Michigan
[29] Serbin, L., Birkholz, D., 1995a sensitive analytical procedure forthe determination of primary and secondary alkanolamines in air American Industrial Hygiene Association Journal, Vol. 56, 1995, S. 66-69
[30] Shimizu, H., Suzuki, Y., Takemura, N., Goto, S., Matsushita, H., 1985The results of microbial mutation test for fortythree industrial chemicals Japanese Journal of Industrial Health, Vol. 27, 1985, S. 400-419, zitiert nach Greim, 1994
[31] Smyth, H. F., Carpenter, C. P., Weil, C. S., 1949Rangefinding toxicity data: List 111 Journal of Industrial Hygiene and Toxicology, Vol. 31, 1949, S. 60-62, zitiert nach o.V., 1987
[32] Smyth, H. F., Carpenter, C. P., Weil, C. S., 1951 Rangefinding toxicity data: List IVArchives of Industrial Hygiene and Occupational Medicine, Vol. 4, 1951, S. 119-122, zitiert nach Greim, 1994
[33] SRC PhysProp Database, http://esc.syrres.com/interkow/physdemo.htm (Suche vom 04.09.2002) Daraus zitiert die physikochemischen Daten von Methylaminopropanol in Fußnote 2
[34] Toropkov, V. V., 1980aStudy of the embryotropic effect of mono-, di- and triisopropanolamine Trudy Leningradskogo Sanitarno-Gigieniceskogo Medicinskogo Instituta, Vol. 130, 1980, S. 29-31, zitiert nach BIBRA, 1999 und Greim, 1994
[35] Toropkov, V. V., 1980bState of the hypothalamichypophysealadrenal system in poisoning by isopropanolamines Trudy Leningradskogo Sanitarno-Gigieniceskogo Medicinskogo Instituta, Vol. 130, 1980, S. 31-34, zitiert nach BIBRA, 1999 und Greim, 1994
[36] Toropkov, V. V., 1980cClinicalmorphological study on the effect of isopropanolamines on the eye Gigiena Truda i Professional nye Zabolevarija, Vol. 2, 1980, S. 48-50, zitiert nach BIBRA, 1999 und Greim, 1994
[37] Toropkov, V. V., 1980dSubstantiation of maximum permissible concentrations of mono-, di- and triisopropanolamines in reservoir water Gigiena i Sanitarija, Vol. 45, 1980, S. 79-81, zitiert nach BIBRA, 1999 und Greim, 1994
[38] Union Carbide, 1971 Union Carbide Data Sheet dated 21 May (cited in RTECS, 1998), zitiert nach BIBRA, 1999
[39] Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K., Speck, W., 1987Salmonella mutagenicity tests: III. Results from the testing of 255 chemicals Environmental Mutagenesis, Vol. 9, Suppl. 9, 1987, S. 1-28, zitiert nach Greim 1994
.
| Stellungnahme von Herrn Dr. Hübner, VSI, zur Frage der Nitrosaminbildung unter Beteiligung von MIPA | Anlage 1 |
J.HÜBNER 22.10.2002
1-Amino-2-propanol (Isopropanolamin) - Mögliche Bildung von N-Nitrosooxazolidinen in wassermischbaren und wassergemischten Kühlschmierstoffen (KSS)
STEPHANY et al. hatten 1978 30mg/kg N-Nitroso-5-methyl-1,3-oxazolidin (5,1,3-NMOX) in einem offensichtlich nitrithaltigen KSS-Konzentrat gefunden (R.W.STEPHANY et al., Recueil B J.Royal Netherl.Chem.Soc. 97, 177-178 (1978)). Da sie das zugehörige sekundäre Amin (5-Methyl-1,3-oxazolidin) nicht finden konnten (ein direkter Beweis der Abwesenheit wurde jedoch nicht geführt), haben sie folgende Hypothese aufgestellt:
5,1,3-NMOX könnte synchron aus drei Reaktionspartnern, nämlich 1-Amino-2-propanol, Formaldehyd und Natriumnitrit entstanden sein. Labor-Modelluntersuchungen zeigen eine langsame Bildung von 5,1,3-NMOX aus diesen drei Reaktionspartnern; es wurden jedoch keine Angaben zu den Reaktionsbedingungen gemacht.
Die Arbeit von STEPHANY et al. weist erhebliche Schwachpunkte auf. Es werden weder Angaben zur Zusammensetzung noch zu den Herstellungsbedingungen des KSS-Konzentrats gemacht. Es ist nicht ersichtlich, ob 1-Amino-2-propanol überhaupt im KSS-Konzentrat enthalten war, welche Formaldehyd-Quelle und -Konzentration vorlag und welche Verunreinigungen und Nebenprodukte ggf. anwesend waren. Auch die Nitrit-Konzentration wird nicht angegeben. Aufgrund einer ähnlichen Arbeit von G.ELLEN et al. mit einem hochnitrithaltigen KSS-Konzentrat (18 % Nitrit !) liegt jedoch die Vermutung nahe, dass der Nitritgehalt erheblich war (Recueil-J.Royal Netherl. Chem.Soc. 101, 357-359 (1980)).
Wassermischbare KSS (Konzentrate), die Nitrit oder andere Nitrosierungsagenzien enthalten, dürfen in Deutschland spätestens seit 1993 nicht mehr eingesetzt werden (TRGS 611 und GefStoffV). Eine Bildung von N-Nitrosooxazolidinen in heutigen KSS-Konzentraten ist daher in der Praxis in Deutschland auf diesem Wege nicht möglich.
S.FADLALLAH et al. (J.Chromat.Science, 28, 517-523 (1990)) haben im übrigen in nitrithaltigen (!) KSS-Konzentraten gezielt nach 5,1,3-NMOX und N-Nitroso-1,3-oxazolidin gesucht. In keinem Falle wurde eines dieser beiden N-Nitrosooxazolidine gefunden.
Eine Bildung von N-Nitrosooxazolidinen aus den drei Reaktionspartnern primäres Alkanolamin, Nitrit und Formaldehyd (oder anderer Aldehyd) ist zwar unter gezielten Synthesebedingungen (etwa bei pH 2, hohe Konzentration der Reaktionspartner) im Labor in geschlossenen Reaktionsgefäßen möglich (' EintopfreaktionA). Für in Deutschland eingesetzte wassergemischte KSS kann jedoch eine derartige Bildung von N-Nitrosooxazolidinen wegen der großen Verdünnung, des alkalischen Milieus und der sehr geringen Konzentration oder Abwesenheit der Reaktionspartner Nitrit und Formaldehyd (oder anderer Aldehyde) ausgeschlossen werden.
Aufgrund eines von der MAK-Kommission geäußerten Verdachts wurden 2000/2001 gezielte Nitrosierungstests mit wassergemischten KSS durchgeführt, die Formaldehyddepot-Biozide mit Oxazolidinstrukturen enthielten (darunter das aus 1-Amino-2-propanol und Formaldehyd hergestellte 3,3>-Methylenbis(5-methyloxazolidin)).
In keinem Falle wurden signifikante Konzentrationen von 5,1,3-NMOX oder anderer NNitrosooxazolidine gefunden.
Die MAK-Kommission hat sich aufgrund dieser Recherchen und Ergebnisse der Schlussfolgerung angeschlossen, dass das Auftreten von N-Nitrosooxazolidinen in heutigen wassermischbaren und wassergemischten KSS sehr unwahrscheinlich ist. Der diesbezüglich geäußerte Verdacht wurde aus der MAK- und BAT-Werte-Liste gestrichen.
1) RD50: Konzentration einer atemwegsreizenden Substanz, die im Versuchstier zu einer Verminderung der mittleren Respirationsrate um 50 % führt. Detwiler-Okabayashi und Schaper (1996) unterscheiden dabei anhand der beobachteten Veränderungen der Atmung zwischen einer sensorischen (RD50S) und einer pulmonalen Reizung (RD50P).
2) 2-Amino-2-methylpropanol-1 [MG 89,14 g/mol; Schmelzpunkt 25,5 °C, Siedepunkt 165,5 °C] weist bei 20 °C einen Dampfdruck von 1 mm Hg (1,33 hPa) auf (SRC, 2002), der nur geringfügig geringer als der von MIPa (vgl. Abschnitt 2.1) ist.
 |
weiter |
(Stand: 20.08.2018)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: 90.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion