 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk |  |
Ovarialkarzinom (Eierstockkrebs) durch Asbest
- Berufskrankheiten-Verordnung
Empfehlung des Ärztlichen Sachverständigenbeirats "Berufskrankheiten"
Vom 1. Dezember 2016
(GMBl. Nr. 2 vom 31.01.2017 S. 13, ber. 2019 S. 1294)
Empfehlung des Ärztlichen Sachverständigenbeirats "Berufskrankheiten" - Ovarialkarzinom (Eierstockkrebs) durch Asbest -
- Bek. d. BMAS v. 1.12.2016 - IVa 4-45222
Der Ärztliche Sachverständigenbeirat "Berufskrankheiten" beim Bundesministerium für Arbeit und Soziales hat in seiner Sitzung am 14. September 2016 empfohlen, die Nummer 4104 der Anlage 1 zur Berufskrankheiten-Verordnung um folgende neue Berufskrankheit zu ergänzen:
"Ovarialkarzinom (Eierstockkrebs)
Die hierzu vom Ärztlichen Sachverständigenbeirat erarbeitete wissenschaftliche Begründung lautet wie folgt:
1. Aktueller Erkenntnisstand
1.1 Vorkommen und Gefahrenquellen
Bezüglich chemisch-physikalischer und/oder biologischer Charakteristika sowie des Vorkommens von Gefahrenquellen wird auf die Merkblätter zu den Berufskrankheiten Nr. 4103 , 4104 und 4105 der Anlage 1 zur Berufskrankheiten-Verordnung verwiesen. Hinsichtlich der arbeitstechnischen Voraussetzungen für die Ermittlung der kumulativen Faserjahrdosis ist der BK-Report "Faserjahre" in der jeweils aktuellsten Fassung zugrunde zu legen (DGUV, 2013).
1.2 Kenntnisse zur Wirkung am Menschen
1.2.1 Pathomechanismen
Eingeatmete Asbestfasern besitzen neben fibrogenen für den Menschen gesicherte lokal tumorerzeugende Eigenschaften. Die Kanzerogenität ist für die Zielorgane Lunge, Larynx, Pleura einschließlich Perikard sowie Peritoneum einschließlich Tunica vaginalis testis gesichert. Die aktuelle Empfehlung gilt dem Ovarialkarzinom, für welches die Verursachung durch Asbest aufgrund neuer wissenschaftlicher Erkenntnisse ebenfalls gesichert ist.
Die Aufnahme von Asbestfasern erfolgt in erster Linie inhalativ mit der Atemluft. Durch die mukoziliäre Clearance wird der größte Teil deponierter Fasern zunächst in das Gastrointestinalsystem überführt und von hier aus offenbar z. T. in die Bauchhöhle. Darüber hinaus werden neben einem lymphogenen auch ein hämatogener Transport sowie die Penetration von Asbestfasern in die serösen Höhlen des Brust- und Bauchraumes diskutiert. Die körpereigene Abwehrreaktion einer Ferroproteineinhüllung der inkorporierten Fasern führt z.T. zur Bildung sogenannter Asbestkörperchen (Großgarten und Woitowitz, 1991). Diese können nicht nur in der Lunge, sondern in zahlreichen extrapulmonalen und extrathorakalen Organen nachgewiesen werden (Marten et al., 1989).
Da der Gebrauch von (früher oft asbesthaltigem) Talkumpuder in Damm-Puder mit einer signifikant erhöhten Odds Ratio von 1,33 (95 % CI 1,16-1,45, Huncharek et al. 2003), bzw. 1.24 (95 % CI 1,15-1,33, Terry et al. 2013) für die Entstehung von Ovarialkarzinomen assoziiert war, kann auch über eine direkte transvaginale Inkorporation von Asbestfasern spekuliert werden. In keiner dieser beiden Studien fand sich allerdings eine signifikante Dosis-Wirkungs-Beziehung. Andere Autoren bezweifeln daher einen Kausalzusammenhang (Gross und Berg 1995). Schildkraut et al. (2016) berichteten bei Afroamerikanerinnen, die nach Angaben der Autoren im Vergleich zur weißen Bevölkerung häufiger Damm- und Körperpuder verwenden, über eine erhöhte Odds Ratio beim Gebrauch von Dammpuder für Ovarialkarzinome von 1,44 (95 % CI 1,11 - 1,86), mit einer positiven Dosis-Wirkungs-Beziehung. In welchem Ausmaß eine Erinnerungsverzerrung (recall bias, also bessere Erinnerung bei Exponierten, insbesondere wenn es um Regreßforderungen geht) eine Rolle spielt (Trabert 2016) oder ob bei Afroamerikanern im Vergleich zur weißen Bevölkerung eine stärkere Bereitschaft zu entzündlichen Reaktionen des Organismus (z.B. Paalani et al. 2011) zu der Beobachtung von Schildkraut et al. (2016) beigetragen hat, muss derzeit offen bleiben.
Der Pathomechanismus der Entstehung eines Ovarialkarzinoms basiert auf einer Aktivierung von Onkogenen, dem Nicht-Ansprechen auf wachstumshemmende zelluläre Signale, dem Überstehen apoptotischer Prozesse und der Immortalisierung von Zellen. Angiogenese, invasives Wachstum und Metastasierung sind frühe Ereignisse (Saad et al. 2010). Bei jeder Ovulation sind Zytokinvermittelte entzündliche Vorgänge beteiligt, welche auch eine Rolle bei der Gewebereparatur spielen (Ness und Cottreau 1999). Die Rolle von Entzündungsprozessen in der Tumorentstehung wird durch die Beobachtung unterstützt, dass Frauen, die antientzündliche Medikamente wie nichtsteroidale Antiphlogistika einnehmen, seltener an Ovarialkarzinomen erkranken (Altinoz und Korkmaz 2004). Saad und Koautoren (2011) sehen die Kanzerogenität von Talkumpuder (im Sinne von asbesthaltigem Talkum) und Asbest ebenfalls über entzündliche Vorgänge vermittelt, wenngleich hierzu kein Tiermodell existiert.
Über die Asbest-Genese hinaus ist eine Reihe von weiteren außerberuflichen Risikofaktoren mit der Entstehung des Ovarialkarzinoms assoziiert. Verwandte mit Ovarialkarzinomen, Nulligravida, Infertilitätsanamnese, höhere Schulbildung bzw. höheres Einkommen, Wohnsitz in Nordeuropa und Nordamerika sowie frühe Menarche und späte Menopause sind mit einer erhöhten Inzidenz von Ovarialkarzinomen assoziiert. Progesterone senken das Erkrankungsrisiko (Rosenberg et al. 1994, Risch 1998), auch eine Hysterektomie soll vor der Erkrankung schützen. Bestimmte genetische Suszeptibilitätsgene sind identifiziert. Etwa 10% aller Ovarialkarzinome werden auf diese genetische Ursache zurückgeführt, hier sind insbesondere Mutationen von BRCA1 und 2 bekannt, Patienten mit Lynch-Syndrom (HNPCC) zeigen ebenfalls eine erhöhte Inzidenz von Ovarialkarzinomen.
1.2.2 Krankheitsbild und Diagnose
1.2.2.1 Inzidenz
Die meisten bösartigen Neubildungen des Ovars entstehen vom ovariellen Oberflächenepithel und machen etwa 30 % aller malignen Tumoren des weiblichen Genitaltraktes aus. Die Inzidenz primärer Ovarialkarzinome zeigt große geografische Variabilität, die altersadjustierte Inzidenzrate streut von weniger als zwei Neuerkrankungen/100.000 Frauen in Südostasien und Südafrika bis hin zu 15 Erkrankungsfällen der Frauen in Nordeuropa. In Deutschland steht das Ovarialkarzinom auf Platz sechs aller bösartigen Erkrankungen, das Lebenszeitrisiko liegt bei 1,4 %. Im Jahr 2012 sind 7.380 Frauen erkrankt. Die Fünf-Jahres-Überlebensrate liegt bei etwa 41 %.
1.2.2.2. Pathologie
Etwa 65-70 % der Ovarialtumoren sind epitheliale Tumoren, abgeleitet vom Oberflächenepithel. 15- 20% sind Keimzelltumoren (Teratom, Dysgerminom). 5-15 % sind Stromatumoren.
Ovarialkarzinome entstehen aus dem ovariellen Oberflächenepithel, sind daher Zölomepithelderivate. Ebenso wie primär peritoneale Karzinome werden sie zu den Adenokarzinomen gerechnet. Es werden unterschiedliche histologische Subtypen definiert. Neben serösen Karzinomen werden muzinöse Karzinome, endometrioide Karzinome, sogenannte Klarzelltumoren und Transitionalzelltumoren voneinander differenziert. Seltene histologische Subtypen sind plattenepithelial differenzierte Tumoren und Mischtumoren, die aus unterschiedlichen histologischen Komponenten bestehen können.
Neuere genetische Daten zeigen, dass mindestens zwei biologisch differente Subtypen des Ovarialkarzinoms differenziert werden müssen. Sogenannte low-grade Tumoren mit einer guten Prognose zeigen sehr selten p53-Mutationen, relativ häufig BRAF und Kras-Mutationen sowie pTEN-Mutationen, high-grade Adenokarzinome des Ovars zeigen häufig, bis 80 % p53-Mutationen, eine Expression von Her-2/neu und sind selten mikrosatelliteninstabil. Die unterschiedliche genetische Ausstattung ist mit einer unterschiedlichen Prognose assoziiert.
Eine Sonderform der Ovarialtumoren sind die Borderline-Tumoren, die etwa 15-20 % aller Neoplasien des Ovars ausmachen. Es handelt sich hierbei um epitheliale Tumoren, die sich oberflächlich ausbreiten und keine Tiefeninfiltration aufweisen. Sie können hinsichtlich ihrer histologischen Subtypen wie die Karzinome in seröse, endometroide und hellzellige Borderline-Tumoren differenziert werden. Die Prognose der Borderline-Tumoren ist sehr gut mit einem Gesamtüberleben von 95%.
Da die Totenscheindaten in denjenigen epidemiologischen Studien, welche dieser Berufskrankheit wissenschaftlich zugrunde liegen, keine Angaben zur Histologie enthalten, ergeben sich aus den genannten histopathologischen Daten keine für das Berufskrankheitenrecht richtunggebenden Erkenntnisse.
1.2.3 Erkenntnisse aus epidemiologischen Untersuchungen
Die International Agency for Research on Cancer (IARC, Lyon) der Weltgesundheitsorganisation (WHO) kam in ihrer Monographie 100 C nach Sichtung der publizierten Kohortenstudien einschließlich Populationsbasierter Kohortenstudien und von Fall-Kontroll-Studien zu der Einschätzung, es gebe beim Menschen hinreichende Evidenz ("sufficient evidence") für die Karzinogenität von Asbest für die Verursachung von Mesotheliomen sowie von Lungenkarzinomen, Larynxkarzinomen und Ovarialkarzinomen (Sitzung am 17.- 24. März 2009, Publikation IARC, 2012). Dabei seien alle Formen von Asbest (Chrysotil, Krokydolit, Amosit, Tremolit, Aktinolit und Anthophyllit) karzinogen für den Menschen. Eine Meta-Analyse war in der Einschätzung der IARC (2012) nicht vorgenommen worden.
Die vorliegende wissenschaftliche Begründung basiert primär auf einem systematischen Review der medizinisch-wissenschaftlichen Literatur sowie einer Meta-Analyse von Camargo et al. (2011) zur Frage der Assoziation zwischen der beruflichen Exposition gegenüber Asbest und der Entstehung eines Ovarialkarzinoms.
Darüber hinaus wurden die systematischen Reviews von Reid et al. (2011) und von Bounin et al. (2014) ausgewertet sowie die Literatur mit Stand September 2016 nach Neuerscheinungen zum Thema gescreent. Schließlich erfolgte eine eigene Meta-Analyse aller Studien (Stand September 2016).
Die selektive Literaturrecherche von Camargo et al. (2011) war in PubMed durchgeführt worden. Gesucht wurden Artikel jeglicher Sprache, die vor 20 10 erschienen waren, und zwar mit den Suchworten: "ovarian cancer", "cancer of the ovary", "asbestos" , "chrysotile", "crocidolite", "mortality", "standardized mortality ratio", "incidence", "standardized incidence ratio", "cancer", "mesothelioma", "cohort", "female" und "women". Zusätzlich hatten die Autoren die publizierten Kohortenstudien Asbestexponierter Kollektive hinsichtlich Daten über Ovarialkarzinome durchsucht. Auch wurden die Zitate der selektierten Artikel zusätzlich überprüft.
Ergänzend wurde Herr Prof. Leslie Stayner an der Universität Illinois, Chicago, persönlich zur Frage der Methodik der Literatur-Recherche kontaktiert. Er bestätigte am 15. Dezember 2014 (Stayner 2014), dass durch die Suche nach Kohorten, in denen "ovarian cancer" OR "cancer of the ovary" nicht im Such-Term steht, auch solche Studien eingeschlossen wurden, in denen das Ovarialkarzinom nicht als Zielgröße im Abstract stand. Dies bedeutet, dass hinsichtlich der Zieldiagnose "Ovarialkarzinom" negative Studien (bei denen das Ovarialkarzinom folglich regelhaft nicht im Abstract genannt wurde) gleichfalls in die Auswertung einflossen und dass kein systematisches "oversampling" positiver Studien stattfand.
1.2.3.1 Studien, die in die Meta-Analyse von Camargo et al. (2011) eingingen
Die von Camargo et al. (2011) ausgewerteten Studien sind in Tabelle 1 zusammengefasst. Das gepoolte Standardisierte Mortalitätsverhältnis für Ovarialkarzinome betrug 1,77 (95% CI 1,37-2,28).
1.2.3.2. Einzelstudien, die nicht im Review von Camargo et al. (2011) berücksichtigt wurden bzw. erst später publiziert wurden
In die Studie von Vasama-Neuvonen et al. (1999) ging die weibliche Bevölkerung Finnlands der Geburtsjahrgänge 1906-1945 ein. Diese wurde mit dem finnischen Krebsregister für die Periode 1971- 1995 abgeglichen. Über dieses Verfahren wurden insgesamt 5.072 primäre Ovarialkarzinome identifiziert. Die Exposition gegenüber Asbest wurde anhand der im 1970er-Zensus erhobenen Angaben zu Beruf und Branche in Verbindung mit einer Job-Exposure-Matrix (FINJEM) abgeschätzt. Insgesamt wurden 7% der weiblichen Erwerbsbevölkerung als gegenüber Asbest exponiert eingestuft. Für Frauen mit einem als mittel bzw. hoch eingestuften Expositionsgrad wurde bezüglich des Ovarialkarzinoms eine SIR (standardisierte Inzidenzrate) = 1,3 (95 % CI 0,9-1,8) ermittelt.
Reid et al. (2008) berichteten über die Krebsmortalität in einer Kohorte von 2.555 Frauen und Mädchen, die in der Stadt Wittenoom im westlichen Australien lebten, wo Krokydolit-Asbest zwischen 1943 und 1992 abgebaut wurde, und die nicht in die Abbau- und Mahlarbeiten involviert waren. Die Umweltbelastung durch Asbeststaub war erheblich. In dieser Kohorte zeigten sich neun Todesfälle durch Ovarialkarzinome (SMR 1,26, 95 % CI 0,58-2,40). Auf der Basis des Krebsregisters in West-Australien wurde im Rahmen einer eingebetteten Fall-Kontroll-Studie später der Einfluss der beruflichen Exposition auf die Inzidenz der Ovarialkarzinome in dieser Region untersucht (Reid et al. 2009). Unter den 416 Frauen, die in der Asbestindustrie gearbeitet hatten, waren im Zeitraum 1960-2006 insgesamt drei Fälle aufgetreten. Im Vergleich zu den Bewohnerinnen der Stadt ohne berufliche Exposition wurde eine OR = 1,01 (95 % CI 0,29-3,55) ermittelt.
Ferrante et al. (2007) untersuchten die Krebsmortalität in einer Kohorte, die aus 1.780 Ehefrauen von Männern bestand, welche in der Asbestzementfabrik "Eternit" in Casale Monferrato (Italien) arbeiteten und die dort gegenüber Krokydolit und Chrysotil exponiert waren. Bei Frauen mit häuslicher Exposition gegenüber Asbest fanden sich neben 21 Pleuramesotheliomen (SMR=18) auch 11 Todesfälle durch Ovarialkarzinome im Vergleich zu 7,7 erwarteten Fällen (SMR 1,42, 95 % CI 0,71-2,54).
Pukkala et al. (2009) untersuchten die Inzidenz des Ovarialkarzinoms bei Frauen, die in Dänemark, Finnland, Island, Norwegen und Schweden in verschiedenen Berufskategorien exponiert waren. Hierzu gehörten die Installateure, bei denen eine berufliche Asbestexposition angenommen wurde. Die SIR betrug 3,33 (95 % CI 0,91-8,52). Diese Arbeit wurde von Camargo et al. (2011) nicht genannt.
Langseth und Kjaerheim (2004) führten eine eingebettete Fall-Kontroll-Studie innerhalb einer Kohortenstudie bei Arbeiterinnen in der norwegischen Papierindustrie durch. In der Kohortenstudie hatte sich eine signifikant erhöhte SIR von 1,50 (95 % CI 1,07-2,09) gezeigt. Der Fasertyp wurde nicht spezifiziert. In der Fall-Kontroll-Studie mit 46 Fällen von Ovarialkarzinom lag die OR für eine berufliche Asbestexposition bei 2,02 (95 % CI 0,72-5,66).
Wang et al. (2013) berichteten die Daten einer Kohortenstudie von 279 chinesischen Textilarbeiterinnen. Das standardisierte Mortalitätsverhältnis für Ovarialkarzinome lag bei 7,69 (95 % CI 1.36-43.58), basierte jedoch nur auf einem Fall.
Oddone et al. (2014) publizierten die Ergebnisse einer Kohortenstudie von Asbestzementarbeitern in Broni (Pavia, Italien), darunter 42 Frauen. Auch hier zeigte sich ein signifikant erhöhtes standardisiertes Mortalitätsverhältnis für Ovarialkarzinome (n=2; SMR = 8.56, 95 % CI 1.04-30.91).
Pira et al. (2016) berichteten über die Ergebnisse des verlängerten Beobachtungszeitraums der bei Pira et al. (2007) beschriebenen Kohorte von Asbest-Textilarbeitern. In der Arbeit von Pira et al. (2007), die in den systematischen Review von Camargo et al. (2011) eingeflossen war, hatte die Beobachtung am 3 1. Dezember 2004 geendet, in der Arbeit von Pira et al. (2016) am 30. November 2013. Der Effektschätzer für das Ovarialkarzinom stieg gegenüber Pira et al. (2007) mit 2,83 (1,22-5,57) nach etwa neun Jahre längerem follow-up bei Pira et al. (2016) auf 3,03 (1,69-4,99) an.
2. Validität und Reliabilität der vorliegenden epidemiologischen Erkenntnisse
Die IARC hat in ihrer Monographie 100 C aufgrund ihrer Sitzung im März 2009 (IARC 2012) Asbest als erwiesenes Humankarzinogen mit dem Zielorgan "Ovar" eingestuft. Grundlage dieser Einschätzung waren elf Kohortenstudien in 13 Populationen, davon zehn mit beruflicher Asbestexposition, sowie drei weitere mit Umweltexposition, hinzu kam eine Fall-Kontroll-Studie.
Camargo et al. (2011) hingegen werteten 18 Kohortenstudien beruflich exponierter Frauen aus und führten zusätzlich eine Meta-Analyse zum Zusammenhang zwischen beruflicher Asbestexposition und Ovarialkarzinom durch, wobei in 17 Studien die Mortalität, in einer die Inzidenz das Zielkriterium war.
2.1 Gemeinsamkeiten und Unterschiede zwischen IARC (2012) und Camargo et al. (2011)
Die IARC (2012) und Camargo (2011) hatten folgende Studien in analoger Weise ausgewählt und in die Bewertung eingeschlossen: Acheson et al. (1982), Newhouse und Sullivan (1989), Rösler et al. (1994), Germani et al. (1999), Berry et al. (2000), Pira et al. (2005, 2007), Magnani et al. (2008), Reid et al. (2009), Wignall und Fox (1982).
Folgende Arbeiten wurden von der IARC (2012) in die Bewertung eingeschlossen, jedoch nicht von Camargo et al. (2011), und zwar vorrangig wegen der Beschränkung von Camargo et al. (2011) auf berufliche Expositionen gegenüber Asbest bei Fehlen wesentlicher sonstiger Exposition gegenüber beruflichen Karzinogenen und wegen der Beschränkung von Camargo et al. (2011) auf Kohortenstudien:
Es muss angemerkt werden, dass alle Studien, die von der IARC (2012) in die Bewertung mit aufgenommen wurden, aber aus verschiedenen Gründen von Camargo et al. (2011) nicht eingeschlossen wurden, ein erhöhtes Risiko für die Entstehung eines Ovarialkarzinoms bei beruflich oder umweltbedingt gegenüber Asbest exponierten Frauen belegen.
Folgende Studien wurden von Camargo et al. (2011) eingeschlossen, nicht jedoch von der IARC (2012) aufgeführt: Gardner et al. (1986), Tarchi et al. (1994), Szeszenia-Dabrowska et al. (2002), Mamo et al. (2004), Wilczynska et al. (2005), McDonald et al. (2006), Hein et al. (2007), Loomis et al. (2009), Harding et al. (2009), Clin et al. (2009). Die Arbeiten von Hein et al. (2007), Loomis et al. (2009) und Clin et al. (2009) wurden von Camargo et al. (2011) allerdings auch erst nach Kontaktaufnahme mit den Autoren und Übermittlung unpublizierter Daten zur Mortalität an Ovarialkarzinomen eingeschlossen. Aus welchen Gründen die Arbeiten von Gardner et al. (1986), Tarchi et al. (1994), Szeszenia-Dabrowska et al. (2002), Mamo et al. (2004), Wilczynska et al. (2005), McDonald et al. (2006), Harding et al. (2009) in der IARC-Monographie entweder unberücksichtigt blieben oder nur für andere Krebserkrankungen zur Auswertung herangezogen wurden, ist nicht ohne weiteres erkennbar.
Zusammenfassend ist festzustellen, dass aus weitgehend nachvollziehbaren Gründen Unterschiede in der Heranziehung von Studien zwischen Camargo et al. (2011) und der IARC (2012) vorliegen. Wichtig ist die Feststellung, dass die von der IARC (2012) bei breiterer Auswahl (einschließlich Fall-Kontroll-Studien und einschließlich alleiniger Umweltexposition gegenüber Asbest) gegenüber Camargo et al. (2011) hinzugezogenen Studien ausnahmslos in die Richtung eines erhöhten Erkrankungsrisikos an Ovarialkarzinomen bei Asbestexponierten gehen.
2.2 Weiterführende Erkenntnisse aus den systematischen Reviews von Reid et al. (2011) und Bounin et al. (2014)
Neben der Arbeit von Camargo et al. (2011) liegen noch zwei weitere systematische Reviews mit Meta-Analyse vor (Reid et al. 2011 und Bounin et al. 2014).
Reid et al. (2011) errechneten für den Zusammenhang zwischen Asbestexposition und Ovarialkarzinomen eine 75%-ige Risikoerhöhung (95 % CI 1,45-2,10), wobei die Autoren diesen Effekt in erster Linie auf pathologisch-anatomische Fehlklassifizierungen in den einzelnen Studien zurückführen. Als Begründung wird in erster Linie genannt, dass sich der Effekt abschwächte, wenn nur diejenigen Studien analysiert wurden, die Krebsinzidenz (und nicht -mortalität) als Endpunkt einschlossen. Allerdings sollte bedacht werden, dass die dann beobachtete Effektgröße von 1,29 (95 % CI 0,97-1,73) weiterhin auf einen Zusammenhang zumindest hindeutet und der Effekt möglicherweise nur aufgrund fehlender statistischer Power nicht mehr statistisch signifikant ist, da lediglich vier in den Review eingeschlossenen Studien mit Inzidenzdaten arbeiteten. Eine Sub-Analyse der Mortalitätsstudien mit pathologisch bestätigter Ovarialkarzinomdiagnose errechnete eine Risikoerhöhung um 53 % (OR 1,53, 95 % CI 1,20-1,95).
Um die vordergründig divergierenden Schlussfolgerungen zwischen den Reviews von Camargo et al. (2011) und Reid et al. (2011) genauer zu untersuchen, erscheint es erforderlich, die Differenzen zwischen den beiden Arbeiten im Hinblick auf die eingeschlossenen Studien näher zu betrachten:
Die Fall-Kontroll-Studie von Rosenblatt et al. (1992), die nur in den Review von Reid eingeschlossen wurde, hat zwar die Diagnosen der Fälle überprüft, jedoch dürfte die Exposition bezüglich Asbest keinesfalls spezifisch sein, denn sowohl bei den Fällen als auch bei den Kontrollen gelten fast 90 % der Probanden als exponiert. Diese Studie sollte daher nicht in einen Review aufgenommen werden.
Eine weitere kritisch zu betrachtende Studie, welche ebenfalls nur im Review von Reid berücksichtigt wurde, ist die Arbeit von Vasama-Neuvonen et al. (1999). Es handelt sich hierbei nicht um eine arbeitsmedizinische Kohortenstudie im klassischen Sinne, da hier nicht die Belegschaft bestimmter Betriebe, sondern die gesamte Population der weiblichen Beschäftigten Finnlands untersucht wird. Über der Exposition dürfte deshalb ein erhebliches Rauschen liegen, was zu einer Reduktion des Schätzers führt. Die Zugrundelegung einer Job-Exposure-Matrix, bei der 7% der gesamten Population der weiblichen Beschäftigten als asbestexponiert angesehen wird, scheint die Exposition zu überschätzen, was zu einem konservativeren Effektschätzer führt. Da diese Studie durch ihre hohe Fallzahl ein hohes Gewicht (28,6 %) in der Meta-Analyse bekommt und auf Inzidenzdaten beruht, trägt sie stark zu der von Reid et al. (2011) beschriebenen geringen Effektgröße bei.
Die norwegische Fall-Kontroll-Studie von Langseth et al. (2004), welche im Review von Camargo et al. (2011) ausgeschlossen, jedoch von Reid et al. (2011) eingeschlossen wurde, sollte mit in ein Review aufgenommen werden. Die Exposition erscheint ausreichend beschrieben.
Die Kohortenstudie von Ferrante et al. (2007), welche nur von Reid et al. (2011) berücksichtigt wurde, schließt die Ehefrauen der in der Studie von Magnani et al. (2008) untersuchten Asbestarbeiter der Firma Eternit ein. Da bei den Ehefrauen auch extrem hohe Mesotheliom-Risiken beobachtet wurden, kann man diese Kohorte durchaus in einem Review berücksichtigen.
Auch der Umgang mit der Kohortenstudie von Reid et al. (2009) ist in den beiden Reviews unterschiedlich. Camargo et al. (2011) verwenden nur den Teil, der sich auf die in der Asbestindustrie beschäftigten Frauen bezieht, während Reid et al. (2011) die gesamte Population einbeziehen. Hier erscheint der Ansatz von Camargo et al. (2011) plausibler.
Es wurde zur Vorbereitung der Empfehlung für diese Berufskrankheit eine neuerliche Meta-Analyse erstellt (Stand September 2016). Diese Meta-Analyse ging über die Arbeit von Camargo et al. (2011) hinaus und berücksichtigte zusätzlich die Arbeiten von Langseth et al. (2004) sowie Ferrante et al. (2007). Weiterhin wurden die beiden zwischenzeitlich publizierten Studien von Wang et al. (2013) und Oddone et al. (2014) eingeschlossen. Auch wurde die Arbeit von Pira et al. (2007) durch diejenige von Pira et al. (2016) aktualisiert.
Diese Meta-Analyse wurde mit der Software STATA durchgeführt (version 14; Stata Corp LP, College Station, TX, USA) und dem entsprechenden Makro Metan.
Es ergab sich folgendes Ergebnis (Abbildung 1):
Abbildung 1: Meta-Analyse zum Zusammenhang zwischen beruflicher Exposition gegenüber Asbest und Ovarialkarzinomen, basierend auf Camargo et al. (2011) und zusätzlicher Berücksichtigung der Daten von Langseth et al. (2004), Ferrante et al. (2007), Wang et al. (2013) und Oddone et al. (2014), Ersatz von Pira et al. (2007) durch Pira et al. (2016).
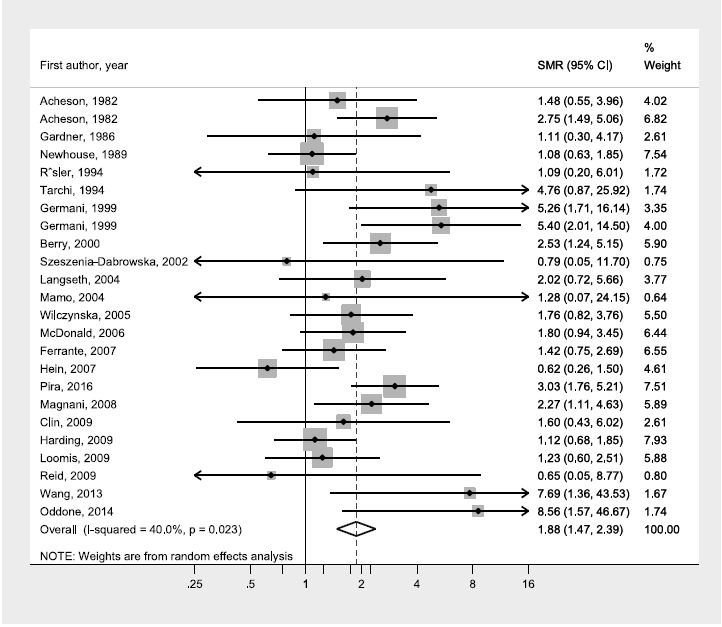
Die Meta-Analyse aller Studien unter Verwendung eines Modelles mit zufälligen Effekten ergab SMRoverall = 1,88 (95 % CI 1,47-2,39).
Unterscheidet man wie bei Reid et al. (2011) nach "Ovarian cancers confirmed", so erhält man für die Studien ohne histologische Verifikation einen gepoolten Effektschätzer von 1,89 (95 % CI 1,40-2,55) und für jene mit histologischer Sicherung einen gepoolten Effektschätzer von 1,98 (95 % CI 1,32-2,97). Der Unterschied ist damit vernachlässigbar (p > 0.8).
Ein zusätzlicher Review - jedoch ohne Meta-Analyse - wurde von Bounin et al. (2014) durchgeführt. Er beinhaltet - über Camargo et al. (2011) hinausgehend - auch die in vorstehende Meta-Analyse eingeschlossenen Arbeiten von Wang et al. (2013) und Oddone et al. (2014). Auch diese Autoren kommen zu dem Schluss, dass von einem konsistent erhöhten Erkrankungsrisiko in Folge von Asbestexposition gesprochen werden kann.
Insgesamt können die Ergebnisse von Camargo et al. (2011) also als bestätigt angesehen werden.
2.3 Bedeutung möglicher pathologisch-anatomischer Fehlklassifikationen
Prinzipiell ist die Möglichkeit der Fehlklassifikation von peritonealen Karzinomen und auch von Peritonealmesotheliomen als Ovarialkarzinom zu bedenken.
So beschrieb Otto (1985), dass die Differenzierung zwischen bivalenten malignen Mesotheliomen und primären Ovarialkarzinomen häufig problematisch sei. Auch Großgarten und Woitowitz (1991) berichteten, dass bei drei von zwölf Patientinnen, die an Peritonealmesotheliomen verstorben waren, zunächst histologisch die Diagnose eines metastasierenden Ovarialkarzinoms gestellt worden war.
Auch Grzankowski et al. (2015) und Hancock et al. (2016) wiesen in kasuistischen Darstellungen darauf hin, dass klinisch seitens der gynäkologischen Operateure vordergründig an ein Ovarialkarzinom gedacht werden kann, wobei sich histologisch in den beiden publizierten Fällen ein malignes Peritonealmesotheliom ergab.
Daher ist die von Camargo et al. (2011) vorgenommene Sensitivitätsanalyse zur Frage der Auswirkungen von Fehlklassifikationen wichtig: Selbst unter der Annahme, dass in 20 % der Fälle die Diagnose eines Ovarialkarzinoms eine Fehlklassifikation wäre, blieb das standardisierte Mortalitätsverhältnis mit 1,42 (95 % CI 1,11-1,82) signifikant erhöht.
Man darf in den publizierten Studien, in denen die histologische Sicherung noch nicht mit der hohen Sensitivität und Spezifität der heutigen Diagnostik erfolgte, von einer nicht-differentiellen Fehlklassifikation ausgehen, da Fehldiagnosen (Peritonealmesotheliom statt Ovarialkarzinom und umgekehrt) unabhängig von der Asbestexposition sind. Nicht-differentielle Fehlklassifikation führt generell zur Unterschätzung des Risikos, d. h., das wahre Risiko ist höher als der Erwartungswert aller publizierten Schätzer.
Die Versorgungsqualität der histopathologischen Diagnostik von Ovarialkarzinomen ist heute auch unter Berücksichtigung immunhistochemischer Verfahren so hoch, dass bei aktuell diagnostizierten Patientinnen kaum Fehldiagnosen zu erwarten sind.
2.4 Bedeutung möglicher nicht-identifizierter oder nicht-publizierter Studien
Auf Nachfrage hat der korrespondierende Autor des Reviews von Camargo et al. (2011) am 15. Dezember 2014, wie bereits vorstehend im Abschnitt 1.2.3 ausgeführt, die exakte Such-Syntax zur Verfügung gestellt. Diese entspricht der guten epidemiologischen Praxis und erscheint angemessen, um alle für die Thematik relevanten Studien identifizieren zu können. Zusätzlich gaben die Autoren an, auch die Referenzlisten der identifizierten Publikationen nach weiteren relevanten Artikeln durchsucht zu haben. Es kann somit mit ausreichender Sicherheit davon ausgegangen werden, dass die Ergebnisse von Camargo und Kollegen nicht dadurch beeinträchtigt sind, dass relevante Artikel übersehen wurden.
Durch Volltext-Screening war überdies sichergestellt, dass Publikationen, in denen das Ovarialkarzinom nicht explizit in der Zusammenfassung, sondern möglicherweise nur in Tabellen genannt wurde, erfasst wurden.
Ebenso haben sich Camargo et al. (2011) mit der Möglichkeit eine Publikationsbias, d. h. einer möglichen Verzerrung des Reviews aufgrund bevorzugter Veröffentlichung von Studien mit "positiven" Ergebnissen auseinandergesetzt. Die Analyse lieferte keine Hinweise auf das Vorliegen eines relevanten Publikationsbias.
3. Zusammenfassende Bewertung
Die Auswertung der international verfügbaren arbeitsmedizinisch-epidemiologischen Literatur, insbesondere die IARC-Bewertung (2012) und die Meta-Analyse von Camargo et al. (2011), ergänzt durch eine aktuelle chinesische (Wang et al. 2013) sowie eine italienische Kohortenstudie (Oddone et al. 2014), lassen eine berufliche Asbestexposition als generell geeignet für die Entstehung von Ovarialkarzinomen ansehen.
Zwei weitere systematische Reviews mit (Reid et al. 2011) und ohne (Bounin et al. 2014) Meta-Analyse liefern ebenfalls unterstützende Evidenz.
Unterstützende epidemiologische Evidenz liefern umweltepidemiologische Befunde (Reid et al. 2008, Ferrante et al. 2007) sowie Daten zur Verwendung von asbesthaltigem Damm-Puder (Gross und Berg 1995, Huncharek et al. 2003). Es ist nicht anzunehmen, dass Dammpuder bei beruflich Exponierten im Vergleich zu beruflich Nicht-Exponierten in unterschiedlicher Weise zur Anwendung kam, so dass der Effektschätzer durch berufliche Asbestexposition unabhängig von außerberuflicher Anwendung von Dammpuder sein dürfte.
Die Meta-Analyse von Camargo et al. (2011) ergab summarisch für beruflich Asbest-exponierte Kohorten ein gepooltes standardisiertes Mortalitätsrisiko (SMR) von 1,77 (95% CI 1,37-2,28).
Die Effektschätzer waren in der Meta-Analyse von Camargo et al. (2011) höher, wenn die Erkrankten bereits eine Entschädigung für eine Asbestose erhielten: bei diesen Personen lag die SMR bei 4,67 (95 % CI 2,28-9,54). Auch in Subgruppen, bei denen die SMR für Lungenkarzinome über 2,0 lag, war die gepoolte SMR für Ovarialkarzinome über 2 erhöht: Sie betrug 2,25 (95 % CI 1,64-3,07) (Tabelle 2).
Auch sei erwähnt, dass die SMR in europäischen Studien mit 1,95 (95 % CI 1,51-2,51) höher war als in US-amerikanischen oder australischen Studien (Tabelle 2).
Zur Annäherung an eine Dosis-Wirkungs-Abschätzung nahmen Camargo et al. (2011) in Form einer Subgruppen-Analyse eine Meta-Analyse derjenigen Studien vor, die die Ergebnisse von Frauen mit der höchsten beruflichen Asbestexposition in solchen Studien zusammenfassten, die entweder Dauer oder kumulative Asbestexposition angaben. Dies war in insgesamt sechs Studien möglich (Berry et al. 2000, Hein et al. 2007, Loomis et al. 2009, Magnani et al. 2008, Pira et al. 2005, Wignall and Fox 1982; siehe Tabelle 3). Die gepoolte SMR für Ovarialkarzinome in diesen sechs hochexponierten Gruppen lag bei 2,78 (95% CI 1,36-5,66).
4. Abgrenzung der bestimmten Personengruppe gemäß § 9 Absatz 1 SGB VII
Die vorliegende epidemiologische Literatur, zusammengefasst von der IARC (2012), belegt die generelle Geeignetheit einer beruflichen Asbestexposition für die Verursachung von Ovarialkarzinomen. Metaanalytisch ausgewertet von Camargo et al. (2011) zeigt sich ein standardisiertes Mortalitätsverhältnis von 1,77 (95 % CI 1,37-2,28) in beruflich Asbest-exponierten Kohorten. Das Verdoppelungsrisiko für Ovarialkarzinome bei beruflich Asbest-Exponierten wird erreicht bzw. überschritten bei:
Die Studien, die von der IARC (2012) bzw. von Camargo et al. (2011) zur Bewertung des Risikos eines Ovarialkarzinoms durch Asbest herangezogen wurden, einschließlich neuerer Publikationen, lassen per se kein quantitativ präzises "Abschneidekriterium" im Sinne einer kumulativen Asbestfaserdosis errechnen. Es ist jedoch naheliegend, auf inländische Vorarbeiten zurückzugreifen, die das Verdoppelungsrisiko für die Entstehung eines Lungenkarzinoms im Sinne der BK-Nr. 4104 unter drei Bedingungen bejahen: Dies ist im deutschen Berufskrankheitenrecht bis dato gegeben
Wenn nun die Personengruppe, bei der das Verdoppelungsrisiko für die Entstehung eines Lungenkarzinoms durch arbeitsbedingte Asbestexposition gegeben ist, aufgrund der Daten von Camargo et al. (2011) überdies ein im Mittel 2,25-fach (95 % CI 1,64-3,07) erhöhtes Risiko für die Mortalität an einem Ovarialkarzinom aufweist, so scheint es wissenschaftlich legitim und gerechtfertigt, die Anerkennung eines Ovarialkarzinoms als Berufskrankheit infolge beruflicher Asbestexposition an dieselben medizinischen und arbeitstechnischen Voraussetzungen zu knüpfen, die für die Bejahung eines asbestbedingten Lungenkarzinoms gefordert werden, da auch bei Einführung dieser Berufskrankheit (BK-Nr. 4104) das Verdoppelungsrisiko für die Entstehung eines Lungenkarzinoms (später auch Kehlkopfkarzinoms) durch eine berufsbedingte Asbestexposition im Fokus stand. Diese Einschätzung steht in Übereinstimmung mit den 2014 publizierten Helsinki-Kriterien (Oksa et al., 2014).
Acheson ED, Gardner MJ, Pippard EC, Grime LP. Mortality of two groups of women who manufactured gas masks from Chrysotile and crocidolite asbestos: A 40-year follow-up. Br J Ind Med 1986; 39:344-348
Altinoz MA, Korkmaz R. NF-kappaB, macrophage migration inhibitory factor and cyclooxygenase-inhibitions as likely mechanisms behind the acetaminophen- and NSAID-prevention of the ovarian cancer. Neoplasma 2004; 51:239-247
Berry G, Newhouse ML, Wagner JC. Mortality from all cancers of asbestos factory workers in east London 1933-80. Occup Environ Med 2000; 57:782-785
Bounin A, Charbotel B, Fervers B, Bergeret A. Professional risk factors associated with the cancer of the ovary. Literature review. Bull Cancer. 2014;101:1089-1108
Camargo MC, Stayner LT, Straif K, et al. Occupational exposure to asbestos and ovarian cancer: a meta-analysis. Environ Health Perspect 2011; 119:1211-1217
Clin B, Morlais F, Dubois B, et al. Occupational asbestos exposure and digestive cancers - a cohort study. Aliment Pharmacol Ther 2009; 30:364-374
DGUV, Deutsche Gesetzliche Unfallversicherung: BK Report "Faserjahre", 2013. http://publikationen.dguv.de/dguv/ pdf/10002/bk_rep01 13.pdf
Ferlay J, Shin HR, Bra. F. Forman D, Mathers C, Parkin DM. 2010. GLOBOCAN 2008, v1.2, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 10 [ Internet]. Available: http://globocan.iarc.fr [accessed 20 October 2010].
Ferrante D, Bertolotti M, Todesco A et al. (2007). Cancer mortality and incidence of mesothelioma in a cohort of wives of asbestos workers in Casale Monferrato, Italy. Environ Health Perspect 2007; 115:1401-1405
Gardner MJ, Winter PD, Pannett B, Powell CA. Follow up study of workers manufacturing chrysotile asbestos cement products. Br J Ind Med 1986; 43:726-732
Germani D, Belli S. Bruno C, et al. Cohort mortality study of women compensated for asbestosis in Italy. Am J Ind Med 1999; 36:129-134
Gross AJ, Berg PH. A meta-analytical approach examining the potential relationship between talc exposure and ovarian cancer. Journal of Exposure Analysis and Environmental Epidemiology 1995; 5:181-195
Großgarten K, Woitowitz HJ. Tödliche Peritonealmesotheliomerkrankungen bei Frauen infolge Asbesteinwirkung am Arbeitsplatz. Gynäkologe 1991; 21:261-264
Grzankowski KS. Brightwell RM, Kasznica JM, Odusi KO. Malignant peritoneal mesothelioma without asbestos exposure: An ovarian cancer imitator. Gynecologic Oncology Reports 2015; 11:10-12
Hancock KL, Clinton CM, Dinkelspiel HE, Saab J, Schneider B, Caputo TA. A case of mesothelioma masquerading preoperatively as ovarian cancer and brief review of the literature. Gynecologic Oncology Reports 2016; 17:26-28
Harding A-H, Darnton A, Wegerdt J, McElvenny D. Mortality among British asbestos workers undergoing regular medical examinations (1971-2005). Occup Environ Med 2009; 66:487-495
Hein MJ, Stayner LT, Lehman E, Dement JM. Follow-up study of chrysotile textile workers: cohort mortality and exposure-response. Occup Environ Med 2007; 64:616-625
Huncharek M, Geschwind JF, Kupelnick B. Perineal application of cosmetic talc and risk of invasive epithelial ovarian cancer: a meta-analysis of 11,933 subjects from sixteen observational studies. Anticancer Research. 2003; 23:1955-1960
IARC, International Agency for the Research on Cancer. IARC Monographs, Volume 100 C. A Review of Human Carcinogens. Arsenic, Metals, Fibres, and Dusts. World Health Organization, IARC, Lyon 2012
Langseth H & Kjærheim K. Ovarian cancer and occupational exposure among pulp and paper employees in Norway. Scand J Work Environ Health 2004; 30:356-361
Loomis D, Dement JM, Wolf SH, Richardson DB. Lung cancer mortality and fibre exposure among North Carolina asbestos textile workers. Occup Environ Med 2009; 66:535-542
Magnani C, Ferrante D, Barone-Adesi F, et al. Cancer risk after cessation of asbestos exposure: a cohort study of Italian asbestos cement workers. Occup Environ Med 2007; 65:164-170
Mamo C, Costa G. Mortality experience in a historical co-hort of chrysotile asbestos textile workers. In: Proceedings from the Global Asbestos Congress, 19-21 November 2004, Waseda University, Tokyo, Japan
Marten M, Dirksen M, Püschel K, Lieske K. Verteilung von Asbestkörpern in menschlichen Organen. Pathologe 1989; 10:114-117
McDonald JC, Harris JM, Berry G. Sixty years on: the price of assembling military gas masks in 1940. Occup Environ Med 2006; 63:852-855
Muscat JE, Huncharek MS. Perineal talc use and ovarian cancer: A critical review. Eur J Cancer Prev 2008; 17:139-146
Ness RB, Cottreau C. Possible role of ovarian epithelial inflammation in ovarian cancer. J Natl Cancer Inst 1999; 91:1459-1467
Newhouse ML, Sullivan KR. A mortality study of workers manufacturing friction materials: 1941-86. Br J Ind Med 1989; 46:176-179
Oddone E, Ferrante D, Cena T, Tùnesi S. Amendola P, Magnani C. [Asbestos cement factory in Broni (Pavia, Italy): a mortality study]. Med Lav. 2014;105:15-29
Oksa P, Wolff H, Vehmas, Pallasaho P, Frilander H (eds.) Asbestos, asbestosis, and cancer - Helsinki Criteria for Diagnosis and Attribution (2014) Finnish Institute of Occupational Health
Otto H. Pathology of pleural mesothelioma. Thorac Cardiovasc Surgeon 1985; 33:332-334
Paalani M, Lee JW, Haddad E, Tonstad S. Determinants of inflammatory markers in a bi-ethnic population. Ethn Dis 2011;21:142-149
Pira E, Pelucchi C, Buffoni L, Palmas A, Turbiglio M, Negri E, et al. Cancer mortality in a cohort of asbestos textile workers. Br J Cancer 2005; 92:580-586
Pira E, Pelucchi C, Piolatto PG, Negri E, Discalzi G, La Vecchia C. First and subsequent asbestos exposures in relation to mesothelioma and lung cancer mortality. Br J Cancer 2007; 97:1300-1304
Pira E, Romano C, Violante FS. Farioli A, Spatri G, LaVecchia C, Boffetta P. Updated mortality study of a cohort of asbestos textile workers. Cancer Medicine doi:10.1002/ cam4.824 (2016)
Pukkala E, Martinsen JI, Lynge E et al. (2009). Occupation and cancer - follow-up of 15 million people in five Nordic countries. Acta Oncol, 2009;48:646-790
Reid A, Heyworth J, de Klerk N, Musk AW (2008). The mortality of women exposed environmentally and domestically to blue asbestos at Wittenoom, Western Australia. Occup Environ Med, 2008; 65:743-749
Reid A, Segal A, Heyworth JS. de Klerk NH, Musk AW. Gynecologic and breast cancers in women after exposure to blue asbestos at Wittenoon. Cancer Epidemiol Biomarkers Prev 2009; 18:140-147
Reid A, de Klerk N, Musk AW. Does exposure to asbestos cause ovarian cancer? A systematic literature review and meta-analysis. Cancer Epidemiol Biomarkers Prev. 2011;20: 1287-1295.
Risch HA. Hormonal etiology of epithelial ovarian cancer, with a hypothesis concerning the role of androgens and progesterone. J Natl Cancer Inst 1998; 90:1774-1786
Rösler JA, Woitowitz Hj, Lange Hj, Woitowitz RH, Ulm K, Rödelsperger K. Mortality rates in a female cohort following asbestos exposure in Germany. J Occup Med 1994; 36:889-893
Rosenberg L, Palmer JR, Zauber AG, Warshauer ME, Lewis JL, jr, Strom BL, Harlap S. Shapiro S. A case-control study of oral contraceptive use and invasive epithelial ovarian cancer. Am J Epidemiol 1994;139:654-661
Rosenblatt KA, Szklo M, Rosenshein NB. Mineral fiber exposure and the development of ovarian cancer. Gynecologic oncology. 1992;45:20-25
Saad AF, Hu W, Sood AK. Microenvironment and pathogenesis of epithelial ovarian cancer. Horm Cancer 2010; 1:277-290
Schildkraut JM, Abbott SE, Alberg AJ, Bandera EV, Barnholtz-Sloan JS. Bondy ML, Cote ML, Funkhouser E, Peres LC, Peters ES. Schwartz AG, Terry P, Crankshaw S. Camacho F, Wan. F. Moorman PG. Association between body powder use and ovarian cancer: The African American Cancer Epidemiology Study (AACES). Cancer Epidemiol Biomarkers Prev (2016) Online first: doi:10.1158/1055-9965. EPI-15-1281
Stayner L, persönliche Kommunikation (15.12.2014)
Szeszenia-Dabrowska N, Wilczynska U, Szymczak W, Strzelecka A. Mortality study of workers compensated for asbestosis in Poland, 1970-1997. Int J Occup Med Environ Health 2002; 15:267-278
Tarchi M, Orsi D, Comba P, et al. Cohort mortality study of rock salt workers in Italy. Am J Ind Med 1994; 25:251-256
Terry KL, Karageorgi S. Shvetsov YB, Merritt MA, Lurie G, Thompson PJ, Carney ME, Palmieri Weber R, Akushevich L, Lo-Ciganic W-H, Cushing-Haugen K, Sieh W, Moysich K, Doherty JA, Nagle CM, Berchuck A, Pearce CL, Pike M, Ness RB, Webb PM, for the Australian Cancer Study (Ovarian Cancer), and the Australian Ovarian Cancer Study Group; Rossing MA, Schildkraut J, Risch H, Goodman MT, on behalf of the Ovarian Cancer Association Consortium. Genital powder use and risk of ovarian cancer: A pooled analysis of 8525 cases and 9859 controls. Cancer Prev Res 2013; 6:811-821
Trabert B. Body powder and ovarian cancer risk - what is the role of recall bias? Cancer Epidemiol Biomarkers Prev (2016) Online first: doi:10.1158/1055-9965.EPI-16-0476
Vasama-Neuvonen K, Pukkala E, Paakkulainen H et al. Ovarian cancer and occupational exposures in Finland. Am J Ind Med 1999; 36:83-89
Wang X, Lin S. Yu I, Qiu H, Lan Y, Yano E. Cause-specific mortality in a Chinese chrysotile textile worker cohort. Cancer science. 2013;104:245-249.
Wignall BK, Fox AJ (1982). Mortality of female gas mask assemblers. Br J Ind Med 1982; 39: 34-38
Wilczynska U, Szymczak W, Szeszenia-Dabrowska N. Mortality from malignant neoplasms among workers of an asbestos processing plant in Poland: results of prolonged observation. Int J Occup Med Environ Health 2005; 18:313-326
Tabelle 1: Charakteristika der Studien in der Meta-Analyse von Camargo et al. (2011)
| Referenz | Land | Nationale Inzidenz- rate des Ovarial- karzi- noms° | Endpunkt | Industrie | Asbest Art | Größe der Ko- horte | Zeit der Beschäftigung | Follow-up Zeitraum | Personen - Jahre | Anzahl der Sterbe- fälle | Anzahl an Krebs- Er- krank- ter | Lungen- krebs SMR | Ovarialkarzinom - Befunde | |
| Beobachtete/ Erwartete Sterbefälle oder Fälle | SMR oder SIR (95 % CI) | |||||||||||||
| Acheson et al. 1982 | Vereinigtes Königreich | 12,8 | Sterblichkeit | Gasmasken-Montage (in Leyland und Preston) | Krokydolit | 757 | 1927-1939 | 1951-1980 | 18.781 | 219 | 66 | 2,41** | 12/4,4 | 2,75 (1,42-4,81) |
| Sterblichkeit | Gasmasken-Montage (in Blackburn) | Chrysotil | 570 | 1972-1945 | 1951-1980 | 14.324 | 177 | 44 | 1,45** | 5/3,4 | 1,48 (0,48-3,44) | |||
| Gardner et al. 1986 | Vereinigtes Königreich | 12,8 | Sterblichkeit | Zement | Chrysotil | 657 | 1941-1954 | 1941-1984 | - | 102 | 26 | 1,42 | 3/2,7 | 1,11 (0,23-3,25) |
| Newhouse and Sullivan 1989 | Vereinigtes Königreich | 12,8 | Sterblichkeit | Produktion von Reibmate-Hallen | Chrysotil | 4.345 | 1941-1979 | 1941-1986 | - | 522 | 148 | 0,66** | 11/10'1 | 1,08 (0,61-1,79) |
| Rösler et al. 1994 | Deutschland | 10 | Sterblichkeit | Verschiedene (hauptsächlich Textilien) | Verschiedene (hauptsächlich Chrysotil) | 616 | - | 1977-1988 | 6.236 | 64 | 32 | 3,39 | 2/1,8 | 1,09 (0,13-3,95) |
| Tarchi et al' 1994 | Italien | 8,7 | Sterblichkeit | Bergbau | Chrysotil | 120 | - | 1965-1989 | - | 28 | 8 | 4,14*** | 2/0,42 | 4,76 (0,58-17,2) |
| Germani et al. 1999 | Italien | 8,7 | Sterblichkeit | Textilien | Chrysotil | 276 | - | 1980-1997 | 3.761 | 123 | 40 | 6,82 | 4/0,76 | 5,26 (1,43-13,47) |
| Sterblichkeit | Zement | Verschiedene (hauptsächlich Krokydolit) | 278 | - | 1980-1997 | 3.932 | 129 | 54 | 2,39 | 5/0,93 | 5,40 (1,75-12,61) | |||
| Berry et al. 2000 | Vereinigtes Königreich | 12,8 | Sterblichkeit | Textilien | Verschiedene | 700 | 1936-1942 | Bis Juni 1980 | 17.146 | - | 129 | 7,46 | 9/3,56 | 2,53 (1,16-4,80) |
| Szeszenia-Dabrowska et al. 2002 | Polen | 12,6 | Sterblichkeit | Verschiedene | Verschiedene | 490 | 1970-1997 (Diagnose) | Bis 31. Dezember 1999 | - | 121 | 34 | 6,21 | 1/1,27 | 0,79 (0,02-4,39) |
| Mamo 2004 | Italien | 8,7 | Sterblichkeit | Textilien | Chrysotil | 645 | 1951-1978 | 1981-1995 | 7.450 | 84 | 36 | 5,23 | 1/0,78 | 1,28 (0,02-7,12) |
| Wilczynska et al. 2005 | Polen | 12,6 | Sterblichkeit | Verschiedene | Verschiedene | 1.201 | 1945-1980 | Bis 31. Dezember 1999 | - | 414 | 124 | 2,09 | 8/4,5 | 1,76 (0,76-3,47) |
| McDonald et al. 2006 | Vereinigtes Königreich | 12,8 | Sterblichkeit | Gasmasken-Montage | Krokydolit | 1.073 | 1940-1944 | 1963-2003 | - | - | - | 2,73- | 10/5,6 | 1,80 (0,9-3,3) |
| Hein et al. 2007 | Vereinigte Staaten von Amerika | 8,8 | Sterblichkeit | Textilien | Chrysotil | 1.265 | 1940-1965 | 1979-2001 | 49.22 | 709 | 169 | 2,22*** | 6/9,68 | 0,62 (0,23-1,35) |
| Pira et al. 2007 | Italien | 8,7 | Sterblichkeit | Textilien | Verschiedene | 1.077 | 1946-1984 | Bis 31. Dezember 2004 | 36.86 | 254 | 130 | 6,5 | 8/2,8 | 2,83 (1,22-5,57) |
| Magnani et al. 2008 | Italien | 8,7 | Sterblichkeit | Zement | Verschiedene | 777 | 1912-1986 | 1965-2003 | 22.67 | 371 | 169 | 2,21 | 9/4 | 2,27 (1,04-4,32) |
| Loomis et al. 2009 | Vereinigte Staaten von Amerika | 8,8 | Sterblichkeit | Textilien | Chrysotil | 1.795 | 1950-1973 | Bis 31. Dezember 2003 | 59.49 | 608 | 160 | 1,73*** | 9/7,34 | 1,23 (0,56-2,33) |
| Reid et al' 2009 | Australien | 7,7 | Neuerkrankung | Bergbau und Fräsen | Krokydolit | 416 | 1943-1966 | 1960-2006 | - | - | - | - | 1/1,54 | 0,65 (0,02-3,64) |
| Harding et al. 2009 | Vereinigtes Königreich | 12,8 | Sterblichkeit | Verschiedene | Verschiedene | 4.495 | - | 1971-2005 | 103.94 | - | - | - | 17/15'2 | 1,12 (0,66-1,80) |
| Clin et al' 2009 | Frankreich | 7,7 | Sterblichkeit | Verschiedene | Verschiedene | 420 | - | 1978-2004 | - | - | 11 | - | 3/1,88 | 1,60 (0,33-4,67) |
_____
- = nicht verfügbar,
* Fälle per 100,000 Frauen, GLOBOCAN 2008 (Ferlay et al. 2010) " Lunge und Rippenfell mit inbegriffen
*" Luftröhre, Bronchien und Lunge mit inbegriffen
"" Von Wignall un.F.x (1982)
Tabelle 2: Gepoolte Random-effects-Modellbasierte SMR-Schätzer und 95 %-Konfidenzintervalle für das Ovarialkarzinom in Zusammenhang mit Asbestexposition entsprechend den Charakteristika der Studien (Camargo et al., 2011)
| Kovariable | n› | Gepoolte SMR (95 % CI) | I2(%) | PQ | PLLR | Adjustiertes R2 (%)b |
| Keine Kovariable | 20 | 1,77 (1,37-2,28) | 35,3 | 0,06 | - | |
| Endpunkt | ||||||
| Neuerkrankung | 1 | - | - | - | 0,48 | -1,8 |
| Mortalität | 19 | 1,79 (1,38-2,31) | 37,6 | 0,05 | ||
| Asbest Art | ||||||
| Chrysotil | 8 | 1,40 (0,88-2,21) | 39,2 | 0,12 | 0,26 | 17,8 |
| Krokydolit | 3 | 2,18 (1,40-3,37) | 0,0 | 0,42 | ||
| Verschiedene | 9 | 2,00 (1,41-2,84) | 29,9 | 0,18 | ||
| Entschädigung für Asbestose | ||||||
| Ja | 3 | 4,67 (2,28-9,54) | 0,0 | 0,41 | 0,01 | 52,0 |
| Nein | 17 | 1,60 (1,28-2,00) | 17,6 | 0,25 | ||
| Geographische Region | ||||||
| Europa | 17 | 1,95 (1,51-2,51) | 28,2 | 0,13 | 0,03 | 26,2 |
| Vereinigte Staaten von Amerika und Australien | 3 | 0,92 (0,54-1,59) | 0,0 | 0,48 | ||
| Pathologische Bestätigung | ||||||
| Ja | 2 | 2,08 (1,05-4,14) | 0,0 | 0,36 | 1,0 | -14,0 |
| Nein | 18 | 1,76 (1,34-2,31) | 39,7 | 0,04 | ||
| Follow-up Zeitraum in Jahren | ||||||
| < 25 | 6 | 1,83 (0,81-4,16) | 67,2 | 0,01 | 1,0 | -15,2 |
| > 25 | 14 | 1,73 (1,38-2,16) | 7,9 | 0,37 | ||
| Stichproben Größe | ||||||
| < 500 | 6 | 3,37 (1,82-6,25) | 9,0 | 0,36 | 0,01 | 100,0 |
| 500 - 1.000 | 7 | 2,16 (1,54-3,03) | 0,0 | 0,80 | ||
| > 1.000 | 7 | 1,35 (0,99-1,84) | 34,0 | 0,17 | ||
| SMR für Lungenkrebs | ||||||
| < 2,0 | 4 | 1,18 (0,81-1,72) | 0,0 | 0,96 | < 0,001 | 89,7 |
| > 2,0 | 13 | 2,25 (1,64-3,07) | 30,5 | 0,14 | ||
| Keine Daten verfügbar | 3 | 1,15 (0,73-1,82) | 0,0 | 0,81 | ||
| Industrie | ||||||
| Bergbau | 2 | 2,27 (0,34-14,97) | 36,7 | 0,21 | 0,55 | -20,0 |
| Textilien | 5 | 1,73 (0,81-3,70) | 65,0 | 0,02 | ||
| Zement | 3 | 2,56 (1,17-5,58) | 47,8 | 0,15 | ||
| Gasmasken Montage | 3 | 2,10 (1,40-3,15) | 0,0 | 0,48 | ||
| Verschiedene | 6 | 1,50 (1,07-2,10) | 0,0 | 0,56 | ||
| Andere | 1 | - | - | - | ||
| Inzidenzrate des Ovarialkarzinoms c | ||||||
| < 12 | 11 | 2,02 (1,27-3,21) | 46,2 | 0,05 | 0,58 | -5,9 |
| > 12 | 9 | 1,59 (1,22-2,06) | 14,5 | 0,31 |
Abkürzungen: - nicht zutreffend, PQ: p-Wert für Heterogenitätstest, PLLR: p-Wert für log-likelihood ratio test (im Vergleich zum Modell ohne Kovariablen), SMR beeinhaltet Daten aus einer Kohorte, in der SIR angegeben war. a: Anzahl der eingeschlossenen Kohorten, b: Schätzer können negativ sein wenn die Kovariable einen geringeren Teil der Heterogenität erklärt, als bei Zufall zu erwarten (Sterne, 2009). c: Nationale Rate, Fälle je 100.000 Frauen, GLOBOCAN 2008 (Ferlay et al. 2010)
Tabelle 3: SMR-Schätzungen von Studien aus der Meta-Analyse von Camargo et al. (2011) mit Auswertung der hochexponierten Gruppen
| Referenz | Land | Industrie | Ovarialkarzinom-Befunde | Variable (höchste Kategorie) | |
| Beobachtete/ Erwartete Sterbefälle | SMR oder SIR (95 % CI) | ||||
| Pira et al. 2005, 2007 | Italien | Textilien | 3/0,53 | 5,74 (1,18-16,7) | Dauer des Beschäftigungsverhältnisses (> 10 Jahre) |
| Berry et al. 2000 | Vereinigtes Königreich | Textilien und vorfabrizierte Zementrohre | 5/0,9 | 5,56 (2,04-12,31) | Exposition und Dauer (starke Exposition mit > 2 Jahre) |
| Wignall und Fox 1982 | Vereinigtes Königreich | Gasmasken-Montage | 3/0,95 | 3,16 (0,65-9,23) | Dauer des Beschäftigungsverhältnisses (> 1 Jahr) |
| McDonald et al. 2006 | |||||
| Loomis et al. 2009 | Vereinigte Staaten von Amerika | Textilien | 6./5,45 | 1,10 (0,37-2,21) | Kumulative Exposition (> 120 Faser-Tage/ml) |
| Hein et al. 2007 | Vereinigte Staaten von Amerika | Textilien | 1/1,99 | 0,50 (1,01-2,80) | Kumulative Exposition und Dauer (> 30 Beschäftigungsjahre und > 5.479 Faser-Tage/ml) |
| Magnani et al. 2008 | Italien | Zement | 2/0,7 | 2,97 (0,35-10,32) | Dauer der Exposition (> 30 Jahre) |
| * Drei Ovarialkarzinom - Fälle aus der vierten Fabrik sind entfallen | |||||
ID: 170160
 | ENDE |  |