 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2006, Tierschutz - EU Bund

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2006, Tierschutz - EU Bund |  |
Entscheidung 2006/437/EG der Kommission vom 4. August 2006 über die Genehmigung eines Handbuchs zur Diagnose der Aviären Influenza gemäß der Richtlinie 2005/94/EG des Rates
(Bekannt gegeben unter Aktenzeichen K(2006) 3477)
(ABl. Nr. L 237 vom 31.08.2006 S. 1;
VO (EU) 2020/689 - ABl. L 174 vom 03.06.2020 S. 211 aufgehoben)
aufgehoben/ersetzt gem. Art. 86 der VO (EU) 2020/689
Die Kommission der Europäischen Gemeinschaften -
gestützt auf die Richtlinie 2005/94/EG des Rates vom 20. Dezember 2005 mit Gemeinschaftsmaßnahmen zur Bekämpfung der Aviären Influenza und zur Aufhebung der Richtlinie 92/40/EWG 1, insbesondere auf Artikel 50 Absatz 1 Unterabsatz 2,
in Erwägung nachstehender Gründe:
(1) Die Richtlinie 2005/94/EG sieht bestimmte Vorbeugungsmaßnahmen hinsichtlich der Überwachung und Früherkennung der Aviären Influenza sowie Mindestbekämpfungsmaßnahmen vor, die bei Ausbruch der Aviären Influenza bei Geflügel oder in Gefangenschaft gehaltenen Vögeln anderer Spezies durchzuführen sind.
(2) Diagnoseverfahren, Vorschriften für die Entnahme von Proben sowie Kriterien für die Bewertung der Ergebnisse von Laboranalysen zur Bestätigung eines Verdachts auf Aviäre Influenza müssen auf Gemeinschaftsebene festgelegt werden.
(3) In Anhang VII zur Richtlinie 2005/94/EG sind die Funktionen und Aufgaben des Gemeinschaftlichen Referenzlabors für Aviäre Influenza festgelegt, das in Absprache mit der Kommission die in den Mitgliedstaaten angewandten Methoden zur Diagnose dieser Krankheit koordiniert. Zu den genannten Funktionen und Aufgaben gehören auch die regelmäßige Durchführung von Tests zum Vergleich der Diagnoseverfahren und die Abgabe von Standardreagenzien auf Gemeinschaftsebene. Vor kurzem wurden Labortests entwickelt, die eine Schnellanalyse der Aviären Influenza ermöglichen.
(4) Anhand der Erfahrungen, die in den vergangenen Jahren bei der Bekämpfung der Aviären Influenza erzielt wurden, konnten Probenahmeverfahren und Kriterien für die Auswertung von Laborbefunden festgelegt werden, die für unterschiedliche Situationen eine gezielte Seuchendiagnose gewährleisten.
(5) Die in dieser Entscheidung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit
- hat folgende Entscheidung erlassen:
Das in der Richtlinie 2005/94/EG vorgesehene und im Anhang zu dieser Entscheidung beschriebene Diagnosehandbuch wird genehmigt.
Die Mitgliedstaaten verwenden das Diagnosehandbuch ab dem Zeitpunkt der Umsetzung der Richtlinie 2005/94/EG in innerstaatliches Recht oder ab dem 1. Juli 2007; maßgebend ist das frühere Datum.
Diese Entscheidung ist an die Mitgliedstaaten gerichtet.
Brüssel, den 4. August 2006
| Handbuch zur Diagnose der Aviären Influenza | Anhang |
Kapitel I
Einführung, Ziele und Definitionen
Der Ausdruck "Probe für Diagnosezwecke" bezeichnet jede Art tierischen Materials, einschließlich eines kompletten Tierkörpers, das für Diagnose- oder Forschungszwecke transportiert wird, jedoch mit Ausnahme infizierter lebender Tiere.
Kapitel II
Beschreibung der Aviären Influenza mit Schwerpunkt auf der Differenzialdiagnose
1. Ätiologie und Virulenz
Bei der Aviären Influenza handelt es sich um eine hoch ansteckende Vireninfektionskrankheit, die durch Viren der Familie Orthomyxoviridae, Gattung Influenzavirus A, verursacht wird. Influenza-A-Viren sind die einzigen Orthomyxoviren, die bekanntermaßen Vögel infizieren können. Zahlreiche Vogelarten sind nachweislich anfällig für Influenza-A-Viren. Ein bedeutendes Reservoir für solche Viren bilden Wasservögel, doch die überwältigende Mehrheit der nachgewiesenen Isolate war niedrig pathogen und wurde bei Hühnern und Truthühnern festgestellt, denen unter den Vögeln, die durch die Seuche gefährdet sind, die wirtschaftlich größte Relevanz zukommt.
Influenza-A-Viren weisen antigenetisch verwandte Nukleoproteine und antigenetisch verwandte Matrixproteine auf, werden jedoch aufgrund der antigenetischen Verwandtschaft der Oberflächenglykoproteine Hämagglutinin (HA) und Neuraminidase (NA) in Subtypen eingeteilt. Zurzeit sind 16 HA-Subtypen (H1 - H16) und 9 NA-Subtypen (N1 - N9) identifiziert. Jedes Influenza-A-Virus besitzt ein HA- und ein NA-Antigen, und zwar anscheinend in beliebiger Kombination.
Influenza-A-Viren werden anhand ihrer Fähigkeit, die Krankheit in anfälligem Geflügel auszulösen, wie folgt in zwei Gruppen unterteilt:
Wildvögel, vor allem Wasserzugvögel, spielen als Reservoirs für das Influenza-A-Virus eine wichtige Rolle, wie durch die Isolation nahezu aller möglichen Kombinationen von HA- und NA-Subtypen aus Wildvögeln nachgewiesen wurde. Generell werden in Wildvögeln, außer im Fall eines Übergreifens von HPAI von infiziertem Geflügel, ausschließlich NPAI-Viren festgestellt.
Die primäre Einschleppung aviärer Influenzaviren in Geflügelbetriebe ist aller Wahrscheinlichkeit nach auf mittelbaren oder unmittelbaren Kontakt mit Wildvögeln zurückzuführen.
Es besteht die Möglichkeit, dass sich solche von einem Wildwirt übertragenen NPAI-Viren bei Hausgeflügel unentdeckt verbreiten, da entsprechende klinische Symptome häufig harmlos sind oder gänzlich fehlen.
Nach dem Übergreifen auf Geflügel können NPAI-Virenstämme der Subtypen H5 und H7 zu HPAI-Stämmen mutieren. Bislang wurden ausschließlich Viren der Subtypen H5 und H7 als Auslöser von HPAI nachgewiesen.
Es scheint zwar, dass mehrere Mechanismen für die Mutation des NPAI-Virus zum HPAI-Virus verantwortlich sein können, doch die Faktoren, die diese Mutation bewirken, sind nicht bekannt. In einigen Fällen hat die Mutation anscheinend am ersten Ort des Auftretens nach dem Übergreifen von Wildvögeln innerhalb kurzer Zeit stattgefunden, wohingegen sich in anderen Fällen das NPAI-Virus über Monate hinweg in Geflügel weiterverbreitet hat, bevor es dann mutierte. Deshalb ist es unmöglich, vorherzusagen, ob und - wenn ja - wann eine solche Mutation statt-findet. Allerdings besteht Grund zu der Annahme, dass die Wahrscheinlichkeit einer Mutation zum HPAI-Virus umso größer ist, je weiter NPAI-Viren in Geflügel verbreitet sind.
Die Inkubationszeit ist schwierig zu bestimmen und variiert wahrscheinlich je nach Virenstamm und Wirt; in der Regel wird sie mit fünf bis sechs Tagen angegeben, doch für einzelne Vögel liegt sie vermutlich zwischen einigen Stunden und etwa sieben Tagen.
2. Klinische Symptome bei Vögeln, die mit dem HPAI-Virus infiziert sind
Die klinischen Symptome variieren erheblich und werden von verschiedenen Faktoren beeinflusst, wie zum Beispiel Virulenz des betreffenden Virus, betroffene Spezies, Alter, Geschlecht, gleichzeitig vorhandene Krankheiten und Umgebung.
Zu den frühzeitigen Symptomen können eine verringerte Futter- und/oder Wasseraufnahme sowie eine relativ niedrige Sterblichkeit gehören. Andererseits kann die Krankheit jedoch auch ganz plötzlich in einem Bestand auftreten, wobei unter Umständen zahlreiche Vögel ohne vorherige Krankheitssymptome oder mit nur minimalen Anzeichen in Form von reduzierter Aktivität, verringerter Futteraufnahme, zerrupften Federn und Fieber verenden. Generell sind die klinischen Symptome umso ausgeprägter, je länger die Vögel überleben. Die Dauer der Entwicklung von Symptomen ist abhängig vom Virus, vom Wirt und von der ursprünglichen Infektionsdosis in Verbindung mit dem Haltungssystem. Das Virus breitet sich unter Vögeln in Käfig- oder Freilandhaltung langsamer aus als in Mastgeflügelställen.
Mit dem HPAI-Virus infizierte Hennen legen möglicherweise zunächst weichschalige Eier und stellen dann die Legetätigkeit gänzlich ein. Erkrankte Vögel sitzen oder stehen häufig in halbkomatösem Zustand, wobei ihr Kopf den Boden berührt. Kämme und Kehllappen sind zyanotisch und ödematös und können an den Spitzen petechiale Blutungen oder ecchymatöse Hämorrhagien aufweisen. Häufig haben die Vögel starke, wässrige Diarrhö und sind übermäßig durstig. Die Atmung kann angestrengt und der Tränenfluss übermäßig sein. Unbefederte Hautareale können Hämorrhagien aufweisen. Die Bestandssterblichkeit variiert von 50 bis 100 %.
In Mastgeflügel sind die HPAI-Symptome häufig weniger offensichtlich als in anderem Geflügel, wobei es sich in der Regel um auffällige Inaktivität und verringerte Futteraufnahme handelt; die erste festzustellende Abnormität kann ein starker Anstieg der Sterblichkeit sein. Außerdem können sich Ödeme an Kopf und Hals sowie neurologische Symptome wie Torticollis und Ataxie zeigen.
Die Symptome von HPAI sind bei Truthühnern ähnlich wie bei Hausgeflügel, doch scheinen einige HPAI-Viren bei Truthühnern virulenter, andere hingegen weniger virulent zu sein.
Bei mit dem HPAI-Virus infizierten Gänsen sind die Symptome in Form von Inaktivität, mangelnder Futteraufnahme und Diarrhö ähnlich denen bei Gänsen in Legebeständen, allerdings häufig in Verbindung mit geschwollenen Sinus. Bei jüngeren Vögeln können auch neurologische Symptome auftreten.
Mit dem HPAI-Virus infizierte Enten zeigen unter Umständen keinerlei klinische Symptome, doch wurde gemeldet, dass einige Virenstämme ähnliche Symptome wie bei Gänsen verursachen, verbunden mit einer gewissen Sterblichkeit.
Bei HPAI- und NPAI-Infektionen von Straußenvögeln sind unter Umständen keine klinischen Symptome erkennbar. Bei Ausbrüchen von HPAI, wie beispielsweise 1999/2000 in Italien, wurde festgestellt, dass Perlhühner und japanische Wachteln eine Infektionsanfälligkeit zeigten, wobei Symptome und Sterblichkeit ähnlich seien wie beim Auftreten der Krankheit bei Hühnern oder Truthühnern. Einigen experimentellen Untersuchungen zufolge sind jedoch Wachteln gegen bestimmte HPAI-Virenstämme resistent. Für alle Vögel gilt: Die Präsenz von Antikörpern gegen denselben H-Subtyp - unabhängig davon, ob durch Impfung oder eine natürliche Infektion hervorgerufen - kann dazu führen, dass bei einer Infektion mit dem HPAI-Virus keine erkennbaren klinischen Symptome auftreten.
3. Sektionsbefunde bei Vögeln, die mit dem HPAI-Virus infiziert waren
Vögel, die perakut verenden, weisen möglicherweise nur geringfügige makroskopische Läsionen in Form von Dehydratation und verlegten Eingeweiden und Muskeln auf.
Bei Vögeln, die nach langem klinischem Verlauf verenden, sind Petechien und ecchymatöse Hämorrhagien am ganzen Körper nachweisbar, insbesondere an Larynx, Luftröhre, Drüsenmagen und epikardialem Fettgewebe sowie den Teilen der Serosa, die neben dem Brustbein liegen. Es finden sich großflächige subkutane Ödeme, hauptsächlich um den Kopf und an den Läufen. Der Tierkörper kann dehydriert sein. Milz, Leber, Nieren und Lungen können gelbe oder graue nekrotische Herde aufweisen. Die Luftsäcke können ein Exsudat enthalten. Die Milz kann vergrößert und hämorrhagisch sein.
Histologisch charakterisiert wird die Aviäre Influenza durch Blutgefäßstörungen, die Ödeme, Hämorrhagien und perivaskuläre Entzündungen hervorrufen, vor allem in Herzmuskel, Milz, Lungen, Gehirn, Bauchspeicheldrüse und Kehllappen. Lungen, Leber und Nieren weisen nekrotische Herde auf. Im Gehirn können Gliose, vaskuläre Proliferation und neurale Degeneration auftreten.
4. Differenzialdiagnose
Bei der Differenzialdiagnose von HPAI sind insbesondere folgende Krankheiten zu berücksichtigen:
5. Klinische Symptome bei Vögeln, die mit dem NPAI-Virus infiziert sind
Die Schwere der von NPAI-Viren verursachten Krankheit wird größtenteils durch folgende Faktoren beeinflusst:
Im einen Extremfall können die klinischen Krankheitssymptome nicht sichtbar oder geringfügig sein, in Form von harmlosen Atemproblemen oder Problemen bei der Legetätigkeit. Im anderen Extremfall können Infektionen mit dem NPAI-Virus mit gravierenden klinischen Krankheitssymptomen einhergehen, insbesondere bei Truthühnern; dabei handelt es sich in der Regel um rasselnde Atmung, Husten, Anschwellen des infraorbitalen Sinus und Fieber in Verbindung mit reduzierter Futteraufnahme und hoher Sterblichkeit.
NPAI kann mit zahlreichen Krankheiten, bei denen sich respiratorische oder enterale Symptome zeigen, verwechselt oder durch diese kompliziert werden. Bei jedem Krankheitsausbruch unter Geflügel, der trotz Anwendung präventiver und therapeutischer Maßnahmen gegen andere Krankheiten andauert, muss von Aviärer Influenza ausgegangen werden.
6. Klinische Symptome bei Vögeln, die in Gefangenschaft gehalten werden
Das Spektrum der klinischen Symptome kann sehr breit sein und wie bei Geflügel von nicht erkennbaren bis hin zu gravierenden Krankheitsanzeichen mit hoher Sterblichkeit variieren.
Generell breitet sich die Infektion in einem Bestand in Gefangenschaft gehaltener Vögel langsamer aus; zurückzuführen ist dies auf die Vielzahl der gehaltenen Spezies mit unterschiedlicher Anfälligkeit, die ungleichmäßige Ausscheidung des Virus und eine häufig relativ langsame Übertragung infolge geringer Kontaktraten und verhältnismäßig geringer Bestandsdichten.
Kapitel III
Leitlinien für den Fall eines Verdachts auf Aviäre Influenza in einem Betrieb
Die Variabilität der klinischen Symptome von HPAI und NPAI hat zur Folge, dass keine klaren Leitlinien für den Fall des Verdachts auf einen Ausbruch gegeben werden können. Bei einer plötzlich auftretenden hohen Sterblichkeit in Geflügelbeständen mit oder ohne die in Kapitel II beschriebenen klinischen Symptome sind Proben einzureichen und im Labor zu untersuchen; liegt jedoch keine hohe Sterblichkeitsrate vor, so ist es schwieriger, den Verdacht auf Aviäre Influenza zu bestätigen oder zu entkräften.
Da bei HPAI oder NPAI aufgrund einer Infektion mit den Subtypen H5 und H7 eine schnelle Diagnose äußerst wichtig ist, um die frühzeitige Bekämpfung und Tilgung der Krankheit zu ermöglichen, muss Aviäre Influenza bei der Differenzialdiagnose von Atemproblemen oder Problemen bei der Legetätigkeit sowie von erhöhter Sterblichkeit in Geflügelbeständen stets in Betracht gezogen werden, und entsprechende Proben für Laboruntersuchungen sind einzureichen.
Abbildung
Schematischer Überblick über die Diagnoseschritte zur Bestätigung von Aviärer Influenza
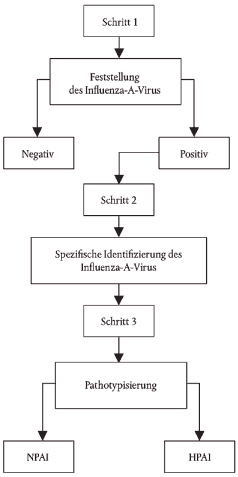 |  |
Kapitel IV
Allgemeine Verfahren für die Entnahme und Beförderung von Proben
1. Richtlinie 2005/94/EG und Diagnosehandbuch
Sofern die Richtlinie 2005/94/EG auf das Diagnosehandbuch verweist, sind die in diesem Kapitel des Diagnosehandbuchs beschriebenen Untersuchungen, Probenahmen und Überwachungsverfahren obligatorisch.
2. Anzuwendende Verfahren im Fall eines Verdachts auf Aviäre Influenza
Wenn der amtliche Tierarzt einen klinischen Verdacht auf Aviäre Influenza hat oder aber die Ergebnisse einer einschlägigen Laboruntersuchung nicht negativ sind, hat die zuständige Behörde sicherzustellen, dass im Einklang mit Artikel 7 der Richtlinie 2005/94/EG vor einem Ausschluss dieser Krankheit eine Untersuchung nach Maßgabe dieses Kapitels des Diagnosehandbuchs durchgeführt und mit zufrieden stellendem Ergebnis abgeschlossen wird.
3. Interpretation der virologischen Untersuchung
Die zuständige Behörde kann einen Ausbruch der Aviären Influenza ausschließen, wenn eine aussagekräftige Zahl der erkrankten oder toten Vögel und Luftröhren-/Oropharynxabstriche oder Kloakenabstriche nach Maßgabe dieses Kapitels zur Untersuchung auf dieses Virus oder sein Genom übersandt wurden und die Untersuchung mittels eines der in Kapitel V oder VI genannten oder von der zuständigen Behörde nach Kapitel I Nummer 6 Buchstabe b zugelassenen spezifischen Virusnachweisverfahrens negative Befunde erbracht hat.
4. Standardsatz an Proben für virologische oder serologische Laboruntersuchungen
Die Untersuchung eines Betriebs, bei dem der Verdacht auf Aviäre Influenza besteht, hat in der Form zu erfolgen, dass der Standardsatz an Proben für die virologische oder serologische Untersuchung gemäß a und b ("Standardproben") genommen und direkt für die virologischen und serologischen Laboruntersuchungen übersandt wird.
Tierkörper müssen von erst kurz zuvor verendeten oder schwer erkrankten bzw. verendenden Vögeln stammen, die vom Menschen getötet wurden.
Abstriche sind der unter a genannten Zahl von Vögeln oder, wenn es sich um einen kleineren Bestand handelt, allen Vögeln in dem untersuchten Betrieb zu entnehmen. Vögel, die klinische Krankheitssymptome auf-weisen, müssen gezielt in die Probenahme einbezogen werden.
Die Kloakenabstriche müssen ausreichend mit Fäzes bedeckt sein (im Optimalfall 1 g). Sollte die Entnahme von Kloakenproben aus lebenden Vögeln nicht möglich sein, können stattdessen sorgfältig gesammelte frische Fäkalproben übersandt werden.
Die Entnahme von Luftröhren-/Oropharynxabstrichen aus der Wangentasche erweist sich häufig als am besten praktizierbar.
Sobald die Wachstumseigenschaften des Virus bekannt sind, kann die zuständige Behörde entscheiden, entweder Luftröhren-/Oropharynxabstriche oder Kloakenabstriche anstatt beidem zu untersuchen, abhängig davon, ob sich das Virus besser im Atmungs- oder im Verdauungstrakt repliziert und um welche Spezies es sich handelt.
Proben sind der unter b genannten Zahl von Vögeln oder, wenn es sich um einen kleineren Bestand handelt, allen Vögeln in dem untersuchten Betrieb zu entnehmen. Vögel, die krank erscheinen oder sich anscheinend wieder erholt haben, müssen gezielt in die Probenahme einbezogen werden.
Die zuständige Behörde kann entscheiden, dass nicht der komplette Standardsatz an Proben entnommen werden muss, sondern ein bestimmter Teil an Standardproben ausreicht.
5. Beförderung der Proben
Bei der Lagerung von Proben und deren Beförderung ins Testlabor ist besondere Sorgfalt geboten.
Die Abstriche müssen sofort auf Eis oder mit Gefriergelpackungen gekühlt und schnellstmöglich in das Labor gebracht werden. Falls nicht unbedingt erforderlich, sollten die Proben nicht eingefroren werden. Ist nicht gewährleistet, dass die Beförderung ins Labor innerhalb von 24 Stunden erfolgt, müssen die Proben sofort eingefroren, gelagert und dann auf Trockeneis befördert werden.
Zusätzlich - und nicht alternativ zur Kühlung - sind die Abstriche in ein antibiotisches oder spezifisches Virustransportmedium mit einer Temperatur von 4 °C zu geben, so dass sie von diesem vollständig bedeckt sind. Ist kein solches Medium vorhanden, müssen die Abstriche wieder in ihr Behältnis gegeben und in trockenem Zustand an das Labor zur Untersuchung übersandt werden.
Die Lagerung und die Beförderung von Proben können durch eine Vielzahl von Faktoren beeinflusst werden, weshalb eine zweckgeeignete Beförderungsmethode zu wählen ist.
6. Antibiotisches Medium
Das antibiotische Medium, auf das in Nummer 5 Bezug genommen wird, muss auf einer phosphatgepufferten Salzlösung mit einem pH-Wert von 7,0 bis 7,4 (gemessen nach der Antibiotikazugabe) basieren.
Medien auf Proteinbasis, zum Beispiel Herz-Hirn-Nährboden oder Tris-gepufferter Tryptose-Agar, können dem Virus, insbesondere während der Beförderung, zusätzliche Stabilität verleihen. Die eingesetzten Antibiotika und ihre Konzentrate können, je nach lokalen Faktoren und Verfügbarkeit, variieren.
Für Fäkalproben können sehr hohe Dosen Antibiotika erforderlich sein; geeignet sind 10.000 IE/ml Penicillin, 10 mg/ml Streptomycin, 0,25 mg/ml Gentamycin und 5 000 IE/ml Nystatin. Für Gewebe und Luftröhrenabstriche können diese Mengen bis auf ein Fünftel verringert werden.
Soll auch eine Kontrolle auf Chlamydophila vorgenommen werden, sind 0,05-0,1 mg/ml Oxytetracyclin beizufügen.
7. Medium auf der Basis eines Herz-Hirn-Nährbodens
Es ist eine wässrige Lösung mit 15 Vol.- % Herz-Hirn-Nährbodenpulver - vor dem Sterilisieren - herzustellen (durch Autoklavieren bei 121 °C/15 min).
Die nachstehenden Sterilisationsantibiotika sind wie folgt beizugeben: 10.000 IE/ml Penicillin G, 20 µg Amphotericin B und 1000 µg/ml Gentamycin. Die Medien können bei einer Temperatur von 4 °C bis zu zwei Monate lang gelagert werden.
8. Gemäß den einschlägigen Bestimmungen der Richtlinie 2005/94/EG anzuwendende Verfahren
8.A. Verdacht auf Seuchenausbruch
8.1. Artikel 7 Absatz 1 - Maßnahmen in Betrieben mit Seuchenverdacht
Inspiziert ein amtlicher Tierarzt einen seuchenverdächtigen Betrieb, so sind folgende Maßnahmen durchzuführen:
8.2. Artikel 10 Absatz 3 - Zusätzliche Maßnahmen infolge einer epidemiologischen Untersuchung
In jeder Produktionseinheit sind Standardproben aus getötetem Geflügel oder getöteten in Gefangenschaft gehaltenen Vögeln anderer Spezies zu entnehmen.
8.B. Hoch pathogene Aviäre Influenza (HPAI)
8.3. Artikel 11 Absatz 4 - Maßnahmen in Bezug auf Geflügel aus Eiern, die aus Betrieben abgeholt wurden, für die der Seuchenverdacht bestätigt wurde
Inspiziert ein amtlicher Tierarzt einen Betrieb mit Geflügel aus Eiern, die während der Inkubationszeit aus einem Betrieb abgeholt wurden, für den der Verdacht auf HPAI bestätigt wurde, so sind folgende Maßnahmen durchzuführen:
8.4. Artikel 13 Absatz 2 Buchstabe b - Ausnahmen für bestimmte Betriebe
Inspiziert ein amtlicher Tierarzt einen Betrieb, dem eine Ausnahme von den Maßnahmen gemäß Artikel 11 Absatz 2 Unterabsatz 1 der Richtlinie 2005/94/EG gewährt wurde, so sind folgende Maßnahmen durchzuführen:
Die zuständige Behörde kann jedoch auf der Grundlage des Ergebnisses einer Risikobewertung Ausnahmen von dem unter Ziffer i und ii genannten Probenumfang gewähren;
8.5. Artikel 15 Absätze 1 und 3 - Maßnahmen in Kontaktbetrieben
Inspiziert ein amtlicher Tierarzt einen Kontaktbetrieb, so sind folgende Maßnahmen durchzuführen:
8.6. Artikel 18 Buchstaben b und c - Zählung, Betriebsbesichtigungen durch den amtlichen Tierarzt und Überwachung in Betrieben innerhalb der Schutzzone
Inspiziert ein amtlicher Tierarzt eine gewerbliche Haltung, so sind folgende Maßnahmen durchzuführen:
8.7. Artikel 19 Buchstabe f - Maßnahmen in Betrieben innerhalb von Schutzzonen
Inspiziert ein amtlicher Tierarzt einen Betrieb, der einen Anstieg der Morbiditäts- und/oder Mortalitätsrate oder Veränderungen bei der Produktion gemeldet hat, so sind folgende Maßnahmen durchzuführen:
8.8. Artikel 23 Buchstabe b - Ausnahmen für Direktbeförderungen von Geflügel zur unverzüglichen Schlachtung
Inspiziert ein amtlicher Tierarzt einen Betrieb, dem eine Ausnahme von den Maßnahmen gemäß Artikel 22 der Richtlinie 2005/94/EG gewährt wurde, so sind folgende Maßnahmen durchzuführen:
8.9. Artikel 25 Buchstabe b - Ausnahmen für Direktbeförderungen von Junglegehennen
Inspiziert ein amtlicher Tierarzt einen Betrieb, dem eine Ausnahme von den Maßnahmen gemäß Artikel 22 vor der Direktbeförderung von Junglegehennen gewährt wurde, so sind folgende Maßnahmen durchzuführen:
8.10. Artikel 26 Absatz 1 Buchstabe a - Ausnahmen für Direktbeförderungen von Brut- und Konsumeiern
Inspiziert ein amtlicher Tierarzt eine Elterntierhaltung, der eine Ausnahme von den Maßnahmen gemäß Artikel 22 vor der Direktbeförderung von Bruteiern gewährt wurde, so sind folgende Maßnahmen durchzuführen:
8.11. Artikel 29 Absatz 1 - Dauer der Maßnahmen
Die gemäß Kapitel IV Abschnitt 3 der Richtlinie 2005/94/EG für die Schutzzone vorgesehenen Maßnahmen sind frühestens 21 Tage nach dem Zeitpunkt des Abschlusses der Grobreinigung und der ersten Desinfektion des Seuchenbetriebs aufzuheben, vorausgesetzt dass
8.12. Artikel 30 Buchstabe g - Maßnahmen in Überwachungszonen
Inspiziert ein amtlicher Tierarzt einen Betrieb, der einen Anstieg der Morbiditäts- und/oder Mortalitätsrate oder Veränderungen bei der Produktion gemeldet hat, so sind folgende Maßnahmen durchzuführen:
8.13. Artikel 35 - Untersuchung von HPAI-Verdachtsfällen in Schlachthöfen und Transportmitteln
Inspiziert ein amtlicher Tierarzt einen Herkunftsbetrieb von Vögeln aufgrund eines Verdachts in Schlachthöfen oder Transportmitteln, so sind folgende Maßnahmen durchzuführen:
8.14. Artikel 36 Absatz 1 - Maßnahmen in Schlachthöfen
Nach Abschluss der Untersuchungen gemäß Nummer 8.13 und unter der Voraussetzung, dass die Laborunteruntersuchungen Negativbefunde ergeben haben und kein klinischer Verdacht auf HPAI im Herkunftsbetrieb und im Schlachthof besteht, kann die amtliche Überwachung aufgehoben werden.
8.15. Artikel 37 Absätze 1 und 2 - Maßnahmen in Grenzkontrollstellen oder Transportmitteln
8.15.1. Inspiziert ein amtlicher Tierarzt in völliger Isolation befindliche Hühner oder in Gefangenschaft gehaltene Vögel anderer Spezies, die aufgrund eines HPAI-Verdachts oder einer HPAI-Bestätigung aus Grenzkontrollstellen oder Transportmitteln verbracht wurden, so sind folgende Maßnahmen durchzuführen:
8.15.2. Inspiziert ein amtlicher Tierarzt einen identifizierten Herkunftsbetrieb geschlachteter Hühner oder geschlachteter in Gefangenschaft gehaltener Vögel anderer Spezies, so sind folgende Maßnahmen durchzuführen:
8.C. Niedrig pathogene Aviäre Influenza (NPAI)
8.16. Artikel 39 Absatz 6 Buchstaben b und h) - In Betrieben mit bestätigtem Ausbruch von NPAI durchzuführende Maßnahmen
Inspiziert ein amtlicher Tierarzt einen Betrieb, bevor von dort Geflügel in einen Schlachthof befördert werden soll, oder einen Betrieb mit Geflügel aus Eiern, die bereits während der Inkubationszeit aus dem Betrieb abgeholt wurden, so sind folgende Maßnahmen durchzuführen:
8.17. Artikel 40 Absatz 2 Buchstabe b - Ausnahmen für bestimmte Betriebe von den bei bestätigtem Seuchenausbruch vorgeschriebenen Maßnahmen
Inspiziert ein amtlicher Tierarzt einen Betrieb, dem eine Ausnahme von den Maßnahmen gemäß Artikel 39 Absatz 2 und Absatz 5 Buchstabe b der Richtlinie 2005/94/EG gewährt wurde, so sind folgende Maßnahmen durchzuführen:
Die zuständige Behörde kann jedoch auf der Grundlage des Ergebnisses einer Risikobewertung Ausnahmen von dem unter Ziffer i und ii genannten Probenumfang gewähren;
8.18. Artikel 42 Absätze 1 und 3 - Maßnahmen in Kontaktbetrieben
Inspiziert ein amtlicher Tierarzt einen Kontaktbetrieb, so sind folgende Maßnahmen durchzuführen:
8.19. Artikel 44 Absatz 1 Buchstabe b - Maßnahmen für das Restriktionsgebiet
Inspiziert ein amtlicher Tierarzt eine gewerbliche Haltung in einem Restriktionsgebiet, so sind folgende Maßnahmen durchzuführen:
8.20. Artikel 45 Buchstaben a und b - Dauer der Maßnahmen
Die nach Kapitel V Abschnitt 3 der Richtlinie 2005/94/EG geltenden Maßnahmen für das Restriktionsgebiet sind frühestens 21 Tage nach dem Zeitpunkt des Abschlusses der Grobreinigung und der ersten Desinfektion des Seuchenbetriebs im Anschluss an die Räumung des Betriebs oder frühestens 42 Tage nach dem Zeitpunkt der Bestätigung des Ausbruchs von NPAI aufzuheben, vorausgesetzt dass
8.D. Maßnahmen zur Verhütung der Übertragung von Viren der Aviären Influenza auf andere Spezies
8.21. Artikel 47 Absätze 1 und 6 - Laboranalysen und andere Maßnahmen betreffend Schweine und andere Tiere
Inspiziert ein amtlicher Tierarzt einen Schweinehaltungsbetrieb nach der Bestätigung des Verdachts auf Aviäre Influenza, so sind folgende Maßnahmen durchzuführen:
Die Beförderung von Schweinen in einen Schlachthof kann genehmigt werden, wenn mindestens 60 Nasen-/ Oropharynxabstriche aus jeder Produktionseinheit 14 Tage nach der Bestätigung des Verdachts auf Aviäre Influenza negative Befunde erbracht haben;
im Falle nicht eindeutiger oder positiver Laborergebnisse weitere Untersuchungen jeglicher Art, die zum Ausschluss einer Infektion oder Übertragung der Aviären Influenza unter Schweinen erforderlich sind;
8.E. Wiederbelegung
8.22. Artikel 49 Absatz 3 Buchstaben b und c - Wiederbelegung von Betrieben
Inspiziert ein amtlicher Tierarzt eine gewerbliche Haltung, die wiederbelegt wurde, so sind folgende Maßnahmen durchzuführen:
|8.F. Impfung
8.23. Artikel 56 Absatz 2 Buchstabe i - Präventive Impfung von Geflügel oder in Gefangenschaft gehaltenen Vögeln anderer Spezies
Das geimpfte Geflügel oder die geimpften in Gefangenschaft gehaltenen Vögel anderer Spezies sind Laboruntersuchungen gemäß Kapitel IX der Richtlinie 2005/94/EG zu unterziehen, wobei die zugelassenen DIVA-Verfahren anzuwenden sind, sofern das Feldvirus bekannt ist.
Werden Sentineltiere verwendet, so müssen diese in jedem geimpften Bestand eingesetzt, klinisch inspiziert und einem Hämagglutinationshemmungstest (HI-Test) unterzogen werden. Zu diesem Zweck sind den nicht geimpften Sentineltieren in jedem geimpften Betrieb mindestens alle 60 Tage 20 Blutproben zu entnehmen.
8.24. Anhang IX - Vorschriften für die Verbringung von Geflügel oder in Gefangenschaft gehaltenen Vögeln anderer Spezies und Geflügelerzeugnissen im Falle der Notimpfung
Bei der Beförderung von lebendem Geflügel oder lebenden in Gefangenschaft gehaltenen Vögeln anderer Spezies sowie deren Eiern sind strikte Überwachungsmaßnahmen anzuwenden, um das Risiko einer Weiterverbreitung der Aviären Influenza zu minimieren.
Zu Beginn einer Notimpfkampagne müssen bei der Beförderung von lebendem Geflügel oder lebenden in Gefangenschaft gehaltenen Vögeln anderer Spezies sowie deren Eiern dieselben Überwachungsmaßnahmen angewandt werden, um das Risiko einer Weiterverbreitung der Aviären Influenza inner- und außerhalb des Impfgebietes zu minimieren.
Kapitel V
Diagnostische virologische Tests und Ergebnisbewertung
1. Bis zur Entwicklung von Molekulartests wurde die Virusisolierung durch die Beimpfung embryonierter Hühnereier als bei weitem aussagekräftigster diagnostischer Test auf Aviäre Influenza und als grundlegend für die anschließende Identifizierung und Charakterisierung des Infektionsvirus erachtet. Die wichtigsten Schritte werden in diesem Kapitel erläutert.
2. Behandlung von Probenmaterial
"Trocken" eingereichte Abstriche sind so in ein antibiotisches Medium einzutauchen, dass sie von diesem vollständig bedeckt werden. Proben können in Chargen zu jeweils fünf Stück gepoolt werden, sofern sie von derselben Spezies und derselben epidemiologischen Einheit stammen sowie zum selben Zeitpunkt entnommen wurden.
Die an das Labor übersandten Tierkörper sind einer Schlachtkörperuntersuchung zu unterziehen, wobei Proben aus folgenden Organen entnommen werden müssen: Fäzes oder Darminhalt, Hirngewebe, Luftröhre, Lungen, Leber, Milz oder andere eindeutig infizierte Organe. Diese Organe und Gewebe können gepoolt werden, doch Fäkalmaterial ist unbedingt gesondert zu behandeln.
Fäkalproben und Organe müssen in antibiotischem Medium (im geschlossenen Blender oder unter Verwendung von Stößel und Mörser und sterilem Sand) homogenisiert und zu 10 bis 20 Vol.- % suspendiert werden.
Die eingetauchten Abstriche und Suspensionen sind für rund 2 Stunden bei Umgebungstemperatur (bei 4 °C entsprechend länger) stehen zu lassen und danach durch Zentrifugieren zu klären (z.B. 800-1 000 g 10 Minuten lang).
3. Virusisolierung in embryonierten Hühnereiern
Die Allantoishöhlen von mindestens vier embryonierten Eiern, die neun bis elf Tage vorbebrütet wurden, werden mit 0,1-0,2 ml des geklärten flüssigen Überstands beimpft. Im Idealfall sollten diese Eier aus einer spezifiziert pathogenfreien Herde stammen; ansonsten können auch Eier aus einem Bestand verwendet werden, der nachweislich frei von Antikörpern gegen Aviäre Influenza (negativer Test auf Serumantikörper - SAN) ist.
Die beimpften Eier sind bei 37 aufzubewahren und täglich zu durchleuchten. Eier mit toten bzw. absterbenden Embryonen sowie alle anderen Eier sind sechs Tage nach der Beimpfung auf 4 abzukühlen und die Allantois-/Amnionflüssigkeiten auf Hämagglutination zu untersuchen. Lässt sich keine Hämagglutination feststellen, muss dieses Verfahren mit unverdünnter Allantois-/Amnionflüssigkeit als Inokulum wiederholt werden. Wird Hämagglutination festgestellt, so ist im Kulturverfahren zu prüfen, ob eine Bakterienkontamination vorliegt. Sind Bakterien vorhanden, so können die Flüssigkeiten durch einen 450-nm-Membranfilter passiert und nach Zugabe weiterer Antibiotika in embryonierte Eier - wie oben beschrieben - inokuliert werden.
Um die Diagnose zu beschleunigen, haben einige Laboratorien zwei 3-Tages-Passagen oder 2-Tages- und 4-Tages-Passagen verwendet und mitgeteilt, dass die erzielten Ergebnisse mit zwei 6-Tages-Passagen vergleichbar seien, doch hierfür liegt noch keine umfassende Bewertung vor.
Positive Flüssigkeiten müssen auf Bakterienfreiheit getestet werden. Sind Bakterien vorhanden, können die Flüssigkeiten zur Entfernung der Bakterien durch einen 450-nm-Membranfilter passiert oder zentrifugiert und nach Zugabe weiterer Antibiotika wieder in Eiern passagiert werden.
4. Differenzialdiagnose
Da es wesentlich ist, zur Eindämmung der Virusverbreitung möglichst schnell Bekämpfungsmaßnahmen durchzuführen, muss jedes nationale Referenzlabor, das ein hämagglutinierendes Virus isoliert hat, in der Lage sein, dieses als Influenza-A-Virus des Subtyps H5 bzw. H7 oder als NDV-Virus zu identifizieren. Die hämagglutinierenden Flüssigkeiten müssen Hämagglutinationshemmungstests nach Kapitel IX unterzogen werden. Eine positive Hemmung, wie zum Beispiel ein Titer, der nur um 2-3 log2 von dem eines positiven Kontrollserums abweicht, mit den für die Subtypen H5 oder H7 des Influenza-A-Virus spezifischen polyklonalen Antiseren, würde als vorläufiger Nachweis ausreichen und die Anordnung zwischenzeitlicher Bekämpfungsmaßnahmen rechtfertigen.
Da es 16 Hämagglutinin-Subtypen und 9 Neuraminidase-Subtypen von Influenza-Viren gibt, die ihrerseits variieren, ist es für die einzelnen nationalen Referenzlaboratorien weder praktikabel noch kostenwirksam, Antiseren vorrätig zu halten, die eine vollständige Identifizierung der Subtypen von Influenza-Isolaten gestatten. Jedes nationale Referenzlabor muss jedoch zumindest
Darüber hinaus ist es wünschenswert, in Laboren mit entsprechender Ausstattung
Zudem müssen die nationalen Referenzlaboratorien das nötige Fachwissen und die Ausrüstung für eine Nukleotid-Sequenzanalyse bereitstellen, anhand deren untersucht werden kann, ob bei NPAI-Viren des Subtyps H5 oder H7 multiple basische Aminosäuren im Spaltbereich des Hämagglutinins vorhanden sind. Obwohl das Gemeinschaftliche Referenzlabor - im Rahmen seiner Aufgaben gemäß Anhang VII Nummer 2 Buchstabe b der Richtlinie 2005/94/EG - mit hoher Priorität den Pathogenitätsindex ermitteln wird, verkürzt sich durch eine solche Viruscharakterisierung auf nationaler Ebene der Diagnosezeitraum erheblich, und im Falle eines positiven Befunds auch der Zeitraum für die vollständige Durchführung der HPAI-Bekämpfungsmaßnahmen.
Die nationalen Referenzlaboratorien müssen alle hämagglutinierenden Viren an das Gemeinschaftliche Referenzlabor übermitteln, das diese weiteren Antigen- und Genstudien unterzieht, um entsprechend den Befugnissen und Aufgaben des gemeinschaftlichen Referenzlabors gemäß Anhang VII der Richtlinie 2005/94/EG weitere Erkenntnisse über den Seuchenverlauf in der Gemeinschaft zu gewinnen.
Darüber hinaus obliegt dem Gemeinschaftlichen Referenzlabor die umfassende Antigentypisierung aller eingegangenen Influenzaviren. Bei Viren des Subtyps H5 bzw. H7, deren intravenöser Pathogenitätsindex nicht über 1,2 liegt, ist im Rahmen einer Nukleotid-Sequenzanalyse des Hämagglutiningens ferner unverzüglich zu bestimmen, ob im Spaltbereich des Hämagglutininproteins multiple basische Aminosäuren vorhanden sind. Sobald die Ergebnisse vorliegen, sind das nationale Referenzlabor und die zuständige Behörde des Herkunftslands zu informieren, damit umfassende HPAI-Bekämpfungsmaßnahmen durchgeführt werden können.
 | weiter . |  |
___________________________
1) ABl. L 10 vom 14.01.2006 S. 16.