
umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (33)
 | zurück |
3. Literaturangaben
(1) Kukowski H. and Brümmer G., (1987). Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02 045, Part II.
(2) Fränzle O., Kuhnt G. and Vetter L. (1987). Selection of Representative Soils in the EC-Territory. UBA Report 106 02 045, Part I.
(3) Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection. Treatment, Characterisation. Special Publication No 1.94.60, Joint Research Centre. European Commission, ISPRA, December 1994.
(4) OECD Test Guidelines Programme. Final Report of the OECD Workshop on Selection of Solls/Sediments, Belgirate, Italy, 18-20 January 1995 (June 1995).
(5) US Environment Protection Agency: Pesticide Assessment Guidelines. Subdivision N, Chemistry: Environmental Fate, Series 16 3-1, Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 540/09-88-096, Date: 1/1988.
(6) US Environment Protection Agency: Prevention. Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines, Series 835-Fate, Transport and Transformation Test Guidelines, OPPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048. April 1996.
(7) ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (Koc) for an Organic Chemical in Soil and Sediments.
(8) Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987.
(9) Netherlands Commission Registration Pesticides (1995): Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air.
(10) Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment.
(11) BBA (1990), Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany.
(12) Calvet R. (1989),Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils, in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), INRA, Paris, (Review).
(13) Calvet R. (1980),Adsorption-Desorption Phenomenain Interactions between herbicides and the soil. (R.J. Hance ed.), Academic Press, London, 83-122.
(14) Hasset J. J. and Banwart W.L. (1989),The sorption of nonpolar organics by soils and sedimentsin Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S.S.S.A), Special Publication no. 22, 31-44.
(15) Van Genuchten M. Th., Davidson J. M. and Wierenga P. J. (1974),An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media. Soil Sci. So Am. Proc., Vol. 38(1), 29-35.
(16) McCall P. J., Laskowski D. A., Swann R. L. and Dishburger H. J. (1981),Measurement f of sorptio coefficients of organic chemicals and their use, in environmental fate analysis, in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC.
(17) Lambert S. M., Porter P. E. and Schieferrstein R. H., (1965),Movement and sorption of chemicals applie d to the soil. Weeds, 1 3, 185-190.
(18) Rhodes R. C, Belasco I. J., and Pease H. L, (1970)Determination of mobility and adsorption o f agrochemicals in soils. J.Agric.Food Chem., 18, 524-528.
(19) Russell M. H. (1995),Recommended approaches to assess pesticide mobility in soilin Environmental Behavior of Agrochemicals (ed. T. R. Roberts and P. C. Kearney). John Wiley & Sons Ltd.
(20) Esser H. O., Hemingway R. J., Klein W., Sharp D. B., Vonk J. W. and Holland P. T., (1988),Recommende approach to the evaluation of the environmental behavior of pesticides, ', IUPAC Reports n on Pesticide (24). Pure Appl. Chem., 60, 901-932.
(21) Guth J. A., Burkhard N. and D. O. Eberle (1976),Experimental models for studying the persistence of pesticides in soils. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, 137-157, BCPC, Surrey, UK.
(22) Furminge C. G. L and Osgerby J. M. (1967),Persistence of herbicides in soil. J. Sci. Fd Agric, 18, 269-273.
(23) Burkhard N. and Guth J. A. (1981), Chemical hydrolysis of 2-Chloro-4,6-bis(alkylamino)-l,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption. Pestic. Sci. 12, 45-52.
(24) Guth J. A., Gerber H. R. and Schlaepfer T. (1977),Effect of adsorption, movement and persistence on the biological availability of soilapplied pesticides. Proc. Br. Crop Prot. Conf., 3, 961-971.
(25) Osgerby J. M. (1973),Process affecting herbicide action in soil. Pestic. Sci., 4, 247-258.
(26) Guth J. A., (1972), "Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden". Schr. Reihe Ver. Wass.-Boden-Lufthyg. Berlin-Dahlem, Heft 37, 143-154.
(27) Hamaker J. W. (1975),The interpretation of soil leaching experiments, in Environmental Dynamics f o Pesticides (eds R. Haque and V.H. freed), 135-172. Plenum Press, NY.
(28) Helling C. S. (1971),Pesticide mobility in soils. Soil Sci. Soc. Amer. Proc, 35, 732-210.
(29) Hamaker J. W. (1972),Diffusion and volatilizationin Organic chemicals in the soil environment (C.A.I. Goring and J. W. Hamaker eds), Vol. I, 49-143.
(30) Burkhard N. and Guth J. A. (1981),Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system. Pestic. Sci. 12, 37-44.
(31) Cohen S. Z., Creeger S. M, Carsel R.F. and Enfield C.G. (1984),Potential pesticide contamination of groundwater from agricultural uses, in Treatment and Disposal of Pesticide Wastes, 297-325, Acs Symp. Ser. 259, American Chemical Society, Washington, DC.
(32) Gustafson D. I., (1989),Groundwater ubiquity score: a simple method for assessing pesticid e leachability. J. Environ. Toxic. Chem., 8(4), 339-357.
(33) Leistra M. and Dekkers W. A. (1976),Computed effects of adsorption kinetics on pesticide movement i n soils. J. of Soil Sci., 28, 340-350.
(34) Bromilov R. H. and Leistra M. (1980), "Measured and simulated behavior of aldicarb and its oxydatio n products in fallow soils". Pest. Sci., 11, 389-395.
(35) Green R. E. and Karickoff S. W., (1990),Sorption estimates for modeling, in Pesticides in the Soil Environment: Process, Impacts and Modeling (ed. h.H. Cheng). Soil Sci. Soc. Am., Book Series no. 2, 80-101.
(36) Lambert S. M. (1967),Functional relationship between sorption in soil and chemical structure. J. A gri. Food Chem., 15, 572-576.
(37) Hance R. J. (1969),An empirical relationship between chemical structure and the sorption of some herbicides by soils.). Agri. Food Chem., 17, 667-668.
(38) Briggs G. G. (1969),Molecular structure of herbicides and their sorption by soils. Nature, 223, 1288.
(39) Briggs G. G. (1981).Theoretical and experimental relationships between soil adsorption, otanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem 29, 1050-1059.
(40) Sabljic A. (1984),Predictions of the nature and strength of soil sorption of organic polutance b y molecular topology. J. Agric. Food Chem., 32, 243-246.
(41) Bailey G. W. and White J. L. (1970), "Factors influencing the adsorption, desorption and movement o f pesticides in soil". Residue Rev., 32, 29-92.
(42) Bailey G. W., J. L. White and Y. Rothberg. (1968),Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate. Soil Sci. Soc. Amer. Proc. 32, 222-234.
(43) Karickhoff S. W. (1981),Semiempirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere 10, 833-846.
(44) Paya-Perez A., Riaz M. and Larsen B. (1989),Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners '. Environ. Toxicol. Safety 21, 1-17.
(45) Hamaker J. W. and Thompson J. M. (1972),Adsorption in organic chemicalsin Organic Chemicals in the Soil Environment (Goring C.A.I. and Hamaker J.W., eds), Vol I and II, Marcel Dekker, Inc., New York, NY, 1972, 49-143.
(46) Deli J. and Warren G. F., 1971,Adsorption, desorption and leaching of diphenamid in soils. Weed Sc . 19, 67-69.
(47) Chu-Huang Wu, Buehring N., Davinson J. M. and Santelmann, (1975),Napropamide Adsorption desorption and Movement in soils. Weed Science, Vol. 23, 454-457.
(48) Haues M. H. B., Stacey M. and Thompson J. M. (1968),Adsorption of striazine herbicides by soil organic preparationsin Isotopes and Radiation in Soil Organic Studies, 75, International. Atomic Energy Agency, Vienna.
(49) Pionke H. B. and Deangelis R. J. (1980),Methods for distributing pesticide loss in field runoff between the solution and adsorbed phase, CREAMS, in A Field Scale Model for Chemicals, Runoff and Erosion from Agricultural Management Systems, Chapter 19, Vol. III: Supporting Documentation, USDA Conservation Research report.
(50) ISO Standard Compendium Environment: Soil Quality - General aspects: chemical and physical methods of analysis; biological methods of analysis. First Edition (1994).
(51) Scheffer F. and Schachtschabel, Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart (1982), 11th edition.
(52) Black, Evans D. D., White J. L, Ensminger L. E. and Clark F. E., eds.,Methods f of Soil Analysis, Vol 1 and 2, American Society of Agronomy, Madison, WI, 1982.
(53) ISO/DIS 10381-1 Soil Quality - Sampling - Pan 1: Guidance on the design of sampling programmes.
(54) ISO/DIS 10381-2 Soil Quality - Sampling - Part 2: Guidance on sampling techniques.
(55) ISO/DIS 10381-3 Soil Quality - Sampling - Part 3: Guidance on safety of sampling.
(56) ISO/DIS 10381-4 Soil Quality - Sampling - Part 4: Guidance on the investigation of natural and cultivated soils.
(57) ISO/DIS 10381-5 Soil Quality - Sampling - Part 5: Guidance on the investigation of soil contamination of urban and industrial sites.
(58) ISO 10381-6, 1993: Soil Quality - Sampling - Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
(59) Green R. E. and Yamane V. K. (1970),Precision in pesticide adsorption measurements. Soil Sci. Am. Proc, 34, 353-354.
(60) Grover R. and Hance R. J. (1970),Effect of ratio of soil to water on adsorption of linuron and atrazine '. Soil Sci., 109-138.
(61) Boesten, J. J. T. I,Influence of soil/liquid ratio on the experimental error of sorption coefficients i n pesticide/soil system. Pest. Sci. 1990, 30, 31-41.
(62) Boesten, J. J. T. I.Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106. Proceedings of 5th international workshop on environment al behaviour of pesticides and regulator)' aspects, Brussels, 26-29. April 1994.
(63) Bastide J., Cantier J. M. et Coste C. (1980),Comportement de substances herbicides dans le sol e n fonction de leur structure chimique. Weed Res. 21, 227-231.
(64) Brown D. S. and Flagg E. W. (1981),Empirical prediction of organic pollutants sorption in natur al sediments. J. Environ.Qual, 10(3), 382-386.
(65) Chiou C. T., Porter P. E., and Schmedding D. W., (1983),Partition equilibria f of nonionic organ compounds between soil organic matter and water. Environ. Sci. Technol., 17(4), 227-231.
(66) Gerstl Z., and Mingelgrin U. (1984), Sorption of organic substances by soils and sediments. J. Environm. Sci. Health, B19 (3), 297-312.
(67) Vowles P. D. and Mantoura R. F. C. (1987),Sedimentwater partition coefficient and HPLC retentio n factors of aromatic hydrocarbons. Chemosphere, 16(1), 109-116.
(68) Lyman W. J. , Reehl W. F. and Rosenblatt D. H. (1990). Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC.
(69) Keniga E. E., and Goring, C. A. I. (1980).Relationship between water solubility, soil sorption, Otano water partitioning and concentration of chemicals in the biotain Aquatic Toxicology (eds J.G. Eaton, et al.), 78-115, ASTM STP 707, Philadelphia.
(70) Chiou C. T., Peters L. J., and Freed V. H., (1979),A physical concept of soilwater equilibria for nonionic organic compounds. Science, Vol. 206, 831-832.
(71) Hassett J. J., Banwart W. I., Wood S. G. and Means J. C. (1981),Sorption of/-Naphtol: implication s concerning the limits of hydrophobic sorption. Soil Sci. Soc. Am. J. 45, 38-42.
(72) Karickhoff S. W. (1981),Semiempirical estimation of sorption of hydrophobic pollutants on natur al sediments and soils. Chemosphere, Vol. 10(8), 833-846.
(73) Moreale A., van Bladel R., (1981),Adsorption de 13 herbicides et insecticides par le sol. Relation solubilitereactivite. Revue de l'Agric, 34 (4), 319-322.
(74) Müller M., Kördel W. (1996),Comparison of screening methods for the determination/estimation o f adsorption coefficients on soil. Chemosphere, 32(12), 2493-2504.
(75) Kördel W., Kotthoff G., Müller M. (1995).HPLC - screening method for the determination of the adsorption coefficient on soil - results of a ring test. Chemosphere 30 (7), 1373-1384.
(76) Kördel W., Stutte J., Kotthoff G. (1993),HPLC - screening method for the determination of the adsorption coefficient on soil - comparison of different stationary phases. Chemosphere 7 27 (12, 2341-2352.
(77) Hance, R. J. (1967),The Speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides. Weed Research, Vol. 7, 29-36.
(78) Koskinen W. C and Harper S. (1990),The retention processes: mechanismsin Pesticides in the Soil Environment: Processes, Impacts and Modelling (ed. h.H. Cheng). Soil Sci. Soc. Am. Book Series, No. 2, Madison, Wisconsin.
(79) Cohen S. Z., Creeger S. M., Carsel R. F. and Enfield C. G. (1984),Potential pesticide contamination of groundwater from agricultural uses, in Treatment and Disposal of Pesticide Wastes, 297-325, ACS Symp. Ser, 259, American Chemical Society, Washington DC.
(80) Giles C. H. (1970),Interpretation and use f of SoSorption isothermsin Sorption and Transport Processes in Soils. S.C.I. Monograf No. 37, 14-32.
(81) Giles C. H., McEwan J. H., Nakhwa S.N. and Smith D. (1960),Studies in adsorption: XI. A System of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils. J. Chem. Soc, 3973-93.
(82) Calvet R., Terce M. and Arvien J. C. (1980), Adsorption des pesticides par les sols et leurs constituants: 3. Caracteristiques generales de l'adsorption. Ann. Agron. 31, 239-251.
(83) Bedbur E. (1996), Anomalies in the Freundlich equation', Proc. COST 66 Workshop, Pesticides in soil and the environment, 13-15 May 1996, Stratfordupon-Avon, UK.
(84) Guth, J. A., (1985),Adsorption/desorption, in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1-3, Canterbury, UK.
(85) Soil Texture Classification (US and FAO Systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
...
1) Csads (eq) = Kd· Caqads (eq).
2) Einträge der Konzentration der Testsubstanz in der wässrigen Phase ((Caqads)) in Abhängigkeit von der Zeit könnten ferner zur Abschätzung des Erreichens des Gleichgewichtsplateaus verwendet werden (siehe Abbildung 2 in Anlage 5).
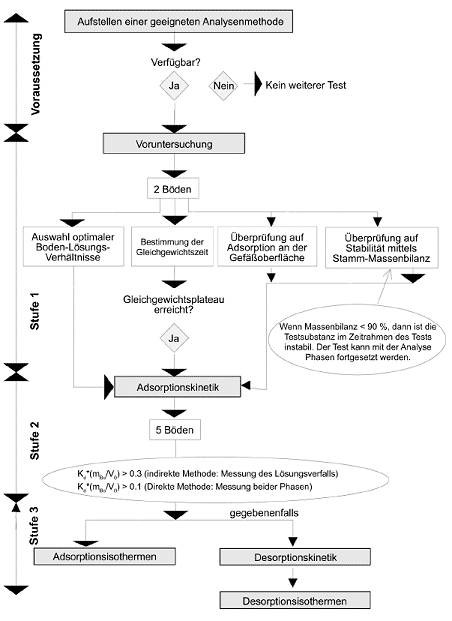
| Testplan | Anlage 1 |
| Einfluss der Genauigkeit der Analysenmethode und der Konzentrationsveränderung auf die Genauigkeit von Adsorptionsergebnissen | Anlage 2 |
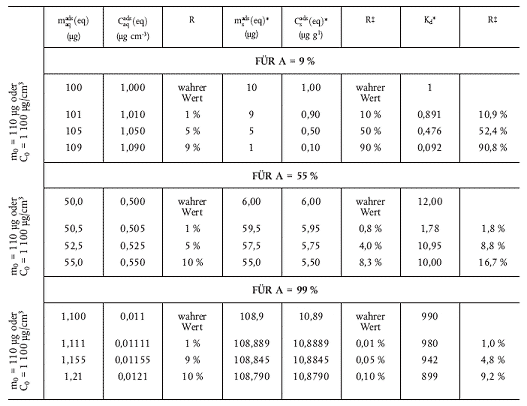
Wie die nachstehende Tabelle (84) verdeutlicht, führt dann, wenn die Differenz zwischen der Anfangsmasse (m0 = 110 µg) und der Gleichgewichtsmasse (maqads (eq)) der Testsubstanz sehr gering ist, eine Abweichung von 5 % bei der Messung der Gleichgewichtskonzentration zu einer Abweichung von 50 % bei der Berechnung des Gehalts der an Boden adsorbierten Substanz (msads (eq)) und von 52,4 % bei der Berechnung von Kd.
| Menge des Bodens | mBoden | = 10 g |
| Volumen der Lösung | V0 | = 100 cm3 |
Hierin bedeuten:
| *msads (eq) | 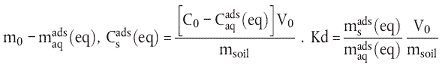 |
| msads (eq) | = Masse der Testsubstanz in der Bodenphase bei Gleichgewicht, µg; |
| maqads (eq) | = Masse der Testsubstanz in der wässrigen Phase bei Gleichgewicht, Itg; |
| Csads (eq) | = Gehalt der Testsubstanz in der Bodenphase bei Gleichgewicht, µg g-1; |
| Caqads (eq) | = Massenkonzentration der Testsubstanz in der wässrigen Phase bei Gleichgewicht, µg cm-3; |
| R | = Analysenfehler bei der Bestimmung der maqads (eq); |
| R | = rechnerische Abweichung als Folge des Analysenfehlers R. |
| Abschätzungsverfahren für Kd | Anlage 3 |

Tabelle 1. Beispielhafte Korrelationen zwischen dem Adsorptionsverteilungskoeffizienten und dem Oktanol-Wasser-Verteilungskoeffizienten; weitere Beispiele siehe (12) (68).
| Substanzen | Korrelationen | Verfasser |
| Substituierte Harnstoffe | log Kom = 0,69 + 0,52 log Pow | Briggs (1981) (39) |
| Aromatische chlorierte Substanzen | log Koc = - 0,779 + 0,904 log Pow | Chiou et al. (1983) (65) |
| Verschiedene Pestizide | log Kom = 4,4 + 0,72 log Pow | Gerstl und Mingelgrin (1984) (66) |
| Aromatische Kohlenwasserstoffe | log Koc = - 2,53 + 1,15 log Pow | Vowles und Mantoura (1987) (67) |
Tabelle 2. Beispielhafte Korrelationen zwischen dem Adsorptionsverteilungskoeffizienten und der Wasserlöslichkeit: weitere Beispiele siehe (68) (69).
| Verbindungen | Korrelationen | Verfasser |
| Verschiedene Pestizide | log Kom = 3,8 - 0,561 log Sw | Gerstl und Mingelgrin (1984) (66) |
| Aliphatische, aromatische chlorierte Substanzen | log Kom = (4,040 +/- 0,038) - (0,557 +/-0,012) log Sw | Chiou et al. (1979) (70) |
| a-Naphtol | log Koc = 4,273 - 0,686 log Sw | Hasset et al. (1981) (71) |
| Cyclische, aliphatische aromatische Substanzen | log Koc = - 1,405 - 0,921 log Sw-0,00953 (mp 25) | Karickhoff (1981) (72) |
| Verschiedene Verbindungen | log Kom = 2,75 - 0,45 log Sw | Moreale van Blade (1982) (73) |
| Berechnungen zur Festlegung der Zentrifugationsbedingungen | Anlage 4 |
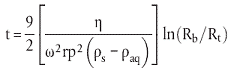 | (1) |
Zur Vereinfachung sind alle Parameter in Nicht-SI-Einheiten beschrieben (g, cm).
Hierin bedeuten:
| ω | = die Drehzahl (= 2 πUpm/60), rad s-1; |
| rpm | = Umdrehungen pro Minute; |
| η | = Viskosität der Lösung, g s-1 cm-1; |
| rp | = Partikelradius, cm; |
| ρs | = Lösungsdichte, g cm-3; |
| ρaq | = solution density, g cm-3; |
| Rt | = Abstand vom Zentrum des Zentrifugenrotors zum oberen Ende der Lösung im Zentrifugenglas, cm; |
| Rb | = Abstand vom Zentrum des Zentrifugenrotors zum unteren Ende des Zentrifugenglases, cm; |
| Rb-Rt | = Länge des Boden-Lösungs-Gemischs im Zentrifugenrohr |
In der Praxis wird zur Gewährleistung einer vollständigen Trennung üblicherweise das Doppelte der berechneten Zeiten angesetzt.
Daraus ergibt sich die Zentrifugationszeit nach folgender Gleichung (2):
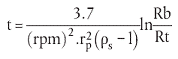 | (2) |
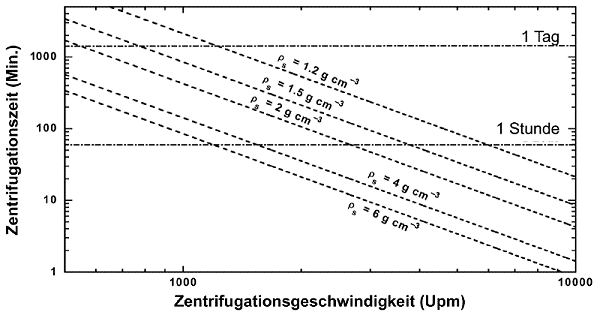
Variationen der Zentrifugationszeit (t) in Abhängigkeit von der Zentrifugiergeschwindigkeit (Upm) für unterschiedliche Bodendichten (ρs). Rt = 10 cm, Rb-Rt = 10 cm, η= 8,95 x 10-3 g s-1 cm-11und ρaq = 1,0 g cm-3 und 25 °C.
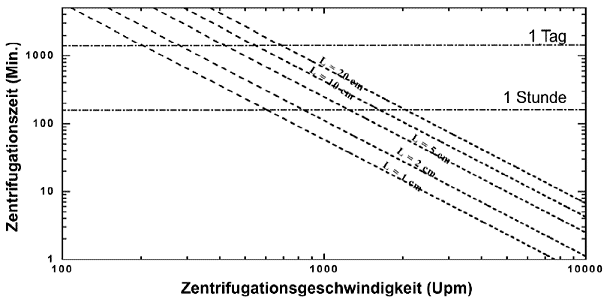
Variationen der Zentrifugationszeit (t) in Abhängigkeit von der Zentrifugiergeschwindigkeit (Upm) für unterschiedliche Längen des Gemischs im Zentrifugenglas (Rb-Rt) = L; Rt = 10 cm, η= 8,95 x 10-3 g s-1 cm-1, ρaq = 1,0 g cm-3 at 25 °C und ρs = 2,0 g cm-3.
| Berechnung von Adsorption A (%) und Desorption D (%) | Anlage 5 |
Die Zeitplanung des Ablaufs sieht wie folgt aus:
Für alle Berechnungen wird angenommen, dass die Testsubstanz stabil ist und nicht signifikant an den Behälterwänden adsorbiert.
Adsorption A (A %)
a) Gesamtbeprobungsmethode
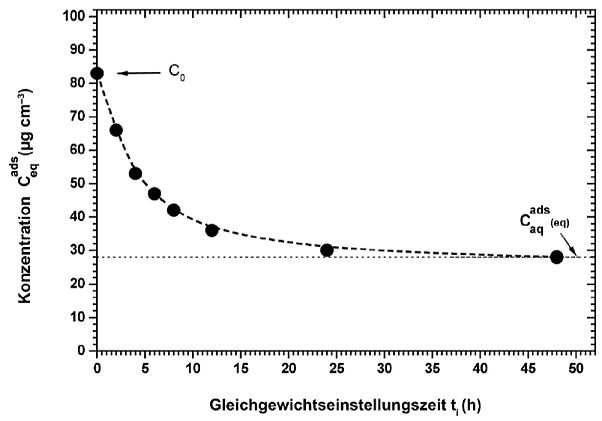
Der Adsorptionsanteil wird für jedes Reagenzglas (i) zu jedem Zeitpunkt (ti) nach folgender Gleichung berechnet:
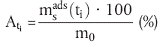 | (1) |
Die Tenne dieser Gleichung lassen sich wie folgt berechnen:
| m0 = C0 · V0 (µg) | (2) |
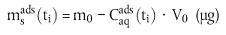 | (3) |
Hierin bedeuten:
| Ati | = Adsorptionsanteil (%) zum Zeitpunkt ti; |
| msads (ti) | = Masse der Testsubstanz an Boden zum Zeitpunkt ti, an dem die Analyse durchgeführt wird (µg); |
| m0 | = Masse Testsubstanz im Reagenzglas zu Beginn des Tests (µg): |
| C0 | = Anfangsmassenkonzentration der Testlösung in Kontakt mit dem Boden (µg cm-3): |
| Caqads (ti) | = Massenkonzentration der Substanz in der wässrigen Phase zur Zeit ti, zu der die Analyse durchgeführt wird (µg cm-3); diese Konzentration wird analytisch unter Berücksichtigung der anhand der Leerproben gewonnenen Werte bestimmt. |
| V0 | = Anfangsvolumen der Testlösung in Kontakt mit dem Boden (cm3). |
Die Werte des Adsorptionsanteils Ati bzw. Caqads (ti) werden grafisch in Abhängigkeit von der Zeit aufgetragen, und die Zeit, nach der das Sorptionsgleichgewicht erreicht ist, wird bestimmt. Beispiele für solche grafischen Darstellungen sind die Abb. 1 und 2.
Abb. 1. Grafische Darstellung eines Adsorptionsgleichgewichts
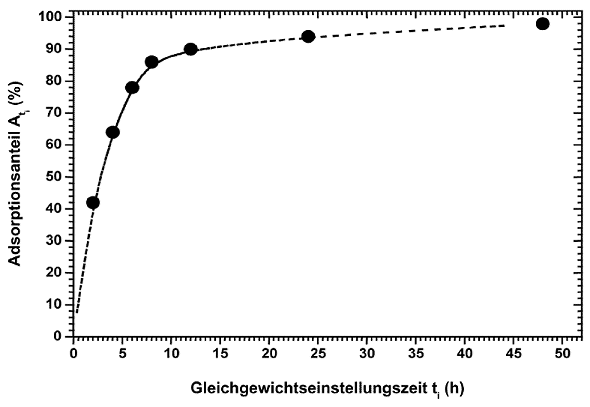
Abb. 2. Massenkonzentration der Testsubstanz in der wässrigen Phase (Caq) in Abhängigkeit von der Zeit
(1) Gleichungen sowohl auf die direkte als auch auf die indirekte Methode anwendbar. Alle anderen Gleichungen gelten nur für die indirekte Methode.
b) Aliquotenbeprobungsmethode
Bei den folgenden Gleichungen wird in Rechnung gestellt, dass die Adsorptionsprozedur durch Messungen der Testsubstanz in kleinen Aliquoten der wässrigen Phase in bestimmten Zeitintervallen ausgeführt wird.
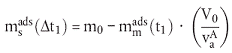 | (4) |
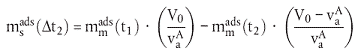 | (5) |
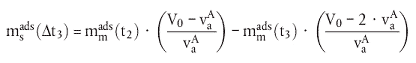 | (6) |
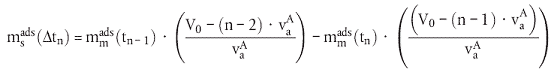 | (7) |
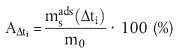 | (8) |
wohingegen der Adsorptionsanteil (Ati) zu einem Zeitpunkt ti nach folgender Gleichung erhalten wird:
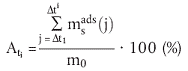 | (9) |
Die Werte der Adsorption Ati bzw. AΔ ti (in Bezug auf die Anforderungen der Untersuchung) werden grafisch in Abhängigkeit von der Zeit aufgetragen, und die Zeit, nach der das Sorptionsgleichgewicht eingestellt ist, wird bestimmt.
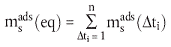 | (10) |
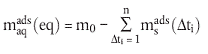 | (11) |
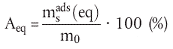 | (12) |
Die vorstehend verwendeten Parameter werden wie folgt definiert:
| msads (Δt1), msads (Δt2), ..., msads (Δtn) | = Masse der am Boden während der Zeitintervalle Δt1, Δt2, ..., Δtn adsorbierten Substanz (µg); |
| mmads (t1), mmads (t2), ..., mnads (tn) | = Masse der in einer Aliquote vaA zu den Zeitpunkten t1, t2, ..., tn gemessenen Substanz (µg); |
| msads (eq) | = Masse der am Boden bei Adsorptionsgleichgewicht adsorbierten Substanz (µg); |
| maqads (eq) | = Masse der Substanz in der Lösung bei Adsorptionsgleichgewicht (µg): |
| vaA | = Volumen der Aliquote, in der die Testsubstanz gemessen wird (cm3); |
| AΔti | = Adsorptionsanteil bei Adsorptionsgleichgewicht (%). |
| Aeq | = entsprechender Adsorptionsanteil in einem Zeitintervall Δti (%); |
(1) Gleichungen sowohl auf die direkte als auch auf die indirekte Methode anwendbar. Alle anderen Gleichungen gelten nur für die indirekte Methode.
Desorption D (%)
Als die Zeit t0, bei der das Desorptionskinetikexperiment beginnt, gilt der Augenblick, in dem das höchste erhaltene Volumen der Testsubstanzlösung (nach Einstellen des Adsorptionsgleichgewichts) durch ein identisches Volumen 0,01 M CaCl2-Lösung ersetzt wird.
a) Gesamtbeprobungsmethode
Zu einem Zeitpunkt ti wird die Masse der Testsubstanz in der wässrigen Phase gemessen, die aus dem Glas i (Vri) abgenommen wurde, und die desorbierte Masse wird nach folgender Gleichung berechnet:
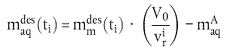 | (13) |
ei Desorptionsgleichgewicht ist ti = teq und folglich ist maqdes (ti) = maqdes (eq)
Die Masse der während eines Zeitintervalls (Δti) desorbierten Testsubstanz wird durch folgende Gleichung erhalten:
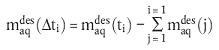 | (14) |
Die Berechnung des Desorptionsanteils erfolgt:
zu einem Zeitpunkt ti aus der Gleichung:
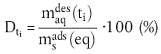 | (15) |
und während eines Zeitintervalls (Δti) aus der Gleichung:
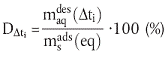 | (16) |
Hierin bedeuten:
| Dti | = Desorptionsanteil zu einem Zeitpunkt ti (%); | |
| DΔti | = Desorptionsanteil entsprechend einem Zeitintervall Δti (%); | |
| maqdes (t1) | = Masse der zu einem Zeitpunkt ti desorbierten Testsubstanz (µg); | |
| maqdes (Δt1) | = Masse der während eines Zeitintervalls Δti desorbierten Testsubstanz (µg): | |
| mmdes (ti) | = Masse der zu einem Zeitpunkt ti in einem Lösungsvolumen Vri analytisch gemessenen Testsubstanz, die zur Analyse abgenommen wird (µg); | |
| maqA | = Masse der nach Adsorptionsgleichgewichtseinstellung infolge unvollständigen Volumenaustauschs verbleibenden Testsubstanz (µg); | |
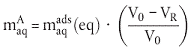 | (17) | |
| maqads (eq) | = Masse der Testsubstanz in der Lösung bei Adsorptionsgleichgewicht (µg); | |
| VR | = Volumen des nach Erreichen des Adsorptionsgleichgewichts aus dem Glas abgenommenen und durch ein identisches Volumen 0,01 M CaCl2-Lösung ersetzten Überstandes (cm3); | |
| Vri | = Volumen der im Desorptionskinetikversuch aus dem Glas (i) zur Messung der Testsubstanz abgenommenen Lösung (cm3). | |
Die Desorptionswerte Dti bzw. DΔ ti (gemäß den Anforderungen der Untersuchung) werden grafisch in Abhängigkeit von der Zeit aufgetragen, und die Zeit, nach der das Desorptionsgleichgewicht erreicht wird, wird bestimmt.
b) Aliquotenbeprobungsmethode
Bei den nachstehenden Gleichungen wird in Rechnung gestellt, dass die zuvor ausgeführte Adsorptionsprozedur mittels Messung der Testsubstanz in kleinen Aliquoten (vaA) der wässrigen Phase (Aliquotenbeprobungsmethode siehe 1.9 "Durchführung des Tests") ausgeführt wurde. Es wird angenommen, dass a) das Volumen des aus dem Glas nach dem Adsorptionskinetikversuch abgenommenen Überstands durch ein identisches Volumen 0,01 M CaCl2-Lösung (VR) ersetzt wurde, und dass b) das Gesamtvolumen der wässrigen Phase in Kontakt mit dem Boden (VT) während des Desorptionskinetikversuchs konstant bleibt und nach folgender Gleichung erhalten wird:
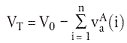 | (18) |
Zu einem Zeitpunkt ti:
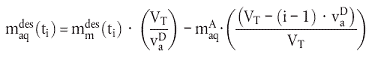 | (19) |
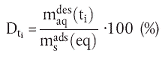 | (20) |
In einem Zeitintervall (Δti):
Während jedes Zeitintervalls wird die Menge der desorbierten Substanz wie folgt berechnet:
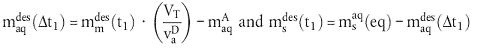 | (21) |
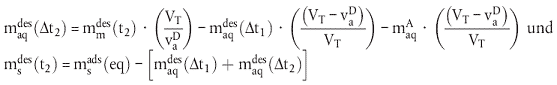 | (22) |
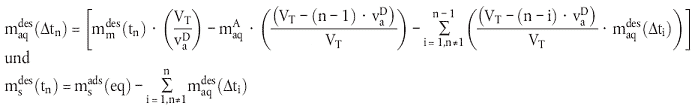 | (23) |
Abschließend wird der Desorptionsanteil für jedes Zeitintervall, DΔti, nach folgender Gleichung berechnet:
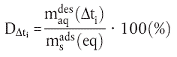 | (24) |
wobei der Desorptionsanteil Dti zu einem Zeitpunkt ti durch folgende Gleichung erhalten wird:
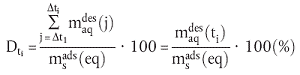 | (25) |
dabei werden die vorstehend eingesetzten Parameter wie folgt definiert:
| msdes (Δt1), msdes (Δt2), ..., msdes (Δtn) | = Masse der nach den Zeitintervallen Δti, Δt2, ..., Δtn am Boden adsorbiert bleibenden Substanz (µg); | |
| maqdes (Δt1), maqdes (Δt2), ..., maqdes (Δtn) | = Masse der während der Zeitintervalle Δt1Δt2, ... bzw. Δtn desorbierten Substanz (µg); | |
| mmdes (t1), mmdes (t2), ..., mmdes (tn) | = Masse der in einer Aliquote ((vaD) zu den Zeitpunkten t1, t2, ... bzw. tn, gemessenen Substanz (µg); | |
| VT | = Gesamtvolumen der wässrigen Phase in Kontakt mit dem Boden während des nach der Aliquotenbeprobungsmethode durchgeführten Desorptionskinetikversuchs (cm3); | |
| maqA | = Masse der nach Adsorptionsgleichgewichtseinstellung infolge unvollständigen Volumenaustauschs verbliebenen Testsubstanz (µg); | |
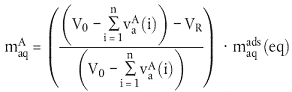 | (26) | |
| VR | = Volumen des aus dem Glas nach Einstellen des Adsorptionsgleichgewichts abgenommenen und durch das identische Volumen 0,01 M CaCl2-Lösung ersetzten Überstands (cm3); | |
| vaD | = Volumen der während des nach der Aliquotenbeprobungsmethode durchgeführten Desorptionskinetikversuchs als Probe zu Analysenzwecken aus dem Glas abgenommenen Aliquote (i) (cm3); | |
| vaD≤0,02 · VT | (27) | |
| Adsorption-Desorption in Böden: Datenberichtsformulare | Anlage 6 |
Getestete Substanz:
Getesteter Boden:
Trockenmassegehalt des Bodens (105 °C, 12 h): ........................................ %
Temperatur: ................................................................................................ °C
Eignung der Analysenmethode
| Bodeneinwaage | g | |
| Boden: Trockenmasse | g | |
| Volumen CaCl2-Lösung | cm3 | |
| Nennkonzentration fertige Lösung | µg cm-3 | |
| Analysenkonzentration fertige Lösung | µg cm-3 |
Prinzip der zugrunde liegenden Analysenmethode:
Kalibrierung der Analysenmethode:
Getestete Substanz:
Getesteter Boden:
Trockenmassegehalt des Bodens (105 °C, 12h): .......................................................... %
Temperatur: ................................................................................................................. °C
| Zugrundeliegende Analysenmethodik: | Indirekt [ ]
Direkt [ ] | Gesamt [ ] | Aliquoten [ ] |
Adsorptionstest:
Testproben
| Symbol | Einheiten | Gleichgewichts- einstellungszeit | Gleichgewichts- einstellungszeit | Gleichgewichts- einstellungszeit | Gleichgewichts- einstellungszeit | |||||
| Glas Nr. | ||||||||||
| Bodeneinwaage | - | g | ||||||||
| Boden: Trockenmasse | mBoden | g | ||||||||
| Wasservolumen in Bodeneinwaage (rechnerisch) | Vws | cm3 | ||||||||
| Volumen 0,01 M CaCl2-Lösung zur Gleichgewichtseinstellung des Bodens | cm3 | |||||||||
| Volumen Vorratslösung | cm3 | |||||||||
| Gesamtvolumen wässrige Phase in Kontakt mit Boden | V0 | cm3 | ||||||||
| Anfangskonzentration Testlösung | C0 | µg cm-3 | ||||||||
| Masse Testsubstanz bei Beginn des Tests | m0 | µg | ||||||||
| Nach Schütteln und Zentrifugieren | ||||||||||
| INDIREKTE METHODE | ||||||||||
| Gesamtbeprobungsmethode | ||||||||||
| Konzentration Testsubstanz wässrige Phase, Leerkorrektur berücksichtigt | Caqads (ti) | µg cm-3 | ||||||||
| Aliquotenbeprobungsmethode | ||||||||||
| Gemessene Masse Testsubstanz in der Aliquote VaA | mmads (ti) | µg | ||||||||
| DIREKTMETHODE | ||||||||||
| Masse der an Boden adsorbierten Testsubstanz | msads (ti) | µg | ||||||||
| Adsorptionsberechnung | ||||||||||
| Adsorption | Ati | % | ||||||||
| AΔti | % | |||||||||
| Mittel | ||||||||||
| Adsorptionskoeffizient | Kd | cm3 g-1 | ||||||||
| Mittel | ||||||||||
| Adsorptionskoeffizient | Koc | cm3 g-1 | ||||||||
| Mittel | ||||||||||
Getestete Substanz:
Getesteter Boden:
Trockenmassegehalt des Bodens (105 °C, 12 h): ........................................................................... %
Temperatur: ................................................................................................................................... °C
Adsorptionstest:
Leer- und Kontrollwerte
| Symbol | Einheiten | Leerwert | Leerwert | Kontrollwert | ||||
| Glas Nr. | ||||||||
| Bodeneinwaage | g | 0 | 0 | |||||
| Wassermenge in Bodeneinwaage (rechnerisch) | cm3 | - | - | |||||
| Volumen zugesetzter 0,01 M CaCl2-Lösung | cm3 | |||||||
| Volumen der zugesetzten Vorratslösung der Testsubstanz | cm3 | 0 | 0 | |||||
| Gesamtvolumen wässriger Phase (rechnerisch) | cm3 | - | - | |||||
| Anfangskonzentration der Testsubstanz in wässriger Phase | µg cm-3 | |||||||
| Nach Schütteln und Zentrifugieren | ||||||||
| Konzentration in wässriger Phase | µg cm-3 | |||||||
Hinweis: Falls erforderlich, können weitere Spalten angefügt werden.
Getestete Substanz:
Getesteter Boden:
Trockenmassegehalt des Bodens (105 °C, 12 h): ........................................................... %
Temperatur: ................................................................................................................. °C
Massenbilanz
| Symbol | Einheiten | |||||
| Glas Nr. | ||||||
| Bodeneinwaage | - | g | ||||
| Boden: Trockenmasse | mBoden | g | ||||
| Wasservolumen in Bodeneinwaage (rechnerisch) | Vws | ml | ||||
| Volumen 0,01 M CaCl2-Lösung zur Gleichgewichtseinstellung des Bodens | ml | |||||
| Volumen der Vorratslösung | cm3 | |||||
| Gesamtvolumen wässrige Phase in Kontakt mit Boden | v0 | cm3 | ||||
| Anfangskonzentration der Testlösung | C0 | µg cm-3 | ||||
| Gleichgewichtseinstellungszeit | - | h | ||||
| Nach Schütteln und Zentrifugieren | ||||||
| Testsubstanz wässrige Phase bei Adsorptionsgleichgewicht, Leerkorrektur berücksichtigt | Caqads (eq) | µg cm-3 | ||||
| Gleichgewichtseinstellungszeit | teq | h | ||||
| Erste Verdünnung mit Lösungsmittel | ||||||
| Abgenommenes Volumen wässrige Phase | Vrec | cm3 | ||||
| Zugesetztes Volumen Lösungsmittel | ΔV | cm3 | ||||
| Erste Extraktion mit Lösungsmittel | ||||||
| Signalanalysiert in Lösungsmittel | SE1 | var. | ||||
| Konzentration Testsubstanz in Lösungsmittel | CE1 | µg cm-3 | ||||
| Masse der aus Boden und von Gefäßwänden extrahierten Substanz | mE1 | µg | ||||
| Zweite Verdünnung mit Lösungsmittel | ||||||
| Abgenommenes Volumen Lösungsmittel | ΔVS | cm3 | ||||
| Zugesetztes Volumen Lösungsmittel | ΔV' | cm3 | ||||
| Zweite Extraktion mit Lösungsmittel | ||||||
| Signal analysiert in Lösungsmittelphase | SE2 | var. | ||||
| Konzentration Testsubstanz in Lösungsmittel | CE2 | µg cm-3 | ||||
| Masse der aus Boden und von Gefäßwänden extrahierten Substanz | mE2 | µg | ||||
| Gesamtmasse Testsubstanz extrahiert in zwei Schritten | mE | µg | ||||
| Massenbilanz | MB | % | ||||
Getestete Substanz:
Getesteter Boden:
Trockenmassegehalt des Bodens (105 °C, 12 h): ............................................................ %
Temperatur: .................................................................................................................... °C
Adsorptionsisothermen
| Symbol | Einheiten | ||||||||||||||||
| Glas Nr. | |||||||||||||||||
| Bodeneinwaage | - | g | |||||||||||||||
| Boden: Trockenmasse | E | g | |||||||||||||||
| Wasservolumen in Bodeneinwaage (rechnerisch) | VWS | cm3 | |||||||||||||||
| Volumen 0,01 M CaCl2-Lösung zur Gleichgewichtseinstellung des Bodens | cm3 | ||||||||||||||||
| Volumen zugesetzter Vorratslösung | cm3 | ||||||||||||||||
| Gesamtvolumen wässrige Phase in Kontakt mit Boden (rechnerisch) | V0 | cm3 | |||||||||||||||
| Konzentration Lösung | C0 | µg cm-3 | |||||||||||||||
| Gleichgewichtseinstellungszeit | - | h | |||||||||||||||
| Nach Schütteln und Zentrifugieren | |||||||||||||||||
| Konzentration Substanz wässrige Phase, Leerkorrektur berücksichtigt | Caqads (eq) | µg cm-3 | |||||||||||||||
| Temperatur | °C | ||||||||||||||||
| Adsorbierte Masse je Einheit Boden | Csads (eq) | µg g-1 | |||||||||||||||
Regressionsanalyse:
Wert von: KFads:
Wert von l/n:
Regressionskoeffizient r2:
Getestete Substanz:
Getesteter Boden:
Trockenmassegehalt des Bodens (105 °C, 12 h): ............................................................. %
Teperatur: ....................................................................................................................................... °C
| Zugrunde liegende Analysenmethodik: Indirekt [ ] | Gesamt [ ] | Aliquoten [ ] |
Desorptionstest
| Symbol | Einheiten | Zeitintervall | Zeitintervall | Zeitintervall | Zeitintervall | ||
| Glas Nr. aus dem Adsorptionsschritt | |||||||
| Masse von an Boden bei Adsorptionsgleichgewicht adsorbierter Substanz | msads (eq) | µg | |||||
| Abgenommenes Volumen wässrige Phase, ersetzt durch 0,01 M CaCl2 | VR | cm3 | |||||
| Gesamtvolumen wässrige Phase in Kontakt mit Boden | GM | V0 | cm3 | ||||
| AM | VT | cm3 | |||||
| Masse der nach Adsorptionsgleichgewichtseinstellung infolge unvollständigen Volumenaustauschs verbliebenen Testsubstanz | maqA | µg | |||||
| Desorptionskinetik | |||||||
| Gemessene Masse von aus Boden zur Zeit ti desorbierter Substanz | mmdes (ti) | µg | |||||
| Volumen der abgenommenen Lösung aus dem Glas (i) zur Messung der Testsubstanz | GM | Vfi | cm3 | ||||
| AM | vaD | cm3 | |||||
| Masse der aus Boden zur Zeit ti desorbierten Substanz (rechnerisch) | maqdes (ti) | µg | |||||
| Masse der aus Boden im Zeitintervall Δti desorbierten Substanz (rechnerisch) | maqdes (Δti) | µg | |||||
| Desorptionsanteil | |||||||
| Desorption zur Zeit ti | Dti | % | |||||
| Desortion im Zeitintervall Δti | DΔti | % | |||||
| Scheindesorptionskoeffizient | Kdes | ||||||
GM: Gesamtbeprobungsmethode
AM: Aliquotenbeprobungsmethode
 | weiter . |  |