
umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (35)
 | zurück |
| Definitionen | Anlage 1 |
Definitionen
Für diese Prüfmethode gelten folgende Definitionen:
Bestimmungsgrenze: die niedrigste Konzentration, die quantitativ gemessen werden kann.
Chemikalie: Stoff oder Gemisch.
ECx: die Konzentration der in Wasser gelösten Prüfchemikalie, die innerhalb eines angegebenen Expositionszeitraums zu einer Verringerung der Reproduktion der Daphnien um x Prozent führt.
Elterntiere: diejenigen weiblichen Daphnien, die zu Beginn der Prüfung vorhanden sind und deren Reproduktionsleistung in der Prüfung untersucht werden soll.
Immanente Wachstumsrate: ein Maß für das Wachstum der Population, das die Reproduktionsleistung und die altersspezifische Mortalität mit einbezieht (1) (2) (3). In stabilen Populationen ist die immanente Wachstumsrate gleich null. Bei wachsenden Populationen ist sie positiv, und bei schrumpfenden Populationen ist sie negativ. Letztere ist offensichtlich nicht nachhaltig und führt schließlich zum Aussterben.
Lowest Observed Effect Concentration (LOEC): die niedrigste geprüfte Konzentration, bei der innerhalb eines angegebenen Expositionszeitraums eine statistisch signifikante Wirkung der Chemikalie auf die Reproduktion und die Mortalität der Elterntiere (bei p < 0,05) im Vergleich zu der Kontrolle beobachtet wird. Alle Prüfkonzentrationen oberhalb der LOEC sollten jedoch eine mindestens ebenso große schädigende Wirkung haben wie die LOEC. Können diese beiden Bedingungen nicht erfüllt werden, sollte die Auswahl der LOEC (und damit auch der NOEC) ausführlich erklärt werden.
Mortalität: Ein Tier wird als tot protokolliert, wenn es unbeweglich ist, d. h., wenn es nicht schwimmen kann oder sich innerhalb von 15 Sekunden nach vorsichtigem Hin- und Herbewegen des Prüfbehälters keine Bewegungen von Extremitäten oder Postabdomen beobachten lassen. (Wird eine andere Definition herangezogen, muss diese zusammen mit dem dazugehörigen Literaturhinweis angegeben werden).
Mortalität ungeklärter Ursache: Mortalität unbekannter Ursache ohne Zusammenhang mit der Chemikalie.
Mortalität, auf Versehen zurückzuführend: Mortalität ohne Zusammenhang mit der Chemikalie, die durch ein Versehen verursacht wurde (d. h. bekannte Ursache).
Nachkommen: die jungen Daphnien, die von den Elterntieren im Verlauf der Prüfung produziert werden.
Nachweisgrenze: die niedrigste Konzentration, die nachgewiesen, aber nicht quantifiziert werden kann.
No Observed Effect Concentration (NOEC): die Prüfkonzentration unmittelbar unterhalb der LOEC, bei der im Vergleich zu der Kontrolle innerhalb eines angegebenen Expositionszeitraums keine statistisch signifikante Wirkung (p < 0,05) vorliegt.
Prüfchemikalie: Stoff oder Gemisch, der bzw. das mit dieser Prüfmethode getestet wird.
Reproduktionsleistung: die Anzahl lebender Nachkommen, die von Elterntieren während der Prüfung produziert wurden.
Literaturhinweise
(1) Wilson, E.O. and Bossert, W.H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers.
(2) Poole, R.W. (1974). An Introduction to quantitative Ecology. Mc Graw Hill Series in Population Biology, New York, 532.
(3) Meyer, J. S., Ingersoll, C. G., McDonald, L.L. and Boyce, M.S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, 1156-1166.
| Herstellung der vollständig definierten Medien Elendt M7 und M4 | Anlage 2 |
Gewöhnung an die Medien Elendt M7 und M4
Einige Prüfeinrichtungen haben Schwierigkeiten, Daphnien direkt in die Medien M4 (1) und M7 umzusetzen. Erfolgreich war jedoch eine schrittweise Eingewöhnung, d. h. Wechsel vom eigenen Medium in 30 %iges Elendt, dann in 60 %iges Elendt und dann in 100 %iges Elendt. Die Eingewöhnungszeiten können dabei durchaus einen Monat betragen.
Herstellung
Spurenelemente
Zunächst werden gesonderte Stammansätze (I) einzelner Spurenelemente in Wasser mit geeignetem Reinheitsgrad, z.B. entionisiertes oder destilliertes Wasser oder Wasser aus umgekehrter Osmose, hergestellt.
Aus diesen unterschiedlichen Stammansätzen (I) wird ein zweiter einziger Stammansatz (II) hergestellt, der alle Spurenelemente enthält (kombinierte Lösung), d. h.:
| Stammansätze I (einzelner Stoff) | Dem Wasser zugesetzte Menge | Konzentration (in Verhältnis zum Medium M4) | Zur Herstellung des kombinierten Stammansatzes II die folgende Menge an Stammansatz I in Wasser geben | |
| mg/l | ml/l | |||
| M4 | M7 | |||
| H3BO3 | 57.190 | 20.000 | 1,0 | 0,25 |
| MnCl2·4 H2O | 7.210 | 20.000 | 1,0 | 0,25 |
| LiCl | 6.120 | 20.000 | 1,0 | 0,25 |
| RbCl | 1.420 | 20.000 | 1,0 | 0,25 |
| SrCl2·6 H2O | 3.040 | 20.000 | 1,0 | 0,25 |
| NaBr | 320 | 20.000 | 1,0 | 0,25 |
| Mo Na2O4 ·2 H2O | 1.260 | 20.000 | 1,0 | 0,25 |
| CuCl2·2 H2O | 335 | 20.000 | 1,0 | 0,25 |
| ZnCl2 | 260 | 20.000 | 1,0 | 1,0 |
| CoCl2·6 H2O | 200 | 20.000 | 1,0 | 1,0 |
| KI | 65 | 20.000 | 1,0 | 1,0 |
| Na2SeO3 | 43,8 | 20.000 | 1,0 | 1,0 |
| NH4VO3 | 11,5 | 20.000 | 1,0 | 1,0 |
| Na2EDTA·2 H2O | 5.000 | 2.000 | - | - |
| FeSO4·7 H2O | 1 991 | 2.000 | - | - |
| Sowohl die Na2EDTA- als auch die FeSO4-Lösung werden einzeln hergestellt, zusammengegossen und sofort autoklaviert. Dies ergibt: | ||||
| Fe-EDTA-Lösung | 1.000 | 20,0 | 5,0 | |
Medien M4 und M7
Die Medien M4 und M7 werden wie folgt aus dem Stammansatz II, Makronährstoffen und Vitaminen hergestellt:
| Dem Wasser zugesetzte Menge | Konzentration (in Verhältnis zum Medium M4) | Zur Herstellung des Mediums zugesetzte Menge an Stammansatz | ||
| mg/l | ml/l | |||
| M4 | M7 | |||
| Stammansatz II
(kombinierte Spurenelemente) | 20 | 50 | 50 | |
| Makronährstoff-Stammansätze (einzelner Stoff) | ||||
| CaCl2·2 H2O | 293.800 | 1.000 | 1,0 | 1,0 |
| MgSO4·7 H2O | 246.600 | 2.000 | 0,5 | 0,5 |
| KCl | 58.000 | 10.000 | 0,1 | 0,1 |
| NaHCO3 | 64.800 | 1.000 | 1,0 | 1,0 |
| Na2SiO3·9 H2O | 50.000 | 5.000 | 0,2 | 0,2 |
| NaNO3 | 2.740 | 10.000 | 0,1 | 0,1 |
| KH2PO4 | 1.430 | 10.000 | 0,1 | 0,1 |
| K2HPO4 | 1.840 | 10.000 | 0,1 | 0,1 |
| Kombinierter Vitamin-Stammansatz | - | 10.000 | 0,1 | 0,1 |
| Der kombinierte Vitamin-Stammansatz wird hergestellt, indem die drei Vitamine wie folgt in 1 Liter Wasser gegeben werden: | ||||
| mg/l | ||||
| Thiaminhydrochlorid | 750 | 10.000 | ||
| Cyanocobalamin (B12) | 10 | 10.000 | ||
| Biotin | 7,5 | 10.000 | ||
Der kombinierte Vitamin-Stammansatz wird in kleinen Portionen tiefgefroren aufbewahrt. Die Vitamine werden den Medien kurz vor der Verwendung zugesetzt.
Hinweis: Um die Ausfällung von Salzen bei der Herstellung der vollständigen Medien zu vermeiden, die Portionen von Stammansätzen in etwa 500-800 ml Wasser entionisiertes Wasser geben und dann auf 1 Liter auffüllen.
Hinweis: Erstmals in einer Publikation erwähnt wird das Medium M4 bei Elendt, B.P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. 11(154), 25-33;
| Analyse des gesamten organischen Kohlenstoffs (TOC) und Erstellung von Nomogrammen für den TOC-Gehalt von Algenfutter | Anlage 3 |
Bekanntermaßen wird der Kohlenstoffgehalt des Algenfutters normalerweise nicht direkt gemessen, sondern aus Korrelationen (d. h. Nomogrammen) mit Ersatzgrößen wie der Algenzellenzahl oder der Lichtextinktion abgeleitet.
Der TOC sollte eher durch Oxidation bei hoher Temperatur als durch UV- oder Persulfatmethoden gemessen werden. (Siehe hierzu auch: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
Für die Erstellung von Nomogrammen sollten die Algen durch Zentrifugierung vom Wachstumsmedium getrennt und dann in destilliertem Wasser resuspendiert werden. Der Ersatzparameter und die TOC-Konzentration werden in jeder Probe im Dreifachreplikat gemessen. Es sollten Blindproben des destillierten Wassers analysiert und die TOC-Konzentration von der TOC-Konzentration in der Algenprobe abgeleitet werden.
Die Nomogramme sollten über den geforderten Bereich von Kohlenstoffkonzentrationen linear verlaufen. Es folgen einige Beispiele.
Hinweis: Diese Beispiele sollten nicht für Umrechnungen herangezogen werden. Die Prüfeinrichtungen müssen ihre eigenen Nomogramme erstellen.
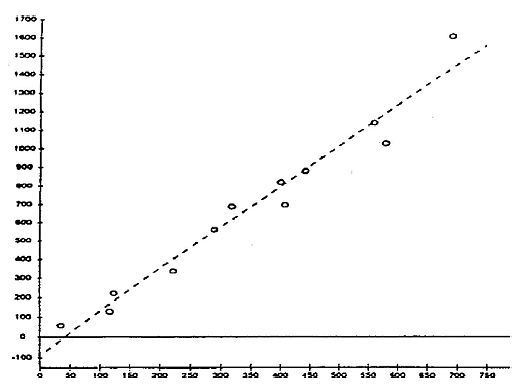
Chlorella vulgaris var. viridis (CCAP 211/12).
Regression von mg/l Trockengewicht zu mg C/1. Daten von konzentrierten Suspensionen von Zellen, die in semi-kontinuierlichen Chargen kultiviert und in destilliertem Wasser resuspendiert wurden.
X-Achse: mg C/1 konzentriertes Algenfutter
Y-Achse: mg/1 Trockengewicht konzentriertes Algenfutter
Korrekturkoeffizient -0,980
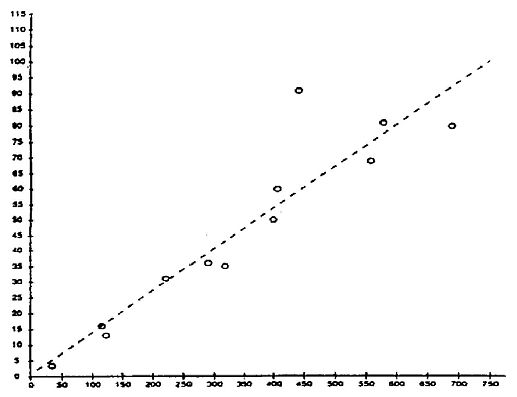
Chlorella vulgaris var. viridis (CCAP 211/12).
Regression der Zellenzahl zu mg C/1. Daten von konzentrierten Suspensionen von Zellen, die in semi-kontinuierlichen Chargen kultiviert und in destilliertem Wasser resuspendiert wurden.
X-Achse: mg C/1 konzentriertes Algenfutter
Y-Achse: Anzahl Zellen/1 konzentriertes Algenfutter
Korrekturkoeffizient -0,926
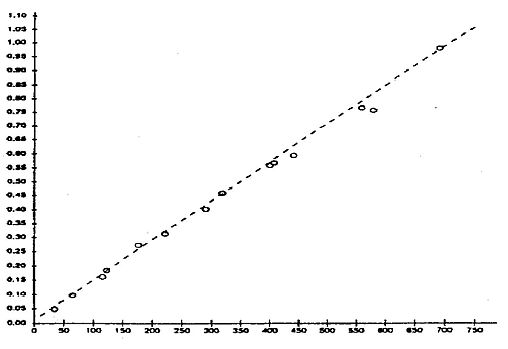
Chlorella vulgaris var. viridis (CCAP 211/12).
Regression der Extinktion zu mg C/1 (1 cm Pfadlänge). Daten von konzentrierten Suspensionen von Zellen, die in semi-kontinuierlichen Chargen kultiviert und in destilliertem Wasser resuspendiert wurden.
X-Achse: mg C/1 konzentriertes Algenfutter
Y-Achse: Extinktion von im Verhältnis 1:10 verdünntem konzentrierten Algenfutter bei 440 nm
Korrekturkoeffizient -0,998
| Beispieldatenblatt zur Protokollierung der Erneuerung des Prüfmediums, von physikalisch-chemischen Überwachungsdaten, der Fütterung, Daphnien-Reproduktion und Mortalität von Elterntieren | Anlage 4 |
| Versuch Nr.: | Startdatum: | Klon: | Medium: | Futterart: | Prüfchemikalie: | Nominale Konz.: | ||||||||||||||||||
| Tag | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | ||
| Mediumerneuerung (ankreuzen) | ||||||||||||||||||||||||
| PH * | neu | |||||||||||||||||||||||
| alt | ||||||||||||||||||||||||
| O2 (mg/l) * | neu | |||||||||||||||||||||||
| alt | ||||||||||||||||||||||||
| Temp. °C) * | neu | |||||||||||||||||||||||
| alt | ||||||||||||||||||||||||
| Geb. Futter (ankreuzen) | ||||||||||||||||||||||||
| Anz. leb. Nachkommen ** | Gesamt | |||||||||||||||||||||||
| Gefäß 1 | ||||||||||||||||||||||||
| 2 | ||||||||||||||||||||||||
| 3 | ||||||||||||||||||||||||
| 4 | ||||||||||||||||||||||||
| 5 | ||||||||||||||||||||||||
| 6 | ||||||||||||||||||||||||
| 7 | ||||||||||||||||||||||||
| 8 | ||||||||||||||||||||||||
| 9 | ||||||||||||||||||||||||
| 10 | ||||||||||||||||||||||||
| Gesamt | ||||||||||||||||||||||||
| Kumulative Mortalität bei Elterntieren *** | ||||||||||||||||||||||||
| *) Angeben, welches Gefäß für den Versuch verwendet wurde
**) Unreife Bruten als "AB" in dem betreffenden Kästchen protokollieren ***) Die Mortalität von Elterntieren als "M" in dem betreffenden Kästchen protokollieren | ||||||||||||||||||||||||
| Beispieldatenblatt für die Protokollierung der Ergebnisse der chemischen Analyse | Anlage 5 |
a) Gemessene Konzentrationen
| Nominale Konzentration | Probe aus Woche 1 | Probe aus Woche 2 | Probe aus Woche 3 | |||
| Frisch | Alt | Frisch | Alt | Frisch | Alt | |
b) Gemessene Konzentrationen in Prozent der Nominalkonzentrationen
| Nominale Konzentration | Probe aus Woche 1 | Probe aus Woche 2 | Probe aus Woche 3 | |||
| Frisch | Alt | Frisch | Alt | Frisch | Alt | |
| Berechnung eines zeitgewichteten Mittels | Anlage 6 |
Zeitgewichtetes Mittel
Da die Konzentration der Prüfchemikalie sich zwischen den Erneuerungen des Prüfmediums verringern kann, muss überlegt werden, welche Konzentration als repräsentativ für den Konzentrationsbereich, dem die Elterndaphnien ausgesetzt werden, ausgewählt werden sollte. Die Auswahl sollte dabei sowohl auf biologischen als auch auf statistischen Erwägungen beruhen. Geht man beispielsweise davon aus, dass die Reproduktion am stärksten durch die zur Anwendung kommende Spitzenkonzentration beeinflusst wird, dann sollte die maximale Konzentration herangezogen werden. Wird jedoch die kumulierte oder längerfristige Wirkung der toxischen Chemikalie für wichtiger gehalten, dann hat eine Durchschnittskonzentration eine größere Relevanz. In diesem Fall ist die zeitgewichtete mittlere Konzentration zu verwenden, bei der die Schwankung der momentanen Konzentration im Zeitverlauf berücksichtigt wird.
Abbildung 1 Beispiel für ein zeitgewichtetes Mittel
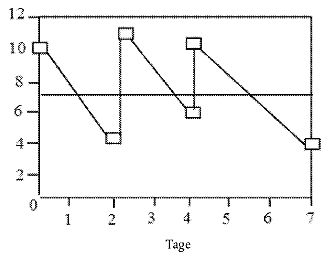
Abbildung 1 zeigt ein Beispiel für eine (vereinfachte) Prüfung über sieben Tage, bei der das Prüfmedium an den Tagen 0, 2 und 4 erneuert wird.
Das zeitgewichtete Mittel wird so berechnet, dass die Fläche unterhalb des zeitgewichteten Mittels gleich der Fläche unterhalb der Konzentrationskurve ist. Die Berechnung für das oben genannte Beispiel ist in Tabelle 1 dargestellt.
Tabelle 1 Berechnung des zeitgewichteten Mittels
| Erneuerung Nr. | Tage | Konz0 | Konz1 | ln(Konz0) | ln(Konz1) | Fläche |
| 1 | 2 | 10,000 | 4,493 | 2,303 | 1,503 | 13,767 |
| 2 | 2 | 11,000 | 6,037 | 2,398 | 1,798 | 16,544 |
| 3 | 3 | 10,000 | 4,066 | 2,303 | 1,403 | 19,781 |
| Gesamtanzahl Tage: | 7 | Gesamtfläche: | 50,092 | |||
| Zeitgew. Mittel: | 7,156 | |||||
Tage steht für die Anzahl von Tagen des Erneuerungszeitraums.
Konz0 ist die gemessene Konzentration zu Beginn jedes Erneuerungszeitraums.
Konz1 ist die gemessene Konzentration am Ende jedes Erneuerungszeitraums.
ln(Konz0) ist der natürliche Logarithmus von Konz0.
ln(Konz1) ist der natürliche Logarithmus von Konz1.
Fläche ist die Fläche unter der exponentiellen Kurve für jeden Erneuerungszeitraum. Sie wird wie folgt berechnet:
| Konz 0 - Konz 1 | ||
| Fläche = |
| x Tag |
| Ln(Konz 0) - ln(Konz 1) |
Das zeitgewichtete Mittel (zeitgew. Mittel) ist gleich der Gesamtfläche dividiert durch die Gesamtanzahl Tage.
Natürlich müsste die Tabelle für den Daphnien-Reproduktionstest auf einen Zeitraum von 21 Tagen erweitert werden.
Wenn Beobachtungen nur am Anfang und am Ende eines jeden Erneuerungszeitraums erfolgen, kann natürlich nicht bestätigt werden, ob der Zerfallsprozess tatsächlich exponentiell verläuft. Eine andere Kurve würde zu einer anderen Berechnung für die Fläche führen. Jedoch ist ein exponentieller Zerfallsprozess durchaus plausibel und wahrscheinlich die beste Kurve, die bei Fehlen anderer Informationen zu verwenden ist.
Vorsicht ist allerdings geboten, wenn in der chemischen Analyse am Ende des Erneuerungszeitraums keine Chemikalie gefunden wird. Wenn keine Möglichkeit besteht, abzuschätzen, wie schnell die Chemikalie aus der Lösung verschwunden ist, ist es unmöglich, eine realistische Fläche unter der Kurve zu erhalten, und damit auch unmöglich, ein plausibles zeitgewichtetes Mittel zu bestimmen.
| Leitfaden für die Geschlechtsbestimung bei frisch geschlüpften Daphnien | Anlage 7 |
Unter wechselnden Umgebungsbedingungen, wie z.B. Verkürzung der Fotoperiode, Temperaturschwankungen, Verringerung der Futterkonzentration und Erhöhung der Populationsdichte (Hobaek und Larson, 1990; Kleiven et al., 1992), können männliche Nachkommen produziert werden. Die Produktion männlicher Tiere ist auch eine bekannte Reaktion auf Insektenwachstumsregulatoren (Oda et al., 2005). Unter bestimmten Bedingungen, unter denen chemische Stressoren eine Verringerung der reproduktiven Nachkommen von parthenogenetischen Weibchen induzieren, wäre eine erhöhte Anzahl Männchen zu erwarten (OECD, 2008). Auf der Grundlage der vorliegenden Informationen lässt sich nicht vorhersagen, ob der Endpunkt "Geschlechterverhältnis" oder der Endpunkt "Reproduktion" empfindlicher ist; es gibt jedoch Anhaltspunkte dafür (vgl."Validierungsbericht", Teil 1), dass dieser Anstieg der Anzahl männlicher Tiere weniger empfindlich sein könnte als der Rückgang der Nachkommenschaft. Da der wichtigste Zweck der Prüfmethode darin besteht, die Anzahl an produzierten Nachkommen zu bestimmen, stellt das Auftreten männlicher Tiere eine optionale Beobachtung dar. Wird dieser optionale Endpunkt in einer Studie bewertet, sollte ein zusätzliches Testvaliditätskriterium von höchstens 5 % männlichen Tieren in den Kontrollen angewandt werden.
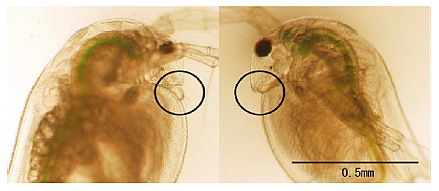
Die praktischste und einfachste Methode zur Geschlechtsbestimmung bei Daphnien besteht in der Nutzung ihrer phänotypischen Merkmale, da männliche und weibliche Tiere genetisch identisch und ihr Geschlecht abhängig von der Umgebung ist. Männliche und weibliche Tiere unterscheiden sich in Länge und Morphologie der ersten Antennen, die bei den Männchen länger sind (Abbildung 1). Dieser Unterschied ist direkt nach dem Schlüpfen erkennbar, während sich andere sekundäre Geschlechtsmerkmale mit dem Heranwachsen ausbilden (z.B. siehe Abbildung 2 in Olmstead und LeBlanc, 2000).
Zur Bestimmung des morphologischen Geschlechts sollten die von jedem Versuchstier produzierten Schlüpflinge per Pipette umgesetzt und in eine Petrischale mit Prüfmedium gelegt werden. Das Medium wird minimal gehalten, um die Bewegung der Tiere einzuschränken. Die ersten Antennen können unter einem Stereomikroskop (x 10-60) beobachtet werden.
Abbildung 1 24 Stunden altes Männchen (links) und Weibchen (rechts) der Art D. magna. Männchen unterscheiden sich in Länge und Morphologie der ersten Antennen von den Weibchen wie in den Kreisen gezeigt (Tatarazako et al., 2004).
Referenzdokumente
Hobaek A and Larson P. 1990. Sex determination in Daphnia magna. Ecology 71: 2255-2268.
Kleiven O.T., Larsson P., Hobaek A. 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197-206.
Oda S., Tatarazako N, Watanabe H., Morita M., and Iguchi T. 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61:1168-1174.
OECD, 2008. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. OECD Series on Testing and Assessment, Number 88. Organisation for Economic Co-operation and Development, Paris.
Olmstead, A.W., LeBlanc, G.A., 2000. Effects of endocrine-active chemicals on the development characteristics of Daphnia magna. Environmental Toxicology and Chemistry 19:2107-2113.
Tatarazako, N., Oda, S., Abe, R., Morita M. and Iguchi T., 2004. Development of a screening method for endocrine disruptors in crustaceans using Daphnia magna (Cladocera, Crustacea). Environmental Science 17, 439-449.
C.21 Bodenmikroorganismen: Stickstofftransformationsstest
1. Methode
Diese Testmethode entspricht der Prüfrichtlinie OECD TG 216 (2000).
1.1 Einleitung
Diese Testmethode beschreibt eine Labormethode zur Untersuchung der Langzeitauswirkungen von Chemikalien auf die Stickstofftransformationsaktivität von Bodenmikroorganismen nach einmaliger Exposition. Der Test beruht im Wesentlichen auf den Empfehlungen der Pflanzenschutzorganisation für Europa und den Mittelmeerraum (1), doch auch andere Richtlinien wurden berücksichtigt, wie die der deutschen Biologischen Bundesanstalt (2), der US-amerikanischen Environmental Protection Agency (3), SETAC (4) und von der Internationalen Organisation für Normung (5). Auf einem OECD-Workshop zur Boden-/Sedimentauswahl, der 1995 im italienischen Belgirate stattfand (6), wurden die bei diesem Test zu verwendende Anzahl und Art von Böden vereinbart. Die Empfehlungen zur Entnahme, Behandlung und Lagerung von Bodenproben basieren auf einer ISO-Anleitung (7) und auf Empfehlungen des Belgirate-Workshops. Bei der Be- und Auswertung toxischer Eigenschaften von Testsubstanzen kann eine Bestimmung der Auswirkungen auf die mikrobielle Aktivität des Bodens erforderlich sein, z.B. wenn Daten zu möglichen Nebenwirkungen von Pflanzenschutzmitteln auf die Mikroflora des Bodens benötigt werden oder wenn eine Exposition von Bodenmikroorganismen gegenüber anderen Chemikalien als Pflanzenschutzmitteln erwartet wird. Der Stickstofftransformationstest wird durchgeführt, um den Einfluss derartiger Chemikalien auf die Bodenmikroflora zu ermitteln. Bei der Prüfung von Agrochemikalien (z.B. Pflanzenschutzmittel, Düngemittel, Forstchemikalien), werden sowohl Stickstoff- als auch Kohlenstofftransformationstests durchgeführt. Bei anderen Substanzen als Agrochemikalien genügt der Stickstofftransformationstest. Liegen jedoch die EC50-Werte des Stickstofftransformationstests bei diesen Chemikalien im Bereich, der für käufliche Nitrifikationshemmstoffe (z.B. Nitrapyrin) ermittelt wurde, kann ein Kohlenstofftransformationstest durchgeführt werden, um weitere Informationen zu gewinnen,
Boden besteht sowohl aus lebenden als auch aus nichtlebenden Komponenten, die in komplexen und heterogenen Gemischen vorkommen. Beim Abbau organischen Materials und seiner Transformation in fruchtbaren Böden spielen Mikroorganismen eine wichtige Rolle, wobei viele Arten für unterschiedliche Aspekte der Bodenfruchtbarkeit verantwortlich sind. Jede langfristige Störung dieser biochemischen Prozesse kann sich potenziell auf den Nährstoffkreislauf auswirken und dadurch wiederum die Bodenfruchtbarkeit beeinflussen. Die Transformation von Kohlenstoff und Stickstoff erfolgt in allen fruchtbaren Böden. Die Transformationspfade sind im Wesentlichen gleich, auch wenn je nach Boden unterschiedliche mikrobielle Populationen für diese Prozesse verantwortlich sind.
Mit der hier beschriebenen Testmethode können durch einen Stoff hervorgerufene langfristige nachteilige Auswirkungen auf den Prozess der Stickstofftransformation in aeroben Oberböden bestimmt werden. Darüber hinaus ermöglicht die Testmethode die Abschätzung der Auswirkungen von Substanzen auf die Kohlenstoffumwandlung durch die Bodenmikroflora. Die Nitratbildung findet nach dem Zerfall der Kohlenstoff-Stickstoff-Bindungen statt. Werden also bei behandelten und Kontrollböden gleiche Nitratbildungsraten festgestellt, sind höchstwahrscheinlich die wichtigsten Kohlenstoffabbauwege intakt und funktionstüchtig. Das für den Test gewählte Substrat (pulverisiertes Luzernemehl) besitzt ein günstiges Kohlenstoff-Stickstoff-Verhältnis (in der Regel zwischen 12:1 und 16:1). Deshalb wird der Kohlenstoffmangel während des Tests verringert, und sollten mikrobielle Populationen durch eine Chemikalie geschädigt werden, könnten sie sich innerhalb von 100 Tagen wieder erholen.
Die Tests, auf deren Grundlage diese Testmethode entwickelt wurde, waren in erster Linie für Substanzen ausgelegt, bei denen die in den Boden gelangende Menge vorherbestimmt werden kann. Dies ist z.B. bei Pflanzenschutzmitteln der Fall, bei denen die Applikationsrate auf dem Feld bekannt ist. Bei Agrochemikalien genügt es, zwei Konzentrationen zu testen, die für die erwartete oder vorhergesagte Applikationsmenge relevant sind. Agrochemikalien können als Wirkstoffe (a.i.) oder als formulierte Handelsprodukte getestet werden. Der Test ist jedoch nicht auf Agrochemikalien begrenzt. Durch Veränderung sowohl der Mengen der auf den Boden aufgebrachten Testsubstanz als auch der Art und Weise, wie die Daten ausgewertet werden, kann der Test auch für Chemikalien angewendet werden, bei denen nicht bekannt ist, in welcher Menge sie in den Boden gelangen. Somit werden bei anderen Substanzen als Agrochemikalien die Wirkungen einer Reihe von Konzentrationen auf die Stickstoffumwandlung bestimmt. Die Daten dieser Tests werden verwendet, um eine Dosis-Wirkungs-Kurve zu erstellen und ECx-Werte zu berechnen, wobei x als die Wirkung in % definiert ist.
1.2 Definitionen
Stickstofftransformation: der Endabbau stickstoffhaltiger organischer Substanz durch Mikroorganismen über die Schritte Ammonifikation und Nitrifikation zum entsprechenden anorganischen Endprodukt Nitrat.
ECx (Effektkonzentration): diejenige Konzentration der Testsubstanz im Boden, die die Umwandlung von Stickstoff in Nitrat zu x % hemmt.
EC50 (Medianwert der Effektkonzentration): diejenige Konzentration der Testsubstanz im Boden, die die Transformation von Stickstoff in Nitrat zu 50 Prozent (50 %) hemmt.
1.3 Referenzsubstanzen
Keine.
1.4 Prinzip der Testmethode
Gesiebter Boden wird mit pulverisiertem Pflanzenmehl angereichert und entweder mit der Testsubstanz behandelt oder unbehandelt (Kontrollprobe) belassen. Werden Agrochemikalien geprüft, wird eine Mindestanzahl von zwei Testkonzentrationen empfohlen, die im Verhältnis zur höchsten auf dem Feld erwarteten Konzentration gewählt werden sollten. Nach 0, 7, 14 und 28 Tagen Inkubation werden Proben behandelter und unbehandelter Böden mit einem geeigneten Lösungsmittel extrahiert, und die Nitratmengen in den Extrakten bestimmt. Die Nitratbildungsrate in behandelten Proben wird mit der in den Kontrollproben verglichen, und es wird die prozentuale Abweichung der behandelten Proben von den Kontrollproben berechnet. Alle Versuche laufen über mindestens 28 Tage. Sind die Differenzen zwischen behandelten und unbehandelten Böden am 28. Tag gleich oder größer als 25 %, werden die Messungen bis zur Höchstdauer von 100 Tagen fortgesetzt. Werden andere Substanzen als Agrochemikalien geprüft, wird die Testsubstanz in einer Reihe von Konzentrationen Proben des Bodens zugesetzt, und nach 28 Tagen Inkubation werden die Mengen des gebildeten Nitrats in behandelten Proben und in Kontrollproben gemessen. Die Ergebnisse aus Versuchen mit mehreren unterschiedlichen Konzentrationen werden mit Hilfe eines Regressionsmodells analysiert, und die ECx-Werte berechnet (d. h. EC50, EC25 und/oder EC10). Siehe Definitionen.
1.5 Validität des Tests
Auswertungen von Testergebnissen mit Agrochemikalien beruhen auf vergleichsweise kleinen Differenzen (d. h. Mittelwert ± 25 %) zwischen Nitratkonzentrationen in Kontrollproben und behandelten Bodenproben, so dass große Schwankungen bei den Kontrollproben zu falschen Ergebnissen führen können. Daher sollte die Schwankungsbreite zwischen Replikatkontrollproben weniger als ± 15 % betragen.
1.6 Beschreibung der Testmethode
1.6.1 Geräte
Es werden Testgefäße aus chemisch inertem Material verwendet. Ihr Fassungsvermögen sollte sich nach dem gewählten Inkubationsverfahren der Böden richten, d. h. für die Inkubation von Sammelproben oder einer Reihe einzelner Bodenproben (siehe 1.7.1.2). Während des Tests ist darauf zu achten, dass sowohl der Wasserverlust möglichst gering gehalten wird als auch ein Gasaustausch stattfinden kann (so könnten die Testbehälter z.B. mit perforierter Polyethylenfolie abgedeckt werden). Beim Testen flüchtiger Substanzen sind abdichtbare und gasdichte Behälter zu verwenden. Diese sollten in ihrer Größe so bemessen sein, dass sie etwa zu einem Viertel ihres Volumens mit der Bodenprobe gefüllt sind.
Verwendet werden Standardlaborgeräte, darunter folgende:
1.6.2 Auswahl und Anzahl der Röden
Es wird ein einziger Boden verwendet. Empfohlen wird Boden mit folgenden Eigenschaften:
Meist stellt ein Boden mit diesen Eigenschaften den "worst case" dar, da seine Adsorption minimal und die Verfügbarkeit der Testchemikalie für die Mikroflora maximal ist. Demnach sind in aller Regel keine Tests mit anderen Böden notwendig. Unter bestimmten Umständen jedoch, wenn z.B. der erwartete hauptsächliche Einsatz der Testsubstanz auf bestimmten Böden wie sauren Waldböden stattfindet, oder bei elektrostatisch aufgeladenen Chemikalien kann es erforderlich sein, einen zusätzlichen Boden zu verwenden.
1.6.3 Entnahme und Lagerung von Bodenproben
1.6.3.1 Entnahme
Es sind ausführliche Informationen über die Vorgeschichte des Feldstandorts erforderlich, von dem der Testboden entnommen wird. Diese Angaben beinhalten unter anderem die genaue Lage, den Bewuchs, die Behandlung mit Pflanzenschutzmitteln sowie mit organischen und anorganischen Düngemitteln, Zugaben biologischen Materials oder unbeabsichtigte Kontaminationen. Der für die Bodenentnahme gewählte Standort muss über einen längeren Zeitraum hinweg nutzbar sein. Geeignet sind Dauerweiden, Felder mit einjährigen Getreidekulturen (ausgenommen Mais) oder dicht gesäten Gründüngungspflanzen. Der gewählte Probenahmestandort sollte mindestens ein Jahr vor der Probenahme nicht mit Pflanzenschutzmitteln behandelt worden sein. Ferner sollten mindestens sechs Monate vorher keine organischen Düngemittel ausgebracht worden sein. Die Verwendung von Mineraldünger ist nur zulässig, wenn dies für die Kultur erforderlich ist, und die Entnahme der Bodenproben sollte frühestens drei Monate nach Ausbringung des Düngemittels erfolgen. Zu vermeiden ist die Verwendung von Boden, der mit Düngemitteln mit bekannter biozider Wirkung (z.B. Kalkstickstoff) behandelt wurde.
Die Probenahme während oder unmittelbar nach längeren (mehr als 30 Tage) Dürre- oder Überschwemmungsperioden sollte vermieden werden. Bei gepflügten Böden sind die Proben aus einer Tiefe von 0 bis 20 cm zu entnehmen. Bei Grünland (Weiden) oder anderen Böden, die über längere Zeiträume (mindestens eine Vegetationsperiode) nicht gepflügt werden, kann die maximale Tiefe der Probenahme geringfügig über 20 cm liegen (z.B. bei bis zu 25 cm).
Die Bodenproben sollten in Behältern und unter Temperaturbedingungen transportiert werden, die sicherstellen, dass die ursprünglichen Bodeneigenschaften nicht wesentlich verändert werden.
1.6.3.2 Lagerung
Bevorzugt wird die Verwendung feldfrischer Böden. Lässt sich die Lagerung im Labor nicht vermeiden, sollten die Böden im Dunkeln bei 4 ± 2 °C höchstens drei Monate gelagert werden. Während der Lagerung der Böden müssen aerobe Bedingungen sichergestellt sein. Werden Böden von Flächen entnommen, die über mindestens drei Monate im Jahr gefroren sind, kann eine Lagerung für sechs Monate bei - 18 °C bis - 22 °C in Betracht gezogen werden. Vor jedem Versuch ist die mikrobielle Biomasse der gelagerten Böden zu bestimmen, und der Kohlenstoffgehalt in der Biomasse sollte mindestens 1 % des gesamten organischen Kohlenstoffs des Bodens befragen (siehe 1.6.2).
1.6.4 Handhabung und Vorbereitung des Bodens für den Test
1.6.4.1 Vorinkubation
Falls der Boden gelagert wurde (siehe 1.6.3.2), wird eine Vorinkubation über eine Zeitdauer von 2 bis 28 Tagen empfohlen. Die Temperatur und der Feuchtegehalt des Bodens während der Vorinkubation sollten den Testbedingungen möglichst entsprechen (siehe 1.6.4.2 und 1.7.1.3).
1.6.4.2 Physikalisch-chemische Eigenschaften
Der Boden wird manuell von großen Gegenständen befreit (z.B. Steine, Pflanzenteile usw.) und im feuchten Zustand ohne übermäßiges Austrocknen auf eine Partikelgröße von kleiner als oder gleich 2 mm gesiebt. Der Feuchtegehalt der Bodenprobe sollte mit destilliertem oder entionisiertem Wasser auf einen Wert zwischen 40 % und 60 % der maximalen Wasserhaltekapazität eingestellt werden.
1.6.4.3 Anreicherung mit organischem Substrat
Der Boden ist mit einem geeigneten organischen Substrat anzureichern, z.B. pulverisiertem Luzernegrüngrasmehl (Hauptbestandteil: Medicago sativa) mit einem C:N-Verhältnis zwischen 12:1 und 16:1. Empfohlen wird ein Luzerne-Boden-Verhältnis von 5 g Luzerne je kg Boden (Trockengewicht).
1.6.5 Vorbereitung der Testsubstanz zur Applikation auf den Boden
Üblicherweise wird die Testsubstanz unter Verwendung eines Trägers zugegeben. Bei diesem Träger kann es sich um Wasser (bei wasserlöslichen Substanzen) oder einen inerten Feststoff wie feiner Quarzsand (Partikelgröße: 0,1-0,5 mm) handeln. Andere flüssige Träger als Wasser (z.B. organische Lösungsmittel wie Aceton oder Chloroform) sind zu vermeiden, da sie die Mikroflora schädigen können. Wird Sand als Träger benutzt, kann er mit der in einem geeigneten Lösungsmittel aufgelösten oder suspendierten Testsubstanz überzogen werden. In diesen Fallen sollte das Lösungsmittel vor dem Mischen mit dem Boden durch Verdampfen entfernt werden. Zur optimalen Verteilung der Testsubstanz im Boden wird ein Verhältnis von 10 g Sand je kg Boden (Trockengewicht) empfohlen. Die Kontrollproben werden nur mit einer äquivalenten Menge Wasser und/oder Quarzsand behandelt.
Beim Testen flüchtiger Chemikalien sind Verluste während der Behandlung so weit wie möglich zu vermeiden, und es ist nach Möglichkeit für eine homogene Verteilung im Boden zu sorgen (z.B. indem die Testsubstanz an verschiedenen Stellen in den Boden injiziert wird).
1.6.6 Testkonzentrationen
Werden Agrochemikalien geprüft, sind mindestens zwei Konzentrationen zu verwenden. Die niedrigere Konzentration sollte mindestens der maximalen Menge entsprechen, die unter praxisüblichen Bedingungen voraussichtlich in den Boden gelangt, während die höhere Konzentration ein Mehrfaches der niedrigeren Konzentration sein sollte. Die Konzentrationen der dem Boden zugegebenen Testsubstanz werden unter der Annahme einer gleichmäßigen Einarbeitung bis zu einer Tiefe von 5 cm und einer Bodenrohdichte von 1,5 berechnet. Bei Agrochemikalien, die direkt auf den Boden ausgebracht werden, oder bei Chemikalien, bei denen die den Boden erreichende Menge vorhersagbar ist, werden als Testkonzentrationen die höchste vorhergesagte Umweltkonzentration (PEC) und das Fünffache dieser Konzentration empfohlen. Substanzen, die voraussichtlich mehrmals in einer Kulturperiode auf den Boden ausgebracht werden, sollten in Konzentrationen getestet werden, die sich durch die Multiplikation der PEC mit der höchsten erwarteten Anzahl der Anwendungen ergeben. Allerdings sollte die obere getestete Konzentration das Zehnfache der höchsten einfachen Applikationsrate nicht übersteigen. Werden andere Substanzen als Agrochemikalien geprüft, wird eine geometrische Reihe von mindestens fünf Konzentrationen verwendet. Die getesteten Konzentrationen sollten den zur Bestimmung der ECx-Werte notwendigen Bereich abdecken.
1.7 Durchführung des Tests
1.7.1 Expositionsbedingungen
1.7.1.1 Behandlung und Kontrolle
Werden Agrochemikalien geprüft, wird der Boden in drei Teile gleichen Gewichts aufgeteilt. Zwei Teile werden mit dem produkthaltigen Träger vermischt, und der dritte wird mit dem Träger ohne das Produkt vermischt (Kontrollprobe). Sowohl für die behandelten als auch die unbehandelten Böden wird eine Mindestanzahl von drei Replikaten empfohlen. Werden andere Substanzen als Agrochemikalien geprüft, wird der Boden in sechs Teile gleichen Gewichts aufgeteilt. Fünf dieser Proben werden mit dem die Testsubstanz enthaltenden Träger vermischt, und die sechste wird mit dem Träger ohne die Chemikalie vermischt. Sowohl für die behandelten Proben als auch für die Kontrollproben werden drei Replikate empfohlen. Es ist auf eine homogene Verteilung der Testsubstanz in den behandelten Bodenproben zu achten. Während des Mischens ist eine Verdichtung oder Verklumpung des Bodens zu vermeiden.
1.7.1.2 Inkubation von Bodenproben
Die Inkubation der Bodenproben kann auf zwei Wegen durchgeführt werden: als Sammelproben von jedem behandelten und unbehandelten Boden oder als Reihe von einzelnen, gleich großen Teilproben von jedem behandelten und unbehandelten Boden. Bei flüchtigen Substanzen sollte der Test jedoch nur mit einer Reihe einzelner Teilproben durchgeführt werden. Bei der Inkubation von Böden als Sammelproben werden große Mengen von jedem behandelten und unbehandelten Boden vorbereitet und während des Tests je nach Notwendigkeit zu analysierende Teilproben entnommen. Die zu Beginn für jede Behandlung und Kontrolle vorbereitete Menge ist abhängig von der Größe der Teilproben, der Anzahl der zur Analyse verwendeten Replikate und der höchsten erwarteten Anzahl von Probenahmen. Vor der Entnahme von Teilproben sind die inkubierten Sammelproben gründlich zu mischen. Bei der Bodeninkubation als Reihe einzelne Bodenproben wird jeder behandelte und unbehandelte Sammelboden in die benötigte Anzahl von Teilproben aufgeteilt, und diese Teilproben werden je nach Notwendigkeit verwendet. Für Untersuchungen mit mehr als zwei Probenahmezeitpunkten sind genügend Teilproben herzustellen, um alle Replikate und Probenahmezeiten zu berücksichtigen. Mindestens drei Replikatproben des Testbodens sollten unter aeroben Bedingungen inkubiert werden (siehe 1.7.1.1). Bei allen Tests sind geeignete Behälter mit ausreichendem HEADspace zu verwenden, um das Entstehen anaerober Bedingungen zu vermeiden. Werden flüchtige Substanzen geprüft, ist der Test nur mit einer Reihe einzelner Teilproben durchzuführen,
1.7.1.3 Testbedingungen und -dauer
Der Test wird im Dunkeln bei Raumtemperatur (20 ± 2 °C) durchgeführt. Der Feuchtegehalt der Bodenproben ist im Testverlauf bei 40-60 % (± 5 %) der maximalen Wasserhaltekapazität des Bodens zu halten (siehe 1.6.4.2). Destilliertes bzw. entionisiertes Wasser kann nach Bedarf zugegeben werden.
Die Mindestdauer der Tests beträgt 28 Tage. Bei Agrochemikalien werden die Nitratbildungsraten in den behandelten Proben mit denen in den Kontrollproben verglichen. Weichen diese am 28. Tag um mehr als 25 % voneinander ab, wird der Test bis zum Erreichen einer Differenz von gleich oder weniger als 25 % bzw. für die Höchstdauer von 100 Tagen fortgesetzt, je nachdem, was kürzer ist. Werden andere Substanzen als Agrochemikalien geprüft, wird der Test nach 28 Tagen beendet. Am 28. Tag werden die Nitratmengen in den behandelten Proben und in den Kontrollproben bestimmt und die ECx-Werte berechnet.
1.7.2 Probenahme und Analyse von Böden
1.7.2.1 Probenahmeintervalle
Bei der Prüfung von Agrochemikalien werden Bodenproben am Tag 0, 7, 14 und 28 auf Nitrat analysiert. Ist eine Testverlängerung erforderlich, sind weitere Messungen vom 28. Tag an im Abstand von jeweils 14 Tagen vorzunehmen.
Bei der Prüfung von anderen Substanzen als Agrochemikalien werden mindestens fünf Testkonzentrationen verwendet und Bodenproben am Beginn (Tag 0) und am Ende der Expositionszeit (28 Tage) auf Nitrat analysiert. Gegebenenfalls kann eine Zwischenmessung, z.B. am 7. Tag, eingefügt werden. Die am 28. Tag erhaltenen Daten werden zur Bestimmung des ECx-Werts der Chemikalie benutzt. Falls gewünscht, können die Daten der Kontrollproben vom Tag 0 im Bericht zur Angabe der Ausgangsmenge von Nitrat im Boden verwendet werden,
1.7.2.2 Analyse von Bodenproben
Die Menge des in jeder behandelten Probe und in jedem Kontrollreplikat gebildeten Nitrats wird zu jedem Probenahmezeitpunkt bestimmt. Nitrat wird aus dem Boden durch Schütteln der Proben mit einem geeigneten Extraktionsmittel, z.B. einer 0,1 M Kaliumchloridlösung, extrahiert. Empfohlen wird ein Verhältnis von 5 ml KCl-Lösung je Gramm Trockengewichtsäquivalent Boden. Um die Extraktion zu optimieren, sind die den Boden und die Extraktionslösung enthaltenden Behälter höchstens zur Hälfte zu füllen. Die Gemische werden bei 150 U/min 60 Minuten geschüttelt. Die Gemische werden zentrifugiert oder filtriert, und die Flüssigphasen werden auf Nitrat analysiert. Partikelfreie Flüssigextrakte können vor der Analyse bis zu sechs Monate bei - 20 ± 5 °C aufbewahrt werden.
2. Daten
2.1 Aufbereitung der Ergebnisse
Werden Agrochemikalien geprüft, ist die in jeder Replikatbodenprobe gebildete Nitratmenge aufzuzeichnen, und die Mittelwerte aller Replikate sind in tabellarischer Form darzustellen. Die Stickstofftransformationsraten sind mittels geeigneter und allgemein anerkannter statistischer Methoden (z.B. F-Test, 5 % Signifikanzniveau) zu berechnen. Die Mengen von gebildetem Nitrat werden in mg Nitrat/kg Trockengewicht Boden/Tag ausgedrückt. Die Nitratbildungsrate jeder Behandlung wird mit der in der Kontrollprobe verglichen, und es wird die prozentuale Abweichung von der Kontrollprobe berechnet.
Werden andere Substanzen als Agrochemikalien geprüft, wird die in jedem Replikat gebildete Nitratmenge bestimmt und zur Abschätzung der ECx-Werte eins Dosis-Wirkungs-Kurve erstellt. Die in den behandelten Proben nach 28 Tagen gefundenen Nitratmengen (d. h. mg Nitrat/kg Trockengewicht Boden) werden mit den in der Kontrollprobe gefundenen verglichen. Auf der Basis dieser Daten werden die Inhibitionswerte, ausgedrückt in %, für jede Testkonzentration berechnet. Diese Prozentangaben werden über der Konzentration aufgetragen, und mit Hilfe statistischer Verfahren werden die ECx-Werte berechnet. Mittels Standardverfahren werden ferner Vertrauensbereiche (p = 0,95) für die errechneten ECx-Werte ermittelt (10) (11) (12).
Unter Umständen tragen Testsubstanzen, die große Mengen Stickstoff enthalten, zur Bildung von Nitrat während des Tests bei. Werden diese Substanzen in einer hohen Konzentration getestet (z.B. Chemikalien, bei denen von einer wiederholten Anwendung auszugehen ist), sind in den Test entsprechende Kontrollproben aufzunehmen (d. h. Boden plus Testsubstanz, jedoch ohne Pflanzenmehl). Daten aus diesen Kontrollproben sind bei den ECx-Berechnungen zu berücksichtigen.
2.2 Interpretation der Ergebnisse
Ist bei der Auswertung der Testergebnisse von Agrochemikalien die Differenz der Nitratbildungsraten zwischen der niedrigen Behandlung (d. h. der höchsten erwarteten Konzentration) und den Kontrollproben zu jedem Probenahmezeitpunkt nach dem 28. Tag gleich oder geringer als 25 %, dann ist das Mittel so zu bewerten, dass es keinen langfristigen Einfluss auf die Stickstofftransformation in Böden hat. Für die Auswertung der Testergebnisse von anderen Chemikalien als Agrochemikalien werden die EC50-, EC25- und/oder EC10-Werte herangezogen.
3. Abschlussbericht
Der Testbericht muss folgende Informationen enthalten:
Vollständige Angaben zu den verwendeten Böden, darunter:
Testsubstanz:
Substrat:
Testbedingungen:
Ergebnisse:
4. Literaturangaben
(1) EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16,1994.
(2) BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2. Ausgabe, 1990).
(3) EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. 28. September 1987.
(4) SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brüssel.
(5) ISO/DIS 14238 (1995). Soil Quality - Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: Soil Quality Biological Methods.
(6) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italien,18.-20. Januar 1995.
(7) ISO 10381-6 (1993). Bodenbeschaffenheit - Probenahme - Teil 6: Anleitung zur Probenahme, Behandlung und Lagerung von Boden für die Bestimmung aerober mikrobieller Prozesse unter Laborbedingungen.
(8) ISO 14240-1 (1997). Bodenbeschaffenheit - Bestimmung der mikrobiellen Biomasse von Böden - Teil 1: Substratinduziertes Respirationsverfahren.
(9) ISO 14240-2 (1997). Bodenbeschaffenheit - Bestimmung der mikrobiellen Biomasse von Böden - Teil 2: Fumigations-Extraktionsverfahren.
(10) Litchfield, J.T. und Wilcoxon, F. (1949). A simplified method of evaluating doseeffect experiments. Jour. Pharmacol. and Exper, Ther., 96, 99-113.
(11) Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
(12) Finney, D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
C.22 Bodenmikroorganismen: Kohlenstofftransformationstest
1. Methode
Diese Methode entspricht der Prüfrichtlinie OECD TG 217 (2000).
1.1 Einleitung
Diese Testmethode beschreibt eine Labormethode zur Untersuchung der potenziellen Langzeitauswirkungen einer einmaligen Exposition gegenüber Pflanzenschutzmitteln und etwaigen anderen Chemikalien auf die Kohlenstofftransformationsaktivität von Bodenmikroorganismen. Der Test beruht im Wesentlichen auf den Empfehlungen der Pflanzenschutzorganisation für Europa und den Mittelmeerraum (1), doch auch andere Richtlinien wurden berücksichtigt, wie die der deutschen Biologischen Bundesanstalt (2), der US-amerikanischen Environmental Protection Agency (3) und SETAC (4). Auf einem OECD-Workshop zur Boden-/Sedimentauswahl, der 1995 im italienischen Belgirate stattfand (5), wurden die bei diesem Test zu verwendende Anzahl und Art von Böden vereinbart. Die Empfehlungen zur Entnahme, Behandlung und Lagerung von Bodenproben basieren auf einer ISO-Anleitung (6) und auf Empfehlungen des Belgirate-Workshops.
Bei der Be- und Auswertung toxischer Eigenschaften von Testsubstanzen kann eine Bestimmung der Auswirkungen auf die mikrobielle Aktivität des Bodens erforderlich sein, z.B., wenn Daten zu möglichen Nebenwirkungen von Pflanzenschutzmitteln auf die Mikroflora des Bodens benötigt werden oder wenn eine Exposition von Bodenmikroorganismen gegenüber anderen Chemikalien als Pflanzenschutzmitteln erwartet wird. Der Kohlenstofftransformationstest wird durchgeführt, um den Einfluss derartiger Chemikalien auf die Bodenmikroflora zu ermitteln. Bei der Prüfung von Agrochemikalien (z.B. Pflanzenschutzmittel, Düngemittel, Forstchemikalien) werden sowohl Kohlenstoff- als auch Stickstofftransformationstests durchgeführt. Bei anderen Substanzen als Agrochemikalien genügt der Stickstofftransformationstest. Liegen jedoch die EC50-Werte des Stickstofftransformationstests bei diesen Chemikalien im Bereich, der für käufliche Nitrifikationshemmstoffe (z.B. Nitrapyrin) ermittelt wurde, kann ein Kohlenstofftransformationstest durchgeführt werden, um weitere Informationen zu gewinnen,
Boden besteht sowohl aus lebenden als auch aus nichtlebenden Komponenten, die in komplexen und heterogenen Gemischen vorkommen. Beim Abbau organischen Materials und seiner Transformation in fruchtbaren Böden spielen Mikroorganismen eine wichtige Rolle, wobei viele Arten für unterschiedliche Aspekte der Bodenfruchtbarkeit verantwortlich sind. Jede langfristige Störung dieser biochemischen Prozesse kann sich potenziell auf den Nährstoffkreislauf auswirken und dadurch wiederum die Bodenfruchtbarkeit beeinflussen. Die Transformation von Kohlenstoff und Stickstoff erfolgt in allen fruchtbaren Böden. Die Transformationspfade sind im Wesentlichen gleich, auch wenn je nach Boden unterschiedliche mikrobielle Populationen für diese Prozesse verantwortlich sind.
Mit der hier beschriebenen Testmethode können durch einen Stoff hervorgerufene langfristige nachteilige Auswirkungen auf den Prozess der Kohlenstofftransformation in aeroben Oberböden bestimmt werden. Der Test reagiert empfindlich auf Veränderungen in Größe und Aktivität der mikrobiellen Populationen, die für die Kohlenstofftransformation verantwortlich sind, da diese Populationen sowohl einem chemischen Stress als auch einem Kohlenstoffmangel ausgesetzt werden. Verwendet wird ein an organischem Material armer Sandboden. Dieser Boden wird mit der Testsubstanz behandelt und unter Bedingungen inkubiert, die einen schnellen mikrobiellen Stoffwechsel ermöglichen. Unter diesen Bedingungen werden Quellen von leicht verfügbarem Kohlenstoff im Boden rasch aufgebraucht. Dies verursacht einen Kohlenstoffmangel, der nicht nur mikrobielle Zellen tötet, sondern auch eine Keimruhe und/oder Sporenbildung induziert. Läuft der Test über mehr als 28 Tage, kann die Summe dieser Reaktionen in den Kontrollproben (unbehandelter Boden) als progressiver Verlust an stoffwechselaktiver mikrobieller Biomasse gemessen werden (7). Wird die Biomasse in kohlenstoffgestresstem Boden unter den Versuchsbedingungen von der Anwesenheit einer Chemikalie beeinflusst, kehrt sie möglicherweise nicht auf das Niveau in den Kontrollproben zurück. Folglich halten zu einem beliebigen Zeitpunkt während des Versuchs durch die Testsubstanz verursachte Störungen häufig bis zum Ende des Tests an.
Die Tests, auf deren Grundlage diese Testmethode entwickelt wurde, waren in erster Linie für Substanzen ausgelegt, bei denen die in den Boden gelangende Menge vorherbestimmt werden kann. Dies ist z.B. bei Pflanzenschutzmitteln der Fall, bei denen die Applikationsmenge auf dem Feld bekannt ist. Bei Agrochemikalien genügt es, zwei Konzentrationen zu testen, die für die erwartete oder vorhergesagte Applikationsmenge relevant sind. Agrochemikalien können als Wirkstoffe (a.i.) oder als formulierte Handelsprodukte getestet werden. Der Test ist jedoch nicht auf Chemikalien mit vorhersagbaren Umweltkonzentrationen begrenzt. Durch Veränderung sowohl der Mengen der auf den Boden ausgebrachten Testsubstanz als auch der Art und Weise, wie die Daten ausgewertet werden, kann der Test auch für Chemikalien angewendet werden, bei denen nicht bekannt ist, in welcher Menge sie in den Boden gelangen. Somit werden bei anderen Substanzen als Agrochemikalien die Wirkungen einer Reihe von Konzentrationen auf die Kohlenstofftransformation bestimmt. Die Daten von diesen Tests werden verwendet, um eine Dosis-Wirkungs-Kurve zu erstellen und ECx-Werte zu berechnen, wobei x als die Wirkung in % definiert ist.
1.2 Definitionen
Kohlenstofftransformation: der Abbau organischen Materials durch Mikroorganismen zum anorganischen Endprodukt Kohlendioxid.
ECx (Effektkonzentration): diejenige Konzentration der Testsubstanz im Boden, die die Transformation von Kohlenstoff in Kohlendioxid zu x % hemmt.
EC50 (Medianwert der Effektkonzentration): diejenige Konzentration der Testsubstanz im Boden, die die Transformation von Kohlenstoff in Kohlendioxid zu 50 % hemmt.
1.3 Referenzsubstanzen
Keine.
1.4 Prinzip der Testmethode
Gesiebter Boden wird entweder mit der Testsubstanz behandelt oder unbehandelt (Kontrollprobe) belassen. Werden Agrochemikalien geprüft, wird eine Mindestanzahl von zwei Testkonzentrationen empfohlen, die im Verhältnis zur höchsten auf dem Feld erwarteten Konzentration gewählt werden sollten. Nach 0, 7, 14 und 28 Tagen Inkubation werden Proben behandelter und unbehandelter Böden mit Glucose gemischt, und die Glucoseinduzierten Respirationsraten werden 12 Stunden hintereinander gemessen. Respirationsraten werden als freigesetztes Kohlendioxid (mg Kohlendioxid/kg Trockenboden/h) oder verbrauchter Sauerstoff (mg Sauerstoff/kg Boden/h) ausgedrückt. Die mittlere Respirationsrate in behandelten Bodenproben wird mit der in der Kontrollprobe verglichen, und es wird die prozentuale Abweichung der behandelten Proben von den Kontrollproben berechnet. Alle Tests laufen mindestens 28 Tage. Sind die Differenzen zwischen behandelten und unbehandelten Böden am 28. Tag gleich oder größer als 25 %, werden die Messungen in Abständen von 14 Tagen für die Höchstdauer von 100 Tagen fortgesetzt. Werden andere Substanzen als Agrochemikalien geprüft, wird die Testsubstanz in einer Reihe von Konzentrationen Bodenproben zugesetzt, und nach 28 Tagen werden die Glucoseinduzierten Respirationsraten (d. h. das Mittel der Mengen an gebildetem Kohlendioxid oder verbrauchtem Sauerstoff) gemessen. Die Ergebnisse aus Versuchen mit einer Reihe von Konzentrationen werden mit Hilfe eines Regressionsmodells analysiert, und die EC,-Werte werden berechnet (d. h. EC50, EC25 und/oder EC10). Siehe Definitionen.
1.5 Validität des Tests
Auswertungen von Testergebnissen mit Agrochemikalien beruhen auf vergleichsweise kleinen Differenzen (d. h. Mittelwert ± 25 %) zwischen dem freigesetzten Kohlendioxid oder dem verbrauchten Sauerstoff in (bzw. durch) Kontrollproben und behandelte(n) Bodenproben, so dass große Schwankungen bei den Kontrollproben zu falschen Ergebnissen führen können. Daher sollte die Abweichung zwischen Replikatkontrollproben weniger als ± 15 % betragen.
1.6 Beschreibung der Testmethode
1.6.1 Geräte
Es werden Testgefäße aus chemisch inertem Material verwendet. Ihr Fassungsvermögen sollte sich nach dem gewählten Inkubationsverfahren der Böden richten, d. h. für die Inkubation von Sammelproben oder einer Reihe einzelner Bodenproben (siehe 1.7.1.2). Während des Tests ist darauf zu achten, dass sowohl der Wasserverlust möglichst gering gehalten wird als auch ein Gasaustausch stattfinden kann (so könnten die Testbehälter z.B. mit perforierter Polyethylenfolie abgedeckt werden). Beim Testen flüchtiger Substanzen sind abdichtbare und gasdichte Behälter zu verwenden. Diese sollten in ihrer Größe so bemessen sein, dass sie zu etwa einem Viertel ihres Volumens mit der Bodenprobe gefüllt sind.
Zur Bestimmung der Glucoseinduzierten Respiration werden Inkubationssysteme sowie Geräte für die Messung der Kohlendioxidbildung bzw. des Sauerstoffverbrauchs benötigt. Beispiele für derartige Systeme sind in der Literatur zu finden (8) (9) (10) (11).
1.6.2 Auswahl und Anzahl der Böden
Es wird ein einziger Boden verwendet. Empfohlen wird Boden mit folgenden Eigenschaften:
Meist stellt ein Boden mit diesen Eigenschaften den "worst case" dar, da seine Adsorption minimal und die Verfügbarkeit der Testchemikalie für die Mikroflora maximal ist. Demnach sind in aller Regel keine Tests mit anderen Böden notwendig, Unter bestimmten Umstanden jedoch, wenn z.B. der erwartete hauptsächliche Einsatz der Testsubstanz auf bestimmten Böden wie sauren Waldböden stattfindet, oder bei elektrostatisch aufgeladenen Chemikalien kann es erforderlich sein, einen zusätzlichen Boden zu verwenden.
1.6.3 Entnahme und Lagerung von Bodenproben
1.6.3.1 Entnahme
Es sind ausführliche Informationen über die Vorgeschichte des Feldstandorts erforderlich, von dem der Testboden entnommen wird. Diese Angaben beinhalten unter anderem die genaue Lage, den Bewuchs, die Behandlung mit Pflanzenschutzmitteln sowie mit organischen und anorganischen Düngemitteln, Zusätze biologischer Materialien oder unbeabsichtigte Kontaminationen. Der für die Bodenentnahme gewählte Standort muss über einen längeren Zeitraum hinweg nutzbar sein. Geeignet sind Dauerweiden, Felder mit einjährigen Getreidekulturen (ausgenommen Mais) oder dicht gesäten Gründüngungspflanzen. Der gewählte Probenahmestandort sollte mindestens ein Jahr vor der Probenahme nicht mit Pflanzenschutzmitteln behandelt worden sein. Ferner sollten mindestens sechs Monate vorher keine organischen Düngemittel ausgebracht worden sein. Die Verwendung von Mineraldünger ist nur zulässig, wenn dies für die Kultur erforderlich ist, und die Entnahme der Bodenproben sollte frühestens drei Monate nach Ausbringung des Düngemittels erfolgen. Zu vermeiden ist die Verwendung von Boden, der mit Düngemitteln mit bekannter biozider Wirkung (z.B. Kalkstickstoff) behandelt wurde.
Die Probenahme während oder nach längeren (mehr als 30 Tage) Dürre- oder Überschwemmungsperioden sollte vermieden werden. Bei gepflügten Böden sind die Proben aus einer Tiefe von 0 bis 20 cm zu entnehmen. Bei Grünland (Weiden) oder anderen Böden, die über längere Zeiträume (mindestens eine Vegetationsperiode) nicht gepflügt werden, kann die maximale Tiefe der Probenahme geringfügig über 20 cm liegen (z.B. bei bis zu 25 cm). Die Bodenproben sollten in Behältern und unter Temperaturbedingungen transportiert werden, die sicherstellen, dass die ursprünglichen Bodeneigenschaften nicht wesentlich verändert werden.
1.6.3.2 Lagerung
Bevorzugt wird die Verwendung feldfrischer Böden. Lässt sich die Lagerung im Labor nicht vermeiden, sollten die Böden im Dunkeln bei 4 ± 2 °C höchstens drei Monate gelagert werden. Während der Lagerung der Böden müssen aerobe Bedingungen sichergestellt sein, Werden Böden von Flächen entnommen, die über mindestens drei Monate im Jahr gefroren sind, kann eine Lagerung für sechs Monate bei - 18 °C in Betracht gezogen werden. Vor jedem Versuch ist die mikrobielle Biomasse der gelagerten Böden zu bestimmen, und der Kohlenstoffgehalt in der Biomasse sollte mindestens 1 % des gesamten organischen Kohlenstoffs des Bodens betragen (siehe 1.6.2).
1.6.4 Handhabung und Vorbereitung des Bodens für den Test
1.6.4.1 Vorinkubation
Falls der Boden gelagert wurde (siehe 1.6.4.2 und 1.7.1.3), wird eine Vorinkubation über eine Zeitdauer von 2 bis 28 Tagen empfohlen. Die Temperatur und der Feuchtegehalt des Bodens während der Vorinkubation sollten den Testbedingungen möglichst entsprechen (siehe 1.6.4.2 und 1.7.1.3).
1.6.4.2 Physikalischchemische Eigenschaften
Der Boden wird manuell von großen Gegenständen befreit (z.B. Steine, Pflanzenteile usw.) und im feuchten Zustand ohne übermäßiges Austrocknen auf eine Partikelgröße von < 2 mm gesiebt. Der Feuchtegehalt der Bodenprobe sollte mit destilliertem oder entionisiertem Wasser auf einen Wert zwischen 40 % und 60 % der maximalen Wasserhaltekapazität eingestellt werden.
1.6.5 Vorbereitung der Testsubstanz zur Applikation auf den Boden
Üblicherweise wird die Testsubstanz unter Verwendung eines Trägers zugegeben. Bei diesem Träger kann es sich um Wasser (bei wasserlöslichen Substanzen) oder einen inerten Feststoff wie feinen Quarzsand (Partikelgröße: 0,1-0,5 mm) handeln. Andere flüssige Träger als Wasser (z.B. organische Lösungsmittel wie Aceton oder Chloroform) sind zu vermeiden, da sie die Mikroflora schädigen können. Wird Sand als Träger benutzt, kann er mit der in einem geeigneten Lösungsmittel aufgelösten oder suspendierten Testsubstanz überzogen werden, In diesen Fällen sollte das Lösungsmittel vor dem Mischen mit dem Boden durch Verdampfen entfernt werden. Zur optimalen Verteilung der Testsubstanz im Boden wird ein Verhältnis von 10 g Sand je kg Boden (Trockengewicht) empfohlen. Die Kontrollproben werden nur mit einer äquivalenten Menge Wasser und/oder Quarzsand behandelt.
Beim Testen flüchtiger Chemikalien sind Verluste während der Behandlung so weit wie möglich zu vermeiden, und es ist nach Möglichkeit für eine homogene Verteilung im Boden zu sorgen (z.B., indem die Testsubstanz an verschiedenen Stellen in den Boden injiziert wird).
1.6.6 Testkonzentrationen
Werden Pflanzenschutzmittel oder andere Chemikalien mit vorhersagbaren Umweltkonzentrationen geprüft, sind mindestens zwei Konzentrationen zu verwenden. Die niedrigere Konzentration sollte mindestens der maximalen Menge entsprechen, die unter praxisüblichen Bedingungen voraussichtlich in den Boden gelangt, während die höhere Konzentration ein Mehrfaches der niedrigeren Konzentration sein sollte. Die Konzentrationen der dem Boden zugegebenen Testsubstanz werden unter der Annahme einer gleichmäßigen Einarbeitung bis zu einer Tiefe von 5 cm und einer Bodenrohdichte von 1,5 berechnet. Bei Agrochemikalien, die direkt auf den Boden ausgebracht werden, oder bei Chemikalien, bei denen die den Boden erreichende Menge vorhersagbar ist, werden als Testkonzentrationen die höchste vorhergesagte Umweltkonzentration (PEC) und das 5-fache dieser Konzentration empfohlen. Substanzen, die voraussichtlich mehrmals in einer Kulturperiode auf den Boden ausgebracht werden, sollten in Konzentrationen getestet werden, die sich durch die Multiplikation der PEC mit der höchsten erwarteten Anzahl der Anwendungen ergeben. Allerdings sollte die obere getestete Konzentration das 10-fache der höchsten einfachen Applikationsrate nicht übersteigen.
Werden andere Substanzen als Agrochemikalien geprüft, wird eine geometrische Reihe von mindestens fünf Konzentrationen verwendet. Die getesteten Konzentrationen sollten den zur Bestimmung der ECx-Werte notwendigen Bereich abdecken.
1.7 Durchführung des Tests
1.7.1 Expositionsbedingungen
1.7.1.1 Behandlung und Kontrolle
Werden Agrochemikalien geprüft, wird der Boden in drei Teile gleichen Gewichts aufgeteilt. Zwei Teile werden mit dem produkthaltigen Träger gemischt, und der dritte wird mit dem Träger ohne das Produkt vermischt (Kontrollprobe). Sowohl für die behandelten als auch die unbehandelten Böden wird eine Mindestanzahl von drei Replikaten empfohlen. Werden andere Substanzen als Agrochemikalien geprüft, wird der Boden in sechs Teile gleichen Gewichts aufgeteilt. Fünf dieser Proben werden mit dem die Testsubstanz enthaltenden Träger vermischt, und die sechste wird mit dem Träger ohne die Chemikalie vermischt. Sowohl für die behandelten Proben als auch für die Kontrollproben werden drei Replikate empfohlen. Es ist auf eine homogene Verteilung der Testsubstanz in den behandelten Bodenproben zu achten. Während des Mischens ist eine Verdichtung oder Verklumpung des Bodens zu vermeiden.
1.7.1.2 Inkubation von Bodenproben
Die Inkubation der Bodenproben kann auf zwei Wegen durchgeführt werden: als Sammelproben von jedem behandelten und unbehandelten Boden oder als Reihe von einzelnen, gleich großen Teilproben von jedem behandelten und unbehandelten Boden. Bei flüchtigen Substanzen sollte der Test jedoch nur mit einer Reihe einzelner Teilproben durchgeführt werden. Bei der Inkubation von Böden als Sammelproben werden große Mengen von jedem behandelten und unbehandelten Boden vorbereitet und während des Tests je nach Notwendigkeit zu analysierende Teilproben entnommen. Die zu Beginn für jede Behandlung und Kontrolle vorbereitete Menge ist abhängig von der Größe der Teilproben, der Anzahl der zur Analyse verwendeten Replikate und der höchsten erwarteten Anzahl von Probenahmen. Vor der Entnahme von Teilproben sind die inkubierten Sammelproben gründlich zu mischen. Bei der Bodeninkubation als Reihe einzelner Bodenproben wird jeder behandelte und unbehandelte Sammelboden in die benötigte Anzahl von Teilproben aufgeteilt, und diese Teilproben werden je nach Notwendigkeit verwendet. Für Untersuchungen mit mehr als zwei Probenahmezeitpunkten sind genügend Teilproben herzustellen, um alle Replikate und Probenahmezeiten zu berücksichtigen. Mindestens drei Replikatproben des Testbodens sollten unter aeroben Bedingungen inkubiert werden (siehe 1.7.1.1). Bei allen Tests sind geeignete Behälter mit ausreichendem Headspace zu verwenden, um das Entstehen anaerober Bedingungen zu vermeiden. Werden flüchtige Substanzen geprüft, ist der Test nur mit einer Reihe einzelner Teilproben durchzuführen.
1.7.1.3 Testbedingungen und -dauer
Der Test wird im Dunkeln bei Raumtemperatur (20 ± 2 °C) durchgeführt. Der Feuchtegehalt der Bodenproben ist im Testverlauf bei 40-60 % (+ 5 %) der maximalen Wasserhaltekapazität des Bodens zu halten (siehe 1.6.4.2). Destilliertes bzw. entionisiertes Wasser kann nach Bedarf zugegeben werden.
Die Mindestdauer der Tests beträgt 28 Tage. Bei Agrochemikalien werden die Mengen an freigesetztem Kohlenstoff bzw. verbrauchtem Sauerstoff in den behandelten Proben mit denen in den Kontrollproben verglichen. Weichen diese am 28. Tag um mehr als 25 % voneinander ab, wird der Test bis zum Erreichen einer Differenz von gleich oder weniger als 25 % bzw. für die Höchstdauer von 100 Tagen fortgesetzt, je nachdem, was kürzer ist. Werden andere Substanzen als Agrochemikalien geprüft, wird der Test nach 28 Tagen beendet. Am 28. Tag werden die Mengen an freigesetztem Kohlendioxid bzw. verbrauchtem Sauerstoff in den behandelten Proben und in den Kontrollproben bestimmt und die ECx-Werte berechnet.
1.7.2 Probenahme und Analyse von Böden
1.7.2.1 Probenahmeintervalle
Bei der Prüfung von Agrochemikalien werden Bodenproben am Tag 0, 7, 14 und 28 auf Glucoseinduzierte Respirationsraten analysiert. Ist eine Testverlängerung erforderlich, sind weitere Messungen vom 28. Tag an im Abstand von jeweils 14 Tagen vorzunehmen.
Bei der Prüfung von anderen Substanzen als Agrochemikalien werden mindestens fünf Testkonzentrationen verwendet und Bodenproben am Beginn (Tag 0) und am Ende der Expositionszeit (28 Tage) auf die Glucoseinduzierte Respiration analysiert. Gegebenenfalls kann eine Zwischenmessung, z.B. am 7. Tag, eingefügt werden. Die am 28. Tag erhaltenen Daten werden zur Bestimmung des ECx-Werts der Chemikalie benutzt. Falls gewünscht, können die Daten der Kontrollproben vom Tag 0 zur Abschätzung der Ausgangsmengen der stoffwechselaktiven mikrobiellen Biomasse im Boden herangezogen werden (12).
1.7.2.2 Messung von Glucoseinduzierten Respirationsraten
Die Glucoseinduzierte Respirationsrate in jeder behandelten Probe und in jedem Kontrollreplikat wird zu jedem Probenahmezeitpunkt bestimmt. Die Bodenproben werden mit einer Menge Glucose vermischt, die groß genug ist, um unverzüglich einen maximalen Atmungswert zu erreichen. Die zum Erreichen eines maximalen Atmungswerts in einem bestimmten Boden notwendige Glucosemenge kann in einem Vorversuch mit einer Reihe von Glucosekonzentrationen bestimmt werden (14). Bei sandigen Böden mit einem organischen Kohlenstoffgehalt von 0,5-1,5 % sind jedoch üblicherweise 2.000 mg bis 4.000 mg Glucose je kg Boden (Trockengewicht) ausreichend. Die Glucose kann mit sauberem Quarzsand pulverisiert werden (10 g Sand/kg Trockengewicht Boden) und mit dem Boden homogen vermischt werden.
Die mit Glucose angereicherten Bodenproben werden in einem geeigneten Gerät inkubiert, mit dem die Respirationsraten bei 20 ± 2 °C entweder laufend, stündlich oder in 2-Stunden-Intervallen gemessen werden können (siehe 1.6.1). Das freigesetzte Kohlendioxid bzw. der verbrauchte Sauerstoff werden 12 Stunden lang gemessen, und die Messungen sollten so früh wie möglich beginnen, d. h. innerhalb von 1 bis 2 Stunden nach der Glucosezugabe. Die Gesamtmengen des in den 12 Stunden freigesetzten Kohlendioxids bzw. verbrauchten Sauerstoffs werden gemessen und die minieren Respirationsraten bestimmt.
2. Daten
2.1 Aufbereitung der Ergebnisse
Werden Agrochemikalien geprüft, ist für jedes Replikat die Menge des jeweils freigesetzten Kohlendioxids bzw. verbrauchten Sauerstoffs aufzuzeichnen, und die Mittelwerte aller Replikate sind in tabellarischer Form darzustellen. Die Ergebnisse sind mittels geeigneter und allgemein anerkannter statistischer Methoden (z.B. F-Test, 5 % Signifikanzniveau) zu bewerten, Die Glucoseinduzierten Respirationsraten werden in mg Kohlendioxid/kg Trockengewicht Boden/h bzw. mg Sauerstoff/Trockengewicht Boden/h ausgedrückt. Die mittlere Kohlendioxidbildungsrate bzw. die mittlere Sauerstoffverbrauchsrate jeder Behandlung wird mit der in der Kontrollprobe verglichen, und es wird die prozentuale Abweichung von der Kontrollprobe berechnet.
Werden andere Substanzen als Agrochemikalien geprüft, wird die Menge an freigesetztem Kohlendioxid bzw. an verbrauchtem Sauerstoff für jedes Replikat bestimmt, und zur Abschätzung der ECx-Werte eine Dosis-Wirkungs-Kurve erstellt. Die in den behandelten Proben nach 28 Tagen gefundenen Glucoseinduzierten Respirationsraten (d. h. mg Kohlendioxid/kg Trockengewicht Boden/h bzw. mg Sauerstoff/Trockengewicht Boden/h) werden mit den in der Kontrollprobe gefundenen verglichen. Auf der Basis dieser Daten werden die Inhibitionswerte, ausgedrückt in %, für jede Testkonzentration berechnet. Diese Prozentangaben werden über der Konzentration aufgetragen, und dann werden mit Hilfe statistischer Verfahren die EC,-Werte berechnet. Mittels Standard verfahren werden ferner Vertrauensbereiche (p = 0,95) für die errechneten EC,-Werte ermittelt (15) (16) (17).
2.2 Interpretation der Ergebnisse
Ist bei der Auswertung der Testergebnisse von Agrochemikalien die Differenz der Respirationsraten zwischen der niedrigen Behandlung (d. h. der höchsten erwarteten Konzentration) und den Kontrollproben zu jedem Probenahmezeitpunkt nach dem 28. Tag < 25 %, dann ist das Produkt so zu bewerten, dass es keinen langfristigen Einfluss auf die Kohlenstofftransformation in Böden hat. Für die Auswertung der Testergebnisse von anderen Chemikalien als Agrochemikalien werden die EC50-, EC25- und/oder EC10-Werte herangezogen.
3. Abschlussbericht
Testbericht
Der Testbericht muss folgende Informationen enthalten:
Vollständige Angaben zu den verwendeten Böden, darunter:
Testsubstanz:
Testbedingungen:
Ergebnisse:
4. Literaturangaben
(1) EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soll Microflora. EPPO Bulletin 24: 1-16, 1994.
(2) BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2. Ausgabe, 1990).
(3) EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. 28. September 1987.
(4) SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brüssel.
(5) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italien, 18-20. Januar 1995.
(6) ISO 10381-6 (1993). Bodenbeschaffenheit - Probenahme - Teil 6: Anleitung zur Probenahme, Behandlung und Lagerung von Boden für die Bestimmung aerober mikrobieller Prozesse unter Laborbedingungen.
(7) Anderson, J.P.E. (1987). Handling and Storage of Soils for Pesticide Experiments, in Pesticide Effects o Soit Microflora. Eds. L. Somerville and M.P. Greaves, Chap. 3, 45-60.
(8) Anderson, J.P.E. (1982). Soil Respiration, in Methods of of Soil Analysis - Part 2: Chemical and Microbiological Properties. Agronomy Monograph No 9. Eds. A.L. Page, R.H. Miller and D.R. Keeney. 41, 831-871.
(9) ISO 11266-1. (1993). Soil Quality - Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions.
(10) ISO 14239 (1997E). Bodenbeschaffenheil - Laboratoriumsinkubationssysteme zur Messung der Mineralisierung von organischen Chemikalien im Boden bei aeroben Bedingungen.
(11) Heinemeyer, O., Insam, H., Kaiser, E.A. and Walenzik, G. (1989). Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116, 77-81.
(12) ISO 14240-1 (1997). Bodenbeschaffenheit - Bestimmung der mikrobiellen Biomasse von Böden - Teil 1: Substratinduziertes Respirationsverfahren.
(13) ISO 14240-2 (1997). Bodenbeschaffenheit - Bestimmung der mikrobiellen Biomasse von Böden - Teil 2: Fumigations-Extraktionsverfahren.
(14) Malkomes, H.-P. (1986). Einfluss von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden gegenüber Pflanzenschutzmitteln, dargestellt am Beispiel eines Herbizids. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example), Nachrichtenblatt Deutscher Pflanzenschutzdienst, Braunschweig, 38, 113-120.
(15) Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating doseeffect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113.
(16) Finney, D.J. (1971), Probit Analysis. 3rd ed., Cambridge, London and New York.
(17) Finney D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
 | weiter . |  |