 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk |  |
Stoffmonographie Bisphenol A (BPA) - Referenz- und Human-Biomonitoring-(HBM)-Werte für BPA im Urin
- Stellungnahme der Kommission Human Biomonitoring des Bundesamtes -
(Bundesgesundheitsbl. Nr. 9 vom 9/2012 S. 1215)
| Zusammenfassung Abstract
Bisphenol A (BPA) wird zur Herstellung von Polykarbonat-Kunststoffen und Epoxyharzen verwendet. Viele Gegenstände wie Polykarbonat-Flaschen, innenbeschichtete Getränke- und Konservendosen, die BPA enthalten, können in Nahrungsmittel und Getränke migrieren und stellen damit die Hauptquelle für die ubiquitäre Belastung der Bevölkerung dar. BPA ist als ein endokriner Disruptor einzustufen. Da die Wirkungen noch nicht ausreichend verstanden sind, bleibt die toxikologische Bedeutung von BPA in Dosen unterhalb des NOAEL unklar. Die HBM Kommission nimmt u.a. zur Kenntnis, dass die Risikobewertung derzeit im Fluss ist und dass in der EU und in anderen Ländern regulatorisch im Risikomanagement vorsorglich ein Anwendungsverbot für Babyflaschen eingeführt wurde. Die Kommission sieht sich angesichts der umfangreichen und rapide anwachsenden Literatur nicht in der Lage, die bestehenden Kontroversen aufzulösen und die Fragen zu beantworten, welche Relevanz niedrige BPA-Dosen für die menschliche Gesundheit und damit für die Risikobewertung haben.Wegen der aktuellen Diskussion und dem Bedarf einer Bewertung des Stoffes im Bereich des HBM stellt die Kommission Referenzwerte (RV95) und auf dem TDI-Wert von 0,05 mg/kg KG/Tag basierte HBM-Werte für BPA-Gehalte im Urin zur Verfügung. Die RV95 betragen: 30 4/1 für 3- bis 5-Jährige, 15 μg/l für 6- bis 14-Jährige und 7 μg/l für 20- bis 29-Jährige. Die HBM-I-Werte betragen für Kinder 1,5 mg/l und für Erwachsene 2,5 mg/l. Die Kommission weist ausdrücklich darauf hin, dass diese HBM-Werte im Rahmen etwaiger Neubewertungen umgehend entsprechend anzupassen sind. Für die praktische Anwendung empfiehlt die Kommission in Anwendung des Vorsorgeprinzips eine Bewertung anhand der RV95, da sie gut geeignet sind höhere und vermeidbare Expositionen zu identifizieren und damit eine Expositionsminderung nach dem ALARA-Prinzip zu veranlassen. Schlüsselwörter Bisphenol A-Urin-HBM-Werte - Referenzwerte - Human-Biomonitoring - HBM Kommission |
1 Einleitung
Die Chemikalie 2,2-bis(4-hydroxyphenyl)-propan, kurz als Bisphenol A (BPA) bezeichnet, wird in großem Umfang zur Herstellung von Polykarbonat-Kunststoffen sowie Kunstharzen verwendet. BPA kann ebenfalls in dem weit verbreiteten PVC als Additiv vorhanden sein [1]. Viele der Gegenstände, die BPA enthalten, sind Bedarfsgegenstände und kommen mit Lebensmitteln in Berührung. Dabei kann BPA in die Nahrungsmittel und Getränke migrieren. So sind beispielsweise viele Plastik-, Einweg-, Trinkflaschen, Babyflaschen, Plastikgeschirr oder auch die Innenbeschichtung von Getränke- und Konservendosen für die Verbraucher potentielle Quellen für die Aufnahme von BPA [2]. BPA ist ein weißer, wenig wasserlöslicher Feststoff mit phenolischem Geruch. Die wichtigsten physikalischen und chemischen Eigenschaften von BPA inkl. Stoffidentifizierung [3] sind in Tabelle 1 zusammengestellt.
Zahlreiche Tierversuche und in vitro-Tests belegen, dass BPA als "Endokriner Disruptor" einzustufen ist. Wegen des noch unvollständigen Verständnisses der komplexen und widersprüchlichen Wirkungen von BPA (in Dosen unterhalb des NOAEL) auf den klassischen Östrogenrezeptor, andere Rezeptoren und mole- kulare Funktionen [4-9], ist auch die toxikologische Bedeutung neuerer Befunde gegenwärtig noch unklar [10,11]. Das entsprechende Gremium der Europäischen Behörde für Lebensmittelsicherheit (European Food Safety Authority - EFSA), das EFSA Panel on Food Contact Materials, Enzymes, Flavourings and Processing Aids (CEF) kündigte dazu an, nach weiterer Auswertung neuer Studien, die zur Zeit in den USA durchgeführt werden [12] und 2012 zur Verfügung stehen sollen, sowie neuer Daten aus Studien mit Niedrigdosen, sein Gutachten zu überprüfen und hat dazu eine Bewertung der jüngsten relevanten Literatur erstellen lassen [13].
Auch die Europäische Chemikalienagentur (ECHA) sieht in ihrem Aktionsplan vor, BPA einer weiteren Bewertung zu unterziehen [14].
Die Kommission Human-Biomonitoring (HBM) weist darauf hin, dass der Risikobewertungsprozess derzeit im Fluss ist und dass in der EU und in anderen Ländern regulatorisch im Risiko - Management vorsorglich Anwendungsverbote für BPA in Babyflaschen eingeführt wurden [15]; und dass auch aus anderen Plastikflaschen diverse und toxikologisch nicht bewertete Kontaminanten migrieren [16]. Die Kommission HBM sieht sich angesichts der umfangreichen und fast täglich anwachsenden Literatur und Datenlage aber nicht in der Lage, die bestehenden Kontroversen [17] aufzulösen und die Frage zu beantworten, welche Relevanz die bei niedrigen BPA Dosen an Nagetieren und in Querschnittstudien beobachten Effekte gegenüber den herkömmlichen Studien, die die Grundsätze der Guten Laborpraxis (GLP) einhalten, für die menschliche Gesundheit und damit die Risikobewertung haben.
Die Kommission stellt in dieser Monographie den Ableitungsweg eines auf der tolerierbaren täglichen Aufnahme (Tolerable Daily Intake, TDI) basierten HBM-Wertes vor und weist darauf hin, dass dieser Wert im Rahmen etwaiger Neubewertungen umgehend entsprechend anzupassen ist.
Mehrere jüngere übersichtsarbeiten und Berichte [1, 10, 11, 18-22] befassen sich ausführlich mit BPA, so dass im Folgenden auf eine umfassendere Darstellung verzichtet wird.
Abb.1: Strukturformel von 4,4'-lsopropylidendiphenol

Tab. 1: Physikochemische Daten von BPA [3]
| Substanz | 4,4'-lsopropylidendiphenol |
| Synonyme | Bisphenol A; BPA; 2,2-Bis(4-hydroxyphenyl)propan; Diphenylolpropan |
| Abkürzung | BPA |
| CAS-Nummer | 80-05-7 |
| EG-Nummer (EINECS) | 201-245-8 |
| Mol masse | 228,28 g/mol |
| Summenformel | C15-H16-02 |
| Schmelzpunkt | 152-153 °C |
| Siedepunkt | 360 °C |
| Dichte | 1,2 g/m3 |
| Dampfdruck | 5,3* 10-9 kPa bei 25 °C |
| Wasserlöslichkeit | 0,3 g/l |
| Verteilungskoeffizient (log Kow) | 3,3 |
| Umrechnungsfaktor | 1 ml/m3 = 9,49 mg/m3 |
| Kennzeichnung | Xn |
| Einstufung nach TRGS | R 37 Reizt die Atmungsorgane |
| R 41 Gefahr erster Augenschäden | |
| R 43 Sensibilisierung durch Hautkontakt möglich | |
| R 62 Kann möglicherweise die Fortpflanzungsfähigkeit beeinträchtigen | |
| R 52 Schädlich für Wasserorganismen | |
Tab. 2: Typische BPA-Gehalte in verschiedenen Nahrungsmitteln (Konserven) [76]
| Medium | Typische Gehalte [μg/kg] | Autor |
| Nahrungsmittel | 40 | Goodson et al. [170] |
| Nahrungsmittel | 23 | FSA [171] |
| Getränke | 1,1 | Braunrath et al. [172] |
| Gemüse | 23,9 | |
| Obst | 10,5 | |
| Fetthaltige Speisen | 10,7 |
Tab. 3: Übersicht über tolerierbare Aufnahmemengen an BPA
| Bezeichnung, Institution | Wert [μg/kg KG/Tag] | Autor |
| TDI, EFSA | 50 | EFSA [76] |
| TDI, SCF | 10 | EC [42] |
| RfD, U.S. EPA | 50 | U.S. EPA [173] |
| RfD | 16 | Willhite et al. [81] |
| TDI, Health Canada | 25 | Health Canada [174] |
| IOELV SCOEL | 10 mg/m3 (8 h -TWA) | SCOEL [87] |
| TDI-tolerable daily intake; EESA = European rood Safety Authodty; SCE-scientific committee food EC-European Commission; RfD = reference dose; U.S.-EPA- U.S. Environmental Protection Agency; IOELV-indicative occupational exposure limit values; SCOEL- Scientific Committee on Occupational Exposure Limit Values; TWA-time weighted average | ||
2 Umweltmedizinisch relevante Verbindungen
Physiologisch wirksam ist nach dem gegenwärtigen Erkenntnisstand ausschließlich das systemisch frei verfügbare BPA [23]. Mit der Konjugation oder nach Bindung an Plasmaproteine verliert BPA seine endokrine Wirksamkeit. Die Bewertung der inneren Belastung des Menschen orientiert sich üblicherweise an dem Gesamtgehalt von BPA (gebundenes + frei verfügbares BPA) im Plasma oder Urin [24, 25].
3 Verwendung und Herstellung
BPA wird seit etwa 40 Jahren im großtechnischen Maßstab hergestellt. Dies sind allein in der EU jährlich ca. 1.150.000 Tonnen BPA [1]. Der Stoff zählt damit zu den weltweit in besonders großer Menge hergestellten Chemikalien. Der jährliche Verbrauchszuwachs wird auf 8 % geschätzt.
BPA wird zum überwiegenden Teil zur Herstellung von Polymeren wie Polycarbonat, Epoxidharzen, Kunststoffbeschichtungen und Klebern verwendet. Polycarbonate werden wegen ihrer sehr guten Gebrauchseigenschaften (Durchsichtigkeit, gute Beständigkeit gegenüber Chemikalien und erhöhten Temperaturen) in zahlreichen verbrauchernahen Gegenständen eingesetzt: u. a. in Nahrungs- und Getränkeverpackungen, Plexiglas, Trinkbechern, Plastik- und Mikrowellengeschirr, Kunststoffflaschen, CDs, Armaturen, Kunststoffteilen von Haushaltsgeräten und Kraftfahrzeugen. Epoxidharze werden vielfach in Klebern, Anstrichen, elektronischen Bauteilen und Verbundwerkstoffen sowie als Innenbeschichtungen für Getränkedosen und Konservendosen und bei der Sanierung von Trinkwasserleitungen verwendet. Eine Spezialanwendung (zahntechnische Komposite) erfolgt im zahnmedizinischen Bereich. Aus den epoxidharzähnlichen Füll- und Versiegelungsmassen kann bei oder nach einer zahnmedizinischen Behandlung BPA freigesetzt werden [2, 26-29].
Neben der Herstellung von Polymeren wird BPA auch als Additiv zur Beschichtung von Thermopapier, beim Herstellen und Verarbeiten von PVC (Polyvinylchlorid)-Kunststoffen und in Bremsflüssigkeiten verwendet [30].
4 Vorkommen in der Umwelt
Die Ergebnisse von Gewässeruntersuchungen zeigen, dass vor allem Oberflächengewässer mit einem hohen Abwasseranteil im Fließgewässer höhere Belastungen aufweisen [31].
Informationen zum Vorkommen von BPA in Umweltmedien finden sich z.B. in der Risikobewertung für BPA des Europäischen Chemikalienbüros [32] und im Updated Risk Assessment Report der EU [19] und in einer Zusammenstellung des deutschen Umweltbundesamtes [30] und des österreichischen Umweltbundesamtes [33].
Die folgende Zusammenstellung über das Vorkommen von BPA in Umweltmedien berücksichtigt die Daten, die im Hinblick auf eine direkte Aufnahme durch den Menschen denkbar sind.
Die Nahrung gilt als Hauptquelle, über die BPA aufgenommen wird [32]. BPA in Thermopapier und Druckertinte und in Oberflächenbeschichtungen kann durch dermale Aufnahme ebenfalls zur Exposition beitragen, im Verhältnis zur Gesamtexposition dürfte der Beitrag aber eher gering sein [34, 35].
BPA wird wegen seiner physikalisch-chemischen Eigenschaften nur in niedrigen Konzentrationen in der Innenraumluft und in der Außenluft erwartet. Die wesentlichen Quellen für BPA in der Innenraumluft sind Fußbodenbeläge, Möbel, Bedarfsgegenstände und Reinigungs- mittel. Verlässliche Luftmesswerte für BPA aus Deutschland sind nicht bekannt. Messungen der BPA-Konzentration in zwei Kindertagesstätten in den USA ergaben eine mittlere Konzentration von 6,38 ng/m3 in der Innenraumluft und von 2,53 ng/m3 in der Außenluft. Bei den Messungen der BPA-Konzentration in den Wohnungen der Kinder wurde ein Mittelwert von 11,8 ng/m3 in der Innenraumluft und von 1,26 ng/m3 in der Außenluft ermittelt [36]. Angaben aus Japan über die Belastung der Innenraumluft mit BPA weisen niedrigere Werte aus. Seto et al. [37] nennen einen Konzentrationsbereich von 1,19 bis 1,85 ng/m3. Für die höchste gemessene BPA Konzentration in der Innenraumluft in Japan wurde ein Wert von 8,1 ng/m3 [38] angegeben. Der Gehalt der Außenluft in einem Ballungsgebiet in Japan nennt eine BPA-Konzentration von durchschnittlich 0,42 ng/m3 im urbanen Bereich [37].
Tab. 4: Geschätzte tägliche Aufnahme an BPA aus verschiedenen Quellen
| Medium | Typische Aufnahme [μg/kg KG/Tag] | Bemerkungen | Autor |
| Nahrungsmittel | 1,5 | In Abhängigkeit vom Alter, Adult | EFSA [76] |
| Nahrungsmittel | 5,3 | In Abhängigkeit vom Alter, 1,5 Jahre | |
| Babynahrung | 8,3 | In Abhängigkeit vom Alter, 6 Monate | |
| Muttermilch | 0,2 | In Abhängigkeit vom Alter, Säugling | |
| Hausstaub | 0,025 | Der Berechnung liegt eine tägliche Aufnahme von 100 mg Staub mit einem BPA-Gehalt von 2,5 mg/kg zugrunde. | Scharf [175] |
| Außenluft | 0,0002 | Bei Konzentrationen in der Außenluft bis 0,5 ng/m3 | Seto et al. [37] |
| Innenraumluft | 0,003 | Bei einer Konzentration von 8,1 ng/m3 | Salto et al. [38] |
Tab. 5: Geschätzte tägliche Aufnahmemenge von BPA [32] - verschiedene Altersgruppen
| Altersgruppe | Anwendung | Tägliche Aufnahme [mg/Tagl |
| Säuglinge (1 - 2 Monate) | Flaschenfütterung | 0,035 |
| Kinder (4 - 6 Monate) | Flaschenfütterung | 0,05 |
| Kinder (1,5 bis 4,5 Jahre) | Geschirr | 0,01 |
| Kinder (6 - 12 Monate) | Nahrungsmittel in Kontakt mit Kunstharzen | 0,04 |
| Heranwachsende | Nahrungsmittel in Kontakt mit Kunstharzen | 0,2 |
| Erwachsene | Nahrungsmittel in Kontakt mit Kunstharzen | 0,1 |
| Erwachsene | Wein in Epoxidharz beschichteten Kanistern | 0,5 |
Tab. 6: BPA-Aufnahme der Bevölkerung in den USA. Rückgerechnet aus den im Urin gemessenen BPA-Konzentrationen [98, 176]
| Population | N | Median [μg/kg KG/Tag] | 25. - 95. Perzentil [μg/kg KG/Tag] |
| Gesamt | 2488 | 0,0505 | 0,0235 - 0,2742 |
| 6 -11Jahre | 314 | 0,0674 | 0,031 - 0,3105 |
| 12 - 19 Jahre | 707 | 0,0773 | 0,0378 - 0,3476 |
| 20 - 39 Jahre | 510 | 0,0563 | 0,0272 - 0,289 |
| 40 - 59 Jahre | 427 | 0,0415 | 0,0179 - 0,2335 |
| über 60 Jahre | 530 | 0,0334 | 0,0163 - 0,2331 |
Untersuchungen des österreichischen Umweltbundesamtes ergaben BPA-Gehalte im Hausstaub mit einem Medianwert von 2,5 mg/kg. Die höchste gemessene Konzentration betrug 8,8 mg/kg Staub das 90. Perzentil bei 6,4 mg/kg [39]. Aus den USA wurden BPA Gehalte im Hausstaub von < 0,0005 bis 10,2 mg/kg gemessen, der Median betrug 0,4 mg/kg [40].
5 Toxikologie und deren Bewertung durch nationale und internationale Gremien
Die akute Toxizität von BPA im Tier ist gering. BPA wirkt reizend auf Haut, Augen und Atemwege. Beim Menschen traten vereinzelt Sensibilisierungen auf. Die Substanz ist zudem photosensibilisierend. In Langzeitstudien an Ratten wurde vor allem eine Gewichtsreduktion berichtet, in Mäusen war das vornehmliche Zielorgan die Leber. BPA beeinträchtigte die Fruchtbarkeit und wirkte bei maternal toxischen Dosen entwicklungsverzögernd, jedoch nicht teratogen. Die überwiegende Anzahl von Genotoxizitätstests erwiesen sich als negativ. Dennoch wurden in vitro und in vivo DNA-Addukte nachgewiesen. In Kanzerogenitätsstudien an Ratten und Mäusen ergaben sich keine überzeugenden Hinweise für eine krebserzeugende Wirkung [41].
BPA zeigte in in vitro- und in vivo-Testsystemen hormonartige Wirkungen (östrogene, antiandrogene und antithyroidale Aktivitäten). Das östrogene Potential dieser Verbindung ist bereits seit den 1930er Jahren bekannt und in zahlreichen in-vitro- und in-vivo-Studien belegt [42,43]. Ähnlich wie das weibliche Sexualhormon Östradiol kann BPA Östrogenrezeptoren aktivieren, bindet aber als frei verfügbares BPA über 10.000-mal schwächer als Östradiol an den Östrogenrezeptor alpha. In einigen Zelltypen bindet es jedoch vergleichbar oder stärker als natürliches Östrogen an östrogenstimulierbare Membranrezeptoren [5, 7, 44].
Die Relevanz der hormonellen und entwicklungstoxikologischen Wirkungen von BPA auf den Menschen ist noch unklar. Bei beruflichem Umgang von Frauen mit BPA wurden keine nachteiligen Effekte auf die Reproduktion berichtet. Bei beruflich exponierten Männern in China wurden jedoch Störungen der Potenz, eine verminderte Libido und eine schlechtere Spermienqualität beobachtet [45-47]. In Querschnittstudien wurden Zusammenhänge zwischen erhöhten Belastungen mit BPA in Spontanurinproben und Herz-Kreislauferkrankungen und Diabetes, dem anogenitalen Abstand und dem Geburtsgewicht beobachtet [48-50]. Höhere Uringehalte an BPA in der 14. Schwangerschaftswoche waren mit Verhaltensauffälligkeiten bei Töchtern im 2. Lebensjahr jedoch nicht bei Söhnen korreliert [51,52].
Tab. 7: BPA-Aufnahme der 3- bis 14-jährigen Kinder in Deutschland 2003-2006. Rückgerechnet aus den im Morgenurin gemessenen BPA-Konzentrationen [100]
| Population | N | Median [μg/kg KG/Tag] | 95. Perzentil [μg/kg KG/Tagl | Max [μg/kg KG/Tag] |
| Gesamt (Kreatinin bezogen) | 597 | 0,061 | 0,37 | 6,96 |
| Gesamt (Volumen bezogen) | 599 | 0,047 | 0,22 | 4,52 |
N = Stichprobengröße;
Max = Maximaler Messwert;
KG = Körpergewicht
Tab. 8: BPA-Aufnahme der 20- bis 29-jährigen Studierenden in Münster 1995-2009 Rückgerechnet aus den im 24-Stunden Sammelurin gemessenen BPA-Konzentrationen [103]
| Population | N | Median [μg/kg KG/Tag] | 95. Perzentil [μg/kg KG/Tag] | Max [μg/kg KG/Tag] |
| Gesamt | 596 | 0,037 | 0,171 | 0,947 |
| Frauen | 298 | 0,037 | 0,170 | 0,947 |
| Männer | 298 | 0,036 | 0,165 | 0,691 |
N = Stichprobengröße;
Max = Maximaler Messwert;
KG=Körpergewicht
Allerdings wird die Bedeutung dieser Beobachtungen kontrovers diskutiert [53- 58]. Die Kritik an diesen Querschnittstudien bezieht sich auf die Expositionsschätzung bei unterschiedlichen Zeitachsen, d.h. der über längere Zeiträume sich entwickelnden Erkrankungen oder Entwicklungsstörungen und der Expositionserfassung durch eine Einzelmessung im Spontanurin. Diese stellt wegen der kurzen Halbwertszeit und des Einflusses der aktuellen Ernährung nur eine Momentaufnahme der Exposition der letzten 24h dar [59]. Trotz der grundsätzlichen Vorbehalte gegenüber den Ergebnissen von Querschnittstudien und der Übertragbarkeit von Tierversuchen wurde empfohlen, mit hoher Priorität die beobachteten Entwicklungsauffällig,keiten in einer prospektiven Studie zu untersuchen [11].
Die Schlüsselstudien für die Ableitung des TDI-Wertes sind gegenwärtig die Mehrgenerationenstudien an Ratte und Maus von Tyl et al. [60,61,62]. Zahlreiche Untersuchungen mit oralen Dosen von BPA unterhalb des "no observed adverse effect levels" (NOAEL) der regulatofischen GLP-Studien an Ratten und Mäusen weisen auf Veränderungen des Verhaltens, des Lernvermögen, von Hirnstrukturen und des reproduktiven Sys- tems und nichtmonotone Dosis-Wirkungs-Beziehungen hin [29, 63-69]. Allerdings waren diese Studienergebnisse in den letzten Jahren Anlass für kontroverse Diskussionen bei der Beurteilung der Wirkungen von BPA [11, 70-73] und wurden von U.S. Food and Drug Administration (FDA) und EFSA nicht als Ausgangspunkt für die Ableitung einer tolerablen täglichen Aufnahme herangezogen [10, 74, 75,76].
Detailliert hat sich eine Arbeitsgruppe der Deutsche Gesellschaft für experimentelle und klinische Pharmakologie (DGPT) [21] mit der Datenlage und den kontroversen Positionen auseinandergesetzt und kommt abschließend zu der Auffassung: "dass der aktuelle TDI angemessen begründet sei und dass die BPA Exposition nach der vorhandenen Evidenz kein relevantes Risiko für die Bevölkerung einschließlich von Neugeborenen und Kleinkindern darstelle." Eine Übersicht über tolerierbare Aufnahmemengen für den Menschen, abgeleitet von europäischen und amerikanischen Institutionen gibt Tabelle 3.
Von mehreren Behörden liegen Bewertungen zur Anwendungssicherheit von BPA vor. Die EFSA, das Altstoffprogramm der EU, die U.S. FDA und die zuständigen Behörden Japans sehen keine Bedenken bei den gegenwärtigen menschlichen Belastungen. Das U.S. National Toxicology Programe (U.S. NTP), das wissenschaftliche Komitee der U.S.-FDA, eine Minderheit der EU-Mitgliedsstaaten, Environment Canada und eine Konferenz der National Institute of Environmental Health Sciences (NIEHS) der führenden Wissenschaftler auf dem Gebiet des BPA drückten Besorgnis aus oder sahen Gründe zur Risikoreduktion (vgl. Zusammenfassung: in Umweltbundesamt, Dessau [30]).
Das Bundesinstitut für Risikobewertung (BfR), die in Deutschland zuständige Fachbehörde für die Bewertung von gesundheitlichen Risiken durch z.B. Lebensmittel, hat im Herbst 2008 bezüglich der Daten aus zwei neuen Studien aus den USA zur Wirkung von BPA [48, 77] mitgeteilt: "Das Bundesinstitut für Risikobewertung (BfR) hat geprüft, ob die Studien Erkenntnisse liefern, die eine Änderung der gesundheitlichen Risikobewertung erforderlich machen. Das Institut sieht unter Berücksichtigung der Daten aus beiden Studien keinen Anlass, die bisherige Risikobewertung für BPA zu ändern. Wird die von der Europäischen Behörde für Lebensmittelsicherheit (EFSA) 2006 [76] festgelegte tolerierbare tägliche Aufnahmemenge (TDI) von 0,05 Milligramm BPA pro Kilogramm Körpergewicht eingehalten, besteht für Verbraucher kein gesundheitliches Risiko" [78].
Auf Ersuchen der Europäischen Kommission und als Reaktion auf die Berichte der französischen Behörde für Ernährungssicherheit, Umwelt- und Arbeitsschutz (Anses) hat die EFSA Ende 2011 erneut eine Stellungnahme zu BPA veröffentlicht [79, 80]. Die wissenschaftlichen Sachverständigen des EFSA-Gremiums waren insgesamt der Auffassung, dass die im Bericht über die gesundheitlichen Auswirkungen von BPA enthaltenen Informationen keinen Anlass geben, die vom Gremium in seinem Gutachten von 2010 zur Sicherheit von BPA geäußerten Ansichten zu ändern.
Tab. 9: BPA im Urin der Bevölkerung in Deutschland und in Nordamerika
|
Studie / Autor |
Jahr/e |
Region |
N |
Kollektiv/Lebensalter/ Probenart |
NWG |
%> NWG |
μg/l |
μg/g Kreatinin | ||
| GM | 95P | GM | 95P | |||||||
| KUS / Becker et al., 2009 [100] | 2003-2006 | D | 599 | Kinder 3-14 J., Morgenurin | 0,15 BG | 100 >BG | 2,66 | 14,0 | k.A. | k.A. |
| LGL /Völkel et al., 2008 [23] | 2005-2008 | Bayern | 31 | Frauen 18-41 J., Spontanurin | 0,3 | k.A. | Bereich: <0,3 - 6,5 | |||
| 2005-2008 | Bayern | 30 | Kinder 5-6 J., Spontanurin | 0,3 | k.A. | Bereich: <0,3 - 7,5 | ||||
| 2007-2008 | Bayern | 21 | Kolleginnen 19-52 J. mit 62 Spontanurin | 0,3 | k.A. | Bereich: <0,3 - 3,3 | ||||
| UPB / Koch et al. 2012 [103] | 1995-2009 | Münster | 600 | Studierende 20-291, 24-Stunden Sammelurin | 0,1 BG | 99,9 >BG | 1,55 | 7,37 | 1,76 | 7,31 |
| Duisburg Geburtskohorte / Kasper-Sonnenberg et al. 2012 [128] | 2006-2009 | Duisburg | 104 | Kinder 6-8J., Morgenurin | 0,1 BG | 100 | 2,4 | 9,7 | 2,3 | 10,0 |
| 2006-2009 | Duisburg | 104 | Frauen 29-49 J., orgenurin | 0,1 BG | 100 | 2,1 | 8,4 | 1,8 | 6,2 | |
| NHANES / CDC 2012 [129] | 2003-2004 | USA | 314 | Kinder 6-11 J., pontanurin | 0,4 | k.A. | 3,55 | 16,0 | 4,32 | 15,7 |
| 2005-2006 | USA | 356 | Kinder 6-11 J., pontanurin | 0,4 | k.A. | 2,86 | 22,8 | 3,14 | 24,6 | |
| 2007-2008 | USA | 389 | Kinder 6-11 J., pontanurin | 0,4 | k.A. | 2,48 | 13,4 | 3,05 | 20,8 | |
| 2003-2004 | USA | 1488 (1487) | Erwachsene > 20 J., pontanurin | 0,4 | k.A. | 2,41 | 15,2 | 2,39 | 10,0 | |
| 2005-2006 | USA | 1490 | Erwachsene > 20 J., pontanurin | 0,4 | k.A. | 1,75 | 10,7 | 1,75 | 8,54 | |
| 2007-2008 | USA | 1814 | Erwachsene > 20 J., Spontanurin | 0,4 | k.A. | 1,99 | 13,2 | 2,04 | 9,32 | |
| Canadian Health Measures Survey / Health Canada 2010 [130, 131) | 2007-2009 | Canada | 2659 (2650) | Männliche Probanden 6-79 J. Spontanurin | 0,2 | 92,33 | 1,29 | 6,77 | 1,28 | 6,08 |
| 2817 (2812) | Weibliche Probanden 6-79 J., Spontanurin | 0,2 | 89,24 | 1,04 | 7,04 | 1,54 | 8,59 | |||
| 1031 (1028) | Kinder 6-11 J., Spontanurin | 0,2 | 93,21 | 1,30 | 7,16 | 2,00 | 6,43 | |||
| 1165 (1161) | Erwachsene 20-39 J., Spontanurin | 0,2 | 91,16 | 1,33 | 7,30 | 1,49 | 6,83 | |||
| 1219 (1214) | Erwachsene 40-59 J., Spontanurin | 0,2 | 87,94 | 1,04 | 6,58 | 1,33 | 7,45 | |||
| 1081 | Erwachsene 60-79 J., Spontanurin | 0,2 | 88,34 | 0,90 | 5,22 | 1,26 | 7,63 | |||
| NWG = Nachweisgrenze; %>NWG = Anteil der Werte oberhalb der NWG; BG = Bestimmungsgrenze; GM = geometrischer Mittelwert; 95P-95. Perzentil, k.A.-keine Angabe; KUS = Kinder-Umwelt-Survey; LGL = Landesamt für Gesundheit und Lebensmittelsicherheit Bayern; UPB = Umweltprobenbank des Bundes; NHANES = National Health and Nutntion Examination Survey; grau unterlegts Kinderkollektive; (wxyz) = Stichprobenumfang zu den Kreatinin bezogenen Kennwerten | ||||||||||
Das Scientific Committee on Food (SCF) der Europäischen Kommission veröffentlichte 2002 eine erste Risikobewertung für BPA hinsichtlich seiner Verwendung als Verpackungsmaterialien für Nahrungsmittel. Aus den damals vorliegenden Daten wurde für BPA ein TDI von 0,01 mg/kg KG/Tag abgeleitet [41]. Das Vorliegen zusätzlicher Daten führte 2006 zu einer erneuten Bewertung durch das Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food [AFC] (EF-SA 2006). Aufgrund der verbesserten Datenlage reduzierte das Panel den Sicherheitsfaktor von 500 auf 100. Der seit 2006 von der EFSA festgelegte TDI-Wert für BPA beträgt 0,05 mg/kg KG/Tag [76] und wurde 2008 und 2010 erneut bestätigt [10].
Tab. 10: BPA im Morgenurin (μg/l; BG: 0,15) der 3- bis 14-jährigen Kinder in Deutschland - Kinder-Umwelt-Survey 2003-2009 [100]
| Population | N | %kBG | 50.R | 95.P. | GM | KI-GM | PP95 1,2 | KI-PP95 1,2 |
| Gesamt | 599 | 99 | 2,74 | 14,0 | 2,66 | 2,44-2,89 | ||
| Lebensalter ** | ||||||||
| 3 bis 5 Jahre | 137 | 99 | 3,53 | 22,9 | 3,55 | 2,94-4,28 | 21,5 | 13,1-37,7 |
| 6 bis 14 Jahre | 462 | 99 | 2,52 | 12,1 | 2,44 | 2,23-2,67 | 12,1 | 9,9-16,4 |
| 6 bis 8 Jahre | 145 | 99 | 2,81 | 15,4 | 2,72 | 2,31-3,21 | ||
| 9 bis 11 Jahre | 149 | 99 | 2,13 | 13,8 | 2,22 | 1,89-2,61 | ||
| 12 bis 14Jahre | 168 | 98 | 2,60 | 11,0 | 2,42 | 2,07-2,82 | ||
| Migrantenstatus * | ||||||||
| Migrant/in | 45 | 98 | 1,97 | 11,7 | 1,97 | 1,46-2,66 | ||
| keine Migrant/in | 555 | 99 | 2,80 | 14,0 | 2,72 | 2,50-2,97 | ||
| N = Stichprobenumfang; % -k BG = Anteil der Werte ab der BG (BG - Bestimmungsgrenze; Werte <BG wurden mit BG/2 berücksichtigt); 50.R, 95.P.= Stichprobenperzentil; GM= geometrischer Mittelwert; KI GM = Konfidenzintervall des GM, PP95 = 95. Populationsperzentil; KI-PP95 = 95%-Konfidenzintervall des PP95; 1) bei der Berechnung des PP95 und KI-PP95 wurden nur Proben mit einem Kreatiningehalt zwischen 0,3 und 3,0 g/l Urin berücksichtigt; 2) nonparametrisches Verfahren - Bootstrapping Signifikanzprüfung: t-Test bzw. Varianzanalyse (Unterschiede der GM): * (p<0,05);** (p<0,01) | ||||||||
Von der kalifornischen Umweltbehörde wurde eine Referenzkonzentration zur Festlegung eines Trinkwasserrichtwertes von 0,016 mg/kg-d abgeleitet [81].
Derzeit werden von der U.S.-FDA, dem NIEHS und dem National Toxicology Program (NTP) mehrere Forschungsvorhaben durchgeführt [12, 82]. Sowohl EFSA wie auch ECHA haben daraufhin eine Neubewertung angekündigt.
6 Aufnahmewege und -mengen für den Menschen
BPA wird vor allem oral mit der Nahrung aufgenommen, da es in zahlreichen Materialien mit Lebensmittelkontakt enthalten ist. Nach dem gegenwärtigen Kenntnisstand sind Lebensmittel und Getränke für die Allgemeinbevölkerung die wesentlichen Quellen für das aufgenommene BPA. Auch über die vielen Gegenstände des täglichen Gebrauchs und die Beschichtungen aus denen BPA in Lebensmittel und Getränke migrieren kann, wird die Bevölkerung mit BPA exponiert. Der Tabelle 2 sind typische BPA-Gehalte in verschiedenen Nahrungsmitteln zu entnehmen.
Die Exposition kann für ein 3 Monate altes Baby bis zu 11 μg/kg Körpergewicht/ Tag betragen sowie für ein Baby mit 6 Monaten bis zu 13 μg/kg Körpergewicht/ Tag betragen. Für Erwachsene wurde die mittlere Exposition auf 1,5 μg/kg Körpergewicht/Tag geschätzt [76]. Von der FAO/ WHO wird für Kinder und Teenager eine mittlere Belastung durch die Nahrung von 0,1- 0,5 μg/kgKG/Tag angenommen, für Erwachsene schätzt man die mittlere Exposition auf 0,01- 0,4 μg/kgKG/Tag [11]. Allgemein kann eine höhere Exposition von Kindern im Vergleich zu Erwachsenen angenommen werden [10].
Polycarbonatflaschen werden für Säuglinge und Polycarbonatflaschen und beschichtete Getränke- und Konservendosen werden für Kinder und Erwachsene als wichtigste Quellen angesehen [83]. In einer chinesischen Studie bewirkte Trinken aus Polycarbonat-Tassen oder -flaschen eine signifikante (p<0.05) Erhöhung der BPA-Gehalte im Urin [47].
Im Trinkwasser liegen die BPA-Gehalte meist deutlich unterhalb von 1 μg/l. In Studien aus Ontario, Kanada und China wurden BPA-Gehalte im Trinkwasser im Mittel von 0,002 (Kanada) bis 0,1 μg/l (China) mit Maximalwerten < 0,35 μg/l berichtet [45, 84]. Obwohl es keine repräsentativen Untersuchungen gibt, scheint Trinkwasser normalerweise keinen relevanten Pfad für BPA darzustellen. Eine Ausnahme besteht bei Warmwasser aus mit Epoxidharz beschichteten Rohren, welches Konzentrationen < 30 μg/l aufweisen kann. Die Trinkwasserkommission stellt dazu fest, dass frisch abgelaufenes Trinkwasser, welches aus fachgerecht mit Epoxidharz beschichteten Trinkwasser-Installationen entnommen wird, keinen nennenswerten Beitrag zur Gesamtexposition mit BPA liefert [85]. Allerdings können unter ungünstigen Verhältnissen (nicht sachgerechter Einbau, sehr hohe Temperaturen) auch höhere Werte gemessen werden.
Eine inhalative Exposition der über die Außenluft oder die Innenraumluft ist aufgrund des geringen Dampfdrucks von BPA nur in sehr geringen Mengen anzunehmen und wird durch die gemessenen BPA-Konzentrationen in Innenraum- und Außenluft bestätigt.
Eine ausgeprägte Aufnahme von BPA sowohl oral, dermal [86] als auch über die Atemluft ist an Arbeitsplätzen in der Kunststoffindustrie zu erwarten. Berechnungen liegen bei einer Aufnahme von 71 μg/Tag. Die höchsten Luft-Konzentrationen von BPA werden an Arbeitsplätzen bei der Herstellung von BPA gemessen. Die ermittelten 8-Stunden Time-Weighted Average (TWA)-Konzentrationen liegen zwischen "nicht nachweisbar und 23,3 mg/m3". An Arbeitsplätzen zur Produktion von BPA wird für eine 8 Stunden Schicht unter ungünstigen Bedingungen ("worstcase") eine Konzentration von 3 mg/m3: angenommen [1] , die jedoch trotz eines ldeinen Margin of Safety (MOS) von 3,3 nicht als problematisch und als konsistent mit den aktuellen Empfehlungen vom wissenschaftlichen Ausschuss für Grenzwerte berufsbedingter Exposition gegenüber chemischen Arbeitsstoffen (SCOEL) angesehen wurde. Von SCOEL wurde 2004 [87] ein 8 Stunden IOELV (indicative occupational exposure level) von 10 mg/m3 vorgeschlagen.
Da BPA ubiquitär verbreitet ist, sind praktisch alle Menschen diesem Stoff ausgesetzt. Die Allgemeinbevölkerung nimmt aus Lebensmitteln, Getränken und aus Hausstaub BPA in Mengen unterhalb 1/100 des TDI-Wertes auf Unter besonderen Bedingungen, wie dem überwiegenden Verzehr von Lebensmitteln aus Dosen könnten im Einzelfall Expositionen > 100 μg/Tag resultieren [88]. Auch Zahnbehandlungen mit Kunststofffüllungen können am Tag der Behandlung zu einer Verdopplung der mittleren Exposition führen, die an den Folgetagen aber wieder abklingen [28].
Tab. 11: BPA im 24-Stunden Sammelurin (μg/l, BG: 0,1) der 20- bis 29-jährigen Studierenden in Münster 1995-2009 - Umweltprobenbank des Bundes [103]
| Population | N | % > BG | 50.P. | 95.P. | GM | KI-GM | PP95 1, 2 | KI-PP95 1, 2 |
| 1995 | 60 | 100 | 1,69 | 11,4 | 1,92 | 1,47 - 2,52 | ||
| 1997 | 60 | 100 | 1,98 | 7,36 | 2,03 | 1,61 - 2,57 | ||
| 1999 | 60 | 100 | 1,91 | 8,87 | 1,83 | 1,45 - 2,32 | ||
| 2001 | 60 | 100 | 1,60 | 7,98 | 1,59 | 1,29 - 1,98 | ||
| 2003 | 60 | 100 | 1,58 | 4,59 | 1,50 | 1,22 - 1,85 | ||
| 2005 | 60 | 99,9 | 1,32 | 7,20 | 1,39 | 1,10 - 1,75 | ||
| 2006 | 60 | 100 | 1,22 | 4,12 | 1,31 | 1,07 - 1,60 | ||
| 2007 | 60 | 100 | 1,35 | 6,38 | 1,48 | 1,23 - 1,78 | ||
| 2008 | 60 | 100 | 1,27 | 4,79 | 1,33 | 1,06 - 1,66 | ||
| 2009 | 60 | 100 | 1,35 | 7,07 | 1,30 | 1,02 - 1,65 | ||
| Gesamt | 600 | 99,9 | 1,49 | 7,37 | 1,55 | 1,44 - 1,66 | 7,39 | 5,76 - 9,172 |
| Männer | 300 | 99,9 | 1,66 | 7,74 | 1,71 | 1,55 - 1,89 | ||
| Frauen | 300 | 100 | 1,31 | 5,81 | 1,40 | 1,27 - 1,55 | ||
| BG = Bestimmungsgrenze; N = Stichprobenumfang; % > BG = Anteil der Werte ab der BG; Werte < BG wurden mit BG/2 berücksichtigt); 50.P., 95.P.= Stichprobenperzentil; GM = geometrischer Mittelwert; KI-GM =Konfidenzintervall des GM; PP95 = 95. Populationsperzentil; KI-PP95 = 950/0-Konfidenzjntervall des PP95 1) Bei der Berechnung des PP95 und KI-PP95 wurden nur Proben mit einem Kreatiningehalt zwischen 0,3 und 3,0 g/l Urin berücksichtigt; dadurch verringerte sich der Stichprobenumfang auf n = 584. 2) Nonparametrisches Verfahren - Bootstrapping | ||||||||
Tab. 12: Referenzwerte für BPA im Urin
| Personengruppe | Jahr der Studie | Referenzwert |
| Kinder 3 bis 5 Jahre | 2003-2006 | 30 μg/l |
| Kinder/Jugendliche 6 bis 14 Jahre | 2003-2006 | 15 μg/l |
| Erwachsene 20 bis 29 Jahre | 1995-2009 | 7 μg/l |
In der Tabelle 4 sind geschätzte tägliche Aufnahmen an BPA aus verschiedenen Quellen angegeben. Eine orale Exposition gegenüber BPA ist bei Säuglingen überwiegend durch Polycarbonatfläschchen und bei Kleinkindern vor allem über Trinkgefäße, Fertignahrung und Hausstaub möglich. Bei der Risikobewertung der EU für BPA wird von den in Tabelle 5 wiedergegeben täglichen Aufnahmemengen ausgegangen [32].
Berechnung der Aufnahme an BPA aus der Ausscheidung an BPA über den Urin
Die Menge des über den Urin ausgeschiedenen BPA hängt wegen der kurzen Halbwertszeit von der Menge aufgenommener Lebensmittel und Kontaminationen in den vergangenen Stunden vor der Probenahme ab. Die intraindividuelle Variation bildet dies insbesondere bei Spontanurin-Messungen ab. In 24-Stunden-Sammelurin-Messungen wird die Variation niedriger als in Spontanurin-Messungen sein. 24-Stunden-Sammelurin-Messungen bilden die Tagzu-Tag-Variation ab. Diese Variation ist unter weitgehend konstanten Expositionsbedingungen für einzelne Personen niedrig. Wegen der Unterschiedlichkeit der Expositionsbedingungen über die Personen (insbes. bezüglich der Aufnahme über die Nahrung) kann die interindividuelle Variation deutlich höher sein.
Da Nahrung als Hauptzufuhrpfad für BPA gilt, bietet es sich an, auf der Basis der gemessenen BPA-Gehalte im Urin die tägliche Aufnahme zu modellieren.
Gegen ein solches Vorgehen spricht die sehr kurze Halbwertszeit im menschlichen Körper [89, 90]. Miyamoto und Kotake [91] kamen bei Ihren Betrachtungen zu dem Schluss, dass Ergebnisse, die auf der Analyse von Spontanurin basieren, nicht geeignet sind, um daraus die die tägliche Aufnahme abzuleiten. Andererseits stellen Dekant und Völkel [26] fest, dass in Kollektiven die ermittelten mittleren Gehalte in Spontanurinen relativ gut mit den mittleren Gehalten von 24h-Urinen übereinstimmen, was durch die Untersuchungen von Christensen und Mitarbeitern [92] bestätigt wird. Außerdem zeigten Teitelbaum et al. [93] für das BPA auf, dass trotz der geringen Halbwertszeit des Stoffes nur eine geringe intraindividuelle Schwankung der Gehalte im Urin von Kindern auftreten, was sich durch eine omnipräsente Exposition gegenüber BPA erklären lassen dürfte. Mahalingaiah et al. [94] fanden eine Korrelation der Gehalte im Urin von Ehepartnern, was bei gleicher Ernährung plausibel ist und bestimmten eine Sensitivität von 0,64 zur Einstufung in das höchste Expositionsquartil anhand jeweils einer einzelnen Urinprobe. Der interindividuelle Unterschied zwischen der höchsten und niedrigsten Konzentration betrug etwa zwei Größenordnungen (0,4 - 42 ,6 μg/l), was auch den Befunden von Ye et al. [95] entspricht mit Gehalten zwischen 1,3 lagig und 117,7 μg/g im Spontanurin einer Person an unterschiedlichen Tagen. Ye et al. [95] untersuchten die Variabilität der Gehalte im Urin und bestätigen sowohl die große intraindividuelle Variabilität an unterschiedlichen Tagen, zwischen Morgenurin, 24-h Urin und Spontanproben. Während für eine Einzelperson aus einer Einzelprobe keine verlässliche Aussage über die durchschnittliche Exposition möglich ist, erlaubt die Auswertung aller jeweiligen Probenahmen für das Gesamtkollektiv eine adäquate Abschätzung der Exposition [92, 95].
Formel 1
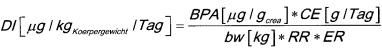
Formel 2
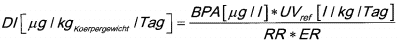
Ausführlich ist die Problematik der Varianz von BPA und anderen Verbindungen in Abhängigkeit von der Halbwertszeit von Aylward et al. [59] dargestellt worden. Für Verbindungen mit kurzer Halbwertszeit muss die intra- und inter-Tage-Variation der Biomarker-Konzentrationen beachtet werden.
Für BPA als Analyt gilt, dass die intraindividuelle die interindividuelle Variabilität übersteigt [24, 52, 94-97]. Daraus folgt, dass eine Expositionsschätzung für eine Einzelperson auf mehreren Proben aufbauen sollte.
Die berechnete tägliche BPA-Aufnahme der Bevölkerung in den USA ist in Tabelle 6 angegeben [98]. Im Rahmen des Kinder-Umwelt-Surveys 2003-2006 [99-102] ] wurden auf der Basis der gemessenen BPA-Gehalte im Morgenurin der 3- bis 14-jährigen Kinder in Deutschland (vgl. Abschnitt 8.2) die tägliche Aufnahme berechnet (vgl. Tab. 7). Für die Berechnung der täglichen Aufnahmemenge von BPA findet folgende Formel
Verwendung (auf Kreatinin bezogen): (vgl. Formel 1)
Für die Berechnung der täglichen Aufnahmemenge von BPA findet folgende Formel Verwendung (volumenbezogen): (vgl. Formel 2)
Auf der Basis der im Rahmen der Umweltprobenbank gemessenen BPA-Gehalte im 24-Stunden Sammelurin von 20- bis 29-jährigen Studierenden in Münster (vgl. Abschnitt 8.2) wurde ebenfalls die tägliche Aufnahme (vgl. Tabelle 8) berechnet [103].
Für BPA wird von einer vollständigen Resorption und Ausscheidung ausgegangen [81]. Die Faktoren für die Resorptionsrate und Exkretionsrate sind daher beide 1.0. Für das Gesamtkollektiv ergibt sich ausgehend von den volumenbezogenen Gehalten eine mittlere Aufnahme von 0,06 μg/kgKG/Tag und ausgehend von auf den Kreatinin bezogenen Gehalten eine mittlere Aufnahme von 0,05 μg/kg KG/Tag (95. Perzentil 0,22 bzw. 0,37 μg/kg KG/Tag).
Dekant und Völkel [26] berechneten ausgehend von einem Gehalt im Urin von 3,75 bis 5 μg/l für Erwachsene eine Aufnahme von 0,06 bis maximal 0,13 μg/kg KG/Tag.
7 Kinetik (Resorption, Verteilung, Metabolismus)
BPA wird nach oraler Aufnahme rasch aus dem Darmtrakt resorbiert und bereits in der Darmwand und in der Leber hauptsächlich zu BPA-Glucuronid metabolisiert. Bei Menschen wird das Glucuronid über die Nieren ausgeschieden. Die Halbwertszeit beträgt etwa 2 bis 6 Stunden, nach 96 Stunden wird das Glucuronid nahezu vollständig ausgeschieden [81, 89, 90]. Nach einer BPA-kontaminierten Mahlzeit erreicht BPA nach etwa 1 1/2 Stunden im Plasma und nach 2 1/2 Stunden im Urin sein Maximum [24]. Aufgrund der schnellen Metabolisierung und Exkretion sowie der Bindung an Plasmaproteine bleiben beim Menschen die Konzentrationen von freiem BPA (Aglykon-BPA) im Blut von Erwachsenen, äußerst niedrig, eine Kumulation findet nicht statt. Gemessene BPA-Metaboliten müssen im zeitlichen Zusammenhang mit der vorherigen Nahrungsaufnahme interpretiert werden. Die kurze Eliminationshalbwertzeit könnte erldären, warum Spontanurinproben im Tagesverlauf am Nachmittag (nach der Mittagsmahlzeit) höhere Werte aufweisen [94].
Nach oraler Aufnahme geringer Dosen führt die effiziente Glucuronidierung von Bisphenol A und die schnelle renale Ausscheidung des gebildeten Glucuronid beim Menschen zu einer geringen inneren Belastung [90]. Bei Nagern hingegen wird BPA-Glucuronid über die Gallenflüssigkeit in den Darm hinein ausgeschieden. Im Darmlumen kann das Glucuronid gespalten und frei verfügbares BPA erneut in das Blut aufgenommen werden. Dieser enterohepatische Kreislauf führt bei Nagern zu einer verlängerten systemischen Verfügbarkeit von freiem BPA und zu einer insgesamt langsameren Exkretion des oral aufgenommenen BPA. Trotz der Differenzen im Metabolismus und der Disposition von BPA zwischen Nagern und Primaten ist die innere Exposition gegenüber dem Aglykon vergleichsweise ähnlich, so dass auf eine pharmakokinetische Anpassung zur Berücksichtigung toxikokinetischer Unterschiede verzichtet werden kann [11].
In einer kontrollierten Aufnahmestudie mit 5 mg BPA pro Person (einmalige Aufnahme) wurde, trotz der erheblichen Überdosierung, im Blut kein frei verfügbares BPA gemessen [90]. Zwei andere Arbeitsgruppen haben bei schwangeren Frauen Mittelwerte von freiem BPA von 4,4 lig/L [104] und 5,9 μg/L im Blut festgestellt sowie einen Höchstwert von 22,4 μg/L ermittelt [105]. Die unterschiedlichen Befunde sind Gegenstand einer anhaltenden wissenschaftlichen Diskussion [106]. In jüngeren Arbeiten [24, 107, 108] wird allerdings die Auffassung vertreten, dass die innere Exposition gegenüber freiem BPA beim Menschen nach oraler Aufnahme eher gering sei [19, 21, 76, 109,110]. Nach Sieli et al. [110] beträgt bei Mäusen der Anteil der inneren Exposition von frei verfügbarem gegenüber gebundenem BPA nach oraler Zufuhr mit dotierter Nahrung (100 mg BPA/kg) gemessen als Fläche unter der Kurve (24h) etwal:100, das entspricht den Befunden von Doerge et al. [108], die bei Rhesusaffen für das Aglykon von < 1 % des Gesamt-BPA ausgehen.
Tab. 13: Berechnung eines TDI-basierten HBM-I-Wertes für Bisphenol A im Urin
| TDI | 0,05 mg BPA/kgKGfrag | |
| Urin-Mengenbezug [I/kg KG] | 0,020 (Erwachsene)* | |
| 0,030 (Kinder)* | ||
| -HBM-I-Wert total-BPA im Urin | ||
| Erwachsene | = 0,05 / 0,02 | = 2,5 mg/l |
| Kinder | = 0,05 /0,03 | = 1,66 mg/l |
*) Standardannahme (default) nach HBM-Kommission
Die dermale und inhalative Aufnahme von BPA ist in der Allgemeinbevöllcerung im Vergleich zur oralen Aufnahme von untergeordneter Bedeutung. Hochexponierte Personen sind somit am Arbeitsplatz zu finden, bei besonderen Ernährungsgewohnheiten und unter der Anwendung von Medizinprodukten aus denen BPA freigesetzt wird und besonders wenn Patienten parenteral exponiert werden.
8 Human-Biomonitoring (HBM)
8.1 Analytik
8.1.1 BPA im Urin als Parameter der inneren Belastung
Eine zusammenfassende Darstellung der HBM-Anwendungen zur Erfassung der humanen BPA-Belastung findet sich in einer aktuellen Übersichtsarbeit von Dekant und Völlcel [26]. In den meisten HBM-Studien wurde eine Analyse der im Urin ausgeschiedenen BPA-Konzentration durchgeführt. Dabei erfolgt in der Regel nach enzymatischer Hydrolyse die Bestimmung der Gesamtkonzentration an freiem (Aglykon) und als an Glucuronid oder Sulfat gebundenes BPA. Darüber hinaus wurde in einigen Studien zusätzlich auch die Konzentration des BPA ohne Hydrolyse bestimmt und durch Dif-
ferenzrechnung der Anteil des gebundenen BPA ermittelt [111-114]. Mit Ausnahme der Studie von Kim und Mitarbeitern war in diesen Studien frei verfügbares BPA nicht oder nur geringfügig oberhalb der Nachweisgrenzen von 0,2 bzw. 0,3 μg/l detektierbar, während Gesamt-BPA in Konzentrationsbereichen von 0,2 -19,1 μg/l [112], 0,2 - 5,6 μg/l [113] bzw. <0,3 - 19,8 μg/l [114] bestimmt wurde. Diese Ergebnisse sind in guter Übereinstimmung mit den Ergebnissen von Völkel und Kollegen [89], die bei Probanden nach oraler d16-Bisphenol-Gabe kein frei verfügbares sondern ausschließlich gebundenes d16-BPA im Urin nachweisen konnten. Im Gegensatz dazu gaben Kim und Mitarbeiter nach Analyse von 30 Urinproben ohne enzymatische Hydrolyse Konzentrationen für das freie BPA im Bereich 0,07 - 2,36 μg/L bei einer Gesamt-BPA-Belastung im Bereich von 0,85 - 9,83 μg/l an [111]. Zwei Arbeitsgruppen führten durch den Einsatz unterschiedlicher Enzyme eine differenziertere Untersuchung des gebundenen Anteils an BPA im Urin durch [111,114]. Dabei fanden Kim und Mitarbeiter für Sulfatgebundenes BPA in einem koreanischen Kollektiv geschlechtsspezifische Unterschiede mit Werten bei Frauen im Bereich <0,28 - 3,40 μg/L und bei Männern im Bereich von < 0,28 - 1,03 μg/L. Der Glucuronidgebundene Anteil war in dieser Studie ebenfalls allerdings invers zu den Sulfat-Konjugaten bei Frauen und Männern unterschiedlich, mit Werten im Bereich von <0,28 - 4,34 μg/L (Frauen) und 0,16 - 11,67 μg/L (Männer). Ye und Kollegen [114] fanden lediglich in 14 von 30 Urinproben von U.S.-Bürgern Sulfatge-bundenes BPA mit einem Maximalwert von 1,8 μg/l (Mittelwert 0,5 μg/l), während Glucuronidgebundenes BPA in 29 Proben mit einem Maximalwert von 19,0 μg/l (Mittelwert 3,1 μg/l) nachweisbar war.
8.1.2 Andere Parameter zur Abschätzung der inneren BPA-Belastung und der biochemischen Effekte
Neben der Untersuchung der BPA-Gehalte im Urin wurden auch einige Messungen des BPA in Blut und Serum durchgeführt. Auch hierzu geben die Veröffentlichungen von Dekant und Völkel [26] und Hengstler et al. [21] eine Übersicht. Aufgrund der östrogenen Wirksamkeit von BPA konzentrierten sich die Untersuchungen im Blut vornehmlich auf Frauen im gebärfähigen Alter, schwangere Frauen und Nabelschnurblut. Viele Untersuchungen hierzu wurden unter Einsatz der ELISA-Technik durchgeführt. Dabei wurden beispielsweise für gesunde nicht schwangere Frauen BPA-Gehalte im Blut (Mittelwert ± Standardabweichung) von 2,0 ± 0,8 μg/L [115]; 0,64 ± 0,1 μg/L [116]; 0,77 ± 0,38 μg/L [117] angegeben. Im Gegensatz dazu ergaben Untersuchungen unter Einsatz der LC-MS-MS-Technik im Blut sowohl von Frauen als auch von Männern keine BPA-Gehalte oberhalb der Nachweisgrenze von 0,5 μg/L [90]. Besonders deutlich wurde die geringe Zuverlässigkeit der ELISA-Messtechnik im direkten Vergleich mit einer Kopplung aus Hochleistungsflüssigkeits-,chromatographie und Elektrochemischen Detektor [118]. Während beim Einsatz zweier ELISA-Meßsysteme auf 52 Probanden BPA-Gehalte im Blut von 0,66 ± 0,29 μg/L und 0,77 ± 0,38 μg/L gemessen wurden, war BPA unter Einsatz eines dritten ELISA-Meßsystems nicht detektierbar und beim Einsatz der HPLC-ECD-Technik ebenfalls unterhalb der Nachweisgrenzen von 0,2 μg/l. Ähnliche Diskrepanzen ergeben sich beim Vergleich der Bestimmung von BPA in Blutseren [23]. Unabhängig von der geringen analytischen Validität der meisten bisher vorliegenden Blutuntersuchungen weist BPA im Blut auch eine sehr kurze Plasma- Halbwertszeit auf (siehe dazu Kapitel Kinetik), so dass kurz nach erfolgter Resorption das Maximum nach einer bis zwei Stunden erreicht wird und danach die Gehalte schnell abfallen und im Blut deutlich unter denen im Urin liegen. Teeguarden et al. [24] erhoben bei 20 Probanden, deren BPA-Aufnahme deutlich über der durchschnittlichen BPA-Aufnahme der Bevölkerung lag, während 24 Stunden stündlich sowohl Urinals auch Serumproben zur Bestimmung der BPA-Konzentrationen. Die BPA-Gehalte im Serum waren im Mittel 42-fach geringer als die BPA-Gehalte im Urin [24]. Zudem lagen die BPA-Gehalte im Serum trotz der überdurchschnittlichen BPA-Aufnahme zu über 80% unterhalb der Nachweisgrenze. Diese Ergebnisse stehen im Einklang damit, dass bei nicht persistenten Chemikalien wie BPA üblicherweise die Konzentrationen im Urin deutlich oberhalb derer, die im Blut gemessen werden, liegen.
In einigen Studien wurde die BPA-Konzentration im Speichel untersucht [28, 119,120]. Dabei diente der Gehalt des BPA im Speichel allerdings nicht als Marker für die innere Belastung der Probanden, sondern als Absorptionsmedium für die Emissionen aus frisch erstellten dentalen Kunststofffiillungen. Untersuchungen über den BPA-Spiegel im Speichel als Surrogat für die im Blut vorliegenden BPA-Gehalte liegen nicht vor.
8.1.3 Analytische Bestimmung von BPA im Urin
Ähnlich wie bei der Anwendung auf den BPA-Gehalt des Blutes sind die zur Untersuchung der renalen BPA-Mengen entwickelten bzw. eingesetzten analytischen Verfahren hinsichtlich ihrer Zuverlässigkeit unterschiedlich zu bewerten. Für die Bestimmung von BPA im Urin wurde die ELISA-Technik allerdings deutlich seltener eingesetzt als bei den Blutuntersuchungen. Auch für diesen Parameter zeigt die vergleichende Studie von Fukata und Kollegen [118] wiederum, dass die ELISA-Technik aufgrund fehlender Spezifität nicht geeignet ist, die BPA-Konzentration in Bevölkerungsstudien richtig zu erfassen. Während der Einsatz eines LC-MS-Verfahrens zur Untersuchung von 52 Urinproben esamt-BPA-Gehalte (Mittelwert ± Standardabweichung) von 1,92 ± 1,99 μg/L ergab, wurden unter Einsatz der drei ELISA-Testsysteme Gehalte von 15,9 ± 9,9 μg/L, 16,7 ± 19,5 μg/L bzw. 18,6 ± 23,7 μg/L ermittelt.
In den meisten Fällen wurden für die Quantifizierung des BPA in Urinproben allerdings Verfahren auf der Basis gaschromatographisch oder hochleistungs- flüssigkeitschromatographischer Analysentechnik eingesetzt [23]. Grundsätzlich wurde hierbei zur Bestimmung der Gesamtmenge an frei verfügbarem und gebundenem BPA eine enzymatische Hydrolyse zur Spaltung der Konjugate verwendet.
Kim et al. [111] verwendeten zur Bestimmung der BPA-Gehalte im Urin koreanischer Frauen und Männer ein HPLC-Verfahren mit Fluoreszenzdetektion, bei dem die Proben sowohl nach enzymatischer Hydrolyse als auch ohne Hydrolyse vermessen wurden.
Die Extraktion des BPA aus der Urinphase erfolgte mit tert.-Butylmethylether.
Die Nachweisgrenze wurde auf der Basis des dreifachen Signal-Rauschverhältnisses mit 0,28 μg/l ermittelt.
Auch Schöringhumer und Cichna-Markl [113] entwickelten für die Bestimmung des BPA in Urin ein HPLC-Verfahren mit Fluoreszenzdetektion.
Allerdings verwendeten sie Sol-Gel-Enzym-Säulen für die Hydrolyse und Immunaffinitätssäulen zur Extraktion von BPA aus der Urinmatrix.
Die Nachweisgrenze für die Bestimmung von BPA in Urin wurde für dieses Verfahren mit 0,2
μg/L angegeben.
Ouchi und Watanabe [112] verwendeten eine zweidimensionale Flüssigchromatographie gekoppelt mit einem elektrochemischen Detektor (HPLC-ECD) zur Bestimmung des BPA. Die Probenaufarbeitung erfolgt sowohl nach enzymatischer Hydrolyse als auch ohne Hydrolyse und anschließender Extraktion in Diethylether.
Die Bestimmungsgrenze wurde mit dem Kalibrierkurven-Verfahren mit 0,2 μg/L ermittelt.
Auch Fukata und Mitarbeitende [118] verwendeten für ihre Untersuchungen eine HPLC-ECD-Methode, die eine Nachweisgrenze von 0,25 μg/L aufwies.
Die meisten Methoden zur Bestimmung von BPA in Urin wurden allerdings auf der Basis der GC-MS-Technik [121-124], der GC-MS-MS- Technik [96] oder LC-MS/MS-Technik [90, 114, 118] entwickelt.
Für die gaschromatographischen Methoden wurde aus der Matrix extrahiertes BPA mit Essigsäureanhydrid [123], Pentafluorbenzylbromid [121, 122, 124] oder N,O-Bis(trimethylsilyptrifluoracetamid (BSTFA) [96] derivatisiert. Dabei erfolgte die Extraktion des Analyten in der Regel mit einer klassischer Festphasenextraktion [96, 121, 122, 124]. Kawaguchi und Kollegen [123] setzten dagegen einen Adsorptionsrührstab für die Extraktion des BPA ein, der nach in-situ-Derivatisation des Analyten der Thermodesorptions-Probenaufgabetechnik zugefügt wurde. Die Nachweisgrenzen der GC-MS- und GC-MS/MS-Verfahren lagen dabei im Bereich von 0,02 μg/L bis 0,38 μg/L.
Bei den flüssigkeitschromatographischen Verfahren mit massenspektrometrischer Detektion wurde entweder auf die Extraktion der Analyten verzichtet [90, 118] oder es erfolgte eine online-Anreicherung auf einer chromatographischen Vorsäule [114, 125]. Dabei verwendete Inoue und Kollegen [125] eine Säulenschaltung, bei der nach Voranreicherung die chromatographische Trennung auf einer Gelpermeationschromatographiesäule und die Detektion im Singlequadrupol-Massensp ektrometer erfolgte. Ansonsten wurden in der Regel Triplequadrupol-Massenspektrometer zur Detektion eingesetzt. Die Nachweisgrenzen der LC-MS- und LC-MS/MS-Verfahren lagen dabei im Bereich von 0,1 μg/L bis 1,14 μg/L. Wie die meisten gaschromatographischen Verfahren werden auch die meisten flüssigchromatographischen Verfahren sowohl für die Bestimmung des freien BPA als auch für die Bestimmung der Gesamtmenge von BPA nach enzymatischer Hydrolyse eingesetzt.
Grundsätzlich ist bei der Bewertung der unterschiedlichen Analysenverfahren hervorzuheben, dass die chromatographischen Verfahren in Verbindung mit der Massenspektrometrie und insbesondere mit der Tandemmassenspektrometrie extrem hohe Substanzspezifität aufweisen, die selbst im unteren Konzentrationsbereich weitgehend erhalten bleibt. Durch den Einsatz von Isotopenmarkierten internen Standardsubstanzen wird zudem eine hohe Reproduzierbarkeit und Robustheit für die BPA-Bestimmung im Urin erreicht. Demzufolge ist der Einsatz derartiger Messverfahren zu Bestimmung des BPA bei der Untersuchung beruflich nicht belasteter Personen allen anderen Analysenverfahren vorzuziehen.
Neben den üblichen analytischen Zuverlässigkeitskriterien sind bei der Bestimmung von BPA in biologischen Materialien noch zwei weitere wesentliche Merkmale hinsichtlich der Qualität der Analytik zu beachten. Erstens führt der weit verbreitete Einsatz von Polymerisationsprodukten und Beschichtungsmitteln, die BPA enthalten können, dazu, dass BPA ubiquitär auftritt und damit bei der Analytik zu hohen Blindwerten führen kann. Zur Vermeidung von Kontaminationen sind in dem Labor, welches die Bestimmung von BPA durchführt, entsprechende Vorsichtsmaßnahmen zu ergreifen. Grundsätzlich muss im Protokoll der präanalytischen Phase sichergestellt sein, dass keine Kontamination mit BPA bereits während der Probennahme oder Probenlagerung erfolgt und es sollten immer fieldblanks mitgeführt werden. Zweitens sind für die toxikologische Bewertung von BPA-Belastungen insbesondere die Konzentrationen an freiem BPA von Interesse, da nach bisherigem Kenntnisstand die Konjugate keine oder eine deutlich geringe östrogene Wirksamkeit aufweisen. Allerdings weisen Untersuchungen von Waechter und Mitarbeitern [125] als auch von Ye et al. [127] darauf hin, dass die Konjugate des BPA in biologischem Material nicht stabil sind und nach der Probenahme je nach Lagerungs- und Transportbedingungen zumindest zu einem Teil relativ schnell zerfallen können und frei verfügbares BPA bilden können. Da sowohl bei Bevölkerungsstudien als auch beim Einsatz des HBM am Patienten nicht gewährleistet werden kann, dass Lagerungs- und Transportbedingungen und Lagerungs- und Transportzeiten eingehalten werden, die eine Zersetzung der Konjugate vermeiden, empfiehlt es sich, bei der Beurteilung von BPA-Expositionen die Gesamtmenge von frei verfügbaren und gebundenen BPA zu verwenden.
Zusammenfassend weist die Mehrzahl der vorliegenden Untersuchungen darauf hin, dass BPA im Bereich der Hintergrundbelastung der Bevölkerung fast vollständig in gebundener Form ausgeschieden wird und die Bestimmung der Konzentration des Gesamt-BPA in Urin einen zuverlässigen Parameter für die innere Belastung des Menschen darstellt, wenn die oben empfohlenen Messverfahren eingesetzt werden.
Zusammenfassend wird empfohlen im Urin sowohl frei verfügbares als auch die Summe aus frei verfügbarem und gebundenem BPA (Gesamt-BPA) zu bestimmen. Dabei kommt dem freien BPA die Bedeutung zu als Indikator einer exogenen Kontamination zu dienen. In der Regel liegen nämlich die Konzentrationen an frei verfügbarem BPA in Urin deutlich unter 1 ng/l. Höhere Werte sind ein Zeichen einer exogenen Kontamination und können ggf. zur Korrektur des Summenwertes Verwendung finden.
Generell ist bei der Bewertung von BPA-Ergebnissen zu bedenken, dass die Nachweisgrenze, auch der empfindlichsten Verfahren mit Werten zwischen 0,2 und 0,4 μg/l angegeben werden. Die Bestimmungsgrenzen können mit Werten angenommen werden, die ca. 3 mal höher liegen. Dies aber bedeutet, dass Werte unter 1,0-1,2 μg/l mit analytischen Fehlern behaftet sind, die eine sinnvolle toxikologische Bewertung nicht mehr zulassen. Dies ist insbesondere zu bedenken bei BPA-Ergebnissen im Blut, die in dieser Größenordnung liegen, und dies muss auch berücksichtigt werden bei den Werten im Urin, die nach Tabelle 9 mit GM-Werten zwischen 1,0 und 7,5 μg/l angegeben werden. Aus diesen Gründen sollten auch BPA-Analysen nur mit GC/MS/MS/ bzw. LC/MS/MS Methoden durchgeführt werden, weil allein diese Methoden ausreichend valide sind, um darauf Bewertungen aufbauen zu können.
8.2 Datenlage zur inneren Exposition der Allgemeinbevölkerung
Aufgrund der weiten Verbreitung der polycarbonathaltigen Materialien und der vielen Anwendungsbereiche von BPA ist praktisch jeder Mensch gegenüber BPA exponiert. Dies zeigen die Human-Biomonitoring-Daten aus Deutschland [26, 100, 103, 128].
Es gibt national und international nur wenige repräsentative Untersuchungen zur Belastung des Menschen mit BPA. Die aktuelle Übersicht von Dekant und Völkel [26] macht deutlich, dass der Schwerpunkt der bisherigen Untersuchungen auf der Entwicldung der analytischen Methode gelegen hat. In Deutschland im Rah- men des Kinder-Umwelt-Surveys 2003- 2006 (KUS) [99-102] und in der Umweltprobenb ank [103], in Nordamerika im Rahmen der NHANES-Studie [129] und des Canadian Health Measures Survey [130, 131] wurden umfangreichere Bevölkerungsstudien durchgeführt (vgl. Tab.9).
In allen Untersuchungen ergaben sich Belastungen in ähnlicher Größenordnung. Sowohl in den USA und Canada als auch bei den Kindern in Deutschland nimmt die BPA-Ausscheidung mit dem Lebensalter ab [132]. Die höchsten Gehalte sind bei Kindern, die jünger als 5 Jahre alt sind, zu beobachten [100].
Die amerikanischen Kollegen stellten fest, dass in nahezu allen Proben BPA nachweisbar war. Dies trifft auch in Deutschland zu, denn BPA kann in 99% der untersuchten Urine des KUS, in 100% der Mutter-Kind-Paare der Duisburg Geburtskohorte und in 96% der untersuchten Proben der Umweltprobenbank nachgewiesen werden. Dies lässt darauf schließen, dass die Exposition in den Industrieländern omnipräsent und über die Zeit relativ konstant erfolgt [103].
Der in den USA ermittelte Einfluss des Haushaltseinkommens, mit höheren BPA-Gehalten im Urin bei geringerem Einkommen, spiegelt sich an den Daten des KUS zur Abhängigkeit vom Sozialstatus nicht wider. Aber im Urin von Kindern aus Familien ohne Migrationshintergrund lässt sich im KUS ein signifikant höherer mittlerer BPA-Gehalt bestimmen als im Urin von Kindern aus Familien mit Migrationshintergrund (2,72 μg/l gegenüber 1,97 μg/l). Die Ergebnisse der Duisburg Studie zeigen ein anderes Bild: sowohl die Mütter als auch die Kinder mit deutscher Staatsangehörigkeit zeigten signifikant niedrigere BPA-Konzentration im Urin im Vergleich zu den Personen mit einer anderen Staatsangehörigkeit. Die NHANES-Studie zeigte, dass "Mexican Americans" geringere Gehalte an BPA in Urin aufweisen als die restliche Bevölkerung [129, 133].
In weiteren Studien wurden Risikogruppen untersucht wie Mutter-Kind Paare [104, 128] und Schwangere zum Zeitpunkt der Geburt bzw. Ehepaare mit Kinderwunsch [94, 105]. In einer weiteren Untersuchung wurde BPA bei Neugeborenen auf einer Intensivstation gemessen [133]. Calafat et al. [134] zeigen in einer Gruppe von Neugeborenen, dass intensivmedizinische Nutzung von PVC-Material zu einer um den Faktor 10 gegenüber der Allgemeinbevölkerung höheren Exposition führt, und dass unter diesen besonderen Bedingungen das gemessene Verhältnis von freiem BPA zu glucuronidiertem BPA im Urin ca. 1:10 beträgt.
9 Referenzwerte für BPA im Urin
Der Referenzwert (RV95) ist definiert als das 95. Perzentil der Messwerte der Stoffkonzentration in dem entsprechenden Körpermedium der jeweiligen Referenzpopulation [135, 136]. Er wird aus dem 95%-Konfidenzintervall des 95. Populationsperzentils abgleitet und möglichst als einfacher Zahlenwert angegeben. Die Berechnung der 95. Populationsperzentile und ihrer 95%-Konfidenzintervalle erfolgten nach dem nichtparametrischen Verfahren (Bootstrapping) mit der Software SPSS für Windows, Version 14.
Basierend auf den Daten des Kinder-Umwelt-Surveys 2003-06 (Tab. 10) und der Umweltprobenbank (Tab. 11) werden anhand der Kennwerte die folgenden Referenzwerte (vgl. Tab 12) abgeleitet:
Bei der Anwendung von RV95 ist grundsätzlich die analytische Messunsicherheit zu berücksichtigen, d. h. bei der Bewertung von HBM-Messwerten ist sicherzustellen, dass die Analysen unter den Bedingungen der internen und externen Qualitätsscherung durchgeführt wurden [137]. Dies zeigen die Erfahrungen aus den Ringversuchen der arbeits- und umweltmedizinischtoxikologischen Analysen, die von der Deutschen Gesellschaft für Arbeits- und Umweltmedizin durchgeführt werden [138].
Es sei nochmals ausdrücklich darauf hingewiesen, dass Referenzwerte statistisch ermittelte Werte sind, welche die obere Grenze der derzeitigen Hintergrundbelastung kennzeichnen. Sie können als Kriterien verwendet werden, um Messwerte von Einzelpersonen oder Personengruppen als "erhöht" oder "nicht erhöht" einzustufen. Eine umweltmedizinischtoxikologische Bewertung einer Belastungssituation ist anhand von RV95 nicht möglich. In der Anwendung des Vorsorgeprinzips sind RV95 aber gut geeignet um höhere und vermeidbare Expositionen zu identifizieren und damit eine Expositionsminderung nach dem ALARA-Prinzip zu veranlassen.
Maßnahmen bei Überschreitung des Referenzwertes
In den Fällen, in denen der RV95 überschritten ist, sind Kontrollmessungen angezeigt. Extrem verdünnte oder konzentrierte Urinproben sind für Kontrolluntersuchungen auszuschließen [139]. Zuverlässige und bestätigte Überschreitungen der RV95 sollten Anlass für eine umweltmedizinische Quellensuche im Rahmen der Verhältnismäßigkeit sein.
Als verbrauchernahe Quellen für BPA kommen Lebensmittel und Bedarfsgegenstände in Frage [30]. Wie bereits in der Eirdeitung beschrieben wurde, erfolgt die Hauptbelastung der Allgemeinbevölkerung über Lebensmittel und Getränke, die in Kunststoffgefäßen oder in innenbeschichteten Dosen aufbewahrt werden.
10 Ableitung von HBM-Werten für BPA im Urin
Für die Ableitung von HBM-Werten auf der Basis tolerabler Aufnahmemengen hat die HBM-Kommission [140, 141] ein einfaches Berechnungsverfahren zusammen mit einem Kriterienkatalog für erforderliche Informationsgrundlagen erarbeitet. In der Ableitung werden folgende Bedingungen voraus gesetzt: (a) Der Ableitung soll ein fachlich anerkannter und wissenschaftlich begründeter ADI- oder TDI-Wert zu Grunde liegen, (b) der Metabolismus und die Kinetik der betrachteten Substanz sollen bekannt sein, (c) Alters- und Geschlechtsunterschiede sollen bezüglich ihres Einflusses auf die Exposition und mögliche gesundheitliche Effekte berücksichtigt werden, und (d) zur Abschätzung der inneren Belastung muss ein diagnostisch zuverlässiger Biomarker zur Verfügung stehen ebenso wie ein zuverlässiges analytisches Verfahren zu seiner Bestimmung.
Der NOAEL von 5 mg/kg KG/Tag für BPA wurde 2006 von der EFSA auf der Basis von Tierversuchen abgeleitet [76] und zuletzt 2011 [80] bestätigt. Unter Anrechnung eines Unsicherheitsfaktors von 100 wurde ein TDI von 0,05 mg/kg KG/ Tag von der EFSA festgelegt. Das BfR [78] unterstützte die Position der EFSA, ebenso die Beratergruppe der DGPT [21].
Die HBM-Kommission weist in Kenntnis jüngerer Arbeiten, die im Bereich der Hintergrundbelastung Assoziationen mit adversen Effekten gefunden haben, deren Bedeutung jedoch noch nicht für eine endgültige Risikobewertung abgeschätzt werden kann, daraufhin, dass im Falle einer Revision des TDI-Bezugswertes eine Neubewertung durch die HBM-Kommission vorgenommen wird.
Die biologische Wirkung von BPA ist auf den frei verfügbaren, nicht gebundenen Stoff im Zielorgan zurück zu führen. Wie diese Konzentration mit den Blutkonzentrationen beim Menschen korrespondiert, ist weitgehend ungeklärt, da die Konzentrationen von frei verfügbarem BPA meist unterhalb der Nachweisgrenzen liegen.
In dieser Ableitung eines TDI-basierten HBM-Wertes wird nicht zwischen frei verfügbarem und gebundenem BPA im Urin unterschieden, da ausgehend von einer "tolerierbaren" oralen BPA-Gesamtaufnahme die erwartete Summe des BPA im Urin berechnet wird.
Unter Anwendung des von der HBM-Kommission vorgeschlagenen Verfahrens zur Ableitung von HBM-Werten [140, 141] wurden aus dem EFSA-TDI [76] für den HBM-Parameter (frei verfügbares und gebundenes BPA = Gesamt-BPA) folgende HBM-I-Werte abgeleitet (vgl. Tab. 13):
Kinder: 1,5 mg BPA /1 Urin
Erwachsene: 2,5 mg BPA /1 Urin
Die Berechnung setzt voraus, dass der oralen BPA-Aufnahme eine nahezu vollständige renale Elimination entspricht und dass die Annahmen über die mittleren altersspezifischen Urinausscheidungsmengen die Spannweite der Unterschiedlichkeit hinreichend abdecken. Eine berücksichtigte höhere körpergewichtsbezogene Urinausscheidung bei Kindern und Jugendlichen geht im Vergleich zu Erwachsenen mit einer höheren Aufnahme von Trinkwasser bzw. Getränken einerseits und einer höheren Aufnahme von Lebensmitteln einher. Die Daten der KUS-Studie [100] zeigen ebenso wie die Ergebnisse aus der Analyse der NHANES-Studie [129], dass Kinder höhere BPA-Gehalte über den Urin ausscheiden als Heranwachsende und Erwachsene. Eine höhere BPA-Konzentration im Urin von Kindern kann durch ihre bezogen auf das Körpergewicht höhere Aufnahmemenge von Lebensmitteln, Trinkwasser bzw. Getränken sowie einer höheren Atemrate erklärt werden. Die belegten Belastungsunterschiede könnten jedoch auch durch altersbedingte Abweichungen in der Absorption, Verteilung, Kinetik und Ausscheidung beeinflusst werden [133].
Zusammenfassende Bewertung Die angesprochenen Kontroversen, Unsicherheiten und offenen Fragen [72, 142- 147] im Zusammenhang mit tierexperimentellen Befunden unterhalb des TDI [29, 148-158], vermuteten epigenetischen Mechanismen [159-161] sowie die Assoziationen von Effekten mit BPA-Expositionen in Querschnittstudien, die teilweise mit tierexperimentellen Beobachtungen übereinstimmen [48-51, 162-168] haben bereits zur Anwendung des "Vorsorgeprinzips" ("precautionary principle") geführt, wie die Entscheidung der EU-Kommission zu "Babyflaschen" [15] und die geplante Überprüfung der Risikobewertung durch EFSA und FDA zeigen. Das Ergebnis dieser Überprüfung bleibt abzuwarten.
Für die praktische Anwendung des Human-Biomonitorings empfiehlt die Kommission eine Bewertung anhand der Referenzwerte. Konkrete Empfehlungen zur Verminderung einer inneren BPA-Belastung können nicht angegeben werden. Als Quellen werden vom BfR benannt: Die Substanz kann in Gegenständen aus Polycarbonat enthalten sein, auch in solchen, die mit Lebensmitteln in Kontakt kommen. Beispiele dafür sind Trinkflaschen (früher auch Babyfläschchen) oder Geschirrteile. Bisphenol A wird auch in der Innenbeschichtung voil Konservendosen verwendet. Außerdem wird Bisphenol A als Farbbildner in sogenannten Thermopapieren für Thermodrucker und -faxgeräte eingesetzt [169].
Danksagung
Die Kommission dankt Herrn Dr. Wolfgang Heger, Berlin, und Herrn Prof. Dr. Birger Heinzow, Kiel, für die Erarbeitung der Stellungnahme und den Herrn Prof. Dr. Jürgen Angerer und Dr. Holger M. Koch, Bochum, für die kritischen Hinweise und fachlichen Ergänzungen.
Literatur
1. EU (2008) Updated European Risk Assessment Report 4,4'-lsopropylidenediphenol (bisphenol-A). Environment Addendum of February 2008 (to be read in conjunction with published EU RAR of BPA, 2003) http://ecb.jrcit/documents/Existing-Chemicals/RISK_ASSESSMENT/ADDENDUM/bisphenola_ add_325.pdf
2. von Goetz N, Wormuth M, Scheringer M, et al. (2010) Bisphenol A: How the Most Relevant Exposure Sources Contribute to Total Consumer Exposure. Risk Analysis 30: 473-487
3. BGIA (2009) Institut für Arbeitsschutz der Deutsch Gesetzlichen Unfallversicherung. Gefahrstoffinformationssystem GESTIS-Stoffdatenbank. Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung http://www.dguv.de/bgia/de/gestis/stoffdb/indexjspli
4. Alonso-Magdalena P, Laribi 0, Ropero AB, et al. (2005) Low doses of bisphenol A and diethylstilbestrol impair Ca2+ signals in pancreatic alphacells through a nonclassical membrane estrogen receptor within intact islets of Langerhans. Environ Health Perspect 113: 969-977
5. Alonso-Magdalena P, Ropero AB, Soriano S, et al. (2012) Bisphenol-A acts as a potent estrogen via nonclassical estrogen triggered pathways. Mol Cell Endocrinol. 355(2):201-7
6. Matsushima A, Kakuta Y, Teramoto T, et al. (2007) Structural evidence for endocrine disruptor bisphenol A binding to human nuclear receptor ERR gamma.J Biochem 142: 517-524
7. Nadal A, Ropero AB, La ribi 0, Maillet M, Fuentes E and Soria B. (2000) Nongenomic actions of estrogens and xenoestrogens by binding at a plasma membrane receptor unrelated to estrogen receptor alpha and estrogen receptor beta. Proc Natl Acad Sci USA 97: 11603-11608
8. Okada H, Tokunaga T, Liu X, et al. (2008) Direct evidence revealing structural elements essential for the high binding ability of bisphenol A to human estrogenrelated receptorgamma. Environ Health Perspect 116: 32-38
9. Ryan KK, Haller AM, Sorrell JE, Woods SC, Jandacek FU, Seeley RJ. (2010) Perinatal exposure to bisphenol-a and the development of metabolic syndrome in CD-1 mice. Endocrinology. 151: 2603-12
10. EFSA (2010) Scientific Opinion on Bisphenol A: evaluation of a study investigating its neurodevelopmental toxicity, review of recent scientific literature on its toxicity and advice on the Danish risk assessment of Bisphenol A. EFSA Journal 8: 1829 [116 PP.]
11. FAO/WHO (2011) Toxicological and Health Aspects of Bisphenol A. Report ofJoint FAO/WHO Expert Meeting to review toxicological and health aspects of bisphenol A. World Health Organization. Food and Agriculture Organization of the United Nations. ISBN 978 92 14 156427 4
12. Hamburg MA (2010) Commissioner of Food and Drugs - Remarks at the Food and Drug Law Institute April 21, http://www.fda.gov/NewsEvents/ Speeches/ucm209414.htm
13. Mutti A. (2012) Final Report August 2010 -July 2011, CT/EFSA/CEF/2010/01
14. ECHA- European Chemical Agency (2012) ECHA-Aktionsplan: http://echa.europa.eu/web/guest/informationon-chemicals/evaluation/communityrollingactionplan/coraplistof-substances
15. Europäische Kommission (2011) Richtlinie 2011/8/ EU der Kommission zur Änderung der Richtlinie 2002/72/EG hinsichtlich der Beschränkung der Verwendung von Bisphenol A in Säuglingsflaschen aus Kunststoff. Amtsblatt der Europäischen Union; L 26/11-L26/14
16. Simoneau C, Van den Eede L, Valzacchi S. Identification and quantification of the migration of chemicals from plastic baby bottles used as substitutes forpolycarbonate. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 2012 Mar;29(3):469- 80
17. Schneyer A. (2011) Getting Big on BPA: Role for BPA in Obesity? Endocrinology 152: 3301-3303
18. Beronius A, Ruden C, Hanberg A, et al. (2009) Health risk assessment procedures for endocrine disrupting compounds within different regulatory frameworks in the European Union. Regul Toxicol Pharmacol 55: 111-122.
19. Calafat A. (2011) Background Paper on BPA Biomonitoring and Biomarker Studies. FAO/WHO Expert Meeting on Bisphenol A (BPA) Ottawa, Canada, 2-5 November 2010. Prepared by A. Calafat. World Health Organization, Geneva
20. Chapin RE, Adams J, Boekelheide K, et al. (2008) NTP-CERHR expert panel report on the reproductive and developmental toxicity of bisphenol A. Birth Defects Res B Dev Reprod Toxicol 83: 157-395
21. Hengstler 1G, Foth H, Gebel T, et al. (2011) Critical evaluation of key evidence on the human health hazards of exposure to bisphenol A. Crit Rev Toxicol 41: 263-291
22. Rubin BS. (2011) Bisphenol A: an endocrine disruptor with widespread exposure and multiple effects. 1 Steroid Biochem Mol Biol. 127: 27-34
23. Völkel W, Kiranoglu M and Fromme H. (2008) Determination of free and total bisphenol A in human urine to assess daily uptake as a basis for a valid risk assessment.Toxicol Lett 179: 155-162
24. Teeguarden JG, Calafat AM, Ye X, et al. (2011) Twenty-four hour human urine and serum profiles of bisphenol a during highdietary exposure.Toxicol Sci 123: 48-57
25. Völkel W, Kiranoglu M, Fromme H. (2011) Determination of free and total bisphenol A in urine of infants. Environ Res. 111: 143-8
26. Dekant D, Völkel W (2008) Human exposure to bisphenol A: Methods, results and assessment of environmental exposures.Toxicol. Appl. Pharmocol. 228:114-134
27. Fleisch AF, Sheffield PE, Chinn C et al. (2010) Bisphenol A and related compounds in dental materials. Pedriatrics 126:760-768
28. Joskow R, Barr DB, BarrJR, Ca lafat A, Needham LL and Rubin C. (2006) Exposure to bisphenol A from bisglycidyl dimethacrylatebased dental sealants. JADA 137: 353-362.
29. Vandenberg LN, Maffini MV, Wadia PR, Sonnenschein C, Rubin BS and Soto AM. (2007) Exposure to environmentally relevant doses of the xenoestrogen bisphenol-A alters development of the fetal mouse mammary gland. Endocrinology 148: 116-127
30. Umweltbundesamt Dessau (2010) Bisphenol A-Massenchemikalie mit unerwünschten Nebenwirkungen. http://www.umweltbundesamt.de/ubainfomedien/mysql_medien.php?anfrage=Kennummer&Suchwort=3782
31. Hessisches Landesamt für Umwelt und Geologie 2011 http://www.hlug.de/start/wasser/fliessgewaesserchemie/spurenstoffe/weiterespurenstoffe/bisphenol-a.htm126 Dekant D, Völkel W (2008)Human exposure to bisphenol A by biomonitoring: Methods, results and assessment of environmentalexposures. Toxicol. Appl. Pharmacol. 228: 114-134
32. EU (2003) EU Risk Assessment Report 4,4'-lsopropylidenediphenol (Bisphenol-A). 3rd Priority List, Volume 37, http://ecbjrcit/DOCUMENTS/Existing-Chemicals/RISK_ASSESSMENT/REPORT/bisphenolareport325.pdf
33. Umweltbundesamt Wien (2010) Fact Sheet, Alkylphenole und Bisphenol A und Bisphenol F, Update: 26.08.2010 http://www.umweltbundesamtat/umweltsituation/schadstoff/schadstoffe_einleitung/bpa/
34. Biedermann S, Tschudin P and Grob K. (2010) Transfer of bisphenol A from thermal printer paper to the skin. Anal Bioana I Chem 398: 571-576
35. Mielke H, Partosch F and Gundert-Remy U. (2011) The contribution of dermal exposure to the internal exposure of bisphenol A in man.Toxicol Lett. 204:190-8
36. CERHR (2007) NTP-CERHR Expert Panel Report on the Reproductive and Developmental Toxicity of Bisphenol A. NTP-CERHR-BPA-07; http:// cerhcniehs.nih.govichemicals/bisphenol/BPAFina-lEPVF112607.pdf.
37. Seto H, Salto I, Uehara S and Fujii T (2001) Determination of bisphenol A in air by gas chromatographymass spectrometry as trimethylsilyl derivative. Annual Report of Tokyo Metropolitan Research Laboratory of Public Health 52: 208-212
38. Saito I , Onuki A, Seto H, Uehara S and Kano I. (2003) Survey of Indoor Air Chemicals (Plasticizers, Pesticides and Bisphenol A): July 2001-March 2002. Annual Report of Tokyo Metropolitan Institute of Public Health 54: 253-261
39. Umweltbundesamt Wien (2004) Hausstaub - Ein Indikator für Innenraumbelastung. Berichte BE-258 http://www.umweltbundesamt.at/fileadmin/site/ publikationen/BE258.pdf
40. Loganathan SN and Kannan K. (2011) Occurrence of bisphenol A in indoor dust from two locations in the eastern United States and implications for human exposures. Arch Environ Contam Toxicol 61: 68-73
41. EC, European Commission (2002) Final opinion of the Scientific Committee on Food on Bisphenol A SCF/CS/PM/3936. http://ec.europa.eu/food/fs/sc/scf/out128_en.pdf
42. Safe S. (2000) Bisphenol A and Related Endocrine Disruptors.Toxicol.Sci. 56: 251-252
43. SKLM (1998) Senatskommission zur Beurteilung der gesundheitlichen Unbedenklichkeit von Lebensmitteln (SKLM), Hrsg., Hormonell aktive Stoffe in Lebensmitteln, Wiley-VCH: Weinheim.
44. Wozniak AL, Bulayeva NN and Watson CS. (2005) Xenoestrogens at Picomolar to Nanomolar Concentrations Trigger Membrane Estrogen Receptoralpha-Mediated Ca++ Fluxes and Prolactin Release in GH3/B6 Pituitary Tumor Cells. Environmental Health Perspectives 113: 431-439
45. Li DK, Zhou Z, Miao M, et al. (2010a) Relationship between urine bisphenol-A level and declining male sexual function.J Androl. 31: 500-6
46. Li D, Zhou Z, Qing D, et a I. (2010b) Occupational exposure to bisphenol-A (BPA) and the risk of selfre-ported male sexual dysfunction. Hum Reprod. 25: 519-27
47. Li DK, Zhou Z, Miao M, et al. (2011) Urine bisphenol-A (BPA) level in relation to semen quality. Fertility and Sterility 95: 625-30.e4
48. Lang IA, Ga lloway TS, Scarlett A, et al. (2008) Association of urinary bisphenol A concentration with medical disorders and laboratory abnorma lities in adults. JAMA 300: 1303-1310
49. Miao M, Yuan W, He Y, et al. (2011a) In utero exposure to bisphenol-A and anogenital distance of male offspring. Birth Defects Res A Clin Mol Teratol 91: 867-872
50. Miao M, Yuan W, Zhu G, et al. (2011b) In utero exposure to bisphenol-A and its effect on birth weight of offspring. Reprod Toxicol 32: 64-68
51. Braun JM, Yolton K, Dietrich KN, et al. (2009) Prenatal bisphenol A exposure and early childhood behavior. Environ Health Perspect 117: 1945-1952
52. Braun JM, Kalkbrenner AE, Calafat AM, et al. (2011) Variability and predictors of urinary bisphenol A concentrations during pregnancy. Environ Health Perspect 119: 131-137
53. Haig hton L, Card JW, Lynch B, et al. (2012) Bisphenol a and infant neonatal neurobehavior. Environ Health Perspect 120: a102
54. Klingmüller D and Allera A (2011) Endocrine disruptors: hormoneactive chemicals from the environment: a risk to humans? Dtsch Med Wochenschr 136: 967-972
55. Sathyanarayana S, Braun J, Yolton K, et al. (2012) Bisphenol a and infant neonata I neurobehavior: Respond. Environ Health Perspect 120: a102-103
56. Sharpe RM. (2010) Is it time to end concerns over the estrogenic effects of bisphenol A? Toxicol Sci 114:1-4
57. Sharpe RM. (2010) Bisphenol A exposure and sexual dysfunction in men: editorial commentary on the article 'Occupational exposure to bisphenol-A (BPA) and the risk of selfreported male sexual dysfunction'. Hum Reprod. 25: 292-4
58. Sharpe RM und Drake AJ. (2010) Bisphenol a and metabolic syndrome. Endocrinology 151: 2404- 2407
59. Aylward LL, Kirman CR, Adgate JL, McKenzie LM and Hays SM (2012) Interpreting Variability in Population Biomonitoring Data: Role of Elimination Kinetics. J. Exp. Sci. Environ. Epidemiol, May 2012; doi: 10.1038/jes.2012.35
60. Tyl RW, Myers CB, Marr MC, et al. (2002) Threegeneration reproductive toxicity study of dietary bisphenol A in CD Sprague-Dawley rats.Toxicol Sci 68:121-146
61. Tyl RW. (2003) Bisphenol A: findings of a multigenerational rat study. Environ Health Perspect 111: A632
62. Tyl RW, Myers CB, Marr MC, et a I. (2008) Twogeneration reproductive toxicity study of dietary bisphenol A in CD-1 (Swiss) mice.Toxicol Sci 104: 362-384
63. Cox KH, Gatewood JD, Howeth C, et al. (2010) Gestational exposure to bisphenol A and crossfostering affect behaviors in juvenile mice. Horm Behav 58: 754-761
64. Jabrevid E, Sieli PT, Twellman EE, et al. (2011) Disruption of adult expression of sexually selected traits by developmental exposure to bisphenol A. Proc Natl Acad Sci U S A 108: 11715-20
65. Jenkins S, Wang J, Eltoum I, et al. (2011a) Chronic oral exposure to bisphenol A results in a nonmonotonic dose response in mammary carcinogenesis and metastasis in MMTV-erbB2 mice. Environ Health Perspect 119: 1604-1609
66. vom Saal FS, Nagel SC, Coe BL, Angle BM and Taylor JA. (2012) The estrogenic endocrine disrupting chemical bisphenol A (BPA) and obesity. Mol Cell Endocrinol, May 6;354(1-2):74-84
67. Wei J, Lin Y, Li Y, et al. (2011) Perinatal exposure to isphenol A at reference dose predisposes offspring to metabolic syndrome in adult rats on a highfat diet. Endocrinology. 152: 3049-61
68. Wolstenholme JT, Rissman EF and Connelly JJ. (2011a) The role of Bisphenol A in shaping the brain, epigenome and behavior. Horm Behav 59: 296-305
69. Wolstenholme JT, Taylor JA, Shetty SR, et a I. (2011b) Gestational exposure to low dose bisphenol A alters social behavior in juvenile mice. PLoS One 6: e25448
70. Gies A, Heinzow B, Dieter HH and Heindel J. (2009) Bisphenol a Workshop of the German Federal Environment Agency - March 30-31, 2009 work group report: public health issues of bisphenol a. Int Hyg Environ Health 212: 693-696
71. Stump DG, Beck IVU, Radovsky A, et a I. (2010) Developmental neurotoxicity study of dietary bisphenol A in Sprague-Dawley rats.Toxicol Sci. 115: 167-82
72. Vandenberg LN, Maffini MV, Sonnenschein C, et al. (2009) Bisphenol-A and the great divide: a review of controversies in the field of endocrine disruption. Endocr Rev 30: 75-95
73. vom Saal FS, Akingbemi BT, Belcher SM, et a I. (2007) Chapel Hill bisphenol A expert panel consensus statement: integ ration of mechanisms, effects in animals and potential to impact human health at current levels of exposure. Reprod Toxicol 24:131-138
74. FDA (2008) Science Board Subcommittee on Bisphenol_A: Scientific Peer-Review of the Draft Assessment of Bisphenol-A (BPA) for use in Food Contact Applications. Report Draft version
75. FDA (2010) U.S.Food and Drug Administration. (2010). Update on Bisphenol A (BPA) for Use in Food. http://www.fda.gov/NewsEvents/ Public HealthFocus/ucm064437.htm
76. EFSA (2006) Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food on a request from the Commission related to Bisphenol A. EFSA Journal 428: 1-75
77. Leranth C., Hajszan T., Szigeit-Buck K. et a I. (2008) Bisphenol A prevents the synaptogenic response to estradiol in hippocampus and prefrontal cortex of ovariectomized nonhuman primates. PNAS 105: 14187-14191
78. BfR (2008) Neue Studien zu Bisphenol A stellen die bisherige Risikobewertung nicht in Frage Information Nr. 036/2008 des BfR
79. Arnich N, Canivenc-Lavier MC, Kolf-Clauw M, et al. (2011) Conclusions of the French Food Safety Agency on the toxicity of bisphenol A. Int J Hyg Environ Health 214: 271-5
80. EFSA (2011) Agreed joint report of EFSA and ANSES according to Article 30 of the Regulation (EC) No 178/2002 on Bisphenol A (BPA)
81. Willhite CC, Ball GL and McLellan CJ. (2008) Derivation of a bisphenol A oral reference Dose (RfD) and drinkingwater equivalent concentration. J Toxicol Environ Health Part B 11: 69-146
82. Spivey A. (2009) RESEARCH ISSUES AND INITIA-TIVES: NIEHS funds human BPA research. Environ Health Perspect. 117: A541
83. Carwile JL, Luu HT, Bassett LS, et al. (2009) Polycarbonate bottle use and urinary bisphenol A concentrations. Environ Health Perspect 117: 1368-1372
84. Kleywegt S, Pileggi V, Yang P, Hao C, Zhao X, Rocks C, Thach S, Cheung P, Whitehead B (2011) Pharmaceuticals, hormones and bisphenol A in untreated source and finished drinking water in Ontario, Canada - Occurrence and treatment efficiency. Science of the Total Environment 409 (2011) 1481- 1488
85. Protokoll der 8. Sitzung der Trinkwasserkommission v. 2.3.2010; http://www.umweltdaten.de/wasser/themen/trinkwasserkommission/twk_ergebnisprotokoll_9_sitzung_02_03_10.pdf
86. Marquet F, Payan JP, Beydon D, Wathier L, Grandclaude MC and Ferrari E. (2011) In vivo and ex vivo percutaneous absorption of [14gbisphenol A in rats: a possible extra polation to human absorption? Arch Toxicol. 85: 1035-43
87. SCOEL (2004) Recommendation from Scientific Committee on Occupational Exposure Limits for Bisphenol A. Document is available at: http://ec.europa.eu/employment_social/health_safety/docs/ sum_113.pdf
88. Sathyanarayana S, Braun JM, Yolton K, et al. (2011) Case report: high prenatal bisphenol a exposure and infant neonatal neurobehavior. Environ Health Perspect. 119: 1170-1175
89. Völkel W, Colnot T, Csanady GA, Filser JG and Dekant W (2002) Metabolism and kinetics of bisphenol A in humans at low doses following oral administration. Chem Res Toxicol 15: 1281-1287
90. Völkel W, Bittner N and Dekant W. (2005) Quantitation of bisphenol A and bisphenol A glucuronide in biological samples by high performance liquid chromatographytandem mass spectrometry, Drug. Metab. Dispos. 33: 1748-1757
91. Miyamoto K and Kotake M. (2006) Estimation of daily bisphemol A intake of Japanese individuals with emphasis on uncertainty and variability. Environ. Sciences 13: 15-29
92. Christensen K L. L, Lorber M, Koch H M., Kolossa-Gehring M, Morgan M K. (2012) Population Variability of Phthalates Metabolites and Bisphenol 1 A Concentrations in Spot Urine Sam ples Versus 24- or 48-hour Collections Running Head:Variability of Phthalate, BPA concentrations. Journal of Exposure Analysis and Environmental Epidemiology
93. Teitelbaum SL, Britton JA, Ca lafat AM, et al. (2008) Temporal variability in urinary concentrations of phthalate metabolites, phytoestrogens and phenols among minority children in the United States. Environ. Research 106: 257-269
94. Mahalingaiah S, Meeker JD, Pearson KR, et al. (2008) Tem poral variability and predictors of urinary bisphenol A concentrations in men and women. Environ Health Perspect 116: 173-178.
95. Ye X, Wong LY, Bishop AM, et al. (2011) Variability of urinary concentrations of bisphenol A in spot sa mples, first morning voids, and 24-hour collections. Environ Health Perspect 119: 983-988
96. Arakawa C, Fujimaki K, Yoshinaga J, 'mai H, Serizawa S and Shiraishi (2004) Daily urinary excretion of bisphenol A. Environ. Health Prev. Med. 9: 22-26
97. Nepomnaschy PA, Baird DD, Weinberg CR, et al. (2009) Withinperson variability in urinary bisphenol A concentrations: measurements from specimens after longterm frozen storage. Environ Res 109: 734-737
98. LaKind JS and Naiman DA (2008) Bisphenol A (BPA) daily intake in the United States: Estimates from the 20032004 NHANES urinary PBA data. Journal of Exposure Science ans Environmental Epidemiology 18: 608-615
99. Becker K, Müssig-Zufika M, Conrad A, Lüdecke A, Schulz C, Seiwert M, Kolossa-Gehring M (2007) Kinder-Umwelt-Survey 2003/06 -KUS- Human-Biomonitoring. Stoffgehalte in Blut und Urin der Kinder in Deutschland. WaBoLu-Hefte 01/07, ISSN 1862- 4340. Umweltbundesamt, Dessau-Roßlau
100. Becker K, Göen T, Seiwert M, Conrad A, Pick-Fuß H, Müller J, Wittassek M, Schulz C, Kolossa-Gehring
M. (2009) GerES IV: Phthalate metabolites and bisphenol A in urine of German Children. Int J Hygiene Environ Health (212):685-692
101. Schulz C, Seiwert M, Becker K, Conrad A, Kolossa-Gehring M (2008) Der Kinder-Umwelt-Survey (KUS) 2003-2006: Stichprobe und Studienbeschreibung. Umweltmed Forsch Prax 13 (6), 379 - 390
102. Schulz C, Seiwert M, Babisch W, Becker K, Conrad A, Szewzyk R, Kolossa-Gehring M (2012) Overview of the study design, participation and field work of the German Environmental Survey on Children 2003-2006 (GerES IV). Int. Hyg. Environ. Health 215 (2012) 435- 448
103. Koch HM, Kolossa-Gehring M, Schroeter-Kermani C, Angerer J and Brüning T. (2012) Bisphenol A in 24-hour urine and plasma samples of the German Environmental Specimen Bank from 1995 to 2009: A retrospective exposure assessment. Journal of Exposure Science and Environmental Epidemiology, 23 May 2012, doi: 10.1038/jes.2012.39
104. Schönfelder G, Wittfoht W, Hopp H, Talsness CE, Paul M and Chahoud I. (2002) Parent bisphenol A accumulation in the human maternalfetalplacental Unit. Environ Health Perspect 110: 703-707
105. Padmanabhan V, Siefert K, Ransom S, et al. (2008) Materna' bisphenol-A levels at delivery: a looming problem? J.Perinatol 28: 258-263
106. Ginsberg G and Rice DC. (2009) Does Rapid Metabolism Ensure Negligible Risk from Bisphenol A? Environmental Health Perspectives 117: 1639-1643
107. Doerge DR, Twaddle NC, Woodling KA, et al. (2010) Pharmacokinetics of bisphenol A in neonatal and adult rhesus monkeys.Toxicol Appl Pharmacol 248: 1-11
108. Doerge DR, Twaddle NC, Vanlandingham M, et al. (2011) Pharmacokinetics of bisphenol A in neonatal and adult CD-1 mice: interspecies comparisons with Sprague-Dawley rats and rhesus monkeys. Toxicol Lett 207:298-305
109. Fisher JW, Twaddle NC, Vanlandingham M, et al. (2011) Pharmacokinetic modeling: prediction and evaluation of route dependent dosimetry of bisphenol A in monkeys with extra polation to humans.Toxicol Appl Pharmacol 257: 122-136
110. Sieli PT, Jabrevic E, Warzak D, Aet al. (2011) Comparison of serum bisphenol A concentrations in mice exposed to bisphenol A through the diet versus oral bolus exposure. Environ Health Perspect. 119:1260-5
111. Kim VH, Kim CS, Park S, Han SY, Pyo MY and Yang M. (2003) Gender differences in the levels of bisphenol A metabolites in urine. Biochem. Biophys. Res. Commun. 312: 441-448
112. Ouchi K and Watanabe S. (2002) Measurement of bisphenol A in human urine using liquid chromatography with multichannel coulometric electrochemical detection. J. Chrom. B 780:365-370
113. Schöringhumer K and Cichna-Markl M. (2007) Sample cleanup with solgel enzyme and immunoaffinity columns for the determination of biphenol A in human urine. J. Chrom. B 850:361-369
114. Ye X, Kuklenyik Z, Needham LL and Calafat AM. (2005) Quantification of urinary conjugates of bisphenol A, 2,5-dichlorophenol, and 2-hydroxy-4- methoxybenzophenone in humans by online solid phase extractionhigh performance liquid chromatographytandem mass spectrometry. Anal. Bioanal. Chem. 383: 638-644
115. lkezuki Y, Tsutsumi 0, Takai Y, Kamel Y and Taketani Y (2002) Determination of bisphenol A concentrations in human biological fluids reveals significant early prenatal exposure. Hum. Reprod. 17: 2839-2841
116. Takeuchi T and Tsutsumi 0. (2002) Serum bisphenol A concentrations showed gender differences, possibly linked to androgen levels. Biochem. Biophys. Res. Commun. 291: 76-78
117. Sugiura-Ogasawara M, Ozaki Y, Sonta S, Makino T and Suzumori K. (2005) Exposure to bisphenol A is associated with recurrent miscarrige. Hum. Reprod. 20: 2325-2329
118. Fukata H, Miyagawa H, Yamazaki N, Mori C. (2006) Com parison of ELISA- and LC-MS-based methodologies for the exposure assessment of bisphenol A.Toxicol. Mech. Meth. 16: 427-430
119. Fung EYK, Ewoldsen NO, St. German HA, et al. (2000) Pharmacokinetics of bisphenol A released from dental sealant. J. Am. Dent. Assoc. 131: 51-58
120. Zafra A, Del Olmo M, Pulgar R, Navalon A and Vilchez JL (2002) Determination of bisphenol A and related compounds in human saliva by gas chromatographymass spectrometry.Chromatographia 56: 213-218
121. Calafat AM, Kuklenyik Z, Reidy JA, Caudill SP, Ekong J and Needham LL. (2005) Urinary concentrations of bisphenol A and 4-Nonylphenol in a human reference population. Environ. Health Perspect. 113: 391-395
122. Deutsche Forschungsgemeinschaft (2008) Bisphenol A - Bestimmung in Urin. In: Analytische Methoden, Band 2, Analysen in biologischem Material, 18. Lieferung, WILEY-VCH, Weinheim
123. Kawaguchi M, Sakui N, Okanouchi N, et al. (2005) Stir bar sorptive extraktion with in situ derivatization and thermal desorptiongas chromatographymass spektrometry for measurement of phenolic xenoestrogens in human urine samples. J. Chrom. 820: 49-57
124. Tsukioka T, Brock J, Graiser S, Nguyen J, Na kazawa H and Ma kino T (2003) Determination of trace amounts of bisphenol A in urine by negativeion chemicalionizationgas chromatography/mass spectrometry. Anal. Sci. 19:151-153
125. lnoue K, Kawaguchi M, Funakoshi Y and Nakazawa H (2003) Sizeexclusion flow extraction of bisphenol A in human urine for liquid chromatographymass spectrometry. J. Chrom. 798: 17-23
126. Waechter JM, Domordzki JY, Thornton CM and Markham DA. (2007) Factors affecting accuracy of bisphenol A and bisphenol A-monoglucuronide estimates in mamalian tissue and urine samples. Toxicol. Mech. Method 17: 13-24
127. Ye X, Bishop AM, Reidy JA, Needham LL and Calafat AM. (2007) Tem poral stability of the conjugated species of bisphenol A, parabens, and other environmental phenols in human urine. J. Exp. Sci. Enivron. Epidemiol. 17:567-572
128. Kasper-Sonnenberg M, KochHM, WittsiepeJ, Wilhelm M, Fromme H (2012) Determination of Bisphenol A in urine from childmother pairs - Results from the Duisburg birth cohort study. Journal of Toxicology and Environmental Health, Part A Estimated Publication date - 30 May 2012 (Online), D011 0.1080/15287394.2012.674907
129. CDC (2012) centers of Disease Control and Prevention (CDC) Fourth National Report on Human Exposure to Environmental Chemicals, Updated Tables, February 2012. http://www.cdc.gov/exposurereport/
130. Haines DA and Murray J. (2012) Human Biomonitoring of environmental chemicals - Early results of the 200-2009 Canadian Health Measure Survey for males and females. Int. J. Hyg. Environ. Health 215: 133-137
131. Health Canada (2010) Report on Human Biomonitoring of Environmental Chemicals in Canada. Results of the Canadian Health Measure Survey Cycle 1 (2007-2009). http://www.hcsc.gc.ca/ewhsemt/ pubs/contaminants/chmsecms/indexeng.php
132. Mielke H and Gundert-Remy U. (2009) Bisphenol A levels in blood depend on age and exposure.Toxicol Lett 190:32-40
133. Calafat AM, Ye, X, Wong LJ, Reidy JA and Needham LL. (2008) Exposure of the U.S. Population to Bisphenol A and 4-tertiary-Octylphenol: 2003-- 2004. Environmental Health Perspectives, 116: 39-
134. Calafat AM, Weuve J, Ye X, et al. (2009) Exposure to bisphenol A and other phenols in neonatal intensive care unit premature infants. Environ Health Perspectives 117: 639-644.
135. HBM-Kommission (1996) Konzept der Referenz- und Human-Biomonitoring-Werte (HBM) in der Umweltmedizin. Bundesgesundheitsblatt 39: 221- 224
136. HBM-Kommission (2009) Addendum zum Konzept der Referenz- und Human-Biomonitoring-Werte (HBM) in der Umweltmedizin. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 52: 874-877
137. AngererJ, Ewers U and Wilhelm M (2007) Human Biomonitoring: state of the art. Int. J. Hyg. Environ. Health 210: 201-228
138. Angerer J, Göen T and Lehnen G (1998) Mindestanforderungen an die Qualität von umweltmedizinischtoxikologischen Analysen. Umweltmed Forsch Prax 3: 307-312
139. HBM-Kommission (2005) Normierung von Stoffgehalten im Urin - Kreatinin. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 48: 616-618
140. HBM-Kommission (2007) Ableitung von Human-Biomonitoring-(HBM)-Werten auf der Basis tolerabler Aufnahmemengen -Teil I: Einführung. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 50: 249-250
141. HBM-Kommission (2007) Ableitung von Human-Biomonitoring-(HBM)-Werten auf der Basis tolerabler Aufnahmemengen -Teil 11:Grundlagen und Ableitungsweg. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 50:251-254
142. Beronius A, Ruden C, Hakansson H, et al. (2010) Risk to all or none? A comparative analysis of controversies in the health risk assessment of Bisphenol A. Reprod Toxicol 29: 132-146
143. Erler C and NovakJ. (2010) Bisphenol a exposure: human risk and health policy. Pediatr Nurs 25: 400-407
144. Myers JP, vom Saal FS, Akingbemi BT, et al. (2009) Why public health agencies cannot depend on good la boratory practices as a criterion for selecting data: the case of bisphenol A. Environ Health Perspect 117: 309-315
145. Schwartz AW and Landrigan PJ. (2012) Bisphenol A in thermal paper receipts: an opportunity for evidencebased prevention. Environ Health Perspect 120: A14-15
146. Tweedale AC. (2011) Uses of 'Good Laboratory Practices' by regulated industry and agencies, and the safety of bisphenol A. Epidemiol Community Health. 65: 475-6
147. Tyl R. (2009) Basic Exploratory Research Versus Guideline-Compliant Studies Used for Hazard Evaluation and Risk Assessment: Bisphenol A as a Case Study. Environ Health Perspect. 117(11)1.644-1651
148. Bai Y, Chang F, Zhou R, Jin PP, et al. (2011) Increase of anteroventral periventricular kisspeptin neurons and generation of E2-induced LH-surge system in male rats exposed perinatally to environmental dose of bisphenol-A. Endocrinology 152: 1562-71
149. Betancourt AM, Eltoum IA, Desmond RA, Russo .1, Lamartiniere CA. (2010) In utero exposure to bisphenol A shifts the window of susceptibility for mammary carcinogenesis in the rat. Environ Health Perspect. 118: 1614-9
150. Betancourt AM, Mobley JA, Russ J, Lamartiniere CA. (2010) Proteomic analysis in mammary glands of rat offspring exposed in utero to bisphenol A. J Proteomics 73: 1241-53
151. Braniste V, Jouault A, Gaultier E, et al. (2010) Impact of oral bisphenol A at reference doses on intestinal barrier function and sex differences after perinatal exposure in rats. Proc Natl Acad Sci USA 107:448-453
152. Cabaton NJ, Wadia PR, Rubin BS, et al. (2011) Perinatal exposure to environmentally relevant levels of bisphenol A decreases fertility and fecundity in CD-1 mice. Environ Health Perspect. 119: 547-52
153. Jenkins S, Betancourt AM, Wang J, Lamartiniere CA. (2011b) Endocrineactive chemicals in mammary cancer causation and prevention. Steroid Biochem Mol Biol.
154. Kunz N, Camm EJ, Somm E, et al. (2011) Developmental and metabolic brain alterations in rats exposed to bisphenol A during gestation and lactation. Int Dev Neurosci 29: 37-43
155. Lamartiniere CA, Jenkins 5, Betancourt AM, Wang J and Russo J. (2011) Exposure to the Endocrine Disruptor Bisphenol A Alters Susceptibility for Mammary Cancer. Horm Mol Biol Clin Investig. 5: 45-52
156. Poimenova A, Markaki E, Rahiotis C, Kitraki E. (2010) Corticosteroneregulated actions in the rat brain are affected by perinatal exposure to low dose of bisphenol A. Neuroscience. 167: 741-9
157. Rivera 0E, Varayoud .1, Rodriguez HA, Munozde-Toro M, Luque EH. (2011) Neonatal exposure to bisphenol A or diethylstilbestrol alters the ovarian follicular dynamics in the lamb. Reprod Toxicol. 32: 304-12
158. Xu X, Tan L, Himi T, et al. (2011) Changed preference for sweet taste in adulthood induced by perinatal exposure to bisphenol A-A probable link to overweight and obesity. Neurotoxicol Teratol. 33: 458-63
159. Kundakovic M and Champagne FA. (2011) Epigenetic perspective on the developmental effects of bisphenol A. Brain Behav Immun 25: 1084-93
160. Varayoud Ramos JG, Bosquiazzo VL, Lower M, Muriozde-Toro M and Luque EH. (2011) Neonatal exposure to bisphenol A alters rat uterine implantationassociated gene expression and reduces the number of implantation sites. Endocrinology. 152: 1101-11
161. Zhang X and Ho SM. (2011) Epigenetics meets Endocrinology. Journal of Molecular Endocrinology 46: R11-R32
162. Braun JM, Kalkbrenner AE, Calafat AM, et al. (2011) Impact of earlylife bisphenol A exposure on behavior and executive function in children. Pediatrics 128: 873-882
163. CarwileJL and Michels KB. (2011) Urinary bisphenol A and obesity: NHANES 2003-2006. Environ Res 111: 825-830
164. FujimotoW, Kim D, vom Saal FS, LambJD, Taylor JA, Bloom MS. (2011) Serum unconjugated bisphenol A concentrations in women may adversely influence oocyte quality during in vitro fertilization. Fertil Steril. 95: 1816-9
165. Galloway T, Cipelli R, Guralnik 1, et al. (2010) Daily bisphenol A excretion and associations with sex hormone concentrations: results from the InCHI-ANTI adult population study. Environ Health Perspect 118: 1603-1608
166. Melzer D, Rice NE, Lewis C, et al. (2010) Association of urinary bisphenol a concentration with heart disease: evidence from NHANES 2003/06. PLoS One 5: e8673
167. Melzer D, Harries L, Cipelli R, et al. (2011) Bisphenol A exposure is associated with in vivo estrogenic gene expression in adults. Environ Health Perspect 119:1788-1793
168. Melzer D, Osborne NJ, Henley WE, et al. (2012) Urinary Bisphenol: A Concentration and Risk of Future Coronary Artery Disease in Apparently Healthy Men and Women. Circulation.
169. BfR (2011) Fragen und Antworten zu Bisphenol A in verbrauchernahen Produkten. Aktualisierte FAQ des BfR vom 3. Mai 2011. http://www.bfr.bund.de/ de/fragen_und_antworten_zu_bisphenol a in verbrauchernahen_produkten-7195.html
170. Goodson A, Robin H, Summerfield W and Cooper I. (2004) Migration of bisphenol A from can coatingseffects of damage, storage conditions and heating. Food Addit Contam 21: 1015-26
171. FSA Food Standards Agency (2001) Survey of Bisphenols in Canned Foods. Food Surveillance Information Sheet. 13/01. Food Standards Agency, UK. Available on http://www.foodstandards.gov.uk/ food_surv.htm.
172. Braunrath R, Podlipna D, Padlesak S and Cichna-Mark! M. (2005) Determination of bisphenol a in canned foods by immunoaffinity chromatography, HPLC, and fluorescence detection. Agric Food Chem 53: 8911-7
173. U.S. EPA (1987) Integrated Risk Information System. http://www.epa.gov/iris/subst/0356.htm
174. Health Canada (2008) Health Risk Assessment of Bisphenol A from Food Packaging Applications. Minister of Health. 2008, Bureau of Chemical Safety
175. Scharf S. (2006) 1. Fachgespräch "Innenraum und Gesundheit"vom Hausstaub - ein Indikator für Innenraumbelastung ? Umweltbundesamt 7.03.2006 http://www.umweltbundesamt.at/fileadmin/site/ leistungen/Umweltanalytik/Hausstaub-Ein_Indikator_fuerinnenraumbelastung.pdf
176. CERHR (2008) center for the evaluation of risks to human reproduction: NTP-CERHR monograph on the potential human reproductive and developmental effects of bisphenol A. NIH Publication No. 08-5994: 1-64
 | ENDE |  |