2,5-Bisisocyanatomethylbicyclo[2.2.1]heptan NBDI
| zurück |
2,5-(und 2,6-)Bis(isocyanatomethyl)bicyclo[2.2.1]heptan
(CAS-Nummer: 74.091-64-8)
Ausgabe:
Januar 2006 zuletzt geändert und ergänzt: März 2007
Stand:
März 2007
AGW-Vorschlag:
45 µg/m3
5 ppb
Stoffcharakterisierung
| Synonyme: | 2,5-(und 2,6-) Bis(isocyanatomethyl)-bicyclo[2.2.1]heptan (1:1 bis 3:1)
2,5-Bisisocyanatomethylbicyclo[2.2.1]heptan NBDI |
| Strukturformel: | 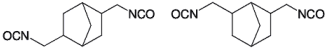 |
| Summenformel: | C11H14N2O2 |
| Molekulargewicht: | 206,2 g/Mol |
| CAS-Nr.: | 74.091-64-8 |
| Schmelzpunkt: | < 73,5 °C |
| Siedepunkt: | Zersetzung bei 208 - 220 °C |
| Dampfdruck: | 0,02 Pa (20 °C) |
| Hydrolysegeschwindigkeit: | Stoff reagiert schnell mit Wasser, die Geschwindigkeit wurde nicht quantifiziert |
| Wasserlöslichkeit: | Test nicht durchführbar, da Substanz mit Wasser reagiert |
| Verteilungskoeffizient: | Test nicht durchführbar, da Substanz mit Wasser reagiert |
Allgemeiner Wirkcharakter
Bis(isocyanatmethyl)-bicyclo[2.2.1]heptan reagiert mit Wasser; quantitative Daten zur Hydrolyse des Stoffes liegen jedoch nicht vor. Die Untersuchungen an Ratten legen eine gute Bioverfügbarkeit nach oraler und inhalativer Applikation nahe; direkte Untersuchungen zur Resorption liegen nicht vor. Im Tierversuch führte die einmalige orale bzw. inhalative Verabreichung des Stoffes zu Todesfällen. An der Haut wirkt der Stoff ätzend und sensibilisierend. Am Auge kam es zu schweren nicht reversiblen Reizwirkungen.
Die wiederholte orale Verabreichung des Stoffes über vier Wochen führte zu systemischer Toxizität (Leber, Hoden und Ovarien). Eine subchronische Studie mit inhalativer Verabreichung führte ausschließlich zu lokalen Effekten. Hierzu gehören Entzündungsreaktionen mit Hyperplasien des Übergangsepithels der Nasenhöhle.
Aus den vorliegenden in vitro Untersuchungen ergibt sich kein Verdacht auf eine mutagene Wirksamkeit.
Erfahrungen am Menschen
Studien und Erfahrungen am Menschen beim Umgang mit dem Stoff liegen nicht vor.
Tierexperimentelle Befunde
Akute Toxizität
Orale Aufnahme
Die orale Gabe von Bis(isocyanatomethyl)-bicyclo[2.2.1]heptan in Dosierungen von 700, 1000, 1400 und 2000 mg/kg Körpergewicht (KG) mittels Schlundsonde an männliche und weibliche Sprague-Dawley-Ratten ergab LD50-Werte von 1842 mg/kg KG ( ) und 1201 mg/kg KG ( ) [Katoh, 1991 a]. Die gestorbenen Tiere zeigten eine grauweiße Magenwand und gelbe Rückstände im Dünndarm. Ein Versuchstier hatte dunkelrote Flecken am Thymus und eine Verfärbung der Milz. Bei der Autopsie wurde bei allen Tieren der höchsten Dosisgruppe Hodenatrophie mit weißen Rückständen in den Hoden beschrieben.
Inhalative Aufnahme
Der Stoff wurde in einer Kopf-Nasen-Exposition als Aerosol (MMAD: 2,0 - 2,5 µm) an je 5 männliche und weibliche Fischer-344-Ratten in Konzentrationen von 15, 50, 100, 250, 500 und 5000 mg/m3 verabreicht (4 Stunden Exposition). Die inhalative LC50 wurde zu 54 mg/m3/4 h bestimmt [Brooker et al., 1992]. In der höchsten Konzentration (5000 mg/m3) wurden keine makroskopischen Veränderungen in den verstorbenen Tieren beobachtet. Lediglich bei einem Versuchstier wurden weiße Rückstände im linken Lungenflügel beobachtet. Die Lungen der verstorbenen Tiere der zweithöchsten Luftkonzentration (500 mg/m3) waren blass oder rot verfärbt. Die verstorbenen sowie die überlebenden Tiere der anderen Konzentrationen zeigten keinerlei morphologische Veränderungen.
Tab. 1: Angaben zur akuten Toxizität von Bicyclo[2.2.1]heptan, bis(isocyanatomethyl)
| Aufnahmeweg | Spezies | Stamm | Geschlecht | LD50/LC50 | Literatur | |
| oral (Schlundsonde) | Ratte | Sprague-Dawley |  | 1201 | mg/kg | Katoh 1991a |
 | 1842 | |||||
| inhalativ (Kopf-Nase) | Ratte | Fischer 344 |  | 54 | mg/m3 | Brooker et al. 1992 |
subakute und subchronische Toxizität
Orale Aufnahme
In der subakuten oralen Studie [Katoh, 1991 b] wurde Bis(isocyanatmethyl)-bicyclo[2.2.1]heptan, gelöst in Olivenöl, je 6 männlichen und weiblichen Sprague-Dawley-Ratten (SPF) täglich über 28 Tage (7 Tage/Woche) in Dosierungen von 0, 15, 100, 500 mg/kg KG per Schlundsonde verabreicht. Je 6 weitere Tiere pro Geschlecht wurden in der Kontrolle und in der höchsten Dosierung analog behandelt und anschließend in einer 14-Tage-Phase ohne Stoffapplikation nachbeobachtet. In Ergänzung dieser Studie wurden je 6 weibliche Sprague-Dawley-Ratten (SPF) über 28 Tage mittels Schlundsonde mit 2 und 10 mg/kg KG dosiert. Die Ergebnisse beider Studien werden hier zusammen dargestellt.
Klinische Beobachtungen
In der Studie traten keine Todesfälle auf. Nach Applikation von 500 mg/kg KG wurde vermehrter Speichelfluss bei den Ratten beiderlei Geschlechts beobachtet. Männliche Tiere zeigten vorübergehend weiche Faeces, reduzierte Bewegung, Rasselgeräusche sowie reduzierte Körpergewichtsentwicklung während der Exposition und in der Nachbeobachtungszeit. Der Futterverbrauch war bei beiden Geschlechtern in der ersten Woche reduziert.
Laboruntersuchungen
Hämatologisch wurden statistisch signifikant reduzierte Hämatokritwerte bei weiblichen Tieren aller Dosierungen beobachtet sowie reduzierte Hämoglobinkonzentrationen in der höchsten Dosierung.
Männliche Tiere aller Dosierungen zeigten erhöhte mittlere korpuskuläre Hämoglobin-Werte (MCHC). Am Ende der Nachbeobachtungszeit war die Thromboplastinzeit (APPT) der Weibchen der höchsten Dosierung verkürzt. In der höchsten Dosierung wurden erhöhte ASAT-Werte (beide Geschlechter), erhöhte ALAT-Werte (nur  ), erniedrigte Glukosekonzentrationen (nur
), erniedrigte Glukosekonzentrationen (nur  ) sowie ein erhöhtes Verhältnis von Albumin/Globulin (nur
) sowie ein erhöhtes Verhältnis von Albumin/Globulin (nur  ) bestimmt.
) bestimmt. 

Organveränderungen
Weibliche Ratten der höchsten Dosierung zeigten im Vergleich zu den Kontrollen erhöhte absolute und relative Lebergewichte sowie reduzierte relative Ovariengewichte. Das absolute Lebergewicht der männlichen Tiere (500 mg/kg KG) war reduziert; die relativen Hirn- und Hodengewichte erhöht. Die weiblichen Tiere aller Dosierungen zeigten reduzierte absolute Nebennierengewichte; die relativen
Nebennierengewichte waren bei den weiblichen Tieren der Gruppen 15 und 100 mg/kg KG erniedrigt, zusätzlich wurde bei den weiblichen Ratten in der höchsten Dosierung eine Glykogeneinlagerung in der Leber beobachtet.
Da bei den vorliegenden Dosierungen aufgrund der Wirkungen bei den weiblichen Versuchstieren kein NOAEL bestimmt werden konnte, wurde eine zusätzliche Studie mit Schlundsondenapplikation [Katoh, 1991 c] in Dosierungen von 2 und 10 mg/kg KG an weiblichen Tieren über einen Zeitraum von 28 Tagen durchgeführt. Keine dieser Dosen führte zu relevanten toxischen Effekten; sodass 10 mg/kg KG den NOAEL darstellen.
Tabelle 2a: Ergebnisse der oralen subakuten Studie bei männlichen Sprague-Dawley-Ratten
| Dosis [mg/kg] | Klinische Beobachtungen | Klinische Chemie | makroskopische Veränderungen | Mikroskopische Veränderungen |
| 0 | - | - | - | - |
| Recovery | - | - | - | - |
| 15 | - | MCHC  | - | - |
| 100 | - | MCHC  | - | - |
| 500 | vermehrter Speichelfluss, Futterkonsum 
(1. Woche), Körpergewichtsentwicklung | ASAT  , ALAT , ALAT 
MCHC | Leber: abs. Gewicht 
Gehirn: rel. Gewicht Hoden: rel. Gewicht | - |
| Recovery | - | - | Gehirn: abs. Gewicht 
Niere: abs. Gewicht | - |
Tabelle 2b: Ergebnisse der oralen subakuten Studie bei weiblichen Sprague-Dawley-Ratten
| Dosis [mg/kg] | Klinische Beobachtungen | Klinische Chemie | makroskopische Veränderungen | Mikroskopische Veränderungen |
| 0 | - | - | - | - |
| Recovery | - | - | - | - |
| 2 | - | - | - | - |
| 10 | - | - | - | - |
| 15 | - | Hämatokrit 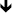 | Nebenniere: abs. & rel. Gewicht 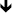 | - |
| 100 | - | Hämatokrit 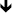 | Nebenniere: abs. & rel. Gewicht 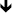 | - |
| 500 | vermehrter Speichelfluss, Futterkonsum  | Hämatokrit 
Hämoglobin APPT ASAT Albumin/Globulin | Leber: rel. & abs. Gewicht 
Ovarien: rel. Gewicht Nebenniere: abs. Gewicht | Leber: Glykogeneinlagerung (6/6) |
| Recovery | Leber: Glykogeneinlagerung (316) |
Inhalative Aufnahme
In der subchronischen Inhalationsstudie [Inaba, 2000] wurde die Substanz je 10 männlichen und weiblichen Sprague-Dawley-Ratten täglich (5 Tage/Woche, 6 Stunden/Tag) während 90 Tagen in Konzentrationen von 0; 0,12; 0,55; 2,03 mg/m3 als Dampf verabreicht (Ganzkörperexposition).
Klinische Beobachtungen
In der Studie traten keine Todesfälle auf. Behandlungsbezogene klinische Befunde waren auf die Tiere der höchsten Exposition (beide Geschlechter) beschränkt: während der Exposition Reiben der Schnauze mit den Pfoten, Niesen sowie eine verringerte Reaktion auf externe Reize. Körpergewichtsentwicklung, Futter- und Wasserverbrauch waren in allen Gruppen unverändert.
Laboruntersuchungen
In der Studie wurden keine signifikanten Veränderungen hämatologischer und biochemischer Parameter beobachtet. Für einzelne dieser Parameter wurden signifikante Abweichungen von den Kontrollen beschrieben; die Unterschiede waren jedoch gering, nicht dosisabhängig und zwischen den Geschlechtern inkonsistent. Sie wurden daher für die AGW-Ableitung als nicht substanzbedingt bewertet.
Organveränderungen/Pathologische Untersuchungen
Die Körpergewichte aller Expositionsgruppen unterschieden sich nicht von denen der Kontrolle. Darüber hinaus wurden keine substanzbezogenen Veränderungen in den Hauptorganen der Versuchstiere beschrieben.
In der höchsten Dosisgruppe kam es zu Erosion (2  ) und Hyperplasie (10
) und Hyperplasie (10 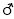 , 6
, 6  ) mit Entzündungen (Rhinithis) im Übergangsepithel der Nasenhöhle. Bei zwei männlichen Ratten wurden bei der Dosierung von 0,55 mg/m3 noch Hyperplasien des Übergangsepithels der Nasenhöhle beobachtet.
) mit Entzündungen (Rhinithis) im Übergangsepithel der Nasenhöhle. Bei zwei männlichen Ratten wurden bei der Dosierung von 0,55 mg/m3 noch Hyperplasien des Übergangsepithels der Nasenhöhle beobachtet.
Die niedrigste Konzentration (0,12 mg/m3) stellt den NOAEL der Untersuchung für lokale Effekte dar. Da in keiner Konzentration systemische Effekte beobachtet wurden, beträgt der NOAEL für systemische Effekte 2,03 mg/m3.
Tabelle 3a: Ergebnisse der subchronischen Inhalationsstudie bei männlichen Sprague-Dawley-Ratten
| Konzentration [mg/m3] | Klinische Beobachtungen | Klinische Chemie | Makroskopische Veränderungen | Mikroskopische Veränderungen |
| 0 | - | - | - | - |
| 0,12 | - | - | - | - |
| 0,55 | - | - | - | Übergangsepithel der Nasenhöhle: Hyperplasie (2/10, minimal) Respiratonsches Epithel: |
| 2,03 | Reiben der Schnauze mit den Pfoten, Niesen, verringerte Reaktion auf externe Reize | - | - | Übergangsepithel der Nasenhöhle Erosion (2/10, minimal) Hyperplasie (10/10, davon 2/10 minimal, 3/10 gering, 5/10 moderat) Entzündungen (3/10 minimal) Respiratonsches Epithel: Hyperplasie (7/10, davon 4/10 minimal, 3/10 gering) |
Tabelle 3b: Ergebnisse der subchronischen Inhalationsstudie bei weiblichen Sprague-Dawley-Ratten
| Konzentration [mg/m3] | Klinische Beobachtungen | Klinische Chemie | Makroskopische Veränderungen | Mikroskopische Veränderungen |
| 0 | - | - | - | - |
| 0,12 | - | - | - | - |
| 0,55 | - | - | - | - |
| 2,03 | Reiben der Schnauze mit den Pfoten, Niesen, verringerte Reaktion auf externe Reize | - | - | Übergangsepithel der Nasenhöhle: Hyperplasie (6/10, davon 4/10 minimal, 2/10 gering) Respiratonsches Epithel: Hyperplasie (2/10, davon 1/10 minimal, 1/10 gering) |
Wirkungen auf Haut und Schleimhäute
An der Haut [Pößnecke, 1992 a] und am Auge [Pößnecke, 1992 b] kam es zu starken, nicht reversiblen Reizwirkungen. Aufgrund dieser Studien ist der Stoff als ätzend eingestuft.
Allergene Wirkung
Im Maximierungstest [Pößnecke, 1993] erwies sich der Stoff als hautsensibilisierend. Reproduktionstoxizität
Es liegen weder Untersuchungen zur fruchtschädigenden Wirkung noch zur fruchtbarkeitsverändernden Wirkung vor.
In der akuten und subakuten oralen Studie wurden Effekte an den Fortpflanzungsorganen insbesondere der männlichen Tiere beobachtet. Alle männlichen Tieren der höchsten Dosisgruppe in der akuten oralen Studie zeigten Hodenatrophie sowie weiße Rückstände in den Hoden. Diese Dosis führte bei 7/10 Tieren zum Tode. Unterhalb dieser Dosierung traten keine Hodenveränderungen auf. In der subakuten oralen Studie war das relative Hodengewicht erhöht und das relative Ovariengewicht der weiblichen Tiere vermindert. Die in der subchronischen Inhalationsstudie verabreichten Luftkonzentrationen führten nicht zu Veränderungen an den Hoden und Ovarien.
Weder auf der Grundlage der akuten Hodeneffekte im Bereich oberhalb der LD50 noch der Gewichtsveränderungen von Hoden und Ovarien im subakuten Versuch ist eine Einstufung als "Fertilitätsmindernd" auf der Grundlage des Leitfadens für die Einstufung [EU, 1998] begründbar. Die vorliegenden Hinweise sprechen daher nicht gegen die Ableitung eines Arbeitsplatzrichtwertes. Studien, in denen eine mögliche entwicklungsschädigende Wirkung des Stoffes untersucht wurde, liegen nicht vor.
Mutagenität
in vitro
Im bakteriellen Mutagenitätstest [Nishitomi, 1991] wurden durch Dosierungen bis 1250 µg/Platte mit und ohne metabolische Aktivierung (S9-Mix) keine Genmutationen hervorgerufen. Dosierungen ab 313 µg/Platte induzierten toxische Effekte.
Die Prüfung auf Chromosomenmutationen an Säugerzellen (CHL-Zellen) [Katoh, 1991 d] verlief für Konzentrationen bis 60 µg/ml (mit S9-Mix) bzw. bis 80 µg/ml (ohne S9-Mix) negativ. Höhere Konzentrationen führten zu toxischen Effekten. Aufgrund einer fehlerhaften Testdurchführung ist die Aussagekraft dieser Prüfung eingeschränkt.
in vivo
Es liegen keine in vivo Untersuchungen vor.
Kanzerogenität
Es liegen keine Untersuchungen zu diesem Endpunkt vor.
Struktur-Wirkungs-Beziehungen
Bis(isocyanatmethyl)-bicyclo[2.2.1]heptan gehört zur Stoffgruppe der Isocyanate. Da Vertreter dieser Stoffgruppe eine atemtraktsensibilisierende Wirkung zeigen, kann diese auch für Bis(isocyanatmethyl)-bicyclo[2.2.1]heptan nicht ausgeschlossen werden.
Ableitung des AGW
Die vorliegenden Hinweise zu möglichen fertilitätsmindernden Eigenschaften aus den oralen Studien sprechen derzeit nicht gegen die Ableitung eines Arbeitsplatzgrenzwertes. Die Atrophie der Hoden in der akuten oralen Prüfung trat in einem Dosisbereich auf, der bei 7/10 Tieren zum Tode führte. In der subakuten Studie zeigten die Tiere lediglich Hodengewichtserhöhungen bei der höchsten Dosierung. In einem Inhalationsversuch über 90 Tage wurden in einem Konzentrationsbereich, der zu lokalen Veränderungen im Atemtrakt führte, keinerlei Effekte auf die Hoden der Versuchstiere beobachtet.
Daten zur Kanzerogenität und Hinweise auf ein mutagenes Potential von Bis(isocyanatmethyl)-bicyclo[2.2.1]heptan liegen nicht vor.
Bis(isocyanatmethyl)-bicyclo[2.2.1]heptan zeigt nach 90-tägiger inhalativer Verabreichung an Ratten ausschließlich lokale Effekte. Der NOAEL dieser Untersuchung liegt bei 0,12 mg/m3. Da die Effekte in der nächst höheren Konzentration (0,55 mg/m3) lediglich bei 2 von 10 Männchen auftraten und der Schweregrad als minimal beschrieben wird, sollte die Ableitung eines Grenzwertes auf einem Wert zwischen 0,12 und 0,55 mg/m3 basieren. Für die AGW-Ableitung wird daher auf den Mittelwert dieses Bereichs der Luftkonzentration Bezug genommen (0,33 mg/m3). Auf der Grundlage des ARW-Konzeptes [Anon, 1998] kann damit ein Grenzwertvorschlag abgeleitet werden. Abweichend von den im ARW-Konzept
genannten Kriterien wird für die Zeitextrapolation ein modifizierter Extrapolationsfaktor angewandt [Kalberlah et al., 1999]. Da der Stoff direkt und ohne metabolische Umwandlung an den Schleimhäuten wirkt, kann ein weniger ausgeprägter Inter- und Intraspeziesextrapolationsfaktor herangezogen werden. Es sind folgende Extrapolationen zu berücksichtigen:
| Extrapolationsschritt | Standardfaktor |
| * 90 Tage Exposition ⏶ chronische Belastung | 1/2 |
| * Speziesextrapolation | 1 |
| * Inter- & Intraspeziesvariabilitäten | 1/2 - 1/3 |
Angesichts fehlender stoffspezifischer Daten errechnet sich unter Verwendung der genannten Standardfaktoren ein Arbeitsplatzrichtwert im Bereich von 55 bis 83 µg/m3. Dabei entspricht ein Wert von 55 µg/m3 einer Luftkonzentration von 6,4 ppb.
Bis(isocyanatmethyl)-bicyclo[2.2.1]heptan reiht sich damit auch in die Grenzwerte für andere Diisocyanate in der TRGS 900 ein.
Für die im Anhang gelisteten Diisocyanaten erfolgte die Grenzwert-Ableitung im Gegensatz zu dieser Ableitung überwiegend auf der Basis der volumenbezogenen Luftkonzentrationen (ppb); die Grenzwerte liegen bei 5 ppb.
Angesichts der Übereinstimmung des abgeleiteten AGW-Wertes mit den Grenzwerten für die anderen Diisocyanate wird ein Wert von 5 ppb (45 µg/m3) festgelegt.
Aufgrund des Verdachts einer atemtraktsensibilisierenden Wirkung kann nicht ausgeschlossen werden, dass auch die Einhaltung dieses Grenzwertes zur Ausprägung einer Atemtraktsensibilisierung führen kann. (siehe Anhang I)
Literatur
Anon (1998)
Kriterien für die Ableitung von gesundheitsbasierten Luftgrenzwerten bei limitierter Datenlage
Bundesarbeitsblatt 10/98, 74 - 76
Brooker, MJ; Lynch, ME; Singer, AW; Placke, ME (1992) Inhalation toxicity study of liquid aerosol in rats: Limit Test / LC-50 unveröffentlichter Bericht, Study No. SC 920.038
EU (1998)
Richtlinie 67/548/EWG,
Annex VI - Allgemeine Anforderungen für die Einstufung und Kennzeichnung gefährlicher Stoffe und Zubereitungen
Amtsblatt der Europäischen Gemeinschaften L225/263
Richtlinie 2001/59/EG der Kommission vom 6. August 2001 zur 28. Anpassung der Richtlinie 67/548/EWG des Rates zur Angleichung der Rechts- und Verwaltungsvorschriften der Mitgliedstaaten für die Einstufung, Verpackung und Kennzeichnung gefährlicher Stoffe an den technischen Fortschritt
Inaba, K (2000)
90 day repeat dose inhalation toxicity study in rats unveröffentlichter Bericht, Study No. 043/994.932
Katoh, M (1991a)
Acute oral toxicity study of 2,5 (or 2,6)-bicyclo [2,2,1]heptanebis-(methylisocyanate) in rats
unveröffentlichter Bericht, Study No. OL 279
Katoh, M (1991b)
Toxicity study of 2,5 (or 2,6)-bicyclo [2,2,1]heptanebis-(methylisocyanate): oral administration of rats for 28 days
unveröffentlichter Bericht, Study No. OL 280
Katoh, M (1991c)
Additional study for determination of the toxicity of 2,5 (or 2,6)-bicyclo [2,2,1]heptanebis-(methylisocyanate) to rats by repeated oral administration for 28 days Study No. OL 465, unveröffentlichter Bericht, Mitsui Toatsu Chemicals, Inc.
Kalberlah, F; Schneider, K; Schuhmacher, US; Voss, JU; Ioannidis, I; Oltmanns, J (1999)
Zeitextrapolation und Interspeziesextrapolation bei lokal wirksamen Stoffen mit begrenzter Datenlage
Schriftenreihe der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Forschungsbericht Fb 862
Katoh, M (1991d)
Chromosomal aberration test of NBDI in cultured mammalian cells unveröffentlichter Bericht, Study No. OL282
Nishitomi, T (1991)
Bacterial reverse mutation test of NBDI unveröffentlichter Bericht, Study No. OL 281
Pößnecker (1992a)
Acut dermal irritation / corrosion study of NBDI in rabbits unveröffentlichter Bericht, Study No. BE-MT-32-92-01-DIK-02
Pößnecker (1992b)
Acut eye irritation / corrosion study of NBDI in rabbits unveröffentlichter Bericht, Study No. BE-MT-32-92-02-EIK-02
Pößnecker (1993)
Acute dermal sensitization study of NBDI in guinea pigs (Maximization Test) unveröffentlichter Bericht, Study No. BE-MT-32-92-03-SIG-02.
.
| Atemtraktsensibilisierende Stoffe aus der TRGS 900 (Stand: Jan. 2006) | Anhang I |
| Stoffbezeichnung | Isocyanate | EG-Nr. CAS-Nr. | μl/m3 (ppb) | mg/m3 | Spitzenbegr.; Überschreitungsfaktor | Bemerkungen |
| Hexamethylen-1,6-diisocyanat | 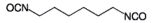 | 2.124.858 822-06-0 | 5 | 0,035 | 1; =2= (1) | DFG, 12 |
| 3-Isocyanatmethyl-3,5,5-trimethylcyclohexylisocyanat (Isophorondiisocyanat) | 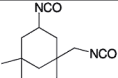 | 2.238.616 4098-71-9 | 5 | 0,046 | 1; =2= (1) | DFG, 12 |
| 4,4'-Methylendiphenyldiisocyanat |  | 2.029.660 101-68-8 | - | 0,05 | 1; =2= (1) | DFG, 11, 12 |
| 4-Methylm-phenylendiisocyanat (2,4-Toluylendiisocyanat) | 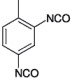 | 2.095.445 584-84-9 | 5 | 0,035 | 1; =4= (1) | AGS;12 |
| 2-Methylm-phenylendiisocyanat(2,6-Toluylendiisocyanat) | 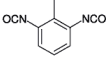 | 2.020.390 91-08-7 | 5 | 0,035 | 1; =4= (1) | AGS;12 |
| 1,5-Naphthylendiisocyanat | 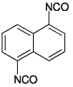 | 2.216.414 3173-72-6 | - | 0,05 | 1; =2= (1) | AGS; 11,12 |
Vgl. Abschnitt IV der MAK-Liste:
"Bis heute lassen sich weder für die Induktion einer Allergie noch für die Auslösung einer allergischen Reaktion beim Sensibilisierten allgemein gültige, wissenschaftlich begründete Grenzwerte ableiten. (...) Für die Auslösung einer akuten Symptomatik sind in der Regel niedrigere Konzentrationen ausreichend als für die Induktion einer Sensibilisierung. Auch bei Einhaltung der MAK-Werte sind Induktion oder Auslösung einer allergischen Reaktion nicht sicher zu vermeiden."
 | weiter . |