

 |
zurück |  |
| Bestimmung der Ökotoxizität
Teil VII: MITI-Test |
Anhang V zur RL 67/548/EWG |
C.4-F. VII.1. Prinzip der Methode
Das Prinzip der Methode besteht in der automatischen Messung der Sauerstoffaufnahme durch eine gerührte Lösung oder Suspension der Prüfsubstanz in einem mit speziell gezüchteten, nicht adaptierten Mikroorganismen angeimpften mineralischen Medium; die Messung erfolgt über einen Zeitraum von 28 Tagen in einem abgedunkelten, geschlossenen Respirationsmeßgerät bei 25 ± 1 °C. Das entstehende Kohlendioxid wird durch Natronkalk absorbiert. Die biologische Abbaubarkeit wird als prozentuale Sauerstoffaufnahme (nach Berücksichtigung der Aufnahme aus dem Blindansatz) auf der Grundlage der theoretischen Aufnahme (ThSB) angegeben. Zusätzlich wird der Grad des biologischen Primärabbaus aus der ergänzenden spezifischen Analyse errechnet, die zu Beginn und am Ende der Inkubation vorgenommen wird, wahlweise auch durch DOC-Analyse.
C.4-F. VII.2. Beschreibung der Methode
C.4-F. VII.2.1. Geräte
C.4-F. VII.2.2. Ansatz des mineralischen Mediums
Die folgenden Stammlösungen sind unter Verwendung von Reagenzien des Reinheitsgrades zur Analyse (p.a.) und Wasser ( I.6.1.) anzusetzen:
| (a) | Kaliumdihydrogenorthophosphat, KH2PO4 | 8,50 g |
| Dikaliummonohydrogenorthophosphat, K2HPO4 | 21,75 g | |
| Dinatriummonohydrogenorthophosphat dodecahydrat, Na2HPO4 ξ12 H2O | 44,60 g | |
| Ammoniumchlorid, NH4Cl in Wasser gelöst und auf 1 l aufgefüllt; der pH-Wert der Lösung sollte 7,2 betragen. |
1,70 g | |
| (b) | Magnesiumsulfat heptahydrat, MgSO4ξ7 H2O in Wasser gelöst und auf 1 l aufgefüllt. |
22,50 g |
| (c) | Calciumchlorid, wasserfrei, CaCl2 in Wasser gelöst und auf 1 l aufgefüllt. |
27,50 g |
| (d) | Eisen(III)chlorid hexahydrat, FeCl3 ξ6 H2O in Wasser gelöst und auf 1 l aufgefüllt. Je 3 ml der Lösungen (a), (b), (c), (d) zusammengeben und auf 1 l auffüllen. |
0,25 g |
C.4-F. VII.2.3. Ansatz des Inokulums
Es sind frische Proben an mindestens zehn Orten zu entnehmen, vorzugsweise aus Gebieten, in denen eine Vielzahl chemischer Substanzen verwendet und eingetragen werden. An solchen Orten wie kommunalen Kläranlagen, Industriekläranlagen, Flüssen, Seen oder dem Meer sind 1-l-Proben Belebtschlamm, Oberboden, Wasser usw. zu entnehmen und gründlich zu durchmischen. Nach Entfernen aufschwimmender Stoffe wird die Probe stehengelassen und der Überstand mit Natronlauge oder Phosphorsäure auf einen pH-Wert von 7 ± 1 eingestellt.
Ein geeignetes Volumen des abfiltrierten Überstands wird in ein Belebtschlammgefäß gefüllt und etwa 23 1/2 h belüftet. Eine halbe Stunde nach Abschalten der Belüftung wird etwa ein Drittel des gesamten Überstands entnommen und das gleiche Volumen einer Lösung (pH 7), aus jeweils 0,1 % Glukose, Pepton und Kaliumorthophosphat, dem abgesetzten Material hinzugefügt und weiterbelüftet. Diese Schritte sind täglich zu wiederholen. Die Belebtschlammanlage ist unter Beachtung folgender Kriterien ordnungsgemäss zu betreiben: der Überstand sollte klar sein und einen pH-Wert von 7 ± 1 aufweisen, die Temperatur sollte 25 ± 2 °C betragen, der Schlamm sollte sich gut absetzen, die Anlage sollte ausreichend belüftet werden, um die Mischung jederzeit aerob zu halten, es sollten Protozoa vorhanden sein, und die Aktivität des Schlamms sollte mindestens alle 3 Monate mit einer Referenzsubstanz überprüft werden. Vor Verwendung einer Schlammprobe als Inokulum muß die Anlage mindestens einen Monat, aber nicht länger als vier Monate in Betrieb gewesen sein. Danach sind in regelmässigen Abständen, alle 3 Monate, Proben an mindestens 10 Orten zu entnehmen.
Um frischen und alten Belebtschlamm bei gleicher Aktivität zu halten, wird der filtrierte Überstand des alten, bereits in der Prüfung verwendeten Belebtschlamms mit einem gleichen Teil Überstandsfiltrat einer frisch gewonnenen Mischung von zehn Orten gemischt. Die Gesamtmischung wird wie beschrieben weitergezüchtet. Als Inokulum sind Schlammproben erst 18-24 h nach Beschickung der Anlage zu verwenden.
C.4-F. VII.2.4. Ansatz der Flaschen
Es sind folgende sechs Flaschen anzusetzen:
Nr. 1: 100 mg/l Prüfsubstanz in Verdünnungswasser
Nr. 2, 3 und 4: 100 mg/l Prüfsubstanz in mineralischem Medium
Nr. 5: 100 mg/l Referenzsubstanz (z.B. Anilin) in mineralischem Medium
Nr. 6: nur mineralisches Medium
Schwerlösliche Prüfsubstanzen werden gewichts- oder volumenbezogen direkt in die Flasche gegeben oder entsprechend Anhang III behandelt (mit der Abweichung, daß weder Lösungsmittel noch Emulgatoren verwendet werden dürfen). Das CO2-Absorbens wird allen Flaschen in die dafür vorgesehenen Behälter gegeben und der pH-Wert in den Flaschen Nr. 2, 3 und 4 auf 7,0 eingestellt.
C.4-F. VII.2.5. Durchführung der Prüfung
Die Flaschen Nr. 2, 3 und 4 (Prüfsuspensionen), Nr. 5 (Aktivitätsprüfung) und Nr. 6 (Inokulum-Blindversuch) werden mit einer geringen Menge Inokulum angeimpft, um eine Konzentration an suspendierten Feststoffen von 30 mg/l zu erhalten. Flasche Nr. 1, die als abiotische Kontrolle dient, erhält kein Inokulum. Anschliessend ist die Versuchsanordnung aufzubauen, auf Luftabschluss zu prüfen, die Rührgeräte anzustellen und mit der Messung der Sauerstoffaufnahme im Dunkeln zu beginnen. Es sind tägliche Kontrollen der Temperatur, des Rührgerätes und des coulometrischen Registriergerätes für die Sauerstoffaufnahme vorzunehmen und eventülle Farbänderungen des Flascheninhalts zu protokollieren. Die Sauerstoffaufnahme für die sechs Flaschen ist direkt mit Hilfe eines geeigneten Gerätes, zum Beispiel am Sechsfachschreiber abzulesen, der eine BSB-Kurve erzeugt. Am Ende der Inkubation, normalerweise nach 28 Tagen, sind die pH-Werte der Flascheninhalte zu messen und die Konzentration der restlichen Prüfsubstanz sowie möglicher Abbauprodukte und, im Falle wasserlöslicher Stoffe, die DOC-Konzentration zu bestimmen (Anhang II.4). Besondere Vorsicht ist bei flüchtigen Substanzen geboten. Ist eine Nitrifikation zu erwarten, sind - wenn möglich - Nitrat- und Nitritkonzentration zu bestimmen.
C.4-F. VII.3. Daten und Abschlußbericht
C.4-F. VII.3.1. Auswertung der Ergebnisse
Die Sauerstoffaufnahme (mg) durch die Prüfsubstanz nach einer vorgegebenen Zeit (korrigiert um die Sauerstoffaufnahme der Inokulum-Blindkontrolle nach der gleichen Zeit) ist durch die Menge der verwendeten Prüfsubstanz zu dividieren. Dadurch erhält man den BSB, angegeben als mg Sauerstoff pro mg Prüfsubstanz:
| mg O2-Aufn. Prüfsubst. - mg O2-Aufn. Blindkontrolle | ||
| BSB = | = mg O2 pro mg Prüfsubstanz | |
| mg Prüfsubst. in der Flasche |
Der prozentuale biologische Abbau ist dann wie folgt zu berechnen:
| % biolog. Abbau = % ThSB = | BSB (mg O2/mg Prüfsubstanz) | x 100 |
| ThSB (mg O2/mg Prüfsubstanz) |
Bei Mischungen ist der ThSB aus der Elementanalyse - wie für einfache Verbindungen - zu berechnen. Der zu verwendende ThSB-Wert (ThSBNH4 oder ThSBNO3) richtet sich danach, ob keine oder eine vollständige Nitrifikation stattgefunden hat (Anhang II.2). Bei auftretender, jedoch unvollständiger Nitrifikation, ist ein Korrekturfaktor für den durch die Nitrifikation verbrauchten Sauerstoff aus den Änderungen der Nitrit- und Nitratkonzentration zu berechnen (Anhang V).
Der prozentuale biologische Primärabbau wird aus dem Verlust an spezifischer (Ausgangs-)Substanz ermittelt (vgl. I.7.2.).
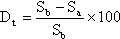 %
%
Wird in Flasche Nr. 1 bei der Bestimmung des physikalisch-chemischen Abbaus ein Verlust an Prüfsubstanz festgestellt, so ist dies zu protokollieren und die Konzentration der Prüfsubstanz (Sb) nach 28 Tagen in dieser Flasche zur Berechnung des prozentualen biologischen Abbaus zu verwenden.
Wenn DOC-Bestimmungen vorgenommen werden (wahlweise), dann ist der prozentuale biologische Endabbau entsprechend I.7.1. aus

zu berechnen. Wird in Flasche Nr. 1 bei der Bestimmung des physikalisch-chemisch bedingten Abbaus eine Abnahme an DOC festgestellt, so ist die DOC-Konzentration in dieser Flasche zur Berechnung des prozentualen biologischen Abbaus zu verwenden.
Sämtliche Ergebnisse sind auf den beigefügten Datenblättern zu protokollieren.
C.4-F. VII.3.2. Gültigkeit der Ergebnisse
Die Sauerstoffaufnahme in dem Inokulum-Blindansatz liegt normalerweise bei 20-30 mg/l O2 und sollte nach 28 Tagen einen Wert von 60 mg/l nicht überschreiten. Bei Werten über 60 mg/l sollten die Daten und die Versuchsdurchführung kritisch überprüft werden. Liegt der pH-Wert ausserhalb des Bereichs 6-8,5 und der Sauerstoffverbrauch durch die Prüfsubstanz unter 60 %, ist der Test mit einer geringeren Konzentration an Prüfsubstanz zu wiederholen.
Vgl. auch I.5.2.
Wenn der aus dem Sauerstoffverbrauch berechnete prozentuale Abbau des Anilins nach 7 Tagen nicht mehr als 40 % und nach 14 Tagen nicht mehr als 65 % beträgt, wird der Test als ungültig betrachtet.
C.4-F. VII.3.3. Abschlußbericht
Vgl. I.8.
C.4-F. VII.4. Datenblatt
Nachstehend ein Beispiel eines Datenblattes
MITI-(I)-TEST
Name:
Konzentration der Stammlösung: ... mg/l auf Substanz bezogen
Anfangskonzentration im Medium, C0: ... mg/l auf Substanz bezogen
Volumen des Reaktionsgemisches, V: ... ml
ThSB: ... mg O2/l
Entnahmeorte:
| 1) ... | 6) ... |
| 2) ... | 7) ... |
| 3) ... | 8) ... |
| 4) ... | 9) ... |
| 5) ... | 10) ... |
Konzentration der suspendierten Feststoffe im Belebtschlamm nach Akklimatisierung mit synthetischen Abwässern = ... mg/l
Menge Belebtschlamm pro Liter im Versuchsansatz = ... ml
Konzentration des Schlamms im Versuchsansatz = ... mg/l
Verwendeter Respirometertyp: ...
| Zeit (Tage) | |||||||
| 0 | 7 | 14 | 21 | 28 | |||
| Aufn. (mg) Prüfsubstanz | a1 | ||||||
| a2 | |||||||
| a3 | |||||||
| O2-Aufn. (mg) Blindwert | b | ||||||
| Korrigierte O2 Aufn. (mg) | (a1-b) | ||||||
| (a2-b) | |||||||
| (a3-b) | |||||||
| BSB pro mg Prüfsubstanz | (a-b)/C0V | Flasche 1 | |||||
| Flasche 2 | |||||||
| Flasche 3 | |||||||
| % Abbau
BSB/ThSB ξ 100 |
1 | ||||||
| 2 | |||||||
| 3 | |||||||
| Mittelwert* | |||||||
| * Bei erheblichem Unterschied sollten die Parallelansätze nicht gemittelt werden | |||||||
Anmerkung: Für die Referenzsubstanz sowie Toxizitätskontrolle können ähnliche Formblätter verwendet werden.
Kohlenstoffanalysator: ...
| Flasche | DOC | % DOC- Abnahme |
Mittelwert | |||
| Gemessener | Korrigierter | |||||
| Wasser + Prüfsubstanz | a | - | - | |||
| Schlamm + Prüfsubstanz | b1 | b1-c | ||||
| Schlamm + Prüfsubstanz | b2 | b2-c | ||||
| Schlamm + Prüfsubstanz | b3 | b3-c | ||||
| Blindkontrolle | c | - | - | |||
% DOC-Abnahme: (a-(b-c))/a x 100
| Restliche Menge an Prüfsubstanz zu Versuchsende |
% Abbau | |
| Blindversuch mit Wasser | Sb | |
| angeimpftes Medium | Sa1 | |
| Sa2 | ||
| Sa3 |
% Abbau =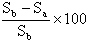
Der prozentuale Abbau ist für die Flaschen a1, a2 bzw. a3 zu berechnen.
Nach Möglichkeit ist die BSB-Zeit-Kurve beizufügen.
Anhang I
zur RL 67/548/EWG Anhang V C.4-F.
Abkürzungen und Definitionen
| DO: | Gelöster Sauerstoff (Dissolved Oxygen) (mg/l) - Konzentration des in einer wässrigen Probe gelösten Sauerstoffs. |
| BSB: | Biochemischer Sauerstoffbedarf (g) - von den Mikroorganismen beim Abbau einer Prüfsubstanz verbrauchte Sauerstoffmenge; auch angegeben als g Sauerstoffaufnahme pro g Prüfsubstanz (vgl. Methode C.5). |
| CSB: | Chemischer Sauerstoffbedarf (g) - bei der Oxidation einer Prüfsubstanz mit heissem, saurem Dichromat verbrauchte Sauerstoffmenge; Mass für die vorhandene Menge an oxidierbarer Substanz; auch angegeben als g Sauerstoffverbrauch pro g Prüfsubstanz (vgl. Methode C.6). |
| DOC: | Gelöster organischer Kohlenstoff (Dissolved Organic Carbon) - Menge an organischem Kohlenstoff, die in der Lösung vorliegt oder ein Filter mit 0,45 µm Porengrösse passiert bzw. nach 15 Minuten Zentrifugieren bei 40.000 m/s-2 (± 4000 g) im Überstand verbleibt. |
| ThSB: | Theoretischer Sauerstoffbedarf (mg) - Gesamtmenge an Sauerstoff, die zur vollständigen Oxidation einer Substanz erforderlich ist; wird aus der Summenformel berechnet (siehe Anhang II.2); auch angegeben als mg Sauerstoffbedarf pro mg Prüfsubstanz. |
| ThCO2: | Theoretisches Kohlendioxid (mg) - Kohlendioxidmenge, die sich rechnerisch aus dem bekannten oder gemessenen Kohlenstoffgehalt der Prüfsubstanz bei vollständiger Mineralisation ergibt; auch angegeben als mg Kohlendioxidentwicklung pro mg Prüfsubstanz. |
| TOC: | Gesamter organischer Kohlenstoff (Total Organic Carbon) einer Probe - Summe des organischen Kohlenstoffs in Lösung und in Suspension. |
| IC: | Anorganischer Kohlenstoff (Inorganic Carbon). |
| TC: | Gesamtkohlenstoff (Total Carbon) - Summe des in einer Probe enthaltenen organischen und anorganischen Kohlenstoffs. |
Biologischer Primärabbau:
durch biologische Prozesse in der chemischen Struktur einer Substanz herbeigeführte Veränderung, die zum Verlust spezifischer Eigenschaften dieser Substanz führt.
Biologischer Gesamtabbau (aerob):
der nach vollständiger Umsetzung durch Mikroorganismen erreichte Abbaugrad der Prüfsubstanz unter Erzeugung von Kohlendioxid, Wasser, Mineralsalzen und neuen mikrobiellen Zellbestandteilen (Biomasse).
biologisch leicht abbaubar:
ein willkürlich festgelegter Begriff für eine Kategorie von chemischen Substanzen, die bestimmte Screening-Tests auf voll ständige biologische Abbaubarkeit durchlaufen haben; diese Tests sind so stringent, daß angenommen wird, daß diese Substanzen im aquatischen Milieu unter aeroben Bedingungen schnell und vollständig biologisch abgebaut werden.
potentiell biologisch abbaubar:
ein Begriff für eine Kategorie von chemischen Substanzen, deren biologische Abbaubarkeit (primär oder vollständig) eindeutig in einem beliebigen, anerkannten Test auf biologische Abbaubarkeit nachgewiesen worden ist.
in einer Kläranlage abbaubar:
Eigenschaft chemischer Substanzen, im Verlauf der biologischen Abwasserbehandlung entfernt zu werden, ohne daß der normale Betrieb der Klärprozesse negativ beeinträchtigt wird. Im allgemeinen sind biologisch leicht abbaubare Substanzen in einer Kläranlage abbaubar, nicht aber alle potentiell abbaubaren Substanzen. Hier können auch abiotische Prozesse stattfinden.
Lag-Phase
in einem Abbaubarkeitstest die Zeit zwischen der Animpfung und dem Zeitpunkt, zu dem der prozentuale Abbau mindestens 10 % erreicht hat. Die Lag-Phase ist häufig sehr variabel und schwer reproduzierbar.
Abbauzeit
Zeit vom Ende der Lag-Phase bis zu dem Zeitpunkt, zu dem 90 % des maximalen Abbauwertes erreicht sind.10-Tage-Fenster der 10-Tage-Abschnitt, der unmittelbar auf das Erreichen von 10 % Abbau folgt.
Anhang II
zur RL 67/548/EWG Anhang V C.4-F.
Berechnung und Bestimmung geeigneter Summenparameter
Je nach der gewählten Methode werden bestimmte Summenparameter benötigt. Nachfolgend wird die Ableitung dieser Werte beschrieben. Die Verwendung dieser Parameter wird bei den einzelnen Methoden angegeben.
1. Kohlenstoffgehalt
Der Kohlenstoffgehalt wird aus der bekannten Elementzusammensetzung berechnet oder durch Elementanalyse der Prüfsubstanz bestimmt.
2. Theoretischer Sauerstoffbedarf (ThSB)
Der Theoretische Sauerstoffbedarf (ThSB) kann berechnet werden, wenn die Summenformel bekannt ist oder durch Elementaranalyse bestimmt wird. Für die Substanz
CcHhClclNnNanaOoPpSs
beträgt sie ohne Nitrifikation
| ThSBNH4 = | 16 (2 c + 1/2 (h-cl 3 n) + 3 s + 5/2 p + 1/2 na-o) | mg/mg |
| MG |
bzw. mit Nitrifikation
| ThSBNO3 = | 16 (2 c + 1/2 (h-cl) + 5/2 n + 3 s + 5/2 p + 1/2 na-o) | mg/mg |
| MG |
3. Chemischer Sauerstoffbedarf (CSB)
Der Chemische Sauerstoffbedarf (CSB) wird nach Methode C.6 bestimmt.
4. Gelöster organischer Kohlenstoff (DOC)
Gelöster organischer Kohlenstoff (DOC) ist per definitionem der organische Kohlenstoff, der bei Filtration einer chemischen Substanz oder Gemischs in Wasser durch ein Filter mit 0,45 µm Porengröße in dieser verbleibt.
Dazu werden Proben aus den Prüfgefässen entnommen und sofort im Filtrationsgerät unter Verwendung eines geeigneten Membranfilters filtriert. Die ersten 20 ml (diese Menge kann bei Verwendung kleiner Filter verringert werden) des Filtrats werden verworfen. 10 - 20 ml oder - bei Injektion - weniger (je nach der für den Kohlenstoffanalysator benötigten Menge) werden für die Kohlenstoffanalyse zurückbehalten. Die DOC-Konzentration wird mit Hilfe eines organischen Kohlenstoffanalysators bestimmt, der eine genaue Messung einer Kohlenstoffkonzentration von 10 % oder weniger der im Versuch verwendeten DOC-Ausgangs-Konzentration ermöglichen muss.
Filtrierte Proben, die am selben Arbeitstag nicht mehr analysiert werden können, können 48 h im Kühlschrank bei 2-4 °C bzw. über längere Zeiträume bei Temperaturen unter 18 °C aufbewahrt werden.
Anmerkungen:
Membranfilter sind häufig mit oberflächenaktiven Substanzen versehen, die ihnen hydrophile Eigenschaften verleihen. Daher kann der Filter bis zu mehreren mg löslichen organischen Kohlenstoff enthalten, der die Bestimmung der biologischen Abbaubarkeit beeinträchtigt. Um die oberflächenaktiven Substanzen sowie andere lösliche organische Verbindungen aus den Filtern zu entfernen, werden diese 3 x jeweils 1 Stunde in deionisiertem Wasser gekocht. Danach können die Filter eine Woche in Wasser aufbewahrt werden. Bei Verwendung von Einwegfilterpatronen, ist jede einzelne darauf zu überprüfen, daß sie keinen löslichen organischen Kohlenstoff freisetzt.
Bestimmte Membranfilter haben die Eigenschaft, die Prüfsubstanz zu adsorbieren. Es wird daher empfohlen, die Filter in dieser Hinsicht zu überprüfen.
Anstelle der Filtration kann zur Differenzierung von TOC und DOC eine 15-minütige Zentrifugation bei 40.000 m/s-2 (4000 g) vorgenommen worden. Allerdings ist dieses Verfahren bei einer Ausgangskonzentration < 10 mg/l DOC nicht zuverlässig, da entweder nicht alle Bakterien beseitigt werden oder aber der Kohlenstoff als Bestandteil des Bakterienplasmas erneut gelöst wird.
Literatur
Anhang III
zur RL 67/548/EWG Anhang V C.4-F.
Bewertung der biologischen Abbaubarkeit von schwerlöslichen Substanzen
Bei Bioabbaubarkeitstests mit schwerlöslichen Substanzen ist folgenden Aspekten besondere Aufmerksamkeit zu schenken.
Während homogene Flüssigkeiten selten Probleme bei der Probenahme bereiten, wird empfohlen, Feststoffe durch geeignete Mittel zu homogenisieren, um so durch Inhomogenität bedingte Fehler zu vermeiden. Besondere Vorsicht ist geboten, wenn repräsentative Proben von nur wenigen mg von Mischungen bzw. Substanzen, die reich an Verunreinigungen sind, benötigt werden.
Während der Prüfungen können verschiedene Bewegungsvorginge angewandt werden. Dabei sollte darauf geachtet werden, daß nur soviel bewegt wird, um die Substanz gut zu verteilen, und daß ein Überhitzen, übermäßige Schaumbildung sowie übermäßige Scherkräfte vermieden werden.
Ein Emulgator, der der Substanz eine stabile Dispersion verleiht, kann verwendet werden. Dieser sollte allerdings nicht bakterientoxisch sein und darf unter den Bedingungen des Versuchs einem biologischen Abbau nicht unterliegen oder Schaum bilden.
Dieselben Kriterien wie für Emulgatoren gelten für Lösungsmittel.
Es wird davon abgeraten, für feste Prüfsubstanzen feste Trägerstoffe zu verwenden; für ölige Substanzen können diese allerdings geeignet sein.
Wenn Hilfsstoffe, wie z.B. Emulgatoren, Lösungsmittel und Trägerstoffe, verwendet werden, ist ein Blindversuch mit dem Hilfsstoff mitzuführen.
Zur Prüfung der biologischen Abbaubarkeit von schwerlöslichen Substanzen kann jeder der drei respirometrischen Tests - CO2, BSB, MITI - eingesetzt werden. -
Literatur
Anhang IV
zur RL 67/548/EWG Anhang V C.4-F.
Beurteilung der biologischen Abbaubarkeit von chemischen Substanzen, bei denen Verdacht auf Toxizität gegenüber dem Inokulum besteht
Wenn eine Prüfsubstanz auf leichte biologische Abbaubarkeit getestet wird und biologisch nicht abbaubar scheint, wird folgendes Verfahren empfohlen, um zwischen Hemmung und stoffbedingter Nichtabbaubarkeit zu unterscheiden (Reynolds et al., 1987).
Für die Toxizitätsprüfung und den Test auf biologische Abbaubarkeit sind ähnliche oder gleiche Inokula zu verwenden.
Zur Bewertung der Toxizität von Prüfsubstanzen, die auf leichte biologische Abbaubarkeit getestet werden, erscheint die Anwendung einer oder einer Kombination der folgenden Methoden geeignet: Belebtschlamm: Prüfung des Atmungshemmung - Richtlinie 88/302/EWG, BSB und/oder Wachstumshemmung.
Um eine toxizisätsbedingte Hemmung zu vermeiden, wird empfohlen, daß die bei den Tests auf leichte biologische Abbaubarkeit verwendeten Prüfsubstanzkonzentrationen unter 1/10 der EC50-Werte (oder unter den EC20-Werten) aus dem Toxizitätsversuch liegen. Bei Verbindungen, deren EC50-Wert über 300 mg/l liegt, sind toxische Wirkungen bei Prüfungen auf leichte biologische Abbaubarkeit unwahrscheinlich.
Bei EC50Werten unter 20 mg/l sind bei den nachfolgenden Tests ernste Probleme zu erwarten. Es müssen niedrige Prüfkonzentrationen verwendet werden, die allerdings die Anwendung des stringenten und empfindlichen Geschlossenen Flaschentests bzw. die Verwendung von14C markiertem Material erforderlich machen. Alternativ dazu kann ein akklimatisiertes Inokulum die Verwendung höherer Prüfkonzentrationen erlauben. Im letzteren Falle geht das spezifische Kriterium der leichten biologischen Abbaubarkeit jedoch verloren.
Literatur
Reynolds, L. et al. Evaluation of the toxicity of substances so be assessed for biodegradability. Chemosphere, 1987, Vol. 16, 2259.
Anhang V
zur RL 67/548/EWG Anhang V C.4-F.
Berücksichtigung der Sauerstoffaufnahme infolge Nitrifikation
Bei Prüfsubstanzen, die keinen Stickstoff enthalten, sind Fehler, die durch Nichtberücksichtigung der Nitrifikation bei der Bewertung der biologischen Abbaubarkeit anhand der Sauerstoffaufnahme entstehen, von marginaler Bedeutung (nicht größer als 5 %), selbst wenn die Oxidation des Ammonium-N im Medium zwischen dem Prüf- und dem Blindansatz gelegentlich schwankt. Bei stickstoffhaltigen Prüfsubstanzen kann es jedoch zu schweren Fehlern kommen.
Bei auftretender, jedoch unvollständiger Nitrifikation, kann die Sauerstoffaufnahme durch das Reaktionsgemisch um den Sauerstoffverbrauch durch Oxidation von Ammonium zu Nitrit und Nitrat korrigiert werden, wenn die Konzentrationsänderungen von Nitrit und Nitrat während der Inkubation bestimmt und durch folgende Gleichungen berücksichtigt werden:
2 NH4CI + 3 O2 = 2 HNO2 + 2 HCl + 2 H2O (1)
2 HNO2 + O2 = 2 HNO3 (2)
insgesamt:
2 NH4CI + 4O2 =2 HNO3 +2 HCI +2 H2O (3)
Aus Gleichung (1) ergibt sich, daß die Sauerstoffaufnahme zur Oxidation von 28 g Stickstoff [Bestandteil von Ammoniumchlorid (NH4CI)] zu Nitrit 96 g beträgt; dies entspricht einem Faktor von 3,43 (96/28). Auf die gleiche Weise ergibt sich aus Gleichung (3) für die Oxidation von 28 g Stickstoff zu Nitrat eine Sauerstoffaufnahme von 128 g; dies entspricht einem Faktor von 4,57 (128/28).
Da es sich hier um aufeinanderfolgende Reaktionen handelt, die auf verschiedene Bakterienarten zurückzuführen sind, kann die Nitritkonzentration zu- oder abnehmen; im letzteren Falle würde eine äquivalente Nitratkonzentration gebildet. Der bei der Nitratbildung verbrauchte Sauerstoff beträgt daher 4,57, multipliziert mit der Konzentrationszunahme des Nitrats, wohingegen der bei der Nitritbildung verbrauchte Sauerstoff 3,43 beträgt, multipliziert mit der Konzentrationszunahme des Nitrits. Bei einer Nitritabnahme beträgt der Sauerstoffverlust -3,43, multipliziert mit der Abnahme der Konzentration.
Das heißt:
der bei der Nitratbildung verbrauchte O2 4,57 x Zunahme in N-Nitratkonz. (4)
und
der bei der Nitritbildung verbrauchte O2 = 3,43 x Zunahme in N-Nitritkonz. (5)
und
O2-Verlust bei der Nitritabnahme = Abnahme der N-Nitritkonzentration x -3,43 (6)
so daß
O2-Aufnahme infolge Nitrifikation = ± 3,43 x Änderung der N-Nitritkonz. + 4,57 x Zunahme der N-Nitratkonz. (7)
und infolgedessen
O2-Aufnahme durch Oxidation von C = festgestellte Gesamtaufnahme - Aufnahme infolge Nitrifikation (8)
Wenn andererseits nur der gesamte oxidierte N bestimmt wird, kann für die Sauerstoffaufnahme infolge Nitrifikation in erster Näherung ein Wert von 4,57 x Zunahme an oxidiertem N angenommen werden.
Der korrigierte Wert für den Sauerstoffverbrauch infolge Oxidation von C wird dann mit dem ThSBNH4, berechnet nach Anhang II, verglichen.
 |
weiter . |  |
(Stand: 04.08.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: 90.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion
...
X
⍂
↑
↓