 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk |
 |
TensV - Tensidverordnung
Verordnung über die Abbaubarkeit anionischer und nicht ionischer grenzflachenaktiver Stoffe in Wasch- und Reinigungsmitteln
Vom 30. Januar 1977
(BGBl. S. 244;...; 04.06.1986 S. 851; 29.04.2007 S. 600aufgehoben)
Gl.-Nr.: 753-8-1
Auf Grund des § 3 Abs. 2 des Waschmittelgesetzes vom 20. August 1975 (BGBl. I S. 2255) wird nach Anhörung der beteiligten Kreise im Einvernehmen mit den Bundesministern für Wirtschaft und für Jugend, Familie und Gesundheit mit Zustimmung des Bundesrates verordnet:
§ 1 Mindestanforderungen an die Abbaubarkeit
Anionische und nichtionische grenzflächenaktive Stoffe in Wasch- und Reinigungsmitteln müssen durchschnittlich zu mindestens 90 vom Hundert auf biologischem Wege abbaubar sein. Diese Anforderung gilt als eingehalten, wenn eine einmalige Prüfung unter Anwendung des nach § 2 vorgeschriebenen Meßverfahrens mindestens den Wert 80 vom Hundert ergibt.
§ 2 Meßverfahren
Die Abbaubarkeit im Sinne dieser Verordnung ist nach den in der Anlage vorgeschriebenen Meßverfahren zu bestimmen.
§ 3 Übergangsbestimmung
(1) Die § § 1 und 2 finden auf diejenigen nichtionischen grenzflächenaktiven Stoffe, die als schwachschäumende Additionsprodukte von Alkenoxiden mit Substanzen wie Alkoholen, Alkylphenolen, Glykolen, Polyolen, Fettsäuren, Amiden oder Aminen oder als alkaliresistente endständig blockierte Alkyl- und Alkylarylpolyglykolether in Reinigungsmitteln für die Lebensmittelindustrie und für die metallverarbeitende Industrie verwendet werden, bis zum 31. Dezember 1989 keine Anwendung. Dies gilt nicht, soweit diese Stoffe im Bereich der Lebensmittelindustrie bei der schnellaufenden Hochleistungsflaschenreinigung verwendet werden.
(2) Der Absatz 1 findet auf die dort genannten nichtionischen grenzflächenaktiven Substanzen, die nach dem 31. März 1986 in Verkehr gebracht werden, nur Anwendung, wenn die biologische Abbaubarkeit der genannten Substanzen größer ist als diejenige der Produkte, die für den gleichen Verwendungszweck bis zum 31. März 1986 hergestellt worden sind.
§ 4 Berlin-Klausel
Diese Verordnung gilt nach § 14 des Dritten Überleitungsgesetzes vom 4. Januar 1952 (BGBl. I S. 1) in Verbindung mit § 13 des Waschmittelgesetzes auch im Land Berlin.
§ 5 Inkrafttreten
(1) Diese Verordnung tritt am 1. Oktober 1977 in Kraft.
(2) Mit dem Inkrafttreten dieser Verordnung tritt die Verordnung über die Abbaubarkeit von Detergentien in Wasch- und Reinigungsmitteln vom 1. Dezember 1962 (BGBl. I S. 698) außer Kraft.
| Meßverfahren zur Bestimmung der biologischen Abbaubarkeit von anionischen und nichtionischen synthetischen Tensiden in Wasch- und Reinigungsmitteln |
Anlage zu § 2 |
0 Grundsätzliches
Als anionische Tenside im Sinne dieser Rechtsverordnung gelten Verbindungen, die nach der unter Nummer 4.2 beschriebenen Analysenvorschrift als methylenblauaktive Substanz (MBAS) bestimmt werden.
Als nichtionische Tenside im Sinne dieser Rechtsverordnung gelten Verbindungen, die nach Durchgang durch einen Kationen- und Anionenaustauscher nach der unter Nummer 4.3 beschriebenen Analysenvorschrift als wismutaktive Substanz (BiAS) bestimmt werden.
Eine Trennung in anionische und nichtionische Tenside aus Wasch- und Reinigungsmitteln ist notwendig, um gegenseitige Störungen bei der biologischen Abbauprüfung zu vermeiden.
Zur Bestimmung der Abbaubarkeit sind zwei biologische Meßverfahren anwendbar:
Tenside, die im Auswahltest eine Abbaurate von 80 % erreichen, gelten als abbaubar. Liegt die Abbaurate unter 80% oder ist das Testergebnis nicht eindeutig, so ist der Bestätigungstest durchzuführen.
1 Auswahltest
1.1 Anwendungsbereich, Prinzip, Störungen
Der Auswahltest ist auf anionische synthetische Tenside und nichtionische synthetische Tenside anwendbar. 5 mg MBAS/l bzw. BiAS/l oder eine ebensoviel MBAS bzw. BiAS enthaltende Menge des zu untersuchenden und nach Nummer 3 vorbehandelten Wasch- und Reinigungsmittels werden in einem mineralischen Nährmedium mit aeroben, polyvalenten Mikroorganismen beimpft und bei einer Temperatur von 298 ± 1 (K) (25 ± 1 °C) bebrütet. Der Versuchsablauf wird mittels eines biologisch "harten" und eines biologisch "weichen" Standard-Tensids kontrolliert.
Der Test kann gestört werden z.B. durch Metallionen, organische Lösungsmittel und Bakterizide.
1.2 Chemikalien und Geräte
1.2.1 Entsalztes Wasser:
Als Lösungsmittel ist entsalztes Wasser zu verwenden, das keine den Abbau störenden Konzentrationen von Metallionen, z.B. Kupfer, enthält. Geeignet ist Wasser, das durch Ionenaustausch oder Destillation entsalzt wurde.
1.2.2 Mineralische Nährlösung:
Je 1 ml der nachstehenden Lösungen Nummer 1.2.2.1, 1.2.2.2, 1.2.2.3 und 1.2.2.4 wird unmittelbar vor Gebrauch zu 1000 ml entsalztem Wasser gegeben:
| 8,5 g | Kaliumdihydrogenphosphat KH2PO4 p. a. |
| 21,75 g | Dikaliumhydrogenphosphat K2HPO4p. a. |
| 33,4 g | Dinatriumhydrogenphosphat Na2HPO4 × 2H2O p. a. |
| und | |
| 1,7 g | Ammoniumchlorid NH4Cl p. a, gelöst in 1000 ml entsalztem Wasser. |
Der pH-Wert der Lösung soll 7,2 betragen.
1.2.2.2 Magnesiunmsulat-Lösung:
22,5 g MgSO4 × 7H2O p. a., gelöst in 1000 ml entsalztem Wasser
1.2.2.3 Calciumchlorid-Lösung:
27,5 g CaCl2 × 2H2O p. a., gelöst in 1000 ml entsalztem Wasser
1.2.2.4 Eisen (III)-Chlorid-Lösung:
0,25 g FeCl3 × 6H2O p. a., gelöst in 1000 ml entsalztem Wasser
1.2.3 Abbaustandard:
Bei der Abbauprüfung anionischer und nichtionischer Tenside sind Abbaustandards zur Kontrolle des biologischen Systems anzuwenden.
Als Abbaustandard W (weich) für biologisch leicht abbaubare anionische Tenside dient technisches lineares Alkylbenzolsulfonat (OECD-Standard: Marion A). Dieses weist unter den Bedingungen des Auswahltestes eine Abbaurate um 92 % auf.
Als Abbaustandard H (hart) für biologisch schwer abbaubare anionische Tenside dient Tetrapropylenbenzolsulfonat (Alkylbenzolsulfonat mit verzweigter Alkylkette), das unter den Bedingungen des Auswahltestes eine Abbaurate bis zu 35 % aufweist.
1.2.4 Konservierungslösung:
Lösung von 10 g Quecksilber (II)-chlorid HgCl2 in 1000 ml entsalztem Wasser zur Konservierung von Proben.
1.2.5 Schüttelmaschine für Erlenmeyerkolben mit 2 l Inhalt, gegebenenfalls mit Temperaturregulierung:
Bei Verwendung eines Schüttelgerätes ohne Thermostat ist die Prüfung in einem thermostatisierten Raum bei 298 ± 1 (K) (25 ± 1 °C) durchzuführen.
1.2.6 Erlenmeyerkolben mit engem Hals, Inhalt 2 l:
Die Gefäße sind vor der Verwendung sorgfältig mit Alkohol zu reinigen, auszuspülen und zu trocknen, um Reste von Verunreinigungen (Tenside) aus früheren Versuchen zu entfernen. Neue Gefäße können Fehlresultate ergeben. Deshalb ist eine Reinigung auch vor der ersten Verwendung erforderlich.
1.3 Vorbereitung der Proben
Vor Ansatz der Testlösung sind die Gehalte an MBAS, BiAS und Seife der Probe nach Nummer 4 und 5 zu bestimmen. Der analytische Befund entscheidet über die weitere Behandlung der Probe.
Anionische bzw. nichtionische Tenside (Waschrohstoffe) werden für sich allein ohne Vorbehandlung geprüft.
Wasch- und Reinigungsmittel werden nach Nummer 3 vorbehandelt.
1.4 Beimpfung
1.4.1 Zur Beimpfung der anorganischen Nährlösung mit aeroben polyvalenten Mikroorganismen ist der Ablauf einer biologischen Kläranlage für vorwiegend häusliches Abwasser als Impfsuspension einzusetzen.
Ist der Ablauf einer geeigneten biologischen Kläranlage nicht verfügbar, so kann auch eine Impfsuspension aus Erde benutzt werden. Bei Verwendung von Impfsuspension aus Erde gilt folgende Vorschrift: 100 g Gartenerde (fruchtbar, nicht steril) werden in 1000 ml chlorfreiem Trinkwasser suspendiert (Böden mit viel Lehm oder Sand oder stark humushaltige Böden sind ungeeignet). Nach dem Einrühren der Bodenprobe läßt man 30 Minuten lang absetzen. Das überstehende Wasser wird durch ein grobporiges Papierfilter filtriert. Man verwirft die ersten 200 ml; der Rest des Filtrats wird sofort und bis zur Verwendung belüftet. In jedem Fall muß die Impfsuspension am gleichen Tag verwendet werden. Die Eignung wird ebenfalls in Parallelversuchen mit dem "weichen" und "harten" Standard kontrolliert.
Die anzuwendende Menge ist von der biologischen Aktivität der Impfsuspension abhängig.
Diese ist vor Durchführung der Tests experimentell am Abbaustandard W und H zu ermitteln. Im allgemeinen sind Mengen unter 0,5 ml Impfsuspension auf 1000 ml Nährlösung ausreichend.
Der Abbaustandard W muß innerhalb von 14 Tagen (tΑ ) einen Abbau um 92 % erreichen; der Abbaustandard H darf in der Zeit tA + tX, das sind maximal 19 Tage, nur um 35 % oder niedriger abgebaut werden.
1.4.2 Impfsuspension aus Kläranlagen-Ablauf
Verwendet wird der Ablauf einer biologischen Kläranlage für vorwiegend häusliches Abwasser. Die Ablaufprobe muß von der Entnahme bis zur Verwendung aerob gehalten werden. Das Abwasser wird durch ein grobporiges Papierfilter filtriert; die ersten 200 ml werden verworfen. Das Filtrat der Impfsuspension wird bis zur Verwendung belüftet. Die Impfsuspension muß am gleichen Tag verwendet werden.
1.5 Durchführung der Abbauprüfung
1.5.1 Anionische Tenside
Das anionische Tensid bzw. die nach Nummer 3 vorbereitete Probe des Wasch- und Reinigungsmittels und die Abbaustandards W bzw. H werden gleichzeitig und jeweils in Doppelansätzen geprüft. Für den Doppelansatz werden etwa 2 l Kulturlösung benötigt.
Die Kulturlösung wird wie folgt hergestellt:
Zu 2 l mineralischer Nährlösung nach Nummer 1.2.2 werden 10 ml der etwa 1 mg MBAS/ml enthaltenden Lösung der zu untersuchenden Probe oder der Lösung des Abbaustandards W bzw. H und die entsprechende Menge Impfsuspension nach Nummer 1.4.2 gegeben, die empirisch ermittelt wurde.
Die Kulturlösung muß bei der Probeentnahme schaumfrei sein. In einer Doppelbestimmung wird der MBAS-Gehalt nach Nummer 4.2 auf 0,1 mg/l genau festgestellt. Der Mittelwert ist die in die Auswertung einzusetzende Anfangskonzentration Co, die zwischen 4,5 und 5,5 mg MBAS/l liegen muß.
Für die Abbauprüfung werden je 900 ml der Kulturlösung in zwei Erlenmeyerkolben nach Nummer 1.2.6 gefüllt. Die Gefäße werden mit einem Wattestopfen lose verschlossen und bei 298 ± 1 (K) (25 ± 1 °C) im Schüttelapparat nach Nummer 1.2.5 bebrütet. Die Temperatur muß während der Prüfzeit eingehalten werden. Die Gefäße sind gegen Lichteinwirkung abzuschirmen. Die Luft in der Umgebung der Gefäße darf keine hemmend wirkenden Verunreinigungen wie z.B. Lösungsmitteldämpfe enthalten.
Im Verlauf der Abbauprüfung wird der MBAS-Gehalt am 5., 8. und dann jeden 2. Tag nach Nummer 4.2 bestimmt. Für die jeweiligen Einzelbestimmungen dürfen nur die unbedingt erforderlichen Mengen der Kulturlösung entnommen werden; zu Versuchsbeginn etwa 10 bis 20 ml, gegen Versuchsende bis etwa 100 ml. Verdunstungsverluste der Kulturlösung sind unter Berücksichtigung der entnommenen Probemengen zumindest bei der Probenahme für die letzte Bestimmung mit entsalztem Wasser auszugleichen. Vor der Entnahme ist vorhandener Schaum zu zerstören und die Kulturlösung gut zu durchmischen. Dabei ist an den Kolbenwandungen angetrocknetes Material mit zu erfassen. Müssen die entnommenen Meßproben länger als 3 Stunden bis zur Analyse aufbewahrt werden, sind sie mit 5 ml der Konservierungslösung nach Nummer 1.2.4 je 1 Meßprobe oder durch Einfrieren zu konservieren. Die Abbauprüfung ist beendet, wenn die Differenz der Abnahmen der MBAS-Gehalte bei 2 Messungen im Abstand von 4 Tagen geringer als 0,15 mg/l oder wenn die Prüfzeit von 19 Tagen erreicht ist.
1.5.2 Nichtionische Tenside
Das nichtionische Tensid oder die nach Nummer 3 vorbereitete Probe des zu untersuchenden Wasch- oder Reinigungsmittels und die Abbaustandards W bzw. H werden gleichzeitig und jeweils in Doppelansätzen geprüft. Für den Ansatz des nichtionischen Tensids benötigt man 5 l Kulturlösung.
Die Kulturlösung wird wie folgt hergestellt:
Zu 5 l Nährlösung werden 25 ml der etwa 1 mg BiAS/ml enthaltenden Lösung der zu untersuchenden Probe oder der Lösung des Abbaustandards W bzw. H und die entsprechende Menge Impfsuspension nach Nummer 1.4.2 gegeben, die empirisch ermittelt wurde. Die Kulturlösung muß bei Probenahme schaumfrei sein. Der BiAS-Gehalt wird nach Nummer 4.3 in einer Doppelbestimmung auf 0,1 mg/l genau festgestellt. Der Mittelwert ist die in die Auswertung einzusetzende Anfangskonzentration Co, die zwischen 4,5 und 5,5 mg BiAS/l liegen muß.
Für die Abbauprüfung werden je 1200 ml der Kulturlösung in 4 Erlenmeyerkolben nach Nummer 1.2.6 gefüllt. Die Gefäße werden mit einem Wattestopfen lose verschlossen und bei 298 ± 1 (K) (25 ± 1 °C) im Schüttelapparat nach Nummer 1.2.5 bebrütet. Die Temperatur muß während der Prüfzeit eingehalten werden. Die Gefäße sind gegen Lichteinwirkung abzuschirmen. Die Luft in der Umgebung darf keine hemmend wirkenden Verunreinigungen wie z.B. Lösungsmitteldämpfe enthalten.
Die Bestimmung der nichtionischen Tenside hat nach 14 und 19 Tagen zu erfolgen. Es empfiehlt sich, auch nach 5 Tagen Tensidbestimmungen zur Ermittlung des Verlaufs der Abbaukurve durchzuführen. Nach 14 Tagen werden aus je 2 Kolben je 200 ml Kulturlösung entnommen und zu einer Analysenprobe vereinigt. Nach 19 Tagen werden in gleicher Weise je 500 ml aus je 2 Kolben entnommen und vereinigt. Verdunstungsverluste sind mit entsalztem Wasser auszugleichen. Vor der Entnahme der Probe ist vorhandener Schaum zu zerstören und die Kulturlösung zu durchmischen. Dabei ist an der Kolbenwandung angetrocknetes Material mit zu erfassen. Müssen die entnommenen Meßproben länger als 3 Stunden bis zur Analyse aufbewahrt werden, so sind sie mit 5 ml der Konservierungslösung nach Nummer 1.2.4 je 1 Meßprobe oder durch Einfrieren zu konservieren. Die Untersuchung der Standardsubstanzen erfolgt nach Nummer 1.5.1.
1.6 Auswertung
Aus den Tensidgehalten der Kulturlösungen zu den verschiedenen Entnahmezeiten wird in Beziehung zur Ausgangskonzentration Co der jeweilige Abbau in Prozenten nach folgender Formel berechnet:
| Co- Ct | ||
| At= | x 100 | |
| Co |
Es sind:
At = Abbau zur Zeit t in Prozenten
Co = mittlere Ausgangskonzentration der Kulturlösung in mg Tensid/l
Ct = Konzentration der Kulturlösung in mg Tensid/l zum Zeitpunkt t
Die Abbauraten der Einzelbestimmungen werden auf 0,1 % genau berechnet. Angegeben wird das auf ganze Prozentzahlen gerundete Mittel der Abbauraten der Einzelbestimmungen. Auf 0,5 % endende Resultate werden abgerundet.
Die zeichnerische Ermittlung der Abbaurate für anionische und nichtionische Tenside erfolgt nach dem Diagramm in Abbildung 1.
Für anonische Tenside werden die Werte gegen die Zeit gemäß Abbildung 1 aufgetragen. Bei biologisch abbaubarer MBAS zeigt die Kurve einen deutlich ausgeprägten Knickpunkt. Das Plateau nach dem Knickpunkt ist erreicht, wenn zwei Meßwerte über eine Periode von 4 Tagen eine Differenz von weniger als 0,15 mg MBAS/1 zeigen. Der erste dieser Meßwerte (Ct) wird als Beginn des Plateaus angenommen und der Bewertung in Prozenten der Abbaurate (At) zugrunde gelegt.
Erreichen Produkte in der Zeit tA + tX (max. 19 Tage, siehe Abb. 1) kein Plateau, dann wird die jeweilige Konzentration zu diesem Zeitpunkt der Bewertung zugrunde gelegt, z.B. bei Abbaustandard H.
Bei nichtionischen Tensiden ist Ct der am 19. Tag bestimmte Wert.
Die Resultate der Abbauprüfung sind gültig, wenn folgende Bedingungen erfüllt sind:
In der gleichzeitig durchgeführten Vergleichsmessung muß der Abbaustandard W innerhalb 14 Tagen (tA) eine Abbaurate um 92 % erreicht haben (im allgemeinen sind Zeiten von 7 bis 10 Tagen zu beobachten); der Abbaustandard H darf nach 19 Tagen höchstens um 35 % abgebaut sein.
Wenn diese Bedingungen nicht erfüllt sind, ist die Prüfung mit einer variierten Impfmenge nach Nummer 1.4.1 zu wiederholen.
Tenside, die innerhalb der gegebenen Versuchszeit tA + tX eine Abbaurate von 80 % nicht erreichen oder deren Abbauraten in den Einzelansätzen bei Wiederholung des Tests nicht übereinstimmen oder deren Abbaukurven nicht dem allgemeinen Verlauf, z.B. der Abbaustandards entsprechen, sind im Bestätigungstest zu prüfen.
2 Bestätigungstest
2.1 Anwendungsbereich, Prinzip, Störungen
Der Bestätigungstest ist auf anionische und nichtionische synthetische Tenside (MBAS und BiAS) anwendbar.
In einer Belebungsanlage (Labormaßstab) wird ein synthetisches Abwasser, das etwa 20 mg MBAS/l oder etwa 10 mg BiAS/l enthält oder eine ebensoviel MBAS bzw. BiAS enthaltende Menge des zu untersuchenden und nach Nummer 3 vorbehandelten Wasch- oder Reinigungsmittels, in kontinuierlichem Durchfluß 3 Stunden lang belüftet. Aus der Differenz der MBAS bzw. BiAS-Gehalte zwischen Zu- und Ablauf der Anlage wird die Abbaurate in Prozenten errechnet.
Abbildung 1
Ermittlung der biologischen Abbaurate
Auswahl-Test

Der Test kann gestört werden z.B. durch Metallionen, organische Lösungsmittel und Bakterizide.
2.2 Chemikalien und Geräte
2.2.1 Prüfeinrichtung:
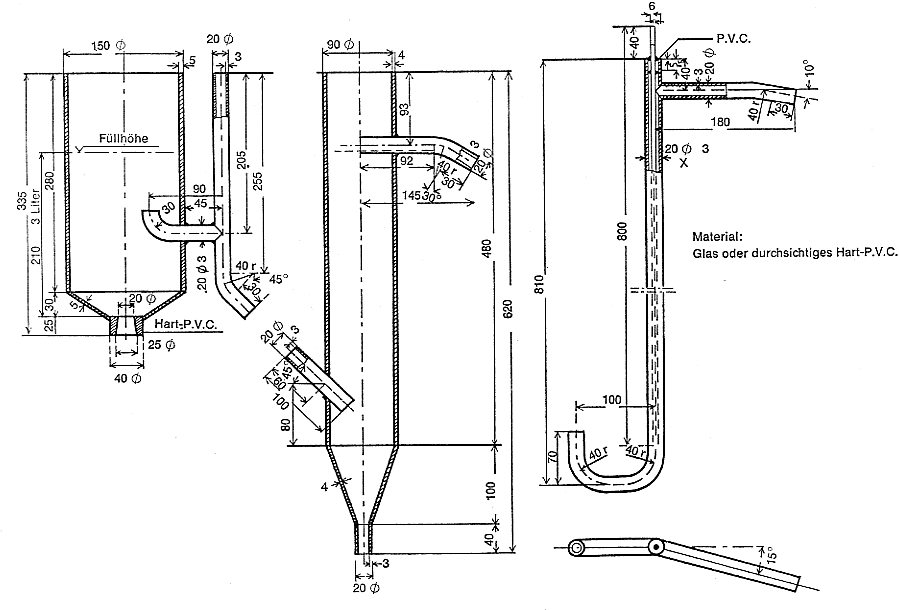
Für den Bestätigungstest ist die in Abbildung 2 dargestellte Belebungsanlage in den Maßen und Ausführungen nach Abbildung 3 zu verwenden.
Die Anordnung besteht aus dem Vorratsgefäß a für das synthetische Abwasser, der Dosierungseinrichtung B, dem Belebungsgefäß C, dem Absetzgefäß D, der Mammutpumpe E (für die Rückförderung des abgesetzten belebten Schlammes) und dem Sammelgefäß F für den Ablauf.
Das Vorratsgefäß a und das Sammelgefäß F müssen aus Glas oder Kunststoff bestehen. Der Inhalt soll mindestens 24 l betragen. Die Dosiereinrichtung B muß einen regelmäßigen Zufluß des synthetischen Abwassers zum Belebungsgefäß C gewährleisten. Die Füllmenge des Belebungsgefäßes C beträgt 3 l. Zur Belüftung wird an der Spitze des konischen Teils des Belebungsgefäßes eine Fritte G gehängt. Zur Kontrolle der eingeblasenen Luftmenge ist ein geeignetes Meßgerät anzuschließen.
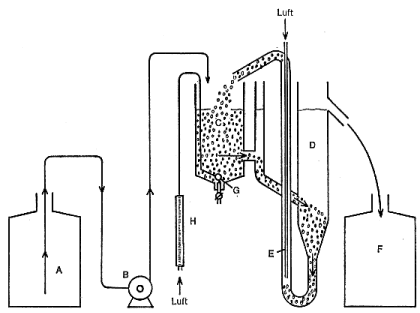
| A | Vorratsgefäß | E | Mammutpumpe |
| B | Dosiereinrichtung | F | Sammelgefäß |
| C | Belebungsgefäß (Inhalt 3 l) | G | Fritte |
| D | Absetzgefäß | H | Luftmengenmesser |
2.2.2 Synthetisches Abwasser:
Für den Bestätigungstest wird ein synthetisches Abwasser verwendet, von dem je Tag 24 l benötigt werden.
Zur Bereitung des synthetischen Abwassers werden in 1000 ml Trinkwasser gelöst:
| 160 mg | Pepton aus Casein |
| 110 mg | Fleischextrakt |
| 30 mg | Harnstoff CO(NH2)2 |
| 7 mg | Natriumchlorid NaCl |
| 4 mg | Calciumchlorid CaCl2 × 2H2O |
| 2 mg | Magnesiumsulfat MgSO4 × 7H2O |
| und | etwa |
| 20 mg | Methylenblauaktive Substanz (MBAS) |
| oder | etwa |
| 10 mg | Wismutaktive Substanz (BiAS) |
Das synthetische Abwasser ist täglich frisch zu bereiten.
2.2.3 Eisen (III)-Chlorid-Lösung, 5 % FeCl3.
2.3 Vorbereitung der Proben
Anionische und nichtionische Tenside (Waschrohstoffe) können ohne Vorbehandlung geprüft werden.
Wasch- und Reinigungsmittel werden auf den MBAS- und/oder den BiAS- sowie den Seifengehalt analysiert. Die Vorbehandlung nach Nummer 3 ist auf jeden Fall erforderlich.
2.4 Betrieb der Prüfeinrichtung
Zu Beginn des Testes werden das Belebungsgefäß C sowie das Absetzgefäß D mit synthetischem Abwasser nach Nummer 2.2.2 gefüllt und das Absetzgefäß D in der Höhe so fixiert, daß das Belebungsgefäß C 3 l aufnimmt. Dann werden die Luftzufuhr, die Mammutpumpe E und die Dosierungseinrichtung B eingeschaltet. Der Zulauf des synthetischen Abwassers in das Belebungsgefäß C muß 1 l je Stunde betragen, um eine Belüftungszeit von 3 Stunden zu gewährleisten. Nach Füllen der Gefäße C und D wird mit 3 ml Impfsuspension durch Zugabe in das Belebungsgefäß C angeimpft, um einheitliche Ausgangsbedingungen zu erhalten.
Als Impfsuspension ist Kläranlagenablauf nach Nummer 1.4.2 der Vorschrift des Auswahltestes anzuwenden.
Die Luftzufuhr ist so einzustellen, daß im Belebungsgefäß C ein Absetzen des belebten Schlammes verhindert und ein Mindestgehalt an gelöstem Sauerstoff von 2 mg/l, ermittelt nach Nummer 6 , ständig aufrecht erhalten wird.
Auftretender stabiler Schaum ist durch geeignete Maßnahmen zu bekämpfen. Bei Anwendung von Entschäumern dürfen diese keine nachteilige Wirkung auf den belebten Schlamm ausüben und keine MBAS bzw. BiAS enthalten.
Die Mammutpumpe E muß so eingestellt werden, daß ein gleichmäßiger Rücklauf von belebtem Schlamm aus dem Absetzgefäß D zum Belebungsgefäß C erfolgt. Angesammelter Schlamm ist mindestens einmal pro Tag auf geeignete Weise vom Rand des Belebungsgefäßes, des Absetzbeckens und aus den Leitungen in das Kreislaufsystem zurückzuführen. Wenn der Schlamm sich nicht absetzt, kann sein Volumengewicht durch gegebenenfalls wiederholte Zugabe von je 2 ml einer 5 % Eisen (III)-Chlorid-Lösung nach Nummer 2.2.3 erhöht werden.
Das aus dem Absetzgefäß D abfließende Wasser wird in dem Sammelgefäß F über 24 Stunden aufgefangen. Nach Ablauf dieser Zeit wird die Probe nach intensiver Durchmischung entnommen. Das Sammelgefäß F ist gründlich zu reinigen.
2.5 Überwachung der Prüfeinrichtung
Der MBAS- bzw. BiAS-Gehalt des synthetischen Abwassers (mg/l) wird nach Nummer 4.2 bzw. 4.3 unmittelbar vor dem Gebrauch und der des Ablaufes aus dem Sammelgefäß F unmittelbar nach der Probenahme bestimmt. Ist die Bestimmung innerhalb von 3 Stunden nicht möglich, müssen die Proben durch Zugabe von Konservierungslösung nach Nummer 1.2.4 entsprechend 50 mg HgCl2 je 1 Probe oder durch Einfrieren konserviert werden.
Zur Kontrolle des störungsfreien biologischen Abbaues im Testverlauf ist in gleichmäßigen Zeitabständen, mindestens zweimal wöchentlich, die Oxidierbarkeit nach Nummer 7 im Filtrat des Zu- und Ablautes zu bestimmen und deren Abnahme in Prozenten zu berechnen. Das Ende der Einarbeitungszeit ist an einem weitgehend stetigen Verlauf der Abnahme der Oxidierbarkeit und des MBAS- bzw. des BiAS-Abbaus zu erkennen.
Der organische Anteil der Trockensubstanz des belebten Schlammes (Glühverlust) im Belebungsgefäß C soll 2 bis 2,5 g/l betragen. Er ist zweimal wöchentlich nach Nummer 8 zu bestimmen. Beträgt der Glühverlust mehr als 2,5 g/l, so ist, um eine Änderung der Schlammbelastung zu vermeiden, der Überschußschlamm portionsweise, aber jeweils nicht mehr als ein Drittel der Gesamtschlammenge aus dem System zu entfernen.
Der Bestätigungstest muß bei annähernd gleichbleibender Raumtemperatur im Bereich zwischen 291 (K) und 298 (K) (18 - 25 °C) durchgeführt werden.
2.6 Auswertung
Aus den Werten der täglich durchgeführten Bestimmungen der MBAS- bzw. BiAS-Gehalte im Zulauf und in einem Zeitraum von 24 Stunden gesammelten Ablauf im Sammelgefäß F wird der tägliche Abbauwert in Prozenten der MBAS bzw. BiAS berechnet und gemäß Abbildung 4 graphisch dargestellt. Für die Bewertung der biologischen Abbaurate der MBAS bzw. der BiAS ist das arithmetische Mittel aus den Abbauwerten in Prozenten zu bilden, die nach dem Ende der Einarbeitungszeit an 21 aufeinanderfolgenden Tagen mit etwa gleichbleibendem Abbau bei störungsfreiem Betrieb ermittelt wurden. In keinem Fall soll die Einarbeitungszeit länger als 6 Wochen dauern. In eindeutigen Fällen kann die Häufigkeit dieser Bestimmungen auf jeden 2. oder 3. Tag beschränkt werden. Zur Berechnung der Abbaurate müssen aber innerhalb der 21 Tage dauernden Bewertungszeit mindestens 14 Bestimmungen durchgeführt worden sein.
2.7 Angabe der Ergebnisse
Die Abbauwerte an den einzelnen Tagen werden auf 0,1 % berechnet. Die mittlere Abbaurate während der Bewertungszeit wird in ganzzahligen Prozenten des Abbaus angegeben.
Die Bewertung der biologischen Abbaurate bezieht sich nur auf die MBAS oder auf die BiAS.
3 Präparative Gewinnung der synthetischen Tenside für die Prüfung der biologischen Abbaubarkeit nach Nummer 1 bzw. Nummer 2
3.1 Vorbemerkungen
Anionische und nichtionische Tenside (Waschrohstoffe) werden bei den Abbauprüfungen ohne Vorbehandlung eingesetzt.
In Wasch- oder Reinigungsmitteln bestimmt man nach Homogenisierung zunächst den Gehalt an anionischen und nichtionischen Tensiden nach Nummer 4.1 und Nummer 4.2. Die Bestimmung des Seifengehaltes erfolgt nach der unter Nummer 5 angegebenen Analysenmethode. Die Bestimmung der Gehalte ist für die Berechnung der Ausbeute der präparativen Aufarbeitung erforderlich.
Eine quantitative Extraktion ist nicht erforderlich, jedoch sind wenigstens 80 % der betreffenden Tenside zu extrahieren; im allgemeinen werden 90 % und mehr erreicht.
Störende kationische Tenside werden durch den vorgeschalteten Kationenaustauscher entfernt.
Die für die biologische Abbauprüfung benötigten Tensidmengen sind etwa:
| MBAS | BiAS | |
| Auswahltest | 1 g | 1 g |
| Bestätigungstest | 50 g | 25 g |
Abbildung 4
Berechnung der biologischen Abbaurate
Bestätigungs-Test

3.2 Chemikalien und Geräte
3.2.1 Entsalztes Wasser
3.2.2 Äthanol, 95 Vol. % C2H5OH
(zulässig als Vergällungsmittel: Methyläthylketon)
3.2.3 Lösung von Kohlendioxid in Äthanol (etwa 0,1 % CO2):
Zur Herstellung leitet man mittels eines mit Fritte versehenen Einleitungsrohres 10 Minuten Kohlendioxid (CO2) durch das Äthanol nach Nummer 3.2.2. Die Lösung ist stets frisch zu bereiten.
3.2.4 Isopropanol-Wassergemisch (50/50):
50 Volumteile Isopropanol (CH3CHOH × CH3) auf 50 Volumteile Wasser nach Nummer 3.2.1
3.2.5 Ammoniumhydrogencarbonat-Lösung (20/80):
1 Mol NH4HCO3 in 1000 ml Isopropanol-Wassergemisch aus 20 Volumteilen Isopropanol und 80 Volumteilen Wasser nach Nummer 3.2.1
3.2.6 Ammoniumhydrogencarbonat-Lösung (60/40):
0,3 Mol NH4HCO3 in 1000 ml Isopropanol-Wassergemisch aus 60 Volumteilen Isopropanol und 40 Volumteilen Wasser nach Nummer 3.2.1
3.2.7 Kationenaustauscher (KAT), stark sauer, alkoholfest (50 - 100 mesh)
3.2.8 Anionenaustauscher (AAT) makroporös Merck Lewatit MP 7080 (70 - 150 mesh)
3.2.9 Salzsäure, 10 % HCl
3.2.10 Rundkolben mit Schliff und Rückflußkühler, Inhalt 1000 ml
3.2.11 Nutsche (heizbar) für Papierfilter, Durchmesser 90 mm
3.2.12 Saugflasche, 2 l
3.2.13 Austauschersäule mit Heizmantel und Hahn:
Durchmesser des Innenrohres 30 mm, Höhe 200 mm ( Abbildung 5 )
3.2.14 Wasserbad
3.2.15 Vakuumtrockenschrank
3.2.16 Thermostat
3.2.17 Austauschersäule wie nach Nummer 3.2.13 mit Heizmantel und Hahn, in veränderten Maßen (analog Abb. 5): Durchmesser des Innenrohres 60 mm, Höhe 450 mm.
 |
weiter . |  |
(Stand: 05.02.2021)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: 90.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion