 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, Arbeitsschutz; Arbeits- und Sozialrecht, BKV
 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, Arbeitsschutz; Arbeits- und Sozialrecht, BKV |
Wissenschaftliche Stellungnahme zu der Berufskrankheit Nr. 1302 der Anlage 1 zur Berufskrankheiten-Verordnung
"Erkrankungen durch Halogenkohlenwasserstoffe"
Erkrankungen durch Polychlorierte Biphenyle - Allgemeiner Teil
Vom 1. Februar 2018
(GMBl. Nr. 12/13 vom 06.04.2018 S. 223)
Zur Übersicht in Anlage 1 der BKV siehe =>
Zum Merkblatt 1302 siehe =>
- Bek. d. BMAS v. 1.2.2018 - IVa 4-45222 - 1302 -
Der Ärztliche Sachverständigenbeirat "Berufskrankheiten" beim Bundesministerium für Arbeit und Soziales hat am 30. November 2017 die nachstehende wissenschaftliche Stellungnahme zu der Berufskrankheit Nr. 1302 der Anlage 1 zur Berufskrankheiten-Verordnung beschlossen:
Allgemeiner Teil
Die wissenschaftlichen Erkenntnisse zu gesundheitlichen Auswirkungen polychlorierter Biphenyle (PCBs) werden in mehreren wissenschaftlichen Stellungnahmen zielorganbezogen behandelt. Im nachfolgenden "Allgemeinen Teil" werden die grundlegenden Erkenntnisse zur Charakteristik, zum Vorkommen und zu den Gefahrenquellen der PCBs sowie zur Aufnahme, Ausscheidung und zum Stoffwechsel beim Menschen abgehandelt.
1. Charakteristik der ursächlich schädigenden Einwirkung
PCBs wurden erstmals 1881 durch Chlorieren von Biphenyl synthetisiert und seit 1929 industriell produziert. Bei der chemischen Synthese entstehen dabei immer Stoffgemische, die aus theoretisch bis zu 209 unterschiedlichen PCB-Kongeneren bestehen können, die sich in Anzahl und Stellung
der Chloratome im Molekül unterscheiden (siehe Abbildung 1). In der Regel entstehen bei der technischen Herstellung ca. 130 - 140 unterschiedliche Kongenere. Je nach Chlorierungsgrad sind PCBs helle und viskose Flüssigkeiten, die sich vor allem durch eine hohe thermische Stabilität und niedrige Dielektrizitätskonstanten auszeichnen [1].
Abbildung 1: Allgemeine Strukturformel der Polychlorierten Biphenyle
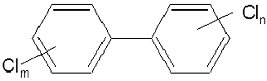
Die Kongeneren-Zusammensetzung einiger handelsüblicher PCB-Gemische ist in der Literatur veröffentlicht [2].
Allgemein wurde der Chlorierungsgrad des Gemisches in den Handelsnamen codiert mit angegeben (z.B. Arochlor 1248 = 48 Gew. % Chlor; Clophen A - 6 Chloratome pro Molekül) [3]. Die einzelnen Kongenere wurden zur Vereinfachung der Nomenklatur durchnummeriert nach Ballschmiter, dabei steigt der Chloranteil mit der Nummerierung an (z.B. PCB 1 = 2-Chlor-Biphenyl bis PCB 209 = Decachlor-Biphenyl) [4].
Aus analytischen und praktischen Gründen wird bei der Analytik von PCBs in der Regel auf sechs sogenannte "Indikator-Kongenere" zurückgegriffen. Diese Indikatorkongenere reflektieren zum einen die unterschiedlichen physikalisch-chemischen Eigenschaften der Kongenere, zum anderen sind diese auch zu einem relativ großen Anteil in den technischen Gemischen enthalten. Somit werden diese sechs Indikator-PCBs als repräsentativ für den Gesamt-PCB-Anteil in einer Probe angesehen. Die physikalisch-chemischen Daten dieser Indikator-Kongenere sind in Tabelle 1 zusammengefasst.
Vereinfachend lässt sich zusammenfassen, dass PCBs äußerst lipophil sind und nur eine extrem geringe Wasserlöslichkeit aufweisen. Die fettlöslichen Eigenschaften steigen dabei mit dem Chlorierungsgrad an, während Dampfdruck und Wasserlöslichkeit mit steigendem Chlorgehalt im Molekül sinken.
Tabelle 1: Physikalisch-Chemische Eigenschaften der Indikator-PCBs.
| Ballschmiter- Nummer | IUPAC- Bezeichnung | CAS-Nummer | Molgew. (g/ Mol) | Wasserlöslichkeit bei 25° C [5] (mg/l) | Dampfdruck [6] (atm) |
| PCB 28 | 2,4,4"-Trichlorbiphenyl | 7012-37-5 | 257,5 | 0,085-0,266 | 1,5 * 10-7 |
| PCB 52 | 2,2",5,5"-Tetrachlorbiphenyl | 35693-99-3 | 292,0 | 0,006-0,046 | 8,9 * 10-7 |
| PCB 101 | 2,2",4,5,5"-Pentachlorbiphenyl | 37680-73-2 | 326,4 | 0,0042-0,031 | 1,4 * 10-8 |
| PCB 138 | 2,2",3,4,4",5"-Hexachlorbiphenyl | 35065-28-2 | 360,9 | k.A. | 1,5 * 10-9 |
| PCB 153 | 2,2",4,4",5,5"-Hexachlorbiphenyl | 35065-27-1 | 360,9 | 0,0011-0,0099 | 2,5 * 10-9 |
| PCB 180 | 2,2",3,4,4",5,5"-Heptachlorbiphenyl | 35065-29-3 | 395,3 | k.A. | 0,3 * 10-9 |
Die hohe Fettlöslichkeit in Verbindung mit einer hohen Stabilität und einer damit verbundenen geringen (mikrobiellen) Abbaurate führte zu einer Anreicherung vor allem der höherchlorierten PCBs in allen Umweltkompartimenten. Da PCBs kaum verstoffwechselt werden können, reichern sie sich in fetthaltigen Geweben an und erreichen über die Nahrungskette schließlich den Menschen.
Für die toxikologische Bewertung von PCBs sind speziell die sogenannten "dioxin-ähnlichen" Kongenere von Bedeutung. Da bei diesen zwölf Kongeneren keines oder nur ein Chloratom in ortho-Position der Biphenyl-Brücke vorhanden ist, können diese Kongenere auf molekularer Ebene eine planare Anordnung annehmen und so Wirkungen entfalten, die aus toxikologischer Sicht denen der Tetrachlordibenzodioxine (TCDDs) ähnlich sind. Genaueres zur Toxizität findet sich in den einzelnen krankheitsbezogenen Kapiteln.
Um die unterschiedliche Wirkstärke dieser dioxin-ähnlichen Kongenere bewerten zu können, wurden von der WHO Toxizitätsäquivalenzfaktoren (TEFs) für diese PCB-Kongenere evaluiert, die die relative Wirkstärke des jeweiligen Kongeners im Vergleich zum 2,3,7,8-TCDD (TEF = 1) berücksichtigen sollen [7]. Eine Übersicht über die dioxinähnlichen PCB-Kongenere sowie die zugehörigen Toxizitätsäquivalente gibt Tabelle 2.
Tabelle 2: Übersicht über die dioxin-ähnlichen PCBs.
| Ballschmiter- Nummer | IUPAC-Bezeichnung | CAS-Nummer | Molgew. (g/ Mol) | Toxizitätsäquiva- lenzfaktor (TEF) |
| PCB 77 | 3,3",4,4"-Tetrachlorbiphenyl | 32598-13-3 | 292,0 | 0,0001 |
| PCB 81 | 3,4,4",5-Tetrachlorbiphenyl | 70362-50-4 | 292,0 | 0,0003 |
| PCB 126 | 3,3",4,4",5-Pentachlorbiphenyl | 57465-28-8 | 326,4 | 0,1 |
| PCB 169 | 3,3",4,4",5,5"-Hexachlorbiphenyl | 32774-16-6 | 360,9 | 0,03 |
| PCB 105 | 2,3,3",4,4"-Pentachlorbiphenyl | 32598-14-4 | 326,4 | 0,00003 |
| PCB 114 | 2,3,4,4",5-Pentachlorbiphenyl | 74472-37-0 | 326,4 | 0,00003 |
| PCB 118 | 2,3",4,4",5-Pentachlorbiphenyl | 31508-00-6 | 326,4 | 0,00003 |
| PCB 123 | 2",3,4,4",5-Pentachlorbiphenyl | 65510-44-3 | 326,4 | 0,00003 |
| PCB 156 | 2,3,3",4,4",5-Hexachlorbiphenyl | 38380-08-4 | 360,9 | 0,00003 |
| PCB 157 | 2,3,3",4,4",5"-Hexachlorbiphenyl | 69782-90-7 | 360,9 | 0,00003 |
| PCB 167 | 2,3",4,4",5,5"-Hexachlorbiphenyl | 52663-72-6 | 360,9 | 0,00003 |
| PCB 189 | 2,3,3",4,4",5,5"-Heptachlorbiphenyl | 39635-31-9 | 395,3 | 0,00003 |
Pharmakologisch unterscheiden sich die dioxin-ähnlichen Kongenere von den nicht-dioxin-ähnlichen PCBs: speziell die "non-ortho" PCB-Kongenere mit hohen TEFs vermitteln über den Ah-Rezeptor in der Leber eine Induktion der Enzyme CYP 450 1A1 und 1A2. Anders die nicht-dioxinähnlichen PCB-Kongenere mit zwei Chlor-Atomen in ortho-Position (z.B. PCB 153, PCB 180): diese Kongenere nehmen auf molekularer Ebene eine "verschränkte" Anordnung an und induzieren in der Leber ähnlich Phenobarbital das CYP 450 2B1-Monooxigenase-System."Mono-ortho" PCB-Kongenere (z.B. PCB 105, PCB 118) können beide Leberenzyme induzieren [8]. Da Expositionen in der Arbeitswelt stets mit Gemischen aller PCB-Kongenere erfolgen, ist hier von additiven Effekten auszugehen.
Die hohe Persistenz der PCBs führte in den USA Ende der 70er-Jahre zu einem Produktionsstopp sowie in Deutschland 1989 mit der Gefahrstoffverordnung zu einem endgültigen Verbot der Herstellung, des Verkaufs sowie des Im- oder Exports von PCB-haltigen Produkten. Durch Inkrafttreten der "Stockholm convention on persistent organic pollutants (POP)" im Jahr 2004 wurden Produktion und Neueinsatz von PCB weltweit verboten [9]. Es wird geschätzt, dass weltweit bis zum Produktionsstopp zwei Millionen Tonnen PCB produziert wurden [4].
Bei arbeitsbedingt gegenüber PCBs exponierten Kollektiven spielt neben der inhalativen Aufnahme vor allem die Aufnahme über die Haut bzw. ein möglicher peroraler Kontakt die größte Rolle. PCBs können sehr gut über die Haut aufgenommen werden, neuere Untersuchungen zeigen, dass speziell die niedriger chlorierten PCB-Kongenere (< 5 Chlor atome) im Vergleich zu den höher chlorierten Kongeneren schneller und effektiver durch die Haut penetrieren können [10].
Für die Allgemeinbevölkerung erfolgt die Aufnahme von PCBs vorwiegend durch die Nahrung. Rauchen führt hier nicht zu einem zusätzlichen Eintrag. Speziell fettreiche Lebensmittel tierischer Herkunft gelten als eine der Haupt-Aufnahmequellen für PCBs in der Allgemeinbevölkerung [1]. Aus dieser nahrungsbedingten Aufnahme resultiert eine altersabhängige Hintergrundbelastung, die vor allem die höherchlorierten PCB-Kongenere (> 6 Chloratome) betrifft und in verschiedenen Studien quantifiziert wurde [1, 11 - 13] (vgl. Abschnitt 3).
International sind in der Vergangenheit in den Jahren 1968 in Japan bzw. 1979 in Taiwan Intoxikationen bekannt geworden, die auf den Verzehr von Reisöl zurückzuführen waren, das sowohl mit PCBs als auch teilweise mit polychlorierten Dibenzofuranen verunreinigt war ("Yusho" bzw."Yu Cheng"-Krankheit) [8].
2. Vorkommen und Gefahrenquellen
Infolge des weltweiten Verbots stellen PCB-haltige Altlasten heutzutage die hauptsächlichen Expositionsquellen für PCBs in der Arbeitsmedizin dar. PCBs waren in geschlossenen Systemen als Hydrauliköl im Bergbau, als Kühlmittel in Transformatoren sowie als Dielektrikum in Kondensatoren enthalten. Sogenannte "offene" Anwendungen von PCBs beinhalten die früher übliche Verwendung als Weichmacher in Farben, Lackharzen und Kunststoffen sowie Schmier- und Imprägniermitteln, als Flammschutzmittel in Dichtungsmassen, Kitten, Spachtelmassen, in Pressspanplatten sowie als Wärmeaustauschflüssigkeit [1].
Die Verwendung von PCBs beim Bau von Gebäuden führt aufgrund des Ausgasens aus den PCB-haltigen Materialien zu einer Belastung der Innenraumluft, die jedoch aufgrund des unterschiedlichen Dampfdrucks der einzelnen Kongenere vornehmlich die flüchtigeren PCB-Kongenere (< 5 Chloratome) betrifft (vgl. Tabelle 1).
Der Nachweis niedrig chlorierter PCB-Kongenere im Blut deutet in der Regel auf eine inhalative Belastung hin und kann somit von einer ernährungsbedingten Aufnahme differenzieren.
Da im Hinblick auf Berufskrankheiten nicht nur aktuelle, sondern auch frühere Belastungsquellen von Relevanz sind, müssen bei der Beurteilung folgende Bereiche und Tätigkeiten beachtet werden:
Beim offenen Umgang mit PCBs muss strikt auf die Einhaltung der Arbeitssicherheitsvorschriften geachtet werden. Mangelnde Arbeitshygiene kann unter Umständen zu einem Eintrag von PCBs in das häusliche Umfeld und zu zusätzlichen inneren Belastungen bei Angehörigen führen [14].
3. Aufnahme und Ausscheidung, Stoffwechsel
PCBs können aufgrund ihrer guten fettlöslichen Eigenschaften sehr effektiv gastrointestinal aufgenommen werden. In Tierversuchen ergaben sich für verschiedene PCB-Gemische Resorptionsquoten von mehr als 90 % [8].
Auch inhalativ können PCBs sehr gut aufgenommen werden, die Resorptionsquote bei Aufnahme der PCBs mit der Atemluft beim Menschen ist allerdings nicht bekannt. Untersuchungen an männlichen Sprague-Dawley-Ratten, die unter kontrollierten Bedingungen inhalativ einer Mischung von Arochlor 1242 ausgesetzt waren, ergaben unter Berücksichtigung der gemessenen Körperdosis in den Organen der Tiere eine Resorptionsquote von ca. 82 % bei einer inhalativen Dosis von 40 µg pro Ratte [15].
Die dermale Resorption der PCBs hängt von der Dauer des Verbleibs auf der Haut ab. Unter vergleichbaren Bedingungen penetriert eine um den Faktor 250 höhere Dosis an PCB 28 im Vergleich zu PCB 180 durch exzidierte Humanhaut [10]. Aufgrund der lipophilen Eigenschaften der PCBs kann davon ausgegangen werden, dass Hautcremes als Lösungsvermittler die dermale Resorption von PCBs deutlich verstärken.
Vom Resorptionsort werden die PCBs über die Blutzirkulation in alle Gewebe des Körpers verteilt. Innerhalb des Transportmediums Blut sind PCBs hauptsächlich mit den Lipoprotein- und Plasmaproteinfraktionen assoziiert. Die Verteilung vom Blut in die Gewebe wird durch die lipophilen Eigenschaften der Kongenere und den Gehalt an Lipiden im Gewebe wesentlich bestimmt. Die Verteilung scheint dabei unabhängig von der Art der Zufuhr (oral, dermal, inhalativ) zu sein [8]. Auf den Fettgehalt bezogen sind die Konzentrationen in den einzelnen Organen und dem Blut nahezu gleich - mit der Ausnahme des Gehirns, in dem eine deutlich geringere Konzentration, bezogen auf den Fettgehalt, nachgewiesen wurde [1]. Das Ausmaß der Anreicherung im Fettgewebe wird durch die chemische Stabilität und die Position der Chloratome im Molekül bestimmt [8]. Ausgehend von dieser Anreicherung im Fettgewebe ergeben sich für die einzelnen PCB-Kongenere unterschiedliche Halbwertszeiten im Blut. Eine Übersicht über die in der Literatur berichteten Halbwertszeiten im Blut für die Indikator-PCBs beim Menschen gibt Tabelle 3.
Tabelle 3: Übersicht über die mittleren Halbwertszeiten der Indikator-PCBs im Blut.
| Ballschmiter-Nummer | Mittlere Eliminationshalbwertszeit (Jahre) | Literatur |
| PCB 28 | 4,6 | [16] |
| 4,5 | [17] | |
| 3,0 | [18] | |
| PCB 52 | 1,3 | [17] |
| PCB 101 | 2,8 | [17] |
| PCB 138 | 16,3 | [18] |
| 7,8 | [19] | |
| PCB 153 | 27,5 | [18] |
| 12,4 | [19] | |
| PCB 180 | 3,7 - 5,7 | [20] |
PCBs können in der Leber durch Cytochrom-P-450-abhängige Monooxigenasen je nach Chlorierungsgrad zu einem geringen Anteil zu phenolischen Metaboliten (Hydroxy-PCBs) metabolisiert werden. Nach Konjugation mit Glucuronsäure oder Sulfat unterliegen diese Hydroxy-PCBs je nach Chlorierungsgrad einem enterohepatischen Kreislauf. Speziell die Konjugate höherchlorierter Hydroxy-PCBs weisen ein hohes Molekulargewicht auf und können biliär ausgeschieden werden. Die Spaltung der Konjugate im Darm führt zu einer Rückresorption über die Pfortader in die Leber. Somit sind im Blut der Allgemeinbevölkerung auch Hydroxy-PCBs nachweisbar. Die Konjugation des intermediär gebildeten Epoxids mit Glutathion führt zur Bildung von Methyl-Sulfon-PCBs. Die toxikologische Bedeutung dieser PCB-Metabolite ist noch nicht vollständig geklärt, es gibt aber Hinweise darauf, dass diese eine höhere Toxizität als die PCBs selbst aufweisen [21]. Die intermediär gebildeten Arenoxide sind darüber hinaus sehr reaktiv und können Addukte mit Proteinen, RNA und DNA bilden.
Eine Übersicht über den Metabolismus von PCBs am Beispiel von PCB 105 gibt Abb. 2.
Abbildung 2: Metabolismus-Schema von PCB 105 [21].
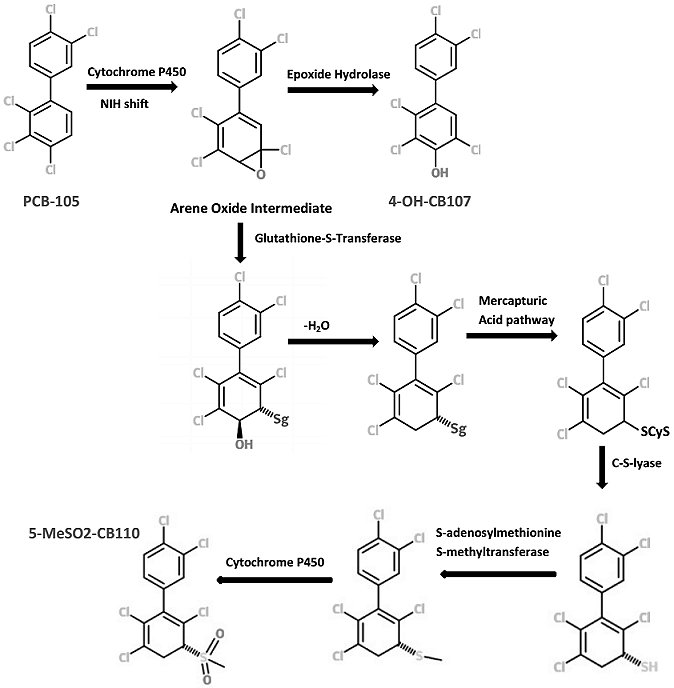
Niedrig chlorierte PCBs (< 5 Chloratome) können leichter metabolisiert und schneller ausgeschieden werden. Die entsprechenden Metabolite und deren Konjugate weisen ein geringeres Molekulargewicht auf und können so auch über die Niere ausgeschieden werden [22], In Tierversuchen zeigten Mono- und Di-Chlorbiphenyle dementsprechend ein geringes Akkumulationspotential [15]. 4-Monochlorbiphenyl (PCB 3) und die entsprechenden Oxidationsprodukte weisen jedoch ein genotoxisches Potential auf [23, 24]. Dies kann zumindest als Hinweis darauf gewertet werden, dass auch die Metabolite anderer niedrig chlorierter PCB-Kongenere ein genotoxisches Potential aufweisen könnten. Als möglicher Wirkungsmechanismus wird hier die Bildung von Hydrochinon-Metaboliten und der damit verbundene oxidative Stress diskutiert [24].
Hinweise auf ein kanzerogenes Potential niedrig chlorierter PCBs ergeben sich auch aus Untersuchungen, die eine Verkürzung der Telomerlängen und eine Reduktion der Telomeraseaktivität bei HaCaT-Zellen nachgewiesen haben, die gegenüber PCB 28 und PCB 52 exponiert waren [25]. Dieser Befund wurde mittlerweile auch in vivo durch die Untersuchung von hochbelasteten Beschäftigten eines Transformator-Recycling-Betriebs bestätigt. Als ein wesentlicher Auslöser für die Verkürzung der Telomere wurde von den Autoren ein Hydroxy-Metabolit des niedrigchlorierten PCB 28 identifiziert, der im Blut der Arbeiter nachgewiesen wurde [26],
4. Nachweis der PCB-Belastung
Der Nachweis der PCB-Belastung mittels Humanbiomonitoring ist gut etabliert. In der Regel werden sechs Indikatorkongenere im Plasma gemessen (PCB 28, 52, 101, 138, 153, 180). Einige Labors messen zusätzlich noch sog. dioxinähnliche PCBs, insbesondere PCB 118.
Eine Differenzierung zwischen außerberuflicher, insbesondere ernährungsbedingter Belastung und beruflicher Belastung ist für die höherchlorierten Kongenere nicht eindeutig möglich. Eine vermehrte Belastung gegenüber niedrig-chlorierten Kongeneren kann dagegen als Indikator einer beruflichen Belastung gelten. Zudem unterliegen niedrig-chlorierte PCBs keinem Altersgang.
Bei der Feststellung der individuellen arbeitsbedingten Belastung mit PCBs sind die biologischen Halbwertszeiten der einzelnen Indikator-Kongenere im Blut zu berücksichtigen (s. Tabelle 3), die zum Teil nur ein bis zwei Jahre betragen. Daraus folgt, dass nach einem Expositionsende bestimmte Biomarker nur eine begrenzte Zeit nachweisbar sind.
[1] UBA. Umweltbundesamt (1999): Stoffmonographie PCB - Referenzwerte für Blut. Bundesgesundheitsbl Gesundheitsforsch-Gesundheitsschutz 42, 511-521
[2] Frame GM, Cochran JW, Bowadt SS (1996): Complete PCB congener distributions for 17 Arochlor mixtures determined by 3 HRGC systems optimized for comprehensive, quantitative, congener-specific analysis. J High Resol Chromatogr 19, 657-668
[3] Drexler H und Kraus T (2011): Biomonitoring polychlorierter Biphenyle. Gefahrstoffe - Reinhaltung der Luft 71, 20-24
[4] Ballschmiter K und Zell M (1980): Analysis of Polychlorinated Biphenyls (PCB) by glass capillary gas chromatography. Fresenius Z Anal Chem 302, 20-31
[5] Shiu WY und Mackay D (1986): A critical review of aqueous solubilities, vapor pressures, Henry's Law constants and octanol-water partition coefficients of the polychlorinated biphenyls. J Phys Chem Ref Data 15, 911- 929
[6] Murphy TJ, Mullin MD, Meyer JA (1987): Equilibration of polychlorinated biphenyls and toxaphene with air and water. Environ Sci Technol 21, 155-162
[7] Van den Berg M, Birnbaum LS, Denison M, De Vito M, Farland W, Feeley M, Fiedler H, Hakansson H, Hanberg A, Haws L, Rose M, Safe S, Schrenk D, Tohyama C, Tritscher A, Tuomisto J, Tysklind M, Walker N, Peterson RE (2006): The 2005 World Health Organisation re-evaluation of human and mammalian toxic equivalency factors for dioxins and dioxin-like compounds. Toxicol Sci 93, 223-241
[8] Koss G (1997): Polychlorierte Biphenyle (PCB). In: H. Marquardt und S. Schäfer: Lehrbuch der Toxikologie. Spektrum Akademischer Verlag, Heidelberg, 1. Aufl., 417434
[9] Stockholm convention on persistent organic pollutants (POPs). Hrsg.: Stockholm Convention Secretariat, Genf, Schweiz. http://chm.pops.int/default.aspx
[10] Dennerlein K, Kilo S, Göen T, Korinth G, Zschiesche W, Drexler H (2013): Penetration von polychlorierten Biphenylen (PCB) in und durch exzidierte Humanhaut. In: Dokumentationsband zur 53. Wissenschaftlichen Jahrestagung der Deutschen Gesellschaft für Arbeits- und Umweltmedizin (DGAUM) in Bregenz. S. 693-695 (ISBN: 978-3-9811784-87).
[11] UBA. Umweltbundesamt (2003): Aktualisierung der Referenzwerte für PCB-138, -153, -180 im Vollblut sowie Referenzwerte für HCB, β-HCH und DDE im Vollblut. Bundesgesundheitsbl-Gesundheitsforsch-Gesundheitsschutz 46, 161-168
[12] UBA. Umweltbundesamt (2009): Neue und aktualisierte Referenzwerte für Organochlorverbindungen (PCB138, -153, -180, HCB, β-HCH und DDE) im Vollblut von Kindern in Deutschland. Bundesgesundheitsbl-Gesundheitsforsch-Gesundheitsschutz 52, 973-976
[13] Schettgen T, Gube M, Alt A, Fromme H, Kraus T (2011): Pilot study on the exposure of the general population to non-dioxin-like and dioxin-like PCBs. Int J Hyg Environ Health 214, 319-325
[14] Schettgen T, Gube M, Esser A, Alt A, Kraus T (2012): Plasma polychlorinated biphenyls (PCB) levels of workers in a transformer recycling company, their family members and employees of surrounding companies. J Toxicol Environ Health A 75, 414-422
[15] Hu X, Adamcakova-Dodd A, Lehmler HJ, Hu D, Kania-Korwel I, Hornbuckle KC, Thorne PS (2010): Time course of congener uptake and elimination in rats after short-term inhalation exposure to an airborne polychlorinated biphenyls (PCB) mixture. Environ Sci Technol 44, 6893-6900
[16] Seegal RF, Fitzgerald EF, Hills EA, Wolff MS, Haase RF, Todd AC, Parsons P, Molho ES, Higgins DS, Factor SA, Marek KL, Seibyl JP, Jennings DL, McCaffrey RJ (2011): Estimating the half-lives of PCB congeners in former capacitor workers measured over a 28-year interval. J Expos Sci Environ Epidemiol 21, 234-246
[17] Schettgen T, Alt A, Preim D, Keller D, Kraus T (2012): Biological monitoring of indoor-exposure to dioxin-like and non-dioxin-like polychlorinated biphenyls (PCB) in a public building. Toxicol Letters 213, 116-121
[18] Yakushiji T, Watanabe I, Kuwabara K, Tanaka R, Kashimoto T, Kunita N, Hara I (1984): Rate of decrease and half-life of polychlorinated biphenyls (PCBs) in the blood of mothers and their children occupationally exposed to PCBs. Arch Environ Contam Toxicol 13, 341- 345
[19] Brown JF, Lawton RW, Ross MR, Feingold J, Wagner RE, Hamilton SB (1988): Persistence of PCB congeners in capacitor workers and Yusho patients. Chemosphere 19, 829-834
[20] Ryan JJ, Levesque D, Panopio LG, Sun WF, Masuda Y, Kuroki H (1993): Elimination of polychlorinated dibenzofurans (PCDFs) and polychlorinated biphenyls (PCBs) from human blood in the Yusho and Yu-Cheng rice-oil poisonings. Arch Environ Contam Toxicol 24, 504512
[21] Quinete N, Schettgen T, Bertram J, Kraus T (2014): Occurence and distribution of PCB metabolites in blood and their potential health effects in humans: a review. Environ Sci Pollut Res 21, 11951-11972
[22] Quinete N, Esser A, Kraus T, Schettgen T (2016): Determination of hydroxylated polychlorinated biphenyls (OH-PCBs) in human urine in a highly occupationally exposed German cohort: New prospects for urinary biomarkers of PCB exposure. Env Int 97: 171-179
[23] Lehmann L, Esch HL, Kirby PA, Robertson LW, Ludewig G (2007): 4-Monochlorobiphenyl (PCB 3) induces mutations in the livers of transgenic Fisher 344 rats. Carcinogenesis 28, 471478
[24] Zettner MA, Flor S, Ludewig G, Wagner J, Robertson LW, Lehmann L (2007): Quinoid metabolites of 4-monochlorobiphenyl induce gene mutations in cultured Chinese hamster V79 cells. Toxicol Sci 100, 88-98
[25] Senthilkumar PK, Klingelhutz AJ, Jacobus JA, Lehmler H, Robertson LW, Ludewig G (2011): Airborne polychlorinated biphenyls (PCBs) reduce telomerase activity and shorten telomere length in immortal human skin keratinocytes (HaCaT). Toxicol Letters 204, 64-70
[26] Ziegler S, Schettgen T, Beier F, Wilop S, Quinete N, Esser A, Masouleh BK, Ferreira MS, Vankann L, Uciechowski P, Rink L, Kraus T, Brümmendorf TH, Ziegler P (2017): Accelerated telomere shortening in peripheral blood lymphocytes after occupational polychlorinated biphenyls exposure. Arch Toxicol 91, 289- 300
 | ENDE |