 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. ▢ Regelwerk; BGI / DGUV-I |
BGI 505-64 / DGUV Information 213-564 - Verfahren zur Bestimmung von 1,2- und 1,3-Phenylendiamin
Von den Berufsgenossenschaften anerkannte Analysenverfahren zur Feststellung der Konzentrationen krebserzeugender Arbeitsstoffe in der Luft in Arbeitsbereichen
Berufsgenossenschaftliche Informationen für Sicherheit und Gesundheit bei der Arbeit (BGI)
(bisherige ZH 1/120.64)
(Ausgabe 12/1998)
Erprobtes und von den Berufsgenossenschaften anerkanntes, diskontinuierliches Verfahren zur Bestimmung von 1,2- und 1,3-Phenylendiamin in Arbeitsbereichen.
Es sind personenbezogene und ortsfeste Probenahmen für Messungen zur Beurteilung von Arbeitsbereichen möglich.
Probenahme mit Pumpe und Abscheidung auf einem Filter, Flüssigchromatographie (HPLC) nach Desorption.
"1,2- und 1.3-Phenylendiamin - 1 - HPLC"
(Ausgabe:
Dezember 1998)
| IUPAC-Name: | 1,2-Phenylendiamin, 1,2-Diaminobenzol |
| CAS-Nr.: | 95-54-5 |
| IUPAC-Name: | 1,3-Phenylendiamin, 1,3-Diaminobenzol |
| CAS-Nr.: | 108-45-2 |
| Molmasse: | 108,14 g/mol |
| Summenformel: | C6H8N2 |
Probenahme mit Pumpe und Abscheidung auf einem Filter, HPLC nach Desorption
Kurzfassung
Mit diesem Verfahren wird die über die Probenahmedauer gemittelte Konzentration von 1,2- und 1,3-Phenylendiamin im Arbeitsbereich personenbezogen oder ortsfest bestimmt.
| Messprinzip: | Mit Hilfe einer Pumpe wird ein definiertes Luftvolumen gemäß der Definition des einatembaren Staubes [1] durch ein mit Salzsäure imprägniertes Glasfaserfilter gesaugt. Das adsorbierte 1,2- und 1,3-Phenylendiamin wird mit einer Lösung aus Acetonitril und Ammoniak-Wasser desorbiert und flüssigchromatographisch bestimmt. |
| Technische Daten | |
| Bestimmungsgrenze: | absolut: 7,3 ng 1,2- bzw. 5,5 ng 1,3-Phenylendiamin relativ: 0,006 mg/m3 an 1,2- bzw. 0,004 mg/m3 an 1,3-Phenylendiamin bei 500 l Probeluft, 5 ml Desorptionslösung (Verdünnung im Verhältnis 1:1 v/v) und 25 µl Injektionsvolumen. |
| Selektivität: | Infolge von Störkomponenten sind zu hohe Werte möglich; Störeinflüsse sind im allgemeinen durch die Wahl anderer Trennbedingungen vermeidbar. |
| Vorteile: | Personenbezogene und selektive Messungen möglich. |
| Nachteile: | Keine Anzeige von Konzentrationsspitzen. |
| Apparativer Aufwand: | Pumpe, Gasmengenzähler oder Volumenstromanzeiger, säureimprägniertes Glasfaserfilter mit Filterhalter, Flüssigchromatograph mit UV/VIS-Detektor. |
Ausführliche Verfahrensbeschreibung
1 Geräte, Chemikalien und Lösungen
1.1 Geräte
Für die Probenahme:
- Pumpe, geeignet für einen Volumenstrom von 2 l/min, z.B. Typ PP5 ex Fa. Gilian, Vertrieb in Deutschland Fa. DEHA Haan und Wittmer, 71288 Friolzheim,
- Gasmengenzähler oder Volumenstromanzeiger,
- Filterhalter, z.B. Aerosol Monitor, Kat.- Nr. M 000 0337 A0, Fa. Millipore, 65731 Eschborn,
- Glasfaserfilter, Durchmesser 37 mm, z.B. No. 9, Fa. Schleicher und Schüll, 37582 Dassel.
Für die Probenaufbereitung und Analyse:
- Messkolben, 10 ml, 25 ml und 50 ml,
- Variable Dosierpipetten, 5 µl bis 5 ml, z.B. Typ Pipetman P, Fa. Abimed, 40736 Langenfeld,
- Probengläschen, 20 ml, braun,
- PTFE-Spritzenvorsatzfilter, z.B. Millex FG13, 0,2 µm Porenweite, Fa. Millipore,
- Einmalspritzen, 2 ml,
- HPLC-Gerät mit UV/VIS-Detektor,
- Auswerteeinheit,
- Wasseraufbereitungsgerät, z.B. Typ Nanopure II, Fa. Barnsteadt, Vertrieb in Deutschland Fa. Wilhelm Werner GmbH, 51381 Leverkusen,
- Schnappdeckelgläschen, 10 ml, braun,
- Ultraschallbad,
- Schüttler, z.B. Typ MTS 4, Fa. IKA, 79219 Staufen.
1.2 Chemikalien und Lösungen
1,2-Phenylendiamin, Reinheit > 99 %, z.B. Fa. Aldrich, 89552 Steinheim,
1,3-Phenylendiamin, Reinheit > 99 %, z.B. Fa. Aldrich, 89552 Steinheim,
Ammoniaklösung 25 % zur Analyse, z.B. Fa. Merck, 64271 Darmstadt,
Salzsäure 32 % zur Analyse, z.B. Fa. Merck.
Für die HPLC:
hochreines Wasser, z.B. mit Nanopure II aufbereitet (UHQ-Wasser), Acetonitril, LiChrosolv; z.B. Fa. Merck.
| Desorptionslösung: | Mischung aus 92 Volumenteilen Acetonitril und 8 Volumenteilen Ammoniaklösung. |
| Lösemittelgemisch 1: | Mischung aus Acetonitril/Wasser (1:1 v/v). |
| Lösemittelgemisch 2: | Mischung aus 96 Volumenteilen Lösemittelgemisch 1 und 8 Volumenteilen der Ammoniaklösung. |
| Stammlösung: | Lösung von je ca. 1 mg 1,2- und 1,3-Phenylendiamin pro Milliliter Lösemittelgemisch 2. In einen 25-ml-Messkolben werden z.B. je ca. 25 mg 1,2- und 1,3-Phenylendiamin auf 0,1 mg genau eingewogen und mit dem Lösemittelgemisch bis zur Marke aufgefüllt. |
| Kalibrierlösungen: | Lösungen von je ca. 0,5; 1,0; 5; 10; 15; 20 und 25 mg 1,2- und 1,3-Phenylendiamin pro Milliliter Lösemittelgemisch 1. In je einem 10-ml-Messkolben werden einige Milliliter Lösemittelgemisch 1 vorgelegt. Anschließend werden 5; 10; 50; 100; 150; 200 und 250 µl der Stammlösung in die jeweiligen Messkolben pipettiert und mit dem Lösemittelgemisch 1 bis zur Marke aufgefüllt. Mit diesen Lösungen wird bei einem Probeluftvolumen von 500 l ein Konzentrationsbereich von 10 bis 500 µg/m3 für 1,2- und 1,3-Phenylendiamin abgedeckt. |
Die Stamm- und Kalibrierlösungen sind nicht beständig und müssen vor Gebrauch jeweils frisch hergestellt werden.
1.3 Imprägnierung der Filter
Die Glasfaserfilter werden in ein Gemisch aus 22 ml UHQ-Wasser und 3 ml 32 %-iger Salzsäure eingetaucht und auf einem Uhrglas an der Luft getrocknet. Die imprägnierten Filter sind mindestens vier Wochen haltbar.
2 Probenahme
Zur Probenahme wird ein Filterhalter mit zwei der säureimprägnierten Glasfaserfilter bestückt und mit der Pumpe verbunden. Der Filterhalter wird mit Aluminiumfolie umwickelt, um die Filter vor Lichteinfluss zu schützen. Pumpe und Filterhalter werden von einer Person während der Arbeitszeit getragen oder ortsfest aufgestellt. Der Volumenstrom wird entsprechend der Definition für einatembaren Staub [1] auf 2 l/min eingestellt. Bei einer Probenahmedauer von vier Stunden entspricht dies einem Probeluftvolumen von 480 l.
3 Analytische Bestimmung
3.1 Probenaufbereitung und Analyse
Zur Aufbereitung werden die Filter in je ein Schnappdeckelgläschen gegeben und mit 5 ml Desorptionslösung versetzt. Nach der anschließenden Behandlung im Ultraschallbad und Schütteln (jeweils 15 Minuten) werden feste Bestandteile mit einem PTFE-Spritzenvorsatzfilter (0,2 µm Porenweite) vom Desorbat abgetrennt. Ein aliquoter Teil dieses Desorbats wird anschließend mit UHQ-Wasser im Verhältnis 1:1 v/v verdünnt. Dies ist dringend erforderlich, um eine Schädigung der Trennsäule zu verhindern.
Um sicherzustellen, dass das zur Desorption verwendete Wasser und das Glasfaserfilter keine störenden Verunreinigungen enthalten, wird ein unbeladenes, imprägniertes Filter analog aufgearbeitet (Leerwertlösung).
Aus den verdünnten Desorbaten werden jeweils 25 µl entnommen, in den Flüssigchromatographen eingespritzt und ein Chromatogramm, wie unter 3.2 beschrieben, angefertigt. Nach der chromatographischen Trennung werden 1,2- und 1,3-Phenylendiamin bei einer Wellenlänge von 210 nm detektiert.
3.2 HPLC-Arbeitsbedingungen
Die in Abschnitt 5 angegebenen Verfahrenskenngrößen wurden unter folgenden Gerätebedingungen erarbeitet:
| Gerät: | Hewlett Packard 1090 mit Diodenarraydetektor (DAD) und Autosampler. |
| Trennsäule: | Macherey und Nagel Typ 250/8/4 Nucleosil 100-5 C18 AB (250 mm x 4 mm) mit Vorsäule (30 mm x 4 mm) mit dem gleichen Packungsmaterial. |
| Elution: | Isokratisch |
| Eluent: | Acetonitril/UHQ-Wasser (20:80 v/v) |
| Flussrate: | 0,7 ml/min |
| Injektionsvolumen: | 25 µl |
| Messwellenlänge: | 210 nm |
| Ofentemperatur: | 40 °C |
4 Auswertung
4.1 Kalibrierung
Von den unter Abschnitt 1.2 beispielhaft beschriebenen Kalibrierlösungen werden je 25 µl in das Analysengerät eingespritzt und Chromatogramme angefertigt. Durch Auftragen der ermittelten Flächen über die in den jeweiligen Kalibrierlösungen enthaltenen Konzentrationen an 1,2- und 1,3-Phenylendiamin werden die Kalibrierkurven erstellt. Im angegebenen Konzentrationsbereich verlaufen sie linear.
4.2 Berechnen des Analysenergebnisses
Die Berechnung, der Konzentrationen an 1,2- bzw. 1,3-Phenylendiamin in der Probeluft in mg/m3 erfolgt nach Formel (1):
(1) 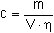
| cm = | Massenkonzentration des 1,2- bzw. 1,3-Phenylendiamins in der Probeluft in mg/m3, |
| m = | die aus der Kalibrierkurve ermittelte Masse des 1,2- bzw. 1,3-Phenylendiarnins in der Probe in µg, |
| V = | Probeluftvolumen in l, |
| η = | Wiederfindungsrate. |
Falls auf dem zweiten Filter mehr als 10 % der auf dem ersten Filter abgeschiedenen Masse des 1,2- bzw. 1,3-Phenylendiamins ermittelt wird, muss die Probenahme mit einem geringeren Probeluftvolumen wiederholt werden.
5 Beurteilung des Verfahrens
5.1 Genauigkeit und Wiederfindungsrate
Zur Ermittlung der relativen Standardabweichung und der Wiederfindungsrate wurden jeweils
- 20 µl einer Lösung von 0,86 mg 1,2- und 0,38 mg 1,3-Phenylendiamin pro Milliliter Lösemittelgemisch 2,
- 17 µl einer Lösung von je 2,96 mg 1,2- und 1,3-Phenylendiamin pro Milliliter Lösemittelgemisch 2,
- 17 µl einer Lösung von je 5,83 mg 1,2- und 1,3-Phenylendiamin pro Milliliter Lösemittelgemisch 2
auf je zwei hintereinander liegende, imprägnierte Glasfaserfilter aufgebracht.
Nach dem Auftragen der jeweiligen Lösungen wurden die Filterhalter zum Schutz der Filter vor Lichteinfluss mit Aluminiumfolie umwickelt.
Anschließend wurden 500 l Laborluft wie unter Abschnitt 2 beschrieben durch die Filter gesaugt.
Die dotierten Massen an 1,2- und 1,3-Phenylendiamin entsprechen beim untersuchten Luftvolumen Konzentrationen von 0,034; 0,1 und 0,2 mg/m3 für 1,2-Phenylendiamin (1,2-PDA) und 0,015; 0,1 und 0,2 mg/m3 für 1,3-Phenylendiamin (1,3-PDA). Anschließend wurden die Filter wie unter 1 beschrieben analysiert.
Für jede Konzentration wurden sechs unabhängige Bestimmungen durchgeführt. Es ergaben sich die in der folgenden Tabelle aufgeführten relativen Standardabweichungen und Wiederfindungsraten:
| Konzentration [mg/m3] |
relative Standardabweichung [%] | Wiederfindungsrate | ||
|---|---|---|---|---|
| 1,2-PDA | 1,3-PDA | 1,2-PDA | 1,3-PDA | |
| 0,015 | 5,8 | 0,94 | ||
| 0,034 | 3,6 | 0,90 | ||
| 0,1 | 1,4 | 1,6 | 0,92 | 0,98 |
| 0,2 | 3,2 | 1,7 | 0,92 | 0,98 |
5.2 Bestimmungsgrenze
Die absolute Bestimmungsgrenze beträgt 7,3 ng 1,2- und 5,5 ng 1,3-Phenylendiamin. Sie wurde aus dem Signal/Rausch-Verhältnis der Leerwertchromatogramme ermittelt.
Die relative Bestimmungsgrenze beträgt 0,006 mg/m3 an 1,2- und 0,004 mg/m3 an 1,3-Phenylendiamin für ein Probeluftvolumen von 500 l, 5 ml Desorptionslösung, Verdünnung des Desorbats im Verhältnis 1:1 v/v und 25 µl Injektionsvolumen.
5.3 Selektivität
Infolge von Störkomponenten sind zu hohe Werte möglich. Störeinflüsse sind im allgemeinen durch die Wahl anderer Trennbedingungen vermeidbar. In der Praxis haben sich die angegebenen Trennbedingungen bewährt.
6 Bemerkungen
Die beaufschlagten Filter können im Dunkeln bei Raumtemperatur mindestens eine Woche ohne Verlust an abgeschiedenem 1,2- und 1,3-Phenylendiamin gelagert werden.
Mit dem beschriebenen Verfahren kann neben 1,2- und 1,3-Phenylendiamin auch 1,5-Diaminonaphthalin in der Luft am Arbeitsplatz bestimmt werden.
7 Literatur
| [1] | DIN EN 481 Festlegung der Teilchengrößenverteilung zur Messung luftgetragener Partikel. Beuth Verlag GmbH, Berlin und Köln |
 | ENDE |
...
X
⍂
↑
↓
