 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. ▢ Regelwerk; BGI / DGUV-I |  |
DGUV Information 213-583 / BGI/GUV-I 505-83 Verfahren zur Bestimmung von aromatischen Aminen
Von den Unfallversicherungsträgern anerkannte Messverfahren zur Feststellung der Konzentrationen krebserzeugender, keimzellmutagener oder reproduktionstoxischer Stoffe in der Luft in Arbeitsbereichen
Deutsche Gesetzliche Unfallversicherung (DGUV) Information
(Ausgabe 06/2013; 06/2019)
Archiv: 06/2013
Verfahren 01
Probenahme mit Pumpe und Abscheidung auf einem sauer imprägnierten Filter, Gaschromatographie nach Elution
Aromatische Amine - 01 - GC
(erstellt:
März 2012)
Verfahren 02
Probenahme mit Pumpe und Abscheidung auf einem sauer imprägnierten Filter, Gaschromatographie nach alkalischer Extraktion und Derivatisierung
Aromatische Amine - 02 - GCMSD
(erstellt:
Juni 2019)
Teil dieses Verfahrens sind die im "Allgemeinen Teil" (DGUV Information 213-500) beschriebenen Anforderungen und Grundsätze.
Die Verfahren wurden bis 1998 unter der Nummer ZH 1/120.XX und von 1999 bis 2014 unter der Nummer BGI 505-XX bzw. BGI/GUV-I 505-XX veröffentlicht.
Eine Übersicht über die aktuellen und zurückgezogenen Analysenverfahren der Reihe der DGUV Information 213-500 finden Sie unter http://analytik.bgrci.de
Probenahme mit Pumpe und Abscheidung auf einem sauer imprägnierten Filter, Gaschromatographie nach Elution
Erprobtes und von den Unfallversicherungsträgern anerkanntes Verfahren zur Bestimmung von aromatischen Aminen in Arbeitsbereichen.
Für die folgenden Stoffe ist das Verfahren validiert.
| Name | CAS-Nr. | Molmasse |
| Anilin; Aminobenzol | 62-53-3 | 93,13 |
| 2,4-Dimethylanilin; 2,4-Xylidin | 95-68-1 | 121,18 |
| 2,5-Dimethylanilin; 2,5-Xylidin | 95-78-3 | 121,18 |
| 2,6-Dimethylanilin; 2,6-Xylidin | 87-62-7 | 121,18 |
| 4-Ethoxyanilin; p-Phenetidin | 156-43-4 | 137,18 |
| 2-Methoxyanilin; o-Anisidin | 90-04-0 | 123,15 |
| 3-Methoxyanilin; m-Anisidin | 536-90-3 | 123,15 |
| 4-Methoxyanilin; p-Anisidin | 104-94-9 | 123,15 |
| 2-Methylanilin; o-Toluidin | 95-53-4 | 107,16 |
| 3-Methylanilin; m-Toluidin | 108-44-1 | 107,16 |
| 4-Methylanilin; p-Toluidin | 106-49-0 | 107,16 |
Es sind personengetragene und ortsfeste Probenahmen für Messungen zur Beurteilung von Arbeitsbereichen möglich.
Mit diesem Verfahren wird die über die Probenahmedauer gemittelte Konzentration von Anilin, 4-Ethoxyanilin, Methoxyanilinen, Methylanilinen und Dimethylanilinen, im Folgenden kurz Amine genannt, im Arbeitsbereich personengetragen oder ortsfest bestimmt.
| Messprinzip: | Mit Hilfe einer Pumpe wird ein definiertes Luftvolumen durch einen mit einem sauer imprägnierten Filter bestückten Filterhalter gesaugt. Anschließend werden die abgeschiedenen Amine mit Acetonitril/ Ammoniakwasser- Gemisch vom Filter desorbiert und nach gaschromatographischer Trennung mit dem massenselektiven Detektor bestimmt. |
| Bestimmungsgrenze: | absolut: 0,2 bis 1,6 ng je Amin relativ: von 0,003 bis 0,026 mg/m3 an Amin für 240 l Probeluftvolumen, 4 ml Desorptionslösung und einem Injektionsvolumen von 1 μl (siehe auch Abschnitt 5.2) |
| Selektivität: | Eine hohe Selektivität wird durch die gaschromatographische Trennung und Verwendung eines massenselektiven Detektors erreicht. |
| Vorteile: | Personengetragene und selektive Messungen möglich. |
| Nachteile: | Keine Anzeige von Konzentrationsspitzen. |
| Apparativer Aufwand: | Pumpe, Volumenstrommessgerät, Filterhalter mit sauer imprägniertem Filter, Gaschromatograph mit massenselektivem Detektor. |
1 Geräte und Chemikalien
1.1 Geräte
Für die Probenahme:
- Probenahmepumpe, geeignet für einen Volumenstrom von 1 l/min, z.B. PP5, Fa. Gilian, Bezug z.B. über Fa. Haan & Wittmer, 71288 Friolzheim
- Volumenstrommessgerät, z.B. Gilibrator, Fa. Gilian
- GSP-Probenahmesystem mit einem Ansaugkegel für einen Volumenstrom von 1 l/min, z.B. Fa. GSM, 41469 Neuss
- Glasfaserfilter, Durchmesser 37 mm, z.B. Typ MN 85/90 BF, Fa. Macherey und Nagel, 52355 Düren
Für die Probenaufbereitung und analytische Bestimmung:
- Flachbettschüttler
- Analysenwaage
- automatische Verdrängerpipette, z.B. Multipette pro, Fa. Eppendorf, 22339 Hamburg
- Mikroliterspritzen mit den Volumina von 10 bis 250 µl
- Messkolben 5 ml, 10 ml, 250 ml, 1000 ml
- Probengefäße 5 ml
- Gaschromatograph mit massenselektivem Detektor (MSD)
- Filterhalter mit Zwischenringen, z.B. Aerosol Analysis Monitors, Best.-Nr. M000037A0, Fa. Millipore, 65824 Schwalbach (für die Validierung)
1.2 Chemikalien
- Anilin, Reinheit 99,5 %, z.B. Fa. Sigma-Aldrich, 82024 Taufkirchen
- 2,4-Dimethylanilin, Reinheit 98 %, z.B. Fa. Sigma-Aldrich
- 2,5-Dimethylanilin, Reinheit 99 %, z.B. Fa. Sigma-Aldrich
- 2,6-Dimethylanilin, Reinheit 99 %, z.B. Fa. Sigma-Aldrich
- 4-Ethoxyanilin, Reinheit 98 %, z.B. Fa. Sigma-Aldrich
- 2-Methylanilin, Reinheit 99 %, z.B. Fa. Sigma-Aldrich
- 3-Methylanilin, Reinheit 99 %, z.B. Fa. Sigma-Aldrich
- 4-Methylanilin, Reinheit 99,7 %, z.B. Fa. Sigma-Aldrich
- 2-Methoxyanilin, Reinheit 99 %, z.B. Fa. Sigma-Aldrich
- 3-Methoxyanilin, Reinheit 97 %, z.B. Fa. Sigma-Aldrich
- 4-Methoxyanilin, Reinheit 99 %, z.B. Fa. Sigma-Aldrich
- 4-Propylanilin, Reinheit 98 % (interner Standard (ISTD)), z.B. Fa. Sigma-Aldrich
- Ammoniakwasser, 25 %ig, z.B. Fa. Merck, 64293 Darmstadt
- Acetonitril, Chromasolv, Reinheit > 99,9 %, z.B. Fa. Sigma-Aldrich
- Methanol, zur Analyse, z.B. Fa. Merck
- Schwefelsäure 0,5 mol/l, z.B. Fa. Merck
Gase zum Betrieb des Gaschromatographen:
- Helium, Reinheit 99,999 %
| Lösemittelgemisch: | Lösemittelgemisch aus Acetonitril/Ammoniakwasser (95 + 5, v + v) In einen 1000-ml-Messkolben werden 50 ml Ammoniak wasser vorgelegt und mit Acetonitril auf 1 l aufgefüllt. Dieses Gemisch ist mindestens 6 Monate haltbar. |
| Desorptionslösung: | Lösung von ca. 36 mg 4-Propylanilin/l Lösemittelgemisch In einen 250-ml-Messkolben, in dem einige Milliliter Lösemittelgemisch vorgelegt wurden, werden 10 μl 4-Propylanilin (Dichte 0,919 g/ml) pipettiert, mit dem Lösemittelgemisch bis zur Marke aufgefüllt und umgeschüttelt. |
| Stammlösung: | Lösungen von ca. 3 mg Amin/ml Desorptionslösung (siehe Tabelle 1)
In einen 10-ml-Messkolben werden die in Tabelle 1 aufgeführten Amine auf 0,1 mg genau eingewogen. Anschließend wird mit der Desorptionslösung bis zur Marke aufgefüllt und umgeschüttelt. |
Tabelle 1: Einwaagen und Konzentrationen der Amine in der Stammlösung
| Stoff | Einwaage [mg] | Konzentration [mg/ml] |
| Anilin | 29,94 | 3,0 |
| 2,4-Dimethylanilin | 32,64 | 3,2 |
| 2,5-Dimethylanilin | 32,22 | 3,2 |
| 2,6-Dimethylanilin | 37,82 | 3,7 |
| 4-Ethoxyanilin | 27,98 | 2,7 |
| 2-Methoxyanilin | 29,95 | 3,0 |
| 3-Methoxyanilin | 32,58 | 3,2 |
| 4-Methoxyanilin | 31,60 | 3,1 |
| 2-Methylanilin | 26,93 | 2,7 |
| 3-Methylanilin | 27,24 | 2,7 |
| 4-Methylanilin | 30,10 | 3,0 |
| Kalibrierlösungen: | Lösungen von ca. 1,4 bis 37 mg Amin/l Desorptionslösung (siehe Tabelle 2)
In je einen 10-ml-Messkolben werden die sechs in der Tabelle 2 angegebenen Volumina der Stammlösung pipettiert, mit Desorptionslösung aufgefüllt und umgeschüttelt. |
Tabelle 2: Konzentrationen der Amine in den Kalibrierlösungen in mg/l
| Lösung | 1 | 2 | 3 | 4 | 5 | 6 |
| Zugabe Stammlösung in μl | 5 | 20 | 40 | 60 | 80 | 100 |
| Anilin | 1,49 | 5,96 | 11,9 | 17,9 | 23,8 | 29,8 |
| 2,4-Dimethylanilin | 1,60 | 6,40 | 12,8 | 19,2 | 25,6 | 32,0 |
| 2,5-Dimethylanilin | 1,59 | 6,38 | 12,8 | 19,1 | 25,5 | 31,9 |
| 2,6-Dimethylanilin | 1,87 | 7,49 | 15,0 | 22,5 | 30,0 | 37,4 |
| 4-Ethoxyanilin | 1,37 | 5,48 | 11,0 | 16,5 | 21,9 | 27,4 |
| 2-Methoxyanilin | 1,48 | 5,93 | 11,9 | 17,8 | 23,7 | 29,7 |
| 3-Methoxyanilin | 1,58 | 6,32 | 12,6 | 19,0 | 25,3 | 31,6 |
| 4-Methoxyanilin | 1,56 | 6,26 | 12,5 | 18,8 | 25,0 | 31,3 |
| 2-Methylanilin | 1,33 | 5,33 | 10,7 | 16,0 | 21,3 | 26,7 |
| 3-Methylanilin | 1,35 | 5,39 | 10,8 | 16,2 | 21,6 | 27,0 |
| 4-Methylanilin | 1,50 | 6,00 | 12,0 | 18,0 | 24,0 | 30,0 |
Mit diesen Lösungen wird bezogen auf ein Probeluftvolumen von 240 l ein Konzentrationsbereich von ca. 0,02 bis ca. 0,6 mg/m3 an Einzelsubstanz (siehe Tabelle 3) abgedeckt.
Tabelle 3: Umgerechnete Konzentrationen der Amine in den Kalibrierlösungen in mg/m3 (bezogen auf ein Probeluftvolumen von 240 l)
| Lösung | 1 | 2 | 3 | 4 | 5 | 6 |
| Anilin | 0,025 | 0,099 | 0,20 | 0,30 | 0,40 | 0,50 |
| 2,4-Dimethylanilin | 0,027 | 0,11 | 0,21 | 0,32 | 0,43 | 0,53 |
| 2,5-Dimethylanilin | 0,027 | 0,11 | 0,21 | 0,32 | 0,43 | 0,53 |
| 2,6-Dimethylanilin | 0,031 | 0,12 | 0,25 | 0,37 | 0,50 | 0,62 |
| 4-Ethoxyanilin | 0,023 | 0,091 | 0,18 | 0,27 | 0,37 | 0,46 |
| 2-Methoxyanilin | 0,025 | 0,099 | 0,20 | 0,30 | 0,40 | 0,49 |
| 3-Methoxyanilin | 0,026 | 0,105 | 0,21 | 0,32 | 0,42 | 0,53 |
| 4-Methoxyanilin | 0,026 | 0,104 | 0,21 | 0,31 | 0,42 | 0,52 |
| 2-Methylanilin | 0,022 | 0,089 | 0,18 | 0,27 | 0,36 | 0,44 |
| 3-Methylanilin | 0,022 | 0,090 | 0,18 | 0,27 | 0,36 | 0,45 |
| 4-Methylanilin | 0,025 | 0,10 | 0,20 | 0,30 | 0,40 | 0,50 |
1.3 Herstellung der imprägnierten Filter
Die Glasfaserfilter werden in die 0,5 molare Schwefelsäure eingetaucht, auf ein Uhrglas abgelegt und über Nacht an der Luft getrocknet. Die imprägnierten Filter werden in verschlossenen Glasschalen bei Raumtemperatur gelagert und sind unter diesen Bedingungen mindestens sechs Monate haltbar.
2 Probenahme
Das GSP-Probenahmesystem wird mit einem sauer imprägnierten Glasfaserfilter bestückt und mit der Pumpe verbunden. Es wird ein Volumenstrom von 1 l/min eingestellt. Mit diesem Volumenstrom wird die Definition des einatembaren Staubes nach DIN EN 481 [1] eingehalten. Die Pumpe und das Probenahmesystem werden von einer Person im Arbeitsbereich getragen oder ortsfest verwendet. Das Verfahren wurde bis zu einem Probeluftvolumen von 240 l (entsprechend einer Probenahmedauer von 4 Stunden) überprüft. Nach der Probenahme ist der Volumenstrom auf Konstanz zu überprüfen. Ist die Abweichung vom eingestellten Volumenstrom größer ± 5 %, wird empfohlen, die Messung zu verwerfen (siehe hierzu "Allgemeiner Teil", Abschnitt 3, in BGI/GUV-I 505-0 [4]). Der Filterhalter wird anschließend aus dem Probenahmesystem entnommen und dicht verschlossen.
3 Analytische Bestimmung
3.1 Probenaufbereitung und Analyse
Zur Aufbereitung wird das Glasfaserfilter in ein 5-ml-Probengefäß überführt. Nach dem Zusatz von 4 ml Desorptionslösung wird das Gefäß sofort verschlossen und 30 Minuten auf dem Flachbettschüttler geschüttelt. Danach wird ein Aliquot der überstehenden Lösungen (Probelösung) in ein Autosamplergläschen überführt.
Um sicherzustellen, dass die verwendete Desorptionslösung und die Filter keine störenden Verunreinigungen enthalten, wird pro Probenserie ein sauer imprägnierter Filter mit 4 ml Desorptionslösung wie oben beschrieben desorbiert (Leerwertlösung).
Jeweils 1 μl der ProbelÆsung und Leerwertlösung werden in den Gaschromatographen eingespritzt und ein Chromatogramm, wie nachfolgend beschrieben, angefertigt. Die quantitative Auswertung erfolgt nach der Methode des internen Standards über die Peakflächen des jeweiligen Amins und des 4-Propylanilins als internem Standard.
3.2 Gaschromatographische Arbeitsbedingungen
Die in Abschnitt 5 angegebenen Verfahrenskenngrößen wurden unter folgenden Gerätebedingungen erarbeitet:
| Gerät: | Gaschromatograph HP 6890 A mit massenspezifischem Detektor MSD 5973 Network und Split/Splitless-Injektor, Fa. Agilent |
| Trennsäule: | Quarzkapillare, stationäre Phase VF-Wax-MS quervernetzt, Innendurchmesser 0,25 mm, Länge 30 m, Filmdicke 0,5 pm, Fa. Varian |
| Temperaturen: | Injektor: 250 °C
Ofen mit Temperaturprogramm:
|
| Injektion: | Splitverhältnis 1:10 |
| Injektionsvolumen: | 1 µl |
| Gase: | Trägergas Helium |
| MSD-Bedingungen: | Ionisierungsart:
El (70 eV)
Messmodus: SIM/Scan (Massenbereich: 29 - 250 amu) |
Tabelle 4: SIM-Auswertemassen (m/z)
| Stoff | Target | Qualifier 1 | Qualifier 2 |
| Anilin | 93 | 66 | 65 |
| 2,4-Dimethylanilin | 121 | 120 | 106 |
| 2,5-Dimethylanilin | 121 | 120 | 106 |
| 2,6-Dimethylanilin | 121 | 120 | 106 |
| 4-Eth oxyan ili n | 108 | 109 | 137 |
| 2-Methoxyanilin | 108 | 123 | 80 |
| 3-Methoxyanilin | 123 | 94 | 93 |
| 4-Methoxyanilin | 108 | 123 | 80 |
| 2-Methylanilin | 106 | 107 | 77 |
| 3-Methylanilin | 106 | 107 | 77 |
| 4-Methylanilin | 106 | 107 | 77 |
| 4-Propylanilin (ISTD) | 106 | 135 |
4 Auswertung
4.1 Kalibrierung
Von den unter Abschnitt 1.2 exemplarisch beschriebenen sechs Kalibrierlösungen wird jeweils 1 μl in den Gaschromatographen eingespritzt.
Die Verhältnisse der Peakflächen der Amine zu den Peakflächen des 4-Propylanilins (ISTD) werden gegen die entsprechenden, aus den Kalibrierlösungen erhaltenen Massenverhältnisse aufgetragen. Mit Hilfe der Regressionsrechnung ermittelt man die Kalibrierfunktion.
4.2 Berechnen des Analysenergebnisses
Aus den erhaltenen Chromatogrammen werden die Peakflächen der Amine und des 4-Propylanilins ermittelt, der Quotient gebildet und aus der jeweiligen Kalibrierfunktion der zugehörige Wert für die Masse in der Probelösung in μg bestimmt.
Die Berechnung der Massenkonzentration der jeweiligen Einzelsubstanz in der Probeluft in mg/m3 erfolgt nach der folgenden Formel:
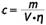
Es bedeuten:
| c = | Massenkonzentration des jeweiligen Amins in der Probeluft in mg/m3 |
| m = | die aus der entsprechenden Kalibrierfunktion ermittelte Masse des Amins in der Probelösung in pg |
| V = | Probeluftvolumen in l |
| η = | Wiederfindung (siehe Abschnitt 5.1) |
5 Beurteilung des Verfahrens
5.1 Präzision und Wiederfindung
Die Präzision im Mindestmessbereich nach DIN EN 482 [2] sowie die Wiederfindung wurden für drei Konzentrationen bestimmt. Die Validierlösung wurde entsprechend den Angaben in Tabelle 5 hergestellt:
| Validierlösung: | Lösung von ca. 2 bis 37 mg Amin/ml Methanol In einen 5-ml-Messkolben wurden die in Tabelle 5 für die einzelnen Lösungen angegebenen Massen an Aminen auf 0,1 mg genau eingewogen. Anschließend wurde mit Methanol bis zur Marke aufgefüllt und umgeschüttelt. |
Für die Validierung wurden Millipore-Filterhalter mit Zwischenringen zur Aufnahme eines nicht imprägnierten und zweier sauer imprägnierter Filter verwendet. Mit einer Mikroliterspritze wurden 5, 50 und 100 µl der Validierlösung auf den nicht imprägnierten Glasfaserfilter dotiert, hinter dem die mit Schwefelsäure imprägnierten Filter, durch einen Zwischenring getrennt, angeordnet waren. Durch diese Kombination wurde vier Stunden lang Laborluft bei einer Umgebungstemperatur von 23 °C und einer Luftfeuchte von ca. 55 % mit einem Volumenstrom von 1 l/min gesaugt. Die Aufarbeitung und analytische Bestimmung erfolgte wie in Abschnitt 3 beschrieben. Die dotierten Massen entsprachen für 240 l Probeluftvolumen den in der Tabelle 5 angegebenen Validierkonzentrationen.
Tabelle 5: Konzentrationen der Amine in der Validierlösung und bei der Validierung
| Substanz | Einwaage | Konzent- ration | Validierkonzentration | ||
| [mg] | [mg/ml] | c1 [mg/m3] | c2 [mg/m3] | c3 [mg/m3] | |
| Anilin | 186,2 | 37,05 | 0,77 | 7,72 | 15,4 |
| 2,4-Dimethylanilin | 24,1 | 4,77 | 0,10 | 0,994 | 1,99 |
| 2,5-Dimethylanilin | 30,2 | 5,98 | 0,13 | 2,25 | 2,49 |
| 2,6-Dimethylanilin | 25,8 | 5,10 | 0,11 | 1,06 | 2,12 |
| 4-Ethoxyanilin | 26,9 | 5,27 | 0,11 | 1,01 | 2,20 |
| 2-Methoxyanilin | 28,6 | 5,66 | 0,12 | 1,18 | 2,36 |
| 3-Methoxyanilin | 14,8 | 2,86 | 0,06 | 0,597 | 1,19 |
| 4-Methoxyanilin | 11,9 | 2,36 | 0,05 | 0,493 | 0,99 |
| 2-Methylanilin | 15,4 | 3,05 | 0,06 | 0,636 | 1,27 |
| 3-Methylanilin | 26,0 | 5,15 | 0,11 | 1,07 | 2,15 |
| 4-Methylanilin | 25,2 | 5,04 | 0,11 | 1,05 | 2,10 |
Bei jeweils sechsfacher Durchführung der beschriebenen Vorgehensweise ergaben sich für die einzelnen Konzentrationen die in Tabelle 6 aufgeführten Wiederfindungen und relativen Standardabweichungen.
Es konnte kein Durchbruch auf den zweiten sauer imprägnierten Filter festgestellt werden.
Tabelle 6: Präzision und Wiederfindungen bei der Validierung der Amine
| Substanz | Wiederfindung | Relative Standardabweichung [%] | ||||||
| c1 | c2 | c3 | Ø | c1 | c2 | c3 | Ø | |
| Anilin | 0,97 | 0,98 | 0,97 | 0,97 | 1,3 | 0,5 | 1,7 | 1,2 |
| 2,4-Dimethylanilin | 0,96 | 0,99 | 0,98 | 0,98 | 1,9 | 0,6 | 2,3 | 1,6 |
| 2,5-Dimethylanilin | 0,95 | 0,98 | 0,98 | 0,97 | 1,8 | 0,6 | 1,9 | 1,4 |
| 2,6-Dimethylanilin | 0,94 | 0,97 | 0,96 | 0,96 | 1,4 | 0,2 | 2,2 | 1,3 |
| 4-Ethoxyanilin | 1,04 | 0,99 | 1,04 | 1,02 | 1,0 | 0,9 | 2,3 | 1,4 |
| 2-Methoxyanilin | 0,95 | 0,98 | 0,98 | 0,97 | 1,0 | 0,4 | 2,1 | 1,2 |
| 3-Methoxyanilin | 0,96 | 0,98 | 0,99 | 0,98 | 2,5 | 0,7 | 2,1 | 1,7 |
| 4-Methoxyanilin | 1,04 | 1,01 | 1,03 | 1,03 | 4,5 | 0,9 | 2,0 | 2,5 |
| 2-Methylanilin | 0,96 | 0,98 | 0,97 | 0,97 | 3,5 | 0,5 | 1,9 | 1,9 |
| 3-Methylanilin | 0,99 | 0,99 | 1,00 | 0,99 | 1,9 | 0,7 | 1,8 | 1,5 |
| 4-Methylanilin | 0,99 | 0,99 | 0,99 | 0,99 | 1,3 | 0,6 | 1,6 | 1,2 |
5.2 Bestimmungsgrenzen
Die Bestimmungsgrenzen wurden gemäß DIN 32645 [3] mittels einer 10-Punkt-Kalibrierung im unteren Konzentrationsbereich von ca. 5 bis 50 µg/m3 (bezüglich 240 l Probeluftvolumen) für eine statistische Sicherheit von 99 % und einer relativen Ergebnisunsicherheit von 33,3 % (k = 3) ermittelt.
Die absoluten Bestimmungsgrenzen der einzelnen Amine liegen zwischen 0,2 und 1,6 ng. Dies entspricht bei einem Probeluftvolumen von 240 l, einem Desorptionsvolumen von 4 ml und einem Einspritzvolumen von 1 µl relativen Bestimmungsgrenzen von 0,003 bis 0,026 mg/m3 (siehe Tabelle 7).
Tabelle 7: Bestimmungsgrenzen der Amine
| Substanz | Bestimmungsgrenzen | |
| absolut [ng] | relativ [μg/m3] | |
| Anilin | 0,4 | 6 |
| 2,4-Dimethylanilin | 0,2 | 3 |
| 2,5-Dimethylanilin | 0,3 | 5 |
| 2,6-Dimethylanilin | 0,2 | 4 |
| 4-Ethoxyanilin | 1,6 | 26 |
| 2-Methoxyanilin | 0,4 | 7 |
| 3-Methoxyanilin | 1,0 | 17 |
| 4-Methoxyanilin | 1,1 | 18 |
| 2-Methylanilin | 0,6 | 10 |
| 3-Methylanilin | 0,5 | 8 |
| 4-Methylanilin | 0,3 | 5 |
5.3 Selektivität
Eine hohe Selektivität wird durch die gaschromatographische Trennung und Verwendung eines massenselektiven Detektors gewährleistet.
5.4 Messunsicherheit
Die erweiterte Messunsicherheit wurde unter Berücksichtigung aller relevanten Einflussgrößen nach DIN EN 482 [2] abgeschätzt. Die Ergebnisunsicherheit des Gesamtverfahrens und damit auch des Analysenergebnisses setzt sich im Wesentlichen zusammen aus den Unsicherheitsbeträgen bei der Probenahme (z.B. Probeluftvolumen, Abweichung zur Probenahmekonvention) und der analytischen Bearbeitung (Extraktionsmittelvolumen, Streuung der Kalibrierfunktion, Schwankung der Wiederfindungen und der Reproduzierbarkeiten). Die erweiterte Messunsicherheit liegt je nach Amin und Konzentration zwischen 21 % und 23 %.
5.5 Lagerfähigkeit
Die verlustfreie Lagerfähigkeit der Substanzen im adsorbierten Zustand beträgt bei Raumtemperatur mindestens 14 Tage.
6 Literatur
| [1] | DIN EN 481 Arbeitsplatzatmosphäre, Festlegung der Teilchengrößenverteilung zur Messung luftgetragener Partikel Beuth Verlag GmbH, Berlin 1993 |
| [2] | DIN EN 482 Arbeitsplatzatmosphäre - Allgemeine Anforderungen an die Leistungsfähigkeit von Verfahren zur Messung chemischer Arbeitsstoffe Beuth Verlag GmbH, Berlin 2006 |
| [3] | DIN 32645 Chemische Analytik - Nachweis-, Erfassungs- und Bestimmungsgrenze unter Wiederholbedingungen - Begriffe, Verfahren, Auswertung Beuth Verlag GmbH, Berlin 2008 |
| [4] | BGI/GUV-I 505-0 (jetzt DGUV Information 213-500 (2015)) Von den Berufsgenossenschaften anerkannte Analysenverfahren zur Feststellung der Konzentrationen krebserzeugender Arbeitsstoffe in der Luft in Arbeitsbereichen - A. Allgemeiner Teil - Carl Heymanns Verlag, 2003 |
Eingereicht durch Wilhelm Krämer, BASF SE, Ludwigshafen.
Erarbeitet und verabschiedet durch die AG Analytik im Sachgebiet "Gefahrstoffe" des Fachbereichs "Rohstoffe und chemische Industrie" der DGUV.
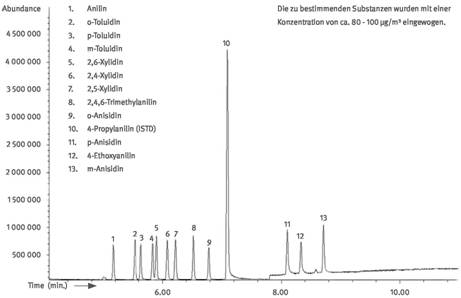
| Chromatogramm einer Kalibriermischung | Anhang |
Verfahren 02 - Probenahme mit Pumpe und Abscheidung auf einem sauer imprägnierten Filter, Gaschromatographie nach alkalischer Extraktion und Derivatisierung
Erprobte und von den Unfallversicherungsträgern anerkannte, diskontinuierliche Verfahren zur Bestimmung von aromatischen Aminen in Arbeitsbereichen.
| Name | CAS-Nr. | Molmasse |
| 2-Methylanilin; o-Toluidin | 95-53-4 | 107,16 |
| 3-Methylanilin; m-Toluidin | 108-44-1 | 107,16 |
| 4-Methlylanilin; p-Toluidin | 106-49-0 | 107,16 |
| 1-Naphthylamin; α-Naphthylamin; 1-Aminonaphthalin | 134-32-7 | 143,19 |
| 2-Naphthylamin; β-Naphthylamin; 2-Aminonaphthalin | 91-59-8 | 143,19 |
| 2-Aminobiphenyl; 2-Phenylanilin; 2-Biphenylamin | 90-41-5 | 169,23 |
| 3-Aminobiphenyl; 3-Phenylanilin; 3-Biphenylamin | 2243-47-2 | 169,23 |
| 4-Aminobiphenyl; 4-Phenylanilin; 4-Biphenylamin | 92-67-1 | 169,23 |
Es sind personengetragene und ortsfeste Probenahmen für Messungen zur Beurteilung von Arbeitsbereichen möglich.
Mit diesem Verfahren wird die über die Probenahmedauer gemittelte Konzentration von Methylanilinen, Phenylanilinen und Naphthylaminen, im Folgenden kurz Amine genannt, im Arbeitsbereich personengetragen oder ortsfest bestimmt.
| Messprinzip: | Mit Hilfe einer Pumpe wird ein definiertes Luftvolumen durch eine mit zwei sauer imprägnierten Filtern bestückte Kassette gesaugt. Anschließend werden die abgeschiedenen Amine in eine wässrige Vorlage überführt, im alkalischen Milieu mit Toluol extrahiert und mit Heptafluorbuttersäureanhydrid derivatisiert. Die Bestimmung erfolgt nach gaschromatographischer Trennung mit dem massenselektiven Detektor. |
| Bestimmungsgrenze: | absolut: 0,04 bis 0,23 pg je Amin relativ: von 0,001 bis 0,008 pg/m3 an Amin für 120 l Probeluftvolumen, 2 ml Desorptionslösung und einem Injektionsvolumen von 0,5 μl |
| Arbeitsbereich: | Validiert im Bereich von 1,04 bis 100 μg/m3 bezogen auf 120 l Probeluftvolumen für alle Amine; Ausnahme: 1-Naphthylamin durch Minderbefunde bei niedrigen Konzentrationen ab 100 μg/m3 bestimmbar. |
| Selektivität: | Eine sehr hohe Selektivität wird durch die pH-gesteuerte Extraktion, die Derivatisierung der Amine, die gaschromatographische Trennung der Derivate und die Verwendung eines massenselektiven Detektors erreicht. |
| Vorteile: | Personengetragene und selektive Messungen sind mit sehr hoher Empfindlichkeit möglich. |
| Nachteile: | Keine Anzeige von Konzentrationsspitzen, relativ aufwändige Aufarbeitung notwendig. |
| Apparativer Aufwand: | Probenahmeeinrichtung, bestehend aus Pumpe, Volumenstrommessgerät und Kassette mit sauer imprägnierten Filtern, Gaschromatograph mit massenselektivem Detektor. |
1 Geräte und Chemikalien
1.1 Geräte
Für die Probenahme:
- Pumpe mit einem Volumenstrom-Nennbereich von 1 l/min, z.B. SG 2500, Fa. GSA, 40880 Ratingen
- Volumenstrommessgerät, z.B. Gilibrator, Fa. Gilian, Bezug z.B. über DEHA Haan & Wittmer GmbH, 71296 Heimsheim
- Zentrifugenröhrchen aus Perfluorethylenpropylen (FEP) mit Schraubverschluss, 10 ml, z.B. Nalgene, Bezug z.B. über VWR, 64295 Darmstadt
- Aluminiumfolie
- Probenträger, bestehend aus zwei in einer Polystyrol-Kassette getrennt fixierte Glasfaserfilter, Durchmesser 37 mm, jeweils imprägniert mit 0,5 ml 0,13 molarer Schwefelsäure; z.B. Fa. SKC; Bezug z.B. über Analyt-MTC GmbH, 79379 Müllheim
Alternativ die Glasfaserfilter (Fa. Pall) selbst in einer Glasschale oder auf einem Uhrglas mit 0,5 ml 0,13 molarer Schwefelsäure benetzen und über Nacht an der Luft trocknen lassen. Dann die Filter in eine Leer-Kassette (Fa. SKC) einlegen. Sie sind unter diesen Bedingungen mindestens sechs Monate haltbar. Bezug der Filter und Leer-Kassetten z.B. ebenfalls über Analyt-MTC GmbH.
Für die Probenvorbereitung:
- Pinzette
- Tischzentrifuge mit mindestens 5000 U/min,
- z.B. Fa. Hettich GmbH, 78532 Tuttlingen
- Horizontalschüttler mit mindestens 420 Schwingungen/min, z.B. Fa. Bühler GmbH, 72379 Hechingen
- Reagenzglasschüttler mit mindestens 2500 Schwingungen/min, z.B. Fa. IKA-Werke GmbH, 79219 Staufen
- pH-Meter, z.B. Fa WTW, Xylem Analytics Germany GmbH, 82362 Weilheim
- automatische Verdrängerpipette, z.B. Multipette Xstream, Fa. Eppendorf, 22339 Hamburg
- Schraubgläschen, 4 ml (braun)
Für die analytische Bestimmung:
- Gaschromatograph mit massenselektivem Detektor (MSD)
- Messkolben, 5 ml, 10 ml, 100 ml (Braunglas)
- Erlenmeyerkolben, 100 ml
- Autosamplergläschen, 1,5 ml (braun)
1.2 Chemikalien
- m-Toluidin, Reinheit 99,8 %, z.B. Fa. LGC Standards, 46485 Wesel
- p-Toluidin, Reinheit 99,5 %, z.B. Fa. LGC Standards
- 2-Aminobiphenyl, Reinheit 99 %, z.B. LGC Standards
- 3-Aminobiphenyl, Reinheit 99,9 %, z.B. LGC Standards
- Amin-Mix, z.B. Fa. LGC Standards: u. a. je 2000 µg/ml o-Toluidin, 1-Naphthylamin, 2-Naphthylamin und 4-Aminobiphenyl in Dichlormethan
- 1-Aminofluoren, Reinheit 99 %, als interner Standard (ISTD), z.B. Fa. Sigma-Aldrich, 82024 Taufkirchen
- Toluol, zur Analyse, z.B. Fa. Merck, 64293 Darmstadt
- Natriumhydroxid, z.B. Fa. Merck
- Natronlauge, 0,5 mol/l, z.B. Fa. Merck
- Heptafluorbuttersäureanhydrid (HFBAA), Reinheit 99 %, z.B. Fa. Sigma-Aldrich
- Kaliumdihydrogenphosphat, z.B. Fa. Sigma-Aldrich
- Reinstwasser, z.B. Fa. Merck
- Schwefelsäure, konzentriert, z.B. Fa. Merck
- Helium 5.0, Reinheit 99,999 %
| Phosphatpuffer: | 1 molare Kaliumdihydrogenphosphat-Lösung, pH 7 In einen 100-ml-Erlenmeyerkolben werden 13,6 g Kaliumdihydrogenphosphat eingewogen und mit Wasser auf ca. 90 ml ergänzt. Nun wird mit konzentrierter Natronlauge auf einen pH-Wert von 7 eingestellt und mit Wasser auf 100 ml aufgefüllt. |
| Schwefelsäure: | Verdünnte Schwefelsäure, 0,13 molar In einen 100-ml-Messkolben, in dem einige ml Wasser vorgelegt wurden, werden 722 μl der konzentrierten Schwefelsäure (96 %) pipettiert. Anschließend wird mit Wasser bis zur Marke aufgefüllt und umgeschüttelt. |
| Stammlösung ISTD: | Lösung von ca. 570 μg/ml 1-Aminofluoren in Toluol In einen 10-ml-Messkolben werden ca. 5,7 mg 1-Aminofluoren auf 0,1 mg genau eingewogen. Anschließend wird mit Toluol bis zur Marke aufgefüllt und umgeschüttelt. |
| Desorptionslösung: | Lösung von ca. 500 ng/ml 1-Aminofluoren in Toluol In einen 100-ml-Messkolben, in dem einige ml Toluol vorgelegt wurden, werden ca. 90 μl der Stammlösung ISTD pipettiert, mit Toluol bis zur Marke aufgefüllt und umgeschüttelt. |
| Stammlösungen 1: | Vier Lösungen von ca. 2000 μg Amin/ml Toluol (siehe Tabelle 1) In einen braunen 10-ml-Messkolben werden die in Tabelle 1 aufgeführten Amine getrennt jeweils auf 0,1 mg genau eingewogen. Anschließend wird mit Toluol bis zur Marke aufgefüllt und umgeschüttelt. |
Tabelle 1: Einwaagen und Konzentrationen der Amine in den Stammlösungen 1
| Stoff | Einwaage [mg] | Konzentration [μg/ml] |
| m-Toluidin | 20,0 | 2000 |
| p-Toluidin | 20,1 | 2000 |
| 2-Aminobiphenyl | 20,2 | 2000 |
| 3-Aminobiphenyl | 20,0 | 2000 |
| Stammlösung 2: | Lösung von ca. 5,0 µg Amin/ml Desorptionslösung In einen braunen 20-ml-Messkolben, in dem einige ml Desorptionslösung vorgelegt wurden, werden jeweils 50 µl der Stammlösungen 1 sowie 50 µl des Amin-Mixes zugegeben. Dieser Amin-Mix (siehe Abschnitt 1.2) enthält u. a. die Verbindungen o-Toluidin, 1-Naphthylamin, 2-Naphthylamin und 4-Aminobiphenyl mit einer Konzentration von je 2000 µg/ml. Anschließend wird mit Desorptionslösung bis zur Marke aufgefüllt und umgeschüttelt. |
| Kalibrierlösungen: | Lösungen von 20 bis 500 ng Amin/ml Desorptionslösung (siehe Tabelle 2) In je einen braunen 10-ml-Messkolben, in dem einige ml Desorptionslösung vorgelegt wurden, werden die sieben in der Tabelle 2 angegebenen Volumina der Stammlösung 2 pipettiert, mit Desorptionsmittel aufgefüllt und umgeschüttelt. |
Tabelle 2: Konzentrationen der Amine in den Kalibrierlösungen in ng/ml
| Lösung | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Zugabe Stammlösung 2 in μl | 40 | 200 | 360 | 520 | 680 | 840 | 1000 |
| o-Toluidin | 20 | 100 | 180 | 260 | 340 | 420 | 500 |
| m-Toluidin | 20 | 100 | 180 | 260 | 340 | 420 | 500 |
| p-Toluidin | 20 | 100 | 180 | 260 | 340 | 420 | 500 |
| 1-Naphthylamin | 20 | 100 | 180 | 260 | 340 | 420 | 500 |
| 2-Naphthylamin | 20 | 100 | 180 | 260 | 340 | 420 | 500 |
| 2-Aminobiphenyl | 20 | 100 | 180 | 260 | 340 | 420 | 500 |
| 3-Aminobiphenyl | 20 | 100 | 180 | 260 | 340 | 420 | 500 |
| 4-Aminobiphenyl | 20 | 100 | 180 | 260 | 340 | 420 | 500 |
| 1-Aminofluoren | 500 | 500 | 500 | 500 | 500 | 500 | 500 |
Jeweils 1 ml der Kalibrierlösungen wird entsprechend Abschnitt 3.1 zur Derivatisierung eingesetzt.
Mit diesen Lösungen wird bezogen auf ein Probeluftvolumen von 120 l ein Konzentrationsbereich von 0,333 bis 8,33 µg/m3 an Einzelsubstanz (siehe Tabelle 3) abgedeckt.
Tabelle 3: Umgerechnete Konzentrationen der Amine in den Kalibrierlösungen in µg/m3 (bezogen auf ein Probeluftvolumen von 120 l)
| Lösung | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| o-Toluidin | 0,333 | 1,67 | 3,00 | 4,33 | 5,67 | 7,00 | 8,33 |
| m-Toluidin | 0,333 | 1,67 | 3,00 | 4,33 | 5,67 | 7,00 | 8,33 |
| p-Toluidin | 0,333 | 1,67 | 3,00 | 4,33 | 5,67 | 7,00 | 8,33 |
| 1-Naphthylamin | 0,333 | 1,67 | 3,00 | 4,33 | 5,67 | 7,00 | 8,33 |
| 2-Naphthylamin | 0,333 | 1,67 | 3,00 | 4,33 | 5,67 | 7,00 | 8,33 |
| 2-Aminobiphenyl | 0,333 | 1,67 | 3,00 | 4,33 | 5,67 | 7,00 | 8,33 |
| 3-Aminobiphenyl | 0,333 | 1,67 | 3,00 | 4,33 | 5,67 | 7,00 | 8,33 |
| 4-Aminobiphenyl | 0,333 | 1,67 | 3,00 | 4,33 | 5,67 | 7,00 | 8,33 |
2 Probenahme
Die mit zwei sauer imprägnierten Glasfaserfiltern bestückte Polystyrol-Kassette wird unter Beachtung der korrekten Orientierung (Aufdruck "Inlet" zum Probenahmeort gerichtet) mit der Pumpe verbunden. Es wird ein Volumenstrom von 1 l/min eingestellt. Die Pumpe und das Probenahmesystem werden von einer Person im Arbeitsbereich getragen oder ortsfest verwendet. Das Verfahren wurde bis zu einem Probeluftvolumen von 120 l (entsprechend einer Probenahmedauer von 120 Minuten) überprüft. Die Anforderung einer Probenahme der einatembaren Fraktion ist durch die Kombination aus Volumenstrom und Geometrie des Probenahmesystems erfüllt. Nach der Probenahme ist der Volumenstrom auf Konstanz zu überprüfen. Ist die Abweichung vom eingestellten Volumenstrom > ± 5 %, wird empfohlen, die Probenahme zu wiederholen (siehe hierzu DGUV Information 213-500 "Allgemeiner Teil" [3]). Die Kassette wird anschließend mit den Blindstopfen dicht verschlossen.
Die weitere Vorgehensweise ist abhängig von den zu bestimmenden Aminen (siehe Tabelle 8).
Können die Filter in den Kassetten verbleiben, sind diese lichtgeschützt aufzubewahren und nach den Vorgaben des Abschnitts 5.3 dem Untersuchungslabor zuzuführen, wo sie unter Einhaltung der maximalen Lagerzeiten in die wässrigen Vorlagen zu überführen sind (siehe unten). Ansonsten werden die beiden Filter nach beendeter Probenahme umgehend, spätestens jedoch nach 4 Stunden aus der Kassette entnommen und jeweils in eine Vorlage (Zentrifugenröhrchen, gefüllt mit 2 ml Wasser) gegeben. Hierzu wird die Kassette aufgehebelt und die Filter werden mit Hilfe einer Pinzette überführt (Kontrollfilter zuerst), wobei auf eine vollständige Benetzung des Filters im Probengefäß zu achten ist. Anschließend werden die Probengefäße mit Aluminiumfolie umhüllt und entsprechend den Vorgaben der Tabelle 8 dem Labor zur Verfügung gestellt.
3 Analytische Bestimmung
3.1 Probenaufbereitung
Jedes der sich noch im Probenträger befindenden Glasfaserfilter wird im Labor nach Aufhebeln der Kassette in eine separate Vorlage (Zentrifugenröhrchen, gefüllt mit 2 ml Wasser) überführt und komplett benetzt (siehe oben). Nun werden die Proben wie auch die bereits in der Vorlage verschickten Filter im Probengefäß mit 1 ml 0,5 N Natronlauge versetzt. Anschließend werden genau 2 ml Desorptionslösung zupipettiert. Nach jeder Zugabe wird kurz aufgeschüttelt. Das Gefäß wird verschlossen und zunächst für ca. 20 Sekunden mittels Reagenzglasschüttler auf der höchsten Stufe geschüttelt. Anschließend wird für 20 Minuten auf dem Horizontalschüttler geschüttelt. Danach erfolgt eine 10-minütige Zentrifugation der Probengefäße mit 5000 U/min. Von der überstehenden organischen Phase wird nun 1 ml abpipettiert und in ein braunes 4-ml-Schraubglas überführt.
Jeweils 1 ml Kalibrierlösung (Tabelle 2) bzw. Probenextrakt wird im braunen 4-ml-Schraubglas mit 25 μl Heptafluorbuttersäureanhydrid versetzt und für 20 Sekunden mittels Reagenzglasschüttler intensiv geschüttelt. Nach Abwarten einer Derivatisierungszeit von mindestens 10 Minuten wird zu jeder Lösung 1 ml Phosphatpuffer gegeben. Anschließend wird nochmals für 20 Sekunden intensiv geschüttelt (die Lösung muss milchigweiß sein). Nach der Phasentrennung wird ein Aliquot der überstehenden organischen Phase (Probelösung) in ein braunes Autosamplergläschen überführt.
Um sicherzustellen, dass die verwendeten Lösungen und die Filter keine störenden Verunreinigungen enthalten, wird pro Probenserie ein sauer imprägnierter Filter in 2 ml Wasser gegeben. Dann wird, wie oben beschrieben, zunächst Natronlauge und dann Desorptionslösung zugegeben. Die Extraktion, Derivatisierung und Reinigung des Extraktes wird ebenfalls wie oben beschrieben durchgeführt (Leerwertlösung).
Jeweils 0,5 µl der Probelösungen bzw. 0,5 µl der Leerwertlösung werden in den Gaschromatographen eingespritzt und ein Chromatogramm, wie nachfolgend beschrieben, angefertigt.
3.2 Instrumentelle Arbeitsbedingungen
Die in Abschnitt 5 angegebenen Verfahrenskenngrößen wurden unter folgenden Gerätebedingungen erarbeitet:
| Gerät: | Gaschromatograph HP 6890 A mit massenspezifischem Detektor MSD 5973 Network und PTV-Injektor, Fa. Agilent, 76337 Waldbronn |
| GC-Parameter: | |
| Trennsäule: | Quarzkapillare, stationäre Phase: 50 % Phenyl/50 % Methylpolysiloxan, z.B. DB-17ms, Innendurchmesser 0,25 mm, Länge 30 m, Filmdicke 0,25 pm, z.B. Fa. Agilent |
| Injektion: | 0,5 pl; Splitlos für 1 min, Injektortemperatur: 250 °C |
| Ofenprogramm: | Anfangstemperatur: 55 °C für 2 min
Heizrate I: 10 °C/min bis 250 °C Heizrate II: 16 °C/min bis 270 °C, 5 min isotherm |
| Trägergas: | Helium, 130 kPa Vordruck (constant pressure) |
| Transferleitung: | 250 °C |
| MSD-Parameter: | |
| Ionisierungsart: | EI (70 eV) |
| Messmodus: | SIM (Registriermassen, siehe Tabelle 4) |
| Dwell time: | 60-80 ms Messung in Zeitfenstern: [Toluidine], [2-Aminobiphenyl], [Naphthylamine], [3- und 4-Aminobiphenyl], [1-Aminofluoren] |
Tabelle 4: SIM-Registriermassen (m/z) zur Quantifizierung (Target-Ion) und Qualifizierung (Qualifier-Ionen, mit Angabe ihrer Signalintensitäten bezüglich Target-Ion in %)
| Stoff | Target | Qualifier 1 | Intensität | Qualifier 2 | Intensität |
| 2-Methylanilin - HFBA-Amid | 303 | 134 | 100 | 106 | 32 |
| 3-Methylanilin - HFBA-Amid | 303 | 134 | 39 | 106 | 23 |
| 4-Methylanilin - HFBA-Amid | 303 | 134 | 23 | 106 | 39 |
| 1-Naphthylamin - HFBA-Amid | 339 | 115 | 42 | 142 | 30 |
| 2-Naphthylamin - HFBA-Amid | 339 | 115 | 44 | 142 | 36 |
| 2-Aminobiphenyl - HFBA-Amid | 365 | 366 | 19 | 168 | 13 |
| 3-Aminobiphenyl - HFBA-Amid | 365 | 366 | 20 | 168 | 15 |
| 4-Aminobiphenyl - HFBA-Amid | 365 | 366 | 18 | 168 | 42 |
| 1-Aminofluoren - HFBA-Amid | 377 | 165 | 32 | - | - |
4 Auswertung
4.1 Kalibrierung
Von den unter Abschnitt 1.2 beschriebenen und nach Abschnitt 3.1 derivatisierten Kalibrierlösungen werden jeweils 0,5 µl in den Gaschromatographen injiziert.
Die Verhältnisse der Peakflächen der Amin-Derivate zu den Peakflächen des Derivats des 1-Aminofluorens (ISTD) werden gegen die entsprechenden, aus den Kalibrierlösungen erhaltenen Massenverhältnisse aufgetragen. Mit Hilfe der Regressionsrechnung ermittelt man die Kalibrierfunktionen.
4.2 Berechnen des Analysenergebnisses
Aus den erhaltenen Chromatogrammen werden die Peakflächen der Amin-Derivate und des 1-Aminofluoren-Derivats ermittelt, der Quotient gebildet und aus der jeweiligen Kalibrierfunktion der zugehörige Wert für die Masse in der Probelösung in ng bestimmt.
Die Berechnung der Massenkonzentration der jeweiligen Einzelsubstanz in der Probeluft in µg/m3 erfolgt nach der Formel:
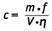
Es bedeuten:
| c = | Massenkonzentration des jeweiligen Amins in der Probeluft in µg/m3 |
| m = | Summe der aus der entsprechenden Kalibrierfunktion ermittelten Massen des Amins in den beiden Probelösungen des Sammel- und Kontrollfilters in ng |
| f = | Aliquotierungsfaktor, ohne Verdünnungsschritt gilt f=2 |
| V = | Probeluftvolumen in l |
| η = | Wiederfindung (siehe Abschnitt 5.1) |
Liegen die Gehalte einzelner Amin-Derivate oberhalb des Kalibrierbereiches, so ist die Derivatisierung mit einem geringeren Extraktvolumen zu wiederholen. Beispielsweise werden für eine vierfache Verdünnung 250 µl des Original-Probenextrakts mit Desorptionslösung auf 1 ml ergänzt und zur Derivatisierung eingesetzt (dann gilt f = 8).
5 Beurteilung des Verfahrens
5.1 Präzision und Wiederfindung
Die Präzision im Mindestmessbereich nach DIN EN 482 [1] sowie die Wiederfindung wurden für drei Konzentrationen bestimmt. Die Validierlösungen wurden entsprechend den Angaben in Tabelle 5 hergestellt:
| Validierlösungen 1 - 3: | Lösungen von 2,5 mg/l, 20 mg/l und 240 mg/l Amin in Toluol In jeweils einen braunen 5-ml-Messkolben wurden
gegeben, mit Toluol bis zur Marke aufgefüllt und umgeschüttelt. |
Mit einer Mikroliterspritze wurden jeweils 50 μl der Validierlösungen auf den oberen, imprägnierten Glasfaserfilter der Polystyrol-Kassette dotiert. Nach einer Wartezeit von einer Stunde wurde für 120 Minuten bei einer Umgebungstemperatur von 22 °C und einer Luftfeuchte von ca. 55 % Laborluft durch die Probenträger mit einem Volumenstrom von 1 l/min gesaugt. Die Aufarbeitung, Derivatisierung und analytische Bestimmung erfolgte wie in Abschnitt 3 beschrieben.
Als Referenz dienten 1-ml-Aliquote der mit Desorptionslösung 1 : 40 verdünnten Validierlösungen, die nach Abschnitt 3.1 entsprechend den Kalibrierlösungen derivatisiert und mit Pufferlösung gereinigt wurden.
Die eingesetzten Massen entsprachen für 120 l Probeluftvolumen den angegebenen Validierkonzentrationen (siehe Tabelle 5).
Tabelle 5: Konzentrationen der Amine bei der Validierung
| Substanz | dotierte Masse | Validierkonzentration | ||||
| c1 [µg] | c2 [µg] | c3 [µg] | c1 [µg/m3] | c2 [µg/m3] | c3 [µg/m3] | |
| o-Toluidin | 0,125 | 1,0 | 12,0 | 1,04 | 8,33 | 100 |
| m-Toluidin | 0,125 | 1,0 | 12,0 | 1,04 | 8,33 | 100 |
| p-Toluidin | 0,125 | 1,0 | 12,0 | 1,04 | 8,33 | 100 |
| 1-Naphthylamin | 0,125 | 1,0 | 12,0 | 1,04 | 8,33 | 100 |
| 2-Naphthylamin | 0,125 | 1,0 | 12,0 | 1,04 | 8,33 | 100 |
| 2-Aminobiphenyl | 0,125 | 1,0 | 12,0 | 1,04 | 8,33 | 100 |
| 3-Aminobiphenyl | 0,125 | 1,0 | 12,0 | 1,04 | 8,33 | 100 |
| 4-Aminobiphenyl | 0,125 | 1,0 | 12,0 | 1,04 | 8,33 | 100 |
Bei jeweils mindestens sechsfacher Durchführung der beschriebenen Vorgehensweise ergaben sich die in Tabelle 6 aufgeführten Wiederfindungen (Quotient aus der Filterbelegung nach dem Saugvorgang und der Referenz) und relativen Standardabweichungen.
Auch bei der höchsten Validierkonzentration betrugen die Amin-Massen auf dem nachgeschalteten Filter weniger als 1 %, bezogen auf die Gesamtmasse eines Amins.
Tabelle 6: Präzision und Wiederfindungen bei der Validierung der Amine
| Substanz | Wiederfindung | Relative Standardabweichung [%] | ||||||
| c1 | c2 | c3 | Ø | c1 | c2 | c3 | Ø | |
| o-Toluidin | 0,88 | 0,85 | 0,92 | 0,88 | 4,0 | 3,5 | 3,7 | 3,7 |
| m-Toluidin | 0,90 | 0,87 | 0,92 | 0,90 | 4,4 | 3,4 | 3,6 | 3,8 |
| p-Toluidin | 0,87 | 0,85 | 0,91 | 0,87 | 4,5 | 3,5 | 3,8 | 3,9 |
| 1-Naphthylamin | (0,06) | (0,49) | 0,89 | Trend | (24,9) | (12,7) | 3,6 | - |
| 2-Naphthylamin | 0,75 | 0,89 | 0,94 | Trend | 3,9 | 2,2 | 3,8 | 3,3 |
| 2-Aminobiphenyl | 0,99 | 0,91 | 0,95 | 0,95 | 3,0 | 2,2 | 4,0 | 3,1 |
| 3-Aminobiphenyl | 0,93 | 0,90 | 0,93 | 0,92 | 2,6 | 2,1 | 4,1 | 2,9 |
| 4-Aminobiphenyl | 0,88 | 0,89 | 0,95 | 0,91 | 2,0 | 2,0 | 4,0 | 2,7 |
Die Daten weisen bei den Naphthylaminen auf eine Konzentrationsabhängigkeit der Wiederfindungen hin. Während im Allgemeinen zur Berechnung der Analysenergebnisse in Formel (1) der Durchschnittswert der Wiederfindung eingesetzt werden kann, ist letztere bei 2-Naphthylamin von der Höhe des Messwertes abhängig. 1-Naphthylamin kann mit diesem Verfahren erst ab 100 µg/m3 bestimmt werden, was einem Zehntel seines aktuellen Arbeitsplatzgrenzwertes entspricht [7].
5.2 Bestimmungsgrenzen
Die Bestimmungsgrenzen wurden gemäß DIN 32645 [4] mittels einer 10-Punkt-Kalibrierung im Konzentrationsbereich von 0,08 - 0,8 ng/ml für eine statistische Sicherheit von 95 % und einer relativen Ergebnisunsicherheit von 33,3 % (k=3) ermittelt.
Die Bestimmungsgrenzen der einzelnen HFBA-Derivate liegen, bezogen auf das jeweilige Amin, zwischen 0,16 und 0,90 ng pro Filter. Die absoluten Bestimmungsgrenzen liegen zwischen 0,04 und 0,23 pg. Dies entspricht bei einem Probeluftvolumen von 120 l und einem Desorptionsvolumen von 2 ml relativen Bestimmungsgrenzen von 0,001 bis 0,008 µg/m3 (siehe Tabelle 7).
Tabelle 7: Bestimmungsgrenzen der Amine
| Substanz | Bestimmungsgrenzen | ||
| absolut [pg] | Masse [ng/Filter] | relativ [μg/m3] | |
| o-Toluidin | 0,16 | 0,64 | 0,005 |
| m-Toluidin | 0,08 | 0,32 | 0,003 |
| p-Toluidin | 0,05 | 0,20 | 0,002 |
| 1-Naphthylamin | 0,23 | 0,90 | 0,008 |
| 2-Naphthylamin | 0,12 | 0,48 | 0,004 |
| 2-Aminobiphenyl | 0,07 | 0,28 | 0,002 |
| 3-Aminobiphenyl | 0,04 | 0,16 | 0,001 |
| 4-Aminobiphenyl | 0,07 | 0,26 | 0,002 |
5.3 Lagerfähigkeit
Die Lagerstabilität der mit 50 µl Validierlösung 2 beaufsch lagten, verkapselten Filter wurde untersucht. Darüber hinaus wurde auch die Lagerfähigkeit der Amine auf dem Filter geprüft, wenn sich dieses in der wässrigen Vorlage befand. In Abhängigkeit von den zu untersuchenden Aminen sind unterschiedliche Lagerbedingungen einzuhalten (siehe Tabelle 8). Die Lagerfähigkeit gilt hier als erfüllt, wenn der Verlust an Analyt weniger als 10 % beträgt.
Tabelle 8: Lagerfähigkeit der Amine
| Substanz | Filter in Kassette | Filter in wässriger Vorlage | ||
| Raum- temperatur | 4 - 8 °C | Raum- temperatur | 4 - 8 °C | |
| Toluidine | 7 d | - | 14 d | - |
| 1-Naphthylamin | 4 h | - | - | 7 d |
| 2-Naphthylamin | 1 d | 7 d | 14 d | - |
| Aminobiphenyle | 7 d | - | 14 d | - |
Es zeigt sich, dass die Toluidine und Aminobiphenyle bei Raumtemperatur bis zu einer Woche auf dem Filter in der verschlossenen Kapsel verbleiben können.
Nach Überführung in die wässrige Vorlage sind die Lösungen 2 Wochen stabil.
2-Naphthylamin sollte bereits nach einem Tag bzw. bei Kühlung der Kapsel nach spätestens einer Woche in die Vorlage überführt werden, wobei dann ebenfalls eine Stabilität über weitere 2 Wochen gewährleistet ist.
Wenn 1-Naphthylamin zu analysieren ist, erfordert dies eine umgehende Überführung der Filter in die wässrige Vorlage: die Lagerdauer von 4 h darf nicht überschritten werden. Darüber hinaus muss die wässrige Vorlage gekühlt an das Untersuchungslabor verschickt werden, da bei Raumtemperatur bereits nach 3 Tagen erhebliche Verluste auftraten.
Demzufolge kann, wenn 1-Naphthylamin nicht bestimmt werden muss, bei sachgemäßer Lagerung der Proben eine Überführung der Filter durch die Probenehmer vermieden werden.
Die Proben sind lichtgeschützt aufzubewahren; im Untersuchungslabor sollten zur Minimierung der Lagerverluste die Probenträger bzw. die wässrigen Vorlagen gekühlt aufbewahrt werden. Lediglich die Analytik von 1-Naphthylamin erfordert eine möglichst rasche Probenaufarbeitung.
5.4 Selektivität
Eine sehr hohe Selektivität wird durch die pH-gesteuerte Extraktion, die Derivatisierung der Amine, die gaschromatographische Trennung der Derivate und die Verwendung eines massenselektiven Detektors gewährleistet.
5.5 Messunsicherheit
Die erweiterte Messunsicherheit wird unter Berücksichtigung aller relevanten Einflussgrößen nach DIN EN 482 [1] und DIN EN 1076 [2] abgeschätzt. Die Ergebnisunsicherheit des Gesamtverfahrens und damit auch des Analysenergebnisses setzt sich im Wesentlichen zusammen aus den Unsicherheitsbeträgen des Probeluftvolumens unter Berücksichtigung des Probenahmewirkungsgrades für die E-Fraktion, des Extraktionsvolumens, der Wiederfindungen und der Einflüsse auf die Messwerte, insbesondere die Streuung der Kalibrierfunktion und die laborinterne Reproduzierbarkeit (Präzision).
In Tabelle 9 sind die im Bottomup-Verfahren ermittelten, einzelnen Messunsicherheitsbeträge dargestellt. Da die Unsicherheiten der Messwerte (Einheit ng/ml) von deren Höhe abhängen, wurden diese in hoch, mittel und niedrig unterschieden (entsprechend den Kalibrierniveaus 7, 4 und 2; siehe auch Tabellen 2 bzw. 3).
Tabelle 9: Messunsicherheitsbeträge der Amine, Angaben in %
| Amin | Probeluft- volumen | Extraktions- volumen | Lagerung | Messwert | ||
| hoch | mittel | niedrig | ||||
| o-Toluidin | 9,2 | 0,9 | 3,3 | 8,0 | 6,9 | 10,2 |
| m-Toluidin | 3,2 | 7,1 | 7,0 | 10,3 | ||
| p-Toluidin | 4,5 | 8,2 | 7,0 | 11,1 | ||
| 1-Naphthylamin | 4,8 | 7,5 | - | - | ||
| 2-Naphthylamin | 5,2 | 9,8 | 8,3 | 13,7 | ||
| 2-Aminobiphenyl | 2,6 | 9,6 | 8,7 | 12,8 | ||
| 3-Aminobiphenyl | 3,3 | 8,7 | 5,5 | 10,1 | ||
| 4-Aminobiphenyl | 4,8 | 9,9 | 5,3 | 11,6 | ||
Hinsichtlich der Lagerung wurden die unter Abschnitt 5.3 genannten Einschränkungen für die beiden Naphthylamine berücksichtigt. Als Wiederfindungswert wurde mit Ausnahme der Naphthylamine jeweils der Mittelwert der 3 Wiederfindungsversuche (siehe Tabelle 6) zugrunde gelegt.
Für die kombinierten und die erweiterten Messunsicherheiten ergeben sich aus den einzelnen Unsicherheitsbeträgen die in Tabelle 10 aufgeführten stoff- und konzentrationsabhängigen Werte.
Tabelle 10: Ermittlung der erweiterten Messunsicherheiten des Gesamtverfahrens, Angaben in %
| Amin | kombinierte Analysenergebnis Messunsicherheit | erweiterte Analysenergebnis Messunsicherheit | ||||
| hoch | mittel | niedrig | hoch | mittel | niedrig | |
| o-Toluidin | 11,5 | 11,3 | 13,7 | 23 | 23 | 27 |
| m-Toluidin | 11,4 | 11,3 | 13,7 | 23 | 23 | 27 |
| p-Toluidin | 12,0 | 11,8 | 14,8 | 24 | 24 | 30 |
| 1-Naphthylamin | 12,8 | - | - | 26 | - | - |
| 2-Naphthylamin | 14,4 | 13,4 | 17,3 | 29 | 27 | 35 |
| 2-Aminobiphenyl | 13,5 | 12,9 | 16,0 | 27 | 26 | 32 |
| 3-Aminobiphenyl | 11,4 | 11,0 | 13,9 | 23 | 22 | 28 |
| 4-Aminobiphenyl | 11,9 | 11,5 | 14,6 | 24 | 23 | 29 |
| zugehörige Konzentration in µg/m3 | 100 | 8,3 | 1,0 | 100 | 8,3 | 1,0 |
Die erweiterte Messunsicherheit liegt somit für alle Amine zwischen 22 und 33 %. Die zugehörige Konzentration der Analysenergebnisse ergibt sich aus einer Probenahmedauer von 2 Stunden.
6 Bemerkungen
Das vorliegende Verfahren beruht auf den beiden OSHA-Methoden 73 (Toluidine) und 93 (Naphthylamine, 4-Aminobiphenyl), die jedoch keinen internen Standard vorsehen, siehe [5] und [6].
Aus Arbeitsschutzgründen empfiehlt es sich, insbesondere die krebserzeugenden, keimzellmutagenen oder reproduktionstoxischen Stoffe (KMR-Stoffe) nicht einzuwiegen, sondern in Form von käuflichen Stammlösungen (meist in Mischungen mit anderen Aminen) einzusetzen.
Eine höhere Luftfeuchte (75 % relative Feuchte) führte insbesondere bei geringeren Konzentrationen der Amine zu deutlich verbesserten Wiederfindungen; dies trifft vor allen Dingen auf die beiden Naphthylamine zu.
Als Trennsäule kann auch eine übliche 5 % Phenyl/95 % Methylpolysiloxan-Phase verwendet werden; dabei eluieren allerdings die Derivate des 2-Aminobiphenyls und 1-Naphthylamins in umgekehrter Reihenfolge.
Ein Teil der aromatischen Amine (Toluidine, 1-Naphthylamin) ist lichtempfindlich, daher empfiehlt sich das Arbeiten mit Braunglas-Gefäßen sowie eine Lagerung im Dunkeln.
Der Einsatz des GSP-Systems ergab eine deutliche Verschlechterung der Wiederfindungsraten gegenüber der Verwendung von Polystyrol-Kassetten, insbesondere bei den KMR-Stoffen 2-Naphthylamin und 4-Aminobiphenyl. Auch die Lagerung der Filter in den GSP-Kapseln erwies sich als ungeeignet. Zudem kann bei höheren Amin-Konzentrationen (größer 0,1 mg/m3) ein Durchbruch nicht ausgeschlossen werden.
7 Literatur
| [1] | DIN EN 482:2015-12 Exposition am Arbeitsplatz - Allgemeine Anforderungen an die Leistungsfähigkeit von Verfahren zur Messung chemischer Arbeitsstoffe Beuth Verlag GmbH, Berlin 2015 |
| [2] | DIN EN 1076:2010-04 Exposition am Arbeitsplatz - Messung von Gasen und Dämpfen mit pumpenbetriebenen Probenahmeeinrichtungen - Anforderungen und Prüfverfahren Beuth Verlag GmbH, Berlin 2010 |
| [3] | DGUV Information 213-500 Von den Unfallversicherungsträgern anerkannte Analysenverfahren zur Feststellung der Konzentrationen krebserzeugender, erbgutverändernder oder fortpflanzungsgefährdender Stoffe in der Luft in Arbeitsbereichen - Allgemeiner Teil DGUV, Berlin 2015 |
| [4] | DIN 32645:2008-11 Chemische Analytik - Nachweis-, Erfassungs- und Bestimmungsgrenze unter Wiederholbedingungen - Begriffe, Verfahren, Auswertung Beuth Verlag GmbH, Berlin 2008 |
| [5] | OSHA Sampling and Analytical Methods o-Toluidine, m-Toluidine, p-Toluidine Method Number 73, August 1988 |
| [6] | OSHA Sampling and Analytical Methods 4-Aminodiphenyl (4-Aminobiphenyl), α-Naphthylamine (1-Naphthylamine), β-Naphthylamine (2-Naphthylamine) Method Number 93, January 1992 |
| [7] | Technische Regel für Gefahrstoffe: Arbeitsplatzgrenzwerte (TRGS 900) Ausg. Januar 2006, BArbBl. Heft 1/2006, S. 41 - 55; zuletzt geändert und ergänzt: GMBl 2017, S. 368 - 370 [ Nr. 20] vom 08.06.2017 |
Eingereicht durch Jürgen Fauss, Berufsgenossenschaft Nahrungsmittel und Gastgewerbe, Mannheim.
Erarbeitet und verabschiedet durch die AG Analytik im Sachgebiet "Gefahrstoffe" des Fachbereichs "Rohstoffe und chemische Industrie" der DGUV.
| Anhang |
Abb. 1 Chromatogramm der Kalibrierlösung 4 (260 µg/l je Komponente)
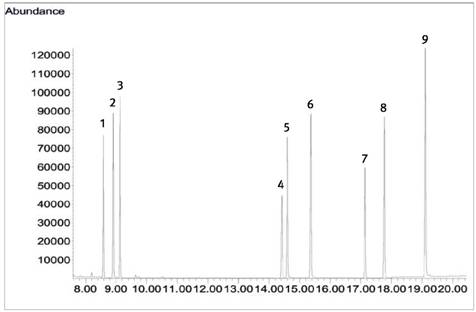
1 o-Toluidin-HFBA-Amid
2 m-Toluidin-HFBA-Amid
3 p-Toluidin-HFBA-Amid
4 2-Aminobiphenyl-HFBA-Amid
5 1-Naphthylamin-HFBA-Amid
6 2-Naphthylamin-HFBA-Amid
7 3-Aminobiphenyl-HFBA-Amid
8 4-Aminobiphenyl-HFBA-Amid
9 1-Aminofluoren-HFBA-Amid (ISTD)
Abb. 2 Derivatisierungsreaktion am Beispiel des 2-Naphthylamins
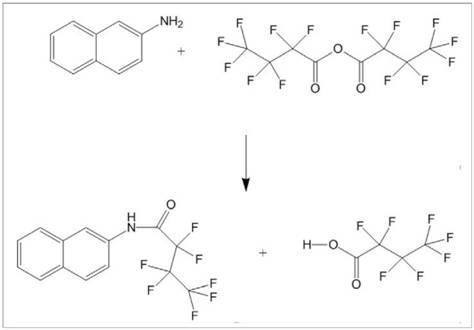
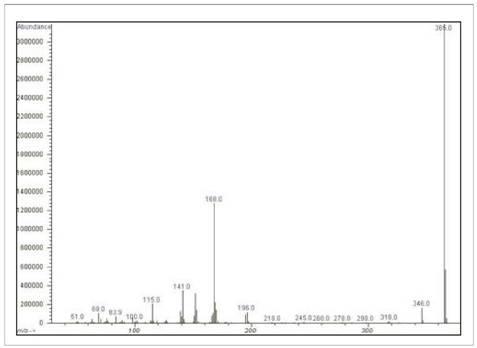
Abb. 3 Massenspektrum des 2-Aminobiphenyl-HFBA-Derivats
 | ENDE |  |
...
X
⍂
↑
↓
