Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. ▢ Regelwerk |  |
Grenzwerte der Organ-Äquivalentdosen für die berufliche Strahlenexposition
- Empfehlung mit wissenschaftlicher Begründung der Strahlenschutzkommission -
Vom 10. Dezember 2020
(BAnz. AT vom 24.11.2021 B3)
Verabschiedet in der 309. Sitzung der Strahlenschutzkommission am 10. Dezember 2020
1 Einleitung
1.1 Beratungsauftrag
Die Umsetzung der EURATOM-Grundnormen für den Strahlenschutz (Euratom 2014) in nationale Regelungen war der äußere Anlass für eine umfassende Modernisierung des deutschen Strahlenschutzrechtes. In diesem Zusammenhang hat das Bundesministerium für Umwelt, Naturschutz, Bau und Reaktorsicherheit (BMUB) am 27. Juni 2014 einen Beratungsauftrag an die Strahlenschutzkommission (SSK) gestellt, in dem ausgeführt wird, dass sowohl in der Strahlenschutzverordnung, Teil 2 "Schutz von Mensch und Umwelt vor radioaktiven Stoffen oder ionisierender Strahlung aus der zielgerichteten Nutzung bei Tätigkeiten" (StrlSchV 2001) (siehe § 55 Absatz 2 Nummer 3 bis 5 und Absatz 3) als auch in der Röntgenverordnung (RöV 2003) (siehe § 31a Absatz 2 Nummer 3 bis 5 und Absatz 3) neben Teilkörpergrenzwerten für die Augenlinse, Haut und Extremitäten 1) entsprechend Artikel 9 Nummer 3a, 3b, 3c der Richtlinie 2013/59/EURATOM (Euratom 2014) zusätzliche Organ-Äquivalentdosisgrenzwerte festgelegt sind, die nicht in der Richtlinie 2013/59/EURATOM verankert sind. Dabei handelt es sich um Grenzwerte der Organ-Äquivalentdosis für Keimdrüsen, Gebärmutter, rotes Knochenmark, Schilddrüse, Knochenoberfläche, Dickdarm, Lunge, Magen, Blase, Brust, Leber, Speiseröhre, Nebenniere, Gehirn, Dünndarm, Niere, Muskel, Bauchspeicheldrüse, Milz und Thymusdrüse.
In der Strahlenschutzverordnung von 2001 (StrlSchV 2001) wird zwischen den Handlungen für die zielgerichtete Nutzung ionisierender Strahlung (Tätigkeiten) und verschiedenen, dort genau benannten Handlungen unterschieden, die, ohne Tätigkeiten zu sein, bei natürlich vorkommender Radioaktivität die Strahlenexposition oder Kontamination erhöhen können, welche aus der Sicht des Strahlenschutzes nicht außer Acht gelassen werden dürfen (Arbeiten). Die genannten Grenzwerte der Organ-Äquivalentdosis galten für Tätigkeiten, nicht aber für Arbeiten.
Die SSK hat sich bereits 1998 im Zusammenhang mit der Einführung der damals verabschiedeten EURATOM-Grundnormen (Euratom 1996) in ihrer Empfehlung "Positionen zu Grundsatzfragen bei der Anpassung der Strahlenschutzverordnung an die neuen EURATOM-Grundnormen" (SSK 1998) wie folgt zu den Grenzwerten der Organ-Äquivalentdosis geäußert:
"Die SSK hat sorgfältig geprüft, daß bei Einhaltung der in der EURATOM-Richtlinie vom 13. Mai 1996 vorgeschlagenen Begrenzung der effektiven Dosis auf 100 mSv in fünf aufeinanderfolgenden Jahren und maximal 50 mSv in einem einzelnen Jahr deterministische Effekte in einzelnen Organen sicher ausgeschlossen werden können, vorausgesetzt, daß die Dosis durch Inkorporation einen Wert von 20 mSv pro Jahr nicht übersteigt. Sie empfiehlt daher, auf eine Begrenzung von Organdosen zu verzichten, die über die in der EURATOM-Richtlinie vom 13. Mai 1996 enthaltenen Teilkörperdosisgrenzwerte [für die Augenlinse, für die Haut, für Hände, Unterarme, Füße und Knöchel] hinausgeht."
Der Auftrag an die SSK lautet zu prüfen, ob diese Empfehlung vor dem Hintergrund der Weiterentwicklung des Standes der Wissenschaft weiterhin Bestand hat. Dabei sind folgende Fragen zu beantworten:
- Ein Ziel der neuen Strahlenschutzgesetzgebung ist es, die Unterscheidung zwischen dem Umgang mit natürlich vorkommenden radioaktiven Stoffen (NORM) und "künstlichen" radioaktiven Stoffen aufzugeben. Ist es nun sinnvoll, ausschließlich die Grenzwerte der Richtlinie 2013/59/EURATOM (Euratom 2014) für Teilkörperexpositionen (Augenlinse, Haut, Extremitäten) zu übernehmen oder ist es sinnvoller, den zusätzlichen Schutz durch weitere Organ-Äquivalentdosen (z.B. für die Schilddrüse oder das Knochenmark) beizubehalten? Bei einer Beibehaltung dieser zusätzlichen Grenzwerte würden diese in Zukunft auch für den bisherigen Bereich der Arbeiten im Sinne der Strahlenschutzverordnung gelten, da in der aktuellen Strahlenschutzgesetzgebung nicht mehr zwischen Tätigkeiten und Arbeiten unterschieden wird.
- Entspricht die oben genannte Empfehlung der SSK aus dem Jahr 1998 dem heutigen Stand der Wissenschaft?
1.2 Abgrenzung des Beratungsauftrags
Die in der Richtlinie 2013/59/EURATOM (Euratom 2014) festgelegten Grenzwerte für die Augenlinse, Haut und Extremitäten sowie Fragen zum Schutz des ungeborenen Lebens (Uterusdosis für Frauen im gebärfähigen Alter) werden in dieser Empfehlung nicht erörtert.
Für eine berufliche Radonexposition wird die Überwachung der Aktivitätskonzentration in der Raumluft von der SSK als die geeignete Strategie zur Erfassung der Exposition erachtet. Es wird keine Personendosis bestimmt. Aus diesem Grund werden in dieser Empfehlung mögliche Organdosen durch Radonexposition nicht betrachtet.
1.3 Zur Entwicklung der Grenzwerte im Strahlenschutz
In der Vergangenheit wurden im Strahlenschutz strahlenbedingte Erkrankungen in deterministische und stochastische Schäden unterteilt. Deterministische Effekte wurden durch eine Dosis-Wirkungsbeziehung mit einem Schwellenwert definiert, unterhalb dessen die Effekte nicht auftreten, während oberhalb des Schwellenwertes die Schwere der Erkrankung mit der Dosis zunimmt. Unter stochastischen Schäden wurden Krebserkrankungen und vererbbare genetische Effekte zusammengefasst. Die Ziele des Strahlenschutzes bestanden darin, schädliche deterministische Effekte zu vermeiden und darüber hinaus die Wahrscheinlichkeit für das Auftreten von stochastischen Effekten auf ein Maß zu beschränken, das als akzeptabel 2) angesehen wird. Durch das Prinzip der Dosislimitierung wird das Risiko auf ein tolerables 3) Maß beschränkt. Durch das Prinzip der Optimierung soll die Reduktion auf ein akzeptables Maß erreicht werden (Rühm et al. 2019). Die wissenschaftlichen Grundlagen für die Begründung von Grenzwerten für die effektive Dosis von beruflich strahlenexponierten Personen werden in einer aktuellen Empfehlung der SSK ausführlich beschrieben und erläutert (SSK 2018).
Mit dem in der ICRP-Publikation 26 veröffentlichten Strahlenschutzkonzept (ICRP 1977) hat die Internationale Strahlenschutzkommission (International Commission on Radiological Protection, ICRP) für beruflich bedingte Expositionen Grenzwerte der effektiven Dosis von 50 mSv pro Kalenderjahr zur Begrenzung stochastischer Schäden und der Äquivalentdosis einzelner Organe von 500 mSv pro Kalenderjahr zur Vermeidung deterministischer Schäden empfohlen. Der Grenzwert der Organ-Äquivalentdosis galt für jedes einzelne Organ mit Ausnahme der Augenlinse, der Haut und der Extremitäten, für die eigene Grenzwerte mit anderen numerischen Werten vorgegeben waren.
Die ICRP hat in ihrer Publikation 60 den Grenzwert für die effektive Dosis beruflich exponierter Erwachsener auf 20 mSv im Kalenderjahr gesenkt (ICRP 1991). Für beruflich exponierte Personen unter 18 Jahren gilt ein Wert von 1 mSv pro Kalenderjahr. Das Konzept für die Dosisbegrenzung durch Grenzwerte der Äquivalentdosis für die einzelnen Organe wurde mit Ausnahme von Augenlinse, Haut und Extremitäten aufgegeben. Die ICRP sah die Grenzwerte für die effektive Dosis bei der Strahlenschutzüberwachung als ausreichend zur Vermeidung deterministischer Effekte in allen anderen Organen und Geweben an und verzichtete deshalb auf die Empfehlung von Grenzwerten für die anderen Organe und Gewebe.
In ihrer Publikation 103 hat die ICRP, auch mit Blick auf die notwendige Beständigkeit internationaler und nationaler Bestimmungen, Empfehlungen herausgegeben, um neue biologische und physikalische Erkenntnisse sowie wissenschaftliche Trends bei der Festlegung von Strahlensicherheitsstandards zu berücksichtigen und die Präsentation der Empfehlungen zu verbessern und zu vereinheitlichen (ICRP 2007). Die ICRP erweiterte darin den Begriff "deterministic effects" (Deterministische Effekte) auf "tissue reactions" (Gewebe-Reaktionen), damit neben den klassischen deterministischen Hochdosis-Effekten auch weitere Strahleneffekte mit unklaren Dosis-Wirkungsbeziehungen erfasst werden können. Diese Empfehlungen sind zugleich eine Weiterentwicklung der bisherigen Vorgehensweise bei Tätigkeiten oder Arbeiten und Interventionen. In der aktuellen deutschen Strahlenschutzgesetzgebung wird jedoch nicht mehr zwischen Tätigkeiten und Arbeiten unterschieden. Mit steigendem Erkenntnisfortschritt mehrte sich die Evidenz, dass auch für strahleninduzierte Erkrankungen außer Krebs und vererbbaren genetischen Erkrankungen Dosis-Wirkungsbeziehungen ohne Schwelle existieren können. ICRP definierte in ihrer Publikation 118 einen praktischen Schwellenwert von Gewebe-Effekten (tissue effects) durch diejenige Dosis, die den Effekt bei 1 % der Exponierten bewirkt (ICRP 2012a).
Die SSK hat in ihrer Stellungnahme "Induktion benigner Tumoren durch ionisierende Strahlung" (SSK 2017) ihre Einschätzung zum Ausdruck gebracht, dass für benigne Tumoren wie auch für Krebs Dosis-Wirkungsbeziehungen ohne Schwelle zu erwarten sind. Dementsprechend könnten auch niedrige Strahlenexpositionen benigne Tumoren verursachen. Sie ließen sich bei Strahlenexposition nicht vermeiden, sondern nur in ihrer Häufigkeit beschränken. Bis zur Klärung des Strahlenschutzes bezüglich benigner Tumoren - z.B. durch Berücksichtigung im Detriment - berücksichtigt die SSK benigne Tumoren nicht in der Diskussion von Organdosisgrenzwerten.
In der vorliegenden Stellungnahme zu Organdosisgrenzwerten werden Erkrankungen berücksichtigt, die weder Krebs noch benigne Tumoren oder vererbbare genetische Erkrankungen sind. Im Folgenden wird für diese Erkrankungen abkürzend der Begriff "nichtneoplastische Erkrankungen" benutzt. Es wird geprüft, ob zur Begrenzung nicht-neoplastischer Erkrankungen weitere Grenzwerte der Äquivalentdosis in einzelnen Organen neben den Grenzwerten der effektiven Dosis und der Äquivalentdosis in Augenlinse, Haut und Extremitäten nötig sind.
1.4 Dosisbegriffe und Ermittlung der Dosis
Strahlenexpositionen werden (mit Ausnahme von Radonexpositionen) durch Dosisgrößen quantifiziert. Die physikalische Basisgröße ist die Energiedosis (engl. absorbed dose). Sie gibt die mittlere Energie dE, die durch ionisierende Strahlung auf das betrachtete Material in einem Volumenelement der Masse dm übertragen wird, an. Ihre Einheit im internationalen Einheitensystem SI ist Joule pro Kilogramm (J kg-1). Als Einheitenname wird im Fall von ionisierender Strahlung Gray (1 Gy = 1 J kg-1) verwendet. Im Strahlenschutz werden die Dosen auf dem Organlevel betrachtet. Die Basisgröße ist also die Energiedosis DT gemittelt über das Organ/Gewebe T. Unterschiedliche Strahlenarten haben unterschiedliche Wechselwirkungsmechanismen und damit unterschiedliche Muster der Energieübertragung. Um dieses in der Bewertung der Exposition und des damit verbundenen Risikos zu berücksichtigen, betrachtet man nicht die mittlere Energiedosis DT im Organ, sondern die Organ-Äquivalentdosis 4) HT (engl. equivalent dose). Diese berechnet sich aus den mittleren Energiedosen pro Strahlenart DT,R und einem dimensionslosen Strahlungswichtungsfaktor wR über: HT = ΣR wR · DT,R× Der Strahlungswichtungsfaktor berücksichtigt die relative biologische Wirksamkeit der betrachteten Strahlung und wird von der ICRP in ihren Grundsatzempfehlungen - aktuell ICRP-Publikation 103 (ICRP 2007) - definiert. Die Einheit der Organ-Äquivalentdosis ist also weiterhin J kg-1. Zur Unterscheidung zwischen Energie- und Äquivalentdosis und um die strahlenbiologische Bewertung in der Organ-Äquivalentdosis zu verdeutlichen wird als Einheitenname Sievert (Sv) verwendet.
Um das Gesamtrisiko, das durch eine Strahlenexposition entsteht, bewerten zu können, werden die Organ-Äquivalentdosiswerte HT der exponierten Organe mit einem dimensionslosen Gewebewichtungsfaktor wT gewichtet addiert: E = ΣTw T · HT× Man erhält so die effektive Dosis E, welche ebenfalls die Einheit J kg-1 hat. Als Einheitenname wird hier ebenfalls Sievert (Sv) verwendet, da auch hier eine doppelte (strahlenbiologische) Gewichtung durchgeführt wird.
Für die praktische Ermittlung der Werte der effektiven Dosis bei Expositionen durch körperexterne Strahlenfelder wurden von der International Commission on Radiation Units and Measurements (ICRU) operationelle Größen (Personendosis, Ortsdosis) eingeführt, die konservative Schätzwerte der von der ICRP definierten Schutzgrößen (siehe oben) darstellen. Messgeräte (Dosimeter) können für die Anzeige der Messwerte in den operationellen Größen kalibriert und geeicht werden. Bei Inkorporationen von Radionukliden können keine direkten Messungen durchgeführt werden. Zudem handelt es sich um chronische Expositionen, die über einen längeren Zeitraum (d. h. solange Zerfälle im Körper stattfinden) Dosisbeiträge akkumulieren. Hier werden Folgedosiswerte (engl. committed doses) betrachtet, die durch Integration über einen Zeitraum τ von 50 Jahren (für Erwachsene) bzw. bis zum Alter von 70 Jahren berechnet werden. Die Werte der effektiven Folgedosis bzw. der Organ-Folgedosen können mit Hilfe von Dosiskoeffizienten und von biokinetischen Modellen aus Messwerten der Aktivitäten (in Bq) in der Raumluft, im Körper oder den Ausscheidungen berechnet werden. Für den Vergleich mit den Grenzwerten werden die Werte der Folgedosis dem Kalenderjahr, in dem die Inkorporation stattgefunden hat, zugeordnet.
Grundsätzlich werden im Strahlenschutz die Dosiswerte für einen idealisierten Referenzmenschen berechnet. Dieser Referenzmensch wird in Publikation 89 (ICRP 2002) von der ICRP beschrieben. Die für den Referenzmenschen ermittelten Dosiswerte werden mit den Grenzwerten verglichen, um das Einhalten der Schutzziele zu überprüfen. Dabei wird davon ausgegangen, dass, wenn die Dosiswerte des Referenzmenschen unterhalb der vorgegebenen Dosisgrenzwerte bleiben, das betrachtete Individuum ausreichend geschützt ist.
Mit den aktuellen Grundsatzempfehlungen der ICRP aus Publikation 103 (ICRP 2007) wurde ein neues Konzept zur Ermittlung der effektiven Dosis E eingeführt. Die Organ-Äquivalentdosiswerte HT werden nun unter Berücksichtigung der Strahlungswichtungsfaktoren wR im männlichen und weiblichen Referenzphantom getrennt ermittelt. Danach werden beide Organ-Äquivalentdosiswerte gemittelt, diese Mittelwerte werden unter Berücksichtigung der Gewebewichtungsfaktoren wT zur effektiven Dosis aufaddiert. Die Geschlechtermittelung für die Referenzdosiswerte wird nun also explizit und nicht wie bislang (z.B. durch die Verwendung hermaphroditer Phantome) implizit durchgeführt. Für die Berechnungen der Referenzdosiswerte werden nun statt des bislang verwendeten geometrischen Körpermodells, die in Publikation 109 (ICRP 2009a) definierten Voxelmodelle für Referenzmann und Referenzfrau verwendet.
Die numerischen Werte der Strahlungs- und Gewebewichtungsfaktoren wR und wT wurden in ICRP-Publikation 103 (ICRP 2007) aktualisiert und an neuere strahlenbiologische Erkenntnisse angepasst. So wurde zum Beispiel der wT-Wert für die Gonaden von 0,2 auf 0,08 gesenkt, der Wert für die Brust von 0,05 auf 0,08 erhöht. Die Organe Gehirn und Speicheldrüsen erhalten eigene Wichtungsfaktoren und werden damit nicht mehr dem Restgewebe zugerechnet. Die Ermittlung des Beitrags des Restgewebes zur effektiven Dosis erfolgt durch Mittelwertbildung über die Organ-Äquivalentdosen der 13 zum Restgewebe zählenden Organe. Dieser Mittelwert wird mit dem Wichtungsfaktor w T des Restgewebes in die effektive Dosis eingerechnet.
Für die Berechnung der Organ-Äquivalentdosen und der effektiven Dosis bei externer Bestrahlung werden in der Praxis Konversionsfaktoren verwendet, die mit Referenzphantomen in Referenzgeometrien berechnet wurden. Für die Dosimetrie nach ICRP-Publikation 60 (ICRP 1991) wurden diese Werte von der ICRP in ihrer Publikation 74 (ICRP 1996) zusammengestellt. ICRP-Publikation 116 (ICRP 2010) enthält diese Konversionsfaktoren für das aktuelle Dosimetriekonzept der Publikation 103 (ICRP 2007). In Publikation 119 (ICRP 2012b) wurden für die Betrachtung interner Expositionen die Daten, die mit den bisherigen biokinetischen und dosimetrischen Modellen (ICRP-Publikation 67 Serie) berechnet wurden, zusammengestellt. Im neuen Dosimetriekonzept nach ICRP-Publikation 103 wird die Biokinetik inkorporierter Radionuklide, sofern Daten und Modelle vorhanden, prinzipiell geschlechtsabhängig betrachtet. Für die Interpretation werden im Standardverfahren der Dosisermittlung jedoch vereinfachend die mit dem männlichen Modell berechneten Referenzfunktionen verwendet. In den aktuellen Publikationen der ICRP zur internen Dosimetrie (OIR-Serie 5): ICRP 2015, ICRP 2016a, ICRP 2017, ICRP 2019) werden die für die explizite Berechnung der 50-Jahre-Folgedosis im Organ benötigten geschlechtsabhängigen Dosiskoeffizienten in einem elektronischen Anhang, dem sog."OIR Data Viewer" (ICRP 2019) zur Verfügung gestellt.
Die Empfehlungen der ICRP aus dem Jahre 2007 (ICRP 2007) wurden von der Europäischen Kommission in der Richtlinie 2013/59/EURATOM (Euratom 2014) und von der Internationalen Atomenergie-Organisation (International Atomic Energy Agency, IAEA) in den IAEA Safety Standards (GSR Part 3) (IAEA 2014) übernommen. Sie bilden damit auch die Grundlage für die nationale Neuregelung des Strahlenschutzes.
2 Vorgehensweise
Die ICRP hat mit (ICRP 2010) aktuelle Dosiskonversionsfaktoren für externe Expositionen und mit (ICRP 2015, ICRP 2016a, ICRP 2017, ICRP 2019) aktuelle Dosiskoeffizienten für interne Expositionen der 31 in der Strahlenschutzdosimetrie berücksichtigten Organe und Gewebe publiziert. Bei externer Exposition wurden die Dosiskonversionsfaktoren für die Strahlungsarten Photonen-, Elektronen-, Positronen-, Myonen-, Pionen-, Protonen-, Neutronen- und Alphastrahlung bei Strahlungsenergien von 10 keV bis 1.000 MeV und für verschiedene Einfallsrichtungen der Strahlung (siehe Abbildung 1.1 und Tabelle 1.1) berechnet. Bei interner Exposition erfolgte die Berechnung der Dosiskoeffizienten für die Inkorporationspfade Ingestion, Inhalation und Injektion für eine Vielzahl von Radionukliden unterschiedlicher chemischer Form sowie bei Inhalation für verschiedene Aerosole, Gase und Dämpfe. Die Berechnungsergebnisse der ICRP sind als Datensätze in digitaler Form getrennt für den männlichen und weiblichen Referenzmenschen verfügbar. Die gemeinsam für die beiden Geschlechter benutzten Eingangsdaten werden im Folgenden als Expositionssituationen oder Expositionsszenarien bezeichnet; zu jeder Expositionssituation gibt es also zwei Datensätze.
Für die Beurteilung der Frage, ob bei Strahlenexpositionen die Überwachung der effektiven Dosis ausreichend ist, um nichtneoplastische Erkrankungen auf ein tolerables Maß zu beschränken, hat die SSK Berechnungen mit den oben beschriebenen Daten der ICRP sowohl für externe als auch interne Expositionen durchgeführt. Für alle betrachteten Expositionsszenarien wurden die Werte der Organ-Äquivalentdosis im männlichen und im weiblichen Referenzmenschen berechnet, die bei einer effektiven Dosis der Referenzperson von 20 mSv erreicht werden.
Dabei wurden, sofern vorhanden, die Daten der aktuellen ICRP-Publikationen (ICRP 2010, ICRP 2015, ICRP 2016a, ICRP 2017, ICRP 2019) verwendet. Da der fünfte Teil der OIR-Serie noch nicht veröffentlicht wurde, sind nicht für alle Radionuklide aktuelle Dosiskoeffizienten zur Berechnung der Dosis nach Inkorporationen vorhanden. Für die wenigen Radionuklide, für die keine aktuellen Daten vorlagen, wurden die bislang in Deutschland verwendeten, auf ICRP-Publikation 60 beruhenden Werte (ICRP 1991) verwendet. Um in diesen Fällen die in ICRP-Publikation 103 (ICRP 2007) eingeführten numerischen Änderungen der Werte der Gewebewichtungsfaktoren dennoch zu berücksichtigen, wurde der Dosiskoeffizient für die effektive Dosis nicht direkt übernommen, sondern aus den Dosiskoeffizienten für die Organe mit den aktualisierten Werten für wT neu berechnet.
Die ICRP geht in der Publikation 118 (ICRP 2012a) davon aus, dass Gewebeeffekte erst oberhalb von Organ-Energiedosen von 500 mGy wichtig werden. Weiterhin geht die ICRP davon aus, dass die Unterschiede verschiedener Strahlungsarten (z.B. von Alpha- und Neutronenstrahlung relativ zu Gammastrahlung) in ihrer auf die Dosis bezogenen Wirkung für Gewebeeffekte geringer sind als für Krebserkrankungen (ICRP 1990, ICRP 2003). Demnach kann man davon ausgehen, dass für Strahlenarten mit einem Strahlenwichtungsfaktor > 1 Gewebeeffekte nach Expositionen mit Organ-Äquivalentdosen unterhalb von 500 mSv erst recht nicht als wichtig erachtet werden.
Für die vorliegende Empfehlung wendet die SSK diesen Dosiswert von 500 mSv an und untersucht die Evidenz für strahlenbedingte nichtneoplastische Erkrankungen in denjenigen Organen, für welche die Organ-Äquivalentdosis in mindestens einem der untersuchten Szenarien größer ist als 500 mSv. Organe, in welchen die Organ-Äquivalentdosen bei Erreichen des Grenzwertes für die effektive Dosis kleiner sind als 360 mSv (im Dosisbereich zwischen 360 mSv und 500 mSv gibt es keine Organe mit entsprechender Organ-Äquivalentdosis), werden in dieser Empfehlung nicht betrachtet, weil die entsprechenden Organ-Äquivalentdosen hinreichend weit unterhalb von 500 mSv liegen.
Die Diskussion der Notwendigkeit eines zusätzlichen Grenzwerts für ein Organ oder Gewebe basiert die SSK auf einem Vergleich der in den Szenarien maximal auftretenden Äquivalentdosis mit den Dosisbereichen, in denen nichtneoplastische Erkrankungen in dem betreffenden Organ oder Gewebe beobachtet wurden. Die entsprechenden Veröffentlichungen beziehen sich in der Regel auf Energiedosen. Liegen unterschiedliche Strahlenqualitäten in den relevanten Szenarien und in den Studien der Strahleneffekte vor, so werden in den Vergleich Informationen zur relativen biologischen Wirksamkeit einbezogen. Liegt der Maximalwert der Organ-Äquivalentdosis erheblich unterhalb der Dosisbereiche, für die Erhöhungen nicht-neoplastischer Erkrankungen beobachtet wurden, so wird für das betreffende Organ oder Gewebe keine Notwendigkeit für einen eigenen Grenzwert gesehen. Ist dies nicht der Fall, so werden sowohl die Höhe des Strahlenrisikos als auch die Schwere des Effektes für eine Empfehlung über einen eigenen Grenzwert der Äquivalentdosis im entsprechenden Organ oder Gewebe berücksichtigt. Nur wenn die Effekte als tolerabel angesehen werden, wird auch für dieses Organ oder Gewebe kein eigener Grenzwert der Organ-Äquivalentdosis als notwendig angesehen.
3 Zusammenfassung der Ergebnisse
Die Ergebnisse der Dosisberechnungen werden im ersten Abschnitt dieses Kapitels in Form von maximalen Äquivalentdosen (in Sv) angegeben. Demgegenüber wird im zweiten Abschnitt über nicht-neoplastische Effekte - wie in der Regel auch in der Literatur zu Strahleneffekten - die Energiedosis (in Gy) verwendet. Die Energiedosen, bei denen Effekte beobachtet wurden, und die maximalen Äquivalentdosen in den Expositionsszenarien werden dann zueinander in Bezug gesetzt.
3.1 Dosisberechnungen
Die Ergebnisse der geschlechtsspezifischen Berechnungen für Expositionen des männlichen und des weiblichen Phantoms sind in Tabelle 1 zusammengefasst. Sie zeigen, dass bei externer Exposition keines der betrachteten Szenarien bei Einhaltung des Grenzwertes der effektiven Dosis in Höhe von 20 mSv zu einer Organ-Äquivalentdosis größer als 500 mSv führt. Für die Expositionsszenarien der internen Exposition kann jedoch nicht ausgeschlossen werden, dass bei Einhaltung des Grenzwertes der effektiven Dosis bei den fünf Organen Knochenoberfläche, Schilddrüse, Lymphknoten, obere Atemwege und Nieren die Organ-Äquivalentdosis größer als 500 mSv ist. In der Tabelle sind für diese Organe bei den drei Expositionspfaden Ingestion, Inhalation und Injektion diejenigen Radionuklide mit den zugehörigen Organdosen angegeben, bei denen für eines der Geschlechter die jeweils maximale Organ-Äquivalentdosis HT,max beobachtet wird. Dabei werden Niedrig-LET- und Hoch-LET-Strahlung emittierende Radionuklide getrennt und jeweils in dieser Reihenfolge aufgeführt. Sollte für eine der beiden Strahlungsarten Niedrig-LET- oder Hoch-LET-Strahlung kein inkorporiertes Radionuklid zu einer relevanten Organdosis führen, so wird dies in der Tabelle durch einen Strich (-) verzeichnet. Die Expositionsbedingung "Injektion" umfasst die direkt in die Blutbahn verbrachten Radionuklide, z.B. über offene Wunden. Der für ein Organ oder Gewebe auftretende Maximalwert der Organ-Äquivalentdosis ist durch Fettdruck hervorgehoben.
Tabelle 1: Organe und Szenarien, in denen die Organ-Äquivalentdosis beim Erreichen des Grenzwertes der effektiven Dosis größer als 0,5 Sv ist;
der für ein Organ oder Gewebe auftretende Maximalwert der Organ-Äquivalentdosis ist durch Fettdruck hervorgehoben.
| Organ | Expositionsszenarien | Radionuklide mit HT,max > 0,5 Sv | H T,max männlich | H T,max weiblich | |
| Externe Exposition (2.610 geschlechtsspezifische Datensätze für 1.305 Szenarien) | |||||
| Alle Organe | Alle Expositionsszenarien | < 0,32 Sv | < 0,29 Sv | ||
| Interne Exposition (51.810 geschlechtsspezifische Datensätze für 25.905 Szenarien) | |||||
| Knochenoberfläche | 3.155 Datensätze 132 Radionuklide | Ingestion: | 93Zr-
150Gd 230Th | 0,76 Sv
0,57 Sv 0,53 Sv | 1,0 Sv
0,75 Sv 0,70 Sv |
| Inhalation: | 93Zr-
230Th | 0,80 Sv
0,54 Sv | 1,1 Sv
0,73 Sv | ||
| Injektion: | 93Zr
230Th | 0,77 Sv
0,53 Sv | 1,0 Sv
0,70 Sv | ||
| Schilddrüse | 598 Datensätze 26 Radionuklide I-, Te-, Sb-Isotope | Ingestion: | 126I
129I | 0,45 Sv
0,45 Sv - | 0,53 Sv
0,53 Sv - |
| Inhalation: | 126I
129I | 0,46 Sv
0,47 Sv - | 0,55 Sv
0,55 Sv - | ||
| Injektion: | 126I
129I | 0,46 Sv
0,44 Sv - | 0,54 Sv
0,53 Sv - | ||
| Lymphknoten | 1.178 Datensätze 66 Radionuklide | Ingestion: | -
- | -
- | -
- |
| Inhalation: | 123Te
241Pu | 1,0 Sv
0,82 Sv | 1,2 Sv
1,0 Sv | ||
| Injektion: | -
- | -
- | -
- | ||
| Nieren | 484 Datensätze 11 Radionuklide Po-, Bi-, Pa-, U-Isotope | Ingestion: | -
230U | -
0,72 Sv | -
0,85 Sv |
| Inhalation: | -
230U | -
0,35 Sv | -
0,42 Sv | ||
| Injektion: | -
230U | -
0,70 Sv | -
0,85 Sv | ||
| Obere Atemwege | 8.874 Datensätze 415 Radionuklide | Ingestion: | -
- | -
- | -
- |
| Inhalation: | 212Pb
234U | 1,6 Sv
1,5 Sv | 1,8 Sv
1,5 Sv | ||
| Injektion: | -
- | -
- | -
- | ||
3.2 Nicht-neoplastische Effekte
3.2.1 Knochen und Knochenoberfläche
In ICRP-Publikation 133 (ICRP 2016b) ist für die Dosimetrie der Knochenoberfläche das betrachtete Zielvolumen neu definiert. Das Zielvolumen ist jetzt eine an der Knochenoberfläche liegende 50 µm-Schicht statt einer 10 µm-Schicht, in welcher sich in der Regel keine proliferierenden Zellen befinden. Demgegenüber enthält die 50 µm-Schicht einige Knochenpräkursor- und Knochenstammzellen; ob aber alle gefährdeten Zellen dieses komplexeren Gewebes miteinbezogen sind, ist nicht bekannt.
Osteoradionekrosen (strahlenbedingtes Absterben des Knochens) wird erst bei einer Dosis weit oberhalb von einigen Gy beobachtet. Inhibitionen des longitudinalen Knochenwachstums treten erst oberhalb von 5 Gy auf und sind reversibel. Reversible metabolische Knochenerkrankungen werden ab Dosen von 1 Gy berichtet, allerdings sind diese durch eine indirekte Einwirkung auf den Knochenmetabolismus verursacht. Da in allen betrachteten Expositionsszenarien für eine effektive Dosis von 20 mSv die Organ-Äquivalentdosis der Knochenoberfläche kleiner als 2 Sv ist, reversible Schäden jedoch erst ab einer Dosis von über 5 Gy und irreversible Schäden ab 10 Gy zu erwarten sind, hält es die SSK für nicht notwendig, für berufliche Strahlenexpositionen einen Grenzwert für die Organ-Äquivalentdosis in der Knochenoberfläche aufrechtzuerhalten.
3.2.2 Schilddrüse
Strahlenexpositionen der Schilddrüse werden mit erhöhtem Auftreten von Hyperthyreose, akuter Thyreoiditis und autoimmuner Thyreoiditis in Verbindung gebracht. Erhöhungen der Inzidenz dieser nicht-neoplastischen Erkrankungen wurden in der Regel nur für Expositionen Erwachsener mit Niedrig-LET-Strahlung und Energiedosen der Schilddrüse beobachtet, die wesentlich höher sind als 550 mGy. Ausgedrückt in Äquivalentdosen liegen die Beobachtungen bei Werten wesentlich höher als 550 mSv, dem Maximalwert in den oben beschriebenen Expositionsszenarien. Es gibt jedoch zwei Ausnahmen.
In einer Studie zur Hypothyreose nach Strahlentherapie im Alter von 0 Jahren bis 20 Jahren wurden auch in den niedrigsten Dosisgruppen Erhöhungen beobachtet. Diese Studie ist mit einem zusätzlichen absoluten Hypothyreose-Risiko in der Größenordnung von 1 % nach Exposition junger Erwachsener mit einer Schilddrüsenäquivalentdosis von 550 mSv konsistent.
In einer Studie von Schilddrüsenerkrankungen unter beruflich strahlenexponierten Frauen wurde eine Erhöhung autoimmuner Thyreoiditis berichtet. Dies ist allerdings ein singuläres Ergebnis, dem zwei Studien beruflich strahlenexponierter Männer und zwei Studien durch Umweltkontaminationen exponierter Personen gegenüberstehen.
Neben den Erkrankungen wurden auch strahlenbedingte Veränderungen von Thyreoperoxid- und Thyreoglobulin-Antikörper-Konzentrationen im Blut beobachtet. Hierzu gibt es bei Energiedosen der Schilddrüsen in der Größenordnung von 1 Gy gemischte Evidenz, unterhalb von 1 Gy allerdings keine Evidenz.
Insgesamt hält es die SSK nicht für erforderlich, die Dosis der Schilddrüse zusätzlich zur effektiven Dosis zu begrenzen.
3.2.3 Lymphknoten
Im Expositionsszenario mit einer Bestrahlung durch 40-MeV-Protonen von hinten (PA) unter Berücksichtigung des Bragg-Peaks ist nicht der Grenzwert für die effektive Dosis, sondern der Grenzwert für die Organ-Äquivalentdosis der Haut der limitierende Faktor für die in einem Lymphknoten maximal mögliche Energiedosis. Die so lokal maximal mögliche Energiedosis beträgt 1,6 Gy.
In den Lymphknoten vorhandene Lymphozyten sind hoch strahlenempfindlich. Bereits bei niedrigen Dosen in der Größenordnung von 500 mGy kann es zu einer deutlichen Reduktion der Lymphozytenzahl in Folge von Apoptose kommen. Im hier relevanten Dosisbereich erfolgt jedoch bei lokaler Bestrahlung einzelner Lymphknoten eine Repopulation durch Lymphozyten aus dem Knochenmark und der Thymus-Drüse.
Ionisierende Strahlung kann Lymphtransport und Filterfunktion der Lymphknoten beeinträchtigen: Als niedrigste Strahlendosis, die mit einem reduzierten Lymphtransport verbunden war, wurden 5 Gy in einer Studie mit Ratten berichtet. Die Evidenz aus Studien an größeren Säugetieren spricht dafür, dass verminderter Lymphtransport und reduzierte Filtrationskapazität der Lymphknoten erst ab Strahlendosen oberhalb von 10 Gy auftreten.
Als weiteres relevantes Krankheitsbild ist das sekundäre Lymphödem bei Patientinnen und Patienten mit Krebserkrankungen und Strahlentherapie beobachtet worden. Die Evidenz aus Tiermodellen spricht dafür, dass strahlenassoziierte Lymphödeme nur bei sehr hohen Strahlendosen weit oberhalb von 10 Gy Einzeitdosis und vor allem in Kombination mit der Entfernung von Lymphknoten auftreten.
Insgesamt ist die unter Einhaltung des Grenzwerts der effektiven Dosis auftretende Dosis in den Lymphknoten weitaus kleiner als Dosiswerte, bei denen Evidenz für strahlenassoziierte, nichtneoplastische, gesundheitlich relevante Effekte in den Lymphknoten vorliegt.
3.2.4 Nieren
Eine chronische Beeinträchtigung der Nierenfunktion ist ab einer gewichteten Energiedosis von 2 Gy bis 6 Gy Gesamtnierenexposition zu beobachten. Bei einer partiellen Bestrahlung erhöht sich der Schadenschwellenwert auf 10 Gy Energiedosis. Die Äquivalentdosis der Nieren bei Einhaltung des Grenzwerts der effektiven Dosis von 20 mSv liegt in den betrachteten Szenarien bei maximal 0,85 Sv und ist damit deutlich kleiner als eine Dosis von 2 Sv, unterhalb derer keine gesundheitlichen Effekte in der Niere beobachtet wurden.
3.2.5 Obere Atemwege
Die Äquivalentdosis der oberen Atemwege bei Einhaltung des Grenzwerts der effektiven Dosis von 20 mSv liegt in den betrachteten Szenarien der Inhalation von Radionukliden bei maximal 1,8 Sv. Durch den Wichtungsfaktor > 1 für die assoziierte Strahlenqualität liegt die zugehörige Energiedosis unter 1,8 Gy.
Die Evidenz zu nicht-neoplastischen Schäden nach Strahlenexposition der oberen Atemwege stammt von Patientinnen und Patienten mit Krebserkrankungen und Strahlentherapie. Als strahlenassoziierte Erkrankungen werden bei diesen Patientinnen und Patienten Mukositis, Dysphagie und Aspiration, eingeschränkte Sprechfähigkeit sowie Ödeme berichtet. Die Anwendbarkeit der ermittelten Dosis-Wirkungsbeziehungen ist unter anderem dadurch eingeschränkt, dass diese meist auf Beobachtungen mit mittleren Energiedosen über 10 Gy beruhen. Lediglich für eingeschränkte Sprechfähigkeit wurden gesundheitlich relevante Effekte unter einer Dosis von 10 Gy tatsächlich beobachtet. Hier betrug die kleinste relevante Energiedosis 3,6 Gy. Insgesamt liegt damit keine Evidenz für strahlenassoziierte, nichtneoplastische, gesundheitlich relevante Effekte in den oberen Atemwegen bei Dosen vor, die unter Einhaltung des Grenzwerts für die effektive Dosis erzielt werden können.
4 Zusammenfassende Empfehlungen
Neben den klassischen Zielen des Strahlenschutzes, deterministische Effekte zu vermeiden und die Wahrscheinlichkeit für das Auftreten von Krebs und vererbbaren genetische Effekten zu beschränken, ist auch das Auftreten anderer nicht-neoplastischer Erkrankungen auf ein tolerables Niveau zu beschränken. Die SSK hat im Jahr 1998 in diesem Zusammenhang empfohlen, auf eine Begrenzung von Organdosen zu verzichten, die über die in der EURATOM-Richtlinie vom 13. Mai 1996 enthaltenen Teilkörperdosisgrenzwerte hinausgeht (SSK 1998). Mittlerweile hat sich der Kenntnisstand zu strahlenbedingten nicht-neoplastischen Erkrankungen wesentlich erweitert.
Die SSK hat in der vorliegenden Studie untersucht, inwieweit nach dem heutigen Stand des Wissens bei Einhaltung der Grenzwerte der effektiven Dosis und der Organ-Äquivalentdosis in Augenlinse, Haut und Extremitäten strahlenbedingte nicht-neoplastische Effekte auftreten können. Sie ist dabei davon ausgegangen, dass nichtneoplastische Erkrankungen erst bei Organdosen oberhalb von 500 mSv wichtig werden. Dieser Wert kann in den untersuchten Expositionsszenarien in den folgenden fünf Organen überschritten werden: Knochenoberfläche, Schilddrüse, Lymphknoten, obere Atemwege und Nieren. Die in der Wissenschaftlichen Begründung beschriebene Literaturstudie ergab jedoch auch für die maximal auftretenden Äquivalentdosen in diesen Organen keine hinreichende Evidenz für nichtneoplastische Erkrankungen oder Strahleneffekte, die eine Begrenzung der Äquivalentdosis in diesen Organen nahelegt.
- Die SSK empfiehlt deshalb, auf eine Begrenzung von Organ-Äquivalentdosen zu verzichten, die über die in der Richtlinie 2013/59/EURATOM (Euratom 2014) enthaltenen Grenzwerte der Organdosis hinausgeht. Sie begrüßt, dass diese Empfehlung bereits im neuen Strahlenschutzgesetz vollzogen wurde.
- Die SSK betont, dass mit ihrer Empfehlung keines der Schutzziele im Strahlenschutz aufgegeben wird, sondern lediglich diejenigen Grenzwerte der Organ-Äquivalentdosis, die nicht notwendig sind, um die Schutzziele zu erreichen.
- Für einige Expositionsszenarien, insbesondere für junge Erwachsene mit Inkorporation radioaktiver Iodisotope, weist eine epidemiologische Studie jedoch auf ein zusätzliches Hypothyreoserisiko von 1 % hin. Auch können strahlenbedingte Veränderungen von Thyreoperoxid- und Thyreoglobulin-Antikörper-Konzentrationen im Blut nicht ausgeschlossen werden. Es wird empfohlen, diese Beobachtungen in die internationale Diskussion der Grenzwerte von Organ-Äquivalentdosen einzubringen und die weitere Entwicklung von Untersuchungen strahlenbedingter Veränderungen der Schilddrüse bei Äquivalentdosen unterhalb von 1 Sv zu verfolgen.
5 Literatur
| Euratom 1996 | Rat der Europäischen Union. Richtlinie 96/29/Euratom des Rates vom 13. Mai 1996 zur Festlegung der grundlegenden Sicherheitsnormen für den Schutz der Gesundheit der Arbeitskräfte und der Bevölkerung gegen die Gefahren durch ionisierende Strahlungen. Amtsblatt der Europäischen Gemeinschaften L159/1, 29. Juni 1996 |
| Euratom 2014 | Rat der Europäischen Union. Richtlinie 2013/59/EURATOM des Rates vom 5. Dezember 2013 zur Festlegung grundlegender Sicherheitsnormen für den Schutz vor den Gefahren einer Exposition gegenüber ionisierender Strahlung und zur Aufhebung der Richtlinien 89/618/Euratom, 90/641/Euratom, 96/29/Euratom, 97/43/Euratom und 2003/122/EURATOM . Amtsblatt der Europäischen Union, L 13/1, 17. Januar 2014 |
| IAEA 2014 | International Atomic Energy Agency (IAEA). Radiation Protection and Safety of Radiation Sources: International Basic Safety Standards. General Safety Requirements (GSR) Part 3. Wien, 2014, ISBN 9789201353108 |
| ICRP 1977 | International Commission on Radiological Protection (ICRP). Recommendations of the ICRP. ICRP Publication 26. Ann ICRP 1 (3), Pergamon Press, 1977 |
| ICRP 1990 | International Commission on Radiological Protection (ICRP). RBE for Deterministic Effects. ICRP Publication 58. Ann ICRP 20 (4), Pergamon Press, 1990, ISBN 008041732 |
| ICRP 1991 | International Commission on Radiological Protection (ICRP). Recommendations of the ICRP. ICRP Publication 60. Ann ICRP 21(1-3), SAGE Publications Ltd, 1991, ISBN 0080411444 |
| ICRP 1996 | International Commission on Radiological Protection (ICRP). Conversion Coefficients for use in Radiological Protection against External Radiation. ICRP Publication 74. Ann ICRP 26 (3-4), SAGE Publications Ltd, 1996, ISBN 9780080427393 |
| ICRP 2002 | International Commission on Radiological Protection (ICRP). Basic Anatomical and Physiological Data for Use in Radiological Protection Reference Values. ICRP Publication 89. Ann ICRP 32 (3-4), SAGE Publications Ltd, 2002, ISBN 9780080442662 |
| ICRP 2003 | International Commission on Radiological Protection (ICRP). Relative Biological Effectiveness (RBE), Quality Factor (Q), and Radiation Weighting Factor (w R). ICRP Publication 92. Ann ICRP, 33(4), 2003 |
| ICRP 2007 | International Commission on Radiological Protection (ICRP). Recommendations of the ICRP. ICRP Publication 103. Ann ICRP 37(2-4):1-332, SAGE Publications Ltd, 2007, ISBN 9780702030482, doi: 10.1016/j.icrp.2007.10.003 |
| ICRP 2009a | International Commission on Radiological Protection (ICRP). Application of the Commission's Recommendations for the Protection of People in Emergency Exposure Situations. ICRP Publication 109. Ann ICRP 39(1):1-110, Elsevier, Oxford, 2009, ISBN 9780702040986, doi: 10.1016/j.icrp.2009.05.004 |
| ICRP 2010 | International Commission on Radiological Protection (ICRP). (Authors on behalf of ICRP: Petoussi-Henss N, Bolch WE, Eckerman KF Endo A, Hertel N, Hunt J, Pelliccioni M, Schlattl H, Zankl M). Conversion Coefficients for Radiological Protection Quantities for External Radiation Exposures. ICRP Publication 116, Ann ICRP 40 (2-5):1-257, Elsevier, Oxford, 2010, ISBN 9781455728589, doi: 10.1016/j.icrp.2011.10.001 |
| ICRP 2012a | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Stewart FA, Akleyev AV, Hauer-Jensen M, Hendry JH, Kleiman NJ, Macvittie TJ, Aleman BM, Edgar AB, Mabuchi K, Muirhead CR, Shore RE, Wallace WH). Statement on Tissue Reactions/Early and Late Effects of Radiation in Normal Tissues and Organs - Threshold Doses for Tissue Reactions in a Radiation Protection Context. ICRP Publication 118, Ann ICRP. 2012 Feb;41(1-2):1-322, Elsevier, Oxford, ISBN 9780702052279, doi:10.1016/j.icrp.2012.02.001 |
| ICRP 2012b | International Commission on Radiological Protection (ICRP). (Authors on behalf of ICRP: Eckerman K, Harrison J, Menzel H-G, Clement CH). Compendium of Dose Coefficients based on ICRP Publication 60. ICRP Publication 119. Ann. ICRP 41(Suppl.), Elsevier, Oxford, 2012, ISBN 9781455754304, doi: 10.1016/j.icrp.2012.06.038 |
| ICRP 2015 | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Paquet F, Etherington G, Bailey MR, Leggett RW, Lipsztein J, Bolch W, Eckerman KF, Harrison JD). Occupational Intakes of Radionuclides: Part 1. ICRP Publication 130. Ann. ICRP. 2015 Sep;44(2):5-188, Sage Publishing, London, ISBN 9781473944404, doi:10.1177/0146645315577539 |
| ICRP 2016a | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Paquet F, Bailey MR, Leggett RW, Lipsztein J, Fell TP, Smith T, Nosske D, Eckerman KF, Berkovski V, Ansoborlo E, Giussani A, Bolch WE, Harrison JD). Occupational Intakes of Radionuclides: Part 2. ICRP Publication 134. Ann ICRP. 2016 Dec;45(3-4):7-349. Sage Publishing, London, ISBN 9781526408310, doi: 10.1177/0146645316670045 |
| ICRP 2016b | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Bolch WE, Jokisch D, Zankl M, Eckerman KF, Fell T, Manger R, Endo A, Hunt J, Kim KP, Petoussi-Henss N) The ICRP computational framework for internal dose assessment for reference adults: specific absorbed fractions. ICRP Publication 133. Ann. ICRP. 2016 Nov;45(2):5-73. Sage Publishing, London, ISBN 9781526404152, doi:10.1177/0146645316661077 |
| ICRP 2017 | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Paquet F, Bailey MR, Leggett RW, Lipsztein J, Marsh J, Fell TP, Smith T, Nosske D, Eckerman KF, Berkovski V, Blanchardon E, Gregoratto D, Harrison JD). Occupational Intakes of Radionuclides: Part 3. ICRP Publication 137. Ann ICRP. 2017 Dec;46(3-4):1-486. Sage Publishing, London, ISBN 9781526440167, doi: 10.1177/0146645317734963 |
| ICRP 2019 | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Paquet F, Bailey MR, Leggett RW, Etherington G, Blanchardon E, Smith T, Ratia G, Melo D, Fell TP, Berkovski V, Harrison JD). Occupational Intakes of Radionuclides: Part 4. ICRP Publication 141. Ann ICRP. 2019 Dec;48(2-3):9-501. Sage Publishing, London, ISBN 9781529700749, doi: 10.1177/0146645319834139 |
| RÖV 2003 | Verordnung über den Schutz vor Schäden durch Röntgenstrahlen (Röntgenverordnung - RöV) in der Fassung der Bekanntmachung vom 30. April 2003 (BGBl. I S. 604), die zuletzt durch Artikel 6 der Verordnung vom 11. Dezember 2014 (BGBl. I S. 2010) geändert worden ist |
| Rühm et al. 2019 | Rühm W, Breckow J, Dietze G, Friedl A, Greinert R, Jacob P, Kistinger S, Michel R, Müller W-U, Otten H, Streffer C, Weiss W. Dose limits for occupational exposure to ionising radiation and genotoxic carcinogens: a German perspective. Radiat Environ Biophys. 2020 Mar;59(1):9-27. doi: 10.1007/s00411-019-00817-x. Epub 2019 Nov 1 |
| SSK 1998 | Strahlenschutzkommission (SSK). Positionen zu Grundsatzfragen bei der Anpassung der Strahlenschutzverordnung an die neuen EURATOM-Grundnormen. Empfehlung der Strahlenschutzkommission, verabschiedet in der 158. Sitzung der SSK am 17./18. Dezember 1998, Veröffentlichungen der Strahlenschutzkommission, Band 44, Empfehlungen und Stellungnahmen der Strahlenschutzkommission 1998, Urban & Fischer, München, 1999, ISBN 3437214497 |
| SSK 2017 | Strahlenschutzkommission (SSK). Induktion benigner Tumoren durch ionisierende Strahlung. Stellungnahme der Strahlenschutzkommission, verabschiedet in der 290. Sitzung der Strahlenschutzkommission am 4./5. Dezember 2017. Bekanntmachung im Bundesanzeiger (BAnz AT 17.04.2018 B4); urn:nbn:de:101:1-201804238518 |
| SSK 2018 | Strahlenschutzkommission (SSK). Grundlagen zur Begründung von Grenzwerten für beruflich strahlenexponierte Personen.
Empfehlung der Strahlenschutzkommission mit wissenschaftlicher Begründung, verabschiedet im Umlaufverfahren am 7. September 2018. Bekanntmachung im Bundesanzeiger (BAnz AT 14.11.2019 B5) |
| StrlSchG 2017 | Gesetz zum Schutz vor der schädlichen Wirkung ionisierender Strahlung (Strahlenschutzgesetz - StrlSchG) vom 27. Juni 2017 (BGBl. I S. 1966), das zuletzt durch Artikel 11 des Gesetzes vom 12. Dezember 2019 (BGBl. I S. 2510) geändert worden ist |
| StrlSchV 2001 | Verordnung über den Schutz vor Schäden durch ionisierende Strahlen (Strahlenschutzverordnung - StrlSchV) vom 20. Juli 2001 (BGBl. I S. 1714; 2002 I S. 1459), die zuletzt durch nach Maßgabe des Artikel 10 durch Artikel 6 des Gesetzes vom 27. Januar 2017 (BGBl. I S. 114, 1222) geändert worden ist |
In dieser Empfehlung wird die Evidenz für strahlenbedingte nichtneoplastische Erkrankungen in denjenigen Organen untersucht, für welche die Organ-Äquivalentdosis in mindestens einem der untersuchten Szenarien größer ist als 500 mSv. Dabei können Effekte am ungeborenen Leben außer Betracht bleiben, da es einen separaten Grenzwert für die Uterusdosis von Schwangeren gibt.
1 Organ-Äquivalentdosen von Erwachsenen mit effektiven Dosen von 20 mSv
1.1 Externe Exposition am Arbeitsplatz: Abschätzung gemäß ICRP
Für die Beurteilung der Frage, ob bei einer externen Strahlenexposition die Überwachung der effektiven Dosis ausreichend ist, um Überschreitungen der Schwellendosis für deterministische Schäden in einzelnen Organen sicher zu erkennen, hat die SSK die publizierten Daten der Publikation 116 der Internationalen Strahlenschutzkommission (International Commission on Radiological Protection, ICRP) (ICRP 2010) herangezogen. Mit dieser Publikation sind berechnete Werte für die auf die Fluenz bezogene Energiedosis in den relevanten Organen für verschiedene Strahlungsarten und Bestrahlungsgeometrien als Funktion der Strahlungsenergie tabellarisch und geschlechtsspezifisch verfügbar. Die ebenfalls berechneten Werte der auf die Fluenz bezogenen effektiven Dosis E sind in diesem Bericht für dieselben Strahlungsarten und Bestrahlungsgeometrien angegeben.
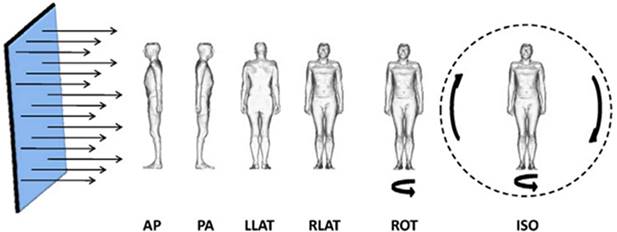
Die in dieser Publikation der ICRP (ICRP 2010) angeführten Rechnungen wurden mit Hilfe der Monte-Carlo-Methode für die ICRP/ICRU-Phantome durchgeführt, welche die erwachsenen männlichen und weiblichen Referenzpersonen (ICRP 2002) repräsentieren. Dabei wurden die in Abbildung 1.1 dargestellten und in Tabelle 1.1 beschriebenen idealisierten Ganzkörper-Expositionsgeometrien mit breiten parallelen Strahlungsfeldern, die aus verschiedenen Richtungen auf ein Phantom treffen, verwendet.
Abbildung 1.1: Schematische Darstellung der betrachteten Ganzkörper-Bestrahlungsgeometrien (aus ICRP 2010);
zur Bedeutung der Symbole siehe Tabelle 1.1
Tabelle 1.1: Beschreibung der betrachteten Ganzkörper-Bestrahlungsgeometrien
| Symbol | Bedeutung | Beschreibung |
| AP | antero-posterior | Strahlungseinfall von vorn |
| PA | postero-anterior | Strahlungseinfall von hinten |
| LLAT | links-lateral | Strahlungseinfall von links |
| RLAT | rechts-lateral | Strahlungseinfall von rechts |
| ROT | rotationssymmetrisch | Strahlungseinfall aus allen Richtungen senkrecht zur Längsachse des Körpers |
| ISO | isotrop | Strahlungseinfall aus allen Richtungen |
| DIV | divergent | divergentes Photonen-Strahlenbündel |
In den Rechnungen wurden weder die Streuung noch die Absorption der Strahlung durch die umgebende Luft berücksichtigt. Die Abschätzungen für die effektiven Dosen ergeben sich unter Berücksichtigung der entsprechenden Energiedosen, der Strahlungswichtungsfaktoren wR und der Gewebewichtungsfaktoren wT gemäß ICRP-Publikation 103 (ICRP 2007). Die dafür in der Richtlinie 2013/59/EURATOM (Euratom 2014) festgelegten Werte stimmen damit überein.
Alle für die vorliegende Empfehlung der SSK mit den Daten aus ICRP-Publikation 116 (ICRP 2010) berechneten Werte der Organdosis wurden getrennt für die beiden Geschlechter berechnet. Sie repräsentieren Schätzwerte für beide Geschlechter und alle Altersgruppen. Dabei ist zu betonen, dass alle diese Abschätzungen naturgemäß mit deutlichen Unsicherheiten einhergehen.
Die Daten aus ICRP-Publikation 116 (ICRP 2010) beziehen sich auf einen parallelen oder isotropen Einfall der Strahlung. Für stark divergente Photonen-Strahlungsfelder von Punktquellen, besonders für Abstände zwischen Quelle und Haut unter ca. 2,5 m, können die für Parallelfelder berechneten Verhältnisse HT/E in Abhängigkeit vom Abstand einer Punktquelle von der Haut mit Korrektionsfaktoren kk korrigiert werden. Diese werden von Zankl (Zankl 1997) für divergente Photonenfelder organspezifisch für Quelle-Haut-Abstände von 0,5 m, 1,5 m und 2,5 m sowie Quelle-Boden-Abstände von 0 m, 1 m und 1,5 m angegeben. Dabei wird vorausgesetzt, dass sich die Ortsdosis auf einen Punkt in der Luft bezieht, der sich 1 m über der Standfläche in der Vertikalachse des aufrechtstehenden anthropomorphen Phantoms befindet. Die Korrektionsfaktoren kk sind in der Regel energieabhängig. Für die vorliegenden Abschätzungen werden jedoch nur die Höchstwerte für alle Photonenenergien benutzt. Die jeweiligen Maximalwerte kk,max für diese Korrektionsfaktoren sind - soweit vorhanden - in Tabellen 1.2 und 1.3 angegeben. Sie werden bei der Beurteilung der ausschließlichen Eignung der effektiven Dosis für die Überwachung beruflich strahlenexponierter Personen berücksichtigt. In jedem Punkt der Rechnungen werden konservative, die Organ-Äquivalentdosen keinesfalls unterschätzende Szenarien zugrunde gelegt. In den Tabellen 1.2 und 1.3 sind die maximalen Organ-Äquivalentdosen für jedes betrachtete Organ und getrennt für die beiden Geschlechter angegeben, die für alle in ICRP 116 (ICRP 2010) vorgegebenen 1.305 Expositionsszenarien und Strahlungsenergien (mit 2.610 geschlechterspezifischen Datensätzen) bei Erreichen des Grenzwertes der effektiven Dosis von 20 mSv berechnet worden sind. Die Organ-Äquivalentdosiswerte größer als 500 mSv sind in den Tabellen farbig hinterlegt. Für die betreffenden Organe sind eigene Organdosis-Grenzwerte eingeführt worden.
Es zeigt sich, dass bei externer Exposition keines der betrachteten Szenarien (ohne Augenlinse, Haut und Extremitäten) bei Einhaltung des Grenzwertes der effektiven Dosis in Höhe von 20 mSv zu einer Organ-Äquivalentdosis größer als 500 mSv führt.
Bei der Berechnung der Organdosis wird die im Organ deponierte Energie durch die Masse des gesamten Organs geteilt. Bei inhomogenen Energiedepositionen, z.B. nach externer Exposition durch Strahlungen mit geringer Eindringtiefe, können so im Gewebe lokal sehr hohe Dosen auftreten, die dann durch die Mittelung über die gesamte Organmasse zu sehr geringen Organdosen führen. Dies betrifft z.B. das Muskelgewebe und die Lymphknoten bei Exposition mit Protonen oder Alpha-Teilchen. Diese Szenarien haben zum gegenwärtigen Zeitpunkt keine Relevanz bei der Überwachung beruflich strahlenexponierter Personen. Im Rahmen derzeit nicht absehbarer Technologieentwicklungen 6) und damit verbundener neuartiger Tätigkeiten, die zu Expositionen ionisierender Strahlung führen können, sind solche Szenarien in Zukunft möglicherweise zu berücksichtigen.
Daher betrachtet die SSK nachfolgend beispielhaft für das Muskelgewebe und die Lymphknoten zwei Expositionsszenarien mit Protonenbestrahlung, in denen die Organ-Äquivalentdosis im gesamten Organ unterhalb von 500 mSv bleibt, in denen jedoch auf Grund der Verteilung der Energiedeposition lokale Dosisüberhöhungen auftreten können. Die Tabellen 1.2 und 1.3 zeigen, dass für diese Szenarien die jeweiligen Organdosen im Muskel bzw. in den Lymphknoten bei Erreichen des Grenzwertes für die effektive Dosis zwar kleiner sind als 500 mSv, es aber nicht ohne weiteres ersichtlich ist, ob durch lokale Dosisüberhöhungen nicht doch nicht-neoplastische Effekte auftreten können.
Muskelgewebe
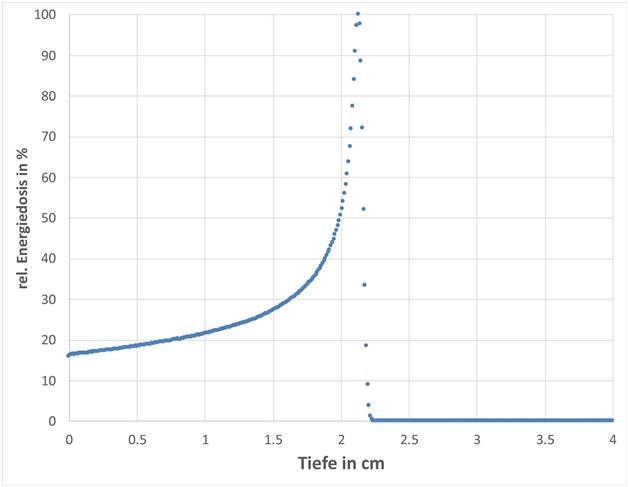
Die bei Erreichen einer effektiven Dosis von 20 mSv im Organ Muskel maximal auftretende Dosis von 320 mSv erhält man bei einer Bestrahlung des männlichen Referenzphantoms mit Protonen einer Energie von 50 MeV in der PA-Geometrie. Aufgrund der extrem inhomogenen Dosisverteilung bei einer solchen Exposition können lokal deutlich höhere Werte im Muskelgewebe auftreten. Die SSK hat Monte-Carlo-Simulationen des Strahlentransports für eine Protonenbestrahlung von Muskelgewebe mit einer Eintrittsenergie von 50 MeV durchgeführt. In Abbildung 1.2 ist ersichtlich, dass die Energiedosis im Muskelgewebe bis zu einer Tiefe von ca. 2,3 cm zunimmt und danach schnell auf null abfällt.
Abbildung 1.2: Relative Tiefendosis auf Zentralstrahl bei gaußförmigem Protonenstrahl-Profil mit 1 cm Halbwertsbreite mit 50 MeV Energie in Muskelgewebe
Die Energiedosis in einer Tiefe von 0,07 mm kann als eine gute Näherung für die Energiedosis der Haut angesehen werden. Sie beträgt im betrachteten Szenario ca. 17 % der Dosis, die im schmalen Bereich des Bragg-Peaks auftritt. Die maximal zulässige Äquivalentdosis für die Haut, gemittelt über eine Hautfläche von einem Quadratzentimeter, beträgt pro Jahr 500 mSv. Für Protonenbestrahlung (wR = 2) entspricht dies einer Energiedosis von 0,25 Gy. Für eine Energiedosis der Haut von 0,25 Gy beträgt die Energiedosis im relativ schmalen Bereich des Bragg-Peaks in 2,3 cm Tiefe des Muskelgewebes dann ca. 0,25 Gy / 0,17 = 1,5 Gy.
Bei Einhaltung des im Strahlenschutzgesetz festgelegten Grenzwertes für die Äquivalentdosis der Haut können im Muskelgewebe lokal maximale Dosiswerte im Bereich von 1,5 Gy auftreten, die aber deutlich unter dem in ICRP 118 (ICRP 2012a) angegebenen Schwellenwert in Höhe von 25 Gy liegen, so dass eine weitere Betrachtung dieses Spezialfalles, der außerhalb des Beratungsauftrags liegt, für nicht notwendig erachtet wird.
Lymphknoten
Im Organ Lymphknoten sind bei Bestrahlungen des weiblichen Referenzphantoms mit Protonen in PA-Geometrie mit 288 mSv relativ hohe Äquivalentdosiswerte im gesamten Organ zu beobachten. Um das Verhältnis der lokal maximal auftretenden Energiedosis in Lymphknoten zur Energiedosis in der Haut abzuschätzen, hat die SSK Monte-Carlo-Simulationen des Strahlentransports für eine Protonenbestrahlung von hinter Fett- und Muskelgewebe liegenden Lymphknoten mit einer Eintrittsenergie von 40 MeV durchgeführt. Die Energiedosis im Gewebe nimmt dabei bis zu einer Tiefe von ca. 1,6 cm zu und fällt danach schnell auf null ab. Die Energiedosis in einer Tiefe von 0,07 mm wird wie in den obigen Betrachtungen zum Muskelgewebe wieder als eine Näherung für die Energiedosis der Haut angesehen. Sie beträgt im ungünstigsten Fall ca. 16 % der Dosis, die im schmalen Bereich des Bragg-Peaks auftritt. Für eine Energiedosis der Haut von 0,25 Gy beträgt die Energiedosis im relativ schmalen Bereich des Bragg-Peaks in 1,6 cm Tiefe dann ca. 0,26 Gy / 0,16 = 1,6 Gy.
Bei Einhaltung des im Strahlenschutzgesetz festgelegten Grenzwertes für die Äquivalentdosis der Haut können in Lymphknoten lokal maximale Dosiswerte im Bereich von 1,6 Gy auftreten. Diese Dosis ist weitaus kleiner als Dosiswerte, bei denen Evidenz für strahlenassoziierte nichtneoplastische gesundheitlich relevante Effekte in den Lymphknoten vorliegt, siehe Abschnitt 2.3.7 der wissenschaftlichen Begründung.
Tabelle 1.2: Maximalwerte der für das männliche Phantom berechneten Organ-Äquivalentdosis bei externer Exposition;
Organ-Äquivalentdosiswerte größer als 500 mSv sind kursiv hinterlegt.
Für die Organe Augenlinse, Haut und Extremitäten gibt es eigene Grenzwerte für die Organ-Äquivalentdosis.
Diese Organe werden im Folgenden nicht mehr betrachtet.
Externe Exposition - Männlich
| HT,max = Egr * hT / ein mSv | ||||||||||||
| Organ | kk,max | Photonen PAR | Photonen DIV | Elektronen | Positronen | Neutronen | Alpha | Protonen | Mu- | Mu+ | Pi- | Pi+ |
| Augenlinse | 2,7 | 216 | 583 | 335 | 265 | 66 | 354 | 357 | 133 | 130 | 247 | 141 |
| Haut | 1,5 | 1964 | 2946 | 2000 | 1053 | 55 | 2000 | 2000 | 404 | 364 | 847 | 561 |
| Extremitäten | 200 | 267 | 174 | 40 | 320 | 320 | 86 | 82 | 119 | 95 | ||
| Blasenwand | 1,5 | 25 | 38 | 23 | 23 | 26 | 24 | 25 | 29 | 29 | 26 | 26 |
| Brust | 1,9 | 117 | 222 | 141 | 129 | 55 | 144 | 144 | 90 | 89 | 118 | 98 |
| Dickdarm | 1,4 | 28 | 39 | 21 | 21 | 28 | 24 | 42 | 24 | 24 | 28 | 25 |
| Gehirn | 1,9 | 35 | 67 | 58 | 48 | 46 | 63 | 59 | 37 | 36 | 46 | 40 |
| Keimdrüsen | 1,9 | 42 | 80 | 41 | 40 | 33 | 43 | 44 | 39 | 39 | 42 | 40 |
| Knochenmark (rot) | 1,5 | 42 | 63 | 60 | 52 | 32 | 64 | 64 | 43 | 43 | 52 | 48 |
| Knochenoberfläche | 1,5 | 53 | 79 | 108 | 82 | 31 | 118 | 131 | 50 | 49 | 65 | 57 |
| Leber | 1,5 | 38 | 57 | 23 | 23 | 42 | 23 | 41 | 23 | 23 | 24 | 22 |
| Lunge | 1,6 | 25 | 40 | 43 | 41 | 29 | 50 | 50 | 40 | 40 | 43 | 39 |
| Magenwand | 1,5 | 34 | 50 | 23 | 23 | 34 | 24 | 43 | 25 | 25 | 28 | 26 |
| Schilddrüse | 2,3 | 45 | 104 | 68 | 64 | 32 | 66 | 88 | 60 | 60 | 63 | 48 |
| Speicheldrüsen | 1,8 | 176 | 318 | 212 | 153 | 61 | 265 | 284 | 72 | 69 | 107 | 86 |
| Speiseröhre | 1,9 | 26 | 50 | 28 | 28 | 27 | 24 | 24 | 44 | 43 | 40 | 32 |
| Restliche Gewebe | 32 | 31 | 29 | 24 | 33 | 36 | 26 | 26 | 28 | 28 | ||
| Nebennieren | 55 | 90 | 89 | 44 | 82 | 94 | 64 | 63 | 101 | 89 | ||
| Obere Atemwege | 69 | 39 | 37 | 59 | 40 | 99 | 33 | 33 | 36 | 34 | ||
| Gallenblasenwand | 40 | 23 | 23 | 46 | 24 | 42 | 29 | 29 | 39 | 34 | ||
| Herzwand | 24 | 22 | 22 | 24 | 22 | 32 | 25 | 25 | 24 | 24 | ||
| Nieren | 60 | 74 | 70 | 40 | 84 | 85 | 65 | 63 | 82 | 72 | ||
| Lymphknoten | 110 | 194 | 103 | 26 | 222 | 228 | 47 | 45 | 78 | 60 | ||
| Muskelgewebe | 200 | 267 | 174 | 40 | 320 | 320 | 86 | 82 | 119 | 95 | ||
| Mundschleimhaut | 35 | 29 | 28 | 50 | 34 | 81 | 33 | 33 | 33 | 31 | ||
| Bauchspeicheldrüse | 29 | 23 | 22 | 26 | 29 | 43 | 34 | 34 | 33 | 31 | ||
| Prostata (Männer) | 29 | 32 | 32 | 27 | 26 | 27 | 52 | 51 | 61 | 47 | ||
| Dünndarmwand | 24 | 22 | 22 | 24 | 24 | 25 | 26 | 26 | 26 | 25 | ||
| Milz | 63 | 97 | 90 | 44 | 104 | 109 | 72 | 70 | 83 | 75 | ||
| Thymusdrüse | 30 | 54 | 52 | 31 | 49 | 62 | 41 | 41 | 53 | 52 | ||
| Gebärmutter/Gebärmutterhals (Frauen) | 1,4 | |||||||||||
Tabelle 1.3: Maximalwerte der für das weibliche Phantom berechneten Organ-Äquivalentdosis bei externer Exposition;
Organ-Äquivalentdosiswerte größer als 500 mSv sind kursiv hinterlegt.
Für die Organe Augenlinse, Haut und Extremitäten gibt es eigene Grenzwerte für die Organ-Äquivalentdosis.
Diese Organe werden im Folgenden nicht mehr betrachtet.
Externe Exposition - Weiblich
| HT,max = Egr * hT / e in mSv | ||||||||||||
| Organ | kk,max | Photonen PAR | Photonen DIV | Elektronen | Positronen | Neutronen | Alpha | Protonen | Mu- | Mu+ | Pi- | Pi+ |
| Augenlinse | 2,7 | 279 | 753 | 527 | 379 | 74 | 555 | 560 | 161 | 156 | 351 | 180 |
| Haut | 1,5 | 1989 | 2984 | 2000 | 1007 | 50 | 2000 | 2000 | 332 | 304 | 843 | 502 |
| Extremitäten | 116 | 190 | 121 | 32 | 245 | 245 | 62 | 59 | 85 | 64 | ||
| Blasenwand | 1,5 | 39 | 59 | 42 | 40 | 29 | 38 | 50 | 40 | 39 | 42 | 36 |
| Brust | 1,9 | 108 | 205 | 148 | 128 | 46 | 155 | 155 | 81 | 79 | 114 | 89 |
| Dickdarm | 1,4 | 24 | 34 | 27 | 27 | 25 | 30 | 32 | 30 | 30 | 34 | 29 |
| Gehirn | 1,9 | 34 | 65 | 62 | 38 | 48 | 43 | 66 | 33 | 32 | 35 | 33 |
| Keimdrüsen | 1,9 | 32 | 60 | 28 | 27 | 27 | 27 | 29 | 39 | 39 | 57 | 49 |
| Knochenmark (rot) | 1,5 | 37 | 56 | 69 | 46 | 28 | 58 | 63 | 35 | 34 | 37 | 35 |
| Knochenoberfläche | 1,5 | 43 | 65 | 111 | 72 | 30 | 143 | 143 | 44 | 42 | 55 | 44 |
| Leber | 1,5 | 39 | 58 | 26 | 21 | 39 | 22 | 44 | 23 | 23 | 23 | 23 |
| Lunge | 1,6 | 37 | 58 | 46 | 63 | 33 | 78 | 80 | 53 | 52 | 61 | 52 |
| Magenwand | 1,5 | 45 | 67 | 24 | 23 | 40 | 26 | 52 | 27 | 26 | 26 | 25 |
| Schilddrüse | 2,3 | 61 | 139 | 83 | 79 | 35 | 95 | 95 | 68 | 67 | 89 | 71 |
| Speicheldrüsen | 1,8 | 130 | 235 | 93 | 59 | 66 | 78 | 172 | 41 | 40 | 48 | 44 |
| Speiseröhre | 1,9 | 24 | 47 | 29 | 25 | 27 | 24 | 24 | 31 | 30 | 44 | 38 |
| Restliche Gewebe | 26 | 27 | 24 | 23 | 31 | 34 | 23 | 22 | 25 | 23 | ||
| Nebennieren | 59 | 45 | 38 | 32 | 50 | 52 | 44 | 43 | 53 | 42 | ||
| Obere Atemwege | 56 | 29 | 29 | 57 | 33 | 110 | 30 | 30 | 32 | 30 | ||
| Gallenblasenwand | 28 | 22 | 22 | 32 | 26 | 36 | 28 | 28 | 34 | 29 | ||
| Herzwand | 24 | 50 | 23 | 24 | 24 | 34 | 25 | 25 | 28 | 25 | ||
| Nieren | 40 | 52 | 43 | 32 | 62 | 62 | 48 | 48 | 56 | 49 | ||
| Lymphknoten | 80 | 178 | 94 | 24 | 150 | 288 | 47 | 45 | 76 | 51 | ||
| Muskelgewebe | 116 | 190 | 121 | 32 | 245 | 245 | 62 | 59 | 85 | 64 | ||
| Mundschleimhaut | 38 | 29 | 29 | 51 | 33 | 94 | 29 | 29 | 29 | 28 | ||
| Bauchspeicheldrüse | 24 | 25 | 24 | 25 | 35 | 35 | 35 | 35 | 37 | 31 | ||
| Prostata (Männer) | ||||||||||||
| Dünndarmwand | 23 | 23 | 22 | 25 | 27 | 27 | 27 | 27 | 27 | 25 | ||
| Milz | 60 | 95 | 77 | 39 | 87 | 104 | 68 | 66 | 73 | 66 | ||
| Thymusdrüse | 32 | 55 | 52 | 32 | 51 | 64 | 40 | 39 | 59 | 58 | ||
| Gebärmutter/Gebärmutterhals (Frauen) | 1,4 | 29 | 40 | 25 | 24 | 25 | 25 | 25 | 33 | 33 | 30 | 31 |
Erklärung der Symbole
| HT,max | Maximum der Äquivalentdosis im Organ oder Gewebe in Sv |
| E | Effektive Dosis in Sv |
| Egr | Grenzwert für die effektive Dosis in Sv, Egr = 0,02 Sv |
| hT | Dosis-Konversionsfaktor für die Organ-Äquivalentdosis in Sv cm2 |
| e | Dosis-Konversionsfaktor für die effektive Dosis in Sv cm2 |
| kk,max | Korrektionsfaktor für divergente Photonen-Strahlenbündel |
| PAR | Paralleles Strahlenbündel, Strahlungseinfall nicht spezifiziert |
| DIV | Divergentes Strahlenbündel, Strahlungseinfall nicht spezifiziert |
1.2 Interne Exposition am Arbeitsplatz: Abschätzung gemäß ICRP
Werden Radionuklide in den Körper aufgenommen, nutzen sie die ihnen zur Verfügung stehenden Stoffwechselpfade. Sie werden im Körper transportiert, lagern sich in Organen an und werden über Urin und Stuhl wieder ausgeschieden. Es kommt zu einer Verteilung auf die Organe des Körpers, teilweise mit Anreicherungen in einzelnen Organen (z.B. in der Schilddrüse für Iodisotope). Die inhomogene Verteilung der Nuklide führt zu einer inhomogenen Dosisverteilung im Körper. Die Dosis durch inkorporierte Radionuklide wird über die Deposition der beim Zerfall der Radionuklide freigesetzten Energie über die Zeit akkumuliert. Für den Vergleich mit Grenzwerten wird bei Erwachsenen diejenige Dosis betrachtet, welche durch die Zerfälle in einem Zeitraum von 50 Jahren entsteht, und diese sogenannte 50-Jahre-Folgedosis dann dem Kalenderjahr der Aufnahme der Radionuklide in den Körper zugeordnet.
Das Verhalten der in den Körper aufgenommenen Radionuklide vom Zeitpunkt ihrer Aufnahme über die (Um-)Verteilung im Körper bis hin zu ihrer Elimination durch Zerfall oder Ausscheidung wird mit Hilfe biokinetischer Modelle beschrieben.
Die Lösungen dieser mathematischen Modelle geben den zeitlichen Verlauf der Aktivitätskonzentration in Geweben und Organen des Körpers bzw. den Ausscheidungen wieder.
Aus den Retentionsfunktionen in den Quellregionen rS kann durch Integration die Anzahl der in τ = 50 Jahren nach der Aufnahme des Radionuklids in den Körper stattfindenden Zerfälle Ãi(rS, τ) berechnet werden.
Aus den Zerfällen in den einzelnen (Quell-)Organen kann durch Multiplikation mit den im weiblichen (F) bzw. männlichen (M) Referenzphantom berechneten S-Koeffizienten ; welche die Dosis in der Zielregion rT pro Zerfall im Quellorgan rS angeben, die zugehörige Äquivalentdosis
; welche die Dosis in der Zielregion rT pro Zerfall im Quellorgan rS angeben, die zugehörige Äquivalentdosis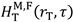 berechnet werden.
Für die Berechnung der S-Koeffizienten werden die Voxelmodelle der Referenzfrau (F) bzw. des Referenzmanns (M) verwendet (ICRP 2009b, ICRP 2016b). Die Dosisbeiträge der einzelnen Quellorgane rS und aller im Körper gebildeten Folgeprodukte (i) des inkorporierten Radionuklids müssen aufsummiert werden.
berechnet werden.
Für die Berechnung der S-Koeffizienten werden die Voxelmodelle der Referenzfrau (F) bzw. des Referenzmanns (M) verwendet (ICRP 2009b, ICRP 2016b). Die Dosisbeiträge der einzelnen Quellorgane rS und aller im Körper gebildeten Folgeprodukte (i) des inkorporierten Radionuklids müssen aufsummiert werden.
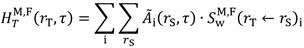
Führt man diese Rechnungen für eine Zufuhr von 1 Bq des Radionuklids durch, so erhält man die Dosiskoeffizienten hT(50) bzw. e(50), welche die Dosis im Organ bzw. die effektive Dosis pro zugeführter Aktivität des Radionuklids angeben. Setzt sich ein Gewebe/Organ T aus mehreren betrachteten Zielregionen rT zusammen, muss eine Gewichtung über deren Massenanteile f(rT,T) erfolgen. In den (meisten) Fällen, in denen sich das Ziel nur aus einem Gewebe zusammensetzt, ist f(rT,T) = 1. Der Dosiskoeffizient für ein Gewebe/Organ T im männlichen bzw. weiblichen Referenzmodell ergibt sich dann als:

Da auch die Gewebewichtungsfaktoren wT Referenzwerte sind (vgl. (ICRP 2015)), kann für die effektive Dosis E(τ), die sich durch die gewichtete Summation über verschiedene Gewebe ergibt, ebenfalls ein Dosiskoeffizient e(τ) angegeben werden. Zur Ermittlung der Organdosis wird eine Geschlechtermittelung durchgeführt.
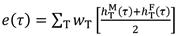
Aus der aufgenommenen Menge des Radionuklids kann dann durch Multiplikation mit dem Dosiskoeffizienten die 50-Jahre-Folgedosis (effektiv oder für das Organ T) berechnet werden.
Die nachfolgenden Berechnungen beruhen auf den Dosiskoeffizienten für die Organdosis und für die effektive Dosis, welche die ICRP in ihren Publikationen ICRP 134 (ICRP 2016a), ICRP 137 (ICRP 2017) und ICRP 141 (ICRP 2019) veröffentlicht und mit dem Programm "ICRP OIR Data Viewer 4.01.04.19" (ICRP 2019) digital verfügbar gemacht hat. Die veröffentlichten Dosiskoeffizienten sind auf der Grundlage biokinetischer Modelle, physiologischer Referenzparameter und anthropomorpher mathematischer Phantome für die jeweilige 50-Jahre-Folgedosis berechnet worden. Da der letzte Teil der auf fünf Teile angelegten OIR-Serie noch nicht veröffentlicht wurde, sind nicht für alle Radionuklide aktuelle Dosiskoeffizienten zur Berechnung der Dosis nach Inkorporationen vorhanden. Für die wenigen Radionuklide, für die keine aktuellen Daten vorlagen, wurden die bislang in Deutschland verwendeten, auf der ICRP-Publikation 60 beruhenden Werte (ICRP 1991) verwendet. Um in diesen Fällen die in ICRP-Publikation 103 (ICRP 2007) eingeführten numerischen Änderungen der Werte der Gewebewichtungsfaktoren dennoch zu berücksichtigen, wurden die Dosiskoeffizienten für die effektive Dosis nicht direkt übernommen, sondern aus den Dosiskoeffizienten für die Organe mit den aktualisierten Werten für wT neu berechnet. Die ICRP gibt die Dosiskoeffizienten mit nur zwei signifikanten Stellen an, wodurch die Grundgenauigkeit der darauf beruhenden Rechenoperationen eingeschränkt ist. Mit den Dosiskoeffizienten werden für die vorliegenden Expositionsszenarien (je 25.905 männlich/ weiblich) diejenigen Organ-Folgedosen nach Aktivitätszufuhren berechnet, die zum Erreichen des Grenzwertes der effektiven Folgedosis von 20 mSv führen. Diese Berechnungen werden für alle von der ICRP zur Verfügung gestellten Parameter der Inkorporationsszenarien (z.B. Zufuhrpfade, Löslichkeitsklassen, Korngrößen der Aerosole) durchgeführt. Aus den berechneten Daten werden diejenigen Fälle identifiziert, in denen die Organ-Äquivalentdosis den Wert von 500 mSv überschreitet. In Tabelle 1.4 sind für die drei Expositionspfade Ingestion, Inhalation und Injektion - getrennt nach den Geschlechtern - diejenigen Radionuklide mit den zugehörigen Organdosen angegeben, bei denen für eines der Geschlechter die jeweils maximale Organ-Äquivalentdosis HT,max beobachtet wird. Dabei werden Niedrig-LET- und Hoch-LET-Strahlung emittierende Radionuklide getrennt und jeweils in dieser Reihenfolge aufgeführt. Sollte für eine der beiden Strahlungsarten Niedrig-LET- oder Hoch-LET-Strahlung kein inkorporiertes Radionuklid zu einer relevanten Organdosis führen, so wird dies in der Tabelle durch einen Strich (-) verzeichnet. Für den Expositionspfad "Inhalation" werden alle in den Datenbanken verfügbaren Expositionsparameter wie zum Beispiel Aerosoltyp und -größe berücksichtigt. Der Expositionspfad "Injektion" umfasst die direkt in die Blutbahn verbrachten Radionuklide, z.B. über offene Wunden. Der für ein Organ oder Gewebe auftretende Maximalwert der Organ-Äquivalentdosis ist durch Fettdruck hervorgehoben.
Tabelle 1.4: Organ-Äquivalentdosis von mehr als 0,5 Sv in einzelnen Organen/Geweben bei Erreichen des Grenzwertes der effektiven Dosis;
der für ein Organ oder Gewebe auftretende Maximalwert der Organ-Äquivalentdosis ist durch Fettdruck hervorgehoben.
| Organ | Expositionsszenarien | Radionuklide mit HT,max > 0,5 Sv | H T,max männlich | H T,max weiblich | |
| Knochenoberfläche | 3.155 Datensätze 132 Radionuklide | Ingestion: | 93Zr
150Gd 230Th | 0,76 Sv
0,57 Sv 0,53 Sv | 1,0 Sv
0,75 Sv 0,70 Sv |
| Inhalation: | 93Zr
230Th | 0,80 Sv
0,54 Sv | 1,1 Sv
0,73 Sv | ||
| Injektion: | 93Zr
230Th | 0,77 Sv
0,53 Sv | 1,0 Sv
0,70 Sv | ||
| Schilddrüse | 598 Datensätze 26 Radionuklide I-, Te-, Sb-Isotope | Ingestion: | 126I
129I - | 0,45 Sv
0,45 Sv - | 0,53 Sv
0,53 Sv - |
| Inhalation: | 126I
129I - | 0,46 Sv
0,47 Sv - | 0,55 Sv
0,55 Sv - | ||
| Injektion: | 126I
129I - | 0,46 Sv
0,44 Sv - | 0,54 Sv
0,53 Sv - | ||
| Lymphknoten | 1.178 Datensätze 66 Radionuklide | Ingestion: | -
- | -
- | -
- |
| Inhalation: | 123Te
241Pu | 1,0 Sv
0,82 Sv | 1,2 Sv
1,0 Sv | ||
| Injektion: | -
- | -
- | -
- | ||
| Nieren | 484 Datensätze 11 Radionuklide Po-, Bi-, Pa-, U-Isotope | Ingestion: | -
230U | -
0,72 Sv | -
0,85 Sv |
| Inhalation: | - 230U | -
0,35 Sv | -
0,42 Sv | ||
| Injektion: | - 230U | -
0,70 Sv | -
0,85 Sv | ||
| Obere Atemwege | 8.874 Datensätze 415 Radionuklide | Ingestion: | -
- | -
- | -
- |
| Inhalation: | 212Pb
234U | 1,6 Sv
1,5 Sv | 1,8 Sv
1,5 Sv | ||
| Injektion: | -
- | -
- | -
- | ||
2 Strahleninduzierte nicht-neoplastische Erkrankungen
Die SSK geht davon aus, dass Strahlenexpositionen von beruflich exponierten Personen mit Organ-Äquivalentdosen unterhalb von 500 mSv keine nichttolerablen Risiken bewirken. Eine mögliche Ausnahme ist die Augenlinse, für die ein eigener Dosisgrenzwert im Strahlenschutzgesetz definiert ist. Im vorliegenden Kapitel werden Dosis-Wirkungsbeziehungen nicht-neoplastischer Erkrankungen 7) Erwachsener in Organen diskutiert, in denen bei einer effektiven Dosis von 20 mSv die Organ-Äquivalentdosis größer als 500 mSv sein kann. Im ersten Kapitel dieser Wissenschaftlichen Begründung wurde abgeleitet, dass dies für die fünf Organe und Gewebe Knochenoberfläche, Schilddrüse, Lymphknoten, Niere und obere Atemwege der Fall ist.
Für die Analyse nicht-neoplastischer Erkrankungen nach Strahlenexposition Erwachsener werden in dieser Wissenschaftlichen Begründung auch Studien von Expositionen im Kindes- und Jugendalter berücksichtigt, da sie für Expositionen junger Erwachsener relevant sein können. Studien der Folgen von Expositionen ausschließlich im Kindesalter wurden nicht berücksichtigt. Für die vorliegende Diskussion von Grenzwerten im beruflichen Strahlenschutz werden, soweit möglich, epidemiologische Evidenz und biologische Plausibilität berücksichtigt. Einzelbeobachtungen können Anlass zur Empfehlung weiterer Untersuchungen sein.
Die Publikation 118 der ICRP fasst wesentliche Ergebnisse zu Gewebereaktionen nach Strahlenexpositionen zusammen (ICRP 2012a). Das vorliegende Kapitel basiert auf dieser ICRP-Publikation und einer Darstellung neuerer Studien. Nur für diejenigen Fälle, in denen die ICRP keine Aussage zu einem Schwellenwert gemacht hat, wird hier auch die ältere Literatur diskutiert.
Häufig basieren in der Literatur diskutierte Studien von strahlenbedingten Gesundheitsschäden auf der Energiedosis (in Gy). Dementsprechend werden in diesem Kapitel der wissenschaftlichen Begründung die Beobachtungen nicht-neoplastischer Erkrankungen zunächst in Abhängigkeit von der Energiedosis zusammengefasst. Erst im letzten Unterabschnitt Implikation für eine Grenzwertsetzung der fünf Abschnitte für die einzelnen Organe und Gewebe werden die Energiedosen, für die nicht-neoplastische Erkrankungen zu erwarten sind, in Beziehung gesetzt zu den Organ-Äquivalentdosen, die beim Einhalten der effektiven Dosis von 20 mSv maximal auftreten können. Dazu wird soweit notwendig auf den aktuellen Kenntnisstand der relativen biologischen Wirksamkeit (relative biological effectiveness, RBE) verschiedener Strahlenarten für nicht-neoplastische Erkrankungen eingegangen.
2.1 Knochen und Knochenoberfläche
Es gibt umfangreiche Studien nicht-neoplastischer Schäden durch externe Strahlenexpositionen des Knochens mit Photonen einer Energie oberhalb von einigen hundert keV. Für solche externe Strahlenexpositionen unterscheiden sich die Organ-Äquivalentdosen der Knochenoberfläche und des Knochens nur unwesentlich, sodass diese Studien auch für mögliche deterministische Effekte durch Expositionen der Knochenoberfläche relevant sind. Studien nicht-neoplastischer Schäden speziell für Expositionen der Knochenoberfläche liegen nur in sehr beschränktem Maße vor.
2.1.1 Grundlagen
Bei Knochen handelt es sich um ein hochdynamisches Gewebe, das altersabhängig verschiedene Aufgaben erfüllt. Im präpubertären Alter erfolgt primär das Längenwachstum, und im Erwachsenenalter dominiert die strukturelle Anpassung an körperliche Belastung. Das höhere Alter ist durch morbide Alterungsprozesse (Knochenschwund) geprägt. In jedem Alter ist der Knochen in der Lage, sich nach einem Trauma zu regenerieren. Da Knochen von körperlicher Aktivität, Lebensstil und Hormonen beeinflusst werden, kommt es zu geschlechtsspezifischen Anpassungen in Knochenstruktur und -metabolismus.
Knochenzellen sind in zwei funktionelle Zelltypen aus unterschiedlichen Herkunftslinien aufzuteilen. Die knochenresorbierenden Osteoklasten sind aus der hämatopoetischen Linie und zeigen Eigenschaften konsistent zu einer hämatopoetischen Stammzelldifferenzierung in Myeloid/Makrophagen-Richtung. Die knochenmatrixsynthetisierenden Osteoblasten stammen aus der mesenchymalen Stammzelllinie und bilden sich im Rahmen der osteogenen Differenzierung aus Osteoprogenitoren. Beide Zellarten können durch Strahleneinwirkung geschädigt werden. Der Verlust der Osteoklasten führt zu einem verminderten resorptiven Knochenabbau. Aber auch die neue Synthese durch Osteoblasten wird hierbei gehemmt, da diese indirekt durch Osteoklastenaktivität stimuliert wird. Der Verlust der Osteoblasten verhindert sowohl neue Knochensynthese als auch eine effektive Mineralisierung frisch produzierter Knochenmatrix. Proliferierende Zellen auf allen Stufen der Osteoblastlinie zwischen mesenchymaler Stammzelle und reifem Osteoblast sind Kandidaten für Ursprungszellen eines Osteosarkoms.
Der Knochenumbau ist das Ergebnis einer ständigen Anpassung der reifen Knochenstruktur an mechanische Belastungen. Der Umbau erfolgt in drei Phasen und beginnt mit der lokalen Resorption der vorhandenen mineralisierten Knochengrundsubstanz durch Osteoklasten, welche aus den hämatopoetischen Stammzellen aus dem angrenzenden Knochenmark entstehen. Es folgt die Phase der Neusynthese der kollagenreichen, organischen Grundsubstanz durch Osteoblasten, welche sich aus präosteoblastischen Vorläuferzellen entwickeln, die sich wiederum aus der mesenchymalen Stammzellepopulation differenzieren. Der Umbau schließt mit der Mineralisierung der organischen Grundsubstanz durch Ablagerung von anorganischen, kalziumreichen Knochenmineralien ab. Einige Osteoblasten verbleiben im neuen Knochen und werden zu Osteozyten, die über ein Netzwerk aus mikroskopischen Kanälen miteinander interagieren, und somit eine physische Belastung des Knochens wahrnehmen können, die zu einem erneuten Knochenumbau führen kann.
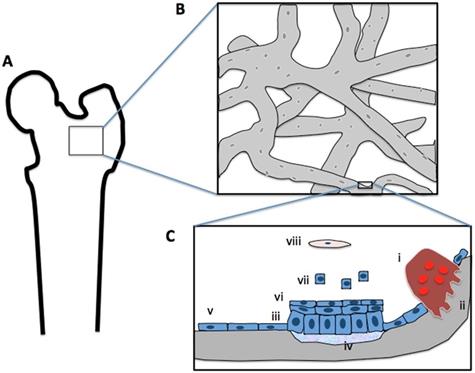
Abbildung 2.1: Graphische Darstellung der (A) makroskopischen Ansicht des Femurkopfes mit einem Ausschnitt aus dem trabekulären Knochengewebe (B),
der in Vergrößerung die mikroskopische Struktur des Trabekularknochens des Hüftkopfes darstellt; eine weitere Vergrößerung aus der Knochenoberfläche (C) stellt die zelluläre Struktur der Knochenoberfläche mit Knochenbildungszellen um einen einzelnen Knochentrabekel dar. Letzteres ist mit dem ICRP-Model ≪Endosteum≫ gleichgestellt (siehe unten).
Legende: (i) knochenresorbierender Osteoklast, (ii) Resorptionslacuna, (iii) aktive Osteobasten, (iv) neue Knochenmatrix, (v) "ruhende" Osteoblasten, (vi) prä-Osteoblasten, (vii) an die osteoblastäre Linie gebundene Zellen, (viii) mesenchymale Stammzelle im Knochenmark
Das Skelett besteht hauptsächlich aus zwei Arten von Knochen: Der dichtere, kortikale Knochen ist für die mechanische Festigkeit verantwortlich, welche für tragende Strukturen, wie die Außenseite der langen Knochen des Stammskeletts wichtig ist, aber auch der leichtere, trabekuläre Knochen trägt maßgeblich zur Stabilität bei. So führt der Verlust an Spongiosa bei der Osteoporose zu Frakturen oder langsamen Sinterungen z.B. der Wirbel, auch bei weitgehend erhaltener Kortikalis. Am Femurhals kann man gut erkennen, wie die Trabekel ausgerichtet sind, um z.B. Biegekräfte abzufangen. Letztlich dienen die Trabekel dazu, ein Maximum an Stabilität bei vergleichsweise "leichter Bauweise" zu gewährleisten. Sie haben eine viel größere Umsatzrate aufgrund des größeren Oberflächen-Volumen-Verhältnisses und einer größeren Zahl an Knochenzellen und deren Vorläufern im angrenzenden Knochenmark. Beeinträchtigungen des Knochenstoffwechsels werden in erster Linie in diesen hochmetabolischen trabekulären Strukturen beobachtet.
2.1.2 Schäden des Knochengewebes
Irrtümlicherweise wurden Knochen früher für hoch strahlungsresistent gehalten. Dies hatte zur Folge, dass biologische Effekte meist nur nach Anwendung von Dosen > 5 Gy untersucht wurden. Die Forschung zur Wirkung von Dosen < 5 Gy auf die Knochenstruktur und -funktion wurde vernachlässigt. Die vorliegende Literatur ist aufgrund von Unterschieden in Bestrahlungsschemata, den untersuchten Tierarten, deren Alter und Geschlecht, der Sensitivität der untersuchten Endpunkte und der angegebenen Zeitverläufe mit Vorsicht zu interpretieren (Luz et al. 1991). Besondere Vorsicht ist bei der Interpretation von Studien an Strahlentherapiepatientinnen und -patienten geboten, da sowohl Geschlecht und Alter als auch Tumorart, Nebenwirkungen von Chemotherapie und Immobilität einen erheblichen Einfluss auf die beobachteten Auswirkungen auf die Knochenfunktion haben können (Bozzola et al. 1993, Edwards et al. 2011). Struktur und Stabilität von Knochen werden durch Exposition gegenüber ionisierender Strahlung beeinträchtigt (Hopewell 2003, Goldwein 1991). Die Schädigung aufgrund einer solchen Exposition kann entweder lokal begrenzt um ein äußerlich angewandtes Strahlungsfeld sein oder systemisch, durch die Inkorporation knochensuchender Radionuklide (z.B. Plutonium, Strontium und Thorium) das gesamte Skelett betreffend. Sekundäreffekte der Strahlung auf das Skelett aufgrund von Schäden an Geweben, welche die Knochenfunktion regulieren, wie die Nebenschilddrüse, Hypophyse und Nieren, oder die Knochenzerstörung durch bösartiges Wachstum von strahlungsinduzierten primären und sekundären Tumoren sind nicht Teil der vorliegenden Diskussion. Die regenerative Kraft des Knochens ist ausgeprägt. Viele Schäden können innerhalb von Wochen repariert werden.
Die von ICRP 110 (ICRP 2009b) beim Menschen konzeptionell auf 10 µm begrenzte Einzelzellschicht an allen Knochenoberflächen (trabekulärer und kortikaler Knochen, nicht aber das Periost) ist als Zielpopulation "Endosteum" definiert. Dieses enthält die knochenfunktionsrelevanten Zellen (aktive und ruhende, reife Osteoblasten), die aber fast ausschließlich aus ausdifferenzierten, nichtproliferierenden Zellen mit kurzer Lebenszeit (maximal ca. 60 Tage) bestehen (vgl. Abbildung 2.1).
Mit ICRP 133 (ICRP 2016b) ist dieses Endosteum neu definiert und umfasst jetzt eine 50 µm dicke Zellschicht um die Knochenoberfläche der trabekulären Knochen. Diese enthält die reifen Osteoblasten und möglicherweise einige Vorläuferzellstufen. Ob mesenchymale Stammzellen und deren direkte Abkömmlinge enthalten sind, ist ungewiss.
ICRP-Publikation 118 (ICRP 2012a) berücksichtigt für deterministische Effekte durch Strahlenexpositionen des Knochens Veröffentlichungen bis zum Jahre 2003. Die wesentlichen Ergebnisse der ICRP-Publikation werden im Folgenden kurz zusammengefasst ohne die Originalliteratur erneut zu zitieren.
Nach ICRP 118 (ICRP 2012a) können Strahlenexpositionen des Knochens mit extrem hohen Dosen bei Erwachsenen drei Arten von nicht-neoplastischen Effekten bewirken: Osteonekrose, Stressfrakturen und Beeinträchtigungen von Bruchheilungen. Verzögerung des Knochenlängenwachstums durch Strahlung bei heranwachsenden Jugendlichen wird nicht explizit beschrieben.
2.1.3 Osteonekrose
Deterministische Strahlenschäden im Skelett werden als Osteonekrose und metabolische Knochenerkrankungen oftmals getrennt beschrieben. Diese Unterscheidung erscheint etwas willkürlich, da sich beide aufgrund einer verringerten Anzahl von funktionsfähigen Zellen im Knochen entwickeln, wobei die Nekrose das Ergebnis einer vollständigeren Zelldepletion bei höheren Dosen ist, während es sich bei den metabolischen Knochenerkrankungen um das Ergebnis einer weniger gravierenden Störung des Gleichgewichts zwischen knochenaufbauenden und -abbauenden Zellen bei niedrigeren Dosen handelt.
2.1.3.1 Strahlentherapiepatientinnen und -patienten
Nach ICRP 118 (ICRP 2012a) tritt die strahlenbedingte Osteonekrose nur selten und nicht vor ein bis zwei Jahren nach Exposition auf. Sie wurde nach Strahlentherapien von Kopf-Hals-Tumoren im Unterkiefer und Schläfenbein, und von Beckentumoren in Beckenknochen, Kreuzbein und Femurkopf und nur in Regionen mit Energiedosen von mehr als 50 Gy beobachtet.
2.1.3.2 Tierexperimente
Zellverlust im bestrahlten Knochengewebe führt zu einer Veränderung im knochenmetabolischen Gleichgewicht, mit einer gleichzeitigen Reduktion von Neusynthese und Resorption. Als Folge der Nekrose ist der für den Ausgleich der mechanischen Belastung erforderliche adaptive Knochenumbau beeinträchtigt und kann so zeitverzögert zur Fraktur oder zum Kollaps des Skeletts führen (Schmitt und Zamboglou 1990). Es kann trotzdem zu einer, wenn auch verzögerten, Frakturheilung an der strahlengeschädigten Stelle des Knochens kommen (Bonfiglio 1953), vermutlich durch die Migration regenerativer Zellen an die Stelle der Schädigung (Läsion).
Eine Kausalität zwischen dieser strahleninduzierten Osteonekrose und vaskulärem Tod wird zwar angenommen, ist jedoch nicht allgemein akzeptiert. So wurde z.B. in den Schienbeinen von Kaninchen, denen 90Sr injiziert wurde, beobachtet, dass eine Schädigung der Blutgefäße dem Tod von Osteoblastzellen vorausging (Macpherson et al. 1962). Grimm stellt die These auf, dass es zwei verschiedene Formen strahleninduzierter Nekrose gibt: eine frühe Form, die direkt durch den Tod von Knochenzellen verursacht wird, gefolgt von einer späteren Form, bei der der vaskuläre Zelltod zu einer Abnahme der Zahl der Knochenzellen führt (Grimm 1971). Die Schwere der Nekrose hängt vermutlich vom Ausmaß des Gefäßverlusts ab und es ist wohl davon auszugehen, dass eine Genesung nur möglich ist, wenn ein intaktes Gefäßsystem aufrechterhalten werden kann (Überschär 1959).
Es kann Monate bis Jahre dauern, bis sich Osteoradionekrosen manifestieren. Dies hängt auch von Alter und Geschlecht (Knochenumsatzrate) des exponierten Individuums ab. In den ersten Lebensjahren mit relativ schnellem Skelettstoffwechsel erhöht sich die Zahl der durch die Strahlung abgetöteten, proliferierenden Zellen rasch. Im Erwachsenenalter kann die langsamere Proliferationsrate die Auswirkungen des Zellverlusts abfangen und es kann dauern, bis sich nekrotische Läsionen manifestieren. Während diese osteoradionekrotischen Läsionen in der Regel räumlich begrenzt sind und sich langsam entwickeln, kann auch eine schnellere und schwerwiegendere Art der Osteoradionekrose auftreten. Diese steht üblicherweise in Zusammenhang mit einer lokalen Infektion (Dambrain et al. 1988).
Knochennekrosen werden normalerweise nach einer Exposition im höheren zweistelligen Gray-Bereich beobachtet. So führte z.B. die externe Bestrahlung des Unterkiefers mit 192Ir in Höhe von 80 Gy über den Verlauf von drei Tagen in einem Katzenmodell zu einer Nekrose, die zwei Monate nach der Bestrahlung auftrat (Dambrain et al. 1990). Bei Studien zur Wirkung inkorporierter Radionuklide wurden ähnlich hohe Dosen verwendet, um nachweisbare, nekrotische Veränderungen zu provozieren. So führte in einem Hundemodell mit Beagles eine Dosis mit 239Pu in Höhe von 32 Gy nach einem Jahr zu spontanen (nekrosebedingten) Knochenfrakturen (Taylor et al. 1972).
Die Dosis-Wirkungsbeziehung ist unklar, da Unterschiede im Tiermodell, in der verabreichten Dosis und im Beobachtungszeitraum zu widersprüchlichen Ergebnissen führen. Es gibt Hinweise darauf, dass eine Exposition gegenüber Röntgenstrahlen in Höhe von 5 Gy sowohl bei Ratten (Überschär 1959) als auch bei Kaninchen (Hulth und Westerborn 1962) zu einem Absterben der Osteoblasten und letztendlich zu nekrotischen Veränderungen im bestrahlten Knochen führt. Bei akuter externer Exposition liegt der niedrigste Wert der Dosis, bei dem ein Effekt beobachtet wurde, bei 4 Gy (Melanotte und Follis 1961). Die berechnete Toleranzdosis (5 % Komplikationen nach fünf Jahren) liegt bei 80 Gy (Rubin und Casarett 1972).
2.1.4 Frakturen und Bruchheilung bei Strahlentherapiepatientinnen und -patienten
Nach ICRP-Publikation 118 (ICRP 2012a) sind Stressfrakturen nach Strahlentherapie mit hohen Knochendosen in der Regel asymptomatisch. In seltenen Fällen bewirken sie jedoch Schmerzen und eine erhöhte Anfälligkeit für zu einem offenen Bruch führende Traumata. Patientinnen und Patienten mit Erkrankungen des Bindegewebes sind besonders anfällig für strahlenbedingte Stressfrakturen.
Auf strahlenbedingte Beeinträchtigungen von Bruchheilungen geht ICRP 118 (ICRP 2012a) nicht weiter ein.
Es gibt umfangreiche neuere Literatur zu Effekten im Knochen nach Strahlentherapie (siehe z.B. die Übersichtsartikel von Pacheco und Stock (Pacheco und Stock 2013) und von Wissing (Wissing 2015)). Die überwiegende Anzahl der Artikel geht allerdings nicht auf das Thema Schwellenwerte ein.
Eine Ausnahme ist der Übersichtsartikel von Mavrogenis et al. (Mavrogenis et al. 2015). Eine Schwellendosis von 65 Gy bis 70 Gy wird für Gesundheitseffekte im ausgewachsenen Knochen angegeben. Dementsprechend werden Energiedosen im Knochen von mehr als 50 Gy als ein Risikofaktor für strahleninduzierte Frakturen angesehen.
2.1.5 Auswirkungen auf das Knochenwachstum
2.1.5.1 Klinische Beobachtungen
Das Längenwachstum des Skeletts ist sowohl bei Männern als auch bei Frauen im Alter von 20 Jahren (Crowder und Austin 2005) mit der Fusion der Epiphysen abgeschlossen. Eine Strahlenexposition vor diesem Alter kann die enchondrale Ossifikation stören und so zu einer Verzögerung oder frühzeitigen Einstellung des Wachstums führen.
2.1.5.2 Tierexperimente
Verzögerungen traten bei jungen Ratten (Hinkel 1943) nach einer Ganzkörperbestrahlung mit Dosen > 5 Gy auf. Auch bei externbestrahlten juvenilen Rhesus-Affen traten Verzögerungen bei Dosen > 5 Gy auf (Sonneveld und Van Bekkum 1979). Eine Erholung ist nach einer Exposition < 10 Gy bei einem mit Röntgenstrahlung behandeltem Rattenmodell beobachtet worden (Blackburn und Wells 1963, Melanotte und Follis 1961).
Dosisfraktionierung scheint den Wachstumsinhibitionseffekt zu reduzieren. Bei jungen Ratten führt eine Dosis von 17,5 Gy in fünf gleich hohen Fraktionen nur zu einer vorübergehenden Schädigung der Wachstumsfugen (Damron et al. 2008). Ein Wachstumsdefizit bei jungen Ratten nach interner Bestrahlung durch 239Pu ist ab einer Dosis von 3 Gy beschrieben (Gamer 1988). Dies stimmt mit der klinischen Beobachtung einer Wachstumsreduktion bei mit 224Ra behandelten Kindern überein (Spiess et al. 1985).
2.1.6 Metabolische Knochenerkrankungen
Metabolische Knochenerkrankungen führen zu strukturell schwachen Knochen, die mehr (Osteopetrose) oder weniger (Osteoporose) dicht sein können als bei einem Gesunden. Osteopetrose entsteht, wenn die Rate der Knochenneubildung die Resorptionskapazität übersteigt, während bei der Osteoporose die Resorptionsrate über der der Neubildung liegt und so zu Knochenverlust führt. Eine unzureichende Mineralisierung der Knochengrundsubstanz (Osteomalazie) kann sowohl bei normalen als auch bei krankhaft veränderten Knochen auftreten. All diese Krankheitsbilder führen zum Verlust der strukturellen Integrität und somit zu Bruch oder Kollaps der Knochen unter Belastung.
2.1.6.1 Strahlentherapiepatientinnen und -patienten
Klinisch treten metabolische Knochenerkrankungen bei einem nicht bestrahlten Individuum aufgrund von hormonellen Veränderungen, physischem Trauma, ungesunder Lebensweise/Ernährung oder genetischen Defekten in der Knochenzellfunktion auf. Die Krankheitsbilder präsentieren sich in verschiedenen Schweregraden, von klinisch nicht nachweisbar bis lebensbedrohlich. Eine mögliche Wechselwirkung zwischen Bestrahlung und jeder dieser Erkrankungsursachen muss im Einzelfall geprüft werden.
Strahleninduzierter Knochenverlust aufgrund der gleichen lokalen, zelltötenden Mechanismen, wie sie bei Osteoradionekrosen beobachtet werden, ist eine Folge der Strahlenexposition im Rahmen einer Tumortherapie (Willey et al. 2011). Das Risiko für Brüche des Oberschenkelknochenhalses und -kopfes, der Rippen und des Beckens erhöht sich, wenn diese Knochen während der Strahlentherapie exponiert waren (Kolar und Vrabek 1976, Baxter et al. 2005), da die Knochenqualität an der Stelle der Strahlenfraktur reduziert und grundsätzlich weniger organisiert und stabil ist (Bonfiglio 1953, Wernle et al. 2010). Wie bei Knochenbrüchen und postmenopausaler Osteoporose sagt ein reduzierter Knochenmineralgehalt an und für sich keine vermehrten Knochenbrüche voraus (Heuck und Lauritzen 1967), da diese in erster Linie von einer Kombination der lokalen Knochenqualität und von am Knochen wirkenden physikalischem Stress bestimmt werden.
2.1.6.2 Atombombenüberlebende
Eine Wirkung von Strahlung auf den Knochenstoffwechsel bei Dosen unterhalb von 3 Gy ist nicht dokumentiert. Obwohl die Knochenmineraldichte bei Atombombenüberlebenden untersucht wurde, erschwert die in dieser Kohorte beobachtete hohe Rate von Hyperparathyreoidismus (ERR von 4,1 bei 1 Gy (Fujiwara et al. 1992)) und vorzeitig eintretender Menopause die Interpretation (Kodama et al. 1996, Sakata et al. 2011).
2.1.6.3 Tierexperimente
In Studien an weiblichen Mäusen führt eine Ganzkörperdosis von 2 Gy Gammastrahlung zu einer 30 %igen Abnahme des trabekulären Knochenvolumens nach 110 Tagen (Hamilton et al. 2006). In einer Studie an männlichen Mäusen (Kondo et al. 2009), die sowohl das kortikale als auch das trabekuläre Knochenvolumen umfasste, ging das Volumen einen Monat nach einer einzelnen Ganzkörperdosis von 1 Gy zurück. Bei einer niedrigeren Dosis von 100 mGy wurde kein Strahlenschaden beobachtet. Bezeichnenderweise war das Knochenvolumen in dieser Studie nach vier Monaten auf das Kontrollniveau zurückgekehrt (Kondo et al. 2009). Eine klarere Sicht auf die Dosis-Wirkungsbeziehung bietet die aktuelle Studie von Lima et al. (Lima et al. 2017), die ein reduziertes Knochenvolumen bei weiblichen Mäusen 21 Tage nach Erhalt einer Ganzkörperdosis von 1 Gy Gammastrahlung zeigt, jedoch nicht bei einer Dosis von 0,5 Gy.
Die Studien zu den Mechanismen, die für die beobachteten Veränderungen der Knochenqualität und -menge verantwortlich sind, sind nicht immer kongruent, womöglich durch sich eine zeitlich schnell ändernde zelluläre Antwort nach Bestrahlung. Eine Studie von Willey et al. beschrieb einen Anstieg in der Zahl der Osteoklasten bei Mäusen drei Tage nach einer Bestrahlung mit 2 Gy (Willey et al. 2008). Obwohl während dieser kurzen Zeit keine Veränderungen in der Knochenstruktur beobachtet wurden, ist von einer zeitlich verstärkten Knochenresorption als Folge auszugehen. Im Gegensatz dazu berichten Melanotte und Follis über eine vorübergehend erhöhte Rate an neu geformten Knochen in einem adulten Rattenmodell, das 4 Gy ausgesetzt war (Melanotte und Follis 1961), genauso wie Wernle et al. nach einer 5 Gy Dosis (Wernle et al. 2010) und Gong et al. bei Mäusen nach einer fraktionierten Bestrahlung mit 20 Gy (Gong et al. 2013). Die beiden letzteren Studien zeigen nach der anfänglich hypertrophen Reaktion eine signifikante Abnahme der Knochenqualität. Bei der beobachteten schnellen Abnahme der Osteoklastenzahl im Mausmodell nach einer Bestrahlung mit 5 Gy handelt es sich um einen plausiblen Mechanismus. Er führt zu einer kurzfristigen Zunahme der Knochenneubildung; der neue Knochen ist jedoch strukturell schwach (Oest et al. 2015).
Die Studie von Cao et al. (Cao et al. 2011) zeigt, dass eine Teilbestrahlung des Oberschenkelknochens der Maus mit 20 Gy sowohl zu einer Abnahme von Osteoblasten und Osteoklasten, als auch während des gesamten vierwöchigen Beobachtungszeitraums zu dem Verlust der endothelialen und mesenchymalen Stammzellen im bestrahlten Bereich des Knochens führt. Da das umliegende Knochenmarkgewebe wesentlich für die fortlaufende Bildung von sowohl Osteoblasten als auch Osteoklasten aus den Stammzellen im Knochenmark verantwortlich ist, könnte dies die dauerhaften Strahlenschäden nach hohen Dosen erklären (Green et al. 2012).
In einem experimentellen Mausmodell zeigten sich Resorptionsdefekte bei Mäusen, die über vier Wochen eine Dosis von 5 Gy erhielten. Dieses Ergebnis wurde auch einer reduzierten Osteoklastendifferenzierung aus dem von einer strahleninduzierten Zellzahlverminderung betroffenen Knochenmark zugeschrieben. Im Gegensatz dazu erhöhte sich die Zahl der Osteoklasten bei niedrigen Dosen (0,338 Gy) durch inkorporiertes 239Pu (Gamer 1988). Interessanterweise zeigen Studien mit hohem LET im Mausmodell eine Dosisempfindlichkeit, die nur geringfügig über der liegt, wie sie sich bei niedrigem LET in einem Dosisbereich von 0,5 Gy bis 2 Gy feststellen lässt (Alwood et al. 2017, Hamilton et al. 2006). Zwei neue Studien zeigen einen starken abscopalen (außerhalb des Strahlenfelds auftretenden) Effekt nach lokaler Bestrahlung der Extremitäten auf die Knochenqualität beim nicht bestrahlten kontralateralen Bein bei Mäusen, deren anderes Bein mit 4 x 5 Gy behandelt wurde (Oest et al. 2018), und auf die Fähigkeit von nicht bestrahltem Knochenmark, neue Osteoklasten in der nicht bestrahlten Extremität von Ratten zu bilden, deren andere Extremität mit 2 Gy behandelt wurde (Sun et al. 2017). Wie die Autoren betonen, könnten Studien, bei denen die nicht bestrahlte Extremität als interne Kontrolle verwendet wird, weniger aussagekräftig beim Nachweis von Schäden sein als bisher angenommen.
2.1.7 Mineralisierungsstörungen
Bei Dosen von 5 Gy und mehr wurde bei Mäusen eine Verminderung der Mineralisierung festgestellt (Wilson 1956). Dosen von 1 Gy oder 2,5 Gy hatten hingegen keinen irreversiblen Einfluss auf die Mineralisierung (Blackburn und Wells 1963). Beim Menschen scheint es unter einer Dosis von 2 Gy keinen bleibenden negativen Einfluss auf die Mineralisierung zu geben (Hattner et al. 1982). Es kann aber durchaus sein, dass solche Auswirkungen nur vorübergehend sind, da es im Tiermodell selbst nach einer Exposition von 10 Gy zu einer schnellen und vollständigen Erholung in der Mineralisierung kommt (Jee und Arnold 1961). Hinweise auf Osteomalazie bei mit Thorotrast behandelten Individuen können mit Störungen im Leber- und Mineralstoffwechsel erklärt werden, die hauptsächlich für den beobachteten Knochenverlust verantwortlich sein könnten (Gondos 1973).
2.1.8 Zusammenfassende Bewertung
In ICRP 133 (ICRP 2016b) ist für die Dosimetrie der Knochenoberfläche das betrachtete Zielvolumen neu definiert. Statt nicht-proliferierender Zellen in einer an der Knochenoberfläche liegenden 10 µm-Einzelzellschicht ist jetzt eine 50 µm-Schicht an der Oberfläche definiert. Diese enthält einige Knochenpräkursor- und Knochenstammzellen; ob aber alle gefährdeten Zellen dieses komplexeren Gewebes miteinbezogen sind, ist nicht bekannt.
Osteoradionekrosen, durch akutes oder auch chronisches Absterben von sowohl Knochenzellen als auch Endothelzellen, sind nur mit therapierelevanten Dosen bei Patientinnen und Patienten beschrieben. Erfahrung aus Tiermodellen, die einen menschenähnlichen Knochenmetabolismus besitzen, zeigen, dass nekrotische Reaktionen nur bei einer Dosis weit oberhalb von einigen Gray auftreten.
Es gibt einen klaren Nachweis von Strahlenschäden im longitudinalen Knochenwachstum bevor sich die Epiphysenfugen schließen. Nach neustem Wissensstand treten im Tier(Nager)modell keine Strahlenschäden unter 5 Gy auf, und bis 10 Gy sind die Schäden reversibel. Ob dieses auch für den Mensch relevant ist, ist aufgrund der unterschiedlichen Knochenwachstumskinetik bei heranwachsenden Menschen und Nagern zu hinterfragen.
Metabolische Knochenerkrankungen werden durch einen Verlust des Gleichgewichts zwischen Knochenresorption und Knochenneusynthese verursacht. Dieses kann sowohl durch fehlende Ausdifferenzierung der knochenmetabolisierenden Osteoklasten und Osteoblasten aus ihrer jeweiligen Stammzellpopulation im Knochenmarksraum als auch durch Funktionsverlust der bereits differenzierten Zellen an der Knochenoberfläche geschehen. Die Kopplung zwischen Osteoblasten und Osteoklasten ist im Mensch und Tiermodell vergleichbar. Ein Schwellenwert von 5 Gy am Endosteum (ICRP 110 Definition (ICRP 2009b)) für metabolische, aber nicht strukturrelevante Schäden muss jetzt hinterfragt werden. Die Ergebnisse aus hochauflösenden Verfahren (z.B. Nano-CT oder MRT der neuesten Generation) in den jüngsten Tierversuchen haben gezeigt, dass metabolische Effekte ab Dosen in Höhe von 1 Gy auftreten. Ein Einfluss von genetischer Disposition (z.B. häufig auftretende Varianten des Kollagen-Gens), Lebensstil, Geschlecht und Alter auf die Dosis-Wirkungsbeziehung in Einzelfällen kann im Moment nicht ausgeschlossen werden.
Neuere Studien von Strahlentherapiepatientinnen und -patienten bestätigen den in der ICRP-Publikation 118 (ICRP 2012a) angegebenen Schwellenwert für die Organ-Äquivalentdosis von mindestens 50 Sv für Gesundheitseffekte im Knochen. Die Studien beziehen sich auf externe Expositionen mit Photonen der Energie oberhalb von einigen hundert keV und sind damit auch für nicht-neoplastische Effekte durch Expositionen der Knochenoberfläche relevant.
2.1.9 Implikation für eine Grenzwertsetzung
Die oben dargestellten Ergebnisse zu Strahlenwirkungen im Knochen beziehen sich auf die Energiedosis. Für Niedrig-LET-Strahlung hat die Äquivalentdosis den gleichen numerischen Wert wie die Energiedosis. Es ist weiterhin nicht davon auszugehen, dass die biologische Wirksamkeit von inkorporiertem 239Pu bezüglich nicht-neoplastischer Erkrankungen geringer ist als die von Niedrig-LET-Strahlung (Alwood et al. 2017). Dementsprechend sind die numerischen Werte der Äquivalentdosis für die beobachteten Effekte größer als die der Energiedosis, da stets WT 239Pu) > 1. In allen betrachteten Expositionsszenarien ist für eine effektive Dosis von 20 mSv die Organ-Äquivalentdosis der Knochenoberfläche kleiner als 2 Sv. Reversible Schäden sind erst ab einer Dosis von über 5 Gy und irreversible Schäden erst ab 10 Gy zu erwarten. Daher hält die SSK einen Grenzwert für die Organ-Äquivalentdosis in der Knochenoberfläche für berufliche Strahlenexpositionen nicht für notwendig.
Die in Tierversuchen gefundenen metabolischen Effekte ab Dosen von 1 Gy stellen selbst noch keine Schäden dar und sollten daher auch nicht als Begründung für einen Grenzwert für die Organ-Äquivalentdosis in der Knochenoberfläche herangezogen werden. Da sie aber Hinweise auf mögliche Schäden sein könnten, sollte die weitere Entwicklung der Untersuchung dieser Effekte im Auge behalten werden und die Implikationen für eine Grenzwertsetzung nach Vorliegen aussagekräftiger neuer Studienergebnisse neu bewertet werden.
2.2 Schilddrüse
2.2.1 Grundlagen
Als nichtneoplastische Schilddrüsenerkrankungen nach Strahlenexposition der Schilddrüse werden im Folgenden Hypothyreose, Hyperthyreose und Thyreoiditis diskutiert. Neben diesen Funktionsstörungen der Schilddrüse kann die Exposition mit ionisierender Strahlung auch Schilddrüsenkrebs und gutartige Tumoren (Schilddrüsenknoten) bewirken. Die Begrenzung des Risikos von strahleninduziertem Schilddrüsenkrebs ist durch den Grenzwert der effektiven Dosis für beruflich strahlenexponierte Personen geregelt. Das Strahlenrisiko von Schilddrüsenknoten hat die SSK in einer gesonderten Stellungnahme diskutiert (SSK 2017). Sie geht von wesentlich stochastischen Wirkmechanismen aus, die somit eher bei der Begrenzung der effektiven Dosis als bei einem gesonderten Grenzwert für die Organ-Äquivalentdosis in der Schilddrüse zu berücksichtigen wären.
Schwellenwerte zur Strahleninduktion von Hypothyreose und Hyperthyreose werden in der ICRP-Publikation 118 (ICRP 2012a) unter Berücksichtigung von Literatur, die vor 2009 veröffentlicht wurde, diskutiert. Nach einer kurzen Zusammenfassung der ICRP-Publikation wird in den einzelnen Unterabschnitten dieses Abschnitts die neuere Literatur zusammengefasst.
Thyreoiditis bezeichnet mehrere Arten von Schilddrüsenentzündungen verschiedener Ursache, die teilweise sehr unterschiedliche Krankheitsverläufe haben. Strahlenexpositionen der Schilddrüse werden mit akuter Thyreoiditis (Abschnitt 2.2.4) und autoimmuner Thyreoiditis in Verbindung gebracht (Abschnitt 2.2.5).
Im Folgenden wird die Energiedosis in der Schilddrüse kurz mit Schilddrüsendosis bezeichnet.
2.2.2 Primäre Hypothyreose
Eine Hypothyreose wird als primär bezeichnet, wenn eine Störung der Schilddrüse Ursache der Erkrankung ist. Subklinische Hypothyreose wird durch einen erhöhten Wert des Thyreotropin (Thyreoideastimulierendes Hormon, TSH) im Serum definiert. Kommen erniedrigtes Thyroxin (T4) und klinische Symptome hinzu, so wird von einer klinischen oder manifesten Hypothyreose gesprochen. Diese Nomenklatur wird hier übernommen, auf einen abweichenden Sprachgebrauch wird explizit in der Kurzzusammenfassung der einzelnen Veröffentlichungen hingewiesen.
Eine Prävalenzstudie in Colorado ergab, dass ca. 9 % der Bevölkerung unter subklinischer Hypothyreose und 0,4 % unter klinischer Hypothyreose leiden (Canaris et al. 2000).
2.2.2.1 Strahlentherapiepatientinnen und -patienten
Laut ICRP 118 (ICRP 2012a) können direkte Schäden an der Schilddrüse nach Strahlentherapie im Halsbereich mit einer Schilddrüsendosis von mehr als 18 Gy zu einer Hypothyreose mit niedrigen T4 und erhöhten TSH-Werten führen. Das Erkrankungsrisiko ist einige Jahre nach der Strahlenexposition am höchsten.
Boomsma et al. analysierten fünf Studien des Risikos für Hypothyreose nach Strahlentherapie mit 57 bis 390 Patientinnen und Patienten (Boomsma et al. 2011). Gegenüber nichtexponierten Personen war das Risiko um 23 % bis 53 % erhöht. Zwei der Studien fanden eine Assoziation des Risikos mit Parametern der Dosis-Volumen-Verteilungen. Es war Boomsa et al. nicht möglich, aus den Veröffentlichungen eine Dosisschwelle für strahleninduzierte Hypothyreose abzuleiten.
Vogelius et al. führten Meta-Analysen von Studien zur Hypothyreose nach Strahlentherapie mit Schilddrüsendosen über 20 Gy durch, in denen es Angaben zum Odds Ratio oder zur Dosis-Wirkungsbeziehung gab (Vogelius et al. 2011). Ein erhöhtes Risiko für Hypothyreose nach Strahlentherapie ergab sich für Frauen mit einem Odds Ratio von 1,6 (95 %-KI: 1,3 - 1,9) relativ zu Männern. Zur Analyse der Dosis-Wirkungsbeziehung standen Vogelius et al. entsprechend der von ihnen definierten Kriterien vier Studien zur Verfügung. Allerdings waren die Ergebnisse der verschiedenen Studien zur Dosisabhängigkeit sehr heterogen. Vogelius et al. schreiben die Heterogenität Unterschieden des Followups der Patientinnen und Patienten zu. Nach ihrer Analyse mit einer logistischen Funktion lag das Risiko einer Hypothyreose Erkrankung von 50 % bei einer Organ-Äquivalentdosis der Schilddrüse von 45 Gy (95 %-KI: 28 Gy; 62 Gy) und von 10 % bei ca. 27 Gy (Abbildung 2.2). Der letztere Wert ist mit einer großen Unsicherheit behaftet, da nur zwei der berücksichtigten Studien Angaben zu Dosiswerten unterhalb von 30 Gy beinhalten, und zwar jeweils nur einen Datenpunkt.
Abbildung 2.2: Meta-Analyse von vier Studien des Hypothyreose-Risikos nach Strahlentherapie als Funktion der Schilddrüsendosis (aus Vogelius et al. 2011)
Lin et al. untersuchten 18 Monate lang Schilddrüsenhormone nach Strahlentherapie von 65 Patientinnen und Patienten mit Krebs im Nasen-Rachenraum (Lin et al. 2013). In der Gruppe mit Schilddrüsendosen größer als 70 Gy betrug die Hypothyreose-Inzidenz 59 % (13 Fälle unter 22 Patientinnen und Patienten), in der Gruppe mit kleineren Dosen 5 % (2 Fälle unter 43 Patientinnen und Patienten).
Rønjom et al. analysierten das Risiko für Hypothyreose in 203 Strahlentherapiepatientinnen und -patienten mit Plattenepithelkarzinomen im Kopf-Hals-Bereich (Rønjom et al. 2013). Sie modellierten die Inzidenz in Abhängigkeit von der mittleren Energiedosis in den am höchsten exponierten Schilddrüsenbereichen mit vorgegebenen Volumina. Für das größte der Volumina (25 cm3 wird eine Inzidenz von 25 % ab einer Dosis von 61 Gy erreicht.
Akgun et al. fanden unter 100 Patientinnen und Patienten mit Strahlentherapie im Halsbereich eine Korrelation zwischen der mittleren Schilddrüsendosis und einer auf die Exposition folgende Hypothyreose (p = 0,03) (Akgun et al. 2014). Für die 52 Patientinnen und Patienten mit Hypothyreose lag die Dosis im Bereich von 3,8 Gy bis 66,5 Gy mit einem Mittelwert von 56,2 Gy, für die 48 Patientinnen und Patienten ohne Hypothyreose im Bereich von 5,7 Gy bis 67,3 Gy mit einem Mittelwert von 44,2 Gy.
Kim et al. untersuchten die Schilddrüsenfunktion vor und bis zu zwei Jahren nach Strahlentherapie von 114 Patientinnen und Patienten mit Krebstumoren im Kopf-Hals-Bereich (Kim et al. 2014). Bei 46 % der Patientinnen und Patienten wurde Hypothyreose mit einer mittleren Latenzzeit von acht Monaten festgestellt. In einer multivariaten Datenanalyse erwies sich das Volumen mit einer Schilddrüsendosis von mehr als 45 Gy als einziger unabhängiger Prädiktor für Hypothyreose mit einem Schwellenwert für das Volumen von 50 %. Bei Patientinnen und Patienten mit Dosen größer 45 Gy in weniger als der Hälfte der Schilddrüse betrug die Inzidenz innerhalb des ersten Jahres nach Therapie 22,8 %, bei den anderen Patientinnen und Patienten 56,1 %.
Fujiwara et al. analysierten Daten von 116 überwiegend männlichen Strahlentherapiepatienten mit Krebstumoren im Kopf-Hals-Bereich (Fujiwara et al. 2015). Patienten mit einer mittleren Schilddrüsendosis von weniger als 30 Gy hatten eine signifikant niedrigere Hypothyreose-Inzidenz als die Patienten mit höheren Dosen.
Lee et al. rekrutierten 149 Patientinnen und Patienten mit nichtmetastatischen Krebstumoren im Nasen-Rachenraum, die mit intensitätsmodulierter Strahlentherapie behandelt wurden (Lee et al. 2016). Sie definieren klinische Hypothyreose durch klinische Symptome und das Vorliegen entweder einer Erhöhung des TSH-Wertes oder einer Erniedrigung des T4-Wertes. Bei einer mittleren Untersuchungsdauer von 3,1 Jahren entwickelten 21 (14,1 %) der Patientinnen und Patienten eine klinische Hypothyreose. Sowohl das Schilddrüsenvolumen mit weniger als 60 Gy, als auch dasjenige mit weniger als 45 Gy waren Prädiktoren für das Ausbleiben einer Hypothyreose.
Rønjom fasste drei Studien zur Modellierung des Hypothyreose-Risikos nach Strahlentherapie zusammen (Rønjom 2016). Sowohl die Größe der Schilddrüse (je kleiner desto höher das Risiko) als auch die Höhe der mittleren Schilddrüsendosis beeinflussen das Risiko.
Wolny-Rokicka et al. führten eine randomisierte prospektive Studie der Hypothyreose unter zwei Gruppen von Brustkrebspatientinnen durch (Wolny-Rokicka et al. 2016). Die Schilddrüsenfunktion wurde vor und regelmäßig nach der Strahlentherapie untersucht. Die mittlere Schilddrüsendosis in der ersten Gruppe, die aus 38 Patientinnen mit einer Bestrahlung der Wunde nach brusterhaltender Therapie bestand, betrug 0,2 Gy. Die mittlere Dosis in der zweiten Gruppe mit 32 Patientinnen mit supraklavikularer Strahlentherapie war 19 Gy. In dieser Gruppe erhöhte sich die Hypothyreose-Prävalenz innerhalb von zwei Jahren um 6 %. In der ersten Gruppe blieb die Prävalenz unverändert.
Kanyilmaz et al. bestimmten Schilddrüsenparameter von 243 Brustkrebspatientinnen und fanden bei einer mittleren Beobachtungszeit von 41 Monaten nach Strahlentherapie eine Hypothyreose Inzidenz von 21 % (51 Fälle) (Kanyilmaz et al. 2017). In einer multivariablen Analyse war die mittlere Schilddrüsendosis mit einem Schwellenwert von 21 Sv der einzige Prädiktor.
Zhai et al. fanden unter 138 Strahlentherapiepatientinnen und -patienten mit Krebs im Nasen-Rachenraum bei einer mittleren Followup Periode von 38,1 Monaten eine Inzidenz primärer Hypothyreose von 28,9 % (39 Fälle) (Zhai et al. 2017). Patientinnen und Patienten mit einer mittleren Schilddrüsendosis von mehr als 45 Gy hatten eine 4,9-mal höher Hypothyreose-Inzidenz als diejenigen mit einer niedrigeren Dosis.
El-Shebiney et al. untersuchten unter 78 Strahlentherapiepatientinnen und -patienten mit Krebs im Kopf-Hals-Bereich die Abhängigkeit der Hypothyreose-Prävalenz von der Dosisverteilung in der Schilddrüse (El-Shebiney et al. 2018). Das Volumen der Schilddrüse mit einer Energiedosis von mindestens 30 Gy erwies sich als ein Prädiktor für die Erkrankung. Von den Patientinnen und Patienten, bei denen weniger als 24,1 % der Schilddrüse mit mehr als 30 Gy exponiert wurden, erkrankten 29,4 % an Hypothyreose. War ein größeres Volumen der Schilddrüse mit mehr als 30 Gy exponiert, so erkrankten 71,4 %.
Inskip et al. analysierten Daten zu Hypothyreose-Erkrankungen unter 12.015 Patientinnen und Patienten in der Childhood Cancer Survivor Study mit einer Krebsdiagnose und -therapie im Zeitraum 1970 bis 1986 in 26 Kliniken in den USA und in Kanada (Inskip et al. 2018). Bei der ersten Strahlentherapie war das Alter der Patientinnen und Patienten 0 bis 20 Jahre; das mittlere Alter war acht Jahre. Die Studie basiert auf einer Selbstauskunft der Patientinnen und Patienten auf die Fragen "Have you ever been told by a doctor or other health care professional that you have or have had an underactive thyroid gland (hypothyroid)?" und "If yes, age at first occurrence?". Die Studie erlaubt also keine Bewertung des Schweregrades der Erkrankung. Allerdings nahmen 79 % der Kohortenmitglieder, die angaben, eine Ärztin oder ein Arzt hätte ihnen eine Hypothyreose bescheinigt, auch entsprechende Medikamente.
Für die Analyse der Inzidenz berücksichtigten Inskip et al. nur solche Hypothyreose-Erkrankungen als Fälle, die fünf oder mehr Jahre nach der ersten Strahlentherapie diagnostiziert wurden. Zwischen den beiden Befragungen in den Zeiträumen 1992 bis 2003 und 2007 bis 2009 wurden 777 Fälle gemeldet. Dies entspricht einer Inzidenz I von 777/12.015 = 0,06 (d. h. 6 %). Die mittlere Dauer des Followup betrug 16 Jahre. Mit Ausnahme von Bleomycin fanden die Autoren keine Abhängigkeit des relativen Strahlenrisikos von der Chemotherapie. Relativ zur Altersgruppe jünger als fünf Jahre bei erster Strahlentherapie, war das relative Strahlenrisiko in der Altersgruppe fünf bis neun Jahre 0,60 und in der Altersgruppe größer neun Jahre 0,56. Die Autoren schätzen, dass 33 % der Inzidenz spontane Fälle (I0 = 2 %) sind und 57 % der Strahlentherapie sowie 9 % der Chemotherapie zuzuschreiben sind. In der niedrigsten Dosiskategorie mit mittleren Werten der Schilddrüsendosis von 0,3 Gy und der Hypophysendosis von 0,1 Gy ergibt die kategoriale Analyse nach Adjustierung für Chemotherapie und Krebsart eine relative Inzidenz von I/I0 = 1,3 (95 %-KI: 0,8 - 2,0) 8). Nach dem von Inskip et al. (Inskip et al. 2018) entwickelten mathematischen Modell ist die relative Inzidenz in der niedrigsten Dosiskategorie für Patientinnen und Patienten ohne Chemotherapie 1,1. Der Mittelwert der beiden Ergebnisse, eine relative Inzidenz von 1,2, entspricht einer mit der Exposition assoziierten Inzidenz Ir von ca. 0,4 % 9). Nach Auskunft der Autoren hat die Hypophysendosis von 0,1 Gy einen vernachlässigbaren Einfluss auf das Strahlenrisiko. 10) Insgesamt ist die Risikoschätzung mit einer großen Unsicherheit behaftet.
2.2.2.2 Durch Umweltkontaminationen exponierte Personen
Ostroumova et al. analysierten die Prävalenz subklinischer Hypothyreose (Serum TSH-Konzentration > 4,0 mIU I-l ) unter Personen, die in ihrer Kindheit oder Jugend beim Reaktorunfall von Tschernobyl freigesetztes Radioiod inkorporiert hatten (Ostroumova et al. 2009 und 2013). Die Iodaktivität in der Schilddrüse der Kohortenmitglieder wurde innerhalb der ersten zwei Monate nach dem Unfall gemessen.
In der Ukraine betrug die mittlere Schilddrüsendosis der Kohortenmitglieder 790 mGy (Ostroumova et al. 2009). Unter den untersuchten 11.853 Personen wurden im Zeitraum 1998 bis 2000 insgesamt 719 Fälle von Hypothyreose diagnostiziert. Dies entspricht einer Prävalenz von 6 %. Es wurde eine signifikante Assoziation der Prävalenz mit der Organ-Äquivalentdosis in der Schilddrüse gefunden. In einem linearen Modell betrug das zusätzliche Odds Ratio je Dosis, EOR/D, 0,10 (95 %-KI: 0,03 - 0,21) Gy-1; die zusätzliche Prävalenz, Pr = P/(1+1/EOR), beträgt demnach bei einer Schilddrüsendosis, D, von 790 mGy: 0,4 %. Es wurde keine Abhängigkeit des Strahlenrisikos vom Alter bei Exposition beobachtet. Die mit dem Modell abgeschätzte Hintergrundprävalenz der Hypothyreose nimmt mit dem Lebensalter ab. Die Autoren geben keine Erklärung für diese unerwartete Beobachtung.
In Belarus betrug die mittlere Schilddrüsendosis der Kohortenmitglieder 540 mGy (Ostroumova et al. 2013). Unter den untersuchten 10.827 Personen wurden im Zeitraum 1996 bis 2003 insgesamt 319 Fälle von Hypothyreose diagnostiziert. Dies entspricht einer Prävalenz von 3 %. Es wurde eine signifikante Assoziation der Prävalenz mit der Organ-Äquivalentdosis in der Schilddrüse gefunden. In einem linearen Modell betrug das zusätzliche Odds Ratio je Dosis 0,34 (95 %-KI: 0,15 - 0,62) Gy-1. Das Strahlenrisiko nahm stark mit dem Alter bei Exposition ab. Wie auch in der vorangegangenen Studie nimmt die Hintergrundprävalenz mit dem Lebensalter ab.
2.2.2.3 Beruflich Exponierte
Kindler et al. untersuchten die Schilddrüsenfunktion von 71 männlichen Kernkraftwerksarbeitern mit kumulativen effektiven Dosen im Bereich von 70 mSv bis 400 mSv und verglichen die Werte mit denen von 670 Männern ohne berufliche Strahlenexposition (Kindler et al. 2006). Sie fanden im Serum der Exponierten erhöhte TSH-Werte (somit nach der älteren englischsprachigen Definition: Hypothyreose). Die Autoren machen keine Hinweise auf eventuelle speziell erhöhte Expositionen der Schilddrüse der Kernkraftwerksarbeiter wie durch Inkorporationen von radioaktivem Iod. Der Befund der Studie entspricht nicht den Erwartungen, da Kernkraftwerksarbeiter in der Regel im Wesentlichen durch externe Strahlung exponiert sind. Unter der Annahme wesentlich externer Expositionen lag die Schilddrüsendosis der an der Studie beteiligten Arbeiter im Bereich von 70 mGy bis 400 mGy. Für solch niedrige Expositionen wurde in keiner anderen Veröffentlichung eine Erhöhung der TSH-Werte berichtet.
2.2.2.4 Tierexperimente
Die ICRP (ICRP 2012a) zitiert Studien mit Langzeitexpositionen von Hunden mit externer Gammastrahlung, in denen Schilddrüsendosen im Bereich von 2,4 Gy bis 3,8 Gy zu einer Unterfunktion der Schilddrüse führten. In diesen Studien wurden auch umfangreiche strukturelle Schäden der Schilddrüse festgestellt.
Pajer und Kalisnik exponierten erwachsene BALB/c-Mäuse mit fünf täglichen Fraktionen à 0,8 Gy externer Strahlung (Pajer und Kalisnik 1991). Histologische Untersuchungen 320 Tage nach Exposition ergaben keinen Hinweis auf Veränderungen der Schilddrüse.
Abbildung 2.3: T4 und TSH im Serum von Sprague-Dawley-Ratten als Funktion der Schilddrüsendosis 24 Stunden nach Injektion einer Salzlösung mit unterschiedlicher 131I-Konzentration (aus Rudqvist et al. 2017)
Rudqvist et al. injizierten Kochsalzlösungen mit unterschiedlichen Konzentrationen von 131I in die Schwanzvene von 36 Sprague-Dawley-Ratten (Rudqvist et al. 2017). Die Schilddrüsendosen lagen im Bereich von 0 Gy bis 3 Gy. Messungen von TSH- und T4-Konzentrationen wurden im Blutplasma von 24 Stunden nach Injektion vorgenommen. In der Dosisgruppe 57 mGy war T4 signifikant erhöht, in der Dosisgruppe 220 mGy signifikant erniedrigt (Abbildung 2.3). Alle anderen Werte waren im Normalbereich.
2.2.3 Hyperthyreose
Die ICRP (ICRP 2012a) gibt an, dass sich Hyperthyreose acht Jahre nach Strahlentherapie mit Schilddrüsendosen größer als 35 Gy entwickeln kann. Dies sei jedoch sehr selten. Der SSK ist keine neuere Literatur über Erhöhung des Risikos für Hyperthyreose nach Strahlenexposition bekannt.
2.2.4 Akute Thyreoiditis
Die ICRP-Publikation 118 (ICRP 2012a) beschreibt akute Thyreoiditis als Folge von Strahlenexposition der Schilddrüse mit extrem hohen Organ-Äquivalentdosen. Strahlenthyreoiditis ist eine schmerzhafte Schilddrüsenentzündung, die in seltenen Fällen während (Nishiyama 1996) und in Folge (ICRP 2012a) einer Strahlentherapie im Kopf-Hals-Bereich oder einer Radioiodtherapie beobachtet wurde. Durch die Entzündung kann es zu einer vorübergehenden Schilddrüsenüberfunktion kommen. Die Entzündung klingt ohne Behandlung nach einigen Tagen bis Wochen spontan ab.
Der SSK ist keine neuere Literatur zum Thema akuter Thyreoiditis nach Strahlenexposition bekannt.
2.2.5 Autoimmune Thyreoiditis
Autoimmune Thyreoiditis bezeichnet chronische Entzündungen der Schilddrüse, die durch eine Fehlreaktion der Immunabwehr verursacht sind. Dazu gehören unter anderen die Hashimoto-Thyreoiditis und Morbus Basedow. Bezüglich autoimmuner Thyreoiditis verweist die ICRP-Publikation 118 (ICRP 2012a) nur auf die Widersprüchlichkeit der Aussagen in der Literatur. Da die autoimmune Thyreoiditis für eine Empfehlung über einen Grenzwert der Organ-Äquivalentdosis in der Schilddrüse relevant sein könnte, wird in dieser Wissenschaftlichen Begründung auch explizit auf die ältere Literatur eingegangen.
Die Definition autoimmuner Thyreoditis ist nicht einheitlich. In der Regel spielen dabei Erhöhungen der Thyreoperoxidase-Antikörper (englisch TPOAb), der Thyreoglobulin-Antikörper (englisch TgAb), des TSH, und/oder sonographische oder tastbare Hinweise auf Schilddrüsenanomalitäten eine Rolle.
2.2.5.1 Atombombenüberlebende
Imaizumi et al. untersuchten im Zeitraum von 2000 bis 2003 die Schilddrüsenfunktion von 4.091 Überlebenden der Atombombenexplosionen über Hiroshima und Nagasaki (Imaizumi et al. 2006). Für 3.185 der Überlebenden waren rekonstruierte Schilddrüsendosen 11) bekannt, davon hatten 43 % Dosen kleiner als 5 mGy und 16 % größer als 1 Gy erhalten. Die Autoren fanden keine signifikanten Dosis-Wirkungsbeziehungen für Autoimmunerkrankungen der Schilddrüse, weder für Erhöhungen von Thyreoperoxidase-Antikörpern oder von Thyreoglobulin-Antikörpern noch für die Basedow-Krankheit.
2.2.5.2 Durch Umweltkontaminationen exponierte Personen
Davis et al. untersuchten Erkrankungen der Schilddrüse von 3.440 Personen, die im Kindesalter durch radioaktive Freisetzungen des Hanford-Testgeländes exponiert wurden (Davis et al. 2004). Die Verteilung der rekonstruierten Schilddrüsendosen durch 131I hatte einen Medianwert von 97 mGy und einen arithmetischen Mittelwert von 174 mGy. Es ergab sich kein signifikanter Zusammenhang von autoimmuner Thyreoiditis-Erkrankung und Schilddrüsendosis.
Tronko et al. bestimmten im Zeitraum 1998 bis 2000 die Prävalenz autoimmuner Thyreoiditis unter 12.240 Personen, die im Kindes- oder Jugendalter im Jahre 1986 durch radioaktive Freisetzungen während des Reaktorunfalls von Tschernobyl exponiert wurden (Tronko et al. 2006). Die Verteilung der rekonstruierten Schilddrüsendosen hatte einen geometrischen Mittelwert von 0,26 Gy und einen arithmetischen Mittelwert von 0,79 Gy. Es ergab sich kein signifikanter Zusammenhang autoimmuner Thyreoiditis-Erkrankungen mit der Schilddrüsendosis. Allerdings wurden leichte Erhöhungen von Thyreoperoxidase-Antikörpern beobachtet, die mit der Dosis korreliert waren. Die Autoren zogen die Schlussfolgerung, dass dies möglicherweise eine Vorstufe für spätere, klinisch relevante Schilddrüsenerkrankungen sein könne.
Agate et al. untersuchten das im Zeitraum 1999 bis 2001 genommene Serum von 1.433 zwischen Januar 1982 und Oktober 1986 geborenen Personen, die entweder in nach dem Reaktorunfall von Tschernobyl kontaminierten oder in nichtkontaminierten Ortschaften in der Ukraine, Belarus oder Russland wohnten (Agate et al. 2008). Die Autoren machen keine Angaben zur Höhe der Organ-Äquivalentdosis in der Schilddrüse der untersuchten Personen. In Belarus waren Thyreoperoxidase-Antikörper in den kontaminierten Ortschaften höher als in den nichtkontaminierten Ortschaften. Allerdings zeigten sich in der Ukraine und in Russland zwischen den kontaminierten und den nichtkontaminierten Ortschaften keine Unterschiede der Thyreoperoxidase-Antikörper. Thyreoglobulin-Antikörper waren in kontaminierten belarussischen und ukrainischen Ortschaften erhöht, allerdings nicht in kontaminierten russischen Ortschaften. Bis auf wenige Ausnahmen war die Schilddrüsenfunktion in allen untersuchten Gruppen normal. Die Autoren schlussfolgern, dass ihre Daten Hinweise auf eine vorübergehende autoimmune Reaktion der Schilddrüse durch die Strahlenexposition hindeuten ohne eine Thyreoiditis zu bewirken. Um dieses zu bestästigen, seien allerdings Untersuchungen mit längerer Beobachtungszeit notwendig.
2.2.5.3 Beruflich Exponierte
Völzke et al. untersuchten in einer Querschnittsstudie Schilddrüsenwerte von 2.187 weiblichen und 2.122 männlichen Personen (Völzke et al. 2005). Von den Frauen gaben 40 eine berufliche Strahlenexposition an, von den Männern 120. Die Autoren vermuten, dass externe Quellen den wesentlichen Beitrag zur Strahlenexposition der Studienteilnehmer beitrugen. Vier (10 %) der beruflich strahlenexponierten Frauen hatten eine autoimmune Schilddrüsenerkrankung, und diese Rate war signifikant höher als unter den anderen Frauen. Die Thyreoperoxid-Antikörper waren allerdings unter den beruflich strahlenexponierten Frauen nicht erhöht. Für keinen der beruflich strahlenexponierten Männer wurde eine autoimmune Schilddrüsenerkrankung diagnostiziert.
In der Studie von Kindler et al. wurde unter den Kernkraftwerksarbeitern keine erhöhte Prävalenz von autoimmunen Schilddrüsenerkrankungen gefunden (Kindler et al. 2006, siehe Abschnitt 2.2.2.3).
2.2.6 Zusammenfassende Bewertung
2.2.6.1 Primäre Hypothyreose
Die ICRP (ICRP 2012a) gibt an, dass strahleninduzierte Hypothyreose in der Regel nicht bei Schilddrüsendosen unterhalb von 18 Gy auftritt. Die Meta-Analyse von Vogelius et al. deutet an, dass das Hypothyreose-Risiko nach Strahlentherapie mit einer Schilddrüsendosis von 20 Gy bei ca. 5 % liegt (Vogelius et al. 2011). Diese Ergebnisse beziehen sich im Wesentlichen auf Expositionen älterer Erwachsener und werden durch neuere Studien bestätigt.
In einer Studie von mindestens Fünf-Jahre-Überlebenden nach Strahlentherapie von Kindern, Jugendlichen und jungen Erwachsenen lag die mit der Strahlenexposition assoziierte Hypothyreose in der niedrigsten Dosisgruppe bei ca. 0,4 % (Inskip et al. 2018). Die mittlere Schilddrüsendosis in der Dosisgruppe betrug 300 mGy. Das mittlere Alter bei der ersten Strahlentherapie lag bei acht Jahren. Das Risiko in der Altersgruppe über neun Jahren war nur unwesentlich geringer als das Risiko in der gesamten Kohorte. Die mittlere Beobachtungdauer betrug 16 Jahre. Es ist davon auszugehen, dass in den Folgenjahren weitere strahlenbedingte Hypothyreosefälle aufgetreten sind und weiter auftreten. Die SSK schließt von diesen Ergebnissen auf ein Hypothyreose-Risiko in der Größenordnung von 1 % nach Exposition junger Erwachsener mit einer Energiedosis in der Schilddrüse von 550 mGy. Die Studie basiert auf einer Befragung der Patientinnen und Patienten und erlaubt keinen Rückschluss auf den Schweregrad der Erkrankung.
Die beiden Studien der Prävalenz subklinischer Hypothyreose unter Personen, die während ihrer Kindheit oder Jugend durch den Reaktorunfall von Tschernobyl exponiert wurden, ergaben eine unterschiedliche Abhängigkeit des Strahlenrisikos vom Alter bei Exposition (Ostroumova et al. 2009 und 2013). Während die Daten für die ukrainische Kohorte keine Abhängigkeit ergaben und damit auf ein - wenn auch kleines - Risiko für Expositionen im jungen Erwachsenenalter schließen lassen, fiel das Strahlenrisiko in der belarussischen Kohorte stark mit Alter bei der Exposition, wonach eine Exposition im jungen Erwachsenenalter nur zu einem vernachlässigbaren Strahlenrisiko führt. Beide Studien weisen auf eine geringeres Hypothyreose-Risiko nach einer Exposition der Schilddrüse mit einer Dosis von 550 mGy hin als die Studie von Inskip et al. (Inskip et al. 2018). Wegen der widersprüchlichen Ergebnisse der beiden post-Tschernobyl-Studien bezüglich der Abhängigkeit des Strahlenrisikos vom Alter bei Exposition und wegen der ihnen gemeinsamen aber nicht erklärten Abnahme der Hintergrundprävalenz der Hypothyreose mit dem Lebensalter verzichtet die SSK auf Schlussfolgerungen von diesen Studien auf das Strahlenrisiko junger Erwachsener.
2.2.6.2 Hyperthyreose
Eine erhöhte Inzidenz der Hyperthyreose nach Strahlenexposition wurde nach ICRP 118 (ICRP 2012a) nur für Organ-Äquivalentdosen in der Schilddrüse größer als 35 Sv beobachtet.
2.2.6.3 Akute Thyreoiditis
Akute Thyreoiditis wurde nur nach Expositionen mit extrem hohen Dosen der Schilddrüse, d. h. nach Strahlentherapie im Kopf-Hals-Bereich und nach Radioiodtherapie, beobachtet.
2.2.6.4 Autoimmune Thyreoiditis
Insgesamt gibt es keine Evidenz für eine Erhöhung autoimmuner Thyreoiditis nach Strahlenexposition der Schilddrüse mit einer Energiedosis in der Größenordnung von 1 Gy und darunter (Tabelle 2.1). Die Studien über Thyreoperoxid- und Thyreoglobulin-Antikörper geben eine gemischte Evidenz.
Beschränkt man sich auf Studien mit Dosen unterhalb von 1 Gy, so stehen dem singulären Ergebnis für autoimmune Thyreoiditis unter beruflich strahlenexponierten Frauen zwei Studien für beruflich strahlenexponierte Männer und zwei Studien durch Umweltkontaminationen exponierter Personen gegenüber (Tabelle 2.1). Weiterhin gibt es keine Evidenz für eine Erhöhung der Antikörper.
2.2.7 Implikation für eine Grenzwertsetzung
Die oben diskutierten Veröffentlichungen zu Strahleneffekten in der Schilddrüse beziehen sich auf Röntgen- und Gammastrahlung, für die im Strahlenschutz ein Strahlungswichtungsfaktor von 1 angenommen wird. Der numerische Wert der Energiedosis (in mGy) kann damit dem numerischen Wert der Äquivalentdosis (in mSv) gleichgesetzt werden.
Bei Einhaltung des Grenzwertes für die effektive Dosis in einem Kalenderjahr von 20 mSv beträgt nach Kapitel 1 dieser wissenschaftlichen Begründung die Schilddrüsen-Äquivalentdosis maximal 550 mSv. In der Regel liegen die Dosisbereiche, in denen Erhöhungen nicht-neoplastischer Erkrankungen der Schilddrüse beobachtet wurden, erheblich oberhalb dieses Wertes. Eine Ausnahme bildet die Hypothyreose nach der Exposition junger Erwachsener, für die eine Studie auf ein zusätzliches absolutes Hypothyreoserisiko in der Größenordnung von 1 % nach einer Exposition der Schilddrüse mit einer Äquivalentdosis von 500 mSv hindeutet. Die SSK hält diesen Hinweis nicht für hinreichend, einen eigenen Grenzwert für die Äquivalentdosis der Schilddrüse einzuführen. Sie empfiehlt jedoch, diesen Hinweis in die internationale Diskussion von Grenzwerten für Organ-Äquivalentdosen einzubringen und die weitere Entwicklung von Studien zum Hypothyreose-Risiko nach Exposition junger Erwachsener zu beobachten.
Tabelle 2.1: Zusammenfassung der Ergebnisse für autoimmune Thyreoiditis:
"+" steht für signifikante Dosis-Wirkungsbeziehung/Erhöhung unter Exponierten, "-" für kein signifikantes Ergebnis und "k. A." für keine Angabe.
| Veröffentlichung | exponierte Population | Dosis * | Thyreoperoxid- Antikörper | Thyreoglobulin- Antikörper | Autoimmune Thyreoiditis |
| Imaizumi et al. 2006 | Atombombenüberlebende | 1 Gy | - | - | - |
| Davis et al. 2004 | Anwohner Hanford-Testgelände | 0,2 Gy | k. A. | - | - |
| Tronko et al. 2006 | exponiert durch Reaktorunfall von Tschernobyl: Ukraine | 1 Gy | + | k. A. | - |
| Agate et al. 2008 | exponiert durch Reaktorunfall von Tschernobyl: | 1 Gy | |||
| Ukraine | + | + | - | ||
| Belarus | - | + | - | ||
| Russland | - | - | - | ||
| Völzke et al. 2005 | beruflich strahlenexponierte Personen: | ||||
| alle | k. A. | - | k. A. | k. A. | |
| weiblich | k. A. | k. A. | k. A. | +** | |
| männlich | k. A. | k. A. | k. A. | - | |
| Kindler et al. 2006 | männliche beruflich strahlenexponierte Personen | k. A. | - | k. A. | - |
| *) Größenordnung der Schilddrüsendosis der höher Exponierten **) Basierend auf vier Fällen | |||||
2.3 Lymphknoten
Die ICRP-Veröffentlichung 118 (ICRP 2012a) macht keine Angaben zu nicht-neoplastischen Schäden bei Lymphknoten-Bestrahlung, stuft jedoch Lymphozyten generell als strahlenempfindliche Zellen ein.
Die in den folgenden Abschnitten berücksichtigte Literatur ist nicht auf neuere Publikationen eingeschränkt.
Dosisangaben in den Originalarbeiten werden zusätzlich auch als Energiedosis in der Einheit Gy angegeben. Bei manchen älteren Publikationen ist heute nicht mehr nachvollziehbar, welche mit dem Einheitenzeichen "r" angegebene physikalische Messgröße - Ionendosis (in Luft) in "Röntgen" oder Energiedosis in "rad" - verwendet worden ist. In diesen Fällen werden für diese Empfehlung die Angaben der Autoren immer als Ionendosis (in Luft) in "Röntgen" aufgefasst, um in jedem Fall bei einer konservativen Abschätzung zu bleiben. Die Energiedosis (in Luft!) wird dann mit der Beziehung 1 R = 0,869 rad = 0,00869 Gy (in Luft) abgeschätzt und für die weiteren Betrachtungen benutzt. Damit ist sichergestellt, dass ein beobachteter Effekt nicht einer höheren Energiedosis zugeordnet wird als tatsächlich vorgelegen hat. In den Fällen, in denen von den Autoren mit dem Einheitenzeichen "r" tatsächlich die Energiedosis in "rad" gemeint war, wird die einem beobachteten Effekt zugeordnete Energiedosis durch die Umrechnung um etwa 13 % abgesenkt. Dies ist im Sinne des Strahlenschutzes unschädlich, da konservativ.
2.3.1 Grundlagen
Das lymphatische System besteht aus einem Netzwerk von Lymphgefäßen, das primäre (zentrale) Lymphorgane mit sekundären (peripheren) lymphatischen Organen verbindet (Schünke et al. 2015, Lüllmann-Rauch 2015). In den primären Organen, Thymus und Knochenmark, differenzieren sich Vorläuferzellen zu immunkompetenten Lymphozyten.
Das periphere Lymphgewebe umfasst sowohl Schleimhautassoziierte lymphatische Zellen als auch organisierte feste Strukturen. Das periphere Lymphgewebe enthält eine große Zahl nicht stationärer Leukozyten sowie in geringerem Umfang nichtmobile Nebenzellen, die feste retikuläre Strukturen bilden und für anatomische Stabilität sorgen. Das diffuse periphere Lymphgewebe liegt am Epithel der intestinalen, respiratorischen und urogenitalen Organe an, wo es als Barriere gegen Infektionen dient.
Abgegrenzte Follikel kommen im peripheren Lymphsystem einzeln oder als miteinander verbundene Elemente vor, die größere Strukturen wie die Milz, Tonsillen, Peyer-Plaques oder Lymphknoten bilden. Hier kommt es durch Kontakt mit Fremdkörpern und Antigenen zur Vermehrung und Aktivierung von bereits immunkompetenten Lymphozyten.
Bei den Lymphfollikeln sind zwei Morphologien zu unterscheiden. Primäre Follikel enthalten eine dichte homogene Masse von Lymphozyten, während sekundäre Follikel ein weniger dichtes Keimzentrum besitzen, das von einer Schicht dicht gepackter proliferierender Lymphozyten umgeben ist. Das Keimzentrum enthält antigenpräsentierende Zellen und B-Lymphozyten, die in die Lymphzirkulation übergehen können. Lymphknoten sind Teil des peripheren Lymphgewebes. Sie bilden ovale bis nierenförmige Strukturen einer Größe von wenigen mm bis zu ca. 1,5 cm, die sich entlang der Lymphgefäße von peripher (organnah) bis zentral (Einmündung in den Venenwinkel) nahezu im ganzen Körper befinden. Histologisch bestehen Lymphknoten aus mehreren Follikeln, die von einer Bindegewebskapsel umgeben sind, die Elastin und selten auch glatte Muskelzellen enthält. Das lymphoretikuläre Gewebe kann in drei Schichten gegliedert werden, Cortex (Rinde), Paracortex und Medulla (Mark). Der äußere Cortex umfasst primäre wie sekundäre B-Zell-Follikel, die innere Medulla sowohl B-Zellen, Makrophagen, Granulozyten und Plasmazellen. Der Paracortex zwischen Cortex und Medulla enthält viele dort reifende T-Lymphozyten. Durch ein ausgeprägtes Sinussystem kann die Lymphe abfließen.
Lymphknoten sind verantwortlich für die "Filterung" der Lymphe. Diese wird vom Interstitium der Haut, der Unterhaut, den Muskeln, Gelenken, Knochen und den inneren Organen über blind endende Lymphkapillare und die Lymphgefäße zu den Lymphknoten transportiert. Im Normalzustand besteht ein Gleichgewicht zwischen der durch die Blutgefäße in das Interstitium infiltrierten Flüssigkeit und ihrem Abtransport aus dem Interstitium. Der Abtransport erfolgt über die Lymphbahnen bis in den linken und rechten Venenwinkel zurück in die Blutbahn.
Primäre (regionäre) Lymphknoten nehmen die Lymphe als erste "Filterstation" eines Lymphabflussgebiets auf. Der erste Lymphknoten eines Lymphabflussgebiets wird als Sentinel- bzw. Wächter-Lymphknoten bezeichnet. Sekundäre Lymphknoten sammeln die Zuflüsse aus mehreren primären Lymphknoten und damit aus mehreren Gebieten.
2.3.2 Histologische und morphologische Strahleneffekte an Lymphknoten
Einzelne Lymphozyten wurden bereits früh als sehr strahlenempfindlich eingestuft (Congdon 1966, Heineke 1905), in vitro kommt es ab 2 rad (0,02 Gy) bis 5 rad (0,05 Gy) zu zytotoxischen Effekten (Fajardo 1994), im Blut von Ratten mit Ganzkörperbestrahlung ab einer Dosis von 25 Roentgen (0,22 Gy). In (Ludvik et al. 1969) wird unter Verweis auf (Zollinger 1960) eine Schädigung von Lymphozyten ab 50 Roentgen (0,43 Gy) berichtet.
2.3.2.1 Ganzkörperbestrahlung in Tierversuchen
Bei der Maus kommt es bei einer Ganzkörperbestrahlung mit 1 x 950 r (8,3 Gy) zu einer schnellen Abnahme des Gewichts der Lymphknoten (Congdon 1966) mit Zerstörung des Lymphknotenparenchyms mit Rinde und Mark. Nach einer akuten strahleninduzierten Reduktion der Lymphozytenzahl und Schädigung der Lymphknoten kann es anschließend zu einer dosisabhängigen Regeneration kommen. Auch Benninghoff et al. berichten von einer schnellen (sieben Stunden nach Exposition) und 14 Tage andauernden Erschöpfung der Lymphozytenpopulation nach Ganzkörperbestrahlung der Maus mit 1 x 300 rad (2,6 Gy) (Benninghoff et al. 1969). Die Population an B-Lymphozyten ist nach Ganzkörperbestrahlung der Maus mit 1 x 500 rad (4,4 Gy) offenbar schneller erschöpft als die der T-Lymphozyten und regeneriert sich langsamer (Anderson et al. 1977).
In einer umfassenden Studie untersuchte de Bruyn die Wirkung einer Ganzkörperbestrahlung von Kaninchen mit 1 x 600 r (5,2 Gy) 12) bzw. 1 x 800 r (7,0 Gy) (de Bruyn 1948a, de Bruyn 1948b). Dabei stellte 800 r (7,0 Gy) die Dosis dar, bei der 50 % der bestrahlten Tiere innerhalb von 30 Tagen verstarben (LD50(30)). Nach der beschriebenen Ganzkörperbestrahlung kam es zu einer akuten Zerstörung der Lymphknoten-Lymphozyten innerhalb von drei bis acht Stunden, während die Retikulärzellen verblieben. Nach fünf bis neun Tagen erfolgten eine Repopulation mit Lymphozyten und eine Normalisierung des Erscheinungsbilds nach 21 Tagen. Die Rekonstitution des Lymphgewebes war nach 59 Tagen abgeschlossen. Nach Bestrahlung mit 1 x 400 r (3,5 Gy) überlebten einige Lymphozyten, die Schäden an den Lymphknoten waren geringer, und es kam zu einer früheren Repopulation. Nach fünf Tagen zeigten die Lymphknoten ein normales Erscheinungsbild. Bei 1 x 100 r (0,87 Gy) waren erste Schäden erst nach drei Stunden sichtbar, die meisten Lymphknoten erschienen nach 48 Stunden normal. Bei 1 x 50 r (0,43 Gy) waren leichte Schäden im Vergleich zu Kontroll-Lymphknoten vorhanden, nach 27 Stunden normalisierte sich das Erscheinungsbild der Lymphknoten. Nach 1 x 25 r (0,22 Gy)/1 x 12 r (0,10 Gy)/1 x 6 r (0,05 Gy) war kein systematischer Unterschied zwischen Lymphknoten bestrahlter Tiere und Lymphknoten in Kontrollen sichtbar. Die Befunde für Ratten ähnelten denen bei Kaninchen. Meerschweinchen dagegen zeigten geringere Lymphknotenschäden bei vergleichbarer Dosis relativ zu LD50(30).
Bei Ganzkörperbestrahlung von Hunden mit 1.200 Roentgen (10 Gy) zeigten sich ein Zellverlust im kortikalen und medullären Bereich der Lymphknoten sowie ein vergrößertes Sinussystem (Nelson et al. 1976).
2.3.2.2 Lokale Bestrahlung in Tierversuchen
In einer umfangreichen Studie (Engeset 1966) wurden insgesamt ca. 1.300 Ratten lokal mit 1 x 3.000 r (26 Gy) 13) am Lymphknoten der Kniekehle bestrahlt und mit Kontrolltieren verglichen. 12 Stunden nach Bestrahlung kam es zu einer Degeneration der Lymphozyten, nach 24 Stunden zu einer beginnenden Repopulation, wobei histologische Unterschiede zu Kontrollen erkennbar blieben. Eine Woche nach Bestrahlung war das Erscheinungsbild der Lymphknoten sehr ähnlich zu Kontrollen. Es fehlten jedoch granulierte Mastzellen, die nach ca. acht Wochen wieder auftraten. Nach 14 Tagen kam es zu einer erneuten Reduktion an Lymphozyten mit einer Zunahme von Bindegewebe und reduziertem Lymphknoten-Gewicht. Nach 16 Wochen zeigte sich eine Atrophie der Kortikalzone mit weniger bzw. kleineren Follikeln. Das Sinussystem blieb intakt. Nach 12 Monaten war eine starke Zunahme von Bindegewebe zu verzeichnen, es kam zu Strukturverlust und zu einer Degeneration des Sinussystems. Ähnliche Ergebnisse mit geringerem Effekt traten nach fraktionierter Bestrahlung auf.
Ähnlich zeigte sich nach lokaler Bestrahlung der Gebärmutter der Maus mit 1 x 300 rad (3 Gy) eine geringe Reduktion der Lymphozytenzahl in den Lymphknoten mit anschließender schneller Erholung (Benninghoff et al. 1969). Nach 48 Stunden waren keine Unterschiede zu Kontroll-Lymphknoten mehr feststellbar.
Vergleichbare Beobachtungen von Lymphozytenverlust, Atrophie und Fibrose wurden an thorakalen Lymphknoten von Hunden nach interner Exposition durch Inhalation von [239Pu]Plutoniumdioxid gemacht (Muggenburg et al. 1999, Park et al. 2012). Bei höherer Dosis verdrängte eine erhöhte Zahl retikulärer Zellen und Narbengewebe die atrophierte Lymphknotenstruktur (Park et al. 2012). Ebenfalls an Hunden wurden in einer weiteren Studie (Sherman und O'Brien 1967) ähnliche Beobachtungen gemacht. Zwei bis drei Monate nach externer lokaler Bestrahlung der Leistengegend mit 1.000 rad (10 Gy) bis 3.600 rad (36 Gy) in einer (1.000 rad/10 Gy) bzw. drei (2.400 rad/24 Gy, 3.000 rad/30 Gy, 3.600 rad/ 36 Gy) Fraktionen kam es zu Lymphknotenatrophie und Ersatz durch Bindegewebe.
Auch nach lokaler Bestrahlung der Kniekehle von Ratten mit 1 x 500 rad (5 Gy) bis 1 x 3.000 rad (30 Gy) kam es nach 14 Tagen zu einer deutlichen Degeneration der Lymphozyten im Lymphknoten mit dilatiertem Sinussystem und interstitiellem Ödem (Sinha und Goldenberg 1970).
2.3.2.3 Unklare Bestrahlungssituation
Bei einer Reihe von Studien zur Bestrahlung von Lymphknoten ließ sich die Bestrahlungssituation, aus der die folgend berichteten Ergebnisse stammen, nicht anhand der verfügbaren Literatur rekonstruieren. Insbesondere war dies der Fall, wenn in Sekundärarbeiten Bezug auf Originalstudien genommen wurde, ohne deren Methoden zu schildern.
Ein hoher vorübergehender Verlust an Lymphozyten im Lymphknoten innerhalb von 24 Stunden zeigte sich bei einer Dosis von 350 Roentgen (3,0 Gy) bis 800 Roentgen (7,0 Gy) gefolgt von einer dosisabhängigen Restitution der Lymphknoten (4 x 500 Roentgen/4,3 Gy vollständig, 4 x 1.000 Roentgen/8,7 Gy bis 4 x 1.500 Roentgen/13 Gy unvollständig), einer späten progressiven Erhöhung des Bindegewebsanteils in den Lymphknoten und einer zunehmenden Häufigkeit kleiner Lymphknoten (Fajardo 1994, Ludvik et al. 1969, Burge 1975). Die konkrete Bestrahlungssituation lässt sich mangels Verfügbarkeit der Originalliteratur dabei nicht mehr rekonstruieren, ebenso die bestrahlte Tierart. Retikulumzellen als Teil des retikulären Bindegewebes des Lymphknotens wurden als weniger strahlensensibel beschrieben. Histologisch sichtbare Reaktionen wie eine retikuläre Hyperplasie wurden in (Ludvik et al. 1969) mit Verweis auf (Turolla et al. 1960) erst ab 4.000 Roentgen (35 Gy) bis 6.000 Roentgen (52 Gy) fraktionierter Bestrahlung berichtet (bestrahlte Tierart unklar). Auch hohe Dosen führen nicht sicher zur vollständigen Zerstörung aller Lymphknoten, überlebende Lymphknoten wurden selbst nach lokaler Bestrahlung mit 30.000 Roentgen (2,6 · 102 Gy) beobachtet (Ludvik et al. 1969, Zollinger 1960) (bestrahlte Tierart unklar). Die Evidenz zur Neubildung vollständig zerstörter oder entfernter Lymphknoten ist nicht eindeutig (Ludvik et al. 1969). So wurde nach Entnahme von Lymphknoten in der Leistengegend von Schweinen keine Neubildung beobachtet, wohl aber eine Kompensation zerstörter Lymphgefäße (Ludvik et al. 1969).
2.3.2.4 Strahlentherapiepatientinnen und -patienten
Bei fraktionierter Strahlentherapie von Menschen mit 1.000 rad (10 Gy) bis 7.500 rad (75 Gy) Herddosis im Urogenitaltrakt (Ludvik et al. 1969) zeigte sich ein ähnlicher Verlauf wie im Tiermodell mit schnellem Verlust von Lymphozyten und einer verzögerten zweiten Welle von Lymphozyten-Erschöpfung mit folgender Lymphknoten-Atrophie nach ca. sechs Monaten, (siehe auch Jones und Knox 2014). Auch bei anderen Strahlentherapiepatientinnen und -patienten mit fraktionierter Dosis von 4.000 rad (40 Gy) bis 7.000 rad (70 Gy) wurde eine verzögerte progressive Reduktion der Lymphozytenzahl in den Lymphknoten beobachtet, wobei es im Bereich zerstörter Tumorzellen zu eine Fibrose kam (Fajardo 1994).
In einer Untersuchung von strahlentherapeutisch behandelten Lymphknoten der Gebärmutter (Burge 1975) zeigten Lymphknoten mit einer Dosis von weniger als 1.000 rad (10 Gy) keine Unterschiede zu Kontroll-Lymphknoten. Ab 1.500 rad (15 Gy) lokaler Dosis traten gehäuft geschädigte Lymphknoten ohne Keimzentrum auf. Ab 2.000 rad (20 Gy) Dosis waren alle Lymphknoten, die nach 35 Tagen entnommen wurden, geschädigt mit zerstörten Follikeln und fehlendem Keimzentrum. Anzeichen zunehmender Fibrose waren bei Dosen von 3.000 rad (30 Gy) zu beobachten, die sich stärker bis zur vollständigen Zerstörung bei einer Dosis von 4.000 rad (40 Gy) und Entnahme nach mehreren Monaten zeigte (Burge 1975). Die Größe der Follikel nahm ab Dosen von 3.000 rad (30 Gy) progressiv ab.
2.3.3 Lokale Strahleneffekte auf Lymphtransport und Filterfunktion der Lymphknoten
Bei Bestrahlung von Hunden in der Kniekehle zeigten sich bei 2.000 r (17 Gy) keine Unterschiede beim Lymphtransport im Vergleich zu Kontrollen (Dettmann et al. 1966). Ab 6.000 r (52 Gy) war eine teilweise reduzierte Filterfunktion festzustellen. Deutliche Schäden mit Fibrose waren ab 10.000 r (87 Gy) erkennbar.
Die lokale Bestrahlung von Lymphknoten in der Kniekehle von Kaninchen mit 4 x 8 Gy zog eine reduzierte Lymphtransport-Funktion nach einer Woche bis sechs Monaten nach sich (Baker et al. 2014). Fibrose und Verdickung der Lymphknoten-Kapsel folgten nach ein bis sechs Monaten. Es kam in der weiteren Folge zur Entwicklung neuer Lymphgefäße und alternativer Umgehungen.
In einer Studie an lokal mit 1 x 3.000 r (26 Gy) in der Kniekehle bestrahlten Ratten wurden nach 24 Wochen bis 52 Wochen eine Reduktion der Lymphdrainage und eine Umgehung des Kniekehlen-Lymphknoten beobachtet (Engeset 1966). Nach 14 Tagen war eine reduzierte Filterfunktion feststellbar. Ähnliche Ergebnisse mit geringerem Effekt zeigten sich nach fraktionierter Bestrahlung.
Nach lokaler Bestrahlung von Hunden mit 1.000 R (8,7 Gy) bis 3.000 R (26 Gy) zur Kniekehle konnte kein Effekt auf die Filterfunktion des Lymphknotens festgestellt werden (Herman et al. 1968). Ähnliches wurde nach lokaler Bestrahlung von Hunden in der Leiste mit 3.600 rad (36 Gy) berichtet (Sherman und O'Brien 1967), in denen zwei Monate später kein Ödem und kein reduzierter Lymphfluss feststellbar war.
Demgegenüber folgte auf lokale Bestrahlung der Kniekehle von Ratten mit 1 x 500 rad (4,3 Gy) bis 1 x 3.000 rad (30 Gy) verminderter Lymphabfluss sowie bei 3.000 rad (30 Gy) eine reduzierte Filtrationskapazität (Sinha und Goldenberg 1970). Eine erhöhte Zahl von Umgehungen (Anastomosen) von Lymphgefäßen trat bei 1.000 rad (10 Gy) auf.
Nach Brachytherapie der Leiste in Mäusen konnte kein eingeschränkter Lymphtransport festgestellt werden (Pastouret et al. 2014), da es zu Neubildung und Umgehungen (Anastomosen) von Lymphgefäßen kam.
2.3.4 Regional Strahleneffekte auf die Bildung sekundärer Lymphödeme
Das Lymphödem ist eine Beeinträchtigung des Lymphabflusses mit einer resultierenden Ansammlung der Lymphe im Gewebe des Lymphabflussgebiets (Jones und Knox 2014). Der Rückstau verursacht Schwellungen unter der Haut bis in tiefere Schichten, chronische Inflammation sowie Fibrose. Weitere Folgen können eine eingeschränkte Gelenkbeweglichkeit, bakterielle Infektionen durch das lokal dysfunktionale Immunsystem, Lymphzysten sowie Veränderungen der Mimik und Sprach-, Schluck- und Atembeschwerden bei Ödemen im Gesicht sein.
Im Gegensatz zum primären Lymphödem als Folge einer Anlagestörung von Lymphgefäßen entsteht das sekundäre Lymphödem durch andere Prozesse, welche die Lymphbahnen unterbrechen oder die Lymphknoten schädigen. Die häufigste Ursache des sekundären Lymphödems ist einerseits ein Tumorbefall der Lymphgefäße bzw. des umliegenden Gewebes oder eine metastatische Durchsetzung der Lymphknoten selbst, die zu einer reduzierten Transportkapazität führt. Andererseits kann die Krebstherapie zum Lymphödem führen, insbesondere durch das Entfernen befallener Lymphknoten (Lymphadenektomie) und durch die Strahlentherapie (Allam et al. 2020). Lymphödeme können derzeit nicht kurativ behandelt werden.
Bei soliden Tumoren können Lymphabflussgebiete auch als Zielvolumen bestrahlt werden, um dort angesiedelte Tumorzellen zu zerstören, die sich andernfalls über die Lymphgefäße im Körper verbreiten können. Abhängig von der Größe des bestrahlten Volumens, der Strahlendosis, der Durchführung einer Lymphadenektomie und individuellen Risikofaktoren wie Übergewicht ist das sekundäre Lymphödem eine mögliche Spätfolge der Strahlentherapie, wenn Lymphknoten bestrahlt werden. Der Großteil der sekundären Lymphödeme tritt bis 24 Monate nach der Behandlung auf, eine Erkrankung ist jedoch auch mehrere Jahre nach der Therapie möglich (Rockson 2018).
Ein Beispiel ist die Brustkrebstherapie, bei der in Abhängigkeit vom Nodalstatus das axilläre, supraklavikulare oder parasternale Lymphabflussgebiet bestrahlt und die Lymphknoten der Axilla teilweise oder vollständig (Axilladissektion) entnommen werden können. Die berichtete Inzidenz von Lymphödemen nach einer Bestrahlung der gesamten Brust im Rahmen einer Brustkrebserkrankung liegt bei ca. 5 % bis 65 % (Norman et al. 2009, Shah et al. 2012). Entscheidend zur Inzidenz trägt die Anzahl entnommener Lymphknoten bei.
Auch nach der Therapie von Kopf-Hals-Tumoren und Prostatakarzinom treten Lymphödeme auf. Für Kopf-Hals-Tumoren wird nach einer Bestrahlung eine Prävalenz von Lymphödemen von 50 % bis 75 % beschrieben (Büntzel et al. 2007, Deng et al. 2012). Die Prävalenz sekundärer Lymphödeme nach der Therapie einer Prostataerkrankung liegt zwischen 1 % und 20 % (Cosgriff und Gordon 2010).
Vermutlich wegen der zahlreichen Erkrankungs- und Therapie-bezogenen Einflussfaktoren existieren kaum klinische Daten zur Abhängigkeit des Lymphödem-Risikos von der Strahlendosis. In der Therapie von malignen Lymphomen ist das Lymphsystem das primäre Zielvolumen mit Dosen von ca. 30 Gy bis 55 Gy in Fraktionen von 1,5 Gy bis 2 Gy zur Milz und zu den Lymphknoten (Jones und Knox 2014). Die klinische Erfahrung bei diesen Patientinnen und Patienten zeigt, dass das Lymphödemrisiko nach einer konventionell fraktionierten Radiotherapie erst oberhalb von 40 Gy ansteigt.
Speziell um ein Tiermodell für das Lymphödem zu entwickeln, werden bis heute Untersuchungen mit experimenteller Bestrahlung unterschiedlicher Tiere durchgeführt - oft jedoch mit Lymphknoten-Entfernung (Dai et al. 2016, Daley et al. 2010, Das et al. 1981, Sommer et al. 2012, Yang et al. 2014). Hinzu kommen frühere Studien mit der Bestrahlung von Tieren im Rahmen der Krebstherapieforschung und allgemein zur Strahlenreaktion des Körpers in der Begleitforschung zur Atomwaffenentwicklung.
Nach lokaler Bestrahlung von Mäusen am Schwanz mit 1 x 15 Gy bzw. 1 x 30 Gy konnte etwa nach vier Wochen ein erhöhtes Volumen in Form eines milden Ödems festgestellt werden (Avraham et al. 2010). Zur Rückbildung kam es nach 12 bis 24 Wochen, eine persistierende lymphatische Dysfunktion blieb aber erhalten.
An mit 1 x 4.500 rad (45 Gy) lokal in der Leiste bestrahlten Ratten konnten Lymphödeme nur erfolgreich in Kombination der Entfernung von Lymphknoten induziert werden, nicht jedoch mit Bestrahlung allein (Lee-Donaldson et al. 1999). In einer Studie an lokal mit 1 x 3.000 r (26 Gy) in der Kniekehle bestrahlten Ratten wurden ebenfalls keine Ödeme beobachtet (Engeset 1966). Auch bei in der Leiste bestrahlten Hunden wurden fünf bis sechs Monate nach einer Dosis von 2.400 rad (24 Gy) keine Ödeme festgestellt (Sherman und O'Brien 1967). Zwei Monate nach 3.600 rad (36 Gy) war ebenfalls kein Ödem beobachtbar.
2.3.5 Immunfunktion
Für die Auswirkung von Strahlenexposition auf die Immunfunktion ist entscheidend, welche Organe bestrahlt werden und wie groß das bestrahlte Volumen ist. ICRP 118 (ICRP 2012a) erläutert immunsuppressive Effekte von Ganzkörperbestrahlung sowie von Exposition des Knochenmarks und der Thymus-Drüse, den Haupt-Quellen von Vorläuferzellen immunkompetenter Lymphozyten.
Bei Patientinnen und Patienten mit allogener Stammzelltransplantation wird die immunsuppressive Wirkung einer Bestrahlung als Therapie gegen Graftversus-Host-Disease genutzt. Dabei wird häufig die "Total Nodal Irradiation"-Technik verwendet, bei der alle Lymphknotenregionen ober- und unterhalb des Zwerchfells bestrahlt werden. Mit dieser Technik wurden lang anhaltende Immundefizite beobachtet (Hautmann et al. 2015). Auch bei Patienten mit Strahlentherapie beim Prostata-Karzinom kam es nach Bestrahlung des gesamten Beckens mit den dortigen Lymphknoten zu einer andauernden Lymphopenie (Cozzarini et al. 2016). Eine besondere Bedeutung kommt bei der Induktion von Lymphopenie offenbar dem mit mindestens 5 Gy bestrahlten Volumen zu (Saito et al. 2016).
Im Gegensatz zu den dargestellten Effekten bei der Bestrahlung großer Lymphknotenregionen kommt es bei lokaler Radiotherapie mit Exposition einzelner Lymphknoten in der Regel zu keiner andauernden Einschränkung der Immunfunktion. Hier kann der akute lokale Verlust von Lymphozytenzellen mit Zellen aus Thymus und Knochenmark ausgeglichen werden (Jones und Knox 2014).
Tabelle 2.2: Übersicht der Originalarbeiten, die Ergebnisse nach Lymphknotenbestrahlung berichten
| Quelle | Tier | Followup | Strahlenquelle | Zielgebiet | Dosis (aus Manuskript) |
| Anderson et al. 1977 | Maus | 1 bis 30 Tage | extern | Ganzkörper | 1 x 5 / 50 / 500 rad |
| Avraham et al. 2010 | Maus | 12 bis 24 Wochen | kV X-ray | Schwanz | 1 x 15 / 30 Gy |
| Baker et al. 2014 | Kaninchen | 0,25 bis 6 Monate | kV X-ray | Lymphknoten Kniekehle | 4 x 8 Gy |
| Benninghoff et al. 1969 | Ratte | 2 bis 14 Tage | 60Co | Lymphknoten Gebärmutter/ Ganzkörper | 300 rad |
| Cui et al. 2014 | Maus | 4 bis 16 Wochen | kV X-ray | Thorax | 1 x 14 Gy |
| de Bruyn 1948a, de Bruyn 1948b | Ratte, Kaninchen, Meerschweinchen | 30 Minuten bis 4 Monate | X-ray | Ganzkörper | 1 x 6 / 12 / 25 / 100 / 400 / 600 / 800 r |
| Dettmann et al. 1966 Hund | 24 Stunden bis 3 Monate | kV X-ray | Lymphknoten Kniekehle | 1 x 2.000 / 6.000 / 10.000 r | |
| Engeset 1966 | Ratte | 12 Stunden bis 1,7 Jahre | kV X-ray | Lymphknoten Kniekehle/Niere | 1 x 3.000 r, 5 x 600 r |
| Hale et al. 1991 | Ratte | 13 Tage | 60Co | Ganzkörper | 1 x 1,5 / 5 / 7,5 / 9,5 Gy |
| Baker et al. 2014 | Hund | 2 Stunden bis 6 Wochen | kV X-ray | Lymphknoten Kniekehle | 1 x 1.000 / 2.000 / 3.000 R |
| Lee-Donaldson et al. 1999 | Ratte | 1 bis 3,5 Monate | extern | Leiste | 1 x 4.500 rad |
| Muggenburg et al. 1999 | Hund | bis 15 Jahre | [239Pu]PuO2 / 144Ce Inhalation | Lunge | Kumulative Lungendosis > 6,3 Gy ([239Pu]PuO2)/ > 230 Gy 144Ce) |
| Nelson et al. 1976 | Hund | 10 Tage | kV X-ray | Ganzkörper | 1200 R |
| Park et al. 2012 | Hund | 3 bis > 10 Jahre | [239Pu]PuO2 Inhalation | Lunge | Kumulative Lungendosis 0,3 Gy bis 38 Gy |
| Pastouret et al. 2014 | Maus | 0,5 bis 3 Monate | Brachytherapie | Leiste | 1 x 20 Gy |
| Sherman und O'Brien 1967 | Hund | 0,3 bis 2 Jahre | kV X-ray | Hinterlauf/Lymphknoten Leiste | 1 x 1.000/3 x 800/3 x 1.000/ 3 x 1.200 rad |
| Sinha und Goldenberg 1970 | Ratte | 14 Tage | kV X-ray | Lymphknoten Kniekehle | 1 x 500 rad bis 3.000 rad |
| Smith et al. 1967 | Maus | 5 Minuten bis 6 Stunden | kV X-ray | Ganzkörper | 1 x 500 r |
2.3.6 Zusammenfassende Bewertung
Lymphtransport und Filterfunktion der Lymphknoten: Als niedrigste Strahlendosis, die mit einem reduzierten Lymphtransport verbunden war, wurden 5 Gy in einer Studie mit Ratten berichtet. Die Evidenz aus Studien an größeren Säugetieren spricht dafür, dass verminderter Lymphtransport und reduzierte Filtrationskapazität der Lymphknoten erst ab Strahlendosen oberhalb von 10 Gy auftreten.
Sekundäres Lymphödem: Die Evidenz aus Tiermodellen spricht dafür, dass strahlenassoziierte Lymphödeme nur bei sehr hohen Strahlendosen weit oberhalb von 10 Gy und in Kombination mit der Entfernung von Lymphknoten auftreten.
Immunfunktion: Es liegt keine Evidenz zu einer Einschränkung der Immunfunktion in Folge einer Strahlendosis von ca. 1,6 Gy vor.
2.3.7 Implikationen für eine Grenzwertsetzung
Bei Einhaltung des Grenzwertes für die effektive Dosis in einem Kalenderjahr von 20 mSv ist nach Kapitel 1 dieser wissenschaftlichen Begründung bei einer Bestrahlung des Körpers von hinten mit Protonen einer Energie von 40 MeV eine mittlere Organ-Äquivalentdosis der Lymphknoten von ca. 260 mSv möglich. Aufgrund der extrem inhomogenen Dosisverteilung (durch den beobachteten Bragg-Peak) können bei einer solchen Exposition lokal deutlich höhere Werte in Lymphknoten auftreten. Allerdings erlauben die im ersten Kapitel dieser Wissenschaftlichen Begründung verwendeten Organdosis-Konversionsfaktoren nicht ohne weiteres, solche lokalen Dosiswerte zu berechnen. Da sich das Verhältnis der maximalen zur mittleren Dosis in den Lymphknoten wegen deren inhomogener Verteilung im Körper nur schwer, das Verhältnis der maximalen Lymphknotendosis zur Hautdosis jedoch relativ leicht abschätzen lässt, wird für die Überlegungen zur Notwendigkeit eines eigenen Grenzwertes der Äquivalentdosis der Lymphknoten auf den Grenzwert für die Haut-Äquivalentdosis zurückgegriffen. Die maximal zulässige Äquivalentdosis für die Haut gemittelt über eine Hautfläche von einem Quadratzentimeter beträgt pro Jahr 500 mSv. Für Protonenbestrahlung mit 40 MeV entspricht dies einer Energiedosis von 0,25 Gy.
Um das Verhältnis der lokal maximal auftretenden Energiedosis in Lymphknoten zur Energiedosis in der Haut abzuschätzen, hat die SSK Monte-Carlo-Simulationen des Strahlentransports für eine Protonenbestrahlung von hinter Fett- und Muskelgewebe liegenden Lymphknoten mit einer Eintrittsenergie von 40 MeV durchgeführt. Die Energiedosis im Gewebe nimmt bis zu einer Tiefe von ca. 1,6 cm zu und fällt danach schnell auf null ab. Die Energiedosis in einer Tiefe von 0,07 mm wird als eine Näherung für die Energiedosis der Haut angesehen. Sie beträgt im ungünstigsten Fall ca. 16 % der Dosis, die im schmalen Bereich des Bragg-Peaks auftritt. Für eine Energiedosis der Haut von 0,25 Gy beträgt die Energiedosis im relativ schmalen Bereich des Bragg-Peaks in 1,6 cm Tiefe ca. 0,26 Gy/0,16 = 1,6 Gy.
Die mittlere Organ-Äquivalentdosis der Lymphknoten bei Einhaltung des Grenzwerts der effektiven Dosis von 20 mSv liegt in den betrachteten Expositionsszenarien der Inhalation von Radionukliden bei maximal 1,2 Sv. Die zugehörige Energiedosis liegt aufgrund des Wichtungsfaktors > 1 der assoziierten Strahlenart unter 1,2 Gy und ist damit geringer als beim Expositionsszenario mit externer Bestrahlung durch Protonen.
Die unter Einhaltung des Grenzwerts für die Hautdosis erreichbare Energiedosis bei externer Protonenstrahlung von ca. 1,6 Gy in einem Lymphknoten ist weitaus kleiner als Dosiswerte, bei denen Evidenz für strahlenassoziierte nichtneoplastische gesundheitlich relevante Effekte in den Lymphknoten vorliegen.
Daher betrachtet die SSK die Lymphknoten durch Einhaltung der Grenzwerte für die effektive Dosis und für die Haut als ausreichend geschützt.
2.4 Nieren
2.4.1 Grundlagen
Die Niere ist elementar für den Ausscheidungsprozess und für die Hämatopoese, die Aufrechterhaltung von Blutdruck sowie pH-Wert und Osmolarität des Blutes verantwortlich. Bei der Ausscheidung werden von den ca. 1 Million glomerulären Filtereinheiten (Nephrone) Bestandteile aus dem Blut filtriert und zum Teil resorbiert. Die Niere funktioniert weitgehend autonom, sie kann aber durch Hormone, die von anderen Organen freigesetzt werden, zu denen auch die Nebenschilddrüse, Nebennieren und das periphere Gefäßsystem zählen, extrinsisch beeinflusst werden.
Die Niere ist ein wichtiges endokrines Organ, das 1,25-Dihydroxy-Vitamin D3, Erythropoetin, drei Arten des atrialen natriuretischen Peptids, Prostaglandine, Endothelin und Adrenomedullin produziert. Peptidasen (Renin, das Angiotensinkonvertierende Enzym und Kallikrein) sind Enzyme, die von der Niere produziert und in den Blutkreislauf abgegeben werden, um wiederum biologisch aktive Hormone in entfernten Zielgeweben zu produzieren. Die Hämatopoese erfolgt durch die im Nierengewebe verteilten Erythropoetinproduzierenden endokrinen Zellen.
Dass Strahlung sich schädigend auf die Niere auswirkt (strahleninduzierte Nephropathie), ist seit fast einem Jahrhundert bekannt. Dabei ist allerdings zu beachten, dass die in historischen Studien verwendete Terminologie nicht unmittelbar mit der modernen Klassifikation von Nierenerkrankungen vergleichbar ist. Bekannte Strahlenwirkungen wurden als akute (nicht zu verwechseln mit akuter Nierenschädigung) oder späte Nephrotoxizität bezeichnet, je nachdem, ob die beobachteten Symptome innerhalb von Wochen oder erst viele Jahre nach der Exposition auftraten. Diese Aufteilung in akute und späte Form lässt sich vermutlich auf das relativ asymptomatische Frühstadium von chronischem Nierenversagen (Chronic Kidney Disease - CKD) zurückführen, ist allerdings auch abhängig von bestrahltem Volumen (vergleiche Dosis-Volumen-Modelle in Marks et al. 2010), Dosis und Beobachtungszeitpunkt.
Bei CKD handelt es sich um eine allmählich abnehmende Rate der glomerulären Filtration, welche zunächst asymptomatisch verlaufen, aber auch im vollständigen Organversagen (terminaler Niereninsuffizienz) münden kann, was Dialyse oder Transplantation erforderlich macht. CKD ist eine in den entwickelten Ländern weit verbreitete Krankheit, von der 10 % der erwachsenen Bevölkerung betroffen ist (Lópes-Novoa et al. 2010). Dabei ist auffallend, dass bei bis zu 30 % der Über-70-Jährigen eine Beeinträchtigung der Nierenfunktion nachgewiesen werden kann (Weinstein und Anderson 2010).
Zu den bekannten Auslösern für CKD gehören Bluthochdruck, Diabetes, Autoimmunerkrankungen, Infektionen/Entzündungen und genetische Disposition. Während es sich bei Anreicherung von Abfallprodukten im Blut, begleitet von Störungen des Säure- und Salzgleichgewichts und des Blutdrucks, um die schwerwiegendsten Folgen handelt, ist auch der Verlust der endokrinen Nierenfunktion nicht zu vernachlässigen, da dieser unter anderem zu Anämie und Hypokalzämie führen kann (Ros und Carrero 2013, Kuczera et al. 2015).
CKD wird begleitet von oder folgt sogar einer lokalen Umwandlung von Nierengewebe zu fibrotisch extrazellulärer Matrix. Fibrosen können in den kleinen Gefäßen der Glomeruli (Glomerulosklerose), den tubulären Strukturen des Nephrons (Tubulussklerose) oder in interstitiellem Nierengewebe auftreten (Nogueira et al. 2017). Diese sklerotischen Veränderungen sind häufig idiopathisch, sie können aber auch aufgrund einer Wundreaktion infolge einer Infektion, einer medikamentösen Behandlung, eines hohen BMI oder des natürlichen Alterungsprozesses auftreten (Sun et al. 2016).
Eine akute Nierenschädigung (Acute Kidney Injury - AKI), die schnell zu einem Funktionsverlust führt, kann durch einen Verlust der Filtrationsleistung, eine Schädigung der Nephrone oder einen behinderten Urinfluss entstehen. Im Gegensatz zu CKD klingen die Symptome nach Beginn der Behandlung rasch ab, aber bei fehlender Behandlung kann AKI zu CKD führen. Ursächlich für AKI können Vaskulitis, Infektionen, medikamentöse Behandlungen einschließlich Chemotherapie, eine Überempfindlichkeit gegenüber Antibiotika oder Kontrastmittel und Drogenmissbrauch sein (Lameire et al. 2005).
Eine Entzündung des Nierengewebes (Nephritis) kann sowohl das interstitielle Gewebe als auch die Nephrone betreffen. Heute wird zwischen der sich schnell entwickelnden akuten Nephritis und den erst im Laufe der Zeit auftretenden chronischen Nierenkrankheiten unterschieden, die beide zu Gewebeschäden und einer verminderten Filtrationsleistung führen. Häufige Ursachen sind Infektionen, Ablagerungen von Antikörpern und Überempfindlichkeiten gegenüber Medikamenten.
2.4.2 Schädigung der Niere durch externe Strahlenexposition
Die Schwere der Nierenschäden bei Krebspatientinnen und -patienten, die mit fraktionierter Röntgenstrahlung in Höhe von 25 Gy und 30 Gy (2.500 rad bis 3.000 rad) am Abdomen behandelt wurden, kann sehr unterschiedlich ausfallen (Luxton 1961), wobei sich bei einigen Patientinnen und Patienten CKD bereits einige Monate nach der Exposition nachweisen lässt, während bei anderen einige Jahre bis zur Diagnose vergehen (Dawson et al. 2010). Eine mögliche Erkrankung an CKD nach einer Bestrahlung des Beckenbereichs könnte daher vom Einfluss der Grunderkrankung, dem körperlichen Zustand und von der Begleitmedikation abhängen. Studien mit Krebspatientinnen und -patienten müssen mit erhöhter Vorsicht interpretiert werden, da bei der Radiochemotherapie auch zytotoxische Mittel zum Einsatz kommen, welche die Nieren schädigen können (einschließlich Cisplatin, Cyclophosphamide, Vincaalkaloide und Mitramycin) (Yeung und Gagel 2003). Darüber hinaus könnten bei Studien mit einem zu kurzen Followup spätere Erkrankungen übersehen werden. Die Beschreibung der Dosis-Wirkungsbeziehung in den nachfolgend genannten klinischen Studien ist daher mit Bedacht zu betrachten.
2.4.2.1 Radiochemotherapiepatientinnen und -patienten
Da das unbeschädigte Nierengewebe den Funktionsverlust der bestrahlten Bereiche bis zu einem gewissen Grade ausgleichen kann, hängen die Folgen der Bestrahlung stark von der Dosis an der bestrahlten Niere ab. Eine kürzlich durchgeführte systematische Übersichtsarbeit zu Studien mit Radiochemotherapiepatientinnen und -patienten deutet darauf hin, dass eine Schädigung erst dann spürbar ist, wenn mehr als 30 % der Gewebemasse der Niere einer Exposition ausgesetzt war (Dawson et al. 2014). Eine frühere Studie von Köst et al. zeigt, dass es zu einer 50 %igen Beeinträchtigung der Nierenfunktion kommt, wenn entweder 20 % der Nierenmasse mit 18,5 Gy bestrahlt wurden oder die gesamte Niere einer Exposition von 10 Gy ausgesetzt war (Köst et al. 2002).
2.4.2.2 Ganzkörperbestrahlung vor Knochenmarktransplantation
Eine systematische Übersichtsarbeit mit Patientinnen und Patienten, die vor einer Knochenmarktransplantation einer Ganzkörperbestrahlung (Total Body Irradiation - TBI) unterzogen wurden, zeigte, dass anschließend 13 % an CKD erkrankten (Cohen et al. 2010). Diese Zahl ist deutlich geringer als die aus einer früheren Studie mit ähnlichen Patientinnen und Patienten, bei der eine Erkrankungsrate von bis zu 30 % festgestellt wurde (Ellis et al. 2008). Cohen et al. führen dies auf den zunehmenden Einsatz eines partiellen Nierenschutzes zurück (Cohen et al. 2019). Tatsächlich zeigte eine weitere Studie über die Verwendung von Abschirmungen, dass die Dosis für die Nieren während der Knochenmark-Ablation von 14 Gy auf 2 Gy reduziert werden konnte (Lawton et al. 1992). Zudem wurde beobachtet, dass die Erkrankungsrate für CKD nach einer Exposition gegenüber niedrigen Dosen von 26 % auf 6 % gesunken ist. Es lässt sich allerdings noch nicht sagen, ob die Abschirmung allein für diesen Wert verantwortlich ist oder ob sie ein zusätzlicher Hinweis auf eine sehr steile Dosis-Wirkungskurve ist oder ob sie sogar auf eine Schwellendosis hinweist, was sich mit den Ergebnissen aus den Tiermodellen decken würde (siehe oben). Interessant ist auch, dass die Studie von Cohen et al. keinen Hinweis auf einen Einfluss des Alters zum Zeitpunkt der Exposition gefunden hat, da sich bei Erwachsenen und Kindern eine ähnliche CKD-Rate zeigte (Cohen et al. 2010). Eine systematische Übersichtsarbeit zu 12 klinischen Studien mit Patientinnen und Patienten, die einer TBI unterzogen wurden (Dawson et al. 2010, Cheng et al. 2008), zeigte, dass fünf Jahre nach einer Exposition mit 9,8 Gy ein 5 %iges Risiko besteht, an CKD zu erkranken. Dieser Wert stimmt gut mit denen einer früheren Studie (Cassaday 1995) zur alleinigen Exposition der Nieren überein. Dawson kommt in seiner Analyse zu dem Schluss, dass es einer Mindestdosis von 6 Gy bedarf, um CKD zu induzieren.
2.4.2.3 Computertomografie
Ein potenzieller Zusammenhang zwischen dem medizinischen Einsatz der Computertomografie und CKD ist auf eine Schädigung der Nieren durch die Verwendung von Kontrastmitteln und nicht auf die niedrige Strahlenexposition zurückzuführen (Goldfarb et al. 2009).
2.4.2.4 Atombombenüberlebende
Studien mit Atombombenüberlebenden (Ganzkörperexposition gegenüber Mischstrahlung mit sehr langem Followup) zeigen einen dosisabhängigen Anstieg von CKD nach einer Exposition von über 3 Gy (Adams et al. 2012) bzw. 2 Gy (Sera et al. 2013). Das sehr lange Followup könnte in diesem Fall dazu führen, dass auch CKD-Fälle erkannt werden, die aufgrund des progressiven Charakters der Erkrankung sonst unentdeckt geblieben wären (Sera et al. 2013). Die Autoren weisen jedoch darauf hin, dass ein möglicher Zusammenhang zwischen einer Exposition gegenüber niedrigen Dosen und einer CKD auch auf andere Faktoren zurückzuführen sein könnte, die für CKD prädisponieren und vielleicht sogar mit der Strahlung interagieren, wie Bluthochdruck, Entzündungen und das metabolische Syndrom.
2.4.2.5 Tiermodell
Studien am Nagetiermodell zeigen, dass das mit der Bestrahlung einhergehende progressive Nierenversagen mit dem Verlust von den die Kapillaren auskleidenden Endothelzellen verbunden ist. Dieser Vorgang wird begleitet von einer fortschreitenden tubulointerstitiellen Fibrose und einer lokalen Entzündung. Studien von Guttman und Kohn deuten darauf hin, dass eine Dosis von 550 rad (5,5 Gy) ausreicht, um die für CKD typische progressive Nierenfibrose zu verursachen (Guttman und Kohn 1960). Diese Ergebnisse stimmen gut mit denen der Nierenfunktionsstudie bei Ratten von Moulder und Fish überein, nach der eine Dosis von 8,7 Gy mehrere Monate nach Bestrahlung CKD hervorruft (Moulder und Fish 1989), sowie mit denen der Studie von Oikawa et al., nach der eine Dosis von 12 Gy an beiden Nieren nach 12 bis 24 Wochen zu CKD-typischen Nierenschäden führt, was sich durch eine erhöhe Proteinurie und Kreatinin-Ausscheidung zeigt, begleitet von fortschreitender Sklerose der Glomeruli, Tubuli und des Interstitiums (Oikawa et al. 1997). Sowohl der Zeitraum als auch die Schwere der CKD-Erkrankung nach einer Exposition gegenüber 10 Gy bei nichtmenschlichen Primaten (Rhesus macaques) waren mit denen beim Nagetiermodell und Menschen vergleichbar (Cohen et al. 2019).
Keine der oben genannten Studien wurde im Hinblick darauf konzipiert, eine Dosis zu bestimmen, unterhalb derer die Nieren nicht geschädigt werden. Bei einer einzigen Gamma-Ganzkörperbestrahlung von erwachsenen Mäusen mit 2 Gy ließen sich keine Veränderungen in Histologie oder Serum-Biomarkern beobachten, die auf Nierenschädigung hindeuten, allerdings betrug der Beobachtungszeitrum nur 18 Tage (Karami et al. 2018). Dementsprechend hatte auch eine fraktionierte, niedrigdosierte Bestrahlung (12,5 mGy alle zwei Tage für acht Wochen = 350 mGy, bzw. 25 mGy alle zwei Tage für acht Wochen = 700 mGy) keinen negativen Einfluss auf die Nieren der Mäuse, weder in Histologie noch in Harnparametern (Cheng et al. 2018). Es ist jedoch nicht bekannt, ob sich bei einem längeren Beobachtungszeitraum chronische Veränderungen hätten beobachten lassen.
In einer neueren Studie wurde die Dosisempfindlichkeit von Ratten neu bewertet. In dieser ließen sich CKD-typische histologische Veränderungen sechs Monate und biochemische Veränderungen neun Monate nach einer Röntgenbestrahlung in Höhe von 10 Gy im Alter von sechs Monaten beobachten. Im Vergleich dazu fanden sich nach einer Dosis von 6 Gy keine (histologischen oder biochemischen) Nachweise für CKD bei Ratten (Lenarczyk et al. 2019). In dieser Studie zeigten sich sowohl ein früheres Auftreten als auch eine größere Schwere der Erkrankung bei den Tieren, die im Alter von sechs Wochen einer Exposition ausgesetzt waren, im Gegensatz zu einer Exposition mit sechs Monaten. Diese Ergebnisse stimmen mit früheren Beobachtungen über den Einfluss des Alters zum Zeitpunkt der Exposition überein (Moulder und Fish 1997) und deuten auf eine höhere Strahlentoleranz älterer Tiere hin, möglicherweise aufgrund größerer Reserven und einer besseren Regenerationsfähigkeit der ausgewachsenen Organe bei älteren Tieren.
2.4.3 Schädigung der Niere durch interne Strahlenexposition
2.4.3.1 Uran
Das Uran aus dem Blutkreislauf lagert sich in der Niere ein (Legget 1994), wo es sowohl radiobiologisch als auch toxikologisch wirkt, letzteres bereits bei sehr niedrigen Konzentrationen. Studien mit Menschen sind selten und geben in der Regel keine Auskunft über die individuelle Exposition. Zudem sind sie aufgrund der niedrigen Fallzahlen nur von geringer Aussagekraft. Eine Studie zu Nierenerkrankungen bei Arbeitern der Uranmühlen vom Colorado Plateau konnte in einem 38-jährigen Followup keinen signifikanten Anstieg der Erkrankungszahlen feststellen (Pinkerton et al. 2004). Studien mit einer größeren Kohorte von Arbeitern von Gasdiffusionanlagen zur Uran-Anreicherung zeigten keine signifikanten Zunahmen bei der Zahl der chronischen Nierenerkrankungen (Yiin et al. 2017, Yiin et al. 2018). In den beiden letztgenannten Studien lag die berechnete Lebensdosis der Niere bei 2 mGy und eine chemische Wirkung konnte nicht ausgeschlossen werden. Aufgrund der Exposition des Knochenmarks gegenüber Uran traten Multiple Myelome (MM) signifikant häufiger auf. Laut den Autoren könnten Nierenschäden als Folge einer übermäßigen Antikörpersekretion in MM-Patientinnen und Patienten die Ergebnisse ihrer Studie erklären (Yiin et al. 2018).
2.4.3.2 Radiopharmazeutika
Bei der Tumortherapie mit Radionukliden kommen typischerweise Konjugate aus Radionukliden und natürlichen oder synthetischen Liganden zum Einsatz. Durch die Filtration und Einlagerung von kleinen Molekülen kann es so zu einer erheblichen Dosis für die Nieren kommen. Bei Studien mit Patientinnen und Patienten mit neuroendokrinen Tumoren traten Begleiterkrankungen auf, welche die Nierenaktivität sekundär beeinflussen können. Eine Dosis von 11,5 +/- 5,2 Gy führte in einer Strahlentherapie-Studie mit 177Lu-beladenem DOTATAT zu einem sukzessiven Rückgang der Nierenfunktion ohne akute Nephrotoxizität (Gupta et al. 2012). In einer Studie mit 58 Patientinnen und Patienten mit neuroendokrinen Tumoren, die mit je sechs Gaben [131I] MIBG im Abstand von sechs Monaten behandelt wurden (Gesamtaktivität 45 GBq), zeigte sich trotzt der Höhe der Strahlenexposition nur eine geringe Auswirkung. Nur bei zwei Teilnehmern gab es eine Verschlechterung der Nierenfunktion nach fünf Jahren (Sze et al. 2013).
2.4.3.3 Tiermodelle
Eine Studie zur Nierenfunktion (drei und zehn Tage) nach einer Injektion mit 137Cs (4.000 Bq kg-1 bis 8.000 Bq kg-1) bei Mäusen zeigte geringe und vorübergehende Veränderungen bei denjenigen biochemischen Indikatoren, die auf eine verminderte Nierenfunktion hinweisen. Diese waren weder dosis- noch zeitabhängig (Bellés et al. 2017), aber durch das nur sehr kurze Followup lassen sich keine Rückschlüsse auf eine eventuelle Langzeitwirkung ziehen. Eine Exposition gegenüber 4 mg kg-1 Uran reicht aus, um eine reversible, nicht progressive Nierenerkrankung bei Mäusen zu verursachen (Sangeetha Vijayan et al. 2016). Die Toxizität von Uran für das Nierengewebe gilt jedoch als wesentlich wichtiger als die radiologische Wirkung (siehe oben).
2.4.4 Zusammenfassende Bewertung
Strahleninduzierte Nierenschäden entstehen langsam im Laufe von Monaten und Jahren. Die Schwere der Schädigung hängt von der Dosis und dem Volumen des bestrahlten Nierengewebes ab. Welche Schädigung beobachtet werden kann, hängt von der Dauer des Followups ab. Studien mit Atombombenüberlebenden, welche bei weitem die längste Beobachtungsdauer aufweisen, zeigen eine chronische Beeinträchtigung der Nierenfunktion schon ab einer gewichteten Energiedosis von 2 Gy. Laut Studien mit Strahlentherapiepatientinnen und -patienten mit einem kürzeren Followup kann eine Dosis von 6 Gy bis 10 Gy zu einer Schädigung innerhalb von 10 Jahren führen. Bei einer partiellen Bestrahlung müssen höhere Dosen, in der Regel 10 Gy und mehr, zum Einsatz kommen, damit eine klinisch relevante Wirkung beobachtet werden kann. Der Einfluss des Alters zum Expositionszeitpunkt ist ungeklärt.
2.4.5 Implikation für eine Grenzwertsetzung
Die oben dargestellten Ergebnisse zu Strahlenwirkungen in der Niere beziehen sich auf die Energiedosis. Für Niedrig-LET-Strahlung hat die Äquivalentdosis den gleichen numerischen Wert wie die Energiedosis. Es ist weiterhin nicht davon auszugehen, dass die biologische Wirksamkeit von inkorporiertem Uran bezüglich nicht-neoplastischer Erkrankungen geringer ist als die von Niedrig-LET-Strahlung. Dementsprechend sind die numerischen Werte der Äquivalentdosis für die beobachteten Effekte nicht kleiner als die der Energiedosis.
Die Äquivalentdosis der Nieren bei Einhaltung des Grenzwerts der effektiven Dosis von 20 mSv liegt in den betrachteten Szenarien bei maximal 0,85 Sv. Die in den berechneten Szenarien entsprechende Energiedosis ist damit deutlich kleiner als eine Dosis von 2 Gy, unterhalb derer keine gesundheitlichen Effekte in der Niere beobachtet wurden.
2.5 Obere Atemwege
2.5.1 Grundlagen
Die ICRP stützt sich in der ICRP-Publikation 118 (ICRP 2012) bei ihrer Einschätzung von Strahlenschäden der oberen Atemwege auf Literatur bis zum Jahre 2010. Neben dem ICRP-Bericht wird in diesem Abschnitt auch die Relevanz neuerer Arbeiten für eine Grenzwertsetzung der Äquivalentdosis der oberen Atemwege bewertet. Zu den oberen Atemwegen im Sinne der ICRP-Definition zählen der Rachen (Pharynx, Schlund), der Kehlkopf (Larynx) sowie der extrathorakale Bereich der Trachea.
Der Rachen ist ein mit Schleimhaut ausgekleidetes Hohlorgan, das die Mundhöhle mit der Speiseröhre und die Nasenhöhle über den Kehlkopf mit der Luftröhre verbindet. Die Rachenwand wird von Knochen, Knorpel und Muskulatur gestützt. Der Rachen erstreckt sich von der Schädelbasis zum Ringknorpel des Kehlkopfes (Larynx) mit Übergang in die Speiseröhre und ist - von cranial nach caudal - in drei Abschnitte gegliedert: Nasopharynx, Oropharynx und Laryngopharynx. Die Mandeln als lymphatisches Gewebe befinden sich in der Schleimhaut des Rachens. Der Rachen reguliert den Fluss der Atemluft zwischen Mund bzw. Nase und Luftröhre sowie den Flüssigkeits- und Nahrungstransport in die Speiseröhre. Das mehrschichtige unverhornte oropharyngeale Epithel gilt als eher hoch strahlenempfindlich, das respiratorische nasopharyngeale Flimmerepithel als eher gering strahlenempfindlich (Rubin et al. 2014a).
Der Kehlkopf bildet den direkten Übergang von den oberen Atemwegen zu den unteren Atemwegen und wird aus diesem Grund hier ebenfalls betrachtet. Er ist ein aus Knorpelgerüst und Skelettmuskulatur gebildetes Hohlorgan und mit einer Schleimhaut aus mehrschichtigem Plattenepithel ausgekleidet. Im Kehlkopf befinden sich die aus Muskeln und Bindegewebe gebildeten Stimmlippen, deren Regulation beim Ausfluss der Atemluft eine wichtige Rolle in der Sprachproduktion (Phonation) besitzt. Als weitere Aufgabe schützt der Kehlkopf die unteren Atemwege vor Eindringen von Nahrung und Flüssigkeit, indem sich in der Schluckbewegung die Stimmritze (Glottis) zwischen den Stimmbändern schließt und der Kehldeckel den Kehlkopfeingang verschließt. Gelangen Nahrung oder Flüssigkeit vor die Stimmlippen, wird dies als Penetration bezeichnet, gelangen sie in die Trachea als Aspiration. Beim Husten erzeugt initial ein Schluss der Stimmritze ein Anstauen der Luft, um bei der nachfolgenden Öffung eine Beschleunigung des Luftstroms und somit eine effektivere Clearance von Fremdmaterial in der Trachea oder in den Bronchien zu bewirken. Das Larynx-Epithel besitzt eine ähnlich hohe Teilungs- bzw. Regenerationsrate wie andere Hohlorgane der oberen Atemwege.
ICRP-Publikation 118 (ICRP 2012a) berücksichtigt als strahlenbedingte Gewebeschäden im Bereich der oberen Atemwege Schluckbeschwerden (Dysphagie) und Aspiration bei Schädigung des Rachens sowie Störungen der Sprechfähigkeit und Ödembildung bei Schädigung des Kehlkopfes. Zusätzlich geht ICRP 118 auf die radiogene orale Mukositis ein. Da sich die radiogene pharyngeale und laryngeale Mukositis weitgehend analog verhalten, sind die Aussagen von ICRP 118 auch hier relevant. Über ICRP 118 hinaus wird in der Literatur allgemein die Nekrose des Knorpels und Knochens als Folge einer Strahlentherapie beim Larynxkarzinom mit hoher Strahlendosis diskutiert (Rubin et al. 2014a, Chandler 1979, Roh 2009).
Die Schlussfolgerungen in ICRP 118 zu Schwellenwerten für strahlenbedingte Gewebeeffekte fußen auf Evidenz, die von strahlentherapeutisch behandelten Patientinnen und Patienten mit Kopf-Hals-Tumoren stammt. Insbesondere sind dies Reviews der QUANTEC-Gruppe (Quantitative Analysis of Normal Tissue Effects in the Clinic), in denen NTCP-Modelle (Normal Tissue Complication Probability) angepasst wurden (Rancati et al. 2010). Diese Modelle quantifizieren die Effekte der Strahlendosis und des exponierten Volumens auf das Auftreten von Normalgewebstoxizität.
Auch die in den folgenden Abschnitten erwähnte neuere Literatur beruht, sofern nicht explizit anders erwähnt, auf Studien an Strahlentherapiepatientinnen und -patienten. Sind Schweregrade für die Erkrankungen angegeben, beziehen sie sich auf die Skala der Radiation Therapy Oncology Group (Stufen 0 bis 4 für Überlebende) des American College of Radiology oder auf die Skala "Common Terminology Criteria for Adverse Events" (CTCAE) des US National Cancer Institute (Stufen 0 bis 4 für Überlebende).
Die Gesamtdosis einer Strahlentherapie wird dabei oft als umgerechnete Dosis für Fraktionen zu je 2 Gy angegeben (EQD2). Dieser Umrechnung liegt ein linearquadratisches Modell für den induzierten Zelltod zugrunde (IAEA und ICRU 2008).
2.5.2 Pharynx: Pharyngeale Mukositis
Mukositis im Mund- und Rachenbereich ist eine Schleimhautentzündung, die mit unterschiedlichem Schweregrad fast alle Patientinnen und Patienten mit Radio(Chemo)therapie bei Kopf-Hals-Tumoren betrifft. Sie kann sehr schmerzhaft sein und beinhaltet lokale Zerstörung des Schleimhautepithels sowie später Ulzerationen. Sie kann zu Infektionen, schweren Entzündungen und Schluckbeschwerden führen. Die im engeren Sinne pharyngeale Mukositis verhält sich analog zur oralen Mukositis (Rubin et al. 2014b) und tritt - bei zusätzlicher Chemotherapie früher - Tage bis wenige Wochen nach Beginn der Strahlentherapie auf. Die Intensität der Schleimhautveränderungen ist abhängig vom Fraktionierungsschema der Strahlentherapie. Typischerweise bilden sich Schäden nach dem Ende der Strahlentherapie innerhalb von Wochen wieder zurück.
Als Toleranzdosis, bei der eine Auftretenshäufigkeit von 5 % (50 %) für eine schwere Mukositis innerhalb von fünf Jahren erwartet wird, geben Rubin et al. 6 Gy (7,5 Gy) bei Feldgrößen von 50 cm2 an (Rubin et al. 2014a). Toleranzdosen für leichte oder mittelschwere Mukositis werden nicht berichtet.
Bhide et al. führten eine Studie mit Patientinnen und Patienten durch, die sowohl Induktionschemotherapie als auch Radiochemotherapie erhielten (Bhide et al. 2012). Die Extrapolation einer logistischen Funktion für die Auftretenshäufigkeit einer schweren Mukositis (Grad 3) in den unteren Dosisbereich ergab für eine Dosis von 1,8 Gy EQD2 eine Häufigkeit von 2,5 % 12 Monate nach Strahlentherapie (Bhide et al. 2012). In die Anpassung der Funktion flossen dabei tatsächlich beobachtete Daten zwischen 17 Gy und 62 Gy EQD2 mit zugehörigen Häufigkeiten von 30 % und 64 % ein.
In einer Studie von Otter et al. trat pharyngeale Mukositis seltener als orale Mukositis (Grad 3) auf (Otter et al. 2015). Fälle wurden nur bei Patientinnen und Patienten beobachtet, bei denen mehr als 80 % (70 %) des Volumens eine Dosis von mindestens 5 Gy (10 Gy) erhielten - entsprechend einer mittleren Dosis von mindestens 4 Gy (7 Gy). Bei Patientinnen und Patienten ohne Chemotherapie traten Fälle nur auf, wenn 100 % des Volumens mindestens 5 Gy erhielten.
Orlandi et al. beobachteten in ihrer Studie eine Effective Uniform Dose der Mundhöhle zwischen 39 Gy und 56 Gy mit Auftretenshäufigkeiten von oraler Mukositis (mittlerer Grad 1,5 und höher) zwischen 22 % und 50 % (Orlandi et al. 2018). Eine Extrapolation des angepassten logistischen NTCP-Modells liefert für etwa 1,8 Gy eine Auftretenshäufigkeit von 1,62 % und für 0 Gy von 1,56 %.
2.5.3 Pharynx/Larynx: Dysphagie und Aspiration
Oropharyngeale Dysphagie bezeichnet subjektiv empfundene oder objektiv vorhandene Störungen in der pharyngealen Phase der Schluckbewegung, die wesentlich durch Stimulation pharyngealer Drucksensoren eingeleitet und durch sequentielle Kontraktion der Schlundmuskulatur ausgeführt wird. Von oropharyngealer Dysphagie Betroffene haben Schwierigkeiten, Nahrung und Flüssigkeit aus der Mundhöhle in Rachen und Speiseröhre zu bewegen. Als Genese der strahleninduzierten Dysphagie werden Ödeme oder eine entzündungsbedingte Fibrose des Weichgewebes und daraus resultierende Verhärtung der Muskeln, verringerte Muskelkraft, reduzierte Muskel-Kontraktilität und Muskelatrophie diskutiert (Rancati et al. 2010).
Aspiration steht in engem Zusammenhang mit Dysphagie, beide Störungen gehen auf Schäden in den Dysphagia-Aspiration Related Structures (DARS) zurück, zu denen die Schlundmuskulatur sowie Glottis und Supra-Glottis des Larynx zählen (Eisbruch et al. 2011). Eine Ursache für Aspiration ist insbesondere eine verringerte Sensitivität der oropharyngealen Schleimhaut. Diese kann dazu führen, dass bei betroffenen Patientinnen und Patienten eine Aspiration oft unbemerkt verläuft, ohne Hustenreiz auszulösen (engl. Silent Aspiration). Dies stellt eine erhöhte Gefahr für Komplikationen wie Erstickungsanfälle, Atemnot oder eine Aspirationspneumonie dar.
Dysphagie kann sich akut während der Strahlentherapie entwickeln und im Lauf der Therapie verstärken, oder aber Monate bis Jahre nach der Therapie erstmalig auftreten (Duprez et al. 2013). Während akute Dysphagie reversibel ist, bleibt als Spätfolge auftretende Dysphagie oft erhalten und verschlechtert sich. Abhängig von der Art der Diagnostik können bis zu 50 % der Patientinnen und Patienten mit Kopf-Hals-Tumoren und Radiochemotherapie von Dysphagie als Spätfolge betroffen sein (Duprez et al. 2013).
ICRP 118 (ICRP 2012a) gibt als Schwellendosis für das Auftreten von Schluckstörungen (Dysphagie) und Aspiration eine mittlere Dosis von 50 Gy an. Das zugrundeliegende QUANTEC-Review (Rancati et al. 2010) empfiehlt zur Reduktion akuter Dysphagie, den Larynx-Volumenanteil mit 50 Gy Energiedosis unter 27 % zu halten. Analog sollte die mittlere Larynx-Dosis unter 40 Gy und die maximale Larynx-Dosis unter 66 Gy liegen. Für die DARS gibt das QUANTEC-Review (Rancati et al. 2010) insgesamt einen Dosisbereich von 50 Gy bis 60 Gy als Toleranzdosis für eine Auftretenshäufigkeit von 50 % von Dysphagie und Aspiration an. Die angepasste logistische Funktion sagte 1 % Auftretenshäufigkeit von Dysphagie bei 16,7 Gy zur Supraglottis vorher. Eine Dosis-Wirkungsanalyse unter Annahme von Linearität (Levendag et al. 2007) ergab eine Steigerung der Auftretenshäufigkeit von selbstberichteter schwerer Dysphagie um 19 % pro 10 Gy Dosis zu den muskulären Larynx-Strukturen.
Eine Reihe jüngerer Reviews (Hedström 2019, Hutchison et al. 2019, de Felice et al. 2018) fasst die Evidenz einzelner Studien nach 2010 zusammen. Eine Arbeit von Eisbruch et al. gibt für Aspiration eine Dosis von 56 Gy zur Schlundmuskulatur und 39 Gy zur Supraglottis der Larynx an, die mit einer Auftretenshäufigkeit von 25 % nach 12 bis 24 Monaten assoziiert ist (Eisbruch et al. 2011). Bhide et al. führten eine Studie mit Patientinnen und Patienten durch, die sowohl Induktionschemotherapie als auch Radiochemotherapie erhielten (Bhide et al. 2012). Die Extrapolation einer logistischen Funktion für die Auftretenshäufigkeit von Dysphagie (ab Grad 3) in den unteren Dosisbereich ergab einen Wert von ca. 7,6 Gy für eine Häufigkeit von 1 % 12 Monate nach Exposition. In die Anpassung der Funktion flossen dabei tatsächlich beobachtete Daten zwischen 45 Gy und 67 Gy EQD2 mit zugehörigen Häufigkeiten von 47 % und 77 % ein.
Die Extrapolation eines NTCP-Modells auf Basis einer Studie von Christianen et al. ergab eine Auftretenshäufigkeit von Dysphagie von 1 % bei 21,4 Gy zur oberen Schlundmuskulatur bei gleichzeitig 10 Gy zum supraglottischen Larynx (Christianen et al. 2012). In einer Studie von Frowen et al. war bei 60 % der Patientinnen und Patienten mit einer Dosis unter 60 Gy zur Schlundmuskulatur nach sechs Monaten keine Dysphagie vorhanden, bei Patientinnen und Patienten mit Dosis von mindestens 60 Gy nur 17 % (Frowen et al. 2013). Eine Dosis über 60 Gy zur Schlundmuskulatur war in einer Studie von Deantonio et al. statistisch signifikant mit dem Auftreten von Dysphagie (Grad 2 bis Grad 3) assoziiert (Deantonio et al. 2013).
Eine Evaluation der QUANTEC-Empfehlungen (Rancati et al. 2010) durch Anderson et al. ergab eine Auftretenshäufigkeit für eine akute Dysphagie (Grad 3 oder höher) in Woche 5 von 14,3 % für Patientinnen und Patienten, bei denen weniger als 27 % des Organvolumens mit 50 Gy bestrahlt wurden (Anderson et al. 2014). Bei Patientinnen und Patienten mit einer mittleren Dosis von unter 40 Gy hatte in Woche 6 der Strahlentherapie ein Anteil von 23,5 % eine Dysphagie. Bei Patientinnen und Patienten mit einer Maximaldosis von unter 66 Gy betrug in Woche 6 der Anteil mit einer Dysphagie 28 %.
In einer Studie von Chera et al. sagte das extrapolierte angepasste Modell eine Auftretenshäufigkeit einer Dysphagie innerhalb von sechs Monaten nach Strahlentherapie von 1 % vorher, wenn die Schlundmuskulatur eine Dosis von 5,9 Gy erhielt (Chera et al. 2017). In der Studie von Söderström et al. war die extrapolierte Modellvorhersage für Patientinnen und Patienten ohne zusätzlichen Risikofaktor für eine Dysphagie (etwa Alter > 55 Jahre oder Neck Dissection) 1 % Auftretenshäufigkeit von Aspiration bei einer Dosis von 10,1 Gy Dosis zur mittleren Schlundmuskulatur (Söderström et al. 2017). Die extrapolierte Modellvorhersage für Patientinnen und Patienten mit zusätzlichem Risikofaktor war eine Auftretenshäufigkeit von 2,4 % bei 1,8 Gy und 2,1 % bei 0 Gy.
Die von Hedström durchgeführte Studie ergab, dass bei Patientinnen und Patienten, bei denen weniger als 60 % des Epiglottis-Volumens 60 Gy erhielten, also mindestens eine mittlere Dosis von 36 Gy hatten, keine Dysphagie auftrat (Hedström 2019).
2.5.4 Larynx: Laryngeales Ödem
Die Entwicklung eines laryngealen Ödems als Folge einer Entzündung und Störung des Lymphtransports beginnt wenige Wochen bis Monate (ICRP 2012a, Sanguineti et al. 2007) nach Beginn der Strahlentherapie. Als langfristige Folgen eines Ödems können sich Fibrose und schließlich Probleme der Phonation sowie Schluckbeschwerden entwickeln.
ICRP 118 (ICRP 2012a) gibt als Schwellenwert 70 Gy EQD2 an. Das QUANTEC-Review (Rancati et al. 2010) führt aus, dass der Volumenanteil des Larynx mit Dosen über 50 Gy ein statistisch signifikanter Prädiktor für ein laryngeales Ödem (Grad 2 oder höher) war. Bei einem solchen Volumenanteil unter 27 % und einer mittleren Larynx-Dosis unter 43 Gy lag die Inzidenz für ein Ödem unter 20 % innerhalb eines Jahres. Eine einzelne Arbeit schätzt das 5-Jahres-Risiko auf 5 % (50 %) bei einer Gesamtdosis von 45 Gy (80 Gy) (Rubin et al. 2014b).
Das von Rancati et al. angepasste NTCP-Modell für laryngeale Ödeme sagt für eine Larynx-Dosis von 19,1 Gy eine Auftretenshäufigkeit von 1 % vorher (Rancati et al. 2009). Grundlage waren Strahlentherapiepatientinnen und -patienten mit mindestens 15 Monaten Followup. In einer Studie von Nguyen wurden laryngeale Ödeme bei mittleren Larynx-Dosen von 16,3 Gy (Range: 11,7 Gy - 45,5 Gy) in 7 % der beobachteten Patientinnen und Patienten diagnostiziert, die bei Kopf-Hals-Tumoren strahlentherapeutisch behandelt wurden (Nguyen 2011). Dabei lagen die Tumoren nicht im Larynx oder Hypopharynx. Das mediane Followup betrug 14 Monate.
Oyan et al. nutzten in Ratten die einmalige Bestrahlung mit 20 Gy zum Larynx zur Induktion laryngealer Ödeme (Oyan et al. 2018).
2.5.5 Larynx: Eingeschränkte Sprechfähigkeit
Störungen der Sprachqualität und Sprechfähigkeit sind eine Nebenwirkung von Strahlentherapie bei Kopf-Hals-Tumoren, von der bis zu 80 % der Patientinnen und Patienten betroffen sind. Sie resultieren etwa aus laryngealen Ödemen, Schäden an Knorpel oder Muskeln, gestörter Funktion der seromukösen Drüsen sowie Fibrose der Stimmlippen zusammen mit einhergehenden Durchblutungsstörungen.
Als Schwelle für Störungen der Sprechfähigkeit gibt ICRP 118 (ICRP 2012a) eine mittlere Larynx-Dosis von 44 Gy, eine maximale Larynx-Dosis von 66 Gy und einen Volumenanteil von 27 % für eine Dosis von mindestens 50 Gy an, wobei das QUANTEC-Review (Rancati et al. 2010) die Basis bildet.
In einer Studie von Vainshtein et al. berichteten sechs Monate nach Strahlentherapie 25 % der Patientinnen und Patienten mit einer Dosis von bis zu 20 Gy zur Glottis eine Verschlechterung der Sprechfähigkeit, 12 Monate nach Therapie sank dieser Anteil auf 10 % (Vainshtein et al. 2014). Einschränkungen der Sprechfähigkeit wurden sechs (12) Monate nach Strahlentherapie von 25 % (11 %) dieser Patientinnen und Patienten angegeben. Das extrapolierte multivariable logistische Modell sagt sechs (12) Monate nach der Therapie für eine Dosis von 1,8 Gy im Mittel eine Verschlechterung der Sprechfähigkeit bei ca. 15,7 % (8,1 %) der Patientinnen und Patienten vorher. Für eine Dosis von 0 Gy war die Vorhersage analog 14,3 % (7,3 %). Für den Endpunkt einer Einschränkung der Sprechfähigkeit ergab die extrapolierte Modellvorhersage bei einer Dosis von 1,8 Gy eine Häufigkeit von 7,1 % (6,9 %), bei einer Dosis von 0 Gy analog 6,5 % (6,3 %). Im Median war die mittlere Glottis-Dosis bei Patientinnen und Patienten 33,7 Gy und reichte von 14 Gy bis 73 Gy.
2.5.6 Larynx: Laryngeale Mukositis
Die laryngeale Mukositis verhält sich weitgehend analog zur oropharyngealen Mukositis, wobei die Inzidenz etwas geringer ist (Bentzen et al. 2001).
2.5.7 Larynx: Perichondritis und Chondronekrose
Die Perichondritis ist eine als Spätfolge von Strahlentherapie auftretende Entzündung des Perichondriums, eine den Knorpel umgebende und ihn mit Nährstoffen versorgende Bindegewebsschicht. Ist durch strahleninduzierte Schäden die Schutz- und Versorgungsfunktion des Perichondriums gestört, begünstigt dies eine strahleninduzierte Nekrose des Knorpelgewebes (Chondronecrosis).
Im Rahmen der Strahlentherapie des Larynx-Karzinoms ist Chondronecrosis heute ein seltener (< 1 %), aber besonders schwerer strahlenbedingter Schaden des Larynx-Knorpelgewebes. Die Erkrankung tritt typischerweise innerhalb von drei Monaten (selten mehrere Jahre) nach der Strahlentherapie auf und kann zum Tode führen (Roh 2009). Laryngeale Ödeme können die ersten Krankheitszeichen sein. Andere Symptome sind Heiserkeit, Schluckstörungen, Aspiration und Dyspnoe (Roh 2009).
In der Literatur beschriebene Fälle von Perichondritis und Chondronecrosis erhielten fraktioniert mittlere Gesamt-Strahlendosen über 60 Gy zum Larynx (Roh 2009, Becker et al. 1997, Cukurova und Cetinkaya 2010, Halkud et al. 2014). In einer frühen Studie von Mintz et al. trat bei 14 % der Patientinnen und Patienten mit weniger als 64 Gy Larynx-Dosis Perichondritis auf, verglichen mit 30 % der Patientinnen und Patienten mit einer Dosis höher als 64 Gy (Mintz et al. 1981). Eine spätere Studie (Rezvani et al. 1991) berichtete, dass 6 % der Patientinnen und Patienten mit Karzinom im Larynx/Pharynx-Bereich bei Dosen zum Zielvolumen zwischen 40 Gy und 78 Gy innerhalb von 12 Wochen Perichondritis entwickelten.
2.5.8 Zusammenfassende Bewertung
Als grundsätzliche Einschränkung der in ICRP 118 (ICRP 2012a) und später veröffentlichten Evidenz zu strahlenbedingten Gewebeschäden der oberen Atemwege muss berücksichtigt werden, dass an Strahlentherapiepatientinnen und -patienten gewonnene Ergebnisse nicht direkt auf die Strahlenwirkung bei gesunden Personen übertragbar sind. Speziell für Kopf-Hals-Tumoren gilt, dass oft Lebensstilfaktoren (Dong et al. 2017) wie Alkoholkonsum oder Rauchen an der Krebsgenese beteiligt sind, die ihrerseits unabhängige Einflüsse auf andere Krankheiten des Kopf-Hals-Bereichs sein können. Zudem können Kopf-Hals-Tumoren selbst Ursache z.B. für Schluckbeschwerden oder eingeschränkte Sprechfähigkeit sein, die bereits vor der Therapie häufig auftreten (Rancati et al. 2010). Diese können auch auf die chirurgische Entfernung der Tumoren und auf Chemotherapeutika (Dong et al. 2017) zurückgehen. Zusätzlich gibt es Unsicherheit bezüglich der Übertragbarkeit von Folgen fraktionierter Bestrahlung mit in der Regel fünf Fraktionen pro Woche von je 1,8 Gy bis 2,0 Gy auf eine einmalige oder aber länger protrahierte Exposition. Die in der Strahlentherapie erreichte Gesamtdosis liegt deutlich über dem für diese Empfehlung relevanten Bereich, so dass die Anwendung der Evidenz eine weite Extrapolation nach unten erfordert.
Pharyngeale Mukositis: Zunächst ist festzustellen, dass in einer Studie (Bhide et al. 2012) das extrapolierte Vorhersagemodell für schwere orale Mukositis bei einer Dosis von 1,8 Gy EQD2 eine Auftretenshäufigkeit von 2,5 % vorhersagte. Einschränkungen für die Relevanz des Ergebnisses für diese Empfehlung ergeben sich aus drei Gründen:
- Die niedrigste beobachtete Dosis war 17 Gy, woraus eine große Unsicherheit für die Extrapolation der Vorhersage für eine Dosis von 1,8 Gy folgt.
- Alle beobachteten Patientinnen und Patienten erhielten Chemotherapie, die Mukositis potenziell begünstigt.
- Der ausgewertete Endpunkt war orale Mukositis, nicht pharyngeale Mukositis. Diese trat in einer anderen Studie (Otter et al. 2015) bei Patientinnen und Patienten ohne Chemotherapie nur bei einer mittleren Dosis von mindestens 5 Gy auf.
Auch eine weitere Studie (Orlandi et al. 2018) lieferte ein Vorhersagemodell für orale Mukositis, das für eine Dosis von 1,8 Gy eine Auftretenshäufigkeit von 1,62 % vorhersagte. Eine Einschränkung dieser Studie ist zum einen, dass auch hier der Endpunkt die orale, nicht die pharyngeale Mukositis war. Zum anderen wurde auch für eine Dosis von 0 Gy eine Auftretenshäufigkeit von 1,56 % vorhergesagt.
Zusammenfassend liegt keine klare Evidenz vor, dass bei gesunden Personen, die keine Chemotherapie erhalten, das Risiko von strahlenassoziierter pharyngealer Mukositis bei einer Dosis von 1,8 Gy erhöht ist.
Dysphagie und Aspiration: Zunächst ist festzustellen, dass in einer Studie (Söderström et al. 2017) das extrapolierte Vorhersagemodell für Patientinnen und Patienten mit einem Risikofaktor - etwa Alter > 55 Jahre - bei einer Dosis von 1,8 Gy eine Auftretenshäufigkeit von 2,4 % vorhersagte. Allerdings wurde auch bei einer Strahlendosis von 0 Gy eine Auftretenshäufigkeit von 2,1 % vorhergesagt. Tatsächlich beobachtet wurden in einer anderen Studie (Hedström 2019) nur Fälle bei einer mittleren Dosis von über 3,6 Gy.
Zusammenfassend liegt keine klare Evidenz vor, dass das Risiko einer strahlenassoziierten Dysphagie oder Aspiration bei einer Dosis von 1,8 Gy erhöht ist.
Laryngeales Ödem: In keiner berücksichtigten Studie fand sich Evidenz für eine erhöhte Auftretenshäufigkeit laryngealer Ödeme bei einer Dosis von 1,8 Gy.
Eingeschränkte Sprechfähigkeit: Zunächst ist festzustellen, dass in einer Studie (Vainshtein et al. 2014) das extrapolierte Vorhersagemodell bei einer Dosis von 1,8 Gy eine Häufigkeit von 7,1 % vorhersagte. Allerdings wurde auch bei einer Strahlendosis von 0 Gy eine Auftretenshäufigkeit von 6,5 % vorhergesagt. Eine Einschränkung der Studie ergibt sich daraus, dass die niedrigste beobachtete Dosis 14 Gy war.
Zusammenfassend liegt keine klare Evidenz vor, dass das Risiko einer strahlenassoziierten eingeschränkten Sprechfähigkeit bei einer Dosis von 1,8 Gy erhöht ist.
Laryngeale Mukositis: Da die Inzidenz laryngealer Mukositis etwas geringer als die der oropharyngealen Mukositis ist (Bentzen et al. 2001), liegt wie für die pharyngeale Mukositis keine klare Evidenz vor, dass das Risiko von strahlenassoziierter laryngealer Mukositis bei einer Dosis von 1,8 Gy erhöht ist.
Perichondritis und Chondronecrosis: In keiner berücksichtigten Studie fand sich Evidenz für eine erhöhte Auftretenshäufigkeit von Perichondritis und Chondronecrosis bei einer Dosis von 1,8 Gy.
2.5.9 Implikationen für die Grenzwertsetzung
Die Äquivalentdosis der oberen Atemwege bei Einhaltung des Grenzwerts der effektiven Dosis von 20 mSv liegt in den betrachteten Szenarien der Inhalation von Radionukliden bei maximal 1,8 Sv. Durch den Wichtungsfaktor > 1 für die assoziierte Strahlenqualität liegt die zugehörige Energiedosis unter 1,8 Gy und ist damit kleiner als Dosiswerte, bei denen Evidenz für strahlenassoziierte nichtneoplastische gesundheitliche Effekte in den oberen Atemwegen vorliegt.
3 Literatur
| Adams et al. 2012 | Adams MJ, Grant EJ, Kodama K, Shimizu Y, Kasagi F, Suyama A, Sakata R, Akahoshi M. Radiation dose associated with renal failure mortality: a potential pathway to partially explain increased cardiovascular disease mortality observed after wholebody irradiation. Radiat Res. 2012 Feb 177(2):220-8, doi:10.1667/rr2746.1. Epub 2011 Dec 7 |
| Agate et al. 2008 | Agate L, Mariotti S, Elisei R, Mossa P, Pacini F, Molinaro E, Grasso L, Masserini L, Mokhort T, Vorontsova T, Arynchyn A, Tronko MD, Tsyb A, Feldt-Rasmussen U, Juul A, Pinchera A. Thyroid autoantibodies and thyroid function in subjects exposed to Chernobyl fallout during childhood: Evidence for a transient radiationinduced elevation of serum thyroid antibodies without an increase in thyroid autoimmune disease. J Clin Endocrinol MeTabelle 2008 Jul 93(7):2729-36, doi: 10.1210/jc.2008-0060. Epub 2008 Apr 22 |
| Akgun et al. 2014 | Akgun Z, Atosy BM, Ozen Z, Yavuz D, Gulluoglu B, Sengoz M, Abacioglu U. V30 as a predictor for radiationinduced hypothyroidism: a dosimetric analysis in patients who received radiotherapy to the neck. Radiat Oncol. 2014 May 2;9:104, doi: 10.1186/1748-717X-9-104 |
| Allam et al. 2020 | Allam O, Park KE, Chandler L, Mozaffari MA, Ahmad M, Lu X, Alperovich M. The impact of radiation on lymphedema: a review of the literature. Gland Surgery 2020 Apr;9(2):596-602, doi: 10.21037/gs.2020.03.20 |
| Alwood et al. 2017 | Alwood JS, Tran LH, Schreurs AS, Shirazi-Fard Y, Kumar A, Hilton D, Tahimic CGT, Globus RK. Dose- and Ion-Dependent Effects in the Oxidative Stress Response to Space-Like Radiation Exposure in the Skeletal System. Int J Mol Sci. 2017 Oct 10;18(10):2117, doi: 10.3390/ijms18102117 |
| Anderson et al. 1977 | Anderson RE, Olson GB, Autry JR, Howarth JL, M TG, Bartels PH. Radiosensitivity of T and B lymphocytes: IV. Effect of whole body irradiation upon various lymphoid tissues and numbers of recirculating lymphocytes. J Immunol. 1977 Apr 118(4):1191-200 |
| Anderson et al. 2014 | Anderson NJ, Wada M, Schneider-Kolsky M, Rolfo M, Joon DL, Khoo V. Dosevolume response in acute dysphagia toxicity : Validating QUANTEC recommendations into clinical practice for head and neck radiotherapy. QUANTEC recommendations into clinical practice for head and neck. Acta Oncol. 2014 Oct 53(10):1305-11, doi:10.3109/0284186X.2014.933874. Epub 2014 Jul 1 |
| Avraham et al. 2010 | Avraham T, Yan A, Zampell JC, Daluvoy SV, Haimovitz-Friedman A, Cordeiro AP, Mehrara BJ. Radiation therapy causes loss of dermal lymphatic vessels and interferes with lymphatic function by TGF-beta1-mediated tissue fibrosis. Am J Physiol Cell Physiol. 2010 Sep;299(3):C589-605. doi:10.1152/ajpcell.00535.2009. Epub 2010 Jun 2 |
| Baker et al. 2014 | Baker A, Semple JL, Moore S, Johnston M. Lymphatic function is impaired following irradiation of a single lymph node. Lymphat Res Biol. 2014 Jun;12(2):76-88. doi:10.1089/lrb.2013.0036. Epub 2014 May 16 |
| Baxter et al. 2005 | Baxter NN, Habermann EB, Tepper JE, Durham SB, Virnig BA. Risk of pelvic fractures in older women following pelvic irradiation. JAMA. 2005 Nov 23;294(20):2587-93, doi: 10.1001/jama.294.20.2587 |
| Becker et al. 1997 | Becker M, Schroth G, Zbären P, Delavelle J, Greiner R, Vock P, Allal A, Rüfenacht DA, Terrier F. Longterm Changes Induced by High-Dose Irradiation of the Head and Neck Region: Imaging Findings. Radiographics. 1997 Jan;17(1):5-26, doi:10.1148/radiographics.17.1.9017796 |
| Bellés et al. 2017 | Bellés M, Gonzalo S, Serra N, Esplugas R, Arenas M, Domingo JL, Linares V. Environmental exposure to lowdoses of ionizing radiation. Effects on early nephrotoxicity in mice. Environ Res. 2017 Jul;156:291-296, doi:10.1016/j.envres.2017.03.034. Epub 2017 Apr 3 |
| Benninghoff et al. 1969 | Benninghoff DL, Tyler RW, Everett NB. Repopulation of irradiated lymph nodes by recirculating lymphocytes. Radiat Res. 1969 Feb;37(2):381-400 |
| Bentzen et al. 2001 | Bentzen SM, Saunders MI, Dische S, Bond SJ. Radiotherapyrelated early morbidity in head and neck cancer: Quantitative clinical radiobiology as deduced from the CHART trial. Radiother Oncol. 2001 Aug;60(2):123-35, doi: 10.1016/s0167-8140(01)00358-9 |
| Bhide et al. 2012 | Bhide SA, Gulliford S, Schick U, Miah A, Zaidi S, Newbold K, Nutting CM, Harrington KJ. Dose - response analysis of acute oral mucositis and pharyngeal dysphagia in patients receiving induction chemotherapy followed by concomitant chemo-IMRT for head and neck cancer. Radiother Oncol. 2012 Apr;103(1):88-91, doi:10.1016/j.radonc.2011.12.027. Epub 2012 Jan 24 |
| Blackburn und Wells 1963 | Blackburn J, Wells AB. Radiation damage to growing bone: the effect of X-ray doses of 100 to 1,000 r on mouse tibia and kneejoint. Br J Radiol. 1963 Jul;36:505-13, doi: 10.1259/0007-1285-36-427-505 |
| Bonfiglio 1953 | Bonfiglio M. The pathology of fracture of the femoral neck following irradiation. Am J Roentgenol Radium Ther Nucl Med. 1953 Sep;70(3):449-59 |
| Boomsma et al. 2011 | Boomsma MJ, Bijl HP, Langendijk JA. Radiationinduced hypothyroidism in head and neck cancer patients: A systematic review. Radiother Oncol. 2011 Apr;99(1):1-5, doi: 10.1016/j.radonc.2011.03.002. Epub 2011 Apr 1 |
| Bozzola et al. 1993 | Bozzola M, Giorgiani G, Locatelli F, Cisternino M, Gambarana D, Zecca M, Torcetta F, Severi F. Growth in children after bone marrow transplantation. Horm Res. 1993;39(3-4):122-6, doi: 10.1159/000182711 |
| Büntzel et al. 2007 | Büntzel J, Glatzel M, Mücke R, Micke O, Bruns F. Influence of amifostine on late radiationtoxicity in head and neck cancer - a followup study. Anticancer Res. 2007 Jul-Aug;27(4A):1953-6 |
| Burge 1975 | Burge JS. Histological changes in cervical lymph nodes following clinical irradiation. Proc R Soc Med. 1975 Feb;68(2):77-9 |
| Canaris et al. 2000 | Canaris GJ, Manowitz NR, Mayor G, Ridgway EC. The Colorado thyroid disease prevalence study. Arch Intern Med. 2000 Feb;28;160(4):526-34, doi: 10.1001/archinte.160.4.526 |
| Cao et al. 2011 | Cao X, Wu X, Frassica D, Yu B, Pang L, Xian L, Wan M, Lei W, Armour M, Tryggestad E, Wong J, Wen CY, Lu WW, Frassica FJ. Irradiation induces bone injury by damaging bone marrow microenvironment for stem cells. Proc Natl Acad Sci U S A. 2011 Jan 25;108(4):1609-14, doi: 10.1073/pnas.1015350108. Epub 2011 Jan 10 |
| Cassady 1995 | Cassady JR. Clinical radiation nephropathy. Int J Radiat Oncol Biol Phys. 1995 Mar 30;31(5):1249-56, doi:10.1016/0360-3016(94)00428-N |
| Chandler 1979 | Chandler JR. Radiation fibrosis and necrosis of the larynx. Ann Otol Rhinol Laryngol. 1979 Jul-Aug;88(4 Pt 1):509-14, doi: 10.1177/000348947908800410 |
| Cheng et al. 2008 | Cheng JC, Schultheiss TE, Wong JY. Impact of drug therapy, radiation dose, and dose rate on renal toxicity following bone marrow transplantation. Int J Radiat Oncol Biol Phys. 2008 Aug 1;71(5):1436-43, doi: 10.1016/j.ijrobp.2007.12.009. Epub 2008 Mar 20 |
| Cheng et al. 2018 | Cheng J, Li F, Wang G, Guo W, Huang S, Wang B, Li C, Jiang Q, Cai L, Cui J. Optimal LDR to Protect the Kidney From Diabetes: Whole-Body Exposure to 25 mGy X-rays Weekly for 8 Weeks Efficiently Attenuates Renal Damage in Diabetic Mice. Dose Response. 2018 Sep 6;16(3):1559325818789843, doi: 10.1177/1559325818789843. eCollection 2018 Jul-Sep |
| Chera et al. 2017 | Chera BS, Fried D, Price A, Amdur RJ, Mendenhall W, Lu C, Das S, Sheets N, Marks L, Mavrodis P. Dosimetric predictors of patient reported xerostomia and dysphagia with deintensified chemoradiotherapy for HPV-associated oropharyngeal squamous cell carcinoma. Int J Radiat Oncol Biol Phys. 2017 Aug 1;98(5):1022-1027. doi:10.1016/j.ijrobp.2017.03.034. Epub 2017 Mar 27 |
| Christianen et al. 2012 | Christianen MEMC, Schilstra C, Beetz I, Muijs CT, Chouvalova O, Burlage FR, Doornaert P, Koken PW, Leemans CR, Rinkel RNPM, de Bruijn MJ, de Bock GH, Roodenburg JL, van der Laan BF, Slotman BJ, Verdonckde Leeuw IM, Bijl HP, Langendijk JA. Predictive modelling for swallowing dysfunction after primary (chemo)radiation: Results of a prospective observational study. Radiother Oncol 2012 Oct;105(1):107-14, doi: 10.1016/j.radonc.2011.08.009. Epub 2011 Sep 8 |
| Cohen et al. 2010 | Cohen EP, Pais P, Moulder JE. Chronic kidney disease after hematopoietic stem cell transplantation. Semin Nephrol. 2010 Nov;30(6):627-34, doi: 10.1016/j.semnephrol.2010.09.010 |
| Cohen et al. 2019 | Cohen EP, Hankey KG, Farese AM, Parker GA, Jones JW, Kane MA, Bennett A, MacVittie TJ. Radiation Nephropathy in a Nonhuman Primate Model of Partialbody Irradiation with Minimal Bone Marrow Sparing-Part 1: Acute and Chronic Kidney Injury and the Influence of Neupogen. Health Phys. 2019 Mar;116(3):401-408, doi:10.1097/HP.0000000000000960 |
| Congdon 1966 | Congdon CC. The destructive effect of radiation on lymphatic tissue. Cancer Res. 1966 Jun;26(6):1211-20 |
| Cosgriff und | Cosgriff N, Gordon S. Cancerrelated lymphedema in males: A literature review. J Lymphoedema. 2010;5(2):49-61 Gordon 2010 |
| Cozzarini et al. 2016 | Cozzarini C, Noris Chiorda B, Sini C, Fiorino, Briganti A, Montorsi F, Di Muzio N. Hematologic Toxicity in Patients Treated With Postprostatectomy Whole-Pelvis Irradiation With Different Intensity Modulated Radiation Therapy Techniques Is Not Negligible and Is Prolonged: Preliminary Results of a Longitudinal, Observational Study. Int J Radiat Oncol Biol Phys. 2016 Jun 1;95(2):690-695, doi: 10.1016/j.ijrobp.2016.01.022. Epub 2016 Jan 28 |
| Crowder und Austin 2005 | Crowder C, Austin D. Age ranges of epiphyseal fusion in the distal tibia and fibula of contemporary males and females. J Forensic Sci. 2005 Sep;50(5):1001-7 |
| Cui et al. 2014 | Cui Y, Wilder J, Rietz C, Gigliotti A, Tang X, Shi Y, Guilmette R, Wang H, George G, de Magaldi EN, Chu SG, Doyle-Eisele M, McDonald JD, Rosas IO, El-Chemaly S. Radiationinduced impairment in lung lymphatic vasculature. Lymphat Res Biol. 2014 Dec;12(4):238-50. doi: 10.1089/lrb.2014.0012 |
| Cukurova und Cetinkaya 2010 | Cukurova I, Cetinkaya EA. Radionecrosis of the larynx: Case report and review of the literature. Acta Otorhinolaryngol Ital. 2010 Aug;30(4):205 |
| Dai et al. 2016 | Dai T, Cui C, Cao W, Jiang Z, Li S. A refined mouse hind limb model of secondary lymphedema. Int J Clin Exp Med. 2016 Apr 9(4):7565-72 |
| Daley et al. 2010 | Daley SK, Bernas MJ, Stea BD, Bracamonte E, McKenna, Stejskal A, Hirleman ED, Witte MH. Radioprotection from radiationinduced lymphedema without tumor protection. Lymphology. 2010 Jun;43(2):48-58 |
| Dambrain et al. 1988 | Dambrain R, Dhem A, Gueulette J, Wambersie A. Bone vitality in the cat's irradiated jaw. Histological study. Strahlenther Onkol. 1988 Jun;164(6):351-6 |
| Dambrain et al. 1990 | Dambrain R, Raphael B, Dhem A, Lebeau J. Radiation osteitis of the clavicle following radiotherapy and radical neck dissection of head and neck cancer. Bull Group Int Rech Sci Stomatol Odontol. 1990 Jul;33(2):65-70 |
| Damron et al. 2008 | Damron TA, Horton JA, Pritchard MR, Stringer MT, Margulies BS, Strauss JA, Spadaro JA, Farnum CE. Histomorphometric Evidence of Growth Plate Recovery Potential after Fractionated Radiotherapy: An In Vivo Model. Radiat. Res. 2008 Sep;170:284-291, doi:10.1667/RR1254.1 |
| Das et al. 1981 | Das SK, Franklin JD, O'Brien BM, Morrison WA. A practical model of secondary lymphedema in dogs. Plast Reconstr Surg. 1981 Sep;68(3):422-8 |
| Davis et al. 2004 | Davis S, Kopecky KJ, Hamilton TE, Onstad L and the Hanford Thyroid Disease Study Team. Thyroid neoplasia, autoimmune thyroiditis, and hypothyroidism in persons exposed to iodine 131 from the Hanford nuclear site. JAMA. 2004 Dec 1;292(21):2600-13, doi: 10.1001/jama.292.21.2600 |
| Dawson et al. 2010 | Dawson LA, Kavanagh BD, Paulino AC, Das SK, Miften M, Li XA, Pan C, Ten Haken RK, Schultheiss TE. Radiationassociated kidney injury. Int J Radiat Oncol Biol Phys. 2010 Mar 1;76(3 Suppl):S108-15, doi: 10.1016/j.ijrobp.2009.02.089 |
| Dawson et al. 2014 | Dawson LA, Horgan A, Cohen EP. Kidney and Urete. In: Rubin P, Constine LS, Marks LB (Eds). ALERT - Adverse Late Effects of Cancer Treatment. Volume 2: Normal Tissue Specific Sites and Systems Medical Radiology. Springer, Berlin, Heidelberg 2014, ISBN 9783540758631 |
| de Bruyn 1948a | de Bruyn PP. The effect of X-rays on the lymphatic nodule, with reference to the dose and relative sensitivities of different species. Anat Rec. 1948 Jul;101(3):373-405 |
| de Bruyn 1948b | de Bruyn PPH. Lymph node and intestinal lymphatic tissues. In: Bloom W (Ed). Histopathology of irradiation from external and internal sources: National nuclear energy series. McGraw-Hill, New York, 1948, pp. 348-445,ISBN 9781258741969 |
| de Felice et al. 2018 | de Felice F, de Vincentiis M, Luzzi V, Magliulo G, Tombolini M, Ruoppolo G, Polimeni A. Late radiationassociated dysphagia in head and neck cancer patients: evidence, research and management. Oral Oncology. 2018 Feb;77:125-30, doi:10.1016/j.oraloncology.2017.12.021. Epub 2018 Jan 4 |
| Deantonio et al. 2013 | Deantonio L, Masini L, Brambilla M, Pia F, Krengli M. Dysphagia after definitive radiotherapy for head and neck cancer. Strahlenther Onkol. 2013 Mar;189:230-6, doi:10.1007/s00066-012-0288-8. Epub 2013 Jan 16 |
| Deng et al. 2012 | Deng J, Ridner SH, Dietrich MS, Wells N, Wallston KA, Sinard RJ, Cmelak AJ, Murphy BA. Prevalence of secondary lymphedema in patients with head and neck cancer. J Pain Symptom Manage. 2012 Feb;43(2):244-52. doi: 10.1016/j.jpainsymman.2011.03.019. Epub 2011 Jul 30 |
| Dettman et al. 1966 | Dettman PM, King ER, Zimberg YH. Evaluation of lymph node function following irradiation or surgery. Am J Roentgenol Radium Ther Nucl Med. 1966 Mar;96(3):711-8, doi: 10.2214/ajr.96.3.711 |
| Dong et al. 2017 | Dong Y, Ridge JA, Li T, Lango MN, Churilla TM, Bauman JR, Galloway TJ. Longterm toxicities in 10-year survivors of radiation treatment for head and neck cancer. Oral Oncol. 2017 Aug;71:122-8, doi:10.1016/j.oraloncology.2017.05.009. Epub 2017 Jun 23 |
| Duprez et al. 2013 | Duprez F, Madani I, de Potter B, Boterberg T, de Neve W. Systematic Review of Dose-Volume Correlates for Structures Related to Late Swallowing Disturbances After Radiotherapy for Head and Neck Cancer. Dysphagia. 2013 Sep;28(3):337-49, doi:10.1007/s00455-013-9452-2. Epub 2013 Feb 22 |
| Edwards et al. 2011 | Edwards BJ, Raisch DW, Shankaran V, McKoy JM, Gradishar W, Bunta AD, Samaras AT, Boyle SN, Bennett CL, West DP, Guise TA. Cancer therapy associated bone loss: implications for hip fractures in midlife women with breast cancer. Clin Cancer Res. 2011 Feb 1;17(3):560-8, doi: 10.1158/1078-0432.CCR-10-1595 |
| Eisbruch et al. 2011 | Eisbruch A, Kim HM, Feng FY, Lyden TH, Haxer MJ, Feng M, Worden FP, Bradford CR, Prince ME, Moyer JS, Wolf GT, Chepeha DB, ten Haken RK. Chemo-IMRT of oropharyngeal cancer aiming to reduce dysphagia: Swallowing organs late complication probabilities and dosimetric correlates. Int J Radiat Oncol Biol Phys. 2011 Nov 1;81(3):e93-9, doi:10.1016/j.ijrobp.2010.12.067. Epub 2011 May 17 |
| Ellis et al. 2008 | Ellis MJ, Parikh CR, Inrig JK, Kanbay M, Patel UD. Chronic kidney disease after hematopoietic cell transplantation: a systematic review. Am J Transplant. 2008 Nov;8(11):2378-90, doi:10.1111/j.1600-6143.2008.02408.x |
| El-Shebiney et al. 2018 | El-Shebiney M, El-Mashad N, El-Mashad W, El-Ebiary AA, Kotkat AE. Radiotherapeutic factors affecting the incidence of developing hypothyroidism after radiotherapy for head and neck squamous cell cancer. J Egypt Natl Canc Inst. 2018 Mar;30(1):33-38, doi: 10.1016/j.jnci.2018.01.004. Epub 2018 Feb 7 |
| Engeset 1966 | Engeset A. Local irradiation of lymph nodes in rats. Progr Exp Tumor Res. 1966;8:225-70 |
| Euratom 2014 | Rat der Europäischen Union. Richtlinie 2013/59/EURATOM des Rates vom 5. Dezember 2013 zur Festlegung grundlegender Sicherheitsnormen für den Schutz vor den Gefahren einer Exposition gegenüber ionisierender Strahlung und zur Aufhebung der Richtlinien 89/618/Euratom, 90/641/Euratom, 96/29/Euratom, 97/43/Euratom und 2003/122/EURATOM . Amtsblatt der Europäischen Union, L 13/1, 17.01.2014 |
| Fajardo 1994 | Fajardo LF. Effects of ionizing radiation on lymph nodes: A review. Front Radiat Ther Oncol. 1994;28:37-45, doi: 10.1159/00042337 |
| Frowen et al. 2013 | Frowen J, Hornby C, Collins M, Senthi S, Cassumbhoy R, Corry J. Reducing posttreatment dysphagia: Support for the relationship between radiation dose to the pharyngeal constrictors and swallowing outcomes. Pract Radiat Oncol. 2013 Oct-Dec;3(4):e187-94, doi:10.1016/j.prro.2012.11.009. Epub 2013 Jan 3 |
| Fujiwara et al. 1992 | Fujiwara S, Sposto R, Ezaki H, Akiba S, Neriishi K, Kodama K, Hosoda Y, Shimaoka K. Hyperparathyroidism among atomic bomb survivors in Hiroshima. Radiat Res. 1992 Jun;130(3):372-8 |
| Fujiwara et al. 2015 | Fujiwara M, Kamikonya N, Odawara S, Suzuki H, Niwa Y, Takada Y, Doi H, Terada T, Uwa N, Sagawa K, Hirota S. The threshold of hypothyroidism after radiation therapy for head and neck cancer: a retrospective analysis of 116 cases. J Radiat Res 2015 May;56(3):577-582, doi:10.1093/jrr/rrv006. Epub 2015 Mar 27 |
| Gamer 1988 | Gamer AO. Histomorphologische und -morphometrische Untersuchungen von frühen Knochenschäden nach Inkorporation optimal kanzerogener Dosen von 239-Plutonium an männlichen Ratten verschiedenen Alters. Kernforschungszentrum Karlsruhe KfK-4380 (Februar 1988) |
| Goldfarb et al. 2009 | Goldfarb S, McCullough PA, McDermott J, Gay SB. Contrastinduced acute kidney injury: specialtyspecific protocols for interventional radiology, diagnostic computed tomography radiology, and interventional cardiology. Mayo Clin Proc. 2009 Feb;84(2):170-9, doi: 10.1016/S0025-6196(11)60825-2 |
| Goldwein 1991 | Goldwein JW. Effects of radiation therapy on skeletal growth in childhood. Clin Orthop Relat Res. 1991 Jan;(262):101-7 |
| Gondos 1973 | Gondos B. Late clinical and roentgen observations following thorotrast administration. Clin Radiol. 1973 Apr;24(2):195-203, doi: 10.1016/s0009-9260(73)80082-0 |
| Gong et al. 2013 | Gong B, Oest ME, Mann KA, Damron TA, Morris MD. Raman spectroscopy demonstrates prolonged alteration of bone chemical composition following extremity localized irradiation. Bone. 2013 Nov;57(1):252-8, doi: 10.1016/j.bone.2013.08.014. Epub 2013 Aug 23 |
| Green et al. 2012 | Green DE, Adler BJ, Chan ME, Rubin CT. Devastation of adult stem cell pools by irradiation precedes collapse of trabecular bone quality and quantity. J. Bone Miner Res. 2012 Apr;27(4):749-59, doi:10.1002/jbmr.1505 |
| Grimm 1971 | Grimm G. Klinische und experimentelle Untersuchungen über die radiogene Knochenschädigung am Kieferapparat. Nova Acta Leopoldina 1971;36:196 |
| Gupta et al. 2012 | Gupta SK, Singla S, Bal C. Renal and hematological toxicity in patients of neuroendocrine tumors after peptide receptor radionuclide therapy with Lu-DOTATATE. Cancer Biother Radiopharm. 2012 Nov;27(9):593-9, doi: 10.1089/cbr.2012.1195. Epub 2012 Sep 25 |
| Guttmann und Kohn 1960 | Guttmann PH, Kohn HI. Progressive intercapillary glomerulosclerosis in the mouse, rat, and Chinese hamster, associated with aging and xray exposure. Am J Pathol. 1960 Sep;37:293-307 |
| Hale et al. 1991 | Hale ML, Briggs R, McCarthy KF. Interaction of lymphocytes and high endothelial venules in irradiated lymph nodes. Radiat Res. 1991 Feb;125(2):129-33 |
| Halkud et al. 2014 | Halkud R, Shenoy AM, Naik SM, Pasha T, Chavan P, Sidappa KT. Chondroradionecrosis of Larynx a Delayed Complication of Radiotherapy: Management and Review of Literature. Indian J Surg Oncol. 2014 Jun;5(2):128-33, doi:10.1007/s13193-014-0315-6. Epub 2014 May 23 |
| Hamilton et al. 2006 | Hamilton SA, Pecaut MJ, Gridley DS, Travis ND, Bandstra ER, Willey JS, Nelson GA, Bateman TA. A murine model for bone loss from therapeutic and spacerelevant sources of radiation. J Appl Physiol (1985). 2006 Sep;101(3):789-93, doi: 10.1152/japplphysiol.01078.2005. Epub 2006 Jun 1 |
| Hattner et al. 1982 | Hattner RS, Hartmeyer J, Wara WM. Characterization of radiationindcued photopenic abnormalities on bone scans. Radiology. 1982 Oct;145(1):161-3, doi: 10.1148/radiology.145.1.6812159 |
| Hautmann et al. 2015 | Hautmann AH, Wolff D, Hilgendorf I, Fehn U, Edinger M, Hoffmann P, Herr W, Kölbl O, Holler B, Sporrer D, Holler E, Hautmann MG. Total nodal irradiation in patients with severe treatmentrefractory chronic graftversushost disease after allogeneic stem cell transplantation: Response rates and immunomodulatory effects. Radiother Oncol. 2015 Aug;116(2):287-93. doi: 10.1016/j.radonc.2015.07.035. Epub 2015 Aug 6 |
| Hedström 2019 | Hedström J. Radiationinduced dysphagia in head and neck cancer - risk structures and methodological aspects (PhD thesis). University of Gothenburg; 2019 |
| Heineke 1905 | Heineke H. Experimentelle Untersuchungen über die Einwirkung der Röntgenstrahlen auf innere Organe. Mitt Grenzgeb Med u Chir. 1905;14:21-94 |
| Herman et al. 1968 | Herman PG, Benninghoff DL, Mellins HZ. Radiation effect on the barrier function of the lymph node. Radiology. 1968 Oct;91(4):698-702. doi: 10.1148/91.4.698 |
| Heuck und Lauritzen 1967 | Heuck F, Lauritzen C. Veränderungen von Mineralgehalt und Struktur des femurs nach gynäkologischer Strahlentherapie. Strahlenther. 1967;66:87-92 |
| Hinkel 1943 | Hinkel CL. The effect of roentgen rays upon the composition and vascularity of growing rat bones. Am J Roentgenol 1943;50:516-526 |
| Hopewell 2003 | Hopewell JW. Radiationtherapy effects on bone density. Med Pediatr Oncol. 2003 Sep;41(3):208-11, doi: 10.1002/mpo.10338 eCollection 2014 Jan |
| Hulth und Westerborn 1962 | Hulth A, Westerborn O. Early Changes of the Growth Zone in the Rabbit Following Roentgen Irradiation: Autoradiographic Investigation after the Administration of Radiosulphate. Br J Exp Pathol. 1962 Apr;43(2):137-41 |
| Hutchison et al. 2019 | Hutchison AR, Cartmill B, Wall LR, Ward EC. Dysphagia optimized radiotherapy to reduce swallowing dysfunction severity in patients undergoing treatment for head and neck cancer: A systematized scoping review. Head Neck. 2019 Jun;41(6):2024-33, doi:10.1002/hed.25688. Epub 2019 Feb 5 |
| IAEA und ICRU 2008 | International Atomic Energy Agency (IAEA) und International Commission on Radiation Units and Measurements (ICRU). Relative Biological Effectiveness in Ion Beam Therapy, Technical Reports Series No. 461, IAEA, Wien 2008, ISBN 9789201078070 |
| ICRP 1991 | International Commission on Radiological Protection (ICRP). Recommendations of the ICRP. ICRP Publication 60, Ann. ICRP 21(1-3), SAGE Publications Ltd, 1991, ISBN 0080411444 |
| ICRP 2002 | International Commission on Radiological Protection (ICRP). Basic Anatomical and Physiological Data for Use in Radiological Protection Reference Values. ICRP Publication 89. Ann. ICRP 32 (3-4), SAGE Publications Ltd, 2002, ISBN 9780080442662 |
| ICRP 2007 | International Commission on Radiological Protection (ICRP). Recommendations of the ICRP. ICRP Publication 103. Ann. ICRP 37(2-4):1-332, SAGE Publications Ltd, 2007, ISBN 9780702030482, doi: 10.1016/j.icrp.2007.10.003 |
| ICRP 2009b | International Commission on Radiological Protection (ICRP). Realistic reference phantoms: an ICRP/ICRU joint effort. A report of adult Reference Computational Phantoms. ICRP Publication 110. Ann. ICRP 39 (2):1-164, SAGE Publications Ltd, 2009, ISBN 9780702041860, doi: 10.1016/j.icrp.2009.09.001 |
| ICRP 2010 | International Commission on Radiological Protection (ICRP). (Authors on behalf of ICRP: Petoussi-Henss N, Bolch WE, Eckerman KF, Endo A, Hertel N, Hunt J, Pelliccioni M, Schlattl H, Zankl M). Conversion Coefficients for Radiological Protection Quantities for External Radiation Exposures. ICRP Publication 116, Ann. ICRP 40 (2-5):1-257, Elsevier, Oxford, 2010, ISBN 9781455728589, doi: 10.1016/j.icrp.2011.10.001 |
| ICRP 2012a | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Stewart FA, Akleyev AV, Hauer-Jensen M, Hendry JH, Kleiman NJ, Macvittie TJ, Aleman BM, Edgar AB, Mabuchi K, Muirhead CR, Shore RE, Wallace WH). Statement on Tissue Reactions/Early and Late Effects of Radiation in Normal Tissues and Organs - Threshold Doses for Tissue Reactions in a Radiation Protection Context. ICRP Publication 118, Ann. ICRP. 2012 Feb;41(1-2):1-322, Elsevier, Oxford, 2012, ISBN 9780702052279, doi:10.1016/j.icrp.2012.02.001 |
| ICRP 2015 | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Paquet F, Etherington G, Bailey MR, Leggett RW, Lipsztein J, Bolch W, Eckerman KF, Harrison JD). Occupational Intakes of Radionuclides: Part 1. ICRP Publication 130. Ann. ICRP. 2015 Sep;44(2):5-188, Sage Publishing, London, ISBN 9781473944404, doi:10.1177/0146645315577539 |
| ICRP 2016a | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Paquet F, Bailey MR, Leggett RW, Lipsztein J, Fell TP, Smith T, Nosske D, Eckerman KF, Berkovski V, Ansoborlo E, Giussani A, Bolch WE, Harrison JD). Occupational Intakes of Radionuclides: Part 2. ICRP Publication 134. Ann ICRP. 2016 Dec;45(3-4):7-349, Sage Publishing, London, ISBN 9781526408310, doi: 10.1177/0146645316670045 |
| ICRP 2016b | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Bolch WE, Jokisch D, Zankl M, Eckerman KF, Fell T, Manger R, Endo A, Hunt J, Kim KP, Petoussi-Henss N). The ICRP computational framework for internal dose assessment for reference adults: specific absorbed fractions. ICRP Publication 133. Ann. ICRP Nov;45(2),5-73 Sage Publishing, London, ISBN 9781526404152, doi:10.1177/0146645316661077 |
| ICRP 2017 | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Paquet F, Bailey MR, Leggett RW, Lipsztein J, Marsh J, Fell TP, Smith T, Nosske D, Eckerman KF, Berkovski V, Blanchardon E, Gregoratto D, Harrison JD). Occupational Intakes of Radionuclides: Part 3. ICRP Publication 137. Ann. ICRP. 2017 Dec;46(3-4):1-486, Sage Publishing, London, ISBN 9781526440167, doi: 10.1177/0146645317734963 |
| ICRP 2019 | International Commission on Radiological Protection (ICRP) (Authors on behalf of ICRP: Paquet F, Bailey MR, Leggett RW, Etherington G, Blanchardon E, Smith T, Ratia G, Melo D, Fell TP, Berkovski V, Harrison JD). Occupational Intakes of Radionuclides: Part 4. ICRP Publication 141. Ann. ICRP. 2019 Dec;48(2-3):9-501. Sage Publishing, London, ISBN 9781529700749, doi: 10.1177/0146645319834139 |
| Imaizumi et al. 2006 | Imaizumi M, Usa T, Tominaga T, Neriishi K, Akahoshi M, Nakashima E, Ashizawa K, Hida A, Soda M, Fujiwara S, Yamada M, Ejima E, Yokoyama N, Okubo M, Sugino K, Suzuki G, Maeda R, Nagataki S, Eguchi K. Radiation doseresponse relationships for thyroid nodules and autoimmune thyroid diseases in Hiroshima and Nagasaki atomic bomb survivors 55-58 years after radiation exposure. JAMA. 2006 Mar 1;295(9):1011-22, doi: 10.1001/jama.295.9.1011 |
| Inskip et al. 2018 | Inskip PD, Veiga LHS, Brenner AV, Sigurdson AJ, Ostroumova E, Chow EJ, Stovall M, Smith SA, Weathers RE, Leisenring W, Robison LL, Armstrong GT, Sklar CA, Lubin JH. Hypothyroidism after radiation therapy for childhood cancer: A report from the Childhood Cancer Survivor Study. Radiat Res. 2018 Aug;190(2):117-132, doi: 10.1667/RR14888.1. Epub 2018 May 15 |
| Jee und Arnold 1961 | Jee WSS, Arnold JS. The toxicity of plutonium deposited in skeletal tissues of beagles. I. The relation of the distribution of plutonium to the sequence of histopathologic bone changes. Lab Invest. 1961 Jul-Aug;10:797-825 |
| Jones und Knox 2014 | Jones JC, Knox SJ. Lymph nodes, thymus, spleen, and lymphatics. Rubin P, Constine LS, Marks LB (Eds). ALERT - adverse late effects of cancer treatment: Volume 2: Normal tissue specific sites and systems. Springer, Berlin, Heidelberg 2014, ISBN 9783540758631 |
| Kanyilmaz et al. 2017 | Kanyilmaz G, Aktan M, Koc M, Demir H, Demir LS. Radiationinduced hypothyroidism in patients with breast cancer: a retrospective analysis of 243 cases. Med Dosim. 2017 Autumn;42(3):190-196, doi: 10.1016/j.meddos.2017.03.003. Epub 2017 May 11 |
| Karami et al. 2018 | Karami M, Asri-Rezaei S, Dormanesh B, Nazarizadeh A. Comparative study of radioprotective effects of selenium nanoparticles and sodium selenite in irradiationinduced nephropathy of mice model. Int J Radiat Biol. 2018 Jan;94(1):17-27, doi:10.1080/09553002.2018.1400709. Epub 2017 Nov 29 |
| Kim et al. 2014 | Kim MY, Yu T, Wu H-G. Dose volumetric parameters for predicting hypothyroidism after radiotherapy for head and neck cancer. Jpn J Clin Oncol. 2014 Apr;44(4):331-7, doi: 10.1093/jjco/hyt235. Epub 2014 Jan 30 |
| Kindler et al. 2006 | Kindler S, Roser M, Below H, Hoffmann W, Kohlmann T, Kramer A, Kirsch G, Völzke H. Thyroid disorders in employees of a nuclear power plant. Thyroid. 2006 Oct;16(10):1009-17, doi: 10.1089/thy.2006.16.1009 |
| Kodama et al. 1996 | Kodama K, Fujiwara S, Yamada M, Kasagi F, Shimizu Y, Shigematsu I. Profiles of noncancer diseases in atomic bomb survivors. World Health Stat Q. 1996;49(1):7-16 |
| Kolar und Vrabec 1976 | Kolář J, Vrabec R. Strahlenbedingte Knochenschäden. In: Diethelm J (Ed). Röntgendiagnostik der Skeletterkrankungen. Teil 1, Springer, Berlin, Heidelberg 1976, ISBN 9783642808784, doi: 10.1007/978-3-642-80878-4 |
| Kondo et al. 2009 | Kondo H, Searby ND, Mojarrab R, Phillips J, Alwood J, Yumoto K, Almeida EA, Limoli CL, Globus RK. Totalbody irradiation of postpubertal mice with 137Cs acutely compromises the microarchitecture of cancellous bone and increases osteoclasts. Radiat Res. 2009 Mar;171(3):283-9. doi: 10.1667/RR1463.1 |
| Köst et al. 2002 | Köst S, Dörr W, Keinert K, Glaser FH, Endert G, Herrmann T. Effect of dose and dosedistribution in damage to the kidney following abdominal radiotherapy. Int J Radiat Biol. 2002 Aug;78(8):695-702, doi:10.1080/09553000210134791 |
| Kuczera et al. 2015 | Kuczera P, Adamczak M, Wiecek A. Endocrine Abnormalities in Patients with Chronic Kidney Disease. Pril (Makedon Akad Nauk Umet Odd Med Nauki). 2015;36(2):109-18, doi:10.1515/prilozi-2015-0059 |
| Lameire et al. 2005 | Lameire N, Van Biesen W, Vanholder R. Acute renal failure. Lancet. 2005 Jan 29-Feb 4;365(9457):417-30, doi:10.1016/S0140-6736(05)17831-3 |
| Lawton et al. 1992 | Lawton CA, Barber-Derus SW, Murray KJ, Cohen EP, Ash RC, Moulder JE. Influence of renal shielding on the incidence of late renal dysfunction associated with T-lymphocyte deplete bone marrow transplantation in adult patients. Int J Radiat Oncol Biol Phys. 1992;23(3):681-6, doi:10.1016/0360-3016(92)90035-g |
| Lee et al. 2016 | Lee V, Chan SY, Choi CW, Kwong D, Lam KO, Tong CC, Sze CK, Ng S, Leung TW, Lee A. Dosimetric predictors of hypothyroidism after radical intensitymodulated radiation therapy for nonmetastatic nasopharyngeal carcinoma. Clin Oncol (R Coll Radiol). 2016 Aug;28(8):e52-60, doi: 10.1016/j.clon.2016.05.004. Epub 2016 May 24 |
| Lee-Donaldson et al. 1999 | Lee-Donaldson L, Witte MH, Bernas M, Witte CL, Way D, Stea B. Refinement of a rodent model of peripheral lymphedema. Lymphology. 1999 Sep;32(3):111-7 |
| Leggett 1994 | Leggett RW. Basis for the ICRP's agespecific biokinetic model for uranium. Health Phys. 1994 Dec;67(6):589-610, doi:10.1097/00004032-199412000-00002 |
| Lenarczyk et al. 2019 | Lenarczyk M, Kronenberg A, Mäder M, North PE, Komorowski R, Cheng Q, Little MP, Chiang IH, LaTessa C, Jardine J, Baker JE. Age at Exposure to Radiation Determines Severity of Renal and Cardiac Disease in Rats. Radiat Res. 2019 Jul;192(1):63-74, doi:10.1667/RR15043.1. Epub 2019 May 16 |
| Levendag et al. 2007 | Levendag PC, Teguh DN, Voet P, van der Est H, Noever I, de Kruijf WJ, Kolkman-Deurloo IK, Prevost JB, Poll J, Schmitz PI, Heijmen BJ. Dysphagia disorders in patients with cancer of the oropharynx are significantly affected by the radiation therapy dose to the superior and middle constrictor muscle: a doseeffect relationship. Radiother Oncol. 2007 Oct;85(1):64-73, doi: 10.1016/j.radonc.2007.07.009. Epub 2007 Aug 21 |
| Lima et al. 2017 | Lima F, Swift JM, Greene ES, Allen MR, Cunningham DA, Braby LA, Bloomfield SA. Exposure to low dose X-ray radiation alters bone progenitor cells and bone microarchitecture. Radiat Res. 2017 Oct;188(4):433-442, doi: 10.1667/RR14414.1. Epub 2017 Aug 3 |
| Lin et al. 2013 | Lin Z, Wang X, Xie W, Yang Z, Che K, Wu VWC. Evaluation of clinical hypothyroidism risk due to irradiation of thyroid and pituitary glands in radiotherapy of nasopharyngeal cancer patients. J Med Imaging Radiat Oncol. 2013 Dec;57(6):713-8, doi: 10.1111/1754-9485.12074. Epub 2013 May 16 |
| López-Novoa et al. 2010 | López-Novoa JM, Martínez-Salgado C, Rodríguez-Peña AB, López-Hernández FJ. Common pathophysiological mechanisms of chronic kidney disease: therapeutic perspectives. Pharmacol Ther. 2010 Oct;128(1):61-81, doi:10.1016/j.pharmthera.2010.05.006. Epub 2010 Jun 19 |
| Ludvik et al. 1969 | Ludvik W, Wachtler F, Zaunbauer W. Veränderungen am Lymphogramm durch Operation und ionisierende Strahlen: Ein Beitrag zur Regeneration des Lymphsystems. Fortschr Geb Rontgenstr Nuklearmed. 1969 Mar;110(3):307-21, doi:10.1055/s-0029-1228568 |
| Lüllmann-Rauch 2015 | Lüllmann-Rauch R, Asan E . Histologie. 5th ed. Stuttgart: Thieme; 2015, ISBN 9783131292452 |
| Luxton 1961 | Luxton RW. Radiation nephritis. A longterm study of 54 patients. Lancet. 1961 Dec 2;2(7214):1221-4, doi:10.1016/s0140-6736(61)92590-9 |
| Luz et al. 1991 | Luz A, Gössner W, Heuck F. Bone. In: Scherer E, Streffer C, Trott KR (Eds). Radiopathology of Organs and Tissues. Medical Radiology - Diagnostic Imaging and Radiation Oncology. Springer, Berlin, Heidelberg 1991, ISBN 9783642834165 |
| Macpherson et al. 1962 | Macpherson S, Owen M, Vaughan J. The relation of radiation dose to radiation damage in the tibia of weanling rabbits injected with strontium 90. Br J Radiol. 1962 Apr; 35:221-34, doi:10.1259/0007-1285-35-412-221 |
| Marks et al. 2010 | Marks LB, Yorke ED, Jackson A, Ten Haken RK, Constine LS, Eisbruch A, Bentzen SM, Nam J, Deasy JO. Use of normal tissue complication probability models in the clinic. Int J Radiat Oncol Biol Phys. 2010 Mar 1;76(3 Suppl): S10-S19, doi: 10.1016/j.ijrobp.2009.07.1754 |
| Mavrogenis et al. 2015 | Mavrogenis AF, Megaloikonomos PD, Panagopoulos GN, Papagelopoulos PJ, Theophanides T, Anastassopoulu J. Side effects of radiation in bone and cartilage: An FT-IR analysis. J Long Term Eff Med Implants. 2015;25(4):289-95, doi: 10.1615/jlongtermeffmedimplants.2015011782 |
| Melanotte und Follis 1961 | Melanotte PL, Follis RH. Early effects of X-irradiation on cartilage and bone. Am J Pathol. 1961 Jul;39:1-15 |
| Mintz et al. 1981 | Mintz DR, Gullane PJ, Thomson DH, Ruby RR. Perichondritis of the larynx following radiation. Otolaryngol Head Neck Surg. 1981 Jul-Aug;89(4):550-4, doi:10.1177/019459988108900408 |
| Moulder und Fish 1989 | Moulder JE, Fish BL. Late toxicity of total body irradiation with bone marrow transplantation in a rat model. Int J Radiat Oncol Biol Phys. 1989 Jun;16(6):1501-9, doi:10.1016/0360-3016(89)90955-3 |
| Moulder und Fish 1997 | Moulder JE, Fish BL. Age dependence of radiation nephropathy in the rat. Radiat Res. 1997 Mar;147(3):349-53 |
| Muggenburg et al. 1999 | Muggenburg BA, Hahn FF, Ménache MG, Guilmette RA, Boecker BB. Comparative deterministic effects of inhaled, insoluble alpha- and betaparticleemitting radionuclides in dogs. Radiat Res. 1999 Dec;152(6 Suppl):23-6 |
| Nelson et al. 1976 | Nelson B, Calvo W, Fliedner TM, Herbst E, Bruch C, Schnappauf HP, Flad HD. The repopulation of lymph nodes of dogs after 1200 r wholebody X-irradiation and intravenous administration of monoculear blood leukocytes. Am J Pathol. 1976 Aug;84(2):259-82 |
| Nguyen 2011 | Nguyen NP, Abraham D, Desai A, Betz M, Davis R, Sroka T, Chi A, Gelumbauskas S, Ceizyk M, Smith-Raymond L, Stevie M, Jang S, Hamilton R, Vinh-Hung V. Impact of imageguided radiotherapy to reduce laryngeal edema following treatment for nonlaryngeal and nonhypopharyngeal head and neck cancers. Oral Oncol. 2011 Sep;47(9):900-4. doi: 10.1016/j.oraloncology.2011.06.004. Epub 2011 Jul 2 |
| Nishiyama et al. 1996 | Nishiyama N, Kozuka T, Higashihara T, Miyauchi K, Okagawa K. Acute radiation thyroiditis. Int J Radiat Oncol Biol Phys. 1996 Dec 1;36(5):1221-4, doi:10.1016/s0360-3016(96)00480-4 |
| Nogueira et al. 2017 | Nogueira A, Pires MJ, Oliveira PA. Pathophysiological Mechanisms of Renal Fibrosis: A Review of Animal Models and Therapeutic Strategies. In Vivo. 2017 Jan-Feb; 31(1):1-22, doi:10.21873/in-vivo.11019 |
| Norman et al. 2009 | Norman SA, Localio AR, Potashnik SL, Simoes Torpey HA, Kallan MJ, Weber AL, Miller LT, Demichele A, Solin LJ. Lymphedema in breast cancer survivors: Incidence, degree, time course, treatment, and symptoms. J Clin Oncol. 2009 Jan 20;27(3):390-7. doi:10.1200/JCO.2008.17.9291. Epub 2008 Dec 8 |
| Oest et al. 2015 | Oest ME, Franken V, Kuchera T, Strauss J, Damron TA. Longterm loss of osteoclasts and unopposed cortical mineral apposition following limited field irradiation. J Orthop Res. 2015 Mar;33(3):334-42, doi: 10.1002/jor.22761. Epub 2014 Nov 18 |
| Oest et al. 2018 | Oest ME, Policastro CG, Mann KA, Zimmerman ND, Damron TA. Longitudinal Effects of Single Hindlimb Radiation Therapy on Bone Strength and Morphology at Local and Contralateral Sites. J Bone Miner Res. 2018 Jan;33(1):99-112, doi:10.1002/jbmr.3289. Epub 2017 Oct 4 |
| Oikawa et al. 1997 | Oikawa T, Freeman M, Lo W, Vaughan DE, Fogo A. Modulation of plasminogen activator inhibitor-1 in vivo: a new mechanism for the antifibrotic effect of reninangiotensin inhibition. Kidney Int. 1997 Jan;51(1):164-72, doi:10.1038/ki.1997.20 |
| Orlandi et al. 2018 | Orlandi E, Iacovelli NA, Rancati T, Cicchetti A, Bossi P, Pignoli E, Bergamini C, Licitra L, Fallai C, Valdagni R, Cavallo A. Multivariable model for predicting acute oral mucositis during combined IMRT and chemotherapy for locally advanced nasopharyngeal cancer patients. Oral Oncology. 2018 Nov;86:266-72, doi:10.1016/j.oraloncology.2018.10.006. Epub 2018 Oct 11 |
| Ostroumova et al. 2009 | Ostroumova E, Brenner A, Oliynyk V, McConnell R, Robbins J, Terekhova G, Zablotska L, Likhtarev I, Bouville A, Shpak V, Markov V, Masnyk I, Ron E, Tronkon M, Hatch M. Subclinical hypothyroidism after radioiodine exposure: Ukrainian-American Cohort study of thyroid cancer and other thyroid diseases after the Chornobyl accident (1998-2000). Environ Health Perspect. 2009 May;117(5):745-50, doi: 10.1289/ehp.0800184. Epub 2008 Dec 15 |
| Ostroumova et al. 2013 | Ostroumova E, Rozhko A, Hatch M, Furukawa K, Polyanskaya O, McConnell R, Nadyrov E, Petrenko S, Romanov G, Yauseyenka V, Drozdovitch V, Minenko V, Prokopovich A, Savasteeva I, Zablotska L, Mabuchi K, Brenner AV. Measures of thyroid function among Belarusian children and adolescents exposed to iodine-131 from the accident at the Chernobyl nuclear plant. Environ Health Perspect. 2013;121(7):865-871, doi: 10.1289/ehp.1205783. Epub 2013 May 7 |
| Otter et al. 2015 | Otter S, Schick U, Gulliford S, Lal P, Franceschini D, Newbold K, Nutting C, Harrington K, Bhide S. Evaluation of the Risk of Grade 3 Oral and Pharyngeal Dysphagia Using Atlas-Based Method and Multivariate Analyses of Individual Patient Dose Distributions. Int J Radiat Oncol Biol Phys. 2015 Nov 1;93(3):507-15. doi:10.1016/j.ijrobp.2015.07.2263. Epub 2015 Jul 17 |
| Oyan et al. 2018 | Oyan S, Tatlipinar A, Atasoy BM, Güneş P, Özbeyli D, Keskin S, Değerli AD. Early effects of irradiation on laryngeal mucosa in a gastroesophageal reflux model: an experimental study. Eur Arch Otorhinolaryngol. 2018 Aug;275(8):2089-2094. doi:10.1007/s00405-018-5010-8. Epub 2018 Jun 4 |
| Pacheco und Stock 2013 | Pacheco R, Stock U. Effects of radiation on bone. Curr Osteoporos Rep. 2013 Dec;11(4):299-304, doi: 10.1007/s11914-013-0174-z |
| Pajer und Kalisnik 1991 | Pajer Z, Kalisnik M. The effect of sodium perchlorate and ionizing radiation on the thyroid parenchyme and pituitary thyrotropic cells. Oncology. 1991;48(4):317-20, doi: 10.1159/000226950 * note error in dose in abstract |
| Park et al. 2012 | Park JF, Watson CR, Buschbom RL, Dagle GE, Strom DJ, Weller RE. Biological effects of inhaled 239PuO2 in Beagles. Radiat Res. 2012 Nov;178(5):447-67. doi: 10.1667/RR2504.1. Epub 2012 Sep 21 |
| Pastouret et al. 2014 | Pastouret F, Lievens P, Leduc O, Bourgeois P, Tournel K, Lamote J, Zirak C, Leduc A. Short time effects of radiotherapy on lymphatic vessels and restorative lymphatic pathways: Experimental approaches in a mouse model. Lymphology. 2014 Jun;47(2):92-100 |
| Pinkerton et al. 2004 | Pinkerton LE, Bloom TF, Hein MJ, Ward EM. Mortality among a cohort of uranium mill workers: an update. Occup Environ Med. 2004 Jan;61(1):57-64 |
| Rancati et al. 2009 | Rancati T, Fiorino C, Sanguineti G. NTCP modeling of subacute/late laryngeal edema scored by fiberoptic examination. Int J Radiat Oncol Biol Phys. 2009 Nov 1;75(3):915-23. doi:10.1016/j.ijrobp.2009.04.087. Epub 2009 Sep 9 |
| Rancati et al. 2010 | Rancati T, Schwarz M, Allen AM, Feng F, Popovtzer A, Mittal B, Eisbruch A. Radiation dosevolume effects in the larynx and pharynx. Int J Radiat Oncol Biol Phys. 2010 Mar 1;76(3 Suppl):S64-9. doi:10.1016/j.ijrobp.2009.03.079 |
| Rezvani et al. 1991 | Rezvani M, Alcock CJ, Fowler JF, Haybittle JL, Hopewell JW, Wiernik G. Normal tissue reactions in the British Institute of Radiology Study of 3 fractions per week versus 5 fractions per week in the treatment of carcinoma of the laryngopharynx by radiotherapy. Br J Radiol. 1991 Dec;64(768):1122-33, doi:10.1259/0007-1285-64-768-1122 |
| Rockson 2018 | Rockson SG. Lymphedema after Breast Cancer Treatment. N Engl J Med. 2018; 379:1937-1944, doi: 10.1056/NEJMcp1803290 |
| Roh 2009 | Roh JL. Chondroradionecrosis of the Larynx: Diagnostic and Therapeutic Measures for Saving the Organ from Radiotherapy Sequelae. Clin Exp Otorhinolaryngol. 2009 Sep;2(3):115-9, doi:10.3342/ceo.2009.2.3.115. Epub 2009 Sep 23 |
| Rønjom 2016 | Rønjom MF. Radiationinduced hypothyroidism after treatment of head and neck cancer. Dan Med J. 2016 Mar;63(3). pii: B5213 |
| Rønjom et al. 2013 | Rønjom MF, Brink C, Bentzen SM, Hegedüs L, Overgaard J, Johansen J. Hypothyroidism after primary radiotherapy for head and neck squamous cell carcinoma: Normal tissue complication probability modelling with latent time correction. Radiother Oncol. 2013 Nov;109(2):317-22, doi:10.1016/j.radonc.2013.06.029. Epub 2013 Jul 25 |
| Ros und Carrero 2013 | Ros S, Carrero JJ. Endocrine alterations and cardiovascular risk in CKD: is there a link? Nefrologia. 2013;33(2):181-7, doi:10.3265/Nefrologia.pre2012.Oct.11710 |
| Rubin et al. 2014a | Rubin P, Constine LP, Marks LB (Eds). ALERT - Adverse Late Effects of Cancer Treatment. Volume 1: General Concepts and Specific Precepts. Springer, Berlin, Heidelberg 2014 ISBN 9783540723141 |
| Rubin et al. 2014b | Rubin P, Constine LP, Marks LB (Eds). ALERT - Adverse Late Effects of Cancer Treatment. Volume 2: Normal Tissue Specific Sites and Systems Medical Radiology. Springer, Berlin, Heidelberg 2014 ISBN 9783540758631 |
| Rubin und Casarett 1972 | Rubin P, Casarett G. A direction for clinical radiation pathology. The tolerance dose. In: Vaeth JM (Ed): Radiation Effects and Tolerance, Normal Tissue: 6th Annual San Francisco Cancer Symposium, San Francisco, Calif., October 1970: Proceedings. Front Radiat Ther Oncol. Basel, Karger, 1972, vol 6, pp 1-16, doi: 10.1159/000392794 |
| Rudqvist et al. 2017 | Rudqvist N, Spetz J, Schüler E, Parris TZ, Langen B, Helou K, Forsell-Aronsson E. Transcriptional response to 131I exposure of rat thyroid gland. PloS One. 2017 Feb 21;12(2):e0171797, doi: 10.1371/journal.pone.0171797. eCollection 2017 |
| Saito et al. 2016 | Saito T, Toya T, Matsuyama T, Semba A, Oya N. Dosimetric Predictors of Treatmentrelated Lymphopenia induced by Palliative Radiotherapy: Predictive Ability of Dosevolume Parameters based on Body Surface Contour. Radiol Oncol 2016 Oct;51(2):228-234. doi: 10.1515/raon-2016-0050. eCollection 2017 Jun |
| Sakata et al. 2011 | Sakata R, Shimizu Y, Soda M, Yamada M, Hsu WL, Hayashi M, Ozasa K. Effect of radiation on age at menopause among atomic bomb survivors. Radiat Res. 2011 Dec;176(6):787-95, doi:10.1667/rr2676.1 Epub 2011 Oct 11 |
| Sangeetha Vijayan et al. 2016 | Sangeetha Vijayan P, Rekha PD, Dinesh U, Arun AB. Biochemical and histopathological responses of the Swiss albino mice treated with uranyl nitrate and its recovery. Ren Fail. 2016 Jun;38(5):770-5, doi:10.3109/0886022X.2016.1160248. Epub 2016 Mar 16 |
| Sanguineti et al. 2007 | Sanguineti G, Adapala P, Endres EJ, Brack C, Fiorino C, Sormani MP, Parker B. Dosimetric predictors of laryngeal edema. Int J Radiat Oncol Biol Phys. 2007 Jul 1;68(3):741-9, doi:10.1016/j.ijrobp.2007.01.010 Epub 2007 Mar 29 |
| Schmitt und Zamboglou 1990 | Schmitt G, Zamboglou N. Radiation effects on bone and cartilage. Adv radiat biology. 1990; 14:157-176, doi: 0.1016/B978-0-12-035414-6.50010-9 |
| Schünke et al. 2015 | Schünke M, Schulte E, Schumacher U. Prometheus. Lern Atlas der Anatomie - Innere Organe. 4th ed. Stuttgart: Thieme; 2015, ISBN 9783131395344 |
| Sera et al. 2013 | Sera N, Hida A, Imaizumi M, Nakashima E, Akahoshi M. The association between chronic kidney disease and cardiovascular disease risk factors in atomic bomb survivors. Radiat Res. 2013 Jan;179(1):46-52, doi:10.1667/RR2863.1. Epub 2012 Nov 13 |
| Shah et al. 2012 | Shah C, Wilkinson JB, Baschnagel A, Ghilezan M, Riutta J, Dekhne N, Balaraman S, Mitchell C, allace M, Vicini F. Factors associated with the development of breast cancerrelated lymphedema after wholebreast irradiation. Int J Radiat Oncol Biol Phys. 2012 Jul 15;83(4):1095-100. doi: 10.1016/j.ijrobp.2011.09.058. Epub 2011 Nov 16 |
| Sherman und O'Brien 1967 | Sherman JO, O'Brien PH. Effect of ionizing irradiation on normal lymphatic vessels and lymph nodes. Cancer. 1967 Nov;20(11):1851-8, doi:10.1002/1097-0142(196711)20:11 <1851::aidcncr2820201109> 3.0.co;2-w |
| Sinha und Goldenberg 1970 | Sinha BK, Goldenberg GJ. Effect of irradiation on lymph flow and filtration function of lymph nodes. Cancer. 1970 Dec;26(6):1239-45, doi:10.1002/1097-0142(197012)26:6 <1239::aidcncr2820260610> 3.0.co;2-d |
| Smith et al. 1967 | Smith EB, White DC, Hartscock RJ, Dixon AC. Acute ultrastructural effects of 500 Roentgens on the lymph node of the mouse. Am J Pathol. 1967 Jan;50(1):159-75 |
| Söderström et al. 2017 | Söderström K, Nilsson P, Laurell G, Zackrisson B, Jäghagen EL. Dysphagia - Results from multivariable predictive modelling on aspiration from a subset of the ARTSCAN trial. Radiothe Oncol. 2017 Feb;122(2):192-9, doi: 10.1016/j.radonc.2016.09.001. Epub 2016 Sep 27 Sommer et al. 2012 Sommer T, Meier M, Bruns F, Pabst R, Breves G, Hadamitzky C. Quantification of lymphedema in a rat model by 3D-active contour segmentation by magnetic resonance imaging. Lymphat Res Biol. 2012 Mar;10(1):25-9. doi: 10.1089/lrb.2011.0010. Epub 2012 Mar 14 |
| Sonneveld und van Bekkum 1979 | Sonneveld P, van Bekkum DW. The effect of wholebody irradiation on skeletal growth in rhesus monkeys. Radiology 1979 Mar;130(3):789-791, doi:10.1148/130.3.789 |
| Spiess et al. 1985 | Spiess H, Mays CW, Spiess-Paulus E. Growth retardation in children injected with 224Ra. Strahlentherapie Sonderb. 1985;80:45-50 |
| SSK 2017 | Strahlenschutzkommission (SSK). Induktion benigner Tumoren durch ionisierende Strahlung. Stellungnahme der Strahlenschutzkommission, verabschiedet in der 290. Sitzung der Strahlenschutzkommission am 4./5. Dezember 2017. Bekanntmachung im Bundesanzeiger (BAnz AT 17.04.2018 B4); urn:nbn:de:101:1-201804238518 |
| Sun et al. 2017 | Sun R, Zhu G, Wang J, Tong L, Zhai J. Indirect effects of X-irradiation on proliferation and osteogenic potential of bone marrow mesenchymal stem cells in a local irradiated rat model. Mol Med Rep. 2017 Jun;15(6):3706-3714, doi: 10.3892/mmr.2017.6464. Epub 2017 Apr 12 |
| Sze et al. 2013 | Sze WC, Grossman AB, Goddard I, Amendra D, Shieh SC, Plowman PN, Drake WM, Akker SA, Druce MR. Sequelae and survivorship in patients treated with (131)I-MIBG therapy. Br J Cancer. 2013 Aug 6;109(3):565-72, doi:10.1038/bjc.2013.365. Epub 2013 Jul 16 |
| Taylor 1972 | Taylor DM. Interactions between transuranium elements and the components of cells and tissues. Health Phys. 1972 Jun;22(6):575-81, doi: 10.1097/00004032-197206000-00007 |
| Tronko et al. 2006 | Tronko MD, Brenner AV, Olijnyk VA, Robbins J, Epstein OV, McConnell RJ, Bogdanova TI, Fink DJ, Likhtarev IA, Lubin JH, Markov VV, Bouville AC, Terekhova GM, Zablotska LB, Shpak VM, Brill AB, Tereshchenko VP, Masnyk IJ, Ron E, Hatch M, Howe GR. Autoimmune thyroiditis and exposure to iodine 131 in the Ukrainian cohort study of thyroid cancer and other thyroid diseases after the Chernobyl accident: results from the first screening cycle (1998-2000). J Clin Endocrinol Metab 2006 Nov;91(11):4344-4351, doi:10.1210/jc.2006-0498. Epub 2006 Aug 15 |
| Turolla et al. 1960 | Turolla E, Trenta A, Aliprandi G. Effetti della irradiazione frazionata sul linfondo laterocervicale di ca via ricerche morfologiche e istochemichi. Radiobiol. lat. (Milano) 3 (1960), 113 |
| Überschär 1959 | Überschär K-H. Tierexperimentelle Untersuchungen über Verlauf und Reparation der radiogenen Knochenschädigung. Strahlentherapie 1959, 110: 29-540 |
| Vainshtein et al. 2014 | Vainshtein JM, Griffith KA, Feng FY, Vineberg KA, Chepeha DB, Eisbruch A. Patientreported voice and speech outcomes after wholeneck intensity modulated radiation therapy and chemotherapy for oropharyngeal cancer: Prospective longitudinal study. Int J Radiat Oncol Biol Phys. 2014 Aug 1;89(5):973-980. doi:10.1016/j.ijrobp.2014.03.013. Epub 2014 May 3 |
| Vogelius et al. 2011 | Vogelius IR, Bentzen SM, Maraldo MV, Petersen PM, Specht L. Risk factors for radiationinduced thyroidism. Cancer. 2011 Dec 1;117(23):5250-5260, doi:10.1002/cncr.26186. Epub 2011 May 12 |
| Völzke et al. 2005 | Völzke H, Werner A, Wallaschofski H, Friedrich N, Robinson DM, Kindler S, Kraft M, John U, Hoffmann W. Occupational exposure to ionizing radiation is associated with autoimmune thyroid disease. J Clin Endocrinol MeTabelle 2005 Aug;90(8):4587-4592, doi:10.1210/jc.2005-0286. Epub 2005 May 10. |
| Weinstein und Anderson 2010 | Weinstein JR, Anderson S. The aging kidney: physiological changes. Adv Chronic Kidney Dis. 2010 Jul;17(4):302-7, doi:10.1053/j.ackd.2010.05.002 |
| Wernle et al. 2010 | Wernle JD, Damron TA, Allen MJ, Mann KA. Local irradiation alters bone morphology and increases bone fragility in a mouse model. J Biomech. 2010 Oct 19;43(14):2738-46, doi:10.1016/j.jbiomech.2010.06.017. Epub 2010 Jul 23 |
| Willey et al. 2008 | Willey JS, Lloyd SA, Robbins ME, Bourland JD, Smith-Sielicki H, Bowman LC, Norrdin RW, Bateman TA. Early Increase in osteoclast number in mice after wholebody irradiation with 2 Gy X Rays. Radiat Res. 2008 Sep;170(3):388-92, doi: 10.1667/RR1388.1 |
| Willey et al. 2011 | Willey JS, Lloyd SA, Nelson GA, Bateman TA. Ionizing Radiation and Bone Loss: Space Exploration and Clinical Therapy Applications. Clin Rev Bone Miner MeTabelle 2011 Mar;9(1):54-62, doi: 10.1007/s12018-011-9092-8 |
| Wilson 1956 | Wilson CW. The effect of xrays on the uptake of phosphorus 32 by the knee joint and tibia of sixweekold mice: relation of depression of uptake to xray dose. Br J Radiol. 1956 Oct;29(346):571-3, doi: 10.1259/0007-1285-29-346-571 |
| Wissing 2015 | Wissing MD. Chemotherapy- and irradiationinduced bone loss in adults with solid tumors. Curr Osteoporos Rep. 2015 Jun;13(3):140-145, doi: 10.1007/s11914-015-0266-z |
| Wolny-Rokicka et al. 2016 | Wolny-Rokicka E, Tukiendorf A, WydmaDski J, Roszkowska D, Staniul B, ZembroD-Aacny A. Thyroid function after postoperative radiation therapy in patients with breast cancer. Asian Pac J Cancer Prev. 2016 Oct 1;17(10):4577-4581. doi:10.22034/apjcp.2016.17.10.4577 |
| Yang et al. 2014 | Yang CY, Nguyen DH, Wu CW, Fang YH, Chao KT, Patel KM, Cheng MH. Developing a lower limb lymphedema animal model with combined lymphadenectomy and lowdose radiation. Plast Reconstr Surg Glob Open. 2014 Apr 7;2(3):e121. doi:10.1097/GOX.0000000000000064. eCollection 2014 Mar |
| Yeung und Gagel 2003 | Yeung SCJ, Gagel RF. Endocrine Complications and Paraneoplastic Syndromes. In: Kufe DW, Pollock RE, Weichselbaum RR, Bast RC, Gansler TS, Holland JF, Frei E (Eds). Holland-Frei Cancer Medicine, 6th edition. Hamilton (ON): BC Decker; 2003, ISBN 1550092138 |
| Yiin et al. 2017 | Yiin JH, Anderson JL, Daniels RD, Bertke SJ, Fleming DA, Tollerud DJ, Tseng CY, Chen PH, Waters KM. Mortality in a combined cohort of uranium enrichment workers. Am J Ind Med. 2017 Jan;60(1):96-108, doi: 10.1002/ajim.22668. Epub 2016 Oct 18 |
| Yiin et al. 2018 | Yiin JH, Anderson JL, Bertke SJ, Tollerud DJ. Doseresponse relationships between internallydeposited uranium and select health outcomes in gaseous diffusion plant workers, 1948-2011. Am J Ind Med. 2018 Jul;61(7):605-614, doi:10.1002/ajim.22858. Epub 2018 May 9 |
| Zankl 1997 | Zankl M, Petoussi-Henß N, Drexler G, Saito K. The Calculation of Dose from External Photon Exposures Using Reference Human Phantoms and Monte Carlo Methods, Part VII: Organ Doses due to Parallel and Environmental Exposure Geometries. GSF-Bericht 8/97, GSF-Forschungszentrum für Umwelt und Gesundheit, Neuherberg, 1997 |
| Zhai et al. 2017 | Zhai RP, Kong FF, Du CR, Hu CS, Ying HM. Radiationinduced hypothyroidism after IRMT for nasopharyngeal carcinoma: Clinical and dosimetric predictors in a prospective cohort study. Oral Oncol 2017 May;68:44-49, doi: 10.1016/j.oraloncology.2017.03.005. Epub 2017 Mar 21 |
| Zollinger 1960 | Zollinger HU. Radiohistologie und Radiohistopathologie. In: Roulet F (Ed). Handbuch der allgemeinen Pathologie; Bd. 10/1, Strahlung und Wetter p. 127ff, Springer, Berlin, Heidelberg 1960, ISBN 9783642882807 |
4 Glossar
| Atrophie | Mit dem Begriff Atrophie wird ein wahrnehmbarer Gewebeschwund mit Minderung der Funktion bezeichnet. Der Gewebsschwund kann durch Volumen- bzw. Größenabnahme der Zellen (sogenannte einfache Atrophie) oder durch Abnahme der Zellzahl (numerische Atrophie = Hypoplasie) jeweils mit oder ohne gleichzeitige Veränderungen in der Zellstruktur auftreten. |
| Becquerel (Bq) | Besonderer Name für die SI-Einheit der Aktivität, 1 Bq = 1 s-1 (H 2,7 · 1011 Ci) |
| Bragg-Peak | Maximum der Bragg-Kurve; die Bragg-Kurve beschreibt den Energieverlust pro Weglängeneinheit beim Durchgang von Ionen durch Materie. Bei Protonen verläuft die Bragg-Kurve erst langsam ansteigend, bevor sie sehr schnell ansteigt und dann abrupt abfällt. |
| Dosisgrenzwert | Wert der effektiven Dosis (gegebenenfalls der effektiven Folgedosis) oder der Organ-Äquivalentdosis in einem bestimmten Zeitraum, der für eine Einzelperson nicht überschritten werden darf |
| Effektive Dosis | Summe der mit den zugehörigen Gewebe-Wichtungsfaktoren wT multiplizierten Organ-Äquivalentdosen HT in relevanten Organen und Geweben
HT bzw. wR DT,R beschreiben die Äquivalentdosis in einem Gewebe oder Organ T; wT ist der Gewebewichtungsfaktor, wR der Strahlungswichtungsfaktor. |
| Energiedosis | Differentialquotient 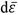 durch dm; dabei ist durch dm; dabei ist  die mittlere Energie, die auf das Material in einem Volumenelement dV übertragen wird, und dm = ρ · dV die Masse des Materials mit der Dichte ρ in diesem Volumenelement: die mittlere Energie, die auf das Material in einem Volumenelement dV übertragen wird, und dm = ρ · dV die Masse des Materials mit der Dichte ρ in diesem Volumenelement:
Die Einheit der Energiedosis ist J kg -1, ihr Name ist Gray (Einheitenzeichen Gy). |
| Equivalenzdosis von 2 Gy (EQD2) | Um die Gesamtdosis einer Strahlentherapie mit unterschiedlichen Fraktionierungs-Schemata hinsichtlich ihrer biologischen Wirkung vergleichbar zu machen, kann sie als biologisch äquivalente Dosis für Fraktionen zu je 2 Gy angegeben werden. Dieser Umrechnung liegt ein linearquadratisches Modell für den induzierten Zelltod zugrunde. |
| Fibrose | Krankhafte Vermehrung von Kollagenfasern im Bindegewebe, die zur Verhärtung von Geweben und Organen führt |
| Fraktionierung | Aufteilung der Gesamtdosis einer Strahlentherapie auf mehrere Bestrahlungseinheiten (Fraktionen) |
| Gewebewichtungsfaktor | Die Gewebewichtungsfaktoren beschreiben näherungsweise den Anteil des Strahlenrisikos, das sich bei homogener Ganzkörperbestrahlung aus der Bestrahlung eines Gewebes oder Organs T für das Gesamtrisiko ergibt. Die Gewebewichtungsfaktoren stellen Mittelwerte dar, gemittelt über Menschen beider Geschlechter und aller Altersgruppen, und beziehen sich somit nicht auf die Eigenschaften einzelner Personen. Durch die Gewebe-Wichtungsfaktoren wT werden die einzelnen Organ-Äquivalentdosen HT entsprechend ihren relativen Beiträgen zu den stochastischen Strahlenwirkungen bei der Bestimmung der effektiven Dosis E gewichtet. Diese Faktoren wT spiegeln die unterschiedliche Empfindlichkeit der verschiedenen Organe, Gewebe und Körperteile T gegenüber stochastischen Strahlenwirkungen (Krebsinduktion, Auslösung von Erbschäden) wider. |
| Grenzwert (Strahlenexposition) | Grenzwerte dienen der Begrenzung der gesetzlich zulässigen Strahlenexposition in geplanten Expositionssituationen der allgemeinen Bevölkerung und von beruflich strahlenexponierten Personen. Die Einhaltung der gesetzlichen Grenzwerte wird behördlich überwacht. Dosisbezugsgrößen sind Werte der effektiven Dosis je Kalenderjahr; für Schutzmaßnahmen bei einer Strahlenexposition von Teilen des Körpers legt das Strahlenschutzgesetz zusätzlich Grenzwerte für einzelne Organe fest. |
| Hypothyreose | Mangelnde Versorgung des Körpers mit den Schilddrüsenhormonen Triiodthyronin (T3) und Thyroxin (T4):
|
| ICD | Die Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme (ICD) ist das weltweit anerkannte Klassifikationssystem der Weltgesundheitsorganisation für medizinische Diagnosen. |
| ICRP | Die International Commission on Radiological Protection ist eine unabhängige internationale Nichtregierungsorganisation. Zentrale Aufgabe ist die Definition von Strahlenschutzgrundsätzen sowie die Empfehlung von Maßnahmen und Standards des Strahlenschutzes. |
| Inzidenz | Die Inzidenz bezeichnet in der Epidemiologie die Anzahl der Ereignisse (insbesondere neuer Erkrankungen), die innerhalb eines Bezugszeitraums auftreten. Neben der Prävalenz stellt die Inzidenz ein Maß für die Morbidität in einer Bevölkerung dar. Definierte Maßzahlen für die Inzidenz sind die Inzidenzrate (Anzahl der neu Erkrankten pro Zeit- bzw. Altersintervall) und die kumulative Inzidenzrate (Summe der altersspezifischen Inzidenzraten). |
| Ionendosis (in Luft): | Eine auf die Ionisation in Luft bezogene Messgröße
J = dQ/dm Dabei ist dQ der Betrag der elektrischen Ladung der Ionen eines Vorzeichens, die in Luft in einem Volumenelement dV mit der Masse dm durch ionisierende Strahlung unmittelbar (z.B. bei Elektronenstrahlung) oder mittelbar (bei Photonenstrahlung über die Sekundärelektronen) gebildet werden.
Die Einheit der Ionendosis ist Coulomb pro Kilogramm (C kg-1). Die Beziehung zu der alten, nicht mehr zulässigen Einheit Röntgen (R) ist 1 R = 2,58 · 10-4 C kg-1. (Nach H. Reich (Hrsg.), Dosimetrie ionisierender Strahlung, B. G. Teubner, Stuttgart 1990) |
| Odds | Quotient aus der Wahrscheinlichkeit, dass ein Ereignis eintritt, und der Wahrscheinlichkeit, dass es nicht eintritt |
| Odds Ratio | Quotient aus zwei Odds, in der Strahlenforschung oft der Odds bei Strahlenexposition und ohne Strahlenexposition |
| Organ-Äquivalentdosis | Die Organdosis oder Organ-Äquivalentdosis ist das Produkt aus der mittleren Energiedosis in einem Organ, Gewebe oder Körperteil und dem Strahlungswichtungsfaktor wR. Die Werte des Strahlungswichtungsfaktor wR richten sich nach Art und Qualität der Strahlung (Photonen, Elektronen, Neutronen, Protonen, Alpha-Teilchen). |
| Personendosis | Mess-Äquivalentdosis, gemessen an der für die Strahlenexposition repräsentativen Stelle der Körperoberfläche; die Einheit der Personendosis ist J kg-1, ihr Name ist Sievert (Einheitenzeichen Sv). Es gibt verschiedene Größen, die die Personendosis beschreiben: die Größen Tiefen-Personendosis Hp(10), Oberflächen-Personendosis Hp(0,07) und Augenlinsen-Personendosis Hp(3). Der Messwert der Tiefen-Personendosis Hp(10) - geeignete Bauart, Kalibrierung sowie richtige Trageweise der Personendosimeter vorausgesetzt - stellt bei Exposition des ganzen Körpers mit durchdringender Strahlung einen Schätzwert für die effektive Dosis und die Organ-Äquivalentdosen tiefliegender Organe, in Spezialfällen auch für die Organ-Äquivalentdosen der Hände, Unterarme, Füße und Knöchel dar. Der Messwert der Oberflächen-Personendosis Hp(0,07) ist bei Ganz- oder Teilkörperexposition ein Schätzwert für die lokale Haut-Äquivalentdosis, in Spezialfällen auch für die Organ-Äquivalentdosen der Hände, Unterarme, Füße und Knöchel. Der Messwert der Augenlinsen-Personendosis Hp(3) liefert einen Schätzwert für die Augenlinsen-Äquivalentdosis. Die wichtigste Voraussetzung für die Möglichkeit solcher Dosisabschätzungen ist die korrekte Trageweise des Personendosimeters. |
| Prävalenz | Kennzahl in der Epidemiologie für die Krankheitshäufigkeit; die sagt aus, welcher Anteil der Menschen in einer bestimmten Gruppe (Population) definierter Größe zu einem bestimmten Zeitpunkt an einer bestimmten Krankheit erkrankt ist oder einen Risikofaktor aufweist. |
| Referenzwert (bei Notfallexpositionen oder in bestehenden Expositionssituationen) | Gibt bei Notfallexpositionen oder bestehenden kontrollierbaren Expositionssituationen den Dosis- oder Risikowert an, bei dessen Überschreitung Expositionen als unangemessen betrachtet werden und bei dessen Unterschreitung eine Optimierung des oder in bestehenden Schutzes durchgeführt werden soll; der genaue Zahlenwert, der als Referenzwert gewählt wird, hängt von den jeweiligen Umständen der betrachteten Exposition ab. Man spricht dann ggf. auch von Richtwert oder Maßnahmenwert. Aus: Die Empfehlungen der Internationalen Strahlenschutzkommission (ICRP) von 2007: ICRP-Veröffentlichung 103 - Deutsche Ausgabe |
| Strahlenrisiko | Als Strahlenrisiko bezeichnet man die Wahrscheinlichkeit, mit der eine bestimmte Bevölkerungsgruppe, die ionisierender oder anderer energiereicher Strahlung ausgesetzt wurde, an den Folgen dieser zusätzlichen Strahlenbelastung erkrankt oder stirbt.
Häufig bezieht man sich bei diesem Strahlenschaden auf Krebs als Folgeerkrankung, der durch zivilisatorische und natürliche Strahlenexposition hervorgerufen werden kann.
Risiko = Risikokoeffizient R × Organ-Äquivalentdosis H.
Ein Risiko gilt als akzeptabel, wenn es ohne weitere Optimierung hingenommen werden kann. Als tolerables Risiko gilt nach ICRP 103 ein Risiko, das zwar nicht willkommen ist, aber nach Optimierung hingenommen werden kann. |
| Stochastischer Effekt | Stochastische Effekte sind Strahlenschäden, bei denen die Wahrscheinlichkeit ihres Auftretens mit zunehmender Dosis zunimmt, ihr Schweregrad jedoch nicht dosisabhängig ist. Folgen stochastischer Effekte können Krebserkrankungen (somatischer stochastischer Strahlenschaden) oder Erbkrankheiten bei Nachkommen (genetischer stochastischer Strahlenschaden) sein. |
| Strahlenqualität | Bezeichnung der unterschiedlichen Ionisationsdichte verschiedener Strahlenarten und damit auch der unterschiedlichen relativen biologischen Wirksamkeit (RBW) |
| Thyreoiditis | Schilddrüsenentzündung. Ursache einer Thyreoiditis kann eine therapeutische Strahlenexposition sein (verschiedene Unterformen der Thyreoditis siehe z.B. Wikipedia ). 14 |
| Tumor | Tumoren sind unkontrollierte Gewebeneubildungen und können in vielen Körpergeweben auftreten.
Es gibt genetische Faktoren, die eine Tumorbildung begünstigen können.
Die Wahrscheinlichkeit der Tumorentstehung kann durch Strahlung erhöht sein.
Im Falle einer Neoplasie (Neubildung von Körpergewebe) erfolgt die Einteilung nach dem biologischen Wachstumsverhalten und nach dem Ursprungsgewebe.
In Abhängigkeit von der Fähigkeit, Metastasen auszubilden, unterscheidet man zwischen benignen (gutartige), malignen und semimalignen Tumoren.
Maligne Tumoren werden häufig als Krebs bezeichnet.
Die Strahlentherapie ist eine der drei Säulen in der Behandlung von Tumoren. |
5 Abkürzungsverzeichnis
| Ãi | Zerfälle im Körper |
| AKI | Acute Kidney Injury - (Akute Nierenschädigung) |
| AP | Anteroposterior |
| BMI | Body-Mass-Index |
| BMUB | Bundesministerium für Umwelt, Naturschutz, Bau und Reaktorsicherheit (Dezember 2013 bis März 2018) |
| Bq | Becquerel, SI-Einheit der Aktivität |
| CKD | Chronic Kidney Disease - (Chronischem Nierenversagen) |
| CT | Computertomografie |
| CTCAE | Common Terminology Criteria for Adverse Events |
| DARS | Dysphagia-Aspiration Related Structures |
| DIV | Divergentes Strahlenbündel |
| DT | Energiedosis in Gy |
| DT,R | Mittlere Energiedosis für die Strahlenart R in Gy |
| E | Effektive Dosis in Sv |
| e | Dosis-Konversionsfaktor für die effektive Dosis in Sv cm2 |
| Egr | Grenzwert für die effektive Dosis in Sv, Egr = 0,02 Sv |
| EQD2 | Equivalenzdosis von 2 Gy |
| F | Referenzfrau |
| Gy | Gray, SI-Einheit der Energiedosis (1 Gy = 1 J kg-1) |
| HT | Organ-Äquivalentdosis in Sv |
| hT | Dosis-Konversionsfaktor für die Organ-Äquivalentdosis in Sv cm2 |
| HT,max | Maximum der Äquivalentdosis im Organ oder Gewebe in Sv bei Erreichen des Grenzwertes für die effektive Dosis |
| i | Im Körper gebildete Folgeprodukte |
| I | Inzidenz |
| IAEA | International Atomic Energy Agency (Internationale Atomenergie-Organisation) |
| ICRP | International Commission on Radiological Protection (Internationale Strahlenschutzkommission) |
| ICRU | International Commission on Radiation Units and Measurements (Internationale Kommission für Strahlungseinheiten und Messung) |
| Ir | Assoziierten Inzidenz |
| ISO | Isotrop |
| KI | Konfidenzintervall |
| kk | Korrektionsfaktoren |
| kk,max | Korrektionsfaktor für divergente Photonen-Strahlenbündel |
| LD50 | Median lethal dose (Mittlere letale Dosis) |
| LET | Linearer Energietransfer |
| LLAT | Linkslateral |
| M | Referenzmann |
| MM | Multiple Myelome |
| MRT | Magnetresonanztomografie |
| NORM | Naturally occurring radioactive materials (Natürlich vorkommende radioaktive Stoffe) |
| NTCP | Normal Tissue Complication Probability |
| P | Prävalenz |
| PA | Posterioranterior |
| PAR | Paralleles Strahlenbündel |
| QUANTEC | Quantitative Analysis of Normal Tissue Effects in the Clinic |
| R | Röntgen oder rad. In dieser Empfehlung wird für R immer die Ionendosis (in Luft) in "Röntgen" verwendet. |
| rad | Veraltete Einheit der Energiedosis |
| RBE | Relative biological effectiveness (Relative biologische Wirksamkeit) |
| RLAT | Rechtslateral |
| Röntgen | Einheit für die Ionendosis (in Luft) |
| ROT | Rotationssymmetrisch |
| rS | Quellorgan |
| rT | Zielorgan |
| SSK | Strahlenschutzkommission |
| Sv | Sievert, SI-Einheit der Äquivalentdosis (1 Sv = 1 J kg-1) |
| Sw | S-Koeffizienten |
| T | Organ/Gewebe |
| T4 | Thyroxin |
| TBI | Total Body Irradiation (Ganzkörperbestrahlung) |
| TgAb | Thyroglobulin antibodies (Thyreoglobulin-Antikörpern) |
| TPOAb | Thyroid peroxidase antibody (Thyreoperoxidase-Antikörpern) |
| TSH | Thyreoideastimulierendes Hormon - Thyreotropin |
| wR | Strahlungs-Wichtungsfaktor |
| wT | Gewebewichtungsfaktor |
| τ | Zeitraum |
________
.
|
Bekanntmachung einer Empfehlung mit wissenschaftlicher Begründung der Strahlenschutzkommission Vom 11. August 2021 Nachfolgend wird die Empfehlung mit wissenschaftlicher Begründung der Strahlenschutzkommission (SSK), verabschiedet in der 309. Sitzung der Kommission am 10. Dezember 2020, bekannt gegeben (Anlage). |
1) Die Extremitäten sind durch Hände, Unterarme, Füße und Knöchel definiert.
2) In der Empfehlung "Grundlagen zur Begründung von Grenzwerten für beruflich strahlenexponierte Personen" definiert als: Als akzeptabel gilt ein Risiko, das nach Optimierung von Strahlenschutzmaßnahmen unterhalb des tolerablen Risikos vernünftigerweise erreicht werden kann.
3) In der Empfehlung "Grundlagen zur Begründung von Grenzwerten für beruflich strahlenexponierte Personen" definiert als: Für tolerabel wird von der ICRP derzeit ein Risiko von einem Todesfall pro Jahr pro tausend Personen gehalten, was unter Berücksichtigung weiterer Faktoren zu dem Grenzwert von 20 mSv pro Jahr geführt hat.
4) Für die Größe H wird im Strahlenschutzgesetz (StrlSchG 2017) (§ 5 Absatz 27) der Begriff Organ-Äquivalentdosis verwendet. Vor der Einführung des Strahlenschutzgesetzes wurde T hierfür in Deutschland - so auch in der deutschen Übersetzung der ICRP-Publikation 103 - der Begriff Organdosis benutzt. Im hier vorliegenden Text werden die Begriffe synonym verwendet und bezeichnen Dosiswerte, in denen die Strahlenart durch Wichtung berücksichtigt wurde.
5) OIR: Occupational Intakes of Radionuclides
6) Ein Beispiel ist die bemannte Raumfahrt, bei der hohe Strahlenexpositionen (z.B. Marsexpedition) durch schwere geladene Teilchen auftreten können.
7) In Abschnitt 1.3 der vorliegenden Empfehlung ist die hier angewandte Verwendung des Begriffs "nichtneoplastische Erkrankungen" definiert.
8) Persönliche Mitteilung von J. Lubin, E-Mail vom 10. September 2019
9) Ir = I0 · ( I/I0 - 1)
10) Persönliche Mitteilung von P. Inskip, E-Mail vom 10. September 2019
11) Gewichtete Energiedosis mit einem Wichtungsfaktor von 10 für Neutronenstrahlung
12) In einem späteren Review (Fajardo 1994) wird davon ausgegangen, dass die mit r bezeichneten Dosisangaben in den Studien von de Bruyn (de Bruyn 1948a, de Bruyn 1948b) in der Einheit Roentgen erfolgen.
13) In einem späteren Review (Fajardo 1994) wird davon ausgegangen, dass die mit r bezeichneten Dosisangaben in der Studie von Engeset (Engeset 1966) in der Einheit Roentgen erfolgen.
14) Wikipedia Quelle: Heufelder AE und Hofbauer LC. Die Thyreoiditiden: Aktueller Stand der Pathogenese, Diagnostik und Therapie. Dtsch Arztebl 1998; 95(9): A-466 / B-394 / C-368, https://www.aerzteblatt.de/pdf.asp?id=9655
 | ENDE |  |
...
X
⍂
↑
↓