umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (31)
 | zurück |
2. Daten und Berichterstattung
2.1 Auswertung der Ergebnisse
Es wird empfohlen, einen Statistiker sowohl an der Auslegung als auch an der Auswertung der Prüfung zu beteiligen, da die Methode eine beträchtliche Bandbreite im Versuchskonzept zulässt, beispielsweise bei der Anzahl an Prüfkammern, der Anzahl an Prüfkonzentrationen, der Ausgangszahl an befruchteten Eiern und der gemessenen Parameter. In Anbetracht der für die Auslegung der Prüfung zur Verfügung stehenden Möglichkeiten wird an dieser Stelle keine konkrete Orientierung zu den statistischen Verfahren gegeben.
Sind LOEC/NOEC-Werte zu bestimmen, wird die Notwendigkeit bestehen, Streuungen innerhalb jeder Wiederholungsreihe durch eine Varianzanalyse (ANOVA) oder Kontingenztabellenverfahren zu analysieren. Für einen Mehrfachvergleich zwischen den Ergebnissen bei den einzelnen Konzentrationen und den Ergebnissen der Kontrollen ist möglicherweise die Dunnet'sche Methode von Nutzen (12) (13). Weitere hilfreiche Beispiele sind ebenfalls verfügbar (14) (15). Der Umfang der Wirkung, der mit ANOVA oder anderen Verfahren nachweisbar ist, (d. h. die Aussagefähigkeit der Prüfung) sollte berechnet und protokolliert werden. Zu beachten ist, dass sich nicht alle in 1.7.5.6 aufgeführten Beobachtungen für eine statistische Auswertung mittels einer ANOVA eignen. Die kumulative Mortalität und die Anzahl an gesunden Larven am Ende der Prüfung könnten beispielsweise mit Hilfe von Probit-Methoden analysiert werden.
Sind LC/ECx-Werte zu bestimmen, sollte(n) (eine) geeignete Kurve(n) wie beispielsweise die logistische Kurve an die Daten von Interesse mittels eines statistischen Verfahrens wie der Methode der kleinsten Quadrate oder der nichtlinearen kleinsten Quadrate angepasst werden. Die Kurve(n) sollte(n) so parametriert werden, dass die LC/ ECx von Interesse und deren Standardfehler direkt abgeschätzt werden können. Dies wird die Berechnung des Vertrauensbereichs rund um die LC/ECx deutlich erleichtern. Soweit keine guten Gründe dafür vorliegen, anderen Vertrauensbereichen den Vorzug zu geben, sollte der zweiseitige 95 % Vertrauensbereich angegeben werden. Das Anpassungsverfahren sollte möglichst einen Weg bieten, um die Signifikanz der mangelnden Anpassung zu bewerten. Für die Anpassung von Kurven können grafische Methoden eingesetzt werden. Für alle in 1.7.5.6 aufgeführten Beobachtungen kommt eine Regressionsanalyse in Frage.
2.2 Interpretation der Ergebnisse
Die Ergebnisse sollten mit Vorsicht interpretiert werden, wenn gemessene toxische Konzentrationen in Prüflösungen in der Nähe der Nachweisgrenze des analytischen Verfahrens liegen. Die Interpretation von Ergebnissen für Konzentrationen oberhalb der Wasserlöslichkeit der Substanz sollte ebenfalls mit Vorsicht erfolgen.
2.3 Abschlussbericht
Der Prüfbericht muss die folgenden Angaben enthalten:
2.3.1 Prüfsubstanz
- Physikalische Beschaffenheit und relevante physikalischchemische Eigenschaften;
- Daten zur chemischen Identifizierung, einschließlich Reinheitsgrad und analytisches Verfahren zur Quantifizierung der Prüfsubstanz, soweit zutreffend.
2.3.2 Geprüfte Fischart
- Wissenschaftlicher Name, Stamm. Anzahl an Elternfischen (d. h., wie viele Weibchen wurden für die erforderlichen Zahlen an Eiern in der Prüfung verwendet), Herkunft und Art der Sammlung der befruchteten Eier sowie anschließende Handhabung.
2.3.3 Prüfbedingungen
- Zum Einsatz kommendes Prüfverfahren (z.B. semistatisches oder Durchflussverfahren, Zeitraum von der Befruchtung bis zum Beginn der Prüfung, Besatz usw.);
- Belichtungszeit(en);
- Auslegung der Prüfung (z.B. Anzahl der Prüfkammern und Wiederholungen, Anzahl an Embryonen je Wiederholung);
- Methode zur Herstellung von Stammansätzen und Häufigkeit der Erneuerung (sollte ein Lösungsmittel verwendet werden, sind dieses Mittel und dessen Konzentration anzugeben);
- die nominalen Prüfkonzentrationen, die Messwerte, deren Mittelwerte und deren Standardabweichungen in den Prüfbehältern sowie das Verfahren, nach dem diese erzielt wurden, und, sofern die Prüfsubstanz in Wasser bei Konzentrationen unterhalb der Prüfkonzentrationen löslich ist; es sollte der Nachweis geführt werden, dass sich die Messungen auf die Konzentrationen der Prüfsubstanz in der Lösung beziehen;
- Eigenschaften des Verdünnungswassers: pH-Wert, Härte, Temperatur, gelöste Sauerstoffkonzentration, Restchlorgehalt (soweit gemessen), gesamter organischer Kohlenstoff (TOC), Schwebstoffe, Salzgehalt des Prüfmediums (soweit gemessen) und eventuelle andere vorgenommene Messungen;
- Wasserqualität innerhalb der Prüfgefäße: pH-Wert, Härte, Temperatur und gelöste Sauerstoffkonzentration.
2.3.4 Ergebnisse
- Ergebnisse von eventuellen vorhergehenden Untersuchungen zur Stabilität der Prüfsubstanz;
- Nachweis, dass die Kontrollen den allgemeinen Standard bezüglich der Annehmbarkeit der Überlebensraten für die geprüfte Fischart erfüllen (Anlagen 2 und 3);
- Daten zu Mortalität/Überleben im Embryo- und Larvenstadium sowie Gesamtmortalität/-überleben;
- Tage bis zum Schlüpfen und Anzahl geschlüpfter Tiere;
- Angaben zur Länge (und zum Gewicht);
- Vorkommen und Beschreibung morphologischer Abnormitäten, soweit zutreffend;
- Vorkommen und Beschreibung von Auswirkungen auf das Verhalten, soweit zutreffend;
- statistische Auswertung und Datenaufbereitung;
- bei Tests, in denen zur Auswertung die ANOVA zum Einsatz kommt, die geringste Dosiskonzentration, bei der eine Wirkung beobachtet wird (LOEC). bei p = 0,05 und die höchste Dosiskonzentration, bei der keine Wirkung beobachtet wird (NOEC), für jede bewertete Reaktion, einschließlich einer Beschreibung der herangezogenen statistischen Verfahren und eine Angabe zum Umfang der Wirkung, die ermittelt werden konnte;
- bei Tests, die unter Zuhilfenahme von Regressionsverfahren ausgewertet werden, die LC/ECX und Vertrauensbereiche sowie ein Graf des angepassten Modells, das für deren Berechnung benutzt wurde;
- Erklärung für eine eventuelle Abweichung von dieser Prüfmethode.
3. Literaturhinweise
(1) Kristensen P. (1990) Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, 60 June 1990.
(2) ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. 26 S.
(3) Brauhn J. L. and Schoettger R. A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota.
(4) Brungs W. A. and Jones B. R. (1977). Temperature Criteria for Freshwater Fish: Protocol and Procedures, 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
(5) Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, 121-173.
(6) Legault R. (1958). A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, 328-330.
(7) Dave G., Damgaard B., Grande M., Martelin J. E., Rosander B. and Viktor T. (1987). Ring Test of an Embryolarval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, 61-71.
(8) Birge J. W., Black J. A. and Westerman A. G. (1985). Shortterm Fish and Amphibian Embryolarval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, 807-821.
(9) Van Leeuwen C. J., Espeldoorn A. and Mol F. (1986). Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. 111. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, 129-145.
(10) Kirchen R. V. and W. R. West (1969). Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company.
(11) Kirchen R. V. and W. R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. 36 S.
(12) Dunnett C. W. (195 5). A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc, 50, 1096-1121.
(13) Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, 482-491.
(14) Mc Clave J. T., Sullivan J. H. and Pearson J.G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
(15) Van Leeuwen C. J., Adema D. M. M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, 321-334.
(16) Environment Canada. (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992. 81 S.
(17) Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. of Environmental Contamination and Toxicology, 21, 126-134.
(18) Meyer A., Bierman C. H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio). a model System in developmental biology - an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: 231-236.
(19) Ghillebaert F., Chaillou C, Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels. of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, 19-28.
(20) US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/ 064, Dec. 1991, EPA, Duluth.
(21) US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth.
(22) De Graeve G. M., Cooney J. D., McIntyre D. 0., Poccocic T. L, Reichenbach N. G., Dean J. H. and Marcus M. D. (1991). Validity in the Performance of the sevenday FatHEAD minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, 1189-1203.
(23) Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, Chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish.
(24) Balon E. K. (1985). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, 280 S.
(25) Blaxter J. H. S. (1988). Pattern and variety in development, in: W. S. Hoar and D. J. Randall eds., Fish Physiology, Vol. XIA, Academic press, 1-58.
Tabelle 1A Für die Prüfung empfohlene Fischarten
| Süßwasserfische |
| Oncorhynchus mykiss Regenbogenforelle (9) (16) Danio rerio Cyprinus caprio |
Tabelle 1B Beispiele für andere hinreichend dokumentierte Arten, die ebenfalls verwendet wurden
| Süßwasserfische | Salzwasserfische |
| Carassius auratus Goldfisch (8) Lepomis macrochirus | Menidia peninsulae Gezeiten-Ährenfisch (23) (24) (25) Clupea |
...
1) OECD. Paris, 1992, Test Guideline 210, Fish. Earlylife Stage Toxicity Test.
| Anleitung zur Durchführung einer Toxizitätsprüfung an Embryonen und Jungtieren mit Dottersack des Zebrabärblings (Brachydanio rerio) | Anlage 1 |
Einführung
Der Zebrabärbling stammt von der Koromandelküste in Indien, wo er in schnell fließenden Strömen lebt. Er ist ein verbreiteter Aquarienfisch und gehört zur Familie der Karpfen; Informationen über seine Pflege und Kultur sind in Standardnachschlagewerken über tropische Fische zu finden. Die Biologie und die Verwendung des Zebrabärblings in der Fischforschung wurden von Laale (1) besprochen.
Nur in seltenen Fällen erreicht der Fisch eine Länge von mehr als 45 mm. Sein Körper ist zylindrisch geformt mit 7 bis 9 dunkelblauen, waagerecht verlaufenden silbernen Streifen. Diese Streifen reichen bis in die Schwanz- und Afterflossen. Der Rücken ist olivgrün gefärbt. Männchen sind schlanker als Weibchen. Bei Weibchen ist die silberne Färbung stärker ausgeprägt, und ihr Bauch ist gebläht, vor allem vor dem Laichen.
Erwachsene Fische können große Schwankungen von Temperatur, pH-Wert und Härte vertragen. Um jedoch gesunde Fische zu erhalten, die Eier von guter Qualität produzieren, sollte für optimale Bedingungen gesorgt werden.
Beim Laichen verfolgt und begattet das Männchen das Weibchen, und im Ausstoßen werden die Eier befruchtet. Die Eier, die transparent sind und keinen klebrigen Stoff enthalten, fallen auf den Grund, wo sie von den Eltern aufgefressen werden können. Das Laichen wird durch Licht beeinflusst. Bei entsprechendem Morgenlicht laichen die Fische im Allgemeinen in den ersten Stunden nach Tagesanbruch.
Ein Weibchen kann im Abstand von einer Woche Chargen von mehreren Hundert Eiern produzieren.
Bedingungen für Elternfische, Fortpflanzung und frühe Entwicklungsstadien
Eine geeignete Anzahl von gesunden Fischen auswählen und mindestens 2 Wochen vor dem beabsichtigten Laichen in geeignetem Wasser (z.B. Anlage 4) halten. Man sollte die Fischgruppe zumindest einmal brüten lassen, bevor sie die für die Prüfung zu verwendende Charge an Eiern produzieren. Die Fischdichte sollte in diesem Zeitraum 1 Gramm Fische je Liter nicht übersteigen. Durch einen regelmäßigen Wechsel des Wassers oder den Einsatz von Reinigungssystemen lässt sich eine höhere Dichte erreichen. Die Temperatur in den Hälterungsbehältern sollte bei 25 ± 2 °C gehalten werden. Den Fischen sollte abwechslungsreiche Nahrung geboten werden, die beispielsweise aus entsprechendem handelsüblichem Trockenfutter, lebenden frischgeschlüpften Arthemien, Chironomiden, Daphnien oder weißen Würmern (Enchytraeiden) bestehen kann.
Im Folgenden werden zwei Verfahren in groben Zügen beschrieben, die in der Praxis eine ausreichende Charge von gesunden befruchteten Eiern für eine durchzuführende Prüfung ergeben haben:
- 8 Weibchen und 16 Männchen werden in einen Behälter mit 50 Litern Verdünnungswasser gesetzt, der vor direktem Licht geschützt und nach Möglichkeit mindestens 48 Stunden lang ungestört gelassen wird. Auf den Boden des Aquariums wird am Nachmittag des Tages, bevor die Prüfung beginnt, eine Laichschale gesetzt. Die Laichschale besteht aus einem Rahmen (aus Plexiglas oder einem anderen geeigneten Material) und ist 5 bis 7 cm hoch; am oberen Ende ist ein grobes Netz mit einer Maschenweite von 2 bis 5 mm befestigt, unten auf dem Boden ein feines Netz mit einer Maschenweite von 10 bis 30m. An dem groben Netz des Rahmens wird eine Reihe von "Laichbäumen", die aus ungedrehtem Nylonfaden bestehen, befestigt. Nachdem die Fische 12 Stunden lang im Dunkeln gelassen wurden, wird ein schwaches Licht eingeschaltet, welches das Laichen in Gang setzen wird. 2 bis 4 Stunden nach dem Laichen wird die Laichschale entfernt, und die Eier werden eingesammelt. Die Laichschale hindert die Fische daran, die Eier aufzufressen, und ermöglicht gleichzeitig ein einfaches Einsammeln der Eier. Die Fischgruppe sollte zumindest einmal vor dem Laich, von dem Eier für die Prüfung verwendet werden, gelaicht haben.
- 5 bis 10 Männchen und Weibchen werden mindestens 2 Wochen vor dem beabsichtigten Laichen einzeln gehalten. Nach 5 bis 10 Tagen sind die Bäuche der Weibchen gebläht und ihre Genitalpapillen sichtbar. Männliche Fische besitzen keine Papillen. Das Laichen erfolgt in Laichbehältern, die mit einem eingeschobenen Gitterboden ausgerüstet sind (wie oben). Der Behälter wird mit Verdünnungswasser gefüllt, so dass das Wasser 5 bis 10 cm über dem Gitter steht. Am Tag vor dem beabsichtigten Laichen werden 1 Weibchen und 2 Männchen in den Behälter gesetzt. Die Wassertemperatur wird schrittweise 1 Grad über die Eingewöhnungstemperatur erhöht. Das Licht wird ausgeschaltet, und der Behälter wird so ungestört wie möglich gelassen. Am Morgen wird ein schwaches Licht eingeschaltet, welches das Laichen in Gang setzen wird. Nach 2 bis 4 Stunden werden die Fische entfernt und die Eier eingesammelt. Werden größere Chargen von Eiern benötigt, als von einem Weibchen gewonnen werden können, kann eine hinreichende Anzahl von Laichbehältern parallel aufgestellt werden. Dadurch, dass man den Reproduktionserfolg der einzelnen Weibchen vor der Prüfung festhält (Größe der Charge und Qualität), können die Weibchen mit dem höchsten Reproduktionserfolg für die Zucht ausgewählt werden.
Die Eier sollten mit Hilfe von Glasröhrchen (mit einem Innendurchmesser von nicht weniger als 4 mm), die mit einem flexiblen Saugkolben ausgestattet sind, in die Prüfgefäße umgesetzt werden. Dabei sollte die Menge Wasser, die zusammen mit den Eiern umgelagert wird, so gering wie möglich sein. Die Eier sind schwerer als Wasser und sinken aus dem Röhrchen. Vorsicht ist geboten, damit die Eier (und Larven) nicht mit Luft in Berührung kommen. Es sollte eine mikroskopische Untersuchung von einer oder mehreren Proben von der/den Charge(n) durchgeführt werden, um sicherzugehen, dass in den ersten Entwicklungsstadien keine Unregelmäßigkeiten vorliegen. Eine Desinfektion der Eier ist nicht zulässig.
Die Mortalitätsrate der Eier ist in den ersten 24 Stunden nach der Befruchtung am höchsten. In dieser Zeit ist häufig eine Mortalität von 5 bis 40 % zu beobachten. Infolge einer erfolglosen Befruchtung oder aufgrund von Entwicklungsfehlern kommt es zur Degeneration von Eiern. Die Qualität der Eiercharge scheint dabei vom Fischweibchen abzuhängen: Einige Weibchen produzieren gleich bleibend Eier von guter Qualität, andere tun das niemals. Auch die Entwicklungs- und Schlüpfrate ist von Charge zu Charge unterschiedlich. Erfolgreich befruchtete Eier und Dottersacklarven überleben gut, normalerweise in einer Größenordnung von mehr als 90 %. Bei einer Temperatur von 25 °C schlüpfen die Eier 3 bis 5 Tage nach der Befruchtung, und der Dottersack ist etwa 13 Tage nach der Befruchtung aufgezehrt.
Die Embryonalentwicklung wurde von Hisaoka und Battle (2) gut bestimmt. Aufgrund der Transparenz der Eier und der Larven nach dem Schlüpfen kann die Entwicklung der Fische verfolgt werden, und vorhandene Missbildungen lassen sich beobachten. Etwa 4 Stunden nach dem Laichen können unbefruchtete Eier von befruchteten unterschieden werden (3). Zu dieser Untersuchung werden Eier und Larven in Prüfgefäße mit geringem Fassungsvermögen gesetzt und unter dem Mikroskop untersucht.
Die für die frühen Entwicklungsstufen geltenden Prüfbedingungen sind in Anlage 2 aufgeführt. Optimal als pH-Wert und Härte für das Verdünnungswasser sind 7,8 beziehungsweise 250 mg CaCO3/l.
Berechnungen und Statistik
Vorgeschlagen wird eine zweistufige Vorgehensweise. In einem ersten Schritt werden Daten zu Mortalität, abnormer Entwicklung und Schlüpfzeit statistisch ausgewertet. Dann wird bei denjenigen Konzentrationen, bei denen keine negativen Auswirkungen auf einen dieser Parameter festgestellt wurden, die Körperlänge statistisch bewertet. Diese Vorgehensweise ist ratsam, da der toxische Stoff kleinere Fisch selektiv töten, die Schlüpfzeit verlängern und grobe Missbildungen hervorrufen und somit zu einseitigen Längenmessungen führen kann. Außerdem soll in etwa die gleiche Anzahl von Fischen für jede Behandlung vermessen werden, um die Validität der Prüfstatistik sicherzustellen.
Bestimmung der LC50 und EC50
Der prozentuale Anteil an überlebenden Eiern und Larven wird berechnet und um die Mortalität in den Kontrollen nach der Abbottschen Formel korrigiert (4):
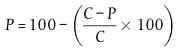
Dabei gilt:
P = korrigierter prozentualer Anteil an überlebenden Eiern und Larven
P' = beobachteter prozentualer Anteil an überlebenden Eiern und Larven in der Prüfkonzentration
C = prozentualer Anteil an überlebenden Eiern und Larven in der Kontrolle
Soweit möglich, wird die LC50 am Ende der Prüfung mittels einer geeigneten Methode bestimmt.
Wird die Berücksichtigung von morphologischen Abnormitäten in der EC50-Statistik gewünscht, finden sich dazu bei Stephan (5) entsprechende Hinweise.
Schätzung der LOEC und NOEC
Eine Zielsetzung, die mit der Prüfung an Eiern und Jungfischen im Dottersack verfolgt wird, besteht darin, die Konzentrationen, die nicht wirkungslos sind, mit der Kontrolle zu vergleichen, das heißt, die LOEC zu bestimmen. Aus diesem Grunde sollten Mehrfachvergleichsverfahren zum Einsatz kommen (6) (7) (8) (9) (10).
Literaturhinweise
(1) Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review). Fish Biol. 10, 121-173.
(2) Hisaoka K. K. and Battle H. I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, 311 S.
(3) Nagel R. (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachyidanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, 173-181.
(4) Finney D. J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, 1-333.
(5) Stephan C. E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J. G. Pearson, R. B. Foster and W. E. Bishop, Eds., American Society for Testing and Materials, 69-81,
(6) Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc., 50, 1096-1121.
(7) Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, 482-491.
(8) Williams D. A. (1971). A Test for Differences between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, 103-117.
(9) Williams D. A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, 519-531.
(10) Sokal R. R. and Rohlf F. J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W. H. Freeman and Co., San Francisco.
| Prüfbedingungen, Dauer und Überlebenskriterien für empfohlene Fischarten | Anlage 2 |
| Fischart | Temperatur
(°C) | Salzgehalt
(0/00) | Belichtungsdauer
(Std.) | Dauer der Stadien
(Tage) | Typische Dauer der Prüfung | Überlebensrate in der Kontrolle
(min.-%) | ||
| Embryonen | Jungfische mit Dottersack | Schlüpferfolg | Nach dem Schlüpfen | |||||
| SÜSSWASSERFISCHE | ||||||||
| Brachydanio rerio
Zebrabärbling | 25 ± 1 | - | 12-16 | 3-5 | 8-10 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 5 Tage nach dem Schlüpfen (8-10 Tage) | 80 | 90 |
| Oncorhynchus mykiss
Regenbogenforelle | 10 ± 1 1
12 ± 1 2 | - | 0 a | 30-35 | 25-30 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 20 Tage nach dem Schlüpfen (50-55 Tage) | 66 | 70 |
| C.yprinus carpio
Gemeiner Karpfen | 21-25 | - | 12-16 | 5 | > 4 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 4 Tage nach dem Schlüpfen (8-9 Tage) | 80 | 75 |
| Oryzias latipes
Japankärpfling/Medaka | 24 ± 1 1
23 ± 1 2 | - | 12-16 | 8-11 | 4-8 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 5 Tage nach dem Schlüpfen (13-16 Tage) | 80 | 80 |
| Pimephales promelas
Fettköpfige Elritze | 25 ± 2 | - | 16 | 4-5 | 5 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 4 Tage nach dem Schlüpfen (8-9 Tage) | 60 | 70 |
| 1) Für Embryonen. 2) Für Larven. a) Dunkelheit für Embryonen und Larven bis eine Woche nach dem Schlüpfen, außer diese werden kontrolliert. Dann gedämpfte Beleuchtung während der gesamten Prüfung. | ||||||||
| Prüfbedingungen, Dauer und Überlebenskriterien für andere hinreichend dokumentierte Fischarten | Anlage 3 |
| Fischart | Temperatur
(°C) | Salzgehalt
(0/00) | Belichtungsdauer
(Std.) | Dauer der Stadien
(Tage) | Typische Dauer der Prüfung an Embryonen und Jungfischen mit Dottersack | Überlebensrate in der Kontrolle
(min.-%) | ||
| Embryonen | Jungfische mit Dottersack | Schlüpferfolg | Nach dem Schlüpfen | |||||
| SÜSSWASSERFISCHE | ||||||||
| Carassius auratus
Goldfisch | 24 ± 1 | - | - | 3-4 | > 4 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 4 Tage nach dem Schlüpfen (7 Tage) | - | 80 |
| Leopomis macrochirus
Blauer Sonnenbarsch | 21 ± 1 | - | 16 | 3 | > 4 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 4 Tage nach dem Schlüpfen (7 Tage) | - | 75 |
| SALZWASSERFISCHE | ||||||||
| Menidia peninsulae
Gezeiten-Ährenfisch | 22-25 | 15-22 | 12 | 1,5 | 10 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 5 Tage nach dem Schlüpfen (6-7 Tage) | 80 | 60 |
| Clupea harengus
Hering | 10 ± 1 | 8-15 | 12 | 20-25 | 3-5 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 3 Tage nach dem Schlüpfen (23-27 Tage) | 60 | 80 |
| Gadus morhua
Kabeljau | 5 ± 1 | 5-30 | 12 | 14-16 | 3-5 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 3 Tage nach dem Schlüpfen (18 Tage) | 60 | 80 |
| Cyprinodon variegatus
Edelsteinkärpfling | 25 ± 1 | 15-30 | 12 | - | - | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 4-7 Tage nach dem Schlüpfen (28 Tage) | > 75 | 80 |
| Verschiedene chemische Eigenschaften eines annehmbaren Verdünnungswassers | Anlage 4 |
| Substanz | Konzentrationen |
| Partikelgehalt | < 20 mg/l |
| Gesamter organischer Kohlenstoff (TOC) | < 2 mg/l |
| Nichtionisierter Ammoniak | < 1 µg/l |
| Restchlor | < 10 µg/l |
| Gesamte phosphororganische Pestizide | < 50 ng/l |
| Gesamte chlororganische Pestizide plus polychlorierte Biphenyle | < 50 ng/l |
| Gesamtes organisches Chlor | < 25 ng/l |
C.16 Honigbienen - Akute orale Toxizitätsprüfung
1. Methode
Diese Methode zur Prüfung der akuten Toxizität entspricht der OECD TG 213 (1998).
1.1 Einleitung
Diese Toxizitätsprüfung ist ein Laborverfahren, mit dem die akute orale Toxizität von Pflanzenschutzmitteln und anderen Chemikalien für erwachsene Arbeitshonigbienen bewertet werden soll.
Bei der Bewertung und Beurteilung der toxischen Merkmale von Substanzen ist unter Umständen die Bestimmung der akuten oralen Toxizität bei Bienen erforderlich, beispielsweise wenn die Wahrscheinlichkeit einer Exposition von Bienen gegenüber einer bestimmten Chemikalie besteht. Die akute orale Toxizitätsprüfung wird durchgeführt, um die spezifische Toxizität von Pestiziden und anderen Chemikalien für Bienen zu bestimmen. Die Ergebnisse dieser Prüfung sollten herangezogen werden, um festzulegen, ob weiterer Beurteilungsbedarf besteht. Diese Methode kann insbesondere in schrittweise aufgebauten Programmen zur Bewertung der Gefahren von Pflanzenschutzmitteln für Bienen verwendet werden, die auf einem sequenziellen Übergang von Labortoxizitätsprüfungen auf Halbfreiland- und Freilandversuche beruhen (1). Pestizide können dabei als Wirkstoffe oder als formulierte Produkte geprüft werden.
Zur Überprüfung der Empfindlichkeit der Bienen und der Genauigkeit des Prüfverfahrens sollte ein toxischer Standard verwendet werden.
1.2 Begriffsbestimmungen
Akute orale Toxizität: Dies sind die negativen Wirkungen, die innerhalb eines Zeitraums von maximal 96 Stunden bei einer oralen Verabreichung einer einfachen Dosis der Prüfsubstanz auftreten.
Dosis: Dies ist die aufgenommene Menge an Prüfsubstanz. Die Dosis wird als Masse (g) Prüfsubstanz je Prüftier ausgedrückt (g/Biene). Die tatsächliche Dosis für jede einzelne Biene kann zwar nicht berechnet werden, da die Bienen gemeinsam gefüttert werden, es lässt sich jedoch eine durchschnittliche Dosis abschätzen (insgesamt aufgenommene Prüfsubstanz/Anzahl der Testbienen in einem Käfig).
Orale LD50 (mittlere letale Dosis): Dies ist die statistisch abgeleitete einfache Dosis einer Substanz, die bei oraler Verabreichung bei 50 % der Tiere zum Tod führen kann. Der LD50-Wert wird µg Prüfsubstanz je Biene angegeben. Bei Pflanzenschutzmitteln kann die Prüfsubstanz entweder als Wirkstoff oder als formuliertes Produkt mit einem oder mehreren Wirkstoffen vorliegen.
Mortalität: Ein Tier wird als tot protokolliert, wenn es absolut unbeweglich ist.
1.3 Prinzip der Methode
Erwachsene Arbeitshonigbienen (Apis mellifera) werden einem Bereich von Dosen der in einer Zuckerlösung dispergierten Prüfsubstanz ausgesetzt. Die Bienen werden dann mit derselben Lösung, jedoch ohne die Prüfsubstanz, gefüttert. Die Mortalität wird täglich im Verlauf von zumindest 48 Stunden protokolliert und mit Kontrollwerten verglichen. Wenn die Mortalitätsrate in der Zeit zwischen 24 Stunden und 48 Stunden zunimmt, während die Kontrollmortalität auf einem akzeptierten Stand bleibt, d. h. < 10 %, ist es angebracht, die Dauer der Prüfung auf maximal 96 Stunden zu verlängern. Die Ergebnisse werden ausgewertet, um die LD50 für 24 Stunden und 48 Stunden und, sofern die Untersuchung verlängert wurde, für 72 Stunden und 96 Stunden zu berechnen.
1.4 Validitätskriterien
Damit die Validität einer Prüfung gegeben ist, gelten die folgenden Bedingungen:
- Die durchschnittliche Mortalität darf bei der gesamten Anzahl an Kontrollen 10 % am Ende der Prüfung nicht übersteigen;
- die LD50 der toxischen Bezugsnormale entspricht dem festgelegten Bereich.
1.5 Beschreibung der Methode
1.5.1 Sammlung der Bienen
Es sollten junge erwachsene Arbeiterinnen derselben Rasse verwendet werden, d. h. Bienen gleichen Alters, gleichen Ernährungszustands usw. Die Bienen sollten aus angemessen gefütterten, gesunden, möglichst krankheitsfreien Völkern mit Königin stammen, deren Vorgeschichte und physiologischer Zustand bekannt ist. Sie könnten am Morgen der Verwendung oder am Abend vor der Prüfung gesammelt und bis zum nächsten Tag unter Prüfbedingungen gehalten werden. Bienen, die von Rähmchen ohne Brut gesammelt werden, sind geeignet. Eine Sammlung im frühen Frühjahr oder Spätherbst sollte vermieden werden, da die Bienen in dieser Zeit eine veränderte Physiologie aufweisen. Müssen Prüfungen im frühen Frühjahr oder Spätherbst durchgeführt werden, können Bienen in einem Brutschrank zum Schlüpfen gebracht und eine Woche lang mit "Bienenbrot" (aus der Wabe gesammelte Pollen) und Zuckerlösung aufgezogen werden. Bienen, die mit chemischen Substanzen behandelt wurden, wie z.B. Antibiotika, Anti-Varroa-Produkten usw., sollten nach dem Ende der letzten Behandlung 4 Wochen nicht für Toxizitätsprüfungen eingesetzt werden.
1.5.2 Unterbringungs- und Fütterungsbedingungen
Verwendet werden einfach zu säubernde und gut belüftete Käfige. Dabei kann jedes geeignete Material verwendet werden, beispielsweise Edelstahl-, Drahtgitter-, Kunststoff- oder Einwegholzkäfige usw. Es sollten möglichst Gruppen von jeweils 10 Bienen pro Käfig zum Einsatz kommen. Die Größe der Prüfkäfige sollte der Anzahl der Bienen entsprechen, d. h. angemessenen Platz bieten.
Die Bienen sollten im Dunkeln in einem Versuchsraum mit einer Temperatur von 25 °C ± 2 °C gehalten werden. Die relative Feuchte, die im Normalfall zwischen 50 und 70 % liegt, sollte während der gesamten Prüfung gemessen und protokolliert werden. Alle Tätigkeiten, einschließlich Behandlung und Beobachtungen, können bei (Tages-)Licht durchgeführt werden. Als Futter wird eine Zuckerlösung in Wasser mit einer endgültigen Konzentration von 500 g/l (50 % Gew./Vol.) verwendet. Nach Verabreichung der Prüfdosen sollte das Futter nach Belieben dargeboten werden. Das Fütterungssystem sollte die Möglichkeit bieten, die Futteraufnahme für jeden Käfig zu protokollieren (siehe 1.6.3.1). Es kann ein Glasröhrchen (circa 50 mm lang und 10 mm breit und am offenen Ende auf einen Durchmesser von etwa 2 mm verjüngt) verwendet werden.
1.5.3 Vorbereitung der Bienen
Die gesammelten Bienen werden nach dem Zufallsprinzip auf die Prüfkäfige verteilt, die ebenfalls zufällig in dem Versuchsraum angeordnet sind.
Vor Beginn der Prüfung kann man die Bienen bis zu 2 Stunden hungern lassen. Es wird empfohlen, den Bienen vor der Behandlung die Nahrung zu entziehen, damit der Darminhalt zu Beginn der Prüfung bei allen Bienen gleich ist. Im Sterben liegende Bienen sollten ausgesondert und vor Beginn der Prüfung durch gesunde Bienen ersetzt werden.
1.5.4 Herstellung der Dosen
Sofern es sich bei der Prüfsubstanz um eine mit Wasser mischbare Verbindung handelt, kann diese direkt in einer 50 %igen Zuckerlösung dispergiert werden. Bei technischen Produkten und Substanzen mit geringer Wasserlöslichkeit können Trägersubstanzen wie organische Lösemittel, Emulgatoren oder Dispersionsmittel mit geringer Bienentoxizität verwendet werden (z.B. Aceton, Dimethylformamid, Dimethylsulfoxid). Die Konzentration des Trägers hängt dabei von der Löslichkeit der Prüfsubstanz ab und sollte für alle geprüften Konzentrationen gleich sein. Im Allgemeinen ist eine Konzentration der Trägersubstanz von 1 % angemessen und sollte nicht überschritten werden.
Es sollten entsprechende Kontrolllösungen hergestellt werden, d. h., wird ein Löse- oder Dispersionsmittel zur Lösung der Prüfsubstanz benutzt, sollten zwei getrennte Kontrollgruppen verwendet werden, und zwar eine Lösung in Wasser und eine Zuckerlösung mit dem Lösemittel/Träger in der Konzentration, die auch in den Dosierlösungen vorliegt.
1.6 Vorgehensweise
1.6.1 Prüf- und Kontrollgruppen
Die Anzahl an geprüften Dosen und Wiederholungen sollte die statistischen Anforderungen für eine Bestimmung der LD50 mit einem 95 %igen Vertrauensbereich erfüllen. Im Normalfall sind für die Prüfung fünf Dosen in einer geometrischen Reihe, die sich um einen Faktor von nicht mehr als 2,2 unterscheiden und den Bereich für die LD50, abdecken, erforderlich. Der Verdünnungsfaktor und die Anzahl an Konzentrationen für die Dosierung müssen jedoch im Verhältnis zur Steigung der Toxizitätskurve (Dosis im Verhältnis zu Mortalität) unter Berücksichtigung der für die Auswertung der Ergebnisse herangezogenen statistischen Methode bestimmt werden. Mit Hilfe einer Vorprüfung zur Bestimmung des Konzentrationsbereichs lassen sich die angemessenen Konzentrationen für die Dosierung auswählen.
Mindestens drei Wiederholungsprüfgruppen von jeweils 10 Bienen sollten jeder Prüfkonzentrationsdosis ausgesetzt werden. Zusätzlich zu den Prüfreihen sollten mindestens drei Kontrollgruppen von jeweils 10 Bienen zum Einsatz kommen. Kontrollgruppen sollten auch für die verwendeten Lösemittel/Trägersubstanzen einbezogen werden (siehe 1.5.4).
1.6.2 Toxischer Standard
In die Prüfreihen ist ein toxischer Standard aufzunehmen. Zumindest drei Dosen sollten ausgewählt werden, die den erwarteten LD50-Wert abdecken. Für jede Prüfdosis sollten mindestens drei Wiederholungskäfige mit jeweils 10 Bienen verwendet werden Der bevorzugte toxische Standard ist Dimethoat; für diesen Stoff liegt die nachgewiesene orale LD50 für 24 Stunden im Bereich von 0,10 bis 0,35 µg Wirkstoff/Biene (2). Andere toxische Standards wären jedoch annehmbar, soweit hinreichende Daten zur Überprüfung der erwarteten Dosisreaktion vorgelegt werden können (z.B. Parathion).
1.6.3 Exposition
1.6.3.1 Verabreichung der Dosen
Jeder Prüfgruppe von Bienen müssen 100 bis 200 µl einer 50 %igen Zuckerlösung in Wasser mit der Prüfsubstanz in der entsprechenden Konzentration verabreicht werden. Bei Produkten mit geringer Löslichkeit, niedriger Toxizität oder geringer Konzentration in der Rezeptur ist ein größeres Volumen erforderlich, da dann größere Anteile an Zuckerlösung verwendet werden müssen. Die Menge an aufgenommener Nahrung je Gruppe ist festzuhalten. Nach dem Verzehr (im Allgemeinen innerhalb von 3-4 Stunden) muss die Fütterungsvorrichtung aus dem Käfig entfernt und durch eine Vorrichtung, die ausschließlich Zuckerlösung enthält, ersetzt werden. Die Zuckerlösung wird dann nach Belieben dargeboten. Bei einigen Verbindungen kann bei höheren Konzentrationen die Ablehnung der Prüfdosis dazu führen, dass nur wenig oder gar kein Futter aufgenommen wird. Nach maximal 6 Stunden sollte das bis dahin unverbrauchte behandelte Futter durch eine reine Zuckerlösung ersetzt werden. Die Menge an aufgenommenem behandeltem Futter muss gemessen werden (z.B. Messung von Volumen/Gewicht des noch verbleibenden behandelten Futters).
1.6.3.2 Dauer
Die Dauer der Prüfung sollte vorzugsweise 48 Stunden ab dem Zeitpunkt, zu dem die Prüflösung durch die Zuckerlösung allein ersetzt wurde, betragen. Steigt die Mortalität nach den ersten 24 Stunden weiterhin um mehr als 10 % an, sollte die Prüfdauer auf maximal 96 Stunden verlängert werden, sofern die Kontrollmortalität nicht über 10 % hinausgeht.
1.6.4 Beobachtungen
Die Mortalität wird 4 Stunden nach Beginn der Prüfung und dann nach 24 Stunden und 48 Stunden protokolliert (d. h. nach Verabreichung der Dosis). Ist ein verlängerter Beobachtungszeitraum erforderlich, sollten weitere Bewertungen im Abstand von 24 Stunden bis maximal 96 Stunden vorgenommen werden, sofern die Kontrollmortalität 10 % nicht übersteigt.
Die Menge an aufgenommenem Futter pro Gruppe muss gemessen werden. Ein Vergleich zwischen den Anteilen an verzehrtem behandeltem und unbehandeltem Futter innerhalb der vorgegebenen 6 Stunden kann Aufschluss über die Genießbarkeit des behandelten Futters geben.
Alle anormalen Verhaltensweisen während des Prüfzeitraums müssen protokolliert werden.
1.6.5 Limit-Test
in einigen Fällen (z.B. wenn man erwartet, dass die Prüfsubstanz eine geringe Toxizität besitzt) kann ein Limit-Test mit 100 µg Wirkstoff/Biene durchgeführt werden, um nachzuweisen, dass die LD50 höher als dieser Wert ist. Dabei sollte das gleiche Verfahren zum Einsatz kommen, einschließlich drei Wiederholungsprüfgruppen für die Prüfdosis, die betreffenden Kontrollen, die Messung der Menge an verzehrtem behandeltem Futter und die Verwendung des toxischen Standards. Sofern Mortalitäten auftreten, sollte eine vollständige Untersuchung durchgeführt werden. Eventuell beobachtete subletale Wirkungen (siehe 1.6.4) müssen dokumentiert werden.
2. Daten und Berichterstattung
2.1 Daten
Daten sollten in tabellarischer Form zusammengefasst werden, wobei für jede Behandlungsgruppe sowie für die Kontrollgruppe und die Gruppe mit dem toxischen Standard die Anzahl an eingesetzten Bienen, die Mortalität für jede Beobachtungszeit und die Anzahl an Bienen mit beeinträchtigtem Verhalten auszuweisen sind. Die Mortalitätsdaten sind mit angemessenen statistischen Verfahren zu analysieren (z.B. Probit-Analyse, gleitender Durchschnitt, binomiale Wahrscheinlichkeit) (3) (4). Die Dosis-Reaktions-Kurven sind für jede empfohlene Beobachtungszeit darzustellen, und die Steigungen der Kurven und die mittleren letalen Dosen (LD50) sind mit einem 95 % Vertrauensbereich zu berechnen. Korrekturen an der Kontrollmortalität könnten mit Hilfe der Abbottschen Korrektur vorgenommen werden (4) (5). Sofern das behandelte Futter nicht vollständig verzehrt wurde, sollte die Prüfsubstanzdosis, die von jeder Gruppe aufgenommen wurde, ermittelt werden. Die LD50 sollte in µg Prüfsubstanz je Biene angegeben werden.
2.2 Prüfbericht
Der Prüfbericht muss die folgenden Angaben enthalten:
2.2.1 Prüfsubstanz
- Physikalische Beschaffenheit und relevante physikalischchemische Eigenschaften (z.B. Stabilität in Wasser, Dampfdruck);
- Daten zur chemischen Identifikation, einschließlich Strukturformel, Reinheit (d. h., für Pflanzenschutzmittel die Identität und Konzentration des/der Wirkstoffs(e).
2.2.2 Geprüfte Bienenart
- Wissenschaftlicher Name, Rasse, ungefähres Alter (in Wochen), Sammlungsverfahren, Datum der Sammlung;
- Angaben über die Völker, die für die Sammlung der Prüfbienen eingesetzt wurden, einschließlich Gesundheitszustand, eventuelle Krankheiten von erwachsenen Bienen, eventuelle Vorbehandlungen usw.
2.2.3 Prüfbedingungen
- Temperatur und relative Feuchte des Versuchsraums;
- Unterbringungsbedingungen einschließlich Art, Größe und Material der Käfige;
- Verfahren für die Herstellung der Stamm- und Prüflösungen (sofern ein Lösemittel verwendet wird, müssen dieses Mittel und seine Konzentration angegeben werden);
- Versuchsanlage, z.B. Anzahl und eingesetzte Prüfkonzentrationen, Anzahl an Kontrollen; für jede Prüfkonzentration und Kontrolle Anzahl an Wiederholungskäfigen und Anzahl an Bienen pro Käfig;
- Datum der Prüfung.
2.2.4 Ergebnisse
- Ergebnisse von eventuellen Vorversuchen zur Ermittlung des Konzentrationsbereichs;
- Rohdaten: Mortalität bei jeder geprüften Dosis zu jeder Beobachtungszeit;
- Darstellung der Dosisreaktionskurven am Ende der Prüfung;
- LD50-Werte mit 95 %igem Vertrauensbereich für jede empfohlene Beobachtungszeit, jede Prüfsubstanz und den toxischen Standard;
- zur Bestimmung der LD50 herangezogene statistische Verfahren;
- Mortalität in Kontrollen;
- sonstige beobachtete oder gemessene biologische Wirkungen, z.B. abnormes Verhalten der Bienen (einschließlich Ablehnung der Prüfdosis), Anteil an verzehrtem Futter in behandelten und unbehandelten Gruppen;
- eventuelle Abweichungen von den hier beschriebenen Prüfverfahren und sonstige relevante Informationen.
3. Literaturhinweise
(1) EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products - Honeybees. EPPO Bulletin, Vol. 23, N.1, 151-165. March 1993.
(2) Gough, H. J., McIndoe, E. C., Lewis, G. B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22, 119-125.
(3) Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating doseeffect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113.
(4) Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
(5) Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. jour. Econ. Entomol., 18, 265-267.
C.17 Honigbienen - Akute Kontakttoxizitätsprüfung
1. Methode
Diese Methode zur Prüfung der akuten Toxizität entspricht der OECD TG 214 (1998).
1.1 Einleitung
Diese Toxizitätsprüfung ist ein Laborverfahren, mit dem die akute Kontakttoxizität von Pflanzenschutzmitteln und anderen Chemikalien für erwachsene Arbeitshonigbienen bewertet werden soll.
Bei der Bewertung und Beurteilung der toxischen Merkmale von Substanzen ist unter Umständen die Bestimmung der akuten Kontakttoxizität bei Bienen erforderlich, beispielsweise wenn die Wahrscheinlichkeit einer Exposition von Bienen gegenüber einer bestimmten Chemikalie besteht. Die akute Kontakttoxizitätsprüfung wird durchgeführt, um die spezifische Toxizität von Pestiziden und anderen Chemikalien für Bienen zu bestimmen. Die Ergebnisse dieser Prüfung sollten herangezogen werden, um festzulegen, ob weiterer Beurteilungsbedarf besteht. Diese Methode kann insbesondere in schrittweise aufgebauten Programmen zur Bewertung der Gefahren von Pflanzenschutzmittel für Bienen verwendet werden, die auf einem sequenziellen Übergang von Labortoxizitätsprüfungen auf Halbfreiland- und Freilandversuche beruhen (1). Pestizide können dabei als Wirkstoffe oder als formulierte Produkte geprüft werden.
Zur Überprüfung der Empfindlichkeit der Bienen und der Genauigkeit des Prüfverfahrens sollte ein toxischer Standard verwendet werden.
1.2 Begriffsbestimmungen
Akute Kontakttoxizität: Dies sind die negativen Wirkungen, die innerhalb eines Zeitraums von maximal 96 Stunden bei einer topikalen Verabreichung einer einzelnen Dosis der Prüfsubstanz auftreten.
Dosis: Dies ist die aufgebrachte Menge an Prüfsubstanz. Die Dosis wird als Menge (g) Prüfsubstanz je Prüftier angegeben (g/Biene).
Kontakt-LD50 (mittlere letale Dosis): Dies ist die statistisch abgeleitete einzelne Dosis einer Substanz, die bei Verabreichung durch Kontakt bei 50 % der Tiere zum Tod führen kann. Der LD50-Wert wird in µg Prüfsubstanz je Biene angegeben. Bei Pestiziden können die Pflanzenschutzmittel entweder als Wirkstoff oder als formuliertes Produkt mit einem oder mehreren Wirkstoffen vorliegen.
Mortalität: Ein Tier wird als tot protokolliert, wenn es absolut unbeweglich ist.
1.3 Prinzip der Methode
Erwachsene Arbeitshonigbienen (Apis mellifera) werden einem Bereich von Dosen der in einem entsprechenden Träger gelösten Prüfsubstanz durch direktes Aufbringen auf den Thorax (Tröpfchen) ausgesetzt. Die Dauer der Prüfung beträgt 48 Stunden. Wenn die Mortalitätsrate in der Zeit zwischen 24 Stunden und 48 Stunden zunimmt, während die Kontrollmortalität auf einem akzeptierten Stand bleibt, d. h. < 10 %, ist es angebracht, die Dauer der Prüfung auf maximal 96 Stunden zu verlängern. Die Mortalität wird täglich protokolliert und mit Kontrollwerten verglichen. Die Ergebnisse werden ausgewertet, um die LD50 für 24 Stunden und 48 Stunden und, sofern die Untersuchung verlängert wurde, für 72 Stunden und 96 Stunden zu berechnen.
1.4 Validitätskriterien
Damit die Validität einer Prüfung gegeben ist, gelten die folgenden Bedingungen:
- Die durchschnittliche Mortalität darf bei der gesamten Anzahl an Kontrollen 10 % am Ende der Prüfung nicht übersteigen;
- die LD50 des toxischen Standards entspricht dem festgelegten Bereich.
1.5 Beschreibung der Methode
1.5.1 Sammlung der Bienen
Es sollten junge erwachsene Arbeiterinnen verwendet werden, d. h. Bienen gleichen Alters, gleichen Ernährungszustands, gleicher Rasse usw. Die Bienen sollten aus angemessen gefütterten, gesunden, möglichst krankheitsfreien Völkern mit Königin stammen, deren Vorgeschichte und physiologischer Zustand bekannt ist. Sie könnten am Morgen der Verwendung oder am Abend vor der Prüfung gesammelt und bis zum nächsten Tag unter Prüfbedingungen gehalten werden. Bienen, die von Rähmchen ohne Brut gesammelt werden, sind geeignet. Eine Sammlung im frühen Frühjahr oder Spätherbst sollte vermieden werden, da die Bienen in dieser Zeit eine veränderte Physiologie aufweisen. Müssen Prüfungen im frühen Frühjahr oder Spätherbst durchgeführt werden, können Bienen in einem Brutschrank zum Schlüpfen gebracht und eine Woche lang mit "Bienenbrot" (aus der Wabe gesammelte Pollen) und Zuckerlösung aufgezogen werden. Bienen, die mit chemischen Substanzen behandelt wurden wie z.B. Antibiotika, Anti-Varroa-Produkten usw., sollten nach dem Ende der letzten Behandlung 4 Wochen nicht für Toxizitätsprüfungen eingesetzt werden.
1.5.2 Unterbringungs- und Fütterungsbedingungen
Verwendet werden einfach zu säubernde und gut belüftete Käfige. Dabei kann jedes geeignete Material benutzt werden, beispielsweise Edelstahl-, Drahtgitter-, Kunststoff- oder Einwegholzkäfige usw. Die Größe der Prüfkäfige sollte der Anzahl der Bienen entsprechen, d. h. angemessenen Platz bieten. Es sollten möglichst Gruppen von jeweils 10 Bienen pro Käfig zum Einsatz kommen.
Die Bienen sollten im Dunkeln in einem Versuchsraum mit einer Temperatur von 25 ± 2 °C gehalten werden. Die relative Feuchte, die im Normalfall zwischen 50 und 70 % liegt, sollte während der gesamten Prüfung gemessen und protokolliert werden. Alle Tätigkeiten, einschließlich Behandlung und Beobachtungen, können bei (Tages-)Licht durchgeführt werden. Als Futter sollte eine Zuckerlösung in Wasser mit einer endgültigen Konzentration von 500 g/l (50 % Gew./Vol.) verwendet und nach Belieben während der Prüfdauer mit Hilfe einer Bienenfütterungsvorrichtung dargeboten werden. Dies kann ein Glasröhrchen (circa 50 mm lang und 10 mm breit und am offenen Ende auf einen Durchmesser von etwa 2 mm verjüngt) sein.
1.5.3 Vorbereitung der Bienen
Die gesammelten Bienen können mit Kohlendioxid oder Stickstoff zum Aufbringen der Prüfsubstanz betäubt werden. Dabei sollten die Menge an Betäubungsmittel und dessen Einwirkungszeit so gering wie möglich gehalten werden. Im Sterben liegende Bienen sollten ausgesondert und vor Beginn der Prüfung durch gesunde Bienen ersetzt werden.
1.5.4 Herstellung der Dosen
Die Prüfsubstanz ist als Lösung in einer Trägersubstanz aufzubringen, d. h. einem organischen Lösemittel oder einer Wasserlösung mit einem Benetzungsmittel. Als organisches Lösemittel wird Aceton bevorzugt, aber auch andere organische Lösemittel mit geringer Bienentoxizität können verwendet werden (z.B. Dimethylformamid, Dimethylsulfoxid). Bei in Wasser dispergierten formulierten Produkten und hochpolaren organischen Substanzen, die in organischen Trägerlösemitteln nicht löslich sind, lassen sich die Lösungen unter Umständen einfacher auftragen, wenn sie in einer schwachen Lösung eines handelsüblichen Benetzungsmittels hergestellt werden (z.B. Agral, Cittowett, Lubrol, Triton, Tween).
Es sollten entsprechende Kontrolllösungen hergestellt werden, d. h., wird ein Löse- oder Dispersionsmittel zur Lösung der Prüfsubstanz benutzt, sollten zwei getrennte Kontrollgruppen verwendet werden, und zwar eine, die mit Wasser, und eine, die mit dem Löse-/Dispersionsmittel behandelt ist.
1.6 Vorgehensweise
1.6.1 Prüf- und Kontrollgruppen
Die Anzahl an geprüften Dosen und Wiederholungen sollte die statistischen Anforderungen für eine Bestimmung der LD50 mit einem 95 %igen Vertrauensbereich erfüllen. Im Normalfall sind für die Prüfung fünf Dosen in einer geometrischen Reihe, die sich um einen Faktor von nicht mehr als 2,2 unterscheiden und den Bereich für die LD50, abdecken, erforderlich. Die Anzahl an Dosen muss jedoch im Verhältnis zur Steigung der Toxizitätskurve (Dosis im Verhältnis zu Mortalität) unter Berücksichtigung der für die Auswertung der Ergebnisse herangezogenen statistischen Methode bestimmt werden. Mit Hilfe einer Vorprüfung zur Bestimmung des Konzentrationsbereichs lassen sich die angemessenen Dosen auswählen.
Mindestens drei Wiederholungsprüfgruppen von jeweils 10 Bienen sollten jeder Prüfkonzentrationsdosis ausgesetzt werden.
Zusätzlich zu den Prüfreihen sollten mindestens drei Kontrollgruppen von jeweils 10 Bienen zum Einsatz kommen. Wird ein organisches Lösemittel oder ein Benetzungsmittel verwendet, müssen drei zusätzliche Kontrollgruppen mit jeweils 10 Bienen für das Löse- oder Benetzungsmittel mit einbezogen werden.
1.6.2 Toxischer Standard
In die Prüfreihen ist ein toxischer Standard aufzunehmen. Zumindest drei Dosen sollten ausgewählt werden, die den erwarteten LD50-Wert abdecken. Für jede Prüfdosis sollten mindestens drei Wiederholungskäfige mit jeweils 10 Bienen verwendet werden. Der bevorzugte toxische Standard ist Dimethoat: Für diesen Stoff liegt die nachgewiesene Kontakt-LD50 für 24 Stunden im Bereich von 0,10 bis 0,30 µg Wirkstoff/Biene (2). Andere toxische Standards wären jedoch annehmbar, soweit hinreichende Daten zur Überprüfung der erwarteten Dosisreaktion vorgelegt werden können (z.B. Parathion).
1.6.3 Exposition
1.6.3.1 Verabreichung der Dosen
Bei den betäubten Bienen erfolgt jeweils einzeln eine topikale Aufbringung. Die Bienen werden nach dem Zufallsprinzip den verschiedenen Prüfdosen und Kontrollen zugeordnet. Ein Volumen von 1 µl Lösung mit der Prüfsubstanz in der geeigneten Konzentration wird mit einem Mikroapplikator auf die Dorsalseite des Thorax einer jeden Biene aufgetragen. Sofern begründet, können andere Volumina verwendet werden. Nach dem Auftragen werden die Bienen auf die Prüfkäfige verteilt und mit den Zuckerlösungen versorgt.
1.6.3.2 Dauer
Die Dauer der Prüfung sollte vorzugsweise 48 Stunden betragen. Steigt die Mortalität zwischen 24 und 48 Stunden um mehr als 10 % an, sollte die Prüfdauer auf maximal 96 Stunden verlängert werden, sofern die Kontrollmortalität nicht über 10 % hinausgeht.
1.6.4 Beobachtungen
Die Mortalität wird 4 Stunden nach der Dosierung und dann nach 24 Stunden und 48 Stunden protokolliert. Ist ein verlängerter Beobachtungszeitraum erforderlich, sollten weitere Bewertungen im Abstand von 24 Stunden bis maximal 96 Stunden vorgenommen werden, sofern die Kontrollmortalität 10 % nicht übersteigt.
Alle anormalen Verhaltensweisen während des Prüfzeitraums müssen protokolliert werden.
1.6.5 Limit-Test
In einigen Fällen (z.B. wenn man erwartet, dass die Prüfsubstanz eine geringe Toxizität besitzt) kann ein Limit-Test mit 100 µg Wirkstoff/Biene durchgeführt werden, um nachzuweisen, dass die LD50 höher als dieser Wert ist. Dabei sollte das gleiche Verfahren zum Einsatz kommen, einschließlich drei Wiederholungsprüfgruppen für die Prüfdosis, die betreffenden Kontrollen und die Verwendung des toxischen Standards. Sofern Mortalitäten auftreten, sollte eine vollständige Untersuchung durchgeführt werden. Eventuell beobachtete subletale Wirkungen (siehe 1.6.4) sind zu dokumentieren.
2. Daten und Berichterstattung
2.1 Daten
Daten sollten in tabellarischer Form zusammengefasst werden, wobei für jede Behandlungsgruppe sowie für die Kontrollgruppe und die Gruppe mit dem toxischen Standard die Anzahl an eingesetzten Bienen, die Mortalität für jede Beobachtungszeit und die Anzahl an Bienen mit beeinträchtigtem Verhalten auszuweisen sind. Die Mortalitätsdaten sind mit angemessenen statistischen Verfahren zu analysieren (z.B. Probit-Analyse, gleitender Durchschnitt, binomiale Wahrscheinlichkeit) (3) (4). Die Dosisreaktionskurven sind für jede empfohlene Beobachtungszeit (d. h. 24 und 48 Stunden sowie, soweit zutreffend, 72 und 96 Stunden) darzustellen, und die Steigungen der Kurven und die mittleren letalen Dosen (LD50) sind mit einem 95 % Vertrauensbereich zu berechnen. Korrekturen um die Kontrollmortalität könnten mit Hilfe der Abbott'schen Korrektur vorg nommen werden (4) (5). Die LD50 sollte in µg Prüfsubstanz je Biene angegeben werden.
2.2 Prüfbericht
Der Prüfbericht muss die folgenden Angaben enthalten
2.2.1 Prüfsubstanz
- Physikalische Beschaffenheit und relevante physikalischchemische Eigenschaften (z.B. Stabilität in Wasser, Dampfdruck);
- Daten zur chemischen Identifikation, einschließlich Strukturformel, Reinheit (d. h. für Pflanzenschutzmittel die Identität und Konzentration des bzw. der Wirkstoffe).
2.2.2 Geprüfte Bienenart
- Wissenschaftlicher Name, Rasse, ungefähres Alter (in Wochen), Sammlungsverfahren, Datum der Sammlung:
- Angaben über die Völker, die für die Sammlung der Prüfbienen eingesetzt wurden, einschließlich Gesundheitszustand, eventuelle Krankheiten von erwachsenen Bienen, eventuelle Vorbehandlungen usw.
2.2.3 Prüfbedingungen
- Temperatur und relative Feuchte des Versuchsraums;
- Unterbringungsbedingungen einschließlich Art, Größe und Material der Käfige;
- Verfahren für die Verabreichung der Prüfsubstanz, z.B. verwendete Trägerlösung, aufgebrachtes Prüflösungsvolumen, verwendetes Betäubungsmittel;
- Versuchsanlage, z.B. Anzahl und eingesetzte Prüfdosen, Anzahl an Kontrollen; für jede Prüfdosis und Kontrolle Anzahl an Wiederholungskäfigen und Anzahl an Bienen pro Käfig;
- Datum der Prüfung.
2.2.4 Ergebnisse
- Ergebnisse von eventuellen Vorversuchen zur Ermittlung des Konzentrationsbereichs;
- Rohdaten: Mortalität bei jeder geprüften Konzentration zu jeder Beobachtungszeit;
- Darstellung der Dosisreaktionskurven am Ende der Prüfung;
- LD50-Werte mit 95 %igem Vertrauensbereich für jede empfohlene Beobachtungszeit, jede Prüfsubstanz und den toxischen Standard;
- zur Bestimmung der LD50 herangezogene statistische Verfahren;
- Mortalität in Kontrollen;
- sonstige beobachtete oder gemessene biologische Wirkungen und eventuelle abnorme Reaktionen der Bienen;
- eventuelle Abweichungen von den hier beschriebenen Prüfverfahren und sonstige relevante Informationen.
3. Literaturhinweise
(1) EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products - Honeybees. EPPO bulletin, Vol. 23, N.1, 151-165. March 1993.
(2) Gough, H. J., McIndoe, E. C., Lewis, G. B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981-1992. Journal of Apicultural Research 22, 119-125.
(3) Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating doseeffect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113.
(4) Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
(5) Abbott, W. S. (1925). A method for Computing the effectiveness of an insecticide. Jour. Econ. Entomol. 18, 265-267.
 | weiter . |  |
...
X
⍂
↑
↓
