 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2020, Chemikalien - EU Bund
 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2020, Chemikalien - EU Bund |
Delegierte Verordnung (EU) 2020/217 der Kommission vom 4. Oktober 2019 zur Änderung der Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen zwecks Anpassung an den technischen und wissenschaftlichen Fortschritt und zur Berichtigung der Verordnung
(Text von Bedeutung für den EWR)
(ABl. L 44 vom 18.02.2020 S. 1, ber. L 51 S. 13, ber. 2021 L 214 S. 72, ber. L 440 S. 11, ber. L 2023/90120)
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen, zur Änderung und Aufhebung der Richtlinien 67/548/EWG und 1999/45/EG und zur Änderung der Verordnung (EG) Nr. 1907/2006 1, insbesondere auf Artikel 37 Absatz 5 und Artikel 53 Absatz 1,
in Erwägung nachstehender Gründe:
(1) Tabelle 3 in Anhang VI Teil 3 der Verordnung (EG) Nr. 1272/2008 enthält die Liste der harmonisierten Einstufungen und Kennzeichnungen gefährlicher Stoffe auf Basis der Kriterien gemäß Anhang I Teile 2 bis 5 der genannten Verordnung.
(2) Der Europäischen Chemikalienagentur wurden gemäß Artikel 37 der Verordnung (EG) Nr. 1272/2008 Vorschläge zur Einführung harmonisierter Einstufungen und Kennzeichnungen bestimmter Stoffe sowie zur Aktualisierung oder Streichung bestimmter anderer Stoffe unterbreitet. Auf der Grundlage der Stellungnahmen des Ausschusses für Risikobeurteilung der Agentur zu diesen Vorschlägen sowie der Bemerkungen der Betroffenen empfiehlt es sich, eine harmonisierte Einstufung und Kennzeichnung bestimmter Stoffe neu einzuführen oder bestehende Einstufungen und Kennzeichnungen zu aktualisieren bzw. zu streichen. Dabei handelt es sich um folgende Stellungnahmen des RAC 2:
(3) Die Schätzwerte Akute Toxizität (ATE) werden hauptsächlich verwendet, um zu entscheiden, wie Gemische, die als akut toxisch eingestufte Stoffe enthalten, in Bezug auf die akute Toxizität für die menschliche Gesundheit einzustufen sind. Die Aufnahme harmonisierter ATE in die Einträge in Anhang VI der Verordnung (EG) Nr. 1272/2008 erleichtert die Harmonisierung der Einstufung von Gemischen und stellt eine Unterstützung für Durchsetzungsbehörden dar. Nach weiteren wissenschaftlichen Bewertungen einiger Stoffe wurden zusätzlich zu den in den Stellungnahmen des RAC vorgeschlagenen Werten ATE für Methylquecksilberchlorid, Pentakalium 2,2",2",2"",2""-(ethan-1,2-diylnitrilo)pentaacetat, N-Carboxymethyliminobis(ethylennitrilo)-tetraessigsäure, Pentanatrium-(carboxylatmethyl)iminobis(ethylennitrilo)tetraacetat (DTPA), Ethylenoxid, Oxiran und Metaldehyd (ISO), 2,4,6,8-Tetramethyl-1,3,5,7-tetraoxacyclooctan berechnet. Diese ATE sollten in die vorletzte Spalte der Tabelle 3 in Anhang VI Teil 3 der Verordnung (EG) Nr. 1272/2008 aufgenommen werden.
(4) In seiner wissenschaftlichen Stellungnahme vom 22. September 2017 über den Stoff Cobalt hat der RAC vorgeschlagen, diesen Stoff als karzinogen (Kategorie 1B) mit einem spezifischen Konzentrationsgrenzwert von ≥ 0,01 % einzustufen. Für die Methode zur Bestimmung eines spezifischen Konzentrationsgrenzwerts war jedoch eine weitere Bewertung insbesondere der Anwendbarkeit bei Metallverbindungen notwendig. Es ist daher angebracht, vorerst keinen spezifischen Konzentrationsgrenzwert in Anhang VI Teil 3 Tabelle 3 der Verordnung (EG) Nr. 1272/2008 für Cobalt einzuführen; in diesem Fall sollte der allgemeine Konzentrationsgrenzwert von ≥ 0,1 % gemäß Tabelle 3.6.2 des Anhangs I der genannten Verordnung gelten.
(5) In seiner wissenschaftlichen Stellungnahme vom 14. September 2017 über den Stoff Titandioxid hat der RAC vorgeschlagen, diesen Stoff als "karzinogen bei Einatmen" (Kategorie 2) einzustufen. Da die krebserregende Wirkung von Titandioxid auf die Lungen mit dem Einatmen von lungengängigen Titandioxidpartikeln sowie der Ablagerung und der schlechten Löslichkeit der Partikel in der Lunge in Verbindung gebracht wird, ist es angezeigt, die lungengängigen Titandioxidpartikel im Eintrag zu Titandioxid festzulegen. Es wird davon ausgegangen, dass die abgelagerten Partikel, nicht aber gelöstes Titandioxid, die beobachtete Toxizität in der Lunge und die anschließende Entwicklung von Tumoren verursachen. Um eine ungerechtfertigte Einstufung nicht gefährlicher Formen des Stoffes zu vermeiden, sollten spezifische Anmerkungen für die Einstufung und Kennzeichnung das Stoffes und der ihn enthaltenden Gemische aufgenommen werden. Da sich gefährlicher Staub oder gefährliche Tröpfchen bei der Verwendung von titandioxidhaltigen Gemischen bilden könnten, ist es außerdem notwendig, die Verwender über die Vorsichtsmaßnahmen zu informieren, die getroffen werden müssen, um die Gefahr für die menschliche Gesundheit möglichst gering zu halten.
(6) Die in den Stellungnahmen des RAC vom 9. Juni 2017 empfohlene Einstufung der Stoffe Pentakalium 2,2",2",2"",2""-(ethan-1,2-diylnitrilo)pentaacetat, N-Carboxymethyliminobis(ethylennitrilo)-tetraessigsäure und Pentanatrium-(carboxylatmethyl)iminobis(ethylennitrilo)tetraacetat (DTPA) als akut toxisch (Kategorie 4) und spezifisch zielorgantoxisch (wiederholte Exposition) (Kategorie 2) sollten in Anhang VI der Verordnung (EG) Nr. 1272/2008 aufgenommen werden, da genügend wissenschaftliche Nachweise vorliegen, die diese neuen Einstufungen rechtfertigen. Die in den Stellungnahmen des RAC vom 9. Juni 2017 empfohlene Einstufung der Stoffe Pentakalium 2,2",2",2"",2""-(ethan-1,2-diylnitrilo)pentaacetat und N-Carboxymethyliminobis(ethylennitrilo)-tetraessigsäure als augenreizend (Kategorie 2) sollte in Anhang VI der Verordnung (EG) Nr. 1272/2008 aufgenommen werden, da genügend wissenschaftliche Nachweise vorliegen, die diese neuen Einstufungen rechtfertigen. Die Einstufung der Stoffe Pentakalium 2,2",2",2"",2""-(ethan-1,2-diylnitrilo)pentaacetat, N-Carboxymethyliminobis(ethylennitrilo)-tetraessigsäure und Pentanatrium-(carboxylatmethyl)iminobis(ethylennitrilo)tetraacetat (DTPA) als reproduktionstoxisch (Kategorie 1B) sollte nicht aufgenommen werden, da dafür eine weitere Bewertung durch den RAC im Hinblick auf neue wissenschaftliche Daten über die Reproduktionstoxizität, die von der Industrie nach Übermittlung der Stellungnahmen des RAC an die Kommission vorgelegt wurden, erforderlich ist.
(7) Die Verordnung (EG) Nr. 1272/2008 sollte daher entsprechend geändert werden.
(8) Die Verordnung (EG) Nr. 1272/2008 enthält die harmonisierte Einstufung, Kennzeichnung und Verpackung für den Stoff Pech, Kohlenteer, Hochtemperatur. Die Kommission hat die harmonisierte Einstufung, Kennzeichnung und Verpackung dieses Stoffes mit Wirkung vom 1. April 2016 durch die Verordnung (EU) Nr. 944/2013 der Kommission 3 geändert. Mit der Verordnung (EU) 2018/669 4 der Kommission wurde die Verordnung (EG) Nr. 1272/2008 erneut geändert. Aufgrund eines Verwaltungsfehlers wurden jedoch bestimmte mit der Verordnung (EU) Nr. 944/2013 eingeführte Änderungen, deren Gültigkeit durch das Urteil des Gerichts in der Rechtssache T-689/13 5, welches durch das Urteil des Gerichtshofs in der Rechtssache C-691/15 P 6 bestätigt wurde, nicht berührt wurde, in der Verordnung (EU) 2018/669 nicht berücksichtigt. Diese Verordnung gilt ab dem 1. Dezember 2019. Die Verordnung (EG) Nr. 1272/2008 sollte daher mit Wirkung ab demselben Datum berichtigt werden.
(9) Damit die Lieferanten von Stoffen und Gemischen Zeit haben, sich an die neuen Vorschriften für die Einstufung und Kennzeichnung anzupassen, sollte die Anwendung dieser Verordnung aufgeschoben werden.
(10) Im Interesse der Kohärenz mit dem Ansatz, der Artikel 61 Absatz 2 der Verordnung (EG) Nr. 1272/2008 zugrunde liegt, sollten die Lieferanten die mit dieser Verordnung eingeführten Einstufungs-, Kennzeichnungs- und Verpackungsvorschriften vor ihrem Geltungsbeginn auf freiwilliger Basis anwenden können
- hat folgende Verordnung erlassen:
Artikel 1 Änderung der Verordnung (EG) Nr. 1272/2008
Die Verordnung (EG) Nr. 1272/2008 wird wie folgt geändert:
1. Anhang II wird gemäß Anhang I der vorliegenden Verordnung geändert.
2. Anhang III wird gemäß Anhang II der vorliegenden Verordnung geändert.
3. Anhang VI wird gemäß Anhang III der vorliegenden Verordnung geändert.
Artikel 2 Berichtigung der Verordnung (EG) Nr. 1272/2008
Anhang VI der Verordnung (EG) Nr. 1272/2008 wird nach Maßgabe des Anhangs IV der vorliegenden Verordnung berichtigt.
Artikel 3 Inkrafttreten und Anwendung
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Sie gilt ab dem 1. Oktober 2021.
Artikel 2 gilt jedoch ab 1. Dezember 2019.
Stoffe und Gemische können vor dem 1. Oktober 2021 in Einklang mit der Verordnung (EG) Nr. 1272/2008 in der durch die vorliegende Verordnung geänderten Fassung eingestuft, gekennzeichnet und verpackt werden.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 4. Oktober 2019
2) https://echa.europa.eu/registry-of-clh-intentions-until-outcome/-/dislist/name/-/ecNumber/-/casNumber/-/dte_receiptFrom/-/dte_receipt To/-/prc_public_status/Opinion+Adopted/dte_withdrawnFrom/-/dte_withdrawn To/-/sbm_expected_submissionFrom/-/sbm_expected_submission To/-/dte_finalise_deadlineFrom/-/dte_finalise_deadline To/-/haz_addional_hazard/-/lec_submitter/-/dte_assessmentFrom/-/dte_assessment To/-/prc_regulatory_programme/-/
3) Verordnung (EU) Nr. 944/2013 der Kommission vom 2. Oktober 2013 zur Änderung der Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen zwecks Anpassung an den technischen und wissenschaftlichen Fortschritt (ABl. L 261 vom 03.10.2013 S. 5).
4) Verordnung (EU) 2018/669 der Kommission vom 16. April 2018 zur Änderung der Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen zwecks Anpassung an den technischen und wissenschaftlichen Fortschritt (ABl. L 115 vom 04.05.2018 S. 1).
5) Urteil des Gerichts vom 7. Oktober 2015, Bilbaína de Alquitranes u. a./Kommission, T-689/13, EU:T:2015:767.
6) Urteil des Gerichtshofs vom 22. November 2017, Kommission/Bilbaína de Alquitranes u. a., C-691/15 P, EU:C:2017:882.
| Anhang I |
Anhang II Teil 2 der Verordnung (EG) Nr. 1272/2008 wird wie folgt geändert:
(1) Der einleitende Absatz wird wie folgt geändert:
"Die Hinweise in den Abschnitten 2.1 bis 2.10 sowie 2.12 sind Gemischen gemäß Artikel 25 Absatz 6 zuzuordnen."
(2) Folgender Abschnitt 2.12 wird angefügt:
"2.12. Gemische, die Titandioxid enthalten
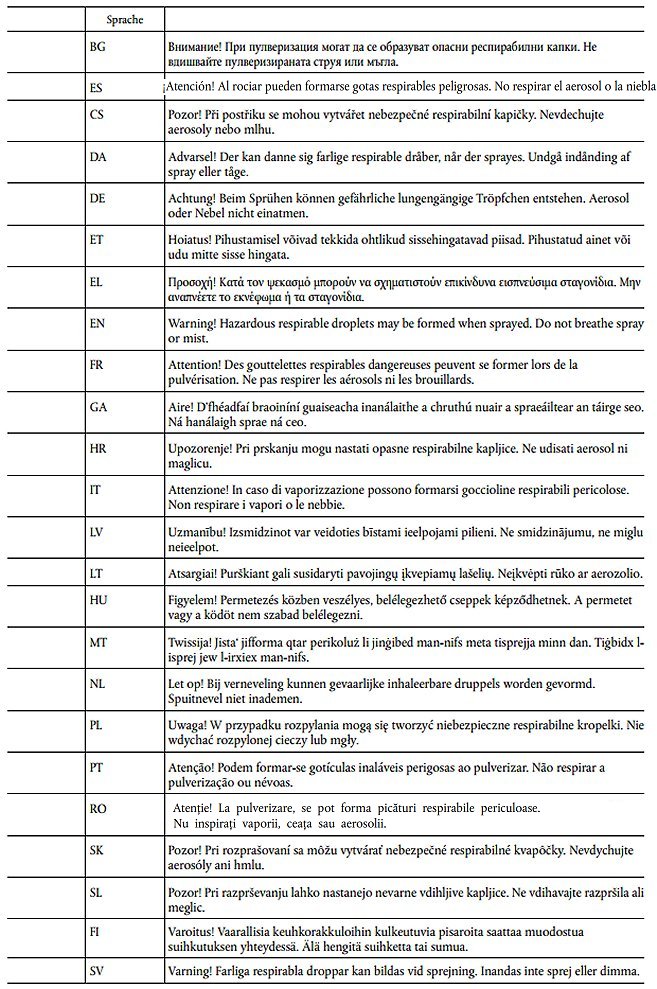
Das Kennzeichnungsetikett auf der Verpackung von flüssigen Gemischen, die mindestens 1 % Titandioxidpartikel mit einem aerodynamischen Durchmesser von höchstens 10 µm enthalten, muss folgenden Hinweis tragen:
EUH211: "Achtung! Beim Sprühen können gefährliche lungengängige Tröpfchen entstehen. Aerosol oder Nebel nicht einatmen."
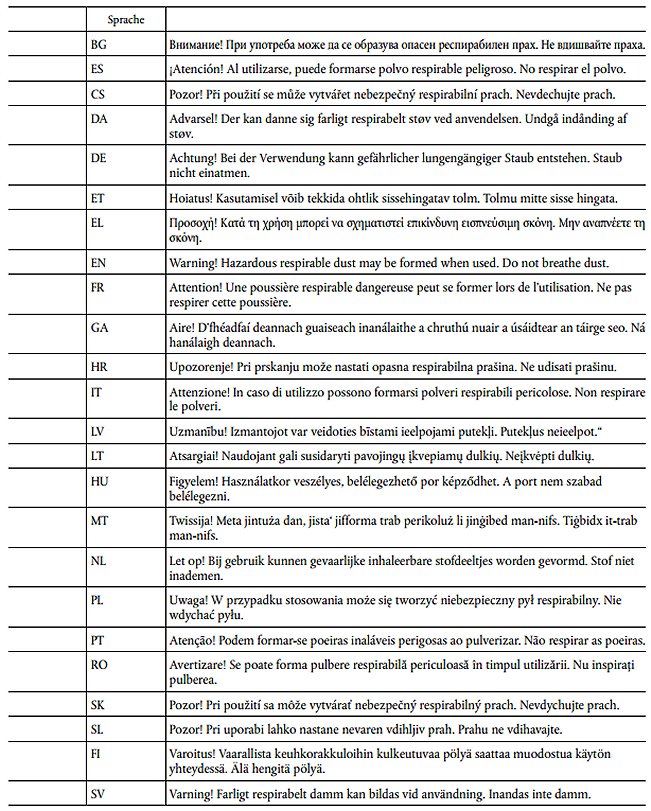
Das Kennzeichnungsetikett auf der Verpackung von festen Gemischen, die mindestens 1 % Titandioxidpartikel enthalten, muss folgenden Hinweis tragen:
EUH212: "Achtung! Bei der Verwendung kann gefährlicher lungengängiger Staub entstehen. Staub nicht einatmen."
Das Kennzeichnungsetikett auf der Verpackung von flüssigen und festen Gemischen, die nicht für die breite Öffentlichkeit bestimmt sind und nicht als gefährlich eingestuft wurden sowie mit EUH211 oder EUH212 gekennzeichnet sind, muss zusätzlich den Hinweis EUH210 tragen."
| Anhang II |
In Anhang III Teil 3 der Verordnung (EG) Nr. 1272/2008 werden die folgenden Zeilen EUH211 und EUH212 angefügt:
EUH211
EUH212
| Anhang III |
Anhang VI der Verordnung (EG) Nr. 1272/2008 wird wie folgt geändert:
(1) Teil 1 wird wie folgt geändert:
a) In Nummer 1.1.3.1 werden folgende Anmerkungen V und W angefügt:
"Anmerkung V:
Soll der Stoff in Form von Fasern in Verkehr gebracht werden (mit Durchmesser < 3 µm, Länge > 5 µm und Seitenverhältnis ≥ 3:1) oder als Stoffpartikel, die die WHO-Kriterien für Fasern erfüllen, oder als Partikel mit veränderter Oberflächenchemie, so müssen ihre gefährlichen Eigenschaften gemäß Titel II dieser Verordnung bewertet werden, um festzustellen, ob eine höhere Kategorie (Carc. 1B oder 1A) und/oder zusätzliche Expositionswege (oral oder dermal) angewandt werden sollten."
"Anmerkung W:
Es wurde festgestellt, dass die Gefahr einer karzinogenen Wirkung dieses Stoffes besteht, wenn lungengängiger Staub in Mengen eingeatmet wird, die zu einer signifikanten Beeinträchtigung der natürlichen Reinigungsmechanismen für Partikel in den Lungen führen.
Diese Anmerkung soll die spezifische Toxizität des Stoffes beschreiben und stellt kein Kriterium für die Einstufung gemäß dieser Verordnung dar."
b) In Nummer 1.1.3.2 wird folgende Anmerkung 10 angefügt:
"Anmerkung 10:
Die Einstufung als "karzinogen bei Einatmen" gilt nur für Gemische in Pulverform mit einem Gehalt von mindestens 1 % Titandioxid in Partikelform oder eingebunden in Partikel mit einem aerodynamischen Durchmesser von≤ 10 µm."
(2) In Teil 3 wird die Tabelle 3 wie folgt geändert:
a) Die Zeilen mit den Indexnummern 604-083-00-X und 611-159-00-6 werden gestrichen.
b) Die Zeilen zu den Indexnummern 015-189-00-5, 027-001-00-9, 028-018-00-4, 603-023-00-X, 605-005-00-7, 606-047-00-9, 607-232-00-7, 607-247-00-9, 608-039-00-0, 613-054-00-0, 616-018-00-2 und 648-055-00-5 erhalten folgende Fassung:
| Index-Nr. | Chemische Bezeichnung | EG-Nr. | CAS-Nr. | Einstufung | Kennzeichnung | Spezifische Konzentrationsgrenzen, M-Faktoren und ATE | Anmerkungen | |||
| Kodierung der Gefahrenklassen und -kategorien | Kodierung der Gefahrenhinweise | Piktogramm, Kodierung der Signalworte | Kodierung der Gefahrenhinweise | Kodierung der ergänzenden Gefahrenmerkmale | ||||||
| "015-189-00-5 | Phenylbis(2,4,6-trimethylbenzoyl)phosphinoxid | 423-340-5 | 162881-26-7 | Skin Sens. 1A Aquatic Chronic 4 | H317 H413 | GHS07 Wng | H317 H413" | |||
| "027-001-00-9 | Cobalt | 231-158-0 | 7440-48-4 | Carc. 1B Muta. 2 Repr. 1B Resp. Sens. 1 Skin Sens. 1 Aquatic Chronic 4 | H350 H341 H360F H334 H317 H413 | GHS08 Dgr | H350 H341 H360F H334 H317 H413" | |||
| "028-018-00-4 | Nickel-bis(sulfamidat); Nickelsulfamat | 237-396-1 | 13770-89-3 | Carc. 1A Muta. 2 Repr. 1B Acute Tox. 4 STOT RE 1 Resp. Sens. 1 Skin Sens. 1 Aquatic Acute 1 Aquatic Chronic 1 | H350i H341 H360D*** H302 H372** H334 H317 H400 H410 | GHS08 GHS07 GHS09 Dgr | H350i H341 H360D*** H302 H372** H334 H317 H410 | Oral: ATE = 853 mg/kg KG (Anhydrat) Oral: ATE = 1098 mg/kg KG (Tetrahydrat) STOT RE 1; H372: C ≥ 1 % STOT RE 2; H373: 0,1 % ≤ C < 1 % Skin Sens. 1; H317: C ≥ 0,01 % M = 1" | ||
| "603-023-00-X | Ethylenoxid; Oxiran | 200-849-9 | 75-21-8 | Flam. Gas 1 Press. Gas Carc. 1B Muta. 1B Repr. 1B Acute Tox. 3 Acute Tox. 3 STOT SE 3 STOT SE 3 STOT RE 1 Skin Corr. 1 Eye Dam. 1 | H220 H350 H340 H360Fd H331 H301 H335 H336 H372 (Nervensystem) H314 H318 | GHS02 GHS08 GHS06 GHS05 Dgr | H220 H350 H340 H360Fd H331 H301 H335 H336 H372 (Nervensystem) H314 | Einatmen:
ATE = 700 ppm (Gase) Oral: ATE = 100 mg/kg KG" | U | |
| "605-005-00-7 | Metaldehyd (ISO); 2,4,6,8-Tetramethyl-1,3,5,7-tetraoxacyclooctan | 203-600-2 | 108-62-3 | Flam. Sol. 2 Repr. 2 Acute Tox. 3 Aquatic Chronic 3 | H228 H361f H301 H412 | GHS02 GHS08 GHS06 Dgr | H228 H361f H301 H412 | Oral: ATE = 283 mg/kg KG" | ||
| "606-047-00-9 | 2-Benzyl-2-dimethylamino-4"-morpholinobutyrophenon | 404-360-3 | 119313-12-1 | Repr. 1B Aquatic Acute 1 Aquatic Chronic 1 | H360D H400 H410 | GHS08 GHS09 Dgr | H360D H410" | |||
| "607-232-00-7 | Pyridat (ISO); O-(6-Chlor-3-phenylpyridazin-4-yl)-S-octylthiocarbonat | 259-686-7 | 55512-33-9 | Acute Tox. 4 Skin Irrit. 2 Skin Sens. 1 Aquatic Acute 1 Aquatic Chronic 1 | H302 H315 H317 H400 H410 | GHS07 GHS09 Wng | H302 H315 H317 H410 | Oral: ATE = 500 mg/kg KG M = 1 M = 10" | ||
| "607-247-00-9 | Dodecylmethacrylat | 205-570-6 | 142-90-5 | STOT SE 3 | H335 | GHS07 Wng | H335 | STOT SE 3; H335: C ≥ 10 %" | ||
| "608-039-00-0 | 2-Phenylhexannitril | 423-460-8 | 3508-98-3 | Acute Tox. 4 Aquatic Chronic 2 | H302 H411 | GHS07 GHS09 Wng | H302 H411 | Oral: ATE = 500 mg/kg KG" | ||
| "613-054-00-0 | Thiabendazol (ISO); 2-(Thiazol-4-yl)benzimidazol | 205-725-8 | 148-79-8 | Aquatic Acute 1 Aquatic Chronic 1 | H400 H410 | GHS09 Wng | H410 | M = 1 M = 1" | ||
| "616-018-00-2 | Diethyltoluamid (ISO): N, N-Diethyl-m-toluamid [deet] | 205-149-7 | 134-62-3 | Acute Tox. 4 Skin Irrit. 2 Eye Irrit. 2 | H302 H315 H319 | GHS07 Wng | H302 H315 H319 | Oral: ATE = 1892 mg/kg KG" | ||
c) Die folgenden Zeilen werden eingefügt:
| Index-Nr. | Chemische Bezeichnung | EG-Nr. | CAS-Nr. | Einstufung | Kennzeichnung | Spezifische Konzentrationsgrenzen, M-Faktoren und ATE | Anmerkungen | |||
| Kodierung der Gefahrenklassen und -kategorien | Kodierung der Gefahrenhinweise | Piktogramm, Kodierung der Signalworte | Kodierung der Gefahrenhinweise | Kodierung der ergänzenden Gefahrenmerkmale | ||||||
| "022-006-00-2 | Titandioxid; [in Pulverform mit mindestens 1 % Partikel mit aerodynamischem Durchmesser ≤ 10 µm] | 236-675-5 | 13463-67-7 | Carc. 2 | H351 (Einatmen) | GHS08 Wng | H351 (Einatmen) | V, W, 10 | ||
| 080-012-00-0 | Methylquecksilberchlorid | 204-064-2 | 115-09-3 | Carc. 2 Repr. 1A Lact. Acute Tox. 2 Acute Tox. 2 Acute Tox. 2 STOT RE 1 Aquatic Acute 1 Aquatic Chronic 1 | H351 H360Df H362 H330 H310 H300 H372 (Nervensystem, Nieren) H400 H410 | GHS08 GHS06 GHS09 Dgr | H351 H360Df H362 H330 H310 H300 H372 (Nervensystem, Nieren) H410 | Einatmen:
ATE = 0,05 mg/L (Stäube oder Nebel) Dermal: ATE = 50 mg/kg KG Oral: ATE = 5 mg/kg KG | 1 | |
| 601-090-00-X | Benzo[rst]pentaphen | 205-877-5 | 189-55-9 | Carc. 1B Muta. 2 | H350 H341 | GHS08 Dgr | H350 H341 | |||
| 601-091-00-5 | Dibenzo[b,def]chrysen; Dibenzo[a,h]pyren | 205-878-0 | 189-64-0 | Carc. 1B Muta. 2 | H350 H341 | GHS08 Dgr | H350 H341 | |||
| 603-236-00-8 | Ethanol, 2,2"-Iminobis-, N-(verzweigte und lineare C13-15-Akyl)-Derivate | 308-208-6 | 97925-95-6 | Repr. 1B | H360D | GHS08 Dgr | H360D | |||
| 607-733-00-0 | Cyflumetofen (ISO); 2-Methoxyethyl-(RS)-2-(4-tert-butylphenyl)-2-cyano-3-oxo-3-(α,α,α-trifluor-o-tolyl)propionat | - | 400882-07-7 | Carc. 2 Skin Sens. 1A | H351 H317 | GHS08 GHS07 Wng | H351 H317 | |||
| 607-734-00-6 | Pentakalium 2,2",2",2"",2""-(ethan-1,2-diylnitrilo)pentaacetat | 404-290-3 | 7216-95-7 | Acute Tox. 4 STOT RE 2 Eye Irrit. 2 | H332 H373 (Einatmen) H319 | GHS08 GHS07 Dgr | H332 H373 (Einatmen) H319 | Einatmen: ATE = 1,5 mg/L (Stäube oder Nebel) | ||
| 607-735-00-1 | N-Carboxymethyliminobis(ethylennitrilo)-tetraessigsäure | 200-652-8 | 67-43-6 | Acute Tox. 4 STOT RE 2 Eye Irrit. 2 | H332 H373 (Einatmen) H319 | GHS08 GHS07 Dgr | H332 H373 (Einatmen) H319 | Einatmen: ATE = 1,5 mg/L (Stäube oder Nebel) | ||
| 607-736-00-7 | Pentanatrium-(carboxylatomethyl)iminobis(ethylennitrilo)tetraacetat | 205-391-3 | 140-01-2 | Acute Tox. 4 STOT RE 2 | H332 H373 (Einatmen) | GHS08 GHS07 Dgr | H332 H373 (Einatmen) | Einatmen: ATE = 1,5 mg/L (Stäube oder Nebel) | ||
| 607-737-00-2 | Diisohexylphthalat | 276-090-2 | 71850-09-4 | Repr. 1B | H360FD | GHS08 Dgr | H360FD | |||
| 608-069-00-4 | Fludioxonil (ISO); 4-(2,2-Difluor-1,3-benzodioxol-4-yl)-1H-pyrrol-3-carbonitril | - | 131341-86-1 | Aquatic Acute 1 Aquatic Chronic 1 | H400 H410 | GHS09 Wng | H410 | M = 1 M = 10 | ||
| 613-329-00-5 | Halosulfuron-methyl (ISO); Methyl-3-chlor-5-{[(4,6-dimethoxypyrimidin-2-yl)carbamoyl]sulfamoyl}-1-methyl-1-H-pyrazol-4-carboxylat | - | 100784-20-1 | Repr. 1B Aquatic Acute 1 Aquatic Chronic 1 | H360D H400 H410 | GHS08 GHS09 Dgr | H360D H410 | M = 1000 M = 1000 | ||
| 613-330-00-0 | 2-Methylimidazol | 211-765-7 | 693-98-1 | Repr. 1B | H360Df | GHS08 Dgr | H360Df | |||
| 616-225-00-8 | (RS)-2-Methoxy-N-methyl-2-[α-(2,5-xylyloxy)-o-tolyl]acetamid; Mandestrobin | - | 173662-97-0 | Aquatic Acute 1 Aquatic Chronic 1 | H400 H410 | GHS09 Wng | H410 | M = 1 M = 10 | ||
| 616-226-00-3 | Carboxin (ISO); 2-Methyl-N-phenyl-5,6-dihydro-1,4-oxathiin-3-carboxamid; 5,6-Dihydro-2-methyl-1,4-oxathiin-3-carboxanilid | 226-031-1 | 5234-68-4 | STOT RE 2 Skin Sens. 1 Aquatic Acute 1 Aquatic Chronic 1 | H373 (Nieren) H317 H400 H410 | GHS08 GHS07 GHS09 Wng | H373 (Nieren) H317 H410 | M = 1 M = 1 | ||
| 616-227-00-9 | Metaflumizon (ISO); (EZ)-2"-[2-(4-Cyanophenyl)-1-(α,α,α-trifluor-m-tolyl)ethyliden][4-(trifluormethoxy)phenyl]carbanilohydrazid [E-Isomer ≥ 90 %, Z-Isomer ≤ 10 % relativer Anteil]; [1] (E)-2"-[2-(4-Cyanophenyl)-1-(α,α,α-trifluor-m-tolyl)ethyliden][4-(trifluormethoxy)phenyl]carbanilohydrazid [2] | - | 139968-49-3 [1] 852403-68-0 [2] | Repr. 2 Lact. STOT RE 2 | H361fd H362 H373 | GHS08 Wng | H361fd H362 H373 | |||
| 650-056-00-0 | Dibutylbis(pentan-2,4-dionato-O,O")tin | 245-152-0 | 22673-19-4 | Repr. 1B STOT RE 1 | H360FD H372 (Immunsystem) | GHS08 Dgr | H360FD H372 (Immunsystem)" | |||
| Anhang IV |
In Anhang VI Tabelle 3 der Verordnung (EG) Nr. 1272/2008 der Kommission erhält die Zeile mit der Indexnummer "648-055-00-5" folgende Fassung:
| Index-Nr. | Chemische Bezeichnung | EG-Nr. | CAS-Nr. | Einstufung | Kennzeichnung | Spezifische Konzentrationsgrenzen, M-Faktoren und ATE | Anmerkungen | |||
| Kodierung der Gefahrenklassen und -kategorien | Kodierung der Gefahrenhinweise | Piktogramm, Kodierung der Signalworte | Kodierung der Gefahrenhinweise | Kodierung der ergänzenden Gefahrenmerkmale | ||||||
| "648-055-00-5 | Pech, Kohlenteer, Hochtemperatur; [Rückstand aus der Destillation von Hochtemperatur-Kohlenteer. Schwarzer Feststoff mit einem Erweichungspunkt von etwa 30 °C bis 180 °C (86 °F bis 356 °F). Besteht in erster Linie aus einem komplexen Gemisch von aromatischen Kohlenwasserstoffen mit drei- oder mehrgliedrigen Ringsystemen.] | 266-028-2 | 65996-93-2 | Carc. 1A Muta. 1B Repr. 1B | H350 H340 H360FD | GHS08 Dgr | H350 H340 H360FD" | |||
 | ENDE |