 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2023, Lebensmittel - EU Bund

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2023, Lebensmittel - EU Bund |  |
Beschluss Nr. 2536/2023 des mit Artikel 14 des zwischen den Vereinigten Staaten und der Europäischen Union vereinbarten geänderten Sektoralen Anhangs über Gute Herstellungspraxis (GMP) für Arzneimittel (im Folgenden "Anhang") eingesetzten Gemischten Sektorausschusses zur Einbeziehung von Tierarzneimitteln in den Geltungsbereich des Anhangs vom 11. Mai 2023 [2023/1044]
(ABl. L 140 vom 30.05.2023 S. 53)
Der gemischte Sektorausschuss -
in der Erwägung, dass der Gemischte Sektorausschuss gemäß Artikel 20 des Anhangs prüfen muss, ob Tierarzneimittel in den Geltungsbereich des Anhangs einbezogen werden sollen,
in der Erwägung, dass der Gemischte Sektorausschuss die Einbeziehung veterinärmedizinischer Produkte im Sinne der Anlage 3 Absatz 6 in den Geltungsbereich des Anhangs gebührend geprüft hat,
unter Berücksichtigung, dass in Artikel 4 Absatz 2 des Anhangs immunologische Tierarzneimittel ausdrücklich vom Geltungsbereich des Anhangs ausgeschlossen sind,
in Anerkenntnis, dass jedweder Beschluss über die Einbeziehung von Tierarzneimitteln in den Geltungsbereich des Anhangs erst nach erfolgreicher gegenseitiger Bewertung durch die Behörden der Vertragsparteien gemäß Artikel 5 und Anlage 4 des Anhangs umgesetzt werden kann,
in Anerkenntnis, dass die Vertragsparteien zu diesem Zweck vereinbart haben, dass jede Vertragspartei die Bewertung der Regelungsbehörden der anderen Vertragspartei gemäß Anlage A zu diesem Beschluss abschließen wird,
in Anerkenntnis, dass die Food and Drug Administration (im Folgenden "FDA") die Bewertung von 14 für Tierarzneimittel zuständigen Behörden der Mitgliedstaaten der Europäischen Union (EU) (von denen fünf ausschließlich für Tierarzneimittel zuständig sind, und in der Erwägung, dass mindestens eine Kompetenzbewertung dieser fünf Behörden der EU-Mitgliedstaaten positiv ausfällt) gemäß Anlage 4 Absatz II.A abgeschlossen hat,
in Anerkenntnis, dass die EU die Bewertung der FDA gemäß Anlage 4 Absatz II.B abgeschlossen hat,
in Anerkenntnis, dass die FDA die noch offenen Bemerkungen, die sich aus dem Audit gemäß Anlage 4 Absatz II.B Ziffer i ergeben, berücksichtigt hat,
in Anerkenntnis, dass die FDA die Voraussetzung nach Anlage 4 Absatz II.B Ziffer ii im Rahmen der Bewertung der FDA in Bezug auf Humanarzneimittel durch die EU bereits erfüllt hat,
in Bestätigung, dass Artikel 9 des Anhangs bis zu dem Zeitpunkt, zu dem alle in Anlage 2 aufgeführten Behörden der Mitgliedstaaten der EU, die für Tierarzneimittel zuständig sind, von der FDA anerkannt wurden, sinngemäß nicht für Tierarzneimittel gilt,
in der Erwägung, dass die Liste der Behörden in Anlage 2 des Anhangs aktualisiert werden muss
beschließt:
1. Veterinärmedizinische Produkte im Sinne der Anlage 3 Absatz 6 fallen in den Geltungsbereich des Anhangs.
Die FDA schließt die Kompetenzbewertung der Behörden aller Mitgliedstaaten der EU gemäß Anlage A zu diesem Beschluss ab.
Die FDA hat die noch offenen Bemerkungen, die sich aus dem Audit gemäß Anlage 4 Absatz II.B Ziffer i ergeben, berücksichtigt.
Artikel 9 des Anhangs gilt zu dem Zeitpunkt, zu dem alle in Anlage 2 aufgeführten Behörden der Mitgliedstaaten der EU, die für Tierarzneimittel zuständig sind, von der FDA anerkannt wurden, für Tierarzneimittel.
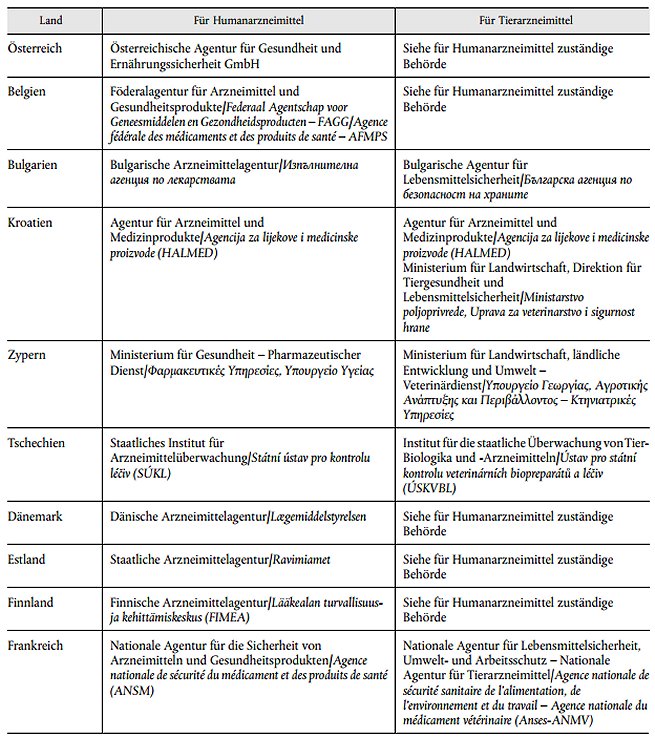
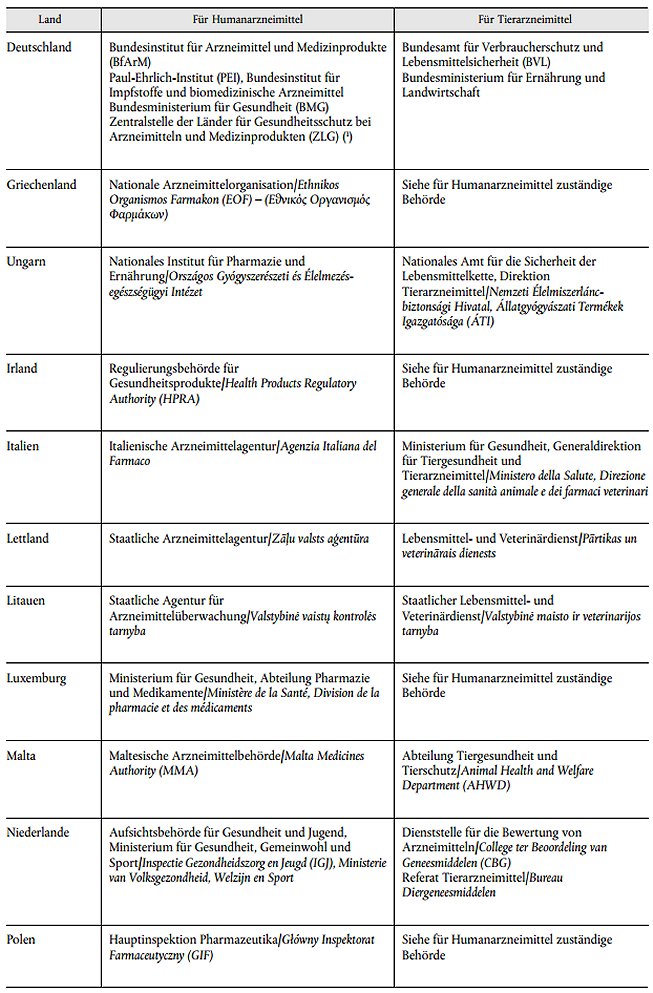
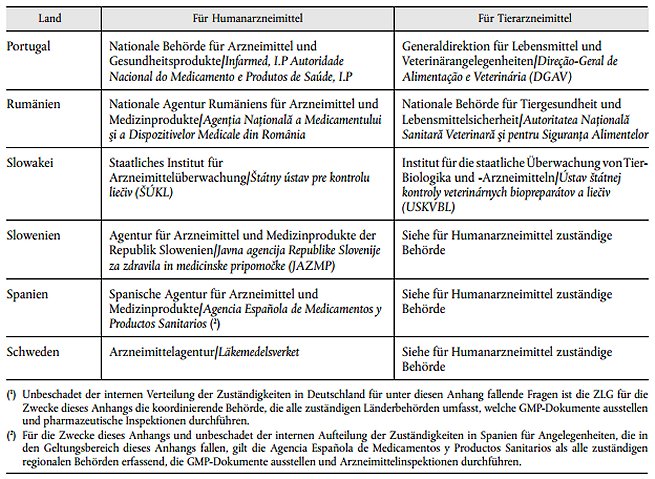
2. Anlage 2 des Anhangs erhält die Fassung der Anlage 2 der Anlage B dieses Beschlusses.
Anlage A: Zeitplan für die Bewertung der für Tierarzneimittel zuständigen Behörden der Mitgliedstaaten
Anlage B: Anlage 2 Liste der Behörden
Dieser Beschluss ist in zwei Urschriften ausgefertigt und wird von den in Artikel 14 Absatz 2 des Anhangs genannten Ko-Vorsitzenden des Gemischten Sektorausschusses unterzeichnet. Er tritt an dem Tag in Kraft, an dem er von der letzten Vertragspartei unterzeichnet wird.
Für die Vereinigten Staaten von Amerika
Mark ABDOO
Unterzeichnet in Silver Spring, MD, am 5. Mai 2023
Für die Europäische Union
Sylvain GIRAUD
Unterzeichnet in Brüssel am 11. Mai 2023
| Zeitplan für die Bewertung der für Tierarzneimittel zuständigen Behörden der Mitgliedstaaten | Anlage A |
1. Die für Tierarzneimittel zuständigen Behörden der Mitgliedstaaten, die in Anlage 2 des Anhangs aufgeführt sind, legen nach folgendem Zeitplan vollständige Kompetenzbewertungsdossiers vor, die die in Anlage 4 des Anhangs genannten Informationen enthalten:
2. Die FDA schließt, sofern ihr im Einklang mit dem in Absatz 1 genannten Zeitplan vollständige Kompetenzbewertungsdossiers für die betreffenden Behörden, die die in Anlage 4 des Anhangs genannten Informationen enthalten, vorgelegt werden, die Kompetenzbewertungen von für Tierarzneimittel zuständigen Behörden der Mitgliedstaaten, die in Anlage 2 des Anhangs aufgeführt sind, gemäß Anlage 4 des Anhangs und im Einklang mit folgendem Zeitplan ab:
3. Für jede Behörde der Mitgliedstaaten gilt:
4. Die Frist für die Vorlage von Kompetenzbewertungsdossiers wird automatisch um drei Monate verlängert, wenn diese aufgrund der Auswirkungen von Maßnahmen im Zusammenhang mit der COVID-19-Pandemie oder ähnlichen störenden Ereignissen wie Reisebeschränkungen, Quarantänemaßnahmen, Krankheitsurlaub und daraus resultierender Ressourcenknappheit nicht rechtzeitig abgeschlossen werden können. Die EU unterrichtet die FDA rechtzeitig über entsprechende Verzögerungen und schlägt einen aktualisierten Zeitplan vor, der im Gemischten Sektorausschuss zu vereinbaren ist.
5. Die Mitteilung über die Anerkennung der bewerteten Behörden der Mitgliedstaaten erfolgt unverzüglich (auf fortlaufender Basis) nach Abschluss der Kompetenzbewertung und im Einklang mit Artikel 7 des Anhangs.
| Anlage 2 Liste der Behörden | Anlage B |
Vereinigte Staaten:
Food and Drug Administration
Europäische Union:
 | ENDE |  |