 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. ▢ Regelwerk |  |
DENV - Dengue Fieber Virus
- Stellungnahmen des Arbeitskreises Blut des Bundesministeriums für Gesundheit -
(Bundesgesundhbl. Nr. 7 vom 7/2011 S. 892)
Der Arbeitskreis Blut des Bundesministeriums für Gesundheit gibt als nationales Beratungsgremium Stellungnahmen zu neuartigen Erregern ab, bewertet neue Erkenntnisse zu bekannten Erregern und erarbeitet entsprechende Empfehlungen für die Fachöffentlichkeit. Diese Serie von Stellungnahmen zu einzelnen Erregern wird als Zusammenfassung des aktuellen Wissensstandes veröffentlicht, speziell unter transfusionsmedizinisch relevanten Aspekten (Bundesgesundhbl., 41, 53, 1998).
Frühere Beiträge befassten sich mit der Creutzfeldt-Jakob-Erkrankung, dem Parvovirus B19 und dem GB-Virus Typ C (Hepatitis-G-Virus), (Bundesgesundheitsbl., 41, 78-90, 1998),
HTLV-I/-II, (Bundesgesundheitsbl., 41, 512, 1998),
Yersinia enterocolitica, (Bundesgesundheitsbl., 42, 613, 1999),
TT-Virus (Bundesgesundheitsbl., 43,154-156, 2000),
Hepatitis B Virus (HBV), (Bundesgesundheitsbl., 43, 240-248, 2000) und
Humanes Cytomegalovirus (HCMV), (Bundesgesundheitsbl., 43, 653-659, 2000),
Hepatitis A Virus (Bundesgesundheitsbl., 44, 844850, 2001),
Treponema pallidum (Bundesgesundheitsbl. 45, 818-826, 2002),
Hepatitis-C-Virus (Bundesgesundheitsbl. 46, 712-722, 2003),
Humanes Immunschwächevirus (HIV) (Bundesgesundheitsbl. 47, 83-95, 2004),
Arboviren - durch Arthropoden übertragbare Viren (Bundesgesundheitsbl. 47, 910-918, 2004),
Coxiella burnetui - Erreger des Q-(query) Fiebers (Bundesgesundheitsbl. 48, 814-821, 2005),
Variante Creutzfeldt-Jakob-Krankheit (Bundesgesundheitsbl. 48, 1082-1090, 2005),
Influenzaviren (Bundesgesundheitsbl. 50, 1184-1191, 2007),
Arbobakterien (über Arthropoden übertragbare Bakterien) (Bundesgesundheitsbl. 50,1192-1207, 2007),
Hepatitis-E-Virus (Bundesgesundheitsbl. 51, 90-97, 2008),
Malaria (Bundesgesundheitsbl. 51, 236-249, 2008),
Arboprotozoen (Bundesgesundheitsbl. 52, 123-146, 2009),
Orthopockenviren:
Infektionen des Menschen (Bundesgesundheitsbl. 53, 957-972, 2010),
Humanes Cytomegalievirus (HCMV) (Bundesgesundheitsbl. 53, 973-983, 2010) und
Parvovirus B19 (Bundesgesundheitsbl. 53, 944-956, 2010).
Dengue Fieber Virus (DENV)
Dengue ist ein portugiesisches Wort, das soviel bedeutet wie eitel, geziert, und das auf den gestörten, schmerzhaft eingeschränkten Gang der Infizierten hinweist (englisch: dandy).
Dengue Virus und Dengue hämorrhagisches Fieber Virus sind Synonyme. Das Dengue Fieber Virus (DENV) ist ein Mitglied des Genus der 53 Flaviviren und eines der 27 Spezies der Flaviviren, die über Mücken übertragen werden. Die Bedeutung der Arboviren für die Transfusionsmedizin ist 2004 zusammengefasst worden [1]. Dieser Beitrag nimmt zu der Frage Stellung, ob DENV eines der drohenden Viren ist, die in naher Zukunft transfusionsmedizinisch bedeutend werden können.
1. Wissensstand über den Erreger
Der wohl älteste Bericht, der klinisch der DENV-Infektion entspricht, stammt aus China aus dem Jahr 992 [2]. Historische Berichte über das sogenannte Knochenbrecher- Fieber (breakbone fever) datieren mehr als 200 Jahre zurück, 1779 in Batavia, Indonesien und Kairo, Ägypten. Die erste im englischsprachigen Raum berichtete Epidemie fand 1780 in Philadelphia, USA, statt, weitere 1934 in Florida und 1945 in New Orleans [3]. Große Epidemien mit hämorrhagischem Schock (Dengue fever virus haemorrhagic shock Syndrome - DHSS) liefen in Australien 1897, in Griechenland 1928 und in Formosa 1921 ab. Die langen Intervalle von zehn bis 40Jahren zwischen Epidemien in der gleichen Region wurden durch den zunehmenden Handel nach dem 2. Weltkrieg verkürzt, ferner führte die rasche Urbanisierung in Südostasien zu Hyperendemien [2]. Die Verbreitung von Aedes aegypti und weiteren Aedes-Spezies über moderne Verkehrsmittel und insbesondere Schiffstransporte führte zu einer schnellen Verbreitung von Aedes-Mücken und simultan DENV in alle tropischen Zonen der Welt, sodass die Zahl der Infizierten mit jährlich 50 bis 100 Millionen, die der Hospitalisierten mit etwa 500.000, und die der Infizierten mit Komplikationen mit 25.000 angenommen wird [4].
Urbaner und sylvatischer Zyklus Denguefieber ist eine typische Zoonose, der wesentliche tierischer Wirt sind Affen; jedoch sind nach Übertragung auf den Menschen und Vorhandensein der entsprechenden Mückenpopulation tierische Wirte nicht mehr notwendig. Alle Alt- und Neuwelt-Affen sind mit DENV infizierbar und entwickeln klinische Zeichen der Infektion und eine Virämie.
Die Bedeutung weiterer Tiere als Reservoir für die Verbreitung von DENV ist eher fraglich. Neugeborene Mäuse können mit DENV infiziert werden, während DENV adulte Meerschweinchen, Kaninchen, Hamster, Hühner, Bambusratten und Eidechsen nicht infizieren kann. Nur mit hohen Virusdosen sind Mäuse im Labor zu infizieren, mit zunehmender Passage bildet sich in diesen ein Neurotropismus aus [5]. In Mexiko wurden DENV-Antikörper in einer Frucht fressenden und drei Insekten fressenden Fledermäusen nachgewiesen, während DENV-2 (Dengue Fieber Virus Serotyp 2 - siehe DENV-Serotypen unter 1.1) in zwei Frucht fressenden und einer Insekten fressenden Fledermaus nachgewiesen wurde, die AK negativ waren [6].
Neben Aedes aegypti und Ae. albopictus vermehrt sich DENV in Ae. africanus, Ae. leuteocephalus, Ae. opok, Ae. taylori, Ae. furcifer und weiteren Spezies [7], sodass auch andere Aedes-Spezies als Vektor dienen könnten.
Sylvatischer Zyklus. Der sylvatische Zyklus läuft in Affen ab, unter Umständen auch in anderen kleinen Säugerspezies. Am Zyklus sind verschiedene Aedes-Spezies beteiligt, die sich an den Lebensraum der Primaten gewöhnt haben. Bevorzugtes Reservoir sind in tropischen Regionen die Regenwälder, in Westafrika auch die Galeriewälder, sodass auch in Savanne-Regionen Epidemien ablaufen [7]. Über den Vektor Mücke sind sylvatischer und urbaner Zyklus miteinander verbunden [8].
Urbaner Zyklus. Der urbane Zyklus wird unterhalten durch Ae. aegypti- und Ae. albopictus-Stämme, die sich an das menschliche Umfeld gewöhnt haben und in kleinen Wasserreservoiren (Abwasser, Trinkwasservorrat, Plastikabfall) ihre Eier ablegen, in denen die Larven bei einer Temperatur >25 °C nach mehreren Tagen schlüpfen und sich zu Mücken entwickeln. Die vertikale Transmission von DENV von der Mücke auf die Nachkommenschaft ist beschrieben. Beim Blutsaugen am DENV-infizierten Menschen werden Mücken infiziert. DENV-tragende Mücken infizieren Menschen, besonders Kinder, die noch keine oder eine nicht ausreichende Immunität haben. Somit ist ein Kreislauf vorhanden, der bisher in endemischen Regionen über ein Trockenlegen der Brutstellen der Mücken nicht unterbrochen werden konnte.
Übertragungsweg
Wesentliche natürliche Vektoren sind Aedes-Mücken. Eine Übertragung durch andere Mücken-Spezies sollte möglich sein. Zecken sind für die Übertragung epidemiologisch unbedeutend. Die Vermehrung des Virus in der Mücke hängt wesentlich von der Außentemperatur ab. Bei erhöhter Temperatur steigt die Viruskonzentration in der Mücke und folglich auch die Transmissionsrate. Jedoch sterben Mücken bei sehr hoher Temperatur und geringer Luftfeuchtigkeit, sodass eine Grenze in der Übertragbarkeit gesetzt ist.
Weitere Faktoren, die die Verbreitung über den Vektor bestimmen, sind relative Luftfeuchtigkeit, Regen und Trockenheit, Wind und Sturm und die Möglichkeit der Eiablage und Larvenentwicklung [8].
1.1 Erregereigenschaften
Virus
DENV ist eines der medizinisch bedeutenden Flaviviren, zu denen weitere Arboviren wie West-Nil-Virus, Japanische-Enzephalitis-Virus, Gelbfieber-Virus und Frühsommer-Meningoenzephalitis-Virus zählen. Das umhüllte DENV hat einen Durchmesser von etwa 50 nm (Abb. 1), mit einem elektronendichten Kapsid von etwa 30 nm, der die einzelsträngige, positiv orientierte RNA enthält. In der Lipidhülle stecken das E-Protein (envelope; mw 50.000), welches die wesentlichen antigenen Determinanten trägt und das M-Protein (membrane; mw 8.000), welches aus dem pre-M-Protein (prM; mw 18.000) durch proteolytische Spaltung entsteht [9]. Das prM wird für das Haften und die Reifung des Virus an der Membran des endoplasmatischen Retikulums benötigt. Das E-Protein bildet in der Membran Dimere und ist über Rotation beweglich, sodass unterschiedliche Epitopregionen in Säuger- oder Mückenzellen auf der Oberfläche präsentiert werden. Die Beweglichkeit, zum Teil unter Ausbildung von Trimeren, erleichtert die Fusion von Virushülle und Zellmembran und findet sich auch bei unreifen Viren, wie für DENV Serotyp 2 (DENV-2) beschrieben [10]. Auch nicht infektiöse leere Viruspartikel werden von Zellen freigesetzt [11].
Abb. 1 Transmissions-Elektronenmikroskopische
Aufnahme von DENV, mit einem Durchmesser von circa 30 nm. Man erkennt die dicke, runde, intensiv gefärbte Hülle. Mit freundlicher Genehmigung von Dr. Regine Allwin, Institut für Medizinische Virologie der Universität Frankfurt.
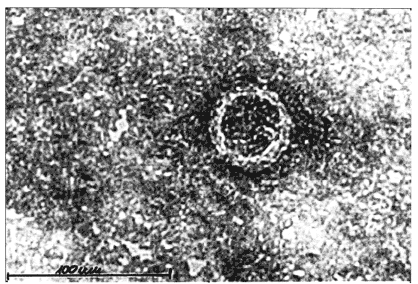
DENV kann in vielen primären und permanenten Zellkulturen von zum Beispiel Menschen, Affen, Hamstern oder Mücken vermehrt werden [8].
DENV-Serotypen 1 bis 4
Es werden die vier Serotypen DENV-1 bis -4 unterschieden, die weiter in Genotypen unterteilt werden. Unter den Serotypen sind DENV-1 und -3 miteinander näher verwandt als mit DENV-2 und schließlich mit DENV-4.
DENV-1.
Der Genotyp 1 des DENV scheint für den Menschen weniger virulent zu sein.
DENV-2.
Von DENV-2 zirkulieren vier pathogene Genotypen: der sylvatische-westafrikanische, amerikanische, südostasiatische und malaysisch- indische. DENV-2 ist für den Menschen sehr pathogen.
DENV-3.
DENV-3 wird in vier Genotypen unterteilt. Der amerikanische Genotyp hat das geringste epidemiologische Verbreitungspotential, da das Virus sich nur in geringem Maße in Mücken vermehrt [12]. Die südostasiatischen und indischen Genotypen von DENV-3 sind für die großen Epidemien verantwortlich, die auf beiden Subkontinenten und auf Sri Lanka 1989/90 abgelaufen sind.
DENV-4.
Von DENV-4 werden drei Genotypen unterschieden, von diesen hat der malaysische Genotyp die geringste pathogenetische Bedeutung, während sich die beiden anderen Genotypen auch in den beiden Amerikas verbreitet haben.
Sechs Aminosäurenaustausche in der prM, E, NS4B oder NS5 Region können ausreichend sein, um eine Virulenzänder ung hervorzurufen [13]. Im E-Protein sind intramolekulare Bindungen zwischen den Aminosäuren 204Arg, 261His und 257Glu in Mutanten für die geänderte Virulenz verantwortlich.
Das Alter des gemeinsamen Vorläufers, aus dem sich die heute bekannten vier DENV-Serotypen aus Primaten entwickelten, wird mit etwa 50o Jahren (Be reich wo bis 1.500 Jahre) angegeben [4, 7]. Die Altersbestimmung erfolgte durch Kalkulation der Mutationen in der Nukleinsäure-Sequenz von verschiedenen DENV-Stämmen, die zu bekannten Zeiten an bestimmten Orten isoliert wurden. Die durchgeführte Berechnung wirft die Frage auf, ob die gefundenen Mutationen alle im Menschen entstanden sind, oder in Tieren, oder durch Rekombination. Wenn die Berechnung richtig ist, hat DENV ein großes Adaptationspotential für künftige Epidemien und für weitere Wirte. Verschiedene DENV können intragenotypische Varianten bilden [8], was die Variabilität von DENV-Stämmen erweitert.
Virusrezeptor und Replikation
Die Anlagerung von DENV an der Wirtszelle, meist an Makrophagen oder dendritische Zellen, teils an Endothelzellen, erfolgt über das C-Typ Lectin, DC-SIGN (ICAM-3) und über die Kohlenhydratkette des E-Proteins [14]. Weitere Membranproteine wie aß-Integrin, GRP78 und CD14 erleichtern die Phagozytose der DENV-Partikel, ferner ist an der Anlagerung Heparansulfat beteiligt [15]. Die Integrin-Bindungsstelle in der E-Protein Domäne III betrifft das RGD (Arginin, Glycin, Asparaginsäure) Motif von enzephalitischen Flaviviren [16], welches bei anderen Viren auch vorhanden ist, wie zum Beispiel bei Rhinoviren. DENV-1 und DENV-2 wird an den Laminin-Rezeptor GRP78 gebunden [17], der auch auf Leberzellen exprimiert wird.
DENV wird ebenfalls über die am Partikel gebundenen Immunglobuline (Immunphagozytose) über Fc-Rezeptor tragende Zellen aufgenommen [18]. Vom phagozytierten Virus wird im Phagosom bei niedrigem pH das Kapsid freigesetzt. Während der Umformung der Virushülle dissoziieren die E-Protein-Dimere zu Monomeren und bilden anschließend Trimere. Hoher Cholesteringehalt der Membran beschleunigt die Fusion [19]. Die beiden Heat-Shock-Proteine 70 und 90 beschleunigen die Aufnahme von DENV in cholesterinreichen Membranen [20].
DENV repliziert im Zytoplasma ohne Beteiligung des Zellkerns, die Reifung erfolgt am endoplasmatischen Retikulum. Das unreife Virus knospt in das endoplasmatische Retikulum, ummantelt sich dort mit Lipidmembran der Zelle und wird in den Schläuchen des endoplasmatischen Retikulums zur Zellmembran transportiert und reif freigesetzt [21].
Genom
Das Genom von DENV ist typisch für Flaviviren mit einer 5' nichtcodierenden Region (NCR) und 3' UTR (untranslated region) an den Flanken, und dazwischen der Region von Core, prM und E und den Nichtstrukturproteinen. Die Gene für die Nichtstrukturproteine codieren die Proteine NS1, NS2A und B, NS3 bestehend aus Protease und Helicase, NS4B und NS5 mit Methyltransferase und der RNA-abhängigen RNA-Polymerase (Abb. 2). Die zehn Proteine werden aus einem gemeinsamen großen Vorläuferprotein herausgespalten [9]. Die Methyltransferase, die die 5'-cap Struktur beeinflusst, kann durch Ribavirin inhibiert werden [22, 23].
1.2 Infektion und Infektionskrankheit
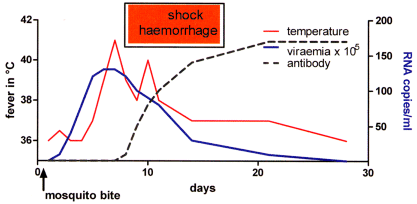
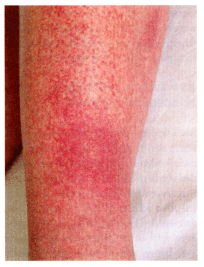
Die Übertragung erfolgt normalerweise über einen Mückenstich der Spezies Aedes. Nach einer Inkubationszeit von typischerweise zwei bis sieben Tagen treten die für DENV typischen Symptome auf, wie zum Beispiel plötzliches hohes Fieber, Kopf- und Gliederschmerzen, retrobulbäre Schmerzen und schwere Muskelschmerzen. Letztere waren der Anlass, die Krankheit als Knochenbrecher-Fieber zu bezeichnen. Nach einigen Tagen erscheint beginnend am Stamm ein makulopapulöses Exanthem (Abb. 5), welches sich auf die Extremitäten und das Gesicht ausbreitet. Petechien können auch auftreten, besonders am Ort des Mückenstichs. Die Ausbildung einer Lymphadenopathie ist selten. In den ersten zwei Wochen zeigen die Infizierten schwere Krankheitszeichen, die sich eine Woche nach Auftreten des Exanthems bessern. Die Fieberkurve ist typisch biphasisch (sattelförmig), wobei mit Erscheinen des Exanthems der zweite Gipfel beginnt. Fieber bis 41 °C ist nicht selten (Abb. 3).
Die Diagnose wird gesichert über den Nachweis von IgM- und IgG-Antikörper und die Virämie über NAT (siehe unter 1.4).
Abb.2 Schematische Darstellung des Genoms (oben) von Dengue Fieber Virus (DENV):
Die drei Strukturproteine werden vom linken (5') Genabschnitt kodiert, die vier Enzyme sind in der rechten (3') nichtstrukturelle Proteine kodierenden Region lokalisiert.
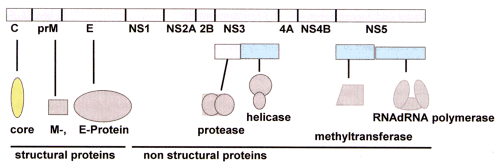
Abb.3 Schematische Darstellung des Verlaufs von Fieber, Virämie und Antikörpern nach primärer Infektion mit DENV
Die Fiebertemperatur ist auf der linken, die Virämie ausgedrückt in Kopien/ml Blut auf der rechten Y-Achse aufgetragen.
Abhängig von der Virulenz von DENV und entsprechend der klinischen Symptome werden unterschieden: das Dengue Fieber (DF), das Dengue hämorrhagische Fieber (DHF) und das Dengue-Schock Syndrom (DSS). Das DHF wurde etwa 1950 auf den Philippinen beschrieben. Es trat vor allem bei Kindern auf, die früher wahrscheinlich mit einem anderen DENV-Serotyp infiziert worden waren. Das DHF kann in das DSS übergehen, was selten bei einer Erstinfektion vorkommt. Beim DHF kann nur eine geringe Blutungsneigung mit Ausbildung von Petechien vorliegen, aber auch ein schweres Krankheitsbild mit Übergang in das DSS oder DHF/DSS, kombiniert mit Blutdruckabfall, Zyanose, Hepatomegalie, teils gastrointestinaler Blutung. Das DSS dauert ein bis zwei Tage und verläuft dann entweder letal oder führt zu kompletter Genesung.
Pathogenese
An der pathogenen Wirkung des DENV sind wesentlich Monozyten und Makrophagen beteiligt. Nach Phagozytose durch Makrophagen wird zumindest ein Teil des DENV in diesen Zellen zerstört. Liegen Antikörper vor, die das DENV nicht ausreichend neutralisieren, wird ein Teil der Viren über Immunphagozytose von Makrophagen aufgenommen und vermehrt sich in diesen Zellen. Weitere Zellen, die den Fc gamma Rezeptor tragen, werden ebenfalls infiziert. Bei Freisetzen des Virus bilden sich Immunkomplexe, die das Komplementsystem aktivieren und bei Anlagerung der Komplexe an Endothelzellen zu Kapillarschädigung mit Hämorrhagie führen. Abhängig vom Grad der intravasalen Aktivierung der Gerinnungskaskade und Schädigung der Endothelzellschicht bildet sich das Schock-Syndrom (DSS) aus. Die Zellschädigung wird weiter gefördert durch Aktivierung verschiedener Zytokin-Kaskaden (sogenannter Zytokin-Sturm) und von NF-kappaB und dem dadurch induzierten Zelltod.
In einer Studie von mit DENV-3 hospitalisierten Patienten in Brasilien zeigten 25 % der >14-Jährigen Zeichen der Kapillarschädigung, teils mit Schock und einer Thrombozytopenie unter 50.000/mm3 und dreifach erhöhten AST-Werten [24]. Eine der Komplikationen des DHF ist die Dengue-Makulopathie, die bei etwa 10 % der Erkrankten auftritt. Ursache ist eine retinale Vaskulopathie mit geringem bis zum totalen Visusverlust [25]. DENV kann bei Patienten mit Enzephalitis im Liquor cerebrospinalis nachgewiesen werden, was zeigt, dass DENV wie die anderen Flaviviren auch neuropathogen sein kann [26, 27].
Eine Ausbildung des DHF und DSS hängt von folgenden Faktoren ab [28]:
- Antikörper: bindende, aber nicht ausreichend neutralisierende Antikörper, sogenannte enhancing antibodies. Sie liegen besonders dann vor, wenn eine Infektion mit einem anderen DENV-Serotyp abgelaufen ist, oder wenn zum Beispiel bei Kindern restliche maternale Antikörper vorhanden sind. Antibody enhancement wird gefördert durch precursor membrane (prM) Antikörper, die zwischen den vier Serotypen kreuzreaktiv, aber nicht neutralisierend sind [29].
- Alter: Mit Erreichen eines Alters von zwölf Jahren treten kaum mehr Komplikationen auf. Wahrscheinlich besteht dann über die wiederholte Exposition mit allen DENV-Serotypen in Endemiegebieten eine ausreichende Immunität.
- Ethnie: Kaukasier und Asiaten haben schwerere Verläufe als Afrikaner.
- Ernährungszustand: Guter Ernährungszustand verbessert die Abwehrlage.
- DENV-Infektionsfolge: Wenn auf DENV-1 das DENV-2 folgt, treten häufiger schwerere Verläufe auf, als wenn zum Beispiel auf DENV-4 das DENV-2 folgt.
- DENV-Serotyp: DENV-2 scheint die höchste Virulenz aufzuweisen.
Wie unter 1.1 beschrieben, bestehen große Virulenzunterschiede auch innerhalb eines DENV-Serotyps.
Für etwa 1 % der Patienten mit DFH oder DSS verläuft die Infektion letal. Laborparameter der DENV-Infektion sind Thrombozytopenie, niedriges Hämoglobin, Hämolyseparameter, Erhöhung der Transaminasen bei Leberzellzerfall. Zeitabhängig lassen sich IgM- und auch IgG-Antikörper nachweisen. Mit dem Auftreten von Fieber ist auch die NAT auf DENV-RNA positiv.
Bei Infektion von Rhesusaffen mit DENV treten keine klinischen Symptome auf [30]. Dies ist ein möglicher Hinweis, dass die Adaptation DENV und Rhesusaffe sehr lange zurückliegt. DENV löst bei anderen Primaten typische klinische Symptome, aber keine neurologischen Störungen aus. Mäuse entwickeln nach kurzer Zeit Immunität (siehe unter 1), sodass sie für Virulenzversuche nicht geeignet sind.
1.3 Epidemiologie
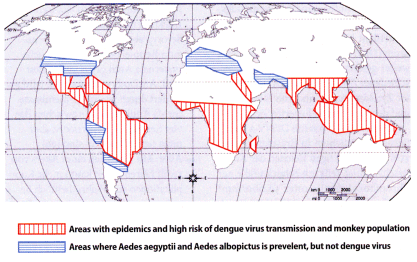
Die Präsenz der vier DENV-Serotypen wird seit 2006 weltweit in tropischen, teils subtropischen Zonen beschrieben. Im Wesentlichen entsprechen die Endemiegebiete von DENV den Verbreitungsgebieten der Aedes-Mücke und den dort lebenden niederen Primaten, siehe Abb. 4 ([31]; WHO: http://gamapserver.who.int/ map Library/). DENV-Regionen sind Asien, Ozeanien, Australien, Afrika und Mittel- und Südamerika. Seit 1990 ist Denguefieber auch in Argentinien, Nepal, Mexiko und Hawaii endemisch. 2008/2009 trat eine große Epidemie mit über 7.250 Fällen in Bolivien auf. Typisch für Denguefieber ist das zyklische Auftreten, welches durch die Verbreitung varianter Serotypen, die Infektionsrate von Mücken, niederen Primaten und Menschen und die darauf folgende Immunität bedingt ist. In Zonen mit urbanem Zyklus bestimmt der Immunstatus der Menschen, die Umgebungstemperatur und die Zahl der Mückenbrutstellen die Frequenz der Epidemien. Die Kreuzprotektion gegenüber verschiedenen DENV-Serotypen scheint manchmal weniger als zwölf Wochen zu betragen [32].
Mit den Moskito-Eradikationsprogrammen zur Bekämpfung der Malaria wurde auch die Aedes-Verbreitung reduziert. Aedes war zum Beispiel 1930 in vielen Ländern Südamerikas weit verbreitet und wurde bis 1970 auf etwa ein Viertel der Verbreitungsfläche reduziert. Im südlichen Südamerika wurde Aedes sogar eradiziert. Seit 1980, mit Beenden der Mücken-Eradikationsprogramme, hat sich Aedes wieder verbreitet und ist heute ähnlich weit verbreitet wie 1930. Die DENV-Serotypen-Verbreitung schwankt über die Zeit, was in einer Studie in Tahlan, Thailand, über 30 Jahre untersucht wurde. Ab Mitte der 8oer Jahre wurde dort DENV-2 durch DENV-1 ersetzt. Ab Mitte der 90er Jahre nahm die Prävalenz von DENV-1 wieder ab, während die von DENV-4 anstieg [33]. Hohe Morbiditätszahlen wurden in der Saison 2008/2009 aus Brasilien, Bolivien, Westindische Inseln, Thailand und Burma (Myanmar) berichtet.
Unter 2.260 deutschen Touristen, die von 1996 bis 2004 untersucht wurden, hatten 4,7 % DENV-IgM-Antikörper, die auf eine erst kürzlich abgelaufene Infektion hindeuteten und 1,1 % DENV-Antikörper, ohne dass klinisch Fieber bemerkt wurde [34] Bei Untersuchungen zur Differentialdiagnostik von Malaria in St Gallen, Schweiz, fanden sich in drei von 38 Touristen (8 %) DENV-IgM- und IgG-Antikörper, die auf eine akut abgelaufene Infektion hinwiesen, in weiteren vier der 38 (10 %) nur DENV-IgG, welches als abgelaufene Infektion gewertet wurde [35]. Bei ausreichender Spezifität der DENV-ELISA deuten diese Ergebnisse darauf hin, dass eine Infektion mit dem DENV auch asymptomatisch verlaufen kann.
Während der DENV-Epidemie in Bangladesh im Jahr 2000 wurden 225 hospitalisierte Patienten mit Fieber in Dhaka untersucht, von diesen hatten 55 (24%) DENV-Antikörper, während in der Kontrollgruppe von 184 Blutspendern nur einer (0,5%) Antikörperpositiv war [36].
Abb.4 Aedes albopictus
Die Verbreitungsgebiete von DENV, gezeigt als rote, senkrecht gestrichelte Areale, sind eng verbunden mit dem Auftreten und den Brutplätzen verschiedener Aedes-Mücken und ihrer humanen und Primaten-Reservoire. Das Verbreitungsgebiet von Aedes-Mücken ohne DENV-Übertragungen (blaue, horizontal gestrichelte Areale) ist ausgedehnter. Die Abbildung zeigt den Stand im Jahr 2009.
Von DENV hervorgerufenes Exanthem bei einer 23-jährigen Frau, zehn Tage nach Mückenstich in Indien. Im Zentrum der dunkelroten Fläche am unteren Unterschenkel liegt die Einstichstelle (Foto: Gürtler, 2005).
Das Verbreitungsgebiet des Denguefiebers ist an die Ausbreitung von zum Beispiel Aedes aegypti gebunden. Inwieweit sich eine permanente Ausbreitung der Aedes-Mücken bei fortbestehender Klimaerwärmung fortsetzt, sollte weiter beobachtet werden [37].
Weitere epidemiologisch relevante Mücken für die Übertragung von DENV sind Aedes albopictus und Ae. polynesiensi. Aedes albopictus ist inzwischen auch im gesamten Mittelmeerraum und Westeuropa vorhanden, wie Untersuchungen aus Spanien, Frankreich, Italien, Kroatien, Belgien und den Niederlanden zeigen [38, 39, 40, 41]. In 964 Aedes-Mücken aus Italien [40] und 596 aus den Niederlanden [42] ließ sich Flavivirus RNA bisher jedoch nicht nachweisen.
Im September 2010 wurde in Frankreich die erste, nicht unerwartete, autochthone DENV-Infektion bei einem 64-jährigen Mann in Nizza berichtet, dem wenige Tage später ein zweiter Fall folgte. Beide Viren sind DENV-2 und haben die gleiche Nukleinsäuresequenz [43]. Weiterhin wurde eine in Kroatien erworbene DENVInfektion bei einem Deutschen bestätigt.
Das DENV des in Kroatien erworbenen Falls hat eine von dem französischen DENV divergente Nukleinsäuresequenz [44].
Über die Eradikation des Vektors ließe sich das Auftreten von Denguefieber vermindern. Die Verhinderung der Ausbreitung der Mücken scheitert an der Tatsache, dass weltweit in der Nähe menschlicher Behausungen stehendes Wasser für die Eiablage zur Verfügung steht (zum Beispiel langlebige, Wasser enthaltende Plastikbehälter und Altreifen) sowie an der Resistenz von Mücken gegenüber Insektiziden. Weitere begünstigende Faktoren für das Auftreten von DENV-Infektionen sind der Mangel an Ventilatoren und Moskitonetzen zur Mückenstich-Prävention in der armen Bevölkerung und das Fehlen eines Impfstoffes.
Meldepflicht. Nach § 7 Infektionsschutzgesetz (IfSG) besteht für den direkten oder indirekten Nachweis von Erregern hämorrhagischer Fieber (§ 7.47) eine namentliche Meldepflicht, folglich auch für DENV.
Importierte DENV-Infektionen sind bisher die alleinige Quelle von DENV in Mitteleuropa. In Österreich wurden zwischen 1990 und 2005 insgesamt 93 Fälle abgeklärt. Ein Exanthem fand sich bei 43%, Lymphadenopathie bei 22%, zusätzlich Thrombozytopenie, Leukopenie und Erhöhung der Transaminasen. Keine Infektion verlief tödlich [45]. In Frankreich wurden zwischen 2001 und 2006 etwa zwölf bis 28 Infektionen pro Monat registriert. Diese Zahl war 2001/2002 höher, da in den überseeischen französischen Departments (Westindische Inseln und Guyana) eine Epidemie ablief [46]. In Schweden wurden zwischen 2004 und 2008 30 bis 60 Fälle jährlich bekannt, von denen sich circa 75% in Südostasien, meist Thailand, infiziert hatten. Die Tendenz, eine DENV-Infektion zu importieren, war ansteigend mit allein 17 Fällen im Januar 2009 [47].
Die über die Meldepflicht erfassten Fälle in Deutschland von DENV lagen jährlich zwischen 6o und mehr als 400, sie sind in der folgenden 13 Tabelle dargestellt (RKI Epidemiologisches Bulletin, 27/2007, ergänzt). Autochthone Übertragungen von DENV über Mückenstich sind bisher in Deutschland nicht berichtet worden, könnten aber, wie in Frankreich und Kroatien identifiziert, auftreten.
| Jahr | Gemeldete Fallzahl |
| 2001 | 60 |
| 2002 | 213 |
| 2003 | 131 |
| 2004 | 121 |
| 2005 | 144 |
| 2006 | 175 |
| 2007 | 264 |
| 2008 | 273 |
| 2009 | 298 |
| 2010 | 595 |
1.4 Nachweisverfahren und Aussagekraft
Für den Virusnachweis über die NAT und die Antikörper-Diagnostik stehen kommerzielle Tests zur Verfügung.
Antikörper-Nachweis
Bei der serologischen Diagnostik ist die ausgeprägte Kreuzreaktivität zwischen den verschiedenen Flaviviren und somit die eingeschränkte Spezifität zu berücksichtigen [1]. Die ersten IgM-Antikörper sind etwa eine Woche nach Auftreten der klinischen Symptome nachweisbar, das heißt etwa zwei Wochen nach Infektion über Mückenstich. Die IgM-Tests sind bisher nicht ausreichend validiert und neigen zu falsch positiven Resultaten [34]. Für IgM-Tests werden Werte für die Sensitivität zwischen 21 bis 99% und für die Spezifität zwischen 77 bis 99 % angegeben [48]. Die Falschpositivrate wird unter anderem durch eine bestehende Malaria und abgelaufene DENV-Infektion beeinflusst [48]. Der Neutralisationstest kann zur Differenzierung von weiteren Flavivirus Spezies eingesetzt werden [49]. Domaine II und III des Envelope E-Proteins sind geeignete Epitope, um spezifisch DENV-2 zu erkennen [50, 51]. Die NAT-PCR ist zur Abklärung von DENV-Doppelinfektionen besser geeignet als der ELISA [52]. Antikörper und Doppelinfektion können auch über Kapillarblut, welches an Filterpapier absorbiert wurde (dry blood Spot), getestet werden [53].
ELISA-Ergebnisse sollten über einen Westernblot mit gereinigtem Virus oder einem Neutralisationstest bestätigt werden. Von den angefärbten Banden sind im Westernblot die des NSt-, E- und prM Proteins am aussagekräftigsten [54].
Antigen-Nachweis
NSt-Protein wird in großen Mengen von infizierten Zellen sezerniert und eignet sich daher zum Antigennachweis. Als Antigennachweis steht ein ELISA, der monoklonale Antikörper gegen NSt-Protein enthält, zur Verfügung [55]. Ein weiterer käuflich erhältlicher Test verwendet NSt in einem capture-ELISA und erreicht eine Sensitivität von 90% bei einer Spezifität von 99,5 % [56]. Ein ähnlich konfigurierter Test ergab in 253 Proben in Thailand eine Sensitivität von 63% und Spezifität von 98 % [57]. Kommerzielle Tests, die die vier DENV-Serotypen mit einer Sensitivität von 77 % und Spezifität von 98% erkennen, werden angeboten [58]. Der NS1-Antigentest ist meist nur während der DEN V-Erstinfektion positiv [59]. Beurteilt werden kann der NS1-Antigentest nur zusammen mit DENV-IgM- und IgG-Ergebnissen [58].
Virus-Nachweis
Bei der Erstinfektion koinizidieren Fieberanstieg und Nachweisbarkeit des Virus mittels NAT. Die Virämie kann ein bis zwei Wochen anhalten. Bei der Zweitinfektion kann das Virus zwei bis drei Tage vor dem Temperaturanstieg im Blut nachweisbar sein, die Virämie besteht dann normalerweise nur für zwei bis fünf Tage [4]. Zur Virusanzucht sind Moskitozellen geeignet, die von Aedes albopictus gewonnen wurden [60, 61, 62], ebenso wie Verozellen, oder zum Beispiel humane primäre Lungen-Epithelzellen und Lungen-Karzinomzellen [63]. DENV-2 kann in Maus-Makrophagen J774 vermehrt werden [64].
DENV beeinflusst den Zellstoffwechsel, wenn es in HepG2-Zellen gezüchtet wird [65]. Alle vier DENV-Serotypen produzierten nach Transfektion von Verozellen oder MRC5-Zellen mit einem c-DNAKlon Viren mit hoher genetischer Stabilität [66].
Genom-Nachweis
Für den Nachweis von DENV-Genom über RT-PCR sind verschiedene Arbeiten publiziert worden [67, 68]. Geeignete Primerbindungsstellen liegen im Core- und Envelope-Genomabschnitt. Um alle DENV-Serotypen zu erfassen, ist eine Taqman real time PCR in der NS5 Region entwickelt worden; der Test wies in Proben aus Malaysia eine Sensitivität von 90 % und Spezifität von 100 % auf [69]. Mit dem TMA- (transcription mediated amplification) Test waren in Blutproben von Patienten aus Puerto Rico mit klinisch erkennbarer, akuter DENV-Infektion 89 % RNA-haltig [70]. Eine hohe Sensitivität wird auch erreicht, wenn die 3'UTR Region als Zielsequenz (target) verwendet wird [71]. DENV-Serotypen lassen sich durch nested PCR bei Amplifikation in der Core-Region differenzieren (Sensitivität von 76 % und Spezifität von 100 %) bei einer Empfindlichkeit des Nachweises von DENV-1 von to Kopien, von DENV-2 bis -4 von wo Kopien [72, 73]. Schließlich ist auch ein Test entwickelt worden, in dem EDTA-Vollblut als Ausgangsmaterial für die RT-PCR verwendet wurde [74]. Nach RT-PCR-Amplifikation können verschiedene Flaviviren durch Massenspektrometrie identifiziert werden [75].
Die DENV-Viruskonzentration im Blut korreliert mit der Schwere der Erkrankung. Bei Werten höher als 106 Genomäquivalenten/ml besteht ein etwa 90 %-iges Risiko, dass sich ein DHF ausbildet [76]. Werte von t09 Genomäquivalenten/ml können im Plasma auftreten [76, 77].
2. Blut- und Plasmaspender
Das Risiko der Blutübertragung von DENV wird nach wie vor als gering angesehen, auch wenn zwei Übertragungen über Blut in Hongkong und Singapur berichtet wurden [78]. Mit einem TMA-Test wurden in Honduras, Brasilien und Australien 13.372 Blutspenden untersucht, unter denen acht aus Honduras und einer aus Brasilien DENV-RNA-haltig waren [79]. Unter 16.521 Proben aus Puerto Rico, die nach dem Gipfel der DENV-Epidemie in 2005 abgenommen wurden, waren zwölf DENV-RNA im TMA-Test positiv, vier von fünf konnten in der PCR bestätigt werden [80]. Für die Möglichkeit der Übertragung von Arboviren sind Modellrechnungen entwickelt worden [81].
2.1 Prävalenz und Inzidenz bei Spenderkollektiven
Bei Inzidenz und Prävalenz muss zwischen den Daten aus endemischen und nichtendemischen Regionen unterschieden werden. In Endemie-Regionen sind Inzidenzen bei Blutabnahme vor Auftreten einer febrilen Phase von 0,1% gefunden worden [79, 80]. Unter 683 Blutspendern und 492 Schwangeren in Burkina Faso hatten 26 % in ländlichen Gebieten und 37% in der Hauptstadt (Ouagadougou) Antikörper gegen DENV [82]. Wie unter 1.3 Epidemiologie erwähnt, wurden in Dakha, Bangladesh, unter 184 Blutspendern einer (0,54 %) mit DENV-Antikörpern gefunden [36]. Unter deutschen Touristen - Reiserückkehrer mit akutem Fieber und Diarrhö - in Berlin hatten etwa 4 bis 5 % Antikörper gegen DENV [34]. Unter 71 Rückkehrern aus den Tropen mit Fieber und typischen klinischen Zeichen einer DENV-Infektion hatten in Berlin in der Zeit von 1993 bis 2001 55 DENV-Antikörper (77,5 %) [83]. Wenn die Zahlen aus Berlin (4 bis 5 %) und aus Frankfurt (9 %) [84] verwendet werden, errechnet sich eine Inzidenz von <1 in 10.000 für Deutschland. In der TropNetEurop Studie von 2002 konnten in den Jahren 1999 bis 2001 bei circa 51.000 Reisenden pro Jahr 294 Patienten mit DENV, unter ihnen sieben mit DHF erfasst werden [85]. Dies entspricht einer Inzidenz bei Reisenden in dieser Gruppe von etwa 0,2%. Die meisten dieser Infektionen wurden in Indien und Thailand erworben, gefolgt von Brasilien, den Karibischen Inseln und Mexiko. Unter Entwicklungshelfern, die nach Deutschland zurückkehrten, waren 6,4% DENV-Antikörper positiv, wobei die größte Zahl von Infektionen in Thailand erworben wurde, gefolgt von Benin und Burkina Faso [86].
2.2 Definition von Ausschlusskriterien
Bei einer DENV-Infektion beobachtet man etwa eine Woche nach dem Mückenstich auch vor Auftritt von Symptomen eine virämische Phase, die insgesamt ein bis eventuell zwei bis drei Wochen dauert (siehe a Abb. 3). Während der Erstinfektion verläuft die Infektion fast immer mit hohem Fieber und weiteren Zeichen einer akuten Entzündung [4]. Bei entsprechender Symptomatik werden Blutspender für vier Wochen von der Spende ausgeschlossen und dadurch eine Übertragung von DENV vermieden. Bei der Zweitinfektion oder möglicherweise einer Reaktivierung kann die DENV-Infektion von asymptomatisch bis tödlich verlaufen, das heißt die kurzfristige virämische Phase kann bei klinisch gesunden Blutspendern nicht erkannt werden.
Ein Großteil der Endemiegebiete von Denguefieber überlappt mit den Regionen, in denen Malaria endemisch ist. Nach Rückstellung für sechs Monate wegen des Aufenthalts in diesen endemischen Gebieten ist eine möglicherweise erworbene DENV-Infektion überwunden. Insofern sind die Ausschlusskriterien zur Verhinderung einer transfusionsassoziierten Übertragung von Malaria auch für DENV wirksam. Eine chronische DENV-Infektion mit Viruspräsenz über sechs Monate, wie beim West-Nil-Fieber beschrieben [87], ist für die DENV-Infektion bisher nicht berichtet worden.
Australien, in dessen Norden DENV endemisch ist, hat das Risiko der Übertragung über Blut durch epidemiologische Überwachung und Spenderselektion minimiert, obwohl DENV-Screeningtests bisher nicht verwendet werden [88].
2.3 Spendertestung und Aussagekraft
Die Testung von Spendern oder Spenden auf DENV ist aufgrund der epidemiologischen Situation derzeit in Deutschland nicht notwendig.
2.4 Spenderbefragung
Spender werden nach ihren Reisen in tropische Regionen und nach allgemeinen Symptomen einer Entzündung sowie Fieber befragt. Spezifisch nach DENV wird nicht gefragt, ist auch aufgrund der epidemiologischen Datenlage zur Vermeidung der Übertragung von DENV derzeit nicht notwendig.
2.5 Spenderinformation und Beratung
Eine spezifische Beratung zu Denguefieber kann in infektiologischen Zentren oder Tropeninstituten gegeben werden. Für Blutspendedienste ist dies derzeit nicht erforderlich.
3. Empfänger
3.1 Prävalenz und Inzidenz von blutassoziierten Infektionen und Infektionskrankheiten bei Empfängerkollektiven
Wenn Empfänger in Deutschland nicht in DEN V-Endemie-Regionen gewesen sind, haben sie keine Antikörper gegen DENV und sind für eine DENV-Infektion empfänglich. Empfänger aus endemischen Regionen können je nach Region und DENV-Prävalenz induzierte Antikörper haben, die abhängig vom Serotyp neutralisierend, kreuzreaktiv oder verstärkend (enhancing) sein können.
3.2 Abwehrlage (Resistenz, vorhandene Immunität, Immunreaktivität, Alter, exogene Faktoren)
Die DENV-Infektion wird normalerweise nach zwei bis drei Wochen überwunden. Alter und iatrogene Immunsuppression können den Heilungsprozess verlangsamen. Über das sogenannte immune enhancement, das heißt eine gesteigerte Pathogenese durch eine unzureichende Immunabwehr, ist bisher nur bei Kindern in endemischer Region berichtet worden.
Eine spezifische antivirale Therapie steht nicht zur Verfügung, sodass der Genesungsverlauf nicht beeinflusst werden kann. Eine natürliche Resistenz gegen DENV ist nicht bekannt und auch nicht zu erwarten, da mehrere Rezeptoren für den Zelleintritt von DENV vorhanden sind (siehe 1.1 Erregereigenschaften).
3.3 Schwere und Verlauf der Erkrankung
Bei etwa einem Viertel der Infizierten zeigt die DENV-Infektion einen schweren Verlauf, der aufgrund der Allgemeinsymptome mit hohem Fieber bei etwa 1% zur Hospitalisierung führt [89]. Bei etwa 5 bis 10 % der Hospitalisierten entwickelt sich ein hämorrhagisches Fieber (DHF), bei etwa 1% ein Schocksyndrom (DSS). Die Todesrate liegt unter 1% der Hospitalisierten [85]. Laborparameter für die Schwere der Infektion sind der Grad der Thrombozytopenie und die Höhe der Transaminasen [89]. Da die Kapillarschädigung beim DHF teils viral, teils autoimmunologisch verursacht ist, kann therapeutisch nicht spezifisch interferiert werden, um die Symptomatik zu lindern. Komplikationen der DENV-Erkrankung sind Beteiligung des Nervensystems [90, 25], teils durch Einblutung bedingt [91], und sehr häufig eine Myositis [92].
Ein spezifisches Hyperimmunglobulin steht nicht zur Verfügung, es müsste, wenn, Serotypspezifisch eingesetzt werden (siehe unter 3.4 Therapie).
3.4 Therapie und Prophylaxemöglichkeiten Therapie
Ein spezifisches gegen DENV oder ein anderes Flavivirus gerichtetes Therapeutikum, das die Virusvermehrung wirksam unterdrückt, ist nicht vorhanden. Die Behandlung erfolgt symptomatisch mit Senken des Fiebers und Flüssigkeitszufuhr.
In vitro zeigen Iminozucker, die die Glucosidase I und II am endoplasmatischen Retikulum hemmen, antivirale Aktivität gegen DENV, WNV (West-Nil-Virus) und BVDV (bovine viral diarrhoea virus) [93]. Eine Rezeptor-Blockade ist über zosterische Säure (psulfoxylcinnamin acid) in vitro möglich [94]. Die Hemmung der NS3-Protease vermindert, wie beim Hepatitis C Virus, die Polyprotein-Spaltung, die ein essenzieller Schritt bei der DENV-Replikation ist [95]
Experimentelle Immunglobulin-Therapie: Mit der Applikation von spezifisch gegen einen DENV-Serotyp gerichteten Antikörpern, auch monoklonalen Antikörpern, kann die pathogenetische Wirkung von DENV in der Maus abgefangen werden [96]. Ein kreuzneutralisierender monoklonaler Antikörper wurde hergestellt, welcher an der ED3-Domaine des E-Proteins bindet und alle vier DENV-Serotypen neutralisiert [97]. Allerdings kann auch über die Gabe von monoklonalen Antikörpern ein "immune enhancement" in vivo und in vitro auf K562-Zellen erzeugt werden [98].
Prophylaxe
Mückenstichprophylaxe: Das Vermeiden von Mückenstichen ist die effizienteste Prophylaxe auch vor der DENV-Infektion, ähnlich wie bei weiteren über Mücken übertragbaren Infektionserregern. In vielen Regionen, in denen DENV übertragen wird, können auch weitere Arboviren, Plasmodien und Mikrofilarien über Mücken übertragen werden. Eine weitere prophylaktische Maßnahme ist die Elimination der Brutstellen der Mücken, wie oben erwähnt.
Impfung
Ein Impfstoff gegen DENV steht bisher nicht zur Verfügung. Die Entwicklung eines Impfstoffes ist durch zwei Schwierigkeiten gekennzeichnet - einmal geeignete kreuzneutralisierende Epitope für alle DENV-Serotypen zu definieren und zum anderen die vakzineinduzierte Immunität so hoch und dauerhaft zu erzeugen, dass ein "immune enhancement" bei Exposition mit einem beliebigen DENVSerotyp ausbleibt. Eine Übersicht über die Möglichkeit einer Impfung gegen DENV für Reisende ist 2008 erschienen [99]. Rhesusaffen können über eine tetravalente Vakzine, bei der E-Protein in einen Adenovirus-Vektor eingebaut wurde, teilgeschützt werden. Geimpfte Tiere entwickeln nach Exposition eine niedrigere Virämie [100]. Abhängig vom Serotyp kann die Immunantwort in Rhesusaffen 70 bis 100 % betragen und eine Schutzwirkung von 50 bis 80% erreichen [101]. Eine Verstärkung der T-Zell-Immunantwort ist durch polytopen Impfstoff erreicht worden [102]. Rekombinantes attenuiertes Virus mit einer Deletion in der 3'UTR-Region konnte nach vier Impfdosisgaben Rhesusaffen gegen Exposition mit DENV-2 schützen [103]. Über eine NSt-Protein enthaltende DNA-Vakzine konnten Balb/c-Mäuse gegen die DENV-Infektion geschützt werden [104]. Eine Vakzine mit einem attenuierten DENV, welches nicht mehr in die Zelle eintreten kann, ist ebenfalls als Impfstoffkandidat hergestellt worden [105]. Rekombinante tetravalente DENV-Vakzine, hergestellt in Drosophila-Zellen, führt zu einer protektiven Immunität in Mäusen und Affen [106].
3.5 Übertragbarkeit
Bluttransfusion
Bisher wurde nur eine Arbeit über drei transfusionsassoziierte DENV- Übertragungen in Singapur 2008 veröffentlicht [107]. Spender war ein asymptomatischer 52-jähriger Mann; die drei Empfänger von Erythrozyten, FFP (fresh frozen plasma) und Thrombozyten hatten alle Zeichen einer DENV-Infektion, als vorherrschendes Symptom eine Myalgie. Eine weitere Übertragung über eine Bluttransfusion wurde aus Hongkong berichtet [108]. Unter 126 hospitalisierten Fällen mit DENV-Infektion zwischen 1998 und 2005 war dies dort die einzige, die über Bluttransfusion erfolgte. Das Risiko einer Übertragung durch Blut außerhalb von Endemiegebieten wird in den USA als sehr niedrig bewertet [78, 81].
Bisher wurde nur eine DENV-Übertragung mit Ausbildung von Dengue hämorrhagischem Fieber (DHF) beim Empfänger nach Nierentransplantation 2005 berichtet [109].
Nadelstichverletzung
Geringe Mengen von Blut, wie bei den vier beschriebenen Übertragungen durch Nadelstichverletzung, reichen aus, um DENV zu übertragen, wenn sich der Indexpatient in der akuten virämischen Phase befindet [110, 111, 112,113]. Klinische Zeichen der Infektion sind nach etwa einer Woche erkennbar, das Exanthem ist nach circa zwei Wochen sichtbar und nach circa drei Wochen sind die Symptome der DENV-Infektion abgeklungen. Bei allen durch Nadelstich verursachten Erstinfektionen traten keine Hämorrhagien auf.
3.6 Häufigkeit und Menge der Applikation der Blutprodukte
Bisher ist in Deutschland eine Übertragung von DENV über Blut oder Blutprodukte nicht berichtet worden. Die Rückstellung der Spender nach Tropenaufenthalt für sechs Monate wegen Malaria einerseits und der Ausschluss für vier Wochen nach fieberhaften Erkrankungen andererseits minimieren das Risiko einer Übertragung. Die geringe Anzahl von transfusionsassoziierten DENV-Infektionen weltweit erlaubt keine Abschätzung des Übertragungsrisikos in Abhängigkeit von Häufigkeit und Menge der Applikation.
4. Blutprodukte
4.1 Belastung des Ausgangsmaterials und Testmethoden
Eine Belastung von in Deutschland entnommenem Blut oder Plasma mit DENV besteht derzeit nicht. Asymptomatische Träger mit schützenden DENV-Antikörpern sind nicht infektiös, weshalb eine Antikörper-Testung nicht erforderlich ist (siehe 4.2).
Tests zur Erkennung von DENV (RNA-NAT oder der weniger empfindliche Antigentest) und DENV-Antikörper (ELISA) sind unter 1.4 beschrieben.
Obwohl der Eintrag importierter DENV-Infektionen durch die oben genannte Reiserückstellung fast vollständig ausgeschlossen werden kann, ist eine Belastung von importiertem Plasma zur Fraktionierung nicht auszuschließen. Eine Testung ist wegen der auch für DENV effektiven Inaktivierungsverfahren jedoch nicht erforderlich.
4.2 Möglichkeiten der Abtrennung und Inaktivierung von Infektionserregern
Aus mit Virus versetztem Plasma konnte DENV über Protein-Fraktionierung und anschließende Inaktivierung durch Pasteurisierung oder Solvent-Detergent-Behandlung vollständig entfernt beziehungsweise inaktiviert werden [114]. Wenn die Einzelschritte der Verfahren aufaddiert werden, ergibt sich für DENV-2 ein kumulativer Abreicherungsfaktor von mehr als to logio für Albumin und mehr als 14 log10 für ein Immunoglobulinpräparat. DENV verhält sich bei der Inaktivierung wie andere umhüllte Viren.
Nachdem in Deutschland Produkte aus Plasma mindestens einen virusinaktivierenden Produktionsschritt in der Herstellung aufweisen müssen, besteht für diese Präparate, auch wenn das Ausgangsmaterial belastet sein sollte, keine Gefahr der DENV-Übertragung.
4.3 Praktikabilität und Validierbarkeit der Verfahren zur Elimination/Inaktivierung von Infektionserregern
DENV ist unter Risikogruppe 3 eingestuft. Arbeiten mit DENV müssen, wie die mit anderen Flaviviren, unter entsprechenden Bedingungen durchgeführt werden [115]. Bisher sind nur perkutane und keine aerogen übertragenen DENV-Infektionen beschrieben worden. Nachdem DENV auf verschiedenen Zellkulturen von Mensch und Affe, zum Beispiel Verozellen, vermehrt werden kann, kann genügend Virus hergestellt werden, um Zwischenstufen bei der Herstellung von Blutprodukte zu speiken.
Die Validierung der Virusreduktion könnte mit charakterisierten DENVStämmen aller Serotypen vorgenommen werden. Die Validierung von DENV ist jedoch entsprechend den Vorgaben des CHMP (Note for Guidance an Virus Validation Studies, CPMP/BWP/ 268/95) nicht gefordert, da die Daten zur Inaktivierung von Modellviren äquivalent sind [116].
Inaktivierung
DENV kann durch Pasteurisierung und Solvent-Detergent-Behandlung inaktiviert werden [114]. DENV wird durch Methylenblau/Licht-Behandlung [117] inaktiviert.
Für die Behandlung mit Psoralen/ Amotosalen und Riboflavin sind keine Inaktivierungsdaten bekannt. Das dem DENV sehr ähnliche Flavivirus West-NilVirus (WNV) wird durch Behandlung mit Amotosalen (Intercept) in Plasma [118] und in Thrombozytenkonzentraten [119] inaktiviert. Hitzebehandlung von Serum bei 56 °C für 30 min inaktiviert 106 pfu/ml WNV vollständig [120]. Eine Belastung von Plasma aus USA mit WNV-RNA wurde gefunden, während sie in Pools aus Asien und Europa fehlte [121]. Im Umkehrschluss sollte die Belastung von Plasmapools mit DENV gering sein.
5. Bewertung
Dengue Fieber Virus (DENV) verursacht weltweit jährlich etwa 50 bis 100 Millionen Infektionen, von denen etwa 500.000 zur Hospitalisierung führen. DENV ist somit die häufigste durch Mücken übertragene Arbovirus-Infektion des Menschen. Tierisches Reservoir für DENV sind in den Tropen niedere Primaten und möglicherweise andere Tiere. Die Eradizierung dieser Zoonose ist nicht wahrscheinlich. Menschliches Reservoir sind im Wesentlichen Kinder und junge Heranwachsende in tropischen Endemiegebieten, bei denen sich noch keine ausreichende Immunität gegen die vier DENV-Serotypen ausgebildet hat. Bei nicht ausreichender Immunität kann die DENV-Infektion über einen Verstärkereffekt (antibody enhancement) zum häufig tödlichen Dengue hämorrhagischen Fieber (DHF) oder Dengue-Schock-Syndrom (DSS) führen. DENV ist bei Erstinfektion für etwa vier bis 21 Tage nach Mückenstich über Blut übertragbar. Eine spezifische antivirale Therapie der DENVInfektion oder eine Impfung stehen derzeit nicht zur Verfügung, obwohl als globales Problem erkannt und angemahnt [122].
Das DENV-Genom ist durch Mutation und Rekombination hoch variabel. DENV hat die Fähigkeit, sich in Primaten bei 37 °C und in der Aedes-Mücke bei Umgebungstemperatur zu vermehren.
Die häufigsten Vektoren für die Übertragung von DENV sind Aedes aegypticus und Aedes albopictus. Diese Mücken haben sich im gesamten Mittelmeerraum und bis nach Mitteleuropa ausgebreitet. Ein menschliches Reservoir, um den urbanen Zyklus für DENV zu initiieren, ist in Mitteleuropa bisher nicht vorhanden. Bis auf drei Fälle im Jahr 2010 wurden in Süd- und Mitteleuropa keine autochthonen Übertragungen berichtet.
Epidemiologische Studien zur Erfassung von importierten DENV-Infektionen in Deutschland und eine Überwachung, ob autochthone Infektionen in Deutschland bei weiterer Klimaerwärmung und Verbreitung des Vektors stattfinden, sollten durchgeführt werden.
Derzeit sind keine zusätzlichen Maßnahmen über die bestehende Rückstellung für vier Wochen nach fieberhafter Erkrankung beziehungsweise für sechs Monate nach Aufenthalt in einer für Malaria endemischen Region erforderlich, um eine mögliche DENV-Übertragung durch Blufftransfusion zu verhindern.
Dieses Papier wurde fertiggestellt am 24.11.2010 und vom Arbeitskreis Blut am 21.03.2011 verabschiedet. Es wurde erarbeitet von den Mitgliedern der Untergruppe "Bewertung Blutassoziierter Krankheitserreger" des Arbeitskreises Blut:
Prof. Dr. Lutz Gürtler, Dr. Ursula Bauerfeind, Dr. Johannes Blümel, Prof. Dr. Reinhard Burger, Prof. Dr. Christian Drosten, Dr. Albrecht Gröner, Dr. Margarethe Heiden, Prof. Dr. Martin Hildebrandt, Prof. Dr. Dr. Bernd Jansen, Dr. Thomas Montag-Lessing, Dr. Ruth Offergeld, Prof. Dr. Georg Pauli, Prof. Dr. Rainer Seitz, Dr. Uwe Schlenkrich, Dr. Volkmar Schottstedt, Dr. Johanna Strobel, Dr. Hannelore Willkommen
6. Literatur
- Blümel J, Burger R, Gerlkh W et al. (2004): Arboviren - durch Arthropoden übertragbare Viren. Stellungnahmen des Arbeitskreises Blut des Bundesministeriums für Gesundheit und Soziale Sicherung. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 47:910-918
- Gubler DJ (2006) Dengue/dengue haemorrhagic fever: history and current status. Novartis Found Symp 277:3-16
- TsaiTF, Vaughn DW, Solomon T (2005) Flaviviruses (Yellow fever, Dengue, Dengue hemorrhagic fever, Japanese encephalitis, West Nile encephalitis, St Louis encephalitis, tickborne encephalitis). In: Mandell GL, Bennett JE, Dolin R (Hrsg) Mandell, Douglas and Bennett's Principles and Practice of Infectious Diseases. 6th ed, Elsevier, Philadelphia, 51927-1950
- Halstead SB (2007) Dengue. Lancet 370: 1644-1652
- Boonpucknavig 5, Vuttivitroj 0, Boonpucknavig V (1981) Infection of young adult mice with dengue virus type 2. Trans Roy Soc Trop Med Hyg 75: 647-653
- Aquilar-Setien A, Romero-Almaraz ML, Sanchez-Hernandez C et al. (2008) Dengue virus in Mexican bats. Epidemiol Infect 136:1678-1683
- Wang E, Ni H, Xu R, Barrett AD, Watowich SJ, Gubler DJ, Weaver SC (2000) Evolutionary relationships of endemic / epidemic and sylvatic dengue viruses.1 Virol 74:3227-3234
- Gubler DJ, Kuno G, Markoff L (2007) Flaviviruses. In Fields-Virology, 5th ed, Wolter & Kluwer, Philadelphia, S 1156-1252
- Lindenbach BD, Thiel HJ, Rice CM (2007) Flaviviridae: the viruses and their replication. In: Fields-Virology, SU' ed, Wolter & Kluwer, Philadelphia, S 1101-1155
- Zhang Y, Corver1, Chipman PR et al. (2003) Structures of immature flavivirus particles. EMBO J 22:2604-2613
- Smith TJ, Brandt WE, Swanson JL, McCrown JM, Buescher EL (1970) Physica I and biological properties of dengue-2 virus and associated antigens. J Virol 5:524532
- Gubler DJ, Rosen L (1977) Quantitative aspects of replication of dengue viruses in Aedes albopictus (Diptera: Culicidae) after oral and parenteral infection. J Med Entomol 13:469-472
- Leitmeyer KC, Vaughn DW, Watts DM et al. (1999) Dengue virus structural differences that correlate with pathogenesis. J Virol 73:4738-4747
- Pokidysheva E, ZhangY, Battisti AJ et al. (2006) Cryo-EM reconstruction of dengue virus in complex with the carbohydrate recognition domain of DCSIGN. Cell 124:485-493
- Chen Y, Maguire T, Hileman RE et al. (1997) Dengue virus infectivity depends on envelope protein binding to target cell hepa ran sulfate. Nature Med 3:866-871
- Lee E, Lobigs M (2000) Substitutions at the putative receptorbinding site of an encephalitic flavivirus alter virulence and holt cell tropism and reveal a role for glycosaminoglycans in entry. J Virol 74:8867-8875
- Jindadamrongwech S, Thepparit C, Smith DR (2004) Identification of GRP 78 (BiP) as a liver cell expressed receptor element for dengue virus serotype 2. Arch Virol 149:915-927
- Littaua R, Kuraue 1, Ennis FA (1990) Human IgG Fc receptor II mediates antibodydependent enhancement of dengue virus infection.1 Immunol 144:3183-3186
- Koschinski A, Wengler G, Wengler G, Reep H (2003) The membrane proteins of flaviviruses from ionpermeable pores in the target membrane after fusion: identification of the pores and analysis of their possible role in virus infection. J Gen Virol 84:1711-1721
- Reyesdel Valle J, Chävez-Salinas 5, Medina F, Del Angel RM (2005) Heat shock protein 90 and hegt shock protein 70 are components of dengue virus receptor complex in human cells. J Virol 79: 4557-4567
- Welsch S, Miller 5, Romero-Brey 1 et al. (2009) Composition and threedimensional architecture of the dengue virus replication and assembly sites. Cell Host Microbe 5:365-375
- Benarroch D, Egloff MP, Mulard L, Guerreiro C, Romette JL, Canard B (2004) A structural basis for the inhibition of the NS5 dengue virus mRNA 2'O-methyltransferase domain by ribavirin 5'-triphosphate.1 Biol Chem 279:35638-35643
- Zhou Y, Ray D, Zhao Y et a I. (2007) Structure and function of flavivirus NS5 methyltransferase. J Virol 81:3891-3903
- Guilarde AO, Turchi MD, Siqueira JB Jr et al. (2008) Dengue and dengue hemorrhagic fever among adults: clinical outcomes related to viremia, serotypes, and antibody response. J Infect Dis 197: 817-824
- Su DH, Bacsal K, Chee SP et a (2007) Prevalence of dengue maculopathy in patients hospitalized for dengue fever. Opthalmology 114:1743-1747
- Domingues RB, Kuster GW, Onuki-Castro FL, Souza VA, Levi JE, Pannuti CS (2008)1nvolvement of the central nervous system in patients with dengue virus infection. J Neurol Sci 267:36-40
- Pecorari M, Longo G, Gennari W et al. (2009) First human case of Usutu virus neuroinvasive infection, Italy, August-September 2009. Euro Surveill 14 (50):pii=19446
- Peters 0 (2008) Infections caused by arthropod- and rodentborne viruses. In: Harrison (Hrsg) Principles of Internal Medicine, 175h edition, McGraw Hill Medical, New York, S 1226-1239
- Dejnirattisai W, Jumnainsong A, Onsirisakul N et al. (2010) Crossreacting antibodies enhance dengue virus infection in humans. Science 328:745-748
- Scott RM, Nisalak A, Eckels KH et al. (1980) Dengue-2 vaccine: viremia and immune responses in rhesus monkeys. Infect Immun 27:181-186
- Haas W, Krause G, Marcus U, Stark K, Ammon A, Burger R (2004) Emerging infectious diseases - Denguefever, West-Nilefever, SARS, avian influenza, HIV. Internist (Berlin) 45:684-692
- Sabin AB (1952) Research on dengue during World War II. Am J Trop Med Hyg 1:30-50
- Zhang C, Mammen MP Jr, Chinnawirotpisan P et al. (2005) Clade replacements in dengue virus serotypes 1 and 3 are associated with changing serotype prevalence. J Virol 79:15123-15130
- Wichmann 0, Lauschke A, Frank C et al. (2005) Dengue antibody prevalence in German travelers. Emerg lnfect Dis 11:762-765
- Settah SG, Vernazza PL, Morant R, Schultze D (1995) Imported dengue fever in Switzerland - serological evidence for a hitherto unexpected high prevalence. Schweiz Med Wochenschr 125:1673-1678
- Hossain MA, Khatun M, Arjumand F, Nislauk A, Breiman RF (2003) Serologic evidence of dengue infection before onset of epidemic, Bangladesh. Emerg Infect Dis 9:1411-1414
- Hemmer Cl, Frimmel S, Kinzelbach R, Gürtler L, Reisinger EC (2007) Global warming: trailblazer for tropica I infections in Germany?. Dtsch Med Wochenschr 132:2583-2589
- Roiz D, Eritja R, Molina R, Melero-Alcibar R, Lucientes (2008) Initial distribution assessment of Aedes albopictus (Diptera: Culicidae) in the Barcelona, Spa in, area. J Med Entomol 45:347-352
- Poffln N, Toty C, L'ambert G et al. (2007) Population dynamics of pest mosquitoes and potential malaria and West Nile virus vectors in relation to climatic factors and human activities in the Camargue, France. Med Vet Entomol 21:350-357
- Masetti A, Rivasi F, Bellini R (2008) Mosquitobased survey for the detection of flaviviruses and filarial nematodes in Aedes albopictus and other a nthropophilic mosquitoes collectes in northern Italy. New Microbiol 31:457-465
- Rahamat-Langendoen JC, van Vliet JA, Reusken CB (2008) Climate change influences the incidence of arthropodborne diseases in the Netherlands. NedTijdschr Geneeskd 152:863-868
- Scholte EJ, Dijkstra E, Blok H et al. (2008) Accidenta I im portation of the mosquito Aedes albopictus into the Netherlands: a survey of mosquito distribution and the presence of dengue virus. Med Vet Entomol 22:352-358
- La Ruche G, Souars Y, Armengaud A et al. (2010) First two autochthonous dengue virus infections in metropolitan France, September 2010. Euro Surveill 15(39):pii=19676
Available online: http://www.eurosurveillance.org/ ViewArticle.aspx? Articleld=19676]. - Schmidt-Chanasit 1, Haditsch M, Schöneberg I, Günther 5, Stark K, Frank C (2010) Dengue virus infection in a traveller returning from Croatia to Germany.
Euro Surveill 15(40):pii=19677
Available online: http://www.eurosurveillance.org/ ViewArticle.aspx? Articleld=19677 - Laferl H, Szell M, Bischof E, Wenisch C (2006) Imported dengue fever in Austria 1990-2005. Travel Med Infect Dis 4:319-323
- Tarantola A; Quatresous I, Ledrans Met al. (2009)1mported cases of dengue fever diagnosed in metropolita n France, from Ja nuary 2001 to December 2006. Med Mal Infect 39:41-47
- Heddini A, Janzon R, Linde A (2009) Increased number of dengue cases in Swedish travellers to Thailand. Euro Surveill 14:pii 19111
- Hunsperger EA, Yoksan S, Buchy P et al. (2009) Evaluation of commercially available antidengue virus immunoglobulin M Tests. Emerg Infect Dis 15:436-440
- Shanaka WW, Rodrigo I, Alcena DC, Rose RC, Jin X, Schlesingern (2009) An automated dengue virus microneutralization plag ue assay performed in human Fc(gamma) receptorexpressing CV-1 cells. Am J Trop Med Hyg 80:61-65
- Lai CY, Tsai WY, Lin SR et al. (2008) Antibodies to enevelope glycoprotein of dengue virus during the natural course of infection are predominantly crossreactive and recognize epitopes containing highly conserved residues at the fusion loop of domain II. J Virol 82:6631-6643
- Sukupolvi-Petty S, Austin SK, Purtha WE et al. (2007) Type- and subcomplexspecific neutralizing antibodies against domain III of dengue virus type 2 envelope protein recognize adjacent epitopes. J Virol 81:1281612826
- Chinnawirotpisan P, Mammen MP Jr, Nisalak A et al. (2008) Detection of concurrent infection with multiple dengue virus serotypes in Thai children by ELISA and nested RT-PCR assay. Arch Virol 153:2225-2232
- Matheus S, Meynard JB, Lavergne A et al. (2008) Dengue-3 outbreak in Paraguay: investigations using capillary blond samples on filter paper. Am J Trop Med Hyg. 79:685-687
- Oceguera LF 3rd, Patiris PJ, Chiles RE, Busch MP, Tobler LH, Ha nson CV (2007) Flavivirus serology by Western blot analysis. Am J Trop Med Hyg 77:159163
- Xu H, Di B, Pan YX et al. (2006) Serotype 1-specific monoclona I antibodybased antigen capture immunoassay for detection of circulating nonstructura I protein NS-1: Implications for early diagnosis and serotyping of dengue virus infections. J Clin Microbiol 44:2872-2878
- Zainah S, Wahab AH, Mariam Met al. (2009) Performance of a commercial rapid dengue NS1 antigen immunochromatography test with reference to dengue NS-1 antigencapture ELISA.1Virol Methods 155:157160
- Lapphra K, Sanqcharaswichai A, Chokephaibulkit K et al. (2008) Evaluation of an NS1 antigen detection for diagnosis of acute dengue infection in patients with acute febrile illness. Diagn Microbiol Infect Dis 60:387-391
- Wang SM, Sekaran SD (2010) Evaluation of a commercial SD dengue virus NS1 antigen capture enzymelinked immunosorbent assay kit for early diagnosis of dengue virus infection. J Clin Microbiol 48:2793-2797
- Lima Mda R, Nogueira RM, Schatzmayr HG, dos Santos FB (2010) Comparison of three commercially available dengue NS1 antigen capture assays for acute diagnosis of dengue in Brazil. PLoS Negl Trop Dis4(7):e738
- Chanyasanha C, Hasebe F, Matias R, Igarashi A (1999) Production of viral antigens in culture fluid of C6/36 mosquito cell line infected with dengue type 4 virus strains isolated from patients with different clinical severities. Acta Virol 43:213-218
- Gleeson F, McBride 1, Norton R (1999) Cultureamplified detection of dengue virus from serum in an outbreak of dengue fever.1 Med Virol 57:212-215
- Zamreel, Drakes N, Rohani A, Lee HL (2005) Sensitivity of Aedes albopictus C6/36 cells line for the detection and infectivity titration of dengue virus. Trop Biomed 22:217-219
- Lee YR, Su CY, Chow NH et al. (2007) Dengue viruses can infect human primary lung epithelia as well as lung carcinoma cells, and can also induce the secretion of IL-6 and RANTES. Virus Res 126:216-225
- Moreno-Altamirano MM, Sänchez-Garcia El, Legorretta-Herera M, Aguilar-Carmona I (2007) Susceptibility of mouse macrophage1774 to dengue virus infection. Intervirology 50:237-239
- Ekkapongpisit M, Wannatung T, Susantad T, Triwitayakorn K, Smith DR (2007) c-DNA-ALFP analysis of differential gene expression in human hepatoma cells (HepG2) upon dengue virus infection. J Med Virol 79: 552-561
- Liu CC, Lee SC, Butler M, Wu SC (2008) High genetic stability of dengue virus propagated in MRC-5 cells as compared to the virus propagated in vero cells. PLoS ONE 19;3:e1810
- Das S, Pingle MR, Munoz-Jordän Jet al. (2008) Detection and serotyping of dengue virus in serum samples by multiplex reverse transcriptase PCR-ligase detection reaction assay. J CIM Microbiol 46:3276-3284
- Dumoulin A, Marti H, Panning M, Hatz C, Hirsch HH (2008) Pandengue virus detection by PCR for travelers returning from the tropics. J Clin Microbiol 46:3104-3106
- Kong YY, Thay CH, Tin TC, Devi S (2006) Rapid detection, serotyping and quantitation of dengue viruses byTaqMan realtime onestep RT-PCR. J Virol Methods 138:123-130
- Mu hoz-Jordän 1L, Collins CS, Vercine E et al. (2009) Highly sensitive detection of dengue virus nucleic acid in samples from clinically ill patients. J Clin Microbiol 47:927-931
- Gurukumar KR, Priyadarshini D, Patil JA et al. (2009) Development of real time PCR for detection and quantitation of Dengue viruses. Virol J 23:10
- Lanciotti RS, Calisher CH, Gubler DJ, Chang GJ, Vorndam AV (1992) Rapid detection and typing of dengue viruses from clinical samples by using reverse transcriptasepolymerase chain reaction.1Clin Microbiol 30:545-551
- Gomes AL, Silva AM, Cordeiro MT, Guimaräes GF, Marques ET Jr, Abath FG (2007) Singletube nested PCR using immobilized internal primers for the identification of dengue virus serotypes.1Virol Methods 145:76-79
- Klungthong C, Gibbons RV, Thaisomboonsuk B et al. (2007) Dengue virus detection using whole blood for reverse transcriptase PCR and virus isolation.1Clin Microbiol 45:2480-2485
- Grant-Klein RJ, Baldwin CD, Turell M1 et al. (2010) Rapid identification of vectorborne flaviviruses by mass spectrometry. Mol Cell Probes 24:219-228
- Wang WK, Chen HL, Yang CF et al. (2006) Slower rates of clearance of viral load and viruscontaining immune complexes in patients with dengue hemorrhagic fever. CIM Infect Dis 43:1023-1030
- Onlamoon N, Noisakran S, Hsiao HM et al. (2010) Dengue virusinduced hemorrhage in a nonhuman primate model. Blood 4:115:1823-1834
- Bianco C (2008) Dengue and Chikungunya viruses in blood donations: risks to blood supply ? Transfusion 48:1279-1281
- Linnen JM, Vinelli E, Sabino EC et al. (2008) Dengue viremia in blood donors from Honduras, Brazil, and Australia. Transfusion 48:1355-1362
- Mohammed H, Linnen JM, Munoz-Jordan JL et al. (2008) Dengue virus in blood donations, Puerto Rico 2005.Transfusion 48:1348-1354
- Petersen LR, Busch MP (2010)Transfusiontransmitted arboviruses. Vox Sang 98:495-503
- Collenberg E, Ouedraogo T, Ganame J et al. (2006) Seroprevalence in six different viruses among pregnant women and blood donors in rural and urban Burkina Faso: A comparative analysis. J Med Virol 78:683-692
- Teichmann D, Göbels K, Niedrig M, Grobusch MP (2004) Dengue virus infection in travellers returning to Berlin, Germany: clinical, laboratory and diagnostic aspects. Acta Trop 90:87-95
- Allwinn R, Hofknecht N, Doerr HW (2008) Dengue in travellers is still underestimated. Intervirology 51:96100
- Jelinek T, Mühlberger N, Harms G et al. (2002) European Network on Imported Infectious Disease Surveillance. Epidemiology and clinical features of imported dengue fever in Europe: sentinel surveillance data from TropNetEurop. Clin Infect Dis 35:1047-1052
- Eisenhut M, Schwarz TF, Hegenscheid B (1999) Seroprevalence of dengue, chikungunya and Sindbis virus infection in German aid workers. Infection 27:82-85
- Murray K, Walker C, Herrington E et al. (2010) Persistent infection with West Nile virus years after initial infection. J Infect Dis 201:2-4
- Dunstan RA, Seed CR, Keller AJ (2008) Emerging vital threats to the Australian blood supply. Austr N Z Public Health 32:354-360
- Wichmann 0, Gascon J, Schunk M et al. (2007) Severe dengue virus infection in travelers: risk factors and laboratory indicators: J Infect Dis 195:1089-1096
- Chotmongkol V, Sawanyawisuth K (2004) Case report: Dengue hemorrhagic fever with encephalopathy in an adult. Southeast Asian J Trop Med Public Health 35:160-161
- Siqueira RC, Vitral NP, Campos WR, Orefice F, de Moraes Figueiredo LT (2004) Ocular manifestations in Dengue fever. Ocul Immunol Inflamm 12:323-327
- Finsterer J, Kongchan K (2006) Severe persisting steroidresponsive Dengue myositis. 1Clin Virol 35:426428
- Chang J, Wang L Ma D et al. (2009) Novel imino sugar derivatives demonstrate potent antiviral activity against flaviviruses. Antimicrob Agents Chemother 53:1501-1508
- Rees CR, Costin JM, Fink RC et al. (2008) In vitro inhibition of dengue virus entry by psulfoxycinnamic acid and structurally related combinatorial chemistries. Antiviral Res 80:135-142
- Lescar J, Luo D, Xu T et al. (2008) Towards the design of antiviral inhibitors against flaviviruses: the case for the multifunctional NS3 protein from dengue virus as a target. Antiviral Res 80:94-101
- Kyle JL, Balsitis SJ, Zhang L, Beatty PR, Harris E (2008) Antibodies play a greater rote than immune cells in heterologous protection against secondary dengue virus infection in a mouse model.Virology 380:296303
- Lisova 0, Hardy F, Petit V, Bedouelle1-1 (2007) Mapping to completeness and transplantation of a groupspecific, discontinuous, neutralizing epitope in the enevelope protein of dengue virus. J Gen Virol 88:2387-2397
- Goncalvez AP, Eng le RE, St Claire M, Purcell RH, Lai C1(2007) Monoclonal antibodymediated enhancement of dengue virus infection in vitro and in vivo and strategies for prevention. Proc Natl Acad Sci USA 104:9422-9427
- Wilder-Smith A, Deen JL (2008) Dengue vaccines for travelers. Expert Rev Vaccines 7:569-578
- Raviprakash K, Wang D, Ewing D et al. (2008) A tetravalent dengue vaccine based on a complex adenovirus vector provides significant protection in rhesus rnonkeys against all four serotypes of dengue virus. J Virol 82:6927-6934
- Sun W, Nisalak A, Gettayacamin Met al. (2006) Protecti on of Rhesus monkeys against dengue virus challenge after tetravalent live attenuated dengue virus vaccination. J Infect Dis 193:1658-1665
- Zhou H, Deem MW (2006) Sculpting the immunological response to dengue fever by polytopic vaccination. Vaccine 24:2451-2459
- Blaney JE, Matro JM, Murphy BR, Whitehead SS (2005) Recombinant, liveattenuated tetravalent dengue virus vaccine formulations induce a balanced, broad, and protective neutralizing antibody response against each of the four serotypes in rhesus monkeys.JVirol 79:5516-5528
- Costa SM, Freire MS, Alves AM (2006) DNA vaccine aga inst the nonstructural 1 protein (NS1) of dengue 2 virus. Vaccine 24:4562-4564
- Widmann DG, Frolov I, Mason PW (2008) Thirdgeneration flavivirus vaccines based on singlecycle, encapsidationdefective viruses. Adv Virus Res 72:77126
- Clements DE, Coller BA, Lieberman MM et al. (2010) Development of a recombinant tetravalent dengue virus vaccine: immunogenicity and efficacy studier in mice and monkeys. Vaccine 28:2705-2715
- Tambyah PA, Koay ES, Poon ML, Lin RV, Ong BK (2008) Transfusion-Transmitted Dengue Infection Study Group. Dengue haemorrhagic fever transmitted by blood transfusion. N Engl J Med 359:15261527
- Chuang VW, Wong TY, Leung YH et al. (2008) Review on Dengue fever cases in Hong Kong during 1998 to 2005. Hong Kong Med J 14:170-177
- Tan FL, Loh DL, Prabhakaran K, Tambyah PA, Yap HK (2005) Dengue haemorrhagic fever after living donor renal transplantation. Nephrol Dial Transplant 20:447-448
- Hirsch JP, Deschamps C, Lhuillier M (1990) Metropolitan transmission of dengue by accidental inoculation at a hospital. Ann Med Interne (Paris) 141:629
- de Wazieres B, Gil H, Vuitton DA, Dupond JL (1998) Nosocomial transmission of dengue from a needlestick injury. Lancet 351:498
- Langgartner 1, Audebert F, Schölmerichl, Glück T (2002) Dengue virus infection transmitted by needle stick injury. J Infect 44:269-270
- Wagner D, de With K, Huzly D et al. (2004) Nosocomial acquisition of dengue. Emerg Infect Dis 10:1872-1873
- Xie YW, Chan PK, Szeto CK et al. (2008) Clearance of dengue virus in the plasmaderived therapeutic Proteins. Transfusion 48:1342-1347
- BG Merkblatt: Berufsgenossenschaft Chemie, Merkblatt 004:, 1998, Jedermann Verlag, Heidelberg
- Willkommen H, Löwer (1993)Theoretical considerations on viral inactivation or elimination. Dev Biol Stand. 81:109-116
- Huang Q Fu WL, Chen B, Huang JF, Zhang X, Xue Q (2004) Inactivation of dengue virus by methylene blue/narrow bandwidth light system. J Photochem Photobiol B 77:39-43
- Singh Y, Sawyer LS, Pinkoski LS et al. (2006) Photochemical treatment of plasma with amotosalen and longwavelength ultraviolet light inactivates pathogens while retaining coagulation function.Transfusion 46:1168-1177
- Gallian P, Vignoli C, Dombey AM et al. (2006) lnactivahon of a European strain of West Nile virus in singledonor platelet concentrate using the INTERCEPT blood system. Vox Sang 91:345-347
- Fang Y, Brault AC, Reisen WK (2009) Comparative thermostability of West Nile, St. Louis encephalitis, and western equine encephalomyelitis viruses during heat inactivation for serologic diagnostics. Am 1 Trop Med Hyg 80:862-863
- Pfleiderer C, Blümel 1, Schmidt Met al. (2008) West Nile virus and blood product safety in Germany. Med Virol 80:557-563
- Thomas SJ (2011) The necessity and quandaries of Dengue vaccine development. JID 203: 299-303
 | ENDE |  |
...
X
⍂
↑
↓
