 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, Biotechnologie
 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, Biotechnologie |
BVL 56/2007/4 - Gentransfer mit Hilfe retroviraler Vektoren
Häufig durchgeführten gentechnischen Arbeiten mit den zugrunde liegenden Kriterien der Vergleichbarkeit
- Aktualisierung der allgemeinen Stellungnahme der Zentralen Kommission für die Biologische Sicherheit (ZKBS) -
Vom 18. September 2007
(BAnz. Nr. 29 vom 21.02.2008 S. 658)
1 Beschreibung des retroviralen Systems
1.1 Allgemeine Einführung
Retroviren (Familie: Retroviridae) sind umhüllte RNA-Viren, die durch das "International Committee an Taxonomy of Viruses" (ICTV) aufgrund ihrer genetischen Nähe in zwei Unterfamilien, die der Orthoretroviren und die der Spumaretroviren, und sieben Gattungen unterteilt wurden.
Das Genom replikationskompetenter Retroviren besteht aus zwei identischen einzelsträngigen RNA-Molekülen mit einer Länge von 7-15 Kb [1]. Sie replizieren über ein doppelsträngiges DNAIntermediat (Provirus), das sich stabil in das Genom der infizierten Zelle integriert. Die drei Gene gag, pol und env sind die Grundbestandteile eines jeden retroviralen Genoms (Abbildung 1).
Abbildung 1:

An beiden Termini des DNA-Genoms (Provirus) befinden sich die sogenannten LTR (long terminal repeat) mit Promotor- und Enhancereigenschaften. Sie beinhalten die repetitiven Sequenzen U3RU5, wobei die Repetition R auch an beiden Termini des RNA-Genoms vorkommt. U5 (unique sequence) bezeichnet eine Nukleotidsequenz, die auf dem RNA-Genom nur am 5'-Ende auftritt, und die als U3 (unique sequence) bezeichnete Sequenz ist im RNA-Genom nur am 3'-Ende vorhanden. Sie sind für die Reverse Transkription des Genoms von Bedeutung. Komplexe Retroviren enthalten über diese Sequenzen hinaus noch verschiedene weitere Leserahmen, deren Genprodukte regulatorische Funktionen übernehmen (siehe Abbildung 1).
1.2 Gentransfer mit Hilfe retroviraler Vektoren
Rekombinante Retroviren für den Gentransfer wurden ursprünglich auf der Basis muriner Retroviren, vor allem dem Moloney Maus Leukämie Virus (MoMLV), entwickelt. Sie transduzieren ausschließlich sich teilende Zellen. Sie können zwar von nichtteilenden Zellen aufgenommen werden, jedoch ist das Nukleokapsid nicht in der Lage, die Kernmembran zu passieren. Erst wenn sich diese während der Zellteilung auflöst, gelangt es in den Kern [2]. Um auch nichtteilende Zellen oder terminal differenzierte Zellen stabil zu transduzieren, werden retrovirale Vektoren hergestellt, die sich von Lentiviren ableiten. Wurden die frühen lentiviralen Vektoren von HIV-1 [3] und SIV (Simian Immunodefizienzvirus) abgeleitet, sind inzwischen auch Vektorsysteme auf Grundlage des FIV (Felines Immundefizienzvirus) [4], EIAV (Equine infectious anemia virus) [5], CAEV (Caprine Arthritis Enzephalitis Virus) [6], BIV (Bovines Immunodefizienzvirus) [7] und MVV (Maedi/Visna Virus) [8] entwickelt worden.
Murine retrovirale Vektoren
Die Herstellung rekombinanter Retroviren, die von murinen Retroviren abgeleitet sind, umfasst zwei Komponenten, den retroviralen Vektor und die Verpackungszelllinie (Abbildung 2). Der retrovirale Vektor ist ein Plasmid, das in der Regel von pBR328 abgeleitet ist. Er kodiert nicht für retrovirale Proteine, sondern verfügt nur über das Verpackungssignal ψ, die Primer-Bindestelle PBS und die retroviralen 5'- und 3'-LTR, die eine Insertionsstelle für das zu übertragende Gen sowie ggf. einen Selektionsmarker flankieren. Die Expression von mehr als einem Transgen wird durch eine bicistronische Expressionskassette, welche die IRES (Internal Ribosome Entry site)-Sequenz aus Picorna-Viren enthält, erreicht. Durch Bindung der Ribosomen an die IRES wird eine capunabhängige Translation der Proteine ermöglicht. Die Verpackungszelllinie stellt die retroviralen Proteine zur Verfügung, die für die Verpackung der Vektor-RNA und somit für die Erzeugung retroviraler Partikel notwendig sind. Die Verpackungszelllinie wird hergestellt, indem Nukleinsäure (Helfergenom), die für die retroviralen Strukturproteine kodiert, in eine Zelllinie eingeführt wird. Bei diesem Helfergenom ist das Verpackungssignal ψ deletiert, so dass virale RNA, die in der Verpackungszelllinie von dem Helfergenom abgelesen wird, nicht in Virionen verpackt wird. Wurden in den ersten konstruierten Verpackungszelllinien die Strukturgene gemeinsam in die Zelle eingeführt, werden gag-pol und env inzwischen getrennt voneinander in die Zelle transfiziert, um Rekombinationsereignisse während der Zellproliferation zu minimieren [9].
Je nach Art der vom Helfergenom exprimierten retroviralen Hüllproteine wird zwischen ecotropen bzw. amphotropen Verpackungszelllinien unterschieden. Der Wirtsbereich ecotroper muriner Retroviren beschränkt sich auf Zellen von Mäusen und Ratten. Amphotrope murine Retroviren besitzen einen breiteren Wirtsbereich, der sowohl murine als auch nichtmurine - auch humane - Zellen einschließt. Zunehmend werden bei der Entwicklung rekombinanter Retroviren die Hüllproteine der murinen Retroviren modifiziert oder ausgetauscht, um einen breiteren Wirtsbereich, einen auf einen bestimmten Zelltyp ausgerichteten Wirtstropismus oder eine höhere Stabilität des Virions zu erzielen (Pseudotypisierung) [10]. Eine Reihe heterolog exprimierter viraler Hüllproteine wurden bereits erfolgreich für eine Pseudotypisierung verwendet. Zu den Spendern gehören z.B. Arenaviren [11], Alphaviren [12] und Vertreter aus den Familien Hepadnaviridae [13], Flaviviridae [14] und Rhabdoviridae. Insbesondere wird das G-Glykoprotein (VSV-G) des Virus der Stomatitis vesicularis (VSV) vielfältig verwendet, um murine Retroviren mit einem breiteren Wirtsbereich auszustatten, der humane Zellen mit einschließt. Die Glykoproteine der umhüllten Viruspartikel binden dabei an spezifische Rezeptoren der Zelloberfäche und initiieren eine Membranfusion. Die Rezeptoren der meisten verwendeten retroviralen Hüllproteine sind funktionell nur basolateral in polarisierten Epithelzellen exprimiert [15]. So konnte eine in vivo Transduktion epithelialer Lungengewebszellen durch VSV-G pseudotypisierte retrovirale Vektoren von apikaler Seite nur gezeigt werden, wenn der Zugang zur basolateralen Oberfläche durch Agenzien ermöglicht wird, die die "tight junctions" öffnen [16, 17]. Darüber hinaus weisen VSVG-Pseudotypretroviren eine höhere Partikelstabilität auf, die eine Konzentrierung der infektiösen Viruspartikel durch Ultrazentrifugation erlaubt.
Ein spezifischer Zelltropismus kann erreicht werden, indem ein Ligand für ein zelluläres Oberflächenprotein, wie z.B. die Erkennungsdomäne eines Antikörpers, in das Hüllprotein muriner Retroviren inseriert wird [18]. Da rekombinante Retroviren mit spezifischem Zelltropismus in erster Linie zur Anwendung in der somatischen Gentherapie dienen sollen, werden hierfür in der Regel Liganden von Epitopen humaner Zellen verwendet.
Abbildung 2:

Herstellung rekombinanter replikationsdefekter Retroviren. Der retrovirale Vektor mit dem zu übertragenden Transgen wird in die Verpackungszelllinie transfiziert, die die retroviralen Strukturproteine konstitutiv exprimiert. Vom retroviralen Vektor werden Transkripte hergestellt, die sowohl translatiert als auch als genomische RNA mit Hilfe der viralen Strukturproteine zu neuen Virionen verpackt werden, welche von der Verpackungszelllinie abgegeben werden.
Abbildung wurde modifiziert nach [19].
Mit Hilfe dieser rekombinanten Retroviren, die in der Regel replikationsdefekt sind, können Zielzellen infiziert werden, in deren Genom sich das von der übertragenen retroviralen RNA umgeschriebene Provirus stabil integriert. Dort werden das übertragene Gen sowie ggf. der Selektionsmarker exprimiert.
Um höhere Virustiter zu erhalten, wurde die sogenannte "Ping-Pong-Amplifikation" entwickelt. Es handelt sich hierbei um ein Verfahren, bei dem die Amplifikation des rekombinanten Retrovirus durch seine abwechselnde Übertragung auf eine amphotrope und eine ecotrope Verpackungszelllinie erreicht wird. Die beiden Verpackungszelllinien werden zu diesem Zweck kokultiviert [20, 21, 22].
Lentivirale Vektoren
Lentiviren besitzen ein komplexes Genom (Abbildung 1). Die Möglichkeit, auch nichtteilende Zellen zu transduzieren, beruht auf der Fähigkeit des lentiviralen Präintegrationskomplexes die intakte Kernmembran zu passieren [3, 23]. Dieser Präintegrationskomplex setzt sich aus dem vom pol-Gen kodierten Enzym Integrase, dem vpr-Genprodukt, dem vom gag-Gen kodierten Matrixprotein, der ebenfalls vom pol-Gen kodierten reversen Transkriptase sowie den viralen RNAs zusammen. Zusätzlich zu den üblicherweise bei Retroviren vorkommenden regulatorischen Elementen wie LTR, dem Verpackungssignal 'tp und den Strukturgenen gag, pol und env verfügen Lentiviren über weitere Elemente und Leserahmen. Der lentivirale transkriptionelle Transaktivator (tat) aktiviert die virale Transkription über Bindung des Tat-Proteins an die "tat activation region" (tar), eine cis regulatorische Sequenz, die am 5'-Ende der viralen RNA und DNA gelegen ist. Rev (regulator of expression of the virion) vermittelt den Transport einfachgespleißter und ungespleißter viraler RNA aus dem Kern durch Interaktion mit dem "rev responsive element", RRE und ermöglicht deren Translation im Zytoplasma. Die sogenannten akzessorischen Gene vif, vpr, vpu und nef sind für die Virusreplikation in Zellkultur nicht essenziell. Vif (viral infectivity factor) erhöht die Infektiösität der Virionen in primären T-Zellen. Vpr (virionassoziiertes Protein) ist am nukleären Import des Präintegrationskomplexes beteiligt. Nef und Vpu beeinflussen die Infektiösität der Virionen. Nef wird dabei mit einer verringerten Expression von CD4-Rezeptoren und MHC-IAntigenen an der Zelloberfläche infizierter Zellen in Verbindung gebracht und Vpu degradiert CD4-Rezeptoren im ER und verhindert so eine Komplexierung mit dem Hüllprotein.
Die Entwicklung lentiviraler Vektoren gewinnt insbesondere für die Gentherapie an Bedeutung. Jedoch besteht wegen der Pathogenität von Lentiviren Besorgnis hinsichtlich der Sicherheit dieser Vektoren. Dabei stellt insbesondere die mögliche Entstehung replikationskompetenter Lentiviren während der Vektorherstellung ein Problem dar. Durch die Verwendung eines Drei- oder Vier-Plasmid-Systems, welches ein Vektor-, ein Verpackungs- und ein oder zwei weitere Plasmide (Hüllproteingen und Rev-Proteingen) umfasst, konnte die Möglichkeit der Rekombination zu replikationskompetenten Lentiviren minimiert werden. Ein minimales Vektorplasmid enthält dabei die cisaktiven Sequenzen, die für die Verpackung, reverse Transkription und Integration essenziell sind. Diese beschränken sich auf die LTR, das Verpackungssignal sp, die Primer-Bindestelle (PBS) und den Polypurintrakt (PPT) und das entsprechende Transgen gegebenenfalls mit einem heterologen Promotor (siehe Abbildung 3a). Aktuelle Konstrukte basieren auch auf induzierbaren Systemen, z.B. durch Tetracyclin oder Ecdyson [24, 25], bzw. gewebespezifische Promotoren [26]. Wird für den Export der mRNA-Moleküle in das Zytoplasma das rev-RRE-System von HIV verwendet, muss der Vektor zusätzlich die RRE-Sequenz enthalten. Die für die Infektion der Zielzelle benötigten Proteine werden in trans zur Verfügung gestellt. Um die Effizienz des Gentransfers zu erhöhen, können jedoch auch zusätzlich regulatorische Sequenzen in den Vektor eingefügt werden. Der zentrale Polypurin-Trakt (cPPT) unterstützt beispielsweise die Translokation des Präintegrationskomplexes in den Zellkern [27]. Ein weiteres Beispiel ist das posttranskriptionale regulatorische Element des Murmeltier Hepatitis Virus (WPRE). Es erhöht die RNA-Stabilität und vermittelt so eine höhere Expressionsrate des Transgens [28, 29].
Da Lentiviren einen eingeschränkten Zelltropismus aufweisen, werden die von ihnen abgeleiteten Vektoren in der Regel mit solchen Hüllproteinen pseudotypisiert, die den Zelltropismus erweitern. Oft wird dafür das env-Gen des amphotropen MLV, meistens jedoch das VSV-G verwendet [30]. Darüber hinaus wurden eine Reihe weiterer heterolog exprimierter viraler Hüllproteine bereits erfolgreich für eine Pseudotypisierung eingesetzt (z.B. Lyssaviren [31], Baculoviren [32], Filoviren [33] und Alphaviren [34]).
Aufgrund der zytotoxischen Eigenschaften der HIV Gag/Pol Proteine ist die Etablierung von Verpackungszelllinien für lentivirale Vektorsysteme nur in induzierbaren oder attenuierten Systemen möglich [35]. Üblicherweise werden die drei oder vier Plasmide, auf welchen die für die Vektorherstellung notwendigen Gene und regulatorischen Sequenzen verteilt sind, auf eine Zelllinie kotransfiziert (siehe Abbildung 3). Dort werden replikationsdefekte lentivirale Vektoren verpackt und von der Zelllinie abgegeben.
Abbildung 3: Komponenten für die Herstellung HIV basierender lentiviraler Vektoren. Vier Plasmide werden für die Herstellung eingesetzt:

Die Abbildung wurde modifiziert nach [36].
Eine weitere Sorge um die Sicherheit, die allerdings nicht nur lentivirale Vektoren sondern ebenso MLV-abgeleitete Vektoren betrifft, ist die Möglichkeit der Aktivierung zellulärer Onkogene durch die zufällige Integration des Vektorprovirus in das Wirtsgenom. Dabei kann die Aktivierung auf drei Ebenen erfolgen: (1) der Vektor beeinflusst benachbarte Enhancer oder Promotorelemente der Zelle und dadurch die Genexpression, (2) Promotor und Enhancer des integrierten Provirus aktivieren benachbarte zelluläre Onkogene, (3) die Anwesenheit der Vektor-DNA kann zu Veränderungen in der Chromatinstruktur regulatorischer Domänen führen und darüber die Genexpression beeinflussen. Bei den sogenannten selbstinaktivierenden (SIN) Vektoren wurde die U3-Region des 3'-LTR deletiert, wodurch die darin enthaltenen Promotor- und Enhancereigenschaften verloren gehen [3, 27, 37]. Einerseits ist dadurch eine potenzielle Aktivierung benachbarter zellulärer Gene eingeschränkt. Zum anderen würde die Deletion während eines viralen Replikationszyklus zum 5'-LTR gelangen, wodurch auch die Vektorexpression abgeschaltet wäre und darüber hinaus die Mobilisierung des integrierten Vektorprovirus verhindert wird (siehe Abbildung 4).
Abbildung 4: Selbstinaktivierender (SIN) Vektor
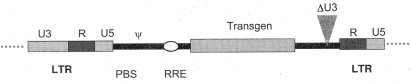
Als zusätzliche Sicherheitsmaßnahme kann bei den Vektoren die PBS mutiert vorliegen, so dass keine zelluläre tRNA angelagert werden kann. Für die Erzeugung der Vektoren ist dann eine entsprechend mutierte tRNA erforderlich, die in trans, entweder als synthetisierte tRNA oder als Pol-IIl-Gen auf einem kotransfizierten Plasmid, zur Verfügung gestellt wird [38].
Das Einführen chromosomaler Insulatoren in das Vektorkonstrukt und die Anwendung zell- und gewebespezischer Promotoren stellen weitere Strategien dar, eine Aktivierung zellulärer Onkogene durch unspezifische Integration zu verhindern. Inzwischen geht die Entwicklung der Vektoren dahin, dass eine Integration gezielt in unschädliche Bereiche des menschlichen Genoms erfolgen kann. Die Experimente zielen auf eine Modifikation der Integrase, z.B. durch Insertion einer spezifischen DNA-bindenden Domäne [39, 40, 41].
Adenovirus/Retrovirus-Hybridvektoren
Um eine effiziente Genübertragung und eine dauerhafte Genexpression zu erreichen, werden chimäre Vektoren auf der Basis adenoviraler und retroviraler Vektoren entwickelt [42, 43]. Drei replikationsdefekte adenovirale Vektoren übertragen nach Koinfektion jeweils den retroviralen Vektor, die retroviralen Verpackungsfunktionen (gag/pol-Bereich) und ein env-Gen auf eine Zelle, die damit zur retroviralen Produzentenzelle wird. Die abgegebenen retroviralen Vektoren können dann weitere Zellen stabil transduzieren. Die Risikobewertung der Herstellung adenoviralen Vektoren erfolgt gemäß der allgemeinen Stellungnahme der ZKBS zu häufig durchgeführten gentechnischen Arbeiten mit den zugrunde liegenden Kriterien der Vergleichbarkeit: Gentransfer mit Hilfe von Adenovirus Typ 5, Az.: 6790-10-28, 2. geänderte Fassung vom November 2001, die Risikobewertung von Zellen nach Koinfektion aller drei adenoviraler Vektoren orientiert sich - wie bei einer mit einem retroviralen Plasmid transfizierten Verpackungszelllinie - an der Abgabe retroviraler Vektoren.
2 Zusammenfassung relevanter Kriterien für die Sicherheitseinstufung gentechnischer Arbeiten zum Gentransfer mit Hilfe retroviraler Vektoren
Das Gefährdungspotenzial beim Umgang mit rekombinanten Retroviren, die von murinen Retroviren abgeleitet sind, wird als gering bewertet, auch wenn es sich nicht um humane Krankheitserreger handelt. Im Verlauf der Infektion integriert das provirale Genom ungerichtet in das Genom der Wirtszelle und könnte in Einzelfällen durch Insertionsmutagenese die Aktivierung zellulärer Onkogene oder die Änderung der Transkriptionsaktivität anderer regulatorischer Gene induzieren. Das Risiko dieses Ereignisses wird durch die Vermehrungsfähigkeit im Wirt, durch die potenziellen Zielzellen sowie durch natürliche Abwehrmechanismen des infizierten Organismus definiert. Natürlich vorkommende Infektionen des Menschen mit murinen Retroviren sind nicht bekannt. Außerdem haben diese Retroviren eine geringe physikalische Stabilität. Eine Übertragung über den Luftweg ist nicht beschrieben. Maßgeblich für die Sicherheitseinstufung gentechnischer Arbeiten mit rekombinanten murinen Retroviren im Einzelnen ist das von den verpackten rekombinanten Retroviren erreichte Wirtsspektrum.
Bei ecotropen murinen Retroviren ist in der Regel ein Gefährdungspotenzial für Menschen oder Tiere nicht anzunehmen (siehe ZKBS-Stellungnahme zur Risikobewertung ecotroper muriner C-Typ-Retroviren). Bei amphotropen murinen Retroviren kann ein geringes Gefährdungspotenzial für den Menschen nicht ausgeschlossen werden, da Primatenzellen sowohl in vitro als auch unter bestimmten Bedingungen in vivo mit amphotropen Retroviren infizierbar sind [1, 44]. Es besteht jedoch für den Menschen und Altweltaffen ein Schutz vor Infektion mit murinen Retroviren. Durch das Glykosylierungssystem der Mauszellen kommt es zur Ausbildung des sogenannten Gal-Epitops sowohl auf zellulären als auch auf retroviralen Glykoproteinen, welche Bestandteile der Virushülle bilden. Die Interaktion mit im humanen Blut zirkulierenden anti-a-Gal-Antikörpern aktiviert das Komplementsystem, was eine Lyse der retroviralen Partikel zur Folge hat [45].
Eine Vermehrungsfähigkeit rekombinanter Retroviren ist dann gegeben, wenn durch Rekombinationsereignisse zwischen homologen Sequenzen des Helfergenoms der Verpackungszelllinie und des Vektorgenoms replikationskompetente Retroviren entstehen. Solch ein Ereignis ist abhängig vom verwendeten Vektor-/Verpackungszelllinien System. Sicherheit kann gewährleistet werden durch geringe Sequenzhomologien zwischen Helfer- und Vektorgenom und eingeführten Stop-Codons, Mutationen und Deletionen, die im Falle einer Rekombination zu einem Replikationsdefekt führen. Als Beispiel sei die amphotrope Verpackungszelllinie PA317 angeführt. Wurde bei Transfektion der Zelllinie mit dem Vektor N2 das Auftreten replikationskompetenter Retroviren beschrieben [46], sind LN abgeleitete Vektoren so konstruiert, dass im Falle einer Rekombination nur replikationsdefekte Retroviren entstehen können [47]. Des Weiteren wird ein Rekombinationsereignis verringert, wenn Verpackungszelllinien verwendet werden, die die Gene gag/pol und das Hüllproteingen env getrennt voneinander vorliegen haben. Dies trifft vor allem dann zu, wenn rekombinante Retroviren mit veränderten Hüllproteinen erzeugt werden. Gewissheit zum Auftreten relikationskompetenter amphotroper Retroviren bietet z.B. der S+L-Assay [48]. Dabei wird der zu testende Zellkulturüberstand auf PG-4 Zellen gegeben. PG-4 Zellen enthalten ein defektes Moloney Maus Sarcoma Virus (M-MSV). Sind replikationskompetente Retroviren im Überstand vorhanden, können die Defekte des M-MSV komplementiert werden, und es bilden sich Foci.
Bei Verwendung von ecotropen Verpackungszelllinien, die replikationskompetente Retroviren erzeugen können, liegt kein Gefährdungspotenzial für Menschen und Tiere vor.
Retroviren mit veränderten Hüllproteinen infizieren in der Regel humane und andere Zellen. Das von ihnen ausgehende Gefährdungspotenzial entspricht dem von amphotropen murinen Retroviren. Bei Verwendung des Hüllproteins des Katzenvirus RD114 oder des Affenvirus SSAV findet jedoch keine effiziente Inaktivierung der entsprechenden Pseudotypen statt [49, 50]. Für Pseudotypen mit dem VSV-G-Protein konnte eine effiziente Inaktivierung durch das Komplementsystem nachgewiesen werden [51]. Beim experimentellen Umgang mit Pseudotypen ist zu berücksichtigen, dass der Vektor auch andere Übertragungswege als die des Wildtyp-Virus benutzen kann [10].
Bei der Herstellung lentiviraler Vektoren ist deren Replikationsinkompetenz sicherheitsrelevant. Die Möglichkeit einer homologen Rekombination zwischen überlappenden retroviralen DNA-Sequenzen im Vektor und den Helfer-Konstrukten könnte zur Entstehung vermehrungsfähiger Lentiviren führen, die pathogen sind und als Wildtypviren der Risikogruppe 3* * zugeordnet sind. Die Verwendung codonoptimierter Verpackungplasmide reduziert den Grad der Homologie und die Länge homologer Bereiche zwischen Verpackungsplasmid und Vektor und kann daher zur Reduktion des Risikos der Entstehung vermehrungsfähiger Lentiviren beitragen [52]. Nur das Gefährdungspotenzial replikationsdefekter lentiviraler Vektoren entspricht dem Gefährdungpotenzial amphotroper muriner retroviraler Vektoren.
3 Kriterien der Vergleichbarkeit gentechnischer Arbeiten zum Gentransfer mit Hilfe retroviraler Vektoren
Im Folgenden werden allgemeine Kriterien der Vergleichbarkeit bei gentechnischen Arbeiten zum Gentransfer mit Hilfe retroviraler Vektoren zusammengefasst.
Hinweis:
Kriterien:
Einbringen retroviraler einschließlich lentiviraler Vektoren in E. coli:
3.1 Werden subgenomische virale oder zelluläre Nukleinsäureabschnitte mit Hilfe der o. g. murinen retroviralen oder lentiviralen Vektoren in ein E. coli K12-Derivat eingeführt, so sind die gentechnisch veränderten Organismen der Risikogruppe 1 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 1 zuzuordnen.
Erzeugung ecotroper Retroviren in einer Zelllinie:
3.2 Werden subgenomische virale oder zelluläre Nukleinsäureabschnitte mit Hilfe der o. g. murinen retroviralen Vektoren in eine ecotrope Verpackungszelllinie der Risikogruppe 1 eingeführt, so sind die gentechnisch veränderten Organismen der Risikogruppe 1 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 1 zuzuordnen.
3.3 Rekombinante replikationsdefekte ecotrope murine Retroviren, die von den unter 3.2. beschriebenen Verpackungszelllinien abgegeben werden, sind der Risikogruppe 1 zuzuordnen, auch wenn von einer Kontamination mit replikationskompetenten ecotropen Retroviren auszugehen ist. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, einschließlich der Infektion weiterer Zellen der Risikogruppe 1 sowie der Inokulation von Tieren, sind miteinander vergleichbar und der Sicherheitsstufe 1 zuzuordnen.
3.4 Zellen der Risikogruppe 1, die mit den unter Nummer 3.3 beschriebenen rekombinanten replikationsdefekten ecotropen Retroviren infiziert worden sind, sind der Risikogruppe 1 zuzuordnen, sofern die infizierten Zellen keine Retroviren mit erweitertem Wirtsbereich abgeben. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 1 zuzuordnen.
Erzeugung amphotroper Retroviren in einer Zelllinie:
3.5 Werden amphotrope Verpackungszelllinien der Risikogruppe 1 mit den unter Nummer 3.3 beschriebenen ecotropen Retroviren infiziert, sind die gentechnisch veränderten Organismen der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
3.6 Werden subgenomische virale oder zelluläre Nukleinsäureabschnitte mit Hilfe der o. g. retroviralen Vektoren in amphotrope Verpackungszelllinien der Risikogruppe 1 eingeführt, sind die gentechnisch veränderten Organismen der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
3.7 Werden subgenomische virale oder zelluläre Nukleinsäureabschnitte mit Hilfe der o. g. retroviralen Vektoren in eine Kokultur von ecotropen und amphotropen Verpackungszelllinien der Risikogruppe 1 eingeführt, sind die gentechnisch veränderten Organismen der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
3.8 Rekombinante replikationsdefekte murine Retroviren, die von den unter den Nummern 3.5, 3.6 oder 3.7 beschriebenen Verpackungszelllinien abgegeben werden, sind der Risikogruppe 2 zuzuordnen, auch wenn von einer Kontamination mit replikationskompetenten amphotropen Retroviren auszugehen ist. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, einschließlich der Infektion weiterer Zellen der Risikogruppe 1 sowie der Inokulation von Tieren, sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
Erzeugung von Lentiviren in einer Zelllinie:
3.9 Werden die unter Nummer 3.1 genannten lentiviralen Vektoren gemeinsam mit weiteren pBR328-abgeleiteten Vektoren, welche subgenomische Nukleinsäureabschnitte, die der lentiviralen Verpackung dienen in Zelllinien der Risikogruppe 1 eingeführt, sind die gentechnisch veränderten Organismen der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
3.10 Rekombinante replikationsdefekte Lentiviren, die von den unter Nummer 3.9 beschriebenen Zelllinien abgegeben werden, sind der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, einschließlich der Infektion weiterer Zellen der Risikogruppe 1 sowie der Inokulation von Tieren sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
Infektion von Zellen mit rekombinanten Retro- einschließlich Lentiviren:
3.11 Zellen der Risikogruppe 1 die mit den unter den Nummern 3.8, 3.10, 3.17 oder 3.19 beschriebenen rekombinanten replikationsdefekten Retroviren infiziert worden sind, bei denen nicht von einer Kontamination mit replikationskompetenten Retroviren auszugehen ist, sind der Risikogruppe 1 zuzuordnen, sofern die Zellen den Replikationsdefekt nicht komplementieren. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 1 zuzuordnen.
3.12 Zellen der Risikogruppe 1, die mit den unter Nummer 3.8 beschriebenen rekombinanten replikationsdefekten amphotropen Retroviren infiziert worden sind, sind der Risikogruppe 2 zuzuordnen, wenn von einer Kontamination mit replikationskompetenten Retroviren auszugehen ist oder wenn die Zellen den Replikationsdefekt komplementieren. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
3.13 Primäre humane Zellen der Risikogruppe 2, die mit den unter den Nummern 3.3, 3.8, 3.10, 3.17 oder 3.19 beschriebenen rekombinanten Retroviren infiziert worden sind, sind der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
Retro- einschließlich Lentiviren mit modifizierten Hüllen:
3.14 Werden subgenomische virale oder zelluläre Nukleinsäureabschnitte mit Hilfe der o. g. lentiviralen Vektoren in Zelllinien der Risikogruppe 1 eingeführt, und replikationsdefekte lentivirale Partikel mit Hüllproteinen ecotroper MLV-gebildet, so sind die gentechnisch veränderten Organismen der Risikogruppe 1 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 1 zuzuordnen.
3.15 Rekombinante replikationsdefekte Lentiviren, die von den unter Nummer 3.14 beschriebenen Zelllinien abgegeben werden, sind der Risikogruppe 1 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, einschließlich der Infektion weiterer Zellen der Risikogruppe 1 sowie der Inokulation von Tieren sind miteinander vergleichbar und der Sicherheitsstufe 1 zuzuordnen.
3.16 Werden subgenomische virale oder zelluläre Nukleinsäureabschnitte mit Hilfe der o. g. murinen retroviralen Vektoren in Verpackungszelllinien der Risikogruppe 1 eingeführt, die gag/pol vom MLV und die Hüllproteine anderer Viren wie z.B. GaLV, VSV oder rekombinante MLV-Hüllproteine exprimieren, entstehen replikationsdefekte, pseudotypisierte retrovirale Partikel. Die gentechnisch veränderten Organismen sind der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
3.17 Rekombinante replikationsdefekte Retroviren, die von den unter Nummer 3.16 beschriebenen Verpackungszelllinien abgegeben werden, sind der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, einschließlich der Infektion weiterer Zellen der Risikogruppe 1 sowie der Inokulation von Tieren sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
3.18 Werden subgenomische virale oder zelluläre Nukleinsäureabschnitte mit Hilfe der o. g. lentiviralen Vektoren in Zelllinien der Risikogruppe 1 eingeführt, und replikationsdefekte lentivirale Partikel mit Hüllproteinen anderer Viren wie z.B. GaLV, VSV, RD114 oder rekombinanten MLV-Hüllproteinen, die den Liganden für ein zelluläres Oberflächenprotein enthalten, gebildet, so sind die gentechnisch veränderten Organismen der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
3.19 Rekombinante replikationsdefekte Lentiviren, die von den unter Nummer 3.18 beschriebenen Zelllinien abgegeben werden, sind der Risikogruppe 2 zuzuordnen. Gentechnische Arbeiten mit gentechnisch veränderten Organismen, die die genannten Kriterien erfüllen, einschließlich der Infektion weiterer Zellen der Risikogruppe 1 sowie der Inokulation von Tieren sind miteinander vergleichbar und der Sicherheitsstufe 2 zuzuordnen.
Hinweis:
Werden Nukleinsäureabschnitte mit onkogenem Potenzial übertragen, so sind beim Umgang mit solchen GVO die gleichen Vorsichtsmaßnahmen für den Personenschutz einzuhalten, wie sie die ZKBS auch in ihrer "Empfehlung für Vorsichtsmaßnahmen beim Umgang mit Nukleinsäuren mit onkogenem Potential" vom September 1991 aufgeführt hat.
Werden bei gentechnischen Arbeiten zur Übertragung von Nukleinsäureabschnitten mit onkogenem Potenzial lentivirale Vektoren verwendet, welche durch Pseudotypisierung eine verstärkte Partikelstabilität oder ein Wirtsspektrum für humane Epithelzellen erhalten oder welche durch ein verändertes Glykosylierungsmuster durch das humane Komplementsystem nicht erkennbar sind, wird zur Vermeidung einer Schmierinfektion empfohlen, zusätzlich zu den Maßnahmen der Sicherheitsstufe 2, einen Mund- und Nasenschutz zu tragen. Die Kriterien für Nukleinsäuren mit onkogenem Potenzial sind in der Allgemeinen Stellungnahme der ZKBS zu adenoviralen Vektoren mit Zellzyklusregulierenden Genen (Mai 2004) festgelegt.
Gentechnische Arbeiten mit Retro- einschließlich Lentiviren an Tieren:
Hinweis:
Da davon auszugehen ist, dass bei den unter den Nummern 2, 3 und 4 genannten Tieren einzelne somatische Zellen die übertragene rekombinante Nukleinsäure für eine unbestimmte Zeit enthalten, wird empfohlen, die Tierkörper so zu beseitigen, dass ihre Bestandteile nicht in die Nahrungskette gelangen können.
4 Literatur
[1] Levy, J. A. (1995). The Retroviridae, Plenum Press, New York.
[2] Roe T, Reynolds TC, Yu G, Brown PO (1993). Integration of murine leukemia virus DNA depends an mitosis. EMBO J. 1993.May;12(5):2099-108.
[3] Naldini, L., Blömer, U., Gallay, P., Ory, D., Mulligan, R., Gage, F. H., Vorma, L M., and Trono, D. (1996). In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science 272: 263-267.
[4] Poeschla E, Wong-Staal F, Looney D (1998). Efficient transduction of nondividing cells by feline immunodeficiency virus lentiviral vectors. Nat Med 4 (3): 354-357.
[5] Poeschla EM (2003). Nonprimate lentiviral vectors. Curr Opin Mol Ther. Oct;5(5):529-40
[6] Mselli-Lakhal L, Favier C, Da Silva Teixeira MF, Chettab K, Legras C, Ronfort C, Verdier G, Mornex JF, Chebloune Y (1998). Defective RNA packaging is responsible for low transduction efficiency of CAEV-baes vectors. Arch Virol 143 (4): 681-695
[7] Berkowitz R, Ilves H, Lin WY, Eckert K, Coward A, Tamaki S, Veres G, Plavec I (2001). Construction and molecular analysis of gene transfer systems derived from bovine immunodeficiency virus. J. Virol 75 (7): 3371-3382.
[8] Berkowitz R, Ilves H, Plavec 1, Veres G (2001). Gene transfer systems derived from Visna virus: analysis of virus production and infectivity. Virology 279 (1):116-129.
[9] Danos, O. and Mulligan, R. C. (1988). Safe and efficient generation of recombinant retroviruses wich amphotropic and ecotropic host ranges. Proc. Natl. Acad. Sci. USA 85: 6460-6464.
[10] Sanders DA (2002). No false start for novel pseudotyped vectors. Curr Opin Biotechnol. 13: 437-442.
[11] Beyer WR, Westphal M, Ostertag W, von Laer D (2002). Oncoretrovirus and lentivirus vectors pseudotyped with lymphocytic choriomeningitis virus glycoprotein: generation, concentration, and broad host range J. Virol 76: 1488-1495
[12] Kolokoltsov AA, Weaver SC, Davey RA. (2005). Efficient hmctional pseudotyping of oncoretroviral and lentiviral vectors by Venezuelian equine encephalitis virus envelope proteins. J. Virol. 79: 756-763.
[13] Sung VM, Lai MM (2002). Murine retroviral pseudotype virus containing hepatitis B virus large and SMALL surface antigens confers specific tropism for primary human hepatocytes: a potential liver specific targeting System. J. Virol 76: 912-917.
[14] Hsu et al. (2003). Hepatitis C virus glycoproteins mediate pH dependent cell entry of pseudotyped retroviral particles. Proc. Natl. Acad. Sci USA 100:7271-7276.
[15] Compans RW (1995). Virus entry and release in polarized epithelial cells. Curr. Top. Microbiol. Immunol. 202: 209-219.
[16] Wang G et al. (1999). Feline immunodeficiency virus vectors persistently transduce nondiving airway epithelia and correct the cystic fibrosis defect. J. Clin. Invest. 104: R55-R62.
[17] Kobinger GP, Weiner DJ, Yu QC, Wilson JM (2001). Filoviruspseudotyped lentiviral vector can efficiently and stably transducer airway epithelia in vivo. Nature Biotechnol. 19: 225-230.
[18] Russell, S. R., Hawkins, R. E., and Winter, G. (1993). Retroviral vectors displaying functional antibody fragments. Nucleic Acids Res. 21: 1081-1085.
[19] Mitani, K., and Caskey, C. T. (1993). Delivering therapeutic genes - matching approach and application. TIBTech 11, 162-166.
[20] Kozak, S. L., and Kabat, D. (1990). Ping-Pong amplification of a retroviral vector achieves highlevel gene expression: Human growth hormone production. J. Virol. 64: 3500-3508.
[21] Lynch CM & Miller AD (1991). Production of High-Titer Helper Virus-Free Retroviral Vectors by Cocultivation of Packaging Cells with Different Host Ranges. J Virol 65 (7): 3887-3890.
[22] Gerstmayer B et al. (1999). Stahle expression of the ecotropic retrovirus receptor in amphotropic packaging cells facilitates the transfer of recombinant vectors and enhances the yield of retroviral particles. J Virol Methods 81: 71-75.
[23] Fouchier RA, Malim MH (1999). Nuclear import of human immunodeficiency virus typel preintegration complexes. Adv. Virus Res. 52: 275-99.
[24] Vigna E et a1., (2002). Robust and efficient regulation of transgene expression in vivo by improved tetracyclinedependent lentiviral vectors. Mol Therapy 5: 252-261.
[25] Galimi F et al. (2005). Development of ecdysoneregulated lentiviral vectors. Mol Therapy 11:142-148.
[26] Follenzi A et al. (2002). Efficient gene delivery and targeted expression to hepatocytes in vivo by improved lentiviral vectors. Hurn Gene Ther. 13: 243-260.
[27] Logan AC et al., (2004). Factors influencing the titer and infectivity of lentiviral vectors. Hum Gene Therapy 15: 976-988.
[28] Brun S et al., (2003). Optimization of transgene expression at the posttranscriptional level in neural cells: implication for gene therapy. Mol Ther 7: 782-789.
[29] Zufferey R, Donello JE, Trono D, Hope TJ (1999). Woodchuck hepatitis virus posttranscriptional regulatory element enhances expression of transgenes delivered by retroviral vectors. J Virol. 73(4):2886-92
[30] Naldini, L., Blömer, U., Gage, F. H., Trono, D., and Verma, L M. (1996). Efficient transfer, integration and sustained longterm expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. USA 93: 11.382-11.388.
[31] Sena-Esteves M, et al., (2004) Optimized ]arge scale production of high titer lentivirus vector pseudotypes. J Virol Methods 122: 131-139
[32] Kurrar M, Bradow BP, Zimmerberg J. (2003). Largescale production of pseudotyped lentiviral vectors using baculovirus GP64. Hum Gene Ther 2003; 14: 67-77
[33] Sinn PL et al. (2003). Lentivirus vectors pseudotyped with filoviral envelope glycoproteins transducer airway epithelia from the apical surface independently of folate receptor alpha. J Virol 77:5902-5910.
[34] Kang Y et al.(2002). In vivo gene transfer using a nonprimate lentiviral vector pseudotyped with Ross River Virus glycoprotein. J. Virol 76: 9378-9388.
[35] Ikeda Y, Takeuchi Y, Martin F, Cosset FL, Mitropheanous K, Collins M (2003). Continous hightiter HIV-1 vector production. Nat Biotechnol 21(5): 569-72.
[36] Sinn PL, Slauter SL and McCray PB (2005). Gene therapy Progress and Prospects: Development of improved lentiviral and retroviral vectorsdesign, biosafety and production. Gene Therapy 12: 1089-1098.
[37] Miyoshi, H., Blömer, U., Takahashi, M., Gage, F., and Verma, I. M. (1998). Development of a selfinactivating lentivirus vector. J. Virol 72: 8150-8157.
[38] Grunwald T, Pedersen FS, Wagner R, Überla K (2004). Reducing mobilization of simian immunodeficiency virus based vectors by primer complementation. J. Gene Med. 6: 147-154.
[39] Bushman FD (2002). Integration site selection by lentiviruses: biology and possible control. Gurr Top Microbiol Immunol 261: 156-177.
[40] Tan W et al. (2004). Fusion proteins consisting of human immunodeficiency virus type 1 integrase and the designsed polyadenylatyl zinc finger protein E2C direct integration of viral DNA into specific sites. J Virol 78: 1301-1313.
[41] Zhu Y, Dai J, Fuerst PG, Voytas DF (2003). From the cover: Controlling integration specifity of the yeast retrotransposon. Proc Natl Acad Sci USA 100: 5891-5895.
[42] Bilbao, G., Feng, M., Rancourt, C., Jackson Jr., W. H., and Curiel, D. T. (1997). Adenoviral/retroviral vector chimeras: a novel strategy to achieve highefficiency stable transduction in vivo. FASEB J. 11: 624-634.
[43] Duisit, G., Salvetti, A., Moullier, P., and Cosset, F.-L. (1999). Functional characterization of adenoviral/retroviral chimeric vectors and their use for efficient screening of retroviral producer lines. Human Gene Ther. 10: 189-200.
[44] Cornetta, K., Moen, R. C., Culver, K., Morgan, R. A., McLachlin, J. R., Sturm, S., Selegue, J., London, W., Blaese, M., and Anderson, W. F. (1990). Amphotropic murine leukemia retrovirus is not an acute pathogen for primates. Hum. Gene Ther. 1: 15-30.
[45] Rother, R. P., Squinto S. P., Mason J. M., and Rollins, S. A. (1995). Protection of retroviral vector particles in human blond through complement inhibition. Human Gene Therapy 6: 429-235.
[46] Bosselman RA, Hsu RY, Bruszewski J, Hu S, Martin F, Nilson M (1987). Replicationdefective chimeric helper proviruses and factors affecting generation of competent virus: expression of Moloney murine leukemia virus structural genes via the metallothionein promoter. Mol Gell Biol.7(5):1797-806
[47] Miller, A. D. and Rosman, G. J. (1989). Improved retroviral vectors for gene transfer and expression. BioTechniques 7: 980-990.
[48] Happala D. K., Robey, W. G., Oroszlan, S. D. and Tsai, W. P., (1985). Isolation from cats of an endogenous type C virus with a novel envelope glycoprotein. J. Virol. 53, pp. 827-833
[49] Takeuchi, Y., Cosset, F. L., Lachmann, P. J., Okada, H., Weiss, R. A., and Collins, M. K. (1994). Type C retrovirus inactivation by human complement is determined by both the viral genome and the producer Gell. J. Virol. 68: 8001-8007.
[50] Cosset, F. L., Takeuchi, Y., Battini, J. L., Weiss, R. A., and Collins, M. K. (1995). Highfiter packaging cells producing recombinant retroviruses resistant to human serum. J. Virol. 69: 7430-7436.
[51] DePolo NJ, Reed JD, Sheridan PL, Townsend K, Sauter SL, Jolly DJ, Dubinsky TW (2000). VSV-G pseudotyped lentiviral vector particles produced in human cells are inactivated by human serum. Mol Ther. 2:218-222.
[52] Wagner R, Graf M, Bieler K, Wolf H, Grunwald T, Foley P, Überla K. (2000). Revindependent expression of synthetic gagpol genes of human immunodeficiency virus type 1 and simian immunodeficiency virus: implications for the safety of lentiviral vectors. Hum. Gene. Ther. 11:2403-13.
 | ENDE |