 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. ▢ Regelwerk |  |
Richtwerte für 2-Ethylhexanol in der Innenraumluft
Fassung 2013
(Bundesgesundheitsbl.
Nr. 4 vom 01.04.2013 S. 590)
- Mitteilung der Ad-hoc-Arbeitsgruppe Innenraumrichtwerte der Kommission Innenraumlufthygiene und der Obersten Landesgesundheitsbehörde -
Bekanntmachung des Umweltbundesamtes
1 Stoffidentifikation
IUPAC-Name: 2-Ethyl-1-hexanol
Synonyme: 2-Ethylhexan-1-ol, 2-Ethylhexanol-1, 2-Ethylhexylalkohol, 2-Ethyl-n-hexylalkohol, Isooctanol
CLP-Index-Nr.: n. a.
EG-Nr.: 203-234-3
CAS-Nr.: 104-76-7
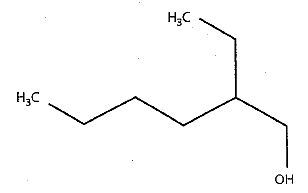
Summenformel: C8H18O
Strukturformel
Abb 1
1.1 Physikalisch-Chemische Eigenschaften [1, 2, 3]
Molekulargewicht: 130,23 g/Mol
Schmelzpunkt: -75°C
Siedepunkte: 184,5°C bei 1013 hPa
Dichte: 0,83 g/cm3 bei 20°C
Dampfdruck: 0,3 hPa bei 20°C
Verteilungskoeffizient log Pow: 2,28
Wasserlöslichkeit: 1-27 g/L bei 20°C
Umrechnung (1013 hPa/20°C): 1 ml/ m3=5,42 mg/m3; 1 mg/m3=0,185 ml/m3
1.2 Stoffeigenschaften und Verwendung
2-Ethyl-l-hexanol (EH) ist eine farblose Flüssigkeit mit einem leicht süßlichen Geruch [2]. Es dient als Zwischenprodukt bei der Herstellung von Weichmachern wie z.B. Diethylhexylphthalat, 2-Ethylhexyl-acrylat, Schmierstoffadditiven und Oberflächenbehandlungsmitteln [4]. Weiterhin wird es als Lösemittel in Farblacken, Tinten, Gummis und chemischen Reinigungen verwendet [2]. Darüber hinaus dient es als Aromastoff in Lebensmitteln, Kosmetika und in Reinigungsprodukten [5, 6].
2 Exposition
2-Ethyl-l-hexanol ist in der Luft der meisten Innenräume nachweisbar. EH kann aus Plastikmaterialien wie z.B. neuen Computern oder Fußbodenbelägen freigesetzt werden [7, 8]. Als weitere Expositionsquellen werden die Hydrolyse von Weichmachern (Hinweise auf Feuchteschaden), Dispersions- und Acrylfarben, Lacke, Kleber und Teppichböden diskutiert [9]. Weiterhin kann EH aufgrund der bakteriellen Zersetzung von Kunststoffen freigesetzt werden [10, 11, 12].
Tab. 2 fasst die Ergebnisse einiger Innenraummessungen in Deutschland zusammen. Im Rahmen des Kinderumweltsurveys wurden Wochenmittelwerte für die Wohnräume erfasst, in denen sich Kinder am häufigsten aufhalten. In 95% der Fälle handelte es sich dabei um das Kinderzimmer [13]. Weiterhin sind Ergebnisse von anlassbezogenen Messungen dargestellt. Die Innenräume (Büro, Wohnung, Schule, Kindergarten) waren in der Regel 8 h vor der Messung ungelüftet [14]. Der Hauptverband der gewerblichen Berufsgenossenschaften zusammen mit dem Bundesverband der Unfallkassen und dem Berufsgenossenschaftlichen Institut für Arbeitsschutz berichtet über Messungen, die in den Jahren 2001 bis 2004 in Büroräumen durch- geführt wurden. Auch vor diesen Messungen waren die Räume mindestens 8 h ungelüftet [9]. Von den Unfallversicherungsträgern liegen Messdaten zur Luftqualität an Innenraumarbeitsplätzen ohne Umgang mit Gefahrstoffen in Betrieben in Deutschland vor. Nach einer Pilotphase in den Jahren 2001-2005 wurde das Messsystem Gefährdungsermittlung der Unfallversicherungsträger etabliert, und weitere Messwerte für die Jahre 2006 bis 2010 wurden erhoben. Die Werte für EH für die beiden Messperioden und über den ganzen Zeitraum sind getrennt in der nachstehenden Tabelle dokumentiert. Die Räume waren mindestens 8 h vor der Messung ungelüftet [15]. Ostendorp und Mitarbeiter [16] erhoben Hintergrundwerte zur VOC-Belastung in Schulen und Kindergärten in Schleswig-Holstein im Zeitraum von 2005-2007. Die vorliegenden Messungen aus bayrischen Schulen wurden im Zeitraum von Dezember 2004 bis Juli 2005 vorgenommen [17]. Die Innenraumkonzentrationen waren bei allen diesen Messungen sehr ähnlich, die Mittelwerte (Mediane) lagen zwischen 2 und 6 µg/m3 und die 95. Perzentile zwischen 9 und 24 µg/m3. Innenraummessungen in Japan während der Jahre 2004-2007, die überwiegend in Büroräumen, aber auch Geschäften, Klassenräumen, Büchereien und Konferenzsälen durchgeführt wurden, ergaben geometrische Mittelwerte für die EH-Belastung in Höhe von 13,7 µg/m3 (Winter) bis 55 µg/m3 (Sommer) [18]. In einer früheren Studie, deren Messungen zwischen 2002 und 2004 durchgeführt wurden, berichten dieselben Autoren Innenraumkonzentrationen von 16,5±5,4 µg/m3 (geometrischer Mittelwert und Standardabweichung). Die gemessene Maximalkonzentration lag bei ca. 2.700 µg/m3 [19]. In Scoubidou-Bändern (Kunststoffschnüre aus Weich-PVC zum Basteln und Flechten) wurden EH-Gehalte zwischen 74 und 506 mg/kg gemessen. Anhand dieser Daten schätzte das Bundesinstitut für Risikobewertung, dass die Exposition bei einem Kind mit 30 kg Körpergewicht (KG) 3,6 µg/kg KG betragen und kurzzeitig eine Innenraumluftkonzentration bis 0,15 mg/m3 auftreten könnte (Annahme: aus 10 g wird der Gesamtgehalt innerhalb von 24 h freigesetzt, Raumvolumen 35 m3, kein Luftaustausch, Atemvolumen 375 l pro Stunde) [20].
McGinty und Mitarbeiter [6] schätzten bei einem hohen Verbrauch von Kosmetika und Körperpflegeprodukten eine maximale tägliche Exposition der Haut von 0,0005 mg/kg.
Tab. 1. Derivation of indoor air guide Values: key data
| Substance | 2-Ethylhexanol | ||
| Parameter | Value/Descriptor | Dimension | Comments |
| General Information | |||
| CLP INDEX No | n. a. | ||
| EC No | 203-234-3 | ||
| CAS No | 104-76-7 | 1 | |
| CLP CMR Classification | Not classified | ||
| Indoor air guide value status | Preliminary | ||
| Guide value II (RW II - Health hazard value) | 1 | mg/m3 | |
| Guide value I (RW I - Precautionary value) | 0,1 | mg/m3 | |
| Conversion factor: 1 ml/m3= | 5,4 | mg/m3 | |
| Year | 2012 | ||
| Database | |||
| Key study/Author(s) (Year) | Kiesswetter E et al. (2005) | Kiesswetter E et al. (2005) | |
| Species | Human | ||
| Route/type of study | Inhalation | ||
| Study length | Acute | ||
| Inhalative exposure duration | 4 h | ||
| Critical endpoint | Sensory irritation | ||
| Point of departure (POD) | LOAEC | NOAEC: 8 mg/m3 | |
| POD Value | 54 | mg/m3 | |
| Assessment factors | |||
| Dose-response assessment factor | n. a. | ||
| Adjusted exposure duration factor (time scaling) | fl. a. | ||
| Adjusted study length factor | 6 | Subacute-chronic | |
| Route-to-route extrapolation factor | n. a. | ||
| Adjusted absorption factor (inhalation/oral) | n. a. | ||
| Interspecies factor | n. a. | ||
| Intraspecies factor | 10 | General population, kinetic + dynamic | |
| Sensitive population factor | n. a. | ||
| Other adjustment factors Quality of whole database | n. a. | ||
| Result | |||
| Total assessment factor (TAF) | 60 | ||
| POD/TAF | 0,9 | mg/m3 | Calculated value; Roun-ded guide value II: 1 |
| LOAEC - NOAEC | 54/8 | Calculated guide value I; 0,13 Rounded guide value I: 0,1 | |
| Referring to the German basic scheme for the derivation of indoor air guide values [60]. n. a. not applied. | |||
3 Toxikokinetik
3.1 Humandaten
Es liegen keine Toxikokinetikdaten beim Menschen vor. An menschlicher Haut wurde in vitro eine Resorptionsrate von 37,8 µg/cm2 und Stunde bestimmt [1].
3.2 Tierexperimentelle Daten Aufnahme
Zur Resorption bei inhalativer Exposition liegen keine quantitativen Daten vor. Untersuchungen zur Toxizität weisen jedoch auf eine effiziente Resorption über diesen Pfad hin. Nach oraler Gabe wurde bei Ratten eine fast vollständige Resorption (89 %) beobachtet [2].
An Ratten wurde nach 6-stündiger dermaler Applikation von 1.000 mg EH/kg KG eine Resorptionsrate von 0,57 mg/cm2 und Stunde gemessen, die Resorption betrug 5,2 %. An Rattenhaut wurde in vitro eine Resorptionsrate von 215 µg/cm2 und Stunde bestimmt, die somit ca. 5-fach höher als bei humaner Haut war. Während 2-EH zu einer Schädigung der Rattenhaut führte, wurde dies bei der humanen Haut nicht beobachtet [1, 4].
Verteilung
Es liegen keine Daten zur Verteilung vor.
Metabolisierung
2-EH wird vor allem zu 2-Ethylhexansäure, 5-Hydroxy-2-ethylhexansäure, 2-Ethyl-1,6-hexandisäure und 6-Hydroxy-2-ethylhexansäure metabolisiert.
Vierundzwanzig Stunden nach einmaliger Gabe von 50 bzw. 500 mg/kg KG an Ratten beträgt der Anteil dieser Metabolite im Urin ca. 37 bzw. 45% der verabreichten Dosis. Als weitere Metabolite wurden 5-Hydroxyethylhexansäure so- wie Laktone von 5-Hydroxyethylhexan- säure und 2 Ethyl-5-hexanonsäure neben unverstoffwechseltem 2-EH nachgewiesen. Die Ausscheidung erfolgt überwiegend in Form der Glukuronide [4, 21].
Ausscheidung
Nach einmaliger und wiederholter oraler Exposition von Ratten gegen 2-EH wurden ca. 95 % der verabreichten Dosis innerhalb von 96 h eliminiert, wobei der Hauptanteil (> 50 %) bereits nach 24 h ausgeschieden wurde.
Die Ausscheidung erfolgte überwiegend über den Urin (ca. 70 %), aber auch über die Faeces (ca. 13 %) und die Atemluft (ca. 11 %). Ein ähnliches Eliminationsmuster wurde auch nach dermaler Exposition beobachtet, wobei die absoluten Mengen aufgrund der geringeren dermalen Absorption geringer waren [4]. Nach dermaler bzw. intravenöser Applikation wurde eine terminale Halbwertszeit von 77 bzw. 60 h berechnet [21].
| Zusammenfassung · Abstract |
| Bundesgesundheitsbl 2013 - 56:590-599 DOI 10.1007/s00103-013-1678-5 © Springer-Verlag Berlin Heidelberg 2013 Bekanntmachung des Umweltbundesamtes Richtwerte für 2-Ethylhexanol in der Innenraumluft |
| Zusammenfassung |
| Zum Schutz der Gesundheit der Bevölkerung setzt die Ad-hoc-Arbeitsgruppe Innenraumrichtwerte der Kommission Innenraumlufthygiene und der Obersten Landesgesundheitsbehörden Richtwerte für die Innenraumluft fest. 2-Ethyl-1-hexanol (EH) wird unter anderem als Zwischenprodukt zur Herstellung von Weichmachern, aber auch als Aromastoff in Lebensmitteln, Kosmetika und in Reinigungsprodukten verwendet. Es ist in der Luft der meisten Innenräume nachweis- bar. In Deutschland gemessene Konzentrationen lagen zwischen 0,002 und 0,006 mg/ m3 (Mediane) und die 95-Perzentile zwischen 0,009 und 0,03 mg/m3. EH weist eine geringe akute Toxizität auf und reizt bei direktem Kontakt die Haut und Augen. Konzentrationen von 54 mg EH/m3 führen beim Menschen bei akuter Exposition zu sensorischen Reizungen (NOAEC 8 mg EH/m3). In einer subchronischen Inhalationsstudie an Ratten traten selbst in der höchsten getesteten Konzentration (638 mg/m3) keine lokalen oder systemischen Effekte auf. EH ist nicht gentoxisch und nicht kanzerogen in Ratten und männlichen Mäusen nach oraler Applikation. Es liegen keine Hinweise auf eine Beeinträchtigung der Fertilität durch EH vor. Entwicklungstoxische Effekte traten erst bei maternal toxischen Dosierungen auf (650 mg/kg KG/d). Die sensorische Reizung steht im Vordergrund der Bewertung von EH in der Innenraumluft. Ausgehend von einer LOAEC von 54 mg EH/m3 in einer 4-stündigen Kurzzeitexpositionstudie an Freiwilligen wurde unter Berücksichtigung eines Intraspeziesfaktors 10 und eines Zeitextrapolationsfaktors 6 ein vorläufiger Richtwert II (Gefahrenwert) in Höhe von 1 mg EH/m3 abgeleitet. Ausgehend von einer NOAEC von 8 mg/m3 ergab sich ein vorläufiger Richtwert I (Vorsorgewert) in Höhe von 0,1 mg EH/m3. |
| Schlüsselwörter |
| 2-Ethyl-1-hexanol · Innenraumluft · Irritation · LOAEC · Richtwert |
| Indoor air guide values for 2-ethylhexanol |
| Abstract |
| The German Ad-hoc Working Group on In- door Guidelines of the Indoor Air Hygiene Committee and of the Supreme State Health Authorities is issuing indoor air guide values to protect public health. 2-Ethylhexan-1-ol (EH) is used amongst others as an interme- diate in the production of plasticisers or as a flavouring agent in food, cosmetics and cleaning agents.
EH is detectable in nearly all indoor air samples.
Indoor air concentra- tions in Germany were reported to be in the range of 0.002 to 0.006 mg/m3 (median), the 95-percentiles were in the range of 0.009 to 0.03 mg/m3.Toxicity after acute exposure to EH is low. EH is irritating to skin and eyes after direct contact.
Acute exposure of humans to 54 mg EH/m3 caused sensory irritation (NOAEC 8 mg EH/m3). In a subchronic inhalation study in rats, neither local nor systemic effects were detectable up to the highest concentration tested (638 mg/m3). EH is not genotoxic and not carcinogenic in rats and male mice after oral application.There is no evidence that EH impairs fertility.
Developmental toxicity was only observed at doses, which already caused maternal toxicity (650 mg/kg bw/d).
Sensory irritation is the most relevant effect for the derivation of indoor air guide values. Based on a LOAEC of 54 mg/m3 and a NOAEC of 8 mg/m3 in a short time (4 h) inhalation study with volunteers, and applying an intra-species extrapolation factor of 10 and a fac-tor of 6 for time extrapolation, a preliminary hazard-based guide value of 1 mg EH/m3 and a preliminary precautionary value of 0.1 mg EH/m3 have been derived. Keywords 2-ethylhexan-1-ol · Indoor air · Irritation · LOAEC · Guide value |
4 Gesundheitliche Wirkung
Im Folgenden werden vor allem die gesundheitlichen Wirkungen einer inhalativen Exposition gegenüber 2-Ethyl-l-hexanol dargestellt.
4.1 Akute Toxizität
Zur akuten Toxizität von EH beim Menschen liegen keine Daten vor.
Bei inhalativer Exposition von Ratten wurde eine LC50(4 h) von > 890 und < 5.300 mg EH/m3 berichtet. Die Tiere wurden über 4 h gegen 890 oder 5.300 mg EH/m3 (Dampf/Aerosolgemisch) exponiert. Bei der niedrigen Konzentration traten während oder nach der Exposition keine auffallenden Befunde auf. Bei der hohen Konzentration verendeten je ein männliches und weibliches Tier während der Exposition und alle übrigen Tiere innerhalb von 2 h nach der Exposition. Die Tiere wirkten hinfällig und zeigten Atemnot, roten Tränen- und Nasenfluss und geschlossene Augen [4, 5]. Einmalige 6-stündige inhalative Exposition von Ratten, Mäusen und Meerschweinchen gegen 1.230 mg/m3 führte zu leichten Irritationen der Augen, Nase und des Rachens sowie zu einer verminderten Motilität und Dyspnoe. Keines der Tiere verstarb während der Exposition oder der 24-stündigen Nachbeobachtungszeit. Bei der Sektion waren makroskopisch in der Lunge leichte Blutungen zu beobachten [22].
EH ist nach oraler, dermaler und in-traperitonealer Exposition wenig toxisch [4, 5].
Tab. 2 Luftkonzentrationen von 2-Ethyl-1-hexanol in ausgewählten Innenräumen in Deutschland
| Innenraum | Anzahl Messwerte (Betriebe) | BG (µg/m3) | n > BG (%BG) | Median (µg/m3) | 95. Perzentil (119/m3) | Maximalwert (µg/m3) |
| Kinderzimmer 2003-2006a [13] | 555 | 1,0 | 469 (85) | 2,6 | 11,4 | 67 |
| Büro, Wohnung, Kita, Schule | 2283 | 1,5 | 1461 (64) | 2,4 | 20,5 | 3301 |
| u. a. 2002-2006 [14] | ||||||
| Büro 2001-2004 [9] | 401 | n. a. | n. a. | 6b | 24 | n. a. |
| Innenraumarbeitsplätze ohne Gefahrstoffumgang 2001-2005 [15] | 664 (203) | 10 | 360 (54) | n. a. | 29 | n. a. |
| Innenraumarbeitsplätze ohne Gefahrstoffumgang, 2006-2010 [15] | 984 (322) | 6 | 572 (58) | n. a. | 26 | n.a. |
| Innenraumarbeitsplätze ohne Gefahrstoffumgang, 2001-2010 [15] | 1648 (515) | 10 | 932 (57) | n. a. | 28 | n. a. |
| Schule, Kindergarten 2005-2007 [16] | 285 | 2 | 240 (84) | 2 | 15 | 175 |
| Schule Winter 2004-2005 [17]c | 90 | 0,1 | 86 (91) | 4 | 9,4 | n. a. |
| Schule Sommer 2005 [17]d | 75 | 0,1 | 73 (97) | 4,6 | 12,6 | n. a. |
| a Wochen mittel.
b Statistisch ermittelter Verteilungswert, der unterhalb der höchsten quantitativen Bestimmungsgrenze liegt. c Messperiode vom 02.12.2004 bis 16.03.2005. d Messperiode vom 02.05.2005 bis 28.07.2005. | ||||||
4.2 Reizerscheinungen
Die Gruppe von van Thriel und Kieswetter [23, 24, 25] führte an einem Freiwilligenkollektiv Laboruntersuchungen zur lokalen Reizwirkung von EH im Atemtrakt bei inhalativer Exposition durch: Zweiundzwanzig bis 24 männliche Probanden (Durchschnittsalter 23 bis 24 Jahre; jeweils ca. die Hälfte der Probanden wies eine selbst berichtete multiple Chemikaliensensitivität auf) wurden über 4 h gegen durchschnittlich 8, 54 oder 108 mg EH/m3 exponiert (Ganzkörperexposition, variabler oder konstanter Konzentrationsverlauf). Der variable Konzentrationsverlauf begann beim Maximum und ging innerhalb von 30 min auf das Minimum zurück bzw. umgekehrt, sodass sich 5 Expositionsspitzen ergaben (Expositionsbereich bei durchschnittlich 8 mg/m3: 7,5- 8,6 mg/m3; bei 54 mg/m3: 7-110 mg/m3; bei 108 mg/m3: 10-230 mg/m3). Alle Probanden wurden gegen alle Konzentrationen exponiert, wobei die Abfolge variierte. Die Pause zwischen 2 Expositionen betrug mindestens 2 Tage. Folgende Parameter wurden bei den Probanden erhoben: Lästigkeitserleben, sensorische Reizung an Augen und Nase, Geruch, Lidschlussfrequenz, nasaler Luftwiderstand (Rhinomanometrie; Methode zur Messung der Nasenreizung), sowie der Gehalt des Neuropeptids Substanz P in der Lavage-Flüssigkeit als Indikator für nasale chemosensorische Reizungen. Die nasale Reizung, Augenreizung und das Geruchserleberi wurden einerseits mit einer erweiterten Methodik des "Swedish Performance Evaluation Systems" (SPES; lineare Skala) zur Erfassung der akuten Symptome und andererseits mittels der "Labeled Magnitude Scale" (LMS; logarith-mische Skala) zur Erfassung der Intensität bewertet.
Beobachtete Effekte bei konstantem Expositionsverlauf:
- statistisch signifikant erhöhte Lidschlussfrequenz bei 108 mg/m3 im Vergleich zu 8 mg/m3 (Faktor ca. 1,5) und 54 mg/m3 (Faktor ca. 1,2); Lidschlussfrequenz bei 54 mg/m3 nicht signifikant verschieden zu 8 mg/m3 [23];
- Nasen- und Augenreizung bei 54 mg/ m3 und 108 mg/m3 ("moderate" und "strong") verstärkt gegenüber 8 mg/m3 ("weak") [24];
- dosisabhängige Geruchswahrneh-mung mit nur geringfügiger Adaption über die Zeit [24];
- insgesamt höheres Bewertungsniveau bei Personen mit Chemikaliensensitivität nach der SPES-Methode, aber kei-ne Unterschiede in der beschriebenen Intensität - LMS-Methode [24].
Beobachtete Effekte bei variablem Expositionsverlauf:
- Lidschlussfrequenz 2- bzw. 3-fach erhöht bei Spitzenkonzentrationen von 108 mg/m3 bzw. 216 mg/m3 (Testung höherer Konzentrationen wegen damit verbundener starker Augenreizung nicht möglich); keine Unterschiede zwischen Personen mit und ohne Chemikaliensensitivität [23];
- nasaler Fluss nach der Exposition im Vergleich zum Wert vor der Exposition erniedrigt, statistisch signifikant bei 108 mg/m3; keine statistisch signifikante Dosisabhängigkeit [25];
- Konzentration Substanz P in der nasalen Lavage-Flüssigkeit nach der Exposition im Vergleich zu vor der Exposition erhöht bei 54 und 108 mg/m3, statistisch signifikant nur bei 108 mg/ m3 [25];
- keine Korrelation zwischen "nasalem Fluss" und "Substanz P" und der standardisierten Bewertung des Erlebens von Lästigkeit, sensorischer Reizung und Geruch oder der Chemikalien-sensitivität [25];
- Nasen- und Augenreizung bei 54 und 108 mg/m3 ("moderate" und "strong") verstärkt gegenüber 8 mg/m3 ("weak"); keine Unterschiede zwischen Personen mit und ohne Chemikaliensensitivität; Reizintensität bei variablem Konzentrationsverlauf stärker als bei konstanter Konzentration [24, 25];
- dosisabhängige Geruchswahrnehmung und Lästigkeitsempfinden in allen Gruppen; Geruchswahrnehmung zeigt nur geringfügige Adaption über die Zeit [24, 25].
In einer weiteren Studie von van Thriel und Kollegen [26] mit gleichem Expositionsschema wie oben beschrieben wurden insgesamt 46 männliche Probanden (19 davon mit selbst berichteter Chemikaliensensitivität; 24 bzw. 22 Probanden insgesamt bei Exposition gegen variable bzw. konstante Expositionskonzentrationen) gegen 8, 54 oder 108 mg EH/m3 exponiert. Die EH-Exposition beeinflusste nicht die untersuchten verhaltenstoxikologischen Effekte mit Ausnahme der Ergeb-nisse eines Aufmerksamkeitstests, in dem die Probanden mit Chemikaliensensitivität mit zunehmender EH-Konzentration eine verminderte Leistung zeigten. Lästigkeit, Augen- und Nasenreizungen nahmen konzentrationsabhängig zu. Während im Mittel die Lästigkeit bei 54 oder 108 mg EH/m3 als stark bzw. sehr stark angegeben wurde, wurde die Intensität der Augen und Nasenreizungen als schwach, moderat bzw. stark bei 8, 54 oder 108 mg EH/m3 beschrieben (ähnliche Intensität bei variablem und konstantem Konzentrationsverlauf). Probanden mit Chemikaliensensitivität empfanden die Reizwirkung auf Augen und Nasen stärker als die Kontrollgruppe bei konstantem Konzentrationsverlauf, aber schwächer bei variablem Konzentrationsverlauf
Die Ergebnisse der Studien von van Thriel und Mitarbeiter werden durch die Untersuchungen von Ernstgard und Kollegen [27] gestützt. Sie exponierten Freiwillige (16 Männer und 14 Frauen) über 2 h gegen 0 oder 1 mg EH/m3. Die Probanden berichteten über leichte, aber signifikante Augenreizungen (Kontrolle: "gar nicht"; Exponierte: "kaum") und eine Geruchswahrnehmung bei 26/30 Probanden nach 1 h Expositionszeit und bei 14/30 Probanden nach 2 h Exposition (Kontrolle: "gar nicht" bis "kaum"; Exponierte: "ein wenig"). Die Exposition führte nicht zu Nasen- oder Rachenirritationen, Kopfschmerzen, Übelkeit, Müdigkeit oder Verwirrtheit. Sie beeinflusste auch nicht die Lidschlussfrequenz, die gemessenen spirometrischen Parameter, die Integrität der Horn- oder Bindehaut und die biochemischen Parameter, die nach Nasenspülung untersucht wurden. Es wurden keine Unterschiede zwischen Männern und Frauen oder Atopikern und Nicht-Atopikern beobachtet.
Bei der Maus führte eine EH-Konzentration von ca. 235 mg/m3 zu einer Verringerung der Atemfrequenz um 50% (RD50) [28].
Am Auge verursachte EH mäßig starke Reizerscheinungen (Reizindex 28,6 bei einem maximalen Reizindex von 110) in einer Guidelinestudie (OECD Richtlinie 405) an Kaninchen [29]. Vergleichbare Ergebnisse wurden in weiteren Untersuchungen beobachtet. Die aufgetretenen Reizerscheinungen am Auge waren meist nach 7 bis 8 Tagen reversibel [4, 6].
4.3 Toxizität bei wiederholter Gabe
In verschiedenen Studien wurde geprüft, ob eine wiederholte Exposition gegen EH zu Effekten im Atemtrakt bis hin zu vermehrtem Auftreten von Asthmasymptomen und zu neurotoxischen Effekten (z.B. Kopfschmerzen, Benommenheit, Müdigkeit) führen könnte [7, 30, 31, 32, 33]. Da in diesen Studien auch eine gleichzeitige Exposition gegen andere Substanzen vorlag, konnte kein eindeutiger Zusammenhang zwischen der EH-Exposition und den beschriebenen Effekten hergestellt werden.
In einer 90-Tage-Inhalationsstudie nach der OECD-Richtlinie 413 wurden Wistar-Ratten (10 Tiere pro Geschlecht und Dosisgruppe) während 5 Tagen/ Woche und 6 h/Tag gegen 80, 220 oder 640 mg EH/m3 exponiert (Ganzkörperexposition). Die höchste Konzentration entsprach dabei einer dampfgesättigten Atmosphäre bei 20°C. Es traten weder lokale noch systemische substanzabhängige adverse Effekte auf. Auch bei der höchsten Konzentration wurde keine Peroxisomenproliferation beobachtet [34]. Zum Umfang der histologischen Untersuchungen ist angegeben, dass alle Organe richtliniengemäß (unter anderem komplette Untersuchung des Respirationstrakts) sowie alle Organe, die bei der Sektion Auffälligkeiten aufwiesen, untersucht wurden.
In einer 90-Tage-Fütterungsstudie an DW-Ratten mit 7, 33, 170 und 830 mg/kg KG/d) beeinflusste EH nicht das Körpergewicht, die Futteraufnahme und Mortalität. In der höchsten Dosisgruppe waren jedoch makroskopische und histologische Veränderungen der Leber und Niere zu beobachten (NOAEL 170 mg/ kg KG/d) [35, 36]. Weitere Daten zur subchronischen Toxizität von EH wurden an Fischer344-Ratten und B6C3F1-Mäusen erhoben. Die Dosierung wurde an 5 Tagen pro Woche durchgeführt und lag für Ratten und Mäuse bei 0, 25, 125, 250 bzw. 500 mg/kg KG/d. Bei den Ratten traten in den beiden höchsten Dosisgruppen Effekte auf, in der höchsten Dosisgruppe u. a. eine verzögerte Körpergewichtsentwicklung, veränderte klinisch-chemische und hämatologische Parameter, erhöhte Leber- und Magengewichte, Akanthosen der (Vor-)Magenschleimhaut sowie fettige Infiltrationen in der Peripherie der Leberläppchen; bei 250 mg/kg KG/d Veränderungen der klinisch-chemischen Parameter, erhöhte relative Lebergewichte (Männchen und Weibchen) und Magengewichte (Weibchen) (NOAEL Ratte 125 mg/kg KG/d). Bei den Mäusen waren keine behandlungsbedingten klinischen Symptome, keine hämatologischen oder klinisch-chemischen Veränderungen zu beobachten. Männliche Mäuse der 250- und 500- mg/kg-KG/d-Dosisgruppen wiesen eine nicht dosisabhängige Erhöhung der relativen Magengewichte auf. Männliche und weibliche Tiere der höchsten Dosisgruppe entwickelten Akanthosen der Vormagenschleimhaut. Im Gegensatz zur Rattenstudie wurde bei den Mäusen kein Hinweis auf eine Induktion der Peroxisomenproliferation gefunden (keine Erhöhung der Aktivität des Markerenzyms Cyanid-in-sensitive Palmitoyl-CoA-Oxidase) (NOAEL männliche Maus 125 mg/kg KG/d; NOAEL weibliche Maus 250 mg/kg KG/d) [37, 38, 39, 40].
In 2 Langzeitstudien wurden Fischer-Ratten (0, 50, 150 oder 500 mg EH/kg KG über 24 Monate) und B6C3F1-Mäuse (0, 50, 200 bzw. 750 mg EH/kg KG über 18 Monate) mittels Schlundsonde exponiert [41]. Die Ratten der höchsten Dosisgruppe wiesen erhöhte Mortalität, klinische Symptome, vermindertes Körpergewicht, erhöhte Organgewichte sowie Blutstauungen in Leber und Lunge auf In der mittleren Dosisgruppe waren klinische Symptome sowie eine leicht verzögerte Körpergewichtsentwicklung zu beobachten. 50 mg/kg KG wurden symptomlos vertragen (NOAEL Ratte 50 mg/kg KG/d). Während bei den Mäusen der höchsten Dosisgruppe eine erhöhte Mortalität, eine verminderte Körpergewichtszunahme sowie Veränderungen im Blutbild zu beobachten waren, wurden die beiden niedrigen Dosierungen symptomlos vertragen (NOAEL Maus 200 mg/ kg KG/d).
Zahlreichen Studien belegen eine peroxisomenproliferierende Wirkung von EH bei Ratten. Es ist dabei allerdings schwächer wirksam als z.B. Diethylhexylphthalat oder Diethylhexyladipat [4, 5].
Nach wiederholter dermaler Exposition von Ratten gegen 2 ml EH (1,7 g) auf die Rückenhaut (12 Applikationen, 14 Tage Nachbeobachtungszeit) wurden Hautirritationen, vermindertes Körpergewicht sowie histologische Veränderungen an Leber, Lunge, Niere, Herz, Hoden, Thymus und Nebennieren beobachtet [42].
4.4 Gentoxizität
Untersuchungen zur Induktion reverser Mutationen in verschiedenen Salmonella-Stämmen und in Escherichia coli WP2uvrA (Ames-Test) mit und ohne metabolische Aktivierung ergaben sowohl im Platteninkubationstest als auch im Präinkubationstest negative Ergebnisse für EH. Auch der Harn von Ratten, die 15 Tage lang 1.000 mg EH/kg KG oral verabreicht bekamen, ergab negative Ergebnisse im Ames-Test. Nur in einem Ames-Test mit TA 100 (Azaguanin-Resistenz-Mutation) wurde ein schwach positives Ergebnis ohne metabolische Aktivierung beobachtet. Untersu-chungen im Rec-Assay mit Bacillus subtilis ergaben positive und negative Ergebnisse. Im DNA-Repair-Test mit E.-coli-Bakterien (polA+/polA-) wirkte EH positiv, wenn Ethanol als Lösemittel verwendet wurde, und negativ, wenn DMS0 als Lösemittel diente. Negative Befunde wurden im Genmutations- und Chromosomenaberrationstest in Säugerzellen erhoben sowie in einem Test auf außerplanmäßige DNA-Synthese. EH führte nicht zur Transformation von Balb-3T3-Zellen in vitro mit und ohne metabolische Aktivierung. Auch in Epidermiszell Kulturen von Mäusen wurde im Konzentrationsbereich von 4x10-7 bis 77x10-7 mMol/l (entsprechend 5,2x10-5 bis 1x10-3 mg/ml) keine transformierende Eigenschaft beobachtet [2, 4, 6].
In einer Untersuchung an B6C3F1-Mäusen, die 1-mal oder 2-mal 456 mg EH/ kg KG intraperitoneal verabreicht bekamen, wurde nach der wiederholten Gabe ein signifikant vermehrtes Auftreten von Mikrokernen in polychromatischen Erythrozyten festgestellt. Die Autoren werteten dieses Ergebnis als falsch positiv aufgrund der zu niedrigen Mikrokernwerte in der Kontrollgruppe. Die Werte für die behandelten Tiere lagen im Bereich der historischen Kontrollen [43].
Ratten, die über 5 Tage 17-167 mg EH/ kg KG verabreicht bekamen, wiesen keine erhöhte Anzahl an Chromosomenaberrationen im Knochenmark auf. Es wurden nur 50 Metaphasen pro Tier ausgewertet [44].
EH induzierte keine dominanten Letalmutationen bei Mäusen. Die männlichen Tiere erhielten an 5 aufeinanderfolgenden Tagen bis zu 1.000 mg/kg KG, bevor sie mit unbehandelten Weibchen verpaart wurden [45].
In der Leber von Ratten konnte keine kovalente Bindung von EH an die DNA nachgewiesen werden [4].
4.5 Kanzerogenität
Es liegen keine Humandaten vor. Die mögliche kanzerogene Wirkung von EH wurde in Ratten und Mäusen untersucht [1, 41]. Männliche und weibliche Fischer-Ratten (je 50 Tiere pro Dosisgruppe) erhielten 5-mal wöchentlich über 24 Monate 0, 50, 150 oder 500 mg EH/kg KG als wässrige Emulsion mit Cremophor® EL mittels Schlundsonde. Weiterhin wurde eine Satellitengruppe von jeweils 10 Tieren/Geschlecht mitgeführt, die 0 oder 500 mg/kg KG verabreicht bekamen und nach 18 Monaten getötet wurden. Eine weitere Gruppe von jeweils 50 Männchen oder Weibchen erhielt über 18 Monate 500 mg/kg KG und für weitere 6 Monate bis zum Versuchsende Vehikel. EH war unter den angegebenen Versuchsbedingungen nicht kanzerogen.
B6C3F1-Mäuse (50 Tiere pro Geschlecht und Gruppe) wurde 5-mal wöchentlich über 18 Monate 0, 50, 200 bzw. 750 mg EH/kg KG als wässrige Emulsion mit Cremophor® EL mittels Schlundsonde verabreicht. In den Satellitengruppen wurden jeweils 10 Tiere (750 mg/kg KG, Untersuchung nach 13 Monaten) oder 50 Tiere (750 mg/kg KG über 13 Monate und 5 Monate Vehikel - Erholungsgruppe) pro Geschlecht und Dosisgruppe eingesetzt. Bei den weiblichen Tieren der höchsten Dosisgruppe des Hauptversuchs war die Anzahl der hepatozellulären Karzinome und der basophilen Foci im Vergleich zur Lösemittelkontrolle signifikant erhöht, aber nicht im Vergleich zur Wasserkontrolle und den historischen Kontrollen. Es waren keine Metastasen erkennbar. Bei den männlichen Tieren wurden keine Tumore beobachtet. Die Autoren folgerten, dass die Relevanz der Tumore bei den weiblichen Tieren unklar ist ("it is likely that EH is a weak or equivocal carcinogen in female mice") [1, 41].
4.6 Reproduktionstoxizität
Es liegen keine Humandaten vor.
Fertilität
Es liegen keine Untersuchungen zu Effekten von EH auf die Fertilität bei inhalativer Exposition vor. In der Langzeitstudie an Ratten war bei allen Dosisgruppen eine gegenüber der Lösemittelkontrolle verstärkte Prostataatrophie zu beobachten, die jedoch im Vergleich zur Wasserkontrollgruppe kaum ausgebildet war [41]. Histopathologische Veränderungen der Testes (interstitielle Ödeme, verminderte Spermienbildung) wurden bei Ratten beobachtet, die wiederholt dermal gegen EH exponiert waren (Einzeldosis 1,7 g, nicht olddusiv) [6, 42]. Sprague-Dawley-Ratten, die 350 mg EH/kg KG/d für 5 Tage mittels Magensonde verabreicht bekamen, wiesen keine Veränderungen des Körper-, Hoden-, Prostata- und Lebergewichts oder der Samenkanälchen (histologisch) auf [46].
In In-vitro-Untersuchungen hatte EH keinen Einfluss auf die Laktat- und Pyruvatproduktion von Sertoli-Zellen. Auch die Untersuchungen in einem weiteren In-vitro-Modell mit Rattensamenkanälchen ergaben keine Hinweise auf eine hodentoxische Wirkung [4].
Entwicklungstoxizität
In einer Studie an Sprague-Dawley-Ratten, die während Tag 1-9 der Trächtigkeit (7 h/d) gegen 850 mg EH/m3 exponiert waren, waren bei der Schnittentbindung am Tag 20 keine entwicklungstoxischen Effekte zu beobachten. Bei den Muttertieren war die Futteraufnahme vermindert [47, 48].
Wistar-Ratten erhielten einmalig am Tag 12 der Trächtigkeit mittels Schlundsonde 0, 830 oder 1.670 mg EH/kg KG. Es wurde ein dosisabhängiger Anstieg an fehlgebildeten Feten beobachtet (0, 2 und 22% in der Kontrolle, niedrigen bzw. hohen Dosisgruppe). Weiterhin wiesen die Feten der hohen Dosisgruppe ein vermindertes Gewicht auf [49, 50]. Es liegen keine Angaben zu maternaltoxischen Effekten vor, obwohl die höchste Dosis im Bereich der halben LD50 lag.
In einer OECD-Richtlinienstudie zur Entwicklungstoxizität (Richtlinie 414) [51] wurde Wistar-Ratten (10 Tiere pro Dosisgruppe) 0, 130, 650 oder 1300 mg EH/kg KG/d mittels Schlundsonde während der Trächtigkeit Tag 6-15 verabreicht. In der niedrigsten Dosisgruppe traten keine adversen Effekte auf In der mittleren Dosisgruppe wiesen 2 Muttertiere erste Anzeichen einer toxischen Wirkung auf (Piloerektion). Bei den Feten war das Gewicht geringfügig reduziert und die Inzidenz an Skelettvariationen und Retardierungen erhöht. In der höchsten Dosisgruppe zeigten die Muttertiere ausgeprägt toxische Effekte (erhöhte Mortalität, klinische Symptome, Organschäden). Bei den Nachkommen wurden vermehrt Implantationsverluste und Resorptionen, Gewichtsverluste, Fehlbildungen der Weichteile und des Skeletts sowie Skelettvariationen und Retardierungen beobachtet. Der NOAEL für maternal- und entwicklungstoxische Effekte war in dieser Studie 130 mg/kg KG.
Trächtigen CD-1-Mäusen (28 Tiere pro Gruppe) wurde von Tag 0-17 der Trächtigkeit EH über das Futter verabreicht (0, 0,009, 0,03 oder 0,09% bzw. 0,13, 43 oder 129 mg/kg KG/d). In keiner Dosisgruppe wurden maternaltoxische oder embryotoxische Effekte beobachtet [52].
In einer Screeningstudie mit CD-1- Mäusen, die 1525 mg EH/kg KG/d an den Tagen 6-15 der Trächtigkeit mittels Schlundsonde verabreicht bekamen, verstarben 17/49 Muttertieren. Weiterhin waren die maternale Gewichtszunahme, die Anzahl der lebenden Würfe, der lebenden Nachkommen pro Wurf, die Überlebensdauer der Nachkommen, das Geburtsgewicht und die Gewichtszunahme der Nachkommen vermindert [53].
Eine mögliche embryotoxische Wirkung von EH nach dermaler Applikation wurde an F344-Ratten untersucht. Vom 6. bis 15. Tag der Trächtigkeit wurden die Tiere täglich 6 h lang gegen 252, 420, 840, 1680 oder 2520 mg EH/kg KG exponiert (unverdünnt, olddusiv auf die enthaarte Rückenhaut). Es wurden keine embryotoxischen Effekte beobachtet. Die Muttertiere der beiden höchsten Dosisgruppen wiesen eine verminderte Körpergewichtszunahme auf, Dosierungen > 420 mg/kg KG führten zu Exfoliationen und Verkrustungen [54].
4.7 Geruchswahrnehmung
Die Geruchsschwelle für EH wird mit 0,4-0,7 mg/m3 angegeben; die dabei zugrunde liegende Studie wurde nicht genannt [55].
5 Gesundheitliche Bewertung
Nach Ansicht des europäischen Wissenschaftlichen Ausschusses für Arbeitsplatzgrenzwerte stellt die Reizwirkung an Augen und im Atemtrakt die kritische Wirkung von 2-Ethylhexanol dar [2]. Die Kammeruntersuchungen an Freiwilligen über 4 h von van Thiel, Kiesswetter und Kollegen belegen eine - wenn überhaupt - nur marginale sensorische Reizung bei 8 mg EH/m3. Ein dosisabhängiger Anstieg der subjektiven und objektiven Effekte ist bei 54 und 108 mg/m3 sichtbar, wobei die objektiv messbaren Parameter wie Lidschlussfrequenz, nasaler Fluss und Substanz P in der nasalen Lavageflüssigkeit erst bei 108 mg/m3 statistisch signifikant erhöht waren (die beiden letzten Parameter wurden nur bei variablem Konzentrationsverlauf bestimmt). Wegen der Schwierigkeit der Einordnung der Effekte bei variablem Konzentrationsverlauf und der Bewertung der Expositionsspitzen werden für die gesundheitliche Bewertung von EH in der Innenraumluft vor allem die Daten zur Lidschlussfrequenz bei konstantem Konzentrationsverlauf herangezogen.
Da bereits bei 54 mg EH/m3 eine - wenn auch statistisch nicht signifikante - Erhöhung der Lidschlussfrequenz zu beobachten war, leitet der Ausschuss aus dieser Studie eine LOAEC in Höhe von 54 mg EH/ m3 [23] für den Endpunkt Reizwirkung ab. Dieser Wert wird durch die Beobachtungen bei variablem Konzentrationsverlauf gestützt. Die NOAEC liegt in dieser Studie bei 8 mg EH/m3. Die Ergebnisse der Studie von Ernstgard et al. [27] unterstützen diese Bewertung.
In einer 90-Tage-Inhalationsstudie an Ratten, die gegen 0, 80, 213, 638 mg EH/ m3, 5 d/w, 6 h/d exponiert waren, traten weder lokal noch systemisch substanzabhängige Effekte auf (NOAEC 638 mg/m3).
In einer subchronischen Fütterungsstudie an Ratten waren als einzige EH-bedingte Effekte in der höchsten Dosisgruppe (ca. 830 mg/kg KG/d) makroskopische und histologische Veränderungen der Leber und Niere zu beobachten (NOAEL ca. 170 mg/kg KG/d). Zwei weitere subchronische Versuche an Ratten und Mäusen ergaben einen NOAEL von 125 mg/kg KG/d für Ratten und männliche Mäuse. Der NO-AEL für weibliche Mäuse lag bei 250 mg/ kg KG/d. In einer chronischen Studie lag der NOAEL für Ratten bei 50 mg/kg KG/d. Der NOAEL für Mäuse lag in der chronischen Studie bei 200 mg/kg KG/d.
EH war in den meisten In-vitro- und In-vivo-Untersuchungen nicht mutagen. Die in einer Untersuchung beobachteten Mikrokerne in Mäusen in vivo wurden als falsch positives Ergebnis bewertet. EH ist ein schwach wirksamer Peroxisomenproliferator. In einer chronischen Fütterungsstudie an Ratten, die bis zu 500 mg/kg KG und Tag erhielten, traten keine Tumore auf. In einer parallel durchgeführten Untersuchung mit Mäusen, die bis zu 750 mg/kg KG und Tag mit dem Futter verabreicht bekamen, entwickelten die weiblichen, aber nicht die männlichen Tiere der höchsten Dosisgruppe, in der bereits toxische Wirkungen auftraten (verringerte Körpergewichtsentwicklung, Mortalität), Lebertumoren. Beobachtungen an Ratten weisen darauf hin, dass die Lebertumoren nicht auf eine Peroxisomenproliferation zurückzuführen sind (die Dosis, die in einer 90-Tage-Rattenstudie Peroxisomenproliferation induzierte, führte nicht zu Lebertumoren in der chronischen Studie).
Tab. 3 Vergleichende Darstellung der möglichen Ableitungen von Richtwert I und II für 2-Ethyl-1-hexanol auf Basis unterschiedlicher Studien
| POD (mg/ m3) | Extrapolationsfaktoren | RW II (mg/m3) | RW I (mg/m3) | |||
| Interspeziesvariabilität | Intraspeziesvariabilität | Kinderfaktor | Studiendauer | |||
| LOAEC, Humandaten, Endpunkt sensorische Reizung (Kiesswetter et al.1eftsquare23]) | ||||||
| 54 | 1 | 10 | 1 | 6 | 0,9 | - |
| NOAEC, Humandaten, Endpunkt sensorische Reizung (Kiesswetter et al. [23]) | ||||||
| 8 | 1 | 10. | 1 | 6 | - | 0,1 |
| NOAEC, 90-Tage-Inhalationsstudie Ratten (Klimisch et al. [34]) | ||||||
| 110a | 2,5 | 10 | 2 | 2 | - | 1 |
| LOAEL, Oralstudie zur Entwicklungstoxizität bei Ratten (Hellwig und Jäckh, [51]) | ||||||
| 230b | (Scaling-Faktor 4, x2,5)c | 10 | 1 | 1 | 23 | - |
| NOAEL, Oralstudie zur Entwicklungstoxizität bei Ratten (Hellwig und Jäckh, [51]) | ||||||
| 46 | (Scaling-Faktor 4, x2,5)c | 10 | 1 | 1 | - | 5 |
| a 638 mg/m3 umgerechnet auf kontinuierliche Exposition (x6/24x5/7).
b L0AEL 650 mg/kg KG/d;NOAEL 130 mg/kg KG/d Umrechnung in eine humane Inhalationsdosis:650 bzw. 130 mg/kg KG/d x 1/4 (Scaling) x 1/2,5 (Interspeziesvariabilität) x 70 kg x 1/20 (Atemvolumen). | ||||||
Einzelne Befunde zu Veränderungen in männlichen Reproduktionsorganen lassen keine Schlussfolgerungen auf eine mögliche fertilitätsmindernde Wirkung des EH zu. In-vitro-Untersuchungen ergaben keine Hinweise auf eine hodentoxische Wirkung. Entwicklungstoxische Effekte traten in den meisten Studien erst bei maternal toxischen Dosierungen auf. Eine Rattenstudie mit einer Exposition an den Tagen 6-15 der Trächtigkeit ergab einen NOAEL von 130 mg/kg KG/d für maternale und entwicklungstoxische Effekte (LOAEL 650 mg/kg KG/d; NO-AEL 130 mg/kg KG/d). Auch bei Mäusen, die über das Futter exponiert waren, waren selbst in der höchsten Dosis (129 mg/ kg KG/d) keine toxischen Effekte bei den Muttertieren oder Nachkommen zu beobachten. Nach inhalativer Exposition von Ratten gegen 850 mg EH/m3 während der Tage 1-9 der Trächtigkeit waren bei der Schnittentbindung am Tag 20 keine entwicklungstoxischen Effekte zu beobachten, bei den Muttertieren war die Futteraufnahme vermindert.
5.1 Einstufungen/Regelungen
Die Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe der Deutschen Forschungsgemeinschaft hat in ihrer neuesten Bewertung [56] den MAK-Wert für 2-EH von 108 mg/m3 auf 54 mg/m3 herabgesetzt. Für die Spitzenbegrenzung gilt weiterhin Kategorie I (Überschreitungsfaktor 1). Als Basis für die Ableitung des MAK-Wertes dienten die Daten von Kiesswetter et al. [23] zur Beeinflussung der Lidschlussfrequenz durch EH. Die Ergebnisse der Untersuchungen bei variabler und konstanter Expositionskonzentration wurden zusammengefasst und mittels eines Benchmarkdosis (BMD)- Verfahrens ausgewertet. Als kritischer Effekt wurde eine Erhöhung der Lidschlussfrequenz (Ausgangswert 14,1 pro min) um eine Standardabweichung (7,3 pro min) gewählt. Aus diesen Analysen ergab sich eine BMD von 110 und eine BMDL von 80 mg EH/m3. Der MAK-Wert wurde auf 54 mg/ m3 festgelegt, auch wenn bei dieser Konzentration subjektive Augen- und Nasenreizungen nicht völlig ausgeschlossen werden können. Physiologische Reaktionen des trigeminalen Systems wurden jedoch als unwahrscheinlich betrachtet [57]. Bezüglich der reproduktionstoxischen Eigenschaften wurde die Einstufung in Gruppe C ("eine fruchtschädigende Wirkung ist bei Einhaltung des MAK-Wertes nicht zu befürchten") beibehalten.
Auf europäischer Ebene wurde 2011 vom Wissenschaftlichen Ausschuss für Arbeitsplatzgrenzwerte auf der Basis der Hurnanstudien (NOAEC 8 mg EH/m3) ein Arbeitsplatzgrenzwert in Höhe von 5 mg/m3 (8-Stunden-Mittelwert) festgelegt [2]. Die US-amerikanische Gesellschaft für Arbeitsplatzhygiene (American Industrial Hygiene Association - AI-HA) hat für EH einen tolerablen 1-Stundenw-Wert in Höhe von 0,5 mg/m3 festgelegt. Eine Begründung für diesen Wert liegt nicht vor [58].
Im Rahmen der Registrierung von EH bei der Europäischen Chemikalienbehörde wurde unter anderem eine sog. abgeleitete Konzentration ohne Wirkung (derived no effect level - DNEL) für die inhalative Langzeitexposition von Verbrauchern in Höhe von 2 mg/m3 angegeben. Das Begründungsdokument für diesen Wert ist nicht öffentlich verfügbar [59].
Die duldbare tägliche Aufnahmemenge für EH liegt bei 0,5 mg/kg KG (Basis: NOEL von 50 mg/kg KG/Tag in der Langzeitstudie an Ratten und einem Extrapolationsfaktor von 100) [5]. Diese Aufnahmemenge entspricht etwa einer Luftkonzentration von 2 mg/m3 (Annahmen: 70 kg KG, Atemvolumen 20 m3 pro Tag).
5.2 Ableitung von Richtwerten für 2-Ethylhexanol in der Innenraumluft
Die Ergebnisse der Untersuchungen von van Thriel, Kiesswetter und Kollegen zeigen, dass die sensorische Reizung im Vordergrund der Bewertung des EH steht. Da bei einmaliger Exposition über 4 h bereits bei 54 mg EH/m3 eine Erhöhung der Lidschlussfrequenz zu beobachten war, hat der europäische Wissenschaftliche Ausschuss für Arbeitsplatzgrenzwerte aus der Studie von Kiesswetter et al. ([23]; Klimisch-Kategorie 2) für den Endpunkt Irritation eine LOAEC von 54 mg/m3 und eine NOAEC von 8 mg/m3 abgeleitet. Die Ad-hoc-Arbeitsgruppe schließt sich dieser Bewertung an und leitet entsprechend dem überarbeiteten Basisschema [60] den Richtwert II auf Basis der LOAEC und den Richtwert I auf Basis der NOAEC aus dieser Studie ab.
Entgegen der sonst üblichen Verwendung eines reduzierten Intraspeziesfaktors von 5 bei Reizstoffen wird in diesem Fall ein Faktor von 10 zur Berücksichtigung der Intraspeziesvariabilität verwendet. Dieses Vorgehen wird damit begründet, dass es sich bei den Angaben zur Chemikaliensensitivität der Exponierten um eine Selbsteinschätzung der Probanden handelt und somit unklar ist, inwieweit es sich um wirklich sensitive Personen handelt. Weiterhin wurden in der Studie nur Männer, aber keine Frauen untersucht. Ein zusätzlicher Kinderfaktor wird nicht verwendet, da keine Hinweise auf eine besondere Empfindlichkeit von Kindern gegenüber sensorischen Reizstoffen vorliegen.
Es fehlen derzeit methodische Vorgaben zur Abschätzung von einer einmaligen Kurzzeitexposition auf eine subakute Expositionssituation. Eine Reizwirkung wird im Allgemeinen vor allem durch die Expositionshöhe und weniger durch die Expositionszeit bestimmt. Während der 4-stündigen Expositionszeit wurde keine deutliche Wirkungsverstärkung mit zu-nehmender Expositionszeit beobachtet. Allerdings zeigte sich in der Ernstgard et al.-Studie eine hohe Variabilität. Auch die deutlich höhere NOAEC in der subchronischen Inhalationsstudie an Ratten spricht gegen eine gravierende Wirkungsverstärkung mit der Zeit, weshalb auf eine Extrapolation von 4 h/Tag an einem Tag auf 24 h/Tag an 7 Tagen/Woche verzichtet wird. Berücksichtigt wird ein Faktor 6 zur Zeitextrapolation von subakut auf chronisch. Wegen der verbleibenden Unsicherheit in diesem Schritt sieht die Ad-hoc-Arbeitsgruppe den abgeleiteten Richtwert als vorläufig an. Somit ergibt sich als vorläufiger Richtwert II ein Wert in Höhe von gerundet 1 mg/m3. In analoger Weise ergibt sich ein vorläufiger Richtwert I in Höhe von 0,1 mg/m3 (Tab. 3).
Diese Ableitung auf Basis der Humanstudie wird nachfolgend möglichen Ableitungen aus Tierstudien gegenübergestellt. Als tierexperimentelle Inhalationsdaten liegen nur eine 90-Tage-Studie an Ratten (Klimisch et al. [34]; Guideline-Studie, Klimisch-Kategorie 1) und eine orale Studie zur Entwicklungstoxizität an Ratten vor (Nelson et al. [47, 48]; nur eine Dosisgruppe getestet, Klimisch-Kategorie 3) vor. Aus der 90-Tage-Studie lässt sich keine LOAEC, sondern nur eine NOAEC ableiten, da selbst in der höchsten getesteten Konzentration (638 mg/m3, der höchsten Dampfkonzentration bei Raumtemperatur), keine systemischen oder lokalen Effekte aufgetreten sind. Diese NOAEC wird als Ausgangspunkt zur Ableitung eines Richtwerts I verwendet. Nach [1] entspricht die NOAEC etwa einer Körperdosis von 156 mg/kg KG/d (Annahmen: 100% Retention, Atemvolumen 10 l/h; Körpergewicht 0,25 kg), und stimmt somit sehr gut mit den Daten aus den subchronischen Oralstudien überein (NOAEL Ratte 125 bzw. 167 mg/kg/d; NOAEL Maus 125 mg/kg/d). Da die vorliegenden Oralstudien eine Wirkungsverstärkung mit zunehmender Expositionszeit belegen, wird ein Zeitfaktor von 2 für die Extrapolation von subchronisch auf chronisch verwendet. Weiterhin ist eine Umrechnung von intermittieren-der auf kontinuierliche Exposition notwendig (x6/24x5/7). Für die Interspeziesextrapolation wird ein Faktor 2,5 zur Berücksichtigung toxikodynamischer Unterschiede verwendet, da als Basis eine Inhalationsstudie vorliegt. Zur Berücksichtigung der Intraspeziesvariabilität wird ein Faktor 10 und zum Schutz besonders empfindlicher Gruppen (Kinder) ein Faktor 2 verwendet. Es ergäbe sich somit ein Richtwert I in Höhe von 1 mg/m3 (638x6/24x5/7x1/100).
Weiterhin wird eine Richtwertableitung auf Basis der Studie zur Entwicklungstoxizität an Ratten (Hellwig und Jäckh [51]) in Pfad-zu-Pfad-Übertragung betrachtet. In dieser Studie lag der LOAEL bei 650 mg/ kg KG/d und der NOAEL bei 130 mg/kg KG/d. Zur Umrechnung der Oraldosis auf eine humane Inhalationskonzentration wurde ein allometrisches Scaling (Faktor 4) durchgeführt und ein Faktor 2,5 für Interspeziesunterschiede angewendet [1]. Weiterhin wurden ein humanes Körpergewicht von 70 kg und ein Atemvolumen von 20 m3 verwendet. Es ergibt sich somit eine humanäquivalente Inhalationskonzentration von 230 mg/m3 für die LOAEC und von 46 mg/m3 für die NOAEC. Für die Intraspeziesvariabilität wird ein Faktor 10 verwendet. Der Kinderfaktor wird nicht angewendet, da die Untersuchungen bereits an den empfindlichen sich entwickelnden Organismen durchgeführt wurden. Damit ergäbe sich ein Richtwert II in Höhe von 23 mg/m3 und ein Richtwert I in Höhe von 5 mg/m3.
Die Ableitung von Innenraumrichtwerten soll in der Regel nicht auf Basis von Akutdaten erfolgen [1]. Für die Verwendung der Humandaten spricht, dass die Probanden bei 54 mg EH/m3 bereits nach Kurzzeitexposition Effekte zeigten, während in der Langzeitrattenstudie noch keine Effekte auftraten; die Humanstudie erfasst also selektiv und empfindlich sensorische Reizeffekte. Die anhand der Humandaten abgeleiteten Richtwerte liegen um den Faktor 23-50 unter den anhand der Entwicklungstoxizität abgeleiteten Werten und um ca. eine Größenordnung unter dem auf Basis der subchronischen Inhalationsstudie abgeleiteten RW I. Wegen der verbleibenden Unsicherheit bei der Ableitung legt die Ad-hoc-Arbeitsgruppe vor-läufige Innenraumluftrichtwerte fest:
Vorläufiger Richtwert II: 1 mg 2-Ethyl-hexanol/m3.
Vorläufiger Richtwert I: 0,1 mg 2-Ethyl-hexanol/m3.
Anmerkungen
Der Textentwurf dieser Empfehlung wurde von Dr. Ulrike Schuhmacher-Wolz und Dr. Fritz Kalberlah erstellt und von der Ad-hoc-Arbeitsgruppe im November 2012 verabschiedet. Die Literaturrecherche wurde im September 2011 abgeschlossen.
| 1. | Greim H (2000) Gesundheitsschädliche Arbeitsstoffe, Toxikologisch-arbeitsmedizinische Begründungen von MAK-Werten, Loseblattsammlung, 30. Lfg. DFG Deutsche Forschungsgemeinschaft. WILEY-VCH, Weinheim |
| 2. | EU-SCOEL (2011) Recommendation from the Scientific Committee on Occupational Exposure Limits for 2-ethylhexanol. SCOELJSUM/158. Scientific Committee for Occupational Exposure Limits. European Commission. http://ec.europa.eu/social/keyDo-cuments.jsp?type=0&policy Area=82&subCatego-ry=153&country=0&year=0&advSearch Key=104- 76-7& mode="advanced" Submit&langld=en |
| 3. | US-NLM (2012) ChemIDplus Lite. U.S. National Library of Medicine; http://chem.sis.nlm.nih.govichemid-plus/chemidlite.jsp |
| 4. | BG-Chemie (1995) 2-Ethylhexanol (Nr. 114).Toxikologische Bewertungen, Programm zur Verhütung von Gesundheitsschädigungen durch Arbeitsstoffe. Berufsgenossenschaft der chemischen Industrie. Lose-blattsammlung, 12. Erg. Lfg., Heidelberg |
| 5. | WHO (1993) Toxicological evaluation of certain food additives and contaminants. Forty-first meeting of the joint FAO/WHO expert committee on food additives. WHO food additives series 32. World Health Organization, Geneva. http://www.inchem.org/pages/ jecfa.html |
| 6. | McGinty D, Scognamiglio J, Letizia CS, Api AM (2010) Fragrance material review on 2-Ethyl-1-hexanol. Food Chem Toxicol 48(Suppl 4):115-129 |
| 7. | Wieslander G, Norbäck D, Nordström K et al (1999) Nasal and ocular symptoms, tear film stability and biomarkers in nasal lavage, in relation to building-dam pness and building design in hospitals. Int Arch Occup Environ Health 72:451-461 |
| 8. | Bakö-Birö Z, Wargocki P, Weschler CJ, Fanger PO (2004) Effects of pollution from personal computers on perceived air quality, SBS symptoms and produc-tivity in offices. Indoor Air 14:178-187 |
| 9. | HVBG (2005) Innenraumarbeitsplätze -Vorgehensempfehlung für die Ermittlungen zum Arbeitsumfeld. Report der gewerblichen Berufsgenossenschaften, der Unfallversicherungsträger der öffentlichen Hand und des Berufsgenossenschaftlichen Instituts für Arbeitsschutz - BGIA. Hauptverband der gewerblichen Berufsgenossenschaften. http://www. dguv.de/ifa/de/pub/rep/pdf/rep05/innenraum/ge-samt.pdf |
| 10. | Nalli S, Cooper DG, Nicell JA (2006) Interaction of metabolites with R. rhodochrous during the bio-degradation of di-ester plasticizers. Chemosphere 65:1510-1517 |
| 11. | Nalli S, Cooper DG, Nicell JA (2006) Metabolites from the biodeg radation of di-ester plasticizers by Rhodo-coccus rhodochrous. Sci Tot Environ 366:286-294 |
| 12. | Nalli S, Horn 0J, Grochowalski AR et al (2006) Origin of 2-ethylhexanol as a VOC. Environ Pollut 140:181-185 |
| 13. | UBA (2008) Vergleichswerte für flüchtige organische Verbindungen (VOC und Aldehyde) in der Innenraumluft von Haushalten in Deutschland. Umweltbundesamt. Bundesgesundheitsblatt 51:109-112 |
| 14. | Hofmann H, Plieninger P (2008) Bereitstellung einer Datenbank zum Vorkommen von flüchtigen organischen Verbindungen in der Raumluft. Forschungsprojekt im Auftrag des Umweltbundesamtes. FuE-Vorhaben Förderkennzeichen 205 61 234. Umweltbundesamt, Dessau |
| 15. | Hahn N von, Gelder R van, Breuer D et al (2011) Ableitung von Innenraumarbeitsplatz-Referenzwerten. Gefahrstoffe - Reinhalt Luft 71:314-322 |
| 16. | Ostendorp G, Riemer D, Harmel K, Heinzow B (2009) Aktuelle Hintergrundwerte zur VOC-Belastung in Schulen und Kindergärten in Schleswig-Holstein. Umweltmed Forsch Prax 14:135-152 |
| 17. | Fromme H, Heitmann D, Dietrich S et al (2008) Raumluftqualität in Schulen - Belastung von Klassenräumen mit Kohlendioxid (CO2), flüchtigen organischen Verbindungen (VOC), Aldehyden, Endotoxinen und Katzenallergenen. Gesundheitswes 70:88-97 |
| 18. | Sakai K, Kamijima M, Shibata E et al (2009) Annual transition and seasonal variation of indoor air pollution levels of 2-ethyl-1-hexanol in large-scale buildings in Nagoya, Japan. J Environ Monit 11:2068-2076 |
| 19. | Sakai K, Kamijima M, Shibata E et al (2006) Indoor air pollution by 2-ethyl-1-hexanol in non-domestic buildings in Nagoya, Japan. 1 Environ Monit 8:1122-1128 |
| 20. | BfR (2004) Daten zu Schadstoffbelastung in Scou-bidou-Bändern. Bundesinstitut für Risikobewertung Stellungnahe des BfR vom 29.0kt. 2004. http:// www.bfr.bund.de/cm/343/daten_zur_schadstoff belastung_von_scoubidou_baendern.pdf |
| 21. | Deisinger PJ, Boatman RJ, Guest D (1994) Metabolism of 2-ethylhexanol administered orally and dermally to the female Fischer 344 rat. Xenobiotica 24:429-440 |
| 22. | Scala RA, Burtis EG (1973) Acute toxicity of a homo-logous series of branched-chain primary alcohols. Am Ind Hyg AssocJ 34:493-499 |
| 23. | Kiesswetter E, Thriel C van, Schäper M et al (2005) Eye blinks as indicator for sensory irritation during constant and peak exposures to 2-ethylhexanol. Environ Toxicol Pharmacol 19:531-541 |
| 24. | Thriel C van, Kiesswetter E, Schä per M et al (2005) An integrative approach considering acute symptoms and intensity ratings of chemosensory sensations during experimental exposures.Environ Toxicol Pharmacol 19:589-598 |
| 25. | Thriel C van, Seeber A, Kiesswetter E et al (2003) Physiological and psychological approaches to chemosensory effects of solvents.Toxicol Lett 140- 141:261-271 |
| 26. | Thriel C van, Kiesswetter E, Schä per M et al (2007) From neurotoxic to chemosensory effects: new insights on acute solvent neurotoxicity exemplified by acute effects of 2-ethylhexanol. Neurotoxicol 28:347-355 |
| 27. | Ernstgard L, Norbäck D, Nordquist T et al (2010) Acute effects of exposure to 1 mg/m3 of vaporized 2-Ethyl-1-hexanol in humans. Indoor Air 20:168-175 |
| 28. | Muller1, Greff G (1984) Relation between the toxicity of molecules of industrial value and their physico-chemical properties: test of upper airway irritation applied to 4 chemical groups.Food Chem Toxicol 22:661-664 |
| 29. | Hüls AG, Ps-Biologie/Toxikologie (1987) Prüfung der akuten Augen- und Schleimhautreizung von 2-Ethyl-hexanol. Unveröffentlichter Bericht Nr. 1048, zitiert nach [4] |
| 30. | Wieslander G, Kumlin A, Norbäck D (2010) Dampness and 2-Ethyl-1-hexanol in floor construction of rehabilitation center: health effects in staff. Arch Environ Occupat Health 65:3-11 |
| 31. | Wieslander G, Norbäck D, Björnsson E et al (1996) Asthma and the indoor environment: the significance of emission of formaldehyde and volatile organic compounds from newly painted indoor surfaces. Int Arch Occup Environ Health 69:115-124 |
| 32. | Norbäck D, Torgen M, Edling C (1990) Volatile organic compounds, respirable dust, and personal factors re-lated to prevalence and incidence of sick building syn-drome in primary schools. BrJ Ind Med 47:733-741 |
| 33. | Norbäck D, Wiesla nder G, Nordström K, Walinder R (2000) Asthma symptoms in relation to measured building dampness in upper concrete floor construction, and 2-Ethyl-1-hexanol in indoor air. IntJ Tuberc Lung Dis 4:1016-1025 |
| 34. | Klimisch HJ, Deckardt K, Gembardt C, Hildebrand B (1998) Subchronic Inhalation toxicity study of 2-ethylhexanol vapour in rats. Food Chem Toxicol 36:165-168 |
| 35. | Meilen Institute of Industrial Research (1961) Gross results of three months of inclusion of 2-ethyl hexanol in the diet of rats. University of Pittsburgh. Spezial report. Bericht Nr. 23-61, im Auftrag der Union Carbide Chemicals Co. NTIS/OTS0515388, zitiert nach [4] |
| 36. | Meilen Institute of Industrial Research (1961) Results of three months of inclusion of 2-ethyl hexanol in the diet of rats. University of Pittsburgh. Pathology report. Bericht Nr. 24-28, im Auftrag der Union Carbide Chemicals Co. NTIS/OTS0515388, zitiert nach [4] |
| 37. | BASF AG AT (1991) Report on the study of the oral toxicity of 2-ethylhexanol in rats after administration by gavage (aqueous emulsion) for 3 months. Un-veröffentlichter Bericht, Project No. 31C0631/87077, im Auftrag der Chemical Manufacturers Association, Washington, USA, zitiert nach [4] |
| 38. | BASF AG AT (1991) Report on a limited study of the oral toxicity of 2-ethylhexanol in rats after administration by gavage (aqueous emulsion) for 3 months. Unveröffentlichter Bericht, Project No. 31C0631/87082, im Auftrag der Chem ical Manufacturers Association, Washington, USA, zitiert nach [4] |
| 39. | BASF AG AT (1991) Report on the study of the oral toxicity of 2-ethylhexanol in mice after administrati-on by gavage (aqueous emulsion) for 3 months. Un-veröffentlichter Bericht, Project No. 36C0631/87085, im Auftrag der Chemical Manufacturers Association, Washington, USA, zitiert nach [4] |
| 40. | BASF AG AT (1991) Report on a limited study of the oral toxicity of 2-ethylhexanol in mice after ad-ministration by gavage (aqueous emulsion) for 3 months. Unveröffentlichter Bericht, Project No. 36C0631/87086, im Auftrag der Chem ical Manufacturers Association, Washington, USA, zitiert nach [4] |
| 41. | Astill BD, Gingell R, Guest D et al (1996) Oncogenicity testing of 2-ethylhexanol in Fischer 344 rats and B6C3F1 mice. Fundam Appl Toxicol 31:29-41 |
| 42. | Schmidt P, Gohlke R, Rothe R (1973) ZurToxizitat einiger C8-Aldehyde und -Alkohole. Zeitschrift für die gesamte Hygiene und ihre Grenzgebiete 19:485- 490 (zitiert nach BG-Chemie, 1995) |
| 43. | LBI (1982) Mutagenicity evaluation of 2-ethylhexanol (2-EH) in the mouse micronucleus test. Unveröffentlichter Bericht. Litton Bionetics Inc., Kensington, Maryland, USA. LBI Project No. 20996, im Auftrag der Chemical Manufacturers Association, Washington, USA, zitiert nach [4] |
| 44. | Putman DL, Moore WA, Schechtman LM, Hodgson JR (1983) Cytogenetic evaluation of di-(2-ethylhexyl) phthalate and its major metabolites in Fischer 344 rats. Environ Mutagen 5:227-231 (zitiert nach [4]) . |
| 45. | Rushbrook CJ, Jorgenson TA, Hodgson JR (1982) Dominant lethal study of di(2-ethylhexyl)phthalate and its major metabolites in ICR/SIM mice. Environ Mutagen 4:387 (zitiert nach [4]) |
| 46. | Sjöberg P, Bondesson U, GrayTJ, Plöen L (1986) Effects of di-(2-ethylhexyl) phthalate and five of its metabolites on rat testis in vivo and in in vitro. Acta Pharmacol Toxicol (Copenh) 58:225-233 (zitiert nach [4]) |
| 47. | Nelson BK, Brightwell WS, Khan A et al (1988) Teratological evaluation of 1-pentanol, 1-hexanol and 2-Ethyl-1-hexanol administered by in halation to rats. Teratology 37:479-480 (zitiert nach [4]) |
| 48. | Nelson BK, Brightwell WS, Khan A et al (1989) Developmental toxicology evaluation of 1-pentanol, 1-hexanol, and 2-Ethyl-1-hexanol administered by inhalation to rats.1 Am Coll Toxicol 8:405-410 (zitiert nach [4]) |
| 49. | Ritter EJ, ScottWJ, Randall JL, Ritter JM (1985)Teratogenicity of dimethoxyethyl phthalate and its metabolites methoxyethanol and methoxyacetic acid in the rat. Teratol 32:25-31 |
| 50. | Ritter EJ, ScottWJ, Randall JL, Ritter JM (1987)Teratogenicity of di(2-ethylhexyl) phthalate, 2-ethylhexanol, 2-ethylhexanoic acid, and valproic acid, and potentiation by caffeine. Teratology 35:41-46 (zitiert nach [4]) |
| 51. | Hellwig 1, Jäckh R (1997) Differential prenatal toxicity of one straight-chain and five branched-chain primary alcohols in rats. Food Chem Toxicol 35:489-500 |
| 52. | Price C1, Tyl RW, Marr MC et al (1991) Developmental toxicity evaluation of DEHP metabolites in Swiss mice.Teratol 43:457 (zitiert nach [4]) |
| 53. | Hardin BD, Schuler RL, Burg JR et al (1987) Evaluation of 60 chemicals in a preliminary developmental toxicity test.Teratog Carcinog Mutagen 7:29-48 |
| 54. | Tyl RW, Fisher LC, Kubena MF et al (1992) The developmental toxicity of 2-ethylhexanol applied dermally to pregnant Fischer 344 rats. Fundam Appl Toxicol 19:176-185 (zitiert nach [4, 5]) |
| 55. | Ruth JH (1986) Odor tresholds and irritation levels of several chemical substances: a review. Am Ind Hyg Assoc 147:A142-A151 |
| 56. | DFG (2011) MAK- und BAT-Werte-Liste 2011. Deutsche Forschungsgemeinschaft. Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe. Mitteilung 47. WILEY-VCH Verlag GmbH, Weinheim |
| 57. | Hartwig A (2011) 2-Ethylhexanol. Nachtrag 2012. Unveröffentlichter Entwurf. Gesundheitsschädliche Arbeitsstoffe, Toxikologisch-arbeitsmedizinische Begründungen von MAK-Werten, Loseblattsammlung |
| 58. | US-AIHA Guideline Foundation (2011) Current ERPGTwi Values (2011). 2011 ERPG/WEEL Handbook 21-30 |
| 59. | ECHA (2012) Information on chemicals - registered substances. European Chemicals Agency. http:// echa.europa.eu/web/guest/information-on-chemicals/registered-substances, Disclaimer: http://echa. europa.eu/web/guest/legal-notice |
| 60. | Ad-hoc-AG (2012) Richtwerte für die Innenraumluft: erste Fortschreibung des Basisschemas. Mitteilung der Ad-hoc-Arbeitsgruppe Innenraumrichtwerte der Innenraumlufthygiene-Kommission des Umweltbundesamtes und der Obersten Landesgesundheitsbehörden. Bundesgesundheitsbl 55:279-290 |
 | ENDE |  |
...
X
⍂
↑
↓
