Carbanil
Isocyansäurephenylester
Phenylcarbimid
Phenylcarbonimid
n-Octanol-Wasser-
1 mg/m3 = 0,202 ml/m3 (ppm)
| zurück |
Phenylisocyanat
(CAS-Nr.: 103-71-9)
Ausgabe:
Januar 2006
Stand:
März 1994
0,01 ml/m3 = 0,05 mg/m3
Spitzenbegrenzung: Kategorie I
1 Substanzcharakteristik
| Substanzname: | Phenylisocyanat |
| Synonyma: | Isocyanatobenzol
Carbanil Isocyansäurephenylester Phenylcarbimid Phenylcarbonimid |
| Strukturformel: | 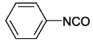 |
| Summenformel: | C7H5NO |
| CAS-Nummer: | 103-71-9 |
| BG-Stoffliste Nr.: | 198 (Toxikol. Bewertung 05/1991) |
| molare Masse: | 119,12 g/mol |
| Schmelzpunkt: | -31,3°C |
| Siedepunkt: | 165°C |
| Flammpunkt: | 51°C |
| Dampfdruck: | 250 Pa (20°C) |
| Luftsättigungskonzentration: | 12.217 mg/m3 (20°C) |
| spezifisches Gewicht: | 1,095 g/cm3 (20°C) |
| Löslichkeit: | Zersetzung in Wasser; mischbar mit organischen Lösungsmitteln (z.B. Ether, Chloroform) |
| Reaktivität:
n-Octanol-Wasser- | Phenylisocyanat reagiert exotherm bei Kontakt mit Wasser, Alkohol, Aminen, Säuren und Laugen sowie mit starken Oxidationsmitteln unter CO2-Entwicklung |
| Verteilungskoeffizient: | nicht anwendbar (Zersetzung) |
| Aussehen: | klare, farblose Flüssigkeit mit stechendem Geruch |
| Umrechnungsfaktoren (20°C): | 1 ml/m3 (ppm) = 4,943 mg/m3 1 mg/m3 = 0,202 ml/m3 (ppm) |
2 Grenzwerte, Einstufungen, Regelungen
| MAK (UdSSR): | 0,5 mg/m3 |
| MAK (Schweden): | 0,02 mg/m3 S (Schichtmittelwert) 0,05 mg/m3 S (Kurzzeit-Grenzwert; 5 min./Schicht) |
| VbF-Klasse: | A II |
| Merkblatt der BG-Chemie Nr. M 044 (Isocyanate)
Transportregelungen: | |
| GGVE/GGVS: 6.1/18 b | RID: 6.1/18 b ADR: 6.1/18 b |
| IMDG-Code: 6.1/II UN-Nr. 2487 | IATA/ICAO: 6.1 UN-Nr. 2487 |
3 Herstellung und Verwendung
Phenylisocyanat wird aus Anilin und Phosgen hergestellt und als Zwischenprodukt bei der Synthese von Pflanzenschutzmitteln, Pharmazeutika, optischen Aufhellern, Textilhilfsmitteln und Weichmachern eingesetzt.
4 Analytische Bestimmungsmethode
| Probenahme: | Adsorption an imprägnierter Glaswatte entsprechend DFG-Methode HDI/TDI |
| Pumpe: | DuPont 2500 S
(1 l/min, ca. 60 l in einer Stunde) |
| Desorption: | 3 ml Acetonitril
15 min Ultraschall 15 min schütteln |
| HPLC-Bestimmung | Stahlsäule, 0,25 m, Durchmesser 8 mm
Füllung ET 250/8/4 auf Lichrosorb RP 18/10 Eluent: 55 ml wässrige Pufferlösung (4 g/l Phosphorsäure; 0,2 g/l Hexylamin) 45 ml Acetonitril Flussrate 1 ml/min Injektionsvolumen 10 µl UV-Detektor (DAD) Absorption bei 270 nm |
| Kalibrierung: | externer Standard |
| Bestimmungsgrenze: | 0,005 mg/m3 bei 200 l Probeluft |
5 Metabolismus, Toxikokinetik
Keine Informationen vorhanden
6 Erfahrungen am Menschen
Aufgrund des Verdachts, dass im MDI-Produkt Bevedan Phenylisocyanat als allergen wirkende Verunreinigung enthalten sei, wurden im Rahmen einer epidemiologischen Studie an 284 Bergleuten, von denen 216 mit einem MDI-haltigen Gebirgsverfestigersystem gearbeitet hatten, auch Radio Allergo Sorbent Tests (RAST) auf Phenylisocyanat im Plasma durchgeführt. Die Score-Werte lagen im Mittel bei 1,033; als normal gelten Score-Werte von maximal 2,0. Zwei Probanden wiesen einen Score-Wert von > 2,0 auf: Während der Proband mit dem mit 2,76 höchsten Score-Wert ansonsten klinisch unauffällig war, hatte der andere Proband mit dem Wert 2,48 bereits vor 4 Jahren eine schwere obstruktive Atemwegserkrankung erlitten und musste auf einen anderen Arbeitsplatz versetzt werden. Im bronchialen Provokationstest wurde bei ihm eine Überempfindlichkeit gegenüber MDI nachgewiesen. Eine Sensibilisierung gegen Phenylisocyanat wurde zwar nicht getestet, erscheint aber durchaus denkbar angesichts des noch 4 Jahre nach Expositionsende positiven RAST [1].
7 Experimentelle Toxizitätsdaten
7.1 Akute Toxizität, lokale Verträglichkeit, Sensibilisierung
7.1.1 Akute Toxizität
Die Daten zur akuten Toxizität von Phenylisocyanat sind in der Tabelle 1 zusammengestellt.
Nach akuter oraler Gabe von Phenylisocyanat per Schlundsonde (gelöst in Erdnussöl) kam es bei Ratten beiderlei Geschlechts ab einer Dosis von 100 mg/kg KGW bereits nach maximal 10-15 Minuten zu zentralnervösen Effekten (Taumeln, geringe Reflexe, verminderte Motilität), zu erschwerter Atmung, Lidschluss, Bauchlage und Cyanose. Die Symptome hielten 24 Stunden an und anschließend waren die Tiere bis zu 48 Stunden lang apathisch. Nach Verabreichung letaler Dosen trat der Tod innerhalb von 0,5-24 Stunden ein. Die Dosis von 25 mg/kg KGW wurde ohne äußere Symptome vertragen. Die Sektion der während des Versuchs verendeten Tiere erbrachte folgenden Befund: Lehmfarbene Lungen, leicht gerötete Nierenbecken, verhärtete Schleimhäute des Vormagens, gerötete Drüsenmagen und teilweise blasse Lebern mit schwacher Läppchenzeichnung. Bei den am Versuchsende getöteten Tieren wies lediglich die Magenschleimhaut eine leichte Verhärtung auf [2].
Innerhalb von 20 Minuten nach akuter Gabe von Phenylisocyanat per Schlundsonde (gelöst in Polyethylenglykol 400) zeigten Ratten beiderlei Geschlechts Apathie und Atembeschwerden. Innerhalb von 24 Stunden waren die Symptome reversibel. Nach Gabe letaler Dosen starben die Tiere unter Krämpfen innerhalb von maximal 24 Stunden. Die Sektion erbrachte bei den verendeten Tieren Entzündungen im Magen-Darm-Trakt, die bei Versuchsende getöteten Tiere waren ohne auffälligen makroskopischen Befund [3].
Tabelle 1: Daten zur akuten Toxizität von Phenylisocyanat
| Spezies | Geschl. | Applikationsweg | LD50/LC50 | Ref. |
| Ratte | mnl./wbl. | oral | 2500-2750 mg/kg KGW | [2] |
| Ratte | männl. | oral | 1044 mg/kg KGW | [3] |
| Ratte | weibl. | oral | 172 mg/kg KGW | [3] |
| Ratte | mnl./wbl. | oral | 887 mg/kg KGW* | [4] |
| Ratte | n | oral | 940 mg/kg KGW | [5] |
| Maus | männl. | oral | 196 mg/kg KGW | [6] |
| Ratte | männl. | dermal | ca. 5475 mg/kg KGW** | [2] |
| Ratte | weibl. | dermal | > 5475 mg/kg KGW** | [2] |
| Kaninchen | mnl./wbl. | dermal | > 2000 mg/kg KGW*** | [3] |
| Kaninchen | weibl. | dermal | 7130 mg/kg KGW** | [7] |
| Ratte | mnl./wbl. | inhal. | 19-61 mg/m3/1 h | [8] |
| Ratte | mnl./wbl. | inhal. | 22 mg/m3/4 h | [9] |
*) Präparat 2x destilliert
**) Expositionszeit 24 Std. okklusiv
***) Expositionszeit 24 Std. okklusiv; keine Todesfälle
n) keine Angabe
Nach Gabe von konzentriertem Phenylisocyanat (2x destilliert) mit der Magensonde kam es bei Ratten zu Cyanose, Narkose, Atmungsstörung, Herabsetzung des Allgemeinbefindens und Gewichtsverlust; die Dosis von 110 mg/kg KGW wurde symptomlos vertragen [4].
Als Test auf eine mögliche lebertoxische Wirkung erhielten 10 männliche Swiss-Webster Mäuse eine einmalige Applikation von 300 mg Phenylisocyanat/kg KGW mit der Magensonde und nach 48 Stunden wurde der Plasma-Bilirubinspiegel gemessen. Es traten keine Todesfälle auf und es ergaben sich keine Anzeichen für eine Hepatotoxizität [10].
Spätestens 15 Minuten nach der dermalen Applikation von Phenylisocyanat kam es bei Ratten zu Schmerzreaktionen, verminderter Motilität, erschwerter Atmung, Schwäche der hinteren Extremitäten und Gewichtsverlust. Im Auftragsbereich traten Entzündungen auf, gefolgt von Nekrosen, die narbig abheilten. Bei der Sektion der während des Versuchs verendeten Tiere wurden geblähte und fleckige Lungen sowie gerötete Nierenbecken festgestellt. Bei den bei Versuchsende getöteten hochdosierten Tieren waren ebenfalls die Lungen gebläht, bei den übrigen Tieren waren alle inneren Organe makroskopisch ohne Befund [2].
Kaninchen vertrugen die dermale Applikation von 2000 mg Phenylisocyanat/kg KGW ohne äußere Symptome. Die Sektion der bei Versuchsende getöteten Tiere erbrachte folgenden Befund: dunkler Ring an der Basis der Nierenrinde, körnige Struktur der Leber, dunkel gefärbte Lungen und Milzkongestionen [3].
Bei der akuten Inhalationsstudie an Ratten traten die Todesfälle überwiegend erst 8-12 Tage nach der Exposition auf; als Vergiftungssymptome werden gesträubtes Fell, Atmungsbeschwerden und Gewichtsverlust genannt [8].
In der neueren akuten Inhalationsstudie (dynamische Verdampfung; Kopf-Nase-Exposition) kam es bei Ratten ab einer Konzentration von ca. 5 mg/m3 zu Atemwegsreizungen und Atmungsbeschwerden und zu einer stark verzögerten Mortalität, wahrscheinlich bedingt durch eine irritative Lungenschädigung. Bei der Sektion der verendeten Tiere wurden geblähte, leberartig veränderte und ödematöse Lungen, mit viskosem Schleim gefüllte Bronchialäste, Hydrothorax, gerötete Dünndarmmucosa und Rhinaria, blasse Leber, Nieren und Milz und blutigschleimiger Inhalt im Magen-Darm-Trakt festgestellt. Bei den am Ende der 4-wöchigen Nachbeobachtungszeit getöteten Tieren wurden ab einer Konzentration von 21 mg/m3 geblähte Lungen vorgefunden. Der NOEL lag bei 0,7 mg/m3/4 h [9].
Im Zeit-Sättigungstest (dynamische Verdampfung bei 20°C) führte die 3-, 10- und 30-minütige Exposition von Ratten beiderlei Geschlechts in allen Fällen zum Tod der Tiere. Als Vergiftungssymptome wurden Verhaltensstörungen, Atmungsbeschwerden, Atemnot, Bauch-Seitenlage, starke Reizung der Schleimhäute von Augen und Nase und Gewichtsverlust beobachtet. Bei der Sektion der verendeten Tiere wurden dunkelrote, leberartig veränderte Lungen, klare Flüssigkeit in Lunge und Brustraum, blasse Milz und Nieren sowie Entzündungen im Magen-Darm-Trakt festgestellt [2].
Die 6-stündige Exposition von je 5 männlichen und weiblichen Ratten gegenüber einer Phenylisocyanat-Dampfkonzentration von ca. 2360 mg/m3 (dynamische Verdampfung bei ca. 22°C) führte zum Tod aller Tiere innerhalb von 75 Minuten nach Expositionsbeginn. Bei der Sektion der verendeten Tiere wurden hämorrhagische Lungen mit Ödemen festgestellt [3].
An der männlichen Maus wurde das sensorische Reizpotential von Phenylisocyanat bestimmt. Es ergab sich ein 30 Minuten-RD50-Wert von 1,2 ppm = 5,9 mg/m3 [11].
7.1.2 Lokale Verträglichkeit
An der Kaninchenhaut wirkte Phenylisocyanat bei 4-stündiger Einwirkzeit stark reizend [2] bzw. nicht reizend [3], bei 24-stündiger Einwirkzeit stark reizend bzw. ätzend [12].
Am Kaninchenauge wirkte Phenylisocyanat stark reizend [13] bzw. stark reizend und ätzend [2,3].
7.1.3 Sensibilisierung
In einer Arbeit aus dem Jahre 1962 wird über eine sensibilisierende Wirkung von Phenylisocyanat beim Meerschweinchen nach subkutaner Injektion berichtet. Nähere Einzelheiten sind der japanischen Arbeit nicht zu entnehmen [14].
7.2 Subakute, subchronische Toxizität
7.2.1 Subakute Toxizität
Je 8 männliche und 8 weibliche Ratten wurden für 6 Stunden/Tag an 5 Tagen/Woche über einen Zeitraum von 3 Wochen gegenüber Phenylisocyanat-Dampfkonzentrationen (generiert in Petrolether) von 0 (Luft- bzw. Petroletherkontrolle); 0,27 bzw. 2,42 mg/m3 exponiert und direkt nach der letzten Exposition getötet. Bei den Tieren der 2,42 mg/m3-Gruppe kam es nach 10-12 Tagen zu Piloerektion, Gewichtsverlust, Hämokonzentration und Atmungsbeschwerden (Atemzugvolumen, Atemfrequenz, Minutenvolumen und Compliance erniedrigt und Resistance erhöht). 1 Männchen starb am 9. und 1 Weibchen am 12. Tag; die restlichen 14 Tiere dieser Gruppe wurden am 12. Tag getötet (davon 7 Tiere im moribunden Zustand). Bei der Sektion dieser Tiere wurden in einigen Fällen makroskopisch sichtbare Lungenveränderungen (Lungen blass mit roten Flecken) festgestellt. Mikroskopisch wurden entzündliche Veränderungen im Atemtrakt mit Epithelhyperplasien, in den Bronchien verbunden mit Polypbildung, submucosaler obstruktiver Fibrosis und squamöser Metaplasie festgestellt. Außerdem wurden minimale Schädigungen des Lungenparenchyms in den Alveoli, bestehend aus alveolären Ödemen und Fibrinablagerungen, Hämorrhagien, akuter Alveolitis, chronischer interstitieller entzündlicher Infiltration/Fibrosis und Epithelisierung, beobachtet.
Bei den Tieren der 0,27 mg/m3-Gruppe wurde lediglich beim Lungenfunktionstest eine erhöhte Resistance gegen Ende der 3. Versuchswoche sowie bei 2 Tieren minimale entzündliche Veränderungen des Atemtrakts im Bereich der Larynx/Trachea und der Bronchien festgestellt.
Damit ergibt sich in dieser Studie kein NOEL [8,15].
Es liegt eine neuere Untersuchung zur orientierenden subakuten Inhalationstoxizität an der Ratte vor. Dabei wurden je 10 männliche und 10 weibliche Ratten/Gruppe an 5 aufeinanderfolgenden Tagen für 6 Stunden täglich gegenüber analytisch gemessenen Phenylisocyanat-Dampfkonzentrationen von 0; 0,12; 0,57 bzw. 3,14 mg/m3 Kopf-Nase exponiert (dynamische Bedingungen). Es traten keine Todesfälle auf und es ergaben sich keine Anzeichen für eine kumulative Wirkung. Bei allen Tieren der 3,14 mg/m3-Gruppe trat ein seröser Nasenausfluss auf, der spätestens am 8. Tag abklang; Rektaltemperatur und Körpergewichtsentwicklung blieben unbeeinflusst. Je 5 männliche und 5 weibliche Ratten/Gruppe wurden am 7./8. und die restlichen Tiere am 28./29. Versuchstag getötet und eingehend untersucht. Die
relativen Organgewichte von Herz, Lunge und Leber zeigten keine Hinweise auf spezifische Veränderungen. Bei den am 7./8. Versuchstag sezierten Tieren der 3,14 mg/m3 Gruppe, nicht jedoch bei den am 28./29. Tag sezierten, zeigte sich ein marginaler Anstieg im Protein- und Laktatdehydrogenase- sowie ein signifikanter Anstieg im b-Glutamyltransferase-Gehalt der Lungenlavageflüssigkeit. Von den Tieren der 0,12 und der 0,57 mg/m3-Gruppe wurden die Expositionen symptomlos vertragen. Diese Befunde lassen die Schlussfolgerung zu, dass es nur bei den Ratten der 3,14 mg/m3-Gruppe zu einer Reizung des oberen (seröser Nasenausfluss) und des unteren Atemtrakts (b-Glutamyltransferase-Anstieg) kommt.
Damit liegt der NOEL bei 0,57 mg/m3 für eine 5x6-stündige Exposition [16].
Je 10 Wistar-Ratten pro Geschlecht und Behandlungsgruppe wurden über einen Zeitraum von 4 Wochen an 5 Tagen/Woche für jeweils 6 Stunden täglich gegenüber analytisch gemessenen mittleren Phenylisocyanat (99,9 % rein)-Dampfkonzentrationen von 0 (Luft-Kontrolle); 0,35; 0,83; 2,79 bzw. 10,07 mg/m3 Kopf-Naseexponiert.
Bis zu einer Konzentration von einschließlich 2,79 mg/m3 wurde die Exposition klinisch symptomlos vertragen; Körpergewicht, Organgewichte, Rektaltemperatur sowie die Reflexe blieben unbeeinflusst. Die hämatologischen und klinischchemischen Untersuchungen blieben ohne toxikologisch relevanten Befund.
Ab 2,79 mg/m3 wurden erste Anzeichen für eine lokale Schädigung des oberen Respirationstrakts, charakterisiert durch eine Gobletzell-Hyperplasie im Turbinalienbereich, festgestellt.
Bei den Tieren der 10,07 mg/m3 Gruppe kam es zu einer fortschreitenden Körpergewichtsretardierung. Die beobachteten klinischen Symptome (Brady-, Tachyund Dyspnoe, seröser Nasenausfluss, Cyanose, Atmungsgeräusche) standen im Kausalzusammenhang mit der Atemtraktreizenden Wirkung des Phenylisocyanats. Weiterhin wurde eine starke Hypothermie sowie bei einzelnen Tieren dieser Gruppe eine verminderte Reaktionsfähigkeit auf äußere Stimuli festgestellt. Die ophthalmologischen Untersuchungen ergaben eine Irishyperämie, einen geröteten Fundus sowie eine Chorioidalgefäßkongestion. Die Organgewichte von Leber, Hoden, Milz und Thymus waren signifikant erniedrigt und das Lungengewicht signifikant erhöht. Bei der histopathologischen Untersuchung wurde eine globale Schädigung des Atemtrakts festgestellt; Hinweise auf spezifische Schädigungen anderer Organe ergaben sich nicht. Ebenfalls erhöht waren die Erythrozyten- und Retikulozytenzahl, der Hämatokrit und die Hämoglobinkonzentration. Bei der klinischchemischen Untersuchung ergaben sich Hinweise auf funktionelle
Leberveränderungen (Gerinnungszeit verlängert, Serum-Aktivität von Aspartataminotransferase und Glutamat-Laktat-Dehydrogenase erhöht, Protein- und Albumin-Konzentration im Serum erniedrigt). Elektrolytverschiebungen (Cl erniedrigt, Na erhöht) und die leichte Azidifizierung des Harns stehen ebenso wie die hämatologischen und klinischen Befunde wahrscheinlich im kausalen Zusammenhang mit der Phenylisocyanatinduzierten Lungenschädigung.
Infolge der Atemtraktveränderungen starben während des Versuchs 70 % der männlichen und 50 % der weiblichen Tiere der 10,07 mg/m3-Gruppe.
Damit ergibt sich in dieser Studie aufgrund der bei 2,79 mg/m3 aufgetretenen Gobletzell-Hyperplasie ein NOEL von 0,83 mg/m3 (20 x 6 h) [17].
Zur Bewertung des asthmatogenen Potentials von Phenylisocyanat wurde eine Ergänzungsstudie zur subakuten Inhalationsstudie [17] durchgeführt. Dabei wurden je 20 männliche Wistar-Ratten pro Gruppe über einen Zeitraum von 2 Wochen gegenüber analytisch gemessenen Phenylisocyanat-Dampfkonzentrationen von 0 (Luft-Kontrolle); 1,04; 4,10; 7,18 bzw. 10,39 mg/m3 (6 Std./Tag, 5 Tage/ Woche) Kopf-Naseexponiert unter dynamischen Bedingungen. Je 10 Tiere/Gruppe (von der 10,39 mg/m3-Gruppe jedoch alle Tiere) wurden in der 3. Woche und die restlichen Tiere am Ende der 7-wöchigen Nachbeobachtungszeit getötet. Während die niedrigste Konzentration symptomlos und schädigungslos vertragen wurde, traten ab 4,10 mg/m3 marginale substanzbedingte Effekte am Atemtrakt auf (veränderte Lungenfunktionsparameter und Gobletzellhyperplasie in den Luftwegen). Ab 7,18 mg/m3 wurden folgende konzentrationsabhängig ausgeprägte Effekte festgestellt: Körpergewichtserniedrigung, Hypothermie, Mortalität, Atemwegsreizung (unregelmäßige Atmung, Dyspnoe, seröser Nasenausfluss, Atemnot, Cyanose, Atemgeräusche, erhöhtes Lungengewicht), verringerte Organgewichte von Milz, Thymus, Leber und Niere, Veränderungen hämatologischer Parameter, Augenveränderungen (Cornea-Dystrophie, Kongestion der Chorioidalgefäße), alveoläre Makrophageninfiltration, Atrophie des olfaktorischen Epithels und schleimige Bronchitis. Die weiterhin nachgewiesenen Rundzellinfiltrationen, peribronchiale Infiltrationen von eosinophilen Granulozyten, Hypertrophien der
Bronchialmuskulatur sowie der Leukotrien (LTB4)-Anstieg in der Lungenspülflüssigkeit stellen klassische Asthmakorrelate dar. Neben dem LTB4-Anstieg waren in der Lungenlavage noch weitere biochemische und cytologische Korrelate einer Bronchioalveolitis nachweisbar und die Tiere wiesen obstruktive
Lungenveränderungen sowie eine Atemwegshyperreaktivität gegenüber Acetylcholin-Aerosol auf. Alle Effekte waren in der Nachbeobachtungszeit nicht oder nur trendartig reversibel.
Die festgestellten Symptome deuten auf eine globale, unspezifische Schädigung des gesamten Atemtrakts sowie auf eine dadurch bedingte Stresssituation der Tiere hin. Damit weist Phenylisocyanat ein ausgeprägtes asthmatogenes Potential auf; der NOEL liegt in dieser Studie bei 1,04 mg/m3 (10 x 6 h) [18].
7.2.2 Subchronische Toxizität Keine Informationen vorhanden
7.3 Chronische Toxizität, Cancerogenität
Keine Informationen vorhanden
7.4 Genotoxizität
In der Tabelle 2 sind die Ergebnisse aus bakteriellen Punktmutationstesten mit Phenylisocyanat zusammengestellt.
Tabelle 2: Punktmutationstest-Ergebnisse mit Phenylisocyanat an Bakterien
| Indikator-Organismus | Dosisbereich (µg/Platte) | Aktivierung | Ergebnis | Lit. |
| S.typh.
TA98,TA100,
TA1535,TA1537 | 20-2500 | mit u. ohne
S9-Mix | - | [19] |
| S.typh.
TA98,TA100,
TA1537 | ? | mit u. ohne
S9-Mix | - | [20] |
| S.typh.
TA98,
TA100 | ? | mit u. ohne
S9-Mix | nicht eindeutig | [21] |
| S.typh. TA100 | 100 | ohne | + | [22] |
| E.coli Sd-4-73 | ? | ? | - | [23] |
An drei auxotrophen Stämmen von Streptomyces aureofaciens zeigte Phenylisocyanat in Konzentrationen von 0,05-0,08 % nach 30-bzw. 60-minütiger Inkubationszeit eine mutagene Wirkung [24].
Im Rahmen eines zytogenetischen Tests erhielten jeweils 10 männliche CFLP-Mäuse/Dosisgruppe eine einmalige orale Gabe von 4,9 bzw. 9,8 mg Phenylisocyanat/kg KGW (= 1/40 bzw. 1/20 LD50). Als Kontrollen dienten unbehandelte bzw. mit Vehikel (0,1 ml Sonnenblumenöl) behandelte Tiere. 24 bzw. 48 Stunden nach der Applikation wurden die Tiere getötet und die Chromosomenaberrationsraten im Knochenmark bestimmt. Phenylisocyanat zeigte unter diesen Versuchsbedingungen keine chromosomenschädigende Wirkung [6].
Es wurde ein Mikronucleus-Test an der Maus durchgeführt. Dazu erhielten je 5 männliche und 5 weibliche Mäuse eine einmalige i.p.-Injektion von 30 mg Phenylisocyanat/kg KGW. Nach 24, 48 bzw. 72 Stunden wurden die Tiere getötet und die Mikronucleus-Rate im Knochenmark bestimmt. Die Tiere zeigten folgende Vergiftungssymptome: Apathie, ungepflegtes Fell, Spasmen, Atmungsstörungen und Diarrhoe; 1 von 40 Tieren starb während des Versuchs. Es ergaben sich keine Hinweise auf eine clastogene Wirkung von Phenylisocyanat [25].
7.5 Reproduktionstoxizität
Im Rahmen einer Embryotoxizitätsstudie erhielten Halle-AB-Jena- bzw. Halle-DBAMäuse am 4., 7., 11. bzw. 15. Tag der Trächtigkeit eine einmalige orale Gabe von 9,8 mg Phenylisocyanat (in Olivenöl)/kg KGW. Am 18. Tag der Trächtigkeit wurden die Tiere getötet und die Zahl der Corpora lutea sowie der lebenden und toten Implantate bestimmt. Phenylisocyanat hatte unter diesen Bedingungen keine embryotoxische Wirkung [6].
In der im Kap. 7.2 näher beschriebenen subakuten Inhalationsstudie an Ratten kam es bei der mit 10,07 mg/m3 (20x6 h) höchsten eingesetzten Phenylisocyanat-Konzentration zu einer Erniedrigung des Hodengewichts. Wegen der stark toxischen Wirkung dieser Konzentration, die besonders in der hohen Mortalität (70 %) zum Ausdruck kommt, ist der Befund von untergeordneter Bedeutung [17].
7.6 Sonstige Wirkungen
Die Inkubation von gereinigter Humanserum- bzw. Rindererythrozyten-Cholinesterase mit Phenylisocyanat im 50-fachen molaren Überschuss führte zu einer 50 %igen reversiblen Hemmung des Enzyms; die Aktivität der Cholinesterase aus dem Zitteraal (Electrophorus electricus) blieb unbeeinflusst [26,27].
In einer anderen Arbeit wurde die Hemmung der Acetylcholinesterase im Vollblut und in gewaschenen Erythrozyten eines gesunden Probanden durch verschiedene Isocyanate untersucht. Phenylisocyanat führte bei einer Konzentration von ca. 120 µM zu einer 50 %igen Hemmung, die innerhalb von 24 Stunden reversibel war [28].
Die Inkubation von Adenin, Guanin und Cytosin mit Phenylisocyanat im molaren Überschuss bei 100-150°C führte zur Bildung der entsprechenden NPhenylcarbamyl-Derivate. Mit Uracil und mit Thymidin traten keine Reaktionsprodukte auf. Die Inkubation von Kalbsthymus-DNA mit Phenylisocyanat (0-4°C, 10 Tage) führte zu einer nahezu vollständigen Reaktion von Adenin, Guanin und Cytosin zu den entsprechenden Phenylcarbamyl-Derivaten (6-NPhenylcarbamyladenin, 2-N-Phenylcarbamylguanin und 4-N-Phenylcarbamylcytosin) [29].
Die Inkubation von Chorion-Gonadotropin mit Phenylisocyanat (ca. 1 Stunde bei +2 bis -2°C und pH 7,4 bzw. 8,0) führte zu einer ca. 90 %igen Hemmung der Enzymaktivität. Als Indikator diente das Uterusgewicht von juvenilen Ratten (jeweils mindestens 9 Tiere/ Dosis) nach 3 Injektionen (1x täglich) von je 0,03-0,15 mg Reaktionsprodukt/Tier (Untersuchungszeitpunkt 76 Stunden nach der ersten Injektion) [30].
8. Bewertende Zusammenfassung der toxikologischen Daten und Ableitung eines Arbeitsplatzrichtwertes (ARW)
Phenylisocyanat wirkt nach akuter oraler Gabe mäßig und bei dermaler Applikation wenig toxisch. Als Vergiftungssymptome treten zentralnervöse Effekte, Atmungsstörungen, Bauchlage, Cyanose, Gewichtsverlust sowie nach oraler Gabe Entzündungen im Magen-Darm-Trakt und nach dermaler Verabreichung in hoher Dosierung Hautreizungen auf. Demgegenüber weist Phenylisocyanat eine hohe akute Inhalationstoxizität auf verbunden mit einer stark verzögerten Mortalität, die offenbar auf einer irritativen Lungenschädigung beruht. Als NOEL ergibt sich in der akuten Inhalationsstudie an der Ratte ein Wert von 0,7 mg/m3/4h.
In einer älteren subakuten Inhalationsstudie wurden auch bei den Tieren der niedrigsten Dosisgruppe (0,27 mg/m3; 15 x 6 h) noch minimale entmündliche Veränderungen im Atemtrakt festgestellt. In einer neueren Studie ergibt sich für Ratten ein NOEL von 0,83 mg/m3/20 x 6 h; bei einer Konzentration von 2,79 mg/m3
treten lokale Schädigungen des oberen Atemtrakts auf. Phenylisocyanat ist stark hautreizend und wirkt stark reizend bis ätzend am Auge. Aus einer älteren Studie am Meerschweinchen ergeben sich Hinweise auf eine sensibilisierende Wirkung. Phenylisocyanat besitzt ein asthmatogenes Potential. Zur subchronischen und chronischen Toxizität sowie zur Frage der Cancerogenität von Phenylisocyanat liegen keine Daten vor.
In 3 von 5 bakteriellen Punktmutationstesten zeigt Phenylisocyanat sowohl mit als auch ohne Zusatz von S9-Mix keine mutagene Wirkung. Neben einem Ames-Test mit fraglichem Resultat liegen auch ein Test an S. typhimurium TA 100 ohne Zusatz von S9-Mix sowie ein Mutationstest an Streptomyces mit positivem Ergebnis vor. Im Mikronucleus-Test und im zytogenetischen Test an der Maus in vivo ist Phenylisocyanat inaktiv. Bei der Maus ergeben sich nach einmaliger oraler Gabe an verschiedenen Tagen der Trächtigkeit keine Hinweise auf ein embryotoxisches Potential. In einer subakuten Inhalationsstudie an Ratten kommt es zwar bei der mit 10,07 mg/m3 höchsten eingesetzten Phenylisocyanat-Konzentration zu einer Erniedrigung des Hodengewichts, dieser Befund ist jedoch angesichts der stark toxischen Wirkung und hohen Mortalität nur von geringer Bedeutung.
Phenylisocyanat führt in vitro lediglich zu einer schwachen, reversiblen Hemmung der Cholinesterase.
Konkrete Erfahrungen über gesundheitsschädliche Wirkungen von Phenylisocyanat in der Luft am Arbeitsplatz liegen nicht vor. Lediglich in einer epidemiologischen Studie an 216 MDI-exponierten Personen wird über 2 Fälle von positiven RASTPhenylisocyanat berichtet; eine Phenylisocyanat-Sensibilisierung wurde nicht untersucht. Insgesamt scheint somit Phenylisocyanat nur ein schwach ausgeprägtes sensibilisierendes Potential zu besitzen, zumal trotz langjährigen Umgangs mit der Substanz keine weiteren Fälle von Sensibilisierung bekannt geworden sind.
Da zur subchronischen und chronischen Toxizität von Phenylisocyanat keine Daten vorliegen, muss für die Ableitung eines Arbeitsplatzrichtwertes auf die Ergebnisse aus neueren Studien an Ratten zur akuten [9] und subakuten (20x6 h) Inhalation [17] zurückgegriffen werden. Die Tatsache, dass die aus diesen Studien abgeleiteten NOEL-Werte (0,7 bzw. 0,83 mg/m3) praktisch identisch sind, weist darauf hin, dass auch bei längerer Exposition die akuten Reizeffekte nicht nachhaltig sind und die Reizschwelle sich nicht verringert. Deutliche Anzeichen für eine systemische Wirkung sind nicht erkennbar. Dessen ungeachtet wird wegen der zytotoxischen Wirkung von Phenylisocyanat ausgehend vom subakuten NOEL von 0,83 mg/m3 unter Anwendung eines Faktors von 1/20 ein NOEL für die chronische Exposition von 0,04 mg/m3 extrapoliert. Daher wird für Phenylisocyanat ein Arbeitsplatzrichtwert (ARW) von 0,01 ppm = 0,05 mg/m3 mit Spitzenbegrenzung nach Kategorie I festgelegt. Dieser Wert, der dem bestehenden MAK-Wert von anderen Isocyanaten wie Toluylendiisocyanat und Methylisocyanat entspricht, wird als ausreichend angesehen, um den Schutz der Arbeitnehmer vor den irritativen Wirkungen des Phenylisocyanats zu gewährleisten.
9. Literatur
[1] Lenaerts-Langanke, H.: Zbl. Arbeitsmed. 42, 2-25 (1992)
[2] Mihail, F. u. Thyssen, J.: Bayer AG, unveröffentlichter Bericht Nr. 9694 vom 20.01.1981
[3] Lamb, D.W. u. Matzkanin, C.S.: Mobay Chemical Corporation/ Chemagro Agricultural Division, unveröffentlichter Bericht Nr. 44.762 vom 01.07.1975
[4] Löser, E.: Bayer AG, unveröffentlichter Bericht vom 17.10.1980
[5] Monsanto Company: Toxicity Information, zitiert in: Registry of Toxic Effects of Chemical Substances (RTECS), U.S. Dept. of Health and Human Services, Cincinnati, Ohio (USA) (1983)
[6] Nehez, M., Fischer, G.W., Nehez, I., Scheufler, H. u. Desi, I.: Ecotoxicol. Environ. Saf. 17, 258-263 (1989)
[7] Vernot, E.H., MacEwen, J.D., Haun, C.C. u. Kinkead, E.R.: Toxicol. Appl. Pharmacol. 42, 417-423 (1977)
[8] Doe, J.E.: ICI Ltd., unveröffentlichter Bericht (April 1978)
[9] Pauluhn, J.: Bayer AG, unveröffentlichter Bericht Nr. 20.354 vom 12.06.1991
[10] Becker, B.A. u. Plaa, G.L.: Toxicol. Appl. Pharmacol. 7, 804-811 (1965)
[11] Sangha, G.K., Matijak, M. u. Alarie, Y.: Toxicol. Appl. Pharmacol. 57, 241-246 (1981)
[12] Schreiber, G.: Fraunhofer-Institut für Toxikologie und Aerosolforschung Schmallenberg, unveröffentlichter Bericht vom 09.07.1980 an die Bayer AG
[13] Schreiber, G.: Fraunhofer-Institut für Toxikologie und Aerosolforschung Schmallenberg, unveröffentlichter Bericht vom 09.07.1980 an die Bayer AG
[14] Ogata, M.: Okayama Igakkai Zasshi 74, 239-246 (1962)
[15] Doe, J.E.: ICI Ltd., unveröffentlichter Bericht (März 1979)
[16] Pauluhn, J.: Bayer AG, unveröffentlichter Bericht Nr. 20.132 vom 28.03.1991
[17] Pauluhn, J.: Bayer AG, unveröffentlichter Bericht Nr. 22.415 vom 26.07.1993
[18] Pauluhn, J.: Bayer AG, unveröffentlichter Bericht Nr. 22.561 vom 22.09.1993
[19] Herbold, B.: Bayer AG, unveröffentlichter Bericht Nr. 9170 vom 20.05.1980
[20] [Andersen, M., Binderup, M.-L., Kiel, P., Larsen, H. u. Maxild, J.: Scand. J. Work Environ. Health 6, 221-226 (1980)
[21] Melnikow, J., Keeffe, J.R. u. Bernstein, R.L.: J. Chem. Education 58, A11-A14 (1981)
[22] Yamaguchi, T.: Agric. Biol. Chem.44, 3017-3018 (1980)
[23] Szybalski, W.: Ann. N. Y. Acad. Sci. 76, 475-489 (1958)
[24] Jarai, M.: Acta Microbiol. Acad. Sci. Hung. 9, 273-284 (1962)
[25] Herbold, B.A.: Bayer AG, unveröffentlichter Bericht Nr. 19.566 vom 26.09.1990
[26] Brown, W.E., Green, A.H., Karol, M.H. u. Alarie, Y.: Toxicologist 2, 164-165 (Abstract 577) (1982)
[27] Brown, W.E., Green, A.H. u. Yen, C.: Fed. Proc. 40, 1615 (Abstract 435) (1981)
[28] Dewair, M., Baur, X. u. Fruhmann, G.: J. Occup. Med. 25, 279-282 (1991)
[29] Jones, A.S. u. Warren, J.H.: Tetrahedron 26, 791-794 (1970) [30] Bischoff, F.: Endocrinology 32, 260-262 (1943)
 | weiter . |