 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. ▢ Regelwerk; BGI / DGUV-I |
BGI 505-76 / DGUV Information 213-576 - Verfahren zur Bestimmung von Glykolethern und -estern
Von den Berufsgenossenschaften anerkannte Analysenverfahren zur Feststellung der Konzentrationen krebserzeugender Arbeitsstoffe in der Luft in Arbeitsbereichen
Berufsgenossenschaftliche Informationen für Sicherheit und Gesundheit bei der Arbeit (BGI)
(bisherige ZH 1/120.76)
(Ausgabe 05/2009)
Erprobtes und von den Unfallversicherungsträgern anerkanntes Verfahren zur Bestimmung von Glykolethern und -estern in Arbeitsbereichen.
Es sind personenbezogene und ortsfeste Probenahmen für Messungen zur Beurteilung von Arbeitsbereichen möglich:
| 01 | Probenahme mit Pumpe und Abscheidung auf einem Filter und Aktivkohleröhrchen, Gaschromatographie nach Desorption Glykolether und -ester - 01 - GC (erstellt: März 2009) |
| Name | CAS-Nr. | Molmasse |
| Bis-(2-methoxyethyl)ether, Diethylenglykoldimethylether, Dimethyldiglykol, Diglyme | 111-96-6 | 134,18 |
| 2-Butoxyethylacetat, Butylglykolacetat | 112-07-2 | 160,21 |
| Butylglykol, 2-Butoxyethanol, Diethylenglykolmonobutylether, Butylcellusolve | 111-76-2 | 118,18 |
| Dipropylenglykol, Bis(2-hydroxypropyl)ether, Oxy-bis-(propanol-2) | 25265-71-8 1 110-98-5 | 134,17 |
| 2-Ethoxyethanol, Ethylglykol, Ethylenglykolmonoethylether, Ethylcellosolve | 110-80-5 | 90,12 |
| 2-Ethoxyethylacetat, Ethylglykolacetat, Essigsäure-2-ethoxyethylester, Ethylglykolmonoethyletheracetat | 111-15-9 | 132,16 |
| Hexylglykol, Hexoxy-1-ethanol, Ethylenglykol-mono-n-hexylether | 112-25-4 | 130,00 |
| 2-Methoxyethanol, Methylglykol, Ethylenglykolmonomethylether, Methylcellosolve | 109-86-4 | 76,10 |
| 2-(2-Methoxyethoxy)ethanol, Methyldiglykol, Diethylenglykolmonomethylether, Methylcarbitol | 111-77-3 | 120,15 |
| 2-Methoxyethylacetat, Methylglykolacetat, Essigsäure-2-methoxyethylester | 110-49-6 | 118,13 |
| 2-Methoxy-1-propanol | 1589-47-5 | 90,12 |
| Phenylglykol, 2-Phenoxyethanol, Monophenylglykol | 122-99-6 | 138,17 |
01 Probenahme mit Pumpe und Abscheidung auf einem Filter und Aktivkohleröhrchen, Gaschromatographie nach Desorption
Kurzfassung
Mit diesem Verfahren wird die über die Probenahmedauer gemittelte Konzentration der Glykolether und -ester Bis-(2-methoxyethyl)ether, 2-Butoxyethylacetat, Butylglykol, Dipropylenglykol, 2-Ethoxyethanol, 2-Ethoxyethylacetat, Hexylglykol, 2-Methoxyethanol, 2-(2-Methoxyethoxy)ethanol, 2-Methoxyethylacetat, 2-Methoxy-1-propanol und Phenylglykol, im Folgenden kurz Glykolderivate genannt, im Arbeitsbereich personenbezogen oder ortsfest bestimmt.
| Messprinzip: | Mit Hilfe einer Pumpe wird ein definiertes Luftvolumen durch ein mit einem Filter und Aktivkohleröhrchen bestücktes GGP-System gesaugt. Anschließend werden die abgeschiedenen Glykolderivate mit einer Dichlormethan-Methanol-Mischung desorbiert und gaschromatographisch bestimmt. | |
| Bestimmungsgrenze: | absolut: | 0,2 bis 3,7 ng je Glykolderivat |
| relativ: | von 0,02 bis 0,31 mg/m3 an Glykolderivat bei 120 l Probeluftvolumen, 10 ml Desorptionslösung und einem Injektionsvolumen von 1 µl (siehe auch Abschnitt 5.2). | |
| Selektivität: | Infolge von Störkomponenten zu hohe Werte möglich; Störeinflüsse im Allgemeinen durch Wahl einer Säule mit anderer Trenncharakteristik eliminierbar. | |
| Vorteile: | Personenbezogene und selektive Messungen möglich. | |
| Nachteile: | Keine Anzeige von Konzentrationsspitzen. | |
| Apparativer Aufwand: | Pumpe mit Gasmengenzähler oder Volumenstromanzeiger, GGP-System mit Filter und Aktivkohleröhrchen, Gaschromatograph mit Flammenionisationsdetektor. | |
Ausführliche Verfahrensbeschreibung
1 Geräte, Chemikalien und Lösungen
1.1 Geräte
Für die Probenahme:
- Probenahmepumpe, geeignet für einen Volumenstrom von 1000 ml/min, z.B. PP5, Fa. Gilian, Bezug z.B. über Fa. Haan & Wittmer, 71288 Friolzheim.
- Durchflussmesser oder Volumenstromanzeiger, z.B. Gilibrator, Fa. Gilian.
- GGP-Probenahmesystem mit einem Ansaugkegel für einen Volumenstrom von 1 l/min, z.B. Fa. GSM, 41469 Neuss.
Modifiziertes GGP-System: Der Ansaugkegel des GGP-Systems 3.5 wird durch den Ansaugkegel des GGP-Systems 1.0 ersetzt (durch den kleineren Durchmesser der Bohrung des Kegels wird die Definition des einatembaren Staubes bei einem Volumenstrom von 1 l/min erfüllt). Zwischen dem unteren Ende des Gusskörpers des GGP-Systems und dem Schlauchadapter wird ein Zwischenstück eingeschraubt, das Bohrungen zur parallelen Aufnahme von zwei Adsorptionsröhrchen aufweist. Zur Probenahme werden die beiden geöffneten Aktivkohleröhrchen in diese Bohrungen eingeführt und das System dicht verschraubt (siehe Abbildung 1). Alternativ zu diesem Eigenbau wird von der Firma GSM, Neuss, ein Probenahmesystem für drei Adsorptionsröhrchen vertrieben.
Abbildung 1: Modifiziertes GGP-System

- Glasfaserfilter, Durchmesser 37 mm, z.B. Typ GF/A, Fa. Whatman, 37587 Dassel.
- Adsorptionsröhrchen, gefüllt mit Aktivkohle (standardisiert, bestehend aus zwei durch poröses Polymermaterial getrennte Aktivkohlefüllungen von 400 und 200 mg), z.B. charcoal tubes, Fa. SKC, Bezug z.B. über Fa. Analyt-MTC, 79379 Müllheim, Bestell-Nr. 226-09.
Für die Probenaufbereitung und Analyse:
- Flachbettschüttler
- automatische Verdrängerpipette, z.B. Multipette pro, Fa. Eppendorf, 22366 Hamburg
- Mikroliterspritzen mit Volumina von 10 bis 250 µl
- Messkolben 10 ml, 250 ml
- Probengefäße 20 ml
- Gaschromatograph mit Flammenionisationsdetektor (FID)
1.2 Chemikalien und Lösungen
Bis-(2-methoxyethyl)ether, Reinheit > 99 %, z.B. Fa. Merck, 64271 Darmstadt
2-Butoxyethylacetat, Reinheit 99 %, z.B. Fa. Merck
Butylglykol, Reinheit 99 %, z.B. Fa. Aldrich, 82024 Taufkirchen
Dipropylenglykol, Reinheit 97 %, z.B. Fa. Merck
2-Ethoxyethanol, Reinheit 99 %, z.B. Fa. Aldrich
2-Ethoxyethylacetat, Reinheit 99 %, z.B. Fa. Aldrich
Hexylglykol, Reinheit 99 %, z.B. Fa. BASF, 67056 Ludwigshafen
2-Methoxyethanol, Reinheit 99,5 %, z.B. Fa. Aldrich
2-(2-Methoxyethoxy)ethanol, Reinheit 99 %, z.B. Fa. Aldrich
2-Methoxyethylacetat, Reinheit 98 %, z.B. Fa. Aldrich
2-Methoxy-1-propanol, Reinheit 93,5 %, z.B. Fa. BASF
Phenylglykol, Reinheit 99 %, z.B. Fa. Fluka, 82024 Taufkirchen
β-Citronellol, Reinheit > 95 % (interner Standard), z.B. Fa. Merck
Dichlormethan, zur Analyse, z.B. Fa. Merck
Methanol, zur Analyse, z.B. Fa. Merck
Gase zum Betrieb des Gaschromatographen:
- Helium, Reinheit 99,999 %
- Wasserstoff, Reinheit 99,999 %
- Synthetische Luft, kohlenwasserstofffrei
- Stickstoff, Reinheit 99,999 %
| Desorptionslösung: | Lösung von 16,3 µg β-Citronellol/ml Dichlormethan-Methanol-Mischung. |
| In einen 250-ml-Messkolben, der fast vollständig mit einer Mischung aus Dichlormethan und Methanol (9+1, v+v) gefüllt wurde, werden 5 µl β-Citronellol zupipettiert und mit der Dichlormethan-Methanol-Mischung bis zur Marke aufgefüllt und umgeschüttelt. | |
| Stammlösung: | Lösung von ca. 6 mg Glykolderivat/ml Desorptionslösung (siehe Tabelle 1). |
| In einen 5-ml-Messkolben werden die in Tabelle 1 aufgeführten Glykolderivate 0,1 mg genau eingewogen. Anschließend wird mit der Desorptionslösung bis zur Marke aufgefüllt und umgeschüttelt. |
Tabelle 1: Einwaagen und Konzentrationen der Glykolderivate in der Stammlösung
| Stoff | Einwaage [mg] | Konzentration [mg/ml] |
| Bis-(2-methoxyethyl)ether | 25,3 | 5,02 |
| 2-Butoxyethylocetat | 25,5 | 5,05 |
| Butylglykol | 26,8 | 5,31 |
| Dipropylenglykol | 35,0 | 6,79 |
| 2-Ethoxyethanol | 27,4 | 5,42 |
| 2-Ethoxyethylacetat | 28,7 | 5,68 |
| Hexylglykol | 26,2 | 5,19 |
| 2-Methoxyethonol | 28,2 | 5,58 |
| 2-(2-Methoxyethoxy)ethanol | 30,8 | 6,04 |
| 2-Methoxyethylacetat | 27,5 | 5,39 |
| 2-Methoxy-1-propanol | 35,8 | 6,70 |
| Phenylglykol | 41,3 | 8,18 |
Kalibrierlösungen: | Lösungen von ca. 2,5 bis 82 mg Glykolderivat/l Desorptionslösung (siehe Tabelle 2). |
| In je einen 10-ml-Messkolben werden die sechs in der Tabelle 2 angegebenen Volumina der Stammlösung pipettiert, mit Desorptionslösung aufgefüllt und umgeschüttelt. |
Tabelle 2: Konzentrationen der Glykolderivate in den Kalibrierlösungen in mg/l
| Lösung | 1 | 2 | 3 | 4 | 5 | 6 |
| Zugabe Stammlösung in µl | 5 | 20 | 40 | 60 | 80 | 100 |
| Bis-(2-methoxyethyl)ether | 2,51 | 100 | 20,1 | 30,1 | 40,1 | 50,2 |
| 2-Butoxyethylacetat | 2,52 | 10,1 | 20,2 | 30,3 | 40,4 | 50,5 |
| Butylglykol | 2,66 | 10,6 | 21,3 | 31,9 | 42,5 | 53,1 |
| Dipropylenglykol | 3,39 | 13,6 | 27,1 | 40,7 | 54,3 | 67,9 |
| 2-Ethoxyethanol | 2,71 | 10,9 | 21,7 | 32,5 | 43,4 | 54,2 |
| 2-Ethoxyethylacetat | 2,84 | 11,4 | 22,7 | 34,1 | 45,4 | 56,8 |
| Hexylglykol | 2,59 | 10,4 | 20,7 | 31,1 | 41,5 | 51,9 |
| 2-Methoxyethanol | 2,79 | 11,2 | 22,3 | 33,5 | 44,7 | 55,8 |
| 2-(2-Methoxyethoxy)-ethanol | 3,02 | 12,1 | 24,2 | 36,2 | 48,3 | 60,4 |
| 2-Methoxyethylacetat | 2,70 | 10,8 | 21,6 | 32,3 | 43,1 | 53,9 |
| 2-Methoxy-1-propanol | 3,35 | 13,4 | 26,8 | 40,2 | 53,6 | 67,0 |
| Phenylglykol | 4,09 | 16,4 | 32,7 | 49,1 | 65,1 | 81,8 |
Mit diesen Lösungen wird bezogen auf ein Probeluftvolumen von 120 l ein Konzentrationsbereich von ca. 0,2 bis 7 mg/m3 an Einzelsubstanz (siehe Tabelle 3) erfasst.
Tabelle 3: Konzentrationen der Glykolderivate in den Kalibrierlösungen in mg/m3
| Lösung | 1 | 2 | 3 | 4 | 5 | 6 |
| Bis-(2-methoxyethyl)ether | 0,209 | 0,836 | 1,67 | 2,51 | 3,34 | 4,18 |
| 2-Butoxyethylacetat | 0,210 | 0,842 | 1,68 | 2,53 | 3,37 | 4,21 |
| Butylglykol | 0,221 | 0,886 | 1,77 | 2,66 | 3,54 | 4,43 |
| Dipropylenglykol | 0,283 | 1,13 | 2,26 | 3,39 | 4,52 | 5,66 |
| 2-Ethoxyethanol | 0,226 | 0,904 | 1,81 | 2,71 | 3,62 | 4,52 |
| 2-Ethoxyethylacetat | 0,237 | 0,947 | 1,89 | 2,84 | 3,79 | 4,73 |
| Hexylglykol | 0,216 | 0,864 | 1,73 | 2,59 | 3,46 | 4,32 |
| 2-Methoxyethanol | 0,233 | 0,930 | 1,86 | 2,79 | 3,72 | 4,65 |
| 2-(2-Methoxyethoxy)-ethanol | 0,252 | 1,01 | 2,01 | 3,02 | 4,03 | 5,03 |
| 2-Methoxyethylacetat | 0,225 | 0,900 | 1,80 | 2,70 | 3,59 | 4,49 |
| 2-Methoxy-1-propanol | 0,279 | 1,12 | 2,23 | 3,35 | 4,47 | 5,58 |
| Phenylglykol | 0,341 | 1,36 | 2,73 | 4,09 | 5,45 | 6,82 |
2 Probenahme
Das modifizierte GGP-System (siehe Abschnitt 1.1) wird mit einem Filter und zwei Aktivkohleröhrchen bestückt und mit der Pumpe verbunden. Es wird ein Volumenstrom von 1 l/min eingestellt. Mit diesem Volumenstrom wird die Definition des einatembaren Staubes [1] eingehalten. Die Pumpe und das Probenahmesystem werden von einer Person im Arbeitsbereich getragen oder ortsfest verwendet. Das Verfahren wurde bis zu einem Probeluftvolumen von 120 l (entsprechend einer Probenahmedauer von 2 Stunden) überprüft. Nach der Probenahme ist der Volumenstrom auf Konstanz zu überprüfen. Ist die Abweichung vom eingestellten Volumenstrom größer ± 5 % wird empfohlen, die Messung zu verwerfen (siehe hierzu BGI 505-0 "Allgemeiner Teil", Abschnitt 3). Der Filterhalter und die Adsorptionsröhrchen werden anschließend dem Probenahmesystem entnommen und dicht verschlossen.
3 Analytische Bestimmung
3.1 Probenaufbereitung und Analyse
Der Filter und der Inhalt der beiden Aktivkohleröhrchen werden zusammen in ein 20-ml-Probengefäß überführt. Nach dem Zusatz von 10 ml Desorptionslösung wird das Gefäß verschlossen und 10 Minuten auf dem Flachbettschüttler geschüttelt. Danach wird ein Aliquot der überstehenden Lösung (Probelösung) in ein Autosamplergläschen überführt.
Um sicherzustellen, dass die verwendete Desorptionslösung, der Filter und die Aktivkohle keine störenden Verunreinigungen enthalten, werden in regelmäßigen Abständen ein Filter und die Füllung zweier unbeladener Aktivkohleröhrchen mit 10 ml Desorptionslösung wie oben beschrieben desorbiert (Leerwertlösung).
Jeweils 1 µl der Probelösung und Leerwertlösung werden in den Gaschromatographen eingespritzt und ein Gaschromatogramm, wie nachfolgend beschrieben, angefertigt. Die quantitative Auswertung erfolgt nach der Methode des internen Standards über die Peakflächen des jeweiligen Glykolderivats und des β-Citronellols als internem Standard.
3.2 Gaschromatographische Arbeitsbedingungen
Die in Abschnitt 5 angegebenen Verfahrenskenngrößen wurden unter folgenden Gerätebedingungen ermittelt:
| Gerät: | Gaschromatograph Hewlett Packard 5890 mit zwei FID und Split/splitless-Injektor | |
| Trennsäulen: | Doppelkapillartechnik; die beiden Kapillaren werden über einen Kapillarverbinder (z.B. Press connect, Fa. Chrompack) mit 40 bis 50 cm unbelegter Kapillare (id = 0,32 mm) verbunden, die in den Injektor eingeführt wird. | |
| Quarzkapillaren: | ||
stationäre Phase DB-WAX quervernetzt, Innendurchmesser 0,25 mm, Filmdicke 0,5 µm, Länge 30 m | ||
stationäre Phase RTx-35 quervernetzt, Innendurchmesser 0,25 mm, Filmdicke 0,5 µm, Länge 30 m | ||
| Temperaturen: | Injektor: 250 °C | |
| Detektor: 250 °C | ||
| Säule mit Temperaturprogramm: | ||
Anfangstemperatur 45 °C, isotherm 3 min | ||
Heizrate I: 3 °C/min bis 65 °C, isotherm 1 min | ||
Heizrate II: 6 °C/min bis 120 °C, isotherm 3 min | ||
Heizrate III: 10 °C/min bis zur Endtemperatur | ||
Endtemperatur: 220 °C, isotherm 10 min | ||
| Injektion: | Splitless (Splitter 1 Minute geschlossen), Splitverhältnis 1:10 | |
| Injektionsvolumen: | 1 µl | |
| Trägergas: | Helium (Vordruck 125 hPa) | |
| Detektorgase: | Wasserstoff ca. 30 ml/min synthetische Luft ca. 330 ml/min | |
| Make-up-Gas: | Stickstoff ca. 30 ml/min | |
4 Auswertung
4.1 Kalibrierung
Von den unter Abschnitt 1.2 exemplarisch beschriebenen sechs Kalibrierlösungen wird jeweils 1 µl in den Gaschromatographen eingespritzt.
Durch Auftragen der Verhältnisse der Peakflächen der Glykolderivate zu den Peakflächen des β-Citronellols als internem Standard über die in den jeweiligen Kalibrierlösungen enthaltenen Massenverhältnisse der Glykolderivate zu β-Citronellol ermittelt man mit Hilfe der Regressionsrechnung die Kalibrierfunktion.
4.2 Berechnen des Analysenergebnisses
Aus den für jede Trennsäule erhaltenen Chromatogrammen werden die Peakflächen der Glykolderivate und des β-Citronellols ermittelt, der Quotient gebildet und aus der jeweiligen Kalibrierfunktion der zugehörige Wert für die Masse in der Probelösung in µg ermittelt. Ist die Abweichung zwischen den auf beiden Kapillaren erhaltenen Ergebnissen < 10 %, so wird der Mittelwert verwendet. Bei einer größeren Abweichung wird der kleinere Messwert genommen (siehe auch Abschnitt 5.3).
Die Berechnung der Massenkonzentration der jeweiligen Einzelsubstanz in der Probeluft in mg/m3 erfolgt nach Formel (1):
(1) 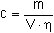
Es bedeuten:
| c | = | Massenkonzentration des jeweiligen Glykolderivats in der Probeluft in mg/m3 |
| m | = | die aus der entsprechenden Kalibrierfunktion ermittelte Masse des Glykolderivats in der Probelösung in µg |
| V | = | Probeluftvolumen in l |
| η | = | Wiederfindung (siehe Abschnitt 5.1) |
Sind die gefundenen Gehalte einzelner Glykolderivate außerhalb des Kalibrierbereiches, so ist die Probelösung entsprechend mit Desorptionslösung zu verdünnen und die Quantifizierung für diese Glykolderivate mit der verdünnten Probelösung zu wiederholen.
5 Beurteilung des Verfahrens
5.1 Präzision und Wiederfindung
Die Präzision im Mindestmessbereich nach DIN EN 482 [2] sowie die Wiederfindung wurden für 3 Konzentrationen (siehe Tabelle 4) bestimmt. Dazu wurde eine Validierlösung entsprechend den Angaben in der Tabelle 4 hergestellt:
| Validierlösung: | Lösung von ca. 11 bis 300 mg Glykolderivat/ml Methanol. |
| In je einen 5-ml-Messkolben wurden die in Tabelle 4 angegebenen Massen an Glykolderivaten auf 0,1 mg genau eingewogen. Anschließend wurde mit Methanol bis zur Marke aufgefüllt und umgeschüttelt. |
Mit einer Mikroliterspritze wurden 5, 50 und 100 µl der jeweiligen Validierlösung auf die Filter der fertig montierten modifizierten GGP-Systeme dotiert und zwei Stunden lang Laborluft bei einer Umgebungstemperatur von 23 °C mit einem Volumenstrom von 1 l/min durch die Probenahmesysteme gesaugt. Die Aufarbeitung und analytische Bestimmung erfolgte wie in Abschnitt 3 beschrieben. Die dotierten Massen entsprachen für ein Probeluftvolumen von 120 l den in der Tabelle 4 angegebenen Validierkonzentrationen.
Tabelle 4: Konzentrationen der Glykolderivate in der Validierlösung und bei der Validierung
| Substanz | Einwaage | Konzentration | Validierkonzentration | ||
| [mg] | [mg/ml] | c1 [mg/m3] | c2 [mg/m3] | c3 [mg/m3] | |
| Bis-(2-methoxyethyl)ether | 340,8 | 67,5 | 2,81 | 28,1 | 56,2 |
| 2-Butoxyethylacetat | 1509,5 | 298,9 | 12,4 | 125 | 249 |
| Butylglykol | 1266,8 | 250,8 | 10,5 | 104 | 209 |
| Dipropylenglykol | 67,3 | 13,1 | 0,54 | 5,46 | 10,9 |
| 2-Ethoxyethanol | 171,8 | 34,0 | 1,42 | 14,2 | 28,3 |
| 2-Ethoxyethylacetat | 320,4 | 63,4 | 2,64 | 26,4 | 52,9 |
| Hexylglykol | 57,4 | 11,4 | 0,474 | 4,74 | 9,48 |
| 2-Methoxyethanol | 188,2 | 37,3 | 1,55 | 15,5 | 31,1 |
| 2-(2-Methoxyethoxy)ethanol | 64,2 | 12,6 | 0,52 | 5,25 | 10,5 |
| 2-Methoxyethylacetat | 299,6 | 58,7 | 2,45 | 24,5 | 48,9 |
| 2-Methoxy-1-propanol | 246,8 | 46,2 | 1,93 | 19,2 | 28,5 |
| Phenylglykol | 1291,2 | 255,7 | 10,7 | 107 | 213 |
Bei jeweils sechsfacher Durchführung der beschriebenen Vorgehensweise ergaben sich für die einzelnen Konzentrationen die in Tabelle 5 aufgeführten Wiederfindungen und relativen Standardabweichungen.
Tabelle 5: Präzision und Wiederfindungen
| Substanz | Wiederfindung | relative Standardabweichung [%] | ||||||
| η (c1) | η (c2) | η (c3) | mittlere η | s (c1) | s (c2) | s (c3) | mittlere s | |
| Bis-(2 methoxyethyl)ether | 1,00 | 0,97 | 0,99 | 0,99 | 0,5 | 1,2 | 0,8 | 0,8 |
| 2-Butoxyethylacetat | 0,98 | 1,01 | 1,00 | 1,00 | 1,1 | 0,5 | 0,6 | 0,7 |
| Butylglykol | 1,01 | 1,01 | 1,00 | 1,00 | 1,0 | 0,5 | 0,6 | 0,7 |
| Dipropylenglykol | 0,87 | 0,88 | 0,91 | 0,89 | 5,3 | 3,1 | 3,6 | 4,0 |
| 2-Ethoxyethanol | 1,00 | 0,99 | 1,03 | 1,01 | 1,8 | 2,8 | 0,5 | 1,7 |
| 2-Ethoxyethylacetat | 1,00 | 1,00 | 1,01 | 1,00 | 1,8 | 3,5 | 0,6 | 2,0 |
| Hexylglykol | 0,99 | 0,99 | 1,01 | 1,00 | 1,1 | 0,8 | 0,6 | 0,8 |
| 2-Methoxyethanol | 1,01 | 1,00 | 1,01 | 1,01 | 2,0 | 1,2 | 1,1 | 1,4 |
| 2-(2-Methoxyethoxy)ethanol | 0,99 | 0,99 | 0,97 | 0,98 | 1,3 | 1,1 | 0,7 | 1,0 |
| 2-Methoxyethylacetat | 1,00 | 0,99 | 0,85 | 0,95 | 1,0 | 1,1 | 0,8 | 1,0 |
| 2-Methoxy-1-propanol | 0,99 | 1,01 | 0,99 | 1,00 | 1,3 | 1,4 | 4,5 | 2,4 |
| Phenylglykol | 0,66 | 0,76 | 0,79 | 0,74 | 1,0 | 1,3 | 1,0 | 1,1 |
5.2 Bestimmungsgrenzen
Die Bestimmungsgrenzen wurden aus dem Signal/Rausch-Verhältnis der Grundlinie des Chromatogramms ermittelt. Zur Berechnung der Bestimmungsgrenze wurde das 10fache Rauschen zugrunde gelegt.
Die absoluten Bestimmungsgrenzen der einzelnen Glykolderivate liegen zwischen 0,2 und 3,7 ng. Dies entspricht bei einem Probeluftvolumen von 120 l, einem Desorptionsvolumen von 10 ml und einem Einspritzvolumen von 1 µl relativen Bestimmungsgrenzen von 0,02 bis 0,31 mg/m3 (siehe Tabelle 6).
Tabelle 6: Bestimmungsgrenzen der Glykolderivate
| Substanz | Bestimmungsgrenzen | |
| absolut [ng] | relativ [mg/m3] | |
| Bis-(2-methoxyethyl)ether | 0,3 | 0,03 |
| 2-Butoxyethylacetat | 0,2 | 0,02 |
| Butylglykol | 0,8 | 0,06 |
| Dipropylenglykol | 3,7 | 0,31 |
| 2-Ethoxyethanol | 2,8 | 0,23 |
| 2-Ethoxyethylacetat | 0,6 | 0,05 |
| Hexylglykol | 0,5 | 0,04 |
| 2-Methoxyethanol | 2,3 | 0,19 |
| 2-(2-Methoxyethoxy)ethanol | 1,8 | 0,15 |
| 2-Methoxyethylacetat | 0,4 | 0,03 |
| 2-Methoxy-1-propanol | 0,2 | 0,02 |
| Phenylglykol | 0,6 | 0,05 |
5.3 Selektivität
Die Selektivität des Verfahrens hängt vor allem von der Art der verwendeten Trennsäule ab. In der Praxis haben sich die angegebenen Trennsäulen bewährt. Das Vorliegen von Störkomponenten wird durch den Vergleich der Ergebnisse der beiden Kapillaren unterschiedlicher Trenncharakteristik erkannt. Bei einer Abweichung > 10 % wird empfohlen, das niedrigere Ergebnis zu berücksichtigen (unter der Annahme, dass das höhere Ergebnis durch die Überlagerung mit einer Störkomponente zustande kam).
6 Bemerkungen
Die verlustfreie Lagerfähigkeit der Substanzen im adsorbierten Zustand beträgt bei Raumtemperatur mindestens 14 Tage.
Einzelne Glykolderivate zeigen im Chromatogramm auf der weniger polaren RTx-35-Säule eine schlechtere Peakform (zum Teil ausgeprägtes Leading) als auf der DB-WAX-Säule, was zu Problemen bei der Integration der Peaks (vor allem bei höheren Konzentrationen) führen kann.
7 Literatur
| [1] | DIN EN 481 Arbeitsplatzatmosphäre; Festlegung der Teilchengrößenverteilung zur Messung luftgetragener Partikel Beuth Verlag GmbH, Berlin 1993 |
| [2] | DIN EN 482 Arbeitsplatzatmosphäre - Allgemeine Anforderungen an Verfahren für die Messung von chemischen Arbeitsstoffen Beuth Verlag GmbH, Berlin 1994 |
_________
1 kommerzielles Produkt als Gemisch aus 3 Isomeren
 | ENDE |
...
X
⍂
↑
↓
