 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2007, Lebensmittel - EU Bund

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2007, Lebensmittel - EU Bund |  |
Verordnung (EG) Nr. 829/2007 der Kommission vom 28. Juni 2007 zur Änderung der Anhänge I, II, VII, VIII, X und XI zur Verordnung (EG) Nr. 1774/2002 des Europäischen Parlaments und des Rates im Hinblick auf das Inverkehrbringen bestimmter tierischer Nebenprodukte
(Text von Bedeutung für den EWR)
(ABl. Nr. L 191 vom 21.07.2007 S. 1;
VO (EG) 1256/2007 - ABl. Nr. L 285 vom 26.10.2006 S. 30 aufgehoben)
aufgehoben (stillschweigend) gem. VO (EG) 1256/2007
Die Kommission der Europäischen Gemeinschaften -
gestützt auf den Vertrag zur Gründung der Europäischen Gemeinschaft,
gestützt auf die Verordnung (EG) Nr. 1774/2002 des Europäischen Parlaments und des Rates vom 3. Oktober 2002 mit Hygienevorschriften für nicht für den menschlichen Verzehr bestimmte tierische Nebenprodukte 1, insbesondere auf Artikel 28 Absatz 2, Artikel 29 Absatz 3 Unterabsatz 1 und Artikel 32 Absatz 1,
in Erwägung nachstehender Gründe:
(1) Die Verordnung (EG) Nr. 1774/2002 enthält die tierseuchen- und hygienerechtlichen Anforderungen für die Einfuhr bestimmter tierischer Nebenprodukte und daraus hergestellter Erzeugnisse in die Gemeinschaft sowie für deren Durchfuhr durch die Gemeinschaft. Diese Verordnung legt allgemeine Hygienevorschriften für die Verarbeitung von Material der Kategorien 1, 2 und 3 fest und enthält außerdem die Anforderungen für das Inverkehrbringen solcher tierischer Nebenprodukte und daraus hergestellter Erzeugnisse, einschließlich Mustern der Veterinärbescheinigungen für deren Einfuhr in die Gemeinschaft.
(2) Wegen der Gefahr der Einschleppung des kleinen Bienenstockkäfers in die Gemeinschaft, in der dieser Parasit zurzeit nicht vorkommt, müssen Anforderungen für die Einfuhr von Bienenwachs für technische Verwendungszwecke festgelegt werden; darüber hinaus bedarf es einer Änderung der Definition des Begriffs "Imkereierzeugnisse" in Anhang I zur Verordnung (EG) Nr. 1774/2002. Deshalb sollten die betreffende Definition in Anhang I der genannten Verordnung, die in Anhang VIII Kapitel IX festgelegten Einfuhrbestimmungen und die in Anhang X Kapitel 13 der genannten Verordnung enthaltene Musterveterinärbescheinigung entsprechend geändert werden.
(3) Anhang II Kapitel X der Verordnung (EG) Nr. 1774/2002 enthält ein Muster des Handelspapiers, das tierischen Nebenprodukten und verarbeiteten Erzeugnissen während der Beförderung beiliegen muss. Um die Rückverfolgbarkeit von Häuten während der Beförderung zu verbessern, bedarf es einer Änderung dieses Musterdokuments. Daher sollte Anhang II der genannten Verordnung entsprechend geändert werden.
(4) Die Verordnung (EG) Nr. 999/2001 des Europäischen Parlaments und des Rates vom 22. Mai 2001 mit Vorschriften zur Verhütung, Kontrolle und Tilgung bestimmter transmissibler spongiformer Enzephalopathien 2 gilt für die Produktion und das Inverkehrbringen lebender Tiere und tierischer Erzeugnisse. Sie verbietet die Verfütterung von verarbeitetem tierischem Eiweiß an landwirtschaftliche Nutztiere, die zur Herstellung von Lebensmitteln gehalten, gemästet oder gezüchtet werden.
(5) Während das Verbot gemäß der Verordnung (EG) Nr. 999/2001 in Kraft bleibt, sollten für aus Schweineblut gewonnenes verarbeitetes tierisches Eiweiß weniger strenge Verarbeitungsvorschriften - wie in Anhang VII Kapitel II der Verordnung (EG) Nr. 1774/2002 festgelegt - als das derzeitige Verarbeitungsverfahren 1 gelten, da es keinen wissenschaftlichen Nachweis eines TSE-Übertragungsrisikos durch Schweine gibt. Allerdings ist es zum Schutz der menschlichen und tierischen Gesundheit erforderlich, eine Mindesttemperatur für die Verarbeitung von Schweineblut einzuführen. Daher sollte Anhang VII Kapitel II der Verordnung (EG) Nr. 1774/2002 entsprechend geändert werden.
(6) Anhang VIII Kapitel II Teil A. Nummer 1 der Verordnung (EG) Nr. 1774/2002 gestattet die Verwendung von Schlachtkörperteilen, die für genusstauglich befunden werden, jedoch aus kommerziellen Gründen nicht für den menschlichen Verzehr bestimmt sind, zur Herstellung von rohem Heimtierfutter innerhalb der Gemeinschaft. Es hat sich gezeigt, dass Teile geschlachteter Tiere, die als genussuntauglich abgewiesen wurden, jedoch keine Anzeichen von auf Mensch oder Tier übertragbaren Krankheiten aufweisen, ebenfalls unbedenklich in Heimtierfutter verwendet werden können. Anhang VIII Kapitel II Teil A. Nummer 1 und Kapitel XI der genannten Verordnung, die die einschlägigen Bestimmungen über die Einfuhr in die Gemeinschaft enthält, sollten daher entsprechend geändert werden.
(7) Es ist erforderlich, die vorhandenen Muster der Veterinärbescheinigungen für die Einfuhr von Häuten in die Gemeinschaft dahin gehend anzupassen, dass einige technische Änderungen aufgenommen werden. Der Klarheit halber sollten daher die spezifischen Anforderungen an die in Anhang VIII Kapitel VI genannten Erzeugnisse sowie die in Anhang X Kapitel 5 Teil A, Teil B und Teil C der Verordnung (EG) Nr. 1774/2002 enthaltenen Muster für Veterinärbescheinigungen entsprechend geändert werden.
(8) Die Europäische Behörde für Lebensmittelsicherheit (EFSA) ist in ihrem "Wissenschaftlichen Gutachten zu den Veterinär- und Tierschutzaspekten der Aviären Influenza" vom 13./14. September 2005 zu dem Schluss gelangt, dass Federn vor der Überführung in den Handel behandelt werden sollten, um die Gefahr einer Ausbreitung der Aviären Influenza zu verringern. Anhang VIII Kapitel VIII der Verordnung (EG) Nr. 1774/2002 enthält die dauerhaft geltenden Gemeinschaftsvorschriften über das Inverkehrbringen und die Einfuhr von Federn. In Anbetracht dieses Gutachtens und der derzeitigen weltweiten epidemiologischen Situation hinsichtlich der Aviären Influenza sollten die einschlägigen Gemeinschaftsvorschriften für die Einfuhr von Federn und ihre Behandlung vor der Einfuhr geändert werden. Daher sollte Anhang VIII dieser Verordnung entsprechend geändert werden.
(9) Die betreffende Veterinärbescheinigung in Anhang X Kapitel 1 der Verordnung (EG) Nr. 1774/2002 für Einfuhren von verarbeitetem tierischem Eiweiß, das nicht für den menschlichen Verzehr bestimmt ist, und von anderen Erzeugnissen als Heimtierfutter, die solches Eiweiß enthalten, in die Gemeinschaft sollten entsprechend geändert werden, damit die Verarbeitungsmöglichkeiten in Drittländern mit denjenigen in der Gemeinschaft gleichwertig sind. Daher ist Anhang X Kapitel 1 der Verordnung (EG) Nr. 1774/2002 entsprechend zu ändern.
(10) Anhang X Kapitel 3 Teil B der Verordnung (EG) Nr. 1774/2002 enthält die Musterveterinärbescheinigung für die Einfuhr von anderem verarbeitetem Heimtierfutter als Heimtierfutter in Dosen in die Gemeinschaft. Es hat sich gezeigt, dass verarbeitetes Heimtierfutter zunehmend in Drittländern hergestellt wird, wobei bereits verarbeitete Zutaten, die einzeln gemäß den Anforderungen dieser Verordnung bearbeitet worden sind, gemischt werden. Eine Wärmebehandlung solcher Zutaten könnte sich schädlich auf deren Nährwerteigenschaften auswirken. Aus diesem Grund sollte die Einfuhr von verarbeitetem Heimtierfutter, das sich aus solchen sicheren Zutaten zusammensetzt, in die Gemeinschaft gestattet werden, und die Musterveterinärbescheinigung in Anhang X Kapitel 3 Teil B der Verordnung (EG) Nr. 1774/2002 ist entsprechend zu ändern.
(11) Gemäß der Verordnung (EG) Nr. 1774/2002 können bestimmte tierische Nebenprodukte für die Herstellung von Heimtierfutter in die Gemeinschaft eingeführt werden, obwohl sie Material von Tieren enthalten, die mit bestimmten verbotenen Stoffen behandelt wurden. Die Einfuhr von verarbeitetem Heimtierfutter, Kauspielzeug und geschmacksverstärkenden Fleischextrakten, die solches Material enthalten, in die Gemeinschaft ist hingegen derzeit nicht gestattet. Da es sich gezeigt hat, dass das Gesundheitsrisiko bei der Einfuhr solchen Materials für die Herstellung von Heimtierfutter in die Gemeinschaft nicht höher hegt als in Fällen, in denen solches Material eine Zutat in eingeführtem verarbeitetem Heimtierfutter, eingeführtem Kauspielzeug und eingeführten geschmacksverstärkenden Fleischextrakten ist, sollte die Einfuhr der genannten verarbeiteten Erzeugnisse, die solches Material enthalten, in die Gemeinschaft ebenfalls gestattet werden. Daher sind die Musterveterinärbescheinigungen in Anhang X Kapitel 3 Teil A, Teil B, Teil C und Teil E der Verordnung (EG) Nr. 1774/2002 entsprechend zu ändern.
(12) Gemäß Anhang X Kapitel 3 Teil B der Verordnung (EG) Nr. 1774/2002 muss die Veterinärbescheinigung für anderes verarbeitetes Heimtierfutter als Heimtierfutter in Dosen einen Nachweis enthalten, aus dem hervorgeht, dass das Heimtierfutter in neuen Verpackungen verpackt wurde, die mit einem Etikett mit der Aufschrift "nicht für den menschlichen Verzehr bestimmt" versehen sind. Die Richtlinie 79/373/EWG des Rates vom 2. April 1979 über den Verkehr mit Mischfuttermitteln 3 enthält bereits gleichwertige Kennzeichnungsvorschriften zur Verhütung des unabsichtlichen oder nachlässigen Missbrauchs solcher Erzeugnisse für den menschlichen Verzehr. Die Anforderungen an das Muster für die Veterinärbescheinigung in Anhang X Kapitel 3 Teil B der Verordnung (EG) Nr. 1774/2002 sollten diesen Vorschriften Rechnung tragen und daher entsprechend geändert werden.
(13) Anhang VIII zur Verordnung (EG) Nr. 1774/2002 enthält Vorschriften für das Inverkehrbringen und die Einfuhr von Heimtierfutter, Kauspielzeug und technischen Erzeugnissen in die Gemeinschaft. Gemäß Kapitel II Teil B Nummer 4 dieses Anhangs muss Kauspielzeug bei der Herstellung einer Wärmebehandlung unterzogen werden, die gewährleistet, dass Krankheitserreger wirksam abgetötet werden. Mehrere Mitgliedstaaten haben Anträge auf Zulassung anderer Behandlungen bei der Verarbeitung von Kauspielzeug gestellt, die gleichwertige Sicherheitsgarantien bieten. Daher ist Anhang VIII Kapitel II Teil B Nummer 4 der Verordnung (EG) Nr. 1774/2002 entsprechend zu ändern.
(14) Anhang X Kapitel 3 Teil C der Verordnung (EG) Nr. 1774/2002 enthält die Musterveterinärbescheinigung für die Einfuhr von Kauspielzeug in die Gemeinschaft. Da andere Behandlungen als die Wärmebehandlung für die Verarbeitung von Kauspielzeug in der Gemeinschaft zugelassen werden, sollten diese anderen Behandlungen auch für eingeführtes Kauspielzeug zugelassen werden. Einige Arten von Kauspielzeug werden nach herkömmlichen Verfahren aus Fisch hergestellt. Aus tierseuchenrechtlicher Sicht ist eine Wärmebehandlung in solchen Fällen nicht erforderlich. Daher sollte die Musterveterinärbescheinigung in Anhang X Kapitel 3 Teil C der genannten Verordnung entsprechend geändert werden.
(15) Anhang VIII Kapitel II Teil B Nummer 6 der Verordnung (EG) Nr. 1774/2002 enthält die mikrobiologischen Normen, denen in der Gemeinschaft hergestelltes rohes Heimtierfutter entsprechen muss. Diese Normen sollten auch für die Einfuhr von rohem Heimtierfutter in die Gemeinschaft für den direkten Verkauf oder von tierischen Nebenprodukten für die Verfütterung an Zuchtpelztiere, die für den Versand in die Gemeinschaft bestimmt sind, eingeführt werden. Daher sollte Anhang X Kapitel 3 Teil D der genannten Verordnung entsprechend geändert werden.
(16) Anhang XI zur Verordnung (EG) Nr. 1774/2002 enthält Listen der Drittländer, aus denen die Mitgliedstaaten die Einfuhr von nicht für den menschlichen Verzehr bestimmten tierischen Nebenprodukten zulassen können. Teil XIII dieses Anhangs enthält eine Liste der Drittländer, aus denen die Mitgliedstaaten die Einfuhr von Equidenserum zulassen können. Gemäß dem genannten Teil XIII umfasst diese Liste die Drittländer, aus denen die Einfuhr von Schlachtpferden gestattet ist und die zu diesem Zweck aufgeführt sind in Anhang I zu der Entscheidung 2004/211/EG der Kommission vom 6. Januar 2004 zur Erstellung der Liste von Drittländern und Teilen von Drittländern, aus denen die Mitgliedstaaten die Einfuhr von lebenden Equiden sowie von Equidensperma, -eizellen und -embryonen zulassen, und zur Änderung der Entscheidungen 93/195/EWG und 94/63/EG 4.
(17) Equidenserum kann jedoch aus lebenden Tieren gewonnen werden. Deshalb sollte der Tiergesundheitsstatus, der die Aufnahme eines Drittlandes in diese Liste von Drittländern gestattet, aus denen die Einfuhr von Zucht- und Nutzequiden zulässig ist, ausreichend für die Feststellung sein, ob Equidenserum aus diesem Drittland eingeführt werden darf. Hierdurch würde insbesondere die Einfuhr von Equidenserum aus Mexiko ermöglicht. Daher ist Anhang XI Teil XIII der Verordnung (EG) Nr. 1774/2002 entsprechend zu ändern.
(18) Veterinärbescheinigungen müssen das Format aufweisen, das in der Entscheidung 2007/240/EG der Kommission 5 zur Annahme harmonisierter Vorlagen für Veterinärbescheinigungen für die Einfuhr von lebenden Tieren und von Erzeugnissen tierischen Ursprungs in die Europäische Gemeinschaft festgelegt wurde. Daher sollten das Handelspapier in Anhang II Kapitel X der Verordnung (EG) Nr. 1774/2002 und die Musterveterinärbescheinigungen in Anhang X der genannten Verordnung entsprechend geändert werden.
(19) Es sollte eine Übergangsfrist für die Zeit nach Inkrafttreten dieser Verordnung vorgesehen werden, um die Einfuhr der unter die Verordnung (EG) Nr. 1774/2002 fallenden tierischen Nebenprodukte und daraus hergestellten Erzeugnisse in die Gemeinschaft unter Beilage von Veterinärbescheinigungen gemäß dieser Verordnung weiterhin zu ermöglichen.
(20) Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit
- hat folgende Verordnung erlassen:
Die Anhänge I, II, VII, VIII, X und XI zur Verordnung (EG) Nr. 1774/2002 werden gemäß dem Anhang zur vorliegenden Verordnung geändert.
Während einer Übergangsfrist bis zum 30. April 2008 akzeptieren die Mitgliedstaaten Sendungen, denen Handelspapiere und Veterinärbescheinigungen beiliegen, die nach den bis zum 23. Juli 2007 geltenden Bestimmungen der Verordnung (EG) Nr. 1774/2002 ausgestellt und unterzeichnet wurden.
Bis zum 30. Juni 2008 akzeptieren die Mitgliedstaaten solche Sendungen, wenn die beiliegenden Handelspapiere und Veterinärbescheinigungen vor dem 1. Mai 2008 ausgestellt und unterzeichnet wurden.
Diese Verordnung tritt am dritten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in allen Mitgliedstaaten.
Brüssel, den 28. Juni 2007
_________
1) ABl. L 273 vom 10.10.2002 S. 1. Verordnung zuletzt geändert durch die Verordnung (EG) Nr. 2007/2006 der Kommission (ABl. L 379 vom 28.12.2006 S. 98).
2) ABl. L 147 vom 31.05.2001 S. 1. Verordnung zuletzt geändert durch die Verordnung (EG) Nr. 1923/2006 der Kommission (ABl. L 404 vom 30.12.2006 S. 1).
3) ABl. L 86 vom 06.04.1979 S. 30. Richtlinie zuletzt geändert durch die Verordnung (EG) Nr. 807/2003 (ABl. L 122 vom 16.05.2003 S. 36).
4) ABl. L 73 vom 11.03.2004 S. 1. Entscheidung zuletzt geändert durch die Verordnung (EG) Nr. 1792/2006 (ABl. L 362 vom 20.12.2006 S. 1).
5) ABl. L 104 vom 21.04.2007 S. 37.
| Anhang |
Die Anhänge zur Verordnung (EG) Nr. 1774/2002 werden wie folgt geändert:
1. Anhang I wird wie folgt geändert:
a) Nummer 1 erhält folgende Fassung:
"1. "Imkereierzeugnisihnkerei-Nebenerzeugnis" Honig, Wachs, Gelee Royale, Kittharz und Pollen, die nicht zum Verzehr bestimmt sind;".
b) Nummer 42 erhält folgende Fassung:
"42. "verarbeitetes tierisches Eiweiß" ausschließlich aus Material der Kategorie 3 gewonnenes tierisches Eiweiß, das gemäß Anhang VII Kapitel II so verarbeitet wurde, dass es direkt als Futtermittel-Ausgangserzeugnis oder auf andere Weise in Futtermitteln, einschließlich Heimtierfutter, oder in organischen Düngemitteln oder Bodenverbesserungsmitteln verwendet werden kann; nicht dazu gehören Blutprodukte, Milch, Erzeugnisse auf Milchbasis, Kolostrum, Gelatine, hydrolysiertes Eiweiß und Dicalciumphosphat, Eier und Eierzeugnisse, Tricalciumphosphat und Kollagen;".
2. Anhang II Kapitel X erhält folgende Fassung:
"Kapitel X
Handelspapier
Muster des Handelspapiers zur Beförderung von tierischen Nebenprodukten und verarbeiteten Produkten innerhalb der Europäischen Gemeinschaft
Anmerkungen
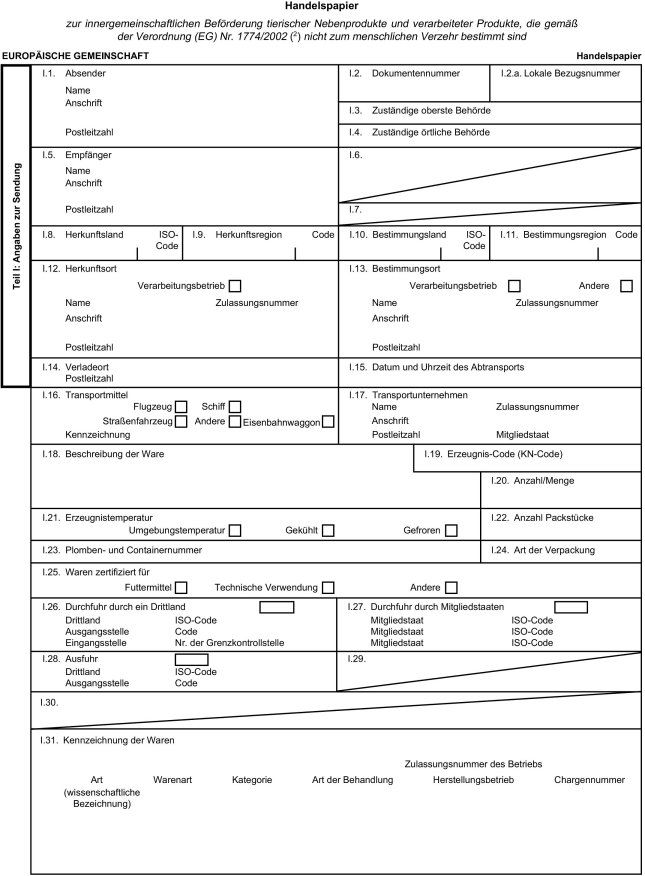


3. Anhang VII Kapitel II Teil A Nummer 1 Unterabsatz 1 erhält folgende Fassung:
"Verarbeitetes Säugetiereiweiß muss nach Verarbeitungsmethode 1 verarbeitet worden sein. Schweineblut kann jedoch auch einer der Verarbeitungsmethoden 1 bis 5 oder der Methode 7 unterzogen werden, sofern es bei Anwendung der Methode 7 durch und durch einer Wärmebehandlung bei einer Mindesttemperatur von 80 °C unterzogen wurde."
4. Anhang VIII wird wie folgt geändert:
a) Kapitel II wird wie folgt geändert:
i) Teil A Nummer 1 erhält folgende Fassung:
"1. Für die Herstellung von Heimtierfutter und Kauspielzeug dürfen nur tierische Nebenprodukte gemäß Artikel 6 Absatz 1 Buchstaben a bis j verwendet werden. Rohes Heimtierfutter darf jedoch nur aus tierischen Nebenprodukten gemäß Artikel 6 Absatz 1 Buchstabe a oder Artikel 6 Absatz 1 Buchstabe b hergestellt werden."
ii) Teil B Nummer 4 erhält folgende Fassung:
"4. Kauspielzeug muss bei der Herstellung einer Behandlung unterzogen werden, die gewährleistet, dass Krankheitserreger, einschließlich Salmonellen, wirksam abgetötet werden.
Nach der Behandlung sind alle erforderlichen Vorkehrungen zu treffen, um eine Kontamination des Kauspielzeugs zu vermeiden. Das Kauspielzeug ist in neuen Verpackungen zu verpacken."
b) Kapitel III wird wie folgt geändert:
i) Abschnitt I Teil A Nummer 3 erhält folgende Fassung:
"3. Es darf nur Handel mit unverarbeiteter Equidengülle getrieben werden, die nicht aus einem Betrieb stammt, der tierseuchenrechtlichen Beschränkungen in Bezug auf Rotz, vesikuläre Stomatitis, Milzbrand oder Tollwut gemäß Artikel 4 Absatz 5 der Richtlinie 90/426/EWG unterliegt."
ii) Abschnitt I Teil B Nummer 4 erhält folgende Fassung:
"4. Die Einfuhr unverarbeiteter Gülle ist verboten."
iii) Abschnitt II Teil B Nummer 6 Buchstabe d erhält folgende Fassung:
"d) ihnen liegt eine Veterinärbescheinigung gemäß dem Muster in Anhang X Kapitel 17 bei."
c) Kapitel VI wird wie folgt geändert:
i) Teil A Nummer 1 Buchstabe a erhält folgende Fassung:
"a) Häute von Huftieren, die den Anforderungen der Verordnung (EG) Nr. 853/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 mit spezifischen Hygienevorschriften für Lebensmittel tierischen Ursprungs entsprechen *
________
*) ABl. L 139 vom 30.04.2004 S. 55; Berichtigung im ABl. L 226 vom 25.06.2004 S. 22)."
ii) Teil B Nummer 3 erhält folgende Fassung:
"3. Der Handel mit frischen oder gekühlten Häuten unterliegt denselben Hygienebedingungen wie der Handel mit frischem Fleisch gemäß der Richtlinie 2002199/EG des Rates vom 16. Dezember 2002 zur Festlegung von tierseuchenrechtlichen Vorschriften für das Herstellen, die Verarbeitung, den Vertrieb und die Einfuhr von Lebensmitteln tierischen Ursprungs *.
________
*) ABl. L 18 vom 23.01.2003 S. 11."
iii) In Teil C Nummer 5 Buchstabe b erhält der einleitende Satzteil folgende Fassung:
"b) Sie stammen aus einem Drittland bzw. - im Falle einer Regionalisierung nach geltendem Gemeinschaftsrecht - einem Drittlandgebiet, das auf der Liste in Anhang XI Teil XIV (A) steht und das je nach Tierart".
iv) Teil C Nummer 6 Buchstaben b bis e erhalten folgende Fassung:
"b) Sie stammen entweder
c) Im Fall gesalzener Häute und Felle, die auf dem Seeweg befördert werden, sind die Häute und Felle gemäß Teil A Nummer 2 Buchstabe b oder c behandelt und nach der Behandlung während der Beförderung im Fall von b mindestens 14 Tage lang und im Fall von c 7 Tage lang vor der Einfuhr getrennt gehalten worden, wobei die Behandlung und die Beförderungsdauer durch die der Sendung beiliegende Veterinärbescheinigung nachgewiesen werden, und
d) ihnen liegt eine Veterinärbescheinigung gemäß dem Muster in Anhang X Kapitel 5 (B) bei, oder im Fall von Häuten und Fellen gemäß Teil C Nummer 6 Buchstabe b Ziffer iii dieses Anhangs eine amtliche Erklärung gemäß dem Muster in Anhang X Kapitel 5 (C)."
d) Kapitel VIII wird wie folgt geändert:
i) In Teil B Nummer 4 erhält der einleitende Satzteil folgende Fassung:
"Die Mitgliedstaaten müssen die Einfuhr unbearbeiteter Wolle und unbearbeiteter Haare genehmigen, wenn sie".
ii) In Teil B wird folgende Nummer 5 angefügt:
"5. Die Einfuhr unbearbeiteter Federn und Federnteile ist untersagt.
Die Mitgliedstaaten genehmigen die Einfuhr bearbeiteter Federn und Federnteile, wenn
e) Kapitel IX wird wie folgt geändert:
i) In Teil A Nummer 1 erhält der einleitende Satzteil folgende Fassung:
"1. Ausschließlich zur Verwendung in der Imkerei bestimmte Imkerei-Nebenerzeugnisse".
ii) Teil B Nummer 3 erhält folgende Fassung:
"3. Die Mitgliedstaaten müssen die Einfuhr anderer Imkerei-Nebenerzeugnisse als Bienenwachs in Wabenform, die zur Verwendung in der Imkerei bestimmt sind, genehmigen, wenn
iii) In Teil B werden folgende Nummern 4 und 5 angefügt:
"4. Die Mitgliedstaaten müssen die Einfuhr von anderem Bienenwachs als Bienenwachs in Wabenform für technische Verwendungszwecke genehmigen, wenn
5. Die Einfuhr von Bienenwachs in Wabenform ist untersagt."
f) Kapitel XI wird wie folgt geändert:
i) Nummer 2 Unterabsatz 2 erhält folgende Fassung:
"Tierische Nebenprodukte zur Verwendung als Tierfutter für Zuchtpelztiere oder zur Verwendung in rohem Heimtierfutter bestehen jedoch nur aus tierischen Nebenprodukten gemäß Artikel 6 Absatz 1 Buchstaben a und b."
ii) Nummer 6 erhält folgende Fassung:
"6. Ihnen liegt eine Bescheinigung gemäß einem der Muster in Anhang X Kapitel 3 (D), Kapitel 3 (F) oder Kapitel 8 bei."
5. Anhang X erhält folgende Fassung:
"Anhang X
Muster der Veterinärbescheinigungen für die Einfuhr und Durchfuhr bestimmter tierischer Nebenprodukte und daraus hergestellter Erzeugnisse aus Drittländern in die bzw. durch die Europäische Gemeinschaft
Erläuterungen






























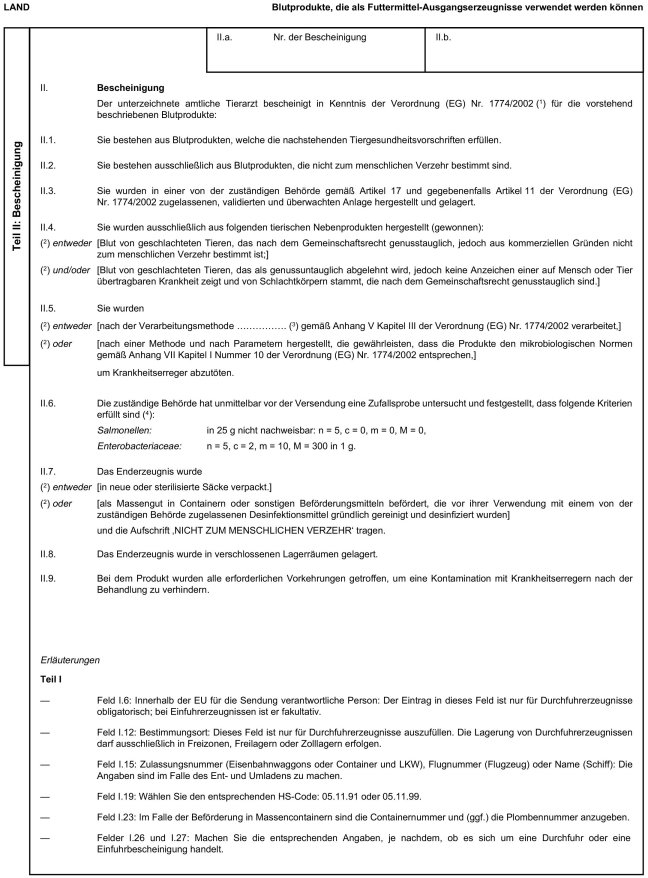





















































6. Anhang XI wird wie folgt geändert:
a) Die Überschrift von Teil VI erhält folgende Fassung:
Teil VI
Liste der Drittländer, aus denen die Mitgliedstaaten die Einfuhr von tierischen Nebenprodukten und Blutprodukten (ausgenommen Blutprodukte von Equiden) für technische einschließlich pharmazeutischer Verwendungszwecke zulassen können (Veterinärbescheinigungen gemäß Kapitel 4 (C) und Kapitel 8)"
b) In Teil VII (A) erhalten die Überschrift und Teil A folgende Fassung:
Teil VII (A)
Liste der Drittländer, aus denen die Mitgliedstaaten die Einfuhr von tierischen Nebenprodukten für die Herstellung von verarbeitetem Heimtierfutter zrlamen können (Veterinärbescheinigungen gemäß Kapitel 3 (B) und Kapitel 3 (F))
A. Tierische Nebenprodukte von Rindern, Schafen, Ziegen, Schweinen und Equiden einschließlich Zuchtwild und frei lebendes Wild
Drittländer bzw. Drittlandgebiete gemäß Anhang II Teil 1 der Entscheidung 79/542/EWG des Rates, aus denen die Einfuhr dieser Kategorie von frischem Fleisch der betreffenden Arten zugelassen ist, sowie für die angegebenen Nebenprodukte die nachstehenden Länder.
südamerikanische und südafrikanische Länder oder Gebiete dieser Länder, in denen gereiftes und entbeintes Fleisch der entsprechenden Tierarten zugelassen ist, für gereiftes und entbeintes Fleisch (einschließlich Zwerchfell) und/oder gereifte zugerichtete Innereien von Rindern, Ziegen, Schafen und frei lebendem Wild oder Zuchtwild)."
c) Teil IX erhält folgende Fassung:
Teil IX
Liste der Drittländer, aus denen die Mitgliedstaaten die Einfuhr von verarbeiteter Gülle und verarbeiteten Gülleprodukten für die Bodendüngung zulamen können (Veterinärbescheinigung gemäß Kapitel 17)
Verarbeitete Gülle und verarbeitete Gülleprodukte: Drittländer gemäß
d) Teil XIII erhält folgende Fassung:
Teil XIII
Liste der Drittländer, aus denen die Mitgliedstaaten die Einfuhr von Equidenserum zulassen können (Veterinärbescheinigung gemäß Kapitel 4 (A))
Drittländer oder Drittlandgebiete gemäß Anhang I der Entscheidung 2004/211/EG der Kommission (8), aus denen die Einfuhr von Zucht- und Nutzequiden zugelassen ist."
 | ENDE |  |