
umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (25)
 | zurück |
C.4 Biologische Abbaubarkeit - Bestimmung der "leichten" biologischen Abbaubarkeit
(red. Anm.: vgl. OECD 301)
Teil I
Allgemeines
I.1 Einleitung
Es werden sechs Prüfverfahren als "Screening"-Untersuchungen zur leichten biologischen Abbaubarkeit von chemischen Substanzen in einem aeroben wässrigen Medium beschrieben:
Teil I der Methode enthält allgemeine Überlegungen sowie Anmerkungen, die für alle sechs Prüfverfahren gelten. Spezielle Ausführungen zu den einzelnen Prüfverfahren werden in den Teilen II bis VII gemacht. Die Anlagen enthalten Definitionen, Formeln und Übersichtsmaterial.
Ein im Jahr 1988 im Bereich der OECD-Länder durchgeführter Ring-Test hat ergeben, dass mit den Prüfverfahren übereinstimmende Ergebnisse erzielt werden. Dennoch wird im Einzelfall, je nach den physikalischen Eigenschaften der Prüfsubstanz, das eine oder das andere Verfahren vorzuziehen sein.
I.2 Auswahl des geeigneten Verfahrens
Um das geeignetste Verfahren auszuwählen, sind Angaben über die Löslichkeit, den Dampfdruck und die Adsorption der chemischen Substanz erforderlich. Zur Berechnung der theoretischen Werte und/oder zur Kontrolle der gemessenen Parameter (z.B. ThSB, ThCO2, DOC, TOC, CSB - siehe Anlagen 1 und 2) müssen chemische Struktur oder Formel bekannt sein.
Prüfsubstanzen, die mindestens 100 mg/l wasserlöslich sind, können mit jedem beliebigen der genannten Verfahren geprüft werden, sofern sie nicht flüchtig und nicht adsorbierend sind. Geeignete Verfahren für schwer wasserlösliche, flüchtige oder adsorbierende chemische Substanzen sind in Tabelle 1 angegeben. Der Umgang mit schwer wasserlöslichen und flüchtigen Substanzen ist in Anlage 3 beschrieben. Mäßig flüchtige Substanzen lassen sich nach dem DOC-Die-Away-Test prüfen, wenn die Prüfgefäße (die mit einem geeigneten Stopfen verschlossen sein müssen) über ausreichenden Gasraum verfügen. In diesem Fall ist hier eine abiotische Kontrolle vorzusehen, um mögliche physikalische Verluste zu berücksichtigen.
Tabelle 1: Anwendbarkeit der Prüfverfahren
| Verfahren | Analysenmethode | Eignung für folgende Substanzen: | ||
| löslich | flüchtig | adsorbierend | ||
| DOC-Die-Away-Test | Gelöster organischer Kohlstoff | +/- | ||
| Modifizierter OECD-Screening-Test | Gelöster organischer Kohlstoff | +/- | ||
| CO2-Entwicklungstest | Respirationstest: CO2-Entwicklung | + | - | + |
| Manometrischer Respirationstest | Manometrische Messung: Sauerstoffverbrauch | + | +/- | + |
| Geschlossener Flaschentest | Respirationstest: Sauerstoffverbrauch | +/ - | + | + |
| MITI-Test | Respirationstest: Sauerstoffverbrauch | + | +/- | + |
Zur Interpretation der erzielten Ergebnisse sind Angaben zur Reinheit oder zu den relativen Anteilen der Hauptbestandteile der Prüfsubstanz erforderlich, insbesondere wenn es sich um niedrige oder marginale Werte handelt.
Angaben zur Bakterientoxizität der Prüfsubstanz (Anlage 4) können bei der Wahl geeigneter Prüfkonzentrationen zweckdienlich und bei der richtigen Interpretation geringer biologischer Abbauwerte wichtig sein.
I.3 Referenzsubstanzen
Zur Überprüfung des Verfahrens werden Referenzsubstanzen getestet, die die Kriterien für eine leichte biologische Abbaubarkeit erfüllen; dazu wird ein geeignetes Prüfgefäß parallel zur normalen Prüfreihe mitgeführt.
Geeignete Chemikalien sind Anilin (frisch destilliert), Natriumacetat und Natriumbenzoat. Diese Referenzsubstanzen werden bei diesen Verfahren durchweg abgebaut, auch wenn kein Inokulum hinzugefügt wird.
Es ist vorgeschlagen worden, dass eine Referenzsubstanz gesucht werden sollte, die biologisch leicht abgebaut wird, aber die Zugabe eines Inokulums erfordert. Als eine solche Substanz wurde Kaliumhydrogenphthalat vorgeschlagen, doch steht ein entsprechender Nachweis noch aus, bevor es als Referenzsubstanz akzeptiert werden kann.
Bei den Respirationstests können stickstoffhaltige Verbindungen die Sauerstoffaufnahme infolge Nitrifikation beeinflussen (siehe Anlagen 2 und 5).
I.4 Prinzip der Methode
Eine Lösung oder Suspension der Prüfsubstanz in einem mineralischen Medium wird unter aeroben Bedingungen im Dunkeln oder bei diffuser Beleuchtung angeimpft und bebrütet. Die DOC-Menge in der Prüflösung, die aus dem Inokulum stammt, muss im Vergleich zu der DOC-Menge aus der Prüfsubstanz so gering wie möglich sein. Die endogene Aktivität des Inokulums wird durch Mitfuhren paralleler Blindproben mit Inokulum aber ohne Prüfsubstanz in der Lösung berücksichtigt, obwohl die endogene Aktivität der Zellen in Gegenwart der Substanz nicht genau dieselbe sein wird wie in der endogenen Kontrolle. Eine Referenzsubstanz wird parallel dazu eingesetzt, um den Verlauf der Vorgänge zu kontrollieren.
Im Allgemeinen wird der Abbau durch Bestimmung von Parametern (z.B. DOC-Abnahme, CO2-Erzeugung und Sauerstoffaufnahme) ermittelt; entsprechende Messungen werden in ausreichenden Abständen vorgenommen, um Beginn und Ende des Bioabbaus zu identifizieren. Automatische Respirometer gestatten eine fortlaufende Messung. Mitunter wird der DOC-Wert zusätzlich zu einem weiteren Parameter gemessen, im Allgemeinen aber nur zu Beginn und am Ende des Tests. Zur Beurteilung des Primärabbaus der Prüfsubstanz und zur Bestimmung der Konzentration eventueller Abbauprodukte können auch spezifische Analysen durchgeführt werden. (Beim MITI-Test sind diese obligatorisch).
Normalerweise beträgt die Testdauer 28 Tage. Die Tests können jedoch auch vorzeitig abgebrochen werden, wenn die biologische Abbaukurve über mindestens drei Messungen ein Plateau erreicht hat. Eine Verlängerung der Tests über 28 Tage hinaus ist ebenfalls möglich, wenn aus der Kurve zu ersehen ist, dass der biologische Abbau eingesetzt hat, das Plateau aber am 28. Tag noch nicht erreicht ist.
I.5 Qualitätskriterien
I.5.1 Reproduzierbarkeit
Wegen der Spezifität des biologischen Abbaus und der als Inokula verwendeten Bakterienmischpopulationen sind die Messungen mindestens in doppelten Ansätzen durchzuführen.
Es ist allgemein bekannt, dass die Unterschiede zwischen Doppelmessungen umso kleiner sind, je größer die Konzentration der dem Prüfmedium anfänglich hinzugefügten Mikroorganismen war. Ringtests haben auch gezeigt, dass zwischen den in verschiedenen Prüfeinrichtungen erzielten Ergebnissen große Unterschiede bestehen können, doch wird normalerweise eine gute Übereinstimmung erreicht, wenn biologisch leicht abbaubare Substanzen verwendet werden.
I.5.2 Gültigkeit des Versuchs
Ein Versuch wird dann als gültig angesehen, wenn die Extremwerte der Wiederholungsmessungen für die Abnahme der Prüfsubstanz nicht mehr als 20 % voneinander abweichen, am Plateau, Testende oder am Ende des 10-Tage-Fensters, und wenn der prozentuale Abbau der Referenzsubstanz das Plateau für leichte biologische Abbaubarkeit innerhalb von 14 Tagen erreicht hat. Ist eine der beiden Bedingungen nicht erfüllt, sollte der Versuch wiederholt werden. Auf Grund der Stringenz der Methoden bedeuten niedrige Ergebnisse nicht unbedingt, dass die Prüfsubstanz unter Umweltbedingungen biologisch nicht abbaubar ist, sondern zeigt nur, dass weitere Untersuchungen erforderlich sind, um einen biologischen Abbau nachzuweisen.
Wenn in einem Toxizitätstest mit Prüf- und Referenzsubstanz innerhalb von 14 Tagen weniger als 35 % Abbau (auf DOC-Basis) bzw. weniger als 25 % (auf der Basis des ThSB oder ThCO2) erzielt wurde, kann von einer Hemmwirkung der Prüfsubstanz ausgegangen werden (vgl. auch Anlage 4). Die Versuchsreihe sollte in diesem Fall wiederholt werden, wenn möglich unter Verwendung einer geringeren Konzentration der Prüfsubstanz und/oder einer höheren Konzentration des Inokulums, jedoch nicht mehr als 30 mg Feststoffe pro Liter.
I.6 Allgemeine Verfahren und Vorbereitungen
Die allgemeinen Prüfbedingungen sind in Tabelle 2 zusammengefasst. Geräte und weitere Versuchsbedingungen speziell zu den Einzeltests werden gesondert in den entsprechenden Kapiteln zu den einzelnen Prüfverfahren angegeben.
Tabelle 2: Prüfbedingungen
| Prüfverfahren | DOC-Die-Away-Test | CO2 Entwicklungstest | Manometr. Respirationstest | Mod. OECD-Screening-Test | Geschlossener Flaschentest | MITI-(I)-Test |
| in mg/l | 100 | 2-10 | 100 | |||
| mg DOC/l | 10-40 | 10-20 | 10-40 | |||
| ThSB/l | 50-100 | 5-10 | ||||
| Konzentration des Inokulums (in Zellen/l, ungefährer Wert) | höchstens 30 mg/l SF oder höchstens 100 ml Kläranlagenablauf pro 1 (107-108) | 0,5 ml Kläranlagenablauf pro 1 (105) | bis zu 5 ml Kläranlagenablauf pro 1 (104-106) | 30 mg/l SF (107-108) | ||
| Konzentration der Elemente im mineral. Medium (in mg/l): | ||||||
| P | 116 | 11,6 | 29 | |||
| N | 1,3 | 0,13 | 1,3 | |||
| Na | 86 | 8,6 | 17,2 | |||
| K | 122 | 12,2 | 36,5 | |||
| Mg | 2,2 | 2,2 | 6,6 | |||
| Ca | 9,9 | 9,9 | 29,7 | |||
| Fe | 0,05- 0,1 | 0,05- 0,1 | 0,15 | |||
| pH | 7,4 ± 0,2 | nach Möglichkeit 7,0 | ||||
| Temperatur | 22 ± 2 °C | 25 ± 1 °C | ||||
| DOC = gelöster organischer Kohlenstoff (Dissolved Organic Carbon). ThSB = Theoretischer Sauerstoffbedarf. SF =suspendierte Feststoffe. | ||||||
I.6.1 Verdünnungswasser
Deionisiertes oder destilliertes Wasser, frei von toxischen Substanzen (z.B. Cu++-Ionen) in hemmenden Konzentrationen, wird verwendet. Es darf nicht mehr als 10 % des von der Prüfsubstanz eingebrachten organischen Kohlenstoffs enthalten. Die hohe Reinheit des Prüfwassers ist zur Vermeidung hoher Blindwerte erforderlich. Eine Kontamination kann sich aus inhärenten Verunreinigungen sowie aus dem Ionenaustauscherharz und Materialien aus Bakterien und Algen ergeben. Für jede Versuchsreihe ist nur eine Charge Wasser zu verwenden, die vorher durch DOC-Analyse zu prüfen ist. Diese Prüfung ist nicht nötig im Closed-Bottle-Test, aber der Sauerstoffverbrauch des Wassers muss gering sein.
I.6.2 Stammlösungen von mineralischen Bestandteilen
Zur Herstellung der Prüflösungen werden Stammlösungen mit geeigneten Konzentrationen an mineralischen Bestandteilen angesetzt. Für den DOC-Die-Away-Test, den modifizierten OECD-Screening-Test, den CO2-Enwicklungstest, den manometrischen Respirationstest und den geschlossenen Flaschentest können folgende Stammlösungen (mit unterschiedlichen Verdünnungsfaktoren) verwendet werden.
Die Verdünnungsfaktoren und - beim MITI-Test - die spezielle Vorbereitung des mineralischen Mediums werden jeweils in den entsprechenden Kapiteln zu den einzelnen Versuchen angegeben.
Stammlösungen:
Die folgenden Stammlösungen sind unter Verwendung von Reagenzien des Reinheitsgrades "zur Analyse" (p. a.) anzusetzen:
| a) | Kaliumdihydrogenorthophosphat, KH2 PO4 | 8,50 g |
| Dikaliummonohydrogenorthophosphat, K2 HPO4 | 21,75 g | |
| Dinatriummonohydrogenorthophosphat-Dihydrat, Na2 HPO4· 2H2 O | 33,40 g | |
| Ammoniumchlorid, NH4 Cl | 0,50 g | |
| in Wasser gelöst und auf 1 l aufgefüllt; der pH-Wert der Lösung sollte 7,4 betragen. | ||
| b) | Calciumchlorid, wasserfrei, CaCl2 | 27,50 g |
| oder Calciumchlorid-Dihydrat, CaCl2· 2H2 O | 36,40 g | |
| in Wasser gelöst und auf 1 l aufgefüllt | ||
| c) | Magnesiumsulfat-Heptahydrat, MgSO4· 7H2 O | 22,50 g |
| in Wasser gelöst und auf 1 l aufgefüllt | ||
| d) | Eisen(III)chlorid-Hexahydrat, FeCl3· 6H2 O | 0,25 g |
| in Wasser gelöst und auf 1 l aufgefüllt |
Anmerkung: Damit diese Lösung nicht unmittelbar vor Gebrauch zubereitet werden muss, ist 1 Tropfen konzentriertes HCl oder 0,4 g Dinatriumsalz der Ethylendiamintetraessigsäure (EDTA) pro Liter zuzufügen.
I.6.3 Stammlösungen der Chemikalien
Liegt die Löslichkeit über 1 g/l, sind je nach Notwendigkeit 1-10 g der Prüf- oder Referenzsubstanz in deionisiertem Wasser zu lösen und auf 1 l aufzufüllen. Ansonsten sind die Stammlösungen im mineralischen Medium anzusetzen, oder die Prüfsubstanz wird direkt dem mineralischen Medium zugegeben. Die Vorgehensweise für schwerlösliche Substanzen ist in Anlage 3 angegeben; beim MITI-Test (Methode C.4-F) jedoch sind weder Lösungsmittel noch Emulgatoren zu verwenden.
I.6.4 Inokula
Das Inokulum kann aus verschiedenen Quellen gewonnen werden: aus Belebtschlamm, aus Kläranlagenablauf (nicht chloriert), aus Oberflächenwasser, aus Böden oder aus mehreren dieser Quellen zugleich. Bei den Methoden DOC-Die-Away-Test, CO2-Entwicklungstest oder manometrischer Respirationstest, sollte der Belebtschlamm, falls dieser verwendet wird, einer Klärgroß- oder -laboranlage entstammen, die hauptsächlich häusliche Abwässer reinigt. Bei Inokula aus anderen Quellen sind stärker streuende Ergebnisse festgestellt worden. Beim modifizierten OECD-Screening-Test und beim geschlossenen Flaschentest ist ein stärker verdünntes Inokulum ohne Schlammflocken erforderlich, vorzugsweise aus dem Ablauf einer kommunalen Kläranlage oder einer Laboranlage für häusliche Abwässer. Beim MITI-Test wird das Inokulum aus einer Kombination verschiedener Quellen gewonnen - siehe Beschreibung im entsprechenden Kapitel.
I.6.4.1 Inokulum aus Belebtschlamm
Eine Belebtschlammprobe ist dem Belüftungstank einer Kläranlage oder einer Laboranlage, die hauptsächlich häusliche Abwässer reinigt, frisch zu entnehmen. Falls erforderlich, sind grobe Partikel durch Filtration durch ein feinmaschiges Sieb zu entfernen; danach ist der Schlamm aerob zu halten.
Eine andere Möglichkeit besteht darin, den Schlamm nach Abtrennung grober Partikel absitzen zu lassen oder zu zentrifugieren (z.B. 10 Min. bei 1.100 g). Der Überstand wird verworfen und der Schlamm kann im mineralischen Medium gewaschen werden. Der konzentrierte Schlamm wird in einem mineralischen Medium suspendiert, um eine Konzentration von 3-5 g suspendierte Feststoffe pro Liter zu erhalten. Anschließend wird bis zur Verwendung belüftet.
Der Schlamm sollte von einer gut arbeitenden konventionellen Anlage genommen werden. Wenn Schlamm aus einer Abwasserkläranlage verwendet werden muss, der vermutlich Substanzen mit hemmender Wirkung enthält, ist er zu waschen. Dazu lässt man den resuspendierten Schlamm nach gründlichem Durchmischen absitzen oder zentrifugiert ihn, verwirft anschließend den Überstand und suspendiert den gewaschenen Schlamm in einem weiteren Volumen mineralischen Mediums erneut. Diese Schritte sind so lange zu wiederholen, bis der Schlamm als frei von übermäßigem Substrat oder Hemmsubstanz angesehen wird.
Nach vollständiger Resuspension oder bei unbehandeltem Schlamm ist unmittelbar vor Gebrauch das Trockengewicht der suspendierten Feststoffe zu bestimmen.
Eine weitere Möglichkeit besteht in der Homogenisierung von Belebtschlamm (3-5 g suspendierte Feststoffe pro Liter). Dazu wird der Schlamm 2 Min. bei mittlerer Geschwindigkeit in einer mechanischen Mischvorrichtung durchmischt. Danach lässt man den durchmischten Schlamm 30 Min., wenn erforderlich länger, absitzen und dekantiert die als Inokulum verwendete Flüssigkeit mit einer Geschwindigkeit von 10 ml pro Liter mineralischen Mediums.
I.6.4.2 Andere Quellen für das Inokulum
Dieses lässt sich aus dem Ablauf einer Kläranlage oder einer Laboranlage für überwiegend häusliche Abwässer gewinnen. Dazu ist eine frische Probe zu entnehmen und während des Transports aerob zu halten. Zum Absetzen wird die Probe eine Stunde stehen gelassen oder durch einen grobporigen Papierfilter filtriert und der dekantierte Ablauf (bzw. das Filtrat) bis zum Gebrauch aerob gehalten. Bis zu 100 ml diesen Inokulumtyps kann pro Liter Medium verwendet werden.
Als weitere Inokulumquelle dient Oberflächenwasser. In diesem Fall ist von einem geeigneten Oberflächenwasser (z.B. Fluss, See) eine Probe zu entnehmen und diese bis zum Gebrauch aerob zu halten. Falls erforderlich, wird das Inokulum durch Filtration oder Zentrifugieren konzentriert.
I.6.5 Vorbereitung der Inokula
Die Inokula können an die Versuchsbedingungen, nicht aber an die Prüfsubstanz adaptiert werden. Die entsprechende Konditionierung besteht in der Belüftung des Belebtschlamms im mineralischen Medium oder des Kläranlagenablaufs über eine Dauer von 5-7 Tagen bei der Prüftemperatur. Die Konditionierung verbessert mitunter die Präzision der Prüfmethoden durch eine Absenkung der Blindwerte. Eine Vorbereitung des MITI-Inokulums wird als nicht erforderlich angesehen.
I.6.6 Abiotische Kontrollen
Sofern erforderlich, sollte der mögliche abiotische Abbau der Prüfsubstanz durch Bestimmung der DOCAbnahme, der Sauerstoffaufnahme oder der Kohlendioxidentwicklung in sterilen Kontrollen ohne Inokulum geprüft werden. Die Sterilisierung ist durch Membranfiltration (0,2- 0,45 µm) oder durch Hinzufügen von einer geeigneten toxischen Substanz in entsprechender Konzentration vorzunehmen. Wenn Membranfiltration verwendet wird, muss die Probenahme aseptisch erfolgen, um sterile Bedingungen zu wahren. Unter der Voraussetzung, dass die Adsorption der Prüfsubstanz nicht von vornherein ausgeschlossen werden kann, müssen Prüfungen auf der Grundlage der Messung von DOC-Abnahme, insbesondere bei Belebtschlamm-Inokula, eine abiotische Kontrolle beinhalten, die beimpft und vergiftet wurde.
I.6.7 Anzahl der Flaschen
Die Anzahl der Flaschen in einem typischen Ansatz wird in den Kapiteln zu jedem Test beschrieben. Die folgenden Flaschen sollten verwendet werden:
Die Bestimmung der Prüfsuspension und des Inokulum-Blindwerts muss unbedingt parallel durchgeführt werden. Die Bestimmungen der anderen Flaschen sollten ebenfalls parallel durchgeführt werden.
Dies ist eventuell nicht immer möglich. Es sollte sichergestellt sein, dass ausreichend Proben genommen oder Ablesungen vorgenommen werden, um die prozentuale Abnahme innerhalb des auszuwertenden "10-Tage Fensters" zu beurteilen.
I.7 Daten und Auswertung
Zur Berechnung von Dt (prozentualer Abbau) werden die Mittelwerte der Wiederholungsmessung der Summenparameter in beiden Prüfgefäßen und im Inokulum-Blindversuch verwendet. Die Formeln sind nachstehend in den jeweiligen Kapiteln angegeben. Der Verlauf des Abbaus wird grafisch dargestellt, und das 10-Tage-Fenster markiert. Die am Ende des 10-Tage-Fensters erreichte prozentuale Abnahme und der bei Erreichen des Plateaus bzw. bei Testende (je nach dem konkreten Fall) erzielte Wert sind zu berechnen und anzugeben.
In den respirometrischen Tests können stickstoffhaltige Substanzen den Sauerstoffverbrauch infolge Nitrifikation beeinträchtigen (vgl. Anlagen 2 und 5).
I.7.1 Messung des Abbaus mittels DOC-Bestimmung
Der prozentuale Abbau (Dt) sollte für die Flaschen mit Prüfsubstanz zu jeder Probenahme-Zeit getrennt berechnet werden, wobei Mittelwerte der beiden DOC-Messungen verwendet werden, um die Validität der Prüfungen beurteilen zu können (siehe I.5.2). Er wird wie folgt berechnet:
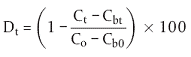
Hierin bedeuten:
| Dt | = prozentualer Abbau zum Zeitpunkt t |
| Co | = mittlere DOC-Anfangskonzentration im angeimpften Kulturmedium mit der Prüfsubstanz (mg DOC/l) |
| Ct | = mittlere DOC-Konzentration im angeimpften Kulturmedium mit der Prüfsubstanz zum Zeitpunkt t (mg DOC/l) |
| Cbo | = mittlere DOC-Anfangskonzentration des Blindwerts im angeimpften mineralischen Medium (mg DOC/l) |
| Cbt | = mittlere DOC-Konzentration des Blindwerts im angeimpften mineralischen Medium zum Zeitpunkt t (mg DOC/l) |
Sämtliche Konzentrationen werden experimentell bestimmt.
I.7.2 Messung des Abbaus mittels spezifischer Analytik
Liegen Daten aus einer spezifischen Analyse vor, ist der biologische Primärabbau wie folgt zu berechnen:
Dt = [(Sb- Sa) / Sb] x 100
Dt = prozentualer Abbau zum Zeitpunkt t, in der Regel nach 28 Tagen
Sa = Restmenge an Prüfsubstanz im angeimpften Medium bei Versuchsende (mg)
Sb = Restmenge an Prüfsubstanz im Blindversuch mit Wasser/Medium, zu dem nur die Prüfsubstanz hinzugefügt wurde (mg)
I.7.3 Abiotischer Abbau
Bei abiotischer Sterilkontrolle wird der prozentuale abiotische Abbau wie folgt berechnet:
% abiotischer Abbau = [(Cs(o)- Cs(t)/ Cs(o) ) x 100
wobei:
Cs(o) = DOC-Konzentration in Sterilkontrolle am Tag 0
Cs(t) = DOC-Konzentration in Sterilkontrolle am Tag t
I.8 Abschlussbericht
Im Prüfbericht ist, wenn möglich, Folgendes anzugeben:
...
1) DOC = dissolved organic carbon.
Teil II
DOC-Dieaway-Test - Abnahme von gelöstem organischem Kohlenstoff (DOC) (Methode C.4-A)
II.1 Prinzip der Methode
Ein definiertes Volumen des angeimpften mineralischen Mediums mit einer bekannten Konzentration der Prüfsubstanz (10-40 mg DOC/l) als einziger nomineller Quelle organischen Kohlenstoffs wird im Dunkeln oder bei diffuser Beleuchtung bei 22 ± 2 °C belüftet.
Der Abbau wird mittels DOC-Analyse über einen Zeitraum von 28 Tagen in kurzen Zeitabständen verfolgt. Der Grad des biologischen Abbaus wird durch die Abnahme der DOC-Konzentration (nach Berücksichtigung des Inokulum-Blindwerts) in % der Ausgangskonzentration berechnet. Der Grad des biologischen Primärabbaus lässt sich aus der ergänzenden chemischen Analyse errechnen, die zu Beginn und am Ende der Inkubation vorgenommen wird.
II.2 Beschreibung der Methode
II.2.1 Geräte
II.2.2 Ansatz des mineralischen Mediums
Zubereitung der Stammlösung siehe I.6.2.
10 ml Lösung (a) mit 800 ml Verdünnungswasser mischen, 1 ml der Lösungen (b) bis (d) hinzugeben und mit Verdünnungswasser auf 1 l auffüllen.
II.2.3 Ansatz und Vorbereitung des Inokulums
Das Inokulum kann aus verschiedenen Quellen gewonnen werden: aus Belebtschlamm, aus Kläranlagenablauf, aus Oberflächenwasser, aus Böden oder aus mehreren dieser Quellen zugleich.
Vgl. I.6.4, I.6.4.1, I.6.4.2 und I.6.5.
II.2.4 Ansatz der Flaschen
Beispiel: Jeweils 800 ml des mineralischen Mediums werden in konische 2-l-Flaschen gegeben, dazu wird in jeweils separate Ansätzen ein ausreichendes Volumen Stammlösung der Prüf- und der Referenzsubstanz gegeben, um ein DOC-Äquivalent von 10-40 mg/l zu erhalten. Der pH-Wert sollte überprüft und wenn nötig auf 7,4 eingestellt werden. Die Flaschen werden mit Belebtschlamm oder einem Inokulum anderer Herkunft (vgl. I.6.4) beimpft, um eine Endkonzentration nicht über 30 mg suspendierter Feststoffe pro Liter zu erhalten. Daneben werden Inokulum-Kontrollen im mineralischen Medium ohne Prüf- oder Referenzsubstanz angesetzt.
Falls erforderlich, ist ein Gefäß zur Kontrolle der möglichen Hemmwirkung der Prüfsubstanz zu verwenden; dazu ist eine Lösung mit vergleichbaren Konzentrationen sowohl der Prüf- als auch der Referenzsubstanz im mineralischen Medium anzuimpfen.
Falls erforderlich, ist eine weitere, sterile Flasche anzusetzen, um zu prüfen, ob die Prüfsubstanz abiotisch abgebaut wird; dazu ist eine nicht angeimpfte Lösung dieser Substanz zu verwenden (vgl. I.6.6).
Wenn vermutet werden muss, dass die Prüfsubstanz signifikant am Glas oder am Schlamm usw. adsorbiert wird, ist eine Vorprüfung vorzunehmen, mit der das Ausmaß der Adsorption und damit die Eignung des Versuchs für die Prüfsubstanz bestimmt werden (vgl. Tabelle 1). Ansetzen einer Flasche mit Prüfsubstanz, Inokulum und Sterilisiermittel.
Alle Flaschen mit dem mineralischen Medium auf 1 l auffüllen, mischen und anschließend von jeder Flasche eine Probe zwecks Bestimmung der DOC-Ausgangskonzentration entnehmen (vgl. Anlage 2.4). Öffnungen der Flaschen so abdecken, z.B. mit Aluminiumfolie, dass ein freier Luftaustausch zwischen der Flasche und der Umgebungsluft möglich bleibt. Danach die Flaschen in die Schüttelmaschine stellen und mit dem Versuch beginnen.
II.2.5 Anzahl der Flaschen in einem typischen Durchgang
Flaschen 1 und 2: Prüfsuspension
Flaschen 3 und 4: Inokulum-Blindwert
Flasche 5: Verfahrenskontrolle
Empfohlen und falls notwendig:
Flasche 6: abiotische Sterilkontrolle
Flasche 7: Adsorptionskontrolle
Flasche 8: Toxizitätskontrolle
Vgl. I.6.7.
II.2.6 Durchführung der Prüfung
Während des Versuchs sind die DOC-Konzentrationen in jeder Flasche in bestimmten Zeitabständen doppelt zu bestimmen, und zwar so häufig, dass der Beginn des 10-Tage-Fensters und die prozentuale Abnahme am Ende des 10-Tage-Fensters bestimmt werden können. Dabei ist pro Messung nur die Mindestmenge an Prüfsuspension zu entnehmen.
Vor der Probeentnahme sind die Verdampfungsverluste aus den Flaschen, falls erforderlich, durch Zufügen von Verdünnungswasser auszugleichen (I.6.1). Der Versuchsansatz ist vor Entnahme einer Probe gründlich zu durchmischen, wobei sicherzustellen ist, dass an den Wänden der Flaschen anhaftendes Material vor der Probenahme gelöst oder suspendiert wird. Unmittelbar nach der Probenahme ist zu filtrieren (Membranfilter) oder zu zentrifugieren (vgl. Anlage 2.4). Die filtrierten oder zentrifugierten Proben sind noch am selben Tag zu analysieren; ansonsten können sie bei 2-4 °C für maximal 48 h bzw. bei unter - 18 °C über einen längeren Zeitraum aufbewahrt werden.
II.3 Daten und Abschlussbericht
II.3.1 Auswertung der Ergebnisse
Der prozentuale Abbau zum Zeitpunkt t ist entsprechend I.7.1 (DOC-Bestimmung) sowie wahlweise entsprechend I.7.2 (spezifische Analyse) zu berechnen.
Sämtliche Ergebnisse sind auf den dafür vorgesehenen Datenblättern zu protokollieren.
II.3.2 Gültigkeit der Ergebnisse
Vgl. I.5.2.
II.3.3 Abschlussbericht
Vgl. I.8.
II.4 Datenblatt
Nachstehend ein Beispiel eines Datenblattes.
DOC-DIE-AWAY-TEST
1. LABOR
2. DATUM BEI VERSUCHSBEGINN
3. PRÜFSUSBSTANZ
Name:
Konzentration der Stammlösung: ... mg/l auf Substanz bezogen
Anfangskonzentration im Medium, t0: ... mg/l auf Substanz bezogen
4. INOKULUM
Herkunft: ...
Vorgenommene Behandlung: ...
Vorbereitung/Konditionierung (soweit zutreffend): ...
Konzentration der suspendierten Feststoffe im Reaktionsgemisch: ... mg/l
5. KOHLENSTOFFBESTIMMUNGEN
Kohlenstoffanalysator: ...
| Flasche Nr. | DOC nach n Tagen (mg/l) | ||||||
| 0 | n1 | n2 | n3 | nx | |||
| Testsubstanz plus Inokulum | 1 | a1 | |||||
| a2 | |||||||
| a, Mittelwert Ca(t) | |||||||
| 2 | b1 | ||||||
| b2 | |||||||
| b, Mittelwert Cb(t) | |||||||
| Inokulum-Blindversuch ohne Testsubstanz | 3 | c1 | |||||
| c2 | |||||||
| c, Mittelwert Cc(t) | |||||||
| 4 | d1 | ||||||
| d2 | |||||||
| d, Mittelwert Cd(t) | |||||||
| Cbl(t) = (Cc(t)+ Cd(t)) / 2 | |||||||
6. AUSWERTUNG DER ROHDATEN
| Flasche Nr. | % Abbau nach n Tagen | ||||||
| 0 | n1 | n2 | n3 | nx | |||
| 1 | 0 | ||||||
| 2 | 0 | ||||||
| Mittel * | D = (D1- D2) / 2 | 0 | |||||
| *) Bei erheblichem Unterschied sollten D1 und D2 nicht gemittelt werden. | |||||||
Anmerkung: Für die Referenz und die Toxizitätskontrolle können ähnliche Formblätter verwendet werden.
7. ABIOTISCHE KONTROLLE (wahlweise)
| Zeit (Tage) | ||
| 0 | t | |
| DOC-Konzentration (mg/l) in Sterilkontrolle | Cs(o) | Cs(t) |
% abiotischer Abbau = [(Cs(o)- Cs(t)) / Cs(o)] x 100
8. SPEZIFISCHE ANALYSE (wahlweise)
| Bei Versuchsende verbliebene Menge an Prüfsubstanz (mg/l) | % Primärabbau | |
| Sterilkontrolle | Sb | |
| Beimpftes Prüfmedium | Sa | ([Sb- Sa) / Sb] x 100 |
Teil III
Modifizierter OECD-Screening-Test (Methode C.4-B)
III.1 Prinzip der Methode
Ein definiertes Volumen des mineralischen Mediums mit einer bekannten Konzentration der Prüfsubstanz (10-40 mg/l DOC) als einziger nomineller Quelle organischen Kohlenstoffs wird mit 0,5 ml Kläranlagenablauf pro Liter Medium angeimpft und im Dunkeln oder bei diffuser Beleuchtung bei 22 ± 2 °C belüftet.
Der Abbau wird mittels DOC-Analyse über einen Zeitraum von 28 Tagen in kurzen Zeitabständen verfolgt. Der Grad des biologischen Abbaus wird durch die Abnahme der DOC-Konzentration (nach Berücksichtigung des Inokulum-Blindwerts) in % der Ausgangskonzentration berechnet. Der Grad des biologischen Primärabbaus lässt sich auch aus der ergänzenden chemischen Analyse errechnen, die zu Beginn und am Ende der Inkubation vorgenommen wird.
III.2 Beschreibung der Methode
III.2.1 Geräte
III.2.2 Ansatz des mineralischen Mediums
Zubereitung der Stammlösung siehe I.6.2.
10 ml Lösung (a) mit 800 ml Verdünnungswasser mischen, 1 ml der Lösungen (b) bis (d) hinzugeben und mit Verdünnungswasser auf 1 l auffüllen.
Bei diesem Verfahren werden nur 0,5 ml Kläranlagenablauf pro Liter als Inokulum verwendet, so dass das Medium möglicherweise mit Spurenelementen und Wachstumsfaktoren angereichert werden muss. Zu diesem Zweck wird von den folgenden Lösungen jeweils 1 ml pro Liter endgültigem Medium zugefügt.
Lösung der Spurenelemente:
| Mangansulfat-Tetrahydrat, MnSO4· 4H2 O | 39,9 mg |
| Borsäure, H3 BO3 | 57,2 mg |
| Zinksulfat-Heptahydrat, ZnSO4· 7H2 O | 42,8 mg |
| Ammoniumheptamolybdat, (NH4)6· Mo7 O24 | 34,7 mg |
| Fe-Chelat (FeCl3 Ethylendiamintetraessigsäure) | 100,0 mg |
| in Verdünnungswasser gelöst und auf 1.000 ml aufgefüllt. | |
| Vitaminlösung: | |
| Hefeextrakt | 15,0 mg |
| in 100 ml Wasser gelöst und durch Membranfilter mit 0,2 µm Porengröße steril filtriert bzw. frisch zubereitet. | |
III.2.3 Ansatz und Vorbereitung des Inokulums
Das Inokulum ist von Abläufen einer Kläranlage oder Anlage im Labormaßstab, denen vorwiegend häusliche Abwässer zugeführt werden, zu entnehmen. Vgl. I.6.4.2 und I.6.5.
0,5 ml pro Liter mineralisches Medium sind zu verwenden.
III.2.4 Ansatz der Flaschen
Beispiel: Jeweils 800 ml mineralischen Mediums werden in konische 2-l-Flaschen gegeben, dazu wird in jeweils separaten Ansätzen ein ausreichendes Volumen Stammlösung der Prüf- und der Referenzsubstanz gegeben, um ein DOC-Äquivalent von 10-40 mg/l zu erhalten. Der pH-Wert sollte überprüft und wenn nötig auf 7,4 eingestellt werden. Die Flaschen werden mit 0,5 ml Kläranlagenablauf pro Liter beimpft (vgl. I.6.4.2). Daneben werden Inokulum-Kontrollen im mineralischen Medium ohne Prüf- oder Referenzsubstanz angesetzt.
Falls erforderlich, ist ein Gefäß zur Kontrolle der möglichen Hemmwirkung der Prüfsubstanz zu verwenden; dazu ist eine Lösung mit vergleichbaren Konzentrationen sowohl der Prüf- als auch der Referenzsubstanz im mineralischen Medium anzuimpfen.
Falls erforderlich, ist eine weitere, sterile Flasche anzusetzen, um zu prüfen, ob die Prüfsubstanz abiotisch abgebaut wird; dazu ist eine nicht angeimpfte Lösung dieser Substanz zu verwenden (vgl. I.6.6).
Wenn vermutet werden muss, dass die Prüfsubstanz signifikant am Glas oder am Schlamm usw. adsorbiert wird, ist eine Vorprüfung vorzunehmen, mit der das Ausmaß der Adsorption und damit die Eignung des Versuchs für die Prüfsubstanz bestimmt werden (vgl. Tabelle 1). Ansetzen einer Flasche mit Prüfsubstanz, Inokulum und Sterilisiermittel.
Alle Flaschen mit dem mineralischen Medium auf 1 l auffüllen, mischen, und anschließend von jeder Flasche eine Probe zwecks Bestimmung der DOC-Ausgangskonzentration entnehmen (vgl. Anlage 2.4). Öffnungen der Flaschen so abdecken, z.B. mit Aluminiumfolie, dass ein freier Luftaustausch zwischen der Flasche und der Umgebungsluft möglich bleibt. Danach die Flaschen in die Schüttelmaschine stellen und mit dem Versuch beginnen.
III.2.5 Anzahl der Flaschen in einem typischen Durchgang
Flaschen 1 und 2: Prüfsuspension
Flaschen 3 und 4: Inokulum-Blindwert
Flasche 5: Verfahrenskontrolle
Empfohlen und falls notwendig:
Flasche 6: abiotische Sterilkontrolle
Flasche 7: Adsorptionskontrolle
Flasche 8: Toxizitätskontrolle
Vgl. I.6.7.
III.2.6 Durchführung der Prüfung
Während des Versuchs sind die DOC-Konzentrationen in jeder Flasche in bestimmten Zeitabständen doppelt zu bestimmen, und zwar so häufig, dass der Beginn des 10-Tage-Fensters und die prozentuale Abnahme am Ende des 10-Tage-Fensters bestimmt werden können. Dabei ist pro Messung nur die Mindestmenge an Prüfsuspension zu entnehmen.
Vor der Probeentnahme sind die Verdampfungsverluste aus den Flaschen, falls erforderlich, durch Zufügen von Verdünnungswasser auszugleichen (I.6.1.). Der Versuchsansatz ist vor Entnahme einer Probe gründlich zu durchmischen, wobei sicherzustellen ist, dass an den Wänden der Flaschen anhaftendes Material vor der Probenahme gelöst oder suspendiert wird. Unmittelbar nach der Probenahme ist zu filtrieren (Membranfilter) oder zu zentrifugieren (vgl. Anlage 2.4). Die filtrierten oder zentrifugierten Proben sind noch am selben Tag zu analysieren; ansonsten können sie bei 2-4 °C für maximal 48 h bzw. bei unter - 18 °C über einen längeren Zeitraum aufbewahrt werden.
III.3 Daten und Abschlussbericht
III.3.1 Auswertung der Ergebnisse
Der prozentuale Abbau zum Zeitpunkt t ist entsprechend I.7.1 (DOC-Bestimmung) sowie wahlweise entsprechend I.7.2. (spezifische Analyse) zu berechnen.
Sämtliche Ergebnisse sind auf den dafür vorgesehenen Datenblättern zu protokollieren.
III.3.2 Gültigkeit der Ergebnisse
Vgl. I.5.2.
III.3.3 Prüfbericht
Vgl. I.8.
III.4 Datenblatt
Nachstehend ein Beispiel eines Datenblattes.
MODIFIZIERTER OECD-SCREENING-TEST
1. LABOR
2. DATUM BEI VERSUCHSBEGINN
3. PRÜFSUSBSTANZ
Name:
...
Konzentration der Stammlösung: ... mg/l auf Substanz bezogen
Anfangskonzentration im Medium, t0: ... mg/l auf Substanz bezogen
4. INOKULUM
Herkunft: ...
Vorgenommene Behandlung: ...
Vorbereitung/Konditionierung (soweit zutreffend): ...
Konzentration der suspendierten Feststoffe im Reaktionsgemisch: ... mg/l
5. KOHLENSTOFFBESTIMMUNGEN
Kohlenstoffanalysator: ...
| Flasche Nr. | DOC nach n Tagen (mg/l) | ||||||
| 0 | n1 | n2 | n3 | nx | |||
| Testsubstanz plus Inokulum | 1 | a1 | |||||
| a2 | |||||||
| a, Mittelwert Ca(t) | |||||||
| 2 | b1 | ||||||
| b2 | |||||||
| b, Mittelwert Cb(t) | |||||||
| Inokulum-Blindversuch ohne Testsubstanz | 3 | c1 | |||||
| c2 | |||||||
| c, Mittelwert Cc(t) | |||||||
| 4 | d1 | ||||||
| d2 | |||||||
| d, Mittelwert Cd(t) | |||||||
| Cbl(t) = (Cc(t)+ Cd(t)) / 2 | |||||||
6. AUSWERTUNG DER ROHDATEN
| Flasche Nr. | % Abbau nach n Tagen | |||||
| 0 | n1 | n2 | n3 | nx | ||
| 1 | 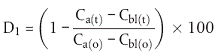 | 0 | ||||
| 2 | 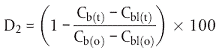 | 0 | ||||
| Mittel * | D = (D1- D2) / 2 | 0 | ||||
| *) Bei erheblichem Unterschied sollten D1 und D2 nicht gemittelt werden. | ||||||
Anmerkung: Für die Referenz und die Toxizitätskontrolle können ähnliche Formblätter verwendet werden.
7. ABIOTISCHE KONTROLLE (wahlweise)
| Zeit (Tage) | ||
| 0 | t | |
| DOC-Konzentration (mg/l) in Sterilkontrolle | Cs(o) | Cs(t) |
% abiotischer Abbau = [(Cs(o)- Cs(t)) / Cs(o)] x 100
8. SPEZIFISCHE ANALYSE (wahlweise)
| Bei Versuchsende verbliebene Menge an Prüfsubstanz (mg/l) | % Primärabbau | |
| Sterilkontrolle | Sb | |
| Beimpftes Prüfmedium | Sa | [(Sb- Sa) / Sb] x 100 |
Teil IV
CO2-Entwicklungstest (Methode C.4-C)
IV.1 Prinzip der Methode
Ein definiertes Volumen des angeimpften mineralischen Mediums mit einer bekannten Konzentration der Prüfsubstanz (10-20 mg/l DOC oder TOC) als einziger nomineller Quelle organischen Kohlenstoffs wird durch Einleiten von kohlendioxidfreier Luft bei gesteuerter Geschwindigkeit im Dunkeln oder bei diffusem Licht belüftet. Der Abbau wird über einen Zeitraum von 28 Tagen durch Bestimmung des erzeugten Kohlendioxids verfolgt, das in Bariumhydroxid oder Natronlauge gebunden und durch Titration des restlichen Hydroxids/der restlichen Lauge oder als anorganischer Kohlenstoff bestimmt wird. Die Menge des aus der Prüfsubstanz freigesetzten Kohlendioxids wird (nach Berücksichtigung der Menge aus dem Inokulum-Blindversuch) in % ThCO2 angegeben. Der Grad des biologischen Abbaus lässt sich auch aus der ergänzenden DOC-Analyse errechnen, die zu Beginn und am Ende der Inkubation vorgenommen wird.
IV.2 Beschreibung der Methode
IV.2.1 Geräte
IV.2.2 Ansatz des mineralischen Mediums
Zubereitung der Stammlösungen siehe I.6.2.
10 ml Lösung (a) mit 800 ml Verdünnungswasser mischen, 1 ml der Lösungen (b) bis (d) hinzugeben und mit Verdünnungswasser auf 1 l auffüllen.
IV.2.3 Ansatz und Vorbereitung des Inokulums
Das Inokulum kann aus verschiedenen Quellen gewonnen werden: aus Belebtschlamm, aus Kläranlagenablauf, aus Oberflächenwasser, aus Böden oder aus mehreren dieser Quellen zugleich.
Vgl. I.6.4, I.6.4.1, I.6.4.2 und I.6.5.
IV.2.4 Ansatz der Flaschen
Die folgenden Mengen- und Gewichtsangaben sind als Beispiel für 5-Liter-Flaschen mit 3 l Suspension zu verstehen. Werden Flaschen mit geringerem Volumen verwendet, sind die Angaben entsprechend zu ändern. Es muss allerdings sichergestellt sein, dass das gebildete Kohlendioxid exakt gemessen werden kann.
In jede 5-l-Flasche werden 2.400 ml mineralisches Medium gegeben. Dazu wird eine geeignete Menge des vorbereiteten Belebtschlamms hinzugefügt (vgl. I.6.4.1 und I.6.5), um schließlich in den 3 l beimpfter Mischung eine Konzentration an suspendierten Feststoffen von nicht mehr als 30 mg/l zu erhalten. Alternativ dazu kann der vorbereitete Belebtschlamm zunächst im mineralischen Medium verdünnt werden zu einer Suspension von 500-1.000 mg/l. Danach wird dem Inhalt der 5-l-Flasche eine aliquote Menge hinzugegeben, um so eine Konzentration von 30 mg/l zu erhalten. Dieses letztere Verfahren sichert eine höhere Präzision. Es kann auch Inokulum anderer Herkunft verwendet werden (vgl. I.6.4.2).
Diese angeimpften Mischungen sind über Nacht mit CO2-freier Luft zu belüften, um das System von Kohlendioxid zu reinigen.
Die Prüf- und die Referenzsubstanz sind getrennt als Stammlösungen bekannten Volumens in die Gefäße des Parallelansatzes zu geben, um so Substanzkonzentrationen von 10 bis 20 mg/l DOC oder TOC zu erhalten; einige Gefäße sind ohne Zugabe von Substanz als Inokulum-Kontrollen mitzuführen. Schwerlösliche Prüfsubstanzen sind auf Gewichts- oder Volumenbasis direkt in die Gefäße zu geben oder gemäß Anlage 3 zu behandeln.
Falls erforderlich, ist ein Gefäß zur Kontrolle der möglichen Hemmwirkung der Prüfsubstanz zu verwenden; dazu ist sowohl die Prüf- als auch die Referenzsubstanz in derselben Konzentration zuzugeben wie in den anderen Gefäßen.
Falls erforderlich, ist eine weitere, sterile Flasche anzusetzen, um zu prüfen, ob die Prüfsubstanz abiotisch abgebaut wird; dazu ist eine nicht angeimpfte Lösung dieser Substanz zu verwenden (vgl. I.6.6). Sterilisierung durch Zugabe einer toxischen Substanz in geeigneter Konzentration.
Die Suspensionen in allen Flaschen sind durch Zugabe des zuvor mit CO2-freier Luft belüfteten mineralischen Mediums aufzufüllen. Wahlweise können Proben zur DOC-Analyse (vgl. Anlage 2.4) und/oder zur spezifischen Analyse entnommen werden. Die Absorptionsflaschen sind mit den Gasauslässen der Flaschen zu verbinden.
Bei Verwendung von Bariumhydroxid sind an jede 5-l-Flasche drei Absorptionsflaschen, jeweils gefüllt mit 100 ml Bariumhydroxidlösung 0,0125 M, in Serie anzuschließen. Die Lösung muss frei von ausgefälltem Sulfat und Karbonat sein; die Konzentration der Lösung ist unmittelbar vor Gebrauch zu bestimmen. Bei Verwendung von Natronlauge sind zwei Absorptionsfallen anzuschließen, wobei die zweite als Kontrolle dafür dient, ob das gesamte Kohlendioxid in der ersten Falle absorbiert wurde. Geeignet sind hierfür Absorptionsflaschen, die mit Serumflaschenverschlüssen versehen sind. In jede Flasche sind 200 ml Natronlauge 0,05 M zu geben; diese Menge ist ausreichend, um das gesamte bei vollständigem Abbau der Prüfsubstanz entstehende Kohlendioxid zu absorbieren. Auch nach frischer Zubereitung enthält die Natronlauge Spuren von Karbonaten, die durch Subtraktion des im Blindwert enthaltenen Karbonats berücksichtigt werden.
IV.2.5 Anzahl der Flaschen in einem typischen Durchgang
Flaschen 1 und 2: Prüfsuspension
Flaschen 3 und 4: Inokulum-Blindwert
Flasche 5: Verfahrenskontrolle.
Empfohlen und falls notwendig:
Flasche 6: abiotische Sterilkontrolle
Flasche 7: Toxizitätskontrolle
Vgl. auch I.6.7.
IV.2.6 Durchführung der Prüfung
Bei Versuchsbeginn wird CO2-freie Luft (Geschwindigkeit: 30-100 ml/min) in die Gefäße mit den Suspensionen geleitet. Zur Bestimmung der CO2-Entwicklung sind regelmäßig Proben des Kohlendioxid-Absorbers zu entnehmen. Es wird empfohlen, diese Messungen in den ersten zehn Tagen alle zwei oder drei, danach bis zum 28. Tag alle fünf Tage vorzunehmen, um das 10-Tage-Fenster zu ermitteln.
Am 28. Tag werden Proben (wahlweise) zwecks DOC- und/oder spezifischer Analyse entnommen, der pH-Wert der Suspensionen gemessen und jeder Flasche 1 ml konzentrierte Salzsäure zugesetzt; die Flaschen sind über Nacht zu belüften, um das in den Prüfsuspensionen vorhandene Kohlendioxid auszutreiben. Am 29. Tag ist die letzte Bestimmung der Kohlendioxidentwicklung vorzunehmen.
An den Tagen, an denen CO2-Messungen vorgenommen werden, ist die dem Testgefäß am nächsten stehende Bariumhydroxid-Absorptionsflasche abzutrennen und die Hydroxidlösung mit HCl 0,05 M unter Verwendung von Phenolphthalein als Indikator zu titrieren. Die verbleibenden Absorptionsflaschen rücken jeweils um einen Platz auf, und eine neue Absorptionsflasche mit 100 ml frischem Bariumhydroxid 0,0125 M wird an das Ende der Serie hinzugefügt. Die Titrationen sind je nach Bedarf vorzunehmen, z.B. wenn in der ersten Falle deutliche Niederschläge auftreten, d. h., bevor ein Niederschlag in der zweiten Falle sichtbar wird, zumindest aber einmal pro Woche. Alternativ kann man - bei Verwendung von NaOH als Absorber - mit einer Spritze eine kleine Probe Natronlauge (je nach verwendetem Kohlenstoffanalysator) aus der dem Testgefäß am nächsten stehenden Absorptionsflasche entnehmen und diese zur Bestimmung der Kohlenstoffentwicklung direkt in den IC-Teil des Kohlenstoffanalysators einspritzen.
Der Inhalt der zweiten Absorptionsfalle ist nur am Versuchsende zu analysieren, um eine mögliche Kohlendioxidübertragung zu berücksichtigen.
IV.3 Daten und Abschlussbericht
IV.3.1 Auswertung der Ergebnisse
Die in einem Absorber gebundene Menge CO2 ergibt sich nach Titration:
mg CO2 = (100 x CB - 0,5 x V x CA) x 44
Hierin bedeuten:
V = zur Titration der 100 ml im Absorber verbrauchtes Volumen HCl (ml)
CB = Konzentration der Bariumhydroxidlösung (M)
CA = Konzentration der Salzsäurelösung (M)
Wenn CB 0,0125 M und CA 0,05 M sind, beträgt das zur Titration von 100 ml Bariumhydroxid verbrauchte Volumen 50 ml, während sich die Menge an CO2 wie folgt ergibt:
0,05/2 x 44 x ml titrierte HCl = 1,1 x ml HCl
Der Faktor zur Umrechnung des titrierten HO-Volumens in mg CO2 beträgt demnach 1,1.
Die Mengen des aus dem Inokulum allein und aus Inokulum plus Prüfsubstanz freigesetzten CO2 sind unter Verwendung der entsprechenden Titrationswerte zu berechnen; aus der Differenz ergibt sich die Menge des aus der Prüfsubstanz allein freigesetzten CO2.
Ergibt z.B. das Inokulum allein einen Titrationswert vom 48 ml, Inokulum plus Prüfsubstanz einen Wert von 45 ml, so betragen
CO2 aus dem Inokulum = 1,1 x (50-48) = 2,2 mg,
CO2 aus Inokulum plus Prüfsubstanz = 1,1 x (50-45) = 5,5 mg;
d. h., die Menge des aus der Prüfsubstanz allein freigesetzten CO2 liegt bei 3,3 mg.
Der prozentuale biologische Abbau berechnet sich wie folgt:
% Abbau = (mg freigesetztes CO2 x 100) / (ThCO2 x mg zugegebene Prüfsubstanz)
oder
% Abbau = (mg freigesetztes CO2 x 100) / (mg im Versuch zugegebener TOC x 3,67)
wobei 3,67 der Umrechnungsfaktor (44/12) von Kohlenstoff in Kohlendioxid ist.
Der prozentuale Abbau für jeden beliebigen Zeitabschnitt kann durch Addition der prozentualen ThCO2-Werte ermittelt werden, die für jeden einzelnen Tag bis zum Zeitpunkt der Messung berechnet worden sind.
Bei Verwendung von Adsorptionsgefäßen mit Natronlauge ist die freigesetzte Kohlendioxidmenge, angegeben als IC (mg), durch Multiplikation der IC-Konzentration im Absorber mit dem Volumen des verwendeten Absorbers zu berechnen.
Der prozentuale biologische Abbau berechnet sich wie folgt:
% ThCO2 = [(mg IC aus dem Prüfgefäß- mg IC des Blindwertes) / (mg als Prüfsubstanz hinzugefügter TOC)] x 100
Die DOC-Abnahme wird (wahlweise) entsprechend den Angaben unter Abschnitt I.7 berechnet. Die erhaltenen Werte werden zusammen mit allen anderen Ergebnissen auf den vorliegenden Datenblättern protokolliert.
IV.3.2 Validität der Ergebnisse
Der IC-Gehalt der Prüfsuspension im mineralischen Medium zu Versuchsbeginn darf nicht mehr als 5 % des TC-Werts betragen, und die gesamte CO2-Entwicklung des Inokulum-Blindwerts zu Versuchsende sollte normalerweise 40 mg/l Medium nicht überschreiten. Bei Werten über 70 mg CO2 pro Liter sollten die Daten und das Versuchsverfahren kritisch überprüft werden.
Vgl. auch I.5.2.
IV.3.3 Abschlussbericht
Vgl. I.8.
IV.4 Datenblatt
Nachstehend ein Beispiel eines Datenblattes.
KOHLENDIOXIDENTWICKLUNGSTEST
1. LABOR
2. DATUM BEI VERSUCHSBEGINN
3. PRÜFSUBSTANZ
Name: ...
Konzentration der Stammlösung: ... mg/l auf Substanz bezogen
Anfangskonzentration im Medium: ... mg/l auf Substanz bezogen
In die Flasche gegebene Gesamtmenge an C (TC): ... mg C
ThCO2: ... mg CO2
4. INOKULUM
Herkunft: ...
Vorgenommene Behandlung: ...
Vorbereitung/Konditionierung (soweit zutreffend): ...
Konzentration der suspendierten Feststoffe im Reaktionsgemisch: ... mg/l
5. KOHLENDIOXIDENTWICKLUNG UND ABBAUBARKEIT
Methode:
Ba(OH)2/NaOH/Sonstige ...
|
Zeit |
Freigesetztes CO2 |
Freigesetztes CO2 |
Freigesetztes CO2 (Test - Blindversuch) |
% ThCO2 kumulativ CO2/ThCO2 x 100 | |||||
|
1 / 2 | Mittelwert |
3 / 4 | Mittelwert | 1 | 2 | 1 | 2 | Mittelwert | |
| 0 | |||||||||
| n1 | |||||||||
| n2 | |||||||||
| n3 | |||||||||
| 28 | |||||||||
Anmerkung: Für die Referenzsubstanz sowie für die Toxizitätskontrolle können ähnliche Formblätter verwendet werden.
6. KOHLENSTOFFANALYSE (wahlweise)
Kohlenstoffanalysator: ...
| Zeit (Tag) | Blindversuch mg/l | Prüfsubstanz mg/l |
| 0 | Cb(o) | Co |
| 28 * | Cb(t) | Ct |
| *) oder am Ende der Inkubation. | ||
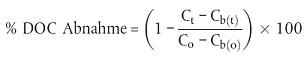
7. ABIOTISCHER ABBAU (wahlweise)
| CO2-Bildung Sterilkontrolle nach 28 Tagen (mg) | ||
| % abiotischer Abbau = |
| x 100 |
| ThCO2 (mg) |
 | weiter . |  |