 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. ▢ Regelwerk, EU 2010, Chemikalien - EU Bund |
Verordnung (EU) Nr. 1152/2010 der Kommission vom 8. Dezember 2010 zur Änderung - zwecks Anpassung an den technischen Fortschritt - der Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH)
(Text von Bedeutung für den EWR)
(ABl. Nr. L 324 vom 09.12.2010 S. 13)
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates vom 18. Dezember 2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH), zur Schaffung einer Europäischen Agentur für chemische Stoffe, zur Änderung der Richtlinie 1999/45/EG und zur Aufhebung der Verordnung (EWG) Nr. 793/93 des Rates, der Verordnung (EG) Nr. 1488/94 der Kommission, der Richtlinie 76/769/EWG des Rates sowie der Richtlinien 91/155/EWG, 93/67/EWG, 93/105/EG und 2000/21/EG der Kommission 1, insbesondere auf Artikel 13 Absatz 3,
in Erwägung nachstehender Gründe:
(1) In der Verordnung (EG) Nr. 440/2008 der Kommission 2 sind die Prüfmethoden zur Bestimmung der physikalisch-chemischen Eigenschaften, der Toxizität und der Ökotoxizität von Stoffen im Rahmen der Verordnung (EG) Nr. 1907/2006 festgelegt.
(2) Es ist angezeigt, die Verordnung (EG) Nr. 440/2008 zu aktualisieren, um vorrangig zwei kürzlich von der OECD angenommene neue Invitro-Prüfmethoden zur Identifizierung augenreizender Stoffe in die Verordnung aufzunehmen, damit die Zahl der für wissenschaftliche Zwecke verwendeten Tiere gemäß der Richtlinie 86/609/EWG des Rates vom 24. November 1986 zur Annäherung der Rechts- und Verwaltungsvorschriften der Mitgliedstaaten zum Schutz der für Versuche und andere wissenschaftliche Zwecke verwendeten Tiere 3 verringert werden kann. Interessenträger wurden zu diesem Entwurf konsultiert.
(3) Die Verordnung (EG) Nr. 440/2008 sollte daher entsprechend geändert werden.
(4) Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des mit Artikel 133 der Verordnung (EG) Nr. 1907/2006 eingesetzten Ausschusses -
- hat folgende Verordnung erlassen:
Teil B des Anhangs der Verordnung (EG) Nr. 440/2008 wird um die Kapitel B.47 und B.48 gemäß dem Anhang der vorliegenden Verordnung ergänzt.
Diese Verordnung tritt am dritten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
____
1) ABl. Nr. L 396 vom 30.12.2006 S. 1.
2) ABl. Nr. L 142 vom 31.05.2008 S. 1.
3) ABl. Nr. L 358 vom 18.12.1986 S. 1.
| Anhang |
"B. 47 Trübungs- und Durchlässigkeitstest an der isolierten Rinderhornhaut zwecks Identifizierung von Stoffen mit augenverätzender und stark augenreizender Wirkung
Einleitung
1. Der Trübungs- und Durchlässigkeitstest an der isolierten Rinderhornhaut (Bovine Corneal Opacity and Permeability, BCOP) ist eine Invitro-Prüfmethode, die unter bestimmten Bedingungen und mit bestimmten Grenzen eingesetzt werden kann, um Stoffe und Gemische als Stoffe und Gemische mit "augenverätzender und stark augenreizender Wirkung" (1) (2) (3) einzustufen. Für die Zwecke dieser Prüfmethode sind Stoffe mit starker Reizwirkung Stoffe, welche Augenläsionen verursachen, die beim Kaninchen nach der Applikation mindestens 21 Tage lang anhalten. Auch wenn der Test den Invivo-Kaninchenaugentest nicht absolut ersetzen kann, wird der BCOP innerhalb eines spezifischen Anwendungsbereichs dennoch als Teil einer gestuften Prüfstrategie zur vorschriftsmäßigen Einstufung und Kennzeichnung empfohlen (4) (5). Prüfsubstanzen und -gemische (6) können als augenverätzend oder stark augenreizend eingestuft werden, ohne dass weitere Tests am lebenden Kaninchen erforderlich sind. Eine Prüfsubstanz mit negativem Testergebnis müsste allerdings nach einer sequenziellen Prüfstrategie, wie in der OECD-Testrichtlinie 405 (7) (Kapitel B. 5 dieses Anhangs) dargelegt, am Kaninchen getestet werden.
2. Diese Prüfmethode beschreibt die Verfahrensschritte für die Beurteilung des augenverätzenden oder stark augenreizenden Potenzials einer Prüfsubstanz, gemessen als seine Fähigkeit, bei isolierten Rinderhornhäuten Trübungs- und verstärkte Durchlässigkeitseffekte hervorzurufen. Toxische Effekte für die Hornhaut sind messbar durch i) verminderte Lichtübertragung (Trübung) und ii) den verstärkten Durchtritt von Fluorescein-Natrium-Farbstoff (Durchlässigkeit). Die Trübungs- und Durchlässigkeitsbewertungen der Hornhaut nach Applikation einer Prüfsubstanz ergeben in Kombination einen In-Vitro-Reizwert (In Vitro Irritancy Score, IVIS), der für die Einstufung des Reizpotenzials der Prüfsubstanz maßgeblich ist.
3. Augenreizende Stoffe, die Läsionen hervorrufen, die in weniger als 21 Tagen abklingen, sowie Stoffe ohne Reizwirkung wurden ebenfalls nach der BCOP-Methode untersucht. Die Genauigkeit und Zuverlässigkeit des BCOP bei Stoffen dieser Kategorien wurden jedoch nicht offiziell evaluiert.
4. Für Definitionen siehe Anlage 1.
Vorbemerkungen und Einsatzgrenzen
5. Diese Prüfmethode basiert auf dem BCOP-Testprotokoll des Organisationsübergreifenden Koordinationsausschusses zur Validierung alternativer Methoden (Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) (8), das im Anschluss an eine internationale Validierungsstudie (4)(5)(9) und unter Mitwirkung des Europäischen Zentrums zur Validierung alternativer Methoden (European Centre for the Validation of Alternative Methods, (ECVAM) und des Japanischen Zentrums zur Validierung alternativer Methoden (Japanese center for the Validation of Alternative Methods, JaCVAM) entwickelt wurde. Das Protokoll beruht auf Informationen des Instituts für Invitro- Forschung (Institute for In Vitro Sciences, IIVS) und auf dem INVITTOX-Protokoll 124 (10), das für die von der Europäischen Gemeinschaft finanzierte BCOP-Prävalidierungsstudie aus den Jahren 1997-1998 herangezogen wurde. Beide Protokolle beruhen auf der BCOP-Prüfmethodik, wie sie von Gautheron et al. (11) erstmals beschrieben wurde.
6. Die anerkannten Einsatzgrenzen dieser Prüfmethode beruhen auf den aus den Validierungsdaten hervorgehenden hohen Falsch-Positiv-Raten für Alkohole und Ketone und der hohen Falsch-Negativ-Rate für Feststoffe (siehe Punkt 44) (5). Durch Ausschluss von Stoffen dieser chemischen und physikalischen Klassen aus der Datenbank lässt sich die Genauigkeit des BCOP in allen Klassifizierungssystemen (EU, EPA und GHS) erheblich verbessern (5). Für die Zwecke dieser Prüfung (d. h. ausschließliche Identifizierung augenverätzender/stark augenreizender Stoffe) sind Falsch-Negativ- Raten nicht maßgeblich, da diese Stoffe anschließend an Kaninchen oder - je nach Vorschriften - im Rahmen anderer angemessen validierter Invitro-Tests nach einer sequenziellen Prüfstrategie mit einem evidenzbasierten Bewertungsansatz (weight of evidence approach) getestet werden. Außerdem konnten bestimmte Chemikalien- oder Produktklassen (z.B. Gemische) mit den derzeitigen Validierungsdaten nicht angemessen evaluiert werden. Prüfer könnten diese Prüfmethode jedoch für alle Arten von Prüfmaterial (auch Gemische) einsetzen und ein Positivergebnis als Indikator einer augenverätzenden oder stark augenreizenden Wirkung akzeptieren. Positivergebnisse bei Verwendung von Alkohol oder Ketonen sollten angesichts des Risikos von Falsch-Positiv-Prognosen (overprediction) jedoch mit einer gewissen Zurückhaltung interpretiert werden.
7. Bei allen Verfahren, die Rinderaugen und Rinderhornhäute involvieren, sollten die geltenden Regeln und Verfahrensvorschriften der Prüfanstalt für den Umgang mit Tiermaterial eingehalten werden, das auch Gewebe und Gewebeflüssigkeiten umfasst, jedoch nicht darauf beschränkt ist. Universelle Laborregeln sollten beachtet werden (12).
8. Eine Grenze der Prüfmethode liegt darin, dass, obgleich zwar einige der im Kaninchenaugentest evaluierten Reizwirkungen und bis zu einem gewissen Grad auch deren Schwere berücksichtigt werden, Bindehaut- und Irisverletzungen außer Acht gelassen werden. Auch wurde - obwohl sich die Reversibilität von Hornhautläsionen per se mit dem BCOP nicht beurteilen lässt -auf der Grundlage von Kaninchenaugenstudien dennoch vorgeschlagen, eine Bewertung der anfänglichen Tiefe der Hornhautverletzung heranzuziehen, um zwischen irreversiblen und reversiblen Wirkungen zu unterscheiden (13). Schließlich sei auch zu erwähnen, dass eine potenziell mit der Augenexposition einhergehende systemische Toxizität nach der BCOP-Methode nicht bewertet werden kann.
9. Es laufen Arbeiten, um Eignung und Grenzen des BCOP zur Identifizierung von Stoffen mit schwacher Reizwirkung oder von Stoffen ohne Reizwirkung genauer zu charakterisieren (siehe auch Punkt 45). Ferner wird empfohlen, dass Anwender den Validierungsorganisationen Exemplare und/oder Daten zur formellen Evaluierung etwaiger künftiger Anwendungsbereiche des BCOP übermitteln, auch um Stoffe mit schwacher Reizwirkung oder Stoffe ohne Reizwirkung identifizieren zu können.
10. Laboratorien, die diese Prüfmethode zum ersten Mal anwenden, sollten die in Anlage 2 genannten Leistungschemikalien verwenden. Laboratorien können diese Chemikalien verwenden, um ihre technische Kompetenz zur Durchführung des BCOP zu demonstrieren, bevor sie BCOP-Testdaten zum Zwecke der vorgeschriebenen Gefahrenklassifizierung einreichen.
Testprinzip
11. Die BCOP-Prüfmethode ist ein organtypisches Modell, das die kurzfristige Aufrechterhaltung der normalen physiologischen und biochemikalischen Funktionen von Rinderhornhäuten in vitro gewährleistet. Bei dieser Methode werden durch die Prüfsubstanz hervorgerufene Schäden bewertet, indem Veränderungen von Trübung und Durchlässigkeit der Hornhaut mithilfe eines Opazimeters bzw. eines VIS-Spektrofotometers quantitativ gemessen werden. Die beiden Messwerte dienen der Berechnung eines Invitro-Reizwertes (IVIS), der seinerseits herangezogen wird, um zwecks Prädiktion des Augenreizpotenzials einer Prüfsubstanz am lebenden Objekt (in vivo) eine Zuordnung zu einer Gefahrenkategorie aufgrund des Invitro-Reizungspotenzials des Stoffes vorzunehmen (siehe Entscheidungskriterien).
12. Für die BCOP-Prüfmethode werden isolierte Hornhäute der Augen frisch geschlachteter Rinder verwendet. Die Hornhauttrübung wird quantitativ bestimmt als Menge der die Hornhaut durchdringenden Lichtstrahlung. Die Durchlässigkeit der Hornhaut wird quantitativ bestimmt als die Menge an Natrium-Fluorescein, die die gesamte Dicke der Hornhaut durchdringt und im Medium in der Hinterkammer nachgewiesen wird. Die Applikation der Prüfsubstanzen auf die Epitheloberfläche der Hornhaut erfolgt durch Zugabe der Stoffe in die Vorderkammer des Hornhauthalters. Anlage 3 enthält eine Beschreibung sowie ein Schaubild einer Halterung, wie sie für den BCOP verwendet wird. Hornhauthalter sind im Handel erhältlich oder können als Bausatz bezogen werden.
Bezugsquelle und Alter der Rinderaugen und Auswahl der Tiere
13. Schlachtrinder werden in der Regel für den menschlichen Verzehr oder für andere gewerbliche Zwecke getötet. Nur gesunde und für die menschliche Nahrungskette geeignet befundene Tiere kommen als Bezugsquelle für Augenhornhäute für den BCOP-Test in Frage. Da Rinder je nach Rasse, Alter und Geschlecht eine große Gewichtsspanne aufweisen, gibt es keine Gewichtsempfehlung für die Tiere zum Zeitpunkt der Schlachtung.
14. Augenhornhäute von Tieren verschiedener Altersklassen sind mitunter unterschiedlich groß. Hornhäute mit einem horizontalen Durchmesser von > 30,5 mm und einer zentralen Hornhautdicke (CCT) von > 1 100 pm stammen in der Regel von über acht Jahre alten Rindern, während Hornhäute mit einem horizontalen Durchmesser von < 28,5 mm und einer zentralen Hornhautdicke von < 900 pm im Allgemeinen von weniger als fünf Jahre alten Tieren stammen (14). Deshalb werden Augen von über 60 Monate alten Tieren in der Regel nicht verwendet. Traditionsgemäß werden keine Augen von weniger als 12 Monate alten Rindern verwendet, da die Augen dieser Tiere noch nicht ausgewachsen sind und Hornhautdicke sowie Hornhautdurchmesser wesentlich kleiner sind als bei ausgewachsenen Rindern. Hornhäute von Jungtieren (d. h. Tiere im Alter von sechs bis 12 Monaten) sind aufgrund ihrer Vorteile jedoch zulässig: Sie sind beispielsweise leichter erhältlich, die Altersspanne ist geringer und das Laborpersonal ist in geringerem Maße BSE-gefährdet (15). Da eine weitere Evaluierung des Einflusses von Hornhautgröße oder Hornhautdicke auf die Wirkung verätzender oder reizender Stoffe nützlich wäre, sollten Anwender das geschätzte Alter und/oder das Gewicht der Tiere, von denen die für eine Studie verwendeten Hornhäute stammen, mitteilen.
Gewinnung und Beförderung der Augen zum Labor
15. Die Rinderaugen werden im Schlachthof gewonnen. Um jede mechanische und sonstige Schädigung der Augen auf ein Minimum zu beschränken, sollten die Augen nach der Tötung des Tieres so bald wie möglich ausgeschält werden. Damit die Augen nicht mit potenziellen Reizstoffen in Berührung kommen, sollte das Schlachthofpersonal zum Abspülen des Schädels keine Detergenzien verwenden.
16. Die Augen sollten in einem angemessen großen Behältnis vollständig in HBSS eingelegt und so zum Labor befördert werden, dass sich ihr Zustand möglichst nicht verschlechtert und/oder es möglichst nicht zu einer bakteriellen Kontamination kommt. Da die Augen während des Schlachtprozesses gewonnen werden, könnten sie mit Blut und anderen biologischen Stoffen wie Bakterien und sonstigen Mikroorganismen in Berührung kommen. Deshalb muss unbedingt sichergestellt werden, dass das Kontaminationsrisiko auf ein Mindestmaß begrenzt wird (z.B. indem das für die Beförderung der Augen verwendete Behältnis auf Nasseis gelagert und die zur Lagerung der Augen während der Beförderung verwendete HBSS-Lösung mit Antibiotika (z.B. 100 IU/mL Penizillin und 100 pg/mL Streptomycin) angereichert wird).
17. Der Zeitabstand zwischen der Gewinnung der Augen und der Verwendung der Hornhäute im BCOP sollte möglichst gering sein (im Idealfall sollten die Hornhäute am selben Tag gewonnen und verwendet werden) und die Testergebnisse nachweislich nicht kompromittieren. Letztere basieren auf den Auswahlkriterien für die Augen sowie auf den Reaktionen der Positiv- und Negativkontrollen. Alle für die Prüfung verwendeten Augen sollten aus einer an ein und demselben Tag gewonnenen Partie Augen stammen.
Auswahlkriterien für Augen, die im BCOP-Test eingesetzt werden
18. Unmittelbar nach ihrer Ankunft im Labor werden die Augen sorgfältig auf Mängel wie unter anderem verstärkte Trübung, Kratzer und Neovaskularisation untersucht. Nur Hornhäute von Augen, die keine derartigen Mängel aufweisen, dürfen verwendet werden.
19. Die Qualität jeder Hornhaut wird auch in späteren Testphasen geprüft. Hornhäute, die nach einer ersten einstündigen Äquilibrierung mehr als sieben Trübungseinheiten aufweisen (Anmerkung: der Opazimeter sollte nach den Trübungsnormen kalibriert werden, die auch zur Festlegung der Trübungseinheiten verwendet werden; siehe Anlage 3), sind zu verwerfen.
20. Jede Behandlungsgruppe (Prüfsubstanz sowie konkurrierende Negativ- und Positivkontrollen) umfasst mindestens drei Augen. Für die Negativkontrollen des BCOP sollten drei Hornhäute verwendet werden. Da die Hornhäute operativ vom Augapfel entfernt und in die Hornhautkammern eingespannt werden, kann es infolge dieser Handgriffe bei einzelnen Hornhäuten zu veränderten Trübungs- und Durchlässigkeitswerten kommen (auch bei der Negativkontrolle). Außerdem werden die Trübungs- und Durchlässigkeitswerte von Hornhäuten der Negativkontrolle dazu verwendet, die Trübungs- und Durchlässigkeitswerte des Prüfobjekts und der Positivkontrolle bei den IVIS-Berechnungen zu korrigieren.
Verfahren
Vorbereitung der Augen
21. Unbeschädigte Hornhäute werden seziert, wobei ein 2 bis 3 mm breiter Sklera-Rand belassen wird, um das anschließende Manipulieren zu erleichtern; dabei ist darauf zu achten, dass die Epithel- und Endothelzellschicht der Hornhaut nicht beschädigt wird. Die isolierten Hornhäute werden in speziell entwickelte Hornhauthalter eingespannt, die aus Vorder- und Hinterkammern bestehen, welche die Schnittstellen zur Epithel- bzw. Endothelseite der Hornhäute bilden. Beide Kammern (Hinterkammer zuerst) werden bis zum Überlaufen mit vorgewärmtem EMEM-Medium gefüllt, wobei sicherzustellen ist, dass sich keine Luftblasen bilden. Das Gerät wird sodann bei 32 ± 1 °C für mindestens eine Stunde äquilibriert, um die Hornhäute mit dem Medium zu äquilibrieren und so weit wie möglich eine normale Stoffwechseltätigkeit zu gewährleisten (die ungefähre Temperatur der Hornhautoberfläche beträgt in vivo 32 °C).
22. Nach der Äquilibrierung wird frisches vorgewärmtes EMEM-Medium in beide Kammern gegeben, und für jede Hornhaut werden Referenztrübungswerte abgelesen. Hornhäute, die makroskopische Gewebeschäden (z.B. Kratzer, Pigmentierung, Neovaskularisation) oder über sieben Trübungseinheiten aufweisen, werden verworfen. Sodann wird die Durchschnittstrübung aller äquilibrierten Hornhäute berechnet. Mindestens drei Hornhäute mit Trübungswerten nahe am Mittelwert sämtlicher Hornhäute werden für die Negativ-(oder Lösungsmittel-)Kontrolle ausgewählt. Die restlichen Hornhäute werden in Behandlungs- und Positivkontrollgruppen aufgeteilt.
23. Da die Wärmekapazität von Wasser höher ist als die Wärmekapazität von Luft, bietet Wasser stabilere Temperaturbedingungen für die Inkubation. Deshalb wird ein Wasserbad empfohlen, um Hornhauthalter samt Inhalt auf einer Temperatur von 32 ± 1 °C zu halten. Es können jedoch auch Luftinkubatoren verwendet werden, sofern alle erforderlichen Vorkehrungen getroffen wurden, um die Temperatur stabil zu halten (z.B. durch Vorwärmen der Halterungen und Medien).
Applikation der Prüfsubstanz
24. Es werden zwei unterschiedliche Behandlungsprotokolle verwendet - eines für Flüssigkeiten und Tenside (Feststoffe oder Flüssigkeiten) und eines für nichttensidische Feststoffe.
25. Flüssigkeiten werden unverdünnt, Tenside in einer Konzentration von 10 % w/v in 0,9 % Natriumchloridlösung, destilliertem Wasser oder einem anderen Lösungsmittel, welches das Testsystem nachweislich nicht beeinträchtigt, getestet. Halbfeste Stoffe, Cremes und Wachse werden in der Regel wie Flüssigkeiten getestet. Sofern alternative Lösungskonzentrationen verwendet werden, ist dies angemessen zu begründen. Die Hornhäute werden den Flüssigkeiten und Tensiden für die Dauer von zehn Minuten ausgesetzt. Bei anderen Expositionszeiten sollten diese wissenschaftlich begründet werden.
26. Nichttensidische Feststoffe werden in der Regel wie Lösungen oder Suspensionen in einer Konzentration von 20 % in 0,9 % Natriumchloridlösung, destilliertem Wasser oder einem anderem Lösungsmittel, welches das Testsystem nachweislich nicht beeinträchtigt, getestet. Unter bestimmten Bedingungen und sofern wissenschaftlich begründet, können Feststoffe auch unverdünnt durch direkte Applikation auf die Hornhautoberfläche getestet werden, wobei die offene Methode (open chamber method, siehe Punkt 29) angewandt wird. Die Hornhäute werden den Feststoffen für die Dauer von vier Stunden ausgesetzt; soweit wissenschaftlich fundiert können jedoch auch, wie bei Flüssigkeiten und Tensiden, alternative Expositionszeiten verwendet werden.
27. Je nach den physikalischen und chemischen Eigenschaften der Prüfsubstanz (z.B. fest, flüssig, zähflüssig oder nicht zähflüssig) können unterschiedliche Behandlungsmethoden angewandt werden. Der kritische Faktor besteht darin sicherzustellen, dass die Prüfsubstanz die Epitheloberfläche angemessen bedeckt und während der Spülungen sachgemäß entfernt wird. Die geschlossene Methode (closed chamber method) wird in der Regel für nicht zähflüssige bis leicht zähflüssige Prüfsubstanzen eingesetzt, während die offene Methode eher für halbzähflüssige und zähflüssige Prüfsubstanzen sowie für unverdünnte Feststoffe verwendet wird.
28. Bei der geschlossenen Methode wird über die Dosieröffnungen auf der Oberseite der Kammer so viel Prüfsubstanz (750 µL) in die Vorderkammer gegeben, dass die Epithelseite der Hornhaut bedeckt ist; die Öffnungen werden anschließend für die gesamte Expositionsdauer mit den Kammerverschlüssen abgedichtet. Es muss unbedingt sichergestellt werden, dass alle Hornhäute der Prüfsubstanz für eine angemessene Dauer ausgesetzt werden.
29. Bei der offenen Methode werden vor der Behandlung Scheibenverschlussring und Glasscheibe von der Vorderkammer entfernt. Die Kontroll- oder die Prüfsubstanz (750 µL bzw. genügend Prüfsubstanz, um die Hornhaut komplett zu bedecken) wird mit einer Mikropipette direkt auf die Epitheloberfläche der Hornhaut appliziert. Erweist sich das Pipettieren einer Prüfsubstanz als schwierig, so kann dieser zur leichteren Dosierung mittels Druckausgleich in eine Direktverdrängungspipette geladen werden. Die Spitze der Direktverdrängungspipette wird in die Dosierspitze der Spritze eingeführt, damit das Material unter Druck in die Spitze der Verdrängungspipette geladen werden kann. Lässt man den Bedienknopf langsam zurückgleiten, fährt der Kolben der Pipette nach oben. Treten in der Pipettenspitze Luftbläschen auf, wird das Prüfobjekt verworfen (ausgestoßen) und der Prozess wird so lange wiederholt, bis die Spitze ohne Luftblasen gefüllt ist. Erforderlichenfalls kann eine normale Spritze (ohne Nadel) verwendet werden, denn sie gestattet das Abmessen einer akkuraten Menge Prüfsubstanz und erleichtert die Applikation auf die Epitheloberfläche der Hornhaut. Nach der Dosierung wird die Glasscheibe wieder auf die Vorderkammer gesetzt, um das System wieder zu schließen.
Inkubation nach der Exposition
30. Nach Ablauf der Expositionszeit werden Prüfsubstanz, Negativkontrolle oder Positivkontrolle aus der Vorderkammer entfernt, und das Epithel wird mindestens drei Mal (oder bis keine Prüfsubstanz mehr sichtbar ist) mit (phenolrothaltigem) EMEM-Medium gewaschen. Phenolrot wird zum Abspülen verwendet, da sich aufgrund der Farbveränderung bei Phenolrot die Wirksamkeit des Abspülens säurehaltiger oder alkalischer Materialien bestimmen lässt. Die Hornhäute werden mindestens drei Mal gewaschen, wenn die Farbveränderung (ins Gelbe oder Lila) anhält oder wenn die Prüfsubstanz nach wie vor sichtbar ist. Sobald das Medium frei von Prüfsubstanz ist, werden die Hornhäute ein letztes Mal mit EMEM-Medium (ohne Phenolrot) abgespült. EMEM-Medium (ohne Zusatz von Phenolrot) wird als letzte Spülung verwendet, um sicherzustellen, dass der Phenolrot-Farbstoff vor der Trübungsmessung aus der Vorderkammer entfernt wurde. Die Vorderkammer wird sodann wieder mit nicht phenolrothaltigem frischem EMEM- Medium aufgefüllt.
31. Bei Flüssigkeiten oder Tensiden werden die Hornhäute nach dem Abspülen für weitere zwei Stunden bei 32 ± 1 °C inkubiert. Unter bestimmten Umständen könnte sich nach der Exposition eine längere Inkubationszeit als zweckdienlich erweisen; dies sollte auf Fallbasis geprüft werden. Mit Feststoffen behandelte Hornhäute werden nach Ablauf der vierstündigen Exposition gründlich abgespült; eine längere Inkubation ist nicht erforderlich.
32. Nach Ablauf der auf die Exposition folgenden Inkubation (Flüssigkeiten und Tenside) bzw. nach Ablauf der vierstündigen Exposition (nichttensidische Feststoffe) werden Trübung und Durchlässigkeit der einzelnen Hornhäute aufgezeichnet. Außerdem wird jede Hornhaut visuell geprüft, und relevante Befunde (z.B. Gewebeabschälung, Reste von Prüfsubstanz, uneinheitliche Trübungsmuster) werden aufgezeichnet. Diese Daten könnten insofern wichtig sein, als sie Abweichungen der Opazimeter-Messwerte bestätigen könnten.
Kontrollstoffe
33. Jeder Versuch beinhaltet konkurrierende Negativ- oder Lösungsmittel-/Vehikelkontrollen und Positivkontrollen.
34. Für Tests von Flüssigstoffen zu 100 % sieht der BCOP eine konkurrierende Negativkontrolle (z.B. 0,9 % Natriumchloridlösung oder destilliertes Wasser) vor, damit unspezifische Veränderungen im Testsystem festgestellt werden können und ein Referenzwert für die Test-Endpunkte ermittelt werden kann: Auf diese Weise wird auch sichergestellt, dass die Testbedingungen nicht zu einer unerwünschten Reizwirkung führen.
35. Für Tests von verdünnten Flüssigkeiten, Tensiden oder Feststoffen sieht der BCOP eine Gruppe konkurrierender Lösungsmittel-/Vehikelkontrollen vor, damit unspezifische Veränderungen im Testsystem festgestellt werden können und ein Referenzwert für die Test-Endpunkte ermittelt werden kann. Es sind nur Lösungsmittel/Vehikel zulässig, die das Testsystem nachweislich nicht beeinträchtigen.
36. Jeder Versuch beinhaltet als konkurrierende Positivkontrolle einen bekannten Augenreizstoff, um überprüfen zu können, dass eine adäquate Wirkung eintritt. Da bei dieser Prüfmethode der BCOP zur Identifizierung augenverätzender oder stark augenreizender Stoffe angewandt wird, sollte es sich bei der Positivkontrolle idealerweise um eine Referenzsubstanz handeln, der bei dieser Prüfmethode eine starke Wirkung hervorruft. Um sicherzustellen, dass im Zeitverlauf auftretende Wirkungsschwankungen bei der Positivkontrolle bewertet werden können, sollte die Reaktion jedoch nicht zu heftig sein.
37. Beispiele für Positivkontrollen für flüssige Prüfsubstanzen sind Dimethylformamid oder 1 %iges Natriumhydroxid. Für feste Prüfsubstanzen käme 20 %iges (Gewichtsprozent) Imidazol in 0,9 % Natriumchloridlösung als Positivkontrolle in Frage.
38. Referenzsubstanzen sind nützlich für die Bewertung des Augenreizpotenzials unbekannter Chemikalien einer spezifischen Chemikalien- oder Produktklasse oder die Bewertung des relativen Reizpotenzials eines Augenreizstoffes innerhalb einer spezifischen Spanne von Reizwirkungen.
Gemessene Endpunkte
39. Die Trübung wird durch Messung der durch die Hornhaut durchgehenden Lichtstrahlung bestimmt. Die quantitative Messung der Hornhauttrübung erfolgt mithilfe eines Opazimeters, eines Messgeräts, bei dem die Trübungswerte kontinuierlich gemessen werden.
40. Die Durchlässigkeit wird durch Messung der Menge Fluorescein-Natrium bestimmt, die alle Zellschichten der Hornhaut (d. h. von der Epithelzellschicht auf der äußeren Hornhautoberfläche bis zur Endothelzellschicht auf der inneren Hornhautfläche) passiert. Die Vorderkammer des Hornhauthalters, die die Verbindung zur Epithelseite der Hornhaut bildet, wird mit 1 mL Fluorescein-Natrium-Lösung (4 oder 5 mg/mL bei Flüssigkeiten und Tensiden bzw. nichttensidischen Feststoffen) aufgefüllt, während die Hinterkammer, die die Verbindung zur Endothelseite der Hornhaut bildet, mit frischem EMEM-Medium gefüllt wird. Die Halterung wird sodann in horizontaler Position für 90 ± 5 Minuten bei 32 ± 1 °C inkubiert. Die Menge an Fluorescein-Natrium, die in die Hinterkammer eindringt, wird mithilfe eines UV/VIS-Spektrofotometers gemessen. Bei 490 nm ausgewertete spektrofotometrische Messungen werden als Werte für optische Dichte (OD 490 ) oder Absorbanzwerte aufgezeichnet, die kontinuierlich gemessen werden. Zur Bestimmung der Fluorescein-Durchlässigkeit werden OD 490 -Werte herangezogen, die mithilfe eines VIS-Spektrofotometers bei einer Standardpfadlänge von 1 cm ermittelt wurden.
41. Alternativ kann ein Plattenleser für 96-Mulden-Mikrotiterplatten verwendet werden, sofern i) der lineare Messbereich des Plattenlesers für die Bestimmung der Fluorescein-OD 490 -Werte festgelegt werden kann und ii) in der 96-Mulden- Mikrotiterplatte Fluorescein-Proben in der richtigen Menge verwendet werden, um OD 490 -Werte zu ergeben, die der Standardpfadlänge von 1 cm entsprechen (dies könnte vollständig gefüllte Mulden [in der Regel 360VL] erfordern).
Daten und Berichterstattung
Datenauswertung
42. Sobald die Trübungs- und die durchschnittlichen Durchlässigkeits-(OD490-)Werte um die Hintergrundtrübungswerte und die OD490-Durchlässigkeitswerte der Negativkontrolle korrigiert wurden, werden die durchschnittlichen Trübungs- und OD490-Durchlässigkeitswerte für jede Behandlungsgruppe in einer empirisch abgeleiteten Formel kombiniert, um für jede Behandlungsgruppe einen Invitro-Reizwert (IVIS) zu berechnen:
IVIS = durchschnittl. Trübungswert + (15 x durchschnittl. OD490-Durchlässigkeitswert)
Nach Sina et al. (16) wurde diese Formel aus Labor- und Interlaborstudien abgeleitet. Die für eine Serie von 36 Verbindungen in einer Multilaborstudie generierten Daten wurden einer multivariaten Analyse unterzogen, um die Bestfit-Gleichung zwischen Invivo- und Invitro-Daten zu ermitteln. Diese Analyse wurde von Wissenschaftlern zweier separater Unternehmen durchgeführt, die zu quasi identischen Gleichungsergebnissen gelangten.
43. Die Trübungs- und Durchlässigkeitswerte sollten auch unabhängig voneinander bestimmt werden, um feststellen zu können, ob eine Prüfsubstanz für nur einen der beiden Endpunkte (siehe Entscheidungskriterien) eine augenverätzende oder stark augenreizende Wirkung verursachte.
Entscheidungskriterien
44. Ein Stoff, der einen IVIS-Wert > 5 5,1 bewirkt, gilt als Stoff mit verätzender oder stark reizender Wirkung. Wie bereits unter Punkt 1 erwähnt, sollten, wenn die Prüfsubstanz nicht als Stoff mit augenverätzender oder stark augenreizender Wirkung identifiziert wird, für Klassifizierungs- und Kennzeichnungszwecke zusätzliche Testungen vorgenommen werden. Gemessen an Daten aus Invivo-Kaninchenaugentests, die nach den EPA (1)-, EU (2)- oder GHS (3)-Klassifizierungssystemen klassifiziert wurden, zeichnet sich der BCOP durch eine allgemeine Genauigkeit von 79 % (113/143) bis 81 % (119/147), eine Falsch-Positiv-Rate von 19 % (20/103) bis 21 % (22/103) und eine Falsch- Negativ-Rate von 16 % (7/43) bis 25 % (10/40) aus. Werden Stoffe bestimmter Chemikalienklassen (d. h. Alkohole, Ketone) oder bestimmter physikalischer Klassen (d. h. Feststoffe) aus der Datenbank ausgeschlossen, so liegen die Genauigkeit des BCOP gemessen an den EU-, EPA- und GHS-Klassifizierungssystemen zwischen 87 % (72/83) und 92 % (78/85), die Falsch-Positiv-Raten zwischen 12 % (7/58) und 16 % (9/56) und die Falsch-Negativ-Raten zwischen 0 % (0/27) und 12 % (3/26).
45. Selbst wenn die augenverätzende oder stark augenreizende Wirkung einer Prüfsubstanz nicht klassifiziert werden kann, können Daten aus dem BCOP in Kombination mit Testdaten aus dem Invivo-Kaninchenaugentest oder aus einem angemessen validierten Invitro-Test zweckdienlich sein, um Eignung und Einsatzgrenzen des BCOP zur Identifizierung von schwach reizenden Stoffen und von Stoffen ohne Reizwirkung genauer zu prüfen (ein Leitfaden für die Anwendung von Invitro-Prüfmethoden zur Untersuchung auf okulare Toxizität wird zur Zeit erarbeitet).
Studienakzeptanzkriterien
46. Ein Test gilt als akzeptabel, wenn die Positivkontrolle einen IVIS-Wert innerhalb von zwei Standardabweichungen des geltenden historischen Mittelwertes ergibt, der mindestens alle drei Monate bzw. immer dann aktualisiert werden muss, wenn Laboratorien, die nur selten Testungen vornehmen (d. h. weniger als einmal im Monat), einen akzeptablen Test durchführen. Die Negativ- oder Lösungsmittel-/Vehikelkontrollen sollten Trübungs- und Durchlässigkeitswerte ergeben, die geringer sind als die Obergrenzen, die für Hintergrundtrübungs- und Durchlässigkeitswerte für Rinderhornhäute vorgegeben sind, welche mit der jeweiligen Negativ- bzw. Lösungsmittel-/Vehikelkontrolle behandelt wurden.
Testbericht
47. Der Testbericht sollte die folgenden Informationen umfassen, soweit sie für die Studie relevant sind:
Prüfsubstanzen und Kontrollsubstanzen
chemische Bezeichnung(en) wie der vom Chemical Abstracts Service (CAS) benutzte strukturelle Name, gefolgt von anderen Bezeichnungen, soweit bekannt;
die CAS-Registrierungsnummer (CAS-Nr.), soweit bekannt;
Reinheit und Zusammensetzung des Stoffes oder des Gemisches (in Gewichtsprozent(en)), soweit diesbezügliche Informationen vorliegen;
physikochemikalische Eigenschaften wie physikalischer Zustand, Flüchtigkeit, pH-Wert, Stabilität, Chemikalienklasse, Wasserlöslichkeit, soweit sie für die Studie relevant sind;
Behandlung der Prüfsubstanzen/Kontrollsubstanzen vor der Testung, soweit zutreffend (z.B. Erwärmung, Zerkleinerung);
Stabilität, soweit bekannt.
Informationen zum Auftraggeber und Prüfanstalt
Name und Anschrift des Auftraggebers, der Prüfanstalt und des Studienleiters;
Angaben zur Identifizierung der Bezugsquelle der Augen (d. h. die Einrichtung, in der sie gewonnen wurden);
Lager- und Transportbedingungen der Augen (z.B. Datum und Uhrzeit der Gewinnung, Zeitspanne vor Testbeginn, Transportmedien und Temperaturbedingungen, eventuell verwendete Antibiotika);
soweit verfügbar, spezifische Angaben zu den Tieren, von denen die Augen gewonnen wurden (z.B. Alter, Geschlecht, Gewicht des Spendertieres).
Begründung der Prüfmethode und des angewandten Protokolls
Integrität der Prüfmethode
Das zur Gewährleistung der Integrität (d. h. der Genauigkeit und Zuverlässigkeit) der Prüfmethode im Zeitverlauf angewandte Verfahren (z.B. regelmäßige Testung von Leistungsstoffen, Hinzuziehung historischer Daten aus Negativ- und Positivkontrollen).
Testakzeptanzkriterien
Akzeptable konkurrierende Positiv- und Negativkontrollen aufgrund historischer Daten; gegebenenfalls akzeptable Reihen konkurrierender Referenzkontrollen aufgrund historischer Daten.
Testbedingungen
Beschreibung des angewandten Testsystems;
Typ des verwendeten Hornhauthalters;
Kalibrierungsdaten zu den für die Messung der Trübung und Durchlässigkeit verwendeten Geräte (z.B. Opazimeter und Spektrofotometer);
Angaben zu den verwendeten Rinderhornhäuten, einschließlich Qualitätsbestätigungen;
Einzelheiten des angewandten Testverfahrens;
verwendete Prüfsubstanzkonzentration(en);
Beschreibung etwaiger Änderungen des Testverfahrens;
Verweis auf historische Modelldaten (z.B. Negativ- und Positivkontrollen, Leistungsstoffe, Referenzsubstanzen); Beschreibung der angewandten Bewertungskriterien.
Ergebnisse
Tabellarische Aufstellung von Daten aus einzelnen Testproben (z.B. Trübungs- und OD 490 -Werte und berechnete IVIS-Werte für die Prüfsubstanz und die Positiv-, Negativ- und Referenzkontrollen [soweit einbezogen], einschließlich Daten aus Wiederholungsversuchen, soweit durchgeführt, sowie Mittelwerte ± Standardabweichung für jeden Versuch);
Beschreibung anderer beobachteter Wirkungen.
Erörterung der Ergebnisse
Schlussfolgerung
Literaturangaben
(1) U.S. EPA (1996). Label Review Manual: Zweite Ausgabe. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency.
(2) Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen, zur Änderung und Aufhebung der Richtlinien 67/548/EWG und 1999/45/EG und zur Änderung der Verordnung (EG) Nr. 1907/2006. ABl. Nr. L 353 vom 31.12.2008 S. 1.
(3) UN (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Zweite überarbeitete Ausgabe, New York & Genf: United Nations Publications, 2007. Verfügbar unter:
[http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html]
(4) ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Verfügbar unter:
[http://ecvam.jrc.it/index.htm]
(5) ICCVAM (200 7). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH-Veröffentlichung Nr. 07-4517. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(6) Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates vom 18. Dezember 2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH), zur Schaffung einer Europäischen Agentur für chemische Stoffe, zur Änderung der Richtlinie 1999/45/EG und zur Aufhebung der Verordnung (EWG) Nr. 793/93 des Rates, der Verordnung (EG) Nr. 1488/94 der Kommission, der Richtlinie 76/769/EWG des Rates sowie der Richtlinien 91/155/EWG, 93/67/EWG, 93/105/EG und 2000/21/EG der Kommission. ABl. Nr. L 396 vom 30.12.2006 S. 1.
(7) OECD (2002). Testrichtlinie 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Verfügbar unter:
[http://www.oecd.org/document/40/0,2340,en_2649_34377_37051368_1_1_1_1,00.html]
(8) ICCVAM (2007). ICCVAM Recommended BCOP Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH-Veröffentlichung Nr. 07-4517. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu-tmer.htm]
(9) ICCVAM. (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability Test Method. NIH-Veröffentlichung Nr. 06-4512. Research Triangle Park: National Toxicology Program. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu-brdice.htm]
(10) INVITTOX (1999). Protokoll Nr. 124: Bovine Corneal Opacity and Permeability Assay - SOP of Microbiological Associates Ltd. Ispra, Italien: Europäisches Zentrum für die Validierung alternativer Methoden (ECVAM).
(11) Gautheron, P., Dukic, M., Alix, D. und Sina, J.F. (1992). Bovine corneal opacity and permeability test: An in vitro assay of ocular irritancy. Fundam. Appl. Toxicol. 18:442-449.
(12) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., und das Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Verfügbar unter:
[http://www.cdc.gov/ncidod/dhqp/pdf].
(13) Maurer, J.K., Parker, R.D. und Jester, J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(14) Doughty, M.J., Petrou, S. und Macmillan, H. (1995). Anatomy and morphology of the cornea of bovine eyes from a slaughterhouse. Can. J. Zool. 73:2159-2165.
(15) Collee, J. und Bradley, R. (1997). BSE: A decade on - Part I. The Lancet 349: 636-641.
(16) Sina, J.F., Galer, D.M., Sussman, R.S., Gautheron, P.D., Sargent, E.V., Leong, B., Shah, P.V., Curren, R.D. und Miller, K. (1995). A collaborative evaluation of seven alternatives to the Draize eye irritation test using pharmaceutical intermediates. Fundam Appl Toxicol 26:20-31.
(17) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu-brdbcop.htm]
(18) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye (ICE) Test Method. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu-brdbcop.htm]
| Begriffsbestimmungen | Anlage 1 |
Genauigkeit: Der Grad der Übereinstimmung zwischen Testergebnissen und anerkannten Referenzwerten. Die Genauigkeit ist ein Maß der Leistung der Prüfmethode und ein Aspekt der "Relevanz". Der Begriff wird oft im Sinne von "Übereinstimmung" verwendet und bezeichnet den Anteil der korrekten Ergebnisse einer Prüfmethode.
Referenzsubstanz: Eine zum Vergleich mit einer Prüfsubstanz verwendete Bezugsgröße. Eine Referenzsubstanz sollte die folgenden Eigenschaften aufweisen: i) beständige und zuverlässige Quelle(n); ii) strukturelle und funktionelle Ähnlichkeit zur Klasse der geprüften Stoffe; iii) bekannte physikalische/chemische Eigenschaften; iv) unterstützende Daten zu bekannten Wirkungen; v) bekannte Potenz innerhalb der erwünschten Wirkungsspanne.
Hornhaut: Der Iris und Pupille überdeckende transparente vordere Teil des Augapfels, über den Licht ins Augeninnere übertragen wird.
Hornhauttrübung: Messwert für die Undurchsichtigkeit der Hornhaut nach Applikation einer Prüfsubstanz. Eine stärkere Hornhauttrübung ist ein Indikator für die Schädigung der Hornhaut. Die Trübung kann subjektiv (Draize-Kaninchenaugentest) oder objektiv (mithilfe eines Messgeräts, z.B. eines Opazimeters) bestimmt werden.
Hornhautdurchlässigkeit: Quantitativer Messwert für die Schädigung der Epithelzellschicht der Hornhaut, ermittelt durch Bestimmung der Menge an Fluorescein-Natrium, die alle Zellschichten der Hornhaut durchdringt.
EPA-Kategorie 1: Verätzende Wirkung (irreversible Schädigung des Augengewebes) oder Hornhautkomplikation oder -reizung, die über 21 Tage lang anhält (1).
EU-Kategorie R41: Schädigung des Augengewebes oder schwere physikalische Beeinträchtigung des Sehvermögens nach Applikation einer Prüfsubstanz auf die Vorderfläche des Auges, die innerhalb von 21 Tagen nach der Applikation nicht vollständig zurückgeht (2).
Falsch-Negativ-Rate: Der Anteil aller positiven Substanzen, die durch eine Prüfmethode fälschlicherweise als negativ identifiziert werden. Die Falsch-Negativ-Rate ist ein Leistungsindikator der Prüfmethode.
Falsch-Positiv-Rate: Der Anteil aller negativen Substanzen, die durch eine Prüfmethode fälschlicherweise als positiv identifiziert werden. Die Falsch-Positiv-Rate ist ein Leistungsindikator der Prüfmethode.
GHS (Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien): Ein System zur Klassifizierung von Chemikalien (Stoffe und Gemische) nach standardisierten Typen und Stufen physikalischer, gesundheitlicher und ökologischer Gefahren und zur entsprechenden Kennzeichnung durch Piktogramme, Signalwörter, Gefahrenhinweise, Sicherheitshinweise und Sicherheitsdatenblätter, um zum Schutz des Menschen (einschließlich Arbeitgeber, Arbeiter, Spediteure, Verbraucher und Notfall-Einsatzkräfte) und der Umwelt Informationen über die schädlichen Wirkungen der betreffenden Chemikalien zu verbreiten (3).
GHS-Kategorie 1: Schädigung des Augengewebes oder schwere physikalische Beeinträchtigung des Sehvermögens nach Applikation einer Prüfsubstanz auf die Vorderfläche des Auges, die innerhalb von 21 Tagen nach der Applikation nicht vollständig zurückgeht (3).
Gefahr: Inhärente Eigenschaft eines Stoffes oder eines Umfelds mit dem Potenzial, einen Organismus, ein System oder eine (Sub)population bei Exposition gegenüber diesem Stoff zu schädigen.
Invitro-Reizwert (IVIS): Eine empirisch abgeleitete Formel zur Verwendung im BCOP, bei der der durchschnittliche Trübungs- und der durchschnittliche Durchlässigkeitswert für jede Behandlungsgruppe in einem einzigen Invitro-Wert zusammengefasst werden. IVIS = durchschnittlicher Trübungswert + (15 x durchschnittlicher Durchlässigkeitswert).
Negativkontrolle: Ein unbehandeltes Replikat, das alle Komponenten eines Testsystems enthält. Diese Probe wird mit prüfsubstanzbehandelten Proben oder anderen Kontrollproben mitgeführt, um festzustellen, ob das Lösungsmittel mit dem Testsystem interagiert.
Stoffe ohne Reizwirkung: Stoffe, die nicht als Augenreizstoffe der EPA-Kategorien I, II oder III, der EU-Kategorien R41 oder R36 oder der GHS-Kategorien 1, 2A oder 2B eingestuft sind.
Augenverätzende Stoffe: a) Stoffe, die das Augengewebe irreversibel schädigen; b) Stoffe, die als Augenreizstoffe der GHS-Kategorie 1, der EPA-Kategorie I oder der EU-Kategorie R41 eingestuft sind (1) (2) (3).
Augenreizende Stoffe: a) Stoffe, die nach Applikation auf die Vorderfläche des Auges eine reversible Augenschädigung verursachen; b) Stoffe, die als Augenreizstoffe der EPA-Kategorien II oder III, der EU-Kategorie R36 oder der GHS- Kategorien 2A oder 2B eingestuft sind (1) (2) (3).
Stark augenreizende Stoffe: a) Stoffe, die nach Applikation auf die Vorderfläche des Auges das Augengewebe derart schädigen, dass die Schädigung nicht innerhalb von 21 Tagen nach der Applikation des Stoffes zurückgeht oder dass das Sehvermögen schwer beeinträchtigt ist; b) Stoffe, die als Augenreizstoffe der GHS-Kategorie 1, der EPA-Kategorie I oder der EU-Kategorie R41 eingestuft sind (1) (2) (3).
Opazimeter: Ein Instrument zur Messung der "Hornhauttrübung" durch quantitative Evaluierung der Lichtübertragung durch die Hornhaut. Das Gerät besteht in der Regel aus zwei Kammern, beide mit eigener Lichtquelle und Fotozelle. Eine Kammer wird für die behandelte Hornhaut verwendet, die zweite zur Kalibrierung und Nulleinstellung des Instruments. Licht aus einer Halogenleuchte wird durch eine Kontrollkammer (leere Kammer ohne Fenster oder Flüssigkeit) zu einer Fotozelle geleitet und mit dem durch die Versuchskammer, die die Kammer mit der Hornhaut enthält, zu einer Fotozelle geleiteten Lichtstrahl verglichen. Der Unterschied bei der Lichtübertragung aus den Fotozellen wird errechnet und als numerischer Trübungswert digital angezeigt.
Positivkontrolle: Ein Replikat, das alle Komponenten eines Testsystems enthält und mit einem Stoff behandelt wird, der bekanntermaßen eine positive Reaktion hervorruft. Um sicherzustellen, dass Abweichungen bei der Positivkontrollreaktion im Zeitverlauf bewertet werden können, sollte die Reaktion nicht zu heftig sein.
Zuverlässigkeit: Maß der Reproduzierbarkeit einer Prüfmethode innerhalb von und zwischen Laboratorien über einen längeren Zeitraum und bei einheitlichem Protokoll. Die Zuverlässigkeit wird durch Berechnung der Intra- und Interlabor- Reproduzierbarkeit bewertet.
Lösungsmittel-/Vehikelkontrolle: Eine unbehandelte Probe, die alle Komponenten eines Testsystems enthält, einschließlich des Lösungsmittels oder Vehikels, und die mit den Prüfsubstanzbehandelten Proben und anderen Kontrollproben mitgeführt wird, um die Referenzreaktion für die mit der Prüfsubstanz behandelten Proben, die im selben Lösungsmittel oder Vehikel aufgelöst wurden, zu bestimmen. Bei der Testung mit einer konkurrierenden Negativkontrolle zeigt diese Probe außerdem an, ob das Lösungsmittel oder Vehikel mit dem Testsystem interagiert.
Stufenweiser Prüfansatz: Eine schrittweise Prüfstrategie, bei der alle vorhandenen Informationen über eine Prüfsubstanz in einer vorgegebenen Reihenfolge überprüft werden, wobei auf jeder Stufe nach dem evidenzbasierten Bewertungsansatz (weightof-evidence) vorgegangen wird, um feststellen zu können, ob genügend Informationen für einen Gefahrenklassifizierungsbeschluss vorliegen, bevor zur nächsten Stufe übergangen wird. Wenn das Reizpotenzial einer Prüfsubstanz auf Basis der vorliegenden Informationen zugeordnet werden kann, sind keine weiteren Testungen erforderlich. Ist dies nicht der Fall, müssen schrittweise sequenzielle Tierversuche durchgeführt werden, bis eine eindeutige Klassifizierung vorgenommen werden kann.
Validierte Prüfmethode: Eine Prüfmethode, für die zwecks Bestimmung ihrer Relevanz (einschließlich Genauigkeit) und Zuverlässigkeit für einen bestimmten Zweck Validierungsstudien abgeschlossen wurden. Es wird jedoch darauf hingewiesen, dass eine validierte Prüfmethode möglicherweise nicht genau und zuverlässig genug ist, um für den vorgeschlagenen Zweck akzeptiert zu werden.
Evidenzbasierte Bewertung: Der Prozess der Prüfung der Stärken und Schwächen verschiedener Informationen, um über das Gefahrenpotenzial eines Stoffes entscheiden zu können und diese Entscheidung zu untermauern.
| Leistungsstoffe für den BCOP | Anlage 2 |
Vor der routinemäßigen Anwendung eines Tests, der den Anforderungen der vorliegenden Prüfmethode genügt, können Laboratorien ihre technische Kompetenz demonstrieren, indem sie die zehn in Tabelle 1 empfohlenen Stoffe in die richtige Ätzwirkungsklasse einstufen. Die Stoffe wurden so ausgewählt, dass sie die Bandbreite lokaler Augenreizungs- /Augenverätzungswirkungen repräsentieren, die auf den Ergebnissen des Invivo-Kaninchenaugentests basiert (TG 405) (d. h. Kategorien 1, 2A, 2B oder "nicht eingestuft und nicht gekennzeichnet" nach dem UN-GHS-System (3) (7). Angesichts der validierten Eignung dieser Tests (d. h. zur ausschließlichen Identifizierung augenverätzender/stark augenreizender Stoffe) kann die Kompetenz des Labors jedoch nur anhand von zwei Klassifizierungsergebnissen (verätzend/stark reizend oder nicht verätzend/schwach reizend) demonstriert werden. Weitere Auswahlkriterien betrafen die Erhältlichkeit der Stoffe im Handel, die Verfügbarkeit hochwertiger Invivo-Referenzdaten und das Vorhandensein hochwertiger Daten aus zwei Invitro-Methoden, für die zurzeit Testrichtlinien erarbeitet werden. Aus diesem Grunde wurden die Reizstoffe aus der von der ICCVAM empfohlenen Liste von 122 Referenzsubstanzen für die Validierung von Invitro-Prüfmethoden zur Untersuchung auf okulare Toxizität ausgewählt (siehe Anhang H: von ICCVAM empfohlene Referenzsubstanzen) (5). Referenzdaten können aus den Background Review Documents der ICCVAM für die BCOP- und die ICE-Prüfmethode (Test am isolierten Hühnerauge) bezogen werden (17) (18).
Tabelle 1 Empfohlene Stoffe für die Demonstration der technischen Kompetenz von Laboratorien zur Durchführung des BCOP
| Stoff | CAS-Nr. | Chemikalien klasse 1 | Physikalischer Zustand | Invivo-Klassifi- zierung 2 | Invitro-Klassifizierung 3 |
| Benzalkoniumchlorid (5 %) | 8001-54-5 | Oniumverbin- dung | flüssig | Kategorie 1 | verätzend/stark reizend |
| Chlorhexidin | 55-56-1 | Amin, Amidin | fest | Kategorie 1 | verätzend/stark reizend |
| Dibenzoyl-D-Wein- säure | 2743-38-6 | Carbonsäure, Es- ter | fest | Kategorie 1 | verätzend/stark reizend |
| Imidazol | 288-32-4 | heterocyclisch | fest | Kategorie 1 | verätzend/stark reizend |
| Trichloressigsäure (30 %) | 76-03-9 | Carbonsäure | flüssig | Kategorie 1 | verätzend/stark reizend |
| 2,6-Dichlorbenzoyl- chlorid | 4659-45-4 | Acylhalolenid | flüssig | Kategorie 2A | Nicht verätzend/ schwach reizend |
| Ethyl-2-methylaceto- acetat | 609-14-3 | Ketone, Ester | flüssig | Kategorie 2B | Nicht verätzend/ schwach reizend |
| Ammoniumnitrat | 6484-52-2 | Anorganisches Salz | fest | Kategorie 2A | Nicht verätzend/ schwach reizend |
| Glyzerin | 56-81-5 | Alkohol | flüssig | Nicht eingestuft | Nicht verätzend/ schwach reizend |
| n-Hexan | 110-54-3 | Kohlenwasser- stoff (acyclisch) | flüssig | Nicht eingestuft | Nicht verätzend/ schwach reizend |
| Abkürzungen:
CAS-Nr. = Registrierungsnummer des Chemical Abstracts Service
1) Jede Prüfsubstanz wurde anhand einer Standard-Klassifizierungsregelung auf Basis des Klassifizierungssystems der National Library of Medicine Medical Subject Headings (MeSH) einer Chemikalienklasse zugeordnet (abrufbar über http//www.nlm.nih.gov/mesh). 2) gestützt auf Ergebnisse aus dem Invivo-Kaninchenaugentest (OECD TG 405) unter Verwendung des UN-GHS-Klassifizierungssystems (3)(7). 3) gestützt auf Ergebnisse der BCOP- und ICE-Prüfmethoden. | |||||
| BCOP-Hornhauthalter | Anlage 3 |
1. BCOP-Hornhauthalter sind aus einem trägen Material (z.B. Polypropylen) gefertigt. Sie bestehen aus zwei Hälften (einer Vorder- und einer Hinterkammer) sowie zwei identischen zylindrischen Innenkammern. Jede Kammer hat ein Fassungsvermögen von 5 mL und schließt mit einer Glasscheibe ab, durch die die Trübungsmesswerte abgelesen werden. Jede Innenkammer hat einen Durchmesser von 1,7 cm und ist 2,2 cm tief 1. Ein auf der Hinterkammer positionierter Dichtungsring verhindert Leckagen. Die Hornhäute werden mit der Endothelseite nach unten auf den Dichtungsring der Hinterkammern platziert, während die Vorderkammern auf die Epithel-Seite der Hornhäute gesetzt werden. Die Kammern werden mit drei nichtrostenden Schrauben an den Außenkanten der Kammer fixiert. Jede Kammer schließt mit einer Glasscheibe ab, die für den leichten Zugang zur Hornhaut abgenommen werden kann. Um Leckagen zu verhindern, befindet sich zwischen Glasscheibe und Kammer ein weiterer Dichtungsring. Zwei Öffnungen auf der Oberseite jeder Kammer gestatten den Ein- und Auslass des Mediums und der Testverbindungen. Sie werden während der Behandlung und der Inkubation mit Gummistöpsel verschlossen.
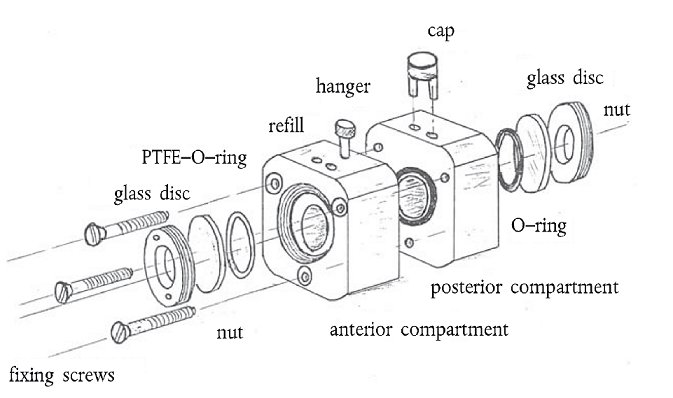
Glossar
Glass disc: Glasscheibe
PTFE-O-ring: PTFE-Dichtungsring
Refill: Einlassöffnung
Hanger: Aufhänger
Cap: Stöpsel
Nut: Sicherungsmutter
O-ring: Dichtungsring
Posterior compartment: Hinterkammer
Anterior compartment: Vorderkammer
Fixing screws: Fixierschrauben
Opazimeter
2. Der Opazimeter ist ein Gerät zur Messung der Lichtübertragung. Licht aus einer Halogenleuchte wird durch eine Kontrollkammer (leere Kammer ohne Fenster oder Flüssigkeit) zu einer Fotozelle geleitet und mit dem Lichtstrahl verglichen, der durch die Versuchskammer, welche die Kammer mit der Hornhaut enthält, zu einer Fotozelle geleitet wird. Der Unterschied bei der Lichtübertragung aus den Fotozellen wird berechnet und als numerischer Trübungswert digital angezeigt. Die Trübungseinheiten sind vorgegeben.
3. Der Opazimeter sollte mittels eine Reihe von Trübungsmesswerten eine lineare Reaktion ergeben, die den Schwellenwerten für die vom Prognosemodell beschriebenen unterschiedlichen Klassifizierungen (d. h. bis zu dem Schwellenwert, der die verätzende/stark reizende Wirkung bestimmt) Rechnung trägt. Um lineare und akkurate Messwerte bis zu 75-80 Trübungseinheiten zu gewährleisten, muss der Opazimeter mit einer Reihe von Kalibratoren geeicht werden. Die Kalibratoren (undurchsichtige Polyesterfolien) werden in die Kalibrierkammer (eine für die Aufnahme der Kalibratoren konzipierte Hornhautkammer) platziert und auf dem Opazimeter abgelesen. Die Kalibrierkammer ist derart konzipiert, dass die Kalibratoren in ungefähr demselben Abstand zu Lichtquelle und Fotozelle gehalten werden, in dem sich die Hornhäute bei der Trübungsmessung befinden würden. Der Opazimeter wird zunächst auf null Trübungseinheiten geeicht, wobei die Kalibrierkammer ohne Kalibrator verwendet wird. Anschließend werden nacheinander drei unterschiedliche Kalibratoren in die Kalibrierkammer gesetzt, und die Trübungswerte werden gelesen. Die Kalibratoren 1, 2 und 3 sollten Trübungswerte ergeben, die ihren eingestellten Werten von 75, 150 bzw. 225 Trübungseinheiten ± 5 % entsprechen.
____
1) Es handelt sich um Abmessungen einer Halterung für Hornhäute von Kühen im Alter von 12 bis 16 Monaten.
Soweit Tiere im Alter von sechs bis 12 Monaten verwendet werden, müsste die Halterung so konzipiert sein, dass jede Kammer 4 mL fasst und jede Innenkammer einen Durchmesser von 1,5 cm aufweist und 2,2 cm tief ist. Bei jedem neuen Halterungsmodell ist ausschlaggebend, dass das Verhältnis zwischen der exponierten Hornhautoberfläche und dem Fassungsvermögen der Hinterkammer dem jeweiligen Verhältniswert bei traditionellen Hornhauthaltern entspricht.
Dadurch wird sichergestellt, dass die Durchlässigkeitswerte zwecks Berechnung des IVIS-Wertes nach der vorgeschlagenen Formel korrekt bestimmt werden.
B. 48 Test am isolierten Hühnerauge zur Identifizierung von Stoffen mit augenverätzender und stark augenreizender Wirkung
Einleitung
1. Der Test am isolierten Hühnerauge (Isolated Chicken Eye, ICE) ist eine Invitro-Prüfmethode, die unter bestimmten Bedingungen und mit bestimmten Grenzen eingesetzt werden kann, um Stoffe und Gemische als Stoffe und Gemische mit augenverätzender und stark augenreizender Wirkung einzustufen (1) (2) (3). Für die Zwecke dieser Prüfmethode sind Stoffe mit starker Reizwirkung Stoffe, welche Augenläsionen verursachen, die beim Kaninchen nach der Applikation mindestens 21 Tage lang anhalten. Auch wenn der Test den Invivo-Kaninchenaugentest nicht absolut ersetzen kann, wird der ICE innerhalb eines spezifischen Anwendungsbereichs dennoch als Teil einer gestuften Prüfstrategie zur vorschriftsmäßigen Einstufung und Kennzeichnung empfohlen (4) (5). Bei diesem Test positiv testende Prüfsubstanzen und -gemische (6) können als Stoffe und Gemische mit augenverätzender oder stark augenreizender Wirkung eingestuft werden, ohne dass weitere Tests am lebenden Kaninchen erforderlich sind. Ein Stoff mit negativem Testergebnis müsste nach einer sequenziellen Prüfstrategie, wie in der OECD-Testrichtlinie 405 (7) (Kapitel B. 5 dieses Anhangs) dargelegt, am Kaninchen getestet werden.
2. Diese Prüfmethode beschreibt die Verfahrensschritte für die Beurteilung des augenverätzenden oder stark augenreizenden Potenzials einer Prüfsubstanz, gemessen als seine Fähigkeit, im isolierten Hühnerauge toxische Wirkung zu zeigen. Toxische Wirkungen auf die Hornhaut werden gemessen durch i) qualitative Bewertung der Trübung, ii) qualitative Bewertung der Schädigung der Epithel-Zellschicht durch Applikation von Fluorescein auf das Auge (Fluorescein-Verfärbung), iii) quantitative Messung verstärkter Dicke (Schwellung) und iv) qualitative Beurteilung makroskopischer morphologischer Oberflächenschädigungen. Hornhauttrübungen, Hornhautschwellungen und Hornhautschädigungen nach Applikation einer Prüfsubstanz werden zunächst einzeln bewertet und anschließend zwecks Klassifizierung des Augenreizwertes (Eye Irritancy Classification) kombiniert.
3. Augenreizende Stoffe, die Läsionen hervorrufen, welche in weniger als 21 Tagen abklingen, und Stoffe ohne augenreizende Wirkung wurden ebenfalls nach der ICE-Methode untersucht. Die Genauigkeit und Zuverlässigkeit des ICE bei Stoffen in diesen beiden Kategorien wurden jedoch nicht offiziell evaluiert.
4. Für Definitionen siehe Anhang 1.
Vorbemerkungen und Einsatzgrenzen
5. Diese Prüfmethode basiert auf dem ICE-Testprotokoll des Organisationsübergreifenden Koordinationsausschusses zur Validierung alternativer Methoden (Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) (8), das im Anschluss an eine internationale Validierungsstudie (4) (5) (9) und unter Mitwirkung des Europäischen Zentrums zur Validierung alternativer Methoden (European Centre for the Validation of Alternative Methods), des Japanischen Zentrums zur Validierung alternativer Methoden (Japanese center for the Validation of Alternative Methods) und der Abteilung Toxikologie und angewandte Pharmakologie des niederländischen Forschungsinstituts TNO Quality of Life entwickelt wurde. Das Protokoll beruht auf Informationen aus veröffentlichten Protokollen und auf dem von TNO derzeit verwendeten Protokoll (10) (11) (12) (13) (14).
6. Die anerkannten Einsatzgrenzen dieser Prüfmethode beruhen auf der Falsch-Positiv-Rate für Alkohole und den Falsch- Negativ-Raten für Feststoffe und Tenside (siehe Punkt 47) (4). Durch Ausschluss von Stoffen dieser chemischen und physikalischen Klassen aus der Datenbank lässt sich die Genauigkeit des ICE in allen Klassifizierungssystemen (EU, EPA und GHS) erheblich verbessern (4). Für die Zwecke dieser Prüfung (d. h. ausschließliche Identifizierung augenverätzender/stark augenreizender Stoffe) sind Falsch-Negativ-Raten nicht maßgeblich, da diese Stoffe anschließend an Kaninchen oder - je nach Vorschriften - im Rahmen anderer angemessen validierter Invitro-Tests anhand einer sequenziellen Prüfstrategie mit einem evidenzbasierten Bewertungsansatz (weight of evidence approach) geprüft werden. Außerdem konnten bestimmte Chemikalien- oder Produktklassen (z.B. Gemische) mit den derzeitigen Validierungsdaten nicht angemessen evaluiert werden. Prüfer könnten diese Prüfmethode jedoch für alle Arten von Prüfmaterial (auch Gemische) einsetzen und ein Positivergebnis als Indikator einer augenverätzenden oder stark augenreizenden Wirkung akzeptieren. Positivergebnisse bei Verwendung von Alkohol sollten angesichts des Risikos von Falsch- Positiv-Prognosen (overprediction) jedoch mit einer gewissen Zurückhaltung interpretiert werden.
7. Bei allen Verfahren, die Hühneraugen involvieren, sollten die geltenden Regeln und Verfahrensvorschriften der Prüfanstalt für den Umgang mit Human- bzw. Tiermaterial eingehalten werden, das auch Gewebe und Gewebeflüssigkeiten umfasst, jedoch nicht darauf beschränkt ist. Universelle Laborregeln sollten beachtet werden (15).
8. Eine Grenze der Prüfmethode liegt darin, dass, obgleich zwar einige der im Kaninchenaugentest evaluierten Reizwirkungen und bis zu einem gewissen Grad auch deren Schwere berücksichtigt werden, Bindehaut- und Irisverletzungen außer Acht gelassen werden. Auch wurde -obwohl sich die Reversibilität von Hornhautläsionen per se mit dem ICE nicht beurteilen lässt - ausgehend von Kaninchenaugenstudien dennoch vorgeschlagen, eine Bewertung der anfänglichen Dicke der Hornhautverletzung heranzuziehen, um zwischen irreversiblen und reversiblen Wirkungen zu unterscheiden (16). Schließlich sei auch zu erwähnen, dass eine potenziell mit der Augenexposition verbundene systemische Toxizität nach der ICE-Methode nicht bewertet werden kann.
9. Es laufen Arbeiten, um Eignung und Grenzen des ICE zur Identifizierung von Stoffen mit schwacher Reizwirkung oder von Stoffen ohne Reizwirkung genauer zu charakterisieren (siehe auch Punkt 48). Ferner wird empfohlen, dass Anwender den Validierungsorganisationen Exemplare und/oder Daten zur formellen Prüfung etwaiger künftiger Anwendungsbereiche des ICE übermitteln, auch um Stoffe mit schwacher Reizwirkung oder Stoffe ohne Reizwirkung identifizieren zu können.
10. Laboratorien, die diese Prüfmethode zum ersten Mal anwenden, sollten die in Anlage 2 genannten Leistungschemikalien verwenden. Laboratorien können diese Chemikalien verwenden, um ihre technische Kompetenz zur Durchführung des ICE zu demonstrieren, bevor sie ICE-Testdaten zum Zwecke der vorschriftsmäßigen Gefahrenklassifizierung einreichen.
Testprinzip
11. Die ICE-Prüfmethode ist ein organtypisches Modell, das die Zellstruktur des Hühnerauges in vitro kurzfristig funktionsfähig hält. Bei dieser Prüfmethode werden durch die Prüfsubstanz hervorgerufene Schäden als Hornhautschwellungen, Hornhauttrübung und korneale Fluorescein-Verfärbung festgestellt. Während die beiden letztgenannten Parameter eine qualitative Bewertung erfordern, muss die Hornhautschwellung quantitativ bestimmt werden. Jedes Messergebnis wird entweder in einen quantitativen Wert umgerechnet, der seinerseits für die Berechnung eines Gesamtreizindexes (Overall Irritancy Index) zugrunde gelegt wird, oder einer Qualitätskategorie zugeordnet, die wiederum für die Einordnung in Klassen für Stoffe mit in vitro augenverätzender und stark augenreizender Wirkung herangezogen wird. Jedes dieser Ergebnisse kann alsdann verwendet werden, um das Potenzial einer Prüfsubstanz, in vivo Augenverätzungen und starke Augenreizungen hervorzurufen, vorauszusagen (siehe Entscheidungskriterien).
Bezugsquelle und Alter der Hühneraugen
12. Traditionell werden für diesen Test Augen von Hühnern verwendet, die in einer Schlächterei für den menschlichen Verzehr geschlachtet wurden; auf diese Weise wird der Einsatz von Versuchstieren vermieden. Nur Augen von gesunden Tieren, die für die Nahrungskette geeignet angesehen werden, dürfen verwendet werden.
13. Es wurde keine kontrollierte Studie zur Bestimmung des optimalen Alters der Hühner durchgeführt, doch werden für diesen Test traditionsgemäß Hühner verwendet, bei denen es sich nach Alter und Gewicht um Junghühner handelt (d. h. Hühner im Alter von ungefähr sieben Wochen mit einem Gewicht von 1,5 bis 2,5 kg), die in der Regel in einer Geflügelschlächterei geschlachtet werden.
Gewinnung und Beförderung der Augen zum Labor
14. Die Köpfe sollten unmittelbar nach dem Betäuben der Tiere, normalerweise durch Elektroschock, und nach dem Entbluten durch Nackenstich abgesetzt werden. Sie sollten aus einer in Nähe des Labors gelegenen Quelle bezogen werden, um die Köpfe möglichst schnell vom Schlachthof zum Labor befördern zu können, damit sich ihr Zustand nicht verschlechtert und/oder Bakterienkontaminationen auf ein Mindestmaß begrenzt werden. Der Zeitabstand zwischen der Gewinnung der Hühnerköpfe und der Verwendung der Augen im ICE sollte möglichst gering sein (d. h. höchstens zwei Stunden betragen) und die Testergebnisse nachweislich nicht kompromittieren. Letztere hängen von den Auswahlkriterien für die Augen sowie von den Reaktionen der Positiv- und Negativkontrollen ab. Alle im Test verwendeten Augen sollten aus derselben Partie Augen stammen, die an ein und demselben Tag gewonnen wurden.
15. Da die Augen im Labor seziert werden, sind die intakten Köpfe in Kunststoffbehältnissen, die mit Tüchern, welche in isotonischer Kochsalzlösung getränkt wurden, ausgeschlagen sind, und bei Umgebungstemperatur vom Schlachthof zum Labor zu befördern.
Auswahlkriterien für Augen, die im ICE-Test eingesetzt werden
16. Augen mit starker Ausgangs-Fluorescein-Verfärbung (d. h. > 0,5) oder mit starker Hornhauttrübung (d. h. > 0,5) nach der Ausschälung werden verworfen.
17. Jede Behandlungsgruppe und die konkurrierende Positivkontrolle umfassen mindestens drei Augen. Die Negativkontrollen bzw. die Lösungsmittelkontrolle (wenn ein anderes Lösungsmittel als Kochsalzlösung verwendet wird) bestehen aus mindestens einem Auge.
Verfahren
Präparieren der Augen
18. Die Augenlider werden sorgfältig weggeschnitten, wobei darauf zu achten ist, dass die Hornhaut nicht beschädigt wird. Die Unversehrtheit der Hornhaut wird mithilfe eines Tropfens von 2 %igem (w/v) Natrium-Fluorescein, der für einige Sekunden auf die Hornhautoberfläche appliziert und anschließend mit isotonischer Kochsalzlösung abgespült wird, schnell überprüft. Fluoresceinbehandelte Augen werden sodann mit einem Spaltlampenmikroskop auf Hornhautschädigung untersucht (d. h. Fluorescein-Verfärbung und Hornhauttrübungswerte müssen !g 0,5 betragen).
19. Liegt keine Schädigung vor, wird das Auge weiter freigelegt, wobei dafür Sorge zu tragen ist, dass die Hornhaut nicht beschädigt wird. Der Augapfel wird aus der Augenhöhle herausgezogen, indem die Nickhaut mithilfe einer chirurgischen Zange festgehalten und die Augenmuskulatur mit einer gebogenen, stumpfendigen Schere durchtrennt wird. Dieser Schritt ist wichtig, um zu vermeiden, dass die Hornhaut durch übermäßigen Druck geschädigt wird (Kompressionsartefakte).
20. Beim Herauslösen des Auges aus der Augenhöhle sollte ein sichtbarer Teil des Sehnervs noch anhaften. Das Auge wird anschließend auf eine saugfähige Unterlage gesetzt, und Nickhaut sowie anderes Bindegewebe werden weggeschnitten.
21. Das auf diese Weise ausgeschälte Auge wird in einer Klemme aus rostfreiem Stahl fixiert, wobei die Hornhaut vertikal positioniert sein muss. Die Klemme wird sodann in eine Kammer des Superfusionsgeräts gesetzt (16). Im Superfusionsgerät sollten die Klemmen so positioniert werden, dass die gesamte Hornhaut mit der Kochsalzinfusion versorgt wird. Die Temperatur in den Kammern des Superfusionsgeräts sollte auf 32 ± 1,5 °C gehalten werden. Anlage 3 zeigt ein Schaubild eines typischen Superfusionsgeräts mit Augenklemmen; das Gerät ist im Handel fertig oder als Bausatz erhältlich. Es kann den Bedürfnissen des jeweiligen Labors angepasst werden (z.B. um Augen in verschiedener Anzahl aufzunehmen).
22. Nach dem Einsetzen ins Superfusionsgerät werden die Augen erneut mit einem Spaltlampenmikroskop untersucht, um sicherzustellen, dass sie während des Sezierens nicht beschädigt wurden. Bei dieser Gelegenheit sollte mit dem Pachometeraufsatz des Spaltlampenmikroskops auch die Hornhautdicke im Apex gemessen werden. Augen mit i) einer Fluorescein-Verfärbung von > 0,5, ii) einer Hornhauttrübung von > 0,5 oder iii) etwaigen anderen Anzeichen einer Schädigung sollten ersetzt werden. Einzelne Augen, auf die keines der genannten Kriterien zutrifft, werden verworfen, wenn sie eine Hornhautdicke aufweisen, die mehr als 10 % vom durchschnittlichen Dickenwert aller Augen zusammengerechnet abweicht. Anwender sollten sich darüber im Klaren sein, dass Spaltlampenmikroskope mit unterschiedlicher Spaltbreiteneinstellung unterschiedliche Dickenmesswerte ergeben können. Die Spaltbreite sollte auf 0,095 mm eingestellt sein.
23. Sobald alle Augen untersucht und für einwandfrei befunden wurden, werden sie zwecks Äquilibrierung des Testsystems vor Applikation der Prüfsubstanz für ungefähr 45 bis 60 Minuten inkubiert. Nach der Äquilibrierung werden Referenzmessungen von Hornhautdicke und Hornhauttrübung zum Zeitpunkt Null vorgenommen, welche als Referenzszenario dienen (d. h. Zeitpunkt = 0). Der beim Sezieren ermittelte Fluorescein-Wert wird als Referenzmesswert für diesen Endpunkt verwendet.
Applikation der Prüfsubstanz
24. Unmittelbar nach den Referenzmessungen zum Null-Zeitpunkt wird das Auge (in seiner Halterung) aus dem Superfusionsgerät entnommen, und zur Applikation der Prüfsubstanz auf die Hornhaut horizontal positioniert.
25. Flüssige Prüfsubstanzen werden in der Regel unverdünnt getestet, können jedoch verdünnt werden, sofern dies für notwendig gehalten wird (z.B. als Teil des Studienkonzepts). Bevorzugtes Lösungsmittel für verdünnte Stoffe ist physiologische Kochsalzlösung. Unter kontrollierten Bedingungen können auch alternative Lösungsmittel verwendet werden, deren Eignung jedoch nachgewiesen werden sollte.
26. Flüssige Prüfsubstanzen werden so auf die Hornhaut appliziert, dass die gesamte Hornhautoberfläche gleichmäßig von der Prüfsubstanz bedeckt ist; das Standardvolumen beträgt 0,03 mL.
27. Feste Prüfsubstanzen sollten wenn möglich im Mörser oder mit einem vergleichbaren Zerkleinerungsgerät so fein wie möglich gemahlen werden. Das Pulver wird so auf die Hornhaut appliziert, dass die Oberfläche von der Prüfsubstanz gleichmäßig bedeckt ist; die Standardmenge beträgt 0,03 g.
28. Die Prüfsubstanz (flüssig oder fest) wird für 10 Sekunden appliziert und anschließend mit isotonischer Kochsalzlösung (ungefähr 20 mL) bei Umgebungstemperatur vom Auge abgespült. Das Auge (in seiner Halterung) wird anschließend wieder in aufrechter Ausgangsstellung in das Superfusionsgerät eingesetzt.
Kontrollsubstanzen
29. Jeder Versuch sollte konkurrierende Negativ- oder Lösungsmittel-/Vehikelkontrollen und konkurrierende Positivkontrollen umfassen.
30. Beim Prüfen unverdünnter (100 % iger) Flüssigkeiten oder Feststoffe wird als konkurrierende Negativkontrolle im ICE- Test physiologische Kochsalzlösung verwendet, um unspezifische Veränderungen im Testsystem festzustellen und um sicherzustellen, dass die Testbedingungen keine ungerechtfertigten Reizwirkungen hervorrufen.
31. Zum Testen verdünnter Flüssigkeiten umfasst der Test auch eine Gruppe konkurrierender Lösungsmittel-/Vehikelkontrollen, um unspezifische Veränderungen im Testsystem nachzuweisen und um sicherzustellen, dass die Testbedingungen keine ungerechtfertigten Reizwirkungen hervorrufen. Wie unter Punkt 25 erwähnt, sind nur Lösungsmittel/Vehikel zulässig, die das Testsystem nachweislich nicht beeinträchtigen.
32. Jeder Versuch umfasst als konkurrierende Positivkontrolle einen bekannten Augenreizstoff, damit überprüft werden kann, ob eine adäquate Wirkung eintritt. Da der ICE-Test bei dieser Prüfmethode eingesetzt wird, um verätzende oder stark reizende Stoffe zu identifizieren, sollte es sich bei der Positivkontrolle um eine Referenzsubstanz handeln, die bei dieser Prüfmethode eine starke Wirkung hervorruft. Um zu gewährleisten, dass die Veränderlichkeit der Reaktion der Positivkontrolle im Zeitverlauf bewertet werden kann, sollte die Reaktionsstärke nicht allzu heftig sein. Es sollten genügend Invitro-Daten für die Positivkontrolle generiert werden, damit eine statistisch vorgegebene vertretbare Spanne für die Positivkontrolle berechnet werden kann. Liegen für eine bestimmte Positivkontrolle keine angemessenen historischen Daten zur ICE-Prüfmethode vor, so können Studien erforderlich werden, um die erforderlichen Daten zu generieren.
33. Beispiele für Positivkontrollen für flüssige Prüfsubstanzen sind 10 % ige Essigsäure oder 5 % iges Benzalkoniumchlorid, während für Positivkontrollen für feste Prüfsubstanzen Natriumhydroxid oder Imidazol in Frage kommen.
34. Referenzsubstanzen sind nützlich für die Evaluierung des Augen-Reizpotenzials unbekannter Chemikalien einer bestimmten Chemikalien- oder Produktklasse oder zur Evaluierung des relativen Reizpotenzials eines Augenreizstoffes innerhalb einer spezifischen Spanne von Reizwirkungen.
Gemessene Endpunkte
35. Behandelte Hornhäute werden vor der Behandlung evaluiert sowie in Abständen von 30, 75, 120, 180 und 240 Minuten (± 5 Minuten) nach dem Abspülen im Anschluss an die Behandlung. Diese Zeitreihe gestattet eine angemessene Anzahl von Messungen während des vierstündigen Behandlungszeitraums und lässt genügend Zeit zwischen den Messungen, um alle Augen vorschriftsgemäß beobachten zu können.
36. Die evaluierten Endpunkte sind Hornhauttrübung, Hornhautschwellung, Fluorescein-Verfärbung und morphologische Effekte (z.B. durchlöchertes oder abgelöstes Epithel). Alle Endpunkte mit Ausnahme der Fluorescein-Verfärbung (die ausschließlich vor der Behandlung sowie 30 Minuten nach Applikation der Prüfsubstanz ermittelt wird) werden zu jedem der vorgenannten Zeitpunkte bestimmt.
37. Hornhauttrübung, Fluorescein-Verfärbung, morphologische Effekte und, sofern sie vorliegen, histopathologische Befunde sollten fotografiert werden.
38. Nach der abschließenden Untersuchung am Ende des vierstündigen Behandlungszeitraums sollten die Augen in einer geeigneten Fixierlösung (z.B. neutrales gepuffertes Formalin) aufbewahrt werden, damit sie gegebenenfalls histopathologisch untersucht werden können.
39. Hornhautschwellungen werden durch Hornhautdickenmessungen bestimmt, die mit dem optischen Pachometeraufsatz eines Spaltlampenmikroskops vorgenommen werden. Der Schwellungsmesswert wird als Prozentsatz ausgedrückt und auf Basis der Hornhautdickenmesswerte nach folgender Formel berechnet:
[(Hornhaut - Dicke zum Zeitpunkt t - Hornhaut - Dicke zum Zeitpunkt = 0) / (Hornhaut - Dicke zum Zeitpunkt)] x 100
40. Für alle getesteten Augen wird die durchschnittliche Hornhautschwellung (in Prozent) für sämtliche Beobachtungszeitpunkte berechnet. Auf Basis des höchsten Mittelwertes für die Hornhautschwellung (beliebiger Beobachtungszeitpunkt) wird jeder Prüfsubstanz ein Gesamtwert für die Kategorie (overall category score) zugeordnet.
41. Die Hornhauttrübung wird anhand der Hornhautfläche berechnet, die am stärksten getrübt ist. Für alle getesteten Augen wird der durchschnittliche Trübungswert für jeden Beobachtungszeitpunkt berechnet. Auf Basis des höchsten Mittelwertes für die Hornhauttrübung (beliebiger Beobachtungszeitpunkt) wird anschließend jede Prüfsubstanz ein Gesamtwert für die Kategorie (overall category score) zugeordnet (Tabelle 1).
Tabelle 1 Hornhauttrübungswerte
| Wert | Beobachtung |
| 0 | keine Trübung |
| 0,5 | sehr schwache Trübung |
| 1 | gestreute oder diffuse Strukturen; Iris deutlich sichtbar |
| 2 | leicht erkennbare lichtdurchlässige Struktur; Iris weniger deutlich sichtbar |
| 3 | starke Hornhauttrübung; Einzelheiten der Iris nicht sichtbar; Pupillengröße kaum erkennbar |
| 4 | vollständige Trübung/Iris unsichtbar |
42. Für alle getesteten Augen wird die durchschnittliche Fluorescein-Verfärbung nur für den 30-minütigen Beobachtungszeitpunkt berechnet, der zur Berechnung des jeder Prüfsubstanz zugeordneten Gesamtwertes für die Kategorie herangezogen wird (Tabelle 2).
Tabelle 2 Fluorescein-Verfärbung
| Wert | Beobachtung |
| 0 | keine Fluorescein-Verfärbung |
| 0,5 | sehr geringfügige Verfärbung einzelner Zellen |
| 1 | Verfärbung einzelner Zellen auf der gesamten behandelten Fläche der Hornhaut |
| 2 | punktuelle oder konfluierende dichte Zellverfärbung |
| 3 | konfluierende großflächige Fluorescein-Verfärbung der Hornhaut |
43. Morphologische Effekte umfassen "durchlöcherte" Hornhaut-Epithelzellen, "abgelöste" Epithelzellen, "aufgeraute" Hornhautoberfläche und "Verklebung" der Hornhaut mit der Prüfsubstanz. Diese Befunde können unterschiedlich stark ausgeprägt sein und gleichzeitig auftreten. Ihre Einstufung erfolgt subjektiv je nach Auswertung des Prüfers.
Daten und Berichterstattung
Datenauswertung
44. Die Ergebnisse für die Hornhauttrübung, die Hornhautschwellung und die Fluorescein-Verfärbung sollten einzeln evaluiert werden, um für jeden Endpunkt eine ICE-Klasse zu generieren. Kombiniert ergeben die ICE-Klassen für die einzelnen Endpunkte eine Reizklasse (Irritancy Classification) für die einzelnen Prüfsubstanzen.
Entscheidungskriterien
45. Nach der Evaluierung jedes Endpunktes können die ICE-Klassen entsprechend einer vorgegebenen Spanne zugeordnet werden. Die Auswertung der Hornhautdicke (Tabelle 3), der Hornhauttrübung (Tabelle 4) und der Fluorescein- Verfärbung (Tabelle 5) und ihre Einstufung in vier ICE-Klassen erfolgen in folgender Rangordnung:
Tabelle 3 Kriterien für die Einstufung in ICE-Klassen - Hornhautdicke
| Durchschnittliche Hornhautschwellung (in %) * | ICE-Klasse |
| 0 bis 5 | I |
| > 5 bis 12 | II |
| > 12 bis 18 (> 75 Minuten nach der Behandlung) | II |
| > 12 bis 18 (< 75 Minuten nach der Behandlung) | III |
| > 18 bis 26 | III |
| > 26 bis 32 (> 75 nach der Behandlung) | III |
| > 26 bis 32 (< 75 Minuten nach der Behandlung) | IV |
| > 32 | IV |
| *) Die Werte für die Hornhautschwellung sind nur gültig, wenn die Dicke mit einem Haag-Streit-BP900-Spaltlampenmikroskop mit Tiefenmessgerät Nr. I und einer Spaltbreiteneinstellung 9,5 (= 0,095 mm) gemessen wird. Anwender sollten sich darüber im Klaren sein, dass Spaltlampenmikroskope mit unterschiedlicher Spaltbreiteneinstellung unterschiedliche Dickenmesswerte ergeben können. | |
Tabelle 4 Kriterien für die Einstufung in ICE-Klassen - Hornhauttrübung
| Durchschnittlicher Höchstwert für die Hornhauttrübung * | ICE-Klasse |
| 0,0-0,5 | I |
| 0,6-1,5 | II |
| 1,6-2,5 | III |
| 2,6-4,0 | IV |
| *) Siehe Tabelle 1. | |
Tabelle 5 Kriterien für die Einstufung in ICE-Klassen - durchschnittliche Fluorescein-Verfärbung
| Durchschnittliche Verfärbung 30 Minuten nach der Behandlung * | ICE-Klasse |
| 0,0-0,5 | I |
| 0,6-1,5 | II |
| 1,6-2,5 | III |
| 2,6-3,0 | IV |
| *) Siehe Tabelle 2. | |
46. Die Gesamtklassifizierung des Invitro-Reizpotenzials (overall in vitro irritancy classification) einer Prüfsubstanz richtet sich nach der Reizklasse (irritancy classification), die der Kombination von Kategorien entspricht, die für die Hornhautschwellung, die Hornhauttrübung und die Fluorescein-Verfärbung ermittelt wurden, und wird nach dem Schema in Tabelle 6 vorgenommen.
Tabelle 6 Gesamtklassifizierung des Invitro-Reizpotenzials
| Klassifizierung | Kombinationen der drei Endpunkte |
| verätzend / stark reizend | 3 x IV
2 x IV, 1 x III 2 x IV, 1 x II * 2 x IV, 1 x I * Hornhauttrübung > 3 nach 30 Min. (bei mindestens zwei Augen) Hornhauttrübung = 4 zu beliebigem Zeitpunkt (bei mindestens zwei Augen) starkes Ablösen der Epithel-Zellschicht (bei mindestens einem Auge) |
| *) weniger gängige Kombinationen. | |
47. Wie unter Punkt 1 bereits erwähnt, sollte die Prüfsubstanz, soweit er nicht als Stoff mit augenverätzender oder stark augenreizender Wirkung identifiziert wurde, zu Einstufungs- und Kennzeichnungszwecken zusätzlich getestet werden. Gemessen an Daten aus Invivo-Kaninchenaugentests, die nach den EPA-(1)-, EU-(2)- oder GHS-(3)-Klassifizierungssystemen eingestuft wurden, zeichnet sich der ICE hinsichtlich der Identifizierung von Stoffen mit augenverätzender oder stark augenreizender Wirkung durch eine allgemeine Genauigkeit von 83 % (120/144) bis 87 % (134/154), eine Falsch-Positiv-Rate von 6 % (7/122) bis 8 % (9/116) und eine Falsch-Negativ-Rate von 41 % (13/32) bis 50 % (15/30) aus. Werden Stoffe einer bestimmten Chemikalienklasse (d. h. Alkohole und Tenside) oder einer bestimmten physikalischen Klasse (d. h. Feststoffe) aus der Datenbank ausgeschlossen, so liegen die Genauigkeit des ICE gemessen an den EU-, EPA- und GHS-Klassifizierungssystemen zwischen 91 % (75/82) und 92 % (69/75), die Falsch-Positiv-Raten zwischen 5 % (4/73) und 6 % (4/70) und die Falsch-Negativ-Raten zwischen 29 % (2/7) und 33 % (3/9) (4).
48. Selbst wenn die augenverätzende oder stark augenreizende Wirkung einer Prüfsubstanz nicht klassifiziert werden kann, können Daten aus dem ICE in Kombination mit Testdaten aus dem Invivo-Kaninchenaugentest oder aus einem angemessen validierten Invitro-Test zweckdienlich sein, um Eignung und Grenzen des ICE zur Identifizierung von schwach augenreizenden Stoffen und von Stoffen ohne Reizwirkung besser zu evaluieren (ein Leitfaden für die Anwendung von Invitro-Prüfmethoden zur Untersuchung auf okulare Toxizität wird zur Zeit erarbeitet).
Studienakzeptanzkriterien
49. Ein Test gilt als akzeptabel, wenn die konkurrierenden Negativ- oder Vehikel-/Lösungsmittelkontrollen sowie die konkurrierenden Positivkontrollen eine Reizklasse ergeben, die unter die Kategorien "Stoffe ohne Reizwirkung" bis hin zu "Stoffe mit starker Reizwirkung/Ätzwirkung" fällt.
Testbericht
50. Der Testbericht sollte die folgenden Informationen umfassen, soweit sie für die Studie relevant sind:
Prüfsubstanzen und Kontrollsubstanzen
Chemische Bezeichnung(en) wie der vom Chemical Abstracts Service (CAS) benutzte strukturelle Name, gefolgt von anderen Bezeichnungen, soweit bekannt;
die CAS-Registrierungsnummer (CAS-Nr.), soweit bekannt;
Reinheit und Zusammensetzung des Stoffes oder des Gemisches (in Gewichtsprozent(en)), soweit diesbezügliche Informationen vorliegen;
Physikochemikalische Eigenschaften wie physikalischer Zustand, Flüchtigkeit, pH-Wert, Stabilität, Chemikalienklasse, Wasserlöslichkeit, soweit sie für die Studie relevant sind;
Behandlung der Prüfsubstanzen/Kontrollsubstanzen vor der Testung, soweit zutreffend (z.B. Erwärmung, Zerkleinerung);
Stabilität, soweit bekannt.
Informationen zu Auftraggeber und Prüfanstalt
Name und Anschrift des Auftraggebers, der Prüfanstalt und des Studienleiters;
Angaben zur Identifizierung der Bezugsquelle der Augen (d. h. Einrichtung, in der sie gewonnen wurden);
Lager- und Transportbedingungen der Augen (z.B. Datum und Uhrzeit der Gewinnung, Zeitspanne vor Testbeginn);
soweit bekannt, spezifische Daten betreffend die Tiere, von denen die Augen gewonnen wurden (z.B. Alter, Geschlecht, Gewicht des Spendertieres).
Begründung der Prüfmethode und des angewandten Protokolls
Integrität der Prüfmethode
Das zur Gewährleistung der Integrität (d. h. Genauigkeit und Zuverlässigkeit) der Prüfmethode im Zeitverlauf angewandte Verfahren (z.B. regelmäßige Testung von Leistungsstoffen, Hinzuziehung historischer Daten über Negativ- und Positivkontrollen).
Testakzeptanzkriterien
gegebenenfalls akzeptable Reihen konkurrierender Referenzkontrollen aufgrund historischer Daten;
Testbedingungen
Beschreibung des angewandten Testsystems;
verwendetes Spaltlampenmikroskop (z.B. Modell);
Einstellungen des verwendeten Spaltlampenmikroskops;
Angaben zu den verwendeten Hühneraugen, einschließlich Qualitätsbestätigungen;
Einzelheiten des angewandten Testverfahrens;
verwendete Prüfsubstanzkonzentration(en);
Beschreibung etwaiger Änderungen am Testverfahren;
Verweis auf historische Modelldaten (z.B. Negativ- und Positivkontrollen, Leistungsstoffe, Referenzsubstanzen);
Beschreibung der angewandten Bewertungskriterien;
Ergebnisse
Beschreibung sonstiger festgestellter Wirkungen;
gegebenenfalls Aufnahmen vom Auge;
Erörterung der Ergebnisse
Schlussfolgerung
Literaturangaben
(1) U.S. EPA (1996). Label Review Manual: Zweite Ausgabe. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency.
(2) Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen, zur Änderung und Aufhebung der Richtlinien 67/548/EWG und 1999/45/EG und zur Änderung der Verordnung (EG) Nr. 1907/2006. ABl. Nr. L 353 vom 31.12.2008 S. 1.
(3) (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Zweite überarbeitete Ausgabe, New York & Genf, 2007. Verfügbar unter:
[http://www.unece.org/trans/danger/publi/ghs/ghs-rev02/02files-e.html]
(4) ICCVAM (2007). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Centre for the Evaluation of Alternative Toxicological Methods (NICE-ATM). NIH-Veröffentlichung Nr. 07-4517. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu-tmer.htm]
(5) ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Verfügbar unter:
[http://ecvam.jrc.it/index.htm]
(6) Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates vom 18. Dezember 2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH), zur Schaffung einer Europäischen Agentur für chemische Stoffe, zur Änderung der Richtlinie 1999/45/EG und zur Aufhebung der Verordnung (EWG) Nr. 793/93 des Rates, der Verordnung (EG) Nr. 1488/94 der Kommission, der Richtlinie
76/769/EWG des Rates sowie der Richtlinien 91/155/EWG, 93/67/EWG, 93/105/EG und 2000/21/EG der Kommission.
ABl. Nr. L 396 vom 30.12.2006 S. 1.
(7) OECD (2002). Testrichtlinie 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Verfügbar unter:
[http://www.oecd.org/document/40/0, 2340, en 2649 34377 37051368 1 1 1 1,00.html]
(8) ICCVAM (2007). ICCVAM Recommended ICE Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Centre for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH-Veröffentlichung Nr. 07-4517. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu-tmer.htm]
(9) ICCVAM. (200 6). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye Test Method. NIH-Veröffentlichung Nr. 06-4513. Research Triangle Park: National Toxicology Program. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu-brdice.htm]
(10) Prinsen, M.K. und Koëter, B.W.M. (1993). Justification of the enucleated eye test with eyes of slaughterhouse animals as an alternative to the Draize eye irritation test with rabbits. Fd. Chem. Toxicol. 31:69-76.
(11) INVITTOX (1994). Protokoll Nr. 80: Chicken enucleated eye test (CEET). Verfügbar unter:
[http://ecvam.jrc.it/index.htm].
(12) Balls, M., Botham, P.A., Bruner, L.H. und Spielmann H. (1995). The EC/HO international validation study on alternatives to the Draize eye irritation test. Toxicol. In Vitro 9:871-929.
(13) Prinsen, M.K. (19 9 6). The chicken enucleated eye test (CEET): A practical (pre)screen for the assessment of eye irritation/ corrosion potential of test materials. Food Chem. Toxicol. 34:291-296.
(14) Chamberlain, M., Gad, S.C., Gautheron, P. und Prinsen, M.K. (1997). IRAG-Arbeitsgruppe I: Organotypic models for the assessment/prediction of ocular irritation. Food Chem. Toxicol. 35:23-37.
(15) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L. und das Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Verfügbar unter:
[http://www.cdc.gov/ncidod/dhqp/pdf/isolation2007.pdf].
(16) Maurer, J.K., Parker, R.D. und Jester, J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(17) Burton, A.B.G., M. York und R.S. Lawrence (1981). The in vitro assessment of severe irritants. Fd. Cosmet.- Toxicol.- 19, 471-480.
(18) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu-brdbcop.htm]
(19) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants Isolated Chicken Eye (ICE) Test Method. Verfügbar unter:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu-brdbcop.htm]
| Begriffsbestimmungen | Anlage 1 |
Genauigkeit: Der Grad der Übereinstimmung zwischen Testergebnissen und anerkannten Referenzwerten. Die Genauigkeit ist ein Maß der Leistung der Prüfmethode und ein Aspekt der "Relevanz". Der Begriff wird oft im Sinne von "Übereinstimmung" verwendet und bezeichnet den Anteil der korrekten Ergebnisse einer Prüfmethode.
Referenzsubstanz: Eine zum Vergleich mit einer Prüfsubstanz verwendete Bezugsgröße. Eine Referenzsubstanz sollte die folgenden Eigenschaften aufweisen: i) beständige und zuverlässige Quelle(n); ii) strukturelle und funktionelle Ähnlichkeit zur Klasse der geprüften Stoffe; iii) bekannte physikalische/chemische Eigenschaften; (iv) unterstützende Daten zu bekannten Wirkungen; v) bekannte Potenz innerhalb der erwünschten Wirkungsspanne.
Hornhaut: Der Iris und Pupille überdeckende transparente vordere Teil des Augapfels, über den Licht ins Augeninnere übertragen wird.
Hornhauttrübung: Messwert für die Undurchsichtigkeit der Hornhaut nach Applikation einer Prüfsubstanz. Eine verstärkte Hornhauttrübung ist ein Indikator für die Schädigung der Hornhaut.
Hornhautschwellung: Objektiver Messwert im Rahmen des ICE für die Umfangszunahme der Hornhaut nach Applikation einer Prüfsubstanz. Der Wert wird als Prozentsatz ausgedrückt und auf Basis von Referenz-Hornhautdickenmessungen (Messung vor der Applikation) und der in regelmäßigen Abständen nach der Applikation der Prüfsubstanz im ICE aufgezeichneten Dicke berechnet. Das Ausmaß der Hornhautschwellung ist ein Indikator der Hornhautschädigung.
EPA-Kategorie 1: Verätzende Wirkung (irreversible Schädigung des Augengewebes) oder Hornhautkomplikation oder -reizwirkung, die über 21 Tage lang anhält (1).
EU-Kategorie R41: Schädigung des Augengewebes oder schwere physikalische Beeinträchtigung des Sehvermögens nach Applikation einer Prüfsubstanz auf die Vorderfläche des Auges, die innerhalb von 21 Tagen nach der Applikation nicht vollständig zurückgeht (2).
Falsch-Negativ-Rate: Der Anteil aller positiven Substanzen, die von einer Prüfmethode fälschlicherweise als negativ identifiziert werden. Die Falsch-Negativ-Rate ist ein Leistungsindikator der Prüfmethode.
Falsch-Positiv-Rate: Der Anteil aller negativen Substanzen, die von einer Prüfmethode fälschlicherweise als positiv identifiziert werden. Die Falsch-Positiv-Rate ist ein Leistungsindikator der Prüfmethode.
Fluorescein-Verfärbung: Subjektiver Messwert im Rahmen des ICE für die Fluorescein-Natrium-Verfärbung der Epithel- Zellen in der Hornhaut nach Applikation einer Prüfsubstanz. Das Ausmaß der Fluorescein-Verfärbung ist ein Indikator der Schädigung der kornealen Epithel-Zellen.
GHS (Globales Harmonisierte System zur Einstufung und Kennzeichnung von Chemikalien): Ein System zur Klassifizierung von Chemikalien (Stoffe und Gemische) nach standardisierten Typen und Stufen physikalischer, gesundheitlicher und ökologischer Gefahren und zur entsprechenden Kennzeichnung durch Piktogramme, Signalwörter, Gefahrenhinweise, Sicherheitshinweise und Sicherheitsdatenblätter, um zum Schutz des Menschen (einschließlich Arbeitgeber, Arbeiter, Spediteure, Verbraucher und Notfall-Einsatzkräfte) und der Umwelt Informationen über die schädlichen Wirkungen der betreffenden Chemikalien zu verbreiten (3).
GHS-Kategorie 1: Schädigung des Augengewebes oder schwere physikalische Beeinträchtigung des Sehvermögens nach Applikation einer Prüfsubstanz auf die Vorderfläche des Auges, die innerhalb von 21 Tagen nach der Applikation nicht vollständig zurückgeht (3).
Gefahr: Inhärente Eigenschaft eines Stoffes oder eines Umfelds mit dem Potenzial, einen Organismus, ein System oder eine (Sub)population bei Exposition gegenüber diesem Stoff zu schädigen.
Negativkontrolle: Ein unbehandeltes Replikat, das alle Komponenten eines Testsystems enthält. Diese Probe wird mit Prüfsubstanzbehandelten Proben oder anderen Kontrollproben mitgeführt, um festzustellen, ob das Lösungsmittel mit dem Testsystem interagiert.
Stoffe ohne Reizwirkung: Stoffe, die nicht als Augenreizstoffe der EPA-Kategorien I, II oder III, der EU-Kategorien R41 oder R36 oder der GHS-Kategorien 1, 2A oder 2B eingestuft sind (1) (2) (3).
Augenverätzende Stoffe: a) Stoffe, die das Augengewebe irreversibel schädigen; b) Stoffe, die als Augenreizstoffe der GHS-Kategorie 1, der EPA-Kategorie I oder der EU-Kategorie R41 eingestuft sind (1) (2) (3).
Augenreizende Stoffe: a) Stoffe, die nach Applikation auf die Vorderfläche des Auges eine reversible Augenschädigung verursachen; b) Stoffe, die als Augenreizstoffe der EPA-Kategorie II oder III, der EU-Kategorie R36 oder der GHS- Kategorien 2A oder 2B eingestuft sind (1) (2) (3).
Stark augenreizende Stoffe: a) Stoffe, die nach Applikation auf die Vorderfläche des Auges das Augengewebe derart schädigen, dass die Schädigung nicht innerhalb von 21 Tagen nach der Applikation des Stoffes zurückgeht oder dass das Sehvermögen schwer beeinträchtigt ist; b) Stoffe, die als Augenreizstoffe der GHS-Kategorie 1, der EPA-Kategorie I oder der EU-Kategorie R41 eingestuft sind (1) (2) (3).
Positivkontrolle: Ein Replikat, das alle Komponenten eines Testsystems enthält und mit einem Stoff behandelt wird, der bekanntermaßen eine positive Reaktion hervorruft. Um sicherzustellen, dass Abweichungen bei der Positivkontrollreaktion im Zeitverlauf bewertet werden können, sollte die Reaktion nicht zu heftig sein.
Zuverlässigkeit: Maß der Reproduzierbarkeit einer Prüfmethode innerhalb von und zwischen Laboratorien über einen längeren Zeitraum und bei einheitlichem Protokoll. Die Zuverlässigkeit wird durch Berechnung der Intra- und Interlabor- Reproduzierbarkeit bewertet.
Spaltlampen-Mikroskop: Ein Instrument zur direkten Untersuchung des Auges, vergrößert mit einem binokularen Aufrechtbild-Stereomikrosop. Beim ICE-Test wird dieses Instrument eingesetzt, um die Vorderkammern des Hühnerauges visuell zu untersuchen und um die Hornhautdicke anhand eines Pachometer-Aufsatzes objektiv zu messen.
Lösungsmittel-/Vehikelkontrolle: Eine unbehandelte Probe, die alle Komponenten eines Testsystems enthält, einschließ-lich des Lösungsmittels oder Vehikels und die mit den Prüfsubstanzbehandelten und anderen Kontrollproben mitgeführt wird, um die Referenzreaktion für die mit der Prüfsubstanz behandelten Proben, die im selben Lösungsmittel oder Vehikel aufgelöst wurden, zu bestimmen. Bei der Testung mit einer konkurrierenden Negativkontrolle zeigt diese Probe außerdem an, ob das Lösungsmittel oder Vehikel mit dem Testsystem interagiert.
Stufenweiser Prüfansatz: Eine schrittweise Prüfstrategie, bei der allen vorhandenen Informationen über eine Prüfsubstanz in einer vorgegebenen Reihenfolge überprüft werden, wobei auf jeder Stufe nach dem evidenzbasierten Bewertungsansatz (weightof-evidence) vorgegangen wird, um feststellen zu können, ob genügend Informationen für eine Gefahrenklassifizierung vorliegen, bevor zur nächsten Stufe übergangen wird. Wenn das Reizpotenzial einer Prüfsubstanz auf Basis der vorliegenden Informationen zugeordnet werden kann, sind keine weiteren Testungen erforderlich. Ist dies nicht der Fall, müssen schrittweise sequenzielle Tierversuche durchgeführt werden, bis eine eindeutige Klassifizierung vorgenommen werden kann.
Validierte Prüfmethode: Eine Prüfmethode, für die zwecks Bestimmung ihrer Relevanz (einschließlich Genauigkeit) und Zuverlässigkeit für einen bestimmten Zweck Validierungsstudien abgeschlossen wurden. Es wird darauf hingewiesen, dass eine validierte Prüfmethode möglicherweise nicht genau und zuverlässig genug ist, um für den vorgeschlagenen Zweck akzeptiert zu werden.
Evidenzbasierte Bewertung: Der Prozess der Prüfung der Stärken und Schwächen verschiedener Informationen, um über das Gefahrenpotenzial eines Stoffes entscheiden zu können und diese Entscheidung zu untermauern.
| Leistungsstoffe für den ICE | Anlage 2 |
Vor der routinemäßigen Anwendung eines Tests, der den Anforderungen der vorliegenden Prüfmethode genügt, können Laboratorien ihre technische Kompetenz demonstrieren, indem sie die zehn in Tabelle 1 empfohlenen Stoffe in die richtige Ätzwirkungsklasse einstufen. Die Stoffe wurden so ausgewählt, dass sie die Bandbreite lokaler Augenreizungs- /Augenverätzungswirkungen repräsentieren, die auf den Ergebnissen des Invivo-Kaninchenaugentests basieren (TG 405) (d. h. Kategorien 1, 2A, 2B oder "nicht eingestuft und nicht gekennzeichnet" nach dem UN-GHS-System (3) (7). Angesichts der validierten Eignung dieser Tests (d. h. Tests zur ausschließlichen Identifizierung augenverätzender/stark augenreizender Stoffe) kann die Kompetenz des Labors jedoch nur anhand von zwei Klassifizierungsergebnissen (verätzend/stark reizend oder nicht verätzend/schwach reizend) demonstriert werden. Weitere Auswahlkriterien betrafen die Erhältlichkeit der Stoffe im Handel, die Verfügbarkeit hochwertiger Invivo-Referenzdaten und das Vorhandensein hochwertiger Daten aus zwei Invitro-Methoden, für die zurzeit Testrichtlinien erarbeitet werden. Aus diesem Grunde wurden die Reizstoffe aus der von der ICCVAM empfohlenen Liste von 122 Referenzsubstanzen für die Validierung von Invitro-Prüfmethoden zur Untersuchung auf okulare Toxizität ausgewählt (siehe Anhang H: von ICCVAM empfohlene Referenzsubstanzen) (4). Referenzdaten können aus den Background Review Documents der ICCVAM für die BCOP-Prüfmethode (Test an der isolierten Rinderhornhaut) und die ICE-Prüfmethode bezogen werden (18) (19).
Tabelle 1 Empfohlene Stoffe für die Demonstration der technischen Kompetenz von Laboratorien zur Durchführung des ICE
| Stoff | CAS-Nr. | Chemikalien- klasse 1 | Physikalischer Zu- stand | Invivo-Klassifizie- rung 2 | Invitro-Klassifizierung 3 |
| Benzalkoniumchlorid (5 %) | 8001-54-5 | Oniumverbindung | flüssig | Kategorie 1 | verätzend/stark reizend |
| Chlorhexidin | 55-56-1 | Amin, Amidin | fest | Kategorie 1 | verätzend/stark reizend |
| Dibenzoyl-D-Wein- säure | 2743-38-6 | Carbonsäure, Ester | fest | Kategorie 1 | verätzend/stark reizend |
| Imidazol | 288-32-4 | heterocyclisch | fest | Kategorie 1 | verätzend/stark reizend |
| Trichloressigsäure (30 %) | 76-03-9 | Carbonsäure | flüssig | Kategorie 1 | verätzend/stark reizend |
| 2,6-Dichlorbenzoyl- chlorid | 4659-45-4 | Acylhalolenid | flüssig | Kategorie 2A | Nicht verätzend/schwach reizend |
| Ethyl-2-methylaceto- acetat | 609-14-3 | Ketone, Ester | flüssig | Kategorie 2B | Nicht verätzend/schwach reizend |
| Ammoniumnitrat | 6484-52-2 | Anorganisches Salz | fest | Kategorie 2A | Nicht verätzend/schwach reizend |
| Glyzerin | 56-81-5 | Alkohol | flüssig | Nicht einge- stuft | Nicht verätzend/schwach reizend |
| n-Hexan | 110-54-3 | Kohlenwasserstoff (acyclisch) | flüssig | Nicht einge- stuft | Nicht verätzend/schwach reizend |
| Abkürzungen:
CAS-Nr. = Registrierungsnummer des Chemical Abstracts Service
1) Jede Prüfsubstanz wurde anhand einer Standard-Klassifizierungsregelung auf Basis des Klassifizierungssystems der National Library of Medicine Medical Subject Headings (MeSH) einer Chemikalienklasse zugeordnet (abrufbar über http//www.nlm.nih.gov/mesh). 2) gestützt auf Ergebnisse aus dem Invivo-Kaninchenaugentest (OECD TG 405) unter Verwendung des UN-GHS-Klassifizierungssystems (3)(7). 3) gestützt auf Ergebnisse der BCOP- und ICE-Prüfmethoden. | |||||
| Schaubilder des ICE-Superfusionsgeräts und der ICE-Augenklemmen | Anlage 3 |
(Siehe Burton et al. (17) für weitere generische Beschreibungen von Superfusionsgeräten und Augenklemmen)

 | ENDE |
...
X
⍂
↑
↓
