

umwelt-online: Verordnung (EU) 2016/266 zur Änderung der Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der Verordnung (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) zwecks Anpassung an den technischen Fortschritt (4)
 | zurück |  |
C.38. Der Amphibien-Metamorphose-Assay (AMA)
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 231 (2009). Angesichts des Risikos, dass in der Umwelt vorhandene Chemikalien Menschen und wild lebende Pflanzen und Tiere beeinträchtigen könnten, muss eine Prüfung zum Nachweis von auf das Schilddrüsensystem von Vertebraten wirkenden Chemikalien entwickelt und validiert werden. 1998 hat die OECD eine prioritäre Aktivität zur Änderung bestehender technischer Leitlinien zum Screening und zum Testen von Chemikalien mit potenziell endokriner Wirkung initiiert. Ein Element dieser Aktivität bestand in der Entwicklung einer technischen Leitlinie für das Screening von Chemikalien, die auf das Schilddrüsensystem von Wirbeltierarten wirken. Vorgeschlagen wurde eine zum einen die Überarbeitung der Studie zur Toxizität bei Nagetieren nach wiederholter 28-tägiger oraler Gabe (Kapitel B.7 in diesem Anhang) und zum anderen die Entwicklung des Amphibien-Metamorphose-Assays (AMA). Die überarbeitete Prüfmethode B.7 wurde einer Validierung unterzogen und anschließend veröffentlicht. Der Amphibien-Metamorphose-Assay (AMA) wurde ebenfalls in einem umfassenden Validierungsprogramm mit Intra- und Interlaborstudien untersucht, in denen die Relevanz und die Zuverlässigkeit des Tests nachgewiesen wurden (1, 2). Anschließend wurde der Test einem Peer-Review durch eine Gruppe unabhängiger Experten unterzogen (3). Diese Prüfmethode beruht auf den Erfahrungen aus Validierungsstudien zum Nachweis von auf die Schilddrüse wirkenden Chemikalien und auf Arbeiten in anderen OECD-Mitgliedsländern.
2. Der Amphibien-Metamorphose-Assay (AMA) ist ein Test zur empirischen Bestimmung von Chemikalien, die das normale Funktionieren der Hypothalamus-Hypophysen-Schilddrüsen-Achse (HPT-Achse) beeinträchtigen können. Der AMA stellt ein generalisiertes Vertebratenmodell dar, das auf den konservierten Strukturen und Funktionen der HPT-Achse beruht. Der Test ist deshalb von Bedeutung, weil die Metamorphose von Amphibien einen gut untersuchten schilddrüsenbezogenen Prozess darstellt, der auf in der HPT-Achse wirksame Chemikalien reagiert. Außerdem ist dieser Test der einzige Test mit dem thyroidale Aktivität in einem Tier während der Metamorphose nachgewiesen werden kann.
3. Das allgemeine Prüfprotokoll sieht die Exposition von Krallenfrosch-Larven (Xenopus-laevis) des Stadiums 51 durch mindestens drei verschiedene Konzentrationen einer Prüfchemikalie und eine Verdünnungswasserkontrolle über einen Zeitraum von 21 Tagen vor. Für jede Prüfkonzentration werden vier Replikate verwendet. Zu Beginn des Tests werden bei allen Behandlungsgruppen 20 Larven pro Prüfbecken eingesetzt. Als Endpunkte werden die Länge der Hinterbeine, die Kopf-Rumpf-Länge, das Entwicklungsstadium, die Feuchtmasse, die Histologie der Schilddrüse und die tägliche Mortalität erfasst.
Prüfspezies
4. Der Krallenfrosch (Xenopus laevis) wird weltweit in Labors kultiviert und ist im Handel ohne Weiteres zu beschaffen. Bei dieser Art kann die Reproduktion ganzjährig leicht durch Injektionen von humanem Choriongonadotropin (hCG) angeregt werden; die entstehenden Larven können in großer Anzahl bis zu den gewünschten Entwicklungsstadien aufgezogen werden, die dann in auf bestimmte Stadien bezogenen Prüfprotokollen verwendet werden können. Die im Test zu verwendenden Larven sollten vorzugsweise von im jeweiligen Labor gezogenen adulten Tieren stammen. Alternativ (wenngleich nicht als bevorzugtes Verfahren) können auch Eier oder Embryos an die mit dem Test beauftragten Labors geschickt werden; in den Labors muss dann eine gewisse Akklimatisierungszeit vorgesehen werden. Der Versand von Larven ist bei diesem Test nicht annehmbar.
Ausrüstung und Verbrauchsmaterial
5. Zur Durchführung dieses Tests werden die folgende Ausrüstung und die folgenden Verbrauchsmaterialien benötigt:
Prüfbarkeit der Chemikalie
6. Der AMA beruht auf einem Protokoll zur Exposition in Wasser, bei dem die Prüfchemikalie über ein Durchflusssystem in die Becken geleitet wird. Mit Durchflusssystemen sind jedoch Einschränkungen hinsichtlich der Chemikalientypen verbunden, die geprüft werden können. Maßgeblich sind die jeweiligen physikalischen und chemischen Eigenschaften der Chemikalie. Vor der Anwendung dieses Protokolls sind daher grundlegende Informationen zur jeweiligen Chemikalie zu beschaffen, die für die Durchführbarkeit des Tests von Bedeutung sind. Außerdem ist das OECD Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures (4) zu konsultieren. Folgende Merkmale sind Anzeichen dafür, dass die betreffende Chemikalie in aquatischen Systemen vielleicht schwierig zu untersuchen ist: hohe Oktanol-Wasser-Verteilungskoeffizienten (log Kow), hohe Flüchtigkeiten, Hydrolyse- und Photolysetendenz im Labor bei Umgebungsbeleuchtung. Ob Chemikalien geprüft werden können, hängt unter Umständen noch von weiteren Faktoren ab, die im Einzelfall ebenfalls zu berücksichtigen sind. Wenn die zu untersuchende Chemikalie mit einem Durchflusssystem nicht getestet werden kann, ist vielleicht ein System mit statischer Exposition geeignet. Kommt bei einer Chemikalie keine dieser beiden Möglichkeiten in Betracht, kann die Chemikalie mit diesem Protokoll nicht geprüft werden.
Expositionssystem
7. Vorzugsweise ist ein Durchflusssystem zu verwenden. Wenn die physikalischen und/oder chemischen Eigenschaften einer Prüfchemikalie die Verwendung eines Durchflusssystems nicht zulassen, kann ein alternatives Expositionssystem (z.B. ein System mit statischer Exposition) eingesetzt werden. Bestandteile des Systems, die mit Wasser in Berührung kommen, müssen aus Glas, Edelstahl und/oder Polytetrafluorethylen bestehen. Wenn die Untersuchungsergebnisse nicht beeinträchtigt werden, kann alternativ auch geeignetes Kunststoffmaterial verwendet werden. Als Expositionsbecken sind Glas- oder Edelstahlaquarien mit Standrohren, einem Volumen zwischen 4,0 und 10,0 l und einer Wassertiefe von mindestens 10-15 cm zu verwenden. Das System muss für sämtliche Expositionskonzentrationen und eine Kontrolle sowie vier Replikate pro Behandlung ausgelegt sein. Der Durchfluss in die einzelnen Becken muss konstant sein; dabei sind sowohl die Aufrechterhaltung der biologischen Bedingungen als auch die Exposition durch die Chemikalie zu berücksichtigen (z.B. 25 ml/min). Die Becken mit den Prüfkonzentrationen sind im Expositionssystem randomisiert aufzustellen, um Beeinflussungen infolge der Aufstellung zu reduzieren (u. a. geringfügige Unterschiede in Temperatur oder Lichtintensität). Mit Leuchtstofflampen wird eine Photoperiode von 12 h Licht: 12 h Dunkelheit mit einer Intensität von 600-2.000 lx (Lumen/m2) auf der Wasseroberfläche eingestellt. In den Becken müssen eine Wassertemperatur von 22 ± 1 °C und ein pH-Wert von 6,5-8,5 aufrechterhalten werden; die Konzentration an gelöstem Sauerstoff in den Becken mit den verschiedenen Prüfkonzentrationen muss > 3,5 mg/l betragen ( > 40 % der Luftsättigung). Mindestens die Wassertemperatur, der pH-Wert und der Anteil an gelöstem Sauerstoff sind wöchentlich zu messen. Die Temperatur sollte vorzugsweise in mindestens einem Prüfgefäß kontinuierlich gemessen werden. In Anlage 1 werden die Versuchsbedingungen des Prüfprotokolls beschrieben. Weitere Informationen zum Aufbau von Durchfluss-Expositionssystemen und/oder von Systemen mit statischer Erneuerung sind dem ASTM Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians (5) sowie den Beschreibungen allgemeiner aquatischer Toxizitätsprüfungen zu entnehmen.
Wasserqualität
8. Für den Test kann beliebiges vor Ort verfügbares Wasser (z.B. Quellwasser oder mit Aktivkohle gefiltertes Leitungswasser) verwendet werden, bei dem Krallenfrosch-Larven normal wachsen und sich entwickeln. Da die Wasserqualität je nach Standort von Region zu Region sehr unterschiedlich sein kann, ist die Wasserqualität insbesondere dann zu analysieren, wenn keine historischen Daten über die Verwendbarkeit des Wassers für die Aufzucht von Krallenfröschen verfügbar sind. Besonders ist darauf zu achten, dass das Wasser frei von Kupfer, Chlor und Chloraminen ist; da diese Chemikalien für Frösche und Kaulquappen giftig sind. Außerdem wird empfohlen, das Wasser auf eine Grundbelastung durch Fluorid, Perchlorat und Chlorat (bei der Desinfektion von Trinkwasser entstehende Nebenprodukte) zu untersuchen, da es sich bei den betreffenden Anionen um Substrate des Jodtransports der Schilddrüse handelt, die in erhöhten Konzentrationen das Ergebnis der Studie beeinflussen können. Die Analysen sind vor Beginn der Tests vorzunehmen. Im für den Test vorgesehenen Wasser sollten die genannten Anionen nicht enthalten sein.
Jodkonzentration des Testwassers
9. Damit die Schilddrüse Hormone synthetisieren kann, muss für die Larven im Wasser und im Futter ausreichend Jod verfügbar sein. Gegenwärtig liegen keine empirisch ermittelten Leitlinien für mindestens erforderliche Jodkonzentrationen vor. Die Jodverfügbarkeit kann jedoch die Empfindlichkeit verändern, mit der das Schilddrüsensystem auf Wirkstoffe reagiert, die auf die Schilddrüse wirken. Es ist bekannt, dass Jod die Grundaktivität der Schilddrüse beeinflusst; dies ist bei der Auswertung der Ergebnisse histopathologischer Untersuchungen der Schilddrüse zu beachten. Daher sind Jodkonzentrationen, die in dem für den Test vorgesehenen Wasser gemessen wurden, zu protokollieren. Den verfügbaren Daten aus den Validierungsstudien zufolge hat sich das Protokoll bei Jodkonzentrationen (I-) zwischen 0,5 und 10 µg/l im Testwasser als geeignet erwiesen. Im Idealfall sollte die minimalste Jodkonzentration im zu verwendenden Wasser bei 0,5 µg/l liegen. Wenn das Testwasser aus entionisiertem Wasser rekonstituiert wird, muss Jod in einer Konzentration von mindestens 0,5 µg/l hinzugegeben werden. Jegliche weitere Zugabe von Jod oder sonstigen Salzen zum Testwasser ist im Bericht zu vermerken.
Hälterung der Tiere
Hälterung der adulten Tiere und Zucht
10. Die Hälterung der adulten Tiere und die Zucht erfolgen entsprechend den Standardleitlinien. Weitere Informationen sind der Standardanleitung zur Durchführung des Froschembryo-Teratogeneseassay-Xenopus (Fetax) (6) zu entnehmen. Diese Standardleitlinien sind ein Beispiel für geeignete Haltungs- und Zuchtverfahren; eine strenge Befolgung ist aber nicht erforderlich. Um die Laichreifung zu induzieren, wird Paaren (3-5) von adulten weiblichen und männlichen Tieren humanes Choriongonadotropin (hCG) injiziert. Weiblichen und männlichen Exemplaren werden etwa 800 IU-1.000 IU bzw. 600 IU-800 IU hCG gelöst in 0,6- bis 0,9 %iger Salzlösung gespritzt. Die Zuchtpaare werden in großen Becken ohne Störungen unter statischen Bedingungen gehalten, um den Amplexus zu fördern. Die Unterseite der Brutbecken sollte jeweils einen Zwischenboden aus Edelstahl- oder Kunststoffgitter enthalten, durch den der Laich auf den Boden des Beckens sinken kann. Frösche, die am späten Nachmittag eine Injektion erhalten haben, laichen meist am Vormittag des Folgetages. Nachdem eine hinreichende Anzahl an Eiern abgelegt und befruchtet wurden, sind die adulten Tiere aus den Brutbecken zu nehmen.
Versorgung und Auswahl der Larven
11. Nachdem die adulten Tiere aus den Brutbecken genommen wurden, werden die Eier entnommen und anhand einer repräsentativen Teilprobe der Embryos aus allen Brutbecken hinsichtlich ihrer Lebensfähigkeit beurteilt. Der beste Laich (möglichst sollten 2-3 Laichproben auf ihre Qualität untersucht werden) wird aufbewahrt; die Qualität des Laichs wird anhand der zu erwartenden Lebensfähigkeit der Embryos und einer angemessenen Anzahl von Embryos (mindestens 1.500) beurteilt. Alle in der Studie verwendeten Tiere sollten aus einem einzigen Laich stammen; der abgelegte Laich darf also nicht gemischt werden. Die Embryos werden in eine große flache Schale oder Schüssel gegeben, und alle offensichtlich toten oder anomal ausgebildeten Eier (siehe Definition in (5)) werden mit einer Pipette entfernt. Die gesunden Embryos aus den drei Gelegen werden in drei getrennte Brutbecken gesetzt. Vier Tage nach dem Einsetzen in die Brutbecken wird der gemessen an seiner Lebensfähigkeit und der Anzahl der geschlüpften Tiere beste Laich ausgewählt, und die Larven werden in eine geeignete Anzahl an Aufzuchtbecken mit einer Temperatur von 22 ± 1 °C gesetzt. Außerdem werden einige zusätzliche Larven in weitere Becken gesetzt, die verwendet werden können, wenn in der ersten Woche Tiere in den Aufzuchtbecken sterben. So können die Besatzdichte aufrechterhalten und Entwicklungsunterschiede innerhalb der Kohorte eines einzigen Laichs reduziert werden. Alle Aufzuchtbecken sind täglich durch Absaugen zu reinigen. Vorsichtshalber sollten keine Latexhandschuhe, sondern Handschuhe aus Vinyl oder Nitril verwendet werden. In der ersten Woche werden tote Larven täglich entfernt und durch neue Larven ersetzt, um die Besatzdichte aufrechtzuerhalten. Die Fütterung muss mindestens zweimal täglich erfolgen.
12. Vor der Exposition werden die Larven (Kaulquappen) an die Bedingungen der eigentlichen Testphase gewöhnt (Futtertyp, Temperatur, Photoperiode und Kulturmedium). Daher sollte in der Phase vor der Exposition dasselbe Kultur-/Verdünnungswasser verwendet werden wie in der Expositionsphase. Wenn die Larven vor der Exposition in einer statischen Kultur gehalten werden, ist das Kulturmedium mindestens zweimal wöchentlich vollständig zu ersetzen. Eine überhöhte Besatzdichte infolge einer zu großen Anzahl an Larven in der Phase vor der Exposition ist zu vermeiden, weil dies die Entwicklung der Larven während der anschließenden Testphase deutlich beeinträchtigen könnte. Daher sollte eine Besatzdichte von etwa 4 Larven/l Kulturmedium (statisches Expositionssystem) bzw. 10 Larven/l Kulturmedium (bei einem Durchfluss von z.B. 50 ml/min vor der Exposition bzw. im Kultursystem) nicht überschritten werden. Unter diesen Bedingungen sollten sich die Larven innerhalb von zwölf Tagen von den Stadien 45/46 bis zu Stadium 51 entwickeln. Repräsentative Larven dieser Stammpopulation sind täglich hinsichtlich ihres Entwicklungsstadiums zu prüfen, um den ungefähren Zeitpunkt für den Beginn der Exposition abschätzen zu können. Es ist sorgfältig darauf zu achten, dass Belastungen und Verletzungen der Larven minimiert werden, insbesondere beim Umsetzen der Larven, beim Reinigen der Aquarien und der Handhabung mit den Larven. Belastende Umgebungsbedingungen/Maßnahmen sind zu vermeiden (beispielsweise hoher und/oder kontinuierlicher Lärm, Klopfen an die Aquarien, Schwingungen in den Aquarien, übermäßige Aktivität im Labor und rasche Änderungen der Umgebungsbedingungen (Beleuchtung, Temperatur, pH-Wert, gelöster Sauerstoff, Wasserdurchfluss usw.)). Wenn die Larven innerhalb von 17 Tagen nach der Befruchtung Stadium 51 nicht erreicht haben, ist dies möglicherweise auf übermäßige Stressbelastung zurückzuführen.
Kultivierung und Füttern der Larven
13. Während der gesamten Phase vor der Exposition (nach Nieuwkoop und Faber (NF) Stadium 45/46) (8) und während der gesamten Testdauer von 21 Tagen werden die Larven. mit handelsüblichem Larvenfutter (z.B. Sera Micron ®) versorgt (siehe Anlage 1); alternativ kann auch ein sonstiges Futter verwendet werden, das sich für die Durchführung des Amphibien-Metamorphose-Assays in gleichwertiger Weise als geeignet erwiesen hat. Das Fütterungsprotokoll in der Phase vor der Exposition ist sorgfältig auf den Bedarf der sich entwickelnden Larven abzustimmen. Frisch geschlüpften Larven sind also mehrmals täglich (mindestens zweimal) kleinere Futtermengen anzubieten. Es darf jedoch nicht zu viel Futter bereitgestellt werden; ansonsten i) wird die Wasserqualität beeinträchtigt, und ii) führen Futterpartikel und Detritus zum Verstopfen der Kiemen. Die tägliche Futtermenge ist entsprechend dem Wachstum der Larven bis auf etwa 30 mg/Tier/Tag kurz vor Beginn des Tests zu erhöhen. Das im Handel erhältliche Futter hat sich in den Validierungsstudien als geeignet erwiesen, um ein angemessenes Wachstum und eine angemessene Entwicklung von X.-laevis-Larven zu ermöglichen. Es besteht aus feinen Partikeln, die in der Wassersäule lange Zeit gelöst bleiben und mit dem Durchfluss ausgewaschen werden. Daher ist die gesamte tägliche Futtermenge auf kleinere Portionen zu verteilen, die mindestens zweimal täglich verabreicht werden. Das Fütterungsprotokoll für dieses Futter ist Tabelle 1 zu entnehmen. Die Futtermenge wird protokolliert. Das Futter kann trocken oder als mit Verdünnungswasser hergestellte Stammlösung verabreicht werden. Diese Stammlösung wird jeden zweiten Tag frisch zubereitet und bei 4 °C gelagert.
Tabelle 1: Fütterungsprotokoll bei handelsüblichem Larvenfutter (z.B. Sera Micron ®) in den Validierungsstudien mit X.-laevis-Larven während der Invivo-Phase des AMA mit einem Durchflusssystem
| Studientag | Futtermenge (mg Futter/Tier/Tag) |
| 0-4 | 30 |
| 5-7 | 40 |
| 8-10 | 50 |
| 11-14 | 70 |
| 15-21 | 80 |
Analytik
14. Vor der Durchführung einer Studie muss die Stabilität der Prüfchemikalie ermittelt werden. Dazu sind die verfügbaren Informationen über die Löslichkeit, die Abbaubarkeit und die Flüchtigkeit zu verwenden. Aus den Becken mit den Replikaten in den verschiedenen Konzentrationen werden zu Beginn des Tests (Tag 0) sowie während des Tests wöchentlich mindestens vier Proben der Testlösungen für chemische Analysen entnommen. Außerdem sollten die einzelnen Prüfkonzentrationen während der Vorbereitung des Systems vor Beginn des Tests analysiert werden, um das Systemverhalten zu prüfen. Ferner wird empfohlen, die Stammlösungen beim Wechseln zu analysieren, insbesondere wenn das Volumen der Stammlösung die Chemikalie nicht in hinreichender Menge für die gesamte Dauer der regelmäßigen Probenahmen enthält. Wenn Chemikalien in einzelnen oder allen im Test verwendeten Konzentrationen nicht nachgewiesen werden können, sind die Stammlösungen zu messen und die Durchflussraten des Systems zu protokollieren, um die nominellen Konzentrationen berechnen zu können.
Applikation der Chemikalie
15. Die Prüfchemikalie kann je nach physikalisch-chemischen Eigenschaften auf unterschiedliche Weise in das Prüfsystem eingebracht werden. Wasserlösliche Chemikalien können in Aliquoten des Testwassers in einer Konzentration gelöst werden, mit der die für den Test vorgesehene Zielkonzentration in einem Durchflusssystem erreicht wird. Chemikalien, die bei Raumtemperatur flüssig sind und sich nur beschränkt in Wasser lösen, können über Flüssig:Flüssig-Sättigungssäulen zugeführt werden. Chemikalien, die bei Raumtemperatur fest sind und sich nur beschränkt in Wasser lösen, können über Sättigungssäulen mit Glaswolle eingebracht werden (7). Vorzugsweise ist ein trägerfreies Prüfsystem zu verwenden; die Prüfchemikalien haben jedoch unterschiedliche physikalisch-chemische Eigenschaften, die wahrscheinlich unterschiedliche Ansätze bei der chemischen Aufbereitung des Wassers erfordern. Aus den folgenden Gründen sollten vorzugsweise weder Lösungsmittel noch Träger verwendet werden: i) Bestimmte Lösungsmittel können ihrerseits toxisch wirken und/oder unerwünschte oder unerwartete endokrine Reaktionen auslösen; ii) die Prüfung von Chemikalien oberhalb ihrer Wasserlöslichkeit (was bei Verwendung von Lösungsmitteln häufig vorkommt) kann die Genauigkeit beeinträchtigen, mit der die wirksamen Konzentrationen ermittelt werden; und iii) die Verwendung von Lösungsmitteln in länger dauernden Tests kann aufgrund der Aktivität von Mikroorganismen zur Entwicklung erheblicher "Biofilme" führen. Bei schwierig zu testenden Chemikalien kann, wenn unbedingt erforderlich, ein Lösungsmittel eingesetzt werden. Zur Ermittlung der besten Methode ist das OECD Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures zu konsultieren (4). Welches Lösungsmittel zu verwenden ist, hängt von den chemischen Eigenschaften der Chemikalie ab. Bei aquatischen Toxizitätstests haben sich u. a. Aceton, Ethanol, Methanol, Dimethylformamid und Triethylen- Glykol als wirksam erwiesen. Wenn ein Lösungsmittel verwendet wird, müssen die Lösungsmittelkonzentrationen unter der chronischen höchsten geprüften Konzentration ohne beobachtete schädliche Wirkung (NOEC) liegen; die OECD-Leitlinie empfiehlt höchstens 100 µl/l. In einer kürzlich veröffentlichten Änderung wird eine Lösungsmittelkonzentration von nur 20 µl/l Verdünnungswasser empfohlen (12). Wenn Lösungsmittel verwendet werden, sind zusätzlich zu den Kontrollen ohne Lösungsmittel auch geeignete Lösungsmittelkontrollen zu untersuchen (sauberes Wasser). Kann eine Chemikalie nicht mit Wasser zugeführt werden (entweder aufgrund der physikalisch-chemischen Merkmale (geringe Löslichkeit) oder wegen der eingeschränkten chemischen Verfügbarkeit), kann eine Verabreichung mit dem Futter in Betracht gezogen werden. Zur Verabreichung über das Futter wurden zwar Untersuchungen durchgeführt; dieser Expositionspfad ist allgemein aber nicht üblich. Die ausgewählte Methode ist zu dokumentieren und analytisch zu verifizieren.
Auswahl der Prüfkonzentrationen
Bestimmung der höchsten Prüfkonzentration
16. Bei diesem Test sollte die höchste Konzentration der Löslichkeitsgrenze der Prüfchemikalie, - bei akut toxischen Chemikalien - der höchsten noch verträglichen Konzentration (Maximum Tolerated Concentration = MTC) oder 100 mg/l entsprechen; maßgeblich ist die jeweils niedrigste Konzentration.
17. Als MTC wird die höchste Prüfkonzentration der Chemikalie bezeichnet, bei der die akute Mortalität weniger als 10 % beträgt. Dieser Ansatz geht davon aus, dass empirische Daten zur akuten Mortalität vorliegen, nach denen die MTC bestimmt werden kann. Die Abschätzung der MTC ist unter Umständen ungenau und setzt in der Regel einschlägige Erfahrung voraus. Die Verwendung von Regressionsmodellen dürfte der technisch solideste Ansatz für die Bestimmung der MTC sein. Eine brauchbare Abschätzung der MTC kann aber auch auf vorhandenen akuten Daten beruhen. In diesem Fall ist 1/3 des akuten LC50-Werts anzunehmen. Für die im Test verwendete Art liegen allerdings vielleicht keine Daten zur akuten Toxizität vor. Wenn für eine Art keine Daten zur akuten Toxizität verfügbar sind, kann ein auf 96 Stunden angelegter Test zur Ermittlung des LC50-Werts mit repräsentativen Larven (d. h. mit Larven aus demselben Stadium wie die für den AMA zu verwendenden Larven) durchgeführt werden. Wenn Daten anderer aquatischer Arten verfügbar sind (z.B. ermittelte LC50-Werte bei Fischen oder sonstigen Amphibienarten), kann die wahrscheinliche MTC mit entsprechender Erfahrung durch Extrapolation auf andere Arten bestimmt werden.
18. Wenn die Chemikalie nicht akut toxisch und bei einer Konzentration über 100 mg/l löslich ist, wird die Konzentration von 100 mg/l als höchste Prüfkonzentration (HTC = Highest Test Concentration) betrachtet, da diese Konzentration in der Regel als ,praktisch ungiftig" angesehen wird.
19. Methoden zur statischen Erneuerung werden zwar nicht empfohlen, können aber verwendet werden, wenn die MTC mit Durchflussmethoden nicht erreicht werden kann. Wenn Methoden zur statischen Erneuerung zur Anwendung kommen, ist die Stabilität der Konzentration der Prüfchemikalie zu dokumentieren; die Konzentration muss innerhalb der Grenzwerte der Leistungskriterien erhalten werden. Zu empfehlen ist eine Erneuerung alle 24 Stunden: Erneuerungsperioden von über 72 Stunden sind nicht annehmbar. Außerdem müssen jeweils am Ende der Erneuerungsperioden unmittelbar vor der Erneuerung Parameter für die Wasserqualität (beispielsweise gelöster Sauerstoff, Temperatur oder pH-Wert) gemessen werden.
Prüfkonzentrationsbereich
20. Es werden mindestens drei Prüfkonzentrationen und eine Kontrolle mit sauberem Wasser (sowie erforderlichenfalls eine Kontrolle mit Lösungsmittel) benötigt. Die höchste und die niedrigste Prüfkonzentration müssen sich mindestens um eine Größenordnung unterscheiden. Der Abstandsfaktor der Dosierungen darf höchstens 0,1 und muss mindestens 0,33 sein.
Beginn und Durchführung der Prüfung
Tag 0
21. Die Exposition wird begonnen, wenn in der noch nicht der Prüfchemikalie ausgesetzten Stammpopulation eine hinreichende Anzahl an Larven Entwicklungsstadium 51 (nach Nieuwkoop und Faber) (8) erreicht hat und höchstens 17 Tage nach der Befruchtung vergangen sind. Zur Auswahl der Testtiere werden gesunde und normal aussehende Larven der Stammpopulation in einem Gefäß mit einer geeigneten Menge an Verdünnungswasser gepoolt. Zur Bestimmung des Entwicklungsstadiums müssen die Larven mit einem kleinen Netz oder einem Sieb einzeln aus dem Sammelbecken entnommen und in eine durchsichtige Messkammer (z.B. eine 100-mm-Petrischale) mit Verdünnungswasser gegeben werden. Bei der Bestimmung des Stadiums sollte keine Betäubung vorgenommen werden; einzelne Larven können jedoch vor der Untersuchung mit 100 mg/l Tricainmethansulfonat (z.B. MS-222) betäubt werden, das in geeigneter Weise mit Natriumbicarbonat auf einen pH-Wert von 7,0 gepuffert wurde. Wenn das Betäubungsmittel MS-222 angewandt wird, sollten Informationen über die richtige Anwendung bei erfahrenen Labors eingeholt werden. Die Methode ist zusammen mit den Testergebnissen zu protokollieren. Beim Umsetzen sind die Tiere sorgfältig zu behandeln, um Stressbelastung während der Behandlung zu minimieren und um Verletzungen zu vermeiden.
22. Das Entwicklungsstadium der Tiere wird mit einem binokularen Präpariermikroskop bestimmt. Um die Unterschiede der Entwicklungsstadien zu minimieren, müssen die jeweiligen Entwicklungsstadien möglichst genau bestimmt werden. Nach Nieuwkoop und Faber (8) ist das wichtigste Anzeichen für das Erreichen von Stadium 41 die Morphologie der Hinterbeine. Die morphologischen Merkmale der Hinterbeine sind unter dem Mikroskop zu prüfen. Anhand auffälliger morphologischer Merkmale lässt sich das Stadium zuverlässig bestimmen, umfassende Informationen zur Bestimmung des Entwicklungsstadiums der Larven sind hingegen dem vollständigen Leitfaden von Nieuwkoop und Faber (8) zu entnehmen. Eine normale Entwicklung vorausgesetzt, kann mithilfe der folgenden Tabelle die Bestimmung der Entwicklungsstadien im gesamten Test vereinfacht und standardisiert werden, indem die auffälligen morphologischen Merkmale ermittelt werden, die mit den jeweiligen Stadien verbunden sind.
Tabelle 2: Auffällige morphologische Merkmale von Entwicklungsstadien nach der Beschreibung von Nieuwkoopund Faber
| Auffällige morphologische Merkmale | Entwicklungsstadium | |||||||||||||||
| 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | |
| Hinterbeine | X | X | X | X | X | X | X | |||||||||
| Vorderbeine | X | X | X | X | X | |||||||||||
| Kraniofaziale Struktur | X | X | X | X | ||||||||||||
| Morphologie des Geruchs nervs | X | X | X | |||||||||||||
| Schwanzlänge | X | X | X | X | ||||||||||||
23. Bei Beginn des Tests müssen alle Larven das Stadium 51 erreicht haben. Das auffälligste morphologische Merkmal dieses Entwicklungsstadiums ist die Morphologie der Hinterbeine (siehe Abbildung 1).
Abbildung 1 Morphologie der Hinterbeine bei einer X.-laevis-Larve in Stadium 51

24. Neben dem Entwicklungsstadium kann für die Auswahl auch die Größe der Versuchstiere berücksichtigt werden. Dazu ist die gesamte Körperlänge (nicht die Kopf-Rumpf-Länge) an Tag 0 bei einer Unterprobe von etwa 20 Larven im NF-Stadium 51 zu messen. Nach der Berechnung der mittleren Körperlänge dieser Gruppe können Mindest- und Höchstwerte für die gesamte Körperlänge der Versuchstiere zuzüglich einer Toleranz von ± 3 mm festgelegt werden (Mittelwerte der gesamten Körperlänge im Bereich von 24,0-28,1 mm für Larven im Stadium 51). Das Entwicklungsstadium ist jedoch das Hauptkriterium dafür, ob die einzelnen Tiere für den Test verwendet werden können. Larven mit offensichtlichen groben Fehlbildungen oder Verletzungen sind vom Test auszuschließen.
25. Larven, die die oben beschriebenen Anforderungen an das Entwicklungsstadium erfüllen, werden in einem Becken mit sauberem Kulturwasser gehalten, bis die Bestimmung des Entwicklungsstadiums abgeschlossen ist. Nach der Bestimmung des Entwicklungsstadiums werden die Larven randomisiert auf die Expositionsbecken verteilt, bis sich in jedem Becken 20 Larven befinden. Danach werden die einzelnen Becken auf Tiere mit Auffälligkeiten (Verletzungen, ungewöhnliches Schwimmverhalten usw.) untersucht. Offensichtlich nicht gesunde Larven sind aus den Becken zu entfernen und durch frisch ausgewählte Larven aus dem Sammelbecken zu ersetzen.
Beobachtungen
26. Detailliertere Informationen über Verfahren zum Abschluss der Prüfung und zur Behandlung der Larven sind dem OECD Guidance Document on Amphibian Thyroid Histology (9) zu entnehmen.
Messungen an Tag 7
27. An Tag 7 werden aus jedem Prüfbecken fünf zufällig ausgewählte Larven pro Replikat entnommen. Das Randomisierungsverfahren muss gewährleisten, dass für alle Tiere die gleiche Auswahlwahrscheinlichkeit gegeben ist. Dies kann mit einem beliebigen Randomisierungsverfahren sichergestellt werden; allerdings müssen alle Larven entnommen werden. Nicht ausgewählte Larven werden wieder in das ursprüngliche Becken gesetzt. Die ausgewählten Larven werden getötet, indem sie (z.B.) in 150-200 mg/l MS-222 (mit Natriumbicarbonat auf pH 7,0 gepuffert) eingelegt werden. Die getöteten Larven werden mit Wasser abgespült und trockengetupft; anschließend wird das Körpergewicht mit einer Genauigkeit von 1 mg bestimmt. Bei den Larven werden jeweils die Länge der Hinterbeine, die Kopf-Rumpf-Länge und (mit einem Präpariermikroskop) das Entwicklungsstadium bestimmt.
Messungen an Tag 21 (Beendigung der Prüfung)
28. Am Ende der Prüfung (an Tag 21) werden die übrigen Larven aus den Prüfbecken entnommen und wie oben beschrieben getötet, indem sie (z.B.) in 150-200 mg/l MS-222 (mit Natriumbicarbonat auf pH 7,0 gepuffert) eingelegt werden. Die Larven werden mit Wasser abgespült und trockengetupft; anschließend wird das Körpergewicht mit einer Genauigkeit von 1 mg bestimmt. Für die Larven werden jeweils das Entwicklungsstadium, die Kopf-Rumpf-Länge und die Länge der Hinterbeine bestimmt.
29. Alle Larven werden zur anschließenden histologischen Untersuchung entweder als Ganzkörperproben oder als Kopfgewebe-Proben, einschließlich Unterkiefer, 48-72 Stunden in Davidson-Fixierlösung gelegt. Für die histologischen Untersuchungen sind insgesamt fünf Larven pro Replikatbecken zu entnehmen. Da die Höhe der follikulären Zellen vom Entwicklungsstadium abhängt (10), sollten für die histologische Untersuchung am besten möglichst Exemplare im gleichen Entwicklungsstadium verwendet werden. Um Exemplare im gleichen Entwicklungsstadium auszuwählen, sind sämtliche Larven zunächst einer Bestimmung des Entwicklungsstadiums zu unterziehen, bevor sie ausgewählt und anschließend zur Datenerfassung untersucht werden. Dieser Schritt ist erforderlich, weil aufgrund der normalen Entwicklungsunterschiede auch in den Becken mit den einzelnen Replikaten unterschiedliche Entwicklungsstadien erreicht werden.
30. Die für die histopathologischen Untersuchungen ausgewählten Tiere (n = 5 pro Replikat) sollten möglichst dem Median der Entwicklungsstadien der Kontrollen (gepoolte Replikate) entsprechen. Wenn sich in einzelnen Replikatbecken mehr als fünf Larven im betreffenden Stadium befinden, sind fünf Larven zufällig auszuwählen.
31. Wenn sich in Replikatbecken weniger als fünf Larven im betreffenden Stadium befinden, sind zufällig ausgewählte Larven des nächstniedrigeren oder -höheren Entwicklungsstadiums zu entnehmen (insgesamt bis zu fünf Larven pro Replikat). Vorzugsweise sollte die Entscheidung zur Untersuchung weiterer Larven aus dem nächsthöheren oder -niedrigeren Entwicklungsstadium auf einer Gesamtbewertung der Verteilung der Entwicklungsstadien in den Kontrollen und in den Becken mit den Prüfkonzentrationen beruhen. Wenn die Exposition eine Entwicklungsverzögerung bewirkt, sollten also zusätzliche Larven aus dem nächstniedrigeren Entwicklungsstadium verwendet werden. Bewirkt die Exposition eine schnellere Entwicklung, sollten zusätzliche Larven aus dem nächsthöheren Entwicklungsstadium verwendet werden.
32. Bei erheblichen Veränderungen in der Entwicklung der Larven infolge der Exposition gegenüber einer Prüfchemikalie gibt es unter Umständen keine Überschneidungen der Verteilung der verschiedenen Entwicklungsstadien bei den Becken mit den Prüfchemikalien mit dem berechneten Median der Entwicklungsstadien der Kontrollen. Nur in diesen Fällen ist der Auswahlprozess zu modifizieren, indem ein vom Median der Entwicklungsstadien der Kontrollen abweichendes Stadium verwendet wird, um für die histopathologische Untersuchung der Schilddrüse eine Entnahme von Larven mit übereinstimmenden Entwicklungsstadien zu erzielen. Zudem werden bei unbestimmten (d. h. asynchronen) Stadien von jedem Replikat fünf Larven zufällig zur histologischen Analyse ausgewählt. Die Entnahme von Larven, die sich nicht in einem dem Median der Entwicklungsstadien der Kontrolle entsprechenden Entwicklungsstadium befinden, ist zu protokollieren.
Bestimmung biologischer Endpunkte
33. Während der 21-tägigen Expositionsdauer werden primäre Endpunkte an den Tagen 7 und 21 gemessen; die Testtiere werden jedoch täglich einer visuellen Prüfung unterzogen. Tabelle 3 bietet einen Überblick über die Endpunkte der Messungen und die Zeitpunkte, zu denen Beobachtungen vorzunehmen sind. Detailliertere Informationen über technische Verfahren zur Messung von apikalen Endpunkten und von histologischen Untersuchungen sind den OECD-Leitfäden zu entnehmen (9).
Tabelle 3 Zeitpunkte der Beobachtungen zur Kontrolle primärer Endpunkte im AMA
| Apikale Endpunkte | Täglich | Tag 7 | Tag 21 |
| - Mortalität | · | ||
| - Entwicklungsstadium | · | · | |
| - Länge der Hinterbeine | · | · | |
| - Kopf-Rumpf-Länge | · | · | |
| - Feuchtmasse der Larven | · | · | |
| - Histologische Untersuchung der Schilddrüse | · |
Apikale Endpunkte
34. Das Entwicklungsstadium, die Länge der Hinterbeine, die Kopf-Rumpf-Länge und die Feuchtmasse sind die apikalen Endpunkte des AMA. Diese Endpunkte werden im Folgenden kurz erläutert. Weitere technische Informationen zur Erfassung dieser Daten sind den Leitfäden zu entnehmen, auf die in der Anlage verwiesen wird. Diese enthalten auch Informationen zur computergestützten Analyse. Die Berücksichtigung dieser Leitfäden ist zu empfehlen.
Entwicklungsstadium
35. Das Entwicklungsstadium der X.-laevis-Larven wird anhand der entsprechenden Kriterien von Nieuwkoop und Faber (8) bestimmt. Aufgrund von Daten zu den Entwicklungsstadien wird festgestellt, ob eine Entwicklung beschleunigt, asynchron oder verzögert verläuft oder nicht beeinträchtigt wird. Eine beschleunigte oder verzögerte Entwicklung ist aus einem Vergleich des Medians der Entwicklungsstadien der Kontrollen und der Gruppen mit den Prüfkonzentrationen zu erkennen. Eine asynchrone Entwicklung ist zu protokollieren, wenn die untersuchten Gewebe zwar keine Fehlbildungen oder Anomalien aufweisen, die relativen Zeitpunkte der Morphogenese oder der Entwicklung verschiedener Gewebe eines einzelnen Tieres aber uneinheitlich sind.
Länge der Hinterbeine
36. Die Differenzierung und das Wachstum der Hinterbeine werden durch Schilddrüsenhormone gesteuert und sind wesentliche Merkmale, die bereits für die Bestimmung des Entwicklungsstadiums herangezogen werden. Die Entwicklung der Hinterbeine wird bei der Bestimmung des Entwicklungsstadiums als qualitativer Aspekt berücksichtigt; hier wird sie jedoch als quantitativer Endpunkt betrachtet. Daher wird die Länge der Hinterbeine als Endpunkt gemessen, um Wirkungen auf die Schilddrüsenachse zu erkennen (Abbildung 2). Um eine konsistente Erfassung zu gewährleisten, wird immer die Länge des linken Hinterbeins ermittelt. Die Länge der Hinterbeine wird sowohl an Tag 7 als auch an Tag 21 des Tests gemessen. An Tag 7 wird die Länge bei gestrecktem Hinterbein gemessen, wie in Abbildung 2 dargestellt. An Tag 21 dagegen gestaltet sich die Messung der Hinterbeine wegen der Beugung der Beine schwieriger. An diesem Tag wird daher von der Körperwand aus über die Mittellinie des Beins und über alle Winkel gemessen. Änderungen der Hinterbeinlänge an Tag 7 werden auch dann als signifikant für eine potenzielle Aktivität der Schilddrüse betrachtet, wenn sie an Tag 21 nicht mehr auffallen. Die Längenmessungen werden anhand von Digitalfotos mithilfe einer Software zur Bildanalyse vorgenommen, wie im OECD Guidance Document on Amphibian Thyroid Histology (9) beschrieben.
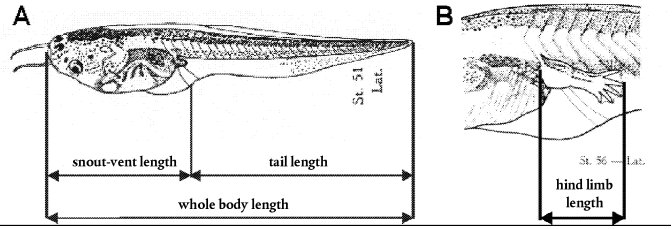
Körperlänge und Feuchtmasse
37. Im Prüfprotokoll ist die Messung der Kopf-Rumpf-Länge (KRL) (Abbildung 2) und der Feuchtmasse vorgesehen, um mögliche Wirkungen der Prüfchemikalien auf das Wachstum der Larven im Vergleich zur Kontrollgruppe beurteilen zu können. Außerdem ermöglichen die Messwerte den Nachweis einer allgemeinen Toxizität der Prüfchemikalie. Da die Entfernung des anhaftenden Wassers bei Gewichtsmessungen für die Larven belastend sein und die Haut der Larven beschädigt werden kann, werden die entsprechenden Messungen an Tag 7 nur an einer Unterprobe der Larven und erst am letzten Tag des Tests (Tag 21) an allen übrigen Larven vorgenommen. Bei der Messung wird regelmäßig das kraniale Ende der Kloake als caudale Begrenzung angenommen.
38. Das Wachstum der Larven wird anhand der Kopf-Rumpf-Länge (KRL) beurteilt (siehe Abbildung 2).
Abbildung 2 Verfahren zur Messung von (A) Körperlänge und (B) Hinterbeinlänge bei X.-laevis-Larven (1)
Histologische Untersuchung der Schilddrüse
39. Das Entwicklungsstadium und die Hinterbeinlänge sind wichtige Endpunkte bei der Bewertung expositionsbezogener Änderungen der Metamorphose. Eine Entwicklungsverzögerung an sich kann aber nicht als diagnostischer Indikator für eine antithyroidale Aktivität betrachtet werden. Einige Änderungen sind vielleicht nur in regelmäßigen histopathologischen Analysen feststellbar. Diagnosekriterien sind u. a. eine Hypertrophie/ Atrophie der Schilddrüse, eine Hypertrophie der follikulären Zellen, eine Hyperplasie der follikulären Zellen und als zusätzliche qualitative Kriterien: das Follikellumen, die Kolloidqualität und die Höhe/Form der follikulären Zellen. Die Symptome sind mit vier Schweregraden zu erfassen. Informationen über die Entnahme und die Behandlung von Proben für histologische Analysen sowie zur Durchführung histologischer Analysen von Gewebeproben sind den Veröffentlichungen ,Amphibian Metamorphosis Assay: Part 1 - Technical guidance for morphologic sampling and histological preparation' und ,Amphibian Metamorphosis Assay: Part 2 - Approach to reading studies, diagnostic criteria, severity grading and atlas' (9) zu entnehmen. Labors, die den Test zum ersten Mal durchführen, sollten sich von erfahrenen Pathologen schulen lassen, bevor sie selbst histologische Analysen und Untersuchungen der Schilddrüse vornehmen. Bei offensichtlichen und signifikanten Änderungen der apikalen Endpunkte, die auf eine beschleunigte Entwicklung oder eine Asynchronie schließen lassen, ist eine histopathologische Analyse der Schilddrüse unter Umständen nicht erforderlich. Sind allerdings keine offensichtlichen morphologischen Änderungen oder Entwicklungsverzögerungen erkennbar, müssen histologische Analysen vorgenommen werden.
Mortalität
40. Alle Prüfbecken sind täglich auf tote Larven zu prüfen, und für alle Becken ist jeweils die Anzahl der toten Larven zu protokollieren. Wenn Mortalitäten festgestellt werden, sind grundsätzlich Datum, Konzentration und Beckennummer zu vermerken. Bemerkte tote Tiere sind umgehend aus den Becken zu entfernen. Mortalitäten von mehr als 10 % können auf ungeeignete Testbedingungen oder toxische Wirkungen der Prüfchemikalie hindeuten.
Zusätzliche Beobachtungen
41. Anomales Verhalten und offensichtliche erhebliche Fehlbildungen und Läsionen sind zu protokollieren. Wenn diese festgestellt werden, sind grundsätzlich Datum, Konzentration und Beckennummer zu vermerken. Normal ist, wenn sich die Larven in der Wassersäule so bewegen, dass sich der Schwanz über dem Kopf befindet, die Schwanzflosse regelmäßig rhythmisch schlägt, die Tiere regelmäßig an die Wasseroberfläche kommen, durch die Kiemen atmen und auf Reize reagieren. Anomal wäre beispielsweise, wenn die Larven auf der Oberfläche treiben, am Boden des Beckens liegen, mit dem Bauch nach oben oder unregelmäßig schwimmen, nicht an die Oberfläche kommen und nicht auf Reize reagieren. Außerdem sind deutliche Unterschiede zwischen den verschiedenen Konzentrationen im Hinblick auf die Futteraufnahme zu protokollieren. Erhebliche Fehlbildungen und Läsionen sind etwa morphologische Anomalien (z.B. Fehlbildungen der Beine), blutende Läsionen oder durch Bakterien oder Pilze verursachte Infektionen, um nur einige Beispiele zu nennen. Die entsprechenden Beobachtungen sind qualitativer Art; sie sind klinischen Anzeichen für Krankheiten/Stressbelastung vergleichbar und in Relation zu den Tieren in den Kontrollen zu sehen. Wenn in den Becken mit der Prüfchemikalie Fehlbildungen oder Läsionen in größerem Umfang und häufiger auftreten als in den Kontrollen, ist dies als Beleg für eine offensichtliche Toxizität zu betrachten.
Datenerfassung
42. Alle Daten sind mit elektronischen Systemen oder manuell entsprechend der guten Laborpraxis (GLP) zu erfassen. Folgende Informationen sollten ermittelt werden:
Prüfchemikalie:
Prüfbedingungen:
Ergebnisse:
Berichtlegung
43. Anlage 2 enthält Tabellen zur täglichen Datenerfassung, die als Orientierung für die Eingabe von Rohdaten und für Berechnungen zusammenfassender Statistiken verwendet werden können. Außerdem werden Tabellen zur Eingabe zusammengefasster Endpunktdaten bereitgestellt. Tabellen für histologische Bewertungen sind Anlage 2 zu entnehmen.
Leistungskriterien und Annehmbarkeit/Validität des Tests
44. Bei erheblichen Abweichungen von der Prüfmethode sind die ermittelten Daten für Beurteilungen und für Berichte im Allgemeinen nicht annehmbar. Daher wurden die folgenden Kriterien (Tabelle 4) als Leitlinien zur qualitativen Bewertung der durchgeführten Tests und des allgemeinen Verhaltens der Kontrollorganismen entwickelt.
Tabelle 4. Leistungskriterien des AMA
| Kriterium | Annehmbare Grenzwerte |
| Prüfkonzentrationen | Kultivierung über eine Testdauer von 21 Tagen bei < 20 % VK (Variabilität der gemessenen Prüfkonzentration |
| Mortalität in Kontrollen | ≤ 10 % - In den Kontrollen darf die Mortalität zwei Larven pro Replikat nicht übersteigen. |
| Mindest-Medianwert der Entwicklungsstadien der Kon- trollen am Ende des Tests | 57 |
| Spanne der Entwicklungsstadien in der Kontrollgruppe | Das 10. und das 90. Perzentil der Verteilung der Entwicklungsstadien dürfen sich um höchstens vier Stadien unterscheiden. |
| Gelöster Sauerstoff | ≥ 40 % Luftsättigung * |
| pH-Wert | Der pH-Wert muss zwischen 6,5 und 8,5 gehalten werden. Die einzelnen Replikate/Konzentrationen dürfen sich höchstens um 0,5 unterscheiden. |
| Wassertemperatur | 22 ± 1 °C - Die einzelnen Replikate/Konzentrationen dürfen sich höchstens um 0,5 °C unterscheiden. |
| Prüfkonzentrationen ohne offensichtliche Toxizität | ≥ 2 |
| Leistungsfähigkeit der Replikate | Im gesamten Test dürfen nicht mehr als 2 Replikate beeinträchtigt sein. |
| Besondere Bedingungen bei Verwendung eines Lösungsmittels | Wenn ein Trägerlösungsmittel verwendet wird, sind jeweils eine Kontrolle mit dem Lösungsmittel und eine Kontrolle mit sauberem Wasser zu verwenden und die Ergebnisse zu protokollieren. |
| Statistisch signifikante Unterschiede zwischen den Kontrollgruppen mit dem Lösungsmittel und mit dem Wasser sind in besonderer Weise zu behandeln (s. u.). | |
| Besondere Bedingungen für statische Prüfsysteme | Repräsentative chemische Analysen vor und nach der Erneuerung sind im Bericht zu vermerken. |
| Unmittelbar vor der Erneuerung wird der Ammoniakgehalt gemessen. | |
| Unmittelbar vor der Erneuerung sind alle in Anlage 1 Tabelle 1 genannten Parameter für die Wasserqualität zu messen. | |
| Erneuerungen sind spätestens nach 72 Stunden vorzunehmen. | |
| Angemessenes Fütterungsprotokoll (50 % der täglichen Menge von handelsüblichem Larvenfutter (z.B. Sera Micron ®)) | |
| *) Die Belüftung des Wassers kann durch Sprudler erfolgen. Die Sprudler sind auf eine Intensität einzustellen, die die Larven nicht unnötig belastet. | |
Validität des Tests
45. Ein Test kann dann als annehmbar/gültig betrachtet werden, wenn die folgenden Anforderungen erfüllt sind: Ein valider Test ergibt hinsichtlich der Aktivität der Schilddrüse einen negativen Befund:
(1) Bei einer Konzentration der Prüfchemikalie (und in den Kontrollen) darf die Mortalität höchstens bei 10 % liegen. In allen Replikaten muss sich die Mortalität auf drei Larven beschränken; ansonsten ist das Replikat als beeinträchtigt zu betrachten.
(2) Für die Analysen müssen mindestens zwei Konzentrationen (sowie die betreffenden vier nicht beeinträchtigten Replikate) zur Verfügung stehen.
(3) Für die Analysen müssen zwei Konzentrationen ohne offensichtlich toxische Wirkung verfügbar sein.
Ein valider Test ergibt hinsichtlich der Aktivität der Schilddrüse einen positiven Befund:
(4) In der Kontrollgruppe muss sich die Mortalität auf zwei Larven/Replikate beschränken.
Entscheidungslogik des AMA
46. Die Entscheidungslogik wurde für den AMA entwickelt, um eine logische Struktur für die Durchführung des Bioassays und für die Interpretation der Ergebnisse bereitzustellen (siehe Flussdiagramm in Abbildung 3). In der Entscheidungslogik werden im Wesentlichen die Endpunkte gewichtet. Eine beschleunigte Entwicklung, eine asynchrone Entwicklung und die histopathologische Untersuchung der Schilddrüse werden stark gewichtet, während eine verzögerte Entwicklung, die Kopf-Rumpf-Länge und die Feuchtmasse als Parameter, die potentiell durch die Toxizität des Prüfstoffs beeinträchtigt werden könnten, weniger schwer gewichtet werden.
Abbildung 3 Entscheidungslogik des Amphibien-Metamorphose-Assays
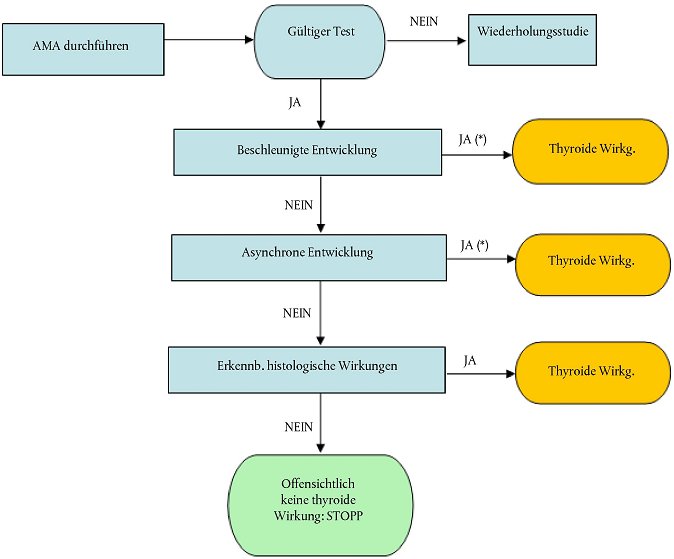
*) Zum Teil werden von zuständigen Behördenauch bei erheblichen Unterschieden in fortgeschrittenen Entwicklungsstadien und bei asynchroner histologischer Untersuchungen verlangt. Labors, die diesen Test vornehmen, sollten sich vor Durchführung des Tests bei den zuständigen Behörden erkundigen, welche Endpunkte verlangt werden.
Beschleunigte Entwicklung (anhand der Entwicklungsstadien sowie aufgrund der Kopf-Rumpf-Länge und der Hinterbeinlänge zu ermitteln)
47. Eine beschleunigte Entwicklung ist ausschließlich infolge von Effekten bekannt, die von Schilddrüsenhormonen verursacht werden. Sie kann bei peripheren Geweben auf eine unmittelbare Wechselwirkung mit dem Schilddrüsenhormonrezeptor (z.B. mit T4) oder auf Effekte zurückzuführen sein, die eine Änderung des Spiegels der zirkulierenden Schilddrüsenhormone nach sich ziehen können. In beiden Fällen wird dies als hinreichendes Anzeichen dafür betrachtet, dass die Chemikalie auf die Schilddrüse wirkt. Zur Feststellung einer beschleunigten Entwicklung bestehen zwei Möglichkeiten. Erstens kann das allgemeine Entwicklungsstadium nach dem von Nieuwkoop und Faber (8) beschriebenen Standardansatz bewertet werden. Zweitens können spezifische morphologische Merkmale quantifiziert werden z.B. die Hinterbeinlänge an den Tagen 7 und 21, die mit einer agonistischen Wirkung auf den Schilddrüsenhormonrezeptor in Zusammenhang steht. Wenn bei dem Test eine statistisch signifikant beschleunigte Entwicklung oder Veränderung der Länge der Hinterbeine festzustellen ist, ist dies ein Hinweis darauf, dass die Chemikalie auf die Schilddrüse wirkt.
48. Die Bewertung der Testtiere auf eine im Vergleich zur Kontrollpopulation beschleunigte Entwicklung beruht auf den Ergebnissen statistischer Analysen der folgenden vier Endpunkte:
49. Die statistischen Analysen der Hinterbeinlängen sind anhand der Länge des linken Hinterbeins vorzunehmen. Die Hinterbeinlänge wird entsprechend dem Verhältnis der Hinterbeinlänge zur Kopf-Rumpf-Länge eines Exemplars normalisiert. Danach wird der Mittelwert der normalisierten Werte der einzelnen Konzentrationen verglichen: Anzeichen für eine beschleunigte Entwicklung ist ein signifikanter Anstieg der mittleren Hinterbeinlänge (normalisiert) in der Behandlungsgruppe im Vergleich zur Kontrollgruppe an Tag 7 und/oder Tag 21 des Tests (siehe Anlage 3).
50. Die statistischen Analysen der Entwicklungsstadien werden vorgenommen, nachdem die Entwicklungsstadien aufgrund der von Nieuwkoop und Faber beschriebenen morphologischen Kriterien (8) bestimmt wurden. Eine beschleunigte Entwicklung ist dann gegeben, wenn an Tag 7 und/oder Tag 21 des Tests bei der multiquantalen Analyse ein signifikanter Anstieg der Werte eines Entwicklungsstadiums in einer Behandlungsgruppe festgestellt wird.
51. Beim AMA wird eine signifikante Wirkung auf einen der vier oben genannten Endpunkte als hinreichender Beleg für eine beschleunigte Entwicklung betrachtet. Signifikante Wirkungen auf die Hinterbeinlänge zu einem bestimmten Zeitpunkt müssen also nicht durch signifikante Wirkungen auf die Hinterbeinlänge zu anderen Zeitpunkten oder auf das Entwicklungsstadium zum betreffenden Zeitpunkt bestätigt werden. Im Umkehrschluss bedeutet das, dass signifikante Wirkungen auf das Entwicklungsstadium zu einem bestimmten Zeitpunkt nicht durch signifikante Wirkungen auf das Entwicklungsstadium zu anderen Zeitpunkten oder durch signifikante Wirkungen auf die Hinterbeinlänge zum betreffenden Zeitpunkt bestätigt werden müssen. Die Anzeichen für eine beschleunigte Entwicklung gewinnen jedoch an Bedeutung, wenn signifikante Wirkungen für mehrere Endpunkte festgestellt werden.
Asynchrone Entwicklung (ermittelt anhand von Kriterien zur Bestimmung des Entwicklungsstadiums)
52. Eine asynchrone Entwicklung ist durch die Störung des relativen Zeitpunkts der Morphogenese oder der Entwicklung unterschiedlicher Gewebe bei einer einzelnen Larve gekennzeichnet. Wenn das Entwicklungsstadium eines Organismus aufgrund der für ein bestimmtes Stadium als typisch betrachteten morphologischen Endpunkte nicht bestimmt werden kann, durchlaufen die Gewebe eine asynchrone Metamorphose. Eine asynchrone Entwicklung ist ein Anzeichen für eine thyroidale Aktivität. Die einzigen bekannten Wirkungen, die eine asynchrone Entwicklung verursachen können, sind Wirkungen von Chemikalien auf periphere Schilddrüsenhormone und/oder auf den Stoffwechsel der Schilddrüsenhormone bei der Ausbildung von Geweben, wie dies beispielsweise bei Deiodinaseinhibitoren zu beobachten ist.
53. Die Bewertung von Testtieren hinsichtlich einer asynchronen Entwicklung im Vergleich zur Kontrollpopulation beruht auf einer groben morphologischen Beurteilung der Testtiere an Tag 7 und an Tag 21 des Tests.
54. Die Beschreibung der normalen Entwicklung von Xenopus laevis durch Nieuwkoop und Faber (8) bietet den Rahmen für die Bestimmung der Abfolge einer normalen Gewebebildung. Der Begriff ,asynchrone Entwicklung' bezieht sich speziell auf die Abweichungen von der allgemeinen morphologischen Entwicklung der Larven, die die Bestimmung eines Entwicklungsstadiums nach den Kriterien von Nieuwkoop und Faber (8) unmöglich machen, weil wesentliche morphologische Merkmale unterschiedlichen Stadien zuzuordnen sind.
55. Entsprechend dem Wortsinn des Begriffs der ,asynchronen Entwicklung" sind nur die Fälle zu berücksichtigen, in denen hinsichtlich der Bildung bestimmter Gewebe im Vergleich zu anderen Geweben Unterschiede festzustellen sind. Einige klassische Phänotypen sind die verzögerte oder fehlende Entwicklung der vorderen Extremitäten trotz normaler oder sogar rascher voranschreitender Ausprägung der Hinterbeine und des Schwanzgewebes oder die vorzeitige Resorption der Kiemen gemessen an der Morphogenese der Hinterbeine und der Resorption des Schwanzes. Die Entwicklung eines Tieres wird dann als asynchron bewertet, wenn ein Tier keinem bestimmten Stadium zugeordnet werden kann, weil wesentliche Kriterien für ein Entwicklungsstadium nach Niewkoop und Faber (8) mehrheitlich nicht erfüllt sind oder weil die Ausprägung eines oder mehrerer wesentlicher Merkmale erheblich verzögert oder beschleunigt ist (z.B. Schwanz vollständig resorbiert, Vorderbeine aber noch nicht durchgebrochen). Bei der entsprechenden qualitativen Beurteilung sind sämtliche von Nieuwkoop und Faber (8) genannten Merkmale zu berücksichtigen. Die Entwicklungsstadien der verschiedenen wesentlichen beobachteten Merkmale der Tiere brauchen allerdings nicht protokolliert zu werden. Wenn bei einem Tier eine asynchrone Entwicklung festgestellt wurde, werden die Tiere keinem Entwicklungsstadium nach Nieuwkoop und Faber (8) zugeordnet.
56. Ein entscheidendes Kriterium für die Einstufung anomaler morphologischer Entwicklungen als 'asynchrone Entwicklung' ist eine Störung des relativen zeitlichen Verlaufs des Gewebeumbaus und der Morphogenese von Geweben ohne offensichtliche Anomalie der Morphologie der betreffenden Gewebe an sich. Eine erhebliche morphologische Anomalie ist beispielsweise gegeben, wenn die Morphogenese der Hinterbeine gemessen an der Entwicklung anderer Gewebe das Kriterium der 'asynchronen Entwicklung' erfüllt. Fehlende Hinterbeine, anomale Fehlentwicklung von Fingern oder Zehen (z.B. Ektrodaktylie oder Polydaktilie) oder sonstige offensichtliche Fehlbildungen der Extremitäten sind hingegen nicht als ,asynchrone Entwicklung" zu bewerten.
57. In diesem Zusammenhang gelten etwa die Morphogenese der Hinter- und der Vorderbeine, der Durchbruch der Vorderbeine, das Stadium der Schwanzresorption (sowie insbesondere die Resorption der Schwanzflosse) und die Morphologie des Kopfes (z.B. die Größe der Kiemen und das Stadium der Kiemenresorption, die Morphologie des Unterkiefers und das Hervortreten des Meckelschen Knorpels) als wesentliche morphologische Merkmale, die hinsichtlich der zeitlich abgestimmten Metamorphose bewertet werden müssen.
58. Je nach Art der chemischen Wirkung können unterschiedliche morphologische Phänotypen auftreten. Klassische Phänotypen sind die verzögerte oder fehlende Entwicklung der vorderen Extremitäten trotz normaler oder sogar rascher voranschreitender Entwicklung der Hinterbeine und des Schwanzgewebes oder die Resorption der Kiemen vor der Entwicklung der Hinterbeine und dem Umbau des Schwanzes.
Histopathologie
59. Wenn eine Chemikalie keine offensichtlich toxische Wirkung verursacht, die Entwicklung nicht beschleunigt und nicht zu asynchroner Entwicklung führt, wird die Histopathologie der Schilddrüsen gemäß dem betreffenden Leitfaden (9) bewertet. Eine verzögerte Entwicklung ohne feststellbare toxische Wirkung ist ein starker Indikator für eine antithyroidale Wirkung; die Analyse aufgrund der Entwicklungsstadien ist jedoch weniger empfindlich und hat eine geringere diagnostische Aussagekraft als die histopathologische Analyse der Schilddrüse. In diesem Fall müssen daher die Schilddrüsen histopathologisch untersucht werden. Effekte auf die Histologie der Schilddrüse wurden auch ohne begleitende Effekte auf die Entwicklung nachgewiesen. Wenn in histopathologischen Untersuchungen der Schilddrüse Veränderungen festgestellt werden, ist davon auszugehen, dass die betreffende Chemikalie eine thyroidale Wirkung hat. Werden keine Entwicklungsverzögerungen oder histologische Läsionen an den Schilddrüsen festgestellt, wird davon ausgegangen, dass die Chemikalie nicht auf die Schilddrüse wirkt. Die Schilddrüse wird nämlich durch TSH gesteuert, und alle Chemikalien, die auf zirkulierende Schilddrüsenhormone so wirken, dass sie die TSH-Sekretion verändern, führen zu histopathologischen Veränderungen der Schilddrüse. Das zirkulierende Schilddrüsenhormon kann auf verschiedene Weise und durch unterschiedliche Mechanismen verändert werden. Der Hormonspiegel der Schilddrüse ist zwar ein Anzeichen für eine Wirkung auf die Schilddrüse; er ist jedoch nicht hinreichend, um festzustellen, auf welche Weise oder über welchen Mechanismus die betreffende Reaktion erfolgt.
60. Da dieser Endpunkt nicht ohne weiteres mit grundlegenden statistischen Ansätzen analysiert werden kann, ist eine auf die Exposition gegenüber einer Chemikalie zurückzuführende Wirkung durch einen sachverständigen Pathologen festzustellen.
Verzögerte Entwicklung (anhand der Entwicklungsstadien sowie anhand von Hinterbeinlänge, Körpergewicht und Kopf- Rumpf-Länge zu ermitteln)
61. Eine verzögerte Entwicklung kann durch anti-tyroidale Mechanismen und durch indirekte Toxizität bedingt sein. Geringe Entwicklungsverzögerungen in Verbindung mit offensichtlichen Anzeichen für eine toxische Wirkung lassen auf eine unspezifische toxische Wirkung schließen. Die Bewertung einer nicht auf die Schilddrüse wirkenden Toxizität ist ein wesentlicher Bestandteil des Tests, der dazu dienen soll, die Wahrscheinlichkeit falsch positiver Ergebnisse zu reduzieren. Übermäßige Mortalität ist ein offensichtliches Anzeichen für anderweitige toxische Mechanismen. Auch geringe Wachstumsbeeinträchtigungen, die z.B. aufgrund der Feuchtmasse und/ oder der Kopf-Rumpf-Länge festgestellt werden, lassen auf eine nicht auf die Schilddrüse wirkende Toxizität schließen. Ein offensichtlich stärkeres Wachstum ist häufig bei Chemikalien zu beobachten, die die normale Entwicklung beeinträchtigen. Entsprechend deutet das Vorkommen größerer Tiere nicht zwangsläufig auf eine nicht auf die Schilddrüse wirkende Toxizität hin. Das Wachstum sollte jedoch nie der einzige Parameter sein, auf den sich die Feststellung einer Toxizität für die Schilddrüse stützt. Um eine Wirkung auf die Schilddrüse konstatieren zu können, sollten zusätzlich zum Wachstum auch das Entwicklungsstadium und die Ergebnisse einer histopathologischen Untersuchung der Schilddrüse herangezogen werden. Bei der Feststellung einer offensichtlichen Toxizität sind auch andere Endpunkte zu berücksichtigen, u. a. Ödeme, hämorrhagische Läsionen, Lethargie, verringerte Nahrungsaufnahme und erratisches/verändertes Schwimmverhalten. Wenn bei allen Prüfkonzentrationen Anzeichen einer offensichtlichen Toxizität festgestellt werden, ist die Prüfchemikalie zunächst einer erneuten Bewertung bei niedrigeren Konzentrationen zu unterziehen, bevor entschieden wird, ob die Chemikalie potenziell auf die Schilddrüse wirkt oder keine Wirkung auf die Schilddrüse hat.
62. Statistisch signifikante Entwicklungsverzögerungen ohne sonstige Anzeichen einer offensichtlichen Toxizität deuten auf eine Wirkung der jeweiligen Chemikalie auf die Schilddrüse hin (als Antagonist). Wenn keine starken statistischen Abhängigkeiten bestehen, kann dieser Befund durch Ergebnisse einer histopathologischen Untersuchung der Schilddrüse bestätigt werden.
Statistische Analysen
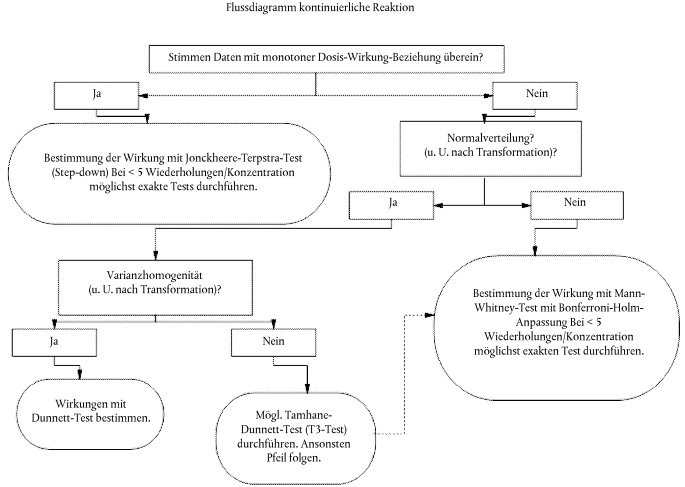
63. Statistische Datenanalysen sollten nach den Verfahren im Dokument 'Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application'(11) durchgeführt werden. Für alle kontinuierlichen quantitativen Endpunkte (Hinterbeinlänge, Kopf-Rumpf-Länge, Feuchtmasse), die mit einer monotonen Dosis-Wirkungs- Beziehung einhergehen, ist der Jonckheere-Terpstra-Test (Stepdown) vorzunehmen, um eine signifikante Wirkung infolge der Exposition feststellen zu können.
64. Wenn kontinuierliche Endpunkte nicht im Einklang mit einer monotonen Dosis-Wirkungs-Beziehung stehen, sind die Daten auf Normalverteilung (vorzugsweise mit dem Shapiro-Wilk- oder dem Anderson-Darling-Test) und auf Varianzhomogenität (vorzugsweise mit dem Levene-Test) zu prüfen. Beide Tests werden mit den Residuen einer ANOVA durchgeführt. Anstelle der Durchführung dieser förmlichen Tests auf Normalverteilung und Varianzhomogenität kann auch fachliches Ermessen angewendet werden; Tests sind jedoch zu bevorzugen. Wenn eine Abweichung von der Normalverteilung oder eine Varianzheterogenität festgestellt wird, ist eine normalisierende bzw. die Varianz stabilisierende Transformation zu versuchen. Ergibt sich (vielleicht nach einer Transformation) eine Normalverteilung mit homogener Varianz, wird mit dem Dunnett-Test eine signifikante Wirkung festgestellt. Wenn (unter Umständen nach einer Transformation) eine Normalverteilung mit heterogener Varianz festgestellt wird, ist mit dem Tamhane/Dunnett-Test, dem T3-Test oder dem Mann- Whitney-Wilcoxon-U-Test eine signifikante Wirkung zu ermitteln. Führt die Transformation nicht zu einer Normalverteilung, ist nach einer Anpassung der p-Werte nach Bonferroni-Holm ebenfalls mit dem Mann- Whitney-Wilcoxon-U-Test eine signifikante Wirkung festzustellen. Der Dunnett-Test wird unabhängig von einem F-Test im Rahmen einer ANOVA durchgeführt, und der Mann-Whitney-Test erfolgt unabhängig von einem allgemeinen Kruskall-Wallis-Test.
65. Auch wenn eine signifikante Mortalität nicht erwartet wird, ist die Mortalität doch durch einen Cochran- Armitage-Test im Stepdown-Verfahren zu prüfen, bei dem die Daten mit der monotonen Dosis-Wirkungs- Beziehung übereinstimmen; ansonsten ist ein Exakter Test nach Fisher mit einer Anpassung nach Bonferroni- Holm vorzunehmen.
66. Eine signifikante Wirkung der Exposition auf die Entwicklungsstadien wird mit dem Jonckheere-Terpstra-Test im Stepdown-Verfahren bezogen auf die Mediane der Replikate ermittelt. Alternativ und vorzugsweise sollte die Wirkung mit einem multiquantalen Jonckheere-Test vom 20. bis zum 80. Perzentil festgestellt werden, da so Änderungen des Verteilungsprofils berücksichtigt werden können.
67. Bei der Analyse ist von den Replikaten auszugehen; beim Jonckheere-Terpstra- und beim Mann-Whitney-U-Test besteht das Datenmaterial aus den Medianen der Replikate und beim Dunnett-Test aus den Mittelwerten der Replikate. Eine monotone Dosis-Wirkungs-Beziehung kann aus den Mittelwerten oder Medianen der Replikate und der Prüfkonzentrationen nach Augenschein oder durch förmliche Tests (s. o.) festgestellt werden (11). Wenn weniger als fünf Replikate pro Prüfkonzentration oder pro Kontrolle verfügbar sind, sollten der Jonckheere-Terpstra- und der Mann-Whitney-Tests möglichst exakt durchgeführt werden. Bei allen Tests wird eine Signifikanz von 0,05 als statistisch relevant betrachtet.
68. Abbildung 4 zeigt ein Flussdiagramm zur Durchführung statistischer Prüfungen bei kontinuierlichen Daten.
Abbildung 4 Flussdiagramm statistischer Verfahren fiir kontinuierliche Daten zur Dosis-Wirkung-Beziehung
Besondere Erwägungen zur Datenanalyse
Behandlung von Konzentrationen mit offensichtlich toxischer Wirkung
69. Um festzustellen, ob ein Replikat oder eine Prüfkonzentration insgesamt offensichtlich toxisch wirkt und von der Analyse ausgeschlossen werden muss, sind mehrere Faktoren zu berücksichtigen. Eine offensichtliche Toxizität ist bei > 2 toten Larven in einem Replikat gegeben, wenn die Mortalität nicht durch einen technischen Fehler, sondern nur durch die toxische Wirkung zu erklären ist. Andere Anzeichen einer offensichtlichen Toxizität sind Hämorrhagien, Verhaltensauffälligkeiten, anomales Schwimmverhalten, Anorexie und sonstige klinische Anzeichen einer Erkrankung. Bei Anzeichen einer subletalen Toxizität können qualitative Untersuchungen erforderlich sein; in diesen Fällen ist grundsätzlich ein Vergleich mit der Kontrollgruppe mit sauberem Wasser vorzunehmen.
Lösungsmittelkontrollen
70. Die Verwendung eines Lösungsmittels ist nur als letzte Möglichkeit in Betracht zu ziehen, wenn alle sonstigen Verfahren zur Applikation der betreffenden Chemikalie geprüft wurden. Wenn ein Lösungsmittel verwendet wird, ist auch eine Kontrolle mit sauberem Wasser zu prüfen. Bei Ende des Tests werden die potenziellen Wirkungen des Lösungsmittels bestimmt. Dazu wird ein statistischer Vergleich der Kontrollgruppe mit dem Lösungsmittel und der Kontrollgruppe mit dem sauberen Wasser vorgenommen. Die wichtigsten Endpunkte für diese Analyse sind das Entwicklungsstadium, die Kopf-Rumpf-Länge und die Feuchtmasse, da diese Parameter auch durch nicht auf die Schilddrüse wirkende Toxizität beeinträchtigt werden können. Wenn bei diesen Endpunkten statistisch signifikante Unterschiede zwischen der Kontrollgruppe mit dem sauberen Wasser und der Kontrollgruppe mit dem Lösungsmittel festgestellt werden, sind die in der Studie verwendeten Endpunkte für die Reaktionsparameter anhand der Kontrolle mit dem sauberen Wasser festzulegen. Besteht zwischen der Kontrolle mit dem sauberen Wasser und der Lösungsmittelkontrolle bei keiner der gemessenen Reaktionsvariablen ein statistisch signifikanter Unterschied, werden die Endpunkte für die Reaktionsparameter aus den gepoolten Werten der Kontrollen mit dem Verdünnungswasser und mit dem Lösungsmittel ermittelt.
Behandlungsgruppen mit Larven mindestens im Entwicklungsstadium 60
71. Ab Stadium 60 verringern sich Größe und Gewicht der Larven, weil Gewebe resorbiert wird und der absolute Wassergehalt zurückgeht. Messungen der Feuchtmasse und der Kopf-Rumpf-Länge können in statistischen Analysen zur Feststellung unterschiedlicher Wachstumsentwicklungen nicht in geeigneter Weise verwendet werden. Daher sollten Daten zur Feuchtmasse und zur Länge von Tieren oberhalb des NF-Entwicklungsstadiums 60 ausgeklammert und bei der Analyse der Mittelwerte oder der Mediane von Replikaten nicht verwendet werden. Zur Analyse dieser wachstumsbezogenen Parameter können zwei andere Ansätze verfolgt werden.
72. Bei einem Ansatz werden in statistischen Analysen der Feuchtmasse und/oder der KRL ausschließlich Larven mit Entwicklungsstadien ≤ 60 berücksichtigt. Dieser Ansatz dürfte hinreichend belastbare Informationen über den Umfang möglicher Wachstumseffekte ergeben, wenn nur wenige Testtiere aus den Analysen herausgenommen werden (≤ 20 %). Hat eine größere Anzahl an Larven (≥ 20 %) in mindestens einer Nominalkonzentration der Prüfchemikalie ein höheres Entwicklungsstadium als Stadium 60 erreicht, ist für alle Larven eine Zwei-Faktor-ANOVA mit geschachtelter Varianzstruktur vorzunehmen, um die Auswirkungen der jeweiligen Chemikalie auf das Wachstum der Larven zu bewerten; dabei ist zu berücksichtigen, wie sich die Entwicklung in späteren Stadien auf die Wachstumsentwicklung auswirkt. Anlage 3 enthält Leitlinien zur ANOVA mit den beiden Faktoren Gewicht und Länge.
(1) OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 - Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 77, Paris.
(2) OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 - Multi- chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 76. Paris.
(3) OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Followup of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 92. Paris.
(4) OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris.
(5) ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729-96(2002), Philadelphia, PA.
(6) ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay - Xenopus (FETAX). E 1439-98
(7) Kahl, M.D., Russom, C.L., DeFoe, D.L. und Hammermeister, D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, S. 539-551.
(8) Nieuwkoop, P.D., und Faber, J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York.
(9) OECD (2007) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 82. Paris.
(10) Dodd, M.H.I., und Dodd, J.M. (1976) Physiology of Amphibia. Lofts, B. (Hrsg,), Academic Press, New York, S. 467-599
(11) OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 54. Paris
(12) Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; S. 69-92.
| Anlage 1 |
Tabelle 1: Versuchsbedingungen des 21-Tage-Amphibien-Metamorphose-Assay (21-Tage-AMA)
| Testtier | Xenopuslaevis-Larven | ||
| Ausgangsstadium der Larven | Nieuwkoop und Faber, Stadium 51 | ||
| Expositionsdauer | 21 Tage | ||
| Kriterien für die Auswahl der Larven | Entwicklungsstadium und Gesamtlänge (optional) | ||
| Prüfkonzentrationen | Mindestens 3 Konzentrationen, verteilt über etwa eine Größenordnung | ||
| Expositionsprotokoll | Durchfluss (vorzugsweise) und/oder statische Erneuerung | ||
| Durchfluss des Prüfsystems | 25 ml/min (vollständiger Austausch etwa nach 2,7 h) | ||
| Primäre Endpunkte / Erfassungstage | Mortalität | Täglich | |
| Entwicklungsstadium | D 7 und 21 | ||
| Länge der Hinterbeine | D 7 und 21 | ||
| Kopf-Rumpf-Länge | D 7 und 21 | ||
| Feuchtmasse der Larven | D 7 und 21 | ||
| Histologie der Schilddrüse | D 21 | ||
| Verdünnungswasser / Laborkontrolle | dechloriniertes Leitungswasser (mit Aktivkohle gefiltert) oder entsprechendes Laborwasser | ||
| Besatzdichte | 20 Larven / Prüfbecken (5 / l) | ||
| Testlösung / Prüfbecken | 4-10 l (mindestens 10-15 cm Wassertiefe) / Glas- oder Edelstahlbecken (z.B. 22,5 cm × 14 cm × 16,5 cm) | ||
| Replikation | 4 Replikatprüfbecken / Prüfkonzentration und Kontrolle | ||
| Annehmbare Mortalität in den Kontrollen | ≤ 10 % pro Replikatprüfbecken | ||
| Fixierung der Schild- drüse | Anzahl fixierter Tiere | Alle Larven (zunächst werden 5 pro Replikat bewertet) | |
| Region | Kopf oder gesamter Körper | ||
| Fixierlösung | Davidson-Fixierlösung | ||
| Fütterung | Futter | Sera Micron® oder gleichwertig | |
| Menge / Häufigkeit | Zum Fütterungsprotokoll mit Sera Micron® siehe Tabelle 1. | ||
| Beleuchtung | Photoperiode | 12 h Licht: 12 h Dunkelheit | |
| Intensität | 600-2.000 lx (gemessen an der Wasseroberfläche) | ||
| Wassertemperatur | 22 ± 1 °C | ||
| pH-Wert | 6,5-8,5 | ||
| Konzentration des gelösten Sauerstoffs | > 3,5 mg/l ( > 40 % Luftsättigung) | ||
| Stichprobenahme zur chemischen Analyse | Einmal pro Woche (4 Probenahmen / Test) | ||
| Berichttabellen für Rohdaten und Zusammenfassung | Anlage 2 |
| Chemische Informationen | |||
| Prüfchemikalie, Konzentrationseinheiten und Konzentrationen eingeben | |||
| Prüfchemikalie: | |||
| Konzentrationseinheiten: | |||
| Konzentration 1 | |||
| Konzentration 2 | |||
| Konzentration 3 | |||
| Konzentration 4 | |||
| Datum (Tag 0): | Datumsformat: MM/TT/JJ | ||
| Datum (Tag 7): | Datumsformat: MM/TT/JJ | ||
| Datum (Tag 21): | Datumsformat: MM/TT/JJ | ||
Tabelle 2: Rohdatenbogen für die Tage 7 und 21
| TAG X DATUM 00/00/00 | |||||||||
| Konzent- ration | Behdlg. Nr. | Replikat. Nr. | Nr. des In- dividuums | ID-Num- mer | Entwick- lungssta- ium | Kopf- Rumpf- Länge (mm) | Hinter- beinlänge (mm) | Feucht- masse des gesamten Organis- mus (mg) | |
| ZEILE | BE- HANDLG. | BEHDLG. Nr. | Replikat. | INDIV. | ID-Nr. | STADIUM | KÖRPERL. | HBL | GEW. |
|
1 | 0,00 | 1 | |||||||
| 2 | 0,00 | 1 | |||||||
| 3 | 0,00 | 1 | |||||||
| 4 | 0,00 | 1 | |||||||
| 5 | 0,00 | 1 | |||||||
| 6 | 0,00 | 1 | |||||||
| 7 | 0,00 | 1 | |||||||
| 8 | 0,00 | 1 | |||||||
| 9 | 0,00 | 1 | |||||||
| 10 | 0,00 | 1 | |||||||
| 11 | 0,00 | 1 | |||||||
| 12 | 0,00 | 1 | |||||||
| 13 | 0,00 | 1 | |||||||
| 14 | 0,00 | 1 | |||||||
| 15 | 0,00 | 1 | |||||||
| 16 | 0,00 | 1 | |||||||
| 17 | 0,00 | 1 | |||||||
| 18 | 0,00 | 1 | |||||||
| 19 | 0,00 | 1 | |||||||
| 20 | 0,00 | 1 | |||||||
| 21 | 0,00 | 2 | |||||||
| 22 | 0,00 | 2 | |||||||
| 23 | 0,00 | 2 | |||||||
| 24 | 0,00 | 2 | |||||||
| 25 | 0,00 | 2 | |||||||
| 26 | 0,00 | 2 | |||||||
| 27 | 0,00 | 2 | |||||||
| 28 | 0,00 | 2 | |||||||
| 29 | 0,00 | 2 | |||||||
| 30 | 0,00 | 2 | |||||||
| 31 | 0,00 | 2 | |||||||
| 32 | 0,00 | 2 | |||||||
| 33 | 0,00 | 2 | |||||||
| 34 | 0,00 | 2 | |||||||
| 35 | 0,00 | 2 | |||||||
| 36 | 0,00 | 2 | |||||||
| 37 | 0,00 | 2 | |||||||
| 38 | 0,00 | 2 | |||||||
| 39 | 0,00 | 2 | |||||||
| 40 | 0,00 | 2 | |||||||
| 41 | 0,00 | 3 | |||||||
| 42 | 0,00 | 3 | |||||||
| 43 | 0,00 | 3 | |||||||
| 44 | 0,00 | 3 | |||||||
| 45 | 0,00 | 3 | |||||||
| 46 | 0,00 | 3 | |||||||
| 47 | 0,00 | 3 | |||||||
| 48 | 0,00 | 3 | |||||||
| 49 | 0,00 | 3 | |||||||
| 50 | 0,00 | 3 | |||||||
| 51 | 0,00 | 3 | |||||||
| 52 | 0,00 | 3 | |||||||
| 53 | 0,00 | 3 | |||||||
| 54 | 0,00 | 3 | |||||||
| 55 | 0,00 | 3 | |||||||
| 56 | 0,00 | 3 | |||||||
| 57 | 0,00 | 3 | |||||||
| 58 | 0,00 | 3 | |||||||
| 59 | 0,00 | 3 | |||||||
| 60 | 0,00 | 3 | |||||||
| 61 | 0,00 | 4 | |||||||
| 62 | 0,00 | 4 | |||||||
| 63 | 0,00 | 4 | |||||||
| 64 | 0,00 | 4 | |||||||
| 65 | 0,00 | 4 | |||||||
| 66 | 0,00 | 4 | |||||||
| 67 | 0,00 | 4 | |||||||
| 68 | 0,00 | 4 | |||||||
| 69 | 0,00 | 4 | |||||||
| 70 | 0,00 | 4 | |||||||
| 71 | 0,00 | 4 | |||||||
| 72 | 0,00 | 4 | |||||||
| 73 | 0,00 | 4 | |||||||
| 74 | 0,00 | 4 | |||||||
| 75 | 0,00 | 4 | |||||||
| 76 | 0,00 | 4 | |||||||
| 77 | 0,00 | 4 | |||||||
| 78 | 0,00 | 4 | |||||||
| 79 | 0,00 | 4 | |||||||
| 80 | 0,00 | 4 | |||||||
Tabelle 3: Berechnete Summen der Endpunktdaten der Tage 7 und 21
| Entwicklungsstadium | KRL (mm) | Hinterbeinlänge (mm) | Gewicht (mg) | |||||||
| Konz- en- tration | Replikat | min | Median | max | Mittel- wert | Standart- abw. | Mittel- wert | Standart- abw. | Mittel- wert | Standart- abw. |
| 1 | 1 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 1 | 2 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 1 | 3 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 1 | 4 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 2 | 1 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 2 | 2 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 2 | 3 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 2 | 4 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 3 | 1 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 3 | 2 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 3 | 3 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 3 | 4 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 4 | 1 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 4 | 2 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 4 | 3 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| 4 | 4 | 0 | #NUM! | 0 | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! | #DIV/0! |
| Hinweis: Die Werte in den Zellen werden anhand der Dateneingaben in Tabelle 2 berechnet. | ||||||||||
Tabelle 4: Tägliche Mortalität
| Testtag | Datum | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 |
| 0 | 00/00/00 | ||||||||||||||||
| 1 | #Value! | ||||||||||||||||
| 2 | #Value! | ||||||||||||||||
| 3 | #Value! | ||||||||||||||||
| 4 | #Value! | ||||||||||||||||
| 5 | #Value! | ||||||||||||||||
| 6 | #Value! | ||||||||||||||||
| 7 | #Value! | ||||||||||||||||
| 8 | #Value! | ||||||||||||||||
| 9 | #Value! | ||||||||||||||||
| 10 | #Value! | ||||||||||||||||
| 11 | #Value! | ||||||||||||||||
| 12 | #Value! | ||||||||||||||||
| 13 | #Value! | ||||||||||||||||
| 14 | #Value! | ||||||||||||||||
| 15 | #Value! | ||||||||||||||||
| 16 | #Value! | ||||||||||||||||
| 17 | #Value! | ||||||||||||||||
| 18 | #Value! | ||||||||||||||||
| 19 | #Value! | ||||||||||||||||
| 20 | #Value! | ||||||||||||||||
| 21 | #Value! | ||||||||||||||||
| Anz. Replikate | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Anz. Behandl. | 0 | 0 | 0 | 0 | |||||||||||||
| Hinweis: Die Werte in den Zellen werden anhand der Dateneingaben in Tabelle 1 berechnet. | |||||||||||||||||
Tabelle 5: Kriterien für die Wasserqualität
| Expositionssystem (Durchfluss/statische Erneuerung): |
| Temperatur: |
| Lichtintensität: |
| Hell-Dunkel-Zyklus: |
| Futter: |
| Fütterungsprotokoll: |
| pH-Wert des Wassers: |
| Jodkonzentration des Testwassers: |
Tabelle 6: Zusammenfassung chemische Daten
|
Name der Chemikalie: | |||||||||||||||||||||
| CAS-Nr.: | |||||||||||||||||||||
| Testtag | Datum | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 |
| 0 | 00/00/00 | ||||||||||||||||||||
| 1 | #Value! | ||||||||||||||||||||
| 2 | #Value! | ||||||||||||||||||||
| 3 | #Value! | ||||||||||||||||||||
| 4 | #Value! | ||||||||||||||||||||
| 5 | #Value! | ||||||||||||||||||||
| 6 | #Value! | ||||||||||||||||||||
| 7 | #Value! | ||||||||||||||||||||
| 8 | #Value! | ||||||||||||||||||||
| 9 | #Value! | ||||||||||||||||||||
| 10 | #Value! | ||||||||||||||||||||
| 11 | #Value! | ||||||||||||||||||||
| 12 | #Value! | ||||||||||||||||||||
| 13 | #Value! | ||||||||||||||||||||
| 14 | #Value! | ||||||||||||||||||||
| 15 | #Value! | ||||||||||||||||||||
| 16 | #Value! | ||||||||||||||||||||
| 17 | #Value! | ||||||||||||||||||||
| 18 | #Value! | ||||||||||||||||||||
| 19 | #Value! | ||||||||||||||||||||
| 20 | #Value! | ||||||||||||||||||||
| 21 | #Value! | ||||||||||||||||||||
| Hinweis: Die Werte in den Zellen werden anhand der Dateneingaben in Tabelle 1 berechnet. | |||||||||||||||||||||
Tabelle 7: Histopathologische Berichttabellen - Kernkriterien
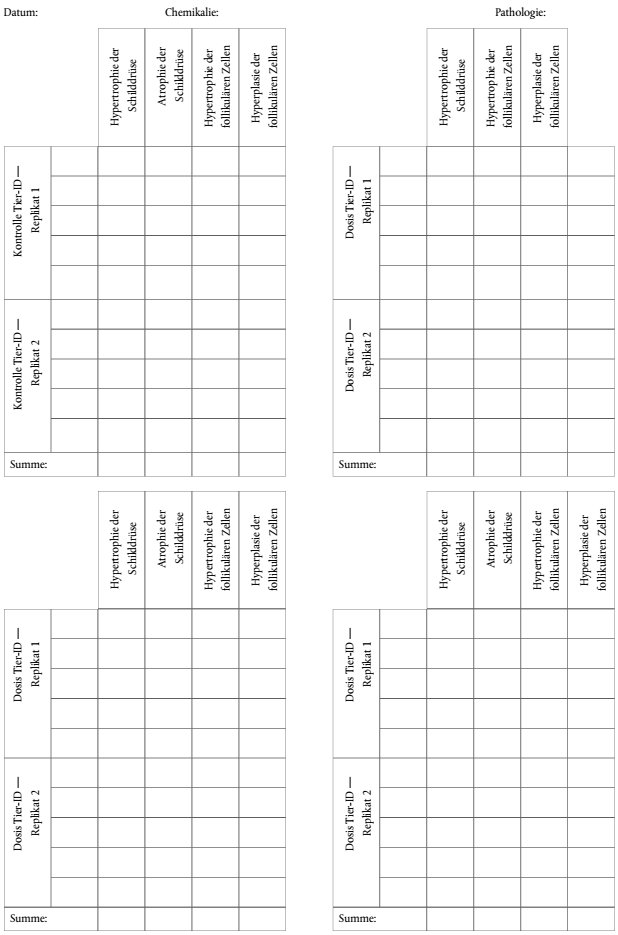
Tabelle 8: Weitere histopathologische Kriterien
Tabelle 9: Ausformulierte Beschreibungen der histopathologischen Ergebnisse

Tabelle 10: Zusammenfassende Übersicht Tag x (7 oder 21) des AMA
| Kontrolle | Dosis 1 | Dosis 2 | Dosis 3 | |||||||||||||||||
| Endpunkt | Replikat | Mittel- wert | SD | CV | N | Mittel- wert | SD | CV | N | p-Wert | Mittel- wert | SD | CV | N | p-Wert | Mittel- wert | SD | CV | N | p-Wert |
| Hinterbeinlänge (mm) | 1 | |||||||||||||||||||
| 2 | ||||||||||||||||||||
| 3 | ||||||||||||||||||||
| 4 | ||||||||||||||||||||
| Mittelwert: | ||||||||||||||||||||
| KRL (mm) | 1 | |||||||||||||||||||
| 2 | ||||||||||||||||||||
| 3 | ||||||||||||||||||||
| 4 | ||||||||||||||||||||
| Mittelwert: | ||||||||||||||||||||
| Feuchtmasse (mg) | 1 | |||||||||||||||||||
| 2 | ||||||||||||||||||||
| 3 | ||||||||||||||||||||
| 4 | ||||||||||||||||||||
| Mittelwert: | ||||||||||||||||||||
Tabelle 11: Zusammenfassende Übersicht Tag x (7 oder 21) Daten zu Entwicklungsstadien im AMA
| Kontrolle | Dosis 1 | Dosis 2 | Dosis 3 | |||||||||||||||||
| Replikat | Median | min | max | N | Median | min | max | N | p-Wert | Median | min | max | N | p-Wert | Median | min | max | Median | p-Wert | |
| Entwicklungs- stadium | 1 | |||||||||||||||||||
| 2 | ||||||||||||||||||||
| 3 | ||||||||||||||||||||
| 4 | ||||||||||||||||||||
| Mittelwert: | ||||||||||||||||||||
| Alternative Gewichts- und Längenanalyse in späten Entwicklungsstadien bei > 20 % der Larven in einer oder mehreren Konzentrationen | Anlage 3 |
Befindet sich eine größere Anzahl an Larven ( ≥ 20 %) in mindestens einer Nominalkonzentration der Prüfchemikalie in einem höheren Entwicklungsstadium als Stadium 60, ist für alle Larven eine Zwei-Faktor-ANOVA mit geschachtelter Varianzstruktur vorzunehmen, um die Auswirkungen der jeweiligen Chemikalie auf das Wachstum der Larven zu bewerten. Dabei ist zu berücksichtigen, wie sich die Entwicklung in späteren Stadien auf das Wachstum auswirkt.
Vorgeschlagen wird die Verwendung aller Daten; dabei ist jedoch der Effekt eines späten Entwicklungsstadiums zu berücksichtigen. Die entsprechende Prüfung kann mit einer Zwei-Faktor-ANOVA mit verschachtelter Varianzstruktur vorgenommen werden. Für ein Tier ist die Eingabe LateStage='Yes' zu definieren, wenn ein Tier mindestens das Entwicklungsstadium 61 erreicht. Ansonsten ist LateStage='No' zu definieren. Dann kann eine ANOVA mit zwei Faktoren (Concentration und LateStage) mit Rep(Conc) als Zufallsfaktor und mit dem Faktor Tadpole(Rep) als einem weiteren zufälligen Effekt vorgenommen werden. Auch hier wird das Replikat als Analyseeinheit behandelt. Es ergeben sich im Wesentlichen die gleichen Ergebnisse wie in einer gewichteten Analyse der Mittelwerte rep*latestage, gewichtet nach der Anzahl der Tiere pro Mittelwert. Wenn die Daten die Anforderungen der ANOVA an die Normalverteilung oder die Varianzhomogenität nicht erfüllen, kann eine normalisierte Rangtransformation vorgenommen werden.
Zusätzlich zu den Standard-F-Tests auf die Effekte der Parameter Conc und LateStage sowie ihrer Wechselwirkungen im Rahmen der ANOVA kann der F-Test zur Ermittlung von Wechselwirkungen in zwei zusätzliche F-Tests 'aufgespalten' werden: einen Test zur Ermittlung der durchschnittlichen Reaktionen über die verschiedenen Konzentrationen für LateStage='No' und einen weiteren für die mittleren Reaktionen über die verschiedenen Konzentrationen für LateStage='Yes'. Weitere Vergleiche der Mittelwerte von Konzentrationen im Vergleich zu den Kontrollen werden jeweils für die verschiedenen Ausprägungen des Parameters LateStage vorgenommen. Mit geeigneten Kontrasten oder mit einfachen paarweisen Vergleichen kann eine Trendanalyse vorgenommen werden, wenn Anzeichen für eine nicht monotone Dosis-Wirkungs-Beziehung innerhalb einer Ebene des Parameters LateStage bestehen. Eine Anpassung der p-Werte nach Bonferroni-Holm erfolgt nur dann, wenn der entsprechende F-Test nicht signifikant ist. Die Anpassung kann mit SAS und wahrscheinlich auch mit sonstiger Statistik-Software vorgenommen werden. Komplikationen können sich ergeben, wenn bei einigen Konzentrationen keine Tiere ein spätes Entwicklungsstadium erreichen; diese Fälle können aber eher pragmatisch gehandhabt werden.
| Begriffsbestimmungen | Anlage 4 |
Prüfchemikalie: Stoff oder Gemisch, der/das mit dieser Prüfmethode getestet wird.
C.39. Collembolen-Reproduktionstests in Böden
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 232 (2009). Mit der Prüfmethode sollen die Wirkungen von Chemikalien auf die Reproduktionsleistung von bodenbewohnenden Collembolen untersucht werden. Die Methode beruht auf bestehenden Verfahren (1)(2). Zwei der am besten zugänglichen Arten sind die parthenogenetische Art Folsomia candida und die sich geschlechtlich vermehrende Art Folsomia fimetaria, die beide kultivierbar und kommerziell erhältlich sind. Wenn spezifische Lebensräume zu bewerten sind, die durch diese beiden Arten nicht abgedeckt werden, ist die Methode auch auf andere Collembola-Arten übertragbar, sofern diese die Validitätskriterien des Tests erfüllen.
2. Erdbewohnende Collembolen sind für Ökotoxizitätsprüfungen ökologisch relevante Arten. Collembolen sind Sechsfüßer mit einem dünnen und stark luft- und wasserdurchlässigen Exoskelett; sie repräsentieren Arthropoden, mit anderem Expositionspfad und anderer Expositionsrate als Regenwürmer und Enchytraeen.
3. In vielen terrestrischen Ökosystemen beträgt die Populationsdichte von Collembolen 105 m- 2 in Böden und in Laubschichten (3)(4). Adulte Tiere sind gewöhnlich 0,5-5 mm lang; ihr Anteil an der gesamten tierischen Biomasse und Respiration im Boden beschränkt sich auf geschätzte 1-5 % (5). Ihre wichtigste Rolle könnte daher die mögliche Regelung von Prozessen durch Fressen von Mikroorganismen und Mikrofauna darstellen. Springschwänze sind Beutetiere für zahlreiche endogäische und epigäische Invertebraten (z.B. Milben, Hundertfüßer, Spinnen, Laufkäfer und Kurzflügler). Collembolen unterstützen Zersetzungsprozesse in sauren Böden, wo sie neben Enchytraeen die wichtigsten Invertebraten sein können, da Regenwürmer und Diplopoden dort gewöhnlich nicht vorkommen.
4. F. fimetaria ist weltweit verbreitet und in verschiedenen Bodentypen von Sandböden bis zu Lehmböden und von Mull- bis Rohhumusböden anzutreffen. Die augenlose, pigmentlose Collembolenart wurde in landwirtschaftlichen Nutzflächen in ganz Europa nachgewiesen (6). Sie ist ein Allesfresser und ernährt sich u. a. von Pilzhyphen, Bakterien, Protozoen und Detritus. Durch das Abweiden kann F. fimetaria einen Einfluss auf Infektionen pflanzenpathogener Pilze haben (7) und kann Mycorrhiza verändern; dies ist beispielsweise bei F. candida bekannt. Wie die meisten Collembolen-Arten vermehrt sich auch F. fimetaria geschlechtlich. Zur Befruchtung der Eier müssen kontinuierlich männliche Tiere vorhanden sein.
5. F. candida kommt ebenfalls weltweit vor. In den meisten natürlichen Böden ist diese Art zwar nicht üblich; an humusreichen Standorten ist sie aber in sehr großer Anzahl zu finden. Die augenlose, pigmentlose Collembolenart besitzt eine gut entwickelte Furca (Springgabel); die Tiere bewegen sich lebhaft und springen, wenn sie gestört werden. Die ökologische Bedeutung von F. candida ist der Bedeutung von F. fimetaria vergleichbar; sie lebt jedoch in Böden, die reicher an organischen Bestandteilen sind. F. candida vermehrt sich parthenogenetisch. Weniger als 1/1.000 aller Exemplare sind männliche Tiere.
6. Synchrone adulte (F. fimetaria) bzw. juvenile (F. candida) Collembolen werden in einem modifizierten künstlichen Boden (8) mit 5 % organischen Bestandteilen (oder einem alternativen Boden) verschiedenen Konzentrationen der Prüfchemikalie ausgesetzt. Die Prüfung kann in zwei Schritte unterteilt werden:
Die toxische Wirkung der Prüfchemikalie auf die Mortalität adulter Tiere und auf die Reproduktionsleistung wird mit den Parametern LCx und ECx mittels nichtlinearer Regression mit einem geeigneten Modell bestimmt, um die Konzentration abzuschätzen, die eine Mortalität von x % oder einen Rückgang der Reproduktionsleistung um x % verursachen würde; alternativ kann die NOEC/LOEC bestimmt werden (9).
Informationen zur Prüfchemikalie
7. Die physikalischen Eigenschaften, die Wasserlöslichkeit, der log Kow-Wert, der Boden-Wasser-Verteilungskoeffizient und der Dampfdruck der Prüfchemikalie sollten möglichst bekannt sein. Wünschenswert sind zudem Informationen über die Persistenz der Chemikalie im Boden (z.B. die Photolyse- und die Hydrolysegeschwindigkeit sowie der biotische Abbau). So weit vorliegend, sind der IUPAC-Name sowie CAS-Nummer, Charge, Los, Strukturformel und Reinheit anzugeben.
8. Diese Prüfmethode kann wahlweise für wasserlösliche und für nicht lösliche Chemikalien verwendet werden. Allerdings ist die Prüfchemikalie den Eigenschaften entsprechend unterschiedlich einzubringen. Für flüchtige Chemikalien ist die Prüfmethode nicht geeignet (d. h. für Chemikalien, bei denen die Henry-Konstante oder der Luft-Wasser-Verteilungskoeffizient größer als 1 ist oder für Chemikalien, bei denen der Dampfdruck bei 25 °C mehr als 0,0133 Pa beträgt).
9. Damit ein Testergebnis als gültig gewertet werden kann, müssen die unbehandelten Kontrollen die folgenden Kriterien erfüllen:
10. Eine Referenzchemikalie muss bei ihrer EC50-Konzentration im ausgewählten Testboden getestet werden; entweder in regelmäßigen Abständen oder nach Möglichkeit bei jeder einzelnen Prüfung, um sicherzustellen, dass die Reaktion der Testorganismen im Prüfsystem im normalen Bereich liegt. Eine geeignete Referenzchemikalie ist Borsäure; unter der Wirkung von Borsäure muss die Reproduktionsleistung bei beiden Arten und bei etwa 100 mg/kg Boden (bezogen auf die Trockenmasse) um 50 % zurückgehen (10)(11).
Prüfgefäße und Apparatur
11. Die Prüfgefäße sollten hinreichend groß für mindestens 30 g feuchten Boden sein und aus Glas oder inertem (nichttoxischem) Kunststoff bestehen. Die Verwendung von Kunststoffbehältern ist jedoch zu vermeiden, wenn die Exposition gegenüber der Prüfchemikalie durch Sorption verringert wird. Der Querschnitt der Prüfgefäße muss eine Verteilung des Bodens im Gefäß auf eine Tiefe von 2-4 cm ermöglichen. Die Deckel der Gefäße (z.B. aus Glas oder Polyethylen) müssen so beschaffen sein, dass sie die Wasserverdunstung reduzieren und gleichzeitig den Gasaustausch zwischen dem Bodenmaterial und der Atmosphäre ermöglichen. Die Behältnisse müssen mindestens zum Teil transparent sein, damit die erforderliche Lichtdurchlässigkeit gegeben ist.
12. Es wird eine normale Laborausrüstung mit folgenden Bestandteilen benötigt:
Herstellung des Testbodens
13. Für den Test wird ein modifizierter künstlicher Boden (8) mit einem Anteil von 5 % an organischen Bestandteilen verwendet. Alternativ kann natürlicher Boden eingesetzt werden, da der künstliche nicht mit natürlichen Böden vergleichbar ist. Der künstliche Boden sollte folgende Zusammensetzung haben (bezogen auf Trockenmassen, nach Trocknung bei 105 °C auf ein konstantes Gewicht):
Hinweis 1: Die benötigte Menge an CaCO3 hängt von den Bestandteilen des Bodensubstrats ab und ist durch Messung des pH-Werts der feuchten Unterproben des Bodens unmittelbar vor der Inkubation zu ermitteln.
Hinweis 2: Der pH-Wert und (optional) das C-N-Verhältnis, die Kationenaustauschkapazität und der Anteil des Bodens an organischen Bestandteilen sollten ermittelt werden, um in einem späteren Stadium eine Normalisierung vornehmen und die Ergebnisse besser interpretieren zu können.
Hinweis 3: Wenn erforderlich, z.B. für spezifische Testanforderungen, können auch natürliche Böden aus nicht verunreinigten Standorten als Test- und/oder Kultursubstrate dienen. Wenn Naturboden verwendet wird, sollten mindestens die Herkunft (Entnahmestandort), der pH-Wert, die Textur (Partikelgrößenverteilung), die Kationenaustauschkapazität und der Gehalt an organischen Bestandteilen angegeben werden. Außerdem darf der Boden in keiner Weise kontaminiert sein. Bei Naturböden ist es anzuraten, vor ihrer Verwendung in einem definitiven Test nachzuweisen, dass sie für einen Test geeignet sind und die Validitätskriterien erfüllt werden können.
14. Die trockenen Bestandteile des Bodens werden gründlich gemischt (z.B. in einem großen Labormischer). Die maximale Wasserrückhaltefähigkeit des künstlichen Bodens wird mit den in Anlage 5 beschriebenen Verfahren ermittelt. Der Feuchtegehalt des Testbodens ist so zu optimieren, dass sich eine lockere poröse Struktur ergibt, in die sich die Collembolen zurückziehen können. Gewöhnlich ist dies bei einem Feuchtegehalt von 40-60 % der maximalen Wasserrückhaltefähigkeit gegeben.
15. Der trockene künstliche Boden wird vorgetränkt, indem so viel entionisiertes Wasser hinzugegeben wird, dass 2-7 Tage vor Beginn des Tests etwa die Hälfte des endgültigen Wassergehalts erreicht ist, damit sich der Säuregrad ausgleichen/stabilisieren kann. Zur Bestimmung des pH-Werts wird eine Mischung aus Boden und 1 mol Kaliumchlorid- (KCl) oder 0,01 mol Calciumchlorid-Lösung (CaCl2) im Verhältnis 1:5 verwendet (siehe Anlage 6). Wenn der Boden saurer als erforderlich ist, kann der pH-Wert durch Zugabe einer geeigneten Menge CaCO3 korrigiert werden. Ist der Boden zu alkalisch, kann durch Zugabe einer anorganischen und für Collembolen unschädlichen Säure korrigiert werden.
16. Der vorgetränkte Boden wird entsprechend der Anzahl der im Test zu verwendenden Prüfkonzentrationen (sowie gegebenenfalls der Referenzchemikalie) und Kontrollen aufgeteilt. Die Prüfchemikalien werden hinzugegeben, und der Wassergehalt wird eingestellt, wie in Nummer 24 beschrieben.
Auswahl und Vorbereitung der im Test zu verwendenden Tiere
17. Die parthenogenetische Art F. candida wird empfohlen, da diese Art im Ringtest der Prüfmethode (11) die Validitätskriterien hinsichtlich der Überlebensquote häufiger erfüllt hat als F. fimetaria. Wenn eine andere Art verwendet wird, muss diese die in Nummer 9 beschriebenen Validitätskriterien erfüllen. Zu Beginn des Tests müssen die Tiere gut gefüttert sein und ein Alter von 23-26 Tagen (F. fimetaria) bzw. von 9-12 Tagen (F. candida) haben. Jedes Replikat muss jeweils 10 männliche und weibliche Tiere (F. fimetaria) bzw. 10 weibliche Tiere (F. candida) enthalten (siehe Anlage 2 und 3). Die synchronisierten Tiere werden zufällig aus den Gefäßen ausgewählt; anschließend werden für jede in ein Replikat eingesetzte Charge der Gesundheitszustand und die physischen Merkmale geprüft. Jede Gruppe von 10/20 Tieren wird in ein zufällig ausgewähltes Testbehältnis gesetzt; bei F. fimetaria werden die großen weiblichen Tiere auswählt, damit die weiblichen Tiere leicht von den männlichen Tieren zu unterscheiden sind.
Herstellung der Prüfkonzentrationen
18. Für die Applikation der Prüfchemikalie kommen vier Methoden in Betracht: 1) Verwendung von Wasser als Trägerstoff zum Mischen der Prüfchemikalie in den Boden; 2) Verwendung eines organischen Lösungsmittels als Trägerstoff zum Mischen der Prüfchemikalie in den Boden, 3) Verwendung von Sand als Trägerstoff zum Mischen der Prüfchemikalie in den Boden und 4) Applikation der Prüfchemikalie auf die Oberfläche des Bodens. Welche Methode jeweils zu verwenden ist, hängt von den Merkmalen der jeweiligen Chemikalie und vom Zweck der Untersuchung ab. Im Allgemeinen wird empfohlen, die Prüfchemikalie in den Boden einzumischen. Es können allerdings Applikationsverfahren entsprechend der Verwendung der Prüfchemikalie in der Praxis erforderlich sein (z.B. Aufsprühen einer flüssigen Formulierung oder Verwendung spezieller Pestizidformulierungen wie z.B. Granulate oder Saatgutbeizen). Die Collembolen werden erst eingesetzt, wenn der Boden mit der Prüfchemikalie gemischt wurde. Wird jedoch die Prüfchemikalie auf den Boden aufgebracht, sind die Collembolen vorher einzusetzen, wobei abgewartet werden muss, bis sie in den Boden eingedrungen sind.
In Wasser lösliche Prüfchemikalie
19. Eine Lösung der Prüfchemikalie wird in entionisiertem Wasser in ausreichender Menge für alle Replikate einer Prüfkonzentration hergestellt. Jede Lösung mit der Prüfchemikalie wird gründlich mit einer Charge des vorgetränkten Bodens gemischt, bevor sie in das Prüfgefäß gegeben wird.
In Wasser nicht lösliche Prüfchemikalie
20. Chemikalien, die zwar nicht in Wasser, dafür aber in organischen Lösungsmitteln löslich sind, können in der geringstmöglichen Menge eines geeigneten Lösungsmittels (z.B. Aceton) gelöst werden. Auch in diesem Fall sind eine angemessene Mischung der Chemikalie im Boden sowie ggf. die Durchmischung mit Quarzsand erforderlich. Es sind jedoch ausschließlich flüchtige Lösungsmittel zu verwenden. Wenn ein organisches Lösungsmittel eingesetzt wird, müssen alle Prüfkonzentrationen sowie eine zusätzliche negative Lösungsmittelkontrolle denselben Mindestgehalt des Lösungsmittels aufweisen. Die Testbehältnisse bleiben eine Zeit lang geöffnet, damit in Verbindung mit der Prüfchemikalie eingebrachte flüchtige Lösungsmittel verdunsten können; dabei ist allerdings sicherzustellen, dass die toxische Chemikalie in dieser Zeit nicht ebenfalls verdunstet.
In Wasser schlecht lösliche Prüfchemikalie und organische Lösungsmittel
21. Bei Chemikalien, die sowohl in Wasser als auch in organischen Lösungsmitteln schlecht löslich sind, wird Quarzsand (als Anteil der Gesamtmenge des dem Boden zugesetzten Sandes) mit der Prüfchemikalie gemischt, bis die gewünschte Prüfkonzentration erreicht ist. Diese Mischung aus Quarzsand und Prüfchemikalie wird zum angefeuchteten Boden hinzugegeben und nach Hinzugabe einer entsprechenden Menge entionisierten Wassers gründlich gemischt, um den erforderlichen Feuchtegehalt zu erhalten. Die endgültige Mischung wird auf die Prüfgefäße verteilt. Dieses Verfahren wird für alle Prüfkonzentrationen wiederholt. Außerdem wird eine geeignete Kontrolle hergestellt.
Aufbringung der Prüfchemikalie auf die Bodenoberfläche
22. Wenn die Prüfchemikalie ein Pestizid ist, kann es angebracht sein, die Chemikalie auf den Boden aufzusprühen. Der Boden wird nach dem Einsetzen der Collembolen behandelt. Zunächst werden die Testbehältnisse mit dem vorgetränkten Bodensubstrat befüllt; anschließend werden die Tiere eingesetzt. Danach werden die Testbehältnisse gewogen. Um eine direkte Exposition der Tiere durch direkten Kontakt mit der Prüfchemikalie zu vermeiden, wird die Prüfchemikalie frühestens eine halbe Stunde nach Einsetzen der Collembolen eingebracht. Die Prüfchemikalie ist mit einer geeigneten Labor-Sprühflasche möglichst gleichmäßig auf den Boden aufzubringen, um ein Versprühen auf dem Feld zu simulieren. Die Applikation muss bei einer Temperatur innerhalb einer Variationsbreite von ± 2 °C erfolgen; bei wässrigen Lösungen, Emulsionen und Dispersionen erfolgt die Applikation mit dem Wasserdurchfluss entsprechend den auf Risikobewertungen beruhenden Empfehlungen. Die Durchflussmenge ist mit einem geeigneten Kalibrierverfahren zu kontrollieren. Spezielle Formulierungen (z.B. Granulate oder Saatgutbeizen) können entsprechend der landwirtschaftlichen Praxis aufgebracht werden. Nach dem Aufsprühen wird Futter hinzugegeben.
Prüfbedingungen
23. Die mittlere Testtemperatur muss bei 20 ± 1 °C liegen (Temperaturbereich 20 ± 2 °C). Der Test wird unter kontrollierten Licht-Dunkel-Zyklen (vorzugsweise 12 Stunden Licht und 12 Stunden Dunkelheit) mit einer Beleuchtungsstärke von 400-800 lx um die Testbehältnisse durchgeführt.
24. Um die Feuchte des Bodens zu ermitteln, werden die Gefäße zu Beginn des Tests, nach Ablauf der halben Testdauer und am Ende des Tests gewogen. Gewichtsverluste von > 2 % werden durch Zugabe entionisierten Wassers ausgeglichen. Wasserverluste können durch Aufrechterhaltung einer hohen Luftfeuchtigkeit ( > 80 %) im Testinkubator reduziert werden.
25. Der pH-Wert ist jeweils am Beginn und am Ende sowohl des Vorversuchs als auch des definitiven Tests zu messen. Die Messungen sind an einer zusätzlichen Kontrolle und an einer zusätzlichen Probe des mit der Prüfchemikalie (in allen Konzentrationen) behandelten Bodens vorzunehmen. Die zusätzliche Kontrolle und die zusätzliche Probe werden in der gleichen Weise wie die Testkulturen hergestellt und gehandhabt, enthalten aber keine Collembolen.
Prüfverfahren und Messungen
26. Für alle Prüfkonzentrationen wird eine geeignete Menge Testboden (entsprechend 30 g Frischgewicht) in die Prüfgefäße gegeben. Außerdem werden Wasserkontrollen ohne die Prüfchemikalie hergestellt. Wenn zur Applikation der Prüfchemikalie ein Trägerstoff verwendet wird, ist zusätzlich zu den Testreihen eine Kontrollreihe mit dem Trägerstoff zu prüfen. Die Konzentration des Lösungsmittels oder des Dispergiermittels sollte mit der Konzentration übereinstimmen, die auch in den Prüfgefäßen mit der Prüfchemikalie verwendet wurde.
27. Die einzelnen Springschwänze werden randomisiert vorsichtig in die verschiedenen Prüfgefäße auf die Bodenoberfläche gesetzt. Um die Tiere möglichst effizient handhaben zu können, kann ein Sauggerät mit niedriger Saugleistung verwendet werden. Die Anzahl der Replikate der Prüfkonzentrationen und der Kontrollen hängt vom jeweiligen Prüfprotokoll ab. Die Prüfgefäße werden zufällig in den Testinkubator gestellt, und die Positionen werden wöchentlich neu randomisiert.
28. Bei F. fimetaria werden 20 adulte Tiere (10 männliche und 10 weibliche Tiere) im Alter von 23-26 pro Testgefäß verwendet. An Tag 21 werden die Collembolen aus dem Boden extrahiert und gezählt. Bei F. fimetaria werden in der für den Test synchronisierten Charge die Geschlechter aufgrund ihrer Größe unterschieden. Die weiblichen Tiere sind deutlich größer als die männlichen (siehe Anlage 3).
29. Bei F. candida sind zehn 9-12 Tage alte juvenile Tiere pro Prüfgefäß zu verwenden. An Tag 28 werden die Collembolen aus dem Boden extrahiert und gezählt.
30. Als geeignetes Futter wird am Anfang des Tests und nochmals nach etwa 2 Wochen in jedes Behältnis eine hinreichende Menge (z.B. 2-10 mg) Trockenhefe in Haushaltsqualität gegeben.
31. Am Ende des Tests werden die Mortalität und die Reproduktionsleistung bewertet. Nach 3 Wochen (F. fimetaria) bzw. nach 4 Wochen (F. candida) werden die Collembolen aus dem Testboden extrahiert (siehe Anlage 4) und gezählt (12). In der Extraktion nicht erfasste Collembolen werden als tot gezählt. Das Extraktions- und das Zählverfahren sind zu validieren. Als Validititäskriterium gilt auch eine Extraktionsleistung von mehr als 95 % juvenilen Tieren; dies ist beispielsweise anhand einer Bodenprobe mit einer bekannten Anzahl an Collembolen zu prüfen.
32. Anlage 2 enthält eine praktische Übersicht und den Zeitplan des Prüfverfahrens.
Prüfprotokoll
Vorversuch
33. Wenn erforderlich, wird ein Vorversuch beispielsweise mit fünf Konzentrationen der Prüfchemikalie von 0,1, 1,0, 10, 100 und 1.000 mg/kg Bodentrockengewicht und zwei Replikate pro Prüfkonzentration und pro Kontrolle vorgenommen. Zusätzliche Informationen aus Untersuchungen ähnlicher Chemikalien oder aus der Literatur hinsichtlich der Mortalität oder der Reproduktionsleistung von Collembolen können ebenfalls bei der Auswahl der im Vorversuch zu verwendenden Konzentrationen herangezogen werden.
34. Um sicherzustellen, dass tatsächlich ein Gelege juveniler Tiere entstanden ist, wird der Vorversuch bei F. fimetaria zwei Wochen und bei F. candida drei Wochen fortgesetzt. Am Ende des Tests werden die Mortalität und die Reproduktionsleistung der Collembolen bewertet. Die Anzahl der adulten und der jungen Tiere wird jeweils protokolliert.
Definitiver Test
35. Zur Ermittlung des ECx-Werts (z.B. EC10 oder EC50) sind zwölf Konzentrationen zu prüfen. Zu empfehlen sind mindestens zwei Replikate pro Prüfkonzentration und sechs Replikate pro Kontrolle. Der Abstandsfaktor kann je nach Dosis-Wirkungs-Beziehung unterschiedlich sein.
36. Zur Bestimmung der NOEC/LOEC sind mindestens fünf Konzentrationen in einer geometrischen Reihe zu prüfen. Zu empfehlen sind vier Replikate je Prüfkonzentration und acht Kontrollen. Die Konzentrationen dürfen sich maximal um den Faktor 1,8 unterscheiden.
37. Ein kombinierter Ansatz ermöglicht die Bestimmung sowohl der NOEC/LOEC als auch des ECx-Werts. Bei diesem kombinierten Ansatz sind acht Behandlungskonzentrationen in einer geometrischen Reihe zu verwenden. Zu empfehlen sind vier Replikate je Behandlung und acht Kontrollen. Die Konzentrationen dürfen sich maximal um den Faktor 1,8 unterscheiden.
38. Wenn im Vorversuch bei der höchsten Konzentration (1.000 mg/kg) keine Wirkungen festzustellen sind, kann der Reproduktionstest als Limit-Test mit der Prüfkonzentration 1.000 mg/kg durchgeführt werden. Mit einem Limit-Test kann nachgewiesen werden, dass bei der Limit-Konzentration keine statistisch signifikante Wirkung gegeben ist. Sowohl für den behandelten Boden als auch für die Kontrollen sind jeweils acht Replikate durchzuführen.
Auswertung der Ergebnisse
39. Wesentlicher Endpunkt ist die Reproduktionsleistung (z.B. gemessen an der Anzahl der pro Prüfgefäß entstandenen juvenilen Tiere). In statistischen Analysen (z.B. durch ANOVA-Verfahren) werden die Ergebnisse der verschiedenen Konzentrationen anhand eines Student-t-Tests, eines Dunnett-Tests oder eines Williams-Tests verglichen. Für die Mittelwerte der einzelnen Konzentrationen werden 95- %-Konfidenzintervalle berechnet.
40. Die Anzahl der überlebenden adulten Tiere in den unbehandelten Kontrollen ist ein wichtiges Validitätskriterium und muss dokumentiert werden. Ebenso wie im Vorversuch sind jedoch im Abschlussbericht auch alle sonstigen Anzeichen für schädliche Wirkungen zu erfassen.
LCx und ECx
41. ECx-Werte einschließlich der entsprechenden oberen und unteren 95- %-Konfidenzintervalle für die einzelnen Parameter werden mit geeigneten statistischen Methoden berechnet (z.B. Logit- oder Weibull-Model oder Trimmed Spearman-Karber-Methode oder einfache Interpolation). Ein ECx-Wert wird ermittelt, indem der x % des Mittelwerts der Kontrollen entsprechende Wert in die gefundene Gleichung eingesetzt wird. Um den EC50-Wert oder einen sonstigen ECx-Wert zu ermitteln, sind sämtliche Daten einer Regressionsanalyse zu unterziehen. Der LC50-Wert wird gewöhnlich mit einer Probit-Analyse oder einem ähnlichen Analyseverfahren bestimmt, bei dem die Binomialverteilung der Mortalitätsdaten berücksichtigt wird.
NOEC/LOEC
42. Wenn eine statistische Analyse beabsichtigt ist, um die NOEC/LOEC zu bestimmen, werden Statistiken für die einzelnen Gefäße benötigt. (Die Gefäße werden jeweils als Replikate betrachtet.) Es sind geeignete statistische Methoden anzuwenden; maßgeblich ist das OECD-Dokument 54 'Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application' (9). Im Allgemeinen werden schädliche Wirkungen der Prüfchemikalie im Vergleich zur Kontrolle einer einseitigen Hypothesenprüfung mit p ≤ 0,05 unterzogen.
43. Die Normalverteilung und die Varianzhomogenität können mit einem geeigneten statistischen Test geprüft werden (z.B. mit dem Shapiro-Wilk- bzw. dem Levene-Test (p ≤ 0,05)). Nach einer einseitigen Varianzanalyse (ANOVA) können Methoden zur multiplen Testung durchgeführt werden. Mit multiplen Tests (z.B. mit dem Dunnett-Test) oder Stepdown-Trendtests (z.B. dem Williams-Test) kann berechnet werden, ob zwischen den Kontrollen und den verschiedenen Prüfkonzentrationen der Prüfchemikalie signifikante Unterschiede (p ≤ 0,05) bestehen. Welcher Test vorzunehmen ist, wird im OECD-Dokument 54 (9) beschrieben. Andernfalls müssen nicht parametrische Methoden (z.B. ein U-Test mit Bonferroni-/Holm-Korrektur oder ein Jonckheere-Terpstra- Trendtest) verwendet werden, um die NOEC und die LOEC zu bestimmen.
Limit-Test
44. Wenn ein Limit-Test (Vergleich der Kontrolle mit einer einzigen Prüfkonzentration) durchgeführt wurde und die Voraussetzungen für parametrische Testverfahren (Normalität, Homogenität) erfüllt sind, können metrische Antworten mit dem Student-Test (t-Test) ausgewertet werden. Sind diese Bedingungen nicht erfüllt, so kann ein t-Test für ungleiche Varianzen (Welch-Test) oder ein nichtparametrischer Test wie der Wilcoxon-Mann- Whithey-U-Test verwendet werden.
45. Um signifikante Unterschiede zwischen den Kontrollen (Kontrollen und Lösungsmittelkontrollen) zu ermitteln, können die Replikate der einzelnen Kontrollen geprüft werden, wie für den Limit-Test beschrieben. Werden bei diesen Tests keine signifikanten Unterschiede festgestellt, können alle Replikate (Kontrollen und Lösungsmittelkontrollen) zusammengefasst werden. Ansonsten sind alle Behandlungen mit der Lösungsmittelkontrolle zu vergleichen.
Prüfbericht
46. Der Testbericht muss mindestens folgende Angaben enthalten:
Prüfchemikalie
Testorganismen
Prüfbedingungen
Prüfergebnisse:
(1) Wiles, JA, und Krogh, PH (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. Handbook of soil invertebrate toxicity tests (Hrsg. H Løkke und CAM Van Gestel), S. 131-156. John Wiley & Sons, Ltd., Chichester
(2) ISO (1999) Bodenbeschaffenheit - Wirkung von Schadstoffen auf Collembolen (Folsomia candida) - Verfahren zur Bestimmung der Wirkung auf die Reproduktionsleistung, Nr. 11267, International Organisation for Standardisation, Genf.
(3) Burges, A, und Raw, F. (Hrsg.) (1967) Soil Biology. Academic Press. London
(4) Petersen, H., und Luxton, M. (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388
(5) Petersen, H. (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111- 118
(6) Hopkin, S.P. (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330 S. (ISBN 0-19- 854084-1)
(7) Ulber, B. (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In: New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Hrsg.), Unterlagen des VI. internationalen Kolloquiums über Bodenzoologie (International Colloquium on Soil Zoology), Louvainla- Neuve (Belgien), 30. August bis 2. September 1982, I Dieu-Brichart, Ottignies-Louvainla-Neuve, S. 261-268
(8) In diesem Anhang Kapitel C.36 Reproduktionstest mit Raubmilben (Hypoaspis (Geolaelaps) aculeifer) in Bodenproben
(9) OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Paris
(10) Scott-Fordsmand, J.J., und Krogh, P.H.(2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen, 61 S., Danish Ministry for the Environment.
(11) Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project No. 1256, S. 66.
(12) Krogh, P.H., Johansen, K., und Holmstrup, M. (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201-205
(13) Fjellberg, A. (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
(14) Edwards, C.A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, London, S. 412-416
(15) Goto, H.E. (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138-140.
| Begriffsbestimmungen | Anlage 1 |
Die folgenden Begriffsbestimmungen beziehen sich auf diese Prüfmethode. (Bei dieser Prüfung werden die Wirkungskonzentrationen als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens ausgedrückt.)
Chemikalie: ein Stoff oder ein Gemisch.
NOEC (höchste geprüfte Konzentration ohne beobachtete schädliche Wirkung): die Konzentration der Prüfchemikalie, bei der keine Wirkung beobachtet wird; bei dieser Prüfung hat die der NOEC entsprechende Konzentration innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle keine statistisch signifikante Wirkung (p < 0,05).
LOEC (niedrigste geprüfte Konzentration, bei der noch schädliche Wirkungen beobachtet werden): niedrigste Konzentration der Prüfchemikalie innerhalb einer bestimmten Expositionsdauer mit statistisch signifikanter Wirkung (p < 0,05) im Vergleich zur Kontrolle.
ECx (Konzentration mit einer Wirkung von x %): Konzentration, bei der innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle eine Wirkung von x % auf die Testorganismen zu verzeichnen ist; der EC50-Wert beispielsweise ist die Konzentration, bei der während einer bestimmten Expositionsdauer bei 50 % einer exponierten Population eine Wirkung auf einen Endpunkt der Prüfung erwartet wird.
Prüfchemikalie: ein beliebiger Stoff oder ein beliebiges Gemisch, der/das nach dieser Methode geprüft wird.
| Wesentliche Schritte und Verlauf eines Colembolen-Tests | Anlage 2 |
Die einzelnen Schritte des Tests lassen sich wie folgt zusammenfassen:
|
Zeitpunkt (Tag) | Schritt |
| - 23 bis - 26 | Herstellen einer synchronen F.-fimetaria-Kultur |
| - 14 | Herstellen des künstlichen Bodens (Mischen trockener Bestandteile)
Prüfung des pH-Werts des künstlichen Bodens und entsprechende Einstellung Messung der maximalen Wasserrückhaltefähigkeit des Bodens |
| - 9 bis - 12 | Herstellen einer synchronen F.-candida-Kultur |
| - 2 bis - 7 | Vortränken des Bodens |
| - 1 | Aufteilung der juvenilen Tiere in Chargen
Herstellen der Stammlösungen und Applikation der Prüfchemikalie, wenn ein Lösungsmittel benötigt wird |
| 0 | Herstellen der Stammlösungen und Applikation der Prüfchemikalie, wenn eine feste Chemikalie oder eine Lösung in Wasser verwendet oder eine oberflächliche Applikation vorgenommen werden muss
Messen des pH-Werts des Bodens und Wiegen der Behältnisse Zugabe des Futters; Einsetzen der Collembolen |
| 14 | Vorversuch mit F. fimetaria: Beenden des Tests, Extrahieren der Tiere, Messen des pH-Werts des Bodens und des Wasserverlusts (Gewicht)
Definitive Tests: Messen des Feuchtegehalts Auffüllen mit Wasser und Zugabe von 2-10 mg Hefe |
| 21 | Definitiver Test mit F. fimetaria: Beenden des Tests, Extrahieren der Tiere, Messen des pH-Werts des Bodens und des Wasserverlusts (Gewicht)
Vorversuch mit F. candida: Beenden des Tests, Extrahieren der Tiere, Messen des pH-Werts des Bodens und des Wasserverlusts (Gewicht) |
| 28 | Definitiver Test mit F. candida: Beenden des Tests, Extrahieren der Tiere, Messen des pH-Werts des Bodens und des Wasserverlusts (Gewicht) |
| Leitlinien zur Zucht und zur Synchronisierung von F. fimetaria und F. candida | Anlage 3 |
Die Angaben in diesen Leitlinien zu Zeitpunkten und Dauer der einzelnen Schritte sind für jeden einzelnen Collembolen-Stamm gesondert zu prüfen, um sicherzustellen, dass der Zeitrahmen eine hinreichende Synchronisierung der juvenilen Tiere ermöglicht. Der Tag für die Entnahme der Eier und der synchronen juvenilen Tiere richtet sich nach dem Zeitpunkt der Eiablage nach Einsetzen der adulten Tiere in ein frisches Substrat und nach dem Zeitpunkt des Schlüpfens.
Es wird eine Dauerkultur bestehend aus z.B. 50 Behältnissen/Petrischalen empfohlen. Die Stammkultur ist wöchentlich mit ausreichend Futter und Wasser zu versorgen; Futterreste und tote Tiere werden entfernt. Wenn sich zu wenige Collembolen auf dem Substrat befinden, kann es zu einer Inhibition durch verstärktes Wachstum von Pilzen kommen. Wird die Stammkultur zu häufig zur Gewinnung von Eiern genutzt, kann die Kultur ermüden. Anzeichen einer Erschöpfung sind tote adulte Tiere und Schimmel auf dem Substrat. Die nach der Erzeugung synchroner Tiere verbliebenen Eier können zur Verjüngung der Kultur genutzt werden.
In einer synchronen F. fimetaria-Kultur sind die männlichen Tiere hauptsächlich aufgrund ihrer Größe von weiblichen Tieren zu unterscheiden. Die männlichen Tiere sind deutlich kleiner als die weiblichen Tiere und bewegen sich rascher als die weiblichen Tiere. Trotzdem erfordert die zuverlässige Erkennung der Geschlechter ein wenig Übung; eine Bestätigung kann durch eine mikroskopische Kontrolle des Genitalbereichs erfolgen (13).
1. Aufzucht
1.a. Herstellen des Kultursubstrats
Als Kultursubstrat wird Gips (Calciumsulfat) mit Aktivkohle verwendet. In diesem feuchten Substrat absorbiert die Aktivkohle freigesetzte Gase und Exkremente (14) (15). Um die Beobachtung der Collembolen zu erleichtern, können verschiedene Formen von Holzkohle verwendet werden. Für F. candida und F. fimetaria beispielsweise wird Holzkohlepulver verwendet. (Entsprechend entsteht ein schwarzgrauer Gips.)
Bestandteile des Substrats:
oder
Die Substratmischung muss sich vor der Verwendung absetzen können.
1.b. Bebrütung
Collembolen werden z.B. in Petrischalen (90 mm × 13 mm) gehalten, deren Boden mit einem 0,5 cm starken Gipssubstrat bzw. Holzkohlesubstrat bedeckt ist. Bei einer Temperatur von 20 ± 1 °C wird eine Photoperiode mit 12 h Licht und 12 h Dunkelheit (bei 400-800 lx) eingerichtet. Die Behältnisse sind ständig feucht zu halten, damit eine relative Luftfeuchte in den Behältnissen von 100 % gewährleistet ist. Dies kann durch freies Wasser im porösen Gips gewährleistet werden; allerdings ist die Entstehung eines Wasserfilms auf der Gipsoberfläche zu vermeiden. Wasserverluste können durch Zufuhr feuchter Umgebungsluft verhindert werden. Tote Tiere sind aus den Behältnissen zu entfernen, da sie die Schimmelbildung fördern könnten. Um die Eiablage anzuregen, müssen die adulten Tiere in Petrischalen mit frisch angesetztem Gips-/Aktivkohle- Substrat gesetzt werden.
1.c. Futter
Als einziges Futter wird sowohl für F. candida als auch für F fimetaria Trockenhefe verwendet. Um Schimmelbildung vorzubeugen, wird frisches Futter ein- oder zweimal wöchentlich bereitgestellt. Das Futter wird in einem kleinen Haufen unmittelbar auf den Gips gegeben. Die Menge an bereitgestellter Backhefe ist der Größe der Collembolen-Population anzupassen, im Allgemeinen sind jedoch 2-15 mg ausreichend.
2. Synchronisierung
Der Test wird mit synchronisierten Tieren durchgeführt, um hinsichtlich des Larvenstadiums und der Größe der Tiere eine homogene Struktur zu gewährleisten. Außerdem ermöglicht die Synchronisierung bei F. fimetaria die Unterscheidung zwischen männlichen und weiblichen Tieren ab einem Alter von 3 Wochen aufgrund des Geschlechtsdimorphismus (d. h. des Größenunterschieds). Im Folgenden wird ein Verfahren zur Gewinnung synchronisierter Tiere vorgeschlagen. (In der Praxis können sich einzelne Schritte unterscheiden.)
2.a. Synchronisierung
2.b. Behandlung der Collembolen zu Beginn des Tests
3. Alternative Collembolen-Arten
Für eine Untersuchung mit dieser Prüfmethode können auch andere Collembolen-Arten verwendet werden (beispielsweise Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi oder Mesaphorura macrochaeta). Damit eine andere Art ausgewählt werden kann, müssen jedoch verschiedene Anforderungen erfüllt sein:
| Extraktion und Zählen der Tiere | Anlage 4 |
1. Zwei Extraktionsmethoden kommen in Betracht:
1.a. Erste Methode: Es kann ein auf den Grundsätzen von MacFadyen (1) beruhendes Extraktionsgerät mit kontrolliertem Temperaturgefälle verwendet werden. Die Wärme strömt (geregelt durch einen Thermistor auf der Oberfläche der Bodenprobe) aus einem Heizelement oben im Extraktionsbehälter. Die Temperatur in der gekühlten Flüssigkeit um das Aufnahmegefäß wird ebenfalls durch einen Thermistor auf der Oberfläche des (unter dem Boden befindlichen) Aufnahmegefäßes geregelt. Die Thermistoren sind an eine programmierbare Steuerung angeschlossen, die die Temperatur nach einem voreingestellten Programm regelt. Die Tiere fallen in das gekühlte Aufnahmegefäß (2 °C), dessen Boden mit Gips/Holzkohle bedeckt ist. Die Extraktion beginnt bei 25 °C; über insgesamt 48 Stunden wird die Temperatur alle 12 h automatisch um 5 °C erhöht. Nach 12 h bei einer Temperatur von 40 °C ist die Extraktion beendet.
1.b. Zweite Methode: Nach der Inkubationsdauer des Versuchs wird die Anzahl der juvenilen Collembolen durch Flotation ermittelt. Zu diesem Zweck wird der Test in Gefäßen mit einem Volumen von etwa 250 ml durchgeführt. Am Ende des Tests werden ca. 200 ml destilliertes Wasser hinzugegeben. Der Boden wird mit einem feinen Pinsel vorsichtig umgerührt, damit die Collembolen auf der Wasseroberfläche aufschwimmen können. Zum Wasser kann ein geringer Anteil (etwa 0,5 ml) schwarze Fotofarbe von Kentmere hinzugegeben werden, um durch Verstärken des Kontrasts zwischen dem Wasser und den weißen Collembolen die Zählung zu erleichtern. Die Farbe ist für Collembolen nicht giftig.
2. Zählen:
Die Anzahl der Tiere kann mit bloßem Auge oder unter einem Lichtmikroskop mit einem Trägernetz über dem Flotationsgefäß oder durch Fotografieren der Oberfläche der einzelnen Gefäße und anschließendes Zählen der Collembolen auf Vergrößerungen oder projizierten Bildern ermittelt werden. Außerdem können Verfahren der digitalen Bildverarbeitung zum Zählen genutzt werden (12). Alle Verfahren müssen validiert werden.
| Ermittlung der maximalen Wasserrückhaltefähigkeit des Bodens | Anlage 5 |
Die folgende Methode hat sich zur Bestimmung der maximalen Wasserrückhaltefähigkeit des Bodens bewährt. Sie wird in Anhang C von ISO DIS 11268-2 (Bodenbeschaffenheit - Wirkungen von Schadstoffen auf Regenwürmer (Eisenia fetida), Teil 2: Bestimmung der Wirkung auf die Reproduktionsleistung) erläutert.
Mit einer geeigneten Vorrichtung zur Probenahme (etwa einem Schneckenrohr) wird eine bestimmte Menge (z.B. 5g) des Testsubstrats entnommen. Der Boden des Rohres wird mit einem Stück feuchtem Filterpapier bedeckt; anschließend wird das Rohr in einem Wasserbad auf ein Gestell gesetzt. Das Rohr wird allmählich eingetaucht, bis das Wasser oberhalb des Bodens steht. Das Rohr wird etwa drei Stunden im Wasser belassen. Da das Wasser nicht vollständig von den Kapillaren des Bodensubstrats aufgenommen werden kann, wird das Rohr zur Entwässerung zwei Stunden in einem geschlossenen Gefäß (um ein Austrocknen zu verhindern) auf ein Bett aus sehr nassem, fein gemahlenem Quarzsand gesetzt. Anschließend wird die Probe gewogen und bei 105 °C auf eine konstante Masse getrocknet. Die Wasserrückhaltefähigkeit (WHC = Water Holding Capacity) wird wie folgt berechnet:
![]()
Dabei sind:
S = mit Wasser gesättigtes Substrat + Masse des Rohrs + Masse des Filterpapiers
T = Tara (Masse des Rohrs + Masse des Filterpapiers)
D = Trockenmasse des Substrats
| pH-Bestimmung des Bodens | Anlage 6 |
Die folgende Methode zur Ermittlung des pH-Werts eines Bodensubstrats beruht auf der Beschreibung in ISO DIS 10390: Bodenbeschaffenheit - Bestimmung des pH-Wertes.
Eine bestimmte Substratmenge wird mindestens 12 Stunden bei Raumtemperatur getrocknet. Eine Bodensuspension (mindestens 5 g Boden) wird mit dem fünffachen Volumen einer 1-M-Lösung Kaliumchlorid (KCl) in Analysequalität oder einer 0,01-M-Calciumchlorid-Lösung (CaCl2) in Analysequalität hergestellt. Die Suspension wird fünf Minuten sorgfältig geschüttelt und bleibt dann mindestens 2 und höchstens 24 Stunden zum Ausfällen stehen. Der pH-Wert der flüssigen Phase wird mit einem pH-Messgerät gemessen, das vor jeder Messung mit einer geeigneten Reihe an Pufferlösungen (z.B. pH 4,0 und 7,0) kalibriert wurde.
C.40. Lebenszyklus-Toxizitätstests bei Chironomiden in Sediment-Wasser-Systemen mit dotiertem Sediment
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 233 (2010). Sie dient der Bewertung der Wirkung einer lebenslangen Chemikalienexposition sedimentbewohnender Larven von Chironomus sp., einem in Süßwasser lebenden Zweiflügler, unter vollständiger Berücksichtigung der 1. Generation (Generation P) und eines frühen Stadiums der 2. Generation (Generation F1). Die Methode ist eine Erweiterung der bestehenden Prüfmethoden C.28 (1) bzw. C.27 (15), bei der die Exposition über dotiertes Wasser bzw. über ein dotiertes Sediment erfolgt. Dabei werden bestehende Protokolle für Toxizitätstests mit Chironomus riparius und Chironomus dilutus (früher auch als C. tentans bezeichnet (2)) berücksichtigt, die in Europa und in Nordamerika entwickelt (3)(4)(5)(6)(7)(8)(9) und anschließend in Ringtests geprüft wurden (1)(7)(10)(11)(12). Auch andere gut dokumentierte Chironomiden-Arten wie Chironomus yoshimatsui (13)(14) sind geeignet. Die Exposition erfolgt insgesamt über eine Dauer von etwa 44 Tagen (C. riparius und C. yoshimatsui) bzw. ca. 100 Tagen (C. dilutus).
2. Für diese Prüfmethode wird sowohl die Wasser- als auch Sedimentexposition beschrieben. Die Wahl des Szenarios hängt von der intendierten Anwendung ab. Die Exposition über Wasser durch Dotieren der Wassersäule soll Sprühverluste beim Aufbringen von Pestiziden simulieren. Dieses Szenario erfasst die Ausgangsspitzen der Konzentration im Oberflächenwasser. Die Dotierung des Wassers ist auch zur Simulation anderer Expositionstypen geeignet (einschließlich Austritt von Chemikalien). Für Anreicherungsprozesse in Sedimenten über Zeiträume, die die Testdauer überschreiten, ist diese Prüfmethode hingegen nicht geeignet. In diesem Fall sowie wenn die Pestizide vorwiegend durch Ablauf in Wasserkörper gelangen, kann ein Prüfprotokoll mit einem dotierten Sediment eher angemessen sein. Sind andere Expositionsszenarien von Interesse, kann das Prüfprotokoll leicht entsprechend angepasst werden. Wenn die Verteilung der Prüfchemikalie zwischen der Wasserphase und der Sedimentschicht nicht von Belang ist und die Adsorption in das Sediment minimiert werden muss, kann die Verwendung eines künstlichen Sedimentsurrogats (z.B. Quarzsand) in Erwägung gezogen werden.
3. An sedimentbewohnenden Organismen zu testende Chemikalien können in Sedimenten eine lange Persistenz haben. Bei sedimentbewohnenden Organismen kommen mehrere Expositionspfade in Betracht. Die relative Bedeutung der einzelnen Expositionspfade und die Geschwindigkeit, mit der diese jeweils zu den gesamten toxischen Wirkungen beitragen, hängen von den physikalisch-chemischen Eigenschaften der betreffenden Chemikalie ab. Bei stark absorbierenden Chemikalien und bei kovalent an das Sediment gebundenen Chemikalien kann die Aufnahme von Schadstoffen über die Nahrung einen wichtigen Expositionspfad darstellen. Die Toxizität hoch lipophiler Chemikalien sollte nicht unterschätzt werden, weshalb gegebenenfalls vor Applikation der Prüfchemikalie dem Sediment Futter hinzugegeben werden sollte (siehe Nummer 31). Daher können alle Expositionspfade und alle Lebensstadien berücksichtigt werden.
4. Zu messende Endpunkte sind die Gesamtzahl der geschlüpften Imagines (1. und 2. Generation), die Entwicklungsrate (1. und 2. Generation), das Geschlechterverhältnis vollständig entwickelter und lebendiger adulter Tiere (1. und 2. Generation), die Anzahl der Eigelege pro weibliches Tier (nur 1. Generation) und die Fertilität der Eigelege (1. Generation).
5. Es wird nachdrücklich empfohlen, formuliertes Sediment zu verwenden, da es gegenüber natürlichen Sedimenten mehrere Vorteile hat:
6. Definitionen der verwendeten Begriffe sind Anlage 1 zu entnehmen.
7. Chironomiden-Larven im ersten Larvenstadium (L1-Larven) werden einem bestimmten Konzentrationsbereich der Prüfchemikalie im Sediment-Wasser-System ausgesetzt. Zu Beginn des Tests werden die L1-Larven (1. Generation) in die Prüfgefäße mit dem dotierten Sediment gesetzt; alternativ kann die Prüfchemikalie auch erst nach dem Einsetzen der Larven zum Wasser hinzugegeben werden. Die Schlupfrate, der Zeitraum bis zum Schlüpfen und das Geschlechterverhältnis der vollständig entwickelten und lebenden Mücken werden bestimmt. Die geschlüpften Imagines werden in Zuchtkäfige umgesetzt, um die Schwarmbildung, die Paarung und die Eiablage zu fördern. Die Anzahl der entstandenen Eigelege und die Fertilität der Eigelege werden ermittelt. Aus diesen Eigelegen werden L1-Larven der 2. Generation im ersten Entwicklungsstadium entnommen. Die Larven werden in frisch vorbereitete Prüfgefäße gesetzt (Dotierung wie bei der 1. Generation), um die Lebensfähigkeit der 2. Generation anhand der Schlupfrate, des Zeitraums bis zur Emergenz und des Geschlechterverhältnisses der vollständig entwickelten und lebenden Mücken zu bestimmen. (Anlage 5 enthält Abbildungen zur Veranschaulichung des Lebenszyklustests.) Alle Daten werden entweder mit einem Regressionsmodell analysiert, um die Konzentration zu ermitteln, bei der sich für den relevanten Endpunkt eine Reduzierung um X % ergibt, oder einer Hypothesenprüfung zur Bestimmung der NOEC (höchste geprüfte Konzentration ohne beobachtete schädliche Wirkung) unterzogen. Hierzu sind die Reaktionen der Prüfchemikalien anhand statistischer Tests mit der Reaktion der Kontrollen zu vergleichen. Bei der Prüfung mit dotiertem Wasser sind im Falle sich rasch abbauender Chemikalien die späteren Entwicklungsstadien der einzelnen Generationen (z.B. das Puppenstadium) unter Umständen erheblich niedrigeren Konzentrationen im Überstandswasser ausgesetzt als die Larven im ersten Entwicklungsstadium. Wenn dies als problematisch betrachtet und ein für alle Stadien vergleichbares Expositionsniveau benötigt wird, sind die folgenden Änderungen der Prüfmethode in Erwägung zu ziehen:
Die entsprechenden Änderungen können nur bei dem Verfahren mit dotiertem Wasser, nicht aber bei der Prüfung mit einem dotierten Sediment vorgenommen werden.
Informationen zur Prüfchemikalie
8. Wasserlöslichkeit und Dampfdruck der Prüfchemikalie und der log-Kow-Wert, die gemessene oder berechnete Verteilung der Prüfchemikalie im Sediment sowie ihre Stabilität im Wasser und im Sediment sollten bekannt sein. Ein zuverlässiges analytisches Verfahren für die Quantifizierung der Prüfchemikalie im Überstandswasser, Porenwasser und Sediment mit bekannter und dokumentierter Genauigkeit und Nachweisgrenze sollte vorhanden sein. Weitere nützliche Informationen sind z.B. die Strukturformel und der Reinheitsgrad der Prüfchemikalie. Informationen über die Persistenz und das Verhalten der Prüfchemikalie in der Umwelt (zu beurteilen u. a. anhand der Verlustrate sowie des abiotischen und biotischen Abbaus). Hinweise zu Prüfchemikalien mit physikalisch-chemischen Merkmalen, welche die Durchführung des Tests erschweren, sind Quelle (16) zu entnehmen.
9. Durch regelmäßige Tests mit Referenzchemikalien kann sichergestellt werden, dass sich die Empfindlichkeit der Laborpopulation nicht geändert hat. Ebenso wie bei Daphnien ist ein akuter Test über eine Dauer von 48 h ausreichend (nach 17). Solange noch keine validierte Leitlinie für einen Test zur akuten Toxizität verfügbar ist, kann auch ein Test zur Ermittlung der chronischen Toxizität (siehe in diesem Anhang Kapitel C.28) durchgeführt werden. Die folgenden Referenzstoffe beispielsweise wurden erfolgreich in Ringtests und Validierungsstudien verwendet: Lindan, Trifluralin, Pentachlorphenol, Cadmiumchlorid und Kaliumchlorid (1) (3)(6)(7)(18).
10. Der Test ist gültig, wenn folgende Bedingungen erfüllt sind:
Prüfgefäße und Zuchtkäfige
11. Die Larven werden der Prüfchemikalie in 600-ml-Glasbechergläsern mit einem Durchmesser von 8,5 cm ausgesetzt (siehe Anlage 5). Andere Gefäße sind ebenfalls geeignet, sofern sie Überstandswasser und Sediment in entsprechender Höhe aufnehmen können. Die Sedimentoberfläche muss so bemessen sein, dass auf jede Larve 2-3 cm2 kommen. Das Verhältnis zwischen Sedimentschicht und Überstandswasser beträgt 1:4. Die Zuchtkäfige (B ×H ×T jeweils mindestens 30 cm) werden oben und mindestens auf einer Seite mit einer Gaze (Maschenweite ca. 1 mm) verschlossen (siehe Anlage 5). In jeden Käfig wird eine 2-l-Kristallisierungsschale mit Testwasser und dem Sediment zur Eiablage gestellt. Auch bei der Kristallisierungsschale muss das Verhältnis zwischen Sedimentschicht und Überstandswasser etwa 1:4 betragen. Nachdem die Eigelege aus der Kristallisierungsschale entnommen wurden, werden sie in eine 12-Well Mikrotiterplatte gegeben (jeweils ein Eigelege pro Vertiefung mit jeweils mindestens 2,5 ml Wasser aus der dotierten Kristallisierungsschale); anschließend werden die Platten mit einem Deckel verschlossen, um signifikante Verdunstungsverluste auszuschließen. Alternativ können auch andere zur Aufnahme der Eigelege geeignete Gefäße verwendet werden. Mit Ausnahme der Mikrotiterplatten müssen alle Prüfgefäße und sonstigen Geräte, die mit dem Prüfsystem in Kontakt kommen, vollständig aus Glas oder einem anderen chemisch inerten Material (z.B. Polytetrafluorethylen) bestehen.
Auswahl der Prüfspezies
12. Als Prüfspezies sollte bevorzugt Chironomus riparius eingesetzt werden. Alternativ kann auch C. yoshimatsui verwendet werden. C. dilutus ist ebenfalls geeignet, aber schwieriger zu handhaben und erfordert eine längere Prüfdauer. Einzelheiten zu den Anzuchtverfahren für C. riparius sind Anlage 2 zu entnehmen. Informationen zu Kulturbedingungen sind auch für C. dilutus (5) und C. yoshimatsui (14) verfügbar. Die Identität der Spezies ist vor der Prüfung zu bestätigen, allerdings ist dies nicht vor jedem Test erforderlich, wenn die Organismen aus laboreigener Zucht stammen.
Sediment
13. Vorzugsweise ist formuliertes Sedimentmaterial (so genanntes rekonstituiertes, künstliches oder synthetisches Sediment) zu verwenden. Wenn jedoch natürliches Sediment verwendet wird, so ist es zu charakterisieren (zumindest pH-Wert und Gehalt an organischem Kohlenstoff; die Bestimmung sonstiger Parameter wie C/N- Verhältnis und Granulometrie wird ebenfalls empfohlen). Das Sediment muss frei von Verunreinigungen sowie von Konkurrenten und Fressfeinden der Chironomidlarven sein. Außerdem wird empfohlen, die Sedimente vor dem Versuch sieben Tage unter Testbedingungen zu akklimatisiern. Für den Versuch wird das folgende formulierte Sediment (siehe (1)) empfohlen (1)(20)(21):
14. Die Herkunft von Torf, Kaolin-Ton und Sand muss bekannt sein. Die Bestandteile des Sediments sind auf chemische Verunreinigungen (z.B. durch Schwermetalle, chlororganische Verbindungen, phosphororganische Verbindungen) zu prüfen. Ein Beispiel für die Herstellung des formulierten Sediments ist in Anlage 3 beschrieben. Die Bestandteile können auch in trockenem Zustand gemischt werden, sofern nachgewiesen ist, dass es nach Zugabe des Überstandswassers nicht zu einer Auftrennung der Sedimentbestandteile kommt (z.B. mit aufschwimmenden Torfpartikeln) und dass der Torf bzw. das Sediment ausreichend konditioniert ist.
Wasser
15. Alle Wassersorten, die den chemischen Eigenschaften von zugelassenem Verdünnungswasser gemäß den Anlagen 2 und 4 entsprechen, sind als Testwasser geeignet. Natürliches Wasser (Oberflächen- oder Grundwasser), rekonstituiertes Wasser (siehe Anlage 2) oder entchlortes Leitungswasser sind als Hälterungs- und Verdünnungswasser zulässig, wenn die Chironomiden hierin während der Zucht- und Testphase ohne Stressanzeichen überleben. Bei Testbeginn muss der pH-Wert des Testwassers zwischen 6 und 9 liegen, und die Gesamthärte des Wassers darf nicht mehr als 400 mg/l (in CaCO3) betragen. Wird jedoch ein Ionenaustausch zwischen den Härteionen und der Prüfchemikalie vermutet, ist Wasser geringerer Härte zu verwenden (und somit in diesem Fall das Elendt-Medium M4 zu vermeiden). Das Wasser muss über die gesamte Testdauer von gleichbleibender Qualität sein. Die Qualitätsparameter des Wassers gemäß Anlage 4 sind mindestens zweimal jährlich bzw. immer dann zu messen, wenn der Verdacht besteht, dass sie sich erheblich verändert haben.
Stammlösungen - dotiertes Wasser
16.a. Die Prüfkonzentrationen werden auf der Grundlage der Konzentrationen in der Wassersäule, d. h. im Überstandswasser, berechnet. Die Prüflösungen werden in der Regel durch Verdünnung einer Stammlösung in den gewünschten Konzentrationen zubereitet. Stammlösungen sollten möglichst durch Auflösung der Prüfchemikalie im Testwasser hergestellt werden. In einigen Fällen kann der Einsatz von Lösungs- oder Dispersionsmitteln erforderlich sein, um eine Stammlösung von geeigneter Konzentration zu erzielen. Geeignete Lösungsmittel sind beispielsweise Aceton, Ethylenglykol-Monoethylether, Ethylenglykol- Dimethylether, Dimethylformamid und Triethylenglykol. Geeignete Dispersionsmittel sind etwa Cremophor RH40, Tween 80, Methylzellulose 0,01 % und HCO-40. Die Konzentration des Lösungsvermittlers in dem endgültigen Prüfmedium sollte auf ein Mindestmaß (d. h. ≤ 0,1 ml/l) beschränkt und bei allen Behandlungen gleich sein. Wird ein Lösungsvermittler verwendet, darf er keine signifikanten Wirkungen auf die Überlebensquote haben, was anhand einer Lösungsmittelkontrolle im Vergleich mit einer negativen (Wasser-)Kontrolle nachzuweisen ist. Es sollten jedoch alle Anstrengungen unternommen werden, um den Einsatz derartiger Stoffe zu vermeiden.
Stammlösungen - dotiertes Sediment
16.b. Die dotierten Sedimente der gewünschten Konzentration werden in der Regel zubereitet, indem eine Lösung der Prüfchemikalie direkt dem Sediment hinzugegeben wird. Eine Stammlösung der in entionisiertem Wasser gelösten Prüfchemikalie wird mithilfe eines Walzwerks oder Futtermischers oder per Hand mit dem formulierten Sediment gemischt. Wenn die Prüfchemikalie im Wasser schwer löslich ist, kann sie in dem kleinstmöglichen Volumen eines geeigneten organischen Lösungsmittels (z.B. Hexan, Aceton oder Chloroform) gelöst werden. Diese Lösung wird anschließend mit 10 g feinem Quarzsand je Prüfgefäß gemischt. Es wird abgewartet, bis das Lösungsmittel vollständig aus dem Sand verdunstet ist; danach wird der Sand mit einer geeigneten Menge des Sediments gemischt. Um die Prüfchemikalie zu lösen, zu dispergieren oder zu emulgieren, dürfen nur sich leicht verflüchtigende Lösungsmittel verwendet werden. Bei der Zubereitung des Sediments ist die in der Mischung von Prüfchemikalie und Sand enthaltene Sandmenge zu berücksichtigen (d. h. das Sediment sollte mit weniger Sand zubereitet werden). Es ist darauf zu achten, dass die Prüfchemikalie mit dem Sediment gut durchmischt wird, damit sie in dem Sediment homogen verteilt ist. Gegebenenfalls können Teilproben analysiert werden, um den Homogenitätsgrad zu bestimmen.
17. Der Versuchsaufbau bezieht sich auf die gewählte Anzahl und den Abstand der Prüfkonzentrationen, die Anzahl der Prüfgefäße je Konzentration und die Anzahl der Larven je Gefäß sowie die Anzahl der Kristallisierungsschalen und der Zuchtkäfige. Im Folgenden wird der Versuchsaufbau für die Ermittlung der ECx und der NOEC sowie ein Limit-Test beschrieben.
Versuchsaufbau für die Analyse durch Regression
18. Die Konzentration mit beobachteter Wirkung (ECx) und der für die Wirkung der betreffenden Prüfchemikalie relevante Konzentrationsbereich sind durch den Versuch abzudecken, damit der Endpunkt nicht über die erzeugten Daten hinaus extrapoliert werden muss. Extrapolationen weit unter der niedrigsten oder über der höchsten Konzentration müssen vermeiden werden. Ein Vorversuch nach den Prüfmethoden C.27 oder C.28 kann für die Auswahl eines geeigneten Konzentrationsbereichs hilfreich sein.
19. Für die Bestimmung von ECx werden mindestens fünf Konzentrationen und acht Replikate pro Konzentration benötigt. Für jede Konzentration müssen zwei Zuchtkäfige (A und B) verwendet werden. Die acht Replikate werden in zwei Gruppen von jeweils vier Replikaten für die beiden Zuchtkäfige aufgeteilt. Diese Zusammenführung der Replikate ist aufgrund der Anzahl der Mücken erforderlich, die pro Käfig benötigt werden, um die Reproduktionsleistung zuverlässig bestimmen zu können. Für die 2. Generation werden wieder acht Replikate verwendet, die aus den der Prüfchemikalie ausgesetzten Populationen in den Zuchtkäfigen hervorgegangen sind. Die Konzentrationen dürfen sich höchstens um den Faktor 2 unterscheiden (eine Ausnahme könnte gemacht werden im Fall einer schwachen Steigung der Dosis- Wirkungs-Kurve). Die Anzahl der Replikate pro Behandlung kann auf sechs (drei pro Zuchtkäfig) reduziert werden, wenn die Anzahl der Prüfkonzentrationen mit unterschiedlicher Wirkung erhöht wird. Eine höhere Anzahl an Replikaten oder eine Verkürzung der Intervalle zwischen den Prüfkonzentrationen führt tendenziell zu engeren Konfidenzintervallen um den ECx-Wert.
Versuchsaufbau für die Bestimmung einer NOEC
20. Zur Bestimmung einer NOEC sind fünf Prüfkonzentrationen mit mindestens acht Replikaten (jeweils 4 pro Zuchtkäfig (A und B)) zu verwenden; der Abstandsfaktor zwischen den einzelnen Konzentrationen darf nicht größer als 2 sein. Die Anzahl der Replikate muss ausreichen, um eine angemessene statistische Aussagekraft zu gewährleisten, mit der sich eine Differenz von 20 % zur Kontrollkonzentration bei einem Signifikanzniveau von 5 % (α = 0,05) nachweisen lässt. Die Entwicklungsrate, Fekundität und Fertilität können gewöhnlich mit einer Varianzanalyse (ANOVA) mit anschließendem Dunnett- oder Williams-Test ermittelt werden (22-25). Zur Bestimmung der Schlupfrate und des Geschlechterverhältnisses können der Cochran-Armitage-Test, der Exakte Test nach Fisher (mit Bonferroni-Korrektur) oder der Mantel-Haenszel-Test durchgeführt werden.
Limit-Test
21. Falls der fakultative Vorversuch bis zu einer bestimmten Höchstkonzentration keine Wirkungen zeigt, kann ein Limit-Test (mit einer Prüfkonzentration und einer oder mehreren Kontrollen) durchgeführt werden. Mit dem Limit-Test lassen sich etwaige toxische Wirkungen der Prüfchemikalie bei Konzentrationen oberhalb der getesteten Grenzkonzentration feststellen. Für Wasser werden 100 mg/l und für Sedimente 1.000 mg/kg (bezogen auf die Trockenmasse) empfohlen. In der Regel sind jeweils mindestens acht Replikate pro Behandlung und Kontrolle erforderlich. Es ist nachzuweisen, dass die statistische Aussagekraft ausreicht, um bei einem Signifikanzniveau von 5 % (α = 0,05) eine Differenz von 20 % zur Kontrollkonzentration festzustellen. Für metrische Effektdaten (z.B. Entwicklungsrate) ist der t-Test eine geeignete statistische Methode, sofern die Daten die Bedingungen für diesen Test (Normalverteilung, Varianzhomogenität) erfüllen. Sind diese Bedingungen nicht erfüllt, so kann ein t-Test für ungleiche Varianzen oder ein nichtparametrischer Test wie der Wilcoxon-Mann-Whitney-Test verwendet werden. Zur Bestimmung der Schlupfrate eignet sich der Exakte Test nach Fisher.
Expositionsbedingungen
Herstellung des Wasser-Sediment-Systems (Dotieren des Wassers)
22.a. Ein formuliertes Sediment (siehe Nummern 13 und 14 und Anlage 3) wird in einer mindestens 1,5 cm und höchstens 3 cm starken Schicht in die einzelnen Prüfgefäße und Kristallisierungsschalen gegeben. (Bei den Kristallisierungsschalen kann die Schicht etwas dünner sein.) Anschließend wird so viel Wasser (siehe Nummer 15) hinzugegeben, dass das Verhältnis der Tiefe der Sedimentschicht zur Wassertiefe maximal 1:4 beträgt. Nach der Vorbereitung der Prüfgefäße wird das Sediment-Wasser-System etwa sieben Tage moderat belüftet, bevor die L1-Larven der 1. und 2. Generation eingesetzt werden (siehe Nummer 14 und Anlage 3). Das Sediment-Wasser-System der Kristallisierungsschalen wird während des Tests nicht belüftet, da die Larven nicht am Leben erhalten zu werden brauchen. (Die Eigelege werden bereits vor dem Schlüpfen entnommen.) Um zu verhindern, dass es während der Zugabe von Prüfwasser in die Wassersäule zu einer Auftrennung der Sedimentbestandteile und einer Resuspension der feinen Partikel kommt, kann das Sediment beim Einfüllen des Wassers mit einer Plastikschale abgedeckt werden. Die Schale wird anschließend sofort entfernt. Andere Hilfsmittel sind ebenfalls geeignet.
Herstellung des Wasser-Sediment-Systems mit dotiertem Wasser
22.b. Entsprechend der Beschreibung in Nummer 16b wird dotiertes Sediment in die Prüfgefäße und in die Kristallisierungsschalen gegeben und anschließend mit Wasser bis zu einem Sediment-Wasser-Verhältnis von 1:4 überschichtet. Das Sediment muss eine Tiefe von 1,5-3 cm haben. (In der Kristallisierungsschale kann die Schicht etwas dünner sein.) Um zu verhindern, dass es während der Zugabe von Prüfwasser in die Wassersäule zu einer Auftrennung der Sedimentbestandteile und einer Resuspension der feinen Partikel kommt, kann das Sediment beim Einfüllen des Wassers mit einer Plastikschale abgedeckt werden, die anschließend sofort entfernt wird. Andere Hilfsmittel können ebenfalls geeignet sein. Nach Fertigstellung des dotierten Sediments mit dem überschichteten Wasser ist abzuwarten, bis die Prüfchemikalie aus dem Sediment in die wässrige Phase partitioniert ist (4)(5)(7)(18). Dies sollte möglichst unter denselben Temperatur- und Belüftungsbedingungen wie im Versuch erfolgen. Die erforderliche Zeit für die Einstellung des Gleichgewichts hängt vom Sediment und der Chemikalie ab. Manchmal reichen ein paar Stunden oder Tage, in seltenen Fällen können aber auch mehrere Wochen (bis zu fünf) erforderlich sein. Es sollte nicht abgewartet werden, bis das Gleichgewicht hergestellt ist, da es in dieser Zeit bei vielen Chemikalien zu Abbauprozessen kommen kann. Empfohlen wird eine Wartezeit von 48 Std. Wenn jedoch bekannt ist, dass die im Sediment enthaltene Chemikalie eine lange Abbau-Halbwertszeit hat (siehe Nummer 8), kann mehr Zeit für den Ausgleich vorgesehen werden. Am Ende dieser Gleichgewichtseinstellungszeit wird die Konzentration der Prüfchemikalie im Überstandswasser, im Porenwasser und im Sediment gemessen - mindestens in der höchsten Konzentration und einer niedrigeren Konzentration (siehe Nummer 38). Diese analytischen Bestimmungen der Prüfchemikalie ermöglichen es, eine Massenbilanz zu berechnen und die Ergebnisse auf der Grundlage der gemessenen Konzentrationen darzustellen.
23. Die Prüfgefäße werden abgedeckt (z.B. mit Glasplatten). Um etwaige Verdunstungsverluste auszugleichen, kann während des Versuchs Wasser bis zum Ausgangsvolumen nachgefüllt werden. Dazu ist destilliertes oder entionisiertes Wasser zu verwenden, damit sich keine Salze bilden. Die Kristallisierungsschalen in den Zuchtkäfigen werden nicht abgedeckt; Wasserverluste während des Tests können (müssen aber nicht) ausgeglichen werden; die Eigelege kommen nämlich nur etwa einen Tag mit dem Wasser in Berührung, und die Schalen werden während des Tests nur kurze Zeit verwendet.
Einsetzen der Prüforganismen
24. Vier bis fünf Tage vor dem Einsetzen der L1-Larven werden Eigelege aus den Kulturen entnommen und in kleinen Gefäßen in das Kulturmedium eingesetzt. Es kann ,altes' Medium aus den Stammkulturen oder frisch zubereitetes Medium verwendet werden. In jedem Fall ist eine geringe Futtermenge (z.B. einige Tröpfchen Filtrat einer fein gemahlenen Suspension aus Fischfutterflocken) zum Kulturmedium hinzuzugeben (siehe Anlage 2). Es sollten nur frische Eigelege verwendet werden. Normalerweise beginnen die Larven einige Tage nach dem Einsetzen der Eier zu schlüpfen (C. riparius: 2-3 Tage bei 20 °C, C. tentans und C. yoshimatsui: 1- 4 Tage bei 23 °C bzw. 25 °C) und durchlaufen während ihres Wachstums vier Stadien von jeweils 4-8 Tagen. Für den Versuch sollten Larven des ersten Larvenstadiums (L1) (maximal 48 h nach dem Schlüpfen) verwendet werden. Das Larvenstadium kann unter Umständen anhand der Kopfkapselbreite bestimmt werden (7).
25. Jeweils 20 L1-Larven der 1. Generation werden nach dem Zufallsprinzip mit einer stumpfen Pipette in die einzelnen Prüfgefäße mit dem Sediment-Wasser-System eingesetzt. Während des Einsetzens der Larven in das Prüfgefäß und der folgenden 24 Stunden wird die Belüftung des Wassers abgestellt (siehe Nummer 32). Je nach Versuchsaufbau (siehe Nummern 19 und 20) werden pro Konzentration für die Ermittlung der ECx-Werte mindestens 120 Larven (6 Replikate pro Konzentration) und zur Bestimmung der NOEC mindestens 160 Larven (8 Replikate pro Konzentration) verwendet. Bei dem Versuchsaufbau mit dem dotierten Sediment beginnt die Exposition mit dem Einsetzen der Larven.
Dotieren des Überstandswassers
26. 24 Stunden nach dem Einsetzen der L1-Larven der 1. Generation wird die Prüfchemikalie in die überstehende Wassersäule dotiert und das System wird erneut schwach belüftet (zu möglichen Änderungen des Test Designs siehe Nummer 7). Kleine Mengen der Stammlösungen mit der Prüfchemikalie werden unterhalb der Oberfläche der Wassersäule pipettiert. Anschließend wird das Überstandswasser vorsichtig gemischt, um das Sediment nicht aufzuwirbeln. Beim Versuch mit dem dotierten Wasser beginnt die Exposition mit dem Dotieren des Wassers (d. h einen Tag nach Einsetzen der Larven).
Entnahme geschlüpfter Imagines
27. Geschlüpfte Mücken der 1. Generation werden mindestens einmal, vorzugsweise sogar zweimal täglich mit einem Sauggerät, einem Abzug oder einem ähnlichen Gerät aus den Prüfgefäßen abgesaugt (Paragraf 36) (siehe Anlage 5). Dabei ist darauf zu achten, dass die Imagines nicht beschädigt werden. Die abgesaugten Mücken aus vier Prüfgefäßen jeweils einer Konzentration werden in den Zuchtkäfig entlassen, dem sie bereits vorher zugeordnet waren. Am Tag, an dem die ersten (männlichen) Imagines schlüpfen, werden die Kristallisierungsgefäße dotiert, indem eine kleine Menge der Stammlösung mit der Prüfchemikalie unter die Wasseroberfläche pipettiert wird (bei dem Versuchsaufbau mit dem dotierten Wasser). Anschließend wird das Überstandswasser vorsichtig gemischt, um das Sediment nicht aufzuwirbeln. Die nominelle Konzentration der Prüfchemikalie im Kristallisierungsgefäß stimmt mit der der Gefäße mit den Prüfkonzentrationen überein, die dem jeweiligen Zuchtkäfig zugeordnet sind. Bei dem Versuchsaufbau mit dem dotierten Sediment werden die Kristallisierungsschalen um Tag 11 nach Beginn der Exposition (d. h. nach Einsetzen der Larven der 1. Generation) angesetzt, damit sie im Laufe von etwa 48 Stunden ein Gleichgewicht erreichen, bevor die ersten Eigelege abgelegt werden.
28. Die Eigelege werden mit einer Pinzette oder einer stumpfen Pipette aus der Kristallisierungsschale im Zuchtkäfig entnommen. Jedes Eigelege wird einzeln in ein Gefäß mit dem Kulturmedium aus der Kristallisierungsschale gebracht, aus der es auch entnommen wurde (z.B. eine Vertiefung einer Mikrotiterplatte mit 12 Vertiefungen mit mindestens 2,5 ml des Mediums). Die Gefäße mit den Eigelegen werden mit einem Deckel verschlossen, um eine signifikante Verdunstung zu verhindern. Die Eigelege werden mindestens sechs Tage nach der Ablage zur Beobachtung aufbewahrt, um sie als befruchtet oder unbefruchtes zu klassifizieren.
Als Ausgangsmaterial für die 2. Generation werden aus jedem Zuchtkäfig mindestens drei, vorzugsweise jedoch sechs befruchtete Eigelege entnommen; anschließend wird etwas Futter bereitgestellt und gewartet, bis die Mücken schlüpfen. Die Eigelege sollten zum Höhepunkt der Eiablage entstanden sein; dieser liegt bei den Kontrollen gewöhnlich um Tag 19 des Tests. Im Idealfall wird mit dem Aufbau der 2. Generation sämtlicher Konzentrationen der Prüfchemikalie am selben Tag begonnen; aufgrund chemischer Wirkungen auf die Entwicklung der Larven ist dies unter Umständen jedoch nicht immer möglich. In diesen Fällen kann der Aufbau in den höheren Konzentrationen später begonnen werden als bei den niedrigeren Konzentrationen und bei der (Lösungsmittel-)Kontrolle.
29.a. Beim Versuch mit dem dotierten Wasser wird das Sediment-Wasser-System für die Larven der 2. Generation hergestellt, indem etwa eine Stunde vor dem Einsetzen der L1-Larven in die Prüfgefäße die Prüfchemikalie in das Überstandswasser dotiert wird. Kleine Mengen der Lösungen mit der Prüfchemikalie werden unterhalb der Oberfläche der Wassersäule pipettiert. Anschließend wird das Überstandswasser vorsichtig gemischt, um das Sediment nicht aufzuwirbeln. Nach dem Dotieren erfolgt eine schwache Belüftung.
29.b. Beim Versuch mit dem dotierten Sediment werden die Expositionsgefäße mit dem Sediment-Wasser-System für Larven der 2. Generation auf die gleiche Weise vorbereitet wie für die Larven der 1. Generation.
30. Jeweils 20 L1-Larven der 2. Generation werden spätestens 48 h nach dem Schlüpfen nach dem Zufallsprinzip mit einer stumpfen Pipette in die einzelnen Prüfgefäße mit dem dotierten Sediment-Wasser-System eingesetzt. Während des Einsetzens der L1-Larven in das Prüfgefäß und der folgenden 24 Std. wird die Belüftung gestoppt. Je nach Prüfprotokoll (siehe Nummern 19 und 20) werden pro Konzentration für die Ermittlung der ECx-Werte mindestens 120 Larven (6 Replikate pro Konzentration) und zur Bestimmung der NOEC mindestens 160 Larven (8 Replikate pro Konzentration) verwendet.
Futter
31. Die Larven in den Prüfgefäßen müssen täglich, mindestens jedoch dreimal pro Woche gefüttert werden. Pro juvenile Larve und Tag sind in den ersten 10 Tagen ihres Lebenszyklus 0,25-0,5 mg (bzw. 0,35-0,5 mg bei C. yoshimatsui) Fischfutter (suspendiert in Wasser oder fein gemahlenen, z.B. Tetra-Min oder Tetra-Phyll; siehe Anlage 2) angemessen. Ältere Larven benötigen etwas mehr Nahrung. Für den Rest des Versuchs dürften 0,5- 1,0 mg Futter pro Larve und Tag ausreichen. Bei Pilzbesatz oder Absterben von Kontrollorganismen wird die Futterration für alle behandelten Organismen und Kontrollorganismen reduziert. Lässt sich die Pilzentwicklung nicht stoppen, muss der Versuch wiederholt werden.
Die toxikologische Relevanz der Exposition durch Aufnahme mit dem Futter ist im Allgemeinen höher bei Chemikalien mit hoher Affinität für organischen Kohlenstoff und bei Chemikalien mit kovalenter Bindung an das Sediment. Wenn Chemikalien mit diesen Eigenschaften getestet werden, kann die Menge an Futter, die zur Gewährleistung des Überlebens und einer natürlichen Wachstumsentwicklung der Larven benötigt wird, je nach regulatorischen Anforderungen vor der Stabilisierungsphase zum formulierten Sediment hinzugegeben werden. Um eine Beeinträchtigung der Wasserqualität zu verhindern, wird das Fischfutter durch pflanzliches Material ersetzt, z.B. durch Zugabe von 0,5 % (Trockenmasse) feingeriebenen Blättern z.B. von Brennnessel (Urtica dioeca), Maulbeere (Morus alba), Weißklee (Trifolium repens) oder Spinat (Spinacia oleracea) oder von sonstigem pflanzlichen Material (Cerophyl oder Alphacellulose). Die Zugabe der gesamten Menge eines organischen Futters zum Sediment noch vor dem Dotieren ist für die Wasserqualität und die biologischen Parameter (21) nicht unerheblich und stellt auch keine standardisierte Methode dar. Neuere Studien lassen jedoch darauf schließen, dass diese Methode funktioniert (19)(26). Imagines im Zuchtkäfig brauchen normalerweise kein Futter; die Fekundität und die Fertilität verbessern sich jedoch, wenn ein in gesättigter Saccharoselösung getränktes Wattepad als Futterquelle für die adulten Mücken bereitgestellt wird (34).
Inkubationsbedingungen
32. Das Überstandswasser in den Prüfgefäßen wird 24 Stunden nach dem Einsetzen der L1-Larven beider Generationen über den gesamten Versuchszeitraum moderat belüftet. (Es ist darauf zu achten, dass die Konzentration an gelöstem Sauerstoff nicht unter 60 % des Luftsauerstoff-Sättigungswertes fällt.) Die Belüftung erfolgt mit einigen Blasen pro Sekunde durch eine gläserne Pasteur-Pipette, deren Öffnung 2-3 cm über der Sedimentschicht angesetzt wird. Wenn flüchtige Chemikalien getestet werden, ist darauf zu achten, dass das Sediment-Wasser-System nicht belüftet wird; trotzdem muss allerdings das Validitätskriterium eines Luftsauerstoff-Sättigungswerts von mindestens 60 % (Nummer 10) erfüllt sein. Weitere Informationen sind Quelle (16) zu entnehmen.
33. Der Test mit C. riparius wird bei einer konstanten Raumtemperatur von 20 ± 2 °C durchgeführt. Für C. dilutus und C. yoshimatsui wird eine Temperatur von 23 bzw. 25 ± 2 °C) empfohlen. Die Photoperiode beträgt 16 Std. und die Beleuchtungsstärke 500-1.000 lux. Für die Zuchtkäfige kann jeweils morgens und abends eine einstündige Dämmerungsphase eingerichtet werden.
Expositionsdauer
34. Versuch mit dotiertem Wasser: Die Expositionsdauer für die 1. Generation beginnt, wenn die Prüfchemikalie in das Überstandswasser der Prüfgefäße dotiert wird (d. h. einen Tag nach Einsetzen der Larven; zu möglichen Änderungen des Expositionsaufbaus siehe Nummer 7). Die Exposition der 2. Generation beginnt sofort, da diese Larven in ein bereits dotiertes Sediment-Wasser-System eingesetzt werden. Bei C. riparius und C. yoshimatsui beträgt die maximale Expositionsdauer für die 1. Generation 27 Tage und für die 2. Generation 28 Tage. (Die Larven der 1. Generation verbringen einen Tag ohne Exposition in den Gefäßen). Aufgrund der Überschneidung ergibt sich eine Testdauer von insgesamt etwa 44 Tagen. Bei C. dilutus dauert die Exposition höchstens 64 bzw. 65 Tage (1. bzw. 2. Generation). Die Gesamtdauer beträgt etwa 100 Tage.
Versuch mit dotiertem Sediment: Die Exposition beginnt mit dem Einsetzen der Larven und dauert bei C. riparius und C. yoshimatsui bei beiden Generationen höchstens 28 Tage und bei C. dilutus, ebenfalls beide Generationen, höchstens 65 Tage.
Beobachtungen
Schlupf
35. Es werden die Entwicklungsdauer und die Anzahl der vollständig geschlüpften lebenden männlichen und weiblichen Mücken in beiden Generationen bestimmt. Männchen sind leicht an den gefiederten Antennen und an ihrem schlanken Körper zu erkennen.
36. Die Prüfgefäße sind bei beiden Generationen dreimal wöchentlich visuell auf Verhaltensänderungen der Larven (z.B. Verlassen des Sediments, ungewöhnliches Schwimmverhalten) gegenüber den Kontrollgefäßen zu prüfen. Während der Emergenzphase, die bei C. riparius und C. yoshimatsui etwa 12 Tage und bei C. dilutus etwa 20 Tage nach dem Einsetzen der Larven beginnt, werden die Imagines gezählt und mindestens einmal, vorzugsweise aber zweimal täglich (am frühen Morgen und am späten Nachmittag) nach Geschlechtern unterschieden. Nach der Unterscheidung werden die Mücken der 1. Generation sorgfältig aus den Gefäßen entnommen und in einen Zuchtkäfig gebracht. Mücken der 2. Generation werden entnommen und nach der Identifizierung getötet. In den Prüfgefäßen gelegte Eigelege der 1. Generation werden einzeln abgelesen und mit mindestens 2,5 ml nativem Wasser in Mikrotiterplatten mit 12 Vertiefungen (oder sonstige geeignete Gefäße) gelegt; diese werden anschließend mit einem Deckel verschlossen, um wesentliche Verdunstungsverluste zu vermeiden. Die Anzahl der toten Larven und der sichtbaren Puppen, die nicht geschlüpft sind, wird ebenfalls protokolliert. Beispiele für Zuchtkäfige, Prüfgefäße und Absaugvorrichtungen werden in Anlage 5 beschrieben.
Reproduktion
37. Die Wirkung auf die Reproduktion wird anhand der Anzahl der von Mücken der 1. Generation gelegten Eigelege und der Fertilität dieser Eigelege beurteilt. Einmal täglich werden die Eigelege von der in den Zuchtbehältnissen befindlichen Kristallisierungsschale abgelesen. Die Eigelege werden entnommen und mit mindestens 2,5 ml nativem Wasser in eine Mikrotiterplatte mit 12 Vertiefungen (jeweils ein Eigelege pro Vertiefung) oder in sonstige geeignete Gefäße gesetzt; diese werden mit einem Deckel verschlossen, um signifikante Verdunstungsverluste zu vermeiden. Für jedes Eigelege werden folgende Merkmale dokumentiert: Tag der Entstehung, Größe (normal, d. h. 1,0 ± 0,3 cm oder kurz; in der Regel ≤ 0,5 cm) und Struktur (normal = bananenförmig mit spiraligem Eigelege oder anomal z.B. nicht mit spiraligem Eigelege) sowie Fertilität (befruchtet oder unbefruchtet). Im Laufe von sechs Tagen nach der Ablage wird geprüft, ob die Eigelege befruchtet sind. Ein Eigelege wird dann als befruchtet betrachtet, wenn aus mindestens einem Drittel aller Eier Mücken schlüpfen. Aufgrund der Gesamtzahl der in den Zuchtkäfig eingesetzten Weibchen werden die Anzahl der Eigelege pro Weibchen und die Anzahl der befruchteten Eigelege pro Weibchen berechnet. Erforderlichenfalls kann die Anzahl der Eier eines Eigeleges mit der Ringzählmethode zerstörungsfrei geschätzt werden (siehe Beschreibung in den Nummern 32 und 33).
Analysemessungen
Konzentration der Prüfchemikalie
38. Als minimale Anforderung müssen zu Beginn der Exposition (bei dotiertem Wasser vorzugsweise eine Stunde nach Applikation der Prüfchemikalie) und am Ende des Versuchs Proben des Überstandswassers, des Porenwassers und des Sediments mindestens in der höchsten Konzentration und in einer niedrigeren Konzentration analysiert werden. Dies gilt für Gefäße beider Generationen. Aus den Kristallisierungsschalen im Zuchtkäfig wird nur das Überstandswasser analysiert, da die Eigelege nur mit diesem Wasser in Berührung kommen. (Bei dem Versuch mit dotiertem Sediment kann eine analytische Bestätigung der Sedimentkonzentration vorgenommen werden.) Wenn erforderlich, können während des Versuchs weitere Messungen des Sediments, des Porenwassers oder des Überstandswassers vorgenommen werden. Diese Bestimmung der Konzentration der Prüfchemikalie gibt Aufschluss über das Verhalten/die Verteilung der Prüfchemikalie im Wasser-Sediment-System. Wenn zu Beginn und während des Versuchs (siehe Nummer 39) Proben aus dem Sediment und aus dem Porenwasser entnommen und analysiert werden sollen, müssen zusätzliche Prüfgefäße verfügbar sein. Messungen des Sediments bei dem Versuchsaufbau mit dem dotierten Wasser sind möglicherweise nicht erforderlich, wenn die Verteilung der Prüfchemikalie zwischen Wasser und Sediment in einer Wasser-/Sediment-Untersuchung unter vergleichbaren Bedingungen eindeutig bestimmt wurde (z.B. Verhältnis Sediment/Wasser, Applikationsform, Gehalt des Sediments an organischem Kohlenstoff) oder wenn die gemessenen Konzentrationen im Überstandswasser ständig im Bereich von 80-120 % der nominellen Konzentration oder der gemessenen Ausgangskonzentration liegen.
39. Falls Zwischenmessungen (z.B. am 7. und/oder am 14. Tag) vorgenommen werden und für die Analyse größere Proben erforderlich sind, die nicht aus den Prüfgefäßen entnommen werden können, ohne das Prüfsystem zu beeinflussen, sollten die Analysemessungen an Proben aus zusätzlichen Prüfgefäßen vorgenommen werden, die derselben Behandlung (einschließlich Präsenz von Testorganismen) unterzogen, aber nicht für biologische Beobachtungen verwendet wurden.
40. Eine 30-minütige Zentrifugation bei z.B. 10.000 g und 4 °C wird empfohlen, um das Interstitialwasser (= Porenwasser) abzutrennen. Prüfchemikalien, die sich nachweislich nicht an Filtern anlagern, können aber auch filtriert werden. Bei zu kleinen Proben kann es passieren, dass sich die Konzentrationen im Porenwasser nicht analysieren lassen.
Physikalisch-chemische Parameter
41. pH-Wert, gelöster Sauerstoff im Testwasser und Temperatur des Wassers in den Prüfgefäßen und in den Kristallisierungsschalen sind auf geeignete Weise zu messen (siehe Nummer 10). Zu Beginn und am Ende des Versuchs sind Härte und Ammonium-Gehalt bei der höchsten Konzentration und in den Kontrollgefäßen in einem Prüfgefäß und einer Kristallisierungsschale zu bestimmen.
Auswertung der Ergebnisse
42. Mit diesem Lebenszyklustest sollen die Wirkung der Prüfchemikalie auf die Reproduktion sowie - für zwei Generationen - die Entwicklungsrate und die Gesamtzahl der vollständig geschlüpften lebenden männlichen und weiblichen Mücken ermittelt werden. Zur Ermittlung der Schlupfrate werden die Daten männlicher und weiblicher Imagines zusammengefasst. Wenn keine statistisch signifikanten Unterschiede hinsichtlich der Empfindlichkeiten der Entwicklungsraten der beiden Geschlechter bestehen, können die Ergebnisse für männliche und weibliche Mücken in der statistischen Analyse zusammengefasst werden.
43. Die Effektkonzentrationen werden ausgedrückt als Konzentrationen im Überstandswasser (bei dotiertem Wasser) bzw. im Sediment (bei dotiertem Sediment) und gewöhnlich ausgehend von den zu Beginn der Exposition gemessenen Konzentrationen (siehe Nummer 38) berechnet. Daher werden die für dotiertes Wasser gewöhnlich zu Beginn der Exposition bei beiden Generationen im Überstandswasser der Gefäße gemessenen Konzentrationen und die Konzentrationen der Kristallisierungsschalen für jede Konzentrationsstufe gemittelt. Die Konzentrationen für dotierte Sedimente werden gewöhnlich zu Beginn der Exposition bei beiden Generationen in den Gefäßen (sowie optional in den Kristallisierungsschalen) gemessen und für jede Behandlung gemittelt.
44. Für eine Punktschätzung (d. h. zur Ermittlung einer ECx-Konzentration) können die für die einzelnen Gefäße und Zuchtkäfige erstellten Statistiken als echte Replikate dienen. Bei der Berechnung eines Konfidenzintervalls für einen beliebigen ECx-Wert ist die Variabilität zwischen den Gefäßen zu berücksichtigen oder nachzuweisen, dass diese Variabilität so klein ist, dass sie übergangen werden kann. Wird das Modell nach der Methode der geringsten Abweichungsquadrate angepasst, sollten die pro Gefäß erstellten Statistiken transformiert werden, um die Varianzhomogenität zu verbessern. Allerdings werden die ECx-Werte berechnet, nachdem die Ergebnisse auf den ursprünglichen Wert rücktransformiert wurden (11).
45. Wenn die statistische Analyse darauf abzielt, die NOEC anhand von Hypothesenprüfungen zu bestimmen, ist die Variabilität zwischen den Prüfgefäßen zu berücksichtigen, z.B. mit ANOVA-Methoden (etwa dem Williams- oder dem Dunnett-Test). Der Williams-Test ist dann geeignet, wenn theoretisch eine monotone Dosis-Wirkungs-Beziehung zu erwarten wäre; der Dunnett-Test wird durchgeführt, wenn sich die Hypothese der Monotonie nicht bestätigt. Alternativ können in den Fällen, in denen von den herkömmlichen ANOVA- Annahmen abgewichen wird, robustere Tests (27) angewendet werden (31).
Schlupfrate
46. Schlupfraten sind quantale Daten und können anhand des Cochran-Armitage-Tests im Step-Down-Verfahren analysiert werden, wenn eine monotone Dosis-Antwort erwartet wird und die Schlupfdaten dieser Erwartung entsprechen. Andernfalls können ein Exakter Test nach Fisher oder ein Mantel-Haenszel-Test mit Bonferroni- Holmangepassten p-Werten durchgeführt werden. Ist die Varianz zwischen den Replikaten mit derselben Konzentration nachweislich größer als bei einer Binomialverteilung zu erwarten (häufig als ,extrabinomiale' Variation bezeichnet), sollte ein robusterer Test (Cochran-Armitage-Test oder Exakter Test nach Fisher), wie in (27) vorgeschlagen, vorgenommen werden.
Die Summe geschlüpfter lebender männlicher und weiblicher Mücken (ne) je Prüfgefäß wird bestimmt und durch die Anzahl der eingesetzten Larven (na) dividiert:
![]()
Dabei sind:
ER = Schlupfrate
ne = Anzahl der geschlüpften lebenden Mücken je Prüfgefäß
na = Anzahl der eingesetzten Larven je Prüfgefäß (normalerweise 20)
Wenn ne größer als na ist (d. h., wenn versehentlich mehr als die vorgesehene Anzahl an Larven eingesetzt wurde), muss na an ne angepasst werden.
47. Ein alternativer Ansatz, der sich insbesondere für große Proben mit erweiterter Binomialvarianz empfiehlt, ist die Behandlung der Schlupfrate als kontinuierliche Reaktion und die Verwendung entsprechender Verfahren. Als große Probe gilt hier eine Probe, bei der die Anzahl der geschlüpften Mücken und die Anzahl der nicht geschlüpften Mücken jeweils mehr als fünf pro Replikat(gefäß) beträgt.
48. Für die Anwendung von ANOVA-Methoden sollten die ER-Werte zunächst einer Arcus-Sinus-Transformation oder einer Freeman-Tukey-Transformation unterzogen werden, um annähernd eine Normalverteilung und Varianzhomogenität zu erreichen. Bei der Verwendung von absoluten Frequenzen können auch der Cochran- Armitage-, der Exakte Test nach Fisher (mit Bonferroni-Korrektur) oder der Mantel-Haenszel-Test angewendet werden. Bei der Arcus-Sinus-Transformation wird die Umkehrfunktion des Sinus (sin- 1) der Wurzel von ER berechnet.
49. Für die Schlupfraten werden die ECx-Werte durch Regressionsanalysen bestimmt (z.B. Probit-, Logit- oder Weibull-Modell (28)). Versagt die Regressionsanalyse (z.B. bei weniger als zwei Teilantworten), können andere nichtparametrische Methoden wie die Berechnung des gleitenden Durchschnitts oder eine einfache Interpolation angewendet werden.
Entwicklungsrate
50. Die mittlere Entwicklungszeit ist die mittlere Zeitspanne zwischen dem Einsetzen der Larven (Tag 0 des Tests) und dem Schlüpfen der Mückenkohorte. (Zur Berechnung der tatsächlichen Entwicklungszeit ist das Alter der Larven zum Zeitpunkt des Einsetzens zu berücksichtigen.) Die Entwicklungsrate ist der Reziprokwert der Entwicklungszeit (Einheit: 1/Tag) und bezeichnet den Anteil der täglich entstehenden Larven. Für die Bewertung der Sedimenttoxizität ist die Entwicklungsrate zu bevorzugen, da sie gegenüber der Entwicklungszeit eine geringere Varianz aufweist und ihre Werte homogener sind und näher an der Normalverteilung liegen. Aus diesem Grund eignen sich leistungsfähigere parametrische Verfahren mit großer Teststärke eher für die Entwicklungsrate als für die Entwicklungszeit. Wird die Entwicklungsrate als kontinuierliche Antwort behandelt, können die ECx-Werte mittels Regressionsanalyse geschätzt werden (z.B. (29)(30)). Eine NOEC für die mittlere Entwicklungsrate kann mit einer ANOVA (z.B. mit einem Williams- oder einem Dunnett-Test) ermittelt werden. Da männliche Imagines früher schlüpfen als weibliche und da sich entsprechend für Männchen eine höhere Entwicklungsrate ergibt, ist es sinnvoll, die Entwicklungsraten nicht nur für die Imagines insgesamt, sondern auch getrennt nach Geschlechtern zu ermitteln.
51. Für statistische Tests gilt die Anzahl der am Kontrolltag x beobachteten Mücken als die Anzahl der Mücken, die in der Mitte des Zeitintervalls zwischen dem Tag x und dem Tag x - l geschlüpft sind (l = Länge des Kontrollintervalls, gewöhnlich 1 Tag). Die mittlere Entwicklungsrate je Prüfgefäß (![]() ) wird wie folgt berechnet:
) wird wie folgt berechnet:
Dabei sind:
![]() : mittlere Entwicklungsrate je Prüfgefäß
: mittlere Entwicklungsrate je Prüfgefäß
i: Index des Kontrollintervalls
m: maximale Anzahl der Kontrollintervalle
fi: Anzahl der Mücken, die im Kontrollintervall i geschlüpft sind
ne: Gesamtzahl der geschlüpften Mücken bei Versuchsende (=Σfi)
xi: Entwicklungsrate der geschlüpften Mücken im Intervall i
![]()
Dabei sind:
Tagi: Tag der Inspektion (Tage seit Einsetzen der Larven)
li: Länge des Kontrollintervalls i (Tage, in der Regel 1 Tag)
Geschlechterverhältnis
52. Die Geschlechterverhältnisse sind quantale Daten und daher durch einen Exakten Test nach Fisher oder durch sonstige geeignete Methoden zu bestimmen. Das natürliche Geschlechterverhältnis ist bei C. riparius gleich 1, d. h. männliche und weibliche Mücken sind gleich häufig. Bei beiden Generationen sind die Daten zum Geschlechterverhältnis gleich zu behandeln. Da die maximale Anzahl der Mücken pro Gefäß (d. h. 20) für eine aussagekräftige statistische Analyse zu gering ist, wird die Gesamtzahl der vollständig geschlüpften und lebenden Mücken für beide Geschlechter in allen Gefäßen mit jeweils einer Prüfkonzentration summiert. Diese nicht transformierten Daten werden dann in einer Häufigkeitstabelle (2 × 2) bezogen auf die (Lösungsmittel-)Kontrolle oder auf die gepoolten Daten der Kontrollen erneut geprüft.
Reproduktion
53. Die Reproduktion (gemessen als Fekundität) wird an der Anzahl der Eigelege pro Weibchen gemessen. Die Gesamtzahl der in einem Zuchtkäfig gelegten Eigelege wird durch die Gesamtzahl der lebenden und unbeschädigten Weibchen geteilt, die in diesen Käfig einsetzt wurden. Eine NOEC für die Fekundität kann mit einer ANOVA (z.B. mit einem Williams- oder einem Dunnett-Test) ermittelt werden.
54. Die Fertilität der Eigelege dient als Maßstab zur Ermittlung der Anzahl der befruchteten Eigelege pro Weibchen. Die Gesamtzahl der in einem Zuchtkäfig gelegten befruchteten Eigelege wird durch die Gesamtzahl der lebenden und unbeschädigten Weibchen geteilt, die in diesen Käfig eingesetzt wurden. Eine NOEC für die Fertilität kann mit einer ANOVA (z.B. mit einem Williams- oder einem Dunnett-Test) ermittelt werden.
Prüfbericht
55. Der Prüfbericht enthält die folgenden Informationen:
Prüfchemikalie:
Testspezies:
Prüfbedingungen:
Ergebnisse:
(1) Kapitel C.28 dieses Anhangs, 'Chironomiden-Toxizitätstest in Sediment-Wasser-Systemen mit gespiktem Wasser'.
(2) Shobanov, N.A., Kiknadze, I.I., und M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311-322.
(3) Fleming, R., et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. August 1994. WRc, UK.
(4) SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, WOSTA-Workshop in den Niederlanden.
(5) ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
(6) Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, Dezember 1997.
(7) US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sedimentassociated Contaminants with Freshwater Invertebrates, Second edition, EPA 600/R-99/064, März 2000, Änderung der ersten Fassung, Juni 1994.
(8) US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
(9) US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
(10) Milani, D., Day, K.E., McLeay, D.J., und R.S. Kirby (1996), Recent intra- and interlaboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Kanada.
(11) Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R., und C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans shortterm and long- term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662-2674.
(12) Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V., und L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrinedisrupting properties of pesticides, Ecotoxicology, 16: 221-230.
(13) Sugaya, Y. (1997), Intraspecific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345-350.
(14) Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47-57.
(15) Kapitel C.27 dieses Anhangs, , Chironomiden-Toxizitätstest in Sediment-Wasser-Systemen mit gespiktem Sediment".
(16) OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Paris.
(17) Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M., und M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
(18) Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, September 1995.
(19) Oetken, M, Nentwig, G., Löffler, D, Ternes, T., und J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353-361.
(20) Suedel, B.C., und J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163-1175.
(21) Naylor, C., und C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291-3303.
(22) Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096-1121.
(23) Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482-491.
(24) Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
(25) Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510- 531.
(26) Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L., und H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94-102.
(27) Rao, J.N.K., und A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: 577-585.
(28) Christensen, E.R. (1984), Doseresponse functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213-221.
(29) Bruce, R.D., und D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485-1494.
(30) Slob, W. (2002), Doseresponse modelling of continuous endpoints. Toxicol. Sci., 66: 298-312.
(31) OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, 146 S., ENV/JM/MONO(2006)18, OECD, Paris.
(32) Benoit, D.A., Sibley, P.K., Juenemann, J.L., und G.T. Ankley (1997), Chironomus tentans lifecycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165- 1176.
(33) Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M., und J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the nonbiting midge Chironomus riparius (Diptera) - baseline experiments for future multigeneration studies, J. Environ. Sci. Health Part A, 42: 1-9.
(34) OECD (2010), Validation report of the Chironomid full lifecycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paris.
____
1) Bei 20 °C und normalem Atmosphärendruck beträgt der Luftsauerstoff-Sättigungswert in Süßwasser 9,1 mg/l (60 % = 5,46 mg/l).
| Begriffsbestimmungen | Anlage 1 |
Für diese Prüfmethode gelten folgende Definitionen:
Chemikalie: ein Stoff oder Gemisch.
Formuliertes Sediment oder rekonstituiertes, künstliches oder synthetisches Sediment: ein Gemisch aus Stoffen, mit denen die physikalischen Bestandteile eines natürlichen Sediments nachgeahmt werden sollen.
Überstandswasser: das im Prüfgefäß auf dem Sediment stehende Wasser.
Interstitialwasser oder Porenwasser: das Wasser in den Zwischenräumen zwischen Sedimentpartikeln bzw. zwischen Bodenpartikeln.
Dotiertes Wasser: Wasser, dem eine Prüfchemikalie hinzugefügt wurde.
Prüfchemikalie: ein beliebiger Stoff oder eine beliebige Mischung, der/die nach dieser Methode geprüft wird.
| Empfehlungen für die Anzucht von Chironomus riparius | Anlage 2 |
1. Für die Anzucht von Chironomus-Larven können Kristallisierungsschalen oder größere Behälter verwendet werden. Auf dem Boden des Behälters wird eine 5-10 mm dicke Schicht feiner Quarzsand aufgetragen. Kieselgur (z.B. Merck, Art 8117) hat sich ebenfalls als Substrat bewährt (eine dünnere Schicht von nur wenigen Millimetern ist ausreichend). Anschließend wird mit geeignetem Wasser auf eine Höhe von mehreren Zentimetern aufgefüllt. Soweit erforderlich ist bei Verdunstungsverlusten Wasser nachzufüllen, um ein Austrocknen zu verhindern. Nötigenfalls kann das Wasser ausgetauscht werden. Das Wasser wird leicht belüftet. Die Larvenzuchtgefäße sind in geeignete Käfige zu setzen, um zu verhindern, dass die schlüpfenden Imagines entweichen. Der Käfig muss groß genug sein (Mindestgröße ca. 30 × 30 × 30 cm), damit die geschlüpften Imagines schwärmen können. Ansonsten kommt es nicht zur Paarung.
2. Die Käfige sind bei Raumtemperatur oder in einer Klimakammer bei 20 ± 2 °C und einer Licht-/Dunkelphase von 16:8 Std. (Lichtintensität ca. 1.000 lx) zu halten. Es wurde berichtet, dass eine relative Luftfeuchte von weniger als 60 % eine Vermehrung unterbinden kann.
Verdünnungswasser
3. Es kann jedes natürliche oder synthetische Wasser verwendet werden. Im Allgemeinen werden Brunnenwasser, entchlortes Leitungswasser und künstliches Medium (z.B. Elendt-Medium ,M4' oder ,M7', siehe unten) verwendet. Das Wasser muss vor Verwendung belüftet werden. Soweit erforderlich kann das Anzuchtwasser durch vorsichtiges Abgießen oder Absaugen des gebrauchten Wassers aus den Prüfgefäßen erneuert werden; dabei ist darauf zu achten, dass die Wohnröhren der Larven nicht zerstört werden.
Fütterung der Larven
4. Chironomus-Larven sind mit etwa 250 mg frischem Fischfutter (Flocken, Tetra Min®, Tetra Phyll® oder Fischfutter einer vergleichbaren Marke) pro Gefäß und Tag zu füttern. Das Futter kann als trocken gemahlenes Pulver oder suspendiert in Wasser angeboten werden (1,0 g Futterflocken mit 20 ml Verdünnungswasser zu einer homogenen Masse gemischt). Diese Zubereitung kann in 5-ml-Portionen pro Gefäß und Tag verfüttert werden (vor Gebrauch schütteln). Ältere Larven können etwas mehr Futter erhalten.
5. Das Futter ist an die Wasserqualität anzupassen. Bei Trübung des Kulturmediums ist die Futterration zu reduzieren. Die Futterzugaben sind sorgfältig zu notieren. Zu wenig Futter kann dazu führen, dass die Larven in die Wassersäule abwandern, während zu viel Futter die mikrobielle Aktivität verstärkt und die Sauerstoffkonzentrationen verringert. In beiden Fällen kann sich das Wachstum der Organismen verlangsamen.
6. Wenn neue Kulturgefäße angesetzt werden, können auch einige Grünalgenzellen (z.B. Scenedesmus subspicatus, Chlorella vulgaris) hinzugefügt werden.
Fütterung der geschlüpften Imagines
7. Einige Experimentatoren empfehlen, als Futter für die geschlüpften Imagines ein mit gesättigter Zuckerlösung getränktes Wattepad zu verwenden.
Emergenz
8. Nach ca. 13 bis 15 Tagen bei einer Temperatur von 20 ± 2 °C beginnen die Imagines in den Larvenzuchtgefäßen zu schlüpfen. Männchen sind leicht an den gefiederten Antennen und dem schlanken Körper zu erkennen.
Eiegelege
9. Sobald sich Imagines in den Zuchtkäfigen befinden, sind alle Larvenzuchtgefäße dreimal wöchentlich auf gallertartige Eigelege zu kontrollieren. Vorhandene Gelege sind vorsichtig zu entnehmen und in eine kleine Schale mit einer Probe des Zuchtwassers zu geben. Mit den Eigelegen werden neue Kulturen angesetzt (z.B. 2- 4 Eigelege pro Gefäß) oder Toxizitätstests durchgeführt.
10. Nach 2-3 Tagen sollten L1-Larven schlüpfen.
Ansetzen neuer Kulturen
11. Sobald die Zucht etabliert ist, müssten je nach Prüfungsanforderungen wöchentlich oder weniger häufig frische Kulturen angesetzt und die älteren Prüfgefäße nach dem Schlüpfen der Imagines entfernt werden können. So sind bei geringem Aufwand ständig neue Imagines verfügbar.
Zubereitung der Prüflösungen M4 und M7
12. Das Medium M4 wurde von Elendt (1990) beschrieben. Das Medium M7 wird wie das Medium M4 zubereitet, mit Ausnahme der in Tabelle 1 angegebenen Stoffe, deren Konzentration bei M7 viermal niedriger ist als bei M4. Die Prüflösungen werden nicht nach den Anweisungen von Elendt und Bias (1990) zubereitet, da die für die Zubereitung der Stammlösungen angegebenen Konzentrationen von NaSiO3 ·5H2O, NaNO3, KH2PO4 und K2HPO4 für diesen Test nicht geeignet sind.
Herstellung des M7-Mediums
13. Zunächst wird jede Stammlösung (I) einzeln zubereitet; diese Stammlösungen (I) werden anschließend zu einer kombinierten Stammlösung (II) zusammengegossen (siehe Tabelle 1). 50 ml der kombinierten Stammlösung (II) und die in Tabelle 2 angegebenen jeweiligen Mengen der Makronährstoff-Stammlösung werden zur Herstellung des M7-Mediums mit entionisiertem Wasser auf 1 Liter aufgefüllt. Durch Zugabe von drei Vitaminen gemäß Tabelle 3 zu entionisiertem Wasser wird eine kombinierte Vitamin-Stammlösung hergestellt, von der 0,1 ml vor der Verwendung dem fertigen M7-Medium zugesetzt werden. Die Vitaminstammlösung wird in kleinen Portionen tiefgefroren aufbewahrt. Das Medium wird belüftet und stabilisiert.
Tabelle 1: Stammlösungen der Spurenelemente für das M4- und das M7-Medium
| Stammlösungen (I) | Menge (mg), die mit entionisiertem Wasser auf 1 Liter aufgefüllt wird | Herstellung der kombinierten Stammlösung (II): Folgende Mengen (ml) der Stammlösungen (I) werden gemischt und mit entionisiertem Wasser auf 1 Liter aufgefüllt. | Endkonzentrationen der Prüflösungen (mg/l) | ||
| M4 | M7 | M4 | M7 | ||
| H3BO3 (1) | 57.190 | 1,0 | 0,25 | 2,86 | 0,715 |
| MnCl2 · 4H2O (1) | 7.210 | 1,0 | 0,25 | 0,361 | 0,090 |
| LiCl (1) | 6.120 | 1,0 | 0,25 | 0,306 | 0,077 |
| RbCl (1) | 1.420 | 1,0 | 0,25 | 0,071 | 0,018 |
| SrCl2 · 6H2O (1) | 3.040 | 1,0 | 0,25 | 0,152 | 0,038 |
| NaBr (1) | 320 | 1,0 | 0,25 | 0,016 | 0,004 |
| Na2MoO4 · 2H2O (1) | 1.260 | 1,0 | 0,25 | 0,063 | 0,016 |
| CuCl2 · 2H2O (1) | 335 | 1,0 | 0,25 | 0,017 | 0,004 |
| ZnCl2 | 260 | 1,0 | 1,0 | 0,013 | 0,013 |
| CaCl2 · 6H2O | 200 | 1,0 | 1,0 | 0,010 | 0,010 |
| KI | 65 | 1,0 | 1,0 | 0,0033 | 0,0033 |
| Na2SeO3 | 43,8 | 1,0 | 1,0 | 0,0022 | 0,0022 |
| NH4VO3 | 11,5 | 1,0 | 1,0 | 0,00058 | 0,00058 |
| Na2EDTA · 2H2O 1, 2 | 5.000 | 20,0 | 5,0 | 2,5 | 0,625 |
| FeSO4 · 7H2O 1, 2 | 1.991 | 20,0 | 5,0 | 1,0 | 0,249 |
| 1) Diese Stoffe sind in M4 und M7 unterschiedlich dosiert (siehe oben).
2) Diese Lösungen werden einzeln hergestellt, zusammengegossen und sofort autoklaviert. | |||||
Tabelle 2: Makronährstoff-Stammlösung für das M4- und das M7-Medium
| Menge (mg), die mit entionisiertem Wasser auf 1 Liter aufgefüllt wird (mg) | Zur Herstellung des M4- und des M7-Mediums zugesetzte Menge an Makronährstoff Stammlösungen (ml/l) | Endkonzentrationen der Prüflösungen M4 und M7 (mg/l) | |
| CaCl2· 2H2O | 293.800 | 1,0 | 293,8 |
| MgSO4 · 7H2O | 246.600 | 0,5 | 123,3 |
| KCl | 58.000 | 0,1 | 5,8 |
| NaHCO3 | 64.800 | 1,0 | 64,8 |
| NaSiO3 · 9H2O | 50.000 | 0,2 | 10,0 |
| NaNO3 | 2.740 | 0,1 | 0,274 |
| KH2PO4 | 1.430 | 0,1 | 0,143 |
| K2HPO4 | 1.840 | 0,1 | 0,184 |
Tabelle 3: Vitamin-Stammlösung für das M4- und das M7-Medium
Aus den drei Vitaminlösungen wird eine einzige Vitamin-Stammlösung hergestellt.
| Menge (mg), die mit entionisiertem Wasser auf 1 Liter aufgefüllt wird (mg) | Zur Herstellung des M4- und des M7-Mediums zugesetzte Menge an Vitamin-Stammlösung (ml/l) | Endkonzentrationen der Prüflösungen M4 und M7 (mg/l) | |
| Thiaminhydrochlorid | 750 | 0,1 | 0,075 |
| Cyanocobalamin (B12) | 10 | 0,1 | 0,0010 |
| Biotin | 7,5 | 0,1 | 0,00075 |
BBA (1995), Longterm toxicity test with Chironomus riparius: Development and validation of a new test system, Hrsg. M. Streloke und H. Köpp. Berlin.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25-33.
Elendt, B.P., und W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157-1167.
| Zubereitung des formulierten Sediments | Anlage 3 |
Das formulierte Sediment setzt sich wie folgt zusammen:
| Bestandteil | Beschreibung | % der Trockenmasse des Sediments |
| Torf | Sphagnum-Torf, ph-Wert möglichst 5,5-6,0, ohne sichtbare Pflanzenreste, fein gemahlen (Partikelgröße ≤ 1 mm) und luftgetrocknet | 4-5 |
| Quarzsand | Partikelgröße: > 50 % der Partikel 50-200 µm | 75-76 |
| Kaolin-Ton | Kaolinitgehalt > | 20 |
| Organischer Kohlenstoff | Eingestellt durch Zugabe von Torf und Sand | 2 (± 0,5) |
| Calciumcarbonat | CaCO3, pulverisiert, chemisch rein | 0,05-0,1 |
| Wasser | Leitfähigkeit ≤ 10 µS/cm | 30-50 |
Der Torf wird luftgetrocknet und zu feinem Pulver zermahlen. Mit entionisiertem Wasser wird in einer leistungsstarken Homogenisiereinrichtung eine Suspension der erforderlichen Menge an Torfpulver hergestellt. Der pH-Wert dieser Suspension wird mit CaCO3 auf 5,5 ± 0,5 eingestellt. Diese Suspension wird bei 20 ± 2 °C für mindestens zwei Tage unter sanftem Rühren konditioniert, um den pH-Wert zu stabilisieren und eine Etablierung der mikrobiellen Fauna zu ermöglichen. Der pH-Wert wird erneut bestimmt und muss bei 6,0 ± 0,5 liegen. Nun werden die übrigen Komponenten (Sand und Kaolin-Ton) sowie entionisiertes Wasser zur Torf-Wasser-Suspension hinzugegeben und zu einem homogenen Sediment vermischt, dessen Wassergehalt 30-50 % der Trockenmasse des Sediments betragen sollte. Der pH-Wert der fertigen Mischung wird erneut gemessen und erforderlichenfalls mit CaCO3 auf 6,5-7,5 eingestellt. Anhand von Sedimentproben werden die Trockenmasse und der Gehalt an organischem Kohlenstoff bestimmt. Es wird empfohlen, das formulierte Sediment vor der Verwendung in einem Chironomiden-Toxizitätstest sieben Tage unter denselben Bedingungen wie sie im anschließenden Test vorherrschen, zu konditionieren.
Die trockenen Bestandteile für die Zubereitung des künstlichen Sediments können an einem trockenen und kühlen Ort bei Raumtemperatur gelagert werden. Das formulierte (feuchte) Sediment darf vor seiner Verwendung im Prüfversuch nicht gelagert werden. Es ist unmittelbar nach Ablauf der siebentägigen Konditionierung, mit der die Zubereitung abschließt, zu verwenden.
OECD (1984), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R., und B. Streit (1998), Shortterm toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10-20.
| Chemische Eigenschaften eines geeigneten Verdünnungswassers | Anlage 4 |
| Bestandteile | Konzentrationen |
| Partikel | < 20 mg/l |
| Gesamtgehalt an organischen Kohlenstoffen | < 2 mg/l |
| Nicht ionisiertes Ammonium | < 1 µg/l |
| Härte in CaCO3 | < 400 mg/l * |
| Restchlor | < 10 µg/l |
| Gesamtgehalt an phosphororganischen Pestiziden | < 50 ng/l |
| Gesamtgehalt an chlororganischen Pestiziden und polychlorierten Biphenylen | < 50 ng/l |
| Gesamtgehalt an organischem Chlor | < 25 ng/l |
| *)Wird jedoch ein Ionenaustausch zwischen den Härteionen und der Prüfchemikalie vermutet, ist Wasser geringerer Härte zu verwenden. (In diesem Fall ist das Elendt-Medium M4 zu vermeiden.) | |
| Leitlinien zur Durchführung des Tests | Anlage 5 |
Zuchtkäfig (Beispiel):
A: Gaze-Abdeckung oben und mindestens auf einer Seite (Maschenweite ca. 1 mm)
B: Öffnung zum Einsetzen der Imagines in den Zuchtkäfig und zur Entnahme der gelegten Eigelege aus den Kristallisierungsschalen (in dieser Abbildung nicht dargestellt)
C: Mindestabmessungen der Zuchtkäfige (L × H × B): 30 cm × 30 cm × 30 cm
Prüfgefäß (Beispiel):
A: Pasteur-Pipette zur Belüftung des Überstandswassers
B: Glasdeckel, damit die Imagines das Gefäß nicht verlassen
C: Überstandswasser
D: Prüfgefäß (Becherglas mit einem Fassungsvermögen von mindestens 600 ml)
E: Sedimentschicht
Absaugvorrichtung zur Extraktion von Imagines (Luftdurchfluss in Pfeilrichtung):
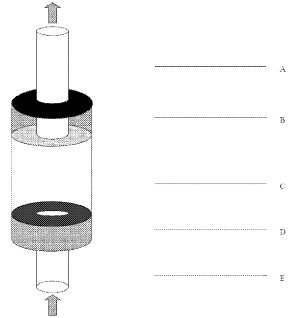
A: Glasrohr (Innendurchmesser ca. 5 mm), mit einer selbstansaugenden Pumpe verbunden
B: Korken aus vulkanisiertem Kautschuk, durch den das Glasrohr (A) geführt wird; innen ist die Öffnung des Glasrohrs (A) mit etwas Watte und einer Gaze (Maschenweite ca. 1 mm2) verschlossen, damit die in die Vorrichtung eingesaugten Mücken nicht beschädigt werden.
C: transparentes Behältnis (Kunststoff oder Glas, Länge ca. 15 cm) für die extrahierten Mücken
D: Korken aus vulkanisiertem Kautschuk, durch den ein Rohr (E) geführt wird; um die Mücken in den Zuchtkäfig zu entlassen, wird der Korken (D) aus dem Behältnis (C) gezogen.
E: Rohr (Kunststoff oder Glas, Innendurchmesser ca. 8 mm) zur Aufnahme der Imagines aus dem Gefäß
Schematische Darstellung eines Lebenszyklustests:
A: 1. Generation - Prüfgefäße mit einem Sediment-Wasser-System, acht Replikate, 20 L1-Larven pro Gefäß
B: vier Prüfgefäße pro Zuchtkäfig, A und B
C: Zuchtkäfige (A und B) zur Förderung der Schwarmbildung, der Paarung und der Eiablage
D: Kristallisierungsschalen zur Ablage der Eigelege
E: Mikrotiterplatten, für jedes Eigelege jeweils eine Vertiefung
F: 2. Generation - Prüfgefäße mit einem Sediment-Wasser-System, acht Replikate, 20 L1-Larven pro Gefäß
 | weiter. |  |