 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. ▢ Regelwerk, EU 2016, Chemikalien - EU Bund |
Verordnung (EU) 2016/266 der Kommission vom 7. Dezember 2015 zur Änderung der Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) zwecks Anpassung an den technischen Fortschritt
(Text von Bedeutung für den EWR)
(ABl. Nr. L 54 vom 01.03.2016 S. 1)
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rats vom 18. Dezember 2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH), zur Schaffung einer Europäischen Chemikalienagentur, zur Änderung der Richtlinie 1999/45/EG und zur Aufhebung der Verordnung (EWG) Nr. 793/93 des Rates, der Verordnung (EG) Nr. 1488/94 der Kommission, der Richtlinie 76/769/EWG des Rates sowie der Richtlinien 91/155/EWG, 93/67/EWG, 93/105/EG und 2000/21/EG der Kommission 1, insbesondere auf Artikel 13 Absatz 2,
in Erwägung nachstehender Gründe:
(1) In der Verordnung (EG) Nr. 440/2008 der Kommission 2 sind die in der Verordnung (EG) Nr. 1907/2006 vorgesehenen Prüfmethoden zur Bestimmung der physikalisch-chemischen Eigenschaften, der Toxizität und der Ökotoxizität von Stoffen festgelegt.
(2) Es ist angezeigt, die Verordnung (EG) Nr. 440/2008 zu aktualisieren und um neue und aktualisierte Prüfmethoden zu ergänzen, die die OECD kürzlich angenommen hat, um dem technischen Fortschritt Rechnung zu tragen und sicherzustellen, dass die Zahl der verwendeten Versuchstiere im Einklang mit der Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates 3 reduziert wird. Interessenträger wurden zu dem vorliegenden Entwurf konsultiert.
(3) Diese Anpassung betrifft 20 neue Prüfmethoden - eine neue Methode zur Bestimmung einer physikalisch- chemischen Eigenschaft, elf neue Prüfmethoden und drei aktualisierte Prüfmethoden zur Bewertung der Ökotoxizität sowie fünf neue Prüfmethoden zur Bewertung des Verbleibs und des Verhaltens in der Umwelt.
(4) Die Verordnung (EG) Nr. 440/2008 sollte daher entsprechend geändert werden.
(5) Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des mit Artikel 133 der Verordnung (EG) Nr. 1907/2006 eingesetzten Ausschusses
- hat folgende Verordnung erlassen:
Der Anhang der Verordnung (EG) Nr. 440/2008 wird nach Maßgabe des Anhangs der vorliegenden Verordnung geändert.
Diese Verordnung tritt am dritten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 7. Dezember 2015
2) Verordnung (EG) Nr. 440/2008 der Kommission vom 30. Mai 2008 zur Festlegung von Prüfmethoden gemäß der Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (ABl. Nr. L 142 vom 31.05.2008 S. 1).
3) Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (ABl. Nr. L 276 vom 20.10.2010 S. 33).
| Anhang |
(1) Am Anfang des Anhangs wird vor Teil A folgender Hinweis eingefügt:
"Hinweis:
Bevor eine der folgenden Methoden zur Prüfung eines mehrkomponentigen Stoffes (multiconstituent substance, MCS), eines Stoffes mit unbekannter oder variabler Zusammensetzung, komplexer Reaktionsprodukte oder biologischer Materialien (UVCB-Stoffe) oder eines Gemischs angewendet wird und soweit in der jeweiligen Methode deren Anwendbarkeit zur Prüfung von MCS, UVCB oder Gemischen nicht vorgesehen ist, sollte überlegt werden, ob die Prüfmethode für den vorgesehenen aufsichtsrechtlichen Zweck geeignet ist.
Wenn die Methode zur Prüfung eines MCS, UVCB oder Gemischs verwendet wird, sind in größtmöglichem Umfang hinreichende Informationen zur Zusammensetzung des Gemischs bereitzustellen (z.B. durch Angabe der chemischen Zusammensetzung, zu den jeweiligen Mengenanteilen und zu ihren relevanten Merkmalen der Komponenten)."
(2) Kapitel A.24 wird angefügt:
"A.24. Verteilungskoeffizient (N-Octanol/Wasser), Hochleistungs-Flüssigkeitschromatographie (HPLC-Methode)
Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 117 (2004).
1. Als Verteilungskoeffizient (P) bezeichnet man das Verhältnis der Gleichgewichtskonzentrationen eines gelösten Stoffs in einem Zweiphasensystem aus zwei weitgehend unmischbaren Lösungsmitteln. Für n-Octanol und Wasser gilt:
![]()
Der Verteilungskoeffizient (P) ist der Quotient zweier Konzentrationen. Er wird ohne Maßeinheit gewöhnlich in Form seines Zehnerlogarithmus angegeben.
2. Der Pow-Wert ist ein Schlüsselparameter in Studien zur Persistenz chemischer Stoffe in der Umwelt. Eine hoch signifikante Beziehung zwischen dem Pow-Wert nicht ionisierter Stoffe und ihrer Bioakkumulation in Fischen wurde nachgewiesen. Außerdem wurde nachgewiesen, dass der Pow-Wert ein hilfreicher Parameter zur Prognose der Adsorption im Boden und in Sedimenten und zur Feststellung quantitativer Struktur-Wirkungs- Beziehungen bei vielfältigen biologischen Wirkungen ist.
3. Der ursprüngliche Vorschlag für diese Prüfmethode beruhte auf einem Artikel von C. V. Eadsforth und P. Moser (1). 1986 hat das deutsche Umweltbundesamt die Entwicklung der Prüfmethode und einen OECD-Ringversuch koordiniert (2).
4. log Pow-Werte von - 2 bis 4 (gelegentlich bis zu 5 und höher) 1 können experimentell mit der Schüttelmethode bestimmt werden (Kapitel A.8 dieses Anhangs, OECD-Prüfrichtlinie 107). Mit der HPLC- Methode können log Pow-Werte von 0 bis 6 ermittelt werden (1)(2)(3)(4)(5). Bei dieser Methode muss unter Umständen der Pow-Wert geschätzt werden, um geeignete Referenzstoffe zuordnen und Schlussfolgerungen aus den in der Prüfung generierten Daten ziehen zu können. Die Berechnungsmethoden werden in der Anlage zu dieser Prüfmethode kurz erläutert. Die HPLC wird mit isokratischer Elution durchgeführt.
5. Die Pow-Werte hängen von den Umgebungsbedingungen (Temperatur, pH-Wert, Ionenkonzentration usw.) ab. Diese sollten im Versuch definiert werden, damit die Pow-Werte richtig interpretiert werden können. Für ionisierbare Stoffe könnte in Zukunft eine andere Methode zur Verfügung stehen (z.B. der Entwurf der OECD- Prüfrichtlinie zur pH-Messung ionisierter Stoffe (6)), die als alternative Methode angewandt werden sollte. Nach diesem Entwurf der OECD-Richtlinie kann zwar unter Umständen der Pow-Wert dieser ionisierbaren Stoffe ermittelt werden; manchmal ist jedoch eher die HPLC-Methode bei einem für die jeweiligen Umgebungsbedingungen relevanten pH-Wert zu empfehlen (siehe Nummer 9).
6. Analysen durch Umkehrphasen-HPLC werden mit Analysensäulen mit handelsüblichen Festphasen durchgeführt, die chemisch an Siliciumdioxid gebundene langkettige Kohlenwasserstoffe (z.B. C8 oder C18) enthalten.
7. Eine in eine solche Säule injizierte Chemikalie partitioniert zwischen der mobilen Lösungsmittelphase und der stationären Kohlenwasserstoffphase, während sie mit der mobilen Phase durch die Säule eluiert wird. Die Stoffe werden proportional entsprechend dem jeweiligen Kohlenwasserstoff/Wasser-Verteilungskoeffizienten abgetrennt; dabei werden zunächst die hydrophilen Stoffe und zuletzt die lipophilen Stoffe eluiert. Die Retentionszeit wird als Kapazitätsfaktor k ausgedrückt und mit folgender Formel bestimmt:
![]()
Dabei ist tR die Retentionszeit des Prüfstoffs und t0 die Totzeit, d. h. die Zeit, die ein Lösungsmittelmolekül durchschnittlich zum Wandern durch die Säule benötigt. Quantitative Analysemethoden sind nicht erforderlich, es müssen lediglich die Retentionszeiten bestimmt werden.
8. Der Octanol/Wasser-Verteilungskoeffizient eines Prüfstoffs kann berechnet werden, indem der Kapazitätsfaktor k des Prüfstoffs bestimmt und der so ermittelte Faktor k in die folgende Gleichung eingesetzt wird:
![]()
Dabei sind:
a, b = lineare Regressionskoeffizienten.
Die vorstehende Gleichung kann durch lineare Regression des Logarithmus der Octanol/Wasser-Verteilungskoeffizienten von Referenzsubstanzen gegen den Logarithmus der Kapazitätsfaktoren der Referenzsubstanzen ermittelt werden.
9. Durch Umkehrphasen-HPLC können Verteilungskoeffizienten im log Pow-Bereich von 0 bis 6 bestimmt werden; in Ausnahmefällen sind Berechnungen aber auch im log Pow-Bereich von 6 bis 10 möglich. Dazu muss unter Umständen allerdings die mobile Phase modifiziert werden (3). Für starke Säuren und Basen sowie für Metallkomplexe, Stoffe, die mit dem Elutionsmittel reagieren, und für grenzflächenaktive Stoffe ist diese Methode nicht geeignet. Messungen an ionisierbaren Stoffen können nur an deren nicht ionisierter Form (freie Säure oder freie Base) durch Verwendung eines geeigneten Puffers mit einem pH-Wert unter (freie Säure) bzw. über (freie Base) dem pKa-Wert durchgeführt werden. Alternativ könnte in Zukunft eine pH-Messmethode zur Prüfung ionisierbarer Stoffe zur Verfügung stehen, die als Alternativmethode (6) angewendet werden könnte. Wenn der log Pow-Wert für eine Einstufung oder eine Bewertung des Umweltrisikos ermittelt wird, ist die Prüfung bei einem für die jeweilige natürliche Umgebung typischen pH-Bereich vorzunehmen (d. h. im pH- Bereich von 5,0 bis 9).
10. Manchmal können Verunreinigungen die Interpretation der Ergebnisse erschweren, weil die Zuordnung der Peaks nicht eindeutig ist. Für Gemische, die ein nicht aufgelöstes Band ergeben, sollten jeweils die obere und die untere Grenze des log Pow-Peaks und die prozentuale Fläche jedes log Pow-Peaks angegeben werden. Für Gemische, die aus einer Gruppe von Homologen bestehen, sollte auch der gewichtete durchschnittliche log Pow- Wert angegeben werden (7); dieser ist ausgehend von den einzelnen Pow-Werten und den entsprechenden prozentualen Flächen zu berechnen (8). Alle Peaks, die mit einer Fläche von mindestens 5 % zur gesamten Peak-Fläche beitragen, sind in der Berechnung zu berücksichtigen (9):
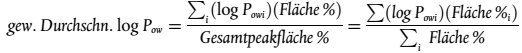
Der gewichtete durchschnittliche log Pow-Wert gilt nur für aus Homologen (z.B. einer Reihe von Alkanen) bestehende Stoffe oder Gemische (z.B. für Tallöle). Die Messung von Gemischen kann zu aussagekräftigen Ergebnissen führen, wenn die Empfindlichkeit des verwendeten analytischen Detektors bei allen in dem Gemisch enthaltenen Stoffen gleich ist und eine angemessene Auflösung erreicht werden kann.
11. Die Dissoziationskonstante, die Strukturformel und die Löslichkeit in der mobilen Phase sollten bekannt sein, bevor diese Methode angewendet wird. Außerdem sind Informationen zur Hydrolyse hilfreich.
12. Um die Zuverlässigkeit der Messung zu erhöhen, sind Doppelbestimmungen durchzuführen.
- Wiederholbarkeit: Der aus wiederholten Messungen unter identischen Bedingungen und mit derselben Gruppe von Referenzstoffen ermittelte log Pow-Wert sollte im Bereich von ± 0,1 log-Einheiten liegen.
- Reproduzierbarkeit: Wenn die Messungen mit einer anderen Reihe von Referenzstoffen wiederholt werden, können andere Ergebnisse ermittelt werden. In der Regel liegt der Korrelationskoeffizient R der Beziehung zwischen log k und log Pow bei einer Reihe von Prüfstoffen etwa bei 0,9; dies entspricht einem Octanol-/Wasser-Verteilungskoeffizienten von log Pow ± 0,5 log-Einheiten.
13. Der Ringversuch hat gezeigt, dass mit der HPLC-Methode log Pow-Werte im Bereich von ± 0,5 Einheiten der mit der Schüttelmethode bestimmten Werte ermittelt werden können (2). Weitere Vergleiche sind der Literatur zu entnehmen (4)(5)(10)(11)(12). Die höchste Genauigkeit wird mit Korrelationsdiagrammen strukturverwandter Referenzstoffe erzielt (13).
14. Um den gemessenen Kapazitätsfaktor k eines Stoffs mit seinem Pow zu korrelieren, muss eine Kalibrierkurve mit mindestens sechs Datenpunkten erstellt werden (siehe Nummer 24). Die Wahl der geeigneten Referenzstoffe obliegt dem Benutzer. Die log Pow-Werte der Referenzstoffe sollten in der Regel den log Pow-Wert des Prüfstoffs einschließen; d. h. mindestens ein Referenzstoff sollte einen Pow-Wert über dem des Prüfstoffs und ein anderer einen Pow-Wert unter dem des Prüfstoffs haben. Extrapolationen sollten nur ausnahmsweise vorgenommen werden. Die Referenzstoffe sollten vorzugsweise mit dem Prüfstoff strukturverwandt sein. Die log- Pow-Werte der für die Kalibrierung verwendeten Referenzstoffe müssen auf zuverlässigen Versuchsdaten beruhen. Bei Stoffen mit hohem log Pow (normalerweise über 4) können berechnete Werte verwendet werden, wenn keine zuverlässigen experimentellen Daten verfügbar sind. Wenn extrapolierte Werte verwendet werden, ist ein Grenzwert anzugeben.
15. Für viele Gruppen von Chemikalien liegen umfangreiche Listen mit log Pow-Werten vor (14)(15). Wenn keine Daten zu den Verteilungskoeffizienten strukturverwandter Stoffe verfügbar sind, kann eine mit sonstigen Referenzstoffen ermittelte allgemeinere Kalibrierung verwendet werden. In Tabelle 1 sind empfohlene Referenzstoffe und die jeweiligen Pow-Werte zusammengestellt. Bei ionisierbaren Stoffen beziehen sich die angegebenen Werte auf die nicht ionisierte Form. Im Ringversuch wurden die Werte einer Plausibilitäts- und Qualitätsprüfung unterzogen.
Tabelle 1: Empfohlene Referenzstoffe
| CAS-Nummer | Referenzstoff | log Pow | pKa | |
| 1 | 78-93-3 | 2-Butanon (Methylethylketon) | 0,3 | |
| 2 | 1122-54-9 | 4-Acetylpyridin | 0,5 | |
| 3 | 62-53-3 | Anilin | 0,9 | |
| 4 | 103-84-4 | Acetanilid | 1,0 | |
| 5 | 100-51-6 | Benzylalkohol | 1,1 | |
| 6 | 150-76-5 | 4-Methoxyphenol | 1,3 | pKa = 10,26 |
| 7 | 122-59-8 | Phenoxyessigsäure | 1,4 | pKa = 3,12 |
| 8 | 108-95-2 | Phenol | 1,5 | pKa = 9,92 |
| 9 | 51-28-5 | 2,4-Dinitrophenol | 1,5 | pKa = 3,96 |
| 10 | 100-47-0 | Benzonitril | 1,6 | |
| 11 | 140-29-4 | Phenylacetonitril | 1,6 | |
| 12 | 589-18-4 | 4-Methylbenzylalkohol | 1,6 | |
| 13 | 98-86-2 | Acetophenon | 1,7 | |
| 14 | 88-75-5 | 2-Nitrophenol | 1,8 | pKa = 7,17 |
| 15 | 121-92-6 | 3-Nitrobenzoesäure | 1,8 | pKa = 3,47 |
| 16 | 106-47-8 | 4-Chloranilin | 1,8 | pKa = 4,15 |
| 17 | 98-95-3 | Nitrobenzol | 1,9 | |
| 18 | 104-54-1 | Zinnamylalkohol (Zimtalkohol) | 1,9 | |
| 19 | 65-85-0 | Benzoesäure | 1,9 | pKa = 4,19 |
| 20 | 106-44-5 | p-Cresol | 1,9 | pKa = 10,17 |
| 21 | 140-10-3 (trans) | Zimtsäure | 2,1 | pKa = 3,89 (cis) 4,44 (trans) |
| 22 | 100-66-3 | Anisol | 2,1 | |
| 23 | 93-58-3 | Methylbenzoat | 2,1 | |
| 24 | 71-43-2 | Benzol | 2,1 | |
| 25 | 99-04-7 | 3-Methylbenzoesäure | 2,4 | pKa = 4,27 |
| 26 | 106-48-9 | 4-Chlorphenol | 2,4 | pKa = 9,1 |
| 27 | 79-01-6 | Trichlorethylen | 2,4 | |
| 28 | 1912-24-9 | Atrazin | 2,6 | |
| 29 | 93-89-0 | Ethylbenzoat | 2,6 | |
| 30 | 1194-65-6 | 2,6-Dichlorbenzonitril | 2,6 | |
| 31 | 535-80-8 | 3-Chlorbenzoesäure | 2,7 | pKa = 3,82 |
| 32 | 108-88-3 | Toluol | 2,7 | |
| 33 | 90-15-3 | 1-Naphthol | 2,7 | pKa = 9,34 |
| 34 | 608-27-5 | 2,3-Dichloranilin | 2,8 | |
| 35 | 108-90-7 | Chlorbenzol | 2,8 | |
| 36 | 1746-13-0 | Allyl-Phenylether | 2,9 | |
| 37 | 108-86-1 | Brombenzol | 3,0 | |
| 38 | 100-41-4 | Ethylbenzol | 3,2 | |
| 39 | 119-61-9 | Benzophenon | 3,2 | |
| 40 | 92-69-3 | 4-Phenylphenol | 3,2 | pKa = 9,54 |
| 41 | 89-83-8 | Thymol | 3,3 | |
| 42 | 106-46-7 | 1,4-Dichlorbenzol | 3,4 | |
| 43 | 122-39-4 | Diphenylamin | 3,4 | pKa = 0,79 |
| 44 | 91-20-3 | Naphthalin | 3,6 | |
| 45 | 93-99-2 | Phenylbenzoat | 3,6 | |
| 46 | 98-82-8 | Isopropylbenzol | 3,7 | |
| 47 | 88-06-2 | 2,4,6-Trichlorphenol | 3,7 | pKa = 6 |
| 48 | 92-52-4 | Biphenyl | 4,0 | |
| 49 | 120-51-4 | Benzylbenzoat | 4,0 | |
| 50 | 88-85-7 | 2,4-Dinitro-6-secbutylphenol | 4,1 | |
| 51 | 120-82-1 | 1,2,4-Trichlorbenzol | 4,2 | |
| 52 | 143-07-7 | Dodecansäure | 4,2 | pKa = 5,3 |
| 53 | 101-84-8 | Diphenylether | 4,2 | |
| 54 | 85-01-8 | Phenanthren | 4,5 | |
| 55 | 104-51-8 | n-Butylbenzol | 4,6 | |
| 56 | 103-29-7 | Dibenzyl | 4,8 | |
| 57 | 3558-69-8 | 2,6-Diphenylpyridin | 4,9 | |
| 58 | 206-44-0 | Fluoranthen | 5,1 | |
| 59 | 603-34-9 | Triphenylamin | 5,7 | |
| 60 | 50-29-3 | DDT | 6,5 |
Vorabschätzung des Verteilungskoeffizienten
16. Erforderlichenfalls kann der Verteilungskoeffizient der Prüfsubstanz geschätzt werden; die Schätzung sollte vorzugsweise mit einer Berechnungsmethode (siehe Anlage) bzw. gegebenenfalls auch aufgrund des Verhältnisses der Löslichkeit der Prüfsubstanz in den reinen Lösungsmitteln erfolgen.
Gerät
17. Benötigt werden ein Flüssigphasenchromatograph mit einer Pumpe mit niedriger Förderleistung und ein geeignetes Detektionssystem. Angesichts der Vielzahl chemischer Gruppen kommen ein UV-Detektor mit einer Wellenlänge von 210 nm oder ein RI-Detektor in Betracht. Die Leistung der HPLC-Säule kann durch polare Gruppen in der stationären Phase erheblich beeinträchtigt werden. Deshalb sollten die stationären Phasen so wenig polare Gruppen wie möglich enthalten (16). Es können handelsübliche Mikroteilchenfüllungen für die Umkehrphasenchromatografie oder Fertigsäulen verwendet werden. Zwischen das Dosiersystem und die Analysensäule kann eine Vorsäule gesetzt werden.
Mobile Phase
18. Zur Zubereitung des Elutionsmittels werden für die HPLC-Methode ausreichend reines Methanol und destilliertes oder entionisiertes Wasser verwendet; das Elutionsmittel wird vor seiner Verwendung entgast. Es ist das Verfahren der isokratischen Elution anzuwenden. Dabei werden Methanol-Wasser-Verhältnisse mit einem Wassergehalt von mindestens 25 % empfohlen. Im Normalfall ist eine Methanol-Wasser-Mischung im Volumenverhältnis 3:1 für die Eluierung von Verbindungen mit einem log P-Wert von 6 bei einer Elutionszeit von einer Stunde und einer Durchflussrate von 1 ml/min ausreichend. Für Verbindungen mit einem log P-Wert von über 6 kann eine Verkürzung der Elutionszeit (auch der der Referenzstoffe) durch Senkung der Polarität der mobilen Phase oder Kürzung der Säulenlänge erforderlich sein.
19. Der Prüfstoff und die Referenzstoffe müssen in der mobilen Phase in ausreichender Konzentration löslich sein, um nachgewiesen werden zu können. Nur in Ausnahmefällen dürfen in der Methanol-Wasser-Mischung Zusatzstoffe verwendet werden, da diese die Eigenschaften der Säule verändern. In diesen Fällen muss sichergestellt werden, dass keine Auswirkungen auf die Retentionszeit der Prüfstoffe und der Referenzstoffe gegeben sind. Wenn die Methanol-Wasser-Mischung ungeeignet ist, können andere Mischungen aus einem organischen Lösungsmittel und Wasser verwendet werden, beispielsweise Ethanol-Wasser, Acetonitril-Wasser oder 2-Propanol-Wasser.
20. Der pH-Wert des Lösungsmittels ist für ionisierbare Stoffe kritisch. Er sollte innerhalb des pH-Bereichs der Säule liegen, der sich im Allgemeinen zwischen 2 und 8 bewegt. Die Anwendung eines Puffers ist zu empfehlen. Dabei muss darauf geachtet werden, dass kein Salz ausfällt und es nicht zur Beschädigung der Säule kommt, was bei einer Reihe von Mischungen von organischer Phase und Puffer möglich ist. HPLC-Messungen mit einer an Siliciumdioxid gebundenen stationären Phase und einem pH-Wert über 8 sind nicht empfehlenswert, da die Leistung der Säule bei Verwendung einer alkalischen mobilen Phase rapide nachlassen kann.
Gelöste Stoffe
21. Der Prüfstoff und die Referenzstoffe müssen ausreichend rein sein, um die Peaks der Chromatogramme den jeweiligen Stoffen zuordnen zu können. Die für Prüf- oder Kalibrierungszwecke verwendeten Stoffe werden möglichst in der mobilen Phase gelöst. Wird für die Lösung des Prüfstoffs und der Referenzstoffe ein anderes Lösungsmittel als die mobile Phase verwendet, so ist die mobile Phase für die letzte Verdünnung vor der Injektion zu verwenden.
Prüfbedingungen
22. Die Temperatur darf während der Messungen um höchstens ± 1 °C schwanken.
Bestimmung der Totzeit t0
23. Die Totzeit t0 lässt sich durch Verwendung nicht chromatografisch verzögerter organischer Verbindungen (z.B. Thioharnstoff oder Formamid) bestimmen. Ein genauerer Wert für die Totzeit ergibt sich aus den gemessenen Retentionszeiten oder aus etwa sieben Komponenten einer homologen Reihe (z.B. n-Alkyl-Methyl-Ketone) (17). Die Retentionszeiten tR (nC + 1) werden gegen tR (nC) aufgetragen; nC ist die Anzahl der Kohlenstoffatome. Es ergibt sich eine Gerade, tR (nC + 1) = A tR (nC) + (1 - A)t0; A ergibt sich aus k(nC + 1)/k(nC) und ist konstant. Die Totzeit t0 wird aus dem Schnittpunkt (1 - A) t0 und der Steigung A bestimmt.
Regressionsgleichung
24. Der nächste Schritt besteht in der Erstellung einer Korrelationskurve log k/log P für geeignete Referenzstoffe mit log P-Werten etwa im Bereich des für den Prüfstoff zu erwartenden Wertes. In der Praxis werden dazu 6 bis 10 Referenzstoffe gleichzeitig eingespritzt. Die Retentionszeiten werden am besten mithilfe eines mit dem Detektionssystem gekoppelten registrierenden Integrators bestimmt. Die Logarithmen der entsprechenden Kapazitätsfaktoren (log k) werden als Funktion von log P aufgezeichnet. Die Regressionsgleichung wird in regelmäßigen Abständen (mindestens einmal täglich) vorgenommen, damit eventuelle Leistungsveränderungen der Säule berücksichtigt werden können.
Bestimmung des Pow-Wertes des Prüfstoffs
25. Der Prüfstoff wird in den geringsten noch nachweisbaren Mengen eingespritzt. Die Retentionszeit wird doppelt bestimmt. Der Verteilungskoeffizient des Prüfstoffs kann aus dem berechneten Kapazitätsfaktor auf der Kalibrierkurve interpoliert werden. Bei sehr niedrigen und sehr hohen Verteilungskoeffizienten ist eine Extrapolation erforderlich. In diesen Fällen ist besonders auf die Vertrauensgrenzen der Regressionsgeraden zu achten. Wenn die Retentionszeit der Probe außerhalb des Bereichs der für die Standards ermittelten Retentionszeiten liegt, ist ein Grenzwert anzugeben.
Prüfbericht
26. Der Bericht muss folgende Angaben enthalten:
- wenn bestimmt, die Vorabschätzung des Verteilungskoeffizienten, die geschätzten Werte und die verwendete Methode; wenn eine Berechnungsmethode verwendet wurde, die vollständige Beschreibung der Methode einschließlich der Datenbasis und detaillierter Informationen zur Auswahl von Substrukturen;
- Prüf- und Referenzstoffe: Reinheit, Strukturformel und CAS-Nummer,
- Beschreibung der Ausrüstung und der Betriebsbedingungen: Analysensäule, Vorsäule
- mobile Phase, Detektionsverfahren, Temperaturbereich, pH-Wert;
- Elutionsprofile (Chromatogramme);
- Totzeit und entsprechendes Messverfahren;
- Retentionswerte und Pow-Werte aus der Literatur für zur Kalibrierung verwendete Referenzstoffe;
- nähere Angaben zur Anpassung der Regressionsgeraden (log k/log Pow) und zum Korrelationskoeffizienten der Geraden einschließlich Konfidenzintervallen;
- durchschnittliche Retentionswerte und interpolierter log Pow-Wert für den Prüfstoff;
- bei Mischungen: Elutionsprofil-Chromatogramm mit Abgrenzungswerten;
- log Pow-Werte im Verhältnis zur prozentualen Fläche des log Pow-Peaks;
- Berechnung mit einer Regressionsgeraden;
- gegebenenfalls berechnete durchschnittliche log Pow-Werte.
(1) C.V. Eadsforth und P. Moser. (1983). Assessment of Reverse Phase Chromatographic Methods for Determining Partition Coefficients. Chemosphere. 12, 1459.
(2) W. Klein, W. Kördel, M. Weiss und H.J. Poremski. (1988). Updating of the OECD Test Guideline 107 Partition Coefficient n-Octanol-Water, OECD Laboratory Intercomparison Test on the HPLC Method. Chemosphere. 17, 361.
(3) C.V. Eadsforth. (1986). Application of Reverse H.P.L.C. for the Determination of Partition Coefficient. Pesticide Science. 17, 311.
(4) H. Ellgehausen, C. D'Hondt und R. Fuerer (1981). Reversedphase chromatography as a general method for determining octan-1-ol/water partition coefficients. Pesticide. Science. 12, 219.
(5) B. McDuffie (1981). Estimation of Octanol Water Partition Coefficients for Organic Pollutants Using Reverse Phase High Pressure Liquid Chromatography. Chemosphere. 10, 73.
(6) OECD (2000). Guideline for Testing of Chemicals - Partition Coefficient (noctanol/water): pH-metric Method for Ionisable Substances. Draft Guideline, November 2000.
(7) OSPAR (1995). "Harmonised Offshore Chemicals Notification Format (HOCFN) 1995", Oslo and Paris Conventions for the Prevention of Marine Pollution Programmes and Measures Committee (PRAM), Annex 10, Oviedo, 20.-24. Februar 1995.
(8) M. Thatcher, M. Robinson, L. R. Henriquez und C. C. Karman. (1999). An User Guide for the Evaluation of Chemicals Used and Discharged Offshore, A CIN Revised CHARM III Report 1999. Version 1.0, 3. August.
(9) E. A. Vik, S. Bakke und K. Bansal. (1998). Partitioning of Chemicals. Important Factors in Exposure Assessment of Offshore Discharges. Environmental Modelling & Software Vol. 13, S. 529-537.
(10) L.O. Renberg, S.G. Sundstroem und K. Sundh-Nygård. (1980). Partition coefficients of organic chemicals derived from reversedphase thinlayer chromatography. Evaluation of methods and application on phosphate esters, polychlorinated paraffins and some PCB-substitutes. Chemosphere. 9, 683.
(11) W.E. Hammers, G.J. Meurs und C.L. De-Ligny. (1982). Correlations between liquid chromatographic capacity ratio data on Lichrosorb RP-18 and partition coefficients in the octanolwater system. J. Chromatography 247, 1.
(12) J.E. Haky und A.M. Young. (1984). Evaluation of a simple HPLC correlation method for the estimation of the octanolwater partition coefficients of organic compounds. J. Liq. Chromatography. 7, 675.
(13) S. Fujisawa und E. Masuhara. (1981). Determination of Partition Coefficients of Acrylates Methacrylates and Vinyl Monomers Using High Performance Liquid Chromatography. Journal of Biomedical Materials Research. 15, 787.
(14) C. Hansch und A. J. Leo. (1979). Substituent Constants for Correlation Analysis in Chemistry and Biology. John Willey, New York.
(15) C. Hansch, Vorsitz; A. J. Leo, Dir. (1982). Log P and Parameter Database: A tool for the quantitative prediction of bioactivity - Available from Pomona College Medical Chemistry Project, Pomona College, Claremont, California 91711.
(16) R. F. Rekker, H. M. de Kort. (1979). The hydrophobic fragmental constant: An extension to a 1.000 data point set. Eur. J. Med. Chem. - Chim. Ther. 14, 479.
(17) G.E. Berendsen, P.J. Schoenmakers, L. de Galan, G. Vigh, Z. Varga-Puchony, und J. Inczédy. (1980). On determination of holdup time in reversedphase liquid chromatography. J. Liq. Chromato. 3, 1669.
| Methoden zur Berechnung von Pow-Werten | Anlage |
1. Diese Anlage enthält eine kurze Einführung in die Berechnung von Pow-Werten. Weitere Informationen sind der Literatur zu entnehmen (1)(2).
2. Die berechneten Pow-Werte werden zu folgenden Zwecken verwendet:
- Auswahl der anzuwendenden Versuchsmethode: Schüttelmethode bei log Pow zwischen - 2 und 4 und HPLC-Methode bei log Pow zwischen 0 und 6;
- Festlegung der Bedingungen der HPLC (Referenzstoffe, Methanol-Wasser-Verhältnis);
- Plausibilitätsprüfung der durch Versuchsverfahren ermittelten Werte;
- Abgabe einer Einschätzung, wenn Versuchsverfahren nicht verwendet werden können.
Prinzip der Berechnungsverfahren
3. Die hier vorgeschlagenen Berechnungsverfahren beruhen auf der theoretischen Aufspaltung des Moleküls in geeignete Substrukturen, für die zuverlässige log Pow-Inkremente bekannt sind. Der log Pow-Wert wird als Summe seiner entsprechenden Teilwerte und der Korrekturglieder für intramolekulare Wechselwirkungen berechnet. Aufstellungen über Konstanten von Substrukturen und Korrekturglieder liegen vor (1)(2)(3)(4)(5)(6). Einige davon werden regelmäßig aktualisiert (3).
Zuverlässigkeit berechneter Werte
4. Im Allgemeinen nimmt die Zuverlässigkeit der Berechnungsverfahren in dem Maße ab, in dem die Komplexität des Prüfstoffs zunimmt. Bei einfachen Stoffen mit niedrigem Molekulargewicht und einer oder zwei funktionellen Gruppen ist mit einer Abweichung von 0,1 bis 0,3 log Pow-Einheiten von den Ergebnissen der verschiedenen Fragmentmethoden gegenüber den Messwerten zu rechnen. Die Fehlerspanne hängt von der Zuverlässigkeit der verwendeten Konstanten für die Substrukturen, der Fähigkeit der Erkennung intramolekularer Wechselwirkungen (z.B. Wasserstoffbindungen) und der richtigen Anwendung der Korrekturglieder ab. Bei ionisierbaren Stoffen ist die richtige Berücksichtigung der Ladung und des Ionisierungsgrades wichtig (10).
Fujita-Hansch'sche π-Methode
5. Die ursprünglich von Fujita et al. (7) für hydrophobe Substituenten eingeführte Konstante π wird wie folgt definiert:
![]()
wobei PhX ein aromatischer Abkömmling und PhH der Ausgangsstoff ist.

Die π-Methode ist vorwiegend bei aromatischen Stoffen von Bedeutung. π-Werte liegen für zahlreiche Substituenten vor (4)(5).
Rekker-Methode
6. Mit der Rekker-Methode (8) wird log Pow wie folgt berechnet:
![]()
wobei ai für die Häufigkeit steht, mit der eine bestimmte Substruktur im Molekül vorkommt, und fi das log Pow-Inkrement der Substruktur ist. Die Glieder für die Wechselwirkungen lassen sich als ein ganzes Vielfaches einer einzigen Konstante Cm (der so genannten magischen Konstante) angeben. Die Substrukturkonstanten fi und Cm wurden aus einer Liste von 1.054 experimentell ermittelten Pow-Werten (825 Verbindungen) mithilfe der mehrfachen Regressionsanalyse bestimmt (6)(8). Die Bestimmung der Glieder für die Wechselwirkungen erfolgt nach den in der Literatur angegebenen Regeln (6)(8)(9).
Hansch-Leo-Methode
7. Nach Hansch und Leo (4) wird der log Pow-Wert wie folgt berechnet:
![]()
wobei fi eine Substrukturkonstante und Fj ein Korrekturglied (, Faktor") ist und ai und bj für die entsprechende Häufigkeit des Vorkommens stehen. Listen der Substrukturwerte für einzelne Atome und Gruppen und für Korrekturglieder Fj wurden durch die Trialand-Error-Methode aus experimentell bestimmten Pow-Werten abgeleitet. Die Korrekturglieder sind in unterschiedliche Kategorien eingeordnet worden (1)(4). Um sämtliche Regeln und Korrekturglieder zu berücksichtigen, wurden geeignete Software-Pakete entwickelt (3).
8. Die Berechnung der log Pow-Werte komplexer Moleküle kann beträchtlich verbessert werden, wenn das Molekül in größere Substrukturen zerlegt wird, für die zuverlässige log Pow-Werte vorliegen, sei es aus Tabellen (3) (4), sei es aus eigenen Messungen. Solche Substrukturen (z.B. Heterocyclen, Anthrachinon, Azobenzol) können dann mit den Hansch'schen π-Werten oder mit den Substrukturkonstanten nach Rekker oder Leo kombiniert werden.
Bemerkungen
- Die Berechnungsmethoden können auf teilweise oder vollständig ionisierte Stoffe nur dann angewendet werden, wenn die erforderlichen Korrekturfaktoren berücksichtigt werden.
- Wenn von intramolekularen Wasserstoffbindungen ausgegangen werden kann, müssen die entsprechenden Korrekturglieder (etwa + 0,6 bis + 1,0 log Pow-Einheiten) addiert werden (1). Hinweise auf das Vorliegen solcher Bindungen sind Stereo-Modellen oder spektroskopischen Daten des Stoffs zu entnehmen.
- Wenn mehrere tautomere Formen möglich sind, ist die wahrscheinlichste Form als Berechnungsgrundlage anzunehmen.
- Die Überarbeitungen der Listen der Substrukturkonstanten sind sorgfältig zu verfolgen.
Literatur zu Berechnungsmethoden
(1) W.J. Lyman, W.F. Reehl und D.H. Rosenblatt (Hrsg.). Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York (1982).
(2) W.J. Dunn, J.H. Block und R.S. Pearlman (Hrsg.). Partition Coefficient, Determination and Estimation, Pergamon Press, Elmsford (New York) und Oxford (1986).
(3) Pomona College, Medicinal Chemistry Project, Claremont, California 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP-3).
(4) C. Hansch und A.J. Leo. Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York (1979).
(5) Leo, C. Hansch und D. Elkins. (1971) Partition coefficients and their uses. Chemical Reviews. 71, 525.
(6) R. F. Rekker, H. M. de Kort. (1979). The hydrophobic fragmental constant: An extension to a 1.000 data point set. Eur. J. Med. Chem. - Chim. Ther. 14, 479.
(7) Toshio Fujita, Junkichi Iwasa & Corwin Hansch (1964). A New Substituent Constant, À, Derived from Partition Coefficients. J. Amer. Chem. Soc. 86, 5175.
(8) R.F. Rekker. The Hydrophobic Fragmental Constant, Pharmacochemistry Library, Vol. 1, Elsevier, New York (1977).
(9) C.V. Eadsforth und P. Moser. (1983). Assessment of Reverse Phase Chromatographic Methods for Determining Partition Coefficients. Chemosphere. 12, 1459.
(10) R.A. Scherrer. ACS - Symposium Series 255, S. 225, American Chemical Society, Washington, D.C. (1984)." (3) Kapitel C.3 erhält folgende Fassung:
"C.3. Süsswasseralgen und Cyanobakterien: Wachstumsinhibitionstest
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 201 (2006, Anhang korrigiert im Jahr 2011). Es wurde festgestellt, dass die Prüfmethode auf weitere Arten ausgeweitet und an die Anforderungen an die Risikobewertung und die Klassifizierung chemischer Stoffe angepasst werden muss. Die Überarbeitung wurde auf der Grundlage umfassender praktischer Erfahrungen sowie des wissenschaftlichen Fortschritts im Zusammenhang mit Untersuchungen zur Algentoxizität und der weit reichenden Anwendung entsprechender Rechtsvorschriften seit Annahme der ursprünglichen Fassung vorgenommen.
2. Definitionen der verwendeten Begriffe sind Anlage 1 zu entnehmen.
3. Mit dieser Prüfung soll die Wirkung einer Chemikalie auf das Wachstum von Süßwasser-Mikroalgen und/oder Cyanobakterien bestimmt werden. Exponentiell wachsende Testorganismen werden in Batch-Kulturen über einen Zeitraum von im Allgemeinen 72 Stunden der Prüfchemikalie ausgesetzt. Trotz der verhältnismäßig kurzen Testdauer können Auswirkungen über mehrere Generationen beurteilt werden.
4. Die Systemantwort besteht in der Verringerung des Wachstums einer Reihe von Algenkulturen (Versuchseinheiten), die einer Prüfchemikalie in unterschiedlichen Konzentrationen ausgesetzt wurden. Diese Reaktion wird in Abhängigkeit von der Expositionskonzentration gegenüber dem durchschnittlichen Wachstum in der Chemikalie nicht ausgesetzten Replikatkontrollkulturen bewertet. Um die Systemantwort auf toxische Auswirkungen (optimale Empfindlichkeit) umfassend beschreiben zu können, wird ein unbegrenztes exponentielles Wachstum der Kulturen bei hinreichender Ernährung und kontinuierlicher Beleuchtung über einen ausreichenden Zeitraum ermöglicht, damit anschließend die Verringerung der spezifischen Wachstumsrate gemessen werden kann.
5. Wachstum und Wachstumshemmung werden durch zeitabhängige Messung der Biomasse der Algen bestimmt. Die Biomasse der Algen wird als Trockenmasse pro Volumen ausgedrückt (z.B. in mg Algen/Liter Testlösung). Die Trockenmasse ist jedoch schwer zu messen; daher werden Surrogatparameter verwendet. Häufigster Surrogatparameter ist die Zellzahl. Weitere Surrogatparameter sind das Zellvolumen, die Fluoreszenz, die optische Dichte usw. Der Faktor für die Umrechnung zwischen dem gemessenen Surrogatparameter und der Biomasse sollte bekannt sein.
6. Der Endpunkt des Tests ist die Wachstumshemmung, ausgedrückt als logarithmische Zunahme der Biomasse (durchschnittliche spezifische Wachstumsrate) während der Expositionsdauer. Aus den in einer Reihe von Testlösungen erfassten durchschnittlichen spezifischen Wachstumsraten wird die Konzentration bestimmt, bei der sich eine spezifizierte Hemmung der Wachstumsrate von x % (z.B. 50 %) ergibt; diese Konzentration wird als ErCx bezeichnet (z.B. ErC50).
7. Eine weitere Reaktionsvariable bei dieser Prüfmethode ist der Zellertrag (Yield). Diese Variable kann erforderlich sein, damit länderspezifische Regulierungsanforderungen erfüllt werden. Der Zellertrag wird definiert als Biomasse am Ende der Expositionsdauer abzüglich der Biomasse zu Beginn der Expositionsdauer. Aus dem in einer Reihe von Testlösungen erfassten Zellertrag wird die Konzentration berechnet, die eine spezifizierte Hemmung des Zellertrags (z.B. um 50 %) hervorruft; diese Konzentration wird als EyCx angegeben (z.B. EyC50).
8. Außerdem können die niedrigste Konzentration mit beobachteter Wirkung (LOEC) und die höchste geprüfte Konzentration ohne beobachtete Wirkung (NOEC) statistisch bestimmt werden.
Informationen zur Prüfchemikalie
9. Informationen zur Prüfchemikalie, die bei der Bestimmung der Prüfbedingungen hilfreich sein könnten, sind z.B. die Strukturformel, die Reinheit, die Lichtbeständigkeit, die Beständigkeit unter den Prüfbedingungen, das Lichtabsorptionsverhalten, pKa und die Ergebnisse von Transformationsstudien (u. a. die Ergebnisse von Studien zur biologischen Abbaubarkeit in Wasser).
10. Die Wasserlöslichkeit, der Octanol/Wasser-Verteilungskoeffizient (Pow) und der Dampfdruck der Prüfchemikalie sollten bekannt sein, und eine validierte Methode zur Quantifizierung der Chemikalie in den Testlösungen mit bekannten Wiederfindungsraten und mit bekannter Nachweisgrenze sollte verfügbar sein.
11. Damit ein Test als valide gewertet werden kann, müssen die folgenden Kriterien erfüllt sein:
- Die Biomasse der Kontrollkulturen muss binnen der 72-stündigen-Testdauer exponentiell um einen Faktor von mindestens 16 gewachsen sein. Dieses Wachstum entspricht einer spezifischen Wachstumsrate von 0,92 d- 1. Bei den am häufigsten verwendeten Arten ist die Wachstumsrate im Allgemeinen erheblich größer (siehe Anlage 2). Dieses Kriterium wird unter Umständen nicht erfüllt, wenn Arten verwendet werden, die langsamer wachsen als die in Anlage 2 genannten Arten. In diesem Fall sollte die Testdauer so verlängert werden, dass ein mindestens 16faches Wachstum der Kontrollkulturen gewährleistet ist; dabei muss das Wachstum während der gesamten Testdauer exponentiell erfolgen. Die Testdauer kann bis auf eine Mindestdauer von 48 Stunden verkürzt werden, um während des Tests ein unbegrenztes exponentielles Wachstum aufrechtzuerhalten; Voraussetzung ist jedoch, dass ein Mindestmultiplikationsfaktor von 16 erreicht wird.
- Der mittlere Variationskoeffizient der sektionalen spezifischen Wachstumsraten (Tage 0-1, 1-2 und 2-3 bei 72-stündigen Tests) der Kontrollkulturen (siehe Anlage 1 unter 'Variationskoeffizient') darf maximal 35 % betragen. Zur Berechnung der sektionalen spezifischen Wachstumsrate sind die Hinweise unter Nummer 49 zu beachten. Dieses Kriterium gilt für den Mittelwert des Variationskoeffizienten, der für Replikatkontrollkulturen berechnet wurde.
- Der Variationskoeffizient der durchschnittlichen spezifischen Wachstumsraten während der gesamten Testdauer darf bei den Replikatkontrollkulturen in Tests mit Pseudokirchneriella subcapitata und Desmodesmus subspicatus höchstens 7 % betragen. Bei weniger häufig in Tests verwendeten Arten sollte der Wert höchstens 10 % betragen.
12. Um das Prüfverfahren zu testen, können Referenzchemikalien wie z.B. das im internationalen Ringtest (1) verwendete 3,5-Dichlorphenol geprüft werden. Für Grünalgen kann auch Kaliumdichromat als Referenzchemikalie verwendet werden. Nach Möglichkeit sollten Referenzchemikalien mindestens zweimal jährlich getestet werden.
13. Diese Prüfmethode ist am einfachsten bei wasserlöslichen Chemikalien anzuwenden, die unter den Prüfbedingungen voraussichtlich im Wasser gelöst bleiben. Zum Prüfen von flüchtigen, stark adsorbierenden, farbigen und schlecht in Wasser löslichen Chemikalien sowie von Chemikalien, die sich auf die Verfügbarkeit von Nährstoffen oder Mineralien im Prüfmedium auswirken können, sind am beschriebenen Verfahren unter Umständen gewisse Änderungen vorzunehmen (z.B. die Herstellung eines geschlossenen Systems oder eine besondere Vorbereitung der Prüfgefäße). Hinweise zu verschiedenen Änderungen sind den Quellen (2), (3) und (4) zu entnehmen.
Apparatur
14. Prüfgefäße und sonstige Apparaturen, die mit den Testlösungen in Berührung kommen, müssen vollständig aus Glas oder einem anderen chemisch inerten Material bestehen. Die Komponenten sollten gründlich gespült werden, um sicherzustellen, dass keine organischen oder anorganischen Verunreinigungen das Algenwachstum oder die Zusammensetzung der Testlösungen beeinträchtigen können.
15. Als Prüfgefäße kommen im Allgemeinen Glaskolben mit Abmessungen in Betracht, die während des Tests ein hinreichendes Kulturvolumen und einen hinreichenden CO2-Transfer aus der Umgebungsluft gewährleisten (siehe Nummer 30). Das Flüssigkeitsvolumen muss für analytische Bestimmungen hinreichend sein (siehe Nummer 37).
16. Außerdem werden unter Umständen die folgenden Geräte benötigt.
- Kulturapparatur: Empfohlen werden ein Schrank oder eine Kammer, in dem bzw. in der die gewählte Inkubationstemperatur mit einer Toleranz von ± 2 °C aufrechterhalten werden kann.
- Lichtmessgeräte: Bei den Tests ist die Methode zur Messung der Lichtintensität zu protokollieren; insbesondere ist der für den Messwert maßgebliche Messkopftyp (Sensor) anzugeben. Die Messungen sollten vorzugsweise mit einem kugelförmigen (4-π)-Messkopf (der unmittelbar reagiert und Licht aus allen Winkeln Ìber und unter der Messebene reflektiert) oder mit einem (2-π)-Messkopf gemessen werden (der auf Licht aus beliebigen Winkeln oberhalb der Geräteebene reagiert).
- Apparatur zur Bestimmung der Biomasse der Algen: Die Zellzahlen als am häufigsten verwendeter Surrogatparameter für die Biomasse von Algen kann mit einem elektronischen Teilchenzähler, mit einem Mikroskop mit Zählkammer und mit einem Durchflusszytometer ermittelt werden. Weitere Surrogate für Biomassen können mit einem Durchflusszytometer, einem Fluorimeter, einem Spektrophotometer oder einem Farbmessgerät gemessen werden. Ein Umrechnungsfaktor, mit dem die Zellzahlen zur Trockenmasse in Beziehung gesetzt wird, kann Berechnungen erleichtern. Um mit einem Spektrophotometer verwertbare Messungen bei geringen Biomassekonzentrationen durchführen zu können, müssen unter Umständen Küvetten mit einem Strahlengang von mindestens 4 cm verwendet werden.
Testorganismen
17. Für die Tests können mehrere Arten frei treibender Mikroalgen und Cyanobakterien verwendet werden. Die in Anlage 2 genannten Stämme haben sich für das in dieser Prüfmethode beschriebene Verfahren als geeignet erwiesen.
18. Wenn andere Arten verwendet werden, sollten der betreffende Stamm und/oder die Herkunft angegeben werden. Außerdem ist sicherzustellen, dass das exponentielle Wachstum der ausgewählten Testalgen während der gesamten Testdauer unter den jeweiligen Bedingungen aufrechterhalten werden kann.
Nährmedium
19. Als Nährmedien werden wahlweise das OECD-Medium oder das AAP-Medium empfohlen. Die Zusammensetzungen dieser Medien sind Anlage 3 zu entnehmen. Beide Medien haben unterschiedliche pH-Ausgangswerte und unterschiedliche Pufferkapazitäten (zur Regulierung des pH-Anstiegs). Daher können die Testergebnisse je nach verwendetem Medium unterschiedlich ausfallen; dies gilt insbesondere für die Prüfung ionisierender Chemikalien.
20. Für bestimmte Zwecke muss unter Umständen das Nährmedium modifiziert werden (z.B. für die Prüfung von Metallen und Chelatbildnern oder für Prüfungen bei unterschiedlichen pH-Werten). Die Verwendung modifizierter Nährmedien ist im Einzelnen zu erläutern und zu begründen (3)(4).
Biomasse-Ausgangskonzentration
21. Die Ausgangsbiomasse der Prüfkulturen muss bei allen Prüfkulturen identisch und so gering sein, dass während der Inkubationsdauer ein exponentielles Wachstum erzielt werden kann, ohne eine Erschöpfung des Nährmediums befürchten zu müssen. Die Ausgangsbiomasse sollte höchstens 0,5 mg/l Trockenmasse betragen. Folgende Ausgangs-Zellkonzentrationen werden empfohlen:
| Pseudokirchneriella subcapitata: | 5 × 103 - 104 Zellen/ml |
| Desmodesmus subspicatus | 2-5 × 103 Zellen/ml |
| Navicula pelliculosa | 104 Zellen/ml |
| Anabaena flosaquae | 104 Zellen/ml |
| Synechococcus leopoliensis | 5 × 104 - 105 Zellen/ml |
Konzentrationen der Prüfchemikalie
22. Der Konzentrationsbereich, in dem Effekte zu erwarten sind, sollte durch einen Vortest (Range-Finding Test) ermittelt werden. Für den definitiven Test sind mindestens fünf Konzentrationen in einer geometrischen Reihe mit einem Faktor von höchstens 3,2 auszuwählen. Bei Prüfchemikalien mit einer flacheren Konzentrations- Wirkungskurve kann ein höherer Faktor gerechtfertigt sein. Die Konzentrationsreihen sollten vorzugsweise einen Bereich abdecken, in dem das Algenwachstum um 5-75 % gehemmt wird.
Replikate und Kontrollen
23. Das Prüfprotokoll muss für jede Testkonzentration drei Replikate vorsehen. Wenn die NOEC nicht bestimmt werden muss, kann das Prüfprotokoll dahingehend geändert werden, dass die Anzahl der Konzentrationen erhöht und die Anzahl der Replikate verringert wird. Es müssen mindestens drei Kontrollreplikate verwendet werden, im Idealfall die doppelte Anzahl der Replikate für jede Testkonzentration.
24. Für analytische Bestimmungen der Prüfchemikalienkonzentrationen kann eine eigene Reihe von Testlösungen hergestellt werden (siehe Nummern 36 und 38).
25. Wenn zur Auflösung der Prüfchemikalie ein Lösungsmittel verwendet wird, sind weitere Kontrollen mit dem Lösungsmittel in der Konzentration zu testen, die auch in den Prüfkulturen verwendet wird.
Herstellung der Impfkultur
26. Um eine Anpassung der Testalgen an die Testbedingungen zu ermöglichen und um sicherzustellen, dass sich die Algen in der Phase des exponentiellen Wachstums befinden, wenn sie zur Impfung der Testlösungen verwendet werden, wird 2-4 Tage vor Testbeginn im Prüfmedium eine Impfkultur hergestellt. Die Algenbiomasse ist so anzupassen, dass die Impfkultur bis zum Testbeginn exponentiell wachsen kann. Die Impfkultur ist unter den gleichen Bedingungen wie die Prüfkulturen zu inkubieren. Die Zunahme der Biomasse der Impfkultur ist zu messen, um sicherzustellen, dass das Wachstum unter den gegebenen Kulturbedingungen für den jeweiligen Teststamm im normalen Bereich liegt. In Anlage 4 wird ein Beispiel für ein Verfahren zur Herstellung einer Algenkultur beschrieben. Um gleichzeitige Zellteilungen während des Tests zu vermeiden, kann unter Umständen ein zweiter Schritt zur Vermehrung der Impfkultur erforderlich sein.
Herstellung der Testlösungen
27. Alle Testlösungen müssen das Nährmedium und die Ausgangsbiomasse der Testalgen in denselben Konzentrationen enthalten. Die Testlösungen in den ausgewählten Konzentrationen werden gewöhnlich durch Mischen einer Stammlösung der Prüfchemikalie mit dem Nährmedium und der Impfkultur hergestellt. Stammlösungen werden im Allgemeinen durch Auflösung der betreffenden Chemikalie im Prüfmedium hergestellt.
28. Wenn Chemikalien mit geringer Wasserlöslichkeit zum Prüfmedium hinzugegeben werden sollen, können Lösungsmittel (z.B. Aceton, t-Butyl-Alkohol und Dimethylformamid) als Träger verwendet werden (2)(3). Die Lösungsmittelkonzentration sollte höchstens 100 µl/l betragen, und für alle Kulturen der Testreihen (einschließlich der Kontrollkulturen) ist die gleiche Konzentration zu verwenden.
Inkubation
29. Die Prüfgefäße sind mit luftdurchlässigen Stopfen zu versehen. Anschließend werden die Gefäße geschüttelt und in die Kulturapparatur gebracht. Während des Tests müssen die Algen suspendiert bleiben, und der CO2- Transfer muss unterstützt werden. Dazu sollten die Gefäße ständig geschüttelt oder umgerührt werden. Die Temperatur der Kulturen wird bei einer Toleranz von ± 2 °C ständig auf 21 bis 24 °C geregelt. Bei anderen als den in Anlage 2 genannten Arten (z.B. bei tropischen Arten) sind unter Umständen höhere Temperaturen angemessen, die Validitätskriterien müssen jedoch erfüllt sein. Es wird empfohlen, die Gefäße zufällig verteilt und täglich neu in den Inkubator einzusetzen.
30. Der pH-Wert des Kontrollmediums darf während des Tests höchstens um 1,5 Einheiten steigen. Bei Metallen und Chemikalien, die bei pH-Werten etwa im Bereich der im Test verwendeten pH-Werte teilweise ionisieren, muss die pH-Verschiebung möglicherweise begrenzt werden, um reproduzierbare und gut definierte Ergebnisse zu erhalten. Es ist technisch möglich, die Verschiebung auf < 0,5 pH-Einheiten zu begrenzen, indem ein angemessener CO2-Transfer aus der Umgebungsluft in die Testlösung sichergestellt wird (z.B. durch stärkeres Schütteln). Eine weitere Möglichkeit besteht in der Verringerung des CO2-Bedarfs durch Verringerung der Ausgangsbiomasse oder in einer Verkürzung der Testdauer.
31. Die Oberfläche, auf der die Kulturen inkubiert werden, sollte kontinuierlich und gleichförmig fluoreszierend beleuchtet werden (z.B. mit den Lichtfarben kaltweiß (,coolwhite") oder mit Tageslicht (,daylight"). Algen- und Cyanobakterienstämme stellen unterschiedliche Anforderungen an die Lichtverhältnisse. Die Lichtintensität sollte entsprechend den verwendeten Testorganismen gewählt werden. Bei den empfohlenen Grünalgenarten ist für die Testlösungen eine Lichtintensität von 60-120 µE m- 2 s- 1 zu wählen (bei Messung im photosynthetisch wirksamen Spektralbereich von 400-700 nm mit einem geeigneten Rezeptor). Einige Arten, insbesondere Anabaena flosaquae, wachsen bei geringeren Lichtintensitäten und können durch größere Lichtintensitäten beschädigt werden. Bei diesen Arten sollte die durchschnittliche Lichtintensität im Bereich 40-60 µE·m- 2·s- 1 liegen. (Bei in Lux kalibrierten Lichtmessgeräten entspricht der Bereich 4.440-8.880 lx für die Lichtfarbe ,cool- white" etwa der empfohlenen Lichtintensität von 60-120 µE m- 2·s- 1. Die Lichtintensität darf um höchstens ± 15 % von der durchschnittlichen Lichtintensität über dem Inkubationsbereich abweichen.
Testdauer
32. Im Allgemeinen dauert der Test 72 Stunden. Allerdings sind auch kürzere oder längere Testzeiten möglich, sofern alle unter Nummer 11 genannten Validitätskriterien eingehalten werden.
Messungen und analytische Bestimmungen
33. Die Algenbiomasse in den einzelnen Kolben wird während der Testdauer mindestens einmal täglich überprüft. Wenn die Messungen an kleinen Volumina vorgenommen werden, die aus der Testlösung pipettiert wurden, sollten die betreffenden Volumina nicht ersetzt werden.
34. Die Biomasse wird durch manuelle Zählung der Zellen unter dem Mikroskop oder mit einem elektronischen Teilchenzähler (bei Zellzahlen und/oder Biovolumen) ermittelt. Alternative Verfahren wie z.B. die Messung mit einem Durchflusszytometer, in vitro und/oder in vivo durchgeführte Chlorophyll-Fluoreszenzmessungen (5)(6) oder Messungen der optischen Dichte kommen in Betracht, wenn in dem für den jeweiligen Test maßgeblichen Biomassebereich eine befriedigende Korrelation mit der Biomasse nachgewiesen werden kann.
35. Der pH-Wert der Lösungen wird am Anfang und am Ende des Tests bestimmt.
36. Wenn ein Analyseverfahren zur Bestimmung der Testsubstanz im maßgeblichen Konzentrationsbereich durchführbar ist, sind die Testlösungen zu analysieren, um die Ausgangskonzentrationen und die Aufrechterhaltung der Expositionskonzentrationen während der Tests zu prüfen bzw. sicherzustellen.
37. Die Analyse der Prüfchemikalienkonzentration am Anfang und am Ende des Tests bei einer niedrigen und einer hohen Testkonzentration sowie bei einer Konzentration im zu erwartenden EC50-Bereich kann hinreichend sein, wenn anzunehmen ist, dass die Expositionskonzentrationen während des Tests um weniger als 20 % von den Nominalwerten abweichen. Wenn die Konzentrationen eher nicht im Bereich von 80-120 % der nominellen Konzentrationen bleiben werden, wird die Analyse sämtlicher Testkonzentrationen am Anfang und am Ende der Tests empfohlen. Bei flüchtigen, instabilen oder stark adsorbierenden Prüfchemikalien werden während der Expositionsdauer weitere Probenahmen zur Durchführung von Analysen in Abständen von jeweils 24 Stunden empfohlen, um den Verlust der Prüfchemikalie besser bestimmen zu können. Bei diesen Chemikalien werden zusätzliche Replikate benötigt. In jedem Fall müssen die Prüfchemikalienkonzentrationen für alle Testkonzentrationen bei den Replikaten jeweils nur für ein Gefäß (bzw. für den Inhalt der gepoolten Gefäße der jeweiligen Replikate) bestimmt werden.
38. Eigens für die Analyse von Expositionskonzentrationen während der Testdauer hergestellte Prüfmedien werden auf die gleiche Weise behandelt wie die für die Tests verwendeten Medien, d. h. die Medien müssen mit Algen geimpft und unter identischen Bedingungen inkubiert werden. Wenn eine Analyse der gelösten Prüfchemikalie erforderlich ist, müssen die Algen unter Umständen vom Medium getrennt werden. Die Trennung sollte vorzugsweise durch Zentrifugierung mit einer so geringen Beschleunigung erfolgen, die gerade ausreicht, damit die Algen sich absetzen.
39. Wenn nachgewiesen wird, dass die Konzentration der Prüfchemikalie während der gesamten Testdauer zufriedenstellend im Bereich von ± 20 % der Nominalkonzentration oder der gemessenen Ausgangskonzentration aufrechterhalten werden konnte, können die Ergebnisse auch ausgehend von den Nominalwerten bzw. von den gemessenen Ausgangswerten analysiert werden. Wenn die Abweichung von der Nominalkonzentration oder von der gemessenen Ausgangskonzentration mehr als ± 20 % beträgt, sollte bei der Analyse der Ergebnisse von der geometrischen mittleren Konzentration während der Expositionsdauer oder von Modellen ausgegangen werden, welche den Rückgang der Prüfchemikalienkonzentration beschreiben (3)(7).
40. Der Test zur Hemmung des Algenwachstums ist ein dynamischeres Prüfsystem als die meisten sonstigen aquatischen Toxizitätstests mit kürzerer Testdauer. Entsprechend sind die tatsächlichen Expositionskonzentrationen unter Umständen schwer zu bestimmen; dies gilt besonders für adsorbierende Chemikalien, die bei niedrigen Konzentrationen getestet werden. In diesen Fällen bedeutet das Verschwinden der Prüfchemikalie aus der Lösung infolge der Adsorption an die zunehmende Algenbiomasse nicht, dass das Prüfsystem die Chemikalie ,verliert". Bei der Analyse des Testergebnisses ist zu prüfen, ob ein Rückgang der Prüfchemikalienkonzentration im Laufe des Tests mit einer Abnahme der Wachstumshemmung einhergeht. Wenn dies der Fall ist, kann der Einsatz eines geeigneten Modells zur Beschreibung des Rückgangs der Prüfchemikalienkonzentration (7) in Betracht gezogen werden. Ansonsten empfiehlt es sich unter Umständen, bei der Analyse der Ergebnisse von den Ausgangskonzentrationen (Nominalkonzentrationen oder gemessenen Konzentrationen) auszugehen.
Sonstige Beobachtungen
41. Durch Beobachtung unter dem Mikroskop wird sichergestellt, dass die Impfkultur normal und gesund wirkt; außerdem können unter dem Mikroskop am Ende des Tests gegebenenfalls Auffälligkeiten an den Algen festgestellt werden (die z.B. auf die Exposition gegenüber der Prüfchemikalie zurückzuführen sein könnten).
Limit-Test
42. Unter gewissen Umständen, z.B. wenn ein Vortest darauf hindeutet, dass die Prüfchemikalie bei Konzentrationen bis zu 100 mg/l bzw. bis zur Löslichkeitsgrenze im Prüfmedium (maßgeblich ist die jeweils niedrigere Konzentration) keine toxische Wirkung hat, kann ein Limit-Test durchgeführt werden, in dem die Reaktionen einer Kontrollgruppe und einer Behandlungsgruppe (100 mg/l bzw. eine der Löslichkeitsgrenze entsprechende Konzentration) verglichen werden. Es wird nachdrücklich empfohlen, diese Tests durch Analysen der Expositionskonzentration zu verifizieren. Alle oben beschriebenen Testbedingungen und Validitätskriterien gelten für Limit-Tests; allerdings sollten mindestens sechs Replikate pro Prüfkonzentration verwendet werden. Die Reaktionsvariablen in den Kontrollgruppen und den Behandlungsgruppen können mit einem statistischen Test zum Vergleich der Mittelwerte analysiert werden (z.B. mit einem Student-t-Test). Wenn keine Varianzenhomogenität vorliegt, wird ein angepasster t-Test durchgeführt.
Grafische Darstellung der Wachstumskurven
43. Die Biomasse in den Prüfgefäßen kann in Einheiten des für die Messung verwendeten Surrogatparameters ausgedrückt werden (z.B. als Zellzahl oder Fluoreszenz).
44. Die geschätzte Biomassekonzentration der Prüfkulturen und der Kontrollkulturen ist zusammen mit den mindestens zu jeder vollen Stunde zu erfassenden Konzentrationen der Prüfchemikalie und den Messzeitpunkten in Tabellen zusammenzustellen und für die Erstellung von Wachstumskurven zu verwenden. In diesem ersten Stadium können sowohl logarithmische Skalen als auch lineare Skalen angebracht sein; während der Testdauer sind jedoch logarithmische Skalen zu verwenden, die im Allgemeinen eine bessere Darstellung von Abweichungen der Wachstumsstrukturen ermöglichen. Exponentielles Wachstum ergibt auf einer logarithmischen Skala aufgetragen eine Gerade, und die Steigung der Geraden gibt die Wachstumsrate an.
45. Mithilfe der Kurven ist zu untersuchen, ob die Kontrollkulturen während der gesamten Testdauer mit der erwarteten Geschwindigkeit exponentiell wachsen. Alle Datenpunkte sowie der Verlauf der Kurven sind kritisch zu prüfen, und Ausgangsdaten und Verfahren sind auf mögliche Fehler zu kontrollieren. Insbesondere sind alle Datenpunkte zu prüfen, die aufgrund eines systematischen Fehlers abzuweichen scheinen. Wenn Verfahrensfehler zweifelsfrei festgestellt und/oder als sehr wahrscheinlich betrachtet werden können, wird der betreffende Datenpunkt als Ausreißer gekennzeichnet und nicht in die anschließende statistische Analyse einbezogen. (Eine Algenkonzentration von null in einem von zwei drei Replikatgefäßen kann darauf hindeuten, dass das Gefäß nicht ordnungsgemäß geimpft oder nicht angemessen gereinigt wurde.) Die Gründe für den Ausschluss eines als Ausreißer eingestuften Datenpunkts sind im Prüfbericht genau anzugeben. Als Begründungen werden ausschließlich (seltene) Verfahrensfehler, nicht aber einfach ungenaue Messungen anerkannt. Statistische Verfahren zur Bestimmung von Ausreißern sind bei dieser Art von Problemen von begrenztem Nutzen und können die Beurteilung durch Fachleute nicht ersetzen. Die Ausreißer sollten (als solche gekennzeichnet) vorzugsweise in den später in grafischen oder tabellarischen Darstellungen von Datenpunkten enthalten sein.
Reaktionsvariablen
46. Mit der Prüfung sollen die Auswirkungen der Prüfchemikalie auf das Algenwachstum bestimmt werden. Da in unterschiedlichen Rechtsordnungen unterschiedliche Präferenzen und rechtliche Anforderungen bestehen, werden in dieser Prüfmethode zwei Reaktionsvariablen beschrieben. Damit die Testergebnisse in allen Rechtsordnungen anerkannt werden können, sollten die Auswirkungen mit Hilfe der beiden im Folgenden beschriebenen Reaktionsvariablen a und b beurteilt werden:
- Durchschnittliche spezifische Wachstumsrate: Diese Reaktionsvariable wird ausgehend von der täglichen logarithmischen Zunahme der Biomasse während der Testdauer berechnet.
- Zellertrag: Diese Reaktionsvariable ergibt sich aus der Biomasse am Ende des Tests abzüglich der Biomasse zu Beginn des Tests.
47. Es wird darauf hingewiesen, dass die mit diesen beiden Reaktionsvariablen berechneten Toxizitätswerte nicht vergleichbar sind; der entsprechende Unterschied muss bei der Verwendung der Testergebnisse berücksichtigt werden. Die aufgrund der durchschnittlichen spezifischen Wachstumsrate (ErCx) berechneten Werte für ECx werden im Allgemeinen höher sein als die anhand des Zellertrags (EyCx) ermittelten Werte, wenn die für diese Testmethode vorgesehenen Bedingungen eingehalten werden; dies ist auf die unterschiedliche mathematische Grundlage der beiden Verfahren zurückzuführen. Die auftretenden Unterschiede sollten jedoch nicht als Anzeichen für eine unterschiedliche Empfindlichkeit der beiden Reaktionsvariablen betrachtet werden; beide Werte sind einfach mathematisch verschieden. Das Konzept der durchschnittlichen spezifischen Wachstumsrate beruht auf dem im Allgemeinen exponentiellen Verlauf des Algenwachstums bei nicht begrenzten Kulturen, bei denen die Toxizität aufgrund der Auswirkungen auf die Wachstumsrate ermittelt wird, ohne jedoch von der absoluten Höhe der jeweiligen Wachstumsrate der Kontrollprobe, von der Steigung der Konzentrations- Wirkungskurve oder von der Testdauer abhängig zu sein. Auf der Reaktionsvariable 'Zellertrag' beruhende Ergebnisse hingegen hängen von allen übrigen genannten Variablen ab. EyCx ist von der spezifischen Wachstumsrate der in den einzelnen Tests verwendeten Algenarten sowie von der maximalen spezifischen Wachstumsrate abhängig, die je nach Art sowie sogar zwischen den einzelnen Algenstämmen unterschiedlich sein kann. Diese Reaktionsvariable sollte nicht verwendet werden, um die Empfindlichkeit von Algenarten oder auch nur verschiedener Algenstämme gegenüber Giftstoffen zu vergleichen. Die Verwendung der durchschnittlichen spezifischen Wachstumsrate zur Ermittlung der Toxizität wird in der Wissenschaft bevorzugt; bei dieser Prüfmethode werden jedoch auch Toxizitätsschätzungen aufgrund des Zellertrags berücksichtigt, um den derzeitigen Regulierungsanforderungen in einigen Ländern Rechnung zu tragen.
Durchschnittliche Wachstumsrate
48. Die durchschnittliche spezifische Wachstumsrate in einem bestimmten Zeitraum wird mit Hilfe der folgenden Formel als logarithmische Zunahme der Biomasse für die Gefäße mit den verschiedenen Kontrollproben und mit den behandelten Proben berechnet [1]:
| [1], |
Dabei sind:
µi-j: durchschnittliche spezifische Wachstumsrate zwischen Zeitpunkt i und Zeitpunkt j;
Xi: Biomasse zum Zeitpunkt i
Xj: Biomasse zum Zeitpunkt j
Für jede Behandlungsgruppe und für jede Kontrollgruppe sind die mittlere Wachstumsrate sowie die Konfidenzintervalle zu berechnen.
49. Die durchschnittliche spezifische Wachstumsrate wird über die gesamte Testdauer (im Allgemeinen Tage 0-3) berechnet; dabei ist eher von der geimpften Nominalbiomasse als von einem gemessenen Ausgangswert auszugehen, da auf diese Weise gewöhnlich eine höhere Genauigkeit erzielt wird. Wenn die zur Messung der Biomasse verwendete Ausrüstung eine hinreichend genaue Bestimmung der Biomasse mit der geringen Masse des Inokulums zulässt (z.B. ein Durchflusszytometer), kann die gemessene Konzentration der Ausgangsbiomasse angenommen werden. Außerdem ist während der gesamten Testdauer (Tage 0-1, 1-2 und 2-3) die sektionale Wachstumsrate als tägliche spezifische Wachstumsrate zu ermitteln und zu prüfen, ob das Wachstum der Kontrollgruppe konstant bleibt (siehe Gültigkeitskriterien, Nummer 11). Eine spezifische Wachstumsrate, die an einem bestimmten Tag signifikant niedriger ist als die durchschnittliche spezifische Gesamtwachstumsrate, kann Anzeichen für eine 'Lag'-Phase sein. Bei den Kontrollkulturen kann eine 'Lag'-Phase minimiert und praktisch ausgeschlossen werden, wenn die Vorkultur in geeigneter Weise vermehrt wird; bei den behandelten Kulturen hingegen kann eine 'Lag'-Phase Anzeichen für eine Erholung nach anfänglicher toxischer Belastung oder Anzeichen für eine geringere Belastung infolge eines Verlustes der Prüfchemikalie (u. a. durch Sorption in die Algenbiomasse) nach der anfänglichen Behandlung sein. Entsprechend kann die sektionale Wachstumsrate bewertet werden, um die Auswirkungen der Prüfchemikalie während der Expositionsdauer zu beurteilen. Erhebliche Unterschiede zwischen der sektionalen Wachstumsrate und der durchschnittlichen Wachstumsrate deuten auf Abweichungen vom konstanten exponentiellen Wachstum hin und erfordern eine genaue Überprüfung der Wachstumskurve.
50. Die prozentuale Hemmung der Wachstumsrate jedes Behandlungsreplikats ist mit folgender Formel zu berechnen:
| [2], |
Dabei sind:
%Ir = Hemmung der durchschnittlichen spezifischen Wachstumsrate in Prozent;
µC = mittlere durchschnittliche spezifische Wachstumsrate (µ) der Kontrollgruppe;
µT = durchschnittliche spezifische Wachstumsrate des Behandlungsreplikats.
51. Wenn die Testlösungen mit Lösungsmitteln hergestellt werden, sollten zur Berechnung der prozentualen Hemmung eher die Kontrolllösungen mit dem Lösungsmittel als die Kontrolllösungen ohne das Lösungsmittel verwendet werden.
Zellertrag
52. Der Zellertrag wird für alle Gefäße mit Kontrolllösungen und mit behandelten Lösungen als Biomasse bei Ende des Tests abzüglich der Biomasse am Anfang des Tests berechnet. Für die Testkonzentrationen und für die Kontrolllösungen ist jeweils ein mittlerer Zellertrag zu berechnen; die Varianzen sind jeweils zu schätzen. Die prozentuale Hemmung des Zellertrags (%Iy) kann für jedes Behandlungsreplikat wie folgt berechnet werden:
|
| [3], |
Dabei sind:
% Iy = prozentuale Hemmung des Zellertrags
YC = mittlerer Zellertrag der Kontrollgruppe
YT = Zellertrag des Behandlungsreplikats.
Grafische Darstellung der Konzentrations-Wirkungskurve
53. Die prozentuale Hemmung ist bezogen auf den Logarithmus der Prüfchemikalienkonzentration grafisch darzustellen und sorgfältig zu überprüfen; dabei sind alle Datenpunkte zu verwerfen, die in der ersten Phase als Ausreißer identifiziert wurden. Die Datenpunkte sind nach visueller oder rechnergestützter Interpolation zu einer gleichmäßigen Kurve zu verbinden, um einen ersten Eindruck von der Beziehung zwischen den verschiedenen Konzentrationen und Wirkungen zu erhalten. Anschließend ist mit einer differenzierteren Methode (vorzugsweise mit einer rechnergestützten statistischen Methode) fortzufahren. Je nach der beabsichtigten Verwendung der Daten, der Qualität (Genauigkeit) und dem Umfang der Daten sowie nach der Verfügbarkeit von Werkzeugen zur Analyse der Daten kann (gelegentlich durchaus berechtigt) entschieden werden, die Datenanalyse in diesem Stadium zu beenden und einfach die wesentlichen Werte für EC50 und EC10 (und/oder EC20) aus der nach visueller Interpolation erstellten Kurve zu entnehmen (siehe auch folgender Abschnitt zu stimulierenden Auswirkungen). Die folgenden Gründe können dafür sprechen, von der Anwendung einer statistischen Methode abzusehen:
- Die Daten sind nicht geeignet, durch rechnergestützte Methoden zuverlässigere Ergebnisse zu liefern als durch die Beurteilung von Fachleuten. In diesen Fällen werden mit manchen Computer-Programmen unter Umständen keinerlei zuverlässige Ergebnisse erzielt (Replikate stimmen nicht überein usw.).
- Das Wachstum stimulierende Wirkungen können mit verfügbarer Software nicht angemessen verarbeitet werden (siehe folgender Abschnitt).
Statistische Verfahren
54. Ziel ist die Ermittlung einer quantitativen Konzentrations-Wirkungsbeziehung durch Regressionsanalyse. Im Anschluss an eine linearisierte Transformation der Reaktionsdaten (z.B. in Einheiten nach dem Probit-, Logit- oder Weibull-Modell) (8) kann eine gewichtete lineare Regression vorgenommen werden; nichtlineare Regressionsverfahren, mit denen die unvermeidlichen Unregelmäßigkeiten der Daten und Abweichungen von gleichförmigen Verteilungen besser verarbeitet werden können, werden jedoch bevorzugt. Gegen null bzw. gegen die vollständige Hemmung können diese Unregelmäßigkeiten durch die Transformation vergrößert werden und die Analyse beeinträchtigen (8). Es wird darauf hingewiesen, dass Standard-Analysemethoden mit Probit-, Logit- oder Weibull-Transformationen für quantale Daten (z.B. Mortalität oder Überlebensraten) vorgesehen sind und zur Anwendung in Verbindung mit Wachstums- oder Biomassedaten modifiziert werden müssen. Spezifische Verfahren zur Bestimmung von ECx-Werten aus kontinuierlichen Daten sind den Quellen (9), (10) und (11) zu entnehmen. In Anlage 5 wird der Einsatz nichtlinearer Regressionsanalysen näher erläutert.
55. Für jede zu analysierende Reaktionsvariable sind aufgrund der Konzentrations-Wirkungsbeziehung ECx-Werte zu ermitteln. Nach Möglichkeit sollten für alle ECx-Werte die 95- %-Konfidenzintervalle bestimmt werden. Die Qualität der Übereinstimmung der Reaktionsdaten mit dem Regressionsmodell wird grafisch oder statistisch bewertet. Die Regressionsanalyse muss mit den Reaktionen der einzelnen Replikate (und nicht mit den Mittelwerten der Behandlungsgruppe) durchgeführt werden. Wenn eine nichtlineare Kurvenanpassung jedoch schwierig oder wegen zu großer Streuung der Daten nicht möglich ist, kann die Regression auch bezogen auf die Mittelwerte der Gruppe vorgenommen werden, um so auf einfache Weise die Auswirkungen erwarteter Ausreißer zu reduzieren. Wenn von dieser Möglichkeit Gebrauch gemacht wird, sollte dies im Prüfbericht als Abweichung vom normalen Verfahren vermerkt und darauf hingewiesen werden, dass mit Kurvenanpassungen der einzelnen Replikate kein befriedigendes Ergebnis erzielt wurde.
56. Schätzwerte für EC50 und für die Konfidenzintervalle können auch durch lineare Interpolation mit einem Bootstrapping-Algorithmus (13) erzielt werden, wenn die verfügbaren Regressionsmodelle/-methoden für die betreffenden Daten nicht geeignet sind.
57. Um die LOEC und entsprechend die NOEC zu schätzen sowie um die Auswirkungen der Prüfchemikalie auf die Wachstumsrate zu ermitteln, müssen die Mittelwerte der behandelten Proben mit Verfahren zur Varianzanalyse (ANOVA) verglichen werden. Der Mittelwert der einzelnen Konzentrationen ist dann mit einer geeigneten Methode zur Durchführung von Mehrfachvergleichen bzw. zur Durchführung von Trendtests mit dem Mittelwert der Kontrollgruppe zu vergleichen. Dunnett- und Williams-Tests können hilfreich sein (12)(14)(15) (16)(17). Die ANOVA-Annahme der Varianzhomogenität muss einer Überprüfung unterzogen werden. Die entsprechende Bewertung kann anhand einer grafischen Darstellung oder aufgrund eines formalen Tests vorgenommen werden (17). Geeignet sind Levene- und Bartlett-Tests. Wenn die Annahme der Varianzhomogenität nicht erfüllt ist, kann gelegentlich eine Korrektur durch logarithmische Datentransformation erfolgen. Bei außerordentlicher Varianzheterogenität, die durch Transformation nicht korrigiert werden kann, sollten Analysemethoden wie z.B. Jonckheere-Trendtests (Stepdown) erwogen werden. Weitere Hinweise zur Bestimmung von NOEC-Werten sind Quelle (11) zu entnehmen.
58. Aufgrund neuer Forschungsergebnisse wird empfohlen, das Konzept der NOEC aufzugeben und durch Punktschätzungen von ECx-Werten zu ersetzen, die durch Regression ermittelt wurden. Für diesen Algentest wurde noch kein geeigneter Wert für x definiert. Ein Bereich von 10 bis 20 % scheint geeignet (je nach ausgewählter Reaktionsvariable); vorzugsweise sollten sowohl EC10 als auch EC20 protokolliert werden.
Wachstumsstimulation
59. Gelegentlich wird bei niedrigen Konzentrationen eine Wachstumsstimulation (negative Hemmung) beobachtet. Diese Wachstumsstimulation kann entweder auf eine Hormesis (,toxische Stimulation") oder darauf zurückzuführen sein, dass im verwendeten Minimalmedium mit dem zu prüfenden Material zusätzliche das Wachstum stimulierende Faktoren zum Tragen kommen. Die Zugabe anorganischer Nährstoffe sollte keine unmittelbaren Auswirkungen haben, weil das Prüfmedium während der gesamten Testdauer ohnehin überschüssige Nährstoffe enthalten sollte. Eine Stimulation mit niedriger Dosierung kann bei Berechnungen von EC50 gewöhnlich übergangen werden, wenn die Stimulation nicht ungewöhnlich stark ist. Bei ungewöhnlich starker Stimulation oder wenn ein ECx-Wert für einen niedrigen x-Wert berechnet werden soll, sind möglicherweise jedoch besondere Verfahrensweisen erforderlich. Die Löschung von Stimulationsreaktionen aus der Datenanalyse sollte nach Möglichkeit vermieden werden, und wenn die verfügbare Software zur Kurvenanpassung nicht in der Lage ist, geringere Stimulationen zu verarbeiten, kann eine lineare Interpolation mit einem Bootstrapping-Algorithmus vorgenommen werden. Bei ungewöhnlich starker Stimulation kann der Einsatz eines Hormesis-Modells erwogen werden (18).
Nicht toxische Wachstumshemmung
60. Licht absorbierende Prüfmaterialien können zu einer Verringerung der Wachstumsrate führen, weil die Abdunklung den Anteil des verfügbaren Lichts verringert. Diese physikalischen Auswirkungen sollten durch geeignete Modifikation der Testbedingungen von toxischen Auswirkungen unterschieden und getrennt protokolliert werden. Entsprechende Hinweise sind den Quellen (2) und (3) zu entnehmen.
61. Der Prüfbericht muss folgende Informationen enthalten:
Prüfchemikalie:
- physikalische Beschaffenheit und maßgebliche physikalisch-chemische Eigenschaften einschließlich der Wasserlöslichkeitsgrenze;
- chemische Kenndaten (z.B. CAS-Nummer) einschließlich der Reinheit (Verunreinigungen).
Im Test verwendete Art:
- Stamm, Lieferant oder Herkunft und Kulturbedingungen.
Prüfbedingungen:
- Datum des Testbeginns und Dauer des Tests;
- Beschreibung des Prüfprotokolls: Prüfgefäße, Kulturvolumina, Biomassedichte zu Beginn des Tests;
- Zusammensetzung des Mediums;
- Testkonzentrationen und Replikate (z.B. Anzahl der Replikate, Anzahl der Testkonzentrationen und verwendete geometrische Progression);
- Beschreibung der Herstellung der Testlösungen, einschließlich Verwendung von Lösungsmitteln usw.;
- Kulturapparatur;
- Lichtintensität und Qualität (Herkunft, Homogenität);
- Temperatur;
- getestete Konzentrationen: nominale Testkonzentrationen sowie alle Ergebnisse der Analysen zur Bestimmung der Konzentration der Prüfchemikalie in den Prüfgefäßen; außerdem sind die mit der Methode erzielte Wiederfindungsrate und die Quantifizierungsgrenze der Testmatrix anzugeben;
- sämtliche Abweichungen von dieser Prüfmethode;
- Methode zur Bestimmung der Biomasse und Anzeichen für eine Korrelation zwischen dem gemessenen Parameter und der Trockenmasse.
Ergebnisse:
- pH-Werte zu Beginn und am Ende des Tests bei allen behandelten Proben;
- Biomasse in jedem Gefäß an allen Messpunkten und Methode zur Messung der Biomasse;
- Wachstumskurven (grafische Darstellung der Entwicklung Biomasse über einem bestimmten Zeitraum;
- berechnete Reaktionsvariablen für alle Behandlungsreplikate mit Mittelwerten und dem Variationskoeffizienten für Replikate;
- grafische Darstellung der Beziehung zwischen Konzentration und Wirkung;
- Schätzungen der Toxizität für die Reaktionsvariablen (z.B. EC50, EC10, EC20) sowie entsprechende Konfidenzintervalle; wenn berechnet, sind die LOEC und die NOEC sowie die zur jeweiligen Berechnung angewendeten statistischen Methoden anzugeben;
- bei Durchführung von Varianzanalysen (ANOVA) der Umfang der nachzuweisenden Auswirkungen (z.B. geringster signifikanter Unterschied);
- jede in behandelten Proben festgestellte Wachstumsstimulation;
- alle sonstigen beobachteten Auswirkungen (z.B. morphologische Veränderungen der Algen);
- Diskussion der Ergebnisse einschließlich aller Auswirkungen auf das Testergebnis, die auf Abweichungen von dieser Prüfmethode zurückzuführen sind.
(1) ISO (1993). ISO 8692 Wasserbeschaffenheit - Süßwasseralgen-Wachstumshemmtest mit einzelligen Grünalgen.
(2) ISO (1998). ISO/DIS 14442. Wasserbeschaffenheit - Anleitung für Algenwachstumshemmtests in Gegenwart schwer löslicher Materialien, flüchtigen Verbindungen, Metallen und Abwasser.
(3) OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23. Organisation for Economic Cooperation and Development, Paris.
(4) ISO (1998). ISO 5667-16 Wasserbeschaffenheit - Probenahme - Teil 16: Anleitung zur Probenahme und Durchführung biologischer Testverfahren.
(5) Mayer, P., Cuhel, R., und Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525-2531.
(6) Slovacey, R.E., und Hanna, P.J. (1997). In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22: 919-925
(7) Simpson, S.L., Roland, M.G.E., Stauber, J.L., und Batley, G.E. (2003). Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem. 22: 2073-2079.
(8) Christensen, E.R., Nyholm, N. (1984). Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19: 713-718.
(9) Nyholm, N. Sørensen, P.S., Kusk, K.O., und Christensen, E.R. (1992). Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11: 157-167.
(10) Bruce, R.D., und Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem. 11: 1485-1494.
(11) OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Organisation for Economic Cooperation and Development, Paris.
(12) Dunnett, C.W. (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096-1121
(13) Norberg-King T.J. (1988). An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment center Technical Report 05-88. US EPA, Duluth, MN.
(14) Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482-491.
(15) Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103-117.
(16) Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 519- 531.
(17) Draper, N.R., und Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York.
(18) Brain, P., und Cousens, R. (1989). An equation to describe doseresponses where there is stimulation of growth at low doses. Weed Research, 29, 93-96.
| Begriffsbestimmungen | Anlage 1 |
Biomasse: Trockenmasse lebenden Materials einer Population bezogen auf ein gegebenes Volumen (z.B. mg Algen/ Liter Testlösung). Gewöhnlich bezeichnet der Begriff 'Biomasse' eine Masse; in Rahmen dieser Prüfung wird er allerdings zur Bezeichnung einer Masse pro Volumen verwendet. Typischerweise werden Surrogate für die betreffende Biomasse (z.B. Zellzahlen oder Fluoreszenz) gemessen; entsprechend bezieht sich der Begriff 'Biomasse' auch auf diese Surrogatparameter.
Chemikalie: ein Stoff oder eine Mischung.
Variationskoeffizient: ein dimensionsloses Maß für die Veränderlichkeit eines Parameters, definiert als Verhältnis der Standardabweichung zum Mittelwert. Der Variationskoeffizient kann auch als Prozentwert ausgedrückt werden. Der mittlere Variationskoeffizient der durchschnittlichen spezifischen Wachstumsrate bei Replikatkontrollkulturen wird wie folgt berechnet:
- Der Variationskoeffizient in Prozent (VK %) der durchschnittlichen spezifischen Wachstumsrate wird aus den täglichen bzw. abschnittsbezogenen Wachstumsraten der jeweiligen Replikate berechnet.
- Der Mittelwert aller gemäß dem ersten Gedankenstrich berechneten Werte ist zu berechnen, um den mittleren Variationskoeffizienten der täglichen/abschnittsbezogenen spezifischen Wachstumsrate in Replikatkontrollkulturen zu bestimmen.
ECx: Konzentration der im Prüfmedium aufgelösten Prüfchemikalie, bei der das Wachstum des Testorganismus binnen einer bestimmten Expositionsdauer (die ausdrücklich anzugeben ist, wenn die Expositionsdauer nicht mit der vollständigen oder gewöhnlichen Dauer der Prüfung übereinstimmt) um x % (z.B. 50 %) abnimmt. Um eindeutig anzugeben, ob ein EC-Wert aus der Wachstumsrate (growth rate) oder aus dem Zellertrag (yield) abgeleitet wurde, werden die Kurzbezeichnungen 'ErC' für die Wachstumsrate und 'EyC' für den Zellertrag verwendet.
Nährmedium: gesamtes synthetisches Kulturmedium, in dem die zu prüfenden Algen wachsen, wenn sie der Prüfchemikalie ausgesetzt werden. Die Prüfchemikalie wird im Allgemeinen im Prüfmedium aufgelöst.
Wachstumsrate (durchschnittliche spezifische Wachstumsrate): logarithmische Zunahme der Biomasse während der Expositionsdauer.
Niedrigste Konzentration mit beobachteter Wirkung (LOEC): niedrigste geprüfte Konzentration, bei der beobachtet wurde, dass die Chemikalie binnen einer bestimmten Expositionsdauer gegenüber der Kontrollprobe eine statistisch signifikante Wachstumsreduzierung bewirkt (bei p < 0,05). Sämtliche Testkonzentrationen über der LOEC müssen schädliche Folgen haben, die mindestens den bei der LOEC beobachteten schädlichen Folgen gleichwertig sind. Wenn diese beiden Bedingungen nicht erfüllt werden können, ist umfassend darzulegen, warum die LOEC (und entsprechend die NOEC) gewählt wurde.
Höchste geprüfte Konzentration ohne beobachtete Wirkung (NOEC): Testkonzentration unmittelbar unterhalb der LOEC.
Reaktionsvariable: Variable für die geschätzte Toxizität, abgeleitet aus beliebigen gemessenen Parametern zur Beschreibung der Biomasse durch verschiedene Berechnungsmethoden. Bei dieser Methode sind Wachstumsrate und Zellertrag Reaktionsvariablen, die aus der direkten Messung der Biomasse oder einer Messung eines der genannten Surrogate abgeleitet werden.
Spezifische Wachstumsrate: Reaktionsvariable, die sich aus dem Quotienten der Differenz der natürlichen Logarithmen eines beobachteten Parameters (bei dieser Prüfmethode die Biomasse) und dem betreffenden Zeitraum ergibt.
Prüfchemikalie: ein beliebiger Stoff oder eine Mischung, der bzw. die nach dieser Methode geprüft wird.
Zellertrag: Wert einer Messvariablen am Ende der Expositionsdauer abzüglich des Wertes der Messvariablen zu Beginn der Expositionsdauer als Maß für die Zunahme der Biomasse während der Prüfung.
| Stämme, die sich für den Test als geeignet erwiesen haben | Anlage 2 |
Grünalgen
Pseudokirchneriella subcapitata (früher auch als Selenastrum capricornutum bezeichnet), ATCC 22662, CCAP 278/4, 61.81 SAG
Desmodesmus subspicatus (früher auch als Scenedesmus subspicatus bezeichnet), 86.81 SAG
Kieselalgen
Navicula pelliculosa, UTEX 664
Cyanobakterien
Anabaena flosaquae, UTEX 1444, ATCC 29413, CCAP 1403/13A
Synechococcus leopoliensis, UTEX 625, CCAP 1405/1
Herkunft der Stämme
Die empfohlenen Stämme sind als artenreine Algenkulturen aus folgenden Sammlungen verfügbar (in alphabetischer Reihenfolge):
| ATCC: American Type Culture Collection 10801 University Boulevard Manassas, Virginia 20110-2209 USA |
| CCAP, Culture Collection of Algae and Protozoa Institute of Freshwater Ecology, Windermere Laboratory Far Sawrey, Amblerside Cumbria LA22 0LP VEREINIGTES KÖNIGREICH |
| SAG: Sammlung Algenkulturen Pflanzenphysiologisches Institut Universität Göttingen Nikolausberger Weg 18 37073 Göttingen DEUTSCHLAND |
| UTEX Culture Collection of Algae Section of Molecular, Cellular and Developmental Biology School of Biological Sciences the University of Texas at Austin Austin, Texas 78712 USA |
Aussehen und Merkmale der empfohlenen Arten
| P. subcapitata | D. subspicatus | N. pelliculosa | A. flosaquae | S. leopoliensis | |
| Aussehen | Gekrümmte und gedrehte einzelne Zellen | Oval, meist einzelne Zellen | Stäbchen | Ketten ovaler Zellen | Stäbchen |
| Größe (L × B) µm | 8-14 × 2-3 | 7-15 × 3-12 | 7,1 × 3,7 | 4,5 × 3 | 6 × 1 |
| Zellvolumen (µm3/Zelle) | 40-60 1 | 60-80 1 | 40-50 1 | 30-40 1 | 2,5 2 |
| Zelltrockenmasse (mg/Zelle) | 2-3 × 10- 8 | 3-4 × 10- 8 | 3-4 × 10- 8 | 1-2 × 10- 8 | 2-3 × 10- 9 |
| Wachstumsrate 3 (Tag- 1) | 1,5-1,7 | 1,2-1,5 | 1,4 | 1,1-1,4 | 2,0 - 2,4 |
| 1) Gemessen mit einem elektronischen Teilchenzähler.
2) Aus der Größe berechnet. 3) Am häufigsten beobachtete Wachstumsrate im OECD-Medium bei einer Lichtintensität von ca. 70 µE · m- 2 · s- 1 und einer Temperatur von 21 °C. | |||||
Spezifische Empfehlungen zur Kultivierung und zur Handhabung der für den Test empfohlenen Arten
Pseudokirchneriella subcapitata und Desmodesmus subspicatus
Diese Grünalgen sind in unterschiedlichen Kulturmedien im Allgemeinen leicht zu kultivieren. Informationen zu geeigneten Medien sind von den Einrichtungen zu beziehen, welche die Sammlungen unterhalten. Die Zellen liegen gewöhnlich als Einzelzellen vor; mit einem elektronischen Teilchenzähler oder unter einem Mikroskop kann die Zelldichte problemlos bestimmt werden.
Anabaena flosaquae
Für Stammkulturen können verschiedene Nährmedien verwendet werden. Insbesondere muss vermieden werden, dass die Batch-Kultur bei der Erneuerung das Stadium des exponentiellen Wachstums überschreitet; ansonsten wäre die Wiederfindung schwierig.
Anabaena flosaquae bildet Ansammlungen verschachtelter Zellketten. Die Größe dieser Ansammlungen kann je nach Kulturbedingungen unterschiedlich sein. Unter Umständen müssen diese Ansammlungen getrennt werden, wenn die Biomasse unter dem Mikroskop bzw. mit einem elektronischen Teilchenzähler bestimmt werden soll.
Zum Trennen der Ketten mit dem Ziel, Schwankungen der Zählergebnisse zu verringern, können Teilproben einer Ultraschallbehandlung unterzogen werden. Eine unnötig lange Ultraschallbehandlung zum Trennen der Ketten in kürzere Stücke kann die Zellen zerstören. Intensität und Dauer der Ultraschallbehandlung müssen bei allen Behandlungen identisch sein.
Mit dem Hämozytometer sind hinreichend Zellen zu zählen (mindestens 400), um auftretende Schwankungen korrigieren zu können und die Zuverlässigkeit der mikroskopischen Dichtebestimmungen zu erhöhen.
Zur Bestimmung des Gesamtvolumens der Anabaena-Zellen nach dem Trennen der Zellketten durch vorsichtige Ultraschallbehandlung kann ein elektronischer Teilchenzähler verwendet werden. Die Ultraschallenergie ist so anzupassen, dass die Zellen nicht beschädigt werden.
Mit einem Wirbelmischer oder durch ein ähnliches geeignetes Verfahren ist sicherzustellen, dass die zur Impfung der Prüfgefäße verwendete Algensuspension gut durchgemischt und homogen beschaffen ist.
Die Prüfgefäße werden auf einen Schütteltisch (mit kreisförmiger oder gerader Schüttelbewegung) gestellt, der mit etwa 150 Umdrehungen pro Minute bewegt wird. Alternativ kann bei Anabaena die Verklumpungstendenz auch durch intermittierendes Schütteln verringert werden. Wenn eine Verklumpung auftritt, ist darauf zu achten, dass repräsentative Proben für Messungen der Biomasse vorliegen. Unter Umständen müssen die Gefäße vor der Probenahme kräftig geschüttelt werden, um die Algenklumpen aufzulösen.
Synechococcus leopoliensis
Für Stammkulturen können verschiedene Nährmedien verwendet werden. Informationen zu geeigneten Medien sind von den Stellen zu beziehen, welche die Sammlungen unterhalten.
Synechococcus leopoliensis wächst in einzelnen stäbchenförmigen Zellen. Die Zellen sind sehr klein; dies erschwert Messungen der Biomasse durch Zählungen unter dem Mikroskop. Elektronische Teilchenzähler, die für die Zählung von Teilchen mit einer Größe von bis zu etwa 1 µm ausgelegt sind, kÆnnen hilfreich sein. Invitro-Fluoreszenzmessungen kommen ebenfalls in Betracht.
Navicula pelliculosa
Für Stammkulturen können verschiedene Nährmedien verwendet werden. Informationen zu geeigneten Medien sind von den Einrichtungen zu beziehen, welche die Sammlungen unterhalten. Das Medium muss Silicat enthalten.
Navicula pelliculosa kann unter bestimmten Wachstumsbedingungen Ansammlungen bilden. Wegen der Bildung von Lipiden neigen die Algenzellen gelegentlich zur Akkumulierung im Oberflächenfilm. In diesem Fall sind besondere Verfahrensweisen erforderlich, wenn repräsentative Unterproben zur Bestimmung der Biomasse genommen werden sollen. Unter Umständen ist ein kräftiges Schütteln z.B. mit einem Wirbelmischer erforderlich.
| Nährmedien | Anlage 3 |
Für die Tests kann eines der beiden folgenden Nährmedien verwendet werden:
- OECD-Medium: Originalmedium gemäß OECD TG 201 sowie gemäß ISO 8692;
- US. EPA-Medium AAP, auch gemäß ASTM.
Bei der Herstellung dieser Medien sind chemische Stoffe in Reagenzien- oder Analysequalität und entionisiertes Wasser zu verwenden.
Zusammensetzung des AAP-Mediums (US. EPA) und des Mediums gemäß OECD TG 201:
| Bestandteil | EPA | OECD | ||
| mg/l | mM | mg/l | mM | |
| NaHCO3 | 15,0 | 0,179 | 50,0 | 0,595 |
| NaNO3 | 25,5 | 0,300 | ||
| NH4Cl | 15,0 | 0,280 | ||
| MgCl2 · 6(H2O) | 12,16 | 0,0598 | 12,0 | 0,0590 |
| CaCl2 · 2(H2O) | 4,41 | 0,0300 | 18,0 | 0,122 |
| MgSO4 · 7(H2O) | 14,6 | 0,0592 | 15,0 | 0,0609 |
| K2HPO4 | 1,044 | 0,00599 | ||
| KH2PO4 | 1,60 | 0,00919 | ||
| FeCl3 · 6(H2O) | 0,160 | 0,000591 | 0,0640 | 0,000237 |
| Na2EDTA · 2(H2O) | 0,300 | 0,000806 | 0,100 | 0,000269* |
| H3BO3 | 0,186 | 0,00300 | 0,185 | 0,00299 |
| MnCl2 · 4(H2O) | 0,415 | 0,00201 | 0,415 | 0,00210 |
| ZnCl2 | 0,00327 | 0,000024 | 0,00300 | 0,0000220 |
| CoCl2 · 6(H2O) | 0,00143 | 0,000006 | 0,00150 | 0,00000630 |
| Na2MoO4 · 2(H2O) | 0,00726 | 0,000030 | 0,00700 | 0,0000289 |
| CuCl2 · 2(H2O) | 0,000012 | 0,00000007 | 0,00001 | 0,00000006 |
| pH-Wert | 7,5 | 8,1 | ||
Das Molverhältnis von EDTA zu Eisen ist geringfügig größer als eins. Daher kann das Eisen nicht ausfällen, und die Chelatbildung von Schwermetallionen wird minimiert.
Im Test mit der Kieselalge Navicula pelliculosa sind beide Medien mit Na2SiO3 · 9H20 aufzufüllen, bis eine Konzentration von 1,4 mg Si/l erreicht ist.
Der pH-Wert des Mediums wird ermittelt, wenn sich das Carbonatsystem des Mediums und der Partialdruck des CO2 in der Umgebungsluft im Gleichgewicht befinden. Die ungefähre Beziehung zwischen dem pH-Wert bei 25 °C und der molaren Bicarbonat-Konzentration lässt sich mit folgender Formel berechnen:
pHeq = 11,30 + log[HCO3]
Bei 15 mg NaHCO3/l, pHeq = 7,5 (U.S. EPA-Medium) und bei 50 mg NaHCO3/l, pHeq = 8,1 (OECD-Medium).
Elementzusammensetzung der Prüfmedien
| Element | EPA | OECD |
| mg/l | mg/l | |
| C | 2,144 | 7,148 |
| N | 4,202 | 3,927 |
| P | 0,186 | 0,285 |
| k | 0,469 | 0,459 |
| Na | 11,044 | 13,704 |
| Ca | 1,202 | 4,905 |
| Mg | 2,909 | 2,913 |
| Fe | 0,033 | 0,017 |
| Mn | 0,115 | 0,115 |
Herstellung des OECD-Mediums
| Nährstoff | Konzentration in der Stammlösung |
| Stammlösung 1: Makronährstoffe NH4Cl |
1,5 g/l |
| Stammlösung 2: Eisen FeCl3 · 6H2O |
64 mg/l |
| Stammlösung 3: Spurenelemente H3BO3 |
185 mg/l |
| Stammlösung 4: Bicarbonat NaHCO3 |
50 g/l |
Die Stammlösungen sind durch Membranfiltration (mittlerer Porendurchmesser 0,2 µm) oder durch Autoklavieren (120 °C, 15 min) zu sterilisieren. Anschließend werden die Lösungen bei einer Temperatur von 4 °C dunkel gelagert.
Die Stammlösungen 2 und 4 dürfen nicht autoklaviert werden, sondern sind durch Membranfiltration zu sterilisieren.
Zum Herstellen des Nährmediums wird eine geeignete Menge der Stammlösungen 1 bis 4 wie folgt zu Wasser hinzugegeben:
Zu 500 ml sterilisiertem Wasser werden folgende Mengen hinzugegeben:
10 ml Stammlösung 1
1 ml Stammlösung 2
1 ml Stammlösung 3
1 ml Stammlösung 4
Anschließend wird mit sterilisiertem Wasser auf 1.000 ml aufgefüllt.
Danach muss hinreichend Zeit zur Herstellung eines Gleichgewichts zwischen dem Medium und dem CO2-Gehalt der Umgebungsluft gelassen werden; wenn erforderlich, ist das Nährmedium einige Stunden mit steriler gefilterter Luft zu sprudeln.
Herstellung des AAP-Mediums
1. Von den Stammlösungen 2.1 bis 2.7 ist jeweils 1 ml zu etwa 900 ml entionisiertem oder destilliertem Wasser hinzuzugeben; anschließend wird auf 1 Liter aufgefüllt.
2. Stammlösungen mit Makronährstoffen werden hergestellt, indem die folgenden Stoffmengen jeweils zu 500 ml entionisiertem oder destilliertem Wasser hinzugegeben werden. Die Reagenzien 2.1, 2.2, 2.3 und 2.4 können zu einer einzigen Stammlösung kombiniert werden.
| 2.1 | NaNO3 | 12,750 g |
| 2.2 | MgCl2·6H2O | 6,082 g |
| 2.3 | CaCl2·2H2O | 2,205 g |
| 2.4 | Mikronährstoff-Stammlösung (siehe 3) | |
| 2.5 | MgSO4·7H2O | 7,350 g |
| 2.6 | K2HPO4 | 0,522 g |
| 2.7 | NaHCO3 | 7,500 g |
| 2.8 | Na2SiO3·9H2O | Siehe Hinweis 1 |
Hinweis 1: Ausschließlich für im Test eingesetzte Kieselalgen-Arten zu verwenden; kann unmittelbar (202,4 mg) hinzugegeben oder mittelbar durch Auffüllen mit einer Stammlösung bis zum Erreichen einer Endkonzentration von 20 mg Si/l im Medium hinzugegeben werden.
3. Die Mikronährstoff-Lösung wird hergestellt, indem folgende Mengen in 500 ml entionisiertem oder destilliertem Wasser aufgelöst werden:
| 3.1 | H3BO3 | 92,760 mg |
| 3.2 | MnCl2·4H2O | 207,690 mg |
| 3.3 | ZnCl2 | 1,635 mg |
| 3.4 | FeCl3·6H2O | 79,880 mg |
| 3.5 | CoCl2·6H2O | 0,714 mg |
| 3.6 | Na2MoO4·2H2O | 3,630 mg |
| 3.7 | CuCl2·2H2O | 0,006 mg |
| 3.8 | Na2EDTA·2H2O | 150,000 mg. [ Dinatrium(ethylendinitril)tetraacetat] |
| 3.9 | Na2SeO4·5H2O | 0,005 mg; siehe Hinweis 2. |
Hinweis 2: Darf ausschließlich im Medium für Stammkulturen mit Kieselalgen-Arten verwendet werden.
4. Der pH-Wert ist auf 7,5 ± 0,1 einzustellen (mit 0,1 N oder 1,0 N NaOH oder HCl).
5. Wenn ein Teilchenzähler verwendet werden soll, wird das Medium durch einen 0,22-µm-Membranfilter in ein steriles Gefäß gefiltert; ansonsten erfolgt die Filtration in ein steriles Gefäß durch ein 0,45-µm-Filter.
6. Das Medium ist bis zur Verwendung bei einer Temperatur von etwa 4 °C dunkel zu lagern.
| Beispiel eines Verfahrens zur Kultivierung der Algen | Anlage 4 |
Allgemeine Bemerkungen
Durch die Kultivierung nach dem folgenden Verfahren sollen Algenkulturen für Toxizitätstests hergestellt werden.
Um sicherzustellen, dass die Algenkulturen nicht mit Bakterien verunreinigt sind, sind geeignete Methoden anzuwenden. Wenngleich u. U. axenische Kulturen erwünscht sein mögen, sind Algenkulturen doch mit einer einzigen Alge herzustellen und zu verwenden.
Sämtliche Schritte sind unter sterilen Bedingungen auszuführen, um Verunreinigungen mit Bakterien und anderen Algen zu vermeiden.
Ausrüstung und Materialien
Siehe Prüfmethode: Apparatur.
Verfahren zur Herstellung von Algenkulturen
Herstellung von Nährlösungen (Medien)
Alle Nährsalze des Mediums werden als konzentrierte Stammlösungen hergestellt und dunkel und kühl gelagert. Die Lösungen werden durch Filtration oder Autoklavieren sterilisiert.
Das Medium wird durch Zugabe der jeweils erforderlichen Menge der Stammlösung zu sterilem destilliertem Wasser hergestellt; dabei ist darauf zu achten, dass keine Verunreinigungen entstehen können. Bei festen Medien ist 0,8 % Agar hinzuzugeben.
Stammkultur
Die Stammkulturen bestehen aus kleinen Algenkulturen, die regelmäßig in frische Medien übertragen werden und als Ausgangs-Prüfmaterial fungieren. Wenn die Kulturen nicht regelmäßig verwendet werden, sind die Kulturen auf Agarröhrchen (Slopes) abzustreichen. Diese werden anschließend mindestens einmal alle zwei Monate in frische Medien gebracht.
Die Stammkulturen werden in Erlenmeyerkolben mit dem jeweils geeigneten Medium kultiviert (Volumen etwa 100 ml). Wenn die Algen bei 20 °C unter ständiger Beleuchtung inkubiert werden, ist eine wöchentliche Überimpfung erforderlich.
Dabei ist von der ,alten" Kultur mit sterilen Pipetten so viel in einen Kolben mit frischem Medium zu geben, dass bei schnell wachsenden Arten die Ausgangskonzentration etwa 100-mal geringer ist als die Konzentration der alten Kultur.
Die Wachstumsrate einer Art kann anhand der Wachstumskurve bestimmt werden. Wenn diese bekannt ist, kann die Dichte geschätzt werden, bei der die Kultur in das neue Medium gegeben werden sollte. Die Dichteschätzung muss erfolgen, bevor die betreffende Kultur in die Absterbephase gelangt.
Vorkultur
Mit der Vorkultur sollen Algen zur Impfung der Prüfkulturen hergestellt werden. Die Vorkultur wird unter den Prüfbedingungen inkubiert und noch während der Phase des exponentiellen Wachstums verwendet (in der Regel nach einer Inkubationsdauer von 2 bis 4 Tagen). Algenkulturen mit deformierten oder anomalen Zellen sind zu verwerfen.
| Datenanalyse durch nichtlineare Regression | Anlage 5 |
Allgemeine Bemerkungen
In den Algentests und in sonstigen Tests zur Ermittlung des mikrobiologischen Wachstums - des Wachstums einer Biomasse - stellt die Reaktion naturgemäß eine kontinuierliche oder metrische Variable dar: eine Prozessrate, wenn von einer Wachstumsrate ausgegangen wird, und ein zeitbezogenes Integral, wenn die Biomasse zugrunde gelegt wird. Diese beide Variablen werden zu der mittleren Wirkung in Beziehung gesetzt, die bei nicht exponierten Replikatkontrollen beobachtet wird, die unter den gegebenen Bedingungen am stärksten reagieren, wobei Licht und Temperatur bei Algentests die wichtigsten Determinanten sind. Das System kann verteilt oder homogen sein, und die Biomasse kann als kontinuierlicher Parameter betrachtet werden; einzelne Zellen brauchen nicht berücksichtigt zu werden. Die Varianzverteilung des Reaktionstyps dieser Systeme hängt ausschließlich von den Versuchsbedingungen ab (die in der Regel durch logarithmischnormale oder normale Fehlerverteilungen gekennzeichnet sind). In dieser Hinsicht besteht ein Unterschied gegenüber typischen Reaktionen in Bioassays mit quantalen Daten, bei denen die Toleranz (typischerweise mit Binomialverteilung) der einzelnen Organismen häufig als maßgebliche Varianzkomponente betrachtet wird. Kontrollreaktionen liegen hier bei null oder im Bereich des Hintergrundwerts.
Im einfachsten Fall nimmt die normalisierte oder relative Reaktion r gleichmäßig von 1 (Hemmung null) bis 0 (vollständige Hemmung) ab. Alle Reaktionen sind mit einem Fehler verbunden, und scheinbare negative Hemmungen können rechnerisch ausschließlich das Ergebnis zufälliger Fehler sein.
Regressionsanalyse
Modelle
Durch eine Regressionsanalyse soll die Konzentrations-Wirkungskurve als mathematische Regressionsfunktion Y = f (C) bzw. häufiger als F (Z) beschrieben werden; dabei ist Z = log C. Umgekehrt ermöglicht C = f- 1 (Y) die Berechnung von ECx-Werten einschließlich EC50, EC10 und EC20 sowie der jeweiligen 95- %-Konfidenzintervalle. Verschiedene einfache mathematische Funktionen haben sich als geeignet zur Beschreibung von Konzentrations- Wirkungsbeziehungen in Tests zur Ermittlung der Hemmung des Algenwachstums erwiesen. Zu diesen Formeln zählen die logistische Gleichung, die nicht symmetrische Weibull-Verteilung und die logarithmische Normalverteilung als sigmoide Kurven, bei denen sich jeweils ein asymptotischer Verlauf gegen 0 bei C → 0 bzw. gegen 1 bei C → unendlich ergibt.
Der Einsatz kontinuierlicher Schwellenwert-Funktionsmodelle (z.B. des Kooijman-Modells der "Hemmung des Populationswachstums" - Kooijman u. a. 1996) wurde kürzlich als Alternative zu asymptotischen Modellen vorgeschlagen. Dieses Modell geht davon aus, dass bei Konzentrationen unter einem bestimmten Schwellenwert EC0+ keine Auswirkungen mehr gegeben sind; dieser Schwellenwert wird mit Hilfe einer einfachen kontinuierlichen Funktion mit undifferenziertem Ausgangspunkt durch Extrapolation der Konzentrations-Wirkungsbeziehung so geschätzt, dass die Konzentrationsachse geschnitten wird.
Die Analyse kann in einer einfachen Minimierung der Restquadratsummen (bei Annahme einer konstanten Varianz) oder der Summe der gewichteten Quadrate (bei Ausgleich einer Varianzheterogenität) bestehen.
Verfahren
Das Verfahren kann wie folgt beschrieben werden: Eine geeignete Funktionsgleichung Y = f (C) wird gewählt und durch nichtlineare Regression an die Daten angepasst. Vorzugsweise sind die Messungen der einzelnen Kolben und nicht die Mittelwerte der Replikate zu verwenden, um möglichst viele Informationen aus den Daten zu gewinnen. Bei einer hohen Varianz haben praktische Erfahrungen hingegen gezeigt, dass die Mittelwerte der Replikate eine sicherere mathematische Schätzung ermöglichen, die weniger von systematischen Fehlern bei den Daten als von den einzelnen ermittelten Datenpunkten abhängt.
Die angepasste Kurve und die gemessenen Daten werden grafisch dargestellt; anschließend ist zu prüfen, ob die Kurve in angemessener Weise angepasst wurde. Eine Analyse der Restwerte könnte für diesen Zweck besonders hilfreich sein. Wenn die gewählte Funktionsbeziehung zur Anpassung der Konzentrations-Wirkungskurve die Kurve nicht vollständig beschreibt oder einen wesentlichen Teil der Kurve wie z.B. die Reaktion bei niedrigen Konzentrationen nicht gut beschreibt, ist eine andere Kurvenanpassung zu wählen (z.B. eine nicht symmetrische Kurve wie etwa die Weibull-Funktion anstelle einer symmetrischen Kurve). Negative Hemmungen können z.B. in Verbindung mit der logarithmischen Normalverteilung problematisch sein und ebenfalls den Einsatz einer alternativen Regressionsfunktion erfordern. Es wird nicht empfohlen, diesen negativen Werten einen Wert von null oder einen kleinen positiven Wert zuzuweisen, weil ansonsten die Fehlerverteilung beeinträchtigt werden könnte. Angemessen sind unter Umständen getrennte Kurvenanpassungen für bestimmte Bereiche der Kurve (z.B. für den Bereich mit der niedrigen Hemmung, wenn EClow x-Werte geschätzt werden sollen). Aus der angepassten Formel sind (mit der Umkehrfunktion C = f- 1(Y)) charakteristische Schätzwerte für ECx zu ermitteln und mindestens für EC50 sowie für einen oder zwei Werte von EClow x zu protokollieren. Praktische Erfahrungen haben gezeigt, dass die Genauigkeit der Algentests im Allgemeinen eine angemessen exakte Schätzung der Konzentration bei einer Hemmung von etwa 10 % ermöglicht, wenn hinreichende Datenpunkte verfügbar sind (sofern nicht eine Unregelmäßigkeit in Form einer Stimulation auch bei niedrigen Konzentrationen gegeben ist). Die Genauigkeit einer EC20-Schätzung ist häufig beträchtlich größer als die Genauigkeit geschätzter EC10-Werte, weil die EC20-Werte gewöhnlich im annähernd linearen Bereich der zentralen Konzentrations-Wirkungskurve vorgenommen werden. Gelegentlich ist die Beurteilung von EC10-Werten wegen der Wachstumsstimulation problematisch. Werte für EC10 sind also im Allgemeinen mit hinreichender Genauigkeit zu erhalten; in jedem Fall empfiehlt sich jedoch, auch die EC20-Werte zu erfassen.
Gewichtungsfaktoren
Die Versuchsvarianz ist nicht grundsätzlich konstant und beinhaltet typischerweise eine proportionale Komponente; daher wird vorzugsweise regelmäßig auch eine gewichtete Regression vorgenommen. Die Gewichtungsfaktoren für diese Analysen werden im Allgemeinen als umgekehrt proportional zur Varianz angenommen:
Wi = 1/Var(ri)
Viele Regressionsprogramme beinhalten die Option zur Durchführung gewichteter Regressionsanalysen mit Gewichtungsfaktoren, die aus einer Tabelle ausgewählt werden können. Die Normalisierung der Gewichtungsfaktoren kann auf bequeme Weise erfolgen, indem die Gewichtungsfaktoren so mit n/Σ wi (n = Anzahl der Datenpunkte) multipliziert werden, dass sich die Summe 1 ergibt.
Normalisierung der Reaktionen
Die Normalisierung durch die mittlere Kontrollreaktion bringt einige grundsätzliche Probleme mit sich und bedingt eine eher komplizierte Varianzstruktur. Mit der Division der Reaktionen durch die mittlere Kontrollreaktion zur Ermittlung der prozentualen Hemmung wird ein weiterer Fehler eingeführt, der auf den in den Mittelwerten der Kontrollen enthaltenen Fehler zurückzuführen ist. Wenn dieser Fehler nicht vernachlässigbar gering ist, sind Gewichtungsfaktoren in Verbindung mit der Regression und mit den Konfidenzintervallen bezogen auf die Kovarianz der Kontrollen zu korrigieren (Draper und Smith, 1981). Eine hohe Genauigkeit der geschätzten Mittelwerte der Kontrollreaktionen ist wichtig, um die Gesamtvarianz der relativen Reaktion zu minimieren. Diese Varianz lässt sich wie folgt beschreiben:
(Dabei steht das tiefgestellte i für die Konzentration i und die tiefgestellte 0 für die Kontrollen.)

Der Fehler im Mittelwert der Kontrollen ist umgekehrt proportional zur Quadratwurzel der Anzahl der in den Durchschnitt einbezogenen Kontrollreplikate; gelegentlich ist die Einbeziehung historischer Daten gerechtfertigt, um den Fehler auf diese Weise erheblich zu reduzieren. Ein alternatives Verfahren besteht darin, die Daten nicht zu normalisieren und die absoluten Reaktionen einschließlich der Daten der Kontrollreaktionen nicht anzupassen, sondern den Kontroll-Reaktionswert als zusätzlichen Parameter einzuführen, der durch nichtlineare Regression anzupassen ist. In Verbindung mit einer normalen Regressionsgleichung mit zwei Parametern erfordert diese Methode die Anpassung von drei Parametern; daher sind mehr Datenpunkte erforderlich als bei der nichtlinearen Regression von Daten, die mit einer vordefinierten Kontrollreaktion normalisiert werden.
Umkehrung der Konfidenzintervalle
Die Berechnung nichtlinearer Konfidenzintervalle durch Schätzung mit der Umkehrfunktion gestaltet sich eher komplex und ist in den üblichen statistischen Computer-Programmen als reguläre Option nicht enthalten. Ungefähre Konfidenzintervalle können mit Standardprogrammen zur Berechnung nichtlinearer Regressionen durch Neu- Parametrisierung ermittelt werden (Bruce und Versteeg, 1992); dabei wird die mathematische Formel mit den angestrebten Punktschätzungen (z.B. EC10 und EC50) als zu schätzenden Parametern neu entwickelt. Vorausgesetzt wird, dass I = f (α, β, Konzentration); die Definitionsbeziehungen f (α, β, EC10) = 0,1 und f (α, β, EC50) = 0,5 werden verwendet, um f (α, β, Konzentration) durch eine äquivalente Funktion g (EC10, EC50, Konzentration) zu ersetzen.
Für eine direktere Berechnung (Andersen u. a. 1998) kann die ursprüngliche Formel verwendet und eine Taylor- Expansion um die Mittelwerte für ri und r0 angenommen werden.
In letzter Zeit werden zunehmend auch Methoden mit Bootstrapping-Algorithmen verwendet. Diese Methoden beruhen auf Schätzungen einer empirischen Varianzverteilung ausgehend von den gemessenen Daten und von häufigen Stichproben unter Einsatz eines Zufalls-Nummerngenerators.
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): Noeffect concentrations in algal growth inhibition tests. Water Research, 30, 1625-1632.
Draper, N.R., und Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York.
Bruce, R..D., und Versteeg" D.J. (1992). A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Environ. Toxicol. Chem.11, 1485-1494.
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A., und Nyholm, N. (1998). Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405-420." (4) Kapitel C.11 erhält folgende Fassung:
"C.11. Belebtschlamm, Prüfung der Atmungshemmung (Kohlenstoff- und Ammoniumoxidation)
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 209 (2010). Sie beschreibt ein Verfahren zur Bestimmung der Auswirkungen einer Chemikalie auf Mikroorganismen (im Wesentlichen Bakterien) in Belebtschlamm durch Messung der Respirationsrate (Kohlenstoff- und/oder Ammoniumoxidation) unter definierten Bedingungen und bei unterschiedlichen Konzentrationen der Prüfchemikalie. Die Prüfmethode beruht auf dem ETAD-Test (ETAD = Ecological and Toxicological Association of the Dyestuffs Manufacturing industry) (1)(2), auf der vorherigen OECD-Prüfrichtlinie 209 (3) und auf der geänderten ISO-Norm 8192 (4). Zweck dieser Methode ist die Schaffung eines schnellen Screening-Verfahrens, mit dem sich die Auswirkungen von Chemikalien auf die im Belebtschlamm der biologischen (aeroben) Stufe von Kläranlagen enthaltenen Mikroorganismen feststellen lassen. Die Testergebnisse können auch als Indikator für geeignete nicht inhibierende Konzentrationen von Prüfchemikalien dienen, welche in Tests zur biologischen Abbaubarkeit (siehe z.B. Kapitel C.4 A-F, C.9, C.10, C.12 und C.29 sowie OECD TG 302C) verwendet werden. In diesem Fall kann der Test als Screening-Test etwa wie ein Vorversuch oder ein Limit-Test (siehe Nummer 39) durchgeführt werden, bei dem nur die Gesamtrespiration berücksichtigt wird. Bei Prüfungen auf leichte biologische Abbaubarkeit (Kapitel C.4 A-F und Kapitel C.29), bei denen die Konzentration des Inokulums erheblich geringer ist als bei der vorliegenden Prüfmethode, sind diese Informationen allerdings mit Vorsicht zu bewerten. Wenn in diesem Respirationstest keine Hemmung festgestellt wird, bedeutet dies nicht zwangsläufig, dass auch bei der Prüfung auf leichte biologische Abbaubarkeit gemäß den Kapiteln C.4 A-F oder C.29 keine Hemmung gegeben wäre.
2. Insgesamt wird die Prüfung der Atmungshemmung seit ihrer erstmaligen Veröffentlichung offenbar erfolgreich durchgeführt; gelegentlich wurde allerdings auch von falschen Ergebnissen berichtet (siehe z.B. (2)(4)(5)). Kurven, die die Respiration in Abhängigkeit von der Konzentration aufzeigen, verlaufen manchmal biphasisch, Darstellungen der Dosis-Wirkungs-Beziehung wurden verzerrt, und EC50-Werte waren außergewöhnlich niedrig (5). In Untersuchungen wurde festgestellt, dass diese Ergebnisse dann ermittelt wurden, wenn der in der Prüfung verwendete Belebtschlamm stark nitrifiziert und wenn die Prüfchemikalie sich stärker auf die Ammoniumoxidation auswirkt als auf die allgemeine heterotrophe Oxidation. Bei diesen falschen Ergebnissen können zusätzliche Prüfungen mit einem spezifischen Nitrifikationshemmer durchgeführt werden. Durch die Messung der Sauerstoffverbrauchsraten mit und ohne diese Hemmstoffe (z.B. N-Allylthioharnstoff (ATU)) können die gesamte und die heterotrophe Sauerstoffverbrauchsrate und die Sauerstoffverbrauchsrate durch Nitrifikation berechnet werden (4)(7)(8). Bei beiden Prozessen kann also die Hemmung durch eine Prüfchemikalie ermittelt werden, und die EC50-Werte können sowohl für die Oxidation von organischem Kohlenstoff (heterotroph) als auch für die Ammoniumoxidation (Nitrifikation) wie gewohnt berechnet werden. In seltenen Fällen kann die hemmende Wirkung von N-Allylthioharnstoff durch die Komplexbildung mit Prüfchemikalien oder Mediumzusätzen, z.B. Cu++-Ionen (6), teilweise oder vollständig aufgehoben werden. Cu++-Ionen sind für Nitrosomonas von entscheidender Bedeutung; in höheren Konzentrationen sind sie allerdings giftig.
3. Die Nitrifikation bei der aeroben Behandlung von Abwässern als unumgänglicher Schritt bei der Abtrennung von Stickstoffverbindungen aus Abwässern durch Denitrifikation in gasförmige Produkte hat in europäischen Ländern besondere Bedeutung erlangt. Inzwischen hat die EU niedrigere Grenzwerte für die Stickstoffkonzentration in behandelten Abwässern festgesetzt, die in aufnehmende Gewässer eingeleitet werden 1.
4. Für die meisten Zwecke reicht es aus, nur die Auswirkungen auf die Mechanismen der Oxidation organischen Kohlenstoffs zu bewerten. Manchmal müssen jedoch die Auswirkungen auf die Nitrifikation allein oder auf die Nitrifikation und die Oxidation organischen Kohlenstoffs getrennt geprüft werden, um die Ergebnisse angemessen interpretieren und die Auswirkungen richtig verstehen zu können.
5. Die Respirationsraten von mit synthetischem Abwasser beschickten Belebtschlammproben werden nach einer Kontaktzeit von drei Stunden in einer geschlossenen Zelle mit einer Sauerstoffelektrode gemessen. Wenn ein realistisches Expositionsszenarium zugrunde gelegt wird, können auch längere Kontaktzeiten angemessen sein. Wenn die Prüfchemikalie rasch abgebaut wird (z.B. abiotisch durch Hydrolyse) oder flüchtig ist und sich keine angemessene Konzentration aufrechterhalten lässt, kann zusätzlich eine kürzere Expositionsdauer (beispielsweise 30 Minuten) gewählt werden. Die Empfindlichkeit der einzelnen Belebtschlammproben ist am Tag der Exposition anhand einer geeigneten Referenzchemikalie zu prüfen. Mit der Prüfung wird gewöhnlich der ECx-Wert (z.B. EC50) der Prüfchemikalie und/oder die höchste geprüfte Konzentration ohne beobachtete Wirkung (NOEC) ermittelt.
6. Die Hemmung der Sauerstoffaufnahme durch Mikroorganismen, die organischen Kohlenstoff oxidieren, kann getrennt von derjenigen durch Ammonium oxidierende Mikroorganismen bestimmt werden; dazu ist die Sauerstoffverbrauchsrate mit und ohne N-Allylthioharnstoff zu messen; N-Allylthioharnstoff ist ein spezifischer Hemmstoff, der der Oxidation von Ammonium zu Nitrit durch Nitritbakterien (Stufe 1) entgegenwirkt. In diesem Fall wird die prozentuale Hemmung der Sauerstoffverbrauchsrate durch einen Vergleich der Sauerstoffverbrauchsrate in Gegenwart der Prüfchemikalie mit der mittleren Sauerstoffverbrauchsrate der entsprechenden Kontrollen ohne Prüfchemikalie berechnet, beides jeweils mit und ohne den spezifischen Inhibitor N-Allylthioharnstoff.
7. Ein etwaiger Sauerstoffverbrauch aufgrund abiotischer Prozesse kann nachgewiesen werden, indem die jeweilige Verbrauchsrate in Mischungen aus Prüfchemikalie, synthetischem Abwassermedium und Wasser, aber ohne Belebtschlamm, ermittelt wird.
Informationen zur Prüfchemikalie
8. Die Kenndaten (vorzugsweise die CAS-Nummer), die Bezeichnung (IUPAC), die Reinheit, die Wasserlöslichkeit, der Dampfdruck, die Flüchtigkeit und das Adsorptionsverhalten der Prüfchemikalie müssen bekannt sein, damit die Ergebnisse richtig interpretiert werden können. Im Allgemeinen können flüchtige Chemikalien nur dann angemessen geprüft werden, wenn spezielle Vorkehrungen getroffen wurden (siehe Nummer 21).
9. Die Prüfmethode kann bei wasserlöslichen, schlecht löslichen und flüchtigen Chemikalien angewendet werden. Bei Chemikalien mit eingeschränkter Löslichkeit ist es jedoch unter Umständen nicht immer möglich, EC50-Werte zu ermitteln. Gültige Ergebnisse für flüchtige Chemikalien lassen sich manchmal nur dann erzielen, wenn die Prüfchemikalie am Ende der Expositionsdauer immer noch größtenteils (d. h. > 80 %) im Reaktionsgemisch enthalten ist. Bei Unsicherheiten hinsichtlich der Stabilität oder der Flüchtigkeit der Prüfchemikalie sollten zusätzliche Analysedaten vorgelegt werden, um die ECx-Konzentration genauer zu bestimmen.
10. Referenzchemikalien müssen regelmäßig geprüft werden, um die Zuverlässigkeit der Prüfmethode und der Prüfbedingungen sicherzustellen und um am Expositionstag die Empfindlichkeit der einzelnen Belebtschlammproben zu prüfen, die als Inokulum verwendet werden. Als Referenz-Hemmstoff wird 3,5- Dichlorphenol (3,5-DCP) empfohlen; diese Chemikalie ist ein bekannter Inhibitor der Respiration und wird in zahlreichen Inhibitions- und Toxizitätstests verwendet (4). In Verbindung mit der Hemmung der Gesamtrespiration kann als Referenzchemikalie auch Kupfer-(II)-sulfat-Pentahydrat verwendet werden (9). N-Methylanilin ist als spezifische Referenzchemikalie zur Nitritifikationshemmung geeignet (4).
Validitätskriterien und Reproduzierbarkeit
11. Die Sauerstoffverbrauchsrate der Blindkontrollen (ohne Prüfchemikalie und ohne Referenzchemikalien) muss pro Stunde mindestens 20 mg Sauerstoff pro Gramm Belebtschlamm (Trockenmasse der suspendierten Feststoffe) betragen. Bei geringerer Sauerstoffverbrauchsrate ist der Test mit gewaschenem Belebtschlamm oder mit Schlamm anderer Herkunft zu wiederholen. Der Variationskoeffizient der Sauerstoffverbrauchsrate der Kontrollreplikate darf am Ende des definitiven Tests höchstens bei 30 % liegen.
12. 2004 hat die ISO einen internationalen Ringtest mit Belebtschlamm aus häuslichen Abwässern organisiert (4); in diesem Test wurde für 3,5-DCP ein EC50-Wert im Bereich von 2 bis 25 mg/l für die Gesamtrespiration, von 5 bis 40 mg/l für die heterotrophe Respiration und von 0,1 bis 10 mg/l für die Nitrifikationsrespiration ermittelt. Wenn der EC50-Wert für 3,5-DCP nicht im erwarteten Bereich liegt, ist der Test mit Belebtschlamm anderer Herkunft zu wiederholen. Der EC50-Wert für Kupfer-(II)-sulfat-Pentahydrat muss für die Gesamtrespiration bei 53 bis 155 mg/l liegen (9).
Prüfgefäße und Apparatur
13. Für die Prüfung sind gewöhnliche Laborausrüstung sowie folgende Materialien zu verwenden:
- Prüfgefäße - z.B. 1.000-ml-Bechergläser für jeweils 500 ml Reaktionsgemisch (siehe Nummer 5 in Abb. 1);
- Zellen und Zubehör zur Messung der Konzentration des gelösten Sauerstoffs, eine geeignete Sauerstoffelektrode, eine geschlossene Zelle zur Aufnahme der Probe ohne Kopfraum (headspace) und ein Aufzeichnungsgerät (z.B. Nummern 7, 8, 9 in Abb. 1, Anlage 2). Alternativ kann eine BSB-Flasche mit geeigneter Übergangstülle zur Abdichtung der Sauerstoffelektrode zum Flaschenhals verwendet werden (siehe Abb. 2 in Anlage 3). Um zu vermeiden, dass beim Einsetzen der Sauerstoffelektrode Flüssigkeit austritt, sollte zunächst ein Trichter oder ein Glasröhrchen durch die Tülle geschoben werden; statt dessen können auch Gefäße mit gebördeltem Rand verwendet werden. In beiden Fällen sind ein Magnetrührer oder ein alternatives Rührverfahren zu verwenden (z.B. eine selbstrührende Sonde);
- Magnetrührer und Rührfisch mit einem Überzug aus inertem Material zur Verwendung in der Messkammer und/oder in den Prüfgefäßen;
- Belüftungseinrichtung: Erforderlichenfalls muss Druckluft durch einen geeigneten Filter geleitet werden, um Staub und Öl abzutrennen und durch Waschflaschen mit Wasser zur Luftbefeuchtung. Die Gefäße sind mit Pasteur-Pipetten oder sonstigen Belüftungseinrichtungen zu belüften, die keine Chemikalien adsorbieren. Mit einer Schüttelmaschine mit Rundschüttelbewegung mit einer Drehzahl zwischen 150 und 250 min- 1 und mit Flaschen mit einem Volumen von z.B. 2.000 ml kann der Sauerstoffbedarf des Schlamms gedeckt werden; außerdem können mit dieser Schüttelmaschine Probleme bei Chemikalien überwunden werden, die übermäßig schäumen, die flüchtig sind und daher verlorengehen können oder schwierig zu dispergieren sind, wenn die Belüftung durch Drucklufteinspeisung (Air Sparging) erfolgt. Das Prüfsystem umfasst gewöhnlich eine Reihe kontinuierlich belüfteter und nacheinander (z.B. in Intervallen von 10 bis 15 Minuten) angesetzter Bechergläser, die dann der Reihe nach analysiert werden. Wahlweise können auch validierte Geräte verwendet werden, die für eine gleichzeitige Belüftung und Messung der Sauerstoffverbrauchsrate der Mischungen ausgelegt sind;
- pH-Messgerät;
- Zentrifuge, normale Tischzentrifuge zur Zentrifugierung von Schlämmen mit 10.000 m/s2.
Reagenzien
14. Für die Prüfungen sind grundsätzlich Reagenzien in Analysequalität zu verwenden.
Wasser
15. Wenn nicht ausdrücklich chlorfreies Leitungswasser vorgeschrieben ist, muss destilliertes oder entionisiertes Wasser mit weniger als 1 mg/l gelöstem organischem Kohlenstoff (DOC) verwendet werden.
Versorgung mit synthetischem Abwasser
16. Das Medium ist so zuzubereiten, dass die folgenden Bestandteile in den jeweils genannten Anteilen enthalten sind:
| - Pepton | 16 g |
| - Fleischextrakt (oder ein vergleichbarer Pflanzenextrakt) | 11 g |
| - Harnstoff | 3 g |
| - Natriumchlorid (NaCl) | 0,7 g |
| - Calciumchlorid-Dihydrat (CaCl2, 2H2O) | 0,4 g |
| - Magnesiumsulfat-Heptahydrat (MgSO4, 7H2O) | 0,2 g |
| - wasserfreies Kaliummonohydrogenphosphat (K2HPO4) | 2,8 g |
| - destilliertes oder entionisiertes Wasser q.s.p. 1 Liter |
17. Der pH-Wert dieser Lösung muss bei 7,5 ± 0,5 liegen. Wenn das hergestellte Medium nicht sofort verwendet wird, kann es bei 0 bis 4 °C im Dunkeln höchstens eine Woche gelagert werden; alternativ kann die Lagerung auch unter anderen Bedingungen erfolgen, bei denen sich die Zusammensetzung nicht verändert. Dieses synthetische Abwasser hat die hundertfache Konzentration des im technischen Bericht der OECD vom 11. Juni 1976 'Vorgeschlagenes Verfahren zur Bestimmung der biologischen Abbaubarkeit von Tensiden in synthetischen Detergenzien' beschriebenen Abwassers und enthält außerdem Dikaliumhydrogenphosphat.
18. Alternativ können die Bestandteile des Mediums vor der Lagerung getrennt sterilisiert werden, oder das Pepton und der Fleischextrakt werden erst kurz vor der Durchführung der Prüfung hinzugegeben. Vor der Verwendung ist das Medium gründlich zu mischen und der pH-Wert erforderlichenfalls auf 7,5 ± 0,5 einzustellen.
Prüfchemikalie
19. Eine Stammlösung ist für leicht wasserlösliche Prüfstoffe nur bis zur maximalen Wasserlöslichkeit herzustellen. (Ausfällungen sind nicht annehmbar.) In Wasser schlecht lösliche Stoffe, Gemische mit Bestandteilen mit unterschiedlicher Wasserlöslichkeit und adsorptive Stoffe sind direkt in die Prüfgefäße einzuwiegen. In diesen Fällen kann die Verwendung von Stammlösungen eine Alternative sein, wenn gelöste Konzentrationen der Prüfchemikalien in den Prüfgefäßen analytisch bestimmt werden (bevor der Belebtschlamm hinzugegeben wird). Wenn WAFs (Water-Accommodated Fractions) hergestellt werden, ist auch eine analytische Bestimmung der aufgelösten Konzentrationen der Prüfchemikalien in den Prüfgefäßen von wesentlicher Bedeutung. Organische Lösungsmittel, Dispergiermittel/Emulgatoren zur Verbesserung der Löslichkeit sind zu vermeiden. Stammlösungen können einer Ultraschallbehandlung unterzogen werden, und Suspensionen können vorgerührt werden (z.B. über Nacht), wenn geeignete Informationen über die Stabilität der jeweiligen Prüfchemikalie unter den betreffenden Bedingungen verfügbar sind.
20. Die Prüfchemikalie kann den pH-Wert im Prüfsystem beeinträchtigen. Der pH-Wert der mit der Prüfchemikalie behandelten Mischungen ist vor der Herstellung des Versuchsaufbaus in einem Vorversuch zu bestimmen, um zu prüfen, ob der pH-Wert vor der eigentlichen Prüfung sowie nochmals am Tag der eigentlichen Prüfung eingestellt werden muss. Lösungen/Suspensionen der Prüfchemikalie in Wasser sind erforderlichenfalls vor Hinzugabe des Inokulums zu neutralisieren. Da die Neutralisierung jedoch die chemischen Eigenschaften der Chemikalie ändern kann, könnten je nach Zweck der Untersuchung weitere Prüfungen durchgeführt werden, um die Auswirkungen der Prüfchemikalie auf den Schlamm ohne Einstellung des pH-Wertes zu ermitteln.
21. Infolge von Stoffverlusten während der Expositionsdauer können die toxischen Wirkungen flüchtiger Chemikalien insbesondere bei Prüfungen, bei denen Luft durch das System geperlt wird, unterschiedlich stark ausgeprägt sein. Bei den betreffenden Stoffen ist Vorsicht geboten; in diesen Fällen sind stoffspezifische Analysen von Kontrollmischungen vorzunehmen, in denen der jeweilige Stoff enthalten ist, und die Belüftung ist entsprechend zu modifizieren.
Referenzchemikalie
22. Wenn 3,5-Dichlorphenol als Referenzchemikalie verwendet wird, ist eine Lösung aus 1,00 g 3,5-Dichlorphenol auf 1.000 ml Wasser herzustellen (15). Die Auflösung ist durch warmes Wasser und/oder eine Ultraschallbehandlung zu beschleunigen; nach dem Abkühlen auf Raumtemperatur ist die Lösung auf das vorgesehene Volumen aufzufüllen. Es muss allerdings sichergestellt werden, dass sich die Struktur der Referenzchemikalie nicht geändert hat. Der pH-Wert der Lösung wird geprüft und gegebenenfalls mit NaOH oder H2SO4 auf 7-8 eingestellt.
23. Wenn Kupfer-(II)-sulfat-Pentahydrat als Referenzchemikalie vorgesehen ist, sind Konzentrationen von 58 mg/l, 100 mg/l und 180 mg/l (Faktor 1,8) zu verwenden. Der Stoff wird unmittelbar in die Prüfgefäße eingewogen (29 - 50 - 90 mg bei einem Gesamtvolumen von 500 ml). Anschließend wird der Stoff in 234 ml autoklaviertem Leitungswasser aufgelöst. Kupfer-(II)-sulfat-Pentahydrat ist leicht löslich. Nach Beginn der Prüfung werden 16 ml synthetisches Abwasser und 250 ml Belebtschlamm hinzugegeben.
Spezifischer Nitrifikationshemmer
24. Es wird eine Stammlösung mit 2,32 g N-Allylthioharnstoff (ATU) pro Liter hergestellt. Die Hinzugabe von 2,5 ml dieser Stammlösung zu einem Inkubationsgemisch mit einem Endvolumen von 500 ml führt zu einer Endkonzentration von 11,6 mg ATU/l (10- 4mol/l); diese Konzentration ist erfahrungsgemäß hinreichend (4), um eine vollständige Hemmung der Nitrifikation in einem nitrifizierenden Belebtschlamm mit 1,5 g/l suspendierten Stoffen zu bewirken.
Abiotische Kontrolle
25. Unter gewissen seltenen Bedingungen kann eine Prüfchemikalie mit starker Reduktionswirkung einen messbaren abiotischen Sauerstoffverbrauch verursachen. In diesen Fällen sind abiotische Kontrollen erforderlich, um zwischen der abiotischen Sauerstoffaufnahme durch die Prüfchemikalie und dem Sauerstoffverbrauch durch Mikroorganismen unterscheiden zu können. Abiotische Kontrollen können hergestellt werden, indem bei den Prüfmischungen auf das Inokulum verzichtet wird. Ebenso können abiotische Kontrollen ohne Inokulum verwendet werden, wenn unterstützende analytische Messungen vorgenommen werden, um die erzielte Konzentration in der Expositionsphase der Prüfung zu bestimmen (z.B. bei Verwendung von Stammlösungen von schlecht wasserlöslichen Chemikalien oder Gemischen mit Bestandteilen mit unterschiedlicher Wasserlöslichkeit). In speziellen Fällen kann die Herstellung einer abiotischen Kontrolle mit einem sterilisierten Inokulum (z.B. durch Autoklavieren oder durch Hinzugabe sterilisierender Giftstoffe) erforderlich sein. Manche Chemikalien können Sauerstoff nur dann erzeugen oder verbrauchen, wenn die Oberfläche hinreichend groß für eine Reaktion ist, selbst dann, wenn die Chemikalien dazu normalerweise eine erhebliche höhere Temperatur oder einen erheblich höheren Druck benötigen. In diesem Zusammenhang ist bei Peroxiden besondere Aufmerksamkeit geboten. Ein sterilisiertes Inokulum besitzt eine große Oberfläche.
Inokulum
26. Im Allgemeinen wird Belebtschlamm am Auslass des Belebungsbeckens, oder in der Nähe des Auslasses des Beckens, einer ordnungsgemäß betriebenen Kläranlage entnommen, in der hauptsächlich häusliche Abwässer aufbereitet werden. Je nach Zweck des Tests können auch sonstige geeignete Typen von Belebtschlamm oder Belebtschlamm sonstiger Herkunft (z.B. im Labor gezüchteter Schlamm) mit geeigneten Konzentrationen an suspendierten Stoffen (2-4 g/l) verwendet werden. Schlämme aus unterschiedlichen Behandlungsanlagen könnten jedoch unterschiedliche Eigenschaften aufweisen und unterschiedlich empfindlich sein.
27. Der Schlamm kann wie entnommen verwendet werden; grobe Teilchen sind jedoch durch kurzzeitiges Absetzen (etwa 5-15 Minuten) und Dekantieren der oberen Schicht der feineren Feststoffe oder durch Sieben (z.B. mit einer Maschenweite von 1 mm2) abzutrennen. Alternativ kann der Schlamm in einem Mischer mindestens etwa 15 Sekunden homogenisiert werden; dabei sind jedoch die Scherkräfte und die Temperaturänderung zu beachten, die bei längerer Mischdauer auftreten können.
28. Häufig muss der Schlamm gewaschen werden (z.B. bei geringer endogener Respirationsrate). Zunächst ist der Schlamm zu zentrifugieren, bis ein klarer Überstand entsteht und sich aus den Feststoffen des Abwassers ein Pellet bildet (z.B. nach 10 Minuten mit etwa 10.000 m/s2). Die überstehende Flüssigkeit wird entfernt und der Schlamm in chlorfreiem Leitungswasser unter Schütteln resuspendiert; anschließend ist das Waschwasser durch Zentrifugieren abzutrennen und ebenfalls zu entfernen. Erforderlichenfalls ist der Wasch- und Zentrifugiervorgang zu wiederholen. Die Trockenmasse eines bekannten Volumens des resuspendierten Schlamms wird ermittelt, und der Schlamm wird unter Abtrennen der Flüssigkeit konzentriert oder in chlorfreiem Leitungswasser weiter verdünnt, bis er die erforderliche Feststoffkonzentration von 3 g/l aufweist. Der Belebtschlamm ist bei der Testtemperatur kontinuierlich zu belüften (z.B. mit 2 l/Minute) und möglichst am Tag der Entnahme zu verwenden. Wenn dies nicht möglich ist, muss dem Schlamm das synthetische Abwasser (50 ml synthetisches Abwasser/l Belebtschlamm) zwei weitere Tage lang täglich zugeführt werden. Anschließend wird der Schlamm für die Prüfung verwendet, und die Ergebnisse sind als gültig anzunehmen, sofern keine signifikante Änderung der Aktivität des Schlamms zu verzeichnen ist; dies ist anhand der endogenen heterotrophen Respirationsrate und der Respirationsrate durch Nitrifikation zu beurteilen.
29. Schwierigkeiten können sich ergeben, wenn es bei der Inkubation zu derartiger Schaumbildung kommt, dass der Schaum und die mit dem Schaum verbundenen Feststoffe des Schlamms aus den Belüftungsgefäßen herausgedrückt werden. Gelegentlich ist ein Schäumen einfach auf das Vorhandensein des synthetischen Abwassers zurückzuführen, aber wenn die Prüfchemikalie aus einem Tensid besteht oder ein Tensid enthält, ist mit Schaumbildung zu rechnen. Der Verlust von Schlamm-Feststoffen aus den Prüfmischungen hat eine künstliche Reduzierung der Respirationsrate zur Folge, die fälschlicherweise als Ergebnis einer Hemmung ausgelegt werden könnte. Außerdem bewirkt die Belüftung der Tensidlösung eine Konzentration der Tenside in der Schaumschicht; der Verlust des Schaums aus dem Prüfsystem reduziert die Expositionskonzentrationen. Die Schaumbildung kann durch einfache mechanische Methoden (z.B. durch gelegentliches manuelles Rühren mit einem Glasstab) oder durch Zugabe eines tensidfreien Silikon-Antischaummittels und/oder durch Belüftung mit einem Schüttelkolben kontrolliert werden. Wenn das Problem auf das Vorhandensein des synthetischen Abwassers zurückzuführen ist, muss die Zusammensetzung des Abwassers geändert werden, indem ein Antischaum-Reagenz zugesetzt wird (z.B. 50 µl/l). Ist die Schaumbildung auf die Prüfchemikalie zurückzuführen, muss die für eine Reduzierung der Schaumbildung erforderliche Menge bei der maximalen Prüfkonzentration ermittelt werden; anschließend sind alle Prüfgefäße in identischer Weise zu behandeln (einschließlich der Prüfgefäße wie Blindkontrollen und Referenzgefäße ohne Schaum). Wenn Antischaummittel verwendet werden, darf es nicht zu Wechselwirkungen mit dem Inokulum und/oder mit der Prüfchemikalie kommen.
30. Die Hemmung kann für drei Arten von Sauerstoffverbrauch bestimmt werden: den Gesamtverbrauch, den heterotrophen Sauerstoffverbrauch und den Verbrauch durch Nitrifikation. Im Allgemeinen ist die Messung der Hemmung des Gesamtsauerstoffverbrauchs ausreichend. Die Auswirkungen auf den heterotrophen Sauerstoffverbrauch durch die Oxidation organischen Kohlenstoffs einerseits und auf die Ammoniumoxidation andererseits müssen aber bestimmt werden, wenn für eine bestimmte Chemikalie eine getrennte Bewertung dieser beiden Endpunkte erforderlich ist oder wenn (optional) atypische Dosis-Wirkungs-Kurven der Hemmung des Gesamtsauerstoffverbrauchs erklärt werden sollen.
Prüfbedingungen
31. Die Prüfung ist bei einer Temperatur von 20 ± 2 °C vorzunehmen.
Prüfmischungen
32. Prüfmischungen (FT wie in Tabelle 1), die Wasser, synthetisches Abwasser und die Prüfchemikalie enthalten, sind mit verschiedenen nominalen Konzentrationen der Prüfchemikalie herzustellen (siehe Tabelle 1 für Beispiele von Volumina der Bestandteile). Erforderlichenfalls ist der pH-Wert auf 7,5 ± 0,5 einzustellen; die Mischungen werden mit Wasser verdünnt, und anschließend wird das Inokulum hinzugegeben, um in den Gefäßen gleiche Endvolumina herzustellen und mit der Belüftung beginnen zu können.
Referenzmischungen
33. Diese Mischungen (FR) sind mit der Referenzchemikalie (z.B. mit 3,5-Dichlorphenol) anstelle der Prüfchemikalie auf die gleiche Weise herzustellen wie die Prüfmischungen.
Blindkontrollen
34. Bei Tests, bei denen die Prüfgefäße nacheinander in regelmäßigen Abständen vorbereitet werden, sind zu Beginn und am Ende der Expositionsdauer Blindkontrollen (FB) vorzunehmen. Wenn Prüfungen mit Geräten vorgenommen werden, die gleichzeitige Messungen des Sauerstoffverbrauchs zulassen, sind für jede Gruppe gleichzeitiger Analysen mindestens zwei Blindkontrollen einzubeziehen. Blindkontrollen enthalten jeweils gleiche Volumina des Belebtschlamms und des synthetischen Mediums, jedoch weder die Prüfchemikalie noch die Referenzchemikalie. Sie sind mit Wasser auf das gleiche Volumen wie die Prüf- und die Referenzmischungen zu verdünnen.
Abiotische Kontrolle
35. Wenn erforderlich (beispielsweise wenn von einer Prüfchemikalie bekannt oder anzunehmen ist, dass sie stark reduzierende Eigenschaften hat), muss ein Gemisch FA hergestellt werden, um den abiotischen Sauerstoffverbrauch zu messen. Das Gemisch muss die gleichen Mengen der Prüfchemikalie und des synthetischen Abwassers enthalten und das gleiche Volumen wie die Prüfmischungen haben, darf aber keinen Belebtschlamm enthalten.
Allgemeines Verfahren und Messungen
36. Prüfmischungen, Referenzmischungen, die Blindkontrollen und die abiotischen Kontrollen werden bei der Testtemperatur inkubiert und zwangsbelüftet (0,5 bis 1 l/min), um die Konzentration des gelösten Sauerstoffs über 60-70 % zu halten und die Suspendierung der Schlammflocken aufrechtzuerhalten. Um die Schlammflocken in Suspension zu halten, müssen die Kulturen zudem gerührt werden. Die Inkubation gilt als begonnen, wenn das Belebtschlamm-Inokulum mit den anderen Bestandteilen des endgültigen Gemischs in Kontakt kommt. Am Ende der Inkubation werden die Proben nach Ablauf der vorgesehenen Expositionsdauer von gewöhnlich drei Stunden entnommen, um in einer für diesen Zweck entwickelten Zelle (Abbildung 2 in Anlage 3) oder in einer vollständig gefüllten BSB-Flasche die Geschwindigkeit der Abnahme der Konzentration des gelösten Sauerstoffs zu messen. Auf welche Weise die Inkubationen beginnen, hängt auch von der Kapazität der Ausrüstung ab, mit der die Sauerstoffverbrauchsraten gemessen werden. Wenn die Ausrüstung beispielsweise nur eine einzelne Sauerstoffsonde enthält, werden die Messungen getrennt vorgenommen. In diesem Fall werden die für die Prüfung in synthetischem Abwasser benötigten Mischungen ohne Zugabe des Inokulums hergestellt, und die jeweils benötigten Anteile Schlamm werden in alle Gefäße der jeweiligen Reihe gegeben. Die Inkubation der Proben wird nacheinander in angemessenen Intervallen (z.B. 10 bis 15 Minuten) gestartet. Das Messsystem kann auch mehrere Sonden enthalten, was die Durchführung mehrerer gleichzeitiger Messungen erleichtert; in diesem Fall kann das Inokulum den Gefäßen der betreffenden Gruppen gleichzeitig hinzugegeben werden.
37. Die Belebtschlamm-Konzentration liegt bei allen Prüf-, Referenz- und Blindmischungen (nicht aber bei der abiotischen Kontrolle) bei nominal 1,5 g/l suspendierte Feststoffe. Der Sauerstoffverbrauch ist nach dreistündiger Exposition zu messen. Gegebenenfalls sind zusätzliche Messungen nach 30-minütiger Exposition vorzunehmen, wie unter Nummer 5 beschrieben.
Nitrifikationspotenzial des Schlamms
38. Um festzustellen, ob der Schlamm nitrifiziert und in welchem Maß diese Nitrifikation gegebenenfalls erfolgt, werden Mischungen (FB) wie die Mischungen für die Blindkontrollen und die zusätzlichen 'Kontrollen' (FN) hergestellt, die jedoch außerdem N-Allylthioharnstoff in einer Konzentration von 11,6 mg/l enthalten. Die Mischungen sind zu belüften und 3 Stunden bei 20 ± 2 °C zu inkubieren. Anschließend wird der Sauerstoffverbrauch gemessen, und die Sauerstoffverbrauchsrate durch Nitrifikation wird berechnet.
Prüfprotokolle
Vorversuch
39. Erforderlichenfalls wird mit einem Vorversuch der Konzentrationsbereich der Prüfchemikalie ermittelt, der in einem definitiven Test zur Bestimmung der Hemmung des Sauerstoffverbrauchs benötigt wird. Alternativ kann durch die Tatsache, dass in einem Vorversuch keine Hemmung des Sauerstoffverbrauchs durch die Prüfchemikalie festgestellt wurde, belegt werden, dass ein definitiver Test nicht erforderlich ist. In diesem Fall sollten drei Proben mit der höchsten geprüften Konzentration (in der Regel 1.000 mg/l, jedoch abhängig von den Datenanforderungen) im Vorversuch enthalten sein.
Tabelle 1: Beispiele für Mischungen für den Vorversuch
| Reagenz | Ausgangskonzentration | ||||
| Stammlösung der Prüfchemikalie Stammlösung des synthetischen Mediums Stammlösung mit Belebtschlamm | 10 g/l Siehe Nummer 16 3 g/l suspendierte Feststoffe | ||||
| Bestandteile von Mischungen | Dosierung in Prüfgefäße a | ||||
| FT1 | FT2 | FT3-5 | FB1-2 | FA | |
| Stammlösung der Prüfchemikalie (ml) (Nummern 19 bis 21) | 0,5 | 5 | 50 | 0 | 0 |
| Stammlösung des synthetischen Mediums (ml) (Nummer 16) | 16 | 16 | 16 | 16 | 16 |
| Belebtschlamm-Suspension (ml) (Nummern 26 bis 29) | 250 | 250 | 250 | 250 | 0 |
| Wasser (Nummer 15) | 233,5 | 229 | 184 | 234 | 434 |
| Gesamtvolumen der Mischungen (ml) | 500 | 500 | 500 | 500 | 500 |
| Konzentrationen in der Mischung | |||||
| Prüfsuspension (mg/l) Belebtschlamm (suspendierte Feststoffe) (mg/l) | 10
1.500 | 100
1.500 | 1.000
0 | 0
1500 | 1000
0 |
| a) Auf dieselbe Weise ist mit der Referenzchemikalie zu verfahren (Gefäße FR1-3). | |||||
40. Die Prüfung ist unter Verwendung von mindestens drei Konzentrationen der Prüfchemikalie (z.B. 10 mg/l, 100 mg/l und 1.000 mg/l) und mit einer Blindkontrolle sowie erforderlichenfalls mit mindestens drei abiotischen Kontrollen mit den höchsten Konzentrationen der Prüfchemikalie vorzunehmen (siehe z.B. Tabelle 1). Im Idealfall hat die niedrigste Konzentration keine Auswirkungen auf den Sauerstoffverbrauch. Die Sauerstoffverbrauchsrate und gegebenenfalls die Nitrifikationsrate sind zu berechnen; anschließend wird die prozentuale Hemmung berechnet. Je nach Zweck der Prüfung ist es auch möglich, nur die Toxizität einer Grenzkonzentration (z.B. 1.000 mg/l) zu bestimmen. Wenn bei diesen Konzentrationen keine statistisch signifikante toxische Wirkung auftritt, brauchen keine weiteren Prüfungen mit höheren oder niedrigeren Konzentrationen mehr vorgenommen zu werden. Schlecht wasserlösliche Stoffe, Mischungen mit Bestandteilen mit unterschiedlicher Wasserlöslichkeit und adsorptive Stoffe sind direkt in die Prüfgefäße einzuwiegen. In diesem Fall ist das für die Stammlösung mit dem Prüfstoff vorgesehene Volumen durch Verdünnungswasser zu ersetzen.
Definitiver Test
Hemmung des Gesamtsauerstoffverbrauchs
41. Die Prüfung wird mit einer Reihe von Konzentrationen durchgeführt, die im Vorversuch ermittelt wurden. Um sowohl eine NOEC als auch einen ECx-Wert (z.B. EC50) zu erhalten, sind meist sechs Kontrollen und fünf Prüfkonzentrationen in einer geometrischen Reihe mit je fünf Replikaten zu empfehlen. Die abiotische Kontrolle braucht nicht wiederholt zu werden, wenn im Vorversuch kein Sauerstoffverbrauch festgestellt wurde; wenn jedoch ein signifikanter Sauerstoffverbrauch zu verzeichnen ist, sind für jede Konzentration der Prüfchemikalie abiotische Kontrollen einzubeziehen. Die Empfindlichkeit des Schlamms ist mithilfe der Referenzchemikalie 3,5-Dichlorphenol zu prüfen. Da diese Empfindlichkeit erfahrungsgemäß schwankt, muss sie bei jeder Testreihe geprüft werden. In jedem Fall werden nach drei Stunden sowie erforderlichenfalls zusätzlich bereits nach 30 Minuten Proben aus den Prüfgefäßen entnommen, um den Sauerstoffverbrauch in der Zelle mit der Sauerstoffelektrode zu messen. Aus den erfassten Daten werden die spezifischen Respirationsraten der Kontroll- und der Prüfmischungen berechnet. Die prozentuale Hemmung ist mit der nachstehenden Gleichung 7 zu ermitteln.
Unterscheidung zwischen der Hemmung der heterotrophen Respiration und der Nitrifikation
42. Die Verwendung des spezifischen Nitrifikationshemmers ATU ermöglicht die unmittelbare Beurteilung der hemmenden Wirkung von Prüfchemikalien auf die heterotrophe Oxidation. Die Auswirkungen auf die Nitrifikationsrate können durch Subtraktion der Sauerstoffverbrauchsrate mit ATU von der Gesamtverbrauchsrate (ohne ATU) berechnet werden. Zwei Reihen von Reaktionsmischungen sind nach den Prüfprotokollen zur Ermittlung des ECx-Wertes bzw. der NOEC herzustellen, wie unter Nummer 41 beschrieben; außerdem ist jedem Gemisch in einer der beiden Reihen ATU in einer Endkonzentration von 11,6 mg/l zuzugeben. (Von dieser Konzentration ist belegt, dass die Nitrifikation in Schlamm mit Konzentrationen suspendierter Feststoffe von bis zu 3.000 mg/l vollständig gehemmt wird (4).) Am Ende des Expositionszeitraums werden die Sauerstoffverbrauchsraten gemessen; diese direkten Werte geben nur Aufschluss über die heterotrophe Respiration. Die Differenz zwischen diesen Werten und den entsprechenden Gesamtrespirationsraten entspricht der Nitrifikation. Anschließend werden die unterschiedlichen Grade der Hemmung berechnet.
Messungen
43. Nach den jeweiligen Expositionszeiten wird eine Probe aus dem ersten Belüftungsgefäß in die Zelle mit der Sauerstoffelektrode gegeben (siehe Abb. 1 in Anlage 2) und umgehend die Konzentration des gelösten Sauerstoffs gemessen. Wenn ein System mit mehreren Elektroden verfügbar ist, können die Messungen gleichzeitig vorgenommen werden. Das Rühren (mit einem beschichteten Magnetrührstäbchen) erfolgt mit der gleichen Geschwindigkeit wie beim Kalibrieren der Elektrode. Dadurch wird sichergestellt, dass die Sonde mit minimaler Verzögerung auf Änderungen der Sauerstoffkonzentrationen reagiert und dass im Messgefäß regelmäßige und reproduzierbare Sauerstoffmessungen vorgenommen werden können. In der Regel ist das selbstrührende Sondensystem einiger Sauerstoffelektroden ausreichend. Zwischen den Messungen ist die Zelle mit Wasser zu spülen. Alternativ kann die Probe auch in eine BSB-Flasche (Abb. 2 in Anlage 3) mit einem Magnetrührer gegeben werden. Anschließend ist eine Sauerstoffsonde mit Dichttülle in den Hals des Gefäßes einzuführen und der Magnetrührer zu starten. In beiden Fällen wird die Konzentration des gelösten Sauerstoffs über einen Zeitraum von gewöhnlich 5 bis 10 Minuten bzw. bis zum Absinken der Sauerstoffkonzentration auf weniger als 2 mg/l kontinuierlich gemessen und aufgezeichnet. Danach wird die Elektrode herausgenommen und das Gemisch wieder in das Belüftungsgefäß gegeben; die Mischung ist weiter zu belüften und zu rühren, wenn eine Messung nach längeren Expositionszeiten erforderlich ist.
Überprüfung der Konzentration der Prüfchemikalie
44. Für bestimmte Zwecke muss unter Umständen die Konzentration der Prüfchemikalie in den Prüfgefäßen gemessen werden. Bei der Verwendung von Stammlösungen mit
- schlecht wasserlöslichen Stoffen,
- Gemischen mit Bestandteilen mit unterschiedlicher Wasserlöslichkeit oder
- Stoffen mit guter Wasserlöslichkeit, deren Konzentration in der Stammlösung jedoch an der Grenze zur maximalen Wasserlöslichkeit liegt,
ist die gelöste Fraktion nicht bekannt, und die tatsächliche Konzentration der in die Prüfgefäße überführten Prüfchemikalie ist demnach unbekannt. Um die Exposition zu beschreiben, müssen die Konzentrationen der Prüfchemikalie in den Prüfgefäßen analysiert werden. Zur Vereinfachung des Verfahrens sollte diese Analyse vor Zugabe des Inokulums erfolgen. Da ausschließlich gelöste Fraktionen in die Prüfgefäße gegeben werden, können die gemessenen Konzentrationen sehr gering sein.
45. Um zeitaufwendige und teure Analysen zu vermeiden, sollte die Prüfchemikalie einfach direkt in die Prüfgefäße eingewogen und bei den anschließenden Berechnungen die anfänglich gewogene nominale Konzentration zugrunde gelegt werden. Eine Unterscheidung zwischen gelöster, nicht gelöster und adsorbierter Fraktion der Prüfchemikalie braucht nicht vorgenommen zu werden, da alle diese Fraktionen auch unter realen Bedingungen in Kläranlagen auftreten und je nach Zusammensetzung des Abwassers sehr unterschiedlich sein können. Ziel der Prüfmethode ist die realistische Abschätzung einer nicht hemmenden Konzentration; die Methode ist nicht geeignet, um im Einzelnen zu untersuchen, welche Fraktionen zur Hemmung der Mikroorganismen im Belebtschlamm beitragen. Auch adsorptive Stoffe sind direkt in die Prüfgefäße einzuwiegen; um Verluste durch Adsorption zu minimieren, werden die Gefäße silanisiert.
Berechnung der Sauerstoffverbrauchsraten
46. Die Sauerstoffverbrauchsraten sind aus dem Mittelwert der gemessenen Werte zu berechnen - z.B. aus dem linearen Abschnitt der Kurven der Sauerstoffkonzentration in Abhängigkeit von der Zeit. Die Berechnungen werden auf Sauerstoffkonzentrationen von 2,0 mg/l bis 7,0 mg/l beschränkt, da höhere und niedrigere Konzentrationen selbst Auswirkungen auf die Sauerstoffverbrauchsraten haben könnten. Die Berücksichtigung von Konzentrationsbereichen ober- oder unterhalb dieser Werte ist manchmal nicht zu vermeiden und erforderlich, wenn die Respiration stark beeinträchtigt und entsprechend gering ist oder wenn bei einem bestimmten Belebtschlamm eine sehr hohe Respiration zu verzeichnen ist. Dies ist annehmbar, wenn die betreffenden Bereiche der Verbrauchskurve gerade verlaufen und wenn sich ihre Steigung unter- bzw. oberhalb der O2-Grenzwerte 2,0 mg/l oder 7,0 mg/l nicht ändert. Gekrümmte Kurvenabschnitte sind ein Beleg dafür, dass sich das Messsystem noch stabilisiert oder dass sich die Verbrauchsrate ändert. Die Sauerstoffverbrauchsrate darf nicht anhand dieser Abschnitte berechnet werden. Die Sauerstoffverbrauchsrate ist in Milligramm pro Liter und Stunde (mg/lh) oder in Milligramm pro Gramm getrockneter Schlamm und Stunde (mg/gh) anzugeben. Die Sauerstoffverbrauchsrate R, in mg/lh, kann nach der Gleichung 1 berechnet oder interpoliert werden ausgehend vom linearen Abschnitt der Kurve des aufgezeichneten Sauerstoffrückgangs:
R = (Q1 - Q2)/Δt × 60 (1)
Dabei sind:
Q1 = Sauerstoffkonzentration am Anfang des ausgewählten Abschnitts der linearen Phase (mg/l);
Q2 = Sauerstoffkonzentration am Ende des ausgewählten Abschnitts der linearen Phase (mg/l);
Δt = Zeitabstand zwischen diesen beiden Messungen (min.).
47. Die spezifische Respirationsrate (Rs) wird als die Menge an Sauerstoff ausgedrückt, die pro Gramm Trockenmasse des Schlamms und pro Stunde (mg/gh) verbraucht wird; sie ist mit Gleichung 2 zu berechnen:
|
Rs = R/SS | (2) |
Dabei ist SS die Konzentration der suspendierten Feststoffe im Prüfgemisch (g/l).
48. Die verschiedenen kombinierbaren Indizes von R sind:
S = spezifische Rate
T = Gesamtrespirationsrate
N = auf Nitrifikationsrespiration zurückzuführende Rate H = auf heterotrophe Respiration zurückzuführende Rate
A = auf abiotische Prozesse zurückzuführende Rate
B = auf Blindkontrollen basierende Rate (Mittelwert)
Berechnung der Sauerstoffverbrauchsrate aufgrund von Nitrifikation
49. Die Beziehung zwischen der Gesamtrespiration (RT), der Nitrifikationsrespiration (RN) und der heterotrophen Respiration (RH) wird mit Gleichung 3 beschrieben:
|
RN = RT - RH |
(3) |
Dabei sind:
RN = Sauerstoffverbrauchsrate aufgrund von Nitrifikation (mg/lh);
RT = gemessene Rate des Sauerstoffverbrauchs der Blindkontrolle (ohne ATU; FB) (mg/lh).
RH = gemessene Rate des Sauerstoffverbrauchs der Blindkontrolle mit ATU (FN) (mg/lh).
50. Diese Beziehung gilt für Blindwerte (RNB, RTB, RHB), abiotische Kontrollen (RNA, RTA, RHA) und Assays mit Prüfchemikalien (RNS, RTS, RHS) (mg/gh). Spezifische Respirationsraten werden wie folgt berechnet:
| RNS = RN/SS | (4) |
| RTS = RT/SS | (5) |
| RHS = RH/SS | (6) |
51. Wenn RN in einem Vorversuch nicht signifikant ist (z.B. < 5 % der RT bei Blindkontrollen), kann davon ausgegangen werden, dass der heterotrophe Sauerstoffverbrauch dem Gesamtverbrauch entspricht und dass keine Nitrifikation stattfindet. Wenn in den Prüfungen die Auswirkungen auf heterotrophe und nitrifizierende Mikroorganismen berücksichtigt werden sollen, wird Belebtschlamm anderer Herkunft benötigt. Der definitive Test ist durchzuführen, wenn bei unterschiedlichen Konzentrationen der Prüfchemikalie Anzeichen für eine Hemmung des Sauerstoffverbrauchs festgestellt werden.
Berechnung der prozentualen Hemmung
52. Die prozentuale Hemmung des Gesamtsauerstoffverbrauchs, IT, bei den einzelnen Konzentrationen der Prüfchemikalie wird mit Gleichung 7 ermittelt:
|
IT = [1 - (RT - RTA)/RTB] × 100 % | (7) |
53. Analog dazu wird die prozentuale Hemmung des heterotrophen Sauerstoffverbrauchs, IH, bei den einzelnen Konzentrationen der Prüfchemikalie mit Gleichung 8 ermittelt:
|
IH = [1 - (RH - RHA)/RHB] × 100 % | (8) |
54. Die Hemmung des Sauerstoffverbrauchs durch Nitrifikation, IN, wird für die einzelnen Konzentrationen schließlich mit Gleichung 9 berechnet:
|
IN = [1 - (RT - RH)/(RTB - RHB)] × 100 % | (9) |
55. Die prozentuale Hemmung des Sauerstoffverbrauchs ist bezogen auf den Logarithmus der Konzentration der Prüfchemikalie grafisch darzustellen (Hemmkurve siehe Abb. 3 in Anlage 4). Die Hemmkurven werden für jede Belüftungsperiode von jeweils 3 Stunden bzw. zusätzlich nach 30 Minuten grafisch dargestellt. Anschließend ist aus der Grafik die Konzentration der Prüfchemikalie zu berechnen oder zu interpolieren, bei der der Sauerstoffverbrauch um 50 % gehemmt wird (EC50). Wenn geeignete Daten verfügbar sind, können die 95- %-Konfidenzintervalle der EC50-Werte, die Steigung der Kurve und geeignete Werte für den Beginn der Hemmung (z.B. EC10 oder EC20) sowie das Ende des Inhibitionsbereichs (etwa EC80 oder EC90) berechnet oder interpoliert werden.
56. Angesichts der häufig beobachteten Variabilität der Ergebnisse kann es in vielen Fällen ausreichen, die Ergebnisse zusätzlich nach der Größenordnung anzugeben, z.B.:
EC50 < 1 mg/l
EC50 1 mg/l bis 10 mg/l
EC50 10 mg/l bis 100 mg/l
EC50 > 100 mg/l
Interpretation der Ergebnisse
ECx
57. ECx-Werte einschließlich der entsprechenden oberen und unteren 95- %-Konfidenzgrenzen für die einzelnen Parameter werden mit geeigneten statistischen Methoden berechnet (z.B. Probit-Analysen, Logit- oder Weibull- Modell, Trimmed Spearman-Karber-Methode oder einfache Interpolation) (11). Ein ECx-Wert wird ermittelt, indem der x % des Mittelwerts der Kontrollen entsprechende Wert in die gefundene Gleichung eingesetzt wird. Um den EC50-Wert oder einen sonstigen ECx-Wert zu ermitteln, sind die Mittelwerte der Vorbehandlung (x) einer Regressionsanalyse zu unterziehen.
Schätzung der NOEC
58. Wenn mit einer statistischen Analyse die NOEC bestimmt werden soll, werden Statistiken für die einzelnen Gefäße benötigt. (Die Gefäße werden jeweils als Replikate betrachtet.) Es sind geeignete statistische Methoden anzuwenden; maßgeblich ist das OECD-Dokument ,Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application' (11). Im Allgemeinen werden schädliche Wirkungen der Prüfchemikalie im Vergleich mit der Kontrolle einer einseitigen (kleineren) Hypothesenprüfung mit p ≤ 0,05 unterzogen.
Prüfbericht
59. Das Prüfprotokoll enthält die folgenden Informationen:
Prüfchemikalie:
- allgemeine Bezeichnung, chemische Bezeichnung, CAS-Nummer, Reinheit;
- physikalisch-chemische Eigenschaften der Prüfchemikalie (z.B. log Kow, Wasserlöslichkeit, Dampfdruck, Henry-Konstante (H) und mögliche Informationen zum Verbleib der Prüfchemikalie (z.B. Adsorption an den Belebtschlamm));
Prüfsystem
- Herkunft, Betriebsbedingungen der Kläranlage und eingeleitete Abwässer, Konzentration, Vorbehandlung und Versorgung des Belebtschlamms;
Prüfbedingungen
- Testtemperatur, pH-Wert während der Prüfung und Dauer der Expositionsphase(n);
Ergebnisse
- Spezifischer Sauerstoffverbrauch der Kontrollen (mg O2/(g Schlamm × h);
- alle gemessenen Daten, die Hemmungskurve(n) und die Methode zur Berechnung von EC50;
- EC50 und nach Möglichkeit die 95- %-Konfidenzgrenzen sowie möglichst EC20 und EC80; wenn möglich, die NOEC und die angewandten statistischen Methoden, wenn EC50 nicht bestimmt werden kann;
- Ergebnisse für die Gesamthemmung sowie gegebenenfalls für die Hemmung der heterotrophen und der Nitrifikationsrespiration;
- der abiotische Sauerstoffverbrauch der physikalisch-chemischen Kontrolle (soweit verwendet);
- Bezeichnung der Referenzchemikalie und Ergebnisse mit dieser Chemikalie;
- sämtliche Beobachtungen und Abweichungen vom Standardverfahren, die Einfluss auf die Ergebnisse gehabt haben könnten.
(1) Brown, D., Hitz, H.R., und Schäfer, L. (1981). The assessment of the possible inhibitory effect of dyestuffs on aerobic wastewater bacteria, Experience with a screening test. Chemosphere 10 (3): 245-261.
(2) King, E. F. und Painter H. A. (1986). Inhibition of respiration of activated sludge; variability and reproducibility of results. Toxicity Assessment 1(1): 27-39.
(3) OECD (1984), Activated sludge, Respiration inhibition test, Test Guideline No. 209, Guidelines for the testing of chemicals, OECD, Paris.
(4) ISO (2007). ISO 8192, Wasserbeschaffenheit - Bestimmung der Hemmung des Sauerstoffverbrauchs von Belebtschlamm nach Kohlenstoff- und Ammonium-Oxidation; Internationale Organisation für Normung.
(5) Bealing, D. J. (2003). Dokument ISO/TC147/WGI/N.183, ISO.
(6) Painter, H A, Jones K (1963). The use of the widebore droppingmercury electrode for the determination of the rates of oxygen uptake and oxidation of ammonia by microorgranisms. Journal of Applied Bacteriology 26 (3): 471-483.
(7) Painter, H. A. (1986). Testing the toxicity of chemicals by the inhibition of respiration of activated sludge. Toxicity Assessment 1:515-524.
(8) Robra, B. (1976). Wasser/Abwasser 117, 80.
(9) Fiebig, S., und Noack, U. (2004). The use of copper(II)sulphate pentahydrate as reference substance in the activated sludge respiration inhibition test - acc. to the OECD guideline 209. Fresenius Environmental Bulletin 13 No. 12b: 1556-1557.
(10) ISO (1995). ISO 10634, Wasserbeschaffenheit - Anleitung für die Vorbereitung und Behandlung von in Wasser schwer löslichen organischen Verbindungen für die nachfolgende Bestimmung ihrer biologischen Abbaubarkeit in einem wässrigen Medium.
(11) OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: a guidance to application, Series on testing and assessment No. 54, ENV/JM/MONO(2006)18, OECD, Paris.
________
1) Richtlinie 91/271/EWG des Rates vom 21. Mai 1991 über die Behandlung von kommunalem Abwasser; ABl. L 135 vom 30.05.1991 S. 40-52.
| Begriffsbestimmungen | Anlage 1 |
Bei dieser Prüfmethode werden die folgenden Begriffsbestimmungen zugrunde gelegt:
Chemikalie: ein Stoff oder eine Mischung.
ECx (Konzentration mit einer Wirkung von x %): Konzentration, bei der innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle eine Wirkung von x % auf die Testorganismen zu verzeichnen ist. Der EC50-Wert beispielsweise ist die Konzentration, bei der bei 50 % einer exponierten Population während einer bestimmten Expositionsdauer von einer Wirkung auf einen Endpunkt der Prüfung ausgegangen wird.
NOEC (höchste geprüfte Konzentration ohne beobachtete Wirkung): Die Konzentration der Prüfchemikalie, bei der keine Wirkung beobachtet wird. Bei diesem Test hat die der NOEC entsprechende Konzentration innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle keine statistisch signifikante Wirkung (p < 0,05).
Prüfchemikalie: ein beliebiger Stoff oder eine Mischung, der bzw. die nach dieser Methode geprüft wird.
| Anlage 2 |
Abb. 1 Messgeräte (Beispiele)
Legende
1 Belebtschlamm
2 Synthetisches Medium
3 Prüfchemikalie
4 Luft
5 Mischgefäß
6 Magnetrührer
7 Sauerstoffmesszelle
8 Sauerstoffelektrode
9 Sauerstoffmessgerät
10 Aufzeichnungsgerät
| Anlage 3 |
Abb. 2 Messgerät (Beispiel) mit einer BSB-Flasche
Legende
1 Prüfgefäß
2 Sauerstoffelektrode
3 Sauerstoffmessgerät
| Anlage 4 |
Abb. 3 Hemmkurven (Beispiel)
Legende
X Konzentration von 3,5-Dichlorphenol (mg/l)
Y Hemmung (%)
![]() Hemmung der heterotrophen Respiration mit einem nitrifizierenden Schlamm
Hemmung der heterotrophen Respiration mit einem nitrifizierenden Schlamm
• Hemmung der Nitrifikation mit einem nitrifizierenden Schlamm"
(5) Kapitel C.26 erhält folgende Fassung:
"C.26 LEMNA SP. - Wachstumsinhibitionstest
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 221 (2006). Sie dient zur Beurteilung der Toxizität von Chemikalien bei Süßwasserpflanzen der Gattung Lemna (Wasserlinse). Die Methode beruht auf bestehenden Methoden (1)(2)(3)(4)(5)(6), sieht aber Änderungen der entsprechenden Methoden vor, die neueren Forschungsergebnissen und Anhörungen bezüglich einer Reihe wesentlicher Aspekte Rechnung tragen. Die Prüfmethode wurde in einem internationalen Ringversuch validiert (7).
2. Die Prüfmethode beschreibt Toxizitätstests mit Lemna gibba und Lemna minor, die beide umfassend untersucht wurden und Gegenstand der genannten Standards waren. Die Taxonomie von Lemna spp. ist schwierig; problematisch sind die zahlreichen Phänotypen. Lemna können zwar genetisch bedingt unterschiedlich auf Giftstoffe reagieren, doch es liegen noch keine ausreichenden Daten zu den Ursachen für diese Variabilität vor, um einen speziellen Klon zur Verwendung bei dieser Prüfmethode empfehlen zu können. Es wird darauf hingewiesen, dass der Test nicht axenisch durchgeführt wird; in verschiedenen Stadien während der Durchführung des Tests wird jedoch mit geeigneten Maßnahmen versucht, Verunreinigungen durch andere Organismen auf ein Minimum zu begrenzen.
3. Die Durchführung von Tests sowohl mit Erneuerung der Testlösung (semistatische Tests und Durchflusstests) als auch ohne Erneuerung der Testlösung (statische Tests) wird detailliert beschrieben. Abhängig von den Zielsetzungen der Tests sowie von rechtlichen Anforderungen wird empfohlen, den Einsatz von semistatischen Methoden sowie von Durchflussmethoden zu prüfen (z.B. für Stoffe, die durch Verflüchtigung, Photoabbau, Ausfällung oder biologischen Abbau rasch verloren gehen). Weitere Informationen sind Quelle (8) zu entnehmen.
4. Definitionen der verwendeten Begriffe sind Anlage 1 zu entnehmen.
5. Exponentiell wachsende Pflanzenkulturen der Gattung Lemna werden über einen Zeitraum von sieben Tagen als Monokulturen in unterschiedlichen Konzentrationen der Prüfchemikalie kultiviert. Ziel des Tests ist es, die durch den Stoff bedingten Auswirkungen auf das Pflanzenwachstum während dieses Zeitraums zu quantifizieren, basierend auf der Auswertung ausgewählter Messvariablen. Die Frondzahl ist die primäre Messvariable. Außerdem wird mindestens eine weitere Messvariable (gesamte Frondfläche, Trockenmasse oder Frischmasse) gemessen, da sich einige Stoffe erheblich stärker auf diese Messvariablen auswirken als auf die Frondzahlen. Um die stoffabhängigen Auswirkungen zu quantifizieren, wird das Wachstum der Testlösungen mit dem Wachstum der Kontrolllösungen verglichen, und die Konzentration, die eine spezifizierte Wachstumshemmung von x % (z.B. 50 %) verursacht, wird bestimmt und als ECx (z.B. EC50) angegeben.
6. Der Endpunkt des Tests ist die Wachstumshemmung, ausgedrückt als logarithmische Zunahme der Messvariablen (durchschnittliche spezifische Wachstumsrate) während der Expositionsdauer. Aus den in einer Reihe von Testlösungen erfassten durchschnittlichen spezifischen Wachstumsraten wird die Konzentration bestimmt, bei der sich eine spezifizierte Hemmung der Wachstumsrate von x % (z.B. 50 %) ergibt; diese Konzentration wird als ErCx bezeichnet (z.B. ErC50).
7. Eine weitere Reaktionsvariable bei dieser Prüfmethode ist der Zellertrag (Yield); diese Variable kann erforderlich sein, damit in manchen Ländern bestimmte Rechtsvorschriften erfüllt werden. Die Variable ergibt sich aus den Messvariablen am Ende der Expositionsdauer abzüglich der Messvariablen bei Beginn der Expositionsdauer. Aus dem in einer Reihe von Testlösungen ermittelten Zellertrag wird die Konzentration berechnet, bei der sich eine festgelegte Zellertrag-Hemmung von x % (z.B. 50 %) ergibt; diese Konzentration wird als EyCx bezeichnet (z.B. EyC50).
8. Außerdem können die niedrigste Konzentration mit beobachteter Wirkung (LOEC) und die höchste geprüfte Konzentration ohne beobachtete schädliche Wirkung (NOEC) statistisch bestimmt werden.
Informationen zur Prüfchemikalie
9. Eine Analysemethode mit geeigneter Empfindlichkeit für die Quantifizierung des im Prüfmedium enthaltenen Stoffs sollte verfügbar sein.
10. Zur Festlegung der Testbedingungen hilfreiche Informationen zur Prüfchemikalie sind die Strukturformel, die Reinheit, die Wasserlöslichkeit, die Stabilität in Wasser, die Lichtbeständigkeit, pKa, Kow, der Dampfdruck und die biologische Abbaubarkeit. Aus der Wasserlöslichkeit und dem Dampfdruck kann die Henry-Konstante berechnet werden, aus der zu entnehmen ist, ob während der Testdauer erhebliche Verluste der Prüfchemikalie zu erwarten sind. Die Konstante gibt Aufschluss darüber, ob bestimmte Maßnahmen zur Überwachung dieser Verluste durchgeführt werden sollten. Wenn Informationen zur Löslichkeit und zur Stabilität der Prüfchemikalie nicht zuverlässig sind, sollten diese unter den Testbedingungen (Nährmedium, Temperatur und Beleuchtung) untersucht werden.
11. Wenn der Einhaltung des pH-Wertes des Prüfmediums besondere Bedeutung zukommt (z.B. beim Testen von Metallen oder sonstigen hydrolytisch instabilen Chemikalien), wird die Zugabe einer Pufferlösung zum Nährmedium empfohlen (siehe Nummer 21). Weitere Hinweise zur Prüfung von Chemikalien mit physikalisch- chemischen Merkmalen, welche die Durchführung des Tests erschweren, sind Quelle (8) zu entnehmen.
12. Die Tests sind nur valide, wenn die Zeit bis zur Verdopplung der Frondzahl der Kontrolle weniger als 2,5 Tage (60 h) beträgt, was in etwa einer Erhöhung um das Siebenfache in sieben Tagen und einer durchschnittlichen spezifischen Wachstumsrate von 0,275 d- 1 entspricht. Für die Medien und Testbedingungen gemäß dieser Methode kann dieses Kriterium mit dem Prüfprotokoll des statischen Tests (5) erfüllt werden. Außerdem wird angenommen, dass dieses Kriterium auch bei den Bedingungen des semistatischen Tests und des Durchflusstests erfüllt wird. Wie die Verdopplungszeit zu berechnen ist, wird unter Nummer 49 beschrieben.
13. Um das Prüfverfahren zu testen, können Referenzstoffe wie z.B. das im internationalen Ringtest (7) verwendete 3,5-Dichlorphenol geprüft werden. Die Referenzchemikalien sollten mindestens zweimal jährlich bzw. - wenn die Tests seltener durchgeführt werden - gleichzeitig mit der Bestimmung der Toxizität einer Prüfchemikalie getestet werden.
Apparatur
14. Sämtliche Geräte, die mit dem Prüfmedium in Berührung kommen, müssen aus Glas oder einem sonstigen chemisch inerten Material bestehen. Die zur Kultivierung und für die Tests verwendeten Glasgeräte müssen steril sein und von chemischen Verunreinigungen befreit werden, die in das Prüfmedium gelangen könnten. Die Prüfgefäße müssen so groß sein, dass die Fronds der verschiedenen Kolonien in den Kontrollgefäßen wachsen können, ohne sich am Ende der Testdauer zu überlagern. Es ist unerheblich, ob die Wurzeln den Boden der Prüfgefäße berühren, in jedem Fall sind jedoch eine Mindesttiefe von 20 mm und ein Mindestvolumen von 100 ml pro Prüfgefäß zu empfehlen. Die Art der Prüfgefäße ist nicht entscheidend, sofern diese Anforderungen erfüllt sind. Bewährt haben sich Bechergläser, Kristallisierungsschalen und Petrischalen mit geeigneten Abmessungen. Die Prüfgefäße werden abgedeckt, um die Verdunstung und zufällige Verunreinigungen zu minimieren und trotzdem den erforderlichen Luftaustausch zu ermöglichen. Die Prüfgefäße und insbesondere die verwendeten Abdeckungen dürfen keine Schatten erzeugen und keine Änderungen des Lichtspektrums bewirken.
15. Kulturen und Prüfgefäße dürfen nicht zusammen gelagert werden. Daher werden am besten getrennte Wachstumskammern bzw. getrennte Inkubatoren verwendet oder getrennte Räume genutzt. Beleuchtung und Temperatur müssen kontrolliert werden können, und für Beleuchtung und Temperatur müssen gleichbleibende Werte aufrechterhalten werden können (siehe Nummern 35 und 36).
Testorganismus
16. Für diesen Test wird entweder Lemna gibba oder Lemna minor verwendet. In Anlage 2 sind Kurzbeschreibungen von in Toxizitätstests verwendeten Wasserlinsenarten zusammengestellt. Das Pflanzenmaterial kann aus einer Kultursammlung oder aus einem anderen Labor bezogen oder aus der Natur entnommen werden. Bei Entnahme aus der Natur sollten die Pflanzen mindestens acht Wochen vor der Verwendung in dem Medium kultiviert werden, das auch für die Tests verwendet wird. Orte in der freien Natur, aus denen die Ausgangskulturen entnommen werden, dürfen keinen offensichtlichen Quellen von Verunreinigungen ausgesetzt sein. Wenn die Kulturen aus einem anderen Labor oder aus einer Kultursammlung bezogen werden, sollten sie ebenfalls mindestens drei Wochen unter ähnlichen Bedingungen kultiviert werden. Angegeben werden sollten auch die Herkunft des Pflanzenmaterials, der Arten und des Klons (wenn bekannt), die für die Tests verwendet werden.
17. Für die Tests werden Monokulturen verwendet, die keine sichtbaren Verunreinigungen durch andere Organismen als Algen und Protozoen aufweisen. Gesunde Pflanzen der Art L. minor bestehen aus Kolonien mit zwei bis fünf Fronds; gesunde L.-gibba-Kolonien können bis zu sieben Fronds umfassen.
18. Qualität und Einheitlichkeit der für die Tests verwendeten Pflanzen haben erhebliche Auswirkungen auf das Ergebnis der Tests; entsprechend sorgfältig müssen die Pflanzen ausgewählt werden. Nach Möglichkeit sollten junge, rasch wachsende Pflanzen ohne sichtbare Läsionen oder Verfärbungen (Chlorose) verwendet werden. Hochwertige Kulturen weisen einen hohen Anteil an Kolonien mit mindestens zwei Fronds auf. Zahlreiche einzelne Fronds deuten auf Umweltstress hin (z.B. auf Nährstoffmangel); Pflanzenmaterial aus diesen Kulturen sollte für die Tests nicht verwendet werden.
Kultivierung
19. Um den Kultivierungsaufwand zu reduzieren (z.B. wenn über einen bestimmten Zeitraum keine Tests mit Lemna vorgesehen sind), können die Kulturen bei verringerter Beleuchtung und niedrigerer Temperatur (4-10 ° C) gelagert werden. Nähere Informationen zur Kultivierung sind Anlage 3 zu entnehmen. Bei offensichtlichen Anzeichen für Verunreinigungen durch Algen oder sonstige Organismen muss eine Oberflächensterilisation einer Teilprobe der Lemna-Fronds vorgenommen werden und anschließend eine Übertragung in ein frisches Medium erfolgen (siehe Anlage 3). In diesem Fall sollte die verbleibende verunreinigte Kultur verworfen werden.
20. Mindestens sieben Tage vor Durchführung der Tests wird eine hinreichende Anzahl an Kolonien keimfrei in ein frisches steriles Medium gebracht und 7-10 Tage bei Testbedingungen kultiviert.
Prüfmedium
21. Für Lemna minor und Lemna gibba werden jeweils die im Folgenden genannten Medien empfohlen. Wenn vermutet wird, dass das Medium mit der Prüfchemikalie reagieren und die Toxizitätswirkung beeinflussen könnte, ist sorgfältig zu prüfen, ob eine pH-Pufferlösung zum Prüfmedium gegeben werden muss (beim L.- minor-Medium MOPS (4-Morpholinpropan-Sulfonsäure, CAS-Nr: 1132-61-2) und beim L.-gibba-Medium NaHCO3). Das Steinberg-Medium (9) ist ebenfalls akzeptabel, wenn die Validitätskriterien erfüllt werden.
22. Zur Kultivierung von L. minor und für Tests mit L. minor wird eine Modifizierung des SIS-Lemna-Nährmediums (SIS = schwedisches Standardmedium) empfohlen. Die Zusammensetzung dieses Mediums ist Anlage 4 zu entnehmen.
23. Zur Kultivierung von L. gibba und für Tests mit L. gibba wird das Nährmedium 20X - AAP (siehe Anlage 4) empfohlen.
24. Das in Anlage 4 beschriebene Steinberg-Medium ist für L. minor ebenfalls geeignet, kann aber auch für L. gibba verwendet werden, wenn die Validitätskriterien erfüllt sind.
Testlösungen
25. Die Testlösungen werden gewöhnlich durch Verdünnung einer Stammlösung hergestellt. Zum Herstellen von Stammlösungen der Prüfchemikalie wird die Chemikalie im Allgemeinen im Nährmedium gelöst.
26. Die höchste getestete Konzentration der Prüfchemikalie sollte in der Regel die Wasserlöslichkeit der Chemikalie bei den jeweiligen Testbedingungen nicht überschreiten. Allerdings wird darauf hingewiesen, dass Lemna spp. auf der Oberfläche treiben und Chemikalien ausgesetzt werden könnten, die sich am Übergang zwischen Wasser und Umgebungsluft sammeln (z.B. schlecht wasserlösliche oder hydrophobe Chemikalien oder oberflächenaktive Chemikalien). Unter diesen Umständen besteht eine Belastung durch nicht in der Lösung enthaltene Materialien, und die Testkonzentrationen können je nach den Merkmalen der Prüfchemikalie die Wasserlöslichkeit überschreiten. Bei Prüfchemikalien mit geringerer Wasserlöslichkeit muss unter Umständen mit einem organischen Lösungsmittel oder einem Dispergiermittel eine konzentrierte Stammlösung oder eine Dispersion der Chemikalie hergestellt werden, damit leichter die exakten Mengen der Prüfchemikalie zum Prüfmedium hinzugegeben werden können und damit die Dispergierung und die Auflösung der Chemikalie begünstigt wird. Die Verwendung dieser Materialien sollte unbedingt vermieden werden. Durch die Verwendung der Lösungsmittel oder Dispergiermittel sollte keine Phytotoxizität entstehen. Häufig verwendete Lösungsmittel, die bei Konzentrationen bis zu 100 µl/l keine phototoxische Wirkung haben, sind z.B. Aceton und Dimethylformamid. Wenn ein Lösungsmittel oder ein Dispergiermittel verwendet wird, muss die Endkonzentration protokolliert und auf ein Minimum ( ≤ 100 µl/l) beschränkt werden; alle behandelten Proben und die Kontrollproben müssen das Lösungsmittel bzw. das Dispergiermittel in derselben Konzentration enthalten. Weitere Informationen zur Verwendung von Dispergiermitteln sind Quelle (8) zu entnehmen.
Test- und Kontrollgruppen
27. Die vorherige Kenntnis der Toxizität der Prüfchemikalie für Lemna (z.B. aufgrund eines Vorversuchs) erleichtert die Auswahl geeigneter Testkonzentrationen. Beim definitiven Toxizitätstest werden in der Regel mindestens fünf Testkonzentrationen in einer geometrischen Reihe angeordnet. Der Abstandsfaktor zwischen den Testkonzentrationen beträgt höchstens 3,2; bei flachen Konzentrations-Reaktionskurven kommen jedoch auch höhere Werte in Betracht. Die Verwendung von weniger als fünf Konzentrationen muss begründet werden. Für jede Testkonzentration sind mindestens drei Replikate zu verwenden.
28. Beim Festlegen des Testkonzentrationsbereichs (zur Bereichsermittlung und/oder für den definitiven Toxizitätstest) sind folgende Punkte zu berücksichtigen:
- Um ein angemessenes Konfidenzintervall sicherzustellen, müssen bei der Bestimmung eines ECx-Wertes die Testkonzentrationen so gewählt werden, dass der ECx-Wert eingeschlossen ist. Bei der Ermittlung von EC50 beispielsweise muss die höchste Testkonzentration größer als EC50 sein. Wenn der EC50-Wert außerhalb des Testkonzentrationsbereichs liegt, sind die entsprechenden Konfidenzintervalle groß, und das verwendete statistische Modell ist eventuell nicht geeignet.
- Wenn die LOEC oder die NOEC bestimmt werden sollen, muss die niedrigste Testkonzentration so gering sein, dass das Wachstum nicht signifikant kleiner als das Wachstum der Kontrollgruppe ist. Außerdem muss die höchste Testkonzentration so hoch sein, dass das Wachstum signifikant geringer ist als das Wachstum der Kontrollgruppe. Ansonsten muss der Test mit einem anderen Konzentrationsbereich wiederholt werden (wenn die höchste Konzentration nicht an der Löslichkeitsgrenze bzw. bei der höchstens erforderlichen Grenzkonzentration [z.B. 100 mg/l- 1] liegt).
29. Die Tests beinhalten jeweils Kontrollen, bei denen das gleiche Nährmedium, die gleiche Anzahl an Fronds und Kolonien und die gleichen Umgebungsbedingungen wie in den Prüfgefäßen gegeben sind und nur die Prüfchemikalie fehlt. Wenn ein zusätzliches Lösungsmittel oder Dispergiermittel verwendet wird, muss eine zusätzliche Kontrolle mit der gleichen Konzentration des Lösungsmittel/Dispergiermittel wie in den Prüfansätzen getestet werden. Die Anzahl der Kontrollgefäße zur Durchführung von Replikaten (sowie ggf. der Lösungsmittelgefäße) muss mindestens identisch mit der Anzahl der für die verschiedenen Testkonzentrationen verwendeten Gefäße sein; im Idealfall sollten sogar doppelt so viele Gefäße verwendet werden.
30. Wenn die NOEC nicht bestimmt werden muss, kann das Prüfprotokoll geändert werden, indem die Anzahl der Konzentrationen erhöht und die Anzahl der Replikate verringert wird. Allerdings müssen mindestens drei Kontrollreplikate verwendet werden.
Exposition
31. Kolonien mit zwei bis vier sichtbaren Fronds werden unter keimfreien Bedingungen aus der Impfkultur übertragen und zufällig den Prüfgefäßen zugewiesen. Die Prüfgefäße enthalten insgesamt jeweils neun bis zwölf Fronds. Die Anzahl der Fronds und Kolonien muss in allen Prüfgefäßen identisch sein. Erfahrungen mit dieser Methode sowie Daten aus Ringtests haben gezeigt, dass drei Replikate pro Behandlung, wobei jedes Replikat anfänglich neun bis zwölf Fronds enthält, hinreichend sind, um Unterschiede hinsichtlich der Wachstumshemmungen in der Größenordnung von ca. 4 bis 7 % aufgrund der Wachstumsrate (pro Zellertrag 10 bis 15 % berechnet) zwischen den Behandlungen feststellen zu können (7).
32. Die Prüfgefäße müssen randomisiert im Inkubator angeordnet werden, um die Auswirkungen räumlich unterschiedlicher Lichtintensitäten und Temperaturen zu minimieren. Außerdem sind die Gefäße blockweise anzuordnen oder zufällig umzustellen, wenn die Messungen vorgenommen werden (bzw. noch häufiger).
33. Wenn aufgrund eines vorläufigen Stabilitätstests anzunehmen ist, dass die Prüfchemikalienkonzentration nicht über die gesamte Testdauer (7 Tage) aufrechterhalten werden kann (d. h. wenn die gemessene Konzentration unter 80 % der gemessenen Ausgangskonzentration fällt), wird ein semistatischer Test empfohlen. In diesem Fall werden die Kolonien während der Testdauer mindestens zweimal (z.B. an den Tagen 3 und 5) in frisch hergestellte Test- und Kontrolllösungen gegeben. Wie häufig die Lösungen dem frischen Medium ausgesetzt werden, hängt von der Stabilität der Prüfchemikalie ab. Bei sehr instabilen oder flüchtigen Chemikalien ist unter Umständen eine häufigere Exposition erforderlich, um die Konzentrationen annähernd konstant zu halten. Unter gewissen Umständen kann auch die Durchführung eines Durchflusstests erforderlich sein (8)(10).
34. Das Expositionsszenario beim Besprühen wird in dieser Prüfmethode nicht berücksichtigt; diesbezüglich wird auf Quelle (11) verwiesen.
Inkubationsbedingungen
35. Durch kontinuierliche fluoreszierende Beleuchtung mit warmem oder kaltweißem Licht wird eine Lichtintensität hergestellt, die bei Messung unter photosynthetisch aktiver Strahlung (400-700 nm) an Punkten jeweils in demselben Abstand von der Lichtquelle wie die Lemna-Fronds bei 85-135 µE·m- 2s- 1 liegt (entsprechend etwa 6.500-10.000 lx). Abweichungen von der gewählten Lichtintensität dürfen im Testbereich höchstens ± 15 % betragen. Dabei ist zu beachten, dass die Messwerte von der Methode zur Feststellung und zur Messung der Lichtintensität (insbesondere vom Sensortyp) abhängen. Kugelförmige Sensoren (die auf Licht aus allen Winkeln über und unter der Messebene reagieren) sowie 'Kosinus'-Sensoren (die auf Licht aus allen Winkeln über der Messebene ansprechen) sind gegenüber unidirektionalen Sensoren zu bevorzugen, da diese Sensoren bei Mehrpunkt-Lichtquellen des hier beschriebenen Typs höhere Messwerte ergeben.
36. Die Temperatur der Prüfgefäße beträgt 24 ± 2 °C. Der pH-Wert des Kontrollmediums darf während des Tests höchstens um 1,5 Einheiten ansteigen. Auch bei Abweichungen von mehr als 1,5 Einheiten sind Testergebnisse dann nicht ungültig, wenn nachgewiesen werden kann, dass die Validitätskriterien erfüllt sind. Erhöhte Sorgfalt ist bei der Beurteilung von Verschiebungen des pH-Wertes in Sonderfällen geboten (z.B. beim Testen instabiler Chemikalien oder beim Testen von Metallen). Weitere Informationen in diesem Zusammenhang sind Quelle (8) zu entnehmen.
Dauer
37. Der Test wird sieben Tage nach Einsetzen der Pflanzen in die Prüfgefäße beendet.
Messungen und analytische Bestimmungen
38. Bei Beginn des Tests wird die Anzahl der in den Prüfgefäßen enthaltenen Fronds ermittelt und protokolliert; zu zählen sind alle herausragenden, deutlich erkennbaren Fronds. Die Anzahl der normal oder anomal aussehenden Fronds ist bei Beginn des Tests, alle drei Tage während der Expositionsdauer (d. h. binnen des Zeitraums von sieben Tagen mindestens zweimal) und am Ende des Tests zu bestimmen. Änderungen in der Entwicklung der Pflanzen (z.B. Änderungen der Größe oder des Aussehens der Fronds, Anzeichen für eine Nekrose, Chlorose oder Aufwölbungen, das Aufbrechen von Kolonien oder der Verlust der Schwimmfähigkeit sowie Veränderungen der Wurzellänge oder der sonstigen Beschaffenheit der Wurzeln) sind zu protokollieren. Wesentliche Merkmale des Prüfmediums (z.B. Vorliegen nicht gelösten Materials oder Algenwachstum im Prüfgefäß) werden ebenfalls vermerkt.
39. Ergänzend zur Ermittlung der Frondzahl während des Tests sind auch die Auswirkungen der Prüfchemikalie auf eine (oder mehrere) der folgenden Messvariablen zu bewerten:
- Gesamtfläche der Fronds,
- Trockenmasse,
- Frischmasse.
40. Die Gesamtfläche der Fronds hat den Vorteil, dass sie für jedes einzelne Prüfgefäß und für jedes einzelne Kontrollgefäß jeweils bei Beginn des Tests, während der Durchführung des Tests und am Ende des Tests bestimmt werden kann. Die Trockenmasse und die Frischmasse werden bei Beginn des Tests an einer Probe der Impfkultur ermittelt, die typisch für das bei Beginn des Tests verwendete Material ist; eine weitere Feststellung erfolgt am Ende des Tests anhand des Pflanzenmaterials jeweils aus den Prüfgefäßen und aus den Kontrollgefäßen. Wenn die Frondfläche nicht gemessen wird, ist eher die Trockenmasse als die Frischmasse zu ermitteln.
41. Die Gesamtfläche der Fronds, die Trockenmasse und die Frischmasse können wie folgt bestimmt werden:
- Gesamtfläche der Fronds: Die Gesamtfläche der Fronds aller Kolonien kann durch Bildanalyse ermittelt werden. Eine Silhouette des Prüfgefäßes und der Pflanzen kann mit einer Videokamera erfasst werden. Dazu wird das Gefäß auf einen Leuchtkasten gestellt; das dort aufgenommene Bild wird anschließend digitalisiert. Durch die Kalibrierung mit flachen Verläufen bekannter Flächen kann dann die Gesamtfläche der Fronds im Prüfgefäß bestimmt werden. Dabei ist darauf zu achten, dass Störungen durch den Rand des Prüfgefäßes ausgeschlossen werden. Ein alternatives, aber aufwendigeres Verfahren besteht darin, Prüfgefäße und Pflanzen zu fotokopieren und die entsprechenden Silhouetten der Kolonien auszuschneiden; anschließend wird die jeweilige Fläche mit einem Blattflächen-Analysator oder mit Millimeterpapier bestimmt. Geeignet sind unter Umständen aber auch andere Verfahren (z.B. die Ermittlung des Papiergewicht-Verhältnisses zwischen der Fläche der Kolonie-Silhouette und der Fläche der jeweils zugrunde gelegten Einheit).
- Trockenmasse: Alle Kolonien werden aus den Prüfgefäßen entnommen und mit destilliertem oder entionisiertem Wasser gespült. Durch anschließendes Ablöschen wird überschüssiges Wasser entfernt; danach werden die Proben bei 60 °C auf ein konstantes Gewicht getrocknet. Wurzelreste werden einbezogen. Die Trockenmasse wird mit einer Genauigkeit von mindestens 0,1 mg angegeben.
- Frischmasse: Alle Kolonien werden in zuvor gewogene Röhrchen aus Polystyrol (oder einem sonstigen inerten Material) mit feinen Löchern (1 mm) im gerundeten Boden gesetzt. Anschließend werden die Röhrchen bei Raumtemperatur 10 Minuten mit 3.000 Umdrehungen/min. zentrifugiert. Die Röhrchen mit den nun getrockneten Kolonien werden noch einmal gewogen; danach wird die Frischmasse durch Subtraktion des Gewichts der leeren Röhrchen bestimmt.
Häufigkeit der Messungen und der analytischen Bestimmungen
42. Bei statischen Tests wird jeweils bei Beginn und am Ende des Tests der pH-Wert der behandelten Lösungen gemessen. Bei semistatischen Tests wird für alle Batches der ,frischen" Testlösung jeweils vor den Erneuerungen der pH-Wert ermittelt; außerdem ist der pH-Wert der ,verbrauchten' Lösungen zu bestimmen.
43. Die Lichtintensität wird in der Wachstumskammer, im Inkubator oder im jeweiligen Raum in dem Abstand von der Lichtquelle gemessen, der auch bei den Lemna-Fronds gegeben ist. Während des Tests wird mindestens eine Messung vorgenommen. Die Temperatur des Mediums in einem Surrogatgefäß unter den gleichen Bedingungen wie in der Wachstumskammer bzw. im Inkubator oder im jeweiligen Raum ist mindestens täglich zu protokollieren.
44. Während des Tests wird die Konzentration der Prüfchemikalie in geeigneten Intervallen bestimmt. Bei statischen Tests ist die Konzentration mindestens bei Beginn des Tests und am Ende des Tests zu ermitteln.
45. Bei semistatischen Tests, bei denen davon ausgegangen wird, dass die Konzentration der Prüfchemikalie nicht im Bereich von ± 20 % der Nominalkonzentration aufrechterhalten werden kann, müssen alle frisch hergestellten Testlösungen sowie alle Lösungen jeweils nach der Erneuerung analysiert werden (siehe Nummer 33). Bei Tests, bei denen die gemessene Ausgangskonzentration der Prüfchemikalie zwar nicht ± 20 % der Nominalkonzentration beträgt, für die aber hinreichend nachgewiesen werden kann, dass die Ausgangskonzentrationen wiederholbar und stabil sind (d. h. dass die Konzentrationen im Bereich von 80-120 % der Ausgangskonzentration liegen), sind chemische Bestimmungen nur bei der höchsten und der niedrigsten Konzentration erforderlich. In jedem Fall brauchen die Prüfchemikalienkonzentrationen für alle Testkonzentrationen vor der Erneuerung jeweils nur bei einem einzigen Replikat (bzw. bei Gefäßen mit zusammengefassten Replikaten jeweils bei nur einem Gefäß) erneut bestimmt zu werden.
46. Bei Durchflusstests ist ähnlich zu verfahren, wie bei den semistatischen Tests, d. h. Analysen sind jeweils bei Beginn des Tests, in der Mitte und am Ende des Tests durchzuführen; Messungen der ,verbrauchten" Lösungen sind jedoch nicht erforderlich. Bei diesem Testtyp wird der Durchfluss des Verdünnungsmittels und der Prüfchemikalie oder der Prüfchemikalien-Stammlösung täglich geprüft.
47. Wenn nachgewiesen wird, dass die Konzentration der Prüfchemikalie während der gesamten Testdauer zufriedenstellend in Höhe von ± 20 % der Nominalkonzentration oder der gemessenen Ausgangskonzentration aufrechterhalten werden konnte, können die Ergebnisse auch ausgehend von den Nominalwerten bzw. von den gemessenen Ausgangswerten analysiert werden. Beträgt die Abweichung von der Nominalkonzentration oder von der gemessenen Ausgangskonzentration mehr als ± 20 %, sollte bei der Analyse der Ergebnisse vom geometrischen Mittel der Konzentration während der Expositionsdauer oder von Modellen ausgegangen werden, die den Rückgang der Prüfchemikalienkonzentration beschreiben (8).
Limit-Test
48. Unter bestimmten Umständen, z.B. wenn ein vorläufiger Test darauf hindeutet, dass die Prüfchemikalie bei Konzentrationen bis zu 100 mg/l bzw. bis zur Löslichkeitsgrenze im Prüfmedium (maßgeblich ist die jeweils niedrigere Konzentration) keine toxische Wirkung hat, kann ein Limit-Test durchgeführt werden, in dem die Reaktionen einer Kontrollgruppe und einer Behandlungsgruppe (100 mg/l bzw. eine mit der Löslichkeitsgrenze identische Konzentration) verglichen werden. Es wird nachdrücklich empfohlen, diese Tests durch Analysen der Expositionskonzentration zu verifizieren. Alle oben beschriebenen Testbedingungen und Validitätskriterien beziehen sich auf einen Limit-Test; allerdings sollte die Anzahl der behandelten Replikate mindestens doppelt so hoch sein. Das Wachstum der Kontrollgruppe und der Behandlungsgruppe kann mit einem statistischen Test zum Vergleich der Mittelwerte analysiert werden (z.B. mit einem Student-t-Test).
Verdopplungszeit
49. Um die Dauer bis zur Verdopplung der Frondzahl (Td) zu bestimmen und um sicherzustellen, dass dieses Validitätskriterium von der Studie erfüllt wird (siehe Nummer 12), sind die Daten der Kontrollgefäße in die folgende Gleichung einzusetzen:
Td = ln 2/µ
Dabei steht µ für die durchschnittliche spezifische Wachstumsrate, die wie unter den Nummern 54 und 55 beschrieben bestimmt wurde.
Reaktionsvariablen
50. Mit der Prüfung sollen die Auswirkungen der Prüfchemikalie auf das vegetative Wachstum von Lemna bestimmt werden. Diese Prüfmethode beschreibt zwei Reaktionsvariablen, da in unterschiedlichen Rechtsordnungen unterschiedliche Präferenzen und rechtliche Anforderungen bestehen. Damit die Testergebnisse in allen Rechtsordnungen anerkannt werden können, sind die Auswirkungen mithilfe der beiden im Folgenden beschriebenen Reaktionsvariablen a und b zu auszuwerten.
- Durchschnittliche spezifische Wachstumsrate: Diese Reaktionsvariable wird aufgrund von Veränderungen der Frondzahlen-Logarithmen sowie ausgehend von den Veränderungen der Logarithmen sonstiger Messparameter der Kontrollen und der einzelnen Behandlungsgruppen (gesamte Frondfläche, Trockenmasse oder Frischmasse) während eines bestimmten Zeitraums (jeweils pro Tag ausgedrückt) berechnet. Gelegentlich wird diese Wachstumsrate auch als relative Wachstumsrate bezeichnet (12).
- Zellertrag: Diese Reaktionsvariable wird ausgehend von Änderungen der Frondzahl sowie aufgrund von Änderungen anderer Messparameter der Kontrollen und der einzelnen Behandlungsgruppen (gesamte Frondfläche, Trockenmasse oder Frischmasse) bis zum Ende der Testdauer berechnet.
51. Es wird darauf hingewiesen, dass die mit diesen beiden Reaktionsvariablen berechneten Toxizitätswerte nicht vergleichbar sind; der entsprechende Unterschied muss bei der Verwendung der Testergebnisse berücksichtigt werden. Die mit der durchschnittlichen spezifischen Wachstumsrate (ErCx) berechneten Werte für ECx werden im Allgemeinen höher sein als die anhand des Zellertrags (EyCx) ermittelten Werte, wenn die für diese Testmethode vorgesehenen Bedingungen eingehalten werden; dies ist auf die unterschiedliche mathematische Grundlage der beiden Berechnungsverfahren zurückzuführen. Die auftretenden Unterschiede sollten jedoch nicht als Anzeichen für eine unterschiedliche Empfindlichkeit der beiden Reaktionsvariablen betrachtet werden; beide Werte sind einfach mathematisch verschieden. Das Konzept der durchschnittlichen spezifischen Wachstumsrate beruht auf dem im Allgemeinen exponentiellen Verlauf des Wasserlinsenwachstums bei nicht beschränkten Kulturen, bei denen die Toxizität aufgrund der Auswirkungen auf die Wachstumsrate ermittelt wird, ohne jedoch von der absoluten Höhe der jeweiligen Wachstumsrate der Kontrollprobe, von der Steigung der Konzentrations-Reaktionskurve oder von der Testdauer abhängig zu sein. Auf der Reaktionsvariable 'Zellertrag' beruhende Ergebnisse hingegen hängen von allen übrigen genannten Variablen ab. EyCx ist von der spezifischen Wachstumsrate der in den einzelnen Tests verwendeten Wasserlinsenarten sowie von der maximalen spezifischen Wachstumsrate abhängig, die je nach Art sowie sogar zwischen den einzelnen Klonen unterschiedlich sein kann. Diese Reaktionsvariable darf nicht verwendet werden, um die Empfindlichkeit von Algenarten oder auch nur verschiedener Klone gegenüber Giftstoffen zu vergleichen. Die Verwendung der durchschnittlichen spezifischen Wachstumsrate zur Schätzung der Toxizität wird in der Wissenschaft bevorzugt; bei dieser Prüfmethode werden jedoch auch Toxizitätsschätzungen aufgrund des Zellertrags berücksichtigt, um den derzeitigen rechtlichen Anforderungen einiger Rechtsordnungen Rechnung zu tragen.
52. Toxizitätsschätzungen müssen auf der Frondzahl sowie auf einer weiteren Messvariablen (gesamte Frondfläche, Trockenmasse oder Frischmasse) beruhen, da sich manche Chemikalien erheblich stärker auf andere Messvariablen auswirken können als die Frondzahl. Diese Auswirkungen würden nicht festgestellt, wenn ausschließlich die Frondzahl berechnet würde.
53. Die Anzahl der Fronds sowie alle sonstigen protokollierten Messvariablen (gesamte Frondfläche, Trockenmasse oder Frischmasse) werden zusammen mit den Konzentrationen der Prüfchemikalie für jede Messung tabellarisch zusammengestellt. Anschließende Datenanalysen z.B. zur Schätzung von LOEC-, NOEC- oder ECx- Werten sollten auf den Werten der einzelnen Replikate, nicht aber auf berechneten Mittelwerten der einzelnen Behandlungsgruppen beruhen.
Durchschnittliche spezifische Wachstumsrate
54. Die durchschnittliche spezifische Wachstumsrate in einem bestimmten Zeitraum wird als logarithmische Zunahme der Wachstumsvariablen (d. h. der Frondzahl und einer sonstigen Messvariablen (gesamte Frondfläche, Trockenmasse oder Frischmasse)) für die einzelnen Replikate der Kontrolllösungen und der behandelten Lösungen mit der nachstehenden Formel berechnet:
![]()
Dabei sind:
- µ i - j: durchschnittliche spezifische Wachstumsrate vom Zeitpunkt i bis zum Zeitpunkt j
- Ni: Messvariable im Prüfgefäß bzw. im Kontrollgefäß zum Zeitpunkt i
- Nj: Messvariable im Prüfgefäß bzw. im Kontrollgefäß zum Zeitpunkt j
- t: Zeitraum vom Zeitpunkt i bis zum Zeitpunkt j
Für jede Behandlungsgruppe und für jede Kontrollgruppe sind die mittlere Wachstumsrate und die Varianzschätzungen zu berechnen.
55. Die durchschnittliche spezifische Wachstumsrate wird für die gesamte Testdauer berechnet. (In der vorstehenden Formel bezeichnet 'i' den Beginn des Tests und der Zeitpunkt 'j' das Ende des Tests.) Für alle Konzentrationen der Testlösungen und der Kontrolllösungen sind ein Mittelwert für die durchschnittliche spezifische Wachstumsrate zu berechnen und die entsprechenden Varianzschätzungen vorzunehmen. Außerdem muss die abschnittsbezogene Wachstumsrate bestimmt werden, um die Auswirkungen der Prüfchemikalie während der Expositionsdauer beurteilen zu können (z.B. durch Prüfung der logarithmisch transformierten Wachstumskurven). Erhebliche Unterschiede zwischen der abschnittsbezogenen Wachstumsrate und der durchschnittlichen Wachstumsrate deuten auf Abweichungen vom konstanten exponentiellen Wachstum hin und erfordern eine genaue Überprüfung der Wachstumskurve. In diesem Fall würde ein vorsichtigerer Ansatz in einem Vergleich der spezifischen Wachstumsraten der behandelten Kulturen während der Dauer der maximalen Hemmung mit den spezifischen Wachstumsraten der Kontrolllösungen im selben Zeitraum bestehen.
56. Die Hemmung der Wachstumsrate in Prozent (Ir) kann anschließend für jede Testkonzentration (Behandlungsgruppe) nach der folgenden Formel berechnet werden:
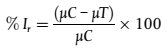
Dabei sind:
- % Ir: Hemmung der durchschnittlichen spezifischen Wachstumsrate in Prozent
- µC: Mittelwert für µ in der Kontrollgruppe
- µT: Mittelwert für µ in der Behandlungsgruppe Zellertrag
57. Die Auswirkungen auf den Zellertrag werden ausgehend von zwei Messvariablen, d. h. der Frondzahl und einer sonstigen Messvariablen (der gesamten Frondfläche, der Trockenmasse oder der Frischmasse) der jeweiligen Prüfgefäße am Anfang und am Ende des Tests bestimmt. Für die Trockenmasse und die Frischmasse wird die Ausgangsbiomasse bezogen auf eine Frond-Probe aus dem betreffenden Batch bestimmt, aus der die Prüfgefäße geimpft wurden (siehe Nummer 20). Für die Testkonzentrationen und für die Kontrolllösungen ist jeweils ein mittlerer Zellertrag zu berechnen; die Varianzen sind jeweils zu schätzen. Die prozentuale Hemmung des Zellertrags (% Iy) kann für die Behandlungsgruppen wie folgt berechnet werden:
![]()
Dabei sind:
- % Iy: Verringerung des Zellertrags in Prozent
- bC: Biomasse am Ende des Tests abzüglich der Biomasse der Kontrollgruppe am Anfang des Tests
- bT: Biomasse am Ende des Tests abzüglich der Biomasse der Behandlungsgruppe am Anfang des Tests Darstellung der Konzentrations-Reaktionskurven
58. Die Konzentrations-Reaktionskurven der mittleren Hemmung der Reaktionsvariablen in Prozent (Ir bzw. Iy berechnet gemäß der Anweisung unter Nummer 56 bzw. Nummer 57) bezogen auf die logarithmische Konzentration der Prüfchemikalie werden grafisch dargestellt.
Schätzung von ECx
59. Schätzungen der ECx-Werte (z.B. EC50) sollten sowohl auf der mittleren spezifischen Wachstumsrate (ErCx) als auch auf dem Zellertrag (EyCx) beruhen, und beide Werte sollten ihrerseits von der Frondzahl und von einer weiteren Messvariablen (gesamte Frondfläche, Trockenmasse oder Frischmasse) ausgehen, weil sich manche Prüfchemikalien unterschiedlich auf die Frondzahl und sonstige Messvariablen auswirken. Die gewünschten Toxizitätsparameter bestehen entsprechend aus vier ECx-Werten für alle berechneten Hemmkonzentrationen x: ErCx (Frondzahl); ErCx (gesamte Frondfläche, Trockenmasse oder Frischmasse); EyCx (Frondzahl) und EyCx (gesamte Frondfläche, Trockenmasse oder Frischmasse).
Statistische Verfahren
60. Ziel ist die Ermittlung einer quantitativen Konzentrations-Wirkungsbeziehung durch Regressionsanalyse. Im Anschluss an eine linearisierte Transformation der Reaktionsdaten (z.B. in Einheiten nach dem Probit-, Logit- oder Weibull-Modell) (13) kann eine gewichtete lineare Regression vorgenommen werden; nichtlineare Regressionsverfahren, mit denen die unvermeidlichen Unregelmäßigkeiten der Daten und Abweichungen von gleichförmigen Verteilungen besser verarbeitet werden können, werden jedoch bevorzugt. Im Bereich von null bzw. der vollständigen Hemmung können diese Unregelmäßigkeiten durch die Transformation vergrößert werden und die Analyse beeinträchtigen (13). Es wird darauf hingewiesen, dass Standard-Analysemethoden mit Probit-, Logit- oder Weibull-Transformationen für quantale Daten (z.B. Mortalität oder Überlebensraten) vorgesehen sind und zur Verwendung in Verbindung mit Wachstums- oder Zellertragsdaten entsprechend modifiziert werden müssen. Spezifische Verfahren zur Bestimmung von ECx-Werten aus kontinuierlichen Daten sind den Quellen (14), (15) und (16) zu entnehmen.
61. Für jede zu analysierende Reaktionsvariable sind aufgrund der Konzentrations-Wirkungsbeziehung ECx-Werte zu ermitteln. Nach Möglichkeit sollten für jeden ECx-Wert die 95- %-Konfidenzintervalle bestimmt werden. Die Qualität der Übereinstimmung der Reaktionsdaten mit dem Regressionsmodell sollte grafisch oder statistisch bewertet werden. Die Regressionsanalyse wird mit den Reaktionen der einzelnen Replikate (und nicht mit den Mittelwerten der Behandlungsgruppe) durchgeführt.
62. Schätzwerte für EC50 und für die Konfidenzintervalle können auch durch lineare Interpolation mit einem Bootstrapping-Algorithmus (17) erzielt werden, wenn die verfügbaren Regressionsmodelle/-methoden für die betreffenden Daten nicht geeignet sind.
63. Für eine Schätzung der LOEC und entsprechend auch der NOEC müssen die Mittelwerte der behandelten Lösungen durch Varianzanalyseverfahren (ANOVA) verglichen werden. Der Mittelwert der einzelnen Konzentrationen ist dann mit einer geeigneten Methode zur Durchführung von Mehrfachvergleichen bzw. zur Durchführung von Trendtests mit dem Mittelwert der Kontrollgruppe zu vergleichen. Dunnett- und Williams- Tests können hilfreich sein (18)(19)(20)(21). Die ANOVA-Annahme der Varianzhomogenität muss einer Überprüfung unterzogen werden. Die entsprechende Bewertung kann anhand einer grafischen Darstellung oder aufgrund eines formalen Tests vorgenommen werden (22). Geeignet sind Levene- und Bartlett-Tests. Wenn die Annahme der Varianzhomogenität nicht erfüllt ist, kann gelegentlich eine Korrektur durch logarithmische Datentransformation erfolgen. Bei außerordentlicher Varianzheterogenität, die durch Transformation nicht korrigiert werden kann, sollten Analysen durch Methoden wie z.B. Jonckheere-Trendtests (Stepdown) erwogen werden. Weitere Hinweise zur Bestimmung von NOEC-Werten sind Quelle (16) zu entnehmen.
64. Aufgrund neuer Forschungsergebnisse wird empfohlen, das Konzept der NOEC aufzugeben und durch Punktschätzungen von ECx-Werten zu ersetzen, die durch Regression ermittelt wurden. Für diesen Lemna-Test wurde noch kein geeigneter Wert für x definiert. Ein Bereich von 10 bis 20 % scheint jedoch geeignet (abhängig von der auswählten Reaktionsvariablen); vorzugsweise sollten sowohl EC10 als auch EC20 protokolliert werden.
Abschlussbericht
65. Der Prüfbericht muss folgende Informationen enthalten:
Prüfchemikalie:
- physikalische Beschaffenheit und physikalisch-chemische Eigenschaften einschließlich der Wasserlöslichkeitsgrenze;
- chemische Kenndaten (z.B. CAS-Nummer) einschließlich der Reinheit (Verunreinigungen).
Im Test verwendete Art:
- wissenschaftliche Bezeichnung, Klon (wenn bekannt) und Herkunft.
Prüfbedingungen:
- verwendetes Testverfahren (statisch, semistatisch oder Durchfluss);
- Datum des Testbeginns und Dauer des Tests;
- Prüfmedium;
- Beschreibung des Prüfprotokolls: Prüfgefäße und Abdeckungen, Lösungsvolumina, Anzahl der Kolonien und Fronds pro Prüfgefäß am Anfang des Tests;
- Testkonzentrationen (Nominalkonzentrationen bzw. gemessene Konzentrationen) und Anzahl der Replikate pro Konzentration;
- Methoden zur Herstellung von Stamm- und Testlösungen einschließlich der Verwendung von Lösungsmitteln und Dispergiermitteln;
- Temperatur während des Tests;
- Lichtquelle, Lichtintensität und Homogenität des Lichts;
- pH-Werte der Prüfmedien und der Kontrollmedien;
- Prüfchemikalienkonzentrationen und Analysemethode mit geeigneten Daten zur Qualitätsbewertung (Validierungsstudien, Standardabweichungen oder Konfidenzgrenzen der Analysen);
- Methoden zur Bestimmung der Frondzahl und sonstiger Messvariablen (z.B. Trockenmasse, Frischmasse oder Frondfläche);
- sämtliche Abweichungen von dieser Prüfmethode.
Ergebnisse:
- Ausgangsdaten: Anzahl der Fronds und sonstige Messvariablen der einzelnen Prüfgefäße und der Kontrollgefäße jeweils bei einer Beobachtung und Analyse;
- Mittelwerte und Standardabweichungen der einzelnen Messvariablen;
- Wachstumskurven bei den verschiedenen Konzentrationen (möglichst mit logarithmisch transformierter Messvariable, siehe Nummer 55);
- Verdopplungszeit/Wachstumsrate in der Kontrolllösung bezogen auf die Frondzahl;
- berechnete Reaktionsvariablen für alle behandelten Replikate mit Mittelwerten und dem Variationskoeffizienten für Replikate;
- grafische Darstellung der Beziehung zwischen Konzentration und Wirkung;
- Schätzungen der Endpunkte der Toxizität für die verschiedenen Reaktionsvariablen (z.B. EC50, EC10 und EC20) und entsprechende Konfidenzintervalle; wenn berechnet, sind die LOEC und/oder die NOEC sowie die zur jeweiligen Berechnung verwendeten statistischen Methoden anzugeben;
- bei Durchführung von Varianzanalysen (ANOVA) der Umfang der nachzuweisenden Auswirkungen (z.B. geringster signifikanter Unterschied);
- jegliche in behandelten Proben festgestellte Wachstumsstimulation;
- alle offensichtlichen Anzeichen einer Phytotoxizität sowie Beobachtungen an den Testlösungen;
- Diskussion der Ergebnisse einschließlich aller Auswirkungen auf das Testergebnis, die auf Abweichungen von dieser Prüfmethode zurückzuführen sind.
(1) ASTM International.(2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415- 91 (neu genehmigt 1998). S. 733-742. In: Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA.
(2) US EPA - United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., "Public draft". EPA 712-C-96-156.8 S.
(3) AFNOR - Association Française de Normalisation.(1996). XP T 90-337: Détermination de l'inhibition de la croissance de Lemna minor. 10 S.
(4) SSI - Swedish Standards Institute.(1995). Water quality - Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13.15 S. (Schwedisch).
(5) Environment Canada.(1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37 - 120 S.
(6) Environment Canada.(1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation.Canadian Wildlife Service, Technical Report Series No. 145.
(7) Sims, I., Whitehouse, P., und Lacey, R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ringtesting of draft OECD Test Guideline.R&D Technical Report EMA 003.WRc plc - Environment Agency.
(8) OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 23.Organisation for Economic Cooperation and Development, Paris.
(9) Internationale Organisation für Normung. ISO DIS 20079. Wasserbeschaffenheit - Bestimmung der toxischen Wirkung von Wasserinhaltsstoffen und Abwasser gegenüber Wasserlinsen (Lemna minor) - Wasserlinsen- Wachstumshemmtest.
(10) Walbridge C. T. (1977). A flowthrough testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory - Duluth, Minnesota 55804.US EPA Report No. EPA-600/3-77.108. September 1977.
(11) Lockhart, W.L., Billeck, B. N., und Baron, C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353 - 359.
(12) Huebert, D.B. and Shay J.M.(1993) Considerations in the assessment of toxicity using duckweeds.Environmental Toxicology and Chemistry, 12, 481-483.
(13) Christensen, E.R., "Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713-718.
(14) Nyholm, N. Sørensen, P.S., Kusk, K.O., und Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157-167.
(15) Bruce, R.D., und Versteeg, D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485-1494.
(16) OECD. (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Organisation for Economic Cooperation and Development, Paris.
(17) Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity:The ICp approach. National Effluent Toxicity Assessment center Technical Report 05-88. US EPA, Duluth, MN.
(18) Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096-1121.
(19) Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482-491.
(20) Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
(21) Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 519- 531.
(22) Brain, P., und Cousens, R. (1989). An equation to describe doseresponses where there is stimulation of growth at low doses. Weed Research, 29, 93-96.
| Begriffsbestimmungen | Anlage 1 |
Biomasse: Trockenmasse des in einer Population enthaltenen lebenden Materials; bei diesem Test werden typischerweise Surrogate für die betreffende Biomasse (z.B. Frondzahl oder Frondfläche) gemessen; entsprechend bezieht sich der Begriff ,Biomasse' auch auf diese Surrogatparameter.
Chemikalie: ein Stoff oder eine Mischung. Chlorose: Gelbfärbung des Blattmaterials.
Klon: ein Organismus oder eine Zelle, der bzw. die durch geschlechtslose Reproduktion aus einem einzelnen Organismus gewonnen wurde; aus demselben Klon gewonnene Organismen sind entsprechend genetisch identisch.
Kolonie: Gesamtheit der miteinander verbundenen Mutter- und Tochter-Fronds (gewöhnlich 2 bis 4); gelegentlich auch als Pflanze bezeichnet.
ECx: Konzentration der im Prüfmedium aufgelösten Prüfchemikalie, bei der sich binnen einer festgelegten Expositionsdauer eine Reduzierung des Wachstums von Lemna um x % (z.B. 50 %) ergibt. (Die Expositionsdauer ist ausdrücklich zu nennen, wenn die Dauer von der vollständigen oder normalen Testdauer abweicht.) Um einen von der Wachstumsrate oder vom Zellertrag abweichenden EC-Wert eindeutig zu kennzeichnen, wird die Bezeichnung ,ErC' für die Wachstumsrate und ,EyC' für den Zellertrag jeweils gefolgt von der verwendeten Messvariablen (z.B. ErC [ Frondzahl]) verwendet.
Durchflusstest: ein Test, bei dem die Testlösungen kontinuierlich ersetzt werden.
Frond: eine separate/einzelne ,blattartige" Struktur einer Wasserlinsen-Pflanze; kleinste reproduktionsfähige Einheit (d. h. einzelner Organismus).
Aufwölbungen: Fronds mit einer Wölbung oder Schwellung.
Wachstum: Zunahme der Messvariablen, z.B. Frondzahl, Trockenmasse, Feuchtmasse oder Frondfläche während der Testdauer.
Wachstumsrate (durchschnittliche spezifische Wachstumsrate): logarithmische Zunahme der Biomasse während der Expositionsdauer.
Niedrigste Konzentration mit beobachteter Wirkung (LOEC): niedrigste geprüfte Konzentration, bei der beobachtet wurde, dass die Chemikalie binnen einer bestimmten Expositionsdauer gegenüber der Kontrollprobe eine statistisch signifikante Wachstumsreduzierung bewirkt (bei p < 0,05); allerdings müssen sämtliche Testkonzentrationen über der LOEC schädliche Folgen haben, die mindestens den bei der LOEC beobachteten schädlichen Folgen gleichwertig sind. Wenn diese beiden Bedingungen nicht erfüllt werden können, ist umfassend darzulegen, warum die LOEC (und entsprechend die NOEC) gewählt wurde.
Messvariablen: alle Variablentypen, die gemessen werden, um mit mindestens einer Reaktionsvariablen den Endpunkt des Tests zu beschreiben; Messvariablen bei dieser Methode sind Frondzahl, Frondfläche, Frischmasse und Trockenmasse.
Monokultur: Kultur mit einer Pflanzenart.
Nekrose: totes (d. h. weißes oder mit Wasser durchfeuchtetes) Blattmaterial.
Höchste geprüfte Konzentration ohne beobachtete schädliche Wirkung (NOEC): Testkonzentration unmittelbar unterhalb der LOEC.
Phänotyp: zu beobachtende Merkmale eines Organismus, die durch Interaktion der Gene dieses Organismus mit seiner Umgebung bestimmt werden.
Reaktionsvariablen: Variablen für die geschätzte Toxizität, abgeleitet aus beliebigen gemessenen Variablen zur Beschreibung der Biomasse durch verschiedene Berechnungsmethoden; bei dieser Prüfmethode sind die Wachstumsraten und der Zellertrag Reaktionsvariablen, die aus Messvariablen wie z.B. Frondzahl, Frondfläche, Frischmasse oder Trockenmasse abgeleitet werden.
Semistatischer (Erneuerungs-)test: Test, bei dem die Testlösung während der Testdauer regelmäßig in bestimmten Intervallen erneuert wird.
Statischer Test: Testmethode, bei der die Testlösung während der Testdauer nicht erneuert wird. Prüfchemikalie: ein beliebiger Stoff oder eine Mischung, der bzw. die nach dieser Methode geprüft wird.
Endpunkt des Tests: beschreibt den allgemeinen Faktor, der bezogen auf die Kontrolle als Testziel durch die Prüfchemikalie verändert wird; bei dieser Prüfmethode wird als Endpunkt des Tests die Wachstumshemmung angenommen; diese kann durch verschiedene Reaktionsvariablen ausgedrückt werden, die jeweils auf mindestens einer Messvariablen beruhen.
Prüfmedium: gesamtes synthetisches Nährmedium, in dem die zu prüfenden Pflanzen wachsen, wenn sie der Prüfchemikalie ausgesetzt werden; die Prüfchemikalie wird im Allgemeinen im Prüfmedium aufgelöst.
Zellertrag: Wert einer Messvariablen zur Beschreibung der Biomasse am Ende der Expositionsdauer abzüglich der Messvariablen am Anfang der Expositionsdauer.
| Beschreibung Lemna spp. | Anlage 2 |
Da von unterschiedlichen Empfindlichkeiten der verschiedenen Arten auszugehen ist, sind ausschließlich Vergleiche der Empfindlichkeit jeweils einer einzigen Art annehmbar.
Beispiele für Lemna-Arten, die in Tests verwendet wurden: Artenreferenz
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2.Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys.Chem., 29: 935-941.
Lemna minor: United States Environmental Protection Agency (US EPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., 'Public draft'. EPA 712-C-96-156.8 S.
Association Française de Normalisation (AFNOR).(1996). XP T 90-337: Détermination de l'inhibition de la croissance de Lemna minor. 10 S.
Swedish Standards Institute (SIS).(1995). Water quality - Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13.15 S. (Schwedisch).
Lemna gibba: ASTM International.(2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415-91 (neu genehmigt 1998). S. 733-742.
United States Environmental Protection Agency (US EPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., "Public draft". EPA 712-C-96-156. 8 S.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch.Environ. Contam.Toxicol., 10:1959-1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol.Environ. Saf., 5:87-96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481- 483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds.Verh.-Int.Ver.Limnol., 19:2102-2111.
Bezugsquellen für Lemna-Arten
University of Toronto Culture Collection of Algae and Cyanobacteria
Department of Botany, University of Toronto
Toronto, Ontario, Kanada, M5S 3 B2
Telefon: +1-416-978-3641
Telefax:+1-416-978-5878
E-Mail: jacreman@botany.utoronto.ca
North Carolina State University
Forestry Dept
Duckweed Culture Collection Campus Box 8002
Raleigh, NC 27695-8002 United States
Telefon +1.919 515-7572 astomp@unity.ncsu.edu
Institute of Applied Environmental Research (ITM) Stockholm University
SE-106 91
Stockholm
SCHWEDEN
Telefon: +46 8.674 7240
Fax +46 8.674 7636
Umweltbundesamt (UBA)
FG III 3.4
Schichauweg 58 12307 Berlin
DEUTSCHLAND E-Mail: Lemna@uba.de
(1) Hillman, W.S.(1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221-287.
(2) Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanisches Inst. ETH, Stiftung Rubel, Zürich, Schweiz.
(3) Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82-991150-0-0. The Agricultural Research Council of Norway, University of Oslo.
(4) Wang, W.(1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1-14.
(5) Wang, W.(1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7-22.
| Haltung der Stammkultur | Anlage 3 |
Regelmäßig wird eine gewisse Anzahl junger, hellgrüner Pflanzen entnommen und mit einem keimfreien Verfahren in neue Kulturgefäße mit einem frischen Medium gebracht. Unter den hier empfohlenen kühleren Bedingungen können in Intervallen von bis zu drei Monaten Teilkulturen hergestellt werden.
In den Prüfungen werden chemische reine (mit Säure gereinigte) und sterile gläserne Kulturgefäße verwendet, die keimfrei zu handhaben sind. Bei einer Verunreinigung der Stammkultur (z.B. durch Algen oder Pilze) sind entsprechende Schritte zur Entfernung der verunreinigenden Organismen erforderlich. Algen und die meisten sonstigen verunreinigenden Organismen können durch eine Oberflächensterilisation entfernt werden. Von dem verunreinigten Pflanzenmaterial wird eine Probe genommen, und die Wurzeln werden abgeschnitten. Das Material wird kräftig in sauberem Wasser geschüttelt und dann 30 Sekunden bis 5 Minuten in eine 0,5 %ige Natriumhypochloridlösung (v/v) getaucht. Danach wird das Pflanzenmaterial mit sterilem Wasser gespült und in mehreren Schritten in Kulturgefäße jeweils mit frischem Nährmedium gebracht. Bei dieser Behandlung werden viele Fronds sterben, besonders bei längerer Expositionsdauer; einige der überlebenden Fronds sollten jedoch frei von Verunreinigungen sein. Diese Fronds können zur Impfung neuer Kulturen verwendet werden.
| Medien | Anlage 4 |
Schwedisches Standard-Lemna-Nährmedium (SIS)
- Die Stammlösungen I-V werden durch Autoklavieren (120 °C, 15 Minuten) oder durch Membranfiltration (Porengröße ca. 0,2 µm) sterilisiert.
- Die Stammlösung VI (sowie optional Stammlösung VII) ist ausschließlich durch Membranfiltration zu sterilisieren; diese Lösungen sollten nicht autoklaviert werden.
- Sterile Stammlösungen werden kühl und dunkel gelagert. Die Stammlösungen I-V sind nach sechs Monaten zu entsorgen; die Stammlösung VI (sowie optional Stammlösung VII) kann einen Monat gelagert werden.
| Stamm- lösung Nr. | Stoff | Konzentration in der Stammlösung (g/l) | Konzentration im hergestellten Medium(mg/·l) | Hergestelltes Medium | |
| Element | Konzentration (mg/·l) | ||||
| I | NaNO3 | 8,50 | 85 | Na; N | 32; 14 |
| KH2PO4 | 1,34 | 13,4 | K; P | 6,0; 2,4 | |
| II | MgSO4·7H2O | 15 | 75 | Mg; S | 7,4; 9,8 |
| III | CaCl2·2H2O | 7,2 | 36 | Ca; Cl | 9,8; 17,5 |
| IV | Na2CO3 | 4,0 | 20 | C | 2,3 |
| V | H3BO3 | 1,0 | 1,00 | B | 0,17 |
| MnCl2·4H2O | 0,20 | 0,20 | Mn | 0,056 | |
| Na2MoO4·2H2O | 0,010 | 0,010 | Mo | 0,0040 | |
| ZnSO0·7H2O | 0,050 | 0,050 | Zn | 0,011 | |
| CuSO4·5H2O | 0,0050 | 0,0050 | Cu | 0,0013 | |
| Co(NO3)2·6H2O | 0,010 | 0,010 | Co | 0,0020 | |
| VI | FeCl3·6H2O | 0,17 | 0,84 | Fe | 0,17 |
| Na2-EDTA 2H2O | 0,28 | 1,4 | - | - | |
| VII | MOPS (Puffer) | 490 | 490 | - | - |
Um einen Liter SIS-Medium herzustellen, werden die folgenden Inhaltsstoffe zu 900 ml entionisiertem Wasser hinzugegeben:
- 10 ml Stammlösung I
- 5 ml Stammlösung II
- 5 ml Stammlösung III
- 5 ml Stammlösung IV
- 1 ml Stammlösung V
- 5 ml Stammlösung VI
- 1 ml Stammlösung VII (optional)
Hinweis: Bei bestimmten Prüfchemikalien kann eine weitere Stammlösung VII (MOPS-Pufferlösung) erforderlich sein (siehe Nummer 11).
Der pH-Wert wird wahlweise mit 0,1 oder 1 mol HCl oder NaOH auf 6,5 ± 0,2 eingestellt; durch Zugabe von entionisiertem Wasser wird ein Volumen von einem Liter hergestellt.
Nährmedium 20X AAP
Die Stammlösungen werden in sterilem destilliertem oder entionisiertem Wasser hergestellt.
Sterile Stammlösungen werden kühl und dunkel gelagert. Unter diesen Bedingungen beträgt die Lagerfähigkeit der Stammlösungen mindestens 6-8 Wochen.
Für das Medium 20X AAP werden fünf Stamm-Nährlösungen (A1, A2, A3, B und C) hergestellt; dabei sind chemische Stoffe mit Reagenzienqualität zu verwenden. Jeweils 20 ml der Stamm-Nährlösungen werden zu etwa 850 ml entionisiertem Wasser hinzugegeben, um das Nährmedium herzustellen. Der pH-Wert wird wahlweise mit 0,1 oder 1 mol HCl oder NaOH auf 7,5 ± 0,1 eingestellt; durch Zugabe von entionisiertem Wasser wird ein Volumen von einem Liter hergestellt. Anschließend wird das Medium durch einen Membranfilter mit einer Porengröße von (etwa) 0,2 µm in ein steriles Behältnis gefiltert.
Das für die Prüfung vorgesehene Nährmedium ist 1-2 Tage vor der Verwendung herzustellen, damit sich der pH- Wert stabilisieren kann. Der pH-Wert des Nährmediums muss vor der Verwendung geprüft und ggf. durch Zugabe von 0,1 oder 1 mol NaOH oder HCl wie oben beschrieben korrigiert werden.
| Stamm- lösung Nr. | Stoff | Konzentration in der Stammlösung (g/·l) (*) | Konzentration im hergestellten Medium (mg/·l) * | Hergestelltes Medium | |
| Element | Konzentration (mg/·l) * | ||||
| A1 | NaNO3 | 26 | 510 | Na; N | 190; 84 |
| MgCl2·6H2O | 12 | 240 | Mg | 58,08 | |
| CaCl2·2H2O | 4.4 | 90 | Ca | 24,04 | |
| A2 | MgSO4·7H2O | 15 | 290 | S | 38,22 |
| A3 | K2HPO4·3H2O | 1,4 | 30 | K; P | 9,4; 3,7 |
| B | H3BO3 | 0,19 | 3,7 | B | 0,65 |
| MnCl2·4H2O | 0,42 | 8,3 | Mn | 2,3 | |
| FeCl3·6H2O | 0,16 | 3,2 | Fe | 0,66 | |
| Na2EDTA·2H2O | 0,30 | 6,0 | - | - | |
| ZnCl2 | 3,3 mg/l | 66 µg/l | Zn | 31 µg/l | |
| CoCl2·6H2O | 1,4 mg/l | 29 µg/l | Co | 7,1 µg/l | |
| Na2MoO4·2H2O | 7,3 mg/l | 145 µg/l | Mo | 58 µg/l | |
| CuCl2·2H2O | 0,012 mg/l | 0,24 µg/l | Cu | 0,080 µg/l | |
| C | NaHCO3 | 15 | 300 | Na; C | 220; 43 |
| *) Wenn nicht anders angegebe
Fußnote: Die theoretisch geeignete Bicarbonat-Endkonzentration (bei der eine nennenswerte Anpassung des pH-Werts nicht erforderlich ist) liegt bei 15 mg/l (und nicht bei 300 mg/l). Trotzdem wird das Medium 20X-AAP - auch im Ringtest dieser Leitlinie - in einer Konzentration von 300 mg/l verwendet. (I. Sims, P. Whitehouse und R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ringtesting of draft OECD Test Guideline. R&D Technical Report EMA 003.WRc plc - Environment Agency.) | |||||
STEINBERG-Medium (nach ISO 20079)
Konzentrationen und Stammlösungen
Das modifizierte Steinberg-Medium ist in ISO 20079 nur für Lemna minor vorgesehen (da dort ausschließlich Lemna minor zugelassen wird); in Tests wurden gute Ergebnisse aber auch mit Lemna gibba erzielt.
Bei der Herstellung des Mediums werden chemische Stoffe in Reagenzien- oder Analysequalität und entionisiertes Wasser verwendet.
Das Nährmedium ist aus Stammlösungen oder aus dem 10fach konzentrierten Medium herzustellen, damit ohne Ausfällungen eine größtmögliche Konzentration des Mediums erzielt werden kann.
Tabelle 1: STEINBERG-Medium mit stabilisiertem pH-Wert (modifiziert nach Altenburger)
| Bestandteil | Nährmedium | ||
| Makroelemente | Molmasse | mg/l | mmol/l |
| KNO3 | 101,12 | 350,00 | 3,46 |
| Ca(NO3)2 · 4H2O | 236,15 | 295,00 | 1,25 |
| KH2PO4 | 136,09 | 90,00 | 0,66 |
| K2HPO4 | 174,18 | 12,60 | 0,072 |
| MgSO4 · 7H2O | 246,37 | 100,00 | 0,41 |
| Bestandteil | Nährmedium | ||
| Mikroelemente | Molmasse | µg/l | µmol/l |
| H3BO3 | 61,83 | 120,00 | 1,94 |
| ZnSO4 · 7H2O | 287,43 | 180,00 | 0,63 |
| Na2MoO4 · 2H2O | 241,92 | 44,00 | 0,18 |
| MnCl2 · 4H2O | 197,84 | 180,00 | 0,91 |
| FeCl3 · 6H2O | 270,21 | 760,00 | 2,81 |
| EDTA-Dinatrium-Dihydrat | 372,24 | 1.500,00 | 4,03 |
Tabelle 2: Stammlösungen (Makroelemente)
| 1. Makroelemente (50fach konzentriert) | g/l |
| Stammlösung 1: | |
| KNO3 | 17,50 |
| KH2PO4 | 4,5 |
| K2HPO4 | 0,63 |
| Stammlösung 2: | |
| MgSO4 · 7H2O | 5,00 |
| Stammlösung 3: | |
| Ca(NO3)2 · 4H2O | 14,75 |
Tabelle 3: Stammlösungen (Mikroelemente)
| 2. Mikroelemente (1.000fach konzentriert) | mg/l |
| Stammlösung 4: | |
| H3BO3 | 120,0 |
| Stammlösung 5: | |
| ZnSO4 · 7H2O | 180,0 |
| Stammlösung 6: | |
| Na2MoO4 · 2H2O | 44,0 |
| 2. Mikroelemente (1.000fach konzentriert) | mg/l |
| Stammlösung 7: | |
| MnCl2 · 4H2O | 180,0 |
| Stammlösung 8: | |
| FeCl3 · 6H2O | 760,00 |
| EDTA-Dinatrium-Dihydrat | 1.500,00 |
- Die Stammlösungen 2 und 3 sowie getrennt auch die Stammlösungen 4 bis 7 können gepoolt werden. (Dabei sind die jeweils erforderlichen Konzentrationen zu berücksichtigen.)
- Um die Lagerfähigkeit zu verlängern, sind die Stammlösungen 20 Minuten bei 121 °C zu autoklavieren oder einer Sterilfiltration (Porengröße 0,2 µm) zu unterziehen. Für die Stammlösung 8 wird eine Sterilfiltration (0,2 µm) nachdrücklich empfohlen.
Herstellung der Endkonzentration des STEINBERG-Mediums (modifiziert)
- Zu 20 ml der Stammlösungen 1, 2 und 3 (siehe Tabelle 2) werden etwa 900 ml entionisiertes Wasser zugegeben, um eine Ausfällung zu vermeiden.
- Von den Stammlösungen 4, 5, 6, 7 und 8 wird jeweils 1,0 ml hinzugegeben (siehe Tabelle 3).
- Der pH-Wert wird durch Zugabe eines minimalen Volumens einer NaOH- oder HCl-Lösung auf 5,5 ± 0,2 eingestellt.
- Anschließend werden die Lösungen mit Wasser auf ein Volumen von 1.000 ml aufgefüllt.
- Wenn die Stammlösungen sterilisiert werden und geeignetes Wasser verwendet wird, ist eine weitere Sterilisierung nicht mehr erforderlich. Wird das endgültige Medium sterilisiert, wird nach dem Autoklavieren (20 Minuten bei 121 °C) die Stammlösung 8 hinzugegeben.
Herstellung des 10fach konzentrierten STEINBERG-Mediums (modifiziert) zur Zwischenlagerung
- Zu 20 ml der Stammlösungen 1, 2 und 3 (siehe Tabelle 2) werden etwa 30 ml entionisiertes Wasser zugegeben, um eine Ausfällung zu vermeiden.
- Von den Stammlösungen 4, 5, 6, 7 und 8 wird jeweils 1,0 ml hinzugegeben (siehe Tabelle 3). Anschließend werden die Lösungen mit Wasser auf ein Volumen von 100 ml aufgefüllt.
- Wenn die Stammlösungen sterilisiert werden und geeignetes Wasser verwendet wird, ist eine weitere Sterilisierung nicht mehr erforderlich. Wird das endgültige Medium sterilisiert, wird nach dem Autoklavieren (20 Minuten bei 121 °C) die Stammlösung 8 hinzugegeben.
- Der pH-Wert des Mediums in der Endkonzentration beträgt 5,5 ± 0,2."
 | weiter. |
...
X
⍂
↑
↓
