 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2017, Lebensmittel - EU Bund

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2017, Lebensmittel - EU Bund |  |
Verordnung (EU) 2017/644 der Kommission vom 5. April 2017 zur Festlegung der Probenahmeverfahren und Analysemethoden für die Kontrolle der Gehalte an Dioxinen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB in bestimmten Lebensmitteln sowie zur Aufhebung der Verordnung (EU) Nr. 589/2014
(Text von Bedeutung für den EWR)
(ABl. Nr. L 92 vom 06.04.2016 S. 9)
Neufassung - Ersetzt VO (EU) 589/2014
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über amtliche Kontrollen zur Überprüfung der Einhaltung des Lebensmittel- und Futtermittelrechts sowie der Bestimmungen über Tiergesundheit und Tierschutz 1, insbesondere auf Artikel 11 Absatz 4,
in Erwägung nachstehender Gründe:
(1) In der Verordnung (EG) Nr. 1881/2006 der Kommission 2 sind Höchstgehalte für nicht dioxinähnliche polychlorierte Biphenyle (PCB), Dioxine und Furane sowie für die Summe der Dioxine, Furane und dioxinähnlichen PCB in bestimmten Lebensmitteln festgelegt.
(2) In der Empfehlung 2013/711/EU der Kommission 3 sind Auslösewerte festgelegt, durch die ein proaktives Vorgehen zur Reduzierung des Vorhandenseins von polychlorierten Dibenzoparadioxinen und polychlorierten Dibenzofuranen (PCDD/F) sowie von dioxinähnlichen PCB in Lebensmitteln angeregt werden soll. Solche Auslösewerte werden von den zuständigen Behörden und den Unternehmen genutzt, um diejenigen Fälle ausfindig zu machen, in denen es angezeigt ist, eine Kontaminationsquelle zu ermitteln und mit den erforderlichen Maßnahmen für ihre Eindämmung oder Beseitigung zu sorgen.
(3) In der Verordnung (EU) Nr. 589/2014 der Kommission 4 werden spezifische Bestimmungen bezüglich der Probenahmeverfahren und Analysemethoden für die Kontrolle der Gehalte an Dioxinen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB festgelegt.
(4) Die Bestimmungen der vorliegenden Verordnung gelten nur für die Probenahme und Analyse von Dioxinen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB zur Durchführung der Verordnung (EG) Nr. 1881/2006 und der Empfehlung 2013/711/EU. Sie betreffen nicht das Probenahmeverfahren, den Umfang und die Häufigkeit der Proben gemäß den Anhängen III und IV der Richtlinie 96/23/EG des Rates 5. Sie betreffen auch nicht die in der Entscheidung 98/179/EG der Kommission 6 festgelegten Kriterien für die zielorientierte Probenahme.
(5) Es sollte sichergestellt werden, dass Lebensmittelunternehmer, die Kontrollen gemäß Artikel 4 der Verordnung (EG) Nr. 852/2004 des Europäischen Parlaments und des Rates 7 durchführen, Probenahmeverfahren anwenden, die den in der vorliegenden Verordnung festgelegten Probenahmeverfahren gleichwertig sind, damit die für solche Kontrollen entnommenen Proben repräsentativ sind. Das Referenzlaboratorium der Europäischen Union für Dioxine und PCB hat zudem nachgewiesen, dass die Untersuchungsergebnisse in bestimmten Fällen nicht verlässlich sind, wenn die Labors, die von den Lebensmittelunternehmern im Rahmen von Artikel 4 der Verordnung (EG) Nr. 852/2004 entnommene Proben untersuchen, die in der vorliegenden Verordnung festgelegten Leistungskriterien nicht anwenden. Bei der Untersuchung solcher Proben sollte die Anwendung der Leistungskriterien daher ebenfalls verbindlich vorgeschrieben sein.
(6) Da das Konzept der Entscheidungsgrenze gemäß der Entscheidung 2002/657/EG der Kommission 8, mit dem sichergestellt wird, dass ein Untersuchungsergebnis mit einer gewissen Wahrscheinlichkeit über dem Höchstgehalt liegt, beim Nachweis von Dioxinen und PCB in Lebensmitteln nicht mehr angewendet wird, sollte dieses Konzept gestrichen und nur noch nach dem Konzept der erweiterten Unsicherheit unter Verwendung eines Erweiterungsfaktors 2 für ein Vertrauensniveau von ca. 95 % verfahren werden.
(7) In Übereinstimmung mit den Berichtsanforderungen für bioanalytische Screening-Verfahren sollten auch für physikalisch-chemische Verfahren, die für Screening-Zwecke eingesetzt werden, spezifische Berichtsanforderungen festgelegt werden.
(8) Da die Untersuchungen für Dioxine, dioxinähnliche PCB und nicht dioxinähnliche PCB in den meisten Fällen gleichzeitig durchgeführt werden, sollten die Leistungskriterien für nicht dioxinähnliche PCB an die Leistungskriterien für Dioxine und dioxinähnliche PCB angeglichen werden. Dies bedeutet eine Vereinfachung, ohne dass in der Praxis wesentliche Veränderungen vorzunehmen sind, da bei nicht dioxinähnlichen PCB die relative Intensität der Qualifizier-Ionen gegenüber den Zielionen > 50 % ist.
(9) Zudem werden einige kleinere Änderungen der geltenden Bestimmungen vorgeschlagen, weshalb es erforderlich ist, die Verordnung (EU) Nr. 589/2014 aufzuheben und durch eine neue Verordnung zu ersetzen, um die Lesbarkeit des Textes zu erhalten.
(10) Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für Pflanzen, Tiere, Lebensmittel und Futtermittel
- hat folgende Verordnung erlassen:
Für die Zwecke dieser Verordnung gelten die Begriffsbestimmungen und Abkürzungen in Anhang I.
Die Probenahme für die amtliche Kontrolle der Gehalte an Dioxinen, Furanen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB in Lebensmitteln, die in Abschnitt 5 des Anhangs der Verordnung (EG) Nr. 1881/2006 aufgeführt sind, erfolgt nach den in Anhang II der vorliegenden Verordnung beschriebenen Verfahren.
Die Vorbereitung und Analyse der Proben für die Kontrolle der Gehalte von Dioxinen, Furanen und dioxinähnlichen PCB in Lebensmitteln, die in Abschnitt 5 des Anhangs der Verordnung (EG) Nr. 1881/2006 aufgeführt sind, erfolgt nach den in Anhang III der vorliegenden Verordnung beschriebenen Verfahren.
Die Analyse für die Kontrolle der Gehalte an nicht dioxinähnlichen PCB in Lebensmitteln, die in Abschnitt 5 des Anhangs der Verordnung (EG) Nr. 1881/2006 aufgeführt sind, erfolgt gemäß den in Anhang IV der vorliegenden Verordnung beschriebenen Anforderungen an die Analyseverfahren.
Die Verordnung (EU) Nr. 589/2014 wird aufgehoben.
Verweise auf die aufgehobene Verordnung gelten als Verweise auf die vorliegende Verordnung.
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 5. April 2017
2) Verordnung (EG) Nr. 1881/2006 der Kommission vom 19. Dezember 2006 zur Festsetzung der Höchstgehalte für bestimmte Kontaminanten in Lebensmitteln (ABl. Nr. L 364 vom 20.12.2006 S. 5).
3) Empfehlung 2013/711/EU der Kommission vom 3. Dezember 2013 zur Reduzierung des Anteils von Dioxinen, Furanen und PCB in Futtermitteln und Lebensmitteln (ABl. Nr. L 323 vom 04.12.2013 S. 37).
4) Verordnung (EU) Nr. 589/2014 der Kommission vom 2. Juni 2014 zur Festlegung der Probenahmeverfahren und Analysemethoden für die amtliche Kontrolle der Gehalte an Dioxinen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB in bestimmten Lebensmitteln sowie zur Aufhebung der Verordnung (EU) Nr. 252/2012 (ABl. Nr. L 164 vom 03.06.2014 S. 18).
5) Richtlinie 96/23/EG des Rates vom 29. April 1996 über Kontrollmaßnahmen hinsichtlich bestimmter Stoffe und ihrer Rückstände in lebenden Tieren und tierischen Erzeugnissen und zur Aufhebung der Richtlinien 85/358/EWG und 86/469/EWG und der Entscheidungen 89/187/EWG und 91/664/EWG (ABl. Nr. L 125 vom 23.05.1996 S. 10).
6) Entscheidung 98/179/EG der Kommission vom 23. Februar 1998 mit Durchführungsvorschriften für die amtlichen Probenahmen zur Kontrolle von lebenden Tieren und tierischen Erzeugnissen auf bestimmte Stoffe und ihre Rückstände (ABl. Nr. L 65 vom 05.03.1998 S. 31).
7) Verordnung (EG) Nr. 852/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über Lebensmittelhygiene (ABl. Nr. L 139 vom 30.04.2004 S. 1).
8) Entscheidung 2002/657/EG der Kommission vom 14. August 2002 zur Umsetzung der Richtlinie 96/23/EG des Rates betreffend die Durchführung von Analysemethoden und die Auswertung von Ergebnissen (ABl. Nr. L 221 vom 17.08.2002 S. 8).
| Begriffsbestimmungen und Abkürzungen | Anhang I |
I. Begriffsbestimmungen
Für die Zwecke dieser Verordnung gelten die Begriffsbestimmungen in Anhang I der Entscheidung 2002/657/EG.
Darüber hinaus gelten für die Zwecke dieser Verordnung folgende Begriffsbestimmungen:
1.1."Auslösewert": Gehalt an einem bestimmten Stoff gemäß dem Anhang der Empfehlung 2013/711/EU, ab dem Untersuchungen zur Bestimmung der Quelle der Kontamination eingeleitet werden müssen, wenn erhöhte Werte dieses Stoffes festgestellt werden.
1.2."Screening-Verfahren": Verfahren zur Auswahl derjenigen Proben, deren Gehalt an PCDD/F und dioxinähnlichen PCB die Höchstgehalte oder die Auslösewerte überschreitet. Diese sollen kostengünstig einen hohen Probendurchsatz ermöglichen, wodurch größere Chancen bestehen, neue Fälle mit hoher Exposition und Gesundheitsgefahren für die Verbraucher aufzudecken. Screening-Verfahren sollten auf bioanalytischen Verfahren oder GC-MS-Verfahren beruhen. Ergebnisse von Proben, die den Cut-off-Wert für die Überprüfung der Konformität mit dem Höchstgehalt überschreiten, müssen durch eine erneute vollständige Untersuchung der ursprünglichen Probe mittels eines Bestätigungsverfahrens überprüft werden.
1.3."Bestätigungsverfahren": Verfahren, die vollständige oder ergänzende Daten liefern, anhand derer PCDD/F und dioxinähnliche PCB im Bereich des Höchstgehalts oder erforderlichenfalls des Auslösewerts eindeutig identifiziert und quantifiziert werden können. Bei diesen Verfahren kommen Gaschromatografie/hochauflösende Massenspektrometrie (GC-HRMS) oder Gaschromatografie/Tandem-Massenspektrometrie (GC-MS/MS) zum Einsatz.
1.4."Bioanalytische Methoden": Verfahren, die auf der Anwendung biologischer Grundsätze beruhen, beispielsweise zellbasierte Assays, Rezeptor-Assays oder Immunoassays. Man erhält damit kein Ergebnis auf Ebene der Kongeneren, sondern lediglich einen Hinweis1 auf den TEQ-Gehalt, ausgedrückt in bioanalytischen Äquivalenten (BEQ), wodurch der Tatsache Rechnung getragen wird, dass möglicherweise nicht alle ein Signal erzeugenden Verbindungen, die in einem Probenextrakt vorliegen, allen Voraussetzungen des TEQ-Prinzips genügen.
1.5."Beobachtete Bioassay-Wiederfindung": BEQ-Gehalt, berechnet anhand einer TCDD-Kalibrierkurve oder einer PCB-126-Kalibrierkurve nach Korrektur um den Blindwert, geteilt durch den mittels des Bestätigungsverfahrens bestimmten TEQ-Wert. Dadurch sollen Faktoren wie der Verlust von PCDD/F und dioxinähnlichen Verbindungen während der einzelnen Extraktions- bzw. Reinigungsschritte, die Verstärkung oder Abschwächung des Signals durch mitextrahierte Verbindungen (agonistische bzw. antagonistische Wirkung), die Qualität der Kurvenanpassung oder Unterschiede zwischen TEF- und REP-Werten möglichst korrigiert werden. Die beobachtete Bioassay-Wiederfindung wird anhand geeigneter Referenzproben berechnet, die im Bereich des Höchstgehalts oder des Auslösewerts liegen und repräsentative Kongeneren-Muster aufweisen.
1.6."Zweitanalyse": getrennte Untersuchung der interessierenden Analyten anhand eines zweiten Aliquots derselben homogenisierten Probe.
1.7."Akzeptierte spezifische Bestimmungsgrenze 2 eines einzelnen Kongeners in einer Probe": niedrigster Analytgehalt, der sich mit angemessener statistischer Zuverlässigkeit quantifizieren lässt und die Identifizierungskriterien erfüllt, wie sie in international anerkannten Normen, z.B. in der Norm EN 16215:2012 (Futtermittel - Bestimmung von Dioxinen und dioxinähnlichen PCB mittels GC/HRMS und von Indikator-PCB mittels GC/HRMS) und/oder in den überarbeiteten EPA-Methoden 1613 und 1668, beschrieben sind.
Die Bestimmungsgrenze eines einzelnen Kongeners lässt sich bestimmen als
oder, falls die Berechnung des Signal-Rausch-Verhältnisses aus technischen Gründen keine zuverlässigen Ergebnisse liefert,
1.8."Obergrenze" (upperbound): Konzept, nach dem der Beitrag jedes nicht quantifizierten Kongeners mit der Bestimmungsgrenze gleichzusetzen ist.
1.9."Untergrenze" (lowerbound): Konzept, nach dem der Beitrag jedes nicht quantifizierten Kongeners mit null gleichzusetzen ist.
1.10."Mittelwert" (mediumbound): Konzept, nach dem der Beitrag jedes nicht quantifizierten Kongeners mit der Hälfte der Bestimmungsgrenze gleichzusetzen ist.
1.11."Partie": unterscheidbare Menge eines in einer Sendung angelieferten Lebensmittels, das gemäß der amtlichen Prüfung einheitliche Merkmale wie Ursprung, Sorte, Art der Verpackung, Verpacker, Absender oder Kennzeichnung aufweist. Bei Fischen und Fischereierzeugnissen muss auch die Größe der Fische vergleichbar sein. Sind Größe und/oder Gewicht der Fische in einer Sendung nicht vergleichbar, gilt die Sendung zwar als Partie, aber es ist ein spezifisches Probenahmeverfahren anzuwenden.
1.12."Teilpartie": bestimmter Teil einer großen Partie, der dem Probenahmeverfahren zu unterziehen ist. Jede Teilpartie muss physisch getrennt und unterscheidbar sein.
1.13."Einzelprobe": an einer einzigen Stelle der Partie bzw. Teilpartie entnommene Menge.
1.14."Sammelprobe": Summe der einer Partie oder Teilpartie entnommenen Einzelproben.
1.15."Laborprobe": für das Labor bestimmte(r) repräsentative(r) Teil/Menge der Sammelprobe.
II. Verwendete Abkürzungen
| BEQ | Bioanalytische Äquivalente |
| GC | Gaschromatografie |
| HRMS | Hochauflösende Massenspektrometrie |
| LRMS | Niedrigauflösende Massenspektrometrie |
| MS/MS | Tandem-Massenspektrometrie |
| PCB | Polychlorierte Biphenyle |
| Nicht dioxinähnliche PCB | PCB 28, PCB 52, PCB 101, PCB 138, PCB 153 und PCB 180 |
| PCDD | Polychlorierte Dibenzo-pdioxine |
| PCDF | Polychlorierte Dibenzofurane |
| QC | Qualitätssicherung |
| REP | Relative Wirksamkeit |
| TEF | Toxizitätsäquivalenzfaktor |
| TEQ | Toxizitätsäquivalente |
| TCDD | 2,3,7,8-Tetrachlordibenzo-pdioxin |
| U | Erweiterte Messunsicherheit |
2) Falls zutreffend, ist den im "Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food" [link to website] beschriebenen Grundsätzen zu folgen.
3) Die Bestimmungsgrenze (LOQ) wird auf der Grundlage des niedrigsten Konzentrationspunkts unter Berücksichtigung der Wiederfindung interner Standards und der Probeneinwaage berechnet.
| Probenahmeverfahren für die amtliche Kontrolle des Gehalts an Dioxinen (PCDD/PCDF), dioxinähnlichen PCB und nicht dioxinähnlichen PCB in bestimmten Lebensmitteln | Anhang II |
I. Geltungsbereich
Proben für die amtliche Kontrolle des Gehalts an Dioxinen (PCDD/F), dioxinähnlichen PCB und nicht dioxinähnlichen PCB in Lebensmitteln werden nach den in diesem Anhang beschriebenen Verfahren genommen. Die mit diesem Verfahren gewonnenen Sammelproben sind als repräsentativ für die betreffenden Partien bzw. Teilpartien anzusehen. Die bei der Analyse der Laborproben festgestellten Befunde geben Aufschluss darüber, ob die in der Verordnung (EG) Nr. 1881/2006 festgesetzten Höchstgehalte eingehalten wurden.
Um Artikel 4 der Verordnung (EG) Nr. 852/2004 zu genügen, verfahren die Lebensmittelunternehmer bei Kontrollen der Gehalte an Dioxinen (PCDD/F), dioxinähnlichen PCB und nicht dioxinähnlichen PCB nach den in Kapitel III dieses Anhangs beschriebenen Verfahren oder wenden ein gleichwertiges Probenahmeverfahren an, das nachweislich genauso repräsentativ ist wie das in Kapitel III dieses Anhangs beschriebene Verfahren.
II. Allgemeine Bestimmungen
1. Personal
Die amtliche Probenahme wird von einer durch den Mitgliedstaat bevollmächtigten Person vorgenommen.
2. Zu beprobendes Material
Jede zu kontrollierende Partie oder Teilpartie ist einzeln zu beproben.
3. Vorsichtsmaßnahmen
Bei der Probenahme und der Vorbereitung der Proben sind Vorsichtsmaßnahmen zu treffen, um Veränderungen zu verhindern, die sich auf den Gehalt an Dioxinen und PCB auswirken, die analytische Bestimmung beeinträchtigen oder die Repräsentativität der Sammelproben zunichtemachen könnten.
4. Einzelproben
Einzelproben sind - soweit möglich - an verschiedenen, über die gesamte Partie oder Teilpartie verteilten Stellen zu entnehmen. Abweichungen von dieser Regel sind in dem unter Nummer II.8 genannten Protokoll festzuhalten.
5. Herstellung der Sammelprobe
Die Sammelprobe wird durch Vereinigung der Einzelproben hergestellt. Sie besteht aus mindestens 1 kg, außer wenn dies praktisch nicht möglich ist, z.B. wenn eine einzige Packung beprobt wurde oder das Erzeugnis einen sehr hohen Marktwert hat.
6. Parallelproben
Parallelproben für Vollzugs-, Handels- (Rechtfertigungs-) und Referenz- (Schieds)zwecke sind von der homogenisierten Sammelprobe zu nehmen, sofern dies nicht gegen die Vorschriften eines Mitgliedstaats über die Rechte des Lebensmittelunternehmers verstößt. Die Laborproben für die Überwachung müssen ausreichend groß sein, um zumindest eine zweite Analyse zu ermöglichen.
7. Verpackung und Versand der Proben
Jede Probe ist in einem sauberen, inerten Behältnis aufzubewahren, das angemessenen Schutz gegen Kontamination, Verlust von Analyten durch Adsorption an der inneren Wand des Behältnisses sowie gegen Beschädigung beim Transport bietet. Es sind alle notwendigen Vorkehrungen zu treffen, um zu verhindern, dass sich die Zusammensetzung der Probe während des Transports oder der Lagerung verändert.
8. Versiegelung und Kennzeichnung der Proben
Jede amtliche Probe wird am Ort der Entnahme versiegelt und gemäß den Vorschriften der Mitgliedstaaten gekennzeichnet.
Über jede Probenahme ist ein Protokoll zu führen, aus dem die Identität der Partie eindeutig hervorgeht, wobei Datum und Ort der Probenahme sowie alle zusätzlichen Informationen, die für die durchzuführende Analyse von Nutzen sein können, zu vermerken sind.
III. Probenahmeplan
Mit dem verwendeten Probenahmeverfahren muss gewährleistet sein, dass die Sammelprobe für die zu kontrollierende (Teil-)Partie repräsentativ ist.
1. Aufteilung von Partien in Teilpartien
Größere Partien werden in Teilpartien aufgeteilt, wenn dies physisch möglich ist. Für als Massengut gehandelte Erzeugnisse (z.B. Pflanzenöle) gilt Tabelle 1. Für andere Erzeugnisse gilt Tabelle 2. Da das Gewicht der Partie nicht immer ein exaktes Vielfaches des Gewichts der Teilpartien ist, darf das Gewicht der Teilpartien das genannte Gewicht um bis zu 20 % überschreiten.
Tabelle 1 Aufteilung von Partien in Teilpartien bei Massengütern
| Gewicht der Partie (t) | Gewicht oder Anzahl der Teil partien |
| > 1 500 | 500 Tonnen |
| > 300 und < 1 500 | 3 Teilpartien |
| > 50 and ≤ 300 | 100 Tonnen |
| < 50 | - |
Tabelle 2 Aufteilung von Partien in Teilpartien bei anderen Erzeugnissen
| Gewicht der Partie (t) | Gewicht oder Anzahl der Teil partien |
| > 15 | 15-30 Tonnen |
| < 15 | - |
2. Anzahl der Einzelproben
Die Sammelprobe, in der alle Einzelproben vereinigt sind, muss mindestens 1 kg wiegen (siehe Nummer II.5).
Die Mindestanzahl der einer Partie oder Teilpartie zu entnehmenden Einzelproben muss den Angaben in den Tabellen 3 und 4 entsprechen.
Bei flüssigen Massenerzeugnissen ist die Partie oder Teilpartie unmittelbar vor der Probenahme entweder manuell oder mechanisch möglichst gründlich zu vermischen, sofern dies die Qualität des Erzeugnisses nicht beeinträchtigt. In dem Fall kann von einer homogenen Verteilung der Kontaminanten in der jeweiligen Partie oder Teilpartie ausgegangen werden. Daher reichen drei Einzelproben aus einer Partie oder Teilpartie für eine Sammelprobe aus.
Das Gewicht der Einzelproben muss annähernd gleich sein. Eine Einzelprobe muss mindestens 100 g wiegen.
Abweichungen von dieser Regel sind in dem unter Nummer II.8 dieses Anhangs genannten Protokoll festzuhalten. Entsprechend den Bestimmungen der Entscheidung 97/747/EG der Kommission 1 beträgt der Umfang einer Sammelprobe bei Hühnereiern mindestens 12 Eier (bei loser Ware ebenso wie bei Partien aus einzelnen Verpackungen; es gelten die Tabellen 3 und 4).
Tabelle 3 Mindestzahl der Einzelproben, die der Partie oder Teilpartie zu entnehmen sind
| Gewicht oder Volumen der Partie/Teilpartie (kg oder l) | Mindestanzahl der zu entnehmenden Einzelproben |
| < 50 | 3 |
| 50 bis 500 | 5 |
| > 500 | 10 |
Besteht die Partie oder Teilpartie aus einzelnen Packungen oder Einheiten, ist die Zahl der Packungen oder Einheiten, die die Sammelprobe bildet, gemäß Tabelle 4 zu wählen.
Tabelle 4 Zahl der Packungen oder Einheiten (Einzelproben), die die Sammelprobe bilden, wenn die Partie oder Teilpartie aus einzelnen Packungen oder Einheiten besteht
| Zahl der Packungen oder Einheiten in der Partie/Teilpartie | Zahl der zu entnehmenden Packungen oder Einheiten |
| 1 bis 25 | mindestens 1 Packung oder Einheit |
| 26 bis 100 | etwa 5 %, mindestens 2 Packungen oder Einheiten |
| > 100 | etwa 5 %, höchstens 10 Packungen oder Einheiten |
3. Spezifische Bestimmungen für die Probenahme von Partien ganzer Fische mit vergleichbarer Größe und vergleichbarem Gewicht
Fische gelten als vergleichbar groß und schwer, wenn die entsprechenden Werte nicht um mehr als 50 % voneinander abweichen.
Die Anzahl der einer Partie zu entnehmenden Einzelproben muss den Angaben in Tabelle 3 entsprechen. Die Sammelprobe, in der alle Einzelproben vereinigt sind, muss mindestens 1 kg wiegen (siehe Nummer II.5).
Der mittlere Teil befindet sich im Schwerpunkt der Fische, in der Regel im Bereich der Rückenflosse (sofern vorhanden) oder in der Mitte zwischen Kiemenöffnung und Darmausgang.
Bei Fischen mittlerer Größe (ungefähr 1-6 kg) wird die Einzelprobe vom Mittelteil als Scheibe im Querschnitt entnommen.
Bei sehr großen Fischen (> ungefähr 6 kg) wird die Einzelprobe im Mittelteil rechtsseitig (von vorne gesehen) aus dem Muskelfleisch der Rückenpartie entnommen. Würde die Entnahme eines Stückes aus dem mittleren Teil des Fisches einen beträchtlichen wirtschaftlichen Schaden nach sich ziehen, kann die Entnahme von drei Einzelproben von jeweils mindestens 350 g als ausreichend angesehen werden, unabhängig von der Größe der Partie. Alternativ dazu kann für die Einzelprobe, die für den Dioxingehalt in dem Fisch insgesamt repräsentativ ist, auch ein gleich großer Teil aus Muskelfleisch im Schwanz- oder Kopfbereich entnommen werden.
4. Probenahme von Partien ganzer Fische mit unterschiedlicher Größe und/oder von unterschiedlichem Gewicht
5. Probenahme im Einzelhandel
Die Probenahme von Lebensmitteln im Einzelhandel muss, soweit möglich, gemäß den unter Nummer III.2 beschriebenen Probenahmebestimmungen durchgeführt werden.
Ist dies nicht möglich, können im Einzelhandel andere geeignete Probenahmeverfahren angewandt werden, vorausgesetzt, dass die nach diesen Verfahren genommenen Sammelproben ausreichend repräsentativ für die beprobten Partien oder Teilpartien sind.
IV. Übereinstimmung der Partie mit den Vorgaben
1. Nicht dioxinähnliche PCB
Die Partie entspricht den Vorgaben, wenn das Ergebnis der Untersuchung für die Summe der nicht dioxinähnlichen PCB den in der Verordnung (EG) Nr. 1881/2006 festgelegten Höchstgehalt unter Berücksichtigung der erweiterten Messunsicherheit nicht überschreitet 3.
Die Partie entspricht nicht dem in der Verordnung (EG) Nr. 1881/2006 festgelegten Höchstgehalt, wenn das Mittel der durch Zweitanalyse 4 ermittelten Obergrenzen ("upperbound") zweier Untersuchungsergebnisse unter Berücksichtigung der erweiterten Messunsicherheit den Höchstgehalt zweifelsfrei überschreitet.
Die erweiterte Messunsicherheit wird mithilfe eines Erweiterungsfaktors von 2 berechnet, der zu einem Grad des Vertrauens von ca. 95 % führt. Eine Partie entspricht nicht den Vorgaben, wenn das Mittel der gemessenen Werte abzüglich der erweiterten Messunsicherheit des Mittels über dem festgelegten Höchstgehalt liegt.
Die in den oben stehenden Absätzen unter dieser Nummer genannten Bestimmungen gelten für das Untersuchungsergebnis der für die amtliche Kontrolle entnommenen Probe. Im Falle einer Analyse für Rechtfertigungs- oder Referenzwecke gelten die einzelstaatlichen Bestimmungen.
2. Dioxine (PCDD/F) und dioxinähnliche PCB
Die Partie entspricht den Vorgaben, wenn das Ergebnis einer einzelnen Untersuchung,
Für Screening-Assays ist ein Cut-off-Wert festzulegen, anhand dessen entschieden wird, ob die jeweiligen Höchstgehalte für PCDD/F bzw. die Summe von PCDD/F und dioxinähnlichen PCB eingehalten werden.
Die Partie entspricht nicht dem in der Verordnung (EG) Nr. 1881/2006 festgelegten Höchstgehalt, wenn das Mittel der Obergrenzen ("upperbound") zweier mit einem Bestätigungsverfahren erzielten Untersuchungsergebnisse (Zweitanalyse 6) unter Berücksichtigung der erweiterten Messunsicherheit den Höchstgehalt zweifelsfrei überschreitet.
Die erweiterte Messunsicherheit wird mithilfe eines Erweiterungsfaktors von 2 berechnet, der zu einem Grad des Vertrauens von ca. 95 % führt. Eine Partie entspricht nicht den Vorgaben, wenn das Mittel der gemessenen Werte abzüglich der erweiterten Messunsicherheit des Mittels über dem festgelegten Höchstgehalt liegt.
Für die Berechnung der geschätzten erweiterten Messunsicherheit der Summe der PCDD/F und dioxinähnlichen PCB ist die Summe der geschätzten erweiterten Messunsicherheiten der getrennten Analyseergebnisse der PCDD/F und dioxinähnlichen PCB zu verwenden.
Die in den oben stehenden Absätzen unter dieser Nummer genannten Bestimmungen gelten für das Untersuchungsergebnis der für die amtliche Kontrolle entnommenen Probe. Im Falle einer Analyse für Rechtfertigungs- oder Referenzwecke gelten die einzelstaatlichen Bestimmungen.
V. Überschreiten der Auslösewerte
Auslösewerte dienen als Instrument zur Auswahl der Proben in Fällen, in denen eine Kontaminationsquelle gefunden werden sollte und Maßnahmen zu deren Eindämmung oder Beseitigung getroffen werden sollten. Durch Screening-Verfahren sind die geeigneten Cut-off-Werte für die Auswahl dieser Proben festzulegen. Wenn zur Bestimmung einer Kontaminationsquelle, deren Eindämmung oder Beseitigung erhebliche Anstrengungen erforderlich sind, könnte es angezeigt sein, die Überschreitung der Auslösewerte durch eine Zweitanalyse im Bestätigungsverfahren und unter Berücksichtigung der erweiterten Messunsicherheit zu bestätigen 7.
2) https://ec.europa.eu/food/sites/food/files/safety/docs/cs_contaminants_catalogue_dioxins_guidancesampling_exemplesdec2006_en.pdf
3) Falls zutreffend, ist den im "Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry" [link to website] beschriebenen Grundsätzen zu folgen.
4) Eine Zweitanalyse ist erforderlich, wenn das Ergebnis der ersten Bestimmung nicht den Vorgaben entspricht. Sie ist erforderlich, um eine interne Kreuzkontamination oder eine versehentliche Vermischung der Proben auszuschließen. Bei einer Untersuchung im Verlauf eines Kontaminationsfalls kann auf die Bestätigung durch Zweitanalyse verzichtet werden, wenn sich die untersuchten Proben auf den Kontaminationsfall zurückverfolgen lassen und der gemessene Wert deutlich über dem Höchstgehalt liegt.
5) Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry [link to website], Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food [link to website].
6) Eine Zweitanalyse ist erforderlich, wenn das Ergebnis der ersten Bestimmung mit einem Bestätigungsverfahren unter Nutzung derC-markierten internen Standards für die jeweiligen Analyten nicht den Vorgaben entspricht. Sie ist erforderlich, um eine interne Kreuzkontamination oder eine versehentliche Vermischung der Proben auszuschließen. Bei einer Untersuchung im Verlauf eines Kontaminationsfalls kann auf die Bestätigung durch Zweitanalyse verzichtet werden, wenn sich die untersuchten Proben auf den Kontaminationsfall zurückverfolgen lassen und der gemessene Wert deutlich über dem Höchstgehalt liegt.
7) Für Zweitanalysen zur Kontrolle der Auslösewerte gelten die gleichen Erklärungen und Anforderungen wie die für Höchstgehalte in Fußnote 6 genannten.
| Probenvorbereitung und Anforderungen an Untersuchungsverfahren zur Kontrolle des Gehalts an Dioxinen (PCDD/F) und dioxinähnlichen PCB in bestimmten Lebensmitteln | Anhang III |
1. Anwendungsbereich
Die in diesem Anhang beschriebenen Anforderungen gelten, wenn Lebensmittel für folgende Zwecke untersucht werden: zur amtlichen Kontrolle des Gehalts an 2,3,7,8-substituierten polychlorierten Dibenzo-pdioxinen und polychlorierten Dibenzofuranen (PCDD/F) und dioxinähnlichen polychlorierten Biphenylen (dioxinähnlichen PCB), sowie für die Probenvorbereitung und Untersuchungsanforderungen zu anderen regulatorischen Zwecken, darunter die Kontrollen der Lebensmittelunternehmer zu Gewährleistung der Vorschriftsmäßigkeit gemäß Artikel 4 der Verordnung (EG) Nr. 852/2004.
Die Überwachung des Vorhandenseins von PCDD/F und dioxinähnlichen PCB in Lebensmitteln kann durch zwei unterschiedliche Analyseverfahren durchgeführt werden:
a) Screening-Verfahren
Das Ziel von Screening-Verfahren ist es, diejenigen Proben zu selektieren, deren Gehalt an PCCD/F und dioxinähnlichen PCB die Höchstgehalte oder die Auslösewerte überschreitet. Screening-Verfahren ermöglichen kostengünstig einen hohen Probendurchsatz, wodurch größere Chancen bestehen, neue Vorfälle aufzudecken, bei denen die Gesundheit der Verbraucher durch hohe Exposition gefährdet ist. Ihre Anwendung hat insbesondere die Vermeidung falschnegativer Ergebnisse zum Ziel. Sie können bioanalytische und GC/MS-Verfahren umfassen.
Bei Screening-Verfahren werden die analytischen Ergebnisse mit einem Cut-off-Wert verglichen; dadurch lässt sich die Frage nach einer möglichen Überschreitung des Höchstgehalts oder des Auslösewerts mit ja oder nein beantworten. Die Konzentration von PCDD/F und der Summe von PCDD/F und dioxinähnlichen PCB in Proben, in denen eine Überschreitung des Höchstgehalts vermutet wird, muss durch ein Bestätigungsverfahren ermittelt oder bestätigt werden.
Darüber hinaus können Screening-Verfahren Hinweise auf den in der Probe vorhandenen Gehalt an PCDD/F und dioxinähnlichen PCB liefern. Bei bioanalytischen Screening-Verfahren wird das Ergebnis in bioanalytischen Äquivalenten (BEQ) und bei physikalisch-chemischen GC-MS-Verfahren in Toxizitätsäquivalenten (TEQ) ausgedrückt. Die in Zahlen ausgedrückten Ergebnisse von Screening-Verfahren sind geeignet, die Konformität bzw. die vermutete Nichtkonformität oder das Überschreiten von Auslösewerten anzuzeigen und weisen außerdem für den Fall einer Weiterverfolgung mittels Bestätigungsverfahren auf die Gehaltsbereiche hin. Sie sind nicht für Zwecke wie die Bewertung von Hintergrundgehalten, die Schätzung der Aufnahme, die Verfolgung der zeitlichen Entwicklung von Gehalten oder die Neubewertung von Auslösewerten und Höchstgehalten geeignet.
b) Bestätigungsverfahren
Bestätigungsverfahren ermöglichen die eindeutige Identifizierung und Quantifizierung von in einer Probe vorhandenen PCCD/F und dioxinähnlichen PCB und liefern vollständige Informationen auf Kongenerenbasis. Sie erlauben somit die Kontrolle von Höchstgehalten und Auslösewerten, einschließlich der Bestätigung von mittels Screening-Verfahren erzielten Ergebnissen. Außerdem können die Ergebnisse für weitere Zwecke genutzt werden, wie die Bestimmung der Belastung im niedrigen Hintergrundbereich bei der Lebensmittelüberwachung, die Verfolgung der zeitlichen Entwicklung, die Bewertung der Exposition der Bevölkerung und für den Aufbau einer Datenbank im Hinblick auf eine mögliche Neubewertung der Auslösewerte und Höchstgehalte. Sie sind außerdem bei der Feststellung von Kongeneren-Mustern zur Bestimmung der Quelle einer möglichen Kontamination von Bedeutung. Diese Verfahren werden mittels GC-HRMS durchgeführt. Zur Bestätigung der Konformität oder Nichtkonformität mit dem Höchstgehalt kann auch die GC-MS/MS verwendet werden.
2. Hintergrund
Zur Berechnung der TEQ-Konzentrationen werden die Konzentrationen der einzelnen Analyten in einer bestimmten Probe mit den jeweiligen TEF der Weltgesundheitsorganisation, die in der Anlage zu diesem Anhang aufgeführt sind, multipliziert und dann addiert, woraus sich die Gesamtkonzentration an dioxinähnlichen Verbindungen, ausgedrückt in TEQ, ergibt.
Screening- und Bestätigungsverfahren dürfen nur dann zur Kontrolle einer bestimmten Probenmatrix verwendet werden, wenn sie empfindlich genug sind, Gehalte im Bereich des Höchstgehalts oder des Auslösewerts zuverlässig zu bestimmen.
3. Anforderungen an die Qualitätssicherung
4. Anforderungen an Laboratorien
5. Grundlegende Anforderungen an Verfahren zur Untersuchung auf Dioxine (PCDD/F) und dioxinähnliche PCB
5.1. Niedriger Arbeitsbereich und niedrige Bestimmungsgrenzen
5.2. Hohe Selektivität (Spezifizität)
5.3. Hohe Genauigkeit (Richtigkeit und Präzision, beobachtete Bioassay-Wiederfindung)
5.4. Validierung im Bereich des Höchstgehalts und allgemeine Qualitätssicherungsmaßnahmen
5.5. Bestimmungsgrenze
5.6. Analysekriterien
| Screening mit bioanalytischen oder physikalisch-chemischen Verfahren | Bestätigungsverfahren | |
| Falsch-Negativ-Rate * | < 5 % | |
| Richtigkeit | - 20 % bis + 20 % | |
| Wiederholbarkeit (RSDr) | < 20 % | |
| Laborpräzision (RSDR) | < 25 % | < 15 % |
| *) Bezogen auf die Höchstgehalte. | ||
5.7. Besondere Anforderungen an Screening-Verfahren
20 % der Probenextrakte sind während des Routine-Screenings sowohl ohne als auch mit Zusatz einer dem Höchstgehalt oder dem Auslösewert entsprechenden Menge von TCDD zu analysieren, damit überprüft werden kann, ob das Signal möglicherweise durch interferierende Stoffe im Probenextrakt unterdrückt wird. Die gemessene Konzentration der dotierten Probe wird mit der Summe aus der Konzentration der nicht dotierten Probe und der Konzentration der Dotierung verglichen. Liegt die gemessene Konzentration mehr als 25 % unter der berechneten (Summen-)Konzentration, ist dies ein Hinweis auf eine mögliche Signalunterdrückung, und die entsprechende Probe ist einem Bestätigungsverfahren zu unterziehen. Die Ergebnisse sind anhand von Qualitätskontroll-Charts zu überwachen.
Etwa 2-10 % der konformen Proben sind, je nach Probenmatrix und Laborerfahrung, zu bestätigen.
Die Rate falschnegativer Ergebnisse beim Screening von Proben unter- und oberhalb der Höchstgehalte oder Auslösewerte ist zu bestimmen. Der tatsächliche Anteil der falschnegativen Ergebnisse muss unter 5 % liegen.
Nachdem im Rahmen der Qualitätssicherung je Matrix/Matrixgruppe mindestens 20 Proben bestätigt wurden, ist aus dieser Datenbasis die Falsch-Negativ-Rate zu ermitteln. Die zur Ermittlung der Falsch-Negativ-Rate mindestens erforderlichen 20 Ergebnisse können auch die Ergebnisse von in Ringversuchen oder im Rahmen eines Kontaminationsereignisses untersuchten Proben mit einschließen, die einen Konzentrationsbereich von beispielsweise bis zum doppelten Höchstgehalt abdecken. Die Proben müssen die häufigsten Kongeneren-Muster abdecken, die verschiedene Kontaminationsquellen repräsentieren.
Obwohl Screening-Verfahren hauptsächlich auf die Ermittlung derjenigen Proben abzielen, in denen der Auslösewert überschritten wird, ist das ausschlaggebende Kriterium zur Bestimmung der Falsch-Negativ-Rate der Höchstgehalt, unter Berücksichtigung der erweiterten Messunsicherheit des Bestätigungsverfahrens.
6. Besondere zu erfüllende Anforderungen an GC-MS-Verfahren für SCREENING- oder Bestätigungszwecke
6.1. Akzeptable Differenzen zwischen Obergrenze ("upperbound") und Untergrenze ("lowerbound") (WHO-TEQ-Werte)
6.2. Kontrolle der Wiederfindungsrate
6.3. Entfernung interferierender Stoffe
6.4. Kalibrierung mittels Standardkurve
6.5. Besondere Kriterien für Bestätigungsverfahren
Bei der HRMS muss die Auflösung für den gesamten Massenbereich bei 10 % Tal in der Regel gleich oder größer als 10 000 sein.
Erfüllung weiterer Identifizierungs- und Bestätigungskriterien, wie sie in international anerkannten Normen, z.B. in der Norm EN 16215:2012 (Futtermittel - Bestimmung von Dioxinen und dioxinähnlichen PCB mittels GC/HRMS und von Indikator-PCB mittels GC/HRMS) und/oder in den überarbeiteten EPA-Methoden 1613 und 1668, beschrieben sind.
Messung von mindestens 2 spezifischen Vorläufer-Ionen, jeweils mit einem spezifischen dazugehörigen Übergangs-Produkt-Ion für alle markierten und nicht markierten Analyten im Untersuchungsbereich.
Zulässige Höchsttoleranz für relative Ionenintensitäten von ± 15 % für ausgewählte Übergangs-Produkt-Ionen im Vergleich zu berechneten oder gemessenen Werten (Mittelwert aus Kalibrierstandards) unter Anwendung identischer MS/MS-Bedingungen, insbesondere Kollisionsenergie und Kollisionsgasdruck, für jeden Übergang eines Analyts.
Festlegung der Auflösung für jeden Quadrupol gleichwertig oder besser als die Einheitsmassenauflösung (Einheitsmassenauflösung: ausreichende Auflösung zur Auftrennung zweier Peaks, die sich um eine Masseneinheit unterscheiden), um mögliche Auswirkungen von Interferenzen auf die interessierenden Analyten zu minimieren.
Erfüllung der weiteren Kriterien, wie sie in international anerkannten Normen, z.B. in der Norm EN 16215:2012 (Futtermittel - Bestimmung von Dioxinen und dioxinähnlichen PCB mittels GC/HRMS und von Indikator-PCB mittels GC/HRMS), und/oder in den überarbeiteten EPA-Methoden 1613 und 1668 beschrieben sind, die Pflicht zur Verwendung von GC-HRMS ausgenommen.
7. Besondere Anforderungen an bioanalytische Methoden
Bioanalytische Methoden sind Verfahren, die auf der Anwendung biologischer Grundsätze beruhen, beispielsweise zellbasierte Assays, Rezeptor-Assays oder Immunoassays. In diesem Abschnitt werden allgemeine Anforderungen an bioanalytische Methoden festgelegt.
Mit einem Screening-Verfahren wird eine Probe prinzipiell entweder als konform oder als vermutlich nicht konform eingestuft. Dazu wird der berechnete BEQ-Wert mit dem Cut-off-Wert verglichen (siehe Nummer 7.3). Proben, die unter dem Cut-off-Wert liegen, gelten als konform, Proben die dem Cut-off-Wert entsprechen oder diesen überschreiten, gelten als vermutlich nicht konform und müssen mit einem Bestätigungsverfahren untersucht werden. In der Praxis kann ein BEQ-Gehalt, der zwei Drittel des Höchstgehalts entspricht, als Cut-off-Wert dienen, sofern eine Falsch-Negativ-Rate von unter 5 % sowie eine annehmbare Rate von falschpositiven Ergebnissen gewährleistet wird. Da für PCDD/F und für die Summe von PCDD/F und dioxinähnliche PCB unterschiedliche Höchstgehalte gelten, ist zur Prüfung der Konformität der Proben ohne Fraktionierung ein geeigneter Bioassay-Cut-off-Wert für PCDD/F erforderlich. Zur Überprüfung von Proben, in denen die Auslösewerte überschritten werden, würde sich ein entsprechender Prozentsatz des jeweiligen Auslösewerts als Cut-off-Wert eignen.
Wird ein ungefährer Gehalt in BEQ ausgedrückt, müssen die Ergebnisse für die Probe angegeben werden, die im Arbeitsbereich liegen und den Meldewert überschreiten (siehe Nummern 7.1.1 und 7.1.6).
7.1. Signalauswertung
7.1.1. Allgemeine Anforderungen
7.1.2. Kalibrierung
7.1.2.1. Kalibrierung mittels Standardkurve
7.1.2.2 Kalibrierung anhand von Referenzproben
Alternativ kann eine Kalibrierkurve auf Grundlage von mindestens 4 Referenzproben verwendet werden (siehe Nummer 7.2): eine Matrixleerwert-Probe sowie drei Referenzproben, die jeweils 0,5 x, 1,0 x und 2,0 x den Höchstgehalt oder den Auslösewert enthalten, wodurch keine Notwendigkeit zur Korrektur um Blindwerte und Wiederfindung besteht, wenn sich die Matrixeigenschaften bei Referenzproben und unbekannten Proben decken. In diesem Fall kann das Signal, das zwei Dritteln des Höchstgehalts entspricht (siehe Nummer 7.3), direkt auf Grundlage dieser Proben berechnet und als Cut-off-Wert verwendet werden. Zur Überprüfung von Proben, in denen die Auslösewerte überschritten werden, würde sich ein entsprechender Prozentsatz dieser Auslösewerte als Cut-off-Wert eignen.
7.1.3. Separate Bestimmung von PCDD/F und dioxinähnlichen PCB
Extrakte können in Fraktionen, welche PCDD/F und dioxinähnliche PCB enthalten, aufgetrennt werden, sodass PCDD/F-TEQ und TEQ der dioxinähnlichen PCB Verbindungen (jeweils als BEQ) getrennt angegeben werden können. Zur Bewertung der Ergebnisse für die Fraktion, die dioxinähnliche PCB enthält, ist vorzugsweise eine PCB-126-Standardkalibrierkurve zu verwenden.
7.1.4. Beobachtete Bioassay-Wiederfindung
Die "beobachtete Bioassay-Wiederfindung" ist auf Grundlage geeigneter Referenzproben mit repräsentativen Kongeneren-Mustern im Bereich des Höchstgehalts oder des Auslösewerts zu berechnen und wird als Prozentsatz des BEQ-Gehalts im Vergleich zum TEQ-Gehalt ausgedrückt. Je nachdem, welche Art von Assay oder TEF2 verwendet wird, können die Unterschiede zwischen TEF- und REP-Faktoren in dioxinähnlichen PCB zu niedrigeren Wiederfindungswerten für dioxinähnliche PCB im Vergleich zu PCDD/F führen. Daher muss die beobachtete Bioassay-Wiederfindung bei einer getrennten Bestimmung von PCDD/F und dioxinähnlichen PCB für dioxinähnliche PCB 20 bis 60 % und für PCDD/F 50 bis 130 % betragen (bei Verwendung einer TCDD-Kalibrierkurve). Der Beitrag der dioxinähnlichen PCB zur Summe der PCDD/F und dioxinähnlichen PCB kann je nach Matrices und Proben unterschiedlich sein; dies spiegelt sich in den Bereichen der beobachteten Bioassay-Wiederfindung für den Summen-Parameter wider, die zwischen 30 und 130 % liegen müssen.
7.1.5. Kontrolle der Wiederfindung nach Reinigung der Probenextrakte
Der Verlust von Verbindungen während der Reinigung ist im Rahmen der Validierung zu überprüfen. Eine Matrixleerprobe, dotiert mit einem Gemisch verschiedener Kongenere, ist dem Reinigungsverfahren zu unterziehen (mindestens n = 3) und Wiederfindung und Streuung sind mittels eines Bestätigungsverfahrens zu untersuchen. Die Wiederfindung muss zwischen 60 und 120 % betragen, insbesondere für Kongenere, die in verschiedenen Gemischen jeweils mehr als 10 % des TEQ-Gehalts ausmachen.
7.1.6. Meldegrenze
Werden BEQ-Gehalte angegeben, ist auf der Grundlage relevanter Matrix-Proben, die typische Kongeneren-Muster aufweisen, eine Meldegrenze zu ermitteln; dabei ist die Kalibrierkurve der Standards aufgrund ihrer geringen Präzision im unteren Bereich nicht heranzuziehen. Die Einflüsse aus Extraktion und Reinigung müssen berücksichtigt werden. Die Meldegrenze muss außerdem deutlich (mindestens um den Faktor 3) über den Methodenleerwerten liegen.
7.2. Verwendung von Referenzproben
7.3. Bestimmung der Cut-off-Werte
Die Beziehung zwischen den in BEQ ausgedrückten Ergebnissen der bioanalytischen Methode und den in TEQ ausgedrückten Ergebnissen von Bestätigungsverfahren ist zu ermitteln (z.B. durch matrixbezogene Kalibrierexperimente unter Verwendung von Referenzproben, die mit 0, 0,5 x, 1 x und 2 x Höchstgehalt dotiert sind und auf jeder Konzentrationsstufe jeweils 6 Mal untersucht werden (n = 24)). Korrekturfaktoren (für Leerwert und Wiederfindung) können auf der Grundlage dieses Verhältnisses geschätzt werden, müssen jedoch in jeder Test-Serie durch Einbeziehung von Methoden-/Matrixleerwert-Proben und Wiederfindungsproben (siehe Nummer 7.2) überprüft werden.
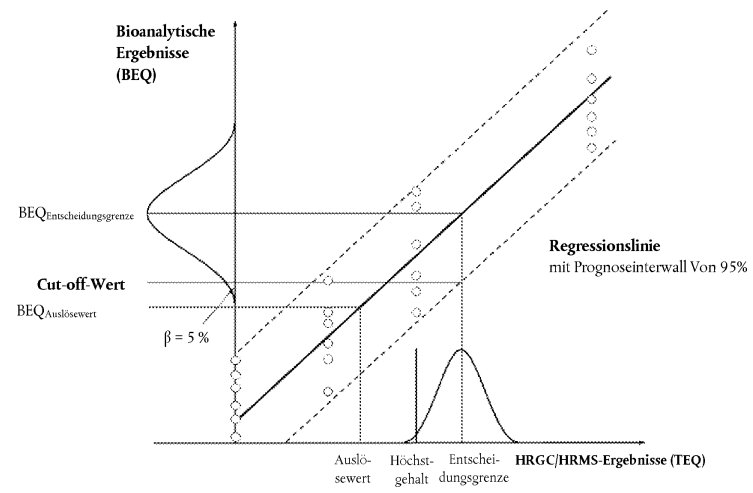
Für die Entscheidung, ob eine Probe den Höchstgehalten entspricht, oder zur Überprüfung der Auslösewerte, falls von Interesse, sind Cut-off-Werte zu ermitteln, wobei die entsprechenden Höchstgehalte oder Auslösewerte entweder einzeln für PCDD/F und dioxinähnliche PCB, oder aber für die Summe von PCDD/F und dioxinähnlichen PCB festgelegt sein können. Sie stellen den unteren Endpunkt der Verteilung bioanalytischer Ergebnisse (korrigiert um Leerwert und Wiederfindung) von Proben dar, die Gehalte an der Entscheidungsgrenze des Bestätigungsverfahrens aufweisen, berechnet auf Grundlage eines Vertrauensniveaus von 95 %, was eine Falsch-Negativ-Rate von < 5 % impliziert, und auf Basis einer RSDR unter 25 %. Die Entscheidungsgrenze des Bestätigungsverfahrens entspricht dem Höchstgehalt zuzüglich der erweiterten Messunsicherheit.
In der Praxis kann der Cu-toff-Wert (in BEQ) gemäß folgenden Ansätzen berechnet werden (siehe Abbildung 1):
7.3.1. Verwendung des unteren Bands des Prognoseintervalls von 95 % an der Entscheidungsgrenze des Bestätigungsverfahrens
![]()
Dabei ist:
| BEQDL | der BEQ-Wert, der der Entscheidungsgrenze des Bestätigungsverfahrens entspricht, die wiederum dem Höchstgehalt unter Berücksichtigung der erweiterten Messunsicherheit entspricht |
| sy,x | die Reststandardabweichung |
| tα,f = m -2 | der Student Faktor (α = 5 %, f = Freiheitsgrade, einseitig) |
| m | die Gesamtzahl der Kalibrierpunkte (Laufzahl j) |
| n | die Anzahl der Wiederholungen auf jeder Ebene |
| xi | Probenkonzentration (in TEQ) des Kalibrierpunkts i, durch ein Bestätigungsverfahren ermittelt |
| der Mittelwert der Konzentrationen (in TEQ) aller Kalibrierproben |

i = Laufzahl des Kalibrierpunkts i
7.3.2. Berechnung aus bioanalytischen Ergebnissen (korrigiert um Leerwert und Wiederfindung) aus der Mehrfachuntersuchung (n ≥ 6) von Proben, die Gehalte an der Entscheidungsgrenze des Bestätigungsverfahrens aufweisen, als unterer Endpunkt der Datenverteilung am entsprechenden BEQ-Mittelwert:
Cut-off Wert = BEQDL - 1,64 × SDR
Dabei ist:
SDR die Standardabweichung der Bioassay-Ergebnisse am BEQDL, gemessen unter laborinternen Reproduzierbarkeitsbedingungen.
7.3.3. Berechnung als Mittelwert bioanalytischer Ergebnisse (in BEQ, korrigiert um Blindwert und Wiederfindung) aus der Mehrfachuntersuchung (n ≥ 6) von Proben, die mit zwei Dritteln des Höchstgehalts oder des Auslösewerts kontaminiert sind. Dieses Verfahren beruht auf der Beobachtung, dass dieser Wert in der Nähe des gemäß Nummer 7.3.1 oder 7.3.2 bestimmten Cut-off-Wertes liegt.
Berechnung der Cut-off-Werte auf der Grundlage eines Vertrauensniveaus von 95 %, was eine Falsch-Negativ-Rate von < 5 % impliziert, und auf Basis einer RSDR < 25 %:
7.3.4. Beschränkungen der Cut-off-Werte
Auf BEQ basierende Cut-off-Werte, die anhand der im Rahmen der Validierung und unter Verwendung einer begrenzten Anzahl von Proben mit unterschiedlichen Matrix-/Kongeneren-Mustern erzielten RSDR berechnet wurden, können höher sein als die auf TEQ basierenden Höchstgehalte oder Auslösewerte, da hier die Präzision höher ist, als es in einer Routine möglich ist, in der ein unbekanntes Spektrum möglicher Kongeneren-Muster überprüft werden muss. In solchen Fällen ist der Berechnung der Cut-off-Werte eine RSDR = 25 % zugrunde zu legen, oder aber es sind zwei Drittel des Höchstgehalts oder des Auslösewerts als Cut-off-Wert zu verwenden.
7.4. Leistungsmerkmale
8. Bericht über die Ergebnisse
Bestätigungsverfahren
Bioanalytische Screening-Verfahren
Physikalisch-chemische Screening-Verfahren
2) Die derzeitigen Anforderungen basieren auf den in M. Van den Berg et al, Toxicol Sci 932, 223-241 (2006) veröffentlichten TEF.
| Anlage |
TEF der WHO zur Bewertung des Risikos beim Menschen auf Grundlage der Schlussfolgerungen der Experten-Sitzung der Weltgesundheitsorganisation und des Internationalen Programms für Chemikaliensicherheit (IPCS - International Programme on Chemical Safety) in Genf im Juni 2005 1
| Kongener | TEF-Wert | Kongener | TEF-Wert |
|
Dibenzo-p-dioxine (PCDD) |
"Dioxinähnliche" PCB: | ||
| 2,3,7,8-TCDD | 1 | ||
| 1,2,3,7,8-PeCDD | 1 | Nonortho-PCB | |
| 1,2,3,4,7,8-HxCDD | 0,1 | PCB 77 | 0,0001 |
| 1,2,3,6,7,8-HxCDD | 0,1 | PCB 81 | 0,0003 |
| 1,2,3,7,8,9-HxCDD | 0,1 | PCB 126 | 0,1 |
| 1,2,3,4,6,7,8-HpCDD | 0,01 | PCB 169 | 0,03 |
| OCDD | 0,0003 | ||
| Dibenzofurane (PCDF) | Monoortho-PCB | ||
| 2,3,7,8-TCDF | 0,1 | PCB 105 | 0,00003 |
| 1,2,3,7,8-PeCDF | 0,03 | PCB 114 | 0,00003 |
| 2,3,4,7,8-PeCDF | 0,3 | PCB 118 | 0,00003 |
| 1,2,3,4,7,8-HxCDF | 0,1 | PCB 123 | 0,00003 |
| 1,2,3,6,7,8-HxCDF | 0,1 | PCB 156 | 0,00003 |
| 1,2,3,7,8,9-HxCDF | 0,1 | PCB 157 | 0,00003 |
| 2,3,4,6,7,8-HxCDF | 0,1 | PCB 167 | 0,00003 |
| 1,2,3,4,6,7,8-HpCDF | 0,01 | PCB 189 | 0,00003 |
| 1,2,3,4,7,8,9-HpCDF | 0,01 | ||
| OCDF | 0,0003 | ||
| Abkürzungen: "T" = tetra; "Pe" = penta; "Hx" = hexa; "Hp" = hepta; "O" = octa; "CDD" = Chlordibenzodioxin; "CDF" = Chlordibenzofuran; "CB" = Chlorbiphenyl | |||
| Probenvorbereitung und Anforderungen an Untersuchungsverfahren zur Kontrolle des Gehalts an nicht dioxinähnlichen PCB in bestimmten Lebensmitteln | Anhang IV |
Die in diesem Anhang beschriebenen Anforderungen gelten, wenn Lebensmittel zur amtlichen Kontrolle des Gehalts an nicht dioxinähnlichen PCB sowie für die Probenvorbereitung und Untersuchungsanforderungen zu anderen regulatorischen Zwecken, darunter die Kontrollen der Lebensmittelunternehmer zur Gewährleistung der Vorschriftsmäßigkeit gemäß Artikel 4 der Verordnung (EG) Nr. 852/2004, untersucht werden.
Die Bestimmungen zur Probenvorbereitung gemäß Anhang III Nummer 3 dieser Verordnung gelten für die Kontrolle der Gehalte an nicht dioxinähnlichen PCB in Lebensmitteln.
1. Anzuwendende Nachweisverfahren
Gaschromatografie/Elektroneneinfangdetektor (GC-ECD), GC-LRMS, GC-MS/MS, GC-HRMS oder gleichwertige Verfahren.
2. Bestimmung und Bestätigung der interessierenden Analyten
Relative Abweichung des Isotopenhäufigkeitsverhältnisses ausgewählter Massenfragmente von der theoretischen Häufigkeit oder dem Kalibrierstandard für das Zielion (das am häufigsten vorkommende Ion) und das/die Qualifizier-Ion/en: ± 15 %.
Bestätigung der Ergebnisse, die den Höchstgehalt überschreiten, anhand von zwei GC-Säulen mit stationären Phasen unterschiedlicher Polarität.
3. Nachweis der Leistungsfähigkeit des Verfahrens
Validierung im Bereich des Höchstgehalts (0,5- bis 2-maliger Höchstgehalt) mit einem akzeptablen Variationskoeffizienten für wiederholte Analysen (siehe Anforderungen an die Laborpräzision unter Nummer 8).
4. Bestimmungsgrenze
Die Summe der Bestimmungsgrenzen (LOQ) 2 nicht dioxinähnlicher PCB darf ein Drittel des Höchstgehalts nicht übersteigen 3.
5. Qualitätssicherung
Regelmäßige Methodenleerwert-Kontrollen, Analysen dotierter Proben, Qualitätssicherungsproben, Teilnahme an Laborvergleichsuntersuchungen zu relevanten Matrices.
6. Kontrolle der Wiederfindungsrate
7. Anforderungen an Laboratorien
Gemäß den Bestimmungen der Verordnung (EG) Nr. 882/2004 müssen die Laboratorien von einer anerkannten Stelle akkreditiert sein, die nach ISO Guide 58 arbeitet, damit sichergestellt ist, dass die Laboratorien bei der Untersuchung Qualitätssicherungsverfahren anwenden. Die Laboratorien müssen gemäß der Norm EN ISO/IEC 17025 akkreditiert sein. Zudem ist den in den technischen Leitlinien für die Schätzung der Messunsicherheit und der Bestimmungsgrenzen für die Untersuchung auf PCB beschriebenen Grundsätzen - falls zutreffend - zu folgen 4.
8. Leistungsmerkmale: Kriterien für die Summe der nicht dioxinähnlichen PCB im Bereich des Höchstgehalts
| Isotopenverdünnungs-Massenspektrometrie* | Andere Techniken | |
| Richtigkeit | - 20 bis + 20 % | - 30 bis + 30 % |
| Laborpräzision (RSDR) | < 15 % | < 20 % |
| Differenz zwischen berechneter Obergrenze ("upperbound") und Untergrenze ("lowerbound") | < 20 % | < 20 % |
| *) Alle sechs 13C-markierten Analoga müssen als interne Standards verwendet werden. | ||
9. Bericht über die Ergebnisse
2) Falls zutreffend, ist den im "Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food" [link to website] beschriebenen Grundsätzen zu folgen.
3) Ein geringerer Beitrag der Methodenleerwerte zum Kontaminationsgehalt der Probe ist äußerst empfehlenswert. Das Labor ist dafür zuständig, die Variation der Methodenleerwerte zu überwachen, insbesondere, wenn die Methodenleerwerte abgezogen werden.
4) Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry [link to website], Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food [link to website].
 | ENDE |  |