umwelt-online: Verordnung (EU) 2017/735 zur Änderung - zwecks Anpassung an den technischen Fortschritt - des Anhangs der Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der Verordnung (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (4)
 | zurück |  |
.
| Definitionen und Einheiten | Anlage 1 |
Definitionen und Einheiten
Assimilationseffizienz (α)- ein Maß für die relative Stoffmenge, die aus dem Darm in den Organismus absorbiert wird (α ist einheitslos, wird jedoch häufig als Prozentsatz und nicht als Bruchteil ausgedrückt).
Aufnahmekonstante (k1)- der numerische Wert, der die Geschwindigkeit des Anstiegs der Konzentration des Prüfstoffs in oder auf den Versuchsfischen (oder bestimmten Geweben dieser Fische) definiert, wenn die Fische diesem Stoff ausgesetzt sind (wobei (k1) in l kg-1 Tag-1 angegeben wird).
Ausscheidungs- oder Post-Expositionsphase - die Zeit nach der Umsetzung der Versuchsfische aus dem prüfstoffhaltigen Medium in ein prüfstofffreies Medium, in der der Abbau (oder der Nettoverlust) des Prüfstoffs in den Versuchsfischen (oder bestimmten Geweben dieser Fische) untersucht wird.
Ausscheidungskonstante (k2)- der numerische Wert, der die Geschwindigkeit der Abnahme der Prüfstoffkonzentration in den Versuchsfischen (oder bestimmten Geweben dieser Fische) definiert, der auf die Umsetzung der Versuchsfische aus einem prüfstoffhaltigen Medium in ein prüfstofffreies Medium folgt (wobei k2 in Tag-1 angegeben wird).
Bioakkumulation - die Anreicherung des Prüfstoffs in einem Organismus auf ein Niveau, das das Konzentrationsniveau im Atmungsmedium (z.B. Wasser für einen Fisch oder Luft für ein Säugetier), im Futter oder in beidem übersteigt (1).
Biokonzentration - die Anreicherung des Prüfstoffs in oder auf einem Organismus (oder bestimmten Geweben dieses Organismus) im Verhältnis zu seiner Konzentration im umgebenden Medium.
Biokonzentrationsfaktor (BCF oder KB)- das Verhältnis (gemessen zu einem beliebigen Zeitpunkt während der Aufnahmephase dieses Akkumulationstests) der Konzentration des Prüfstoff in/auf den Fischen oder bestimmten Fischgeweben (Cf in mg/kg) zur Konzentration des Prüfstoff im umgebenden Medium (Cw in mg/l), ausgedrückt in l-kg 1. Es ist zu beachten, dass Korrekturen um das Wachstum und/oder einen Standardlipidgehalt nicht berücksichtigt werden.
Biokonzentrationsfaktor bei stationärem Zustand oder steady-state- Biokonzentrationsfaktor (BCFSS)- er ändert sich über einen längeren Zeitraum nicht wesentlich; die Konzentration des Prüfstoffs im umgebenden Medium ist während dieser Zeit konstant (siehe Definition des Begriffs "Stationärer Zustand").
Biomagnifikation - die Anreicherung des Prüfstoffs in oder auf einem Organismus (oder bestimmten Geweben dieses Organismus) im Verhältnis zu seiner Konzentration im Futter.
Biomagnifikationsfaktor (BMF)- die Konzentration eines Stoffs in einem Prädator (Raubfisch) im Verhältnis zur Konzentration desselben Stoffs in dessen Beute (oder Nahrung) bei stationärem Zustand. Bei der hier beschriebenen Prüfmethode wird die aquatische Exposition sorgfältig vermieden, weshalb ein BMF-Wert aus dieser Prüfmethode nicht unmittelbar mit einem BMF-Wert aus einem Feldversuch (bei dem die aquatische Exposition und die Exposition über das Futter miteinander kombiniert werden können) vergleichbar ist.
Chemikalie - ein Stoff oder Gemisch.
Expositions- oder Aufnahmephase - die Zeit, in der die Fische dem Prüfstoff ausgesetzt sind.
Festphasen-Mikroextraktion (SPME)- ein lösungsmittelfreies Analyseverfahren, das für verdünnte Systeme entwickelt wurde. Bei dieser Methode wird eine polymerbeschichtete Faser der gasförmigen oder flüssigen Phase mit dem untersuchten Analyt ausgesetzt. Im Allgemeinen wird eine Mindestanalysezeit angesetzt, damit in Bezug auf die Prüfspezies Gleichgewichtsbedingungen zwischen der festen und flüssigen Phase hergestellt werden können. Anschließend kann das untersuchte Analyt je nach Nachweisverfahren direkt aus der Faser oder nach Extraktion aus der Faser in ein Lösungsmittel bestimmt werden.
Futterbezogener Biomagnifikationsfaktor (futterbezogener BMF)- innerhalb dieser Prüfmethode verwendeter Begriff zur Beschreibung der Prüfergebnisse bei Exposition über das Futter, während eine Exposition über das Wasser sorgfältig vermieden wird. Daher ist der futterbezogene BMF-Wert aus dieser Prüfmethode nicht unmittelbar mit einem BMF-Wert aus einer Feldstudie (bei der die aquatische Exposition und die Exposition über das Futter miteinander kombiniert werden können) vergleichbar.
Futteringestionsrate (I)- die pro Fisch und Tag aufgenommene durchschnittliche Futtermenge, bezogen auf das geschätzte durchschnittliche Körpergewicht des ganzen Fisches (ausgedrückt in g Futter/g Fisch/Tag).
Gelöster organischer Kohlenstoff (DOC)- ein Maß für die Konzentration des Kohlenstoffs, der aus gelösten organischen Quellen im Prüfmedium stammt.
Gesamter organischer Kohlenstoff (TOC)- ein Maß für die Konzentration des Kohlenstoffs aus allen organischen Quellen im Prüfmedium, einschließlich partikulären und gelösten Quellen.
Kinetischer Biokonzentrationsfaktor (BCFK)- das Verhältnis der Aufnahmekonstanten, k1, zur Ausscheidungskonstanten, k2 (d. h. k1/k2 - siehe entsprechende Definitionen in dieser Anlage). Im Prinzip sollte der Wert mit dem BCFSS (siehe Definition) vergleichbar sein, es können jedoch Abweichungen auftreten, wenn der stationäre Zustand unsicher war oder der kinetische BCF wachstumskorrigiert wurde.
Lipidnormalisierter kinetischer Biokonzentrationsfaktor (BCFKL)- Standardisierung auf einen Fisch mit einem Lipidgehalt von 5 %.
Lipidnormalisierter wachstumskorrigierter kinetischer Biokonzentrationsfaktor (BCFKgL)- Standardisierung auf einen Fisch mit einem Lipidgehalt von 5 % und Korrektur um das Wachstum während der Versuchsdauer, siehe Anlage 5.
Lipidnormalisierter Biokonzentrationsfaktor im Gleichgewichtszustand (BCFSSL)- Standardisierung auf einen Fisch mit einem Lipidgehalt von 5 %.
Mehrkomponentiger Stoff - im Sinne der REACH-Verordnung definiert als Stoff, der mehrere Hauptkomponenten aufweist, die in einer Konzentration zwischen 10 % und 80 % (w/w) vorhanden sind.
Octanol/Wasser-Verteilungskoeffizient (KOW)- das Verhältnis der Löslichkeit eines Stoffs in n-Octanol und Wasser in stabilem Zustand (Methoden A.8 (2), A.24 (3), A.23 (4)); auch als POW bezeichnet. Der Logarithmus von KOW dient als Indikator des Potenzials eines Stoffes zur Biokonzentration in Wasserorganismen.
Partikulärer organischer Kohlenstoff (POC)- ein Maß für die Konzentration von Kohlenstoff aus suspendierten organischen Quellen im Prüfmedium.
Prüfchemikalie - ein Stoff oder ein Gemisch, der bzw. das nach dieser Methode geprüft wird.
Stationärer Zustand oder Steady-state - gilt in der graphischen Darstellung des gegen die Zeit aufgetragenen Prüfstoffs im Fisch (Cf) als erreicht, wenn die Kurve parallel zur Zeitachse verläuft und drei aufeinanderfolgende Cf-Analysen, die an Proben durchgeführt werden, die im Abstand von mindestens zwei Tagen entnommen wurden, um nicht mehr als ± 20 % voneinander abweichen, bzw. wenn es in der Zeit zwischen der ersten und letzten aufeinanderfolgenden Analyse keinen bedeutenden Anstieg von Cf gibt. Werden gepoolte Proben analysiert, sind mindestens vier aufeinanderfolgende Analysen erforderlich. Für Prüfstoffe, die nur langsam aufgenommen werden, ist ein zeitlicher Abstand zwischen den Probenahmen von sieben Tagen geeigneter.
UVCB-Stoffe- Stoffe mit unbekannter oder variabler Zusammensetzung, komplexe Reaktionsprodukte oder biologische Materialien.
Literaturhinweise
(1) Gobas F.A.P.C., de Wolf W., Burkhard L.P., Verbruggen E. and Plotzke K. (2009), Revisiting bioaccumulation criteria for POPs and PBT assessments. Integr. Environ. Assess. Manag. 5: 624-637.
(2) Kapitel A.8 dieses Anhangs, Verteilungskoeffizient (n-Octanol/Wasser): Schüttelmethode.
(3) Kapitel A.24 dieses Anhangs, Verteilungskoeffizient (n-Octanol/Wasser): HPLC-Methode.
(4) Kapitel A.23 dieses Anhangs, Verteilungskoeffizient (1-Octanol/Wasser): Methode mit langsamem Rühren.
.
| Chemische Eigenschaften eines geeigneten Verdünnungswassers | Anlage 2 |
| Komponente | Limit-Konzentration |
| Partikel | 5 mg/l |
| Gesamter organischer Kohlenstoff | 2 mg/l |
| Nicht ionisierter Ammoniak | 1 µg/l |
| Restchlor | 10 µg/l |
| Gesamtgehalt an phosphororganischen Pestiziden | 50 ng/l |
| Gesamtgehalt an chlororganischen Pestiziden plus polychlorierten Biphenylen | 50 ng/l |
| Gesamtgehalt an organischem Chlor | 25 ng/l |
| Aluminium | 1 µg/l |
| Arsen | 1 µg/l |
| Chrom | 1 µg/l |
| Cobalt | 1 µg/l |
| Kupfer | 1 µg/l |
| Eisen | 1 µg/l |
| Blei | 1 µg/l |
| Nickel | 1 µg/l |
| Zink | 1 µg/l |
| Cadmium | 100 ng/l |
| Quecksilber | 100 ng/l |
| Silber | 100 ng/l |
.
| Für die Prüfung empfohlene Fischarten | Anlage 3 |
| Empfohlene Arten | Empfohlener Prüftemperaturbereich °C) | Empfohlene Gesamtlänge des Versuchstiers (cm) 2 |
| Danio rerio 1 (Teleostei, Cyprinidae) (Hamilton-Buchanan) Zebrafisch | 20 - 25 | 3,0 ± 0,5 |
| Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) Dickkopfelritze | 20 - 25 | 5,0 ± 2,0 |
| Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) Karpfen | 20 - 25 | 8,0 ± 4,0 3 |
| Oryzias latipes (Teleostei, Poecilliidae) (Temminck & Schlegel) Reiskärpfling | 20 - 25 | 4,0 ± 1,0 |
| Poecilia reticulata (Teleostei, Poeciliidae) (Peters) Guppy | 20 - 25 | 3,0 ± 1,0 |
| Lepomis macrochirus (Teleostei Centrarchidae) (Rafinesque) Blauer Sonnenbarsch | 20 - 25 | 5,0 ± 2,0 |
| Oncorhynchus mykiss (Teleostei Salmonidae) (Walbaum) Regenbogenforelle | 13 - 17 | 8,0 ± 4,0 |
| Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) Dreistacheliger Stichling | 18 - 20 | 3,0 ± 1,0 |
| 1) Meyer et al. (1)
2) Es ist zu beachten, dass bei der Prüfung als solcher das Gewicht das bevorzugte Maß für die Berechnung der Größen- und Wachstumskonstanten ist. Es wird jedoch anerkannt, dass die Länge geeigneter ist, wenn die Fische vor Versuchsbeginn visuell (aus der Stammpopulation) ausgewählt werden müssen. 3) Dieser Längenbereich ist in den Prüfmethoden für neue chemische Stoffe angegeben und basiert auf dem Chemical Substances Control Law (CSCL) Japans. | ||
Die folgenden Ästuar- und Meeresspezies wurde weniger häufig verwendet:
| Augenfleck-Umber | (Leiostomus xanthurus) |
| Edelsteinkärpfling | (Cyprinodon variegatus) |
| Gezeiten-Ährenfisch | (Menidia beryllina) |
| Juwelflussbarsch | (Cymatogaster aggregata) |
| Englische Seezunge | (Parophrys vetulus) |
| Geweihgroppe | (Leptocottus armatus) |
| Dreistacheliger Stichling | (Gasterosteus aculeatus) |
| Seebarsch | (Dicentracus labrax) |
| Ukelei | (Alburnus alburnus) |
Die in vorstehender Tabelle genannten Süßwasserfische sind leicht zu züchten oder stehen größtenteils ganzjährig zur Verfügung, wohingegen die Verfügbarkeit der Ästuarinen- und Meeresspezies teilweise auf bestimmte Länder beschränkt ist. Diese Arten können in Teichwirtschaften oder im Labor unter krankheits- und parasitenkontrollierten Bedingungen gezüchtet und aufgezogen werden, damit gesunde Versuchstiere bereitstehen, deren Abstammung bekannt ist. Diese Fische sind in vielen Teilen der Welt verfügbar.
Literaturhinweise
(1) Meyer A., Biermann C.H. and Orti G. (1993), The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: An invitation to the comparative method Proc. R. Soc. Lond. B. 252: 231-236.
.
| Probenahmepläne für Prüfungen mit aquatischer Exposition und mit Exposition über das Futter | Anlage 4 |
1. Hypothetisches Beispiel eines Probenahmeplans für die vollständige Biokonzentrationsprüfung mit aquatischer Exposition eines Stoffs mit log KOW = 4
| Beprobung von Fischen | Probenahmeplan | Anzahl Wasserproben 1 | Anzahl Fische je Probe 1 | |
| Erforderliche Mindesthäufigkeit (Tage) 2 | Zusätzliche Probenahmen (Tage) 2 | |||
| Aufnahmephase | ||||
| 1 | - 1 | 2 3 | 4 4 | |
| 0 | (2) | (3 4) | ||
| 2 | 0,3 | 2 | 4 | |
| 0,4 | (2) | (4) | ||
| 3 | 0,6 | 2 | 4 | |
| 0,9 | (2) | (4) | ||
| 4 | 1,2 | 2 | 4 | |
| 1,7 | (2) | (4) | ||
| 5 | 2,4 | 2 | 4 | |
| 3,3 | (2) | (4) | ||
| 6 | 4,7 | 2 | 4 - 8 5 | |
| (3 6) | ||||
| Ausscheidungsphase | Umsetzung der Fische in prüfstofffreies Wasser | |||
| 7 | 5,0 | 2 | 4 | |
| 5,3 | (4) | |||
| 8 | 5,9 | 2 | 4 | |
| 7,0 | (4) | |||
| 9 | 9,3 | 2 | 4 | |
| 11,2 | (4) | |||
| 10 | 14,0 | 2 | 4 - 8 5 | |
| 17,5 | (4 + 3 6) | |||
|
INSGESAMT | 40 - 72
(48 - 80) 5 | |||
| 1) Die Werte in Klammern entsprechen der Zahl der zu entnehmenden Proben (Wasser, Fische), wenn eine zusätzliche Probenahme durchgeführt wird.
2) Die Vorversuchsschätzung von k2 bei einem log KOW von 4,0 ergibt 0,652 Tage-1. Die Gesamtdauer des Versuchs ist auf 3 x tSS = 3 x 4,6 Tage, d. h. 14 Tage, festgelegt. Für die Schätzung von tSS siehe Anlage 5. 3) Die Wasserprobe entnehmen, nachdem mindestens 3 "Kammervolumen" gezogen wurden. 4) Diese Fische werden der Stammpopulation entnommen. 5) Sind größere Genauigkeit oder Metabolismusuntersuchungen erforderlich, wozu mehr Fische benötigt werden, sollten diese insbesondere am Ende der Aufnahme- und der Ausscheidungsphase entnommen werden (siehe Nummer 40). 6) Zur Analyse des Lipidgehalts können mindestens 3 zusätzliche Fische erforderlich werden, wenn die Fische, die zur Bestimmung der Prüfstoffkonzentrationen zu Beginn des Tests, am Ende der Aufnahmephase und am Ende der Ausscheidungsphase beprobt wurden, nicht verwendet werden können. Es ist zu beachten, dass es in vielen Fällen möglich sein sollte, nur die 3 Kontrollfische zu verwenden (siehe Nummer 56). | ||||
2. Hypothetisches Beispiel eines Probenahmeplans für die Bioakkumulationsprüfung eines Stoffs mit Exposition über das Futter nach 10 Tagen Aufnahme und 42 Tagen Ausscheidung
| Probenahmezeitpunkt | Probenahmeplan | Anzahl Futterproben | Anzahl Fische je Probe | ||
| Tag der Phase | Zusätzliche Fischproben? | Prüfgruppe | Kontrollgruppe | ||
| Aufnahmephase | |||||
| 1 | 0 | Möglich 1 2 | 3 - Prüfgruppe | 0 | 5 - 10 |
| 3 - Kontrollgruppe 1 | (8 - 13) 2 | ||||
| 1A 3 | 1-3 | 5 - 10 | 5 - 10 | ||
| 2 | 10 | Ja 85 | 3 - Prüfgruppe | 10 - 15 4 | 5 - 10 |
| 3 - Kontrollgruppe 1 | (13 - 18) 5 | (8 - 13) 5 | |||
| Ausscheidungsphase | |||||
| 3 | 1 | Ja 4 | 10 - 15 4 | 5 - 10 | |
| 4 | 2 | 5 - 10 | 5 - 10 | ||
| 5 | 4 | 5 - 10 | 5 - 10 | ||
| 6 | 7 | Ja 4 | 10 - 15 4 | 5 - 10 | |
| 7 | 14 | 5 - 10 | 5 - 10 | ||
| 8 | 28 | 5 - 10 | 5 - 10 | ||
| 9 | 42 | Ja 4 | 10 - 15 4
(13 - 18) 5 | 5 - 10
(8 - 13) 5 | |
|
INSGESAMT | 59 - 120
(63 - 126) 4 5 | 50 - 110
(56 - 116) 4 5 | |||
| 1) 3 Futterproben aus der Kontroll- und der Prüfgruppe, die auf Prüfstoffkonzentrationen und Lipidgehalt analysiert wurden.
2) Die Fische werden möglichst zu Beginn des Versuchs aus der Stammpopulation entnommen; mindestens 3 Fische aus der Stammpopulation sollten zu Versuchsbeginn auf ihren Lipidgehalt untersucht werden. 3) Die (optionale) Probenahme zu Beginn der Aufnahmephase liefert Daten für die Berechnung der Assimilation des Prüfstoffs über das Futter, die mit Assimilationseffizienzdaten aus der Ausscheidungsphase verglichen werden können. 4) 5 zusätzliche Fische können für Gewebeanalysen entnommen werden. 5) Zur Analyse des Lipidgehalts können mindestens 3 zusätzliche Fische erforderlich werden, wenn die Fische, die zur Bestimmung der Prüfstoffkonzentrationen bei Versuchsbeginn, am Ende der Aufnahmephase und am Ende der Ausscheidungsphase beprobt wurden, nicht verwendet werden können. Es ist zu beachten, dass es in vielen Fällen möglich sein sollte, nur die 3 Kontrollfische zu verwenden (siehe Nummern 56 und 153). | |||||
Anmerkung zu Phasen und Probenahmezeitpunkten: Die Aufnahmephase beginnt mit der ersten Veabreichung des dotierten Futters. Ein Versuchstag reicht von einer Fütterung bis kurz vor die nächste Fütterung 24 Stunden später. Die erste Probenahme (1 in der Tabelle) sollte kurz vor der ersten Fütterung (z.B. 1 Stunde früher) erfolgen. Im Rahmen eines Versuchs sollte die Probenahme idealerweise kurz vor der Fütterung am Folgetag (d. h. ca. 23 Stunden nach der Fütterung am Probenahmetag) durchgeführt werden. Die Aufnahmephase endet kurz vor der ersten Verabreichung des undotierten Futters, wenn die Ausscheidungsphase beginnt (es muss davon ausgegangen wrden, dass die Fische aus der Prüfgruppe das dotierte Futter in den dazwischenliegenden 24 Stunden seit der letzten Fütterung mit dotiertem Futter wahrscheinlich noch verdauen). Dies bedeutet, dass die Probe am Ende der Aufnahmephase kurz vor der ersten Verfütterung des undotierten Futters und die erste Probe der Ausscheidungsphase ungefähr23 Stunden nach der ersten Verfütterung des undotierten Futters entnommen werden sollte.
.
| Allgemeine Berechnungen | Anlage 5 |
1. Einleitung
Das allgemeine Modell für Bioakkumulation in Fischen im aquatischen Milieu beschreibt den Aufnahme- und den Ausscheidungsprozess; die Aufnahme des Prüfstoffs über das Futter wird dabei ignoriert. Die Differentialgleichung (dCf/dt) zur Beschreibung der Rate der Veränderung der Konzentration im Fisch (mg·kg-1·Tag-1) wird angegeben durch (1):
| DCf/dt = k1 x Cw - (k2 + kg + km + ke) x Cf | [Gleichung A5.1] |
Dabei gilt:
k1 = Geschwindigkeitskonstante erster Ordnung der Aufnahme des Stoffes durch den Fisch (l·kg-1·Tag-1).
k2 = Geschwindigkeitskonstante erster Ordnung der Ausscheidung durch den Fisch (Tag-1).
kg = Geschwindigkeitskonstante erster Ordnung des Fischwachstums (Effekt der Verdünnung durch Wachstum) (Tag-1)
km = Geschwindigkeitskonstante erster Ordnung der metabolischen Umwandlung (Tag-1)
km = Geschwindigkeitskonstante erster Ordnung der Egestion (Tag-1)
Cw = Konzentration in Wasser (mg·l-1).
Cf = Konzentration im Fisch (mg·kg-1 Nassgewicht).
Bei bioakkumulierenden Substanzen kann davon ausgegangen werden, dass ein zeitgewichteter Durchschnitt (time-weighted average, TWA) innerhalb des zulässigen Schwankungsbereichs die relevanteste Expositionskonzentration in Wasser (Cw) ist (siehe Nummer 24). Es wird empfohlen, nach dem Verfahren in Anlage 6 der Prüfmethode TM C.20 (2) einen TWA für die Wasserkonzentration zu berechnen. Es wird darauf hingewiesen, dass die logarithmische Umwandlung der Konzentration im Wasser sinnvoll ist, wenn ein exponentieller Zerfall zwischen Erneuerungsphasen erwartet wird, z.B. bei semistatischem Versuchsaufbau. In einem Durchflusssystem ist die logarithmische Umwandlung der Expositionskonzentrationen u. U. nicht notwendig. Werden zeitgewichtete Durchschnittswerte der Wasserkonzentrationen berechnet, sollten diese angegeben und für die nachfolgenden Berechnungen verwendet werden.
Bei einem Standard-BCF-Fischtest lassen sich Aufnahme und Ausscheidung als zwei kinetische Prozesse erster Ordnung beschreiben.
| Aufnahmerate = k1 x Cw | [Gleichung A5.2] |
| Gesamtausscheidungsrate = (k1 + kg + km + ke) x Cf | [Gleichung A5.3] |
Bei stationärem Zustand und davon ausgehend, dass Wachstum und Metabolisierung unerheblich sind (d. h. die Werte für kg und km sind nicht von Null zu unterscheiden), entspricht die Aufnahmerate der Ausscheidungsrate, sodass die Gleichungen A5.2 und A5.3 kombiniert Folgendes ergeben:
| [Gleichung A5.4] |
Dabei gilt:
Cf-SS = Konzentration im Fisch bei stationärem Zustand (mg kg-1 Nassgewicht).
Cw-SS = Konzentration im Wasser bei stationärem Zustand (mg l-1).
Der Quotient k1/k2 wird als kinetischer BCF (BCFK) bezeichnet und sollte dem BCF bei stationärem Zustand (BCFSS) entsprechen, der aus dem Verhältnis der Konzentration im Fisch bei stationärem Zustand zur Konzentration im Wasser errechnet wurde. Jedoch können Abweichungen auftreten, wenn der stationäre Zustand unsicher ist oder wenn der kinetische BCF wachstumskorrigiert wurde. Da k1 und k2 jedoch Konstanten sind, braucht zur Ableitung eines BCFK kein stationärer Zustand erreicht zu werden.
Gestützt auf diese Gleichungen erster Ordnung enthält Anlage 5 die allgemeinen Berechnungen, die sowohl für die Bioakkumulationsmethode mit aquatischer Exposition als auch für die Bioakkumulationsmethode mit Exposition über das Futter erforderlich sind. Die Abschnitte 5, 6 und 8 sind zwar nur für die Methode mit aquatischer Exposition relevant, werden jedoch als "allgemeine" Verfahren miteinbezogen. Die sequenziellen Methoden (Abschnitte 4 und 5) und die Simultanmethode (Abschnitt 6) ermöglichen die Berechnung von Aufnahme- und Ausscheidungskonstanten, die zur Ableitung kinetischer BCF verwendet werden. Die sequenzielle Methode für die Bestimmung von k2 (Abschnitt 4) ist für die futterbezogene Methode wichtig, da sie sowohl zur Berechnung der Assimilationseffizienz als auch des BMF benötigt wird. Anlage 7 enthält konkrete Berechnungsvorschriften für die futterbezogene Methode.
2. Vorabschätzung der Dauer der Aufnahmephase
Vor der Durchführung des Versuchs kann auf Basis empirischer Beziehungen zwischen k2 und dem n-Octanol/Wasser-Verteilungskoeffizienten (KOW) bzw. zwischen k1 und BCF ein Schätzwert für k2 und somit eine Prozentziffer für die zum Erreichen des stationären Zustands benötigten Zeit abgeleitet werden. Es ist jedoch zu beachten, dass die Gleichungen in diesem Abschnitt nur für den Fall gelten, dass Aufnahme und Ausscheidung der Kinetik erster Ordnung folgen. Ist dies eindeutig nicht der Fall, empfiehlt es sich, den Rat eines Biostatistikers und/oder Pharmakokinetikers einzuholen, um die Aufnahmephase vorabzuschätzen.
k2 (Tag-1) lässt sich nach verschiedenen Methoden schätzen. Beispielsweise könnten als erstes die folgenden empirischen Beziehungen herangezogen werden 1:
| log k2 = 1,47 - 0,414logKOW | (r2 = 0,95) [(3); Gleichung A5.5] |
oder
| k2 = k1/BCF | [Gleichung A5.6] |
| Dabei gilt: k1 = 520 x W-0,32 (für Stoffe mit log KOW > 3) | (r2 = 0,85) [(4); Gleichung A5.7] |
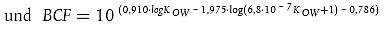 | (r2 = 0,90) [(5); Gleichung A5.8] |
W = mittleres Gewicht des behandelten Fisches (Nassgewicht in g) am Ende der Aufnahme/zu Beginn der Ausscheidung 2
Siehe (6) für andere verwandte Beziehungen. Es kann von Vorteil sein, für die Schätzung von k2 komplexere Modelle zu verwenden, beispielsweise wenn mit einer erheblichen Metabolisierung gerechnet werden muss (7) (8). Da dieses Modell jedoch komplexer ist, sollten Vorabschätzungen mit Vorsicht ausgewertet werden. Das Vorhandensein von Nitro-Gruppen könnte auf eine schnelle Metabolisierung hindeuten, was aber nicht immer der Fall ist. Daher sollte der Anwender die Ergebnisse prädiktiver Methoden bei der Planung einer Studie gegen Informationen zur chemischen Struktur und andere relevante Informationen (z.B. aus Vorversuchen) abwägen.
Die bis zum Erreichen eines bestimmten Prozentsatzes des stationären Zustands erforderliche Zeit lässt sich - durch Anwendung des Schätzwertes k2- - aus der allgemeinen kinetischen Gleichung zur Beschreibung von Aufnahme und Elimination (Kinetik erster Ordnung) ableiten, wobei davon ausgegangen wird, dass Wachstum und Metabolisierung unerheblich sind. Kommt es während des Versuchs zu erheblichem Wachstum, sind die nachfolgend beschriebenen Schätzungen nicht zuverlässig. In solchen Fällen ist die Anwendung des wachstumskorrigierten k2g vorzuziehen, wie weiter unten beschrieben (siehe Abschnitt 7 dieser Anlage):
| dCf/dt = k1CW - k2Cf | [Gleichung A5.9] |
oder, wenn Cw konstant ist:
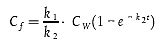 | [Gleichung A5.10] |
Bei Annäherung an den stationären Zustand (t → ∞) kann Gleichung A5.10 gekürzt werden (vgl. (9)(10)) zu
| Cf = (k1/k2) ⋅ CW | [Gleichung A5.11] |
oder
| Cf/CW = k1/k2 = BCF | [Gleichung A5.12] |
BCF x Cw ist somit eine Annäherung an die Konzentration im Fisch bei stationärem Zustand (Cf-SS). [Anm.: Der gleiche Ansatz kann auch bei der futterbezogenen Prüfung zur Schätzung eines BMF bei stationärem Zustand angewendet werden. In diesem Fall wird in den obigen Gleichungen der BCF durch den BMF und Cw durch CFutter, der Konzentration im Futter, ersetzt]
Gleichung A5.10 kann umformuliert zu
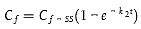 | [Gleichung A5.13] |
oder
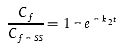 | [Gleichung A5.14] |
Bei Anwendung von Gleichung A5.14 kann die Zeit bis zum Erreichen eines gewissen Prozentsatzes des stationären Zustands vorausgeschätzt werden, wenn k2 zuvor nach den Gleichungen A5.5 oder A5.6 geschätzt wurde.
Als Richtschnur gilt, dass die für die Ableitung statistisch brauchbarer Daten (BCFK) statistisch optimale Aufnahmedauer der Zeit entspricht, die benötigt wird, damit die gegen die lineare Zeit aufgetragene Logarithmuskurve der Prüfstoffkonzentration in den Fischen mindestens 50 % des stationären Zustands (d. h. 0,69/k2), jedoch nicht mehr als 95 % des stationären Zustands (d. h. 3,0/k2) erreicht (11). Geht die Akkumulation über 95 % des stationären Zustands hinaus, kann ein BCFSS berechnet werden.
Die Zeit bis zum Erreichen eines 80 %igen stationären Zustands entspricht (nach Gleichung A5.14)
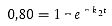 | [Gleichung A5.15] |
oder
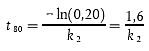 | [Gleichung A5.16] |
Gleichermaßen gilt für einen 95 %igen stationären Zustand:
| [Gleichung A5.17] |
Demnach entspräche beispielsweise die Dauer der Aufnahmephase (d. h. die Zeit bis zum Erreichen eines bestimmten Prozentsatzes des stationären Zustands, z.B. t80 oder t95) für einen Prüfstoff mit log KOW = 4 (unter Anwendung der Gleichungen A5.5, A5.16 und A5.17):
logk2 = 1,47 - 0,414 · 4
k2 = 0,652 Tage-1
t80 = 1,6/0,652 = 2,45 Tage (59 Stunden)
oder t95 = 3,0/0,652 = 4,6 Tage (110 Stunden)
Alternativ kann die Formel
| teSS = 6,54 · 10-3 · KOW + 55,31 (Stunden) | [Gleichung A5.18] |
angewendet werden, um die Zeit bis zum Erreichen des tatsächlichen stationären Zustands (teSS) zu berechnen (12). Für einen Prüfstoff mit log KOW = 4 ergibt dies
teSS = 6,54 · 10-3 · 104 + 55,31 = 121 Stunden
3. Vorabschätzung der Dauer der Ausscheidungsphase
Die Zeit, die zur Reduzierung der Körperbelastung auf einen gewissen Prozentsatz der Anfangskonzentration benötigt wird, lässt sich ebenfalls nach der allgemeinen kinetischen Gleichung über die Aufnahme und Ausscheidung (wobei eine Kinetik erster Ordnung vorausgesetzt wird, siehe Gleichung A5.9) vorabschätzen (1) (13).
Für die Ausscheidungsphase wird Cw (oder CFutter für die futterbezogene Prüfung) als Null angenommen. Die Gleichung kann reduziert werden auf
| DCf/dt = k2Cf | [Gleichung A5.19] |
oder
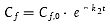 | [Gleichung A5.20] |
wobei Cf,0 der Konzentration zu Beginn der Ausscheidungsphase entspricht.
Eine 50 %ige Ausscheidung wird erreicht zum Zeitpunkt (t50):
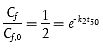
oder
t50 = -ln(0,50)/k2 = 0,693/k2
Gleichermaßen wird eine 95 %ige Ausscheidung erreicht zum Zeitpunkt
t95 = -ln(0,05)/k2 = 3,0/k2
Bei 80 %igen Aufnahme in der ersten Phase (1,6/k2) und 95 %igen Elimination in der Ausscheidungsphase (3,0/k2) wird die Ausscheidungsphase ungefähr doppelt solange dauern wie die Aufnahmephase.
Es wird darauf hingewiesen, dass die Schätzungen auf der Annahme beruhen, dass die Aufnahme- und Ausscheidungsmuster einer Kinetik erster Ordnung folgen. Wenn es sich jedoch eindeutig nicht um eine Kinetik erster Ordnung handelt, sind diese Schätzungen ungültig.
4. Sequentielle Methode: Bestimmung der Ausscheidungs-(Eliminations-)konstanten k2
Bisher wurde davon ausgegangen, dass sich die meisten Biokonzentrationsdaten mit einem einfachen 2-Kammer/2-Parameter-Modell hinreichend gut beschrieben lassen, wie die gradlinige Kurve, die die Punkte für die Konzentrationen in den Fischen (auf einer logarithmischen Skala) während der Ausscheidungsphase annähert, zeigt.
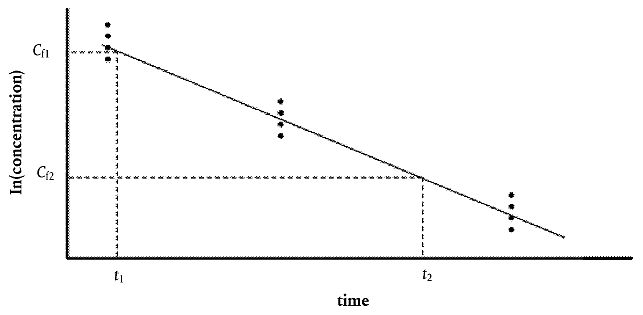
Es ist zu beachten, dass Abweichungen von einer Geraden auf ein komplexeres Ausscheidungsmuster als eine Kinetik erster Ordnung hindeuten können. Für eine Auswertung von Ausscheidungsvorgängen, die von der Kinetik erster Ordnung abweichen, kann eine graphische Methode angewandt werden.
Zur Berechnung von k2 für mehrere (Probenahme-)Zeitpunkte ist eine lineare Regression von ln(Konzentration) gegen die Zeit durchzuführen. Die Steigung der Regressionskurve entspricht einer Schätzung der Ausscheidungskonstanten k2 3. Anhand des Achsenabschnitts lässt sich die mittlere Konzentration in den Fischen zu Beginn der Ausscheidungsphase (C0,d; entspricht der mittleren Konzentration am Ende der Aufnahmephase) leicht berechnen (einschließlich Fehlergrenzen) 3:
| C0,d = e Achsenabschnitt | [Gleichung A5.21] |
Gibt es nur zwei (Probenahme-)Zeitpunkte (wie beim minimierten Versuchsplan), werden zur Berechnung von k2 die zwei durchschnittlichen Konzentrationen in der folgenden Gleichung ersetzt:
| [Gleichung A5.22] |
Dabei sind ln(Cf1) und ln(Cf2) die natürlichen Logarithmen der Konzentrationen zu den Zeitpunkten t1 bzw. t2, und t2 und t1 entsprechen den Zeitpunkten im Verhältnis zum Beginn der Ausscheidung, an dem die beiden Probenahmen erfolgt sind 4.
5. Sequenzielle Methode: Bestimmung der Aufnahmekonstanten k1 (nur bei aquatischer Exposition)
Für die Bestimmung von k1 auf Basis eines vorhandenen Satzes von über die Zeit ermittelten Konzentrationsdaten für die Aufnahmephase ist ein für folgendes Modell geeignetes Computerprogramm anzuwenden:
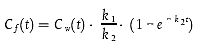 | [Gleichung A5.23] |
wobei k2 aus der vorangegangenen Berechnung stammt und Cf(t) und Cw(t) den Konzentrationen in den Fischen bzw. im Wasser zum Zeitpunkt t entsprechen.
Gibt es nur zwei (Probenahme-)zeitpunkte (wie beim minimierten Versuchsplan), ist zur Berechnung von k1 folgende Formel anzuwenden:
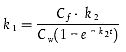 | [Gleichung A5.24] |
wobei k2 aus der vorangegangenen Berechnung stammt und Cf der Konzentration in den Fischen zu Beginn der Ausscheidungsphase und Cw der mittleren Konzentration im Wasser während der Aufnahmephase entsprechen 5.
Durch visuelle Überprüfung der Steigungen von k1 und k2, die gegen die Daten der gemessenen Probenahmepunkte aufgetragen werden, kann die Anpassungsgüte (Goodness-of-Fit) bewertet werden. Sollte es sich herausstellen, dass die sequenzielle Methode zu einer unzulänglichen Schätzung von k1 führt, sollte die simultane Methode zur Berechnung von k1 und k2 angewendet werden (siehe Abschnitt 6). Auch hier sollten die resultierenden Steigungen visuell mit den graphisch dargestellten Messdaten verglichen werden, um die Anpassungsgüte zu gewährleisten. Ist letztere weiterhin unzulänglich, kann dies darauf hindeuten, dass eine Kinetik erster Ordnung nicht zutrifft und andere, komplexere Modelle angewendet werden sollten.
6. Simultane Methode für die Berechnung der Aufnahme- und der Ausscheidungskonstanten (nur bei aquatischer Exposition)
Computerprogramme können auf Basis eines Satzes von über die Zeit ermittelten Konzentrationsdaten und dem Modell für die Bestimmung von k1 und k2 verwendet werden:
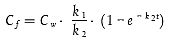 | 0 < t < tc | [Gleichung A5.25] |
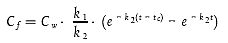 | t > t c | [Gleichung A5.26] |
Dabei gilt:
tc = Zeitpunkt am Ende der Aufnahmephase.
Aus diesem Ansatz ergeben sich unmittelbar die Standardfehler für die Schätzungen von k1 und k2. Wenn k1/k2 in den Gleichungen A5.25 und A5.26 durch den BCF (siehe Gleichung A5.4) ersetzt wird, können der Standardfehler und das 95 %-Konfidenzintervall des BCF ebenfalls geschätzt werden. Dies ist insbesondere nützlich, wenn aufgrund einer Datenumwandlung verschiedene Schätzwerte verglichen werden. Die abhängige Variable (Fischkonzentration) kann mit oder ohne logarithmische Umwandlung angepasst und die resultierende BCF-Unsicherheit kann bewertet werden.
Da zwischen den beiden Parametern k1 und k2 bei gleichzeitiger Schätzung eine starke Korrelation besteht, empfiehlt es sich, k2 zunächst nur anhand der Ausscheidungsdaten (siehe oben) zu berechnen; k2 kann in den meisten Fällen mit relativ hoher Genauigkeit anhand der Ausscheidungskurve geschätzt werden. Anschließend kann k1 unter Anwendung einer nichtlinearen Regression anhand der Aufnahmedaten berechnet werden 6. Es empfiehlt sich, die Daten bei der sequenziellen Anpassung gleichermaßen umzuwandeln.
Durch visuelle Überprüfung der resultierenden Steigungen, die gegen die Daten der gemessenen Probenahmepunkte aufgetragen werden, kann die Anpassungsgüte (Goodness-of-Fit) bewertet werden. Sollte es sich herausstellen, dass diese Methode zu einer unzulänglichen k1 -Schätzung führt, sollten k1 und k2 nach der simultanen Methode berechnet werden. Zur visuellen Überprüfung der Anpassungsgüte sollte das angepasste Modell wiederum mit den graphisch dargestellten Messdaten verglichen werden, und die resultierenden Parameterschätzungen für k1, k2 und den resultierenden BCF sowie die Standardfehler und/oder Konfidenzintervalle nach Anpassungsarten verglichen werden.
Eine unzulängliche Anpassungsgüte kann darauf hindeuten, dass eine Kinetik erster Ordnung nicht zutrifft und andere komplexere Modelle angewandt werden sollten. Eine der häufigsten Komplikationen besteht darin, dass die Fische während des Tests wachsen.
7. Korrektur um den Effekt der Verdünnung durch Wachstum zur Bestimmung des kinetischen BCF und des BMF
In diesem Abschnitt wird eine Standardmethode für die Korrektur um das Fischwachstum während der Prüfung (so genannter Effekt der Verdünnung durch Wachstum) beschrieben, die nur gültig ist, wenn eine Kinetik erster Ordnung zutrifft. Falls es Anzeichen dafür gibt, dass eine Kinetik erster Ordnung nicht zutrifft, empfiehlt es sich, den Rat eines Biostatistikers zur Korrektur um die Verdünnung durch Wachstum einzuholen oder den nachstehend beschriebenen massebasierten Ansatz anzuwenden.
In bestimmten Fällen mangelt diese Methode für die Korrektur um die Verdünnung durch Wachstum an Genauigkeit oder funktioniert nicht (z.B. kann bei sehr langsam ausgeschiedenen Stoffen, die an schnell wachsenden Fischen analysiert werden, die abgeleitete und um die Verdünnung durch Wachstum korrigierte Ausscheidungskonstante k2g sehr gering sein, sodass der Fehler bei den beiden Konstanten, die für die Ableitung herangezogen wurden, kritisch werden kann und in einigen Fällen kg höher geschätzt wird als k2). In solchen Fällen kann ein alternativer Ansatz (d. h. ein Massenansatz) angewendet werden, der auch dann funktioniert, wenn eine Kinetik erster Ordnung nicht zutrifft, weshalb der Korrekturbedarf entfällt. Dieser Ansatz wird am Ende dieses Abschnitts beschrieben.
Methode für die Korrektur um das Wachstum durch Subtraktion der Wachstumsrate
Bei der Standardmethode werden die individuellen Gewichts- und Längendaten in natürliche Logarithmen umgewandelt und ln(Gewicht) oder ln(1/Gewicht) wird gegen die Zeit (Tag) für Prüf- und Kontrollgruppen gesondert aufgetragen. Dasselbe Verfahren wird für die Daten aus der Aufnahme- und Ausscheidungsphase separat durchgeführt. Allgemein sollten bei der Korrektur um den Effekt der Verdünnung durch Wachstum eher die Gewichtsdaten aus der gesamten Studie verwendet werden, um die Wachstumskonstante (kg) abzuleiten. Doch können statistisch signifikante Unterschiede zwischen den Wachstumskonstanten, die für die Aufnahme- und Ausscheidungsphase abgeleitet werden, darauf hindeuten, dass die Ausscheidungskonstante verwendet werden sollte. Anhand der Gesamtwachstumsraten für die Prüf- und Kontrollgruppen aus den Versuchen mit aquatischer Exposition lassen sich behandlungsbedingte Wirkungen kontrollieren.
Für jede Gruppe (Prüf- und Kontrollgruppen, Einzeldaten, keine täglichen Mittelwerte) sowie für den gesamten Versuch, die Aufnahme- und die Ausscheidungsphase wird nach statistischen Verfahren eine lineare Korrelation der kleinsten Quadrate für ln(Fischgewicht) bezogen auf die zur Zeit (Tag) (und für ln(1/Gewicht) bezogen auf die Zeit) berechnet. Die Varianzen in den Steigungen der Kurven werden berechnet und herangezogen, um nach dem Student-t-Test (oder ANOVA, wenn mehr als eine Konzentration geprüft wird) die statistische Signifikanz (p = 0,05) der Differenz bei den Steigungen (Wachstumskonstanten) zu bewerten. Die Gewichtsdaten werden im Allgemeinen für die Korrektur um das Wachstum bevorzugt. Die auf dieselbe Weise behandelten Längendaten können für den Vergleich der Auswirkungen der Behandlung auf die Kontroll- und Prüfgruppen von Nutzen sein. Falls die Analyse der Gewichtsdaten keinen statistisch signifikanten Unterschied ergibt, können die Prüf- und Kontrolldaten gepoolt und eine Gesamtwachstumskonstante für den Versuch (kg), d. h. die Gesamtsteigung der linearen Korrelation, berechnet werden. Wenn statistisch signifikante Unterschiede beobachtet werden, sind die Wachstumskonstanten für jede Fischgruppe und/oder Versuchsphase separat anzugeben. Die kinetische Konstante jeder behandelten Gruppe sollte dann zur Korrektur um den Effekt der Verdünnung durch Wachstum dieser Gruppe herangezogen werden. Wenn zwischen den Aufnahme- und Ausscheidungskonstanten Unterschiede festgestellt wurden, sollten die abgeleiteten Ausscheidungskonstanten verwendet werden.
Die berechnete Wachstumskonstante (kg, angegeben als Tag-1) kann von der Gesamtausscheidungskonstanten (k2) abgezogenwerden, um die Ausscheidungskonstante k2g zu erhalten.
| k2g = k2 - kg | [Gleichung A5.27] |
Die Aufnahmekonstante wird durch die wachstumskorrigierte Ausscheidungskonstante dividiert, um den wachstumskorrigierten kinetischen BCF, bezeichnet als BCFKg, (oder BMFKg) zu ermitteln.
| BCFKg = k1/k2g | [Gleichung A5.28] |
Die Wachstumskonstante, die für einen Versuch mit Exposition über das Futter abgeleitet wird, wird in der Gleichung A7.5 verwendet, um den wachstumskorrigierten BMFKg zu berechnen (siehe Anlage 7).
Massebasierte Methode für die Korrektur um das Wachstum
Es existiert Alternative zur obigen Methode der Subtraktion der Wachstumsrate, bei der die Korrektur um das Wachstum vermieden wird. Das Prinzip dieser alternativen Methode besteht darin, die Ausscheidungsdaten auf Basis der Masse je Ganzfisch und nicht auf Konzentrationsbasis zu verwenden:
Die Gewebekonzentrationen der Ausscheidungsphase (Masse des Prüfstoffs/Masseneinheit der Fische) in Prüfstoff-/Fischmasse umrechnen: Konzentrationen und Gewichte der einzelnen Fische in tabellarischer Form (z.B. unter Verwendung eines Kalkulationsprogramms) zuordnen und jede Konzentration mit dem Fischgesamtgewicht für diese Messung multiplizieren, um einen Satz Prüfstoff-/Fischmassedaten für alle Proben der Ausscheidungsphase zu erhalten.
Den resultierenden natürlichen Logarithmus der Prüfstoffmassedaten für den Versuch (Ausscheidungsphase) gegen die Zeit auftragen, wie dies normalerweise geschehen würde.
Bei der Methode mit aquatischer Exposition die Aufnahmekonstante wie üblich ableiten (siehe Abschnitte 4 und 6; es ist zu beachten, dass der "normale"k2-Wert in den Kurvenanpassungsgleichungen für k1 verwendet werden sollte) und die Ausscheidungskonstante aus den obigen Daten ableiten. Da der resultierende Wert für die Ausscheidungskonstante wachstumsunabhängig ist, da er auf Basis der Masse basis pro Ganzfisch abgeleitet wurde, sollte dieser als k2g und nicht als k2 bezeichnet werden.
8. Normalisierung des Lipidgehalts auf 5 % (nur bei aquatischer Exposition)
BCF-Ergebnisse (kinetisch und steady-state) aus Versuchen mit aquatischer Exposition sollten ebenfalls bezogen auf einen Standard-Lipidgehalt von 5 % Nassgewicht angegeben werden, es sei denn, es kann argumentiert werden, dass der Prüfstoff nicht in erster Linie in den Lipiden akkumuliert (z.B. können einige perfluorierte Stoffe an Proteine gebunden sein). Die Konzentrationen in den Fischen oder der BCF müssen in einen Lipidgehalt von 5 % Nassgewicht umgerechnet werden. Wenn zum Messen der Stoffkonzentrationen und der Lipidgehalte zu allen Probenahmezeitpunkten dieselben Fische verwendet wurden, muss jede einzelne gemessene Konzentration in den Fischen um den Lipidgehalt dieses Fischs korrigiert werden.
| Cf,L = (0,05/L) ⋅ Cf | [Gleichung A5.29] |
Dabei gilt:
Cf,L = lipidstandardsisierte Konzentration in den Fischen (mg kg-1 Nassgewicht)
L = Lipidfraktion (basierend auf Nassgewicht)
Cf = Konzentration des Prüfstoffs in den Fischen (mg kg-1 Nassgewicht)
Wurde die Lipidanalyse nicht bei allen beprobten Fischen durchgeführt, wird der BCF auf Basis eines mittleren Lipidwerts normalisiert. Für den BCF bei stationärem Zustand sollte der Mittelwert, der am Ende der Aufnahmephase für die Prüfgruppe protokolliert wurde, verwendet werden. Bei der Standardisierung eines kinetischen BCF kann es Fälle geben, in denen ein anderer Ansatz gerechtfertigt ist, beispielsweise wenn sich der Lipidgehalt während der Aufnahme- oder Ausscheidungsphase erheblich geändert hat. Jedoch sollte in jedem Fall eine Fütterungsrate eingehalten werden, die drastische Veränderungen des Lipidgehalts auf ein Minimum begrenzt.
| BCFKL = (0.05/Ln) ⋅ BCFK | [Gleichung A5.30] |
Dabei gilt:
BCFKL = lipidstandardisierter kinetischer BCF (L kg-1)
Ln = mittlere Lipidfraktion (basierend auf Nassgewicht)
BCFK = kinetischer BCF (L kg-1)
Literaturhinweise
(1) Arnot J.A. and Gobas F.A.P.C. (2004), A food web bioaccumulation model for organic chemicals in aquatic ecosystems, Environ. Toxicol. Chem. 23: 2343-2355.
(2) Kapitel C.20 dieses Anhangs, Daphnia magna-Reproduktionstest.
(3) Spacie A. and Hamelink J.L. (1982), Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1: 309-320.
(4) Sijm D.T.H.M., Verberne M.E., de Jonge W.J., Pärt P. and Opperhuizen A. (1995), Allometry in the uptake of hydrophobic chemicals determined in vivo and in isolated perfused gills. Toxicol. Appl. Pharmacol. 131: 130-135.
(5) Bintein S., Devillers J. and Karcher W. (1993), Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR QSAR Environ. Res. 1: 29-39.
(6) Kristensen P. (1991), Bioconcentration in fish: comparison of BCF's derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute, Hørsholm, Dänemark.
(7) Arnot J.A., Meylan W., Tunkel J., Howard P.H., Mackay D., Bonnell M. and Boethling R.S. (2009), A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish. Environ. Toxicol. Chem. 28: 1168-1177.
(8) OECD (2011), QSAR Toolbox 2.1. Februar2011. Abrufbar über: http://www.oecd.org/document/54/0,3746,en_2649_34379_42923638_1_1_1_1,00.html.
(9) Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975). Bioconcentration of 2,2',4,4' tetrachlorobiphenyl in rainbow trout as measured by an accelerated test. T. Am. Fish. Soc. 104: 785-792.
(10) Ernst W. (1985), Accumulation in aquatic organisms, in Appraisal of tests to predict the environmental behaviour of chemicals, Sheeman, P., et al., Editors. John Wiley & Sons Ltd, New York, NY, USA: 243-255.
(11) Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977), Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models. Can. J. Chem. Eng. 55: 614-622.
(12) Hawker D.W. and Connell D.W. (1988), Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22: 701-707.
(13) Konemann H. and van Leeuwen K. (1980), Toxicokinetics in fish: Accumulation and elimination of six chlorobenzenes by guppies. Chemosphere. 9: 3-19.
_____
1) Wie bei jeder empirischen Beziehung sollte überprüft werden, ob der Prüfstoff innerhalb des Anwendbarkeitsbereichs der Beziehung liegt.
2) Das Gewicht der Fische am Ende der Aufnahmephase kann geschätzt werden anhand von Daten aus Vorversuchen oder von Infornmationen über die wahrscheinliche Wachstumszunahme der Versuchsspezies ab einem typischen Test-Startgewicht während der üblichen Aufnahmedauer (z.B. 28 Tage).
3) In den meisten Programmen, die eine lineare Regression unterstützen, werden auch Standardfehler und das Konfidenzintervall (CI) der Schätzungen angegeben, z.B. Datenanalysefunktionen in Microsoft Excel.
4) Hingegen ergibt sich bei der Methode der linearen Regression bei Anwendung dieser Formel kein Standardfehler für k2.
5) Im Gegensatz zur linearen Anpassungsmethode liefert diese Methode weder einen Standardfehler noch ein Konfidenzintervall für die Schätzung von k1.
6) Es ist zu beachten, dass die Unsicherheit der k2-Schätzung beim Bioakkumulationsmodell nicht hinreichend berücksichtigt wird, wenn sie bei der Anpassung von k1 bei der sequenziellen Anpassungsmethode im Wesentlichen als konstant gilt. Die resultierende Unsicherheit des BCF ist daher bei der simultanen Anpassungsmethode anders als bei der sequenziellen Methode.
.
| Gleichungen für den Versuch mit aquatischer Exposition: Minimierter Versuchsplan | Anlage 6 |
Dieser Ansatz rechtfertigt sich dadurch, dass der Biokonzentrationsfaktor bei einer vollständigen Prüfung entweder als Biokonzentrationsfaktor bei stationärem Zustand (BCFSS) bestimmt werden kann, indem das Verhältnis der Prüfstoffkonzentration im Fischgewebe zur Prüfstoffkonzentration im Wasser berechtnet wird, oder als kinetischer Biokonzentrationsfaktor (BCFK) durch Berechnung des Verhältnisses der Aufnahmekonstanten k1 zur Ausscheidungskonstanten k2. Der BCFK ist auch dann gültig, wenn während der Aufnahme keine Konzentration bei stationärem Zustand erreicht wird, vorausgesetzt, Aufnahme und Ausscheidung erfolgen ungefähr nach kinetischen Prozessen erster Ordnung.
Wird die Konzentration des Prüfstoffs im Gewebe (Cf1) am Ende der Exposition (t1) bestimmt und die Konzentration im Gewebe (Cf2) nach Ablauf einer bestimmten Zeit (t2) erneut gemessen, kann die Ausscheidungskonstante (k2) nach Gleichung A5.22 (siehe Anlage 5) geschätzt werden.
Die Aufnahmekonstante k1 kann dann algebraisch nach Gleichung A5.23 (Anlage 5) bestimmt werden (wobei Cf gleich Cf1 und t gleich t1) (1). Der kinetische Biokonzentrationsfaktor für den minimierten Versuchsplan (bezeichnet als BCFKm, um ihn von den kinetischen Biokonzentrationsfaktoren zu unterscheiden, die nach anderen Methoden ermittelt werden) entspricht somit
| BCFKm = k1/k2 | [Gleichung A6.1] |
Die Konzentrationen oder Ergebnisse sollten um den Effekt der Verdünnung durch Wachstum korrigiert und auf einen Lipidgehalt von 5 % standardsisiert werden, wie in Anlage 5 beschrieben.
Der minimierte BCFSS entspricht dem am Ende der Aufnahmephase berechneten BCF, wobei davon ausgegangen wird, dass ein stationärer Zustand erreicht wurde. Dies kann lediglich angenommen werden, da die Probenahmezeitpunkte für den entsprechenden Nachweis nicht ausreichen.
| Minimierter BCFSS = Cf-minSS/Cw-minSS | [Gleichung A6.2] |
Dabei gilt:
Cf-minSS = Konzentration in den Fischen bei angenommenem stationärem Zustand am Ende der Aufnahmephase (mg kg-1 Nassgewicht).
Cw-minSS = Konzentration im Wasser bei angenommenem stationärem Zustand am Ende der Aufnahmephase (mg l-1).
Literaturhinweise
(1) Springer T.A., Guiney P.D., Krueger H.O. and Jaber M.J. (2008), Assessment of an approach to estimating aquatic bioconcentration factors using reduced sampling. Environ. Toxicol. Chem. 27: 2271-2280.
.
| Gleichungen für die Prüfung mit Exposition über das Futter | Anlage 7 |
1. Beispiel der Zusammensetzung eines geeigneten handelsüblichen Fischfutters
| Hauptbestandteil | Fischmehl |
| Rohprotein | ≤ 55,0 % |
| Rohfett | ≤ 15,0 % 1 |
| Rohfaser | ≥ 2,0 % |
| Feuchtigkeit | ≥ 12 % |
| Asche | ≥ 8 % |
| 1) In bestimmten Regionen ist möglicherweise nur Fischfutter mit einer Lipidkonzentration erhältlich, die weit unter dieser Obergrenze liegt. In solchen Fällen sollten die Versuche mit der niedrigeren Lipidkonzentration im gelieferten Futter durchgeführt und die Fütterungsrate sollte entsprechend angepasst werden, damit die Fische gesund bleiben. Der Lipidgehalt des Futters sollte nicht durch Beimischung von zu viel Öl künstlich erhöht werden. | |
2. Beispiele für Futterdotierungstechniken
Allgemeines
Kontrollfutter sollte exakt auf dieselbe Weise zubereitet werden wie das dotierte Futter, nur ohne Prüfstoff.
Zur Überprüfung der Konzentration des behandelten Futters sollten nach einer geeigneten Extraktionsmethode drei Proben des dosierten Futters entnommen werden, um die Prüfstoffkonzentration oder Radioaktivität in den Extrakten zu messen. Es sollten hohe Wiederfindungsraten (> 85 %) mit geringer Schwankung zwischen den Proben (3 Konzentrationsproben, zu Prüfungsbeginn entnommen, sollten nicht mehr als ± 15 % vom Mittelwert abweichen) nachgewiesen werden.
Während der futterbezogenen Prüfung sollten drei Futterproben für die Analyse an Tag 0 und am Ende der Aufnahmephase entnommen werden, um den Prüfstoffgehalt im Futter zu bestimmen.
Fischfutterzubereitung mit flüssigem Versuchsmaterial (rein)
Es wird die angestrebte nominale Prüfstoffkonzentration im behandelten Fischfutter festgelegt, beispielsweise auf 500 µg Prüfstoff/g Futter. Die ungefähre Menge (nach Molmasse oder spezifischer Radioaktivität) des reinen Prüfstoffs wird einer bekannten Masse Fischfutter in einem Glasgefäß oder Rotationsverdampfer beigemischt. Diese Masse sollte für die Dauer der Aufnahmephase ausreichen (dabei ist zu berücksichtigen, dass die Mengen bei jeder Fütterung aufgrund des Fischwachstums erhöht werden müssen). Dieses Fischfutter sollte über Nacht durch sanftes Schütteln (z.B. in einem Roto-Mischer oder durch Rotation bei Verwendung eines Rotationsverdampfers) gemischt werden. Das dotierte Futter sollte unter Bedingungen gelagert werden, die die Stabilität des Prüfstoffs in der Futtermischung bis zur Verwendung garantieren (z.B. Kühlung).
Zubereitung von Fischfutter mit Maiskeim- oder Fischöl als Vehikel
Feste Prüfstoffe sollten in einem Mörser zu feinem Pulver zermahlen werden. Flüssige Prüfstoffe können dem Maiskeim- oder Fischöl direkt zugegeben werden. Der Prüfstoff wird in einer bekannten Menge Maiskeim- oder Fischöl (z.B. 5-15 ml) gelöst. Das dosierte Öl wird nach und nach in einen Rotationsverdampfer geeigneter Größe überführt. Das Gefäß zur Vorbereitung des dosierten Öls sollte mit zwei kleinen Aliquoten Öl gespült werden, die anschließend in den Verdampferkolben gegeben werden, um sicherzustellen, dass der gesamte gelöste Prüfstoff überführt wurde. Um eine vollständige Lösung/Dispersion im Öl zu gewährleisten (oder wenn im Versuch mehrere Prüfstoffe verwendet werden), werden ein Mikrorührer hinzugefügt, das Gefäß mit Stopfen verschlossen und die Mischung über Nacht schnell geschüttelt. Eine geeignete Menge Fischfutter (gewöhnlich in Pelletform) wird für die Prüfung in das den Verdampfer gegeben und der Gefäßinhalt gleichmäßig durch ständiges Rotatieren des Glasgefäßes während mindestens 30 Minuten, jedoch vorzugsweise über Nacht gemischt. Anschließend wird das dotierte Futter gelagert (z.B. gekühlt), um die Stabilität des Prüfstoffs im Futter bis seiner Verwendung zu gewährleisten.
Zubereitung von Fischfutter mit einem organischen Lösungsmittel
Eine geeignete Menge Prüfstoff (nach Molmasse oder spezifischer Radioaktivität), die für die Herstellung der Zieldosis ausreicht, wird in einem geeigneten organischen Lösungsmittel gelöst (z.B. Cyclohexan oder Aceton; 10-40 ml, ggf. auch mehr, je nach Menge des zu dotierenden Futters). Ein Aliquot oder die gesamte Menge (portionsweise hinzugefügt) dieser Lösung wird mit der für die Prüfung ausreichende Fischfuttermasse gemischt, um die erforderliche nominale Dosierung zu erhalten. Futter und Prüfstoff können in einem Mischbehälter aus Edelstahl gemischt werden. Das frisch dosierte Fischfutter kann in dem Behälter belassen und zwei Tage lang in einem Laborabzug (mit gelegentlichem Rühren) aufbewahrt werden, damit das überschüssige Lösungsmittel verdampfen kann, oder es kann in einem kontinuierlich drehenden Rotationsverdampfer gemischt werden. Das überschüssige Lösungsmittel kann ggf. durch Luft- oder Stickstoffstrom "weggeblasen" werden. Es sollte unbedingt sichergestellt werden, dass der Prüfstoff nicht kristallisiert, wenn das Lösungsmittel entfernt wird. Das dotierte Futter sollte unter Bedingungen (z.B. Kühlung) gelagert werden, die die Stabilität des Prüfstoffs in der Futtermischung bis seiner Verwendung gewährleisten.
3. Berechnung der Assimilationseffizienz und des Biomagnifikationsfaktors
Zur Berechnung der Assimilationseffizienz sollte zunächst die Gesamtausscheidungskonstante gemäß Anlage 5 Abschnitt 4 (nach der "sequenziellen Methode", d. h. mit standardmäßiger linearer Regression) geschätzt werden; dazu mittlere Konzentrationen vom Proben aus der Ausscheidungsphase verwenden. Die Fütterungskonstante, I, und die Aufnahmedauer, t, sind bekannte Versuchsparameter. CFutter, die mittlere gemessene Konzentration des Prüfstoffs im Futter, ist eine während der Prüfung gemessene Variable. C0,d, die Prüfstoffkonzentration in den Fischen am Ende der Aufnahmephase, wird gewöhnlich aus dem Achsenabschnitt einer graphischen Darstellung von ln(Konzentration) bezogen auf den Ausscheidungstag abgeleitet.
Die Assimilationseffizienz des Stoffes (a, Absorption des Prüfstoffs über den Darm) wird berechnet als
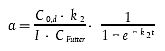 | [Gleichung A7.1] |
Dabei gilt:
C0,d = abgeleitete Konzentration in den Fischen zum Zeitpunkt Null der Ausscheidungsphase (mg kg-1);
k2 = gesamte (nicht wachstumskorrigierte) Ausscheidungskonstante (Tag-1), berechnet nach den Gleichungen in Anlage 5 Abschnitt 3;
I = Futteringestionskonstante (g Futter g-1 Fisch Tag-1);
CFutter = Konzentration im Futter (mg kg-1 Futter);
t = Dauer der Fütterungsphase (Tag)
Die für die Berechnung verwendete Fütterungsrate I muss jedoch möglicherweise um das Fischwachstum korrigiert werden, um eine exakte Assimilationseffizienz a zu erhalten. Bei einer Prüfung, bei der die Fische während der Aufnahmephase (in der die Futtermengen nicht korrigiert werden, um die festgelegte Fütterungsrate einzuhalten) erheblich wachsen, ist die tatsächliche effektive Fütterungsrate mit fortschreitender Aufnahmephase geringer als die vorgegebene Fütterungsrate, was zu einer höheren "realen" Assimilationseffizienz führt. (Dieser Aspekt ist für die Gesamtberechnung des BMF nicht wichtig, da die I-Terme zwischen den Gleichungen A7.1 und A7.4 aufgehoben werden). Die um den Effekt der Verdünnung durch Wachstum korrigierte mittlere Fütterungsrate I g kann auf verschiedene Weise abgeleitet werden; eine einfache und robuste Methode besteht jedoch darin, die Gewichte der Versuchsfische zu bestimmten Zeitpunkten während der Aufnahmephase anhand der bekannten Wachstumskonstanten (kg) zu schätzen, d. h.:
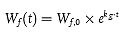 | [Gleichung A7.2] |
Dabei gilt:
Wf(t)= mittleres Fischgewicht am Aufnahmetag t
Wf,0 = mittleres Fischgewicht zu Beginn des Versuchs
Auf diese Weise kann (zumindest) das mittlere Fischgewicht am letzten Expositionstag (Wf, Aufnahmeende) geschätzt werden. Da die Fütterungsrate auf Basis von Wf,0 festgelegt wurde, kann die tatsächliche Fütterungsrate für jeden Tag der Aufnahme anhand dieser beiden Gewichtswerte berechnet werden. Die wachstumskorrigierte Fütterungsrate Ig (g Futter-1 Fisch Tag-1), die anstelle von I bei schnellem Wachstum während der Aufnahmephase zu verwenden ist, kann dann wie folgt berechnet werden:
| Ig = (I x Wf,0) / Wf, Ende der Aufnahme | [Gleichung A7.3] |
Nach Bestimmung der Assimilationseffizienz kann der BMF durch Multiplikation mit der Fütterungskonstanten I (oder Ig, falls zur Berechnung von α herangezogen) und Division des Produkts durch die Gesamtausscheidungskonstante k2 berechnet werden:
| BMF = (I x α) / k2 | [Gleichung A7.4] |
Der wachstumskorrigierte Biomagnifikationsfaktor sollte auf dieselbe Weise berechnet werden, jedoch anhand der wachstumskorrigierten Ausscheidungskonstanten (wie gemäß Anlage 5 Abschnitt 7 abgeleitet). Wenn hingegen Ig zur Berechnung von α herangezogen wurde, sollte sie auch hier anstelle von I verwendet werden:
| BMF = (I x α) / k2g | [Gleichung A7.5] |
Dabei gilt:
α = Assimilationseffizienz (Absorption des Prüfstoff über den Darm);
k2 = gesamte (nicht wachstumskorrigierte) Ausscheidungskonstante (Tag-1), berechnet anhand der Gleichungen in Abschnitt 3 von Anlage 5;
k2g = wachstumskorrigierte Ausscheidungskonstante (Tag-1);
I = Futteringestionskonstante (g Futter g-1 Fisch Tag-1);
Die wachstumskorrigierte Halbwertzeit (t1/2) wird wie folgt berechnet:
| t1/2 = 0,693/k2g | [Gleichung A7.6] |
Die Assimilationseffizienz des Stoffes in der Nahrung kann auch geschätzt werden, wenn während der linearen Phase der Aufnahmephase (zwischen Tag 1 und 3) die Geweberückstände bestimmt werden. In diesem Fall kann die stoffspezifische Assimilationseffizienz (α) wie folgt berechnet werden:
| α = CFisch(t) / (I x CFutter x t) | [Gleichung A7.7] |
Dabei gilt:
CFisch(t) = Konzentration des Prüfstoffs in den Fischen zum Zeitpunkt t (mg kg-1 Nassgewicht).
4. Korrektur um den Lipidgehalt
Wurde der Lipidgehalt zu jedem Probenahmezeitpunkt an derselben Fischen gemessen, die auch chemisch analysiert wurden, sollten die einzelnen Konzentrationen um den Lipidgehalt korrigiert und ln(Konzentration, lipidkorrigiert) sollte gegen die Ausscheidung (Tag) aufgetragen werden, um C0,d und k2 zu erhalten. Die Assimilationseffizienz (Gleichung A7.1) kann sodann auf Lipidbasis unter Verwendung von CFutter berechnet werden (d. h. CFutter wird mit der mittleren Lipidfraktion des Futters multipliziert). Durch anschließende Berechnung nach der Gleichungen A7.4 und A7.5 lässt sich der lipidkorrigierte (und um den Effekt der Verdünnung durch Wachstum korrigierte) BMF direkt ermittelt.
Andernfalls wird die mittlere Lipidfraktion (w/w) in den Fischen und im Futter sowohl für die Prüf- als auch für die Kontrollgruppe abgeleitet (für das Futter und die Fische der Kontrollgruppe geschieht dies in der Regel anhand der zu Expositionsbeginn und -ende gemessenen Daten, für die Fische aus der Prüfgruppe nur anhand der am Expositionsende gemessenen Daten). Bei bestimmten Versuchen kann der Lipidgehalt der Fische stark ansteigen; in solchen Fällen sollte eine mittlere Konzentration der Prüffischlipide zugrunde gelegt werden, die aus den Messwerten am Ende der Exposition sowie am Ende der Ausscheidung errechnet wurde. Die Daten der Prüfgruppe dienen in der Regeln nur für die Ableitung beider Lipidfraktionen.
Der Lipidkorrekturfaktor (Lc) wird wie folgt berechnet:
| Lc = LFisch / LFutter | [Gleichung A7.8] |
Dabei sind: LFisch und LFutter die mittleren Lipidfraktionen in den Fischen bzw. im Futter.
Anhand des Lipidkorrekturfaktors wird der lipidkorrigierte Biomagnifikationsfaktor (BMFL) wie folgt berechnet:
| BMFL = BMF / Lc | [Gleichung A7.9] |
5. Bewertung der Unterschiede zwischen der gemessenen Konzentration zum Zeitpunkt Null (C0,m) und der abgeleiteten Konzentration zum Zeitpunkt Null (C0,d)
Die gemessene Konzentration zum Zeitpunkt Null (C0,m) und die abgeleitete Konzentration zum Zeitpunkt Null (C0,d) sollten miteinander verglichen werden. Sind diese Konzentrationen sehr ähnlich, empfiehlt es sich, das Modell erster Ordnung für die Ableitung der Ausscheidungsparameter zu verwenden.
Bei bestimmten Versuchen kann eine erhebliche Differenz zwischen der abgeleiteten Konzentration zum Zeitpunkt Null, C0,d, und der mittleren gemessenen Konzentration zum Zeitpunkt Null, C0,m (siehe letzter Spiegelstrich unter Nummer 159 dieser Prüfmethode), auftreten. Ist C0,d wesentlich geringer als C0,m (C0,d < < C0,m), kann die Differenz auf das Vorhandensein von unverdautem dotiertem Futter im Darm hindeuten. Dies kann experimentell untersucht werden, indem der entfernte Darm separat analysiert wird, soweit am Ende der Aufnahmephase zusätzliche Proben (Ganzfische) entnommen und gelagert wurden. Sollte ein statistisch gültiger Ausreißertest, der auf die lineare Regression der Ausscheidungsphase angewandt wird, jedoch darauf hindeuten, dass die Konzentration am ersten Probenahmezeitpunkt in der Ausscheidungsphase unangemessen hoch ist, empfiehlt es sich eventuell, die lineare Regression zur Ableitung von k2 durchzuführen, die erste Konzentration der Ausscheidungsphase jedoch auszulassen. In solchen Fällen, wenn die Unsicherheit in der linearen Regression stark verringert und klar ist, dass die Ausscheidungskinetik erster Ordnung ungefähr befolgt wurde, empfiehlt es sich möglicherweise, die C0,d- und k2-Werte aus der Berechnung der Assimilationseffizienz heranzuziehen. Dies sollte im Bericht umfassend begründet werden. Es kann auch vorkommen, dass die Ausscheidungsphase nicht einer Kinetik erster Ordnung folgt. Ist davon auszugehen (d. h. scheinen die durch natürliches Logarithmieren transformierten Daten im Vergleich zur linearen Regressionsgeraden einer Kurve zu folgen), sind die Berechnungen von k2 und C0,d wahrscheinlich ungültig. In diesem Fall sollte der Rat eines Biostatistikers eingeholt werden.
Liegt C0,d erheblich über dem Messwert (C0,d >> C0,m), kann dies darauf hindeuten, dass der Stoff sehr schnell ausgeschieden wurde (d. h. die Probenahmezeitpunkte erreichen die Quantifizierungsgrenze der Analysemethode während der Ausscheidungsphase sehr schnell, vgl. Abschnitt 6), dass der Ausscheidungsprozess nicht der Kinetik erster Ordnung folgte, dass die lineare Regression für die Ableitung von k2 und C0,d mangelhaft ist oder dass zu bestimmten Probenahmezeitpunkten ein Problem mit den gemessenen Konzentrationen aufgetreten ist. In solchen Fällen sollte die lineare Regressionskurve auf Hinweise auf Proben an oder in der Nähe der Quantifizierungsgrenze, auf Ausreißer und auf eine eindeutige Kurvenform (die das Nichtvorliegen einer Kinetik erster Ordnung belegt) untersucht werden, was im Bericht anzugeben ist. Eine anschließende Neubewertung der linearen Regression zur Verbesserung der Schätzwerte sollte beschrieben und begründet werden. Wird eine markante Abweichung von der Kinetik erster Ordnung festgestellt, sind die Berechnungen von k2 und C0,d wahrscheinlich ungültig, und es sollte der Rat eines Biostatistikers eingeholt werden.
6. Empfehlungen für sehr schnell ausgeschiedene Prüfstoffe
Wie unter Nummer 129 der Prüfmethode beschrieben, werden bestimmte Prüfstoffe so schnell ausgeschieden, dass eine zuverlässige Konzentration zum Zeitpunkt Null C0,d und k2 nicht abgeleitet werden können, da der Prüfstoff in Proben, die zu einem sehr frühen Zeitpunkt der Ausscheidungsphase (d. h. ab der zweiten Ausscheidungsprobe) entnommen werden, effektiv nicht mehr gemessen werden kann (Konzentrationen an der Quantifizierungsgrenze). Diese Situation wurde in dem Ringtest beobachtet, der zur Unterstützung dieser Prüfmethode mit Benzo[a]pyren durchgeführt wurde, und im Validierungsbericht für die Methode dokumentiert. In solchen Fällen kann eine lineare Regression nicht zuverlässig durchgeführt werden und führt wahrscheinlich zu einer unrealistisch hohen Schätzung von C0,d und letztlich zu augenscheinlichen Assimilationseffizienz, die wesentlich größer als 1 ist. In diesem Fall ist es möglich, k2 konservativ zu schätzen und den BMF "nach oben" anzusetzen.
Bei Verwendung dieser Datenpunkte der Ausscheidungsphase, an denen eine Konzentration gemessen wurde, einschließlich der ersten nicht "nachweisbaren" Konzentration (Konzentration an der Quantifizierungsgrenze), ergibt eine lineare Regression (auf Basis der durch natürliches Logarithmieren transformierten Konzentrationsdaten im Verhältnis zur Zeit) einen Schätzwert für k2. Dazu sind oft nur zwei Datenpunkte (z.B. Probenahmetage 1 und 2 der Ausscheidung) erforderlich, weshalb k2 alsdann nach der Gleichung A5.22 in Anlage 5 geschätzt werden. Auf Basis auf dieses Schätzwertes für k2 kann mit Gleichung A7.1 eine Assimilationseffizienz geschätzt werden, indem in dieser Gleichung der Wert C0,d durch die gemessene Konzentration zum Zeitpunkt Null (C0,m) ersetzt wird, wenn nach Schätzungen C0,d wesentlich über dem Wert liegt, der im Test hätte erreicht werden können. War C0,m nicht messbar, sollte die Nachweisgrenze im Fischgewebe verwendet werden. Wenn dies in bestimmten Fällen einen Wert α > 1 ergibt, gilt eine Assimilationseffizienz von 1 als Worst Case.
Der maximale BMFK kann dann nach der Gleichung A7.4 geschätzt werden und sollte als Wert "wesentlich kleiner als" (<<) angegeben werden. Bei einem Versuch, der mit einer Fütterungsrate von 3 % und einer Ausscheidungshalbwertzeit von weniger als 3 Tagen und einem Worst Case-α von 1 durchgefÌhrt wurde, ist von einem BMFK von unter ungefähr 0,13 auszugehen. Angesichts des Gegenstands dieser Schätzung und der Tatsache, dass die Werte konservativer Art sind, müssen sie nicht um den Effekt der Verdünnung durch Wachstum oder den Lipidgehalt der Fische bzw. des Futters korrigiert werden.
.
| Ansätze zur Schätzung vorläufiger BCF-Werte anhand von Daten aus dem Versuch mit Exposition über das Futter | Anlage 8 |
Die Methode mit Exposition über das Futter ist Teil der vorliegenden Prüfmethode für die Bioakkumulationsprüfung an Stoffen, die in der Praxis nicht nach der Methode mit aquatischer Exposition geprüft werden können. Die Methode mit aquatischer Exposition ergibt einen Biokonzentrationsfaktor, während die Methode mit Exposition über das Futter direkt Informationen über das Biomagnifikationspotenzial des Futters liefert. Viele Regelungen für Chemikaliensicherheit erfordern Informationen über die aquatischen Biokonzentration (so die Risikobewertung und das Globale Harmonisierte System zur Einstufung und Kennzeichnung von Chemikalien, GHS). Deshalb müssen die Daten aus einem Versuch mit Exposition über das Futter verwendet werden, um einen Biokonzentrationsfaktor zu schätzen, der sich mit Tests vergleichen lässt, die nach der Methode mit aquatischer Exposition durchgeführt wurden 1. In diesem Abschnitt werden Ansätze in dieser Richtung geprüft, ohne jedoch die mit diesen Schätzungen einhergehenden Mängel außer Acht zu lassen.
Beim Versuch mit Exposition über das Futter wird die Ausscheidung gemessen, um eine Ausscheidungskonstante k2 zu bestimmen. Kann anhand der verfügbaren Daten eine Aufnahmekonstante geschätzt werden, wenn der Fisch dem Prüfstoff über das Wasser ausgesetzt wurde, dann kann auch ein kinetischer BCF geschätzt werden.
Die Schätzung einer Aufnahmekonstanten für die Exposition gegenüber eines Prüfstoffs über das Wasser beruht auf zahlreichen Annahmen, die alle zur Unsicherheit der Schätzung beitragen. Zudem setzt dieser Ansatz für die Schätzung des BCF voraus, dass die Gesamtausscheidungsrate (einschließlich Einflussfaktoren wie die Verteilung im Körper und individuelle Ausscheidungsprozesse) von der Expositionsmethode, nach der die prüfstoffbedingte Körperbelastung bestimmt wird, unabhängig ist.
Die wichtigsten Hypothesen dieses Schätzungsansatzes lassen sich wie folgt zusammenfassen:
Die Ausscheidung während der Futteraufnahme ist bei einem gegebenen Prüfstoff mit der Ausscheidung nach einer Exposition über das Wasser identisch.
Die Aufnahme über das Wasser folgt einer Kinetik erster Ordnung.
Je nach Methode, nach der die Aufnahme geschätzt wird, gilt Folgendes:
- Die Aufnahme kann nur mit dem Fischgewicht korreliert werden.
- Die Aufnahme kann nur mit dem Octanol/Wasser-Verteilungskoeffizienten des Prüfstoffs korreliert werden.
- Die Aufnahme kann mit einer Kombination aus Fischgewicht und dem Octanol/Wasser-Verteilungskoeffizienten des Prüfstoffs korreliert werden.
- Faktoren, die sich im praktischen Versuch auf die Aufnahme mit aquatischer Exposition auswirken können, wie z.B. Bioverfügbarkeit, Adsorption an der Apparatur, Molekulargröße usw., haben eine geringe Wirkung.
- und insbesondere:
die Datenbank für die Entwicklung der Methode für die Schätzung der Aufnahme ist für den untersuchten Prüfstoff repräsentativ.
Verschiedene Publikationen in der frei verfügbaren Fachliteratur enthalten abgeleitete Gleichungen, in denen die Aufnahme aus dem Wasser über die Kiemen zum Octanol/Wasser-Verteilungskoeffizienten des Prüfstoffs, zum Fischgewicht (1) (2) (3) (4), zum Volumen und/oder Lipidgehalt, zur Membranpermeation/-diffusion (5) (6), zum Fischatmungsvolumen (7) und zu einem Fugazitäts-/Massenbilanzansatz (8) (9) (10) in Bezug gesetzt wird. Eine ausführliche Bewertung solcher Methoden in diesem Kontext ist Crookes & Brooke (11) zu entnehmen. Eine Veröffentlichung von Barber (12) die sich auf die Modellierung der Bioakkumulation durch Aufnahme über das Futter konzentriert, ist in diesem Zusammenhang ebenfalls hilfreich, da sie Beiträge aus Modellen für die Kinetik der Aufnahme über die Kiemen beinhaltet. Ein Abschnitt des Hintergrunddokuments zum Dietary Protocol 2004 (13) ist ebenfalls diesem Aspekt gewidmet.
Die meisten dieser Modelle scheinen aus begrenzten Datenbanken abgeleitet worden zu sein. Bei Modellen, für die die Datenbanken, auf denen das Modell beruht, verfügbar sind, scheinen die verwendeten Stoffarten häufig von ähnlicher Struktur oder Klasse zu sein (bezogen auf die Funktionalität, z.B. Organchloride). Neben den prüfungsspezifischen Aspekten wie Spezies, Temperatur usw. erhöht dies die mit einem Modell zur Vorhersage einer Aufnahmekonstanten für eine Prüfstoffart einhergehende Unsicherheit noch zusätzlich.
Eine Überprüfung der verfügbaren Methoden (11) ergab, dass keine Methode "richtiger" ist als die anderen. Daher sollte das verwendete Modell genau begründet werden. Existieren verschiedene Methoden, deren Anwendung gerechtfertigt werden kann, kann es ratsam sein, mehrere Schätzwerte für k1 (und den BCF) oder eine Wertebereich von k1 (und BCF) anzugeben, die nach den Methoden für die Schätzung der Aufnahme berechnet wurden. Angesichts der Unterschiede bei den Modelltypen und Datensätzen, die zur Entwicklung dieser Methoden verwendet wurden, wäre die Akzeptanz eines Mittelwerts aus auf verschiedene Weise abgeleiteten Schätzungen jedoch unangemessen.
Einige Wissenschaftler haben gefordert, diese BCF-Schätzungen um die Bioverfügbarkeit zu korrigieren, um die Adsorption des Prüfstoffs an gelöstem organischem Kohlenstoff (DOC) unter aquatischen Expositionsbedingungen zu berücksichtigen, damit die Schätzung mit den Ergebnissen aus Versuchen mit aquatischer Exposition im Einklang steht (z.B. (13) (14)). Jedoch ist diese Korrektur angesichts der niedrigen DOC-Niveaus, die in einer Studie mit aquatischer Exposition für eine Worst-Case-Schätzung erforderlich sind (d. h. Verhältnis des bioverfügbaren Prüfstoffs zum Prüfstoff, wie in der Lösung gemessen) eventuell nicht zweckmäßig. Bei stark hydrophoben Substanzen kann die Aufnahme über die Kiemen durch die Rate der passiven Diffusion nahe der Kiemenoberfläche eingeschränkt sein; in diesem Fall wird dieser Effekt bei der Korrektur möglicherweise stärker berücksichtigt als der ursprünglich vorgesehene Effekt.
Es empfiehlt sich, den Schwerpunkt auf Methoden zu legen, die Inputs erfordern, für die die Daten über Stoffe, die nach der hier beschriebenen Methode mit Exposition über das Futter geprüft wurden (d. h. log KOW, Fischgewicht), problemlos verfügbar sind. Andere Methoden, die komplexere Inputs erfordern, können angewandt werden, doch sind eventuell zusätzliche Messungen im Test oder detaillierte Kenntnisse des Prüfstoffs oder der Fischspezies erforderlich, die nicht allgemein verfügbar sind. Zudem kann die Wahl des Modells durch das Niveau der Validierung und den Anwendungsbereich beeinflusst werden (siehe (11) bezüglich Überprüfung und Vergleich verschiedener Methoden).
Es ist zu beachten, dass die resultierenden Schätzwerte für k1 und BCF unsicher sind und bei einem evidenzbasierten Bewertungsansatz zusammen mit dem abgeleiteten BMF und den Stoffparametern (z.B. Molekulargröße) ausgewertet werden müssen, um ein Gesamtbild des Bioakkumulationspotenzials eines Prüfstoffs zu erhalten. Die Interpretation und Verwendung dieser Parameter kann vom Rechtsrahmen abhängig sein.
Literaturhinweise
(1) Sijm D.T.H.M., Pärt P. and Opperhuizen A. (1993), The influence of temperature on the uptake rate constants of hydrophobic compounds determined by the isolated perfused gills of rainbow trout (Oncorhynchus mykiss). Aquat. Toxicol. 25: 1-14.
(2) Sijm D.T.H.M., Verberne M.E., Part P. and Opperhuizen A. (1994), Experimentally determined blood and water flow limitations for uptake of hydrophobic compounds using perfused gills of rainbow trout (Oncorhynchus mykiss): Allometric applications. Aquat. Toxicol. 30: 325-341.
(3) Sijm D.T.H.M., Verberne M.E., de Jonge W.J., Pärt P. and Opperhuizen A. (1995), Allometry in the uptake of hydrophobic chemicals determined in vivo and in isolated perfused gills. Toxicol. Appl. Pharmacol. 131: 130-135.
(4) Barber M.C. (2003), A review and comparison of models for predicting dynamic chemical bioconcentration in fish. Environ. Toxicol. Chem. 22: 1963-1992.
(5) Opperhuizen A. (1986), Bioconcentration of hydrophobic chemicals in fish, in Aquatic Toxicology and Environmental Fate, STP 921, Poston, T.M. and Purdy, R., Editors. American Society for Testing and Materials, Philadelphia, PA, USA: 304-315.
(6) Arnot J.A. and Gobas F.A.P.C. (2004), A food web bioaccumulation model for organic chemicals in aquatic ecosystems. Environ. Toxicol. Chem. 23: 2343-2355.
(7) Thomann R.V. (1989), Bioaccumulation model of organic chemical distribution in aquatic food chains. Environ. Sci. Technol. 23: 699-707.
(8) Hendriks A.J., van der Linde A., Cornelissen G. and Sijm D.T.H.M. (2001). The power of size. 1. Rate constants and equilibrium ratios for accumulation of organic substances related to octanol-water partition ratio and species weight. Environ. Toxicol. Chem. 20: 1399-1420.
(9) Campfens J. and Mackay D. (1997), Fugacity-based model of PCB bioaccumulation in complex aquatic food webs. Environ. Sci. Technol. 31: 577-583.
(10) Arnot J.A. and Gobas F.A.P.C. (2003), A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22: 337-345.
(11) Crookes M. and Brooke D. (2010), Estimation of fish bioconcentration factor (BCF) from depuration data. Draft Report. Environmental Agency, Bristol, VK.
(12) Barber M.C. (2008), Dietary uptake models used for modelling the bioaccumulation of organic contaminants in fish. Environ. Toxicol. Chem. 27: 755-777
(13) Anonymous (2004), Background document to the fish dietary study protocol, document submitted to the TC-NES WG on PBT.
(14) Gobas F. and Morrison H. (2000), Bioconcentration and biomagnification in the aquatic environment, in Handbook of property estimation methods for chemicals, Boethling, R.S. and Mackay, D., Editors. Lewis Publishers, Boca Racton, FL, USA: 189-231.
_____
1) In freier Wildbahn ist Ingestion wahrscheinlich der beste Weg, um Fische in aquatischem Milieu stark hydrophoben Stoffen auszusetzen, weshalb ein geschätzter BCF für das Bioakkumulationspotenzial eines solchen Stoffs nicht unbedingt repräsentativ ist."
(17) In Teil C erhält Kapitel C.20 folgende Fassung:
"C.20 Daphnia magna-Reproduktionstest
Einleitung
Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 211 (2012). Die OECD-Prüfrichtlinien werden regelmäßig unter Berücksichtigung des wissenschaftlichen Fortschritts überarbeitet. Die Prüfrichtlinie 211 für Reproduktionstests basiert auf der Prüfrichtlinie 202, Teil II, Daphnia sp.-Reproduktionstest (1984). Es wurde allgemein anerkannt, dass die Daten aus Prüfungen gemäß der Prüfrichtlinie 202 variieren könnten. Daher wurde mit Nachdruck an der Aufdeckung der Gründe für diese Variabilität gearbeitet mit dem Ziel, eine bessere Prüfmethode zu entwickeln. Die Prüfrichtlinie 211 basiert auf den Ergebnissen dieser Forschungsaktivitäten, Ringversuche und Validierungsstudien, die 1992 (1), 1994 (2) und 2008 (3) durchgeführt wurden.
Die wichtigsten Unterschiede zwischen der anfänglichen Fassung (TG 202, 1984) und der zweiten Fassung (TG 211, 1998) der Prüfrichtlinie sind:
- Die empfohlene Tierart ist Daphnia magna.
- Die Prüfung dauert 21 Tage.
- Bei semistatischen Prüfungen wurde die Anzahl der bei jeder Prüfkonzentration zu verwendenden Tiere von mindestens 40, die in vier Gruppen von jeweils zehn Tieren aufzuteilen waren, auf mindestens zehn einzeln gehaltene Tiere verringert (obwohl bei Durchflussprüfungen andere Versuchspläne verwendet werden können).
- Die Empfehlungen zum Prüfmedium und zu den Fütterungsbedingungen wurden präzisiert.
- Die wichtigsten Unterschiede zwischen der zweiten Fassung der Prüfrichtlinie (TG 211, 1998) und der vorliegenden Fassung sind:
- Anlage 7 mit Verfahren zur Geschlechtsbestimmung bei frisch geschlüpften Daphnien, sofern erforderlich, wurde hinzugefügt. Wie bei den vorherigen Fassungen dieser Prüfmethode ist das Geschlechterverhältnis ein fakultativer Endpunkt.
- Die Reaktionsvariable "Anzahl an lebenden Nachkommen, die pro lebendem Elterntier produziert werden"wurde durch eine zusätzliche Reaktionsvariable für die Reproduktion von Daphnien ergänzt, d. h. die Gesamtanzahl der am Ende der Prüfung produzierten lebenden Nachkommen von zu Beginn der Prüfung vorhandenen Elterntieren, wobei versehentlich und/oder aus ungeklärter Ursache gestorbene Elterntiere aus der Analyse ausgeschlossen wird. Diese zusätzliche Reaktionsvariable wurde aufgenommen, um diesen Parameter mit anderen Methoden zur Prüfung der Reproduktion bei Wirbellosen in Einklang zu bringen. Außerdem erlaubt diese Prüfmethode die Eliminierung einer Fehlerquelle bei dieser Reaktionsvariablen, nämlich den Effekt der versehentlich gestorbenen Elterntiere und/oder ihrer Mortalität aus ungeklärter Ursache, falls diese während des Expositionszeitraums auftreten sollte.
- Zusätzliche statistische Leitlinien für den Versuchsplan sowie für die Auswertung der Ergebnisse wurden sowohl für den ECx- (z.B. EC10 oder EC50) als auch für den NOEC/LOEC-Ansatz aufgenommen.
- Ein Limit-Test wird eingeführt.
Die Definitionen der verwendeten Begriffe sind Anlage 1 zu entnehmen.
Testprinzip
Hauptziel der Prüfung ist es, die Wirkung von Chemikalien auf die Reproduktionsleistung der Daphnia magna zu bestimmen. Zu diesem Zweck werden junge weibliche Daphnien (die Elterntiere), die zu Beginn der Prüfung weniger als 24 Stunden alt sind, der dem Wasser in verschiedenen Konzentrationen zugesetzten Prüfchemikalie ausgesetzt. Die Prüfung dauert 21 Tage. Am Ende der Prüfung wird die Gesamtzahl an lebenden Nachkommen bewertet. Die Reproduktionsleistung von Elterntieren kann auch auf andere Art und Weise angegeben werden (z.B. Anzahl an lebenden Nachkommen, die je Tier und Tag ab dem ersten Tag, an dem Nachkommen festgestellt wurden, produziert wurden), diese Angaben sollten jedoch zusätzlich zur Gesamtanzahl an Jungtieren protokolliert werden. Aufgrund des besonderen Versuchsaufbaus der semistatischen Prüfung im Vergleich zu anderen Methoden zur Prüfung der Reproduktion bei Wirbellosen kann auch die Anzahl der von jedem einzelnen Elterntier produzierten lebenden Nachkommen gezählt werden. Im Gegensatz zu anderen Methoden zur Prüfung der Reproduktion bei Wirbellosen kann daher die Produktion von Nachkommen aus der Datenbewertung ausgeschlossen werden, falls das Elterntier während des Prüfzeitraums versehentlich und/oder aus ungeklärter Ursache stirbt. Tritt die elterliche Mortalität bei exponierten Replikaten auf, sollte daher geprüft werden, ob die Mortalität einem Konzentrations-/Wirkungs-Muster folgt, z.B. ob eine signifikante Regression der Reaktion im Verhältnis zur Konzentration der Prüfchemikalie mit positiver Steigung vorliegt (hierzu kann ein statistischer Test wie der Cochran-Armitage-Trendtest angewandt werden). Folgt die Mortalität keinem Konzentrations-/Wirkungs-Muster, dann sollten diejenigen Replikate mit elterlicher Mortalität aus der Analyse des Testergebnisses ausgeschlossen werden. Folgt die Mortalität hingegen einem Konzentrations-/Wirkungs-Muster, sollte die elterliche Mortalität als Wirkung der Prüfchemikalie eingeordnet und die Replikate sollten nicht aus der Analyse ausgeschlossen werden. Wenn das Elterntier während der Prüfung stirbt, d. h. versehentlich wegen falscher Behandlung oder eines Unfalls oder aber zufällig aufgrund eines ungeklärten Vorfalls, der nicht mit der Wirkung der Prüfchemikalie in Verbindung steht, oder wenn das Elterntier sich als männlich erweist, wird das Replikat aus der Analyse ausgeschlossen (nähere Angaben unter Nummer 51). Die toxische Wirkung der Prüfchemikalie auf die Reproduktionsleistung wird als ECx angegeben, wobei die Daten durch nichtlineare Regression an ein geeignetes Modell angepasst werden, um die Konzentration zu schätzen, die zu einer x %igen Verringerung der Reproduktionsleistung führen würde, oder als NOEC/LOEC-Wert angegeben (4). Die Prüfkonzentrationen sollten vorzugsweise die niedrigste der verwendeten Wirkungskonzentrationen (z.B. EC10) einschließen, was bedeutet, dass dieser Wert durch Interpolation und nicht durch Extrapolation berechnet wird.
Das Überleben der Elterntiere und die Zeit bis zur Produktion der ersten Brut sollten ebenfalls angegeben werden. Andere Wirkungen der Chemikalie auf Parameter wie das Wachstum (z.B. die Länge) und eine mögliche immanente Wachstumsrate können ebenfalls untersucht werden (siehe Nummer 44).
Angaben zur Prüfchemikalie
Die Ergebnisse einer akuten Toxizitätsprüfung (siehe Kapitel C.2: Daphnia sp.-Test auf akute Schwimmunfähigkeit), die an Daphnia magna durchgeführt wurden, können bei der Auswahl eines geeigneten Bereichs der Prüfkonzentrationen in den Reproduktionstests von Nutzen sein. Die Wasserlöslichkeit und der Dampfdruck der Prüfchemikalie sollten bekannt sein, und ein zuverlässiges Analyseverfahren für die Quantifizierung der Prüfchemikalie in den Prüflösungen mit dokumentierter Wiederfindungsrate und Nachweisgrenze sollte vorhanden sein.
Zu den Informationen über die Prüfchemikalie, die bei der Festlegung der Prüfbedingungen von Nutzen sein können, gehören die Strukturformel, die Reinheit der Chemikalie, die Lichtstabilität, die Stabilität unter den Versuchsbedingungen, pKa, Pow und die Ergebnisse einer Prüfung zur leichten biologischen Abbaubarkeit (siehe Kapitel C.4 (Biologische Abbaubarkeit - Bestimmung der "leichten" biologischen Abbaubarkeit) und C.29 (Leichte biologische Abbaubarkeit - Bestimmung von CO2 in geschlossenen Flaschen (Head-Space-Test)).
Validitätskriterien
Damit die Validität einer Prüfung gegeben ist, sollten die folgenden Leistungskriterien in der/den Kontrolle(n) erfüllt werden:
- Die Mortalität der Elterntiere (weibliche Daphnien) darf am Ende der Prüfung 20 % nicht übersteigen;
- die mittlere Anzahl an lebenden Nachkommen, die pro am Ende der Prüfung noch lebendem Elterntier produziert wurden, ist ≥ 60.
Hinweis: Dasselbe Validitätskriterium (20 %) kann auf die auf ein Versehen oder auf ungeklärte Ursachen zurückzuführende Mortalität der Elterntiere bei den Kontrollen sowie den einzelnen Prüfkonzentrationen angewandt werden.
Beschreibung der Methode
Geräte
Prüfgefäße und sonstige Geräte, die mit den Prüflösungen in Berührung kommen, müssen vollständig aus Glas oder einem anderen chemisch inerten Material bestehen. Normalerweise handelt es sich bei den Prüfgefäßen um Glaskolben.
Zusätzlich sind einige oder alle der folgenden Geräte erforderlich:
- Sauerstoffmessgerät (mit einer Mikroelektrode oder einem anderen geeigneten Gerät zur Messung von gelöstem Sauerstoff in Proben von geringem Volumen);
- geeignetes Gerät zur Regelung der Temperatur;
- pH-Messgerät;
- Gerät zur Bestimmung der Wasserhärte;
- Gerät zur Bestimmung der gesamten organischen Kohlenstoffkonzentration (TOC) von Wasser oder Gerät zur Bestimmung des chemischen Sauerstoffbedarfs (COD);
- geeignetes Gerät zur Regelung der Beleuchtungsverhältnisse und zur Messung der Lichtstärke.
Prüforganismen
In der Prüfung sollte die Art Daphnia magna Straus verwendet werden 1.
Der Klon sollte möglichst durch eine Genotypbestimmung identifiziert worden sein. Untersuchungen (1) haben gezeigt, dass die Reproduktionsleistung von Klon A (der aus dem IRCHA in Frankreich stammt) (5) das Validitätskriterium eines Mittelwerts von ≥ 60 Nachkommen je überlebendem Elterntier gleichbleibend erfüllt, wenn die Kultur unter den in dieser Methode beschriebenen Bedingungen erfolgt. Andere Klone sind jedoch annehmbar, sofern nachgewiesen ist, dass die Daphnien-Kultur die Validitätskriterien für eine Prüfung erfüllt.
Zu Beginn der Prüfung sollten die Tiere weniger als 24 Stunden alt sein, und sie dürfen nicht zur ersten Nachkommensgeneration gehören. Sie sollten aus einem gesunden Bestand stammen (d. h. keine Anzeichen von Stress, wie z.B. eine hohe Mortalität, das Vorhandensein von männlichen Tieren oder Ephippien, eine verzögerte Produktion der ersten Brut, verfärbte Tiere usw. aufweisen). Die Zuchttiere müssen unter ähnlichen Kulturbedingungen (Licht, Temperatur, Medium, Fütterung und Tiere je Volumeneinheit) gehalten werden wie die Tiere, die in der Prüfung verwendet werden. Wird bei der Prüfung ein anderes Kulturmedium für die Daphnien verwendet als bei der routinemäßigen Daphnien-Kultur, empfiehlt sich eine Eingewöhnungszeit vor der Prüfung, die im Normalfall etwa drei Wochen dauert (d. h. eine Generation), um Stress für die Elterntiere zu vermeiden.
Prüfmedium
In dieser Prüfung wird der Einsatz eines vollständig definierten Mediums empfohlen. Dadurch kann die Verwendung von Additiven (z.B. Seetang, Bodenextrakt, usw.), die sich nur schwer charakterisieren lassen, vermieden werden, und es bestehen größere Chancen auf eine Standardisierung unter den Prüfeinrichtungen. Die Medien Elendt M4 (6) und M7 (siehe Anlage 2) haben sich für diesen Zweck als geeignet erwiesen. Allerdings sind andere Medien (z.B. (7) (8)) annehmbar, sofern nachgewiesen ist, dass die Leistung der Daphnien-Kultur die Validitätskriterien für die Prüfung erfüllt.
Werden Medien verwendet, die undefinierte Additive enthalten, sollten diese Additive klar und deutlich spezifiziert werden, und der Prüfbericht sollte Angaben zur Zusammensetzung enthalten, insbesondere im Hinblick auf den Kohlenstoffgehalt, da dieser zu der gebotenen Nahrung beitragen kann. Empfohlen wird, dass der gesamte organische Kohlenstoff (TOC) und/oder der chemische Sauerstoffbedarf (COD) des Stammansatzes des organischen Additivs bestimmt und eine Schätzung des sich daraus ergebenden Beitrags zu dem TOC/COD im Prüfmedium vorgenommen werden. Laut der Empfehlung sollten die TOC-Anteile in dem Medium (d. h. vor dem Zusatz von Algen) unter 2 mg/l liegen (9).
Enthalten die Prüfchemikalien Metalle, ist zu berücksichtigen, dass die Eigenschaften des Prüfmediums (z.B. Härte, Chelatbildungsvermögen) Einfluss auf die Toxizität der Prüfchemikalie haben können. Aus diesem Grund sollte möglichst ein umfassend definiertes Prüfmedium verwendet werden. Gegenwärtig sind jedoch die einzigen umfassend definierten Medien, die bekanntermaßen für die Langzeitkultur von Daphnia magna geeignet sind, Elendt M4 und M7. Beide Medien enthalten den Chelatbildner EDTA. Untersuchungen haben gezeigt (2), dass die "scheinbare Toxizität" von Cadmium im Allgemeinen niedriger ist, wenn der Reproduktionstest in den Medien M4 und M7 durchgeführt wird, als in Medien, die kein EDTA enthalten. M4 und M7 werden aus diesem Grunde nicht für Prüfchemikalien empfohlen, die Metalle enthalten; andere Medien, die bekannte Chelatbildner enthalten, sollten ebenfalls vermieden werden. Bei Chemikalien, die Metall enthalten, kann die Verwendung eines alternativen Mediums ratsam sein, beispielsweise rekonstituiertes hartes Süßwasser (9) nach ASTM, das kein EDTA enthält. Die Kombination von rekonstituiertem hartem Süßwasser nach ASTM und Seetangextrakt (10) ist für die Langzeitkultur von Daphnia magna (2) geeignet.
Zu Beginn und im Verlauf der Prüfung sollte die Konzentration des gelösten Sauerstoffs über 3 mg/l liegen. Der pH-Wert sollte im Bereich von 6 bis 9 liegen und in jedem einzelnen Test um nicht mehr als 1,5 Einheiten schwanken. Eine Härte von mehr als 140 mg/l (als CaCO3) wird empfohlen. Bei Prüfungen mit diesem und höheren Werten wurde eine Reproduktionsleistung im Einklang mit den Validitätskriterien nachgewiesen (11) (12).
Prüflösungen
Prüflösungen der gewählten Konzentrationen werden im Allgemeinen durch Verdünnung einer Stammlösung hergestellt. Stammlösungen sollten möglichst ohne Verwendung von Lösungs- oder Dispergiermitteln durch mechanisches Vermischen oder Schütteln (z.B. durch Schütteln, durch Rühren oder mit Ultraschall oder anderen geeigneten Methoden) der Prüfchemikalie im Prüfmedium hergestellt werden. Die Versuchssysteme sollten den in der Studie zu verwendenden Konzentrationen der Prüfchemikalie vorzugsweise so lange ausgesetzt werden, dass die Aufrechterhaltung stabiler Expositionskonzentrationen nachgewiesen werden kann, bevor Prüforganismen eingesetzt werden. Ist die Prüfchemikalie nur schwer in Wasser löslich, sollten die im OECD Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures beschriebenen Verfahren befolgt werden (13). Die Verwendung von Lösungs- oder Dispergiermitteln sollte vermieden werden, kann jedoch in einigen Fällen notwendig sein, um eine Stammlösung mit geeigneter Konzentration für die Dosierung herzustellen.
Zusätzlich zu den Prüfkonzentrationen sollten eine Verdünnungswasserkontrolle mit entsprechenden Replikaten und, falls unvermeidbar, eine Lösungsmittelkontrolle mit entsprechenden Replikaten durchgeführt werden. Bei der Prüfung sollten nur Lösungs- oder Dispergiermittel verwendet werden, die untersucht wurden und nachweislich keine signifikanten oder nur minimale Wirkungen auf die Reaktionsvariable haben. Beispiele für geeignete Lösungsmittel (z.B. Aceton, Ethanol, Methanol, Dimethylformamid und Triethylenglycol) sowie für Dispergiermittel (z.B. Cremophor RH40, Methylcellulose 0,01 % und HCO-40) sind (13) zu entnehmen. Bei Verwendung eines Lösungs- oder Dispergiermittels sollte seine Endkonzentration nicht größer als 0,1 ml/l (13) sein, und die Konzentration sollte in allen Gefäßen, ausgenommen die Verdünnungswasserkontrolle, gleich sein. Jedoch sollte die Lösungsmittelkonzentration minimal gehalten werden.
Verfahren
Expositionsbedingungen
Dauer
Die Prüfung dauert 21 Tage.
Besatz
Die Elterntiere werden jeweils einzeln in einem Prüfgefäß in der Regel mit 50 bis 100 ml Prüfmedium in jedem Gefäß gehalten, außer wenn ein Durchflusstest durchgeführt werden muss (bei Daphnia magna können kleinere Volumina verwendet werden, insbesondere bei kleineren Daphnien, z.B. Ceriodaphnia dubia).
Mitunter können größere Volumina erforderlich sein, um die Anforderungen des Analyseverfahrens, mit dem die Prüfchemikalienkonzentration bestimmt wird, zu erfüllen, wenngleich ein Poolen von Replikaten für die chemische Analyse ebenfalls zulässig ist. Werden größere Volumina als 100 ml verwendet, muss unter Umständen die Futterration der Daphnien erhöht werden, um ein entsprechendes Nahrungsangebot und die Einhaltung der Validitätskriterien sicherzustellen.
Versuchstiere
Bei semistatischen Prüfungen werden mindestens zehn Tiere einzeln bei jeder Prüfkonzentration und mindestens zehn Tiere einzeln in den Kontrollreihen gehalten.
Bei Durchflussprüfungen haben sich 40 Tiere, die in vier Gruppen von jeweils zehn Tieren bei jeder Prüfkonzentration aufgeteilt werden, als geeignet erwiesen (1). Es kann eine geringere Anzahl an Prüforganismen verwendet werden, und mindestens 20 Tiere je Konzentration, die in zwei oder mehr Replikate mit einer gleichen Anzahl von Tieren aufgeteilt werden (z.B. vier Replikate mit jeweils fünf Daphnien), werden empfohlen. Zu beachten ist, dass es bei Prüfungen, bei denen die Tiere in Gruppen gehalten werden, nicht möglich sein wird, Nachkommen aus der statistischen Analyse auszuschließen, wenn Elterntiere nach Beginn der Reproduktion aufgrund von Versehen oder aus ungeklärter Ursache sterben. In diesen Fällen sollte die Reproduktionsleistung als "Gesamtanzahl an lebenden Nachkommen pro zu Beginn der Prüfung vorhandenem Elterntier" angegeben werden.
Die Behandlungen sollten den Prüfgefäßen zugeordnet werden, und die gesamte anschließende Handhabung der Prüfgefäße sollte nach dem Zufallsprinzip erfolgen. Ist dies nicht der Fall, kann eine Verzerrung auftreten, die als Wirkung der Konzentration ausgelegt werden könnte. Insbesondere wenn Versuchseinheiten in der Reihenfolge der Behandlung oder der Konzentration bearbeitet werden, könnten verschiedene zeitbezogene Faktoren wie beispielsweise die Müdigkeit des Prüfers oder andere Fehler zu größeren Wirkungen bei den höheren Konzentrationen führen. Außerdem sollte eine Blockbildung für die Prüfung in Erwägung gezogen werden, wenn die Prüfergebnisse wahrscheinlich durch eine anfängliche oder umweltbezogene Bedingung der Prüfung, wie z.B. der Position im Labor, beeinflusst werden.
Fütterung
Bei semistatischen Prüfungen sollte die Fütterung möglichst täglich, zumindest jedoch dreimal pro Woche erfolgen (d. h. entsprechend dem Wechsel des Prüfmediums). Die mögliche Verdünnung der Expositionskonzent rationen durch Futterbeimischung sollte berücksichtigt und mit korrekt konzentrierten Algensuspensionen möglichst vermieden werden. Abweichungen hiervon (z.B. bei Durchflussprüfungen) sollten protokolliert werden.
Während der Prüfung sollte die Nahrung der Elterntiere möglichst aus lebenden Algenzellen von einer oder mehreren der folgenden Arten bestehen: Chlorella sp., Pseudokirchneriella subcapitata (früher Selenastrum capricornutum) und Desmodesmus subspicatus (früher Scenedesmus subspicatus). Die angebotene Nahrung sollte auf der Menge an organischem Kohlenstoff (C) beruhen, die jedem Elterntier zur Verfügung gestellt wird. Untersuchungen (14) haben gezeigt, dass bei Daphnia magna Rationen zwischen 0,1 und 0,2 mg C/Daphnie/Tag ausreichend sind, um die zur Erfüllung der Validitätskriterien der Prüfung erforderliche Anzahl an Nachkommen zu erzielen. Die Ration kann entweder aus einer gleichbleibenden Gabe während des gesamten Prüfzeitraums bestehen, oder es kann, sofern gewünscht, am Anfang eine geringere Menge dargeboten werden, die dann im Verlauf der Prüfung erhöht wird, um dem Wachstum der Elterntiere Rechnung zu tragen. In diesem Fall sollte die Ration jederzeit innerhalb des empfohlenen Bereichs von 0,1 bis 0,2 mg C/Daphnie/Tag bleiben.
Kommen zur Bestimmung der erforderlichen Futterration Ersatzgrößen zum Einsatz, beispielsweise die Anzahl an Algenzellen oder die Lichtextinktion (aus Gründen der Zweckmäßigkeit, weil die Messung des Kohlenstoffgehalts zeitaufwendig ist), muss jede Prüfeinrichtung ihr eigenes Nomogramm erstellen, in dem die Ersatzgröße in Bezug zum Kohlenstoffgehalt der Algenkultur gesetzt wird (Anleitung zur Erstellung von Nomogrammen siehe Anlage 3). Nomogramme sollten zumindest einmal pro Jahr oder häufiger überprüft werden, wenn sich die Bedingungen für die Algenkultur geändert haben. Dabei hat sich die Lichtextinktion als eine bessere Ersatzgröße für den Kohlenstoffgehalt als die Zellenanzahl erwiesen (15).
Den Daphnien sollte eine konzentrierte Algensuspension gefüttert werden, um das Volumen des Algenkulturmediums, das in die Prüfgefäße gelangt, auf ein Mindestmaß zu beschränken. Die Konzentration der Algen lässt sich durch Zentrifugieren mit anschließender Resuspension in Daphnia-Kulturmedium erreichen.
Licht
16 Stunden Licht mit einer Stärke von nicht mehr als 15-20 µE · m-2 · s-1, gemessen an der Wasseroberfläche des Gefäßes. Bei in Lux kalibrierten Lichtmessgeräten entspricht der Bereich 1.000-1 500 lx für die Lichtfarbe "cool-white" etwa der empfohlenen Lichtintensität von 15-20 µE · m-2 · s-1.
Temperatur
Die Temperatur der Prüfmedien sollte zwischen 18 und 22 °C liegen. Allerdings sollte die Temperatur bei jeder einzelnen Prüfung nach Möglichkeit um nicht mehr als 21 °C innerhalb dieser Grenzwerte als tägliche Spanne schwanken (z.B. 18 bis 20, 19 bis 21 oder20 bis 221 °C). Zur Überwachung der Temperatur kann die Verwendung eines zusätzlichen Prüfgefäßes angebracht sein.
Belüftung
Die Prüfgefäße dürfen während der Prüfung nicht belüftet werden.
Versuchsplanung
Dosisfindungstest
Wenn erforderlich, wird ein Dosisfindungstest beispielsweise mit fünf Konzentrationen der Prüfchemikalie und zwei Replikaten für jede Behandlung und Kontrolle durchgeführt. Zusätzliche Informationen aus Prüfungen mit ähnlichen Chemikalien oder aus der Literatur zur akuten Toxizität bei Daphnien und/oder anderen Wasserorganismen können ebenfalls hilfreich sein, um die im Dosisfindungstest zu verwendenden Konzentrationen festzulegen.
Der Dosisfindungstest dauert 21 Tage oder ausreichend lange, um das Ausmaß der Wirkungen zuverlässig vorherzusagen. Am Ende des Tests wird die Reproduktion der Daphnien bewertet. Die Anzahl der Elterntiere und das Auftreten von Nachkommen sollten protokolliert werden.
Hauptversuch
Im Normalfall sollten mindestens fünf Prüfkonzentrationen, die die wirksame Konzentration (z.B. ECx) einschließen, in einer geometrischen Reihe angeordnet sind und sich um einen Faktor von möglichst nicht mehr als 3,2 voneinander unterscheiden, verwendet werden. Für jede Prüfkonzentration sollte eine angemessene Anzahl an Replikaten eingesetzt werden (siehe Nummern 24 und 25). Die Verwendung von weniger als fünf Konzentrationen muss begründet werden. Die Chemikalien sollten nicht oberhalb ihrer Löslichkeitsgrenze im Prüfmedium geprüft werden. Vor Durchführung der Prüfung sollten die statistische Trennschärfe des Versuchsplans und die Anwendung geeigneter statistischer Methoden überdacht werden (4). Bei der Festlegung des Bereichs von Konzentrationen ist Folgendes zu berücksichtigen:
- Wenn die ECx für Wirkungen auf die Reproduktion geschätzt wird, ist es ratsam, hinreichende Konzentrationen zur Bestimmung der ECx mit einem angemessenen Konfidenzbereich zu verwenden. Die verwendeten Prüfkonzentrationen sollten vorzugsweise die geschätzte ECx einschließen, sodass die ECx durch Interpolation anstatt durch Extrapolation bestimmt werden kann. Für die anschließende statistische Analyse ist es von Vorteil, mehr Prüfkonzentrationen (z.B. zehn) und weniger Replikate je Konzentration (z.B. fünf, um die Gesamtanzahl an Gefäßen konstant zu halten) und zehn Kontrollen zu verwenden.
- Bei der Bestimmung der LOEC und/oder NOEC sollte die niedrigste Prüfkonzentration so gering sein, dass die Reproduktionsleistung bei dieser Konzentration nicht signifikant niedriger ist als in der Kontrolle. Ist dies nicht der Fall, muss die Prüfung mit einer geringeren niedrigsten Konzentration wiederholt werden.
- Bei der Bestimmung der LOEC und/oder NOEC sollte die höchste Prüfkonzentration so hoch sein, dass die Reproduktionsleistung bei dieser Konzentration signifikant niedriger ist als in der Kontrolle. Ist dies nicht der Fall, muss die Prüfung mit einer höheren höchsten Konzentration wiederholt werden, außer wenn die maximal erforderliche Prüfkonzentration für die Prüfung auf chronische Wirkungen (d. h. 10 mg/l) als höchste Prüfkonzentration in der anfänglichen Prüfung verwendet wurde.
Wenn im Dosisfindungstest bei der höchsten Konzentration (z.B. 10 mg/l) keine Wirkungen beobachtet werden oder wenn die Prüfchemikalie angesichts der Tatsache, dass sie bei anderen Organismen nicht toxisch wirkt und/oder nur in geringem Maße/nicht aufgenommen wird, höchstwahrscheinlich eine geringe/keine Toxizität besitzt, kann der Reproduktionstest als Limit-Test mit einer Prüfkonzentration von z.B. 10 mg/l und der Kontrolle durchgeführt werden. Für die Behandlungs- und Kontrollgruppen sollten jeweils zehn Replikate verwendet werden. Sollte ein Limit-Test in einem Durchflusssystem durchgeführt werden müssen, sind u. U. auch weniger Replikate möglich. Im Rahmen eines Limit-Tests kann nachgewiesen werden, dass bei der Limit-Konzentration keine statistisch signifikante Wirkung eintritt. Sollten aber Wirkungen festgestellt werden, ist im Normalfall eine vollständige Prüfung erforderlich.
Kontrollen
Zusätzlich zu den Testreihen sollten eine Kontrollreihe mit dem Prüfmedium und, sofern zutreffend, auch eine Kontrollreihe mit dem Lösungs- oder Dispergiermittel durchgeführt werden. Werden Lösungs- oder Dispergiermittel verwendet, sollte deren Konzentration gleich den Konzentrationen in den Gefäßen mit der Prüfchemikalie sein. Die entsprechende Anzahl an Replikaten sollte zum Einsatz kommen (siehe Nummern 23 und 24).
Im Allgemeinen sollte in einer ordentlich durchgeführten Prüfung der Variationskoeffizient rund um die mittlere Anzahl an lebenden Nachkommen, die pro Elterntier in der/den Kontrolle(n) produziert werden, ≤ 25 % betragen, und dies sollte bei Versuchsplänen mit einzeln gehaltenen Tieren protokolliert werden.
Erneuerung des Prüfmediums
Die Häufigkeit, mit der das Prüfmedium erneuert wird, hängt von der Stabilität der Prüfchemikalie ab. Jedoch sollte es zumindest dreimal pro Woche ausgetauscht werden. Wenn aus vorhergehenden Stabilitätsprüfungen (siehe Nummer 7) bekannt ist, dass die Konzentration der Prüfchemikalie während des maximalen Erneuerungszeitraums (d. h. drei Tage) nicht stabil ist (d. h. außerhalb des Bereichs von 80 bis 120 % der nominalen Konzentration oder unterhalb von 80 % der gemessenen anfänglichen Konzentration liegt), sollte ein häufigerer Wechsel des Prüfmediums oder der Einsatz einer Durchflussprüfung in Erwägung gezogen werden.
Zur Erneuerung des Mediums in semistatischen Prüfungen wird eine zweite Reihe von Prüfgefäßen vorbereitet, in die die Elterntiere beispielsweise mit einer Glaspipette von geeignetem Durchmesser umgesetzt werden. Dabei sollte die Menge an Prüfmedium, die zusammen mit den Daphnien umgesetzt wird, so gering wie möglich sein.
Beobachtungen
Die Ergebnisse der Beobachtungen während der Prüfung sollten auf Datenblättern (siehe Beispiele in den Anlagen 4 und 5) protokolliert werden. Sind andere Messungen erforderlich (siehe Nummer 44), sind gegebenenfalls weitere Beobachtungen erforderlich.
Nachkommen
Die Nachkommen, die von jedem Elterntier produziert werden, sollten vom Auftreten der ersten Brut an möglichst täglich entfernt und gezählt werden, um zu verhindern, dass sie die für die erwachsenen Tiere bestimmte Nahrung verbrauchen. Für diese Methode braucht zwar nur die Anzahl an lebenden Nachkommen gezählt zu werden, vorhandene unreife Eier oder tote Nachkommen sollten jedoch ebenfalls festgehalten werden.
Mortalität
Sterbefälle unter den Elterntieren sollten möglichst täglich protokolliert werden; sie sollten zumindest zu den gleichen Zeitpunkten gezählt werden wie die Nachkommen.
Sonstige Parameter
Dieses Verfahren dient zwar hauptsächlich der Bewertung der Wirkungen auf die Reproduktionsleistung, aber auch andere Auswirkungen können in hinreichendem Maße für eine statistische Auswertung quantifiziert werden. Die Reproduktionsleistung pro überlebendem Elterntier, d. h. die Anzahl der während der Prüfung produzierten lebenden Nachkommen pro überlebendem Elterntier, kann protokolliert werden. Dieser Wert kann mit der wichtigsten Reaktionsvariablen (Reproduktionsleistung pro am Anfang der Prüfung vorhandenem Elterntier, das während der Prüfung nicht aus ungeklärter Ursache oder versehentlich gestorben ist), verglichen werden. Tritt die elterliche Mortalität bei exponierten Replikaten auf, sollte geprüft werden, ob die Mortalität einem Konzentrations-/Wirkungs-Muster folgt, z.B. ob eine signifikante Regression der Reaktion im Verhältnis zur Konzentration der Prüfchemikalie mit positiver Steigung vorliegt (hierzu kann ein statistischer Test wie der Cochran-Armitage-Trendtest verwendet werden). Folgt die Mortalität keinem Konzentrations-/Wirkungs-Muster, dann sollten diejenigen Replikate mit elterlicher Mortalität aus der Analyse des Testergebnisses ausgeschlossen werden. Folgt die Mortalität hingegen einem Konzentrations-/Wirkungs-Muster, sollte die elterliche Mortalität als Wirkung der Prüfchemikalie eingeordnet und die Replikate sollten nicht aus der Analyse des Testergebnisses ausgeschlossen werden. Besonders wünschenswert sind Wachstumsmessungen, denn sie liefern Informationen über mögliche subletale Wirkungen, die unter Umständen nützlicher sind als die Reproduktionsmessung alleine. Empfohlen wird die Vermessung der Länge der Elterntiere (d. h. die Körperlänge ohne Afterstachel) am Ende der Prüfung. Weitere Parameter, die sich messen oder berechnen lassen, sind unter anderem die Zeit bis zur Produktion der ersten Brut (und folgender Bruten), Anzahl und Umfang der Bruten je Tier, Anzahl an unreifen Eiern, Vorhandensein von männlichen Schlüpflingen (OECD, 2008) oder Ephippien und die immanente Populationswachstumsrate (siehe Anlage 1 bezüglich Definition und Anlage 7 bezüglich der Geschlechtsbestimmung bei frisch geschlüpften Daphnien).
Häufigkeit von analytischen Bestimmungen und Messungen
Sauerstoffkonzentration, Temperatur, Härte und pH-Wert sollten zumindest einmal pro Woche gemessen werden, und zwar in frischen und alten Medien, in der/den Kontrolle(n) und in der höchsten Konzentration der Prüfchemikalie.
Die Konzentrationen der Prüfchemikalie werden während der Prüfung in regelmäßigen Abständen bestimmt.
Bei semistatischen Prüfungen, bei denen erwartet wird, dass die Konzentration der Prüfchemikalie innerhalb von ± 20 % der Nominalkonzentration konstant bleibt (d. h. innerhalb des Bereichs von 80 bis 120 % - siehe Nummern 6, 7 und 39), wird empfohlen, dass zumindest die höchste und die niedrigste Prüfkonzentration sofort nach der Zubereitung und bei der Erneuerung einmal während der ersten Woche der Prüfung analysiert werden (d. h. Analysen sollten anhand einer Probe derselben Lösung erfolgen - sofort nach der Zubereitung und bei der Erneuerung). Diese Bestimmungen sollten anschließend zumindest in wöchentlichen Abständen wiederholt werden.
Bei Prüfungen, bei denen nicht damit zu rechnen ist, dass die Konzentration der Prüfchemikalie innerhalb von ± 20 % der Nominalkonzentration konstant bleibt, ist es notwendig, alle Prüfkonzentrationen sofort nach der Zubereitung und bei der Erneuerung zu analysieren. Bei denjenigen Prüfungen jedoch, bei denen die gemessene Anfangskonzentration der Prüfchemikalie zwar nicht innerhalb von ± 20 % der Nominalkonzentration stabil bleibt, bei der jedoch hinreichend nachgewiesen werden kann, dass die Anfangskonzentrationen reproduzierbar und stabil sind (d. h. innerhalb des Bereichs von 80 bis 120 % der Anfangskonzentrationen), könnten die chemischen Bestimmungen in Woche 2 und 3 der Prüfung auf die höchste und die niedrigste Konzentration reduziert werden. In allen Fällen braucht die Prüfchemikalienkonzentrationen vor der Erneuerung des Prüfmediums nur an einem Wiederholungsgefäß bei jeder Prüfkonzentration bestimmt zu werden.
Bei einer Durchflussprüfung ist ein ähnliches Probenahmeverfahren wie für semistatische Prüfungen beschrieben angebracht (die Messung der "alten" Lösungen gilt in diesem Fall jedoch nicht). Es kann allerdings ratsam sein, die Anzahl an Probenahmen in der ersten Woche zu erhöhen (z.B. drei Messreihen), um sicherzugehen, dass die Prüfkonzentrationen stabil bleiben. Bei diesen Prüfarten sollte die Durchsatzrate des Verdünnungsmittels und der Prüfchemikalie täglich überprüft werden.
Ist nachgewiesen, dass die Konzentration der Prüfchemikalie während der gesamten Prüfung zufriedenstellend innerhalb von ± 20 % der Nominalkonzentration oder der gemessenen Anfangskonzentration bleibt, können die Ergebnisse auf nominalen oder gemessenen Anfangswerten beruhen. Wenn die Abweichung von der nominalen oder gemessenen Anfangskonzentration größer als ± 20 % ist, sollten die Ergebnisse als zeitgewichtetes Mittel dargestellt werden (siehe Leitfaden für die Berechnung in Anlage 6).
Daten und Berichterstattung
Auswertung der Ergebnisse
Mit dieser Prüfung soll die Wirkung der Prüfchemikalie auf die Reproduktionsleistung bestimmt werden. Für jedes Prüfgefäß (d. h. Replikat) sollte die Gesamtanzahl an lebenden Nachkommen pro Elterntier berechnet werden. Darüber hinaus kann die Reproduktion basierend auf der Produktion lebender Nachkommen durch das überlebende Elterntier ermittelt werden. Jedoch ist die aus ökologischer Sicht relevanteste Reaktionsvariable die Gesamtanzahl an lebenden Nachkommen, die pro Elterntier produziert werden, das während der Prüfung nicht versehentlich 2 oder aus ungeklärter Ursache 3 stirbt. Wenn das Elterntier während der Prüfung versehentlich oder aus ungeklärter Ursache stirbt oder sich als Männchen herausstellt, dann wird das betreffende Replikat von der Analyse ausgeschlossen. Die Analyse beruht dann auf einer verringerten Anzahl von Replikaten. Tritt die elterliche Mortalität bei exponierten Replikaten auf, sollte geprüft werden, ob die Mortalität einem Konzentrations-/Wirkungs-Muster folgt, z.B. ob eine signifikante Regression der Reaktion im Verhältnis zur Konzentration der Prüfchemikalie mit positiver Steigung vorliegt (hierzu kann ein statistischer Test wie der Cochran-Armitage-Trendtest verwendet werden). Folgt die Mortalität keinem Konzentrations-/Wirkungs-Muster, dann sollten diejenigen Replikate mit elterlicher Mortalität aus der Analyse des Testergebnisses ausgeschlossen werden. Folgt die Mortalität hingegen einem Konzentrations-/Wirkungs-Muster, sollte die elterliche Mortalität als Wirkung der Prüfchemikalie eingeordnet und die Replikate sollten nicht aus der Analyse des Testergebnisses ausgeschlossen werden.
Wenn die LOEC und NOEC oder die ECx zur Angabe der Wirkungen verwendet werden, empfiehlt es sich, die Wirkung auf die Reproduktion durch Verwendung der beiden oben genannten Reaktionsvariablen zu berechnen, d. h.
- als Gesamtanzahl an lebenden Nachkommen, die pro Elterntier produziert wurden, das während der Prüfung nicht versehentlich oder aus ungeklärter Ursache stirbt, und
- als Anzahl an lebenden Nachkommen jedes überlebenden Elterntiers,
und dann als Endergebnis den niedrigsten NOEC- und LOEC- oder ECx-Wert zu verwenden, der mithilfe einer dieser beiden Reaktionsvariablen berechnet wurde.
Vor der statistischen Analyse, z.B. durch ANOVA-Verfahren oder den Vergleich der Behandlungsgruppen mit den Kontrollen durch die Tests von Student (t-Test), Dunnett, Williams oder Jonckheere-Terpstra (Step-Down), empfiehlt es sich zu prüfen, ob die Daten transformiert werden müssen, um die Anforderungen des jeweiligen statistischen Tests zu erfüllen. Als parameterfreie Alternativen können der Dunn- und Mann-Whitney-Test in Betracht gezogen werden. Für einzelne Behandlungsmittelwerte werden 95 %-Konfidenzintervalle berechnet.
Die Anzahl der überlebenden Elterntiere in den unbehandelten Kontrollen ist ein Validitätskriterium und sollte dokumentiert und angegeben werden. Ferner sollten alle sonstigen schädlichen Wirkungen, z.B. Abweichungen im Verhalten und signifikante toxikologische Erkenntnisse, im Prüfbericht angegeben werden.
ECx
ECx-Werte, einschließlich der entsprechenden oberen und unteren Konfidenzgrenzen, werden mit geeigneten statistischen Methoden berechnet (z.B. Logit- oder Weibull-Modell, Trimmed Spearman-Karber-Methode oder einfache Interpolation). Um den EC10-, EC50- oder einen beliebigen anderen ECx-Wert zu ermitteln, sollte der komplette Datensatz einer Regressionsanalyse unterzogen werden.
NOEC/LOEC
Zur Bestimmung der NOEC-/LOEC-Werte durch statistische Analyse sollten geeignete statistische Methoden angewandt werden (gemäß OECD-Dokument 54 Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application) (4). Im Allgemeinen werden schädliche Wirkungen der Prüfchemikalie im Vergleich mit der Kontrolle einer einseitigen Hypothesenprüfung mit p ≤ 0,05 unterzogen.
Normalverteilung und Varianzhomogenität können mit einem geeigneten statistischen Test, z.B. Shapiro-Wilk-Test bzw. Levene-Test (p ≤ 0,05), geprüft werden. Eine einfaktorielle ANOVA und anschließende multiple Vergleichstests können durchgeführt werden. Mit multiplen Vergleichstests (z.B. Dunnett-Test) oder Step-Down-Trendtests (z.B. Williams-Test oder Jonckheere-Terpstra-Test (Step-Down)) kann berechnet werden, ob zwischen den Kontrollen und den verschiedenen Prüfkonzentrationen signifikante Unterschiede (p ≤ 0,05) bestehen (Auswahl des empfohlenen Tests gemäß OECD-Dokument 54 (4)). Andernfalls könnten parameterfreie Methoden (z.B. U-Test mit Bonferroni-/Holm-Korrektur oder Jonckheere-Terpstra-Trendtest) verwendet werden, um den NOEC- und LOEC-Wert zu bestimmen.
Limit-Test
Wurde ein Limit-Test (Vergleich der Kontrolle mit einer einzigen Behandlungsgruppe) durchgeführt und sind die Bedingungen für parametrische Prüfverfahren (Normalität, Homogenität) erfüllt, können metrische Reaktionen mit dem Student-t-Test ausgewertet werden. Sind diese Bedingungen nicht erfüllt, so kann ein t-Test für ungleiche Varianzen (wie z.B. Welch-Test) oder ein parameterfreier Test wie der U-Test nach Mann und Whitney angewandt werden.
Um signifikante Unterschiede zwischen den Kontrollen (Kontrollen und Lösungs- oder Dispergiermittelkontrollen) zu ermitteln, können die Replikate der einzelnen Kontrollen wie für den Limit-Test beschrieben geprüft werden. Werden bei diesen Tests keine signifikanten Unterschiede festgestellt, können alle Replikate der Kontrolle und Lösungsmittelkontrolle gepoolt werden. Anderenfalls sind alle Behandlungsgruppen mit der Lösungsmittelkontrolle zu vergleichen.
Prüfbericht
Der Prüfbericht muss folgende Informationen enthalten:
Prüfchemikalie:
- physikalischer Zustand und relevante physikalisch-chemische Eigenschaften;
- Daten zur chemischen Identität, einschließlich Reinheit.
Geprüfte Daphnienart:
- der Klon (mit der Angabe, ob er einer Gentypisierung unterzogen wurde), der Lieferant oder die Bezugsquelle (sofern bekannt) und die zum Einsatz kommenden Kulturbedingungen. Wird eine andere Art als Daphnia magna eingesetzt, sollte dies protokolliert und begründet werden.
Prüfbedingungen:
- zum Einsatz kommendes Testverfahren (z.B. semistatisches oder Durchflussverfahren, Volumen, Besatz mit Anzahl Daphnien pro Liter);
- Fotoperiode und Lichtstärke;
- Auslegung der Prüfung (z.B. Anzahl an Replikaten, Anzahl Elterntiere je Replikat);
- nähere Angaben zum verwendeten Kulturmedium;
- sofern verwendet, zugesetztes organisches Material, einschließlich Zusammensetzung, Herkunft, Herstellungsverfahren, TOC/COD der Stammansätze, Schätzung des sich daraus ergebenden TOC/COD im Prüfmedium;
- detaillierte Informationen über die Fütterung, einschließlich Menge (in mg C/Daphnie/Tag) und Plan (z.B. Art von Futtermittel(n), einschließlich spezifischer Name (Art) bei Algen und, sofern bekannt, der Stamm, die Kulturbedingungen);
- Art der Herstellung von Stammansätzen und Häufigkeit der Erneuerung (sofern verwendet, müssen das Lösungs- oder Dispergiermittel und dessen Konzentration angegeben werden).
Ergebnisse:
- Ergebnisse von eventuellen vorhergehenden Untersuchungen zur Stabilität der Prüfchemikalie;
- die nominalen Prüfkonzentrationen und die Ergebnisse aller Analysen zur Bestimmung der Konzentration der Prüfchemikalie in den Prüfgefäßen (siehe Beispieldatenblätter in Anlage 5); die Wiederfindungsrate der Methode und die Bestimmungsgrenze sollten ebenfalls protokolliert werden;
- Wasserqualität in den Prüfgefäßen (d. h. pH-Wert, Temperatur und Konzentration des gelösten Sauerstoffs sowie TOC und/oder COD und Härte, soweit zutreffend) (siehe Beispieldatenblatt in Anlage 4);
- die gesamte Aufzeichnung der Produktion lebender Nachkommen je Elterntier während der Prüfung (siehe Beispieldatenblatt in Anlage 4);
- die Anzahl an Todesfällen unter den Elterntieren und der Tag, an dem diese eingetreten sind (siehe Beispieldatenblatt in Anlage 4);
- der Variationskoeffizient für die Reproduktionsleistung der Kontrolle (anhand der Gesamtanzahl an lebenden Nachkommen pro Elterntier, das am Ende der Prüfung noch lebt);
- Darstellung der Gesamtanzahl an lebenden Nachkommen pro Elterntier (für jedes Replikat), ausschließlich der Elterntiere, die während der Prüfung versehentlich oder aus ungeklärter Ursache gestorben sind, im Verhältnis zur Konzentration der Prüfchemikalie;
- soweit zutreffend, Darstellung der Gesamtanzahl an lebenden Nachkommen, die pro überlebenden Elterntier in jedem Replikat produziert wurden, im Verhältnis zur Konzentration der Prüfchemikalie;
- soweit zutreffend, die Lowest Observed Effect Concentration (LOEC) für die Reproduktion, einschließlich einer Beschreibung der angewandten statistischen Verfahren und einer Angabe zum Umfang der zu erwartenden Wirkung, (hierzu kann vor Beginn des Versuchs eine Teststärkenanalyse durchgeführt werden) und die No Observed Effect Concentration (NOEC) für die Reproduktion; Angaben dazu, welche Reaktionsvariable bei der Berechnung der LOEC- und NOEC-Werte (entweder als Gesamtanzahl an lebenden Nachkommen pro Mutterorganismus, der während der Prüfung nicht versehentlich oder aus ungeklärter Ursache gestorben ist, oder als Gesamtanzahl an lebenden Nachkommen pro überlebendem Mutterorganismus) verwendet wurde; soweit zutreffend, sollten die LOEC/NOECfür die Mortalität der Elterntiere ebenfalls protokolliert werden;
- soweit zutreffend, die ECx für die Reproduktion und die Konfidenzintervalle (z.B. 90 % oder 95 %) und ein Diagramm des angepassten Modells, das für die Berechnungen verwendet wurde, die Steigung der Dosis-/Wirkungs-Kurve und deren Standardfehler;
- andere beobachtete biologische Wirkungen oder Messungen: alle anderen biologischen Wirkungen, die beobachtet oder gemessen wurden (z.B. Wachstum von Elterntieren), sollten dokumentiert und angemessen begründet werden;
- eine Erklärung für eine eventuelle Abweichung von der Prüfmethode.
Literaturhinweise
(1) OECD Test Guidelines Programme. Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, U.K., 20.-21. März 1993.
(2) OECD (1997). Report of the Final Ring Test of the Daphnia magna Reproduction Test. Environmental Health and Safety Publications, Series on Testing and Assessment No.6. OECD, Paris.
(3) OECD (2008). Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. Environmental Health and Safety Publications, Series on Testing and Assessment, No.88. OECD, Paris.
(4) OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. Environmental Health and Safety Publications, Series on Testing and Assessment Number 54. OECD, Paris.
(5) Baird, D.J., et al. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Straus. Ecotox. and Environ. Safety, 21, 257-265.
(6) Elendt, B.-P. (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25-33.
(7) EPA (2002). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. Fifth Edition. EPA/821/R-02/012. U.S. Environmental Protection Agency, Office of Water, Washington, DC. www.epa.gov/waterscience/methods.
(8) Vigano, L. (1991). Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, 775-782.
(9) ASTM. (2008) Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates, and Amphibians. In: Annual Book of ASTM Standards; Water and Environmental Technology, vol. 11.04; ASTM E729 - 96 (2007) American Society for Testing and Materials, Philadelphia, PA.
(10) Baird, D.J., et al. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988. (H. Løkke, H. Tyle and F. Bro-Rasmussen. Eds.) 144-148.
(11) Parkhurst, B.R., J.L Forte. And G.P. and Wright (1981) Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26: 1-8.
(12) Cowgill, U.M. and Milazzo, D.P. (1990). The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2): 185-196.
(13) OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environmental Health and Safety Publications, Series on Testing and Assessment No. 23. OECD, Paris.
(14) Sims, I.R., S. Watson. and D. Holmes (1993) Toward a standard Daphnia juvenile production test. Environ. Toxicol. and Chem., 12, 2053-2058.
(15) Sims, I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, 459-466.
_____
1) Wie bei jeder empirischen Beziehung sollte überprüft werden, ob der Prüfstoff innerhalb des Anwendbarkeitsbereichs der Beziehung liegt.
2) Das Gewicht der Fische am Ende der Aufnahmephase kann geschätzt werden anhand von Daten aus Vorversuchen oder von Infornmationen über die wahrscheinliche Wachstumszunahme der Versuchsspezies ab einem typischen Test-Startgewicht während der üblichen Aufnahmedauer (z.B. 28 Tage).
3) In den meisten Programmen, die eine lineare Regression unterstützen, werden auch Standardfehler und das Konfidenzintervall (CI) der Schätzungen angegeben, z.B. Datenanalysefunktionen in Microsoft Excel.
.
| Anlage 1 |
Definitionen
Für diese Prüfmethode gelten folgende Definitionen:
Bestimmungsgrenze: die niedrigste Konzentration, die quantitativ gemessen werden kann.
Chemikalie: Stoff oder Gemisch.
ECx: die Konzentration der in Wasser gelösten Prüfchemikalie, die innerhalb eines angegebenen Expositionszeitraums zu einer Verringerung der Reproduktion der Daphnien um x Prozent führt.
Elterntiere: diejenigen weiblichen Daphnien, die zu Beginn der Prüfung vorhanden sind und deren Reproduktionsleistung in der Prüfung untersucht werden soll.
Immanente Wachstumsrate: ein Maß für das Wachstum der Population, das die Reproduktionsleistung und die altersspezifische Mortalität mit einbezieht (1) (2) (3). In stabilen Populationen ist die immanente Wachstumsrate gleich null. Bei wachsenden Populationen ist sie positiv, und bei schrumpfenden Populationen ist sie negativ. Letztere ist offensichtlich nicht nachhaltig und führt schließlich zum Aussterben.
Lowest Observed Effect Concentration (LOEC): die niedrigste geprüfte Konzentration, bei der innerhalb eines angegebenen Expositionszeitraums eine statistisch signifikante Wirkung der Chemikalie auf die Reproduktion und die Mortalität der Elterntiere (bei p < 0,05) im Vergleich zu der Kontrolle beobachtet wird. Alle Prüfkonzentrationen oberhalb der LOEC sollten jedoch eine mindestens ebenso große schädigende Wirkung haben wie die LOEC. Können diese beiden Bedingungen nicht erfüllt werden, sollte die Auswahl der LOEC (und damit auch der NOEC) ausführlich erklärt werden.
Mortalität: Ein Tier wird als tot protokolliert, wenn es unbeweglich ist, d. h., wenn es nicht schwimmen kann oder sich innerhalb von 15 Sekunden nach vorsichtigem Hin- und Herbewegen des Prüfbehälters keine Bewegungen von Extremitäten oder Postabdomen beobachten lassen. (Wird eine andere Definition herangezogen, muss diese zusammen mit dem dazugehörigen Literaturhinweis angegeben werden).
Mortalität ungeklärter Ursache: Mortalität unbekannter Ursache ohne Zusammenhang mit der Chemikalie.
Mortalität, auf Versehen zurückzuführend: Mortalität ohne Zusammenhang mit der Chemikalie, die durch ein Versehen verursacht wurde (d. h. bekannte Ursache).
Nachkommen: die jungen Daphnien, die von den Elterntieren im Verlauf der Prüfung produziert werden.
Nachweisgrenze: die niedrigste Konzentration, die nachgewiesen, aber nicht quantifiziert werden kann.
No Observed Effect Concentration (NOEC): die Prüfkonzentration unmittelbar unterhalb der LOEC, bei der im Vergleich zu der Kontrolle innerhalb eines angegebenen Expositionszeitraums keine statistisch signifikante Wirkung (p < 0,05) vorliegt.
Prüfchemikalie: Stoff oder Gemisch, der bzw. das mit dieser Prüfmethode getestet wird.
Reproduktionsleistung: die Anzahl lebender Nachkommen, die von Elterntieren während der Prüfung produziert wurden.
Literaturhinweise
(1) Wilson, E.O. and Bossert, W.H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers.
(2) Poole, R.W. (1974). An Introduction to quantitative Ecology. Mc Graw Hill Series in Population Biology, New York, 532.
(3) Meyer, J. S., Ingersoll, C. G., McDonald, L.L. and Boyce, M.S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, 1156-1166.
.
| Herstellung der vollständig definierten Medien Elendt M7 und M4 | Anlage 2 |
Gewöhnung an die Medien Elendt M7 und M4
Einige Prüfeinrichtungen haben Schwierigkeiten, Daphnien direkt in die Medien M4 (1) und M7 umzusetzen. Erfolgreich war jedoch eine schrittweise Eingewöhnung, d. h. Wechsel vom eigenen Medium in 30 %iges Elendt, dann in 60 %iges Elendt und dann in 100 %iges Elendt. Die Eingewöhnungszeiten können dabei durchaus einen Monat betragen.
Herstellung
Spurenelemente
Zunächst werden gesonderte Stammansätze (I) einzelner Spurenelemente in Wasser mit geeignetem Reinheitsgrad, z.B. entionisiertes oder destilliertes Wasser oder Wasser aus umgekehrter Osmose, hergestellt.
Aus diesen unterschiedlichen Stammansätzen (I) wird ein zweiter einziger Stammansatz (II) hergestellt, der alle Spurenelemente enthält (kombinierte Lösung), d. h.:
| Stammansätze I (einzelner Stoff) | Dem Wasser zugesetzte Menge | Konzentration (in Verhältnis zum Medium M4) | Zur Herstellung des kombinierten Stammansatzes II die folgende Menge an Stammansatz I in Wasser geben | |
| mg/l | ml/l | |||
| M4 | M7 | |||
| H3BO3 | 57.190 | 20.000 | 1,0 | 0,25 |
| MnCl2·4 H2O | 7.210 | 20.000 | 1,0 | 0,25 |
| LiCl | 6.120 | 20.000 | 1,0 | 0,25 |
| RbCl | 1.420 | 20.000 | 1,0 | 0,25 |
| SrCl2·6 H2O | 3.040 | 20.000 | 1,0 | 0,25 |
| NaBr | 320 | 20.000 | 1,0 | 0,25 |
| Mo Na2O4 ·2 H2O | 1.260 | 20.000 | 1,0 | 0,25 |
| CuCl2·2 H2O | 335 | 20.000 | 1,0 | 0,25 |
| ZnCl2 | 260 | 20.000 | 1,0 | 1,0 |
| CoCl2·6 H2O | 200 | 20.000 | 1,0 | 1,0 |
| KI | 65 | 20.000 | 1,0 | 1,0 |
| Na2SeO3 | 43,8 | 20.000 | 1,0 | 1,0 |
| NH4VO3 | 11,5 | 20.000 | 1,0 | 1,0 |
| Na2EDTA·2 H2O | 5.000 | 2.000 | - | - |
| FeSO4·7 H2O | 1 991 | 2.000 | - | - |
| Sowohl die Na2EDTA- als auch die FeSO4-Lösung werden einzeln hergestellt, zusammengegossen und sofort autoklaviert. Dies ergibt: | ||||
| Fe-EDTA-Lösung | 1.000 | 20,0 | 5,0 | |
Medien M4 und M7
Die Medien M4 und M7 werden wie folgt aus dem Stammansatz II, Makronährstoffen und Vitaminen hergestellt:
| Dem Wasser zugesetzte Menge | Konzentration (in Verhältnis zum Medium M4) | Zur Herstellung des Mediums zugesetzte Menge an Stammansatz | ||
| mg/l | ml/l | |||
| M4 | M7 | |||
| Stammansatz II
(kombinierte Spurenelemente) | 20 | 50 | 50 | |
| Makronährstoff-Stammansätze (einzelner Stoff) | ||||
| CaCl2·2 H2O | 293.800 | 1.000 | 1,0 | 1,0 |
| MgSO4·7 H2O | 246.600 | 2.000 | 0,5 | 0,5 |
| KCl | 58.000 | 10.000 | 0,1 | 0,1 |
| NaHCO3 | 64.800 | 1.000 | 1,0 | 1,0 |
| Na2SiO3·9 H2O | 50.000 | 5.000 | 0,2 | 0,2 |
| NaNO3 | 2.740 | 10.000 | 0,1 | 0,1 |
| KH2PO4 | 1.430 | 10.000 | 0,1 | 0,1 |
| K2HPO4 | 1.840 | 10.000 | 0,1 | 0,1 |
| Kombinierter Vitamin-Stammansatz | - | 10.000 | 0,1 | 0,1 |
| Der kombinierte Vitamin-Stammansatz wird hergestellt, indem die drei Vitamine wie folgt in 1 Liter Wasser gegeben werden: | ||||
| mg/l | ||||
| Thiaminhydrochlorid | 750 | 10.000 | ||
| Cyanocobalamin (B12) | 10 | 10.000 | ||
| Biotin | 7,5 | 10.000 | ||
Der kombinierte Vitamin-Stammansatz wird in kleinen Portionen tiefgefroren aufbewahrt. Die Vitamine werden den Medien kurz vor der Verwendung zugesetzt.
Hinweis: Um die Ausfällung von Salzen bei der Herstellung der vollständigen Medien zu vermeiden, die Portionen von Stammansätzen in etwa 500-800 ml Wasser entionisiertes Wasser geben und dann auf 1 Liter auffüllen.
Hinweis: Erstmals in einer Publikation erwähnt wird das Medium M4 bei Elendt, B.P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. 11(154), 25-33;
.
| Analyse des gesamten organischen Kohlenstoffs (TOC) und Erstellung von Nomogrammen für den TOC-Gehalt von Algenfutter | Anlage 3 |
Bekanntermaßen wird der Kohlenstoffgehalt des Algenfutters normalerweise nicht direkt gemessen, sondern aus Korrelationen (d. h. Nomogrammen) mit Ersatzgrößen wie der Algenzellenzahl oder der Lichtextinktion abgeleitet.
Der TOC sollte eher durch Oxidation bei hoher Temperatur als durch UV- oder Persulfatmethoden gemessen werden. (Siehe hierzu auch: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
Für die Erstellung von Nomogrammen sollten die Algen durch Zentrifugierung vom Wachstumsmedium getrennt und dann in destilliertem Wasser resuspendiert werden. Der Ersatzparameter und die TOC-Konzentration werden in jeder Probe im Dreifachreplikat gemessen. Es sollten Blindproben des destillierten Wassers analysiert und die TOC-Konzentration von der TOC-Konzentration in der Algenprobe abgeleitet werden.
Die Nomogramme sollten über den geforderten Bereich von Kohlenstoffkonzentrationen linear verlaufen. Es folgen einige Beispiele.
Hinweis: Diese Beispiele sollten nicht für Umrechnungen herangezogen werden. Die Prüfeinrichtungen müssen ihre eigenen Nomogramme erstellen.
Chlorella vulgaris var. viridis (CCAP 211/12).
Regression von mg/l Trockengewicht zu mg C/1. Daten von konzentrierten Suspensionen von Zellen, die in semi-kontinuierlichen Chargen kultiviert und in destilliertem Wasser resuspendiert wurden.
X-Achse: mg C/1 konzentriertes Algenfutter
Y-Achse: mg/1 Trockengewicht konzentriertes Algenfutter
Korrekturkoeffizient -0,980
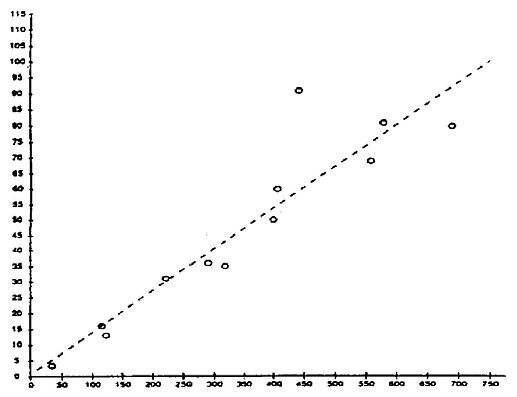
Chlorella vulgaris var. viridis (CCAP 211/12).
Regression der Zellenzahl zu mg C/1. Daten von konzentrierten Suspensionen von Zellen, die in semi-kontinuierlichen Chargen kultiviert und in destilliertem Wasser resuspendiert wurden.
X-Achse: mg C/1 konzentriertes Algenfutter
Y-Achse: Anzahl Zellen/1 konzentriertes Algenfutter
Korrekturkoeffizient -0,926
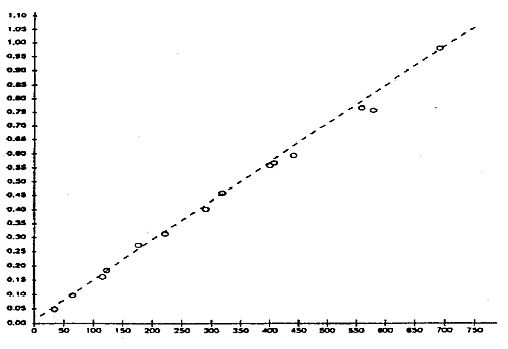
Chlorella vulgaris var. viridis (CCAP 211/12).
Regression der Extinktion zu mg C/1 (1 cm Pfadlänge). Daten von konzentrierten Suspensionen von Zellen, die in semi-kontinuierlichen Chargen kultiviert und in destilliertem Wasser resuspendiert wurden.
X-Achse: mg C/1 konzentriertes Algenfutter
Y-Achse: Extinktion von im Verhältnis 1:10 verdünntem konzentrierten Algenfutter bei 440 nm
Korrekturkoeffizient -0,998
.
| Beispieldatenblatt zur Protokollierung der Erneuerung des Prüfmediums, von physikalisch-chemischen Überwachungsdaten, der Fütterung, Daphnien-Reproduktion und Mortalität von Elterntieren | Anlage 4 |
| Versuch Nr.: | Startdatum: | Klon: | Medium: | Futterart: | Prüfchemikalie: | Nominale Konz.: | ||||||||||||||||||
| Tag | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | ||
| Mediumerneuerung (ankreuzen) | ||||||||||||||||||||||||
| PH * | neu | |||||||||||||||||||||||
| alt | ||||||||||||||||||||||||
| O2 (mg/l) * | neu | |||||||||||||||||||||||
| alt | ||||||||||||||||||||||||
| Temp. °C) * | neu | |||||||||||||||||||||||
| alt | ||||||||||||||||||||||||
| Geb. Futter (ankreuzen) | ||||||||||||||||||||||||
| Anz. leb. Nachkommen ** | Gesamt | |||||||||||||||||||||||
| Gefäß 1 | ||||||||||||||||||||||||
| 2 | ||||||||||||||||||||||||
| 3 | ||||||||||||||||||||||||
| 4 | ||||||||||||||||||||||||
| 5 | ||||||||||||||||||||||||
| 6 | ||||||||||||||||||||||||
| 7 | ||||||||||||||||||||||||
| 8 | ||||||||||||||||||||||||
| 9 | ||||||||||||||||||||||||
| 10 | ||||||||||||||||||||||||
| Gesamt | ||||||||||||||||||||||||
| Kumulative Mortalität bei Elterntieren *** | ||||||||||||||||||||||||
| *) Angeben, welches Gefäß für den Versuch verwendet wurde
**) Unreife Bruten als "AB" in dem betreffenden Kästchen protokollieren ***) Die Mortalität von Elterntieren als "M" in dem betreffenden Kästchen protokollieren | ||||||||||||||||||||||||
.
| Beispieldatenblatt für die Protokollierung der Ergebnisse der chemischen Analyse | Anlage 5 |
a) Gemessene Konzentrationen
| Nominale Konzentration | Probe aus Woche 1 | Probe aus Woche 2 | Probe aus Woche 3 | |||
| Frisch | Alt | Frisch | Alt | Frisch | Alt | |
b) Gemessene Konzentrationen in Prozent der Nominalkonzentrationen
| Nominale Konzentration | Probe aus Woche 1 | Probe aus Woche 2 | Probe aus Woche 3 | |||
| Frisch | Alt | Frisch | Alt | Frisch | Alt | |
.
| Berechnung eines zeitgewichteten Mittels | Anlage 6 |
Zeitgewichtetes Mittel
Da die Konzentration der Prüfchemikalie sich zwischen den Erneuerungen des Prüfmediums verringern kann, muss überlegt werden, welche Konzentration als repräsentativ für den Konzentrationsbereich, dem die Elterndaphnien ausgesetzt werden, ausgewählt werden sollte. Die Auswahl sollte dabei sowohl auf biologischen als auch auf statistischen Erwägungen beruhen. Geht man beispielsweise davon aus, dass die Reproduktion am stärksten durch die zur Anwendung kommende Spitzenkonzentration beeinflusst wird, dann sollte die maximale Konzentration herangezogen werden. Wird jedoch die kumulierte oder längerfristige Wirkung der toxischen Chemikalie für wichtiger gehalten, dann hat eine Durchschnittskonzentration eine größere Relevanz. In diesem Fall ist die zeitgewichtete mittlere Konzentration zu verwenden, bei der die Schwankung der momentanen Konzentration im Zeitverlauf berücksichtigt wird.
Abbildung 1 Beispiel für ein zeitgewichtetes Mittel
Abbildung 1 zeigt ein Beispiel für eine (vereinfachte) Prüfung über sieben Tage, bei der das Prüfmedium an den Tagen 0, 2 und 4 erneuert wird.
- Die dünne Zickzacklinie stellt die Konzentration im Zeitverlauf dar. Es wird angenommen, dass der Rückgang der Konzentration einem exponentiellen Zerfallsprozess folgt.
- Die sechs eingezeichneten Punkte stellen die beobachteten Konzentrationen dar, die am Anfang und am Ende jedes Erneuerungszeitraums gemessen wurden.
- Die dicke durchgezogene Linie gibt die Lage des zeitgewichteten Mittels an.
Das zeitgewichtete Mittel wird so berechnet, dass die Fläche unterhalb des zeitgewichteten Mittels gleich der Fläche unterhalb der Konzentrationskurve ist. Die Berechnung für das oben genannte Beispiel ist in Tabelle 1 dargestellt.
Tabelle 1 Berechnung des zeitgewichteten Mittels
| Erneuerung Nr. | Tage | Konz0 | Konz1 | ln(Konz0) | ln(Konz1) | Fläche |
| 1 | 2 | 10,000 | 4,493 | 2,303 | 1,503 | 13,767 |
| 2 | 2 | 11,000 | 6,037 | 2,398 | 1,798 | 16,544 |
| 3 | 3 | 10,000 | 4,066 | 2,303 | 1,403 | 19,781 |
| Gesamtanzahl Tage: | 7 | Gesamtfläche: | 50,092 | |||
| Zeitgew. Mittel: | 7,156 | |||||
Tage steht für die Anzahl von Tagen des Erneuerungszeitraums.
Konz0 ist die gemessene Konzentration zu Beginn jedes Erneuerungszeitraums.
Konz1 ist die gemessene Konzentration am Ende jedes Erneuerungszeitraums.
ln(Konz0) ist der natürliche Logarithmus von Konz0.
ln(Konz1) ist der natürliche Logarithmus von Konz1.
Fläche ist die Fläche unter der exponentiellen Kurve für jeden Erneuerungszeitraum. Sie wird wie folgt berechnet:
| Konz 0 - Konz 1 | ||
| Fläche = |
| x Tag |
| Ln(Konz 0) - ln(Konz 1) |
Das zeitgewichtete Mittel (zeitgew. Mittel) ist gleich der Gesamtfläche dividiert durch die Gesamtanzahl Tage.
Natürlich müsste die Tabelle für den Daphnien-Reproduktionstest auf einen Zeitraum von 21 Tagen erweitert werden.
Wenn Beobachtungen nur am Anfang und am Ende eines jeden Erneuerungszeitraums erfolgen, kann natürlich nicht bestätigt werden, ob der Zerfallsprozess tatsächlich exponentiell verläuft. Eine andere Kurve würde zu einer anderen Berechnung für die Fläche führen. Jedoch ist ein exponentieller Zerfallsprozess durchaus plausibel und wahrscheinlich die beste Kurve, die bei Fehlen anderer Informationen zu verwenden ist.
Vorsicht ist allerdings geboten, wenn in der chemischen Analyse am Ende des Erneuerungszeitraums keine Chemikalie gefunden wird. Wenn keine Möglichkeit besteht, abzuschätzen, wie schnell die Chemikalie aus der Lösung verschwunden ist, ist es unmöglich, eine realistische Fläche unter der Kurve zu erhalten, und damit auch unmöglich, ein plausibles zeitgewichtetes Mittel zu bestimmen.
.
| Leitfaden für die Geschlechtsbestimung bei frisch geschlüpften Daphnien | Anlage 7 |
Unter wechselnden Umgebungsbedingungen, wie z.B. Verkürzung der Fotoperiode, Temperaturschwankungen, Verringerung der Futterkonzentration und Erhöhung der Populationsdichte (Hobaek und Larson, 1990; Kleiven et al., 1992), können männliche Nachkommen produziert werden. Die Produktion männlicher Tiere ist auch eine bekannte Reaktion auf Insektenwachstumsregulatoren (Oda et al., 2005). Unter bestimmten Bedingungen, unter denen chemische Stressoren eine Verringerung der reproduktiven Nachkommen von parthenogenetischen Weibchen induzieren, wäre eine erhöhte Anzahl Männchen zu erwarten (OECD, 2008). Auf der Grundlage der vorliegenden Informationen lässt sich nicht vorhersagen, ob der Endpunkt "Geschlechterverhältnis" oder der Endpunkt "Reproduktion" empfindlicher ist; es gibt jedoch Anhaltspunkte dafür (vgl."Validierungsbericht", Teil 1), dass dieser Anstieg der Anzahl männlicher Tiere weniger empfindlich sein könnte als der Rückgang der Nachkommenschaft. Da der wichtigste Zweck der Prüfmethode darin besteht, die Anzahl an produzierten Nachkommen zu bestimmen, stellt das Auftreten männlicher Tiere eine optionale Beobachtung dar. Wird dieser optionale Endpunkt in einer Studie bewertet, sollte ein zusätzliches Testvaliditätskriterium von höchstens 5 % männlichen Tieren in den Kontrollen angewandt werden.
Die praktischste und einfachste Methode zur Geschlechtsbestimmung bei Daphnien besteht in der Nutzung ihrer phänotypischen Merkmale, da männliche und weibliche Tiere genetisch identisch und ihr Geschlecht abhängig von der Umgebung ist. Männliche und weibliche Tiere unterscheiden sich in Länge und Morphologie der ersten Antennen, die bei den Männchen länger sind (Abbildung 1). Dieser Unterschied ist direkt nach dem Schlüpfen erkennbar, während sich andere sekundäre Geschlechtsmerkmale mit dem Heranwachsen ausbilden (z.B. siehe Abbildung 2 in Olmstead und LeBlanc, 2000).
Zur Bestimmung des morphologischen Geschlechts sollten die von jedem Versuchstier produzierten Schlüpflinge per Pipette umgesetzt und in eine Petrischale mit Prüfmedium gelegt werden. Das Medium wird minimal gehalten, um die Bewegung der Tiere einzuschränken. Die ersten Antennen können unter einem Stereomikroskop (x 10-60) beobachtet werden.
Abbildung 1 24 Stunden altes Männchen (links) und Weibchen (rechts) der Art D. magna. Männchen unterscheiden sich in Länge und Morphologie der ersten Antennen von den Weibchen wie in den Kreisen gezeigt (Tatarazako et al., 2004).
Referenzdokumente
Hobaek A and Larson P. 1990. Sex determination in Daphnia magna. Ecology 71: 2255-2268.
Kleiven O.T., Larsson P., Hobaek A. 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197-206.
Oda S., Tatarazako N, Watanabe H., Morita M., and Iguchi T. 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61:1168-1174.
OECD, 2008. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. OECD Series on Testing and Assessment, Number 88. Organisation for Economic Co-operation and Development, Paris.
Olmstead, A.W., LeBlanc, G.A., 2000. Effects of endocrine-active chemicals on the development characteristics of Daphnia magna. Environmental Toxicology and Chemistry 19:2107-2113.
Tatarazako, N., Oda, S., Abe, R., Morita M. and Iguchi T., 2004. Development of a screening method for endocrine disruptors in crustaceans using Daphnia magna (Cladocera, Crustacea). Environmental Science 17, 439-449."
(18) In Teil C erhält Kapitel C.29 Nummer 66 folgende Fassung:
"66. Der Test ist gültig, wenn
- der mittlere Abbauprozentsatz der Referenzchemikalie in den Gefäßen FC am 14. Tag der Inkubation > 60 % ist; und
- die mittlere Menge an TIC in den Blindkontrollen FB am Ende des Tests < 3 mg C/l beträgt.
Werden diese Grenzwerte nicht erreicht, so sollte der Versuch mit einem Inokulum aus einer anderen Quelle wiederholt werden und/oder sollten die angewandten Verfahren überprüft werden. Bereitet z.B. die starke IC-Produktion in den Blindkontrollen Probleme, so ist das unter den Nummern 27 bis 32 beschriebene Verfahren anzuwenden."
(19) In Teil C werden die folgenden Kapitel angefügt:
"C.47 Toxizitätsprüfung an Fischen im frühen Entwicklungsstadium
Einleitung
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie 210 (2013). Mithilfe von Prüfungen an Fischen in frühen Entwicklungsstadien sollen die letalen und subletalen Wirkungen von Chemikalien auf die geprüften Entwicklungsstadien und Tierarten bestimmt werden. Die Prüfungen liefern wertvolle Informationen für die Einschätzung der chronischen letalen und subletalen Wirkungen der Chemikalie auf andere Fischarten.
2. Die Prüfrichtlinie 210 basiert auf einem Vorschlag des Vereinigten Königreichs, der auf einer Tagung von OECD-Experten im November 1988 in Medmenham (Vereinigtes Königreich) erörtert und 2013 entsprechend den Erfahrungen bei der Anwendung der Prüfung sowie entsprechend den Empfehlungen eines OECD-Workshops über Toxizitätstests an Fischen, der im September 2010 stattfand, aktualisiert wurde (1).
Prinzip der Prüfmethode
3. Fische in frühen Entwicklungsstadien werden der in Wasser gelösten Prüfchemikalie in einer Reihe von Konzentrationen ausgesetzt. Eine Belastung im Durchflusssystem wird bevorzugt, doch wenn diese nicht möglich ist, ist auch ein semistatisches System möglich. Nähere Informationen sind dem OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures zu entnehmen (2). Zu Beginn der Prüfung werden die befruchteten Eier in die Prüfkammern gesetzt. Die Dauer der Prüfung hängt bei jeder Tierart davon ab, wie lange die Kontrollfische brauchen, um ein juveniles Entwicklungsstadium zu erreichen. Die letalen und subletalen Wirkungen werden bewertet und mit den Kontrollwerten verglichen, um die LOEC (niedrigste Konzentration mit beobachteter Wirkung) und somit i) die NOEC (Konzentration ohne beobachtete Wirkung) und/oder ii) den ECx-Wert (z.B. EC10, EC20) anhand eines Regressionsmodells zu bestimmen, um zu schätzen, welche Konzentration eine Veränderung der gemessenen Wirkung um x % hervorrufen würde. Die Protokollierung der Konzentrationen und Parameter, bei denen relevante Wirkungen auftreten, hängt vom jeweiligen Rechtsrahmen ab. Die Prüfkonzentrationen sollten die ECx einschließen, damit der ECx-Wert nicht extrapoliert werden muss, sondern durch Interpolation bestimmt werden kann (siehe Definitionen in Anlage 1).
Angaben zur Prüfchemikalie
4. Mit dem Begriff "Prüfchemikalie" wird das bezeichnet, was geprüft wird. Die Wasserlöslichkeit (siehe Kapitel A.6) und der Dampfdruck (siehe Kapitel A.4) der Prüfchemikalie sollten bekannt sein, und ein zuverlässiges Analyseverfahren für die Quantifizierung der Prüfchemikalie in den Prüflösungen mit bekannter und dokumentierter Wiederfindungsrate und Bestimmungsgrenze sollte vorhanden sein. Obwohl dies für die Durchführung der Prüfung nicht notwendig ist, können die Ergebnisse einer Prüfung auf akute Toxizität (siehe Kapitel C.1 oder C.49), die vorzugsweise mit den für diese Prüfung gewählten Spezies durchgeführt wurde, nützliche Informationen liefern.
5. Wenn die Prüfmethode zur Prüfung eines Gemischs angewandt wird, sollte die Zusammensetzung des Gemischs so genau wie möglich charakterisiert werden, z.B. durch Angabe der chemischen Identität, des quantitativen Vorkommens und der stoffspezifischen Eigenschaften der Komponenten (wie oben erwähnt). Bevor die Prüfmethode zur gesetzlich vorgeschriebenen Prüfung eines Gemischs angewendet wird, sollte geprüft werden, ob sie für solche Zwecke geeignete Ergebnisse liefern kann.
6. Zu nützlichen Informationen zählen die Strukturformel, die Reinheit des Stoffs, die Wasserlöslichkeit, die Stabilität in Wasser, die Lichtbeständigkeit, pKa, Pow und die Ergebnisse einer Prüfung auf leichte biologische Abbaubarkeit (z.B. Kapitel C.4 oder C.29).
Validität der Prüfung
7. Eine Prüfung wird als valide betrachtet, wenn folgende Bedingungen erfüllt sind:
- Die Konzentration des gelösten Sauerstoffs sollte während der gesamten Prüfdauer > 60 % des Luftsauerstoff-Sättigungswerts betragen;
- die Wassertemperatur sollte während des Prüfdauer in den verschiedenen Prüfkammern und verschiedenen Zeitpunkten nicht um mehr als ± 1,51 °C schwanken und in den Temperaturbereich liegen, der für die geprüfte Tierart vorgeschrieben ist (Anlage 2);
- die Prüfkonzentrationen müssen analytisch bestimmt werden;
- die Gesamtüberlebensrate der befruchteten Eier und nach dem Schlüpfen in den Kontrollen und, soweit zutreffend, in den Lösungsmittelkontrollen muss mindestens den in Anlage 2 festgesetzten Grenzwerten entsprechen.
8. Wird eine geringfügige Abweichung von den Validitätskriterien beobachtet, sollte geprüft werden, welche Folgen dies für die Zuverlässigkeit der Testdaten hat, und diese Erwägungen sollten in den Bericht aufgenommen werden. Wirkungen auf Überleben, Schlupferfolg oder Wachstum in der Lösungsmittelkontrolle im Vergleich zur Negativkontrolle sollten angegeben und im Hinblick auf die Zuverlässigkeit der Testdaten erörtert werden.
Beschreibung der Methode
Prüfkammern
9. Es können beliebige Gefäße aus Glas, Edelstahl oder einem anderen chemisch inerten Werkstoff verwendet werden. Da Silikon bekanntermaßen stark absorbierend auf lipophile Stoffe wirkt, sollte die Verwendung von Silikonschläuchen in Durchflussstudien sowie von Silikondichtungen in Kontakt mit Wasser z.B. durch den Einsatz von Aquarien aus Monoblockglas auf ein Minimum reduziert werden. Die Gefäße sollten so bemessen sein, dass ein hinreichendes Wachstum in der Kontrolle, die Erhaltung der Konzentration an gelöstem Sauerstoff (z.B. bei kleinen Fischarten wird dies bei 7 l Fassungsvermögen erreicht) und die Einhaltung der Besatzratenkriterien gemäß Nummer 19 gewährleistet sind. Es wird empfohlen, die Prüfkammern nach dem Zufallsprinzip in dem Prüfbereich anzuordnen. Einem randomisierten Blockkonzept, bei dem jede Behandlung in jedem Block vorhanden ist, einem vollständig randomisierten Konzept vorzuziehen. Die Prüfkammern sollten vor unerwünschten Störungen geschützt werden. Das Testsystem sollte vorzugsweise so lange mit den Konzentrationen der Prüfchemikalie konditioniert werden, dass die Aufrechterhaltung stabiler Expositionskonzentrationen nachgewiesen werden kann, bevor Prüforganismen eingesetzt werden.
Auswahl der Tierart
10. Empfohlene Fischarten werden in Tabelle 1 genannt. Dies schließt die Verwendung anderer Arten zwar nicht aus, doch ist das Testsystem unter Umständen anzupassen, um geeignete Prüfbedingungen zu schaffen. In diesem Fall sollten die Gründe für die Auswahl der Tierart und der Methode dokumentiert werden.
Haltung der Zuchtfische
11. Nähere Angaben zur Haltung der Testspezies sind Anlage 3 und den Literaturhinweisen (3) (4) (5) zu entnehmen.
Handhabung von befruchteten Eiern, Embryonen und Larven
12. Befruchtete Eier, Embryonen und Larven können der Prüfchemikalie anfänglich innerhalb des Hauptgefäßes in kleineren Behältern aus Glas oder Edelstahl ausgesetzt werden, die an den Seiten und Enden mit Sieben versehen sind, damit die Prüflösung durch das Gefäß hindurchfließen kann. Einen wirbelfreien Durchfluss durch diese kleinen Gefäße kann man dadurch herbeiführen, dass man diese an einem Arm aufhängt, der das Gefäß auf- und abbewegt, dabei jedoch die Organismen immer mit der Prüflösung bedeckt hält. Befruchtete Eier von Salmoniden können auf Einschüben oder Gittern gehältert werden, deren Öffnungen groß genug sind, dass die Larven nach dem Schlüpfen hindurchfallen können.
13. Werden Eierbehälter, Gitter oder Siebe verwendet, um die Eier innerhalb des Hauptprüfgefäßes zu halten, sollten diese Rückhaltevorrichtungen nach dem Schlüpfen der Larven entfernt werden (siehe Leitlinie in Anlage 3); Siebe sollten nur bleiben, um die Larven an der Flucht zu hindern. Müssen die Larven umgesetzt werden, sollten sie nicht der Luft ausgesetzt werden, und es sollten keine Netze verwendet werden, um Fische aus Eierbehältern zu entnehmen. Der Zeitpunkt für diese Umsetzung ist von Art zu Art unterschiedlich und sollte im Bericht dokumentiert werden. Ein Umsetzen ist auch nicht immer erforderlich.
Wasser
14. Als Testwasser kann jedes beliebige Wasser verwendet werden, in dem die zu prüfende Art über einen längeren Zeitraum überleben und wachsen kann (siehe Anlage 4). Während der gesamten Prüfdauer sollte eine konstante Wasserqualität gewährleistet sein. Um sicherzustellen, dass das Verdünnungswasser das Prüfergebnis nicht übermäßig beeinflusst (beispielsweise durch Komplexierung der Prüfchemikalie) oder sich nachteilig auf die Leistung des Zuchtbestands auswirkt, sollten in Abständen Proben zur Analyse entnommen werden. Bei Verdünnungswasser von bekanntermaßen relativ stabiler Qualität sollten beispielsweise halbjährlich der Gehalt an Schwermetallen (z.B. Cu, Pb, Zn, Hg, Cd und Ni), größeren Anionen und Kationen (z.B. Ca2+, Mg2+, Na+, K+, Cl-, SO42-), Ammoniak, der Gesamtgehalt an chlorierten Pestiziden, der gesamte organische Kohlenstoff (TOC) und der Schwebstoffgehalt bestimmt werden. Ist bekannt, dass die Wasserqualität schwankt, müssen die Messungen häufiger durchgeführt werden; wie häufig hängt davon ab, wie stark die Qualität schwankt. Einige chemische Merkmale eines akzeptablen Wassers sind in Anlage 4 angegeben.
Prüflösungen
15. Bei Durchflussprüfungen ist ein System erforderlich, das eine Stammlösung der Prüfchemikalie kontinuierlich abgibt und verdünnt (z.B. Dosierpumpe, Proportionalverdünnungsvorrichtung, Sättigersystem), um den Prüfkammern eine Reihe von Konzentrationen zuzuführen. Die Durchsatzraten der Stammlösung und des Wassers sollten während der Prüfung in Abständen überprüft werden und während der gesamten Prüfung um nicht mehr als 10 % schwanken. Eine Durchsatzrate, die zumindest dem fünffachen Kammervolumen in 24 Stunden entspricht, hat sich als geeignet erwiesen (3). Wenn jedoch die unter Nummer 19 angegebene Besatzrate eingehalten wird, ist eine geringere Durchsatzrate von z.B. 2 bis 3 Prüfkammervolumina möglich, um ein schnelles Entfernen des Futters zu verhindern.
16. Die Prüflösungen werden durch Verdünnung einer Stammlösung auf die gewünschten Konzentrationen eingestellt. Die Stammlösung sollte vorzugsweise durch einfaches Mischen oder Einrühren der Prüfchemikalie in das Verdünnungswasser mit mechanischen Mitteln (z.B. Rührwerk und/oder Ultraschall) hergestellt werden. Zur Herstellung einer Stammlösung in geeigneter Konzentration können Sättigungssäulen (Löslichkeitssäulen) oder passive Dosierungsmethoden (6) verwendet werden. Die Verwendung von Lösungsmitteln wird nicht empfohlen. Ist jedoch ein Lösungsmittel erforderlich, so sollte parallel eine Lösungsmittelkontrolle mit derselben Konzentration wie bei der Prüfchemikalie geprüft werden, d. h. das Lösungsmittelniveau sollte bei allen Konzentrationen und in der Lösungsmittelkontrolle gleich sein. Bei einigen Verdünnungssystemen kann dies technisch schwierig sein; hier sollte die Lösungsmittelkonzentration in der Lösungsmittelkontrolle der höchsten Lösungsmittelkonzentration in der Behandlungsgruppe entsprechen. Bei schwierig zu prüfenden Stoffen sollte das OECD Guidance Document No. 23 on aquatic toxicity testing of difficult substances and mixtures herangezogen werden (2). Falls ein Lösungsmittel verwendet wird, hängt die Wahl von den chemischen Eigenschaften des Stoffs ab. Im OECD Guidance Document No. 23 wird eine Höchstkonzentration von 100 µl/l empfohlen. Um eine potenzielle Wirkung des LÆsungsmittels auf die gemessenen Endpunkte zu vermeiden (7), empfiehlt es sich, die Lösungsmittelkonzentration so gering wie möglich zu halten.
17. Bei einer semistatischen Prüfung können zwei verschiedene Verfahren zur Erneuerung des Prüfmediums eingesetzt werden. Entweder werden neue Prüflösungen in sauberen Gefäßen hergestellt und überlebende Eier und Larven vorsichtig in die neuen Behälter umgesetzt oder die Prüforganismen bleiben in den Prüfgefäßen, während ein Teil (mindestens zwei Drittel) der Prüflösung bzw. des Kontrollvolumens ausgetauscht wird.
Durchführung des Tests
Expositionsbedingungen
Dauer
18. Die Prüfung sollte sobald wie möglich nach der Befruchtung der Eier beginnen. Die befruchteten Eier sollten vorzugsweise vor Beginn des Blastula Stadium oder sobald wie möglich danach in die Prüflösung eingetaucht werden. Die Dauer der Prüfung ist von der verwendeten Tierart abhängig. Einige Empfehlungen sind Anlage 2 zu entnehmen.
Besatz
19. Die Anzahl an befruchteten Eiern bei Beginn der Prüfung sollte zur Erfüllung von statistischen Anforderungen hinreichend groß sein. Die Eier sollten nach dem Zufallsprinzip auf die Behandlungen verteilt werden, und je Konzentration sollten mindestens 80 befruchtete Eier, zu gleichen Teilen auf mindestens vier parallele Prüfkammern aufgeteilt, verwendet werden. Die Besatzrate (Biomasse je Volumen an Prüflösung) sollte gering genug sein, dass während des Ei- und Larvenstadiums eine Konzentration an gelöstem Sauerstoff von mindestens 60 % des Luftsauerstoff-Sättigungswerts ohne Belüftung aufrechterhalten werden kann. Bei Durchflussprüfungen wurde eine Besatzrate von nicht mehr als 0,5 g/l Nassgewicht je 24 Stunden und nicht mehr als 5 g/l Lösung zu jeder Zeit empfohlen (3).
Licht und Temperatur
20. Fotoperiode und Wassertemperatur sind der geprüften Fischart anzupassen (siehe Anlage 2).
Fütterung
21. Futter und Fütterung sind von entscheidender Bedeutung. Wichtig ist, dass das für jedes Entwicklungsstadium geeignete Futter ab dem richtigen Zeitpunkt und in ausreichender Menge zur Unterstützung eines normalen Wachstums bereitgestellt wird. Die Fütterung sollte bei allen Replikaten ungefähr gleich sein, außer wenn es zur Berücksichtigung der Mortalität angepasst wird. Überschüssiges Futter und Exkremente sollten gegebenenfalls entfernt werden, um eine Anreicherung von Abfällen zu vermeiden. Ausführliche Fütterungspläne sind Anlage 3 zu entnehmen. Doch mit zunehmender Erfahrung sollten Futter und Fütterungspläne zur Optimierung von Überlebensrate und Wachstum kontinuierlich verfeinert werden. Lebendfutter sorgt für eine bessere Ausgestaltung des Lebensumfelds und sollte daher anstelle von oder zusätzlich zu Trockenfutter oder gefrorenem Futter verwendet werden, wenn es für die betreffende Fischart und das jeweilige Entwicklungsstadium geeignet ist.
Prüfkonzentrationen
22. Normalerweise werden fünf Konzentrationen der Prüfchemikalie mit mindestens vier Replikaten pro Konzentration und einem konstanten Abstandsfaktor von maximal 3,2 benötigt. Falls Daten über die akute Toxizität vorliegen, die vorzugsweise an derselben Fischart und/oder durch einen Dosisfindungstest ermittelt wurden, sollten sie bei der Wahl des Bereichs an Prüfkonzentrationen berücksichtigt werden (1). Jedoch sollten bei der Wahl des Bereichs an Prüfkonzentrationen alle Informationsquellen berücksichtigt werden, einschließlich Quellen wie z.B. read across, Daten zur akuten Toxizität bei Fischembryonen. Sollen lediglich empirische NOEC-Werte bestimmt werden, kann ein Limit-Test oder ein erweiterter Limit-Test mit weniger als fünf Konzentrationen als endgültiger Test akzeptabel sein. Die Verwendung von weniger als fünf Konzentrationen muss begründet werden. Höhere Konzentrationen der Prüfchemikalie als die LC50 über 96 Stunden oder 10 mg/l, je nachdem, welche Konzentration niedriger ist, müssen nicht geprüft werden.
Kontrollen
23. Zusätzlich zur Reihe der Prüfchemikalienkonzentrationen sollten eine Verdünnungswasserkontrolle und gegebenenfalls eine Lösungsmittelkontrolle, die nur den Lösungsmittelträger enthält, durchgeführt werden (siehe Nummer 16).
Häufigkeit von Analysen und Messungen
24. Vor Beginn der Exposition ist sicherzustellen, dass das System zur Verteilung der Chemikalie auf alle Replikate einwandfrei funktioniert (z.B. durch Messung der Prüfkonzentrationen). Die erforderlichen Analysemethoden, einschließlich einer geeigneten Bestimmungsgrenze, sollten festgelegt werden, und die Stabilität der Chemikalie im Prüfsystem muss hinreichend bekannt sein. Zur Beschreibung der Exposition sind die Konzentrationen der Prüfchemikalie während der Prüfung in regelmäßigen Zeitabständen zu bestimmen. Mindestens fünf Bestimmungen sind notwendig. In Durchflusssystemen sollte die Prüfchemikalie mindestens einmal pro Woche in einem Replikat pro Konzentration analysiert werden, wobei systematisch zwischen den Replikaten abzuwechseln ist. Durch zusätzliche Analysen lässt sich die Qualität des Prüfergebnisses häufig verbessern. Es kann erforderlich sein, die Proben zu filtrieren (z.B. mit einer Porengröße von 0,45 µm) oder zu zentrifugieren, um Partikel zu entfernen und sicherzustellen, dass die Bestimmungen an der Prüfchemikalie in echter Lösung vorgenommen werden. Um die Adsorption der Prüfchemikalie zu verringern, sollten die Filter vor der Verwendung gesättigt werden. Werden die gemessenen Konzentrationen nicht innerhalb von 80 bis 120 % der Nominalkonzentration gehalten, so sollten die Konzentrationen, die Wirkungen hervorrufen, bestimmt und im Fall von Durchflussprüfungen im Verhältnis zum arithmetischen Mittel der Konzentration (zur Berechnung des arithmetischen Mittels siehe Anlage 6 der Prüfmethode C.20 (8)) und im Fall von semistatischen Prüfungen im Verhältnis zum geometrischen Mittel der gemessenen Konzentrationen ausgedrückt werden (siehe Kapitel 5 im OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures (2)).
25. Während der Prüfung sind in allen Prüfgefäßen der gelöste Sauerstoff, der pH-Wert und die Temperatur mindestens wöchentlich sowie der Salzgehalt und die Härte, falls relevant, am Anfang und Ende der Prüfung zu messen. Es wird empfohlen, dass die Temperatur in mindestens einem Prüfgefäß kontinuierlich überwacht wird.
Beobachtungen
26. Stadium der Embryonalentwicklung: Das Embryonalstadium zu Beginn der Exposition gegenüber der Prüfchemikalie sollte so genau wie möglich überprüft werden. Dies kann mithilfe einer repräsentativen Probe von Eiern erfolgen, die in geeigneter Form aufbewahrt und gereinigt wurden.
27. Schlüpfen und Überleben: Beobachtungen zum Schlüpfen und Überleben sollten zumindest einmal pro Tag erfolgen, und die jeweiligen Zahlen sollten protokolliert werden. Ist in einem frühen Stadium der Embryonalentwicklung Schimmelbefall bei Eiern zu beobachten (z.B. an Tag 1 oder 2 der Prüfung), sollten diese Eier gezählt und entfernt werden. Tote Embryonen, Larven und Jungfische sollten sofort nach Feststellung entfernt werden, da sie sich rasch zersetzen und durch die anderen Fische zerlegt werden können. Bei der Entfernung ist äußerste Sorgfalt angezeigt, um benachbarte Eier/Larven nicht körperlich zu beschädigen. Je nach Fischart und Entwicklungsstadium gelten unterschiedliche Kriterien zur Bestimmung des Todes:
- bei befruchteten Eiern: insbesondere in den frühen Stadien ein deutlich erkennbarer Verlust an Lichtdurchlässigkeit und eine Veränderung der Färbung, hervorgerufen durch Gerinnung und/oder Ausfällung von Eiweiß, was zu einem weiß-opaken Aussehen führt;
- bei Embryonen, Larven und Jungfischen: fehlende Körperbewegung und/oder fehlende Atembewegung und/oder fehlender Herzschlag und/oder fehlende Reaktion auf mechanische Reize.
28. Abnormes Aussehen: Die Anzahl der Larven oder Jungfische, die eine abnorme Körperform aufweisen, sollte in angemessenen Abständen in Abhängigkeit von der Dauer der Prüfung und der Art der beschriebenen Abnormität protokolliert werden. Zu beachten ist, dass abnorme Larven und Jungfische auch von Natur aus auftreten und bei einigen Arten in der Größenordnung von mehreren Prozent bei den Kontrollen liegen können. Bei so schwerwiegenden Fehlbildungen mit den entsprechenden abnormen Verhaltensweisen, dass der Organismus erheblich leidet und keine Erholung mehr eintritt, kann dieser aus der Prüfung entfernt werden. Solche Tiere sollten getötet und bei der anschließenden Datenanalyse als Sterbefälle behandelt werden. Bei den meisten in dieser Prüfmethode empfohlenen Arten wurde eine normale Embryonalentwicklung dokumentiert (9) (10) (11) (12).
29. Abnormes Verhalten: Abnormitäten, z.B. Hyperventilation, unkoordiniertes Schwimmen, atypische Ruhe und atypisches Fressverhalten, sollten in angemessenen Abständen in Abhängigkeit von der Dauer der Prüfung protokolliert werden (z.B. einmal täglich bei Warmwasserarten). Diese Auswirkungen lassen sich zwar nur schwer quantifizieren, können aber bei der Interpretation von Mortalitätsdaten helfen.
30. Gewicht: Am Ende des Tests werden alle überlebenden Fische mindestens auf Replikatbasis gewogen (wobei die Anzahl der Tiere im Replikat und das mittlere Gewicht pro Tier angegeben wird): das Nassgewicht (trocken getupft) wird bevorzugt, jedoch kann auch das Trockengewicht angegeben werden (13).
31. Länge: Am Ende des Tests wird die Länge der einzelnen Fische gemessen. Empfohlen wird die Messung der Gesamtlänge; kommt es jedoch zu Schwanzflossenfäule oder Flossenerosion, kann die Standardlänge herangezogen werden. Bei allen Fischen in einem bestimmten Test sollte dieselbe Methode angewandt werden. Die Fische können z.B. entweder mit einem Messschieber, einer Digitalkamera oder einem geeichten Okularmikrometer gemessen werden. Die typischen Mindestlängen sind in Anlage 2 festgelegt.
Daten und Berichterstattung
Auswertung der Ergebnisse
32. Der Versuchsplan und die gewählte Statistikmethode sollten eine ausreichende statistische Aussagekraft (mindestens 80 %) besitzen, damit Änderungen von biologischer Bedeutung bei den Endpunkten erkannt werden können, für die eine NOEC anzugeben ist. Die Angabe der Konzentrationen und Parameter, bei denen relevante Wirkungen auftreten, kann vom jeweiligen Rechtsrahmen abhängen. Ist eine ECx anzugeben, sollten der Versuchsaufbau und das gewählte Regressionsmodell es erlauben, die ECx so zu schätzen, dass i) das für die ECx angegebene 95 %-Konfidenzintervall keine Null enthält und nicht übermäßig breit ist, ii) das 95 %-Konfidenzintervall für den vorhergesagten Mittelwert bei der ECx nicht den Mittelwert der Kontrolle enthält, und iii) das Regressionsmodell keinen signifikanten Lack-of-Fit gegenüber den Daten aufweist. Bei beiden Ansätzen muss die prozentuale Änderung bei jedem Endpunkt festgestellt werden, der nachgewiesen oder geschätzt werden muss. Der Versuchsaufbau sollte entsprechend angepasst werden. Wenn die obigen Bedingungen für die Bestimmung der ECx nicht erfüllt sind, sollte der NOEC-Ansatz angewandt werden. Da es unwahrscheinlich ist, dass derselbe Prozentsatz bei allen Endpunkten zutrifft oder dass ein durchführbarer Versuch geplant werden kann, der diese Kriterien bei allen Endpunkten erfüllt, sollte man sich bei der Versuchsplanung auf die Endpunkte konzentrieren, die für den jeweiligen Versuch von Bedeutung sind. Die Flussdiagramme und Leitlinien für die statistische Vorgehensweise bei jedem Ansatz sind den Anlagen 5 und 6 zu entnehmen und können bei der Auswertung der Daten und bei der Wahl der am besten geeigneten statistischen Methode oder des zu verwendenden Modells als Leitlinie herangezogen werden. Es können andere statistische Ansätze angewandt werden, sofern sie wissenschaftlich begründet sind.
33. Streuungen innerhalb jeder Reihe von Replikaten müssen durch Varianzanalyse oder Kontingenztabellenverfahren analysiert werden, und es müssen geeignete statistische Analysemethoden basierend auf dieser Analyse angewandt werden. Für einen Mehrfachvergleich zwischen den Ergebnissen bei den einzelnen Konzentrationen und den Ergebnissen der Kontrollen werden der Jonckheere-Terpstra-Test (Step-Down) oder der Williams-Test bei kontinuierlichen Wirkungen und der Cochran-Armitage-Test (Step-Down) bei quantalen Wirkungen, die einer monotonen Konzentrations-Wirkungs-Beziehung entsprechen und keine Hinweise auf eine extrabinomiale Varianz zeigen, empfohlen (14). Sind Hinweise auf eine extrabinomiale Varianz vorhanden, wird die Rao-Scott-Abwandlung des Cochran-Armitage-Tests (15) (16) oder der Williams- oder Dunnett-Test (nach einer Arkussinus-Quadratwurzeltransformation) oder der auf Replikatanteile angewandte Jonckheere-Terpstra-Test empfohlen. Entsprechen die Daten keiner monotonen Konzentrations-Wirkungs-Beziehung, können die Dunnett- oder Dunn- oder Mann-Whitney-Methode bei kontinuierlichen Wirkungen und der exakte Test nach Fisher bei quantalen Wirkungen hilfreich sein (14) (17) (18). Bei der Anwendung jeder statistischen Methode oder jedes statistischen Modells muss darauf geachtet werden, dass die Anforderungen der Methode bzw. des Modells erfüllt werden (z.B. Schätzung der Variabilität von Kammer zu Kammer und Berücksichtigung bei der Versuchsplanung oder dem verwendeten Modell). Die Normalität der Daten ist zu bewerten. In Anlage 5 wird angegeben, wie die Residuen einer ANOVA zu behandeln sind. Anlage 6 enthält zusätzliche Erwägungen zum Regressionsansatz. Zur Einhaltung der Anforderungen eines statistischen Tests sollten Transformationen in Betracht gezogen werden. Jedoch erfordern Transformationen, die die Anpassung eines Regressionsmodells ermöglichen, große Sorgfalt, da beispielsweise eine 25 %ige Änderung bei der nicht transformierten Wirkung nicht einer 25 %igen Änderung bei einer transformierten Wirkung entspricht. In allen Analysen bildet die Prüfkammer und nicht der einzelne Fisch die Analyse- und Versuchseinheit, und sowohl die Hypothesentests als auch die Regression sollten dies widerspiegeln (3) (14) (19) (20).
Prüfbericht
34. Der Prüfbericht sollte folgende Angaben enthalten:
Prüfchemikalie:
Einkomponentiger Stoff:
- physikalisches Erscheinungsbild, Wasserlöslichkeit und weitere relevante physikalisch-chemische Eigenschaften
- chemische Bezeichnung, wie z.B. IUPAC- oder CAS-Bezeichnung, CAS-Nummer , SMILES- oder InChI-Code, Strukturformel, Reinheit, chemische Zusammensetzung von Verunreinigungen, soweit zutreffend und praktisch durchführbar usw. (einschließlich des Gehalts an organischem Kohlenstoff, falls zutreffend)
Mehrkomponentiger Stoff, UVCB-Stoffe und Gemische:
- so weit wie möglich charakterisiert durch die chemische Zusammensetzung (siehe oben), das quantitative Vorkommen und die relevanten physikalisch-chemischen Eigenschaften der einzelnen Komponenten
Geprüfte Fischart:
- wissenschaftliche Bezeichnung, Stamm, Herkunft und Art der Sammlung der befruchteten Eier sowie anschließende Handhabung
Prüfbedingungen:
- angewandtes Prüfverfahren (z.B. semistatisches oder Durchflussverfahren, Besatz);
- Fotoperiode(n);
- Testdesign (z.B. Anzahl der Prüfkammern und Replikate, Anzahl an Eiern je Replikat, Material und Größe der Prüfkammer (Höhe, Breite, Volumen), Wasservolumen pro Prüfkammer;
- Methode zur Herstellung von Stammlösung und Häufigkeit der Erneuerung (falls verwendet, sind der Lösungsvermittler und seine Konzentration anzugeben);
- Methode zur Dosierung der Prüfchemikalie (z.B. Pumpen, Verdünnungssysteme);
- Wiederfindungsrate der Methode und nominelle Prüfkonzentrationen, Bestimmungsgrenze, Mittel der gemessenen Werte mit ihren Standardabweichungen in den Prüfgefäßen sowie das Verfahren, durch das diese ermittelt wurden, sowie Nachweise dafür, dass sich die Messungen auf die Konzentrationen der Prüfchemikalie in echter Lösung beziehen;
- Eigenschaften des Verdünnungswassers: pH-Wert, Härte, Temperatur, Konzentration des gelösten Sauerstoffs, Restchlor (falls gemessen), gesamter organischer Kohlenstoff (falls gemessen), Schwebstoffe (falls gemessen), Salzgehalt des Prüfmediums (falls gemessen) sowie alle sonstigen durchgeführten Messungen;
- Wasserqualität innerhalb der Prüfgefäße: pH-Wert, Härte, Temperatur und Konzentration des gelösten Sauerstoffs;
- ausführliche Angaben zur Fütterung (z.B. Art des Futters, Herkunft, Fütterungsmenge und -häufigkeit).
Ergebnisse, einzeln (oder auf Replikatbasis) sowie als Mittelwert und gegebenenfalls Variationskoeffizient für die folgenden Endpunkte angegeben:
- Nachweis, dass die Kontrollen den allgemeinen Standard bezüglich der Annehmbarkeit der Überlebensraten für die geprüfte Art erfüllen (Anlage 2);
- Daten zur Mortalität in jedem Stadium (Embryo, Larve und Jungfisch) sowie Gesamtmortalität;
- Tage bis zum Schlüpfen, Anzahl der täglich geschlüpften Larven und Ende des Schlüpfens;
- Anzahl der gesunden Fische am Ende der Prüfung;
- Angaben zur Länge (entweder Standard- oder Gesamtlänge angeben) und zum Gewicht der überlebenden Tiere;
- Vorkommen, Beschreibung und Anzahl morphologischer Abnormitäten, soweit zutreffend;
- Vorkommen, Beschreibung und Anzahl von Auswirkungen auf das Verhalten, soweit zutreffend;
- Ansatz der statistischen Analyse (Regressionsanalyse oder Varianzanalyse) und Auswertung der Daten (angewandter statistischer Test oder angewandtes Modell);
- NOEC (No Observed Effect Concentration) für jede bewertete Wirkung;
- LOEC (Lowest Observed Effect Concentration) (bei p = 0,05) für jede bewertete Wirkung;
- ECx für jede bewertete Wirkung, falls zutreffend, und Konfidenzintervalle (z.B. 90 % oder 95 %) und ein Diagramm des angepassten Modells, das für deren Berechnung benutzt wurde, die Steigung der Konzentrations-Wirkungs-Kurve, die Formel des Regressionsmodells, die geschätzten Modellparameter und deren Standardfehler.
Eine eventuelle Abweichung von der Prüfmethode.
Erörterungen der Ergebnisse, einschließlich etwaiger Einflüsse von Abweichungen von der Prüfmethode auf das Ergebnis der Prüfung.
Tabelle 1 Für die Prüfung empfohlene Fischarten
| SÜSSWASSER | FLUSSMÜNDUNGS- und SALZWASSER |
| Oncorhynchus mykiss Regenbogenforelle | Cyprinodon variegatus Edelsteinkärpfling |
| Pimephales promelas Dickkopfelritze | Menidia sp. Silverside |
| Danio rerio Zebrabärbling | |
| Oryzias latipes Japanischer Reiskärpfling Medaka |
Literaturhinweise
(1) OECD (2012), Fish Toxicity Testing Framework, Environmental Health and Safety Publications Series on Testing and Assessment No. 171, OECD, Paris.
(2) OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environmental Health and Safety Publications, Series on Testing and Assessment. No. 23, OECD Paris.
(3) ASTM (1988), Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials, E 1241-88. 26 ff.
(4) Brauhn, J.L. und R.A. Schoettger (1975), Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel catfish and Bluegills, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota.
(5) Brungs, W.A. und B.R. Jones (1977), Temperature Criteria for Freshwater Fish: Protocol and Procedures, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
(6) Adolfsson-Erici, et al. (2012), A flow-through passive dosing system for continuously supplying aqueous solutions of hydrophobic chemicals to bioconcentration and aquatic toxicity tests, Chemosphere 86, 593-599.
(7) Hutchinson, T.H. et al. (2006), Acute and chronic effects of carrier solvents in aquatic organisms: A critical review, Aquatic Toxicology, 76, 69-92.
(8) Kapitel C.20, Daphnia magna-Reproduktionstest.
(9) Hansen, D.J. und P.R. Parrish (1977), Suitability of sheepshead minnows (Cyprindon variegatus) for life-cycle toxicity tests, In Aquatic Toxicology and Hazard Evaluation (edited by F.L. Mayer and J.L. Hamelink), ASTM STP 634.
(10) Kimmel, H. B. et al. (1995), Stages of embryonic development of the zebrafish. Developmental Dynamics, 203:253-310.
(11) Gonzalez-Doncel, M. et al. (2005), A quick reference guide to the normal development of Oryzias latipes (Teleostei, Adrinichthydae) Journal of Applied Ichthyology, 20:1-14.
(12) Devlin, E.W. et al. (1996), Prehatching Development of the Fathead Minnow, Pimephales promelas Rafinesque. EPA/600/R-96/079. USEPA, Office of Research and Development, Washington, D.C.
(13) Oris, J.T., S.C. Belanger und A.J. Bailer, (2012), Baseline characteristics and statistical implications for the OECD 210 Fish Early Life Stage Chronic Toxicity Test, Environmental Toxicology and Chemistry 31; 2, 370-376.
(14) OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application, Environmental Health and Safety Publications Series on Testing and Assessment No. 54, OECD, Paris.
(15) Rao, J.N.K. und A.J. Scott (1992), A simple method for the analysis of clustered binary data, Biometrics 48, 577-585.
(16) Rao, J.N.K. und A.J. Scott (1999), A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385.
(17) Dunnett C.W. (1955), A multiple comparisons procedure for comparing several treatments with a control, Journal of American Statistical Association, 50, 1096-1121.
(18) Dunnett C.W. (1964), New tables for multiple comparisons with a control. Biometrics, 20, 482-491.
(19) Rand, G.M. und S.R. Petrocelli (1985), Fundamentals of Aquatic Toxicology. Hemisphere Publication Corporation, New York.
(20) McClave, J.T., J.H. Sullivan und J.G. Pearson (1980). Statistical Analysis of Fish Chronic Toxicity Test Data, Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
.
| Anlage 1 |
Definitionen
Chemikalie: Stoff oder Gemisch.
ECx: (Konzentration mit einer Wirkung von x %) die Konzentration, die innerhalb einer gegebenen Expositionsdauer im Vergleich zur Kontrolle eine Wirkung von x % auf die Prüforganismen kommt. Eine EC50 beispielsweise ist die Konzentration, bei der davon ausgegangen wird, dass sie bei 50 % einer exponierten Population während einer bestimmten Expositionsdauer eine Wirkung auf einen Endpunkt im Test hat.
Gabellänge: die Länge von der Spitze des Fischmauls bis zum Ende der mittleren Schwanzflossenstrahlen; wird bei Fischen verwendet, bei denen das Ende der Wirbelsäule schwer zu bestimmen ist (www.fishbase.org)
Gesamtlänge: die Länge von der Spitze des Fischmauls bis zur Spitze des längeren Lappens der Schwanzflosse; wird gewöhnlich mit entlang der Mittellinie zusammengehaltenen Lappen gemessen. Es wird in gerader Linie gemessen, nicht entlang der Körperkrümmung. (www.fishbase.org)
Abbildung 1 Beschreibung der verschiedenen verwendeten Längen
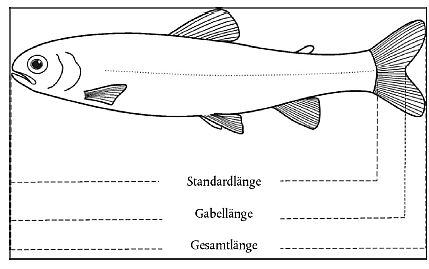
IUPAC: International Union of Pure and Applied Chemistry.
Lowest observed effect concentration (LOEC): die niedrigste geprüfte Konzentration einer Prüfchemikalie, bei der sich im Vergleich zur Kontrolle eine signifikante Wirkung beobachten lässt (bei p < 0,05). Alle Prüfkonzentrationen oberhalb der LOEC müssen jedoch eine schädigende Wirkung haben, die den bei der LOEC beobachteten Wirkungen entspricht oder größer ist. Können diese beiden Bedingungen nicht erfüllt werden, muss ausführlich erklärt werden, wie die LOEC (und damit auch die NOEC) ausgewählt wurde. Weitere Hinweise sind den Anlagen 5 und 6 zu entnehmen.
No observed effect concentration (NOEC): die Prüfkonzentration unmittelbar unterhalb der LOEC, die im Vergleich zur Kontrolle innerhalb eines angegebenen Expositionszeitraums keine statistisch signifikante Wirkung (p < 0,05) hat.
Prüfchemikalie: Stoff oder Gemisch, der bzw. das nach dieser Prüfmethode getestet wird.
SMILES: Simplified Molecular Input Line Entry Specification.
Standardlänge: die Länge eines Fisches, gemessen von der Spitze des Fischmauls bis zum hinteren Ende des letzten Wirbels oder bis zum hinteren Ende des mittellateralen Teils der Hypuralplatte. Einfach ausgedrückt, wird bei diesem Maß die Schwanzflosse nicht mitgemessen (www.fishbase.org)
UVCB-Stoffe: Stoffe mit unbekannter oder schwankender Zusammensetzung, komplexe Reaktionsprodukte oder biologische Materialien.
.
| Prüfbedingungen, Dauer und Überlebenskriterien für empfohlene Fischarten | Anlage 2 |
| FISCHART | PRÜFBEDINGUNGEN | EMPFOH- LENE TESTPRÜF- DAUER | Typische mittlere Mindestgesamtlänge der Kontrollfische am Ende der Prüfung (mm) 1 | ÜBERLEBENS- RATE IN DER KONTROLLE (Minimum) | |||
| Temperatur °C) | Salzgehalt (0/00) | Fotoperiode (Std.) | Schlupf- erfolg | Nach dem Schlüpfen | |||
| Süßwasser | |||||||
| Oncorhynchus mykiss Regenbogenforelle | 10 ± 1,5 2 | 12 - 16 3 | 2 Wochen nach freiem Fressen der Kontrollfische (oder 60 Tage nach Schlüpfen) | 40 | 75 % | 75 % | |
| Pimephales promelas Dickkopfelritze Fathead minnow | 25 ± 1,5 | 16 | 32 Tage ab Beginn des Tests (oder 28 Tage nach dem Schlüpfen) | 18 | 70 % | 75 % | |
| Danio rerio Zebrabärbling | 26 ± 1,5 | 12 - 16 4 | 30 Tage nach dem Schlüpfen | 11 | 70 % | 75 % | |
| Oryzias latipes Japanischer Reiskärpfling Medaka | 25 ± 2 | 12 - 16 4 | 30 Tage nach dem Schlüpfen | 17 | 80 % | 80 % | |
| Flussmündungswasser und Salzwasser | |||||||
| Cyprinodon variegatus Edelsteinkärpfling Sheepshead minnow | 25 ± 1,5 | 15-35 5 | 12 - 16 4 | 32 Tage ab Beginn des Tests (oder 28 Tage nach dem Schlüpfen) | 17 | 75 % | 80 % |
| Menidia sp. | 22 - 25 | 15-35 5 | 13 | 28 Tage | 20 | 80 % | 60 % |
| Legende:
1) Die typische mittlere Mindestgesamtlänge ist zwar kein Validitätskriterium, jedoch sollten Abweichungen unterhalb des angegeben Werts sorgfältig im Hinblick auf die Empfindlichkeit der Prüfung untersucht werden. Die mittlere Mindestgesamtlänge wird von einer Auswahl der zum gegenwärtigen Zeitpunkt vorliegenden Daten abgeleitet. 2) Der jeweils geprüfte Regenbogenforellenstamm muss möglicherweise bei anderen Temperaturen gehalten werden. Der Zuchtbestand muss bei derselben Temperatur gehalten werden wie die Eier. Nach Erhalt der Eier von einem kommerziellen Züchter ist nach dem Eintreffen eine kurze Anpassung (z.B. 1-2 Stunden) an die Prüftemperatur notwendig. 3) Dunkelheit für Larven bis eine Woche nach dem Schlüpfen, außer wenn sie überprüft werden, dann gedämpfte Beleuchtung während der gesamten Prüfung (12-16 Stunden Fotoperiode) (4). 4) Bei gegebenen Prüfbedingungen sollten die Lichtverhältnisse konstant sein. 5) Darf bei keiner Prüfung um mehr als ± 2 0/00 schwanken. | |||||||
.
| Leitlinie zur Fütterung und Handhabung von Zucht- und Prüftieren der empfohlenen Arten | Anlage 3 |
| FISCHART | FUTTER * | UMSETZZEIT- PUNKT NACH DEM SCHLÜPFEN | ZEIT BIS ZUR ERSTEN FÜTTERUNG | |||
| Zuchtfische | Frisch geschlüpfte Larven | Jungfische | ||||
| Typ | Häufigkeit | |||||
| Süßwasser: | ||||||
| Oncorhynchus mykiss Regenbogenforelle | Forellenfutter | kein Futter a | Startfutter für Regenbogenforellen, BSN | 2-4 Fütterungen pro Tag | 14-16 Tage nach dem Schlüpfen oder beim Aufschwimmen (fakultativ) | 19 Tage nach dem Schlüpfen oder beim Aufschwimmen |
| Pimephales promelas Dickkopfelritze | BSN, Flockenfutter, FBS | BSN | BSN48, Flockenfutter | 2-3-mal täglich | bei Schlupfrate von 90 % | 2 Tage nach dem Schlüpfen |
| Danio rerio Zebrabärbling | BSN, Flockenfutter | Handelsübliches Larvenfutter, Protozoa b, Protein c | BSN48, Flockenfutter, | BSN einmal täglich; Flockenfutter 2-mal täglich | bei Schlupfrate von 90 % | 2 Tage nach dem Schlüpfen |
| Oryzias latipes Japanischer Reiskärpfling | Flockenfutter | BSN, Flockenfutter (oder Protozoa oder Rädertierchen) | BSN48, Flockenfutter (oder Rädertierchen) | BSN einmal täglich; Flockenfutter 2-mal täglich oder Flockenfutter und Rädertierchen einmal täglich | nicht zutreffend | 6-7 Tage nach dem Laichen |
| Flussmündungs- und Salzwasser: | ||||||
| Cyprinodon variegatus Edelsteinkärpfling | BSN, Flockenfutter, FBS | BSN | BSN48 | 2-3 Fütterungen pro Tag | nicht zutreffend | 1 Tag nach dem Schlüpfen/Aufschwimmen |
| Menidia sp. Gezeiten-Ährenfisch | BSN48, Flockenfutter | BSN | BSN48 | 2-3 Fütterungen pro Tag | nicht zutreffend | 1 Tag nach dem Schlüpfen/Aufschwimmen |
| Legende:
*) Futter sollte bis zur Sättigung gegeben werden. Überschüssiges Futter und Exkremente sollten erforderlichenfalls entfernt werden, um eine Ansammlung von Abfällen zu vermeiden. FBS Frozen Brine Shrimps (gefrorene Artemia), adulte Artemia sp BSN Brine Shrimp Nauplii (Artemianauplien), frisch geschlüpft BSN48 Brine Shrimp Nauplii (Artemianauplien), 48 Stunden alt a) Larven mit Dottersack benötigen kein Futter b) filtriert aus gemischter Kultur c) Granulate aus Fermentationsprozess | ||||||
.
| Chemische Eigenschaften eines geeigneten Verdünnungswasssers | Anlage 4 |
| Komponente | Höchstkonzentration |
| Partikel | 5 mg/l |
| Gesamter organischer Kohlenstoff | 2 mg/l |
| Nicht ionisierter Ammoniak | 1 µg/l |
| Restchlor | 10 µg/l |
| Gesamtgehalt an phosphororganischen Pestiziden | 50 ng/l |
| Gesamtgehalt an chlororganischen Pestiziden und polychlorierten Biphenylen | 50 ng/l |
| Gesamtgehalt an organischem Chlor | 25 ng/l |
| Aluminium | 1 µg/l |
| Arsen | 1 µg/l |
| Chrom | 1 µg/l |
| Cobalt | 1 µg/l |
| Kupfer | 1 µg/l |
| Eisen | 1 µg/l |
| Blei | 1 µg/l |
| Nickel | 1 µg/l |
| Zink | 1 µg/l |
| Cadmium | 100 ng/l |
| Quecksilber | 100 ng/l |
| Silber | 100 ng/l |
.
| Leitlinie für die statistische Analyse der NOEC-Bestimmung | Anlage 5 |
Allgemeines
Analyseeinheit ist das Replikatgefäß. Bei kontinuierlichen Messungen, wie z.B. Größe, sollte der Mittelwert oder Median der Replikate berechnet werden, und diese Replikatwerte sind die zu analysierenden Daten. Die Aussagekraft der durchgeführten Prüfungen sollte nachgewiesen werden, vorzugsweise auf der Grundlage einer historischen Datenbank für jedes Labor. Die Größenordnung der Wirkung, die bei einer statistischen Aussagekraft von 75-80 % festgestellt wird, sollte für jeden Endpunkt bei dem zu verwendenden statistischen Test angegeben werden.
In den Datenbanken, die zum Zeitpunkt der Entwicklung dieser Prüfmethode verfügbar sind, ist die Aussagekraft, die im Rahmen der empfohlenen statistischen Verfahren möglich ist, angegeben. Ein Labor sollte nachweisen, dass es diese geforderte statistische Aussagekraft erreichen kann, indem es entweder eine eigene Analyse der Teststärke anstellt oder nachweist, dass der Variationskoeffizient (VK) bei jeder Wirkung nicht über dem 90. Perzentil der bei der Ausarbeitung der Prüfrichtlinie herangezogenen Variationskoeffizienten liegt. Diese Variationskoeffizienten sind in Tabelle 1 angegeben. Sind nur Replikat-Mittelwerte oder -Mediane verfügbar, kann der Variationskoeffizient innerhalb der Replikate ignoriert werden.
Tabelle 1 90. Perzentil der Variationskoeffizienten für ausgewählte Süßwasserarten
| Spezies | Wirkung | VK_zwischen Replikaten | VK_innerhalb von Replikaten |
| Regenbogenforelle | Länge | 17,4 | 9,8 |
| Gewicht | 10,1 | 28 | |
| Dickkopfelritze | Länge | 16,9 | 13,5 |
| Gewicht | 11,7 | 38,7 | |
| Zebrabärbling | Länge | 43,7 | 11,7 |
| Gewicht | 11,9 | 32,8 |
Bei fast allen statistischen Tests zur Bewertung von Labor-Toxizitätsstudien geht es um den Vergleich zwischen Behandlungsgruppen und Kontrollen. Aus diesem Grund ist es nicht angezeigt, vor einem Dunnett- oder Williams-Test einen statistisch signifikanten ANOVA-F-Test oder vor einem Jonckheere-Terpstra-, Mann-Whitney- oder Dunn-Test einen statistisch signifikanten Kruskal-Wallis-Test zu verlangen (Hochberg und Tamhane 1987, Hsu 1996, Dunnett 1955, 1964, Williams 1971, 1972, 1975, 1977, Robertson et al. 1988, Jonckheere 1954, Dunn 1964).
Der Dunnett-Test beinhaltet eine integrierte Multiplizitätsanpassung, und durch die Anwendung des F-Tests als Referenz werden die Falsch-Positiv- und Falsch-Negativ-Raten negativ beeinflusst. Ebenso erhalten der Williams- (Step-Down) und Jonckheere-Terpstra-Test unter Verwendung eines Signifikanzwerts von 0,05 bei jedem Schritt eine Falsch-Positiv-Rate von insgesamt 5 %, wobei diese Rate und die Aussagekraft der Tests durch Verwendung des F-Tests oder Kruskal-Wallis-Tests als Referenz negativ beeinflusst werden. Der Mann-Whitney- und Dunn-Test müssen hinsichtlich der Multiplizität angepasst werden und die Bonferroni-Holm-Korrektur wird empfohlen.
Im Dokument OECD (2006) ist eine ausführliche Erörterung der meisten Empfehlungen zur Hypothesentestung und zur Überprüfung der diesen Tests zugrunde liegenden Annahmen sowie eine umfassende Bibliographie zu finden.
Behandlung der Kontrollen bei Verwendung eines Lösungsmittels
Wird ein Lösungsmittel verwendet, sollte sowohl eine Verdünnungswasserkontrolle als auch eine Lösungsmittelkontrolle einbezogen werden. Die beiden Kontrollen sollten in Bezug auf jede Wirkung verglichen und für die statistische Analyse miteinander kombiniert werden, falls kein signifikanter Unterschied zwischen ihnen festgestellt wird. Ansonsten sollte die Lösungsmittelkontrolle für die NOEC-Bestimmung oder ECx-Schätzung verwendet und die Verdünnungswasserkontrolle nicht verwendet werden. Siehe Einschränkung der Validitätskriterien (Nummer 7).
Für Länge, Gewicht, Anteil an ausgeschlüpften Eiern, Larvenmortalität oder abnorme Larven sowie den ersten oder letzten Schlüpf- oder Aufschwimmtag sollten die Verdünnungswasserkontrolle und die Lösungsmittelkontrolle unter Verwendung eines Signifikanzwerts von 0,05 mit einem T-Test oder Mann-Whitney-Test verglichen werden, wobei alle Behandlungsgruppen außer Acht gelassen werden. Die Ergebnisse dieser Tests sollten angegeben werden.
Größenmessungen (Länge und Gewicht)
Die einzelnen Fischlängen- und Fischgewichtswerte können normalverteilt oder logarithmisch normalverteilt sein. In beiden Fällen tendieren die Mittelwerte der Replikate zu einer Normalverteilung entsprechend dem Zentralen Grenzwertsatz, was durch Daten aus mehr als 100 ELS-Studien an drei Süßwasserarten bestätigt wurde. Wenn die Daten oder historischen Datenbanken auf eine logarithmische Normalverteilung bei individuellen Fischgrößenwerten hindeuten, kann der mittlere Logarithmus der Replikate der einzelnen Fischwerte berechnet werden, und die Daten für die Analyse können dann die Antilogarithmen dieser mittleren Logarithmen der Replikate sein.
Die Daten sollten auf Übereinstimmung mit einer Normalverteilung und die Einhaltung der Varianzhomogenität überprüft werden. Zu diesem Zweck sollten die Residuen eines ANOVA-Modells mit der Konzentration als einzige erläuternde Variable verwendet werden. Die visuelle Bestimmung anhand von Streudiagrammen und Histogrammen oder Stamm-Blatt-Diagrammen stellt ebenfalls eine Möglichkeit dar. Alternativ kann ein formaler Test wie z.B. Shapiro-Wilk oder Anderson-Darling durchgeführt werden. Die Einhaltung der Varianzhomogenität kann anhand einer visuellen Überprüfung desselben Streudiagramms oder formal durch einen Levene-Test bewertet werden. Nur parametrische Tests (z.B. Williams, Dunnett) müssen hinsichtlich Normalität oder Varianzhomogenität bewertet werden.
Etwaige Ausreißer und deren Auswirkung auf die Analyse sollten beachtet werden. Der Ausreißertest nach Tukey und die visuelle Überprüfung der oben beschriebenen Residuendiagramme können herangezogen werden. Ferner ist zu beachten, dass es sich bei Beobachtungen um ganze Replikate handelt, sodass ein Ausreißer nur nach sorgfältiger Abwägung in der Analyse unberücksichtigt bleiben sollte.
Die statistischen Tests, bei denen die Merkmale des Versuchsplans und die biologischen Erwartungen genutzt werden, sind Step-Down-Trendtests, wie z.B. Williams und Jonckheere-Terpstra. Bei den Tests wird von einer monotonen Konzentrations-Wirkungs-Beziehung ausgegangen, und die Daten sollten auf Übereinstimmung mit dieser Annahme überprüft werden. Dies kann visuell anhand eines Streudiagramms der Replikat-Mittelwerte im Verhältnis zur Prüfkonzentration erfolgen. Dieses Streudiagramm sollte mit einem linearen Diagramm überlagert werden, bei dem die nach Replikatprobengröße gewichteten Konzentrationsmittelwerte miteinander verbunden werden. Eine starke Abweichung dieses linearen Diagramms von der Monotonie würde darauf hindeuten, dass möglicherweise andere Tests als Trendtests verwendet werden sollten. Alternativ können formale Tests verwendet werden. Bei einem einfachen linearen Test werden die linearen und quadratischen Kontraste der Konzentrationsmittelwerte berechnet. Wenn der quadratische Kontrast signifikant und der lineare Kontrast nicht signifikant ist, deutet dies auf ein mögliches Monotonieproblem hin, das anhand von Diagrammen näher untersucht werden sollte. Wenn Normalität oder Varianzhomogenität möglicherweise ein Problem darstellen, können diese Kontraste aus in Rangfolge transformierten Daten abgeleitet werden. Alternative Verfahren wie beispielsweise der Monotonietest nach Bartholomew können zwar verwendet werden, erhöhen aber die Komplexität.
Abbildung 2 NOEC-Flussdiagramm für Größenmessungen (Länge und Gewicht)
Die NOEC wird durch eine Step-Down-Anwendung des Williams- oder Jonckheere-Terpstra-Tests bestimmt, außer wenn die Daten die Anforderungen dieser Tests nicht erfüllen. Nähere Informationen über diese Verfahren sind OECD (2006) zu entnehmen. Bei Daten, die die Anforderungen eines Step-Down-Trendtests nicht erfüllen, kann der Dunnett- oder der Tamhane-Dunnett-Test (T3) angewandt werden, die beide Anpassungen hinsichtlich der Multiplizität enthalten. Bei diesen Tests wird von Normalität und im Fall von Dunnett von Varianzhomogenität ausgegangen. Sind diese Bedingungen nicht erfüllt, kann der nichtparametrische Test nach Dunn angewandt werden. Nähere Informationen zu all diesen Tests sind OECD (2006) zu entnehmen. Abbildung 2 zeigt eine Übersicht als Entscheidungshilfe für die Wahl des am besten geeigneten Tests.
Schlupferfolg und Überlebensrate der Larven
Die Daten beziehen sich auf die Anteile an ausgeschlüpften Eiern oder an überlebenden Larven in den einzelnen Replikaten. Diese Anteile sollten in Bezug auf extrabinomiale Varianz überprüft werden, die bei solchen Messungen zwar üblich ist, aber nicht generell auftritt. Das Flussdiagramm in Abbildung 3 dient als Orientierung für die Auswahl des Tests; ausführliche Beschreibungen sind dem Text zu entnehmen.
Im Allgemeinen kommen zwei Tests zur Anwendung. Hierbei handelt es sich um den Tarone-C(α)-Test (Tarone, 1979) und den Chi-Quadrat-Test, die jeweils separat bei jeder Prüfkonzentration angewandt werden. Wird auch in nur einer Prüfkonzentration extrabinomiale Varianz festgestellt, dann sollten dementsprechende Methoden angewandt werden.
Formel 1 Tarone-C(α)-Test (Tarone 1979)
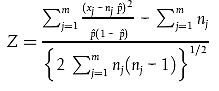
Hierbei gilt: ist der mittlere Anteil bei einer bestimmten Konzentration, m ist die Anzahl der Replikatgefäße, nj ist die Anzahl der Versuchssubjekte in Replikat j und xj ist die Anzahl der reagierenden Versuchssubjekte in diesem Replikat, z.B. nicht geschlüpft oder tot. Der Test wird auf jede Konzentration separat angewandt. Dieser Test kann als angepasster Chi-Quadrat-Test angesehen werden, jedoch haben von Tarone durchgeführte Limited-Power-Simulationen gezeigt, dass er eine stärkere Aussagekraft besitzt als ein Chi-Quadrat-Test.
Abbildung 3 NOEC-Flussdiagramm für Schlupferfolg und Larvenmortalität
Gibt es keine signifikanten Hinweise auf eine extrabinomiale Varianz, kann der Cochran-Armitage-Test (Step-Down) angewandt werden. Bei diesem Test werden Replikate ignoriert. Wenn daher solche Hinweise vorliegen, wird die Rao-Scott-Anpassung des Cochran-Armitage-Tests (RSCA) empfohlen, bei der Replikate, Replikatgrößen und extrabinomiale Varianz berücksichtigt werden. Zu alternativen Tests zählen die Williams- und Jonckheere-Terpstra-Tests (Step-Down) sowie der Dunnett-Test, wie bei den Größenmessungen beschrieben. Diese Tests gelten unabhängig davon, ob eine extrabinomiale Varianz vorliegt oder nicht, besitzen aber eine etwas geringere Aussagekraft (Agresti 2002, Morgan 1992, Rao und Scott 1992, 1999, Fung et al. 1994, 1996).
Erster oder letzter Schlüpf- oder Aufschwimmtag
Das Ergebnis ist eine ganze Zahl, die den Versuchstag angibt, an dem die betreffende Beobachtung bei einem bestimmten Replikatgefäß festgestellt wird. Der Wertebereich ist im Allgemeinen sehr begrenzt und umfasst häufig hohe Anteile von verbundenen Werten, z.B. in der Form, dass der erste Schlüpftag in allen Kontrollreplikaten und vielleicht in ein oder zwei der niedrigen Prüfkonzentrationen identisch ist. Parametrische Tests wie z.B. der Williams- und der Dunnett-Test sind für solche Daten ungeeignet. Außer wenn Hinweise auf eine erhebliche Nicht-Monotonie vorliegen, ist der Jonckheere-Terpstra-Test (Step-Down) ein leistungsfähiges Instrument, um die Wirkungen der Prüfchemikalie nachzuweisen. Ansonsten kann der Dunn-Test angewandt werden.
Abnormitäten von Larven
Das Ergebnis ist die Anzahl an Larven, bei denen irgendeine Art von Abnormität festgestellt wird. Die Inzidenz ist häufig gering. Außerdem zeigen sich z. T. die gleichen Probleme wie beim ersten Schlüpftag sowie eine unregelmäßige Konzentrations-Wirkungs-Beziehung. Wenn die Daten zumindest grob einen monotonen Verlauf der Konzentrations-Wirkungs-Beziehung ergeben, stellt der Jonckheere-Terpstra-Test (Step-Down) ein leistungsfähiges Instrument zum Nachweis der Wirkungen dar. Andernfalls kann der Dunn-Test angewandt werden.
Literaturhinweise
Agresti, A. (2002); Categorical Data Analysis, zweite Auflage, Wiley, Hoboken.
Dunnett C.W. (1955); A multiple comparison procedure for comparing several treatments with a control, J. American Statistical Association 50, 1096-1121.
Dunn O.J. (1964); Multiple Comparisons Using Rank Sums, Technometrics 6, 241-252.
Dunnett C.W. (1964); New tables for multiple comparisons with a control, Biometrics 20, 482-491.
Fung, K.Y., D. Krewski, J.N.K. Rao, A.J. Scott (1994); Tests for Trend in Developmental Toxicity Experiments with Correlated Binary Data, Risk Analysis 14, 639-648.
Fung, K.Y, D. Krewski, R.T. Smythe (1996); A comparison of tests for trend with historical controls in carcinogen bioassay, Canadian Journal of Statistics 24, 431-454.
Hochberg, Y. und A. C. Tamhane (1987); Multiple Comparison Procedures, Wiley, New York.
Hsu, J.C. (1996); Multiple Comparisons: Theory and Methods; Chapman and Hall/CRC Press, Boca Raton.
Jonckheere A.R. (1954); A distribution-free k-sample test against ordered alternatives, Biometrika 41, 133.
Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London.
OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A Guidance to Application. Series on Testing and Assessment, No. 54. Organisation for Economic Co-operation and Development, OECD, Paris.
Rao J.N.K. und Scott A.J. (1992) - A simple method for the analysis of clustered binary data, Biometrics 48, 577-585.
Rao J.N.K. und Scott A.J. (1999) - A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385.
Robertson T., Wright F.T. und Dykstra R.L. (1988); Order restricted statistical inference, Wiley.
Tarone, R.E. (1979); Testing the goodness of fit of the Binomial distribution, Biometrika 66, 585-590.
Williams D.A. (1971); A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics 27, 103-117.
Williams D.A. (1972); The comparison of several dose levels with a zero dose control, Biometrics 28, 519-531.
Williams D.A. (1975); The Analysis of Binary Responses from Toxicological Experiments Involving Reproduction and Teratotlogy, Biometrics 31, 949-952.
Williams D.A. (1977); Some inference procedures for monotonically ordered normal means, Biometrika 64, 9-14.
.
| Leitlinie für statistische Regressionsanalysen | Anlage 6 |
Allgemeines
Die zur Anpassung eines Modells verwendeten Beobachtungen sind die Mittelwerte von Länge und Gewicht je Replikat oder der Anteile ausgeschlüpfter Eier und toter Larven in jedem Replikat (OECD 2006).
Im Allgemeinen wird eine gewichtete Regression unter Verwendung der Replikat-Probengröße als Gewichtung empfohlen. Jedoch sind auch andere Gewichtungen möglich, wie z.B. die Gewichtung nach vorhergesagter mittlerer Wirkung oder eine Kombination dieser Gewichtung mit der Gewichtung nach Replikat-Probengröße. Von der Gewichtung mit dem Kehrwert der Varianz in der Probe bei einer bestimmten Konzentration wird abgeraten (Bunke et al. 1999, Seber and Wild, 2003, Motulsky und Christopoulos 2004, Huet et al. 2003).
Bei der Transformation der Wirkungen vor der Analyse sollte die Unabhängigkeit der Beobachtungen erhalten bleiben. Ferner sollten die ECx und die Grenzen ihres Konfidenzintervalls in den ursprünglichen und nicht in den transformierten Maßeinheiten ausgedrückt werden. Beispielsweise entspricht eine 20 %ige Änderung des Logarithmus der Länge nicht einer20 %igen Änderung der Länge (Lyles et al. 2008, Draper und Smith 1999).
Das Flussdiagramm in Anlage 4 zeigt einen Überblick über die ECx-Schätzungen. Die Einzelheiten werden nachfolgend beschrieben.
Abbildung 4 Flussdiagramm für die Schätzung der ECx für die mittlere Länge, das mittlere Gewicht und den mittleren Anteil an geschlüpften Eiern oder toten Larven je Replikat (Erläuterungen im Text)
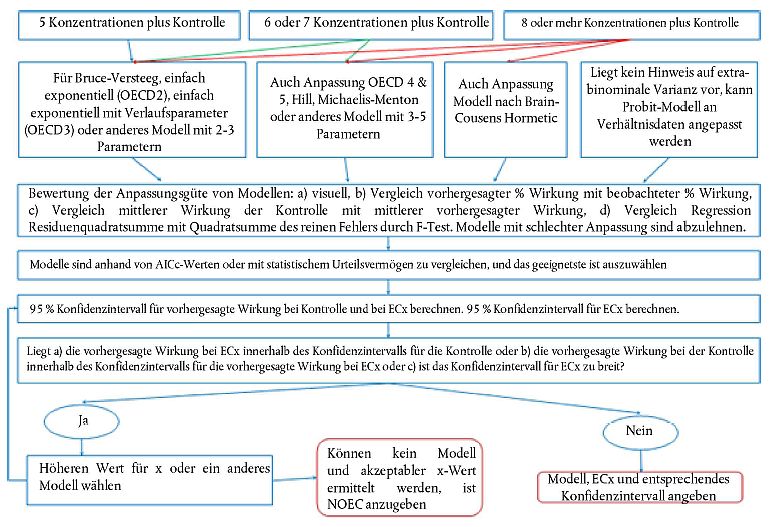
Erwägungen zum Schlüpfe n der Eier und zur Larvenmortalität
Im Hinblick auf das Schlüpfen der Eier und die Larvenmortalität empfiehlt sich normalerweise die Anpassung eines Modells mit abnehmendem Kurvenverlauf, außer wenn wie nachfolgend beschrieben ein Probit-Modell angepasst wird. Das heißt, dass der Anteil an Eiern, die nicht schlüpfen, oder an Larven, die sterben, modelliert werden sollte. Der Grund hierfür liegt darin, dass die ECx eine Konzentration ist, bei der eine Änderung auftritt, die x % der mittleren Wirkung der Kontrolle entspricht. Wenn 5 % der Kontrolleier nicht schlüpfen und das Nichtschlüpfen modelliert wird, dann bezeichnet die EC20 eine Konzentration, bei der eine Änderung von 20 % der 5 % nicht geschlüpften Kontrolleier auftritt, d. h. eine Änderung von 0,2 x 0,05 = 0,01 oder um 1 Prozentpunkt auf 6 % nicht geschlüpfte Eier. Eine solch geringfügige Änderung kann anhand der verfügbaren Daten nicht sinnvoll geschätzt werden und ist biologisch ohne Bedeutung. Würde hingegen der Anteil an geschlüpften Eiern modelliert, so würde der Anteil in den Kontrollen in diesem Beispiel 95 % betragen, und eine 20 %ige Verringerung gegenüber dem Mittelwert der Kontrolle würde eine Änderung von 0,95 x 0,2 = 0,18 bedeuten, d. h. der Schlupferfolg würde von 95 % auf 77 % (= 95-18) zurückgehen. Die Konzentration, bei der diese Wirkung auftritt, kann bestimmt werden und wäre vermutlich von größerem Interesse. Bei Größenmessungen tritt dieses Problem nicht auf, wenngleich nachteilige Auswirkungen auf die Größe im Allgemeinen eine Verringerung der Größe bedeuten.
Modelle für Größe (Länge oder Gewicht) und Schlupferfolg oder Überlebensrate der Larven
Abgesehen vom Hormesis-Modell von Brain-Cousens werden all diese Modelle in OECD (2006) beschrieben und empfohlen. Die Modelle OECD 2 bis 5 werden auch für die Ökotoxiziätsversuche in Slob (2002) erläutert. Selbstverständlich gibt es zahlreiche andere Modelle, die sinnvoll sein könnten. In Bunke et al. (1999) werden zahlreiche Modelle aufgeführt, die hier nicht genannt sind, und es gibt zahlreiche Verweise auf andere Modelle. Die nachfolgend aufgeführten Modelle werden als besonders geeignet für Ökotoxiziätsversuche empfohlen und häufig verwendet.
Bei fünf Prüfkonzentrationen plus Kontrolle
- Bruce-Versteeg
- Einfach exponentiell (OECD 2)
- Exponentiell mit Formparameter (OECD 3)
- Einfach exponentiell mit Untergrenze (OECD 4)
Bei sechs oder mehr Prüfkonzentrationen plus Kontrolle
- Exponential mit Formparameter und Untergrenze (OECD 5)
- Michaelis-Menten
- Hill
Wenn sichtbare Anzeichen von Hormesis vorhanden sind (unwahrscheinlich bei Schlupferfolg oder Überleben der Larven, jedoch manchmal bei Größenbeobachtungen festzustellen)
- Brain-Cousens Hormetic; Brain und Cousens (1989)
Alternative Modelle für nicht geschlüpfte Eier und Larvenmortalität
- Liegen keine Hinweise auf extrabinomiale Varianz vor, können Modelle mit ansteigendem Kurvenverlauf für diese Wirkungen durch (logistische) Probit-Modelle angepasst werden; die Inzidenz der Kontrolle wird in der Modellanpassung geschätzt. Dies ist nicht die bevorzugte Methode, da das Individuum und nicht das Replikat als Analyseeinheit ausgewertet wird (Morgan 1992, O'Hara Hines und Lawless 1993, Collett 2002, 2003).
Anpassungsgüte eines einzelnen Modells
- Visueller Vergleich der beobachteten und der vorhergesagten prozentualen Abnahme bei jeder Prüfkonzentration (Motulsky und Christopoulos 2004, Draper und Smith 1999).
- Vergleich des mittleren Fehlerquadrats der Regression mit dem reinen mittleren Fehlerquadrat anhand eines F-Tests (Draper und Smith 1999).
- Überprüfung, ob jeder Term in dem Modell signifikant von Null abweicht (d. h. Bestimmung, ob alle Modellterme wichtig sind) (Motulsky and Christopoulos 2004).
- Diagramme der Residuen aus der Regression im Verhältnis zur Prüfkonzentration, eventuell auf einer logarithmischen Skala der Konzentration. Dieses Diagramm sollte kein Muster ergeben; die Punkte sollten zufällig um eine waagerechte Linie auf Nullhöhe verstreut sein.
- Die Daten sollten wie in Anlage 5 beschrieben hinsichtlich Normalität und Varianzhomogenität bewertet werden.
- Darüber hinaus sollte die Normalität der Residuen des Regressionsmodells anhand der Methoden, die in Anlage 5 für die Residuen der ANOVA beschrieben werden, bewertet werden.
Vergleich der Modelle
- Anwendung der AICc-Werte nach Akaike. Kleinere AICc-Werte bedeuten eine höhere Anpassungsgüte, und wenn AICc(B) - AICc(A) ≥ 10, ist Modell A mit ziemlicher Sicherheit besser als Modell B (Motulsky und Christopoulos (2004)).
- Visueller Vergleich der beiden Modelle in Bezug darauf, inwieweit sie die obigen Modellkriterien erfüllen.
- Es wird empfohlen, das Sparsamkeitsprinzip anzuwenden, wobei das einfachste Modell, das den Daten hinreichend gut entspricht, verwendet werden sollte (Ratkowsky 1993, Lyles et al., 2008).
Qualität der ECx-Bestimmung
Das Konfidenzintervall für die ECx sollte nicht zu breit sein. Es ist statistisches Urteilsvermögen erforderlich, um zu entscheiden, wie breit das Konfidenzintervall sein darf, damit die ECx noch nützlich ist. Simulationen von Regressionsmodellen mit Anpassung an Daten zu Schlupferfolg und Größe zeigen, dass etwa 75 % der Konfidenzintervalle für die ECx (x=10, 20 oder 30) höchstens zwei Prüfkonzentrationen umfassen. Dies liefert eine Leitlinie dafür, was akzeptabel und erreichbar ist. Zahlreiche Autoren bekräftigen, dass für alle Modellparameter Konfidenzintervalle angegeben werden müssen und dass breite Konfidenzintervalle bei Modellparametern auf inakzeptable Modelle schließen lassen (Ott und Longnecker2008, Alvord und Rossio 1993, Motulsky und Christopoulos 2004, Lyles et al. 2008, Seber and Wild 2003, Bunke et al. 1999, Environment Canada 2005).
Das Konfidenzintervall der ECx (oder jedes anderen Modellparameters) sollte nicht Null enthalten (Motulsky and Christopoulos 2004). Dies ist die Regression, die dem signifikanten Mindestunterschied entspricht, der häufig in Hypothesentestungsansätzen angeführt wird (z.B. Wang et al. 2000). Dies entspricht ferner dem Konfidenzintervall für die mittleren Wirkungen bei der LOEC, wobei der Mittelwert der Kontrolle nicht darin enthalten ist. Es stellt sich die Frage, ob die Schätzungen der Parameter wissenschaftlich plausibel sind. Wenn z.B. das Konfidenzintervall für y0 ± 20 % beträgt, ist keine EC10-Schätzung plausibel. Wenn das Modell eine 20 %ige Wirkung bei der Konzentration C vorhersagt und die maximale beobachtete Wirkung bei C und geringeren Konzentration 10 % beträgt, dann ist die EC20 nicht plausibel (Motulsky und Christopoulos 2004, Wang et al. 2000, Environment Canada 2005).
Die ECx sollte keine Extrapolation außerhalb des Bereichs positiver Konzentrationen erfordern (Draper und Smith 1999, OECD 2006). Beispielsweise könnte eine allgemeine Leitlinie sein, dass die ECx maximal etwa 25 % unter der niedrigsten geprüften Konzentration oder über der höchsten geprüften Konzentration liegen sollte.
Literaturhinweise
Alvord, W.G., Rossio, J.L. (1993); Determining confidence limits for drug potency in immunoassay, Journal of Immunological Methods 157, 155-163.
Brain P. and Cousens R. (1989); An equation to describe dose responses where there is stimulation of growth at low doses. Weed res. 29: 93-96.
Bunke, O., Droge, B. and Polzehl, J. (1999). Model selection, transformations and variance estimation in nonlinear regression. Statistics 33, 197-240.
Collett, D. (2002); Modelling Binary Data, second edition, Chapman and Hall, London.
Collett, D. (2003); Modelling Survival Data in Medical Research, second edition, Chapman and Hall, London.
Draper, N.R. and Smith, H. (1999); Applied Regression Analysis, third edition. New York: John Wiley & Sons.
Environment Canada (2005); Guidance Document on Statistical Methods for Environmental Toxicity Tests, Report EPS 1/RM/46
Huet, S., A. Bouvier, M.-A. Poursat, E. Jolivet (2003); Statistical Tools for Nonlinear Regression: A Practical Guide with S-PLUS and R Examples, Springer Series in Statistics, New York.
Lyles, R. H., C. Poindexter, A. Evans, M. Brown, and C.R. Cooper (2008); Nonlinear Model-Based Estimates of IC50 for Studies Involving Continuous Therapeutic Dose-Response Data, Contemp Clin Trials. 2008 November; 29(6): 878-886.
Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London.
Motulsky, H., A. Christopoulos (2004); Fitting Models to Biological Data Using Linear and Nonlinear Regression: A Practical Guide to Curve Fitting, Oxford University Press, USA.
O'Hara Hines, R. J. and J. F. Lawless (1993); Modelling Overdispersion in Toxicological Mortality Data Grouped over Time, Biometrics Vol. 49, pp. 107-121
OECD (2006); Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series Testing and Assessment, No. 54, Organisation for Economic Co-operation and Development, OECD, Paris.
Ott, R.L., M.T. Longnecker, An Introduction to Statistical Methods and Data Analysis, sixth edition, 2008, Brooks-Cole, Belmont, CA
Ratkowsky, D.A. (1993); Principles of nonlinear regression, Journal of Industrial Microbiology 12, 195-199.
Seber, G.A.F., C.J. Wild, Nonlinear Regression, Wiley, 2003
Slob W. (2002); Dose-response modelling of continuous endpoints. Toxicol. Sci., 66, 298-312
Wang, Q., D.L. Denton, and R. Shukla (2000); Applications and Statistical Properties Of Minimum Significant Difference-Based Criterion Testing In a Toxicity Testing Program, Environmental Toxicology and Chemistry, Vol. 19, pp. 113-117, 2000.
 | weiter . |  |
...
X
⍂
↑
↓
