
umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (43)
 | zurück |
C.44. Versickerung in Bodensäulen 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 312 (2004). Synthetisch hergestellte Chemikalien können durch bewusste Ausbringung (z.B. Agrochemikalien) oder über indirekte Wege (z.B. Abwasser → Klärschlamm → Boden oder Luft → feuchte/trockene Deposition) in den Boden gelangen. Für eine Bewertung des mit diesen Chemikalien verbundenen Risikos müssen das Potenzial der Chemikalien zur Transformation und zur Verlagerung in tiefere Bodenschichten sowie eventuell das Eindringen in das Grundwasser ermittelt werden.
2. Das Versickerungspotenzial von Chemikalien im Boden kann unter kontrollierten Laborbedingungen mit verschiedenen Verfahren ermittelt werden (Dünnschichtchromatographie, Dickschichtchromatographie, Bodensäulenchromatographie und Adsorptions-/Desorptionsmessungen) (1)(2). Bei nicht ionisierten Chemikalien ermöglicht der n-Oktanol-Wasser-Verteilungskoeffizient (Pow) eine frühzeitige Abschätzung des Adsorptionsverhaltens und des Versickerungspotenzials (3)(4)(5).
3. Das in dieser Prüfmethode beschriebene Verfahren beruht auf der Bodensäulenchromatographie mit gestörten Böden (zur Begriffsbestimmung siehe Anlage 1). Das Versickerungspotenzial (i) des Prüfstoffs und (ii) von Transformationsprodukten (Untersuchung mit gealterten Rückständen) von Böden unter kontrollieren Laborbedingungen wurde mit zwei Testtypen ermittelt 1. Die Prüfmethode beruht auf bestehenden Methoden (6)(7)(8)(9)(10)(11).
4. In einem OECD-Workshop zur Auswahl von Böden/Sedimenten, der 1995 in Belgirate, Italien (12) stattfand, wurde eine Einigung über Anzahl und Typ der für diese Prüfmethode zu verwendenden Böden erzielt. Außerdem wurden Empfehlungen bezüglich der Entnahme, Handhabung und Lagerung von Bodenproben für Versickerungstests formuliert.
5. Säulen aus geeignetem inertem Material (Glas, Edelstahl, Aluminium, Teflon, PVC usw.) werden mit Bodenmaterial gepackt. Anschließend wird die Packung mit einer künstlichen Regenlösung (Begriffsbestimmung siehe Anlage 1) gesättigt und äquilibriert bis ein Gleichgewicht hergestellt und die überschüssige Flüssigkeit abgelaufen ist. Danach wird die Oberfläche der Bodensäulen jeweils mit der Prüfchemikalie und/oder mit gealterten Rückständen der Prüfchemikalie behandelt. Die Bodensäulen werden künstlich beregnet, und das Sickerwasser wird aufgefangen. Nach dem Versickerungsprozess wird der Boden aus den Säulen entnommen und je nach den zu untersuchenden Merkmalen in eine geeignete Anzahl an Bodensegmenten geteilt. Diese Bodensegmente und das Sickerwasser werden auf Rückstände der Prüfchemikalie sowie gegebenenfalls auf Transformationsprodukte oder sonstige relevante Chemikalien untersucht.
6. Die Prüfmethode kann bei (nicht markierten oder radioaktiv (etwa mit 14C) markierten) Prüfchemikalien verwendet werden, für die eine hinreichend genaue und empfindliche Analysemethode verfügbar ist. Für Chemikalien, die sich aus dem Boden und aus Wasser verflüchtigen und somit unter den Bedingungen dieser Prüfmethode nicht im Boden und/oder im Sickerwasser verbleiben, ist die Methode nicht geeignet.
Informationen zur Prüfchemikalie
7. Zur Messung des Versickerungsverhaltens in Bodensäulen können nicht markierte oder radioaktiv markierte Prüfchemikalien verwendet werden. Um das Versickerungsverhalten von Transformationsprodukten (gealterten Rückständen des Prüfstoffs) zu untersuchen und um die Massenbilanz zu ermitteln, wird radioaktiv markiertes Material benötigt. Die Markierung mit 14C wird empfohlen; es können aber auch andere Isotope (z.B. 13C, 15N, 3H oder 32P) verwendet werden. Nach Möglichkeit ist die Markierung im stabilsten Teil (in den stabilsten Teilen) des jeweiligen Moleküls zu setzen. Die Prüfchemikalie muss eine Reinheit von mindestens 95 % haben.
8. Die meisten Chemikalien sollten in reiner Form appliziert werden. Nur bei Wirkstoffen von Pflanzenschutzmitteln können die fertigen Produkte zur Untersuchung des Versickerungsverhaltens des Ausgangsprüfstoffes verwendet werden. Dies ist besonders dann empfehlenswert, wenn das jeweilige Produkt die Freisetzungsrate des zu untersuchenden Prüfstoffs beeinflussen kann (z.B. Granulate oder Formulierungen zur kontrollierten Freisetzung). Bezüglich der für die betreffende Formulierung spezifischen Anforderungen an das jeweilige Prüfprotokoll kann es hilfreich sein, sich vor Durchführung einer Prüfung bei der zuständigen Behörde zu erkundigen. Bei Versickerungstests mit gealterten Rückständen ist der Ausgangsprüfstoff in reiner Form zu verwenden.
9. Vor der Durchführung von Versickerungstests mit Bodensäulen sollten die folgenden Informationen zur Prüfchemikalie verfügbar sein:
(1) Löslichkeit in Wasser [ Prüfmethode A.6] (13);(2) Löslichkeit in organischen Lösungsmitteln;
(3) Dampfdruck [ Prüfmethode A.4] (13) und Henry-Konstante;
(4) n-Oktanol-Wasser-Verteilungskoeffizient [ Prüfmethoden A.8 und A.24] (13);
(5) Adsorptionskoeffizient (Kd, Kf oder KOC) [ Prüfmethoden C.18 und/oder C.19] (13);
(6) Hydrolyse [ Prüfmethode C.7] (13);
(7) Dissoziationskonstante (pKa) [OECD-Prüfrichtlinie 112] (25);
(8) aerobe und anaerobe Transformation im Boden [ Prüfmethode C.23] (13).
Hinweis: Die Temperatur, bei der diese Messungen vorgenommen wurden, ist in den jeweiligen Prüfprotokollen zu vermerken.
10. Die Prüfchemikalie ist in hinreichender Menge in die Bodensäulen einzubringen, um in den einzelnen Segmenten mindestens 0,5 % der eingebrachten Dosierung nachweisen zu können. Bei Wirkstoffen in Pflanzenschutzmitteln kann die Menge der eingebrachten Prüfchemikalie der für die Verwendung des Produktes empfohlenen maximalen Aufwandmenge entsprechen (einmalige Applikation).
11. Zur Quantifizierung der Prüfchemikalie sowie gegebenenfalls ihrer Transformationsprodukte im Boden und im Sickerwasser muss eine geeignete Analysemethode mit bekannter Genauigkeit, Präzision und Empfindlichkeit verfügbar sein. Die analytische Nachweisgrenze für die Prüfchemikalie und ihrer wesentlichen Transformationsprodukte (im Allgemeinen mindestens alle Transformationsprodukte, die in Konzentrationen von e 10 % der applizierten Aufwandmenge in Abbaustudien nachgewiesen wurden, vorzugsweise aber alle relevanten Transformationsprodukte) sollten bekannt sein (siehe Nummer 17).
12. Zur Bewertung der relativen Mobilität der Prüfchemikalie im Boden werden Referenzchemikalien mit bekanntem Versickerungsverhalten (z.B. Atrazin oder Monuron) verwendet, von denen aus praktischen Erfahrungen bekannt ist, dass sie in mäßigem Umfang versickern (1)(8)(11). Eine nicht sorbierende und nicht abbaubare polare Referenzchemikalie (z.B. Tritium, Bromid, Fluoreszein oder Eosin) zur Nachverfolgung des Wassertransports in der Säule kann hilfreich sein, um die hydrodynamischen Eigenschaften der Bodensäule zu ermitteln.
13. Chemikalien in Analysequalität können verwendet werden, um durch Chromatographie, Spektroskopie oder sonstige geeignete Verfahren Transformationsprodukte zu beschreiben und/oder zu identifizieren, die in den Bodensegmenten und im Sickerwasser enthalten sind.
Begriffsbestimmungen und Einheiten
14. siehe Anlage 1.
Wiederfindung
15. Im Versickerungstest ist die Summe der Prozentanteile der Prüfchemikalie, die nach der Versickerung in den Bodensegmenten und im Sickerwasser der Säulen nachgewiesen wird, als Wiederfindungsrate zu betrachten. Die Wiederfindungsraten müssen bei radioaktiv markierten Substanzen bei 90-110 % (11) und bei nicht markierten Substanzen bei 70-110 % liegen (8).
Wiederholbarkeit und Empfindlichkeit der Analysemethode
16. Die Wiederholbarkeit der Analysemethode zur Quantifizierung der Prüfchemikalie und der Transformationsprodukte kann durch erneute Analyse desselben Extrakts eines Bodensegments oder des betreffenden Sickerwassers geprüft werden (siehe Nummer 11).
17. Die Nachweisgrenze (LOD) der Methode zur Analyse der Prüfchemikalie und der Transformationsprodukte muss bei den einzelnen Bodensegmenten und im Sickerwasser (als Prüfchemikalie) jeweils mindestens 0,01 mg · kg- 1 oder 0,5 % der in die einzelnen Segmente eingebrachten Dosis betragen; maßgeblich ist der jeweils niedrigere Wert. Der Quantifizierungsgrenze (LOQ) ist ebenfalls zu bestimmen.
Prüfsystem
18. Für die Prüfung werden Bodensäulen (teilbar und unteilbar) aus geeignetem inertem Material (Glas, Edelstahl, Aluminium, Teflon, PVC usw.) mit einem Innendurchmesser von mindestens 4 cm und einer Mindesthöhe von 35 cm verwendet. Das Säulenmaterial ist auf potenzielle Wechselwirkungen mit der Prüfchemikalie und/oder mit Transformationsprodukten der Prüfchemikalie zu testen. In Anlage 2 werden einige geeignete teilbare und nicht teilbare Säulen beschrieben.
19. Zum Füllen und Packen der Bodensäulen sind Löffel, Kolben und Vibrationsvorrichtungen zu verwenden.
20. Zur Einbringung der künstlichen Beregnung in die Bodensäulen können Kolbenpumpen, peristaltische Pumpen, Brauseköpfe, Mariottesche Flaschen oder einfache Tropftrichter verwendet werden.
Laborausrüstung und Chemikalien
21. Es wird die übliche Laborausrüstung insbesondere mit folgenden Bestandteilen benötigt:
(1) Analysegeräte (u. a. GLC-, HPLC- und TLC-Ausrüstung) einschließlich geeigneter Nachweissysteme zur Analyse markierter oder nicht markierter Chemikalien oder zur Analyse mit der inversen Isotopenverdünnungsmethode;(2) Bestimmungsgeräte (MS, GC-MS, HPLC-MS, NMR usw.);
(3) Flüssigszintillationszähler für nicht radioaktiv markierte Prüfchemikalien;
(4) Oxidationsmittel zur Verbrennung von markiertem Material;
(5) Extraktionsgerät (z.B. Zentrifugenröhrchen zur Kaltextraktion und Soxhlet-Apparat zur kontinuierlichen Extraktion unter Rückfluss);
(6) Geräte zur Konzentration von Lösungen und Extrakten (z.B. Rotationsverdampfer).
22. Folgende Chemikalien werden verwendet: organische Lösungsmittel in Analysequalität (Aceton, Methanol usw.); Szintillationsflüssigkeit: 0,01 M CaCl2-Lösung in destilliertem oder entionisiertem Wasser (= 'künstlicher Regen').
Prüfchemikalie
23. Um die Prüfchemikalie in die Bodensäule einzubringen, wird der Stoff in (destilliertem oder entionisiertem) Wasser gelöst. Wenn die Prüfchemikalie in Wasser schlecht löslich ist, kann sie entweder als fertige Formulierung (erforderlichenfalls nach Suspension oder Emulgierung in Wasser) aufgebracht werden, oder die Applikation kann in einem beliebigen organischen Lösungsmittel erfolgen. Soweit überhaupt verwendet, sind organische Lösungsmittel auf ein Minimum zu begrenzen und vor Beginn des Versickerungsprozesses von der Oberfläche des Bodenmaterials zu verdampfen. Feste Zubereitungen (z.B. Granulate) werden in fester Form ohne Wasser in die Säulen gegeben. Um die Verteilung der Materialien über die Oberfläche der Bodensäule zu unterstützen, können die formulierten Produkte vor der Applikation mit einem geringen Anteil an Quarzsand (z.B. 1 g) gemischt werden.
24. Die Prüfchemikalie ist in hinreichender Menge in die Bodensäulen einzubringen, um mindestens 0,5 % der applizierten Dosis in den einzelnen Segmenten nachweisen zu können. Bei Wirkstoffen von Pflanzenschutzmitteln kann die applizierte Dosis auf Basis der empfohlenen maximalen Aufwandmenge (Einzelapplikation) erfolgen und sowohl für den Wirkstoff als auch für gealterte Wirkstoffe sollte sich die applizierte Menge auf die Oberfläche der verwendeten Bodensäule beziehen 2.
Referenzchemikalie
25. In den Versickerungsstests ist eine Referenzchemikalie zu verwenden (siehe Nummer 12). Die Referenzchemikalie ist in ähnlicher Weise wie die Prüfchemikalie auf die Oberfläche der Bodensäule aufzubringen und in ausreichender Menge, um eine angemessene Nachweisgenauigkeit entweder als interner Standard zusammen mit der Prüfchemikalie in derselben Bodensäule oder separat in einer eigenen Bodensäule zu gewährleisten. Vorzugsweise werden beide Chemikalien gemeinsam in derselben Säule zur Versickerung gebracht, außer wenn beide Chemikalien ähnlich markiert wurden.
Böden
Auswahl der Böden
26. Für die Versickerungsuntersuchungen mit der Ausgangsprüfchemikalie werden 3 bis 4 Böden mit unterschiedlichen pH-Werten, Anteilen an organischen Kohlenstoffen und Texturen verwendet (12). Die folgende Tabelle 1 enthält Leitlinien zur Auswahl von Böden für Versickerungsstudien. Bei ionisierbaren Prüfchemikalien müssen die ausgewählten Böden ein breites Spektrum an pH-Werten abdecken, damit die Mobilität der Chemikalien in ionisierter und in nicht ionisierter Form beurteilt werden kann. Mindestens 3 Böden müssen einen pH-Wert aufweisen, bei dem die Prüfchemikalie in mobiler Form vorliegt.
Tabelle 1: Leitlinien zur Auswahl von Böden für Versickerungsstudien
| Boden Nr. | pH-Wert | Organischer Kohlenstoff % | Tonanteil % | Textur * |
| 1 | > 7,5 | 3,5 - 5,0 | 20 - 40 | lehmiger Tonboden |
| 2 | 5,5 - 7,0 | 1,5 - 3,0 | 15 - 25 | lehmiger Schluff |
| 3 | 4,0 - 5,5 | 3,0 - 4,0 | 15 - 30 | Lehm |
| 4 | < 4,0 - 6,0 § | < 0,5 - 1,5 § | < 10 - 15 § | lehmiger Sand |
| 5 | < 4,5 | > 10 # | < 10 | lehmiger Sand/Sand |
| *) Nach dem FAO- und dem USDA-System (14).
§ Die Werte der entsprechenden Variablen sollten im genannten Bereich liegen. Wenn geeignetes Bodenmaterial schwer zu finden ist, können die genannten Mindestwerte unterschritten werden. Böden mit einem Anteil von weniger als 0,3 % organischem Kohlenstoff können die Korrelation zwischen dem Gehalt an organischen Bestandteilen und der Adsorptionsleistung beeinträchtigen. Daher sollten Böden mit mindestens 0,3 % organischem Kohlenstoff verwendet werden. # Böden mit sehr hohem Kohlenstoffanteil (z.B. > 10 %) sind aus rechtlichen Gründen unter Umständen nicht annehmbar (z.B. bei der Zulassung von Pflanzenschutzmitteln). | ||||
27. Manchmal sind andere Bodentypen erforderlich, wenn die Gegebenheiten in kühleren, gemäßigten oder tropischen Regionen nachgebildet werden sollen. Wenn andere Bodentypen bevorzugt werden, müssen diese daher denselben Parametern entsprechen und sollten sich in ihren Merkmalen in ähnlicher Weise unterscheiden wie die in den Leitlinien zur Auswahl von Böden für Versickerungsstudien (siehe vorstehende Tabelle 1) beschriebenen Böden. Dies gilt auch dann, wenn die betreffenden Kriterien nicht genau erfüllt werden.
28. Bei Versickerungstests mit 'gealterten Rückständen' ist eine Bodenprobe (12) mit einem Sandanteil von > 70 % und einem Anteil von 0,5-1,5 % an organischen Kohlenstoffen zu verwenden (z.B. Boden Nr. 4 in Tabelle 1). Wenn Daten zu den Transformationsprodukten hohe Bedeutung zukommt, müssen unter Umständen mehr Bodentypen verwendet werden.
29. Alle Böden sind mindestens hinsichtlich ihrer Textur (% Sand, % Schluff, % Ton nach FAO- und USDA-Klassifizierung (14)), des pH-Werts, der Kationenaustauschkapazität, des Anteils an organischen Kohlenstoffen, der Schüttdichte (bei gestörten Böden) und der Wasserrückhaltefähigkeit zu beschreiben. Die mikrobielle Biomasse muss nur für die Böden bestimmt werden, die während der Alterungs-/Inkubationsphase vor dem Versickerungstest mit den gealterten Rückständen verwendet werden. Angaben zu weiteren Eigenschaften der Böden (z.B. Klassifizierung, Tonmineralogie, spezifische Oberfläche) können bei der Interpretation der Prüfergebnisse hilfreich sein. Zur Bestimmung der Bodenbeschaffenheit können die in den Quellen (15)(16)(17) (18)(19) empfohlenen Methoden verwendet werden.
Entnahme und Lagerung der Böden
30. Die Böden sind aus der oberen Schicht (A-Horizont) bis zu einer Tiefe von höchstens 20 cm zu entnehmen. Pflanzenrückstände, Makrofauna und Steine sind zu entfernen. Die Böden (mit Ausnahme der zur Alterung der Prüfchemikalie verwendeten Böden) werden bei Raumtemperatur (vorzugsweise 20-25 °C) an der Luft getrocknet. Die Zerkleinerung des Materials ist unter möglichst geringem Kraftaufwand vorzunehmen, damit die ursprüngliche Textur des Bodens möglichst wenig verändert wird. Die Böden werden mit einem Sieb mit einer Maschenweite von ≤ 2 mm gesiebt. Eine sorgfältige Homogenisierung ist zu empfehlen, da dadurch die Reproduzierbarkeit der Ergebnisse verbessert wird. Vor der Verwendung können die Böden bei Raumtemperatur und lufttrocken aufbewahrt werden; (12). Zur Lagerfähigkeit werden keine Empfehlungen abgegeben; Böden, die aber länger als drei Jahre gelagert wurden, sollten vor der Verwendung nochmals auf ihren Gehalt an organischen Kohlenstoffen und auf ihren pH-Wert untersucht werden.
31. Zur Historie der Feldstandorte, an denen die Prüfböden entnommen wurden, sollten detaillierte Informationen verfügbar sein. Zu diesen Informationen zählen die genaue Lage (exakt definiert durch UTM (Universale Transversale Mercator-Projektion/European Horizontal Datum) oder geografische Koordinaten) sowie Bewuchs, Behandlungen mit Pestiziden, Behandlungen mit organischen und anorganischen Düngemitteln, biologische Anlagerungen oder unfallbedingte Verschmutzungen (12). Böden, die in den letzten vier Jahren mit der Prüfchemikalie oder mit strukturell analogen Stoffen behandelt wurden, dürfen für Versickerungsstudien nicht verwendet werden.
Prüfbedingungen
32. Während der Prüfung werden die Versickerungssäulen bei Raumtemperatur im Dunkeln aufbewahrt; wichtig ist, dass eine konstante Raumtemperatur (± 2 °C) besteht. Zu empfehlen sind Temperaturen zwischen 18 und 25 °C.
33. Die Oberfläche der Bodensäulen ist kontinuierlich mit künstlichem Regen (0,01 M CaCl2, 200 mm innerhalb von 48 Stunden) zu beregnen 3; diese Beregnungsmenge entspricht einem Niederschlag von 251 ml bei einer Wassersäule mit einem Innendurchmesser von 4 cm. Wenn für die Prüfung benötigt, kann die künstliche Beregnung modifiziert und die Dauer der Beregnung erhöht werden.
Prüfverfahren
Versickerung mit der Ausgangsprüfchemikalie
34. Mindestens zwei Bodensäulen werden bis zu einer Höhe von etwa 30 cm mit unbehandeltem, luftgetrockneten und (mit einer Maschenweite von < 2 mm) gesiebtem Bodenmaterial gefüllt. Um eine einheitliche Packung herzustellen, wird der Boden in kleinen Anteilen mit einem Löffel in die Säulen gegeben und mit einem Kolben unter leichtem Vibrieren der Säule verdichtet, bis die Bodensäule nicht mehr weiter nachgibt. Diese einheitliche Packung wird benötigt, um mit den Bodensäulen reproduzierbare Ergebnisse zu erzielen. Nähere Informationen zu Verfahren zum Packen der Säulen sind den Quellen (20), (21) und (22) zu entnehmen. Um die Reproduzierbarkeit des Packungsvorgangs kontrollieren zu können, wird das Gesamtgewicht der in die Säulen gepackten Böden ermittelt 4. Die beiden verwendeten Säulen müssen ein ähnliches Gewicht haben.
35. Nach dem Packen werden die Bodensäulen mit künstlichem Regen (0,01 M CaCl2) von unten nach oben gesättigt, um in den Bodenporen vorhandene Luft durch Wasser zu verdrängen. Anschließend wird gewartet, bis die Säulen im Gleichgewicht sind und das überschüssige Wasser abgelaufen ist. Methoden zur Sättigung der Säulen werden in (23) erläutert.
36. Anschließend werden die Prüfchemikalie und/oder die Referenzchemikalie in die Bodensäulen gegeben (siehe auch Nummern 23-25). Um eine homogene Verteilung zu erreichen, werden die Lösungen, Suspensionen oder Emulsionen der Prüfchemikalie und/oder der Referenzchemikalie gleichmäßig auf die Oberfläche der Bodensäulen aufgebracht. Wenn eine Einarbeitung in den Boden empfohlen wird, ist die Prüfchemikalie zunächst in eine geringe Menge (z.B. 20 g) des Bodens zu mischen und auf die Oberfläche der Bodensäule zu bringen.
37. Danach werden die Oberflächen der Bodensäulen mit einer Glassinterplatte, Glasperlen, Glasfaserfiltern oder einem runden Filterpapier bedeckt, damit der künstliche Regen gleichmäßig über die gesamte Fläche verteilt und die Oberfläche des Bodens nicht durch die Beregnungstropfen gestört wird. Je größer der Durchmesser der Säule, desto sorgfältiger ist bei der künstlichen Beregnung der Bodensäulen vorzugehen, um eine gleichmäßige Verteilung des künstlichen Regens über die gesamte Bodenfläche sicherzustellen. Der künstliche Regen wird danach mit einer Kolbenpumpe, einer peristaltischen Pumpe oder einem Tropftrichter auf die Bodensäulen getropft. Das Sickerwasser ist vorzugsweise in Fraktionen aufzufangen; die jeweiligen Mengen sind zu protokollieren 5.
38. Nach der Versickerung und dem Abtropfen der Säulen werden die Bodensäulen je nach den gemäß der Studie benötigten Informationen in eine geeignete Anzahl an Segmenten geteilt; die Segmente werden mit geeigneten Lösungsmitteln oder Lösungsmittelgemischen extrahiert und auf die Prüfchemikalie sowie ggf. auf Transformationsprodukte, die Gesamt-Radioaktivität und die Referenzchemikalie analysiert. Das Sickerwasser bzw. die Sickerwasserfraktionen werden unmittelbar nach der Extraktion auf die genannten Produkte untersucht. Wenn radioaktiv markierte Prüfchemikalien verwendet werden, sind alle Fraktionen mit > 10% der eingebrachten Radioaktivität zu ermitteln.
Auswaschen bei gealterten Rückständen
39. Frischer Boden (nicht zuvor luftgetrocknet) wird mit einer der Oberfläche der Bodensäulen angepassten Menge der radioaktiv markierten Prüfchemikalie (siehe Nummer 24) behandelt und unter aeroben Bedingungen gemäß Prüfmethode C.23 inkubiert (13). Die Inkubationsdauer (Alterungsdauer) muss so lang sein, dass erhebliche Mengen an Transformationsprodukten entstehen können; zu empfehlen ist eine Alterung über die Halbwertszeit der jeweiligen Prüfchemikalie 6; eine Dauer von 120 Tagen sollte aber nicht überschritten werden. Vor der Versickerung wird der gealterte Boden auf die Prüfchemikalie und ihre Transformationsprodukte analysiert.
40. Die Versickerungssäulen werden bis zu einer Höhe von 28 cm mit dem gleichen Boden (allerdings luftgetrocknet) wie im Alterungstest (siehe Nummer 34) gepackt; anschließend wird das Gesamtgewicht der gepackten Bodensäulen bestimmt. Danach werden die Bodensäulen vorgefeuchtet, wie in Nummer 35 erläutert.
41. Die Prüfchemikalie und ihre Transformationsprodukte werden in Form von gealterten Bodenrückständen (siehe Nummer 39) als 2 cm starkes Bodensegment auf die Oberfläche der Bodensäulen gebracht. Die Gesamthöhe der Bodensäulen (unbehandelter Boden + gealterter Boden) sollte nicht mehr als 30 cm betragen (siehe Nummer 34).
42. Die Versickerung wird vorgenommen, wie in Nummer 37 beschrieben.
43. Nach der Versickerung werden die Bodensegmente und das Sickerwasser auf die Prüfchemikalie, ihre Transformationsprodukte und nicht extrahierte Radioaktivität untersucht, wie in Nummer 38 erläutert. Um zu ermitteln, welcher Anteil der gealterten Rückstände in der obersten 2 cm starken Bodenschicht nach der Versickerung noch vorhanden ist, wird dieses Segment getrennt analysiert.
Auswertung der Ergebnisse
44. Die Anteile der Prüfchemikalie, der Transformationsprodukte und der nicht extrahierbaren radioaktiven Bestandteile sowie - wenn vorhanden - der Referenzchemikalie werden in Prozent bezogen auf die Ausgangsdosis der einzelnen Bodensegmente und der Sickerwasserfraktion angegeben. Für jede Säule werden die ermittelten Prozentanteile bezogen auf die jeweilige Bodentiefe grafisch dargestellt.
45. Wenn bei den Versickerungstests eine Referenzchemikalie verwendet wurde, kann die Versickerung der Referenzchemikalie auf einer relativen Skala anhand von relativen Mobilitätsfaktoren (RMF; Begriffsbestimmung siehe Anlage 3) bestimmt werden (1)(11); die RMF ermöglichen einen Vergleich der Versickerungsdaten verschiedener Chemikalien bei unterschiedlichen Bodentypen. Anlage 3 enthält Beispiele für RMF-Werte verschiedener Wirkstoffe in Pflanzenschutzmitteln.
46. Ungefähre Werte für Koc (auf organischen Kohlenstoff normalisierter Adsorptionskoeffizient) und Kom (auf organische Bestandteile normalisierter Verteilungskoeffizient) können ebenfalls aus den Ergebnissen des Versickerungstests abgeleitet werden; Ausgangsparameter sind die durchschnittliche Versickerungsstrecke oder festgestellte Korrelationen zwischen dem RMF und Kom bzw. Koc (4); alternativ kann von allgemeinen theoretischen Prinzipien der Chromatographie ausgegangen werden (24). Der letztgenannte Ansatz ist jedoch mit Vorsicht zu bewerten, insbesondere wenn das verwendete System während der Versickerung eher nicht gesättigt war.
Interpretation der Ergebnisse
47. Die bei dieser Methode beschriebenen Versickerungstests mit Bodensäulen ermöglichen die Ermittlung des Versickerungs- oder des Mobilitätspotenzials der Prüfchemikalie (bei Versickerungstests mit Ausgangsstoffen) und/oder bei ihren Transformationsprodukten (bei Versickerungstests mit gealterten Rückständen) aus bzw. in Böden. Aufgrund dieser Prüfungen können keine quantitativen Aussagen über das Versickerungsverhalten in der Natur getroffen werden; die Prüfungen können aber einen Maßstab für den Vergleich des 'Versickerungsverhaltens' eines Stoffs mit anderen Stoffen bieten, deren Versickerungsverhalten vielleicht bereits bekannt ist (24). Ebenso kann nicht ermittelt werden, welcher Prozentanteil des zugeführten Stoffs in das Grundwasser gelangen könnte (11). Die Ergebnisse der Versickerungstests mit Bodensäulen können aber einen Anhaltspunkt dafür bieten, ob bei Chemikalien mit hohem Mobilitätspotenzial in Labortests weitere Halbfreiland- und Freilandstudien durchgeführt werden müssen.
Prüfbericht
48. Der Prüfbericht enthält die folgenden Angaben:
Prüfchemikalie und Referenzchemikalie (sofern verwendet):
Im Test verwendete Böden:
Prüfbedingungen:
Prüfergebnisse:
(1) Guth, J.A., Burkhard, N., und Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
(2) Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals - T.R. Roberts and P.C. Kearney, Hrsg.). J. Wiley & Sons.
(3) Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanolwater partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, 1050-1059.
(4) Chiou, C.T., Porter, P.E., und Schmedding, D.W. (1983). Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227-231.
(5) Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26-33.
(6) US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
(7) Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
(8) Anhang I der Richtlinie 95/36/EG der Kommission vom 14. Juli 1995 zur Änderung der Richtlinie 91/414/EWG über das Inverkehrbringen von Pflanzenschutzmitteln, ABl. Nr. L 172, 22.7.1995, S. 8.
(9) Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
(10) BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
(11) SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
(12) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italien, 18.-20. Januar 1995.
(13) Die folgenden Kapital in diesem Anhang:
Kapitel A.4, DampfdruckKapitel A.6, Wasserlöslichkeit
Kapitel A.8, Verteilungskoeffizient, Schüttelmethode
Kapitel A.24, Verteilungskoeffizient, HPLC-Methode
Kapitel C.7, Abbaubarkeit - abiotischer Abbau: Hydrolyse in Abhängigkeit vom pH
Kapitel C.18, Adsorption/Desorption nach einer Schüttelmethode
Kapitel C.23, Aerobe und anaerobe Transformation im Boden
(14) Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) und Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
(15) Methods of Soil Analysis (19821986). Part 2, Chemical1, Physical and Microbiological Properties Mineralogical Methods (A.L. Page, R.H. Miller und D.R. Kelney, Eds Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
(16) Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller und D. R. Kelney, Hrsg.). Agronomy Series No. 9, 2nd Edition.
(17) ISO Standard Compendium Environment (1994). Soil Quality - General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
(18) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
(19) Scheffer, F., und Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
(20) Weber, J.B., und Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73-78.
(21) Weber, J.B., Swain, L.R., Strek, H.J., und Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190-200.
(22) Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49-53.
(23) Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. - A review. J. Contam. Hydrol. 7, 177-217.
(24) Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Hrsg.), 115-133. Plenum Press, New York.
(25) OECD (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Paris
_____________
1) Säulenversickerungsstudien von Pflanzenschutzmitteln können Aufschluss über die Mobilität einer Prüfchemikalie und seine Transformationsprodukte geben und Batch-Adsorptionsstudien ergänzen.
2) Die zu applizierende Menge bei zylindrischen Bodensäulen kann mit der folgenden Formel berechnet werden:
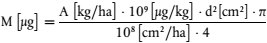
Dabei sind:
M = in die Säule eingebrachte Menge [µg]
A = Applikationsrate [kg · ha- 1]
D = Durchmesser der Bodensäule [cm]
π = 3,14.
3) Dies entspricht einem äußerst starken Niederschlag. Der durchschnittliche jährliche Niederschlag beträgt beispielsweise in Mitteleuropa 800-1.000 mm.
4) Gestörte Böden haben etwa folgende Schüttdichten (Beispiele):
Sandboden 1,66 g · ml- 1
lehmiger Sandboden 1,58 g · ml- 1
Lehmboden 1,17 g · ml- 1
Schluffboden 1,11 ·g ml- 1
5) Typische Mengen an Sickerwasser sind etwa 230-260 ml (entsprechend ca. 92-104 % der gesamten künstlichen Beregnung (251 ml)) bei Säulen mit einem Durchmesser von 4 cm und einer Höhe von 30 cm.
6) Im Boden können mehrere Haupttransformationsprodukte zu unterschiedlichen Zeitpunkten im Verlauf einer Abbaustudie entstehen. In diesen Fällen müssen unter Umständen Versickerungsstudien mit gealterten Rückständen unterschiedlicher Altersstadien durchgeführt werden.
| Begriffsbestimmungen und Einheiten | Anlage 1 |
Gealterte Bodenrückstände: Prüfchemikalie und Transformationsprodukte, die nach der Applikation und nach einem hinreichend langen Zeitraum für Transport-, Adsorptions-, Stoffwechsel- und Ableitungsprozesse zur Änderung der Verteilung und der chemischen Beschaffenheit eines Anteils des zugeführten Stoffs noch im Boden vorhanden sind (1).
Künstlicher Regen: 0,01 M CaCl2-Lösung in destilliertem oder entionisiertem Wasser.
Durchschnittliche Versickerungsstrecke (leaching distance): [normaler Versickerungstest] unterste Schicht des Bodensegments, in der die Summe des wiedergefundenen Stoffs 50 % der insgesamt wiedergefundenen Prüfchemikalie entspricht, oder: [ Versickerungstest mit gealterten Rückständen] unterste Schicht des Bodensegments, in der die Summe der wiedergefundenen Chemikalie 50 % der insgesamt wiedergefundenen Prüfchemikalie entspricht - (Höhe der Schicht mit den gealterten Rückständen) / 2).
Chemikalie: ein Stoff oder ein Gemisch
Sickerwasser: wässrige Phase, die durch ein Bodenprofil oder eine Bodensäule gesickert ist (1). Versickerung: Prozess, bei dem sich ein Stoff abwärts durch ein Bodenprofil oder eine Bodensäule bewegt (1).
Versickerungsstrecke: Unterstes Bodensegment, in dem nach der Versickerung eine Konzentration von ≥ 0,5 % der zugeführten Prüfchemikalie oder der gealterten Rückstände ermittelt wurde (entspricht der Eindringtiefe).
Nachweisgrenze (LOD = Limit of Detection) und Quantifizierungsgrenze (LOQ = Limit of Quantification): Als Nachweisgrenze (LOD) wird die Konzentration einer Chemikalie bezeichnet, unter der die Chemikalie nicht mehr von analytischen Artefakten unterschieden werden kann. Als Quantifizierungsgrenze (LOQ) gilt die Konzentration einer Chemikalie, unter der die Konzentration nicht mehr mit annehmbarer Genauigkeit bestimmt werden kann.
RMF, relativer Mobilitätsfaktor: (Versickerungsstrecke der Prüfchemikalie (cm)) / (Versickerungsstrecke der Referenzchemikalie (cm))
Prüfchemikalie: Stoff oder Gemisch, der/das mit dieser Prüfmethode getestet wird.
Transformationsprodukt: alle aus biotischen und abiotischen Transformationsreaktionen der Prüfchemikalie entstandenen Chemikalien einschließlich CO2 und der an Rückstände gebundenen Produkte.
Boden: ein Gemisch mineralischer und organisch-chemischer Bestandteile, wobei letztere Verbindungen mit hohem Kohlenstoff- und Stickstoffgehalt sowie einem hohen Molekulargewicht enthalten und mit kleinen (zumeist Mikro-) Organismen belebt sind; Boden kann in zwei Zustandsformen vorliegen:
_____
(1) Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167-1193.
(2) OECD Test Guideline 304 A: Inherent Biodegradability in Soil (angenommen am 12. Mai 1981).
| Anlage 2 |
Abbildung 1Nicht teilbare Versickerungssäulen aus Glas (Beispiel);
Länge 35 cm, Innendurchmesser 5 cm (1)

(1) Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden - 70 Jahre Agrarforschung der BASF AG, 225-236. Verlag Wissenschaft und Politik, Köln.
Abbildung 2 Teilbare Metallsäule mit 4 cm Innendurchmesser (Beispiel) (1)

(1) Burkhard, N., Eberle D.O., und Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203-213
| Relative Mobilitätsfaktoren * (RMF) der Chemikalien einiger Pflanzenschutzmittel (Beispiele) (1)(2) und entsprechende Mobilitätsklassen + | Anlage 3 |
| RMF-Bereich | Chemikalie (RMF) | Mobilitätsklasse |
| < 0,15 | Parathion (< 0,15), Flurodifen (0,15) | I immobil |
| 0,15 - 0,8 | Profenophos (0,18), Propiconazol (0,23), Diazinon (0,28), Diuron (0,38), Terbuthylazin (0,52), Methidathion (0,56), Prometryn (0,59), Propazin (0,64), Alachlor (0,66), Metolachlor (0,68) | II leicht mobil |
| w 0,8 - 1,3 | Monuron ** (1,00), Atrazin (1,03), Simazin (1,04), Fluometuron
(1,18) | III mäßig mobil |
| 1,3 - 2,5 | Prometon (1,67), Cyanazin (1,85), Bromacil (1,91), Karbutilat (1,98) | IV verhältnismäßig mobil |
| 2,5 - 5,0 | Carbofuran (3,00), Dioxacarb (4,33) | V mobil |
| > 5,0 | Monocrotophos (> 5,0), Dicrotophos (> 5,0) | VI sehr mobil |
| *) Der relative Mobilitätsfaktor wird wie folgt ermittelt (3):
**) Referenzchemikalie | ||
_______
(1) Guth, J.A. (1985). Adsorption/desorption. In Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment". Canterbury, UK, 1.-3. Juli 1985.
(2) Guth, J.A., und Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91-106.
(3) Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, 214-216.
(4) Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743-748.
(5) McCall, P.J., Laskowski, D.A., Swann, R.L., und Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
(6) Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and and Water, 165-174.
C.45. Abschätzung der Emissionen von mit Holzschutzmitteln behandeltem Holz in die Umwelt: Labormethode für unbeschichtete Holzprodukte, die mit Süsswasser oder mit Meerwasser in Berührung kommen 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 313 (2007). Die Emissionen aus mit Holzschutzmitteln behandeltem Holz in die Umwelt müssen quantifiziert werden, um das mit behandeltem Holz verbundene Umweltrisiko bewerten zu können. Diese Prüfmethode beschreibt eine Labormethode zur Abschätzung der Emissionen aus mit Holzschutzmitteln behandeltem Holz in zwei Situationen, bei denen Emissionen in die Umwelt gelangen könnten:
2. Diese Prüfmethode ist zur Ermittlung der Emissionen aus Hölzern und Holzprodukten vorgesehen, die nicht abgedeckt sind und mit Süßwasser oder mit Meerwasser in Berührung kommen. International werden Gebrauchsklassen verwendet, um die biologische Gefährdung zu beschreiben, der behandelte Holzprodukte ausgesetzt sind. Außerdem beschreiben die Klassen die Verwendungssituation der behandelten Produkte und die Umweltbereiche (Luft, Wasser, Boden), die potenziell durch das mit Holzschutzmitteln behandelte Holz gefährdet sein könnten.
3. Die Prüfmethode besteht in einem Laborverfahren zur Gewinnung von Proben (Eluaten) aus dem Wasser, in die das behandelte Holz untergetaucht wurde; die Probenahme erfolgt nach zunehmenden Expositionsintervallen. Die Menge der Emissionen im Eluat hängt von der Oberfläche des Holzes und von der Expositionsdauer ab; zu ermitteln ist die Emissionsrate in mg/m2/Tag. Auf diese Weise kann die Emissionsrate (die Auswaschungsrate) bei zunehmender Expositionsdauer abgeschätzt werden.
4. Die Menge der Emissionen kann als Parameter in Bewertungen des Umweltrisikos von behandeltem Holz verwendet werden.
5. Das Auswaschverhalten der Holzoberfläche mit Süßwasser wird hinsichtlich der Art und des Umfangs der Auswaschung nicht als gleichwertig mit dem Auswaschverhalten einer Holzoberfläche durch Meerwasser betrachtet. Für Holzschutzmittel oder entsprechende Gemische zur Behandlung von Holz, das mit Meerwasser in Berührung kommt, muss ein Auswaschungstest mit Meerwasser durchgeführt werden.
6. Mit einem Holzschutzmittel behandeltes Holz muss für das im Handel angebotene Holz repräsentativ sein. Es muss entsprechend den Anweisungen des Holzschutzmittelherstellers sowie unter Berücksichtigung der geltenden Normen und Spezifikationen behandelt worden sein. Parameter einer Nachbehandlung des Holzes zur Konditionierung vor Testbeginn sind zu spezifizieren.
7. Die verwendeten Holzproben müssen für die verwendeten Erzeugnisse repräsentativ sein (bezüglich der jeweiligen Art, der Dichte und sonstiger Merkmale).
8. Die Prüfung kann in Verbindung mit einer Druckimprägnierung (Penetrationsverfahren) oder einer Oberflächlenbehandlung sowie mit Holz durchgeführt werden, das eine zusätzliche obligatorische Oberflächenbehandlung erhält (z.B. eine Lackierung als Voraussetzung für die wirtschaftliche Nutzung).
9. Zusammensetzung, Menge, pH-Wert und physikalische Beschaffenheit des Wassers sind für die Bestimmung des Umfangs, der Art und der Beschaffenheit der von dem Holz ausgehenden Emissionen von Bedeutung.
10. Proben von mit Holzschutzmitteln behandeltem Holz werden in Wasser eingetaucht. Von dem Wasser (Eluat) werden im Laufe des Expositionszeitraumes hinreichend oft Proben entnommen und analysiert, um statistische Berechnungen vornehmen zu können. Aus den Ergebnissen der Analysen werden die Emissionsraten in mg/m2/ Tag berechnet. Die Zeitintervalle der Probenahmen sind zu protokollieren. Prüfungen mit unbehandelten Proben können abgebrochen werden, wenn für die ersten drei Datenpunkte keine Hintergrundkonzentration festgestellt wurde.
11. Die Berücksichtigung unbehandelter Holzproben ermöglicht die Bestimmung von Hintergrundkonzentrationen der Eluate aus dem Holz, die nicht auf das verwendete Holzschutzmittel zurückzuführen sind.
Genauigkeit
12. Die Genauigkeit der Prüfmethode zur Abschätzung der Emissionen hängt von der Repräsentativität der in der Prüfung verwendeten Proben für das handelsübliche Holz, der Repräsentativität des Wassers für natürliches Wasser und von der Repräsentativität des Expositionsschemas für die natürlichen Gegebenheiten ab.
13. Die Genauigkeit, die Präzision und die Wiederholbarkeit der Analysemethode sind vor Beginn der Prüfung zu ermitteln.
Reproduzierbarkeit
14. Drei Wasserproben werden entnommen und analysiert; der Mittelwert der Proben ist als Emissionswert anzunehmen. Die Reproduzierbarkeit der Ergebnisse innerhalb eines Labors und zwischen den verschiedenen Labors hängt vom Tauchprotokoll und von den verwendeten Holzproben ab.
Annehmbare Wertebereiche
15. Ein Ergebnisspektrum, bei dem die oberen und die unteren Werte um weniger als eine Größenordnung voneinander entfernt sind, ist bei dieser Prüfung annehmbar.
Wasser
16. Szenarien für die Auswaschung in Süßwasser: Für den Auswaschungstest wird demineralisiertes Wasser (z.B. ASTM D 1193 Typ II) empfohlen, wenn das zu bewertende Holz Süßwasser ausgesetzt wird. Die Wassertemperatur muss bei 20 +/- 2 °C liegen; der gemessene pH-Wert und die Wassertemperatur sind im Prüfbericht zu vermerken. Mittels einer Analyse der Wasserproben, die vor dem Tauchen der behandelten Proben entnommen wurden, kann der Anteil der zu untersuchenden Stoffe im Wasser abgeschätzt werden. Auf diese Weise können die Hintergrundkonzentrationen von Chemikalien ermittelt werden, welche anschließend einer chemischen Analyse unterzogen werden.
17. Szenarien für die Auswaschung in Meerwasser: Für den Auswaschungstest wird künstliches Meerwasser (z.B. ASTM D 1141, künstliches Meerwasser ohne Schwermetalle) empfohlen, wenn das zu bewertende Holz Meerwasser ausgesetzt wird. Die Wassertemperatur muss bei 20 +/- 2 °C liegen; der gemessene pH-Wert und die Wassertemperatur sind im Prüfbericht zu vermerken. Mittels einer Analyse der Wasserproben, die vor dem Tauchen der behandelten Proben entnommen wurden, kann der Anteil der zu untersuchenden Chemikalien im Wasser abgeschätzt werden. Diese Kontrolle ist für die Analyse der Hintergrundkonzentrationen relevanter Chemikalien von Bedeutung.
Im Test zu verwendende Holzproben
18. Die Holzproben müssen typisch für die tatsächlich zur Prüfung der Wirksamkeit von Holzschutzmitteln verwendete Holzart sein. Empfohlene Arten sind Pinus sylvestris L. (Waldkiefer), Pinus resinosa Ait. (Rotkiefer) und Pinus spp (Südkiefer). Mit anderen Arten können weitere Prüfungen durchgeführt werden.
19. Für die Prüfungen ist geradfaseriges astfreies Holz zu verwenden. Harziges Material ist zu vermeiden. Das Holz muss von typischer handelsüblicher Beschaffenheit sein. Herkunft, Dichte und Anzahl der Jahresringe sind jeweils bezogen auf eine Breite von 10 mm zu protokollieren.
20. Zu empfehlen sind immer jeweils fünf Holzproben in Form von Klötzen gemäß EN 113 (25 mm × 50 mm × 15 mm), deren Längsseiten parallel zur Faser verlaufen; es können aber auch andere Abmessungen (z.B. 50 mm × 150 mm × 10 mm) verwendet werden. Die Holzproben sollten vollständig von Wasser bedeckt sein. Sie müssen vollständig aus Splintholz bestehen. Die Proben werden jeweils individuell gekennzeichnet, damit sie während des gesamten Tests identifiziert werden können.
21. Alle Proben werden gehobelt oder flach gesägt; die Oberflächen dürfen nicht geschmirgelt werden.
22. Für jede Analyse sind mindestens fünf Gruppen von Holzproben zu verwenden: Drei Gruppen werden mit einem Holzschutzmittel behandelt, eine Gruppe wird nicht behandelt und eine Gruppe wird zur Ermittlung des Feuchtegehalts der unbehandelten Proben nach der Ofentrocknung verwendet. Es werden hinreichend viele Proben hergestellt, damit drei Probengruppen ausgewählt werden können, bei denen die Werte für die Aufnahme des Holzschutzmittels im Bereich von +/- 5 % um die mittleren Aufnahmewerte aller Proben liegen.
23. Alle Proben werden auf der Stirnseite mit einer Chemikalie versiegelt, die das Eindringen des Holzschutzmittels in die Stirnseite und die Auswaschung über die Stirnseite verhindert. Beim Aufbringen der Versiegelung ist zwischen Proben zur Prüfung einer Oberflächenbehandlung und Proben zur Prüfung einer Druckimprägnierung zu unterscheiden. Die Aufbringung der Versiegelung auf der Stirnseite muss nur bei der oberflächlichen Applikation vor der Behandlung erfolgen.
24. Bei einer Druckimprägnierung muss die Stirnseite für die Holzschutzmittel durchlässig sein. Daher müssen die Proben am Ende der Vorbehandlung versiegelt werden. Die Emissionen sind ausschließlich für die Fläche auf der Längsseite zu bestimmen. Die Versiegelungen sind zu prüfen und gegebenenfalls zu erneuern, bevor mit der Auswaschung begonnen wird. Nach Beginn der Auswaschung darf die Versiegelung nicht noch einmal aufgetragen werden.
Tauchbehältnis
25. Das Behältnis besteht aus inertem Material und ist groß genug zur Aufnahme von fünf Holzproben nach EN113 in 500 ml Wasser bei einem Oberflächen-Wasservolumen-Verhältnis von 0,4 cm2/ml.
Versuchsaufbau (Proben)
26. Die Proben werden so aufgebaut, dass alle exponierten Flächen der Proben mit Wasser in Berührung kommen.
Vorbereitung der behandelten Proben
27. Die Holzproben, die mit dem zu untersuchenden Holzschutzmittel behandelt werden sollen, werden nach dem für das jeweilige Holzschutzmittel beschriebenen Verfahren behandelt; in Betracht kommen eine Druckimprägnierung sowie eine Oberflächlichenapplikation (etwa durch Tauchen, Sprühen oder Streichen).
Schutzmittel die mit einer Druckimprägnierung eingebracht werden
28. Von dem zu prüfenden Holzschutzmittel wird eine Lösung so hergestellt, dass die spezifizierte Aufnahme oder Retention erreicht wird, wenn das Mittel mit einer Druckimprägnierung eingebracht wird. Die Holzprobe wird gewogen und gemessen. Das Verfahren zur Druckimprägnierung ist durchzuführen, wie für die Applikation des Holzschutzmittels für Holz zur Verwendung gemäß den Gebrauchsklassen 4 oder 5 vorgesehen. Nach der Behandlung wird die Probe nochmals gewogen und mit der folgenden Gleichung die Retention des Holzschutzmittels (kg/m3) berechnet:
|
Masse nach Behandlung (kg)- Masse vor Behandlung (kg) | Konzentration der Lösung (%Masse/ Masse) | |
|
| × |
|
|
Volumen der Probe (m3 ) |
100 |
29. Für diesen Test kann in einer Industrieanlage (z.B. durch Vakuumdruckimprägnierung) behandeltes Holz verwendet werden. Die Aufnahmewerte des auf diese Weise behandelten Materials werden ermittelt und sind ebenso wie die verwendeten Verfahren zu protokollieren.
Durch Oberflächlichenapplikation aufzubringende Holzschutzmittel
30. Die Oberflächlichenapplikation kann u. a. durch Tauchen, Sprühen oder Streichen der Holzproben erfolgen. Das Verfahren und die Dosis des Holzschutzmittels (z.B. in l/m2) richten sich nach den Spezifikationen für die oberflächliche Aufbringung des jeweiligen Mittels.
31. Auch in diesem Fall kann in einer Industrieanlage behandeltes Holz für den Test verwendet werden. Die Retentionswerte des auf diese Weise behandelten Materials werden ermittelt und sind ebenso wie die verwendeten Verfahren zu protokollieren.
Weitere Konditionierung der Proben nach der Behandlung
32. Nach der Behandlung werden die behandelten Proben gemäß den Empfehlungen des Holzschutzmittelherstellers auf dem Etikett des Holzschutzmittels bzw. gemäß den bei gewerblicher Verwendung üblichen Verfahren oder nach der Norm EN 252 weiter konditioniert.
Konditionierung und Auswahl der Proben
33. Im Anschluss an die Nachbehandlung wird die mittlere Retention der jeweiligen Probengruppe berechnet, und drei repräsentative Probengruppen mit Retentionswerten im Bereich von +/- 5 % um den Mittelwert der Gruppe werden zufällig für die Auswaschungsmessungen ausgewählt.
Messung der von den Holzschutzmitteln ausgehenden Emissionen
Tauchverfahren
34. Die Proben werden gewogen und anschließend vollständig in Wasser getaucht; Datum und Uhrzeit werden protokolliert. Um die Verdunstung zu reduzieren, werden die Behältnisse abgedeckt.
35. Das Wasser wird in folgenden Intervallen gewechselt: nach 6 Stunden, 1 Tag, 2 Tagen, 4 Tagen, 8 Tagen, 15 Tagen, 22 Tagen, 29 Tagen. (Hinweis: Dies sind Zeiträume und keine Zeitpunkte.) Zeitpunkt und Datum der Wasserwechsel und die Masse des aus den Behältnissen entnommenen Wassers sind zu protokollieren.
36. Nach jedem Wasserwechsel wird eine Probe des Wassers, in das die Holzproben eingetaucht waren, zur anschließenden chemischen Analyse aufbewahrt.
37. Das Probenahmeverfahren ermöglicht die zeitbezogenen Berechnung des Profils der Emissionsmengen. Die Proben sind unter Bedingungen aufzubewahren, bei denen der Analyt nicht beeinträchtigt wird (z.B. in einem Kühlschrank und vor Lichteinfall geschützt, um die Entwicklung von Mikroorganismen in der Probe vor der Analyse zu reduzieren).
Behandelte Proben
38. Das entnommene Wasser wird chemisch auf den Wirkstoff und/oder - so weit von Bedeutung - auf relevante Abbau-/Transformationsprodukte untersucht.
Unbehandelte Proben
39. Die Entnahme des Wassers (Eluat) bei diesem System und die anschließende Analyse der aus den unbehandelten Holzproben ausgewaschenen Chemikalien ermöglichen die Abschätzung der potenziellen Emissionsrate des Holzschutzmittels bei dem unbehandelten Holz. Wenn das Eluat nach jeweils längeren Expositionszeiträumen entnommen und analysiert wird, kann die Geschwindigkeit abgeschätzt werden, mit der sich die Emissionsrate im Laufe der Zeit ändert. Dieses Kontrollverfahren dient zur Ermittlung von Hintergrundkonzentrationen der Prüfchemikalie bei unbehandeltem Holz und soll sicherstellen, dass die verwendeten Holzproben tatsächlich nicht vorher mit dem Holzschutzmittel behandelt wurden.
Chemische Analysen
40. Das entnommene Wasser wird chemisch analysiert, und die Ergebnisse der Analyse werden in geeigneten Einheiten angegeben (z.B. in µg/l).
Datenerfassung
41. Alle Ergebnisse werden protokolliert. In der Anlage sind ein Berichtsformular für eine Gruppe behandelter Proben und die Übersichtstabelle zur Berechnung der mittleren Emissionswerte für die jeweiligen Expositionszeiträume dargestellt.
42. Die tägliche Emissionsrate in mg/m2/Tag wird berechnet, indem der Mittelwert der drei Messungen der drei Replikate durch die Anzahl der Tage im Tauchbad geteilt wird.
Prüfbericht
43. Der Prüfbericht muss mindestens folgende Angaben enthalten:
(1) Europäische Norm, EN 84 - 1997. Holzschutzmittel - Beschleunigte Alterung von behandeltem Holz vor biologischen Prüfungen - Auswaschbeanspruchung.
(2) Europäische Norm, EN 113/A1 - 2004. Holzschutzmittel - Prüfverfahren zur Bestimmung der vorbeugenden Wirksamkeit gegen holzzerstörende Basidiomyceten - Bestimmung der Grenze der Wirksamkeit.
(3) Europäische Norm, EN 252 - 1989; Holzschutzmittel; Freiland-Prüfverfahren zur Bestimmung der relativen Schutzwirkung eines Holzschutzmittels im Erdkontakt.
(4) Europäische Norm, EN 335 - Teil 1: 2006. Dauerhaftigkeit von Holz und Holzprodukten - Definition der Gebrauchsklassen - Teil 1: Allgemeines.
(5) American Society for Testing and Materials Standards, ASTM D 1141 - 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
(6) American Society for Testing and Materials Standards, ASTM D 1193-77 Type II - 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
| Berichtsformular für das Prüfverfahren | Anlage 1 |
Abschätzung der Emissionen von mit Holzschutzmitteln behandeltem Holz in die Umwelt: Labormethode für unbeschichtete Holzprodukte, die mit Süßwasser oder mit Meerwasser in Berührung kommen
| Prüfinstitut | |
| Holzschutzmittel | |
| Hersteller des Holzschutzmittels | |
| spezifischer und individueller Name oder Code des Holzschutzmittels | |
| Handelsname oder Trivialname des Holzschutzmittels | |
| Beistoffe | |
| Relevante Retention (Schutzmittelaufnahme) des Holzes, das mit Wasser in Berührung kommt | |
| Anwendung | |
| Applikationsverfahren | |
| Datum der Applikation | |
| Formel zur Berechnung der Retention: | |
| Vorbehandlungsverfahren | |
| Dauer der Vorbehandlung | |
| Mittel zur Versiegelung der Stirnseite / Anzahl der Behandlungen | |
| Folgebehandlung | (gegebenenfalls) |
| Proben | |
| Holzart | |
| Dichte des Holzes | (Mindestwert... Mittelwert... Höchstwert) |
| Wachstumsrate (Ringe je 10 mm) | (Mindestwert... Mittelwert... Höchstwert) |
| Feuchtegehalt | |
| Versuchsaufbau (*) | Retention (z.B. kg/m3) |
| Behandelt: 'x' | Mittelwert und Standardabweichung oder Bereich bei 5 Proben |
| Behandelt: 'y' | Mittelwert und Standardabweichung oder Bereich bei 5 Proben |
| Behandelt: 'z' | Mittelwert und Standardabweichung oder Bereich bei 5 Proben |
| Unbehandelt | |
| Variable Prüfparameter | (z.B. Wasserqualität oder Abmessungen der Proben) |
| *) x, y und z bezeichnen die drei Replikate. | |
| Zeit | Wasseraus- tausch | Probenmasse | Wasseraufnahme | Wasserprobe | ||||||
| Behandelt (Mittelwert) | Unbehandelt | Behandelt (Mittelwert) | Unbehandelt | Testwasser | X | y | Z | |||
| Datum | g | g | g | g | Nr. | pH-Wert | pH-Wert | pH-Wert | pH-Wert | |
| Start | ||||||||||
| 6 h | 1 | |||||||||
| 24 h | 2 | |||||||||
| 2 d | 3 | |||||||||
| 4 d | 4 | |||||||||
| 8 d | 5 | |||||||||
| 15 d | 6 | |||||||||
| 22 d | 7 | |||||||||
| 29 d | 8 | |||||||||
Für jeden Wirkstoff sind eigene Tabellen zu erstellen.
| Zeit | Wasseraus- tausch | Analyseergebnisse | ||||||||||||||
| Unbehandelte Proben | Behandelte Proben | |||||||||||||||
| Wirkstoffkon- zentration in Wasser mg/l | Abgegebene Menge mg/m2 | Emissionsrate mg/m2/d | Wirkstoffkonzentration in Wasser | Abgegebene Menge | Emissionsrate | |||||||||||
| x | y | z | Mittel- wert | x | y | z | Mittel- wert | x | y | z | Mittel- wert | |||||
| Datum | mg/l | mg/l | mg/l | mg/l | mg/m2 | mg/m2 | mg/m2 | mg/m2 | mg/m2/d | mg/m2/d | mg/m2/d | mg/m2/d | ||||
| 6 h | ||||||||||||||||
| 24 h | ||||||||||||||||
| 2 d | ||||||||||||||||
| 4 d | ||||||||||||||||
| 8 d | ||||||||||||||||
| 15 d | ||||||||||||||||
| 22 d | ||||||||||||||||
| 29 d | ||||||||||||||||
Hinweis: Da die Emissionsraten behandelter Proben unter Umständen anhand der Ergebnisse unbehandelter Proben korrigiert werden müssen, sind zunächst die Ergebnisse der unbehandelten Proben anzugeben; alle Werte der behandelten Proben sind dann 'berichtigte Werte'. Außerdem muss unter Umständen eine Berichtigung der ursprünglichen Wasseranalyse vorgenommen werden.
| Begriffsbestimmungen | Anlage 2 |
Chemikalie: ein Stoff oder ein Gemisch
Prüfchemikalie: Stoff oder Gemisch, der/das mit dieser Prüfmethode getestet wird.
C.46. Bioakkumulation in sedimentbewohnenden benthischen Oligochaeten 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 315 (2008). Sedimentfressende endobenthische Tiere können den in den Sedimenten gebundenen Stoffen ausgesetzt sein (1). Unter diesen sedimentfressenden Tieren kommt den aquatischen Oligochaeten große Bedeutung für die Sedimente aquatischer Systeme zu. Aquatische Oligochaeten leben in den Sedimenten und sind häufig die am meisten verbreitete Art, insbesondere in Lebensräumen mit für andere Tiere ungünstigen Umweltbedingungen. Durch Bioturbation der Sedimente und als Beutetiere haben sie erheblichen Einfluss auf die Bioverfügbarkeit dieser Stoffe für andere Organismen (z.B. benthivore Fischarten). Im Gegensatz zu epibenthischen Organismen graben sich endobenthische aquatische Oligochaeten in die Sedimente ein und nehmen unter der Oberfläche der Sedimente befindliche Partikel auf. Daher sind diese Organismen über viele Expositionspfade vorhandenen Stoffen ausgesetzt (u. a. durch direkten Kontakt und durch Aufnahme von kontaminierten Sedimentpartikeln, Porenwasser und Überstandswasser). In Anlage 6 sind einige Arten benthischer Oligochaeten beschrieben, die gegenwärtig in ökotoxikologischen Untersuchungen verwendet werden.
2. Zu den charakteristischen Parametern der Bioakkumulation eines Stoffs gehören an erster Stelle der Bioakkumulationsfaktor (BAF), die Konstante der Sedimentaufnahme (ks) und die Eliminationskonstante (ke). Ausführliche Definitionen dieser Parameter sind Anlage 1 zu entnehmen.
3. Um das Bioakkumulationspotenzial von Stoffen im Allgemeinen zu beurteilen und um die Bioakkumulation von Stoffen zu untersuchen, die dazu neigen, sich in oder auf Sedimente zu verteilen, wird eine für diesen Umweltbereich spezifische Prüfmethode benötigt (1)(2)(3)(4).
4. Mit dieser Prüfmethode soll die Bioakkumulation sedimentgebundener Stoffe in endobenthischen Oligochaeten ermittelt werden. Der Prüfstoff wird in das Sediment dotiert. Durch die Verwendung eines dotierten Sediments soll ein kontaminiertes Sediment simuliert werden.
5. Diese Prüfmethode beruht auf bestehenden Methoden zur Prüfung der Toxizität von Sedimenten und zur Ermittlung der Bioakkumulation (1)(4)(5)(6)(7)(8)(9). Ebenfalls hilfreich sind die in einem internationalen Workshop (11) geführten Diskussionen und die dort erzielten Ergebnisse sowie das Ergebnis eines internationalen Ringtests (12).
6. Diese Prüfung bezieht sich auf stabile, neutrale organische Stoffe, die sich leicht an Sedimente binden. Die Bioakkumulation sedimentgebundener, stabiler metallorganischer Verbindungen kann mit dieser Methode ebenfalls gemessen werden (12). Für Metalle und sonstige Spurenelemente ist diese Methode nicht geeignet (11), wenn nicht vorher das Prüfprotokoll hinsichtlich des Substrats und der Wasservolumina sowie möglicherweise der Größe der Gewebeproben modifiziert wird.
Voraussetzungen und Informationen zum Prüfstoff
7. Zurzeit gibt es nur wenige allgemein anerkannte QSARs (Quantitative Structure-Activity Relationships = quantitative Struktur-Aktivitätsbeziehungen) für Bioakkumulationsprozesse (14). Die am weitesten verbreitete Beziehung ist die Korrelation zwischen der Bioakkumulation und der Biokonzentration stabiler organischer Stoffe und ihrer jeweiligen Lipophilität (ausgedrückt als Logarithmus des Oktanol-Wasser-Verteilungskoeffizienten (log Kow); Begriffsbestimmung siehe Anlage 1); diese Korrelation wurde entwickelt, um die Verteilung eines Stoffs zwischen Fischen und dem umgebenden Wasser zu beschreiben. Aufgrund dieser Beziehung wurden Korrelationen auch für den Sedimentbereich ermittelt (15)(16)(17)(18). Die Korrelation zwischen log Kow und log BCF als wichtiger QSAR kann für eine erste vorläufige Abschätzung des Bioakkumulationspotenzials sedimentgebundener Stoffe hilfreich sein. Der BAF (Bioakkumulationsfaktor) kann jedoch vom Lipidgehalt der Testorganismen und vom Anteil an organischen Kohlenstoffen im Sediment abhängen. Daher kann auch der Koeffizient für die Verteilung organischer Kohlenstoff/Wasser (Koc) als wichtige Determinante der Bioakkumulation sedimentgebundener organischer Stoffe dienen.
8. Diese Prüfung ist geeignet für:
9. Vor der Untersuchung sind Informationen zum Prüfstoff (z.B. Sicherheitsvorkehrungen, geeignete Lagerbedingungen/Stabilität und Analysemethoden) zu beschaffen. Weitere Hinweise zu Prüfstoffen mit physikalisch-chemischen Merkmalen, welche die Durchführung des Tests erschweren, sind den Quellen (20) und (21) zu entnehmen. Vor der Durchführung eines Bioakkumulationstests bei aquatischen Oligochaeten sollte Folgendes über den Prüfstoff bekannt sein:
Außerdem sind - soweit verfügbar - folgende Informationen von Interesse:
10. Radioaktiv markierte Prüfstoffe können die Analyse von Wasser, Sedimenten und biologischen Proben erleichtern; außerdem kann anhand radioaktiv markierter Prüfstoffe festgestellt werden, ob Abbauprodukte identifiziert und quantifiziert werden müssen. Die hier beschriebene Methode wurde in einem internationalen Ringtest (12) mit Stoffen validiert, die mit 14C markiert wurden. Wenn die Summe radioaktiver Rückstände gemessen wird, beruht der BAF (Bioakkumulationsfaktor) auf dem Ausgangsstoff einschließlich gebundener Abbauprodukte. Außerdem kann eine Untersuchung des Stoffwechsels mit einem Bioakkumulationstest kombiniert werden, indem der Prozentanteil des Ausgangsstoffs und seiner Abbauprodukte in Proben ermittelt wird, die am Ende der Aufnahmephase oder zum Zeitpunkt der maximalen Bioakkumulation entnommen wurden. In jedem Fall wird empfohlen, bei der Berechnung des BAF von der Konzentration des Ausgangsstoffs in den Organismen und nicht allein von der Summe der radioaktiven Rückstände auszugehen.
11. Zusätzlich zu den Merkmalen des Prüfstoffs werden Informationen über die Toxizität für die im Test zu verwendende Oligochaetenart benötigt (z.B. der Medianwert der letalen Konzentration (LC50) in der Aufnahmephase, um sicherzustellen, dass die ausgewählten Expositionskonzentrationen deutlich unter den toxischen Konzentrationen liegen. Nach Möglichkeit sind Toxizitätswerte zu verwenden, die in Langzeituntersuchungen subletaler Endpunkte (EC50) ermittelt wurden. Wenn derartige Daten nicht verfügbar sind, können Daten aus einem Test zur akuten Toxizität unter den Bedingungen des Bioakkumulationstests oder Toxizitätsdaten zu stellvertretenden Arten hilfreich sein.
12. Eine geeignete Analysemethode von bekannter Genauigkeit, Präzision und Empfindlichkeit sollte für die Quantifizierung des Prüfstoffs in den Testlösungen, im Sediment und im biologischen Material ebenso verfügbar sein wie Einzelheiten zur Probenvorbereitung und -aufbewahrung und Sicherheitsdatenblätter. Auch die analytischen Nachweisgrenzen des Prüfstoffs in Wasser, Sedimenten und Wurmgewebe sollten bekannt sein. Wenn ein radioaktiv markierter Prüfstoff verwendet wird, müssen auch die spezifische Radioaktivität (in Bq mol- 1), die Position des radioaktiv markierten Atoms und der Prozentanteil der an Verunreinigungen gebundenen Radioaktivität bekannt sein. Die spezifische Radioaktivität des Prüfstoffs sollte möglichst hoch sein, damit möglichst niedrige Prüfkonzentrationen nachgewiesen werden können (11).
13. Informationen zu Merkmalen des zu verwendenden Sediments (Herkunft oder Bestandteile des Sediments, pH- Wert und Ammoniakkonzentration des Porenwassers (Feldsedimente), Gehalt an organischen Kohlenstoffen (TOC), Partikelgrößenverteilung (Prozentanteile an Sand, Schluff und Ton), Trockenmasse in Prozent usw.) sollten verfügbar sein (6).
14. Der Test besteht aus zwei Phasen: der Aufnahme-(Expositions-)Phase und der Eliminations-(Post-Expositions-) Phase. In der Aufnahmephase werden die Würmer dem mit dem Prüfstoff dotierten Sediment ausgesetzt; das Sediment ist mit rekonstituiertem Wasser bedeckt, gegebenenfalls muss abgewartet werden, bis sich ein Gleichgewicht eingestellt hat (11). Gruppen mit Kontrollwürmern werden unter identischen Bedingungen, aber ohne den Prüfstoff kultiviert.
15. Für die Eliminationsphase werden die Würmer in ein prüfstofffreies Sediment-Wasser-System umgesetzt. Um Informationen über die Geschwindigkeit zu erhalten, mit der der Prüfstoff durch die Testorganismen ausgeschieden wird, ist eine Eliminationsphase grundsätzlich erforderlich (19)(25). Die Eliminationsphase ist nur dann verzichtbar, wenn der Prüfstoff in der Expositionsphase nur in unerheblichem Umfang aufgenommen wurde (d. h., wenn beispielsweise kein statistisch signifikanter Unterschied zwischen der Konzentration des Prüfstoffs in den Würmern der Prüf- und Kontrollansätze besteht). Wenn in der Aufnahmephase kein Gleichgewichtszustand erreicht wurde, kann aufgrund der Ergebnisse in der Eliminationsphase die Kinetik - BAFk, und die Konstante(n) der Aufnahme- und der Eliminationsrate - bestimmt werden. Die Konzentration des Prüfstoffs in/an den Würmern wird während der beiden Phasen durchgehend auf Veränderungen überwacht.
16. In der Aufnahmephase werden Messungen vorgenommen, bis der BAF ein Plateau oder einen Gleichgewichtszustand erreicht hat. Die Aufnahmephase beträgt in der Regel 28 Tage. Praktische Erfahrungen haben gezeigt, dass bei verschiedenen stabilen, neutralen organischen Stoffen bereits in einer Aufnahmephase von 12- 14 Tagen ein Gleichgewichtszustand erreicht wird (6)(8)(9).
17. Wenn auch nach 28 Tagen kein Gleichgewichtszustand erreicht wird, beginnt die Eliminationsphase, indem die exponierten Oligochaeten in Gefäße mit demselben Medium, aber ohne den Prüfstoff umgesetzt werden. Die Eliminationsphase wird beendet, wenn entweder 10 % der an Tag 28 der Aufnahmephase in den Würmern gemessenen Konzentration erreicht ist oder nachdem maximal 10 Tage vergangen sind. Die Rückstandskonzentrationen in den Würmern am Ende der Eliminationsphase werden als zusätzlicher Endpunkt protokolliert (z.B. als NER (nicht eliminierte Rückstände)). Der Bioakkumulationsfaktor (BAFss) wird vorzugsweise sowohl als Verhältnis der Konzentration in den Würmern (Ca) und im Sediment (Cs) nach Erreichen eines offensichtlichen Gleichgewichtszustands als auch als kinetischer Bioakkumulationsfaktor (BAFK), ausgedrückt als Verhältnis der Konstante der Aufnahmerate (Aufnahme aus dem Sediment) (ks) zur Konstante der Eliminationsrate (ke) bei angenommener Kinetik erster Ordnung, berechnet. Wenn in 28 Tagen kein Gleichgewichtszustand erreicht wird, ist BAFK aus den Konstanten der Aufnahmerate und der Eliminationsrate zu ermitteln. Das Berechnungsverfahren wird in Anlage 2 erläutert. Wenn nicht von einer Kinetik erster Ordnung ausgegangen werden kann, sind komplexere Modelle zu verwenden (Anlage 2 und Quelle (25)).
18. Wenn in 28 Tagen kein Gleichgewichtszustand erreicht wird, kann die Aufnahmephase auch verlängert werden, indem Gruppen exponierter Würmer - soweit verfügbar - weiteren Messungen unterzogen werden, bis der Gleichgewichtszustand gegeben ist. Die Eliminationsphase beginnt jedoch trotzdem parallel an Tag 28 der Aufnahmephase.
19. Die Aufnahmekonstante, die Eliminationskonstante (oder Konstanten, wenn komplexere Modelle verwendet werden), der kinetische Bioakkumulationsfaktor (BAFK) und, wenn möglich, die Konfidenzgrenzen eines jeden dieser Parameter werden anhand computergestützter Modellgleichungen berechnet (Modelle siehe Anlage 2). Die Anpassungsgüte eines Modells lässt sich z.B. anhand des Korrelationskoeffizienten oder des Bestimmungskoeffizienten feststellen. (Koeffizienten nahe an 1 deuten auf eine gute Anpassung hin.)
20. Um Schwankungen der Testergebnisse bei organischen Stoffen mit hoher Lipophilität zu reduzieren, sind die Bioakkumulationsfaktoren außerdem bezogen auf den Lipidgehalt der Testorganismen und auf den Gehalt des Sediments an organischen Kohlenstoffen (TOC) (Biota-Sediment-Akkumulationsfaktor oder BSAF in kg TOC Sediment kg- 1 Lipidgehalt der Würmer) auszudrücken. Dieser Ansatz beruht auf Erfahrungen und theoretischen Korrelationen des aquatischen Kompartiments, wenn - bei einigen Chemikalienklassen - eine eindeutige Beziehung zwischen dem Bioakkumulationspotenzial eines Stoffs und seiner Lipophilität besteht, die für Fische als Modellorganismen gut dokumentiert wurde (14)(25)(27). Außerdem besteht ein Zusammenhang zwischen dem Lipidgehalt der Testfische und der festgestellten Bioakkumulation solcher Stoffe. Für benthische Organismen wurden ähnliche Korrelationen festgestellt (15)(16)(17)(18). Wenn genügend Wurmgewebe zur Verfügung steht, kann der Lipidgehalt der Testtiere mit dem biologischen Material bestimmt werden, das auch für die Bestimmung der Prüfstoffkonzentration verwendet wurde. Aus praktischen Gründen sollten akklimatisierte Kontrolltiere zumindest zu Beginn oder - vorzugsweise - am Ende der Aufnahmephase verwendet werden, um den Lipidgehalt zu messen; dieser kann dann zur Normalisierung der BAF-Werte verwendet werden.
21. Der Test ist gültig, wenn folgende Bedingungen erfüllt sind:
Prüfspezies
22. Für den Test können verschiedene Arten aquatischer Oligochaeten verwendet werden. In Anlage 6 werden die gebräuchlichsten Arten genannt.
23. In regelmäßigen Intervallen (z.B. einmal monatlich) werden Toxizitätstests (96 h, nur in Wasser) mit einem Referenzgiftstoff wie z.B. Kaliumchlorid (KCl) oder Kupfersulfat (CuSO4) durchgeführt (1), um Aufschluss über den Gesundheitszustand der Testtiere zu erhalten (1)(6). Wenn nicht regelmäßig Referenz-Toxizitätstests durchgeführt werden, ist die Charge der in einem Sediment-Bioakkumulationstest zu verwendenden Organismen anhand eines Referenzgiftstoffs zu prüfen. Auch aufgrund von Messungen des Lipidgehalts können Rückschlüsse auf den Zustand der Tiere gezogen werden.
Kultivierung der Testorganismen
24. Damit eine ausreichende Anzahl an Würmern für die Sediment-Bioakkumulationstests verfügbar ist, müssen die Würmer unter Umständen in einer Dauerkultur mit einer Einzel-Spezies vorrätig gehalten werden. Labormethoden zur Kultivierung der für den Test ausgewählten Arten werden in Anlage 6 beschrieben. Nähere Informationen sind den folgenden Quellen zu entnehmen: (8)(9)(10)(18)(28)(29)(30)(31)(32).
Apparatur
25. Die Verwendung von Materialien, die sich auflösen können, die Prüfstoffe absorbieren oder andere chemische Stoffe auslaugen bzw. schädigende Auswirkungen auf die Testtiere haben können, sollte für alle verwendeten Teile unbedingt vermieden werden. Es können rechteckige oder zylindrische Standardkammern aus chemisch inertem Material, die ein der Besatzdichte (Anzahl der Testwürmer) entsprechendes Fassungsvermögen haben, verwendet werden. Die Verwendung weicher Kunststoffschläuche zur Zuführung von Wasser oder Luft ist zu vermeiden. Geräte, die mit dem Prüfmedium in Berührung kommen, können aus Polytetrafluorethylen, rostfreiem Stahl und/oder Glas bestehen. Bei Stoffen mit hohen Adsorptionskoeffizienten, wie z.B. synthetischen Pyrethroiden, kann die Verwendung von silanisiertem Glas nötig sein. In solchen Fällen muss die Apparatur/Anlage nach der Benutzung entsorgt werden (5). Bei radioaktiv markierten Prüfstoffen und bei flüchtigen Stoffen ist darauf zu achten, dass es nicht zu einem Stripping und zum Austreten des gestrippten Prüfstoffs kommt. Dazu sind Abscheider (z.B. Gaswaschflaschen aus Glas) mit geeigneten Absorberstoffen zu verwenden, um etwaige Rückstände aufzufangen, die aus den Prüfgefäßen verdunsten könnten (11).
Wasser
26. Die Qualität des Überstandswassers sollte so beschaffen sein, dass die im Test verwendete Art während der Akklimatisierungs- und Testphasen überleben kann, ohne ein abnormales Aussehen oder Verhalten zu entwickeln. Als Überstandswasser für die Tests und für die Laborkulturen der Würmer wird rekonstituiertes Wasser gemäß der Prüfmethode C.1 (25) empfohlen. Es wurde nachgewiesen, dass mehrere für den Test geeignete Arten in diesem Wassertyp überleben, wachsen und sich vermehren (8); außerdem ist eine größtmögliche Standardisierung der Testbedingungen und der Kulturbedingungen gewährleistet. Das Wasser ist mindestens unter Angabe des pH-Werts, der Leitfähigkeit und der Härte zu beschreiben. Mit Wasseranalysen auf Mikroverunreinigungen vor der Verwendung können hilfreiche Informationen ermittelt werden (Anlage 4).
27. Während der gesamten Testdauer muss eine konstante Wasserqualität aufrechterhalten werden. Der pH-Wert des Überstandswassers muss zwischen 6 und 9 liegen. Die Gesamthärte liegt zu Beginn des Tests bei 90- 400 mg CaCO3 pro Liter (7). In der Prüfmethode C.1 (25) werden die pH- und Härtebereiche des rekonstituierten Wassers festgelegt. Wenn eine Wechselwirkung zwischen den Härte-Ionen und dem Prüfstoff zu erwarten ist, muss Wasser geringerer Härte verwendet werden. Anlage 4 gibt einen Überblick über die zusätzlichen Kriterien für annehmbares Verdünnungswasser entsprechend der OECD-Prüfrichtlinie 210 (34).
Sediment
28. Die Qualität des Sediments sollte so beschaffen sein, dass die Testorganismen während der Akklimatisierungs- und Testphasen überleben und sich möglichst vermehren können, ohne ein abnormales Aussehen oder Verhalten zu zeigen. Die Würmer sollten sich in das Sediment eingraben. Ob sich die Würmer eingraben, kann Einfluss auf die Exposition und entsprechend auf den BAF haben. Daher ist - soweit die Trübheit des Überstandswassers dies zulässt - zu protokollieren, ob die Prüforganismen das Sediment verlassen oder sich in das Sediment eingraben. Die Würmer (Kontrollen und Proben mit den Prüfstoffen) müssen sich innerhalb von 24 h nach dem Einsetzen in die Prüfgefäße in das Sediment eingegraben haben. Wenn beobachtet wird, dass die Würmer sich nicht eingraben oder ständig (z.B. mehr als 20 % über mehr als die Hälfte der Aufnahmephase) das Sediment verlassen, deutet dies darauf hin, dass entweder die Prüfbedingungen nicht angemessen sind oder dass die Testorganismen nicht ges- und sind oder dass dieses Verhalten auf die Konzentration des Prüfstoffs zurückzuführen ist. In diesem Fall muss der Test gestoppt und unter günstigeren Bedingungen wiederholt werden. Weitere Informationen über die Sedimentaufnahme sind mit den in (35) und (36) beschriebenen Methoden zu beschaffen, mit denen die Sedimentaufnahme und die Partikelauswahl durch die Testorganismen bestimmt werden können. So weit feststellbar ist zumindest das Vorkommen bzw. Fehlen von Kotbällchen auf der Oberfläche des Sediments als Maßstab für die Sedimentaufnahme durch die Würmer zu protokollieren; dieser Parameter kann für die Interpretation der Testergebnisse im Hinblick auf die Expositionspfade von Bedeutung sein.
29. Sowohl für die Tests als auch für die Laborkulturen der Würmer (Anlage 5) wird ein künstliches Sediment empfohlen, welches auf dem im Zusammenhang mit Prüfmethode C.8 (40) beschriebenen künstlichen Boden beruht, da natürliche Sedimente geeigneter Qualität unter Umständen nicht ganzjährig verfügbar sind. Außerdem können in natürlichen Sedimenten vorkommende einheimische Organismen sowie eventuell vorhandene Mikroverunreinigungen die Testergebnisse beeinflussen. Mehrere in den Tests zu verwendende Arten überleben, wachsen und vermehren sich in künstlichem Sediment (8).
30. Das künstliche Sediment muss mindestens durch die Herkunft seiner Bestandteile, die Korngrößenverteilung (Prozent Sand, Schluff und Ton), den organisch gebundenen Kohlenstoff (TOC), den Wassergehalt und den pH- Wert beschrieben werden. Außerdem kann das Redoxpotenzial gemessen werden. Natürliche Sedimente von nicht kontaminierten Standorten können ebenfalls als Prüf- und/oder Anzuchtsedimente dienen (1). Zur Charakterisierung von natürlichen Sedimenten sind zumindest die Herkunft (Entnahmestandort), der pH-Wert und der Ammoniakgehalt des Porenwassers, der Gehalt an organischem Kohlenstoff, die Korngrößenverteilung (Anteil an Sand, Schluff und Lehm) und der prozentuale Wassergehalt anzugeben (6). Ferner wird empfohlen, natürliches Sediment vor dem Spiken mit dem Prüfstoff für sieben Tage unter denselben Bedingungen wie im anschließenden Test zu konditionieren, wenn die Bildung von Ammoniak zu erwarten ist. Nach dieser Konditionierung ist das Überstandswasser zu entfernen und zu entsorgen. Eine vor Gebrauch durchgeführte Analyse des Sediments oder seiner Bestandteile auf Mikroschadstoffe könnte nützliche Informationen liefern.
Zubereitung
31. Die Handhabung natürlicher Sedimente vor der Verwendung im Labor wird in den Quellen (1)(6)(44) beschrieben. Wie das künstliche Sediment vorzubereiten ist, wird in Anlage 5 erläutert.
Lagerung
32. Natürliche Sedimente sollten im Labor so kurz wie möglich gelagert werden. Nach Empfehlungen der US- amerikanischen EPA (6) beträgt die Haltbarkeit bei Lagerung im Dunkeln bei einer Temperatur von 4 ± 2 °C maximal 8 Wochen. Über dem Sediment darf sich in den Vorratsbehältnissen kein Luftraum mehr befinden. Empfehlungen für die Lagerung künstlicher Sedimente sind Anlage 5 zu entnehmen.
Applikation des Prüfstoffs:
33. Der Prüfstoff wird in das Sediment dotiert. Zur Dotierung werden ein oder mehrere Bestandteile des Sediments mit dem Prüfstoff behandelt. So kann z.B. der Quarzsand (oder ein Teil davon, beispielsweise 10 g je Prüfgefäß) mit einer Lösung des Prüfstoffs in einem geeigneten Lösungsmittel durchtränkt werden; das Lösungsmittel wird anschließend durch Trocknen abgedampft. Die beschichtete Quarzsandfraktion wird sodann mit dem befeuchteten Sediment vermischt. Bei der Zubereitung des Sediments ist die im Gemisch aus Prüfstoff und Sand enthaltene Sandmenge zu berücksichtigen (d. h. das Sediment sollte mit weniger Sand zubereitet werden) (6).
34. Bei natürlichen Sedimenten kann der Prüfstoff, wie oben für das künstliche Sediment beschrieben, durch Dotieren eines luftgetrockneten Teils des Bodens oder durch Einrühren des Prüfstoffs in den feuchten Boden mit anschließendem Abdampfen im Falle der Verwendung eines Lösungsmittels hinzugefügt werden. Geeignete Lösungsmittel zum Dotieren feuchter Sedimente sind Ethanol, Methanol, Ethylenglycolmonomethylether, Ethylenglycoldimethylether, Dimethylformamid und Triethylenglycol (5)(34). Hauptkriterien für die Wahl eines geeigneten Lösungsvermittlers sollten die Toxizität und Flüchtigkeit des Lösungsmittels und die Löslichkeit des Prüfstoffs in dem gewählten Lösungsmittel sein. Weitere Hinweise zu Dotierungsverfahren sind Environment Canada (1995) zu entnehmen (41). Es ist darauf zu achten, dass der Prüfstoff gut mit dem Sediment gemischt wird, damit er in dem Sediment homogen verteilt ist. Unterproben (mit Replikaten) des dotierten Sediments werden analysiert, um die Konzentrationen des Prüfstoffs im Sediment und die Homogenität der Verteilung des Prüfstoffs zu ermitteln.
35. Nach Fertigstellung des dotierten Sediments mit dem überschichteten Wasser ist abzuwarten, bis sich der Prüfstoff zwischen dem Sediment und der wässrigen Phase verteilt hat. Dies sollte bevorzugt unter denselben Temperatur- und Belüftungsbedingungen wie im Versuch erfolgen. Die erforderliche Zeit für die Einstellung des Gleichgewichts hängt vom Sediment und der Chemikalie ab. In einigen Fällen reichen ein paar Stunden oder Tage, in seltenen Fällen können sogar mehrere Wochen (4-5 Wochen) erforderlich sein (28)(42)). Bei diesem Test wird eine Gleichgewichtseinstellung nicht abgewartet; es wird jedoch eine Wartezeit von 48 Stunden bis 7 Tagen empfohlen. Je nach Zweck der Untersuchung (z.B. Nachbildung von Umweltbedingungen) kann ein Gleichgewicht des dotierten Sediments eingestellt oder das Sediment auch über einen längeren Zeitraum stehen gelassen werden (11).
Vorversuch
36. Die Durchführung eines Vorversuchs kann hilfreich sein, um die Prüfbedingungen des definitiven Tests zu optimieren (beispielsweise hinsichtlich der Festlegung der Prüfstoffkonzentration(en) und der Dauer der Aufnahme- und der Eliminationsphase). Verhaltensweisen der Würmer (z.B. das Hervorkommen aus dem Sediment), die auf den Prüfstoff und/oder das Sediment an sich zurückzuführen sein könnten, sind in einem Vorversuch zu erfassen und zu protokollieren. Das Verlassen des Sediments kann in einem Vorversuch zur Abschätzung der Prüfstoffkonzentration(en) für einen Bioakkumulationstest auch als subletaler Parameter verwendet werden.
Expositionsbedingungen
Dauer der Aufnahmephase
37. Die Testorganismen werden während der Aufnahmephase gegenüber dem Prüfstoff exponiert. Die erste Probe wird 4-24 h nach Beginn der Aufnahmephase genommen. Die Aufnahmephase kann bis zu 28 Tage dauern (1) (6)(11), wenn nicht nachgewiesen wurde, dass ein Gleichgewicht bereits vorher erreicht ist. Der Gleichgewichtszustand ist gegeben, wenn folgende Bedingungen erfüllt sind: (i) Die Kurve der Bioakkumulationsfaktoren zu den verschiedenen Zeitpunkten der Probenahme verläuft parallel zur Zeitachse, (ii) drei aufeinanderfolgende Analysen der BAF an Proben, die im Abstand von mindestens zwei Tagen genommen wurden, unterscheiden sich um höchstens ± 20 %,und (iii) es bestehen keine signifikanten Unterschiede zwischen den Zeiträumen der drei Probenahmen (statistischen Vergleichen beispielsweise anhand von Varianz- und Regressionsanalysen zufolge). Wenn in 28 Tagen kein Gleichgewichtszustand erreicht wurde, kann die Aufnahmephase durch Einleitung der Eliminationsphase beendet werden; danach kann aus den Konstanten der Aufnahme- und der Eliminationsrate der BAFK berechnet werden (siehe auch Nummern 16-18).
Dauer der Eliminationsphase
38. Die erste Probe ist 4-24 h nach Beginn der Eliminationsphase zu nehmen, da in der Anfangsphase rasche Änderungen hinsichtlich der Rückstände in Geweben auftreten können. Es wird empfohlen, die Eliminationsphase entweder wenn die Konzentration des Prüfstoffs weniger als 10 % der Gleichgewichtskonzentration beträgt oder spätestens nach 10 Tagen zu beenden. Die Rückstandswerte der Würmer am Ende der Eliminationsphase werden als ein weiterer Endpunkt protokolliert. Die Dauer der Phase kann jedoch von dem Zeitraum abhängen, über den die Konzentration des Prüfstoffs in den Würmern oberhalb der analytischen Nachweisgrenze bleibt.
Testorganismen
Anzahl der Testwürmer
39. Die in einer Probe enthaltenen Würmer müssen so viel Wurmgewebe ergeben, dass die Masse des Prüfstoffs pro Probe zu Beginn der Aufnahmephase und am Ende der Eliminationsphase erheblich über der Nachweisgrenze des Prüfstoffs in biologischem Material liegt. In den genannten Stadien der Aufnahme- und der Eliminationsphase ist die Konzentration in den Testtieren gewöhnlich verhältnismäßig gering (6)(8)(18). Da das individuelle Gewicht bei vielen Arten aquatischer Oligochaeten sehr gering ist (5-10 mg Feuchtmasse pro Tier bei Lumbriculus variegatus und Tubifex tubifex), können die Würmer einer Replikatkammer zum Wiegen und zur Analyse auf die Prüfchemikalie gepoolt werden. Bei Arten mit höherem individuellem Gewicht (z.B. Branchiura sowerbyi) können Replikate mit jeweils einem Tier verwendet werden; in diesen Fällen ist jedoch die Anzahl der Replikate auf fünf pro Zeitpunkt der Probenahme zu erhöhen (11). Es ist jedoch zu beachten, dass B. sowerbyi im Ringtest nicht berücksichtigt wurde (12); dementsprechend wird diese Art für diese Methode nicht ausdrücklich empfohlen.
40. Im Test sind Würmer ähnlicher Größe zu verwenden (zu L. variegatus siehe Anlage 6). Es sollten adulte oder große Tiere identischer Herkunft und derselben Altersklasse sein (siehe Anlage 6). Das Gewicht und das Alter eines Tieres kann entscheidenden Einfluss auf die BAF-Werte haben (beispielsweise aufgrund unterschiedlicher Lipidgehalte und/oder weil Eier vorhanden sind). Diese Parameter sind genau zu protokollieren. Zur Feststellung der mittleren Feucht- und Trockenmasse wird vor Beginn des Tests eine Unterprobe der Würmer gewogen.
41. Bei Tubifex tubifex und Lumbriculus variegatus ist während der Dauer des Tests eine Vermehrung zu erwarten. Eine fehlende Reproduktion bei einem Bioakkumulationstest ist zu protokollieren und bei der Interpretation der Testergebnisse zu berücksichtigen.
Besatz
42. Um die Verringerung der Prüfstoffkonzentration im Sediment während der Aufnahmephase und einen Rückgang der Konzentration an gelöstem Sauerstoff zu verhindern, ist ein hohes Verhältnis von Sedimenten zu Würmern und von Wasser zu Würmern erforderlich. Die gewählte Besatzrate sollte auch den in der Natur gegebenen Populationsdichten der ausgewählten Art entsprechen (43). Bei Tubifex tubifex beispielsweise ist eine Besatzrate von 1-4 mg Wurmgewebe (Feuchtmasse) pro Gramm feuchtes Sediment zu empfehlen (8)(11). In den Quellen (1) und (6) wird für L. variegatus eine Besatzrate von ≤ 1 g Wurmgewebe (Trockenmasse) je 50 g organischer Kohlenstoff im Sediment empfohlen.
43. Die in einem Test zu verwendenden Würmer werden durch Aussieben des Kultursediments aus der Kultur gewonnen. Die Tiere (adulte oder große Tiere, die keine Anzeichen einer kürzlich erfolgten Teilung aufweisen) werden in Glasgefäße (z.B. Petrischalen) mit sauberem Wasser gesetzt. Wenn sich die Testbedingungen von den Kulturbedingungen unterscheiden, ist eine Akklimatisierung vorzunehmen; eine Akklimatisierungsphase von 24Stunden dürfte ausreichend sein. Vor dem Wiegen ist überschüssiges Wasser von den Würmern zu entfernen. Dazu können die Würmer vorsichtig auf ein befeuchtetes Papiertuch gelegt werden. Es wird nicht empfohlen, die Würmer mit saugendem Papier zu trocknen, da die Würmer dadurch eine Stressbelastung erfahren oder beschädigt werden könnten. Brunson et al. (1998) empfehlen die Verwendung nicht trockengetupfter Würmer mit etwa dem 1,33-Fachen der gewünschten endgültigen Biomasse. Die Zugabe von 33 % entspricht dem Unterschied zwischen der Masse trockengetupfter und nicht abgetrockneter Würmer (28).
44. Zu Beginn der Aufnahmephase (Tag 0 des Tests) werden die Testorganismen aus dem Akklimatisierungsbecken genommen und randomisiert auf die Gefäße (z.B. Petrischalen) mit rekonstituiertem Wasser verteilt, indem jeweils zwei Würmer in die Gefäße gegeben werden, bis sich in jedem Gefäß zehn Würmer befinden. Die Gruppen werden dann zufällig auf getrennte Prüfgefäße verteilt (z.B. mit einer weichen Stahlpinzette). Danach werden die Prüfgefäße unter Testbedingungen inkubiert.
Fütterung
45. Angesichts des niedrigen Nährstoffgehalts des künstlichen Sediments ist das Sediment mit Futter anzureichern. Damit die Exposition der Testorganismen nicht unterschätzt wird (indem beispielsweise selektiv nicht kontaminiertes Futter bereitgestellt wird), muss das zum Wachstum und zur Vermehrung der Testorganismen benötigte Futter mit einem Mal vor oder während der Applikation des Prüfstoffs bereitgestellt werden (siehe Anlage 5).
Sediment-Wasser-Verhältnis
46. Das empfohlene Sediment-Wasser-Verhältnis beträgt 1:4 (45). Dieses Verhältnis wird als geeignet betrachtet, um geeignete Sauerstoffkonzentrationen aufrechtzuerhalten und um die Ammoniakbildung im Überstandswasser zu vermeiden. Im Überstandswasser muss ein Sauerstoffgehalt von ≥ 40 % aufrechterhalten werden. Das Überstandswasser der Prüfgefäße ist vorsichtig zu belüften (z.B. mit 2-4 Blasen pro Sekunde); die dazu verwendete Pasteur-Pipette wird etwa 2 cm über der Oberfläche des Sediments angesetzt, um Trübungen des Sediments zu minimieren.
Licht und Temperatur
47. Die Fotoperiode für die Kultur und für den Versuch beträgt 16 Stunden (1)(6). Die Lichtintensität im Prüfbereich soll etwa 500-1.000 lx betragen. Die Prüftemperatur soll während des gesamten Tests bei 20 ± 2 ° C liegen.
Prüfkonzentrationen
48. Die Bestimmung der Aufnahmekinetik erfolgt bei einer einzigen (möglichst niedrigen) Prüfkonzentration; es kann aber auch eine zweite (höhere) Konzentration verwendet werden (siehe z.B. (46)). In diesem Fall werden im Gleichgewichtszustand oder nach 28 Tagen Proben entnommen, um die bei der niedrigeren Konzentration gemessenen BAF-Werte zu verifizieren (11). Die höhere Konzentration ist so zu wählen, dass Beeinträchtigungen ausgeschlossen werden können (beispielsweise indem eine Konzentration in Höhe von etwa 1 % der in maßgeblichen Untersuchungen der chronischen Toxizität ermittelten niedrigsten Konzentration mit bekannter chronischer Wirkung ECx verwendet wird). Die niedrigere Prüfkonzentration muss erheblich über der Nachweisgrenze der verwendeten Methode zur Analyse von Sedimenten und biologischen Proben liegen). Liegt die Wirkungskonzentration des Prüfstoffs in der Nähe der analytischen Nachweisgrenze, wird empfohlen, radioaktiv markierte Prüfstoffe mit hoher spezifischer Radioaktivität zu verwenden.
Replikate mit dem Prüfstoff und Kontrollreplikate
49. Für die kinetischen Messungen in der Aufnahme- und der Eliminationsphase sind pro Messzeitpunkt (11) mindestens drei behandelte Replikate vorzusehen. Zusätzliche Replikate sind beispielsweise zu verwenden, wenn (optional) weitere Probendaten ermittelt werden sollen. Für die Eliminationsphase wird eine entsprechende Anzahl an Replikaten mit nicht dotiertem Sediment und mit Überstandswasser hergestellt, damit die dem Prüfstoff ausgesetzten Würmer aus den betreffenden Gefäßen mit dem Prüfstoff am Ende der Aufnahmephase in Gefäße ohne Prüfstoff gegeben werden können. Die Gesamtzahl der behandelten Replikate mit dem Prüfstoff muss für die Aufnahme- und die Eliminationsphase ausreichend sein.
50. Alternativ können die für die Probenahme während der Eliminationsphase vorgesehenen Würmer in einem großen Behältnis mit dotiertem Sediment aus derselben Charge wie bei der Ermittlung der Aufnahmekinetik des Prüfstoffs exponiert werden. Es muss nachgewiesen werden, dass die Testbedingungen (Sedimenttiefe, Sediment-Wasser-Verhältnis, Besatz, Temperatur, Wasserqualität usw.) den entsprechenden Parametern der für die Aufnahmephase vorgesehenen Replikate vergleichbar sind. Am Ende der Aufnahmephase sind Wasser-, Sediment- und Wurmproben aus diesem Behältnis zur Analyse zu entnehmen; außerdem muss eine hinreichende Anzahl großer Würmer, die keine Anzeichen einer kürzlich erfolgten Teilung aufweisen, vorsichtig entnommen und in die für die Eliminationsphase vorgesehenen Replikate gesetzt werden (z.B. zehn Organismen pro Replikatgefäß).
51. Wenn ausschließlich Wasser als Lösungsmittel eingesetzt wird, sind mindestens 9 Replikate einer negativen Kontrolle (mindestens 3 Probenahmen zu Beginn, 3 am Ende der Aufnahmephase und 3 am Ende der Eliminationsphase) für biologische Analysen und für Analysen der Hintergrundkonzentrationen vorzusehen. Wenn zur Applikation des Prüfstoffs ein Lösungsmittel verwendet wird, ist eine Lösungsmittelkontrolle herzustellen (Probenahmen bei mindestens 3 Replikaten zu Beginn, 3 Replikaten am Ende der Aufnahmephase und 3 Replikaten am Ende der Eliminationsphase). In diesem Fall sind 4 Replikate einer negativen Kontrolle (ohne Lösungsmittel) zur Probennahme am Ende der Aufnahmephase vorzusehen. Diese Replikate können biologisch mit der Lösungsmittelkontrolle verglichen werden, um Informationen über einen möglichen Einfluss des Lösungsmittels auf den Testorganismus zu erhalten. Nähere Informationen sind Anlage 3 zu entnehmen.
Häufigkeit der Messungen der Wasserqualität
52. Während der Aufnahmephase und der Eliminationsphase müssen mindestens folgende Parameter des Überstandswassers gemessen werden:
| Temperatur | Messung in jeweils einem Gefäß pro Prüfkonzentration und Datum der Probenahme und in einem Kontrollgefäß einmal wöchentlich sowie zu Beginn und am Ende der Aufnahmephase und der Eliminationsphase; außerdem kann die Temperatur des umgebenden Mediums (Umgebungsluft oder Wasserbad) oder in einem repräsentativen Prüfgefäß protokolliert werden (beispielsweise kontinuierlich oder stündlich); |
| Gehalt an gelöstem Sauerstoff | je Prüfkonzentration in einem Gefäß sowie in einem Kontrollgefäß pro Datum der Probenahme; ausgedrückt in mg/l und % Luftsauerstoff-Sättigungswert; |
| Luftzufuhr | mindestens einmal täglich (an Werktagen) zu kontrollieren und erforderlichenfalls anzupassen; |
| pH-Wert | in jeweils einem Gefäß pro Prüfkonzentration mit dem Prüfstoff pro Zeitpunkt der Probenahme und in einem Kontrollgefäß einmal wöchentlich sowie zu Beginn und am Ende der Aufnahmephase und der Eliminationsphase; |
| Gesamt-Wasserhärte | in mindestens einem Gefäß mit dem Prüfstoff und in einem Kontrollprüfgefäß zu Beginn und am Ende der Aufnahmephase und der Eliminationsphase, ausgedrückt in mg/l CaCO3; |
| Gesamt-Ammoniakgehalt | in mindestens einem Gefäß mit dem Prüfstoff und in einem Kontrollprüfgefäß am Anfang und am Ende der Aufnahmephase und der Eliminationsphase; ausgedrückt in mg/l NH4+ oder NH3 oder Ammoniak-N gesamt. |
Probenahme und Analyse der Wurm-, Sediment- und Wasserproben
Probenahmeplan
53. Anlage 3 enthält Beispiele von Probenahmeplänen für eine Aufnahmephase von 28 Tagen und eine Eliminationsphase von 10 Tagen.
54. Vor dem Einsetzen der Würmer sowie in der Aufnahmephase und in der Eliminationsphase werden von dem Wasser und dem Sediment in den Prüfbecken Proben zur Bestimmung der Prüfstoffkonzentration entnommen. Während des Tests werden die Konzentrationen des Prüfstoffs in den Würmern, im Sediment und im Wasser ermittelt, um die Verteilung des Prüfstoffs in den verschiedenen Kompartimenten des Prüfsystems zu überwachen.
55. Wurm-, Sediment- und Wasserproben werden jeweils in der Aufnahmephase und in der Eliminationsphase mindestens sechsmal entnommen.
56. Die Probenahmen werden fortgesetzt, bis ein Plateau (Gleichgewichtszustand) erreicht wird (siehe Anlage 1) bzw. bis 28 Tage vergangen sind. Auch wenn sich binnen 28 Tagen kein Plateau einstellt, wird mit der Eliminationsphase begonnen. Zu Beginn der Eliminationsphase werden die vorgesehenen Würmer in die Replikatbecken mit unbehandeltem Sediment und Wasser gesetzt (siehe auch Nummern 17 und 18).
Probenahme und Probenvorbereitung
57. Die Entnahme der Wasserproben erfolgt durch Dekantieren, Absaugen oder Pipettieren eines ausreichenden Volumens zur Quantifizierung des Prüfstoffs in den Proben.
58. Das verbleibende Überstandswasser wird vorsichtig aus den Prüfbecken dekantiert oder abgesaugt. Sedimentproben sind vorsichtig zu entnehmen, damit die Würmer möglichst wenig gestört werden.
59. Bei der Probenahme werden alle Würmer aus dem Replikat entnommen (beispielsweise indem das Sediment mit dem Überstandswasser suspendiert und der Inhalt der einzelnen Replikate auf einer flachen Schale verteilt wird, um die Würmer mit einer weichen Stahlpinzette aufnehmen zu können). Anschließend werden die Würmer kurz in einer flachen Schale aus Glas oder Stahl mit Wasser gespült. Anhaftendes Wasser ist zu entfernen. Die Würmer vorsichtig in ein vorgewogenes Gefäß geben und wiegen. Anschließend werden die Würmer durch Gefrieren (z.B. bei ≤ - 18 °C) getötet. Das Vorhandensein und die Anzahl von Kokons und/ oder juvenilen Tieren sind zu protokollieren.
60. Im Allgemeinen sind die Würmer unmittelbar nach der Probenahme ohne eine Phase der Darmentleerung zu wiegen und zu töten, um die BAF-Werte konservativ zu ermitteln und um Verluste von Rückständen im Gewebe während der Entleerung des Darminhalts nur in Wasser zu vermeiden. Bei log-Kow-Werten über 5 wird davon ausgegangen, dass die betreffenden Stoffe bei Entleerung des Darminhalts nur in Wasser nicht in erheblichem Umfang eliminiert werden; bei Stoffen mit log-Kow-Werten unter 4 hingegen können erhebliche Anteile verlorengehen (47).
61. In der Eliminationsphase entleeren die Würmer ihren Darm in sauberes Sediment, Messungen unmittelbar vor der Eliminationsphase werden entsprechend an Sedimenten mit kontaminiertem Darminhalt vorgenommen. Nach den ersten 4-24 h der Eliminationsphase kann dagegen davon ausgegangen werden, dass der kontaminierte Darminhalt weitgehend durch sauberes Sediment ersetzt wurde (11)(47). Die Konzentration in den Würmern der betreffenden Probe kann dann als Konzentration im Gewebe nach der Entleerung des Darminhalts betrachtet werden. Um der Verdünnung der Prüfstoffkonzentration durch unkontaminiertes Sediment während der Eliminationsphase Rechnung zu tragen, kann das Gewicht des Darminhalts auf Basis des Verhältnisses Nassgewicht/Aschegewicht des Wurms oder des Verhältnisses Trockenmasse/Aschegewicht des Wurms geschätzt werden.
62. Wenn bei einer Untersuchung die Bioverfügbarkeit und die tatsächlichen Rückstände im Gewebe der Testorganismen ermittelt werden sollen, muss mindestens eine Unterprobe exponierter Tiere (z.B. aus drei zusätzlichen Replikatgefäßen), die vorzugsweise im Gleichgewichtszustand entnommen wurde, gewogen, 6 Stunden mit sauberem Wasser gereinigt (47) und danach vor der Analyse nochmals gewogen werden. Daten zum Gewicht der Würmer und zur Konzentration im Körpergewebe der betreffenden Unterprobe können dann mit Werten von Würmern mit Darminhalt verglichen werden. Um die Tiere nicht einer zusätzlichen Stressbelastung auszusetzen, darf der Darm der für die Messung der Elimination vorgesehenen Würmer vor der Umsetzung in sauberes Sediment nicht geleert werden.
63. Die Analyse der Wasser-, Sediment- und Wurmproben sollte vorzugsweise direkt nach der Probenahme (d. h. innerhalb von 1 bis 2 Tagen) erfolgen, um einen Abbau oder sonstige Verluste zu vermeiden und um bei laufendem Versuch die ungefähren Aufnahme- und Eliminationsraten zu ermitteln. Durch eine umgehende Analyse werden auch Verzögerungen bei der Ermittlung des Zeitpunkts vermieden, bei dem ein Plateau einsetzt.
64. Wenn die Analyse nicht umgehend vorgenommen wird, sind die Proben unter geeigneten Bedingungen zu lagern. Vor Beginn der Untersuchung sind Informationen über die Stabilität des betreffenden Prüfstoffs und über geeignete Lagerbedingungen einzuholen (z.B. Haltbarkeit und Lagertemperatur oder Extraktionsverfahren). Wenn diese Informationen nicht verfügbar sind, kann erforderlichenfalls gleichzeitig anhand dotierter Kontrollgewebe die Lagerfähigkeit ermittelt werden.
Qualität der Analysemethode
65. Da Zuverlässigkeit, Genauigkeit und Empfindlichkeit entscheidend für das gesamte Verfahren sind, muss experimentell sichergestellt werden, dass die Präzision und die Reproduzierbarkeit der chemischen Analysen sowie die Wiederfindung des Prüfstoffs aus Wasser-, Sediment- und Wurmproben für die jeweilige Methode mindestens bei der geringsten und bei der höchsten Prüfkonzentration ausreichend sind. Außerdem muss gewährleistet werden, dass der Prüfstoff in den Kontrollbecken nicht in Konzentrationen oberhalb der Hintergrundkonzentration nachweisbar ist. Erforderlichenfalls werden die Cw-, Cs- und Ca-Werte entsprechend den Wiederfindungsraten und den Hintergrundkonzentrationen der Kontrollen korrigiert. Alle Proben müssen während des Tests stets so behandelt werden, dass Verunreinigungen und Verluste (z.B. infolge von Adsorption des Prüfstoffs durch das Probenahmegerät) auf ein Minimum beschränkt werden.
66. Die Gesamtwiederfindungsrate und die Wiederfindung des Prüfstoffs in Würmern, Sedimenten, Wasser und (gegebenenfalls) verwendeten Abscheidern mit Adsorberstoffen zum Auffangen des verdampfenden Prüfstoffs müssen ermittelt und im Protokoll erfasst werden.
67. Da die Verwendung radioaktiv markierter Stoffe empfohlen wird, kann die Gesamt-Radioaktivität (d. h. von Ausgangsstoff und seinen Abbauprodukten) ermittelt werden. Wenn analysetechnisch möglich, können aus der Quantifizierung des Ausgangsstoffs und der Abbauprodukte im Gleichgewichtszustand oder am Ende der Aufnahmephase wichtige Informationen gewonnen werden. Sind derartige Messungen beabsichtigt, müssen die Proben anschließend geeigneten Extraktionsverfahren unterzogen werden, damit der Ausgangsstoff separat quantifiziert werden kann. Wenn ein wesentlicher Prozentanteil (z.B. > 10 %) der in den Testorganismen im Gleichgewichtszustand oder am Ende der Aufnahmephase gemessenen Radioaktivität auf ein nachgewiesenes Abbauprodukt entfällt, sollte dieses Abbauprodukt identifiziert werden (5).
68. Wegen der geringen individuellen Biomasse kann die Konzentration des Prüfstoffs bei den einzelnen Würmern häufig nicht ermittelt werden, außer wenn der Test mit Branchiura sowerbyi (40-50 mg Feuchtmasse pro Wurm) durchgeführt wird (11). Daher können die aus einem Prüfgefäß entnommenen Würmer gepoolt werden; die Daten können dann allerdings nur für gewisse statistische Verfahren verwendet werden. Wird auf ein spezielles statistisches Verfahren bzw. eine bestimmte statistische Aussagekraft Wert gelegt, muss der Test unter Berücksichtigung des Poolings, des Verfahrens und der gewünschten Aussagekraft eine angemessene Anzahl an Testtieren und/oder Replikatbecken umfassen.
69. Der BAF sollte im Verhältnis zur gesamten Feuchtmasse und zur Trockenmasse sowie, falls erforderlich (z.B. bei hochlipophilen Stoffen), im Verhältnis zum Lipidgehalt und zum TOC des Sediments ausgedrückt werden. Zur Bestimmung des Lipidgehalts sind geeignete Methoden zu verwenden (48)(49). Als Standardmethode wird die Extraktion mit Chloroform/Methanol (50) empfohlen (48). Um die Verwendung von gechlorten Lösungsmitteln zu vermeiden, kann jedoch eine in einem Ringtest geprüfte angepasste Version der Methode von Bligh and Dyer (50), wie in (51) beschrieben, verwendet werden. Da die verschiedenen Methoden möglicherweise zu unterschiedlichen Werten führen (48), ist es wichtig, die verwendete Methode anzugeben. Nach Möglichkeit, d. h., wenn genügend Wurmgewebe verfügbar ist, wird der Lipidgehalt an der Probe bzw. dem Extrakt gemessen, die bzw. der auch für die Ermittlung der Konzentration des Prüfstoffs verwendet wurde. Die Lipide müssen nämlich häufig aus dem Extrakt entfernt werden, bevor eine chromatographische Analyse durchgeführt werden kann (5). Aus praktischen Gründen empfiehlt sich allerdings, zumindest zu Beginn oder - vorzugsweise - am Ende der Aufnahmephase akklimatisierte Kontrolltiere zu verwenden, um den Lipidgehalt beispielsweise an drei Proben zu messen.
Auswertung der Ergebnisse
70. Die Aufnahmekurve des Prüfstoffs ergibt sich, indem dessen Konzentration in/auf den Würmern in der Aufnahmephase gegen die Zeit auf einer arithmetischen Skala aufgetragen wird. Wenn die Kurve ein Plateau erreicht hat, wird der BAFss im Gleichgewichtszustand berechnet:
|
Ca im Gleichgewichtszustand bzw:an Tag 28 (Mittelwert) |
|
|
|
Cs im Gleichgewichtszustand bzw:an Tag 28 (Mittelwert) |
71. Bestimmung des kinetischen Bioakkumulationsfaktors (BAFK) als Quotient ks/ke. Die Eliminationskonstante (ke) wird in der Regel aus der Eliminationskurve abgeleitet (d. h. einer grafischen Darstellung der Prüfstoffkonzentration in den Würmern während der Eliminationsphase). Die Aufnahmekonstante ks wird dann anhand der Kinetik der Aufnahmekurve berechnet. Die bevorzugte Methode zur Berechnung des BAFK und der Konstanten ks und ke ist eine computergestützte nichtlineare Parameterschätzung (siehe Anlage 2). Wenn die Ausscheidungskinetik offensichtlich nicht erster Ordnung entspricht, sollten komplexere Modelle herangezogen werden (25)(27)(52).
72. Der Biota-Sediment-Akkumulationsfaktor (BSAF) wird durch Normalisierung des BAFK für den Lipidgehalt der Würmer und für den Gesamtgehalt des Sediments an organischem Kohlenstoff ermittelt.
Interpretation der Ergebnisse
73. Die Prüfergebnisse sind mit Vorsicht zu bewerten, wenn die gemessenen Konzentrationen des Prüfstoffs in Testansätzen in der Nähe der Nachweisgrenze der jeweiligen Analysemethode liegen.
74. Klar definierte Aufnahme- und Eliminationskurven sind ein Anzeichen für die gute Qualität der Bioakkumulationsdaten. Im Allgemeinen sollten die Konfidenzintervalle der BAF-Werte bei gut konzeptionierten Untersuchungen nicht 25 % übersteigen (5).
Prüfbericht
75. Der Prüfbericht muss folgende Informationen enthalten:
Prüfstoff
Versuchstierart
Prüfbedingungen
Ergebnisse
Auswertung der Ergebnisse
| Begriffsbestimmungen und Einheiten | Anlage 1 |
Künstliches Sediment oder formuliertes, rekonstituiertes oder synthetisches Sediment: ein Gemisch aus Stoffen, mit denen die physikalischen Bestandteile eines natürlichen Sediments nachgeahmt werden sollen.
Bioakkumulation: Konzentrationszunahme (Anreicherung) des Prüfstoffs in oder an einem Organismus bezogen auf die Prüfstoffkonzentration im umgebenden Medium; die Bioakkumulation ergibt sich aus Biokonzentrations- und Biomagnifikationsvorgängen (siehe unten).
Bioakkumulationsfaktor (BAF): zu jedem beliebigen Zeitpunkt während der Aufnahmephase dieses Bioakkumulationstests der Quotient aus der Konzentration des Prüfstoffs in/an dem Testorganismus (Ca in g·kg- 1 Feucht- oder Trockenmasse) und der Konzentration des Prüfstoffs im umgebenden Medium (Cs in g·kg- 1 Feucht- oder Trockenmasse des Sediments); entsprechend den Einheiten von Ca und Cs wird der BAF in kg Sediment kg- 1 Wurm angegeben (15).
Bioakkumulationsfaktoren: die direkt anhand des Verhältnisses der Sediment-Aufnahmekonstante zu den Eliminationskonstanten (ks und ke, siehe unten) berechnet werden; werden als kinetischer Bioakkumulationsfaktor (BAFK) bezeichnet.
Biokonzentration: Konzentrationszunahme (Anreicherung) des Prüfstoffs in oder an einem Organismus, ausschließlich aufgrund der Aufnahme über die Körperoberfläche, bezogen auf die Prüfstoffkonzentration im umgebenden Medium.
Biomagnifikation: die Konzentrationszunahme (Anreicherung) des Prüfstoffs in oder an einem Organismus, die hauptsächlich aus der Aufnahme des Prüfstoffs über kontaminiertes Futter oder kontaminierte Beute resultiert, bezogen auf die Prüfstoffkonzentration im Futter bzw. in der Beute; Biomagnifikation kann zum Transfer oder zur Anreicherung des Prüfstoffs in Nahrungsketten oder -netzen führen.
Biota-Sediment-Akkumulationsfaktor (BSAF): Quotient aus der auf den Lipidgehalt normierten Prüfstoffkonzentration in/an dem Testorganismus (Ca in g·kg-1 Lipidgehalt des Organismus) und der auf den organischen Kohlenstoffgehalt normierten Prüfstoffkonzentration im Sediment im Gleichgewichtszustand; Ca wird ausgedrückt in g·kg- 1 Lipidgehalt des Organismus; Cs wird in g·kg- 1 Gehalt des Sediments an organischen Bestandteilen angegeben.
Konditionierungsdauer: Zeitraum zur Stabilisierung der im Sediment vorhandenen Mikroorganismen und zur Abtrennung z.B. von Ammoniak, das aus Bestandteilen des Sediments erzeugt wurde; die Konditionierung erfolgt vor dem Dotieren des Sediments mit dem Prüfstoff. Gewöhnlich wird das Überstandswasser nach dem Konditionieren entsorgt.
Elimination eines Prüfstoffs: Ausscheidung des angereicherten Prüfstoffs aus dem Testorganismus durch aktive oder passive Prozesse, die unabhängig von An- oder Abwesenheit des Prüfstoffs im umgebenden Medium erfolgt.
Eliminationsphase: der Zeitraum, in dem nach Umsetzung der Testorganismen von kontaminiertem Medium in Prüfstofffreies Medium die Ausscheidung (oder der Nettoverlust) des Prüfstoffs durch die Testorganismen untersucht wird.
Eliminationskonstante (ke): der numerische Wert, der die Geschwindigkeit der Konzentrationsabnahme des Prüfstoffs in/an dem Testorganismus nach Umsetzung der Testorganismen aus einem mit dem Prüfstoff belasteten Medium in Prüfstofffreies Medium definiert; ke wird in Tag- 1 (d- 1) angegeben.
Ausgleichszeit: Zeit zur Verteilung des Prüfstoffs zwischen Festphase, Porenwasser und Überstandswasser; der Ausgleich erfolgt nach dem Dotieren des Sediments mit dem Prüfstoff und vor der Zugabe der Testorganismen.
Oktanol-Wasser-Verteilungskoeffizient (Kow): Verhältnis zwischen der Konzentration eines Stoffs in n-Oktanol und in Wasser im Gleichgewicht, auch als Pow-Wert ausgedrückt; der Logarithmus von Kow (log Kow) gilt als Maß für das Anreicherungspotenzial eines Stoffs in aquatischen Organismen.
Koeffizient für die Verteilung organischer Kohlenstoff/Wasser (Koc): Verhältnis der Gleichgewichtskonzentration der Chemikalie im/am organischen Kohlenstoffanteil im Sediment zu derjenigen im Wasser.
Überstandswasser: das im Prüfgefäß über dem Sediment stehende Wasser.
Plateau oder Gleichgewichtszustand (steady state): Gleichgewicht zwischen den während der Aufnahmephase simultan auftretenden Aufnahme- und Eliminationsvorgängen; der Gleichgewichtszustand in der grafischen Darstellung einer Probenahme des zeitbezogenen BAF ist erreicht, wenn die Kurve parallel zur Zeitachse verläuft und wenn drei aufeinander folgende BAF-Analysen an Proben, die im Abstand von mindestens zwei Tagen genommenen werden, um höchstens ± 20 % voneinander abweichen, bzw. wenn es keine statistisch signifikanten Unterschiede zwischen den Zeitabständen der drei Probenahmen gibt. Für Prüfstoffe, die nur langsam aufgenommen werden, ist ein zeitlicher Abstand zwischen den Probenahmen von sieben Tagen geeigneter (5).
Porenwasser oder Interstitialwasser: das Wasser in den Zwischenräumen zwischen Sediment- oder Bodenpartikeln.
Sediment-Aufnahmekonstante (ks): numerischer Wert, der die Geschwindigkeitsrate der Zunahme der Prüfstoffkonzentration im/am Testorganismus bei Anreicherung des Stoffs aus dem Sediment definiert. ks wird in g Sediment g- 1 Wurm d- 1 ausgedrückt.
Dotiertes Sediment: Sediment, zu dem der Prüfstoff hinzugegeben wurde.
Bioakkumulationsfaktor im Gleichgewichtszustand (steady state) (BAFss): BAF im Gleichgewichtszustand; ändert sich über einen längeren Zeitraum nicht wesentlich; die Konzentration des Prüfstoffs im umgebenden Medium (Cs ausgedrückt als g·kg- 1 Feucht- oder Trockenmasse des Sediments) ist während dieser Zeit konstant.
Aufnahme- oder Expositionsphase: Zeitraum, in dem die Testorganismen dem Prüfstoff ausgesetzt sind.
| Berechnung der Aufnahme- und Eliminationsparameter | Anlage 2 |
Hauptendpunkt eines Bioakkumulationstests ist der Bioakkumulationsfaktor (BAF). Zur Berechnung des gemessenen BAF bildet man den Quotienten aus der Konzentration des Prüfstoffs im Testorganismus (Ca) und der Konzentration des Prüfstoffs im Sediment (Cs) im Gleichgewichtszustand. Wenn der Gleichgewichtszustand in der Aufnahmephase nicht erreicht wird, ist der BAF auf die gleiche Weise für Tag 28 zu berechnen. Es ist allerdings anzugeben, ob der BAF auf Konzentrationen im steady state beruht, oder nicht.
Der kinetische Bioakkumulationsfaktor (BAFK), die Konstante der Sedimentaufnahme (ks) und die Eliminationskonstante (ke) sollten vorzugsweise mit Methoden zur nicht linearen Parameterabschätzung per Computer ermittelt werden. Ausgehend von den zeitbezogenen durchschnittlichen Akkumulationsfaktoren (Ca, Mittelwerte zu den einzelnen Zeitpunkten der Probenahme/Cs, Mittelwerte zu den einzelnen Zeitpunkten der Probenahme = AF) der Aufnahmephase bezogen auf die Feuchtmasse der Würmer und des Sediments und der Modellgleichung
| AF(t) = BAF × (1 - eke × t) | [Gleichung 1] |
wobei AF(t) = Verhältnis der Konzentration des Prüfstoffs in den Würmern und der Konzentration im Sediment zu einem beliebigen Zeitpunkt (t) während der Aufnahmephase ist, werden mit entsprechender Software die Werte für BAFK, ks und ke berechnet.
Wird während der Aufnahmephase ein Gleichgewichtszustand erreicht (d. h. t = ∞), kann Gleichung 1 reduziert werden auf:
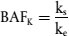 | [Gleichung 2] |
Dabei sind:
ks = Aufnahmekonstante im Gewebe [g Sediment kg- 1 Wurm d- 1]
ke = Eliminationskonstante [d- 1]
Damit stellt ks/ke × Cs eine Annäherung an die Konzentration des Prüfstoffs im Wurmgewebe im Gleichgewichtszustand (Ca,ss) dar.
Der Biota-Boden-Akkumulationsfaktor (BSAF) ist wie folgt zu berechnen:
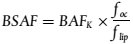
Dabei sind:
foc = Fraktion des organischen Kohlenstoffs im Sediment wahlweise bezogen auf die Trocken- oder die Feuchtmasse;
flip = Lipidfraktion in den Würmern wahlweise bezogen auf die Trocken- oder die Feuchtmasse.
Ausgehend von einer Zeitreihe von Konzentrationswerten kann die Eliminationskinetik mit folgenden Gleichungen und einer Computer-Berechnung nach einer nicht linearen Methode zur Parameterabschätzung modelliert werden.
Als Standard-Ausgangspunkt wird der Mittelwert der gemessenen Rückstände im Gewebe am Ende der Aufnahmephase empfohlen. Der aus der Aufnahmephase modellierte/geschätzte Wert sollte nur dann verwendet werden, wenn beispielsweise der gemessene Wert signifikant von dem im Modell bestimmten Rückstand im Gewebe abweicht. Zur alternativen Vorexposition von zur Elimination vorgesehenen Würmern siehe auch Nummer 50. Bei diesem Ansatz wird davon ausgegangen, dass Proben der vorexponierten Würmer an Tag 0 der Eliminationsphase ein realistisches Bild von den Rückständen im Körper bieten, das als Grundlage für die Ermittlung der Eliminationskinetik dienen kann.
Weisen die gegen die Zeit aufgetragenen Messwerte auf eine konstante exponentielle Abnahme der Prüfstoffkonzentration in den Tieren hin, so lässt sich der Eliminationsverlauf mit einem Ein-Kompartiment-Modell (Gleichung 4) beschreiben.
| Ca(t) = Ca,ss × e-ket | [Gleichung 3] |
Die Elimination kann zuweilen biphasisch verlaufen, mit einer raschen Abnahme von Ca in den Anfangsphasen und einem langsameren Verlust an Prüfstoff in den letzten Phasen der Elimination, z.B. (8)(19)(25). Erklären lassen sich die beiden Phasen mit der Annahme, dass es im Organismus zwei verschiedene Kompartimente gibt, aus denen der Prüfstoff mit unterschiedlichen Geschwindigkeiten eliminiert wird. Für diese Fälle wird auf die einschlägige Literatur verwiesen (15)(16)(17)(25).
Eine Elimination in zwei Kompartimenten wird z.B. mit der folgenden Gleichung beschrieben (25):
| Ca = A × e-ka×t + B × ekb × t | [Gleichung 4] |
A und B bezeichnen die Größe der Kompartimente (in Prozent der Summe der Rückstände im Gewebe), wobei sich der Stoffverlust in Kompartiment A rasch vollzieht und der Prüfstoff in Kompartiment B nur in geringem Umfang verloren geht. Die Summe von A und B ergibt 100 % des Volumens des vollständigen tierischen Kompartiments im Gleichgewichtszustand. ka und kb stehen für die entsprechenden Eliminationskonstanten [d- 1]. Wenn das Modell mit den beiden Kompartimenten auf die Ausscheidungsdaten übertragen wird, kann die Aufnahmekonstante ks wie folgt bestimmt werden (53)(54):
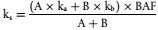 | [Gleichung 5] |
Trotzdem sind diese Modellgleichungen mit Vorsicht zu verwenden, insbesondere wenn sich die Bioverfügbarkeit des Prüfstoffs während des Tests ändert (42).
Alternativ zu den oben beschriebenen Modellgleichungen können die Kinetikparameter (ks und ke) auch in einem Durchlauf berechnet werden, indem die Kinetikmodellgleichung erster Ordnung auf alle Daten aus der Aufnahme- und der Eliminationsphase gemeinsam angewendet wird. Für die Beschreibung einer Methode, die eine solche kombinierte Berechnung der Aufnahme- und Eliminationskonstanten ermöglicht, wird auf (55), (56) und (57) verwiesen.
Die nicht eliminierten Rückstände (NER) sind als ein weiterer Endpunkt zu berechnen, indem das Verhältnis der durchschnittlichen Konzentration in den Würmern (Ca) an Tag 10 der Eliminationsphase zur durchschnittlichen Konzentration in den Würmern (Ca) im Gleichgewichtszustand (bzw. an Tag 28 der Aufnahmephase) mit 100 multipliziert wird:
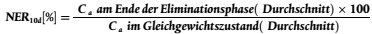
| Beispiel eines Probenahmeplans bei einem 28-Tägigen Bioakkumulationstest | Anlage 3 |
a) Aufnahmephase (einschließlich einer 4-tägigen Equilibrierungsphase)
| Tag | Arbeitsschritte |
| - 6 | Herstellung einer Torfsuspension für das Sediment; Konditionieren der Suspension für 48 h; |
| - 4 | Dotieren des Sediments oder der Sedimentfraktion; Mischen aller Bestandteile des Sediments; Entnahme von Proben des Sediments mit dem Prüfstoff und des Sediments aus der Lösungsmittelkontrolle zur Bestimmung der Konzentration des Prüfstoffs; Zugabe von Überstandswasser; Inkubation unter Prüfbedingungen (Equilibrierungsphase); |
| - 3 / - 2 | Entnahme der Testorganismen aus der Anzuchtkultur zwecks Akklimatisierung; |
| 0 | Messung der Wasserqualität (siehe Nummer 52); Entnahme von Replikaten zur Probenahme von Wasser- und Sedimentproben zur Ermittlung der Prüfstoffkonzentration; randomisierte Verteilung der Würmer auf die Prüfbecken; Aufbewahrung einer ausreichenden Anzahl an Unterproben der Würmer zur Bestimmung des analytischen Hintergrunds; Kontrolle der Luftzufuhr bei Verwendung eines geschlossenen Prüfsystems; |
| 1 | Entnahme von Replikaten zur Probenahme; Kontrolle der Luftzufuhr, des Verhaltens der Würmer und der Wasserqualität (siehe Nummer 56); Entnahme von Wasser, Sediment- und Wurmproben zur Bestimmung der Prüfstoffkonzentration; |
| 2 | Kontrolle von Luftzufuhr, Wurmverhalten und Temperatur; |
| 3 | wie Tag 1; |
| 4 - 6 | wie Tag 2; |
| 7 | wie Tag 1; gegebenenfalls Nachfüllen von verdunstetem Wasser; |
| 8 - 13 | wie Tag 2; |
| 14 | wie Tag 1; gegebenenfalls Nachfüllen von verdunstetem Wasser; |
| 15 - 20 | wie Tag 2; |
| 21 | wie Tag 1; gegebenenfalls Nachfüllen von verdunstetem Wasser; |
| 22 - 27 | wie Tag 2; |
| 28 | wie Tag 1; Messung der Wasserqualität (siehe Nummer 52); Ende der Aufnahmephase; Reservieren einer ausreichenden Anzahl von Teilproben von Würmern zur Bestimmung von analytischen Hintergrundwerten, Feucht- und Trockenmasse sowie Lipidgehalt; Umsetzen der Würmer aus den verbleibenden exponierten Replikaten in Gefäße mit sauberem Sediment für die Eliminationsphase (ohne Entleerung des Darminhalts); Entnahme von Wasser-, Sediment- und Wurmproben aus den Lösungsmittelkontrollen; Entnahme von Abscheidelösungen (wenn Abscheider vorhanden). |
| Die Arbeitsschritte vor der Exponierung (Equilibrierungsphase) sind unter Berücksichtigung der Eigenschaften des Prüfstoffs zu planen. Wenn erforderlich, wird das hergestellte Sediment unter dem Überstandswasser 7 Tage bei 20 ± 2 °C vorbehandelt. Das Sediment ist dann entsprechend früher herzustellen! | |
| Die für Tag 2 beschriebenen Arbeitsschritte sind täglich durchzuführen (mindestens an Werktagen). |
b) Eliminationsphase
| Tag | Arbeitsschritte |
| - 6 | Herstellung einer Torfsuspension für das Sediment; Konditionieren der Suspension für 48 h; |
| - 4 | Mischen aller Bestandteile des Sediments; Entnahme von Proben des Sediments mit dem Prüfstoff und des Sediments aus der Lösungsmittelkontrolle zur Bestimmung der Konzentration des Prüfstoffs; Zugabe von Überstandswasser; Inkubation unter Prüfbedingungen; |
| 0 (Tag 28 der Aufnahme- phase) | Messung der Wasserqualität (siehe Nummer 52); Umsetzen der Würmer aus den verbleibenden exponierten Replikaten in Gefäße mit sauberem Sediment; nach 4-6 h Entnahme von Replikaten zur Probenahme von Wasser-, Sediment- und Wurmproben zur Ermittlung der Prüfstoffkonzentration; randomisierte Verteilung der Würmer auf die Becken; |
| 1 | Entnahme von Replikaten zur Probenahme; Kontrolle der Luftzufuhr, des Verhaltens der Würmer und der Wasserqualität (siehe Nummer 52); Entnahme von Wasser, Sediment- und Wurmproben zur Bestimmung der Prüfsubstoffkonzentration; |
| 2 | Kontrolle von Luftzufuhr, Wurmverhalten und Temperatur; |
| 3 | wie Tag 1; |
| 4 | wie Tag 2; |
| 5 | wie Tag 1; |
| 6 | wie Tag 2; |
| 7 | wie Tag 1; gegebenenfalls Nachfüllen von verdunstetem Wasser; |
| 8 - 9 | wie Tag 2; |
| 10 | wie Tag 1; Ende der Eliminationsphase; Messung der Wasserqualität (siehe Nummer 52); Entnahme von Wasser-, Sediment- und Wurmproben aus den Lösungsmittelkontrollen; Entnahme von Abscheidelösungen (wenn Abscheider vorhanden). |
| Das Sediment wird vor Beginn der Eliminationsphase auf dieselbe Weise zubereitet wie vor der Aufnahmephase. | |
| Die für Tag 2 beschriebenen Arbeitsschritte sind täglich durchzuführen (mindestens an Werktagen). |
| Einige physikalisch-chemische Eigenschaften eines geeigneten Verdünnungswassers | Anlage 4 |
| Bestandteile | Konzentration |
| Partikelmaterial | < 20 mg/l |
| Gesamtgehalt an organischen Kohlenstoffen | < 2 µ g/l |
| Nichtionisiertes Ammonium | < 1 µ g/l |
| Restchlor | < 10 µ g/l |
| Gesamtanteil an organophosphorhaltigen Pestiziden | < 50 ng/l |
| Gesamtgehalt an chlororganischen Pestiziden und polychlorierten Bipheny- len | < 50 ng/l |
| Gesamtgehalt an organischem Chlor | < 25 ng/l |
Zusammensetzung des empfohlenen rekonstituierten Wassers
(a) Calciumchloridlösung11,76 g CaCl2 2H2O werden in entionisiertem Wasser gelöst; anschließend wird entionisiertes Wasser bis zu einem Volumen von 1 l hinzugegeben.
(b) Magnesiumsulfatlösung
4,93 g MgSO4 7H2O werden in entionisiertem Wasser gelöst; anschließend wird entionisiertes Wasser bis zu einem Volumen von 1 l hinzugegeben.
(c) Natriumbicarbonatlösung
2,59 g NaHCO3 werden in entionisiertem Wasser gelöst; anschließend wird entionisiertes Wasser bis zu einem Volumen von 1 l hinzugegeben.
(d) Kaliumchloridlösung
0,23 g KCl werden in entionisiertem Wasser gelöst; anschließend wird entionisiertes Wasser bis zu einem Volumen von 1 l hinzugegeben.
Alle Chemikalien müssen Analysequalität haben.
Die Leitfähigkeit des destillierten oder entionisierten Wassers darf höchstens 10 µScm- 1 betragen.
Von den Lösungen (a) bis (d) werden jeweils 25 ml gemischt; das Gesamtvolumen wird mit entionisiertem Wasser bis auf 1 l aufgefüllt. Die Summe der Calcium- und der Magnesiumionen in dieser Lösung beträgt 2,5 mmol/l.
Der Anteil von Ca- zu Mg-Ionen liegt bei 4:1 und der Anteil der Na- zu K-Ionen bei 10:1. Die Säurekapazität KS4,3 dieser Lösung beträgt 0,8 mmol/l.
Das Verdünnungswasser wird bis zur Sauerstoffsättigung belüftet und anschließend ohne weitere Belüftung bis zur Verwendung zwei Tage gelagert.
Ein annehmbares Verdünnungswasser sollte einen pH-Wert von 6-9 aufweisen.
| Künstliches Sediment - Empfehlungen für die Herstellung und Lagerung | Anlage 5 |
Anders als bei den Anforderungen der Prüfmethode C.8 (40) wird für das künstliche Sediment ein Torfgehalt von 2 % (statt 10 %) Trockenmasse empfohlen, damit ähnlich wie in natürlichen Sedimenten ein niedriger bis mäßiger Gehalt an organischen Bestandteilen gegeben ist (58).
Prozentanteil trockener Bestandteile des künstlichen Sediments:
| Bestandteile | Charakterisierung | % trockenes Sediment |
| Torf | Torfmoos, Zersetzungsgrad: ,mittel", luftgetrocknet, ohne sichtbare Pflanzenreste, fein gemahlen (Partikelgröße ≤ 0,5 mm). | 2 ± 0,5 |
| Quarzsand | Partikelgröße: ≤ 2 mm, aber > 50 % der Partikel sollten eine Größe im Bereich 50-200 µm haben. | 76 |
| Kaolin-Ton | Kaolinitgehalt ≤ 30 % | 22 ± 1 |
| Futter | Folia urticae, gemahlene Blätter von Urtica sp. (Brennnessel), fein gemahlen (Partikelgröße ≤ 0,5 mm) oder ein Gemisch aus gemahlenen Blättern von Urtica sp. mit Alpha-Cellulose (1:1); nach Arzneimittelstandard, zum menschlichen Verzehr; zusätzlich zum trockenen Sediment | 0,4 - 0,5 |
| Calciumcarbonat | CaCO3, in Pulverform, chemisch rein, zusätzlich zum trockenen Sediment | 0,05 - 1 |
| Entionisiertes Wasser | Leitfähigkeit ≤ 10 µS/cm, zusätzlich zum trockenen Sediment | 30 - 50 |
Wenn erhöhte Ammoniakkonzentrationen erwartet werden (beispielsweise wenn bekannt ist, dass der Prüfstoff die Nitrifikation hemmt), kann es hilfreich sein, 50 % des stickstoffreichen Brennnesselpulvers durch Cellulose (z.B. ±- Cellulosepulver, chemisch rein, PartikelgrÆße ≤ 0,5 mm) zu ersetzen.
Zubereitung
Der Torf wird luftgetrocknet und zu einem feinen Pulver (Partikelgröße ≤ 0,5 mm, keine sichtbaren Pflanzenrückstände) gemahlen. Mit einem Teil des zum trockenen Sediment hinzuzufügenden entionisierten Wassers wird mit einer Hochleistungs-Homogenisierungseinrichtung eine Suspension aus der benötigten Menge des Torfpulvers hergestellt. Zur Herstellung eines rührfähigen Torfschlamms hat sich ein Wasservolumen von 11,5 × Trockenmasse des Torfs bewährt (8).
Der pH-Wert dieser Suspension wird mit CaCO3 auf 5,5 ± 0,5 eingestellt. Die Suspension wird mindestens zwei Tage unter sanftem Rühren bei 20 ± 2 °C vorbereitet, damit sich der pH-Wert stabilisieren und ein stabiler Gehalt an Mikroorganismen entwickeln kann. Danach wird der pH-Wert nochmals gemessen und erforderlichenfalls mit CaCO3 auf 6,0 ± 0,5 eingestellt. Anschließend wird die gesamte Suspension mit den übrigen trockenen Bestandteilen gemischt; dabei sind die Dotierungsanteile zu beachten. Unter Zugabe des übrigen entionisierten Wassers wird ein homogenes Sediment hergestellt. Danach wird erneut der pH-Wert gemessen und erforderlichenfalls mit CaCO3 auf 6,5-7,5 eingestellt. Wenn davon ausgegangen wird, dass sich Ammoniak bildet, kann es hilfreich sein, den pH-Wert des Sediments unter 7,0 zu halten (z.B. zwischen 6,0 und 6,5). Anhand von Sedimentproben werden die Trockenmasse und der Gehalt an organischem Kohlenstoff bestimmt. Wenn eine Ammoniakbildung erwartet wird, kann das künstliche Sediment sieben Tage unter den Bedingungen des anschließenden Versuchs (z.B. Verhältnis Sediment:Wasser 1:4, Höhe der Sedimentschicht wie in den Prüfgefäßen) gelagert werden, bevor es mit dem Prüfstoff dotiert wird, d. h., das Sediment ist mit belüftetem Wasser aufzufüllen. Nach dieser Konditionierung ist das Überstandswasser zu entfernen und zu entsorgen. Anhand von Sedimentproben werden die Trockenmasse und der Gesamtgehalt an organischem Kohlenstoff bestimmt (z.B. anhand von drei Proben).
Anschließend wird der dotierte Quarzsand mit dem Sediment in den verschiedenen Konzentrationen gemischt; das Sediment wird auf die als Replikate zu verwendenden Prüfgefäße verteilt und mit dem Testwasser aufgefüllt (z.B. in einem Sediment-Wasser-Verhältnis von 1:4, Höhe der Sedimentschicht wie in den Prüfgefäßen). Danach werden die Gefäße unter den Bedingungen des durchzuführenden Versuchs konditioniert. Nun beginnt die Ausgleichszeit. Das Überstandswasser ist zu belüften.
Das ausgewählte Futter wird hinzugegeben, bevor oder während das Sediment mit dem Prüfstoff dotiert wird. Es kann anfänglich mit der Torfsuspension gemischt werden (s. o.). Ein übermäßiger Abbau des Futters vor der Zugabe der Testorganismen (z.B. bei langer Equilibrierungszeit) kann vermieden werden, indem der Zeitraum zwischen der Zugabe des Futters und dem Beginn der Exposition möglichst verkürzt wird. Um sicherzustellen, dass das Futter ausreichend mit dem Prüfstoff in Berührung kommt, ist das Futter spätestens am Tag der Dotierung des Prüfstoffs in das Sediment mit dem Sediment zu mischen. Ausnahmen sind möglich, wenn es aufgrund der Dauer der Equilibrierungsphase zu einem übermäßigen Abbau des Futters durch Mikroorganismen kommt, bevor die Testorganismen eingesetzt werden. Anhand von Sedimentproben werden die Trockenmasse und der Gesamtgehalt an organischem Kohlenstoff bestimmt (z.B. anhand von drei Proben des dotierten Sediments oder des Kontrollsediments).
Die Trockenmasse der Bestandteile (Torf, Sand und Kaolin) ist in g sowie als Prozentanteil der gesamten Trockenmasse anzugeben.
Das Volumen des bei der Herstellung des Sediments hinzuzugebenden Wassers ist ebenfalls in Prozent der gesamten Trockenmasse zu protokollieren. (Die Angabe 100 % Trockenmasse + 46 % Wasser beispielsweise bedeutet, dass auf 1.000 g (Trockenmasse) insgesamt 460 ml Wasser kommen; entsprechend ergibt sich eine Feuchtmasse des Sediments von 1.460 g.)
Lagerung
Die trockenen Bestandteile des künstlichen Sediments können an einem trockenen und kühlen Ort bei Raumtemperatur gelagert werden. Das hergestellte feuchte Sediment kann (zur späteren Verwendung ausschließlich in der Kultur) bei 4 ± 2 °C im Dunkeln über einen Zeitraum von 2-4 Wochen ab dem Tag der Herstellung aufbewahrt werden (8).
Das Sediment ist unmittelbar nach dem Auftragen des Prüfstoffs zu gebrauchen, sofern keine Informationen darüber vorliegen, dass das betreffende Sediment gelagert werden kann, ohne dass die Toxizität und Bioverfügbarkeit des Prüfstoffs beeinflusst wird. In diesem Fall können Proben des dotierten Sediments bis zur Analyse unter den für den betreffenden Prüfstoff empfohlenen Bedingungen gelagert werden.
| Empfohlene Oligochaeten-Arten für Bioakkumulationstests | Anlage 6 |
Tubifex tubifex (MÜLLER), Tubificidae, Oligochaeta
Der Schlammröhrenwurm (Tubificidae, Oligochaeta) Tubifex tubifex (Müller) bewohnt mit Schleim ausgekleidete Röhren in Süßwassersedimenten. In diesen Röhren leben die Würmer mit dem Kopf nach unten und nehmen Sedimentpartikel auf; verwertet werden die mit den Partikeln verbundenen Mikroorganismen sowie organische Abfälle. Der hintere Teil der Würmer treibt gewöhnlich im Überstandswasser, um die Tiere mit Sauerstoff zu versorgen. Tubifex tubifex bewohnt zwar vielfältige Sedimenttypen auf der gesamten nördlichen Halbkugel, bevorzugt aber verhältnismäßig feine Partikelgrößen (59). Die Eignung dieser Art für Ökotoxizitätsprüfungen wird beispielsweise in (8)(29)(31)(39)(60)(62)(63) bestätigt.
Kulturmethoden
Damit eine ausreichende Anzahl an Würmern (Tubifex tubifex) für die Bioakkumulationstests verfügbar ist, müssen die Würmer in einer Dauerkultur vorrätig gehalten werden. Für eine T.-tubifex-Kultur wird ein System mit einem künstlichen Sediment auf der Grundlage des künstlichen Bodens gemäß Prüfmethode C.8 (40) und mit rekonstituiertem Wasser nach Prüfmethode C.1 empfohlen (8).
Als Kulturgefäße können Glas- oder Edelstahlbehältnisse mit einer Höhe von 12-20 cm verwendet werden. In die Kulturgefäße wird jeweils eine Schicht des feuchten künstlichen Sediments gefüllt, das wie in Anlage 5 beschrieben hergestellt wurde. Die Sedimentschicht muss so tief sich, dass die Würmer sich in natürlicher Weise eingraben können (bei T. tubifex mindestens 2 cm tief). Zum System wird rekonstituiertes Wasser hinzugegeben. Dabei ist darauf zu achten, dass das Sediment möglichst wenig gestört wird. Der Wasserkörper ist mit einer Pasteur-Pipette, die etwa 2 cm über der Sedimentoberfläche angesetzt wird, schwach zu belüften (z.B. 2 Blasen mit 0,45 µm gefilterter Luft pro Sekunde). Die Testtemperatur sollte 20 ± 2 °C betragen.
Die Würmer werden bis zu einer Besatzdichte von maximal 20.000 Tieren/m2 Sedimentoberfläche eingesetzt. Eine höhere Besatzdichte kann das Wachstum und die Vermehrung der Tiere beeinträchtigen (43).
In Kulturen mit künstlichen Sedimenten müssen die Würmer gefüttert werden. Als Zusatzfutter kann fein gemahlenes Fischfutter (z.B. Tetra Min®) angeboten werden (8); Klerks 1994, persönliche Auskunft. Das Fütterungsprotokoll muss ein ausreichendes Wachstum und eine ausreichende Vermehrung ermöglichen und in der Kultur die Entstehung von Ammoniak und das Wachstum von Pilzenauf ein Minimum begrenzen. Das Futter kann zweimal wöchentlich bereitgestellt werden (z.B. 0,6-0,8 mg/cm2 Sedimentoberfläche). Praktische Erfahrungen haben gezeigt, dass die Bereitstellung von in entionisiertem Wasser suspendiertem und homogenisiertem Futter eine homogene Verteilung des Futters auf der Sedimentoberfläche in den Kulturbehältnissen erleichtert.
Um eine Anreicherung von Ammoniak zu vermeiden, ist das Überstandswasser mit einem Durchflusssystem oder mindestens einmal wöchentlich manuell auszutauschen. In den Stammkulturen ist das Sediment alle drei Monate zu wechseln.
Wenn ausschließlich adulte Würmer benötigt werden, kann die Entnahme aus der Kultur erfolgen, indem das Kultursediment durch ein Sieb mit einer Maschenweite von 1 mm gesiebt wird. Wenn Kokons ausgesiebt werden sollen, ist eine Maschenweite von 0,5 mm zu empfehlen; für juvenile Würmer ist eine Maschenweite von 0,25 mm geeignet. Die Siebe können nach dem Aussieben des Sediments in rekonstituiertes Wasser gestellt werden. Die Würmer verlassen dann das Sieb und können mit einer weichen Stahlpinzette oder mit einer feuerpolierten Pipette aus dem Wasser aufgenommen werden.
Zur Durchführung eines Tests und zur Anlage neuer Kulturen dürfen ausschließlich unversehrte und eindeutig identifizierte Exemplare der Art Tubifex tubifex (z.B. (64)) verwendet werden. Tote oder verletzte Würmer sowie von Pilzhyphen befallene Kokons sind zu entsorgen.
Aus einer synchronisierten Kultur können nach Bedarf in geeigneten Zeitabständen Würmer einer bestimmten Altersstufe entnommen werden. In den ausgewählten Intervallen (z.B. alle zwei Wochen) werden neue Kulturgefäße mit Tieren einer bestimmten Altersstufe (z.B. in Kokons) angesetzt. Bei den hier beschriebenen Kulturbedingungen haben die Würmer das adulte Stadium nach 8-10 Wochen erreicht. Die Kulturen können entnommen werden, wenn die Würmer neue Kokons abgelegt haben (etwa nach 10 Wochen). Die entnommenen adulten Tiere können für Tests verwendet werden, und mit den Kokons können neue Kulturen angelegt werden.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
Lumbriculus variegatus, Lumbriculidae, Oligochaeta, lebt ebenfalls weltweit in Süßwassersedimenten und wird häufig in Ökotoxizitätsprüfungen verwendet. Informationen zur Biologie, zu Kulturbedingungen und zur Empfindlichkeit dieser Art sind den Quellen (1)(6)(9)(36) zu entnehmen. Lumbriculus variegatus kann in dem auch für T. tubifex empfohlenen künstlichen Sediment kultiviert werden; dabei sind allerdings gewisse Einschränkungen zu beachten (8). Da L. variegatus in der Natur gröbere Sedimente bevorzugt als T. tubifex (59), können Laborkulturen mit dem für T. tubifex verwendeten künstlichen Sediment nach 4-6 Monaten zum Erliegen kommen. Erfahrungsgemäß kann L. variegatus in einem sandigen Substrat (z.B. Quarzsand oder feiner Kies) in einem Durchflusssystem mit Fischfutter über mehrere Jahre gehalten werden, ohne dass das Substrat erneuert werden muss. Ein wichtiger Vorzug von L. variegatus gegenüber anderen aquatischen Oligochaeten ist die rasche Vermehrung mit entsprechend rascher Zunahme der Biomasse bei in Labors gezogenen Populationen ((1), (6), (9) und (10)).
Kulturmethoden
Die Kulturbedingungen für Lumbriculus variegatus werden eingehend in Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1) und U.S. EPA (2000) (6) beschrieben. Im Folgenden werden diese Bedingungen kurz zusammengefasst.
Die Würmer können in großen Aquarien (57-80 l) bei 23 °C mit einer Photoperiode von 16 L:8 D (100-1.000 lx) und täglichem Austausch des natürlichen Wassers (45 - 50 l pro Aquarium) gezogen werden. Das Substrat wird hergestellt, indem ungebleichte braune Papiertücher in Streifen geschnitten und einige Sekunden mit Kulturwasser befeuchtet werden, damit ein Substrat aus kleinen Papierteilchen entsteht. Dieses Substrat kann dann umgehend im Aquarium zur Zucht von Lumbriculus verwendet werden, indem der Boden des Aquariums bedeckt wird; es kann aber auch in entionisiertem Wasser bis zur Verwendung zu einem späteren Zeitpunkt gefroren gelagert werden. In einem Becken hält das frische Substrat etwa zwei Monate.
Jede Wurmkultur wird mit 500-1.000 Würmern begonnen; die Würmer werden dreimal wöchentlich mit 10 ml einer Suspension mit 6 g Forellen-Starterfutter gefüttert (bei Erneuerung oder Durchflussbedingungen). Um der Ausbreitung von Bakterien und Pilzen entgegenzuwirken, werden statische und semistatische Kulturen seltener gefüttert. Das Futter und das Papiersubstrat werden auf die in Bioakkumulationstests zu verwendenden Stoffe untersucht.
Unter diesen Bedingungen verdoppelt sich die Anzahl der Tiere in der Kultur gewöhnlich in 10-14 Tagen.
Lumbriculus variegatus kann aus den Kulturen entnommen werden, z.B. indem das Substrat durch ein feinmaschiges Sieb gegeben wird oder indem die Organismen mit einer feuerpolierten Glaspipette mit weiter Öffnung (ca. 5 mm Durchmesser) in ein separates Becherglas gegeben werden. Wenn auch das Substrat in das Becherglas gegeben wird, ist das Glas mit den Würmern und dem Substrat über Nacht unter kontinuierlichem Durchfluss zu spülen; dabei wird das Substrat aus dem Glas abgetrennt, und die Würmer bleiben am Boden des Gefäßes zurück. Anschließend können die Würmer in die neuen Kulturbehältnisse gesetzt oder weiter im Test verwendet werden, wie in (1) und (6) beschrieben. Verletzungen und die Provokation von Autotomieverhalten sind zu vermeiden, beispielsweise durch Handhabung der Würmer mit Pipetten mit feuerpolierten Kanten oder mit Edelstahl-Zahnstochern.
Als kritisch ist zu bewerten, wenn sich L. variegatus in Tests zur Bioakkumulation in Sedimenten in der Reproduktionsphase befindet (Architomie nach Morphallaxis). Diese geschlechtslose Vermehrung führt zur Entstehung von zwei Fragmenten, die eine bestimmte Zeit keine Nahrung mehr aufnehmen, bis sich das Kopf- bzw. Schwanzende regeneriert hat (z.B. (36), (37)). Anders als bei Tubificiden, die sich nicht durch Teilung vermehren, kann bei L. variegatus keine kontinuierliche Aufnahme von Sedimenten und Verunreinigungen durch Ingestion erfolgen.
Daher sollte eine Synchronisierung vorgenommen werden, um die unkontrollierte Reproduktion und Regeneration und anschließend entsprechend große Unterschiede in den Testergebnissen zu minimieren. Diese Unterschiede können auftreten, wenn bei einigen einzelnen Tiere eine Fragmentierung stattgefunden hat und diese daher über einen bestimmten Zeitraum keine Nahrung aufnehmen und entsprechend weniger als andere Exemplare, die sich im Versuch nicht geteilt haben, durch den Prüfstoff belastet sind (38). 10-14 Tage vor Beginn der Exposition werden die Würmer manuell zerteilt (Synchronisierung) (65). Für den Test sind große Würmer zu verwenden, die keine Anzeichen einer kürzlich erfolgten Teilung aufweisen sollten. Diese Würmer können auf einen Glasträger in einen Tropfen Kulturwasser gesetzt und in der Mitte des Körpers mit einem Skalpell durchgeschnitten werden. Dabei ist allerdings darauf zu achten, dass die hinteren Enden ähnlich groß sind. Danach wird abgewartet, bis die hinteren Enden in einem Kulturgefäß, welches das auch in der Testkultur verwendete Substrat sowie rekonstituiertes Wasser enthält, neue Kopfteile ausgebildet haben. Erst dann kann mit der Exposition begonnen werden. Die Kopfteile haben sich dann regeneriert, wenn die synchronisierten Würmer sich im Substrat eingraben. (Dass sich Kopfteile regeneriert haben, kann zusätzlich durch Sichtprüfung einer repräsentativen Teilprobe unter einem binokularen Mikroskop festgestellt werden.) Danach kann davon ausgegangen werden, dass sich die Testorganismen in einem ähnlichen physiologischen Zustand befinden. Wenn bei synchronisierten Würmern während des Versuchs eine Reproduktion durch Morphallaxis erfolgt, ist also anzunehmen, dass praktisch alle Tiere in gleichem Umfang dem dotierten Sediment ausgesetzt wurden. Die synchronisierten Würmer werden gefüttert: wenn die Würmer beginnen, sich in das Substrat einzugraben, oder 7 Tage nach dem Zerteilen. Die Fütterung sollte etwa der Fütterung der regulären Kulturen vergleichbar sein; es kann sich jedoch empfehlen, die synchronisierten Würmer mit Futter derselben Herkunft wie im eigentlichen Versuch zu versorgen. Die Würmer sind bei der vorgesehenen Versuchstemperatur zu halten (d. h. bei 20 ± 2 °C). Nach der Regeneration werden unversehrte vollständige Würmer ähnlicher Größe, die nach einem leichten mechanischen Reiz aktiv schwimmen oder zu kriechen beginnen, für den Versuch verwendet. Verletzungen und die Provokation von Autotomieverhalten sind zu vermeiden, beispielsweise durch Handhabung der Würmer mit Pipetten mit feuerpolierten Kanten oder mit Edelstahl-Zahnstochern.
Wenn Lumbriculus variegatus verwendet wird, ist während des Tests unter angemessenen Bedingungen wegen der spezifischen Reproduktionsform bei dieser Art eine Erhöhung der Anzahl der Würmer zu erwarten (6). Eine fehlende Reproduktion bei einem Bioakkumulationstest mit L. variegatus ist zu protokollieren und bei der Interpretation der Testergebnisse zu berücksichtigen.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (im Ringtest nicht validiert)
Branchiura sowerbyi lebt in verschiedenen Sedimenttypen (in Stauseen, Seen, Teichen und Flüssen), ursprünglich in tropischen Regionen. Die Art ist aber auch in warmen Wasserkörpern in der nördlichen Hemisphäre anzutreffen. Häufiger kommt Branchiura sowerbyi allerdings in Schlamm-Ton-Sedimenten mit hohem Gehalt an organischen Bestandteilen vor. Die Würmer leben in der Sedimentschicht. Selbst das hintere Ende der Würmer ist gewöhnlich eingegraben. Diese Art ist an den Kiemenfilamenten am hinteren Teil leicht zu erkennen. Die adulten Tiere können eine Feuchtmasse von 40-50 mg und eine Länge von 9-11 cm erreichen. Sie verfügen über eine hohe Reproduktionsrate; die Populationen verdoppeln sich unter den im Folgenden beschriebenen Temperatur- und Fütterungsbedingungen in weniger als 2 Wochen (Aston et al., 1982, (65)). B. sowerbyi wurde bereits sowohl in Toxizitätstests als auch in Untersuchungen zur Bioakkumulation verwendet (Marchese und Brinkhurst 1996 (31) bzw. Roghair et al. 1996, (67)).
Kulturmethoden
Im Folgenden werden die Kulturbedingungen für Branchiura sowerbyi beschrieben (Angaben von Mercedes R. Marchese, INALI, Argentinien, und Carla J. Roghair, RIVM, Niederlande).
Die Testorganismen müssen nicht nach einem bestimmten Verfahren kultiviert werden. Die Kultivierung kann in nicht kontaminiertem, natürlichem Sediment erfolgen (31). Erfahrungsgemäß bietet ein aus natürlichem Sediment und Sand bestehendes Medium noch günstigere Lebensbedingungen für die Würmer als reines natürliches Sediment (32)(67). Für die Kultur können 3-l-Bechergläser mit einem aus 1.500 ml Sediment und Wasser bestehenden Medium mit 375 ml natürlichem nicht kontaminiertem Sediment (ca. 10 % TOC, ca. 17 % Partikel ≤ 63 µm), 375 ml sauberem Sand (M32) und 750 ml rekonstituiertem oder entchlortem Leitungswasser verwendet werden (31)(32)(67). Papiertücher sind ebenfalls als Kultursubstrat geeignet; die Vermehrung erfolgt dann allerdings langsamer als in natürlichem Sediment. In semistatischen Systemen wird die Wasserschicht im Becherglas langsam belüftet, und das Überstandswasser ist wöchentlich zu erneuern.
In jedes Becherglas werden zunächst 25 juvenile Würmer eingesetzt. Nach zwei Monaten werden die großen Würmer mit einer Pinzette aus dem Sediment genommen und in ein neues Becherglas mit frisch hergestelltem Sediment-Wasser-Medium eingesetzt. Das erste Becherglas enthält auch Kokons und juvenile Würmer. Auf diese Weise können bis zu 400 juvenile Würmer pro Becherglas gewonnen werden. Adulte Würmer können mindestens ein Jahr lang zur Vermehrung verwendet werden.
Die Kulturen sind bei einer Temperatur von 21-25 °C zu halten. Die Temperatur darf maximal um ± 2 °C schwanken. Die Entwicklung eines Embryos von der Eiablage bis zum Verlassen des Kokons dauert bei 25 °C gewöhnlich drei Wochen. Bei B. sowerbyi wurden bei einer Temperatur von 25 °C für jeden überlebenden Wurm im Schlamm 6,36 (31) bis 11,2 (30) Eier gezählt. Die Anzahl der Eier pro Kokon schwankt von 1,8-2,8 (66)(69) bis zu 8 (68).
Der Anteil des gelösten Sauerstoffs sowie die Temperatur und der pH-Wert sind wöchentlich zu messen. Fischfutter (z.B. Tetra Min®) kann nach Bedarf zwei- bis dreimal wöchentlich als Suspension angeboten werden. Alternativ können die Würmer auch mit aufgetautem Salat nach Bedarf gefüttert werden.
Ein wesentlicher Vorteil dieser Art ist die hohe individuelle Biomasse (bis zu 40-50 mg Feuchtmasse pro Tier). Daher kann diese Art für Bioakkumulationstests mit nicht radioaktiv markierten Prüfstoffen verwendet werden. Die Exposition kann in den auch für T. tubifex oder L. variegatus verwendeten Systemen mit jeweils einem Tier pro Replikat erfolgen (11). Wenn keine größeren Becken verwendet werden, ist die Anzahl der Replikate jedoch zu erhöhen (11). Außerdem ist bei dieser Art eine Anpassung in Bezug auf das als Validitätskriterium berücksichtigte Eingrabungsverhalten vorzunehmen.
(1) ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment- associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
(2) Europäische Kommission (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I - IV. Amt für Veröffentlichungen der Europäischen Gemeinschaften), Luxemburg.
(3) OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Cooperation and Development (OECD), Paris.
(4) Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J., und Winger, P.V. (1995). Toxicity and bioaccumulation of sedimentassociated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
(5) Kapitel C.13 dieses Anhangs, Biokonzentration: Durchfluss-Fischtest.
(6) U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sedimentassociated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
(7) Kapitel C.27 dieses Anhangs, Chironomiden-Toxizitätstest in Sediment-Wasser-Systemen mit dotiertem Sediment
(8) Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. und Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
(9) Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J., und Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
(10) Phipps, G.L., Ankley, G.T., Benoit, D.A., und Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sedimentassociated contaminants. Environ.Toxicol. Chem. 12, 269-279.
(11) Egeler, Ph., Römbke, J., Knacker, Th., Franke, C., und Studinger, G. (1999). Workshop on, Bioaccumulation: Sediment test using benthic oligochaetes", 26.-27.4.1999, Hochheim/Main, Deutschland. Abschlussbericht zum F + E-Vorhaben 298 67.419, Umweltbundesamt, Berlin.
(12) Egeler, Ph., Meller, M., Schallnaß, H.J., und Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. (Validierung einer Methode zur standardisierten Bioakkumulation mit endobenthischen aquatischen Oligochaeten) Report to the Federal Environmental Agency (Umweltbundesamt Dessau), UBA-FB 202 67.437.
(13) Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T., und (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301-310.
(14) Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel und R. Loskill (Hrsg.): Bioaccumulation in aquatic systems. Contributions to the assessment. Zusammenfassung des internationalen Workshop, Berlin 1990. VCH, Weinheim
(15) Landrum, P.F., Lee II, H., und Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709-1725.
(16) Markwell, R.D., Connell, D.W., und Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443-1450.
(17) Gabric, A.J., Connell, D.W., und Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225-1231.
(18) Kukkonen, J., und Landrum, P.F. (1994). Toxicokinetics and toxicity of sedimentassociated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
(19) Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D., und Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501-1514.
(20) OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
(21) U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological effects test guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
(22) Die folgenden Kapitel in diesem Anhang:
Kapitel A.4, DampfdruckKapitel A.5, Oberflächenspannung
Kapitel A.6, Wasserlöslichkeit
Kapitel A.8, Verteilungskoeffizient, Schüttelmethode
Kapitel A.24, Verteilungskoeffizient, HPLC-Methode
Kapitel C.7, Abbaubarkeit, Abiotischer Abbau: Hydrolyse in Abhängigkeit vom pH-Wert
Kapitel C.4 A-F, Bestimmung leichter biologischer Abbaubarkeit
Kapitel C.19, Schätzung des Adsorptionskoeffizienten (KOC) im Boden und in Klärschlamm mittels der Hochdruck-Flüssigchromatografie (HPLC).
Kapitel C.29, Leichte biologische Abbaubarkeit - Bestimmung von CO2 in geschlossenen Flaschen (Headspace- Test)
(23) OECD (1996). Direct phototransformation of chemicals in water. OECD-Veröffentlichungen zu Gesundheit und Arbeitsschutz, Reihe , Testing and Assessment", Nr. 3, OECD, Paris.
(24) Antoine, M.D., Dewanathan, S., und Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a nearinfrared hydrophobicity probe. Microchem. J. 43, 165-172.
(25) Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (Hrsg.), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation - New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235- 276.
(26) Spacie, A., und Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320.
(27) Hawker, D.W., und Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701-707.
(28) Brunson, E.L., Canfield, T.J., Ingersoll, C.J., und Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using fieldcollected oligochaetes and laboratory- exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
(29) Reynoldson, T.B., Thompson, S.P., und Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061-1072.
(30) Aston, R.J., und Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155-160.
(31) Marchese, M.R., und Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163-168.
(32) Roghair, C.J., und Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
(33) Kapitel C.1 dieses Anhangs, Akute Toxizität für Fische.
(34) OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Earlylife Stage Toxicity Test. OECD, Paris.
(35) Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J., und Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
(36) Leppänen, M.T. und Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
(37) Leppänen, M.T.,und Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
(38) Leppänen M.T., und Kukkonen, J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
(39) Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I., und Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
(40) Kapitel C.8 dieses Anhangs: Toxizität bei Regenwürmern.
(41) Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
(42) Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588-595.
(43) Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst und D.G. Cook (Hrsg.): Aquatic Oligochaeta Biology, 175-184. Plenum Press, New York.
(44) ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
(45) Hooftman, R.N., van de Guchte, K., und Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
(46) Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment? Chemosphere 32, 1897- 1905.
(47) Mount, D.R., Dawson, T.D., und Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
(48) Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L., und Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431-1436.
(49) Gardner, W.S., Frez, W.A., Cichocki, E.A., und Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
(50) Bligh, E.G., und Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911-917.
(51) De Boer, J., Smedes, F., Wells, D., und Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of totallipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
(52) Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Institut für Wasserqualität, Dänemark.
(53) Zok, S., Görge, G., Kalsch, W., und Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411-421
(54) Nagel, R. (1988). Umweltchemikalien und Fische - Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Germany.
(55) Janssen, M.P.M., A Bruins, T.H. De Vries und Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312.
(56) Van Brummelen, T.C., und Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277-285.
(57) Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M., und Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167-1171.
(58) Suedel, B.C., und Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
(59) Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310-386.
(60) Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratoryspiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785-790.
(61) Chapman, P.M., Farrell, M.A., und Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47-67.
(62) Chapman, P.M., Farrell, M.A., und Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69-78.
(63) Rodriguez, P., und Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (Hrsg.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
(64) Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
(65) Egeler, Ph., Meller, M., Schallnaß, H.J., und Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In Zusammenarbeit mit R. Nagel und B. Karaoglan. Bericht für das Umweltbundesamt Berlin, FKZ 202 67.429.
(66) Aston, R.J., Sadler, K.,und Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137-145.
(67) Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E., und Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for baseline toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
(68) Aston, R.J., (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89-94.
(69) Bonacina, C., Pasteris, A., Bonomi, G., und Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274"
C.47 Toxizitätsprüfung an Fischen im frühen Entwicklungsstadium 17
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie 210 (2013). Mithilfe von Prüfungen an Fischen in frühen Entwicklungsstadien sollen die letalen und subletalen Wirkungen von Chemikalien auf die geprüften Entwicklungsstadien und Tierarten bestimmt werden. Die Prüfungen liefern wertvolle Informationen für die Einschätzung der chronischen letalen und subletalen Wirkungen der Chemikalie auf andere Fischarten.
2. Die Prüfrichtlinie 210 basiert auf einem Vorschlag des Vereinigten Königreichs, der auf einer Tagung von OECD-Experten im November 1988 in Medmenham (Vereinigtes Königreich) erörtert und 2013 entsprechend den Erfahrungen bei der Anwendung der Prüfung sowie entsprechend den Empfehlungen eines OECD-Workshops über Toxizitätstests an Fischen, der im September 2010 stattfand, aktualisiert wurde (1).
3. Fische in frühen Entwicklungsstadien werden der in Wasser gelösten Prüfchemikalie in einer Reihe von Konzentrationen ausgesetzt. Eine Belastung im Durchflusssystem wird bevorzugt, doch wenn diese nicht möglich ist, ist auch ein semistatisches System möglich. Nähere Informationen sind dem OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures zu entnehmen (2). Zu Beginn der Prüfung werden die befruchteten Eier in die Prüfkammern gesetzt. Die Dauer der Prüfung hängt bei jeder Tierart davon ab, wie lange die Kontrollfische brauchen, um ein juveniles Entwicklungsstadium zu erreichen. Die letalen und subletalen Wirkungen werden bewertet und mit den Kontrollwerten verglichen, um die LOEC (niedrigste Konzentration mit beobachteter Wirkung) und somit i) die NOEC (Konzentration ohne beobachtete Wirkung) und/oder ii) den ECx-Wert (z.B. EC10, EC20) anhand eines Regressionsmodells zu bestimmen, um zu schätzen, welche Konzentration eine Veränderung der gemessenen Wirkung um x % hervorrufen würde. Die Protokollierung der Konzentrationen und Parameter, bei denen relevante Wirkungen auftreten, hängt vom jeweiligen Rechtsrahmen ab. Die Prüfkonzentrationen sollten die ECx einschließen, damit der ECx-Wert nicht extrapoliert werden muss, sondern durch Interpolation bestimmt werden kann (siehe Definitionen in Anlage 1).
4. Mit dem Begriff "Prüfchemikalie" wird das bezeichnet, was geprüft wird. Die Wasserlöslichkeit (siehe Kapitel A.6) und der Dampfdruck (siehe Kapitel A.4) der Prüfchemikalie sollten bekannt sein, und ein zuverlässiges Analyseverfahren für die Quantifizierung der Prüfchemikalie in den Prüflösungen mit bekannter und dokumentierter Wiederfindungsrate und Bestimmungsgrenze sollte vorhanden sein. Obwohl dies für die Durchführung der Prüfung nicht notwendig ist, können die Ergebnisse einer Prüfung auf akute Toxizität (siehe Kapitel C.1 oder C.49), die vorzugsweise mit den für diese Prüfung gewählten Spezies durchgeführt wurde, nützliche Informationen liefern.
5. Wenn die Prüfmethode zur Prüfung eines Gemischs angewandt wird, sollte die Zusammensetzung des Gemischs so genau wie möglich charakterisiert werden, z.B. durch Angabe der chemischen Identität, des quantitativen Vorkommens und der stoffspezifischen Eigenschaften der Komponenten (wie oben erwähnt). Bevor die Prüfmethode zur gesetzlich vorgeschriebenen Prüfung eines Gemischs angewendet wird, sollte geprüft werden, ob sie für solche Zwecke geeignete Ergebnisse liefern kann.
6. Zu nützlichen Informationen zählen die Strukturformel, die Reinheit des Stoffs, die Wasserlöslichkeit, die Stabilität in Wasser, die Lichtbeständigkeit, pKa, Pow und die Ergebnisse einer Prüfung auf leichte biologische Abbaubarkeit (z.B. Kapitel C.4 oder C.29).
7. Eine Prüfung wird als valide betrachtet, wenn folgende Bedingungen erfüllt sind:
8. Wird eine geringfügige Abweichung von den Validitätskriterien beobachtet, sollte geprüft werden, welche Folgen dies für die Zuverlässigkeit der Testdaten hat, und diese Erwägungen sollten in den Bericht aufgenommen werden. Wirkungen auf Überleben, Schlupferfolg oder Wachstum in der Lösungsmittelkontrolle im Vergleich zur Negativkontrolle sollten angegeben und im Hinblick auf die Zuverlässigkeit der Testdaten erörtert werden.
Prüfkammern
9. Es können beliebige Gefäße aus Glas, Edelstahl oder einem anderen chemisch inerten Werkstoff verwendet werden. Da Silikon bekanntermaßen stark absorbierend auf lipophile Stoffe wirkt, sollte die Verwendung von Silikonschläuchen in Durchflussstudien sowie von Silikondichtungen in Kontakt mit Wasser z.B. durch den Einsatz von Aquarien aus Monoblockglas auf ein Minimum reduziert werden. Die Gefäße sollten so bemessen sein, dass ein hinreichendes Wachstum in der Kontrolle, die Erhaltung der Konzentration an gelöstem Sauerstoff (z.B. bei kleinen Fischarten wird dies bei 7 l Fassungsvermögen erreicht) und die Einhaltung der Besatzratenkriterien gemäß Nummer 19 gewährleistet sind. Es wird empfohlen, die Prüfkammern nach dem Zufallsprinzip in dem Prüfbereich anzuordnen. Einem randomisierten Blockkonzept, bei dem jede Behandlung in jedem Block vorhanden ist, einem vollständig randomisierten Konzept vorzuziehen. Die Prüfkammern sollten vor unerwünschten Störungen geschützt werden. Das Testsystem sollte vorzugsweise so lange mit den Konzentrationen der Prüfchemikalie konditioniert werden, dass die Aufrechterhaltung stabiler Expositionskonzentrationen nachgewiesen werden kann, bevor Prüforganismen eingesetzt werden.
Auswahl der Tierart
10. Empfohlene Fischarten werden in Tabelle 1 genannt. Dies schließt die Verwendung anderer Arten zwar nicht aus, doch ist das Testsystem unter Umständen anzupassen, um geeignete Prüfbedingungen zu schaffen. In diesem Fall sollten die Gründe für die Auswahl der Tierart und der Methode dokumentiert werden.
Haltung der Zuchtfische
11. Nähere Angaben zur Haltung der Testspezies sind Anlage 3 und den Literaturhinweisen (3) (4) (5) zu entnehmen.
Handhabung von befruchteten Eiern, Embryonen und Larven
12. Befruchtete Eier, Embryonen und Larven können der Prüfchemikalie anfänglich innerhalb des Hauptgefäßes in kleineren Behältern aus Glas oder Edelstahl ausgesetzt werden, die an den Seiten und Enden mit Sieben versehen sind, damit die Prüflösung durch das Gefäß hindurchfließen kann. Einen wirbelfreien Durchfluss durch diese kleinen Gefäße kann man dadurch herbeiführen, dass man diese an einem Arm aufhängt, der das Gefäß auf- und abbewegt, dabei jedoch die Organismen immer mit der Prüflösung bedeckt hält. Befruchtete Eier von Salmoniden können auf Einschüben oder Gittern gehältert werden, deren Öffnungen groß genug sind, dass die Larven nach dem Schlüpfen hindurchfallen können.
13. Werden Eierbehälter, Gitter oder Siebe verwendet, um die Eier innerhalb des Hauptprüfgefäßes zu halten, sollten diese Rückhaltevorrichtungen nach dem Schlüpfen der Larven entfernt werden (siehe Leitlinie in Anlage 3); Siebe sollten nur bleiben, um die Larven an der Flucht zu hindern. Müssen die Larven umgesetzt werden, sollten sie nicht der Luft ausgesetzt werden, und es sollten keine Netze verwendet werden, um Fische aus Eierbehältern zu entnehmen. Der Zeitpunkt für diese Umsetzung ist von Art zu Art unterschiedlich und sollte im Bericht dokumentiert werden. Ein Umsetzen ist auch nicht immer erforderlich.
Wasser
14. Als Testwasser kann jedes beliebige Wasser verwendet werden, in dem die zu prüfende Art über einen längeren Zeitraum überleben und wachsen kann (siehe Anlage 4). Während der gesamten Prüfdauer sollte eine konstante Wasserqualität gewährleistet sein. Um sicherzustellen, dass das Verdünnungswasser das Prüfergebnis nicht übermäßig beeinflusst (beispielsweise durch Komplexierung der Prüfchemikalie) oder sich nachteilig auf die Leistung des Zuchtbestands auswirkt, sollten in Abständen Proben zur Analyse entnommen werden. Bei Verdünnungswasser von bekanntermaßen relativ stabiler Qualität sollten beispielsweise halbjährlich der Gehalt an Schwermetallen (z.B. Cu, Pb, Zn, Hg, Cd und Ni), größeren Anionen und Kationen (z.B. Ca2+, Mg2+, Na+, K+, Cl-, SO42-), Ammoniak, der Gesamtgehalt an chlorierten Pestiziden, der gesamte organische Kohlenstoff (TOC) und der Schwebstoffgehalt bestimmt werden. Ist bekannt, dass die Wasserqualität schwankt, müssen die Messungen häufiger durchgeführt werden; wie häufig hängt davon ab, wie stark die Qualität schwankt. Einige chemische Merkmale eines akzeptablen Wassers sind in Anlage 4 angegeben.
Prüflösungen
15. Bei Durchflussprüfungen ist ein System erforderlich, das eine Stammlösung der Prüfchemikalie kontinuierlich abgibt und verdünnt (z.B. Dosierpumpe, Proportionalverdünnungsvorrichtung, Sättigersystem), um den Prüfkammern eine Reihe von Konzentrationen zuzuführen. Die Durchsatzraten der Stammlösung und des Wassers sollten während der Prüfung in Abständen überprüft werden und während der gesamten Prüfung um nicht mehr als 10 % schwanken. Eine Durchsatzrate, die zumindest dem fünffachen Kammervolumen in 24 Stunden entspricht, hat sich als geeignet erwiesen (3). Wenn jedoch die unter Nummer 19 angegebene Besatzrate eingehalten wird, ist eine geringere Durchsatzrate von z.B. 2 bis 3 Prüfkammervolumina möglich, um ein schnelles Entfernen des Futters zu verhindern.
16. Die Prüflösungen werden durch Verdünnung einer Stammlösung auf die gewünschten Konzentrationen eingestellt. Die Stammlösung sollte vorzugsweise durch einfaches Mischen oder Einrühren der Prüfchemikalie in das Verdünnungswasser mit mechanischen Mitteln (z.B. Rührwerk und/oder Ultraschall) hergestellt werden. Zur Herstellung einer Stammlösung in geeigneter Konzentration können Sättigungssäulen (Löslichkeitssäulen) oder passive Dosierungsmethoden (6) verwendet werden. Die Verwendung von Lösungsmitteln wird nicht empfohlen. Ist jedoch ein Lösungsmittel erforderlich, so sollte parallel eine Lösungsmittelkontrolle mit derselben Konzentration wie bei der Prüfchemikalie geprüft werden, d. h. das Lösungsmittelniveau sollte bei allen Konzentrationen und in der Lösungsmittelkontrolle gleich sein. Bei einigen Verdünnungssystemen kann dies technisch schwierig sein; hier sollte die Lösungsmittelkonzentration in der Lösungsmittelkontrolle der höchsten Lösungsmittelkonzentration in der Behandlungsgruppe entsprechen. Bei schwierig zu prüfenden Stoffen sollte das OECD Guidance Document No. 23 on aquatic toxicity testing of difficult substances and mixtures herangezogen werden (2). Falls ein Lösungsmittel verwendet wird, hängt die Wahl von den chemischen Eigenschaften des Stoffs ab. Im OECD Guidance Document No. 23 wird eine Höchstkonzentration von 100 µl/l empfohlen. Um eine potenzielle Wirkung des LÆsungsmittels auf die gemessenen Endpunkte zu vermeiden (7), empfiehlt es sich, die Lösungsmittelkonzentration so gering wie möglich zu halten.
17. Bei einer semistatischen Prüfung können zwei verschiedene Verfahren zur Erneuerung des Prüfmediums eingesetzt werden. Entweder werden neue Prüflösungen in sauberen Gefäßen hergestellt und überlebende Eier und Larven vorsichtig in die neuen Behälter umgesetzt oder die Prüforganismen bleiben in den Prüfgefäßen, während ein Teil (mindestens zwei Drittel) der Prüflösung bzw. des Kontrollvolumens ausgetauscht wird.
Expositionsbedingungen
Dauer
18. Die Prüfung sollte sobald wie möglich nach der Befruchtung der Eier beginnen. Die befruchteten Eier sollten vorzugsweise vor Beginn des Blastula Stadium oder sobald wie möglich danach in die Prüflösung eingetaucht werden. Die Dauer der Prüfung ist von der verwendeten Tierart abhängig. Einige Empfehlungen sind Anlage 2 zu entnehmen.
Besatz
19. Die Anzahl an befruchteten Eiern bei Beginn der Prüfung sollte zur Erfüllung von statistischen Anforderungen hinreichend groß sein. Die Eier sollten nach dem Zufallsprinzip auf die Behandlungen verteilt werden, und je Konzentration sollten mindestens 80 befruchtete Eier, zu gleichen Teilen auf mindestens vier parallele Prüfkammern aufgeteilt, verwendet werden. Die Besatzrate (Biomasse je Volumen an Prüflösung) sollte gering genug sein, dass während des Ei- und Larvenstadiums eine Konzentration an gelöstem Sauerstoff von mindestens 60 % des Luftsauerstoff-Sättigungswerts ohne Belüftung aufrechterhalten werden kann. Bei Durchflussprüfungen wurde eine Besatzrate von nicht mehr als 0,5 g/l Nassgewicht je 24 Stunden und nicht mehr als 5 g/l Lösung zu jeder Zeit empfohlen (3).
Licht und Temperatur
20. Fotoperiode und Wassertemperatur sind der geprüften Fischart anzupassen (siehe Anlage 2).
Fütterung
21. Futter und Fütterung sind von entscheidender Bedeutung. Wichtig ist, dass das für jedes Entwicklungsstadium geeignete Futter ab dem richtigen Zeitpunkt und in ausreichender Menge zur Unterstützung eines normalen Wachstums bereitgestellt wird. Die Fütterung sollte bei allen Replikaten ungefähr gleich sein, außer wenn es zur Berücksichtigung der Mortalität angepasst wird. Überschüssiges Futter und Exkremente sollten gegebenenfalls entfernt werden, um eine Anreicherung von Abfällen zu vermeiden. Ausführliche Fütterungspläne sind Anlage 3 zu entnehmen. Doch mit zunehmender Erfahrung sollten Futter und Fütterungspläne zur Optimierung von Überlebensrate und Wachstum kontinuierlich verfeinert werden. Lebendfutter sorgt für eine bessere Ausgestaltung des Lebensumfelds und sollte daher anstelle von oder zusätzlich zu Trockenfutter oder gefrorenem Futter verwendet werden, wenn es für die betreffende Fischart und das jeweilige Entwicklungsstadium geeignet ist.
Prüfkonzentrationen
22. Normalerweise werden fünf Konzentrationen der Prüfchemikalie mit mindestens vier Replikaten pro Konzentration und einem konstanten Abstandsfaktor von maximal 3,2 benötigt. Falls Daten über die akute Toxizität vorliegen, die vorzugsweise an derselben Fischart und/oder durch einen Dosisfindungstest ermittelt wurden, sollten sie bei der Wahl des Bereichs an Prüfkonzentrationen berücksichtigt werden (1). Jedoch sollten bei der Wahl des Bereichs an Prüfkonzentrationen alle Informationsquellen berücksichtigt werden, einschließlich Quellen wie z.B. read across, Daten zur akuten Toxizität bei Fischembryonen. Sollen lediglich empirische NOEC-Werte bestimmt werden, kann ein Limit-Test oder ein erweiterter Limit-Test mit weniger als fünf Konzentrationen als endgültiger Test akzeptabel sein. Die Verwendung von weniger als fünf Konzentrationen muss begründet werden. Höhere Konzentrationen der Prüfchemikalie als die LC50 über 96 Stunden oder 10 mg/l, je nachdem, welche Konzentration niedriger ist, müssen nicht geprüft werden.
Kontrollen
23. Zusätzlich zur Reihe der Prüfchemikalienkonzentrationen sollten eine Verdünnungswasserkontrolle und gegebenenfalls eine Lösungsmittelkontrolle, die nur den Lösungsmittelträger enthält, durchgeführt werden (siehe Nummer 16).
Häufigkeit von Analysen und Messungen
24. Vor Beginn der Exposition ist sicherzustellen, dass das System zur Verteilung der Chemikalie auf alle Replikate einwandfrei funktioniert (z.B. durch Messung der Prüfkonzentrationen). Die erforderlichen Analysemethoden, einschließlich einer geeigneten Bestimmungsgrenze, sollten festgelegt werden, und die Stabilität der Chemikalie im Prüfsystem muss hinreichend bekannt sein. Zur Beschreibung der Exposition sind die Konzentrationen der Prüfchemikalie während der Prüfung in regelmäßigen Zeitabständen zu bestimmen. Mindestens fünf Bestimmungen sind notwendig. In Durchflusssystemen sollte die Prüfchemikalie mindestens einmal pro Woche in einem Replikat pro Konzentration analysiert werden, wobei systematisch zwischen den Replikaten abzuwechseln ist. Durch zusätzliche Analysen lässt sich die Qualität des Prüfergebnisses häufig verbessern. Es kann erforderlich sein, die Proben zu filtrieren (z.B. mit einer Porengröße von 0,45 µm) oder zu zentrifugieren, um Partikel zu entfernen und sicherzustellen, dass die Bestimmungen an der Prüfchemikalie in echter Lösung vorgenommen werden. Um die Adsorption der Prüfchemikalie zu verringern, sollten die Filter vor der Verwendung gesättigt werden. Werden die gemessenen Konzentrationen nicht innerhalb von 80 bis 120 % der Nominalkonzentration gehalten, so sollten die Konzentrationen, die Wirkungen hervorrufen, bestimmt und im Fall von Durchflussprüfungen im Verhältnis zum arithmetischen Mittel der Konzentration (zur Berechnung des arithmetischen Mittels siehe Anlage 6 der Prüfmethode C.20 (8)) und im Fall von semistatischen Prüfungen im Verhältnis zum geometrischen Mittel der gemessenen Konzentrationen ausgedrückt werden (siehe Kapitel 5 im OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures (2)).
25. Während der Prüfung sind in allen Prüfgefäßen der gelöste Sauerstoff, der pH-Wert und die Temperatur mindestens wöchentlich sowie der Salzgehalt und die Härte, falls relevant, am Anfang und Ende der Prüfung zu messen. Es wird empfohlen, dass die Temperatur in mindestens einem Prüfgefäß kontinuierlich überwacht wird.
Beobachtungen
26. Stadium der Embryonalentwicklung: Das Embryonalstadium zu Beginn der Exposition gegenüber der Prüfchemikalie sollte so genau wie möglich überprüft werden. Dies kann mithilfe einer repräsentativen Probe von Eiern erfolgen, die in geeigneter Form aufbewahrt und gereinigt wurden.
27. Schlüpfen und Überleben: Beobachtungen zum Schlüpfen und Überleben sollten zumindest einmal pro Tag erfolgen, und die jeweiligen Zahlen sollten protokolliert werden. Ist in einem frühen Stadium der Embryonalentwicklung Schimmelbefall bei Eiern zu beobachten (z.B. an Tag 1 oder 2 der Prüfung), sollten diese Eier gezählt und entfernt werden. Tote Embryonen, Larven und Jungfische sollten sofort nach Feststellung entfernt werden, da sie sich rasch zersetzen und durch die anderen Fische zerlegt werden können. Bei der Entfernung ist äußerste Sorgfalt angezeigt, um benachbarte Eier/Larven nicht körperlich zu beschädigen. Je nach Fischart und Entwicklungsstadium gelten unterschiedliche Kriterien zur Bestimmung des Todes:
28. Abnormes Aussehen: Die Anzahl der Larven oder Jungfische, die eine abnorme Körperform aufweisen, sollte in angemessenen Abständen in Abhängigkeit von der Dauer der Prüfung und der Art der beschriebenen Abnormität protokolliert werden. Zu beachten ist, dass abnorme Larven und Jungfische auch von Natur aus auftreten und bei einigen Arten in der Größenordnung von mehreren Prozent bei den Kontrollen liegen können. Bei so schwerwiegenden Fehlbildungen mit den entsprechenden abnormen Verhaltensweisen, dass der Organismus erheblich leidet und keine Erholung mehr eintritt, kann dieser aus der Prüfung entfernt werden. Solche Tiere sollten getötet und bei der anschließenden Datenanalyse als Sterbefälle behandelt werden. Bei den meisten in dieser Prüfmethode empfohlenen Arten wurde eine normale Embryonalentwicklung dokumentiert (9) (10) (11) (12).
29. Abnormes Verhalten: Abnormitäten, z.B. Hyperventilation, unkoordiniertes Schwimmen, atypische Ruhe und atypisches Fressverhalten, sollten in angemessenen Abständen in Abhängigkeit von der Dauer der Prüfung protokolliert werden (z.B. einmal täglich bei Warmwasserarten). Diese Auswirkungen lassen sich zwar nur schwer quantifizieren, können aber bei der Interpretation von Mortalitätsdaten helfen.
30. Gewicht: Am Ende des Tests werden alle überlebenden Fische mindestens auf Replikatbasis gewogen (wobei die Anzahl der Tiere im Replikat und das mittlere Gewicht pro Tier angegeben wird): das Nassgewicht (trocken getupft) wird bevorzugt, jedoch kann auch das Trockengewicht angegeben werden (13).
31. Länge: Am Ende des Tests wird die Länge der einzelnen Fische gemessen. Empfohlen wird die Messung der Gesamtlänge; kommt es jedoch zu Schwanzflossenfäule oder Flossenerosion, kann die Standardlänge herangezogen werden. Bei allen Fischen in einem bestimmten Test sollte dieselbe Methode angewandt werden. Die Fische können z.B. entweder mit einem Messschieber, einer Digitalkamera oder einem geeichten Okularmikrometer gemessen werden. Die typischen Mindestlängen sind in Anlage 2 festgelegt.
Auswertung der Ergebnisse
32. Der Versuchsplan und die gewählte Statistikmethode sollten eine ausreichende statistische Aussagekraft (mindestens 80 %) besitzen, damit Änderungen von biologischer Bedeutung bei den Endpunkten erkannt werden können, für die eine NOEC anzugeben ist. Die Angabe der Konzentrationen und Parameter, bei denen relevante Wirkungen auftreten, kann vom jeweiligen Rechtsrahmen abhängen. Ist eine ECx anzugeben, sollten der Versuchsaufbau und das gewählte Regressionsmodell es erlauben, die ECx so zu schätzen, dass i) das für die ECx angegebene 95 %-Konfidenzintervall keine Null enthält und nicht übermäßig breit ist, ii) das 95 %-Konfidenzintervall für den vorhergesagten Mittelwert bei der ECx nicht den Mittelwert der Kontrolle enthält, und iii) das Regressionsmodell keinen signifikanten Lack-of-Fit gegenüber den Daten aufweist. Bei beiden Ansätzen muss die prozentuale Änderung bei jedem Endpunkt festgestellt werden, der nachgewiesen oder geschätzt werden muss. Der Versuchsaufbau sollte entsprechend angepasst werden. Wenn die obigen Bedingungen für die Bestimmung der ECx nicht erfüllt sind, sollte der NOEC-Ansatz angewandt werden. Da es unwahrscheinlich ist, dass derselbe Prozentsatz bei allen Endpunkten zutrifft oder dass ein durchführbarer Versuch geplant werden kann, der diese Kriterien bei allen Endpunkten erfüllt, sollte man sich bei der Versuchsplanung auf die Endpunkte konzentrieren, die für den jeweiligen Versuch von Bedeutung sind. Die Flussdiagramme und Leitlinien für die statistische Vorgehensweise bei jedem Ansatz sind den Anlagen 5 und 6 zu entnehmen und können bei der Auswertung der Daten und bei der Wahl der am besten geeigneten statistischen Methode oder des zu verwendenden Modells als Leitlinie herangezogen werden. Es können andere statistische Ansätze angewandt werden, sofern sie wissenschaftlich begründet sind.
33. Streuungen innerhalb jeder Reihe von Replikaten müssen durch Varianzanalyse oder Kontingenztabellenverfahren analysiert werden, und es müssen geeignete statistische Analysemethoden basierend auf dieser Analyse angewandt werden. Für einen Mehrfachvergleich zwischen den Ergebnissen bei den einzelnen Konzentrationen und den Ergebnissen der Kontrollen werden der Jonckheere-Terpstra-Test (Step-Down) oder der Williams-Test bei kontinuierlichen Wirkungen und der Cochran-Armitage-Test (Step-Down) bei quantalen Wirkungen, die einer monotonen Konzentrations-Wirkungs-Beziehung entsprechen und keine Hinweise auf eine extrabinomiale Varianz zeigen, empfohlen (14). Sind Hinweise auf eine extrabinomiale Varianz vorhanden, wird die Rao-Scott-Abwandlung des Cochran-Armitage-Tests (15) (16) oder der Williams- oder Dunnett-Test (nach einer Arkussinus-Quadratwurzeltransformation) oder der auf Replikatanteile angewandte Jonckheere-Terpstra-Test empfohlen. Entsprechen die Daten keiner monotonen Konzentrations-Wirkungs-Beziehung, können die Dunnett- oder Dunn- oder Mann-Whitney-Methode bei kontinuierlichen Wirkungen und der exakte Test nach Fisher bei quantalen Wirkungen hilfreich sein (14) (17) (18). Bei der Anwendung jeder statistischen Methode oder jedes statistischen Modells muss darauf geachtet werden, dass die Anforderungen der Methode bzw. des Modells erfüllt werden (z.B. Schätzung der Variabilität von Kammer zu Kammer und Berücksichtigung bei der Versuchsplanung oder dem verwendeten Modell). Die Normalität der Daten ist zu bewerten. In Anlage 5 wird angegeben, wie die Residuen einer ANOVA zu behandeln sind. Anlage 6 enthält zusätzliche Erwägungen zum Regressionsansatz. Zur Einhaltung der Anforderungen eines statistischen Tests sollten Transformationen in Betracht gezogen werden. Jedoch erfordern Transformationen, die die Anpassung eines Regressionsmodells ermöglichen, große Sorgfalt, da beispielsweise eine 25 %ige Änderung bei der nicht transformierten Wirkung nicht einer 25 %igen Änderung bei einer transformierten Wirkung entspricht. In allen Analysen bildet die Prüfkammer und nicht der einzelne Fisch die Analyse- und Versuchseinheit, und sowohl die Hypothesentests als auch die Regression sollten dies widerspiegeln (3) (14) (19) (20).
Prüfbericht
34. Der Prüfbericht sollte folgende Angaben enthalten:
Prüfchemikalie:
Einkomponentiger Stoff:
Mehrkomponentiger Stoff, UVCB-Stoffe und Gemische:
Geprüfte Fischart:
Prüfbedingungen:
Ergebnisse, einzeln (oder auf Replikatbasis) sowie als Mittelwert und gegebenenfalls Variationskoeffizient für die folgenden Endpunkte angegeben:
Eine eventuelle Abweichung von der Prüfmethode.
Erörterungen der Ergebnisse, einschließlich etwaiger Einflüsse von Abweichungen von der Prüfmethode auf das Ergebnis der Prüfung.
Tabelle 1 Für die Prüfung empfohlene Fischarten
| SÜSSWASSER | FLUSSMÜNDUNGS- und SALZWASSER |
| Oncorhynchus mykiss Regenbogenforelle | Cyprinodon variegatus Edelsteinkärpfling |
| Pimephales promelas Dickkopfelritze | Menidia sp. Silverside |
| Danio rerio Zebrabärbling | |
| Oryzias latipes Japanischer Reiskärpfling Medaka |
(1) OECD (2012), Fish Toxicity Testing Framework, Environmental Health and Safety Publications Series on Testing and Assessment No. 171, OECD, Paris.
(2) OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environmental Health and Safety Publications, Series on Testing and Assessment. No. 23, OECD Paris.
(3) ASTM (1988), Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials, E 1241-88. 26 ff.
(4) Brauhn, J.L. und R.A. Schoettger (1975), Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel catfish and Bluegills, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota.
(5) Brungs, W.A. und B.R. Jones (1977), Temperature Criteria for Freshwater Fish: Protocol and Procedures, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
(6) Adolfsson-Erici, et al. (2012), A flow-through passive dosing system for continuously supplying aqueous solutions of hydrophobic chemicals to bioconcentration and aquatic toxicity tests, Chemosphere 86, 593-599.
(7) Hutchinson, T.H. et al. (2006), Acute and chronic effects of carrier solvents in aquatic organisms: A critical review, Aquatic Toxicology, 76, 69-92.
(8) Kapitel C.20, Daphnia magna-Reproduktionstest.
(9) Hansen, D.J. und P.R. Parrish (1977), Suitability of sheepshead minnows (Cyprindon variegatus) for life-cycle toxicity tests, In Aquatic Toxicology and Hazard Evaluation (edited by F.L. Mayer and J.L. Hamelink), ASTM STP 634.
(10) Kimmel, H. B. et al. (1995), Stages of embryonic development of the zebrafish. Developmental Dynamics, 203:253-310.
(11) Gonzalez-Doncel, M. et al. (2005), A quick reference guide to the normal development of Oryzias latipes (Teleostei, Adrinichthydae) Journal of Applied Ichthyology, 20:1-14.
(12) Devlin, E.W. et al. (1996), Prehatching Development of the Fathead Minnow, Pimephales promelas Rafinesque. EPA/600/R-96/079. USEPA, Office of Research and Development, Washington, D.C.
(13) Oris, J.T., S.C. Belanger und A.J. Bailer, (2012), Baseline characteristics and statistical implications for the OECD 210 Fish Early Life Stage Chronic Toxicity Test, Environmental Toxicology and Chemistry 31; 2, 370-376.
(14) OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application, Environmental Health and Safety Publications Series on Testing and Assessment No. 54, OECD, Paris.
(15) Rao, J.N.K. und A.J. Scott (1992), A simple method for the analysis of clustered binary data, Biometrics 48, 577-585.
(16) Rao, J.N.K. und A.J. Scott (1999), A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385.
(17) Dunnett C.W. (1955), A multiple comparisons procedure for comparing several treatments with a control, Journal of American Statistical Association, 50, 1096-1121.
(18) Dunnett C.W. (1964), New tables for multiple comparisons with a control. Biometrics, 20, 482-491.
(19) Rand, G.M. und S.R. Petrocelli (1985), Fundamentals of Aquatic Toxicology. Hemisphere Publication Corporation, New York.
(20) McClave, J.T., J.H. Sullivan und J.G. Pearson (1980). Statistical Analysis of Fish Chronic Toxicity Test Data, Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
| Definitionen | Anlage 1 |
Definitionen
Chemikalie: Stoff oder Gemisch.
ECx: (Konzentration mit einer Wirkung von x %) die Konzentration, die innerhalb einer gegebenen Expositionsdauer im Vergleich zur Kontrolle eine Wirkung von x % auf die Prüforganismen kommt. Eine EC50 beispielsweise ist die Konzentration, bei der davon ausgegangen wird, dass sie bei 50 % einer exponierten Population während einer bestimmten Expositionsdauer eine Wirkung auf einen Endpunkt im Test hat.
Gabellänge: die Länge von der Spitze des Fischmauls bis zum Ende der mittleren Schwanzflossenstrahlen; wird bei Fischen verwendet, bei denen das Ende der Wirbelsäule schwer zu bestimmen ist (www.fishbase.org)
Gesamtlänge: die Länge von der Spitze des Fischmauls bis zur Spitze des längeren Lappens der Schwanzflosse; wird gewöhnlich mit entlang der Mittellinie zusammengehaltenen Lappen gemessen. Es wird in gerader Linie gemessen, nicht entlang der Körperkrümmung. (www.fishbase.org)
Abbildung 1 Beschreibung der verschiedenen verwendeten Längen
IUPAC: International Union of Pure and Applied Chemistry.
Lowest observed effect concentration (LOEC): die niedrigste geprüfte Konzentration einer Prüfchemikalie, bei der sich im Vergleich zur Kontrolle eine signifikante Wirkung beobachten lässt (bei p < 0,05). Alle Prüfkonzentrationen oberhalb der LOEC müssen jedoch eine schädigende Wirkung haben, die den bei der LOEC beobachteten Wirkungen entspricht oder größer ist. Können diese beiden Bedingungen nicht erfüllt werden, muss ausführlich erklärt werden, wie die LOEC (und damit auch die NOEC) ausgewählt wurde. Weitere Hinweise sind den Anlagen 5 und 6 zu entnehmen.
No observed effect concentration (NOEC): die Prüfkonzentration unmittelbar unterhalb der LOEC, die im Vergleich zur Kontrolle innerhalb eines angegebenen Expositionszeitraums keine statistisch signifikante Wirkung (p < 0,05) hat.
Prüfchemikalie: Stoff oder Gemisch, der bzw. das nach dieser Prüfmethode getestet wird.
SMILES: Simplified Molecular Input Line Entry Specification.
Standardlänge: die Länge eines Fisches, gemessen von der Spitze des Fischmauls bis zum hinteren Ende des letzten Wirbels oder bis zum hinteren Ende des mittellateralen Teils der Hypuralplatte. Einfach ausgedrückt, wird bei diesem Maß die Schwanzflosse nicht mitgemessen (www.fishbase.org)
UVCB-Stoffe: Stoffe mit unbekannter oder schwankender Zusammensetzung, komplexe Reaktionsprodukte oder biologische Materialien.
| Prüfbedingungen, Dauer und Überlebenskriterien für empfohlene Fischarten | Anlage 2 |
| FISCHART | PRÜFBEDINGUNGEN | EMPFOH- LENE TESTPRÜF- DAUER | Typische mittlere Mindestgesamtlänge der Kontrollfische am Ende der Prüfung (mm) 1 | ÜBERLEBENS- RATE IN DER KONTROLLE (Minimum) | |||
| Temperatur °C) | Salzgehalt (0/00) | Fotoperiode (Std.) | Schlupf- erfolg | Nach dem Schlüpfen | |||
| Süßwasser | |||||||
| Oncorhynchus mykiss Regenbogenforelle | 10 ± 1,5 2 | 12 - 16 3 | 2 Wochen nach freiem Fressen der Kontrollfische (oder 60 Tage nach Schlüpfen) | 40 | 75 % | 75 % | |
| Pimephales promelas Dickkopfelritze Fathead minnow | 25 ± 1,5 | 16 | 32 Tage ab Beginn des Tests (oder 28 Tage nach dem Schlüpfen) | 18 | 70 % | 75 % | |
| Danio rerio Zebrabärbling | 26 ± 1,5 | 12 - 16 4 | 30 Tage nach dem Schlüpfen | 11 | 70 % | 75 % | |
| Oryzias latipes Japanischer Reiskärpfling Medaka | 25 ± 2 | 12 - 16 4 | 30 Tage nach dem Schlüpfen | 17 | 80 % | 80 % | |
| Flussmündungswasser und Salzwasser | |||||||
| Cyprinodon variegatus Edelsteinkärpfling Sheepshead minnow | 25 ± 1,5 | 15-35 5 | 12 - 16 4 | 32 Tage ab Beginn des Tests (oder 28 Tage nach dem Schlüpfen) | 17 | 75 % | 80 % |
| Menidia sp. | 22 - 25 | 15-35 5 | 13 | 28 Tage | 20 | 80 % | 60 % |
| Legende:
1) Die typische mittlere Mindestgesamtlänge ist zwar kein Validitätskriterium, jedoch sollten Abweichungen unterhalb des angegeben Werts sorgfältig im Hinblick auf die Empfindlichkeit der Prüfung untersucht werden. Die mittlere Mindestgesamtlänge wird von einer Auswahl der zum gegenwärtigen Zeitpunkt vorliegenden Daten abgeleitet. 2) Der jeweils geprüfte Regenbogenforellenstamm muss möglicherweise bei anderen Temperaturen gehalten werden. Der Zuchtbestand muss bei derselben Temperatur gehalten werden wie die Eier. Nach Erhalt der Eier von einem kommerziellen Züchter ist nach dem Eintreffen eine kurze Anpassung (z.B. 1-2 Stunden) an die Prüftemperatur notwendig. 3) Dunkelheit für Larven bis eine Woche nach dem Schlüpfen, außer wenn sie überprüft werden, dann gedämpfte Beleuchtung während der gesamten Prüfung (12-16 Stunden Fotoperiode) (4). 4) Bei gegebenen Prüfbedingungen sollten die Lichtverhältnisse konstant sein. 5) Darf bei keiner Prüfung um mehr als ± 2 0/00 schwanken. | |||||||
| Leitlinie zur Fütterung und Handhabung von Zucht- und Prüftieren der empfohlenen Arten | Anlage 3 |
| FISCHART | FUTTER * | UMSETZZEIT- PUNKT NACH DEM SCHLÜPFEN | ZEIT BIS ZUR ERSTEN FÜTTERUNG | |||
| Zuchtfische | Frisch geschlüpfte Larven | Jungfische | ||||
| Typ | Häufigkeit | |||||
| Süßwasser: | ||||||
| Oncorhynchus mykiss Regenbogenforelle | Forellenfutter | kein Futter a | Startfutter für Regenbogenforellen, BSN | 2-4 Fütterungen pro Tag | 14-16 Tage nach dem Schlüpfen oder beim Aufschwimmen (fakultativ) | 19 Tage nach dem Schlüpfen oder beim Aufschwimmen |
| Pimephales promelas Dickkopfelritze | BSN, Flockenfutter, FBS | BSN | BSN48, Flockenfutter | 2-3-mal täglich | bei Schlupfrate von 90 % | 2 Tage nach dem Schlüpfen |
| Danio rerio Zebrabärbling | BSN, Flockenfutter | Handelsübliches Larvenfutter, Protozoa b, Protein c | BSN48, Flockenfutter, | BSN einmal täglich; Flockenfutter 2-mal täglich | bei Schlupfrate von 90 % | 2 Tage nach dem Schlüpfen |
| Oryzias latipes Japanischer Reiskärpfling | Flockenfutter | BSN, Flockenfutter (oder Protozoa oder Rädertierchen) | BSN48, Flockenfutter (oder Rädertierchen) | BSN einmal täglich; Flockenfutter 2-mal täglich oder Flockenfutter und Rädertierchen einmal täglich | nicht zutreffend | 6-7 Tage nach dem Laichen |
| Flussmündungs- und Salzwasser: | ||||||
| Cyprinodon variegatus Edelsteinkärpfling | BSN, Flockenfutter, FBS | BSN | BSN48 | 2-3 Fütterungen pro Tag | nicht zutreffend | 1 Tag nach dem Schlüpfen/Aufschwimmen |
| Menidia sp. Gezeiten-Ährenfisch | BSN48, Flockenfutter | BSN | BSN48 | 2-3 Fütterungen pro Tag | nicht zutreffend | 1 Tag nach dem Schlüpfen/Aufschwimmen |
| Legende:
*) Futter sollte bis zur Sättigung gegeben werden. Überschüssiges Futter und Exkremente sollten erforderlichenfalls entfernt werden, um eine Ansammlung von Abfällen zu vermeiden. FBS Frozen Brine Shrimps (gefrorene Artemia), adulte Artemia sp BSN Brine Shrimp Nauplii (Artemianauplien), frisch geschlüpft BSN48 Brine Shrimp Nauplii (Artemianauplien), 48 Stunden alt a) Larven mit Dottersack benötigen kein Futter b) filtriert aus gemischter Kultur c) Granulate aus Fermentationsprozess | ||||||
| Chemische Eigenschaften eines geeigneten Verdünnungswasssers | Anlage 4 |
| Komponente | Höchstkonzentration |
| Partikel | 5 mg/l |
| Gesamter organischer Kohlenstoff | 2 mg/l |
| Nicht ionisierter Ammoniak | 1 µg/l |
| Restchlor | 10 µg/l |
| Gesamtgehalt an phosphororganischen Pestiziden | 50 ng/l |
| Gesamtgehalt an chlororganischen Pestiziden und polychlorierten Biphenylen | 50 ng/l |
| Gesamtgehalt an organischem Chlor | 25 ng/l |
| Aluminium | 1 µg/l |
| Arsen | 1 µg/l |
| Chrom | 1 µg/l |
| Cobalt | 1 µg/l |
| Kupfer | 1 µg/l |
| Eisen | 1 µg/l |
| Blei | 1 µg/l |
| Nickel | 1 µg/l |
| Zink | 1 µg/l |
| Cadmium | 100 ng/l |
| Quecksilber | 100 ng/l |
| Silber | 100 ng/l |
| Leitlinie für die statistische Analyse der NOEC-Bestimmung | Anlage 5 |
Allgemeines
Analyseeinheit ist das Replikatgefäß. Bei kontinuierlichen Messungen, wie z.B. Größe, sollte der Mittelwert oder Median der Replikate berechnet werden, und diese Replikatwerte sind die zu analysierenden Daten. Die Aussagekraft der durchgeführten Prüfungen sollte nachgewiesen werden, vorzugsweise auf der Grundlage einer historischen Datenbank für jedes Labor. Die Größenordnung der Wirkung, die bei einer statistischen Aussagekraft von 75-80 % festgestellt wird, sollte für jeden Endpunkt bei dem zu verwendenden statistischen Test angegeben werden.
In den Datenbanken, die zum Zeitpunkt der Entwicklung dieser Prüfmethode verfügbar sind, ist die Aussagekraft, die im Rahmen der empfohlenen statistischen Verfahren möglich ist, angegeben. Ein Labor sollte nachweisen, dass es diese geforderte statistische Aussagekraft erreichen kann, indem es entweder eine eigene Analyse der Teststärke anstellt oder nachweist, dass der Variationskoeffizient (VK) bei jeder Wirkung nicht über dem 90. Perzentil der bei der Ausarbeitung der Prüfrichtlinie herangezogenen Variationskoeffizienten liegt. Diese Variationskoeffizienten sind in Tabelle 1 angegeben. Sind nur Replikat-Mittelwerte oder -Mediane verfügbar, kann der Variationskoeffizient innerhalb der Replikate ignoriert werden.
Tabelle 1 90. Perzentil der Variationskoeffizienten für ausgewählte Süßwasserarten
| Spezies | Wirkung | VK_zwischen Replikaten | VK_innerhalb von Replikaten |
| Regenbogenforelle | Länge | 17,4 | 9,8 |
| Gewicht | 10,1 | 28 | |
| Dickkopfelritze | Länge | 16,9 | 13,5 |
| Gewicht | 11,7 | 38,7 | |
| Zebrabärbling | Länge | 43,7 | 11,7 |
| Gewicht | 11,9 | 32,8 |
Bei fast allen statistischen Tests zur Bewertung von Labor-Toxizitätsstudien geht es um den Vergleich zwischen Behandlungsgruppen und Kontrollen. Aus diesem Grund ist es nicht angezeigt, vor einem Dunnett- oder Williams-Test einen statistisch signifikanten ANOVA-F-Test oder vor einem Jonckheere-Terpstra-, Mann-Whitney- oder Dunn-Test einen statistisch signifikanten Kruskal-Wallis-Test zu verlangen (Hochberg und Tamhane 1987, Hsu 1996, Dunnett 1955, 1964, Williams 1971, 1972, 1975, 1977, Robertson et al. 1988, Jonckheere 1954, Dunn 1964).
Der Dunnett-Test beinhaltet eine integrierte Multiplizitätsanpassung, und durch die Anwendung des F-Tests als Referenz werden die Falsch-Positiv- und Falsch-Negativ-Raten negativ beeinflusst. Ebenso erhalten der Williams- (Step-Down) und Jonckheere-Terpstra-Test unter Verwendung eines Signifikanzwerts von 0,05 bei jedem Schritt eine Falsch-Positiv-Rate von insgesamt 5 %, wobei diese Rate und die Aussagekraft der Tests durch Verwendung des F-Tests oder Kruskal-Wallis-Tests als Referenz negativ beeinflusst werden. Der Mann-Whitney- und Dunn-Test müssen hinsichtlich der Multiplizität angepasst werden und die Bonferroni-Holm-Korrektur wird empfohlen.
Im Dokument OECD (2006) ist eine ausführliche Erörterung der meisten Empfehlungen zur Hypothesentestung und zur Überprüfung der diesen Tests zugrunde liegenden Annahmen sowie eine umfassende Bibliographie zu finden.
Behandlung der Kontrollen bei Verwendung eines Lösungsmittels
Wird ein Lösungsmittel verwendet, sollte sowohl eine Verdünnungswasserkontrolle als auch eine Lösungsmittelkontrolle einbezogen werden. Die beiden Kontrollen sollten in Bezug auf jede Wirkung verglichen und für die statistische Analyse miteinander kombiniert werden, falls kein signifikanter Unterschied zwischen ihnen festgestellt wird. Ansonsten sollte die Lösungsmittelkontrolle für die NOEC-Bestimmung oder ECx-Schätzung verwendet und die Verdünnungswasserkontrolle nicht verwendet werden. Siehe Einschränkung der Validitätskriterien (Nummer 7).
Für Länge, Gewicht, Anteil an ausgeschlüpften Eiern, Larvenmortalität oder abnorme Larven sowie den ersten oder letzten Schlüpf- oder Aufschwimmtag sollten die Verdünnungswasserkontrolle und die Lösungsmittelkontrolle unter Verwendung eines Signifikanzwerts von 0,05 mit einem T-Test oder Mann-Whitney-Test verglichen werden, wobei alle Behandlungsgruppen außer Acht gelassen werden. Die Ergebnisse dieser Tests sollten angegeben werden.
Größenmessungen (Länge und Gewicht)
Die einzelnen Fischlängen- und Fischgewichtswerte können normalverteilt oder logarithmisch normalverteilt sein. In beiden Fällen tendieren die Mittelwerte der Replikate zu einer Normalverteilung entsprechend dem Zentralen Grenzwertsatz, was durch Daten aus mehr als 100 ELS-Studien an drei Süßwasserarten bestätigt wurde. Wenn die Daten oder historischen Datenbanken auf eine logarithmische Normalverteilung bei individuellen Fischgrößenwerten hindeuten, kann der mittlere Logarithmus der Replikate der einzelnen Fischwerte berechnet werden, und die Daten für die Analyse können dann die Antilogarithmen dieser mittleren Logarithmen der Replikate sein.
Die Daten sollten auf Übereinstimmung mit einer Normalverteilung und die Einhaltung der Varianzhomogenität überprüft werden. Zu diesem Zweck sollten die Residuen eines ANOVA-Modells mit der Konzentration als einzige erläuternde Variable verwendet werden. Die visuelle Bestimmung anhand von Streudiagrammen und Histogrammen oder Stamm-Blatt-Diagrammen stellt ebenfalls eine Möglichkeit dar. Alternativ kann ein formaler Test wie z.B. Shapiro-Wilk oder Anderson-Darling durchgeführt werden. Die Einhaltung der Varianzhomogenität kann anhand einer visuellen Überprüfung desselben Streudiagramms oder formal durch einen Levene-Test bewertet werden. Nur parametrische Tests (z.B. Williams, Dunnett) müssen hinsichtlich Normalität oder Varianzhomogenität bewertet werden.
Etwaige Ausreißer und deren Auswirkung auf die Analyse sollten beachtet werden. Der Ausreißertest nach Tukey und die visuelle Überprüfung der oben beschriebenen Residuendiagramme können herangezogen werden. Ferner ist zu beachten, dass es sich bei Beobachtungen um ganze Replikate handelt, sodass ein Ausreißer nur nach sorgfältiger Abwägung in der Analyse unberücksichtigt bleiben sollte.
Die statistischen Tests, bei denen die Merkmale des Versuchsplans und die biologischen Erwartungen genutzt werden, sind Step-Down-Trendtests, wie z.B. Williams und Jonckheere-Terpstra. Bei den Tests wird von einer monotonen Konzentrations-Wirkungs-Beziehung ausgegangen, und die Daten sollten auf Übereinstimmung mit dieser Annahme überprüft werden. Dies kann visuell anhand eines Streudiagramms der Replikat-Mittelwerte im Verhältnis zur Prüfkonzentration erfolgen. Dieses Streudiagramm sollte mit einem linearen Diagramm überlagert werden, bei dem die nach Replikatprobengröße gewichteten Konzentrationsmittelwerte miteinander verbunden werden. Eine starke Abweichung dieses linearen Diagramms von der Monotonie würde darauf hindeuten, dass möglicherweise andere Tests als Trendtests verwendet werden sollten. Alternativ können formale Tests verwendet werden. Bei einem einfachen linearen Test werden die linearen und quadratischen Kontraste der Konzentrationsmittelwerte berechnet. Wenn der quadratische Kontrast signifikant und der lineare Kontrast nicht signifikant ist, deutet dies auf ein mögliches Monotonieproblem hin, das anhand von Diagrammen näher untersucht werden sollte. Wenn Normalität oder Varianzhomogenität möglicherweise ein Problem darstellen, können diese Kontraste aus in Rangfolge transformierten Daten abgeleitet werden. Alternative Verfahren wie beispielsweise der Monotonietest nach Bartholomew können zwar verwendet werden, erhöhen aber die Komplexität.
Abbildung 2 NOEC-Flussdiagramm für Größenmessungen (Länge und Gewicht)
Die NOEC wird durch eine Step-Down-Anwendung des Williams- oder Jonckheere-Terpstra-Tests bestimmt, außer wenn die Daten die Anforderungen dieser Tests nicht erfüllen. Nähere Informationen über diese Verfahren sind OECD (2006) zu entnehmen. Bei Daten, die die Anforderungen eines Step-Down-Trendtests nicht erfüllen, kann der Dunnett- oder der Tamhane-Dunnett-Test (T3) angewandt werden, die beide Anpassungen hinsichtlich der Multiplizität enthalten. Bei diesen Tests wird von Normalität und im Fall von Dunnett von Varianzhomogenität ausgegangen. Sind diese Bedingungen nicht erfüllt, kann der nichtparametrische Test nach Dunn angewandt werden. Nähere Informationen zu all diesen Tests sind OECD (2006) zu entnehmen. Abbildung 2 zeigt eine Übersicht als Entscheidungshilfe für die Wahl des am besten geeigneten Tests.
Schlupferfolg und Überlebensrate der Larven
Die Daten beziehen sich auf die Anteile an ausgeschlüpften Eiern oder an überlebenden Larven in den einzelnen Replikaten. Diese Anteile sollten in Bezug auf extrabinomiale Varianz überprüft werden, die bei solchen Messungen zwar üblich ist, aber nicht generell auftritt. Das Flussdiagramm in Abbildung 3 dient als Orientierung für die Auswahl des Tests; ausführliche Beschreibungen sind dem Text zu entnehmen.
Im Allgemeinen kommen zwei Tests zur Anwendung. Hierbei handelt es sich um den Tarone-C(α)-Test (Tarone, 1979) und den Chi-Quadrat-Test, die jeweils separat bei jeder Prüfkonzentration angewandt werden. Wird auch in nur einer Prüfkonzentration extrabinomiale Varianz festgestellt, dann sollten dementsprechende Methoden angewandt werden.
Formel 1 Tarone-C(α)-Test (Tarone 1979)
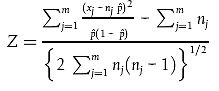
Hierbei gilt: ist der mittlere Anteil bei einer bestimmten Konzentration, m ist die Anzahl der Replikatgefäße, nj ist die Anzahl der Versuchssubjekte in Replikat j und xj ist die Anzahl der reagierenden Versuchssubjekte in diesem Replikat, z.B. nicht geschlüpft oder tot. Der Test wird auf jede Konzentration separat angewandt. Dieser Test kann als angepasster Chi-Quadrat-Test angesehen werden, jedoch haben von Tarone durchgeführte Limited-Power-Simulationen gezeigt, dass er eine stärkere Aussagekraft besitzt als ein Chi-Quadrat-Test.
Abbildung 3 NOEC-Flussdiagramm für Schlupferfolg und Larvenmortalität
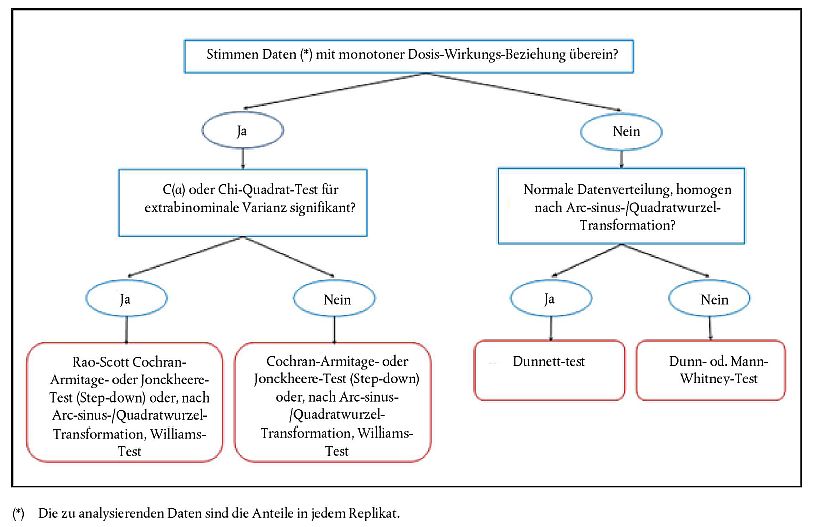
Gibt es keine signifikanten Hinweise auf eine extrabinomiale Varianz, kann der Cochran-Armitage-Test (Step-Down) angewandt werden. Bei diesem Test werden Replikate ignoriert. Wenn daher solche Hinweise vorliegen, wird die Rao-Scott-Anpassung des Cochran-Armitage-Tests (RSCA) empfohlen, bei der Replikate, Replikatgrößen und extrabinomiale Varianz berücksichtigt werden. Zu alternativen Tests zählen die Williams- und Jonckheere-Terpstra-Tests (Step-Down) sowie der Dunnett-Test, wie bei den Größenmessungen beschrieben. Diese Tests gelten unabhängig davon, ob eine extrabinomiale Varianz vorliegt oder nicht, besitzen aber eine etwas geringere Aussagekraft (Agresti 2002, Morgan 1992, Rao und Scott 1992, 1999, Fung et al. 1994, 1996).
Erster oder letzter Schlüpf- oder Aufschwimmtag
Das Ergebnis ist eine ganze Zahl, die den Versuchstag angibt, an dem die betreffende Beobachtung bei einem bestimmten Replikatgefäß festgestellt wird. Der Wertebereich ist im Allgemeinen sehr begrenzt und umfasst häufig hohe Anteile von verbundenen Werten, z.B. in der Form, dass der erste Schlüpftag in allen Kontrollreplikaten und vielleicht in ein oder zwei der niedrigen Prüfkonzentrationen identisch ist. Parametrische Tests wie z.B. der Williams- und der Dunnett-Test sind für solche Daten ungeeignet. Außer wenn Hinweise auf eine erhebliche Nicht-Monotonie vorliegen, ist der Jonckheere-Terpstra-Test (Step-Down) ein leistungsfähiges Instrument, um die Wirkungen der Prüfchemikalie nachzuweisen. Ansonsten kann der Dunn-Test angewandt werden.
Abnormitäten von Larven
Das Ergebnis ist die Anzahl an Larven, bei denen irgendeine Art von Abnormität festgestellt wird. Die Inzidenz ist häufig gering. Außerdem zeigen sich z. T. die gleichen Probleme wie beim ersten Schlüpftag sowie eine unregelmäßige Konzentrations-Wirkungs-Beziehung. Wenn die Daten zumindest grob einen monotonen Verlauf der Konzentrations-Wirkungs-Beziehung ergeben, stellt der Jonckheere-Terpstra-Test (Step-Down) ein leistungsfähiges Instrument zum Nachweis der Wirkungen dar. Andernfalls kann der Dunn-Test angewandt werden.
Agresti, A. (2002); Categorical Data Analysis, zweite Auflage, Wiley, Hoboken.
Dunnett C.W. (1955); A multiple comparison procedure for comparing several treatments with a control, J. American Statistical Association 50, 1096-1121.
Dunn O.J. (1964); Multiple Comparisons Using Rank Sums, Technometrics 6, 241-252.
Dunnett C.W. (1964); New tables for multiple comparisons with a control, Biometrics 20, 482-491.
Fung, K.Y., D. Krewski, J.N.K. Rao, A.J. Scott (1994); Tests for Trend in Developmental Toxicity Experiments with Correlated Binary Data, Risk Analysis 14, 639-648.
Fung, K.Y, D. Krewski, R.T. Smythe (1996); A comparison of tests for trend with historical controls in carcinogen bioassay, Canadian Journal of Statistics 24, 431-454.
Hochberg, Y. und A. C. Tamhane (1987); Multiple Comparison Procedures, Wiley, New York.
Hsu, J.C. (1996); Multiple Comparisons: Theory and Methods; Chapman and Hall/CRC Press, Boca Raton.
Jonckheere A.R. (1954); A distribution-free k-sample test against ordered alternatives, Biometrika 41, 133.
Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London.
OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A Guidance to Application. Series on Testing and Assessment, No. 54. Organisation for Economic Co-operation and Development, OECD, Paris.
Rao J.N.K. und Scott A.J. (1992) - A simple method for the analysis of clustered binary data, Biometrics 48, 577-585.
Rao J.N.K. und Scott A.J. (1999) - A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385.
Robertson T., Wright F.T. und Dykstra R.L. (1988); Order restricted statistical inference, Wiley.
Tarone, R.E. (1979); Testing the goodness of fit of the Binomial distribution, Biometrika 66, 585-590.
Williams D.A. (1971); A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics 27, 103-117.
Williams D.A. (1972); The comparison of several dose levels with a zero dose control, Biometrics 28, 519-531.
Williams D.A. (1975); The Analysis of Binary Responses from Toxicological Experiments Involving Reproduction and Teratotlogy, Biometrics 31, 949-952.
Williams D.A. (1977); Some inference procedures for monotonically ordered normal means, Biometrika 64, 9-14.
| Leitlinie für statistische Regressionsanalysen | Anlage 6 |
Allgemeines
Die zur Anpassung eines Modells verwendeten Beobachtungen sind die Mittelwerte von Länge und Gewicht je Replikat oder der Anteile ausgeschlüpfter Eier und toter Larven in jedem Replikat (OECD 2006).
Im Allgemeinen wird eine gewichtete Regression unter Verwendung der Replikat-Probengröße als Gewichtung empfohlen. Jedoch sind auch andere Gewichtungen möglich, wie z.B. die Gewichtung nach vorhergesagter mittlerer Wirkung oder eine Kombination dieser Gewichtung mit der Gewichtung nach Replikat-Probengröße. Von der Gewichtung mit dem Kehrwert der Varianz in der Probe bei einer bestimmten Konzentration wird abgeraten (Bunke et al. 1999, Seber and Wild, 2003, Motulsky und Christopoulos 2004, Huet et al. 2003).
Bei der Transformation der Wirkungen vor der Analyse sollte die Unabhängigkeit der Beobachtungen erhalten bleiben. Ferner sollten die ECx und die Grenzen ihres Konfidenzintervalls in den ursprünglichen und nicht in den transformierten Maßeinheiten ausgedrückt werden. Beispielsweise entspricht eine 20 %ige Änderung des Logarithmus der Länge nicht einer20 %igen Änderung der Länge (Lyles et al. 2008, Draper und Smith 1999).
Das Flussdiagramm in Anlage 4 zeigt einen Überblick über die ECx-Schätzungen. Die Einzelheiten werden nachfolgend beschrieben.
Abbildung 4 Flussdiagramm für die Schätzung der ECx für die mittlere Länge, das mittlere Gewicht und den mittleren Anteil an geschlüpften Eiern oder toten Larven je Replikat (Erläuterungen im Text)
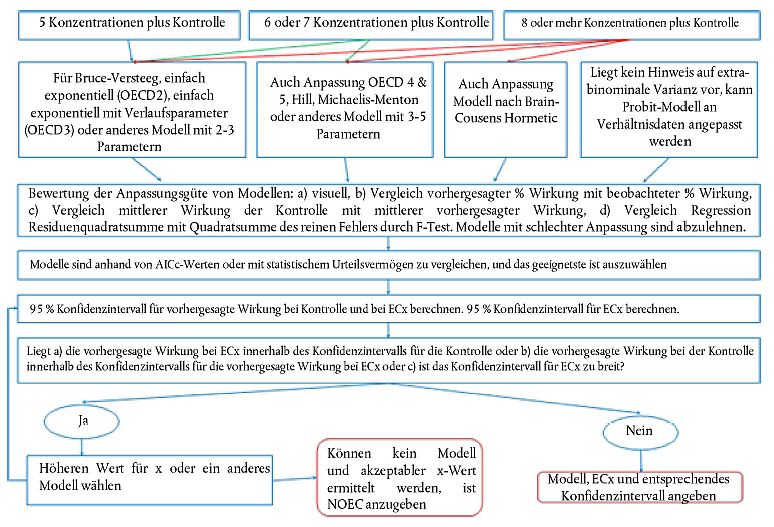
Erwägungen zum Schlüpfen der Eier und zur Larvenmortalität
Im Hinblick auf das Schlüpfen der Eier und die Larvenmortalität empfiehlt sich normalerweise die Anpassung eines Modells mit abnehmendem Kurvenverlauf, außer wenn wie nachfolgend beschrieben ein Probit-Modell angepasst wird. Das heißt, dass der Anteil an Eiern, die nicht schlüpfen, oder an Larven, die sterben, modelliert werden sollte. Der Grund hierfür liegt darin, dass die ECx eine Konzentration ist, bei der eine Änderung auftritt, die x % der mittleren Wirkung der Kontrolle entspricht. Wenn 5 % der Kontrolleier nicht schlüpfen und das Nichtschlüpfen modelliert wird, dann bezeichnet die EC20 eine Konzentration, bei der eine Änderung von 20 % der 5 % nicht geschlüpften Kontrolleier auftritt, d. h. eine Änderung von 0,2 x 0,05 = 0,01 oder um 1 Prozentpunkt auf 6 % nicht geschlüpfte Eier. Eine solch geringfügige Änderung kann anhand der verfügbaren Daten nicht sinnvoll geschätzt werden und ist biologisch ohne Bedeutung. Würde hingegen der Anteil an geschlüpften Eiern modelliert, so würde der Anteil in den Kontrollen in diesem Beispiel 95 % betragen, und eine 20 %ige Verringerung gegenüber dem Mittelwert der Kontrolle würde eine Änderung von 0,95 x 0,2 = 0,18 bedeuten, d. h. der Schlupferfolg würde von 95 % auf 77 % (= 95-18) zurückgehen. Die Konzentration, bei der diese Wirkung auftritt, kann bestimmt werden und wäre vermutlich von größerem Interesse. Bei Größenmessungen tritt dieses Problem nicht auf, wenngleich nachteilige Auswirkungen auf die Größe im Allgemeinen eine Verringerung der Größe bedeuten.
Modelle für Größe (Länge oder Gewicht) und Schlupferfolg oder Überlebensrate der Larven
Abgesehen vom Hormesis-Modell von Brain-Cousens werden all diese Modelle in OECD (2006) beschrieben und empfohlen. Die Modelle OECD 2 bis 5 werden auch für die Ökotoxiziätsversuche in Slob (2002) erläutert. Selbstverständlich gibt es zahlreiche andere Modelle, die sinnvoll sein könnten. In Bunke et al. (1999) werden zahlreiche Modelle aufgeführt, die hier nicht genannt sind, und es gibt zahlreiche Verweise auf andere Modelle. Die nachfolgend aufgeführten Modelle werden als besonders geeignet für Ökotoxiziätsversuche empfohlen und häufig verwendet.
Bei fünf Prüfkonzentrationen plus Kontrolle
Bei sechs oder mehr Prüfkonzentrationen plus Kontrolle
Wenn sichtbare Anzeichen von Hormesis vorhanden sind (unwahrscheinlich bei Schlupferfolg oder Überleben der Larven, jedoch manchmal bei Größenbeobachtungen festzustellen)
Alternative Modelle für nicht geschlüpfte Eier und Larvenmortalität
Anpassungsgüte eines einzelnen Modells
Vergleich der Modelle
Qualität der ECx-Bestimmung
Das Konfidenzintervall für die ECx sollte nicht zu breit sein. Es ist statistisches Urteilsvermögen erforderlich, um zu entscheiden, wie breit das Konfidenzintervall sein darf, damit die ECx noch nützlich ist. Simulationen von Regressionsmodellen mit Anpassung an Daten zu Schlupferfolg und Größe zeigen, dass etwa 75 % der Konfidenzintervalle für die ECx (x=10, 20 oder 30) höchstens zwei Prüfkonzentrationen umfassen. Dies liefert eine Leitlinie dafür, was akzeptabel und erreichbar ist. Zahlreiche Autoren bekräftigen, dass für alle Modellparameter Konfidenzintervalle angegeben werden müssen und dass breite Konfidenzintervalle bei Modellparametern auf inakzeptable Modelle schließen lassen (Ott und Longnecker2008, Alvord und Rossio 1993, Motulsky und Christopoulos 2004, Lyles et al. 2008, Seber and Wild 2003, Bunke et al. 1999, Environment Canada 2005).
Das Konfidenzintervall der ECx (oder jedes anderen Modellparameters) sollte nicht Null enthalten (Motulsky and Christopoulos 2004). Dies ist die Regression, die dem signifikanten Mindestunterschied entspricht, der häufig in Hypothesentestungsansätzen angeführt wird (z.B. Wang et al. 2000). Dies entspricht ferner dem Konfidenzintervall für die mittleren Wirkungen bei der LOEC, wobei der Mittelwert der Kontrolle nicht darin enthalten ist. Es stellt sich die Frage, ob die Schätzungen der Parameter wissenschaftlich plausibel sind. Wenn z.B. das Konfidenzintervall für y0 ± 20 % beträgt, ist keine EC10-Schätzung plausibel. Wenn das Modell eine 20 %ige Wirkung bei der Konzentration C vorhersagt und die maximale beobachtete Wirkung bei C und geringeren Konzentration 10 % beträgt, dann ist die EC20 nicht plausibel (Motulsky und Christopoulos 2004, Wang et al. 2000, Environment Canada 2005).
Die ECx sollte keine Extrapolation außerhalb des Bereichs positiver Konzentrationen erfordern (Draper und Smith 1999, OECD 2006). Beispielsweise könnte eine allgemeine Leitlinie sein, dass die ECx maximal etwa 25 % unter der niedrigsten geprüften Konzentration oder über der höchsten geprüften Konzentration liegen sollte.
Alvord, W.G., Rossio, J.L. (1993); Determining confidence limits for drug potency in immunoassay, Journal of Immunological Methods 157, 155-163.
Brain P. and Cousens R. (1989); An equation to describe dose responses where there is stimulation of growth at low doses. Weed res. 29: 93-96.
Bunke, O., Droge, B. and Polzehl, J. (1999). Model selection, transformations and variance estimation in nonlinear regression. Statistics 33, 197-240.
Collett, D. (2002); Modelling Binary Data, second edition, Chapman and Hall, London.
Collett, D. (2003); Modelling Survival Data in Medical Research, second edition, Chapman and Hall, London.
Draper, N.R. and Smith, H. (1999); Applied Regression Analysis, third edition. New York: John Wiley & Sons.
Environment Canada (2005); Guidance Document on Statistical Methods for Environmental Toxicity Tests, Report EPS 1/RM/46
Huet, S., A. Bouvier, M.-A. Poursat, E. Jolivet (2003); Statistical Tools for Nonlinear Regression: A Practical Guide with S-PLUS and R Examples, Springer Series in Statistics, New York.
Lyles, R. H., C. Poindexter, A. Evans, M. Brown, and C.R. Cooper (2008); Nonlinear Model-Based Estimates of IC50 for Studies Involving Continuous Therapeutic Dose-Response Data, Contemp Clin Trials. 2008 November; 29(6): 878-886.
Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London.
Motulsky, H., A. Christopoulos (2004); Fitting Models to Biological Data Using Linear and Nonlinear Regression: A Practical Guide to Curve Fitting, Oxford University Press, USA.
O'Hara Hines, R. J. and J. F. Lawless (1993); Modelling Overdispersion in Toxicological Mortality Data Grouped over Time, Biometrics Vol. 49, pp. 107-121
OECD (2006); Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series Testing and Assessment, No. 54, Organisation for Economic Co-operation and Development, OECD, Paris.
Ott, R.L., M.T. Longnecker, An Introduction to Statistical Methods and Data Analysis, sixth edition, 2008, Brooks-Cole, Belmont, CA
Ratkowsky, D.A. (1993); Principles of nonlinear regression, Journal of Industrial Microbiology 12, 195-199.
Seber, G.A.F., C.J. Wild, Nonlinear Regression, Wiley, 2003
Slob W. (2002); Dose-response modelling of continuous endpoints. Toxicol. Sci., 66, 298-312
Wang, Q., D.L. Denton, and R. Shukla (2000); Applications and Statistical Properties Of Minimum Significant Difference-Based Criterion Testing In a Toxicity Testing Program, Environmental Toxicology and Chemistry, Vol. 19, pp. 113-117, 2000.
 | weiter . |  |