

 | zurück |  |
| Bestimmung der Ökotoxizität
Teil III: Modifizierter OECD-Screening-Test | Anhang V zur RL 67/548/EWG |
C.4-B.III.1. Prinzip der Methode
Ein definiertes Volumen des mineralischen Mediums mit einer bekannten Konzentration der Prüfsubstanz (10-40 mg/l DOC) als einziger nomineller Quelle organischen Kohlenstoffs wird mit 0,5 ml Kläranlagenablauf pro Liter Medium angeimpft und im Dunkeln oder bei diffuser Beleuchtung bei 22 ± 2 °C belüftet.
Der Abbau wird mittels DOC-Analyse über einen Zeitraum von 28 Tagen in kurzen Zeitabständen verfolgt. Der Grad des biologischen Abbaus wird durch die Abnahme der DOC-Konzentration (nach Berücksichtigung des Inokulum-Blindwertes) in % der Ausgangskonzentration berechnet. Der Grad des biologischen Primärabbaus läßt sich auch aus der ergänzenden chemischen Analyse errechnen, die zu Beginn und am Ende der Inkubation vorgenommen wird.
C.4-B.III.2. Beschreibung der Methode
C.4-B.III.2.1. Geräte
C.4-B.III.2.2. Ansatz des mineralischen Mediums
Zubereitung der Stammlösung siehe I.6.2.
10 ml Lösung (a) mit 800 ml Verdünnungswasser mischen, 1 ml der Lösungen (b) bis (d) hinzugeben und mit Verdünnungswasser auf 1 l auffüllen.
Bei diesem Verfahren werden nur 0,5 ml Kläranlagenablauf pro Liter als Inokulum verwendet, so daß das Medium möglicherweise mit Spurenelementen und Wachstumsfaktoren angereichert werden muß. Zu diesem Zweck werden von den folgenden Lösungen jeweils 1 ml pro Liter endgültigem Medium zugefügt.
Lösung der Spurenelemente:
| Mangansulfat tetrahydrat, MnSO4ξ4H2O | 39,9 mg |
| Borsäure, H3BO3 | 57,2 mg |
| Zinksulfat heptahydrat, ZnSO4 ξ7H2O | 42,8 mg |
| Ammoniumheptamolybdat, (NH4)6Mo7O24 | 34,7 mg |
| Fe-Chelat (FeCl3 Ethylendiamintetraessigsäure) | 100,0 mg |
in Verdünnungswasser gelöst und auf 1000 ml aufgefüllt.
Vitaminlösung:
Hefeextrakt15,0 mg
in 100 ml Wasser gelöst und durch Membranfilter mit 0,2 µm Porengröße steril filtriert bzw. frisch zubereitet.
C.4-B.III.2.3. Ansatz und Vorbereitung des Inokulums
Das Inokulum ist von Abläufen einer Kläranlage oder Anlage im Labormaßstab, denen vorwiegend häusliche Abwässer zugeführt werden, zu entnehmen. Vgl. I.6.4.2. und I.6.5.
0,5 ml pro Liter mineralisches Medium sind zu verwenden.
C.4-B.III.2.4. Ansatz der Flaschen
Beispiel: Jeweils 800 ml mineralischen Mediums werden in konische 2-l-Flaschen gegeben, dazu wird in jeweils separaten Ansätzen ein ausreichendes Volumen Stammlösung der Prüf- und der Referenzsubstanz gegeben, um ein DOC-Äquivalent von 10-40 mg/l zu erhalten. Der pH-Wert sollte überprüft und wenn nötig auf 7,4 eingestellt werden. Die Flaschen werden mit 0,5 ml Kläranlagenablauf pro Liter beimpft (vgl. I.6.4.2.). Daneben werden Inokulum-Kontrollen im mineralischen Medium ohne Prüf- oder Referenzsubstanz angesetzt.
Falls erforderlich, ist ein Gefäß zur Kontrolle der möglichen Hemmwirkung der Prüfsubstanz zu verwenden; dazu ist eine Lösung mit vergleichbaren Konzentrationen sowohl der Prüf- als auch der Referenzsubstanz im mineralischen Medium anzuimpfen.
Falls erforderlich, ist eine weitere, sterile Flasche anzusetzen, um zu prüfen, ob die Prüfsubstanz abiotisch abgebaut wird; dazu ist eine nicht angeimpfte Lösung dieser Substanz zu verwenden (vgl. I.6.6.).
Wenn vermutet werden muß, daß die Prüfsubstanz signifikant am Glas oder am Schlamm usw. adsorbiert wird, ist eine Vorprüfung vorzunehmen, mit der das Ausmaß der Adsorption und damit die Eignung des Versuchs für die Prüfsubstanz bestimmt werden (vgl. Tabelle 1). Ansetzen einer Flasche mit Prüfsubstanz, Inokulum und Sterilisiermittel.
Alle Flaschen mit dem mineralischen Medium auf 1 l auffüllen, mischen, und anschließend von jeder Flasche eine Probe zwecks Bestimmung der DOC-Ausgangskonzentration entnehmen (vgl. Anhang II.4.). Öffnungen der Flaschen so abdecken, z.B. mit Aluminiumfolie, daß ein freier Luftaustausch zwischen der Flasche und der Umgebungsluft möglich bleibt. Danach die Flaschen in die Schüttelmaschine stellen und mit dem Versuch beginnen.
C.4-B.III.2.5. Anzahl der Flaschen in einem typischen Durchgang
| Flaschen 1 und 2: | Prüfsuspension | |
| Flaschen 3 und 4: | Inokulum-Blindwert | |
| Flasche 5: | Verfahrenskontrolle Empfohlen und falls notwendig: | |
| Flasche 6: | abiotische Sterilkontrolle | |
| Flasche 7: | Adsorptionskontrolle | |
| Flasche 8: | Toxizitätskontrolle | Vgl. I.6.7. |
C.4-B.III.2.6. Durchführung der Prüfung
Während des Versuchs sind die DOC-Konzentrationen in jeder Flasche in bestimmten Zeitabständen doppelt zu bestimmen, und zwar so häufig, daß der Beginn des 10-Tage-Fensters und die prozentuale Abnahme am Ende des 10-Tage-Fensters bestimmt werden können. Dabei ist pro Messung nur die Mindestmenge an Prüfsuspension zu entnehmen.
Vor der Probeentnahme sind die Verdampfungsverluste aus den Flaschen, falls erforderlich, durch Zufügen von Verdünnungswasser auszugleichen (I.6.1.). Der Versuchsansatz ist vor Entnahme einer Probe gründlich zu durchmischen, wobei sicherzustellen ist, daß an den Wänden der Flaschen anhaftendes Material vor der Probenahme gelöst oder suspendiert wird. Unmittelbar nach der Probenahme ist zu filtrieren (Membranfilter) oder zu zentrifugieren (vgl. Anhang II.4). Die filtrierten oder zentrifugierten Proben sind noch am selben Tag zu analysieren; ansonsten können sie bei 2-4 °C für maximal 48 h bzw. bei unter 18 °C über einen längeren Zeitraum aufbewahrt werden.
C.4-B.III.3. Daten und Abschlußbericht
C.4-B.III.3.1. Auswertung der Ergebnisse
Der prozentuale Abbau zum Zeitpunkt t ist entsprechend I.7.1.
(DOC-Bestimmung) sowie wahlweise entsprechend I.7.2. (spezifische Analyse) zu berechnen.
Sämtliche Ergebnisse sind auf den dafür vorgesehenen Datenblättern zu protokollieren.
C.4-B.III.3.2. Gültigkeit der Ergebnisse
Vgl. I.5.2.
C.4-B.III.3.3. Prüfbericht
Vgl. I.8.
C.4-B.III.4. Datenblatt
Nachstehend ein Beispiel eines Datenblattes.
Modifizierter OECD-Screening-Test
Name:
Konzentration der Stammlösung: ... mg/l auf Substanz bezogen
Anfangskonzentration im Medium, t0: ... mg/l auf Substanz bezogen
Herkunft: ...
Vorgenommene Behandlung: ...
Vorbereitung/Konditionierung (soweit zutreffend): ...
Konzentration der suspendierten Feststoffe im Reaktionsgemisch: ... mg/l
Kohlenstoffanalysator: ...
| Flasche Nr. | DOC nach n Tagen (mg/l) | ||||||
| 0 | n1 | n2 | n3 | n4 | |||
| Testsubstanz plus Inokulum | 1 | a1 | |||||
| a2 | |||||||
| a, Mittelwert Ca(t) | |||||||
| 2 | b1 | ||||||
| b2 | |||||||
| b, Mittelwert Cb(t) | |||||||
| Inokulum Blindvers. ohne Testsubstanz | 3 | c1 | |||||
| c2 | |||||||
| c, Mittelwert Cc(t) | |||||||
| 4 | d1 | ||||||
| d2 | |||||||
| d, Mittelwert Cd(t) | |||||||
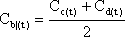 | |||||||
| Flasche Nr. | % Abbau nach n Tagen | |||||
| 0 | n1 | n2 | n3 | n4 | ||
| 1 | 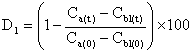 | 0 | ||||
| 2 |  | 0 | ||||
| Mittel (*) |  | 0 | ||||
| (*) bei erheblichem Unterschied sollten D1 und D2 nicht gemittelt werden | ||||||
Anmerkung: Für die Referenz und die Toxizitätskontrolle können ahnliche Formblätter verwendet werden.
| Zeit (Tage) | ||
| 0 | t | |
| DOC Konz. (mg/l) in Sterilkontrolle | Cs(0) | Cs(t) |
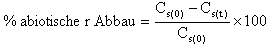
| Bei Versuchsende verbleibende Menge an Prüfsubstanz (mg/l) | % Primärabbau | |
| Sterilkontrolle | Sb | |
| Beimpftes Prüfmedium | Sa | 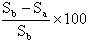 |
 | weiter . |  |