

 | zurück |  |
| Bestimmung der Ökotoxizität
C.4. Teil IV: CO2-Entwicklungstest | Anhang V zur RL 67/548/EWG |
C.4-C.IV.1. Prinzip der Methode
Ein definiertes Volumen des angeimpften mineralischen Mediums mit einer bekannten Konzentration der Prüfsubstanz (10-20 mg DOC oder TOC/l) als einziger nomineller Quelle organischen Kohlenstoffs wird durch Einleiten von kohlendioxidfreier Luft bei gesteuerter Geschwindigkeit im Dunkeln oder bei diffusem Licht belüftet. Der Abbau wird über einen Zeitraum von 28 Tagen durch Bestimmung des erzeugten Kohlendioxids verfolgt, das in Bariumhydroxid oder Natronlauge gebunden und durch Titration des restlichen Hydroxids/der restlichen Lauge oder als anorganischer Kohlenstoff bestimmt wird. Die Menge des aus der Prüfsubstanz freigesetzten Kohlendioxids wird (nach Berücksichtigung der Menge aus dem Inokulum-Blindversuch) in % ThCO2 angegeben. Der Grad des biologischen Abbaus läßt sich auch aus der ergänzenden DOC-Analyse errechnen, die zu Beginn und am Ende der Inkubation vorgenommen wird.
C.4-C.IV.2. Beschreibung der Methode
C.4-C.IV.2.1. Geräte
C.4-C.IV.2.2. Ansatz des mineralischen Mediums
Zubereitung der Stammlösungen siehe I.6.2.
10 ml Lösung (a) mit 800 ml Verdünnungswasser mischen, 1 ml der Lösungen (b) bis (d) hinzugeben und mit Verdünnungswasser auf 1 l auffüllen.
C.4-C.IV.2.3. Ansatz und Vorbereitung des Inokulums
Das Inokulum kann aus verschiedenen Quellen gewonnen werden: aus Belebtschlamm, aus Kläranlagenablauf, aus Oberflächenwasser, aus Böden oder aus mehreren dieser Quellen zugleich.
Vgl. I.6.4., I.6.4.1., I.6.4.2. und I.6.5.
C.4-C.IV.2.4. Ansatz der Flaschen
Die folgenden Mengen- und Gewichtsangaben sind als Beispiel für 5-Liter-Flaschen mit 3 l Suspension zu verstehen. Werden Flaschen mit geringerem Volumen verwendet, sind die Angaben entsprechend zu ändern. Es muß allerdings sichergestellt sein, daß das gebildete Kohlendioxid exakt gemessen werden kann.
In jede 5-l-Flasche werden 2400 ml mineralisches Medium gegeben. Dazu wird eine geeignete Menge des vorbereiteten Belebtschlamms hinzugefügt (vgl. I.6.4.1. und I.6.5.), um schließlich in den 3 l beimpfter Mischung eine Konzentration an suspendierten Feststoffen von nicht mehr als 30 mg/l zu erhalten. Alternativ dazu kann der vorbereitete Belebtschlamm zunächst im mineralischen Medium verdünnt werden zu einer Suspension von 500-1000 mg/l. Danach wird dem Inhalt der 5-l-Flasche eine aliquote Menge hinzugegeben, um so eine Konzentration von 30 mg/l zu erhalten. Dieses letztere Verfahren sichert eine höhere Präzision. Es kann auch Inokulum anderer Herkunft verwendet werden (vgl. I.6.4.2.).
Diese angeimpften Mischungen sind über Nacht mit CO2-freier Luft zu belüften, um das System von Kohlendioxid zu reinigen.
Die Prüf- und die Referenzsubstanz sind getrennt als Stammlösungen bekannten Volumens in die Gefäßes des Parallelansatzes zu geben, um so Substanzkonzentrationen von 10 bis 20 mg/l DOC oder TOC zu erhalten; einige Gefäßes sind ohne Zugabe von Substanz als Inokulum-Kontrollen mitzuführen. Schwerlösliche Prüfsubstanzen sind auf Gewichts- oder Volumenbasis direkt in die Gefäßes zu geben oder gemäß Anhang III zu behandeln.
Falls erforderlich, ist ein Gefäß zur Kontrolle der möglichen Hemmwirkung der Prüfsubstanz zu verwenden; dazu ist sowohl die Prüf- als auch die Referenzsubstanz in derselben Konzentration zuzugeben wie in den anderen Gefäßen.
Falls erforderlich, ist eine weitere, sterile Flasche anzusetzen, um zu prüfen, ob die Prüfsubstanz abiotisch abgebaut wird; dazu ist eine nicht angeimpfte Lösung dieser Substanz zu verwenden (vgl. I.6.6.). Sterilisierung durch Zugabe einer toxischen Substanz in geeigneter Konzentration.
Die Suspensionen in allen Flaschen sind durch Zugabe des zuvor mit CO2-freier Luft belüfteten mineralischen Mediums aufzufüllen. Wahlweise können Proben zur DOC-Analyse (vgl. Anhang II.4.) und/oder zur spezifischen Analyse entnommen werden. Die Absorptionsflaschen sind mit den Gasausläßen der Flaschen zu verbinden.
Bei Verwendung von Bariumhydroxid sind an jede 5-l-Flasche drei Absorptionsflaschen, jeweils gefüllt mit 100 ml Bariumhydroxidlösung 0,0125 M, in Serie anzuschließen. Die Lösung muß frei von ausgefälltem Sulfat und Karbonat sein; die Konzentration der Lösung ist unmittelbar vor Gebrauch zu bestimmen. Bei Verwendung von Natronlauge sind zwei Absorptionsfallen anzuschließen, wobei die zweite als Kontrolle dafür dient, ob das gesamte Kohlendioxid in der ersten Falle absorbiert wurde. Geeignet sind hierfür Absorptionsflaschen, die mit Serumflaschenverschlüssen versehen sind. In jede Flasche sind 200 ml Natronlauge 0,05 M zu geben; diese Menge ist ausreichend, um das gesamte bei vollständigem Abbau der Prüfsubstanz entstehende Kohlendioxid zu absorbieren. Auch nach frischer Zubereitung enthält die Natronlauge Spuren von Karbonaten, die durch Subtraktion des im Blindwert enthaltenen Karbonats berücksichtigt werden.
C.4-C.IV.2.5. Anzahl der Flaschen in einem typischen Durchgang
Flaschen 1 und 2: Prüfsuspension
Flaschen 3 und 4: Inokulum-Blindwert
Flasche 5: Verfahrenskontrolle.
Empfohlen und falls notwendig:
Flasche 6: abiotische Sterilkontrolle
Flasche 7: Toxizitätskontrolle
Vgl. auch I.6.7.
C.4-C.IV.2.6. Durchführung der Prüfung
Bei Versuchsbeginn wird CO2-freie Luft (Geschwindigkeit: 30-100 ml/min) in die Gefäßes mit den Suspensionen geleitet. Zur Bestimmung der CO2-Entwicklung sind regelmäßig Proben des Kohlendioxid-Absorbers zu entnehmen. Es wird empfohlen, diese Messungen in den ersten zehn Tagen alle zwei oder drei, danach bis zum 28. Tag alle fünf Tage vorzunehmen, um das 10-Tage-Fenster zu ermitteln.
Am 28. Tag werden Proben (wahlweise) zwecks DOC- und/oder spezifischer Analyse entnommen, der pH-Wert der Suspensionen gemessen und jeder Flasche 1 ml konzentrierte Salzsäure zugesetzt; die Flaschen sind über Nacht zu belüften, um das in den Prüfsuspensionen vorhandene Kohlendioxid auszutreiben. Am 29. Tag ist die letzte Bestimmung der Kohlendioxidentwicklung vorzunehmen.
An den Tagen, an denen CO2-Messungen vorgenommen werden, ist die dem Testgefäß am nächsten stehende Bariumhydroxid-Absorptionsflasche abzutrennen und die Hydroxidlösung mit HCl 0,05 M unter Verwendung von Phenolphthalein als Indikator zu titrieren. Die verbleibenden Absorptionsflaschen rücken jeweils um einen Platz auf, und eine neue Absorptionsflasche mit 100 ml frischem Bariumhydroxid 0,0125 M wird an das Ende der Serie hinzugefügt. Die Titrationen sind je nach Bedarf vorzunehmen, z.B. wenn in der ersten Falle deutliche Niederschläge auftreten, d. h. bevor ein Niederschlag in der zweiten Falle sichtbar wird, zumindest aber einmal pro Woche. Alternativ kann man - bei Verwendung von NaOH als Absorber - mit einer Spritze eine kleine Probe Natronlauge (je nach verwendetem Kohlenstoffanalysator) aus der dem Testgefäß am nächsten stehenden Absorptionsflasche entnehmen und diese zur Bestimmung der Kohlenstoffentwicklung direkt in den IC-Teil des Kohlenstoffanalysators einspritzen.
Der Inhalt der zweiten Absorptionsfalle ist nur am Versuchsende zu analysieren, um eine mögliche Kohlendioxidübertragung zu berücksichtigen.
C.4-C.IV.3. Daten und Abschlußbericht
C.4-C.IV.3.1. Auswertung der Ergebnisse
Die in einem Absorber gebundene Menge CO2 ergibt sich nach Titration:
mg CO2 = (100 ξ CB - 0,5 ξ V ξ CA) ξ 44
Hierin bedeuten:
| V | = zur Titration der 100 ml im Absorber verbrauchtes Volumen HCl (ml), |
| CB | = Konzentration der Bariumhydroxidlösung (M), |
| CA | = Konzentration der Salzsäurelösung (M), |
Wenn CB 0,0125 M und CA 0,05 M sind, beträgt das zur Titration von 100 ml Bariumhydroxid verbrauchte Volumen 50 ml, während sich die Menge an CO2 wie folgt ergibt:
0,05 / 2 ξ 44 ξ ml titrierte HCl = 1,1 ξ ml HCl
Der Faktor zur Umrechnung des titrierten HCl-Volumens in mg CO2 beträgt demnach 1,1.
Die Mengen des aus dem Inokulum allein und aus Inokulum plus Prüfsubstanz freigesetzten CO2 sind unter Verwendung der entsprechenden Titrationswerte zu berechnen; aus der Differenz ergibt sich die Menge des aus der Prüfsubstanz allein freigesetzten CO2.
Ergibt z.B. das Inokulum allein einen Titrationswert vom 48 ml, Inokulum plus Prüfsubstanz einen Wert von 45 ml, so betragen
CO2 aus dem Inokulum = 1,1 ξ (50-48) = 2,2 mg
CO2 aus Inokulum plus Prüfsubstanz = 1,1 ξ (50-45) = 5,5 mg,
d.h. die Menge des aus der Prüfsubstanz allein freigesetzten CO2 liegt bei 3,3 mg.
Der prozentuale biologische Abbau berechnet sich wie folgt:
| % Abbau = | mg freigesetztes CO2 ξ 100 |
|
| |
| ThCO2 ξ mg zugegebene Prüfsubstanz |
oder
| % Abbau = | mg freigesetztes CO2 x 100 |
|
| |
| mg im Versuch zugegebener TOC x 3,67 |
wobei 3,67 der Umrechnungsfaktor (44/12) von Kohlenstoff in Kohlendioxid ist.
Der prozentuale Abbau für jeden beliebigen Zeitabschnitt kann durch Addition der prozentualen ThCO2-Werte ermittelt werden, die für jeden einzelnen Tag bis zum Zeitpunkt der Messung berechnet worden sind.
Bei Verwendung von Adsorptionsgefäßen mit Natronlauge ist die freigesetzte Kohlendioxidmenge, angegeben als IC (mg), durch Multiplikation der IC-Konzentration im Absorber mit dem Volumen des verwendeten Absorbers zu berechnen.
Der prozentuale biologische Abbau berechnet sich wie folgt:
| % ThCO2 = | mg IC aus dem Prüfgefäß mg IC des Blindwertes | x 100 |
|
| ||
| mg als Prüfsubstanz hinzugefügter TOC |
Die DOC-Abnahme wird (wahlweise) entsprechend den Angaben unter Punkt 1.7. berechnet. Die erhaltenen Werte werden zusammen mit allen anderen Ergebnissen auf den vorliegenden Datenblättern protokolliert.
C.4-C.IV.3.2. Validität der Ergebnisse
Der IC-Gehalt der Prüfsuspension im mineralischen Medium zu Versuchsbeginn darf nicht mehr als 5 % des TC-Wertes betragen, und die gesamte CO2-Entwicklung des Inokulum-Blindwertes zu Versuchsende sollte normalerweise 40 mg/l Medium nicht überschreiten. Bei Werten über 70 mg CO2 pro Liter sollten die Daten und das Versuchsverfahren kritisch überprüft werden.
Vgl. auch I.5.2.
C.4-C.IV.3.3. Abschlußbericht
Vgl. I.8.
C.4-C.IV.4. Datenblatt
Nachstehend ein Beispiel eines Datenblattes.
Kohlendioxidentwicklungstest
Name:
Konzentration der Stammlösung: ... mg/l auf Substanz bezogen
Anfangskonzentration im Medium: ... mg/l auf Substanz bezogen
In die Flasche gegebene Gesamtmenge an °C (TC): ... mg C ThCO2: ... mg CO2
Herkunft: ...
Vorgenommene Behandlung: ...
Vorbereitung/Konditionierung (soweit zutreffend): ...
Konzentration der suspendierten Feststoffe im Reaktionsgemisch: ... mg/l
Methode: Ba(OH)2/NaOH/Sonstige...
| Zeit (Tag) | Freiges.
CO2 Test (mg) | Freiges.
CO2 Blindv. (mg) | Freiges.
CO2 kumulativ. (mg) (Test-Blindv.) | % ThCO2 (kumulativ CO2/ThCO2) ξ 100 | |||||
| 1 / 2 | Mittelw. | 3 / 4 | Mittelw. | 1 | 2 | 1 | 2 | Mittelw. | |
| 0 | |||||||||
| n1 | |||||||||
| n2 | |||||||||
| N3 | |||||||||
| 28 | |||||||||
Anmerkung: Für die Referenzsubstanz sowie für die Toxizitätskontrolle können ähnliche Formblätter verwendet werden.
Kohlenstoffanalysator: ...
| Zeit (Tag) | Blindversuch (mg/l) | Prüfsubstanz (mg/l) |
| 0 | Cb(0) | C0 |
| 28 (*) | Cb(t) | C(t) |
| *) oder am Ende der Inkubation | ||
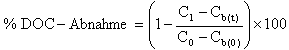
| % abiotischer Abbau = | CO2-Bildung Sterilkontrolle nach 28 Tagen (mg) | x 100 |
|
| ||
| ThCO2 (mg) |
 | weiter . |  |