 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk
 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk |
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Verfahrensordnung: Verfahren für Bewertung von Methoden mit Medizinprodukten der hohen Risikoklassen aufgrund § 137h SGB V
Vom 17. März 2016
(BAnz AT 22.08.2016 B3)
Zur Berichtigung der Änderung vom 07.07.2016 durch den G-BA
Der Gemeinsame Bundesausschuss (G-BA) hat in seiner Sitzung am 17. März 2016 und 7. Juli 2016 beschlossen, die Verfahrensordnung des G-BA in der Fassung vom 18. Dezember 2008 (BAnz. Nr. 84a vom 10. Juni 2009), zuletzt geändert am 18. Dezember 2014 (BAnz AT 15.04.2015 B2), wie folgt zu ändern:
I. Die Verfahrensordnung wird wie folgt geändert:
1. Im Inhaltsverzeichnis werden nach § 28 des zweiten Kapitels die folgenden Angaben ergänzt
"8. Abschnitt Bewertung neuer Untersuchungs- und Behandlungsmethoden mit Medizinprodukten hoher Risikoklasse
§ 29 Regelungsgegenstand
§ 30 Medizinprodukte mit hoher Risikoklasse
§ 31 Neues theoretischwissenschaftliches Konzept
§ 32 Weitere Begriffe
§ 33 Prüfung der Voraussetzungen einer Bewertung nach § 137h Absatz 1 Satz 4 SGB V
§ 34 Plausibilitäts- und Vollständigkeitsprüfung nach Eingang der übermittelten Informationen
§ 35 Verfahren zur Ergänzung von Informationen
§ 36 Entscheidung zum Vorliegen der Voraussetzungen
§ 37 Beschlussfassung nach § 137h Absatz 1 Satz 4 SGB V
§ 38 Beratung nach § 137h Absatz 6 SGB V".
2. In Kapitel 2 wird nach dem 7. Abschnitt der folgende Abschnitt angefügt:
"8. Abschnitt Bewertung neuer Untersuchungs- und Behandlungsmethoden mit Medizinprodukten hoher Risikoklasse
§ 29 Regelungsgegenstand
(1) Der Abschnitt regelt auf der Grundlage von § 137h Absatz 1 Satz 6 SGB V und unter Zugrundelegung der Medizinproduktemethodenbewertungsverordnung (MeMBV) das Bewertungsverfahren nach § 137h SGB V für neue Methoden mit Medizinprodukten hoher Risikoklasse.
(2) Das Bewertungsverfahren nach § 137h SGB V wird durchgeführt für Untersuchungs- und Behandlungsmethoden
§ 30 Medizinprodukte mit hoher Risikoklasse
(1) Medizinprodukte mit hoher Risikoklasse nach § 137h Absatz 1 Satz 1 SGB V sind solche, die der Klasse IIb oder III nach Artikel 9 in Verbindung mit Anhang IX der Richtlinie 93/42/EWG des Rates vom 14. Juni 1993 über Medizinprodukte (ABl. Nr. L 169 vom 12.07.1993 S. 1), die zuletzt durch die Richtlinie 2007/47/EG (ABl. Nr. L 247 vom 21.09.2007 S. 21) geändert worden ist, oder den aktiven implantierbaren Medizinprodukten zuzuordnen sind und deren Anwendung einen besonders invasiven Charakter aufweist.
(2) Die Anwendung eines aktiven implantierbaren Medizinprodukts weist einen besonders invasiven Charakter auf. Ein Medizinprodukt ist den aktiven implantierbaren Medizinprodukten zuzuordnen, wenn es sich um ein aktives implantierbares medizinisches Gerät nach Artikel 1 Absatz 2 Buchstabe c der Richtlinie 90/385/EWG des Rates vom 20. Juni 1990 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über aktive implantierbare medizinische Geräte (ABl. Nr. L 189 vom 20.07.1990 S. 17), die zuletzt durch die Richtlinie 2007/47/EG geändert worden ist, handelt.
(2a) Demnach ist ein aktives implantierbares Medizinprodukt jedes medizinische Gerät, dessen Betrieb auf eine elektrische Energiequelle oder eine andere Energiequelle als die unmittelbar durch den menschlichen Körper oder die Schwerkraft erzeugte Energie angewiesen ist und das dafür ausgelegt ist, ganz oder teilweise durch einen chirurgischen oder medizinischen Eingriff in den menschlichen Körper oder durch einen medizinischen Eingriff in eine natürliche Körperöffnung eingeführt zu werden und dazu bestimmt ist, nach dem Eingriff dort zu verbleiben.
(3) Die Anwendung eines Medizinprodukts, das der Klasse III zuzuordnen ist, weist einen besonders invasiven Charakter auf, wenn mit dem Einsatz des Medizinprodukts ein erheblicher Eingriff in wesentliche Funktionen von Organen oder Organsystemen, insbesondere des Herzens, des zentralen Kreislaufsystems oder des zentralen Nervensystems einhergeht. Erheblich ist ein Eingriff, der die Leistung oder die wesentliche Funktion eines Organs oder eines Organsystems langzeitig verändert oder ersetzt oder den Einsatz des Medizinprodukts in direktem Kontakt mit dem Herzen, dem zentralen Kreislaufsystem oder dem zentralen Nervensystem zur Folge hat.
(3a) Als langzeitig ist ein Zeitraum von mehr als 30 Tagen zu verstehen. Für die Bestimmung, ob der Eingriff die Leistung oder die wesentliche Funktion eines Organs oder eines Organsystems verändert oder ersetzt, sind auch seine beabsichtigten und möglichen Auswirkungen auf die gesundheitliche Situation des Patienten zu betrachten.
(4) Die Anwendung eines Medizinprodukts, das der Klasse IIb zuzuordnen ist, weist nur dann einen besonders invasiven Charakter auf, wenn das Medizinprodukt mittels Aussendung von Energie oder Abgabe radioaktiver Stoffe gezielt auf wesentliche Funktionen von Organen oder Organsystemen, insbesondere des Herzens, des zentralen Kreislaufsystems oder des zentralen Nervensystems einwirkt.
(4a) Für die Bestimmung der gezielten Einwirkung des Medizinprodukts im Sinne von Absatz 4 ist seine der Zweckbestimmung entsprechende Anwendung zugrunde zu legen. Für die Bestimmung, ob die mögliche Einwirkung wesentliche Funktionen eines Organs oder eines Organsystems betrifft, gilt Absatz 3a Satz 2 entsprechend.
§ 31 Neues theoretisch-wissenschaftliches Konzept
(1) Eine Methode weist ein neues theoretischwissenschaftliches Konzept im Sinne von § 137h Absatz 1 Satz 3 SGB V auf, wenn sich ihr Wirkprinzip oder ihr Anwendungsgebiet von anderen, in der stationären Versorgung bereits eingeführten systematischen Herangehensweisen wesentlich unterscheidet.
(2) Als eine bereits in die stationäre Versorgung eingeführte systematische Herangehensweise gilt jede Methode, deren Nutzen einschließlich etwaiger Risiken im Wesentlichen bekannt ist. Wird eine Methode in jeweils einschlägigen methodisch hochwertigen Leitlinien oder anderen systematisch recherchierten Evidenzsynthesen als zweckmäßiges Vorgehen empfohlen, kann die Beurteilung insbesondere hierauf gestützt werden. Als eine bereits in der stationären Versorgung eingeführte systematische Herangehensweise gilt auch eine Methode, die maßgeblich auf Operationen oder sonstigen Prozeduren beruht, die spezifisch in dem vom Deutschen Institut für Medizinische Dokumentation und Information im Auftrag des Bundesministeriums für Gesundheit gemäß § 301 Absatz 2 Satz 2 SGB V herausgegebenen Prozedurenschlüssel in der am 23. Juli 2015 geltenden Fassung aufgeführt sind.
(3) Ein theoretischwissenschaftliches Konzept einer Methode ist die Beschreibung einer systematischen Anwendung bestimmter auf eine Patientin oder einen Patienten einwirkender Prozessschritte (Wirkprinzip), die das Erreichen eines diagnostischen oder therapeutischen Ziels in einer spezifischen Indikation (Anwendungsgebiet) wissenschaftlich nachvollziehbar erklären kann.
(4) Das Wirkprinzip einer Methode unterscheidet sich wesentlich von einer bereits eingeführten systematischen Herangehensweise, wenn der Unterschied in den beschriebenen Prozessschritten
(5) Das Anwendungsgebiet einer Methode unterscheidet sich wesentlich von einer bereits eingeführten systematischen Herangehensweise mit gleichem Wirkprinzip, wenn
(6) Eine schrittweise erfolgende Weiterentwicklung einer bereits eingeführten systematischen Herangehensweise, die nicht zu einer wesentlichen Veränderung des zugrundeliegenden theoretischwissenschaftlichen Konzepts führt, erfüllt nicht die Voraussetzungen des Verfahrens zur Bewertung neuer Untersuchungs- und Behandlungsmethoden mit Medizinprodukten hoher Risikoklasse. Insbesondere wenn mit einer schrittweise erfolgenden Weiterentwicklung der Zweck verfolgt wird, das diagnostische oder therapeutische Ziel in höherem Maße zu erreichen, führt dies für sich allein nicht bereits zu einer wesentlichen Veränderung des zugrundeliegenden Behandlungskonzepts, ohne dass eines der Kriterien nach den Absätzen 4 oder 5 erfüllt ist.
§ 32 Weitere Begriffe
(1) Als erstmalig gilt eine Anfrage, welche eine Methode betrifft,
(2) Das Potenzial einer erforderlichen Behandlungsalternative kann sich etwa ergeben, wenn sie aufgrund ihres Wirkprinzips und der bisher vorliegenden Erkenntnisse mit der Erwartung verbunden ist, dass andere aufwändigere, für den Patienten invasivere oder bei bestimmten Patienten nicht erfolgreich einsetzbare Methoden ersetzt werden können, die Methode weniger Nebenwirkungen hat, sie eine Optimierung der Behandlung bedeutet oder die Methode in sonstiger Weise eine effektivere Behandlung ermöglichen kann. Bei Bewertungen nach § 137h SGB V ergibt sich das fehlende Potenzial insbesondere dann, wenn der Gemeinsame Bundesausschuss auf Grundlage der vorliegenden Evidenz positiv feststellt, dass sie schädlich oder unwirksam ist.
(3) Die technische Anwendung einer Methode beruht maßgeblich auf einem Medizinprodukt, wenn ohne dessen Einbeziehung (technische Anwendung) die Methode bei der jeweiligen Indikation ihr, sie von anderen Vorgehensweisen unterscheidendes, theoretischwissenschaftliches Konzept verlieren würde.
(4) Als betroffen gilt ein Hersteller, wenn er ein Medizinprodukt verantwortlich produziert, welches für die untersuchte Methode maßgeblich im Sinne von Absatz 3 ist.
§ 33 Prüfung der Voraussetzungen einer Bewertung nach § 137h Absatz 1 Satz 4 SGB V
(1) Werden dem Gemeinsamen Bundesausschuss die nach § 137h Absatz 1 Satz 1 SGB V erforderlichen Informationen gemäß Anlage V von einem Krankenhaus übermittelt, prüft er nach Maßgabe der folgenden Regelungen, ob eine Bewertung nach § 137h Absatz 1 Satz 4 SGB V durchzuführen ist.
(2) Voraussetzungen einer Bewertung nach § 137h Absatz 1 Satz 4 SGB V sind:
Voraussetzung einer Prüfung nach § 137h SGB V ist weiterhin, dass bei Erfüllung der Voraussetzungen nach § 137c SGB V die Methode vom Leistungsanspruch des gesetzlich Krankenversicherten umfasst wäre; die Durchführung des Bewertungsverfahrens wird auch beendet, wenn zu einem späteren Zeitpunkt Rechtshindernisse eintreten oder offenkundig werden.
§ 34 Plausibilitäts- und Vollständigkeitsprüfung nach Eingang der übermittelten Informationen
(1) Der Gemeinsame Bundesausschuss prüft die nach Anlage V übermittelten Informationen nach deren Eingang auf Plausibilität und Vollständigkeit und macht sie innerhalb von zwei Wochen nach deren Eingang nach Maßgabe der folgenden Absätze öffentlich bekannt.
(2) Wurde bereits nach § 38 Absatz 2 festgestellt, dass eine Methode Voraussetzungen nach § 33 Absatz 2 erfüllt, wird darauf in der Bekanntmachung hingewiesen. Es sind in diesem Fall keine Informationen zu dem Vorliegen der Voraussetzungen nach § 33 Absatz 2 einzureichen.
(3) Hat die übermittelte Information offenkundig keine Untersuchungs- oder Behandlungsmethode zum Gegenstand, die ein neues theoretischwissenschaftliches Konzept aufweist, oder liegt zumindest eine andere der Voraussetzungen nach § 33 Absatz 2 offenkundig nicht vor, ist darauf in der Bekanntmachung nach Absatz 1 hinzuweisen.
(4) Die Bekanntmachung und die Hinweise erfolgen auf Grundlage der übermittelten Informationen. Der Gemeinsame Bundesausschuss hat im Rahmen der Prüfung nach § 137h SGB V keine Amtsermittlungspflicht und übernimmt keine Haftung für etwaige, aus den übermittelten Informationen übernommene unzutreffende Angaben oder verkürzende Darstellungen. Unbeschadet der fehlenden Amtsermittlungspflicht kann der Gemeinsame Bundesausschuss weitere Informationen einholen und Recherchen durchführen.
(5) Zur Vorbereitung der Bekanntmachung nach § 35 werden die nach Anlage V übermittelten Information von der Geschäftsstelle auf formale Vollständigkeit geprüft, insbesondere ob das Benehmen mit den betroffenen Medizinprodukteherstellern im Sinne von § 137h Absatz 1 Satz 2 SGB V dokumentiert ist. Der Eingang der übermittelten Informationen wird unter Benennung der Methode und des Medizinprodukts von der Geschäftsstelle auf den Internetseiten des Gemeinsamen Bundesausschusses bestätigt. Ist die Anlage in den dort gekennzeichneten wesentlichen Teilen unvollständig, wird weder der Eingang bestätigt noch folgt eine Bekanntmachung. Die Information gilt in diesem Fall nicht als übermittelt, was dem absendenden Krankenhaus mitgeteilt wird.
(6) Bei der Prüfung der Erstmaligkeit nach § 32 Absatz 1 ist eine Auskunft des Instituts für das Entgeltsystem im Krankenhaus (InEK), dass zur selben Methode bereits vor dem 1.1.2016 eine Anfrage nach § 6 Absatz 2 Satz 3 KHEntgG eingegangen ist, als verbindlich zugrunde zu legen. Erstmaligkeit liegt außerdem dann nicht vor, wenn der Gemeinsame Bundesausschuss bereits festgestellt hat, dass deren Gegenstand nicht erstmalig im Sinne von § 32 Absatz 1 ist, oder er die Methode bereits nach § 137h SGB V geprüft hat oder mit der Prüfung nach Veröffentlichung gemäß Absatz 5 Satz 2 begonnen hat. Andernfalls geht der Gemeinsame Bundesausschuss bei einer an ihn übermittelten Anfrage von der Erstmaligkeit aus. Die Anfrage nach § 6 Absatz 2 Satz 3 KHEntgG zum Gegenstand der Informationen gemäß Anlage V gilt bei Fehlen entgegenstehender Anhaltspunkte als gestellt, wenn das Krankenhaus dies in Anlage V erklärt hat. Werden im gleichen Jahr weitere Informationen zu einer Methode übermittelt, die bereits geprüft wird, werden diese Informationen als weitere Informationen nach § 35 gewertet.
(7) Bei der Prüfung der Risikoklasse nach § 33 Absatz 2 Satz 1 Nummer 2 ist die Einordnung im Rahmen des Zertifizierungsverfahrens als Medizinprodukt und seine Risikoklasse im Sinne von § 30 als grundsätzlich verbindlich zugrunde zu legen. Für Medizinprodukte im Sinne des § 3 Nummer 1 des Medizinproduktegesetzes gilt der Nachweis der Funktionstauglichkeit und der Produktsicherheit/Produktqualität durch die CE-Kennzeichnung grundsätzlich als erbracht.
(8) Es wird vorläufig bei Vorliegen der weiteren Voraussetzungen nach § 29 Absatz 2 von einem neuen theoretischwissenschaftlichen Konzept nach § 33 Absatz 2 Satz 1 Nummer 3 ausgegangen. Bei Anhaltspunkten, nach denen dies offenkundig nicht der Fall ist, ergeht ein entsprechender Hinweis nach Absatz 1.
(9) Das Benehmen mit dem betroffenen Medizinproduktehersteller im Sinne von § 137h Absatz 1 Satz 2 SGB V gilt als sichergestellt, wenn das Krankenhaus die Herstellung des Benehmens mit dem Medizinproduktehersteller gemäß Anlage V bestätigt.
(10) Wird zu einem späteren Zeitpunkt im Verfahren festgestellt, dass eine im Rahmen der Prüfung nach den vorstehenden Absätzen getroffene Annahme nicht zutrifft, wird diese spätestens mit der abschließenden Beschlussfassung gemäß § 37 Absatz 1 korrigiert. Bewirkt eine solche Korrektur den Wegfall einer der Voraussetzungen der Durchführung der Bewertung nach § 137h Absatz 1 SGB V, ist das Bewertungsverfahren durch Beschluss zu beenden, es sei denn, das Verfahren wird nach Antragstellung und Einleitungsbeschluss nach § 5 Absatz 1 in ein Methodenbewertungsverfahren nach § 137c SGB V überführt. Ein Beschluss nach Satz 2 ist auf den Internetseiten des Gemeinsamen Bundesausschusses zu veröffentlichen.
§ 35 Verfahren zur Ergänzung von Informationen
Mit der Bekanntmachung nach § 34 Absatz 1 eröffnet der Gemeinsame Bundesausschuss insbesondere allen Krankenhäusern, die eine Erbringung der Methode vorsehen, sowie den jeweils betroffenen Medizinprodukteherstellern die Möglichkeit zur Einreichung weiterer Informationen auf Grundlage der Anlage V nach Vorgaben, die in der Bekanntmachung veröffentlicht werden. Er setzt hierzu eine Frist von in der Regel einem Monat. Die entsprechend den Vorgaben ergänzten Informationen sind zu berücksichtigen.
§ 36 Entscheidung zum Vorliegen der Voraussetzungen
Der Gemeinsame Bundesausschuss trifft unter Berücksichtigung der bis zum Ende der Frist nach § 35 eingegangenen Informationen eine Entscheidung darüber, ob die Voraussetzungen nach § 33 Absatz 2 vorliegen. Er veröffentlicht diese Entscheidung auf den Internetseiten des Gemeinsamen Bundesausschusses und gibt bei einer Ablehnung die Gründe an. § 34 Absatz 4 gilt entsprechend.
§ 37 Beschlussfassung nach § 137h Absatz 1 Satz 4 SGB V
(1) Der Gemeinsame Bundesausschuss nimmt auf Grundlage der nach § 33 und § 35 übermittelten Informationen eine Bewertung vor, ob
Die Bewertung nach Satz 1 wird spätestens nach drei Monaten abgeschlossen und gemäß § 94 Absatz 2 SGB V der Beschluss im Bundesanzeiger und die Tragenden Gründe auf den Internetseiten des Gemeinsamen Bundesausschusses veröffentlicht. § 34 Absatz 4 gilt entsprechend.
(2) Für eine Methode nach Absatz 1 Satz 1 Nummer 1 prüft der Gemeinsame Bundesausschuss, ob Anforderungen an die Qualität der Leistungserbringung in einer Richtlinie nach §§ 136 bis 136b SGB V zu regeln sind.
(3) Für eine Methode nach Absatz 1 Satz 1 Nummer 2 entscheidet der Gemeinsame Bundesausschuss innerhalb von sechs Monaten nach dem Beschluss nach Absatz 1 über eine Richtlinie zur Erprobung nach § 137e SGB V. Für das Verfahren gelten der 6. und 7. Abschnitt entsprechend.
(4) Für eine Methode nach Absatz 1 Satz 1 Nummer 3 entscheidet der Gemeinsame Bundesausschuss unverzüglich über eine Richtlinie nach § 137c Absatz 1 Satz 2 SGB V entsprechend dem im 3. und 4. Abschnitt beschriebenen Verfahren.
(5) Beendet ein Beschluss das Verfahren nach Absatz 1 ohne Rechtsnorm wird dieser und seine Tragenden Gründe auf den Internetseiten des Gemeinsamen Bundesausschusses veröffentlicht.
(6) Die Erprobung dient dem Zweck, die notwendigen Erkenntnisse für die Bewertung des Nutzens der Methode zu gewinnen. Krankenhäuser, die die Methode nach Absatz 3 unter Anwendung des Medizinprodukts zu Lasten der Krankenkassen erbringen wollen, sind verpflichtet, an einer Erprobung nach § 137e SGB V teilzunehmen. Die Anforderungen an die Erprobung nach § 137e Absatz 2 haben unter Berücksichtigung der Versorgungsrealität die tatsächliche Durchführbarkeit der Erprobung und der Leistungserbringung zu gewährleisten. Nach Abschluss der Erprobung entscheidet der Gemeinsame Bundesausschuss innerhalb von drei Monaten über eine Richtlinie nach § 137c SGB V.
(7) In der Erprobungsrichtlinie hat der Gemeinsame Bundesausschuss verschiedene Formen der Beteiligung an der Erprobung vorzusehen. Während es notwendig sein kann, dass eine erforderliche Anzahl von Krankenhäusern an einer randomisierten, kontrollierten Studie teilnimmt, die den Nutzenbeleg erbringen soll, können - wenn sich bereits genügend Krankenhäuser an der vom Gemeinsamen Bundesausschuss vorgesehenen Studie zum Nutzennachweis im engeren Sinne beteiligen und insoweit weitere Krankenhäuser insbesondere aus methodischen Gründen nicht an dieser Studie teilnehmen können - andere Krankenhäuser im Rahmen derselben Erprobung im Sinne einer Beobachtungsstudie flankierende Daten zu Wirksamkeit und Sicherheit liefern und damit ihrer Verpflichtung zur Teilnahme an der Erprobung nachkommen.
§ 38 Beratung nach § 137h Absatz 6 SGB V
(1) Der Gemeinsame Bundesausschuss berät Krankenhäuser und Hersteller von Medizinprodukten auf deren Anforderung nach Anlage VI im Vorfeld des Verfahrens nach § 33 Absatz 1 über dessen Voraussetzungen und Anforderungen im Hinblick auf konkrete Methoden.
(2) Der Gemeinsame Bundesausschuss kann im Rahmen der Beratung nach Absatz 1 auf der Basis von eingereichten aussagekräftigen Unterlagen prüfen, ob eine Methode dem Verfahren nach § 33 Absatz 1 unterfällt, indem er prüft, ob die Voraussetzungen gemäß § 33 Absatz 2 Satz 1 Nummer 2 und Nummer 3, Satz 2, 1. Halbsatz vorliegen und ob eine Prüfung nach § 137h SGB V bereits erfolgt ist oder erfolgt, und hierzu eine Feststellung treffen. Wird vom zu Beratenden eine Beratung zu dieser Frage erbeten, hat er die Informationen nach Anlage VI zu übermitteln. Die Frage nach Satz 1 entscheidet der Gemeinsame Bundesausschuss einheitlich durch Beschluss. § 34 Absatz 4 gilt entsprechend.
(3) Vor einem Beschluss nach Absatz 2 gibt der Gemeinsame Bundesausschuss im Wege einer öffentlichen Bekanntmachung im Internet weiteren betroffenen Krankenhäusern sowie den jeweils betroffenen Medizinprodukteherstellern Gelegenheit zur Stellungnahme. Die Stellungnahmefrist soll nicht kürzer als vier Wochen sein. Die Stellungnahmen sind in die Entscheidungen einzubeziehen. Für den Beschluss gilt § 94 Absatz 2 Satz 1 SGB V entsprechend."
II. Die Änderungen der Verfahrensordnung treten am Tag nach der Veröffentlichung im Bundesanzeiger in Kraft.
Die Tragenden Gründe zu diesem Beschluss werden auf den Internetseiten des Gemeinsamen Bundesausschusses unter www.gba.de veröffentlicht.
Anlage V zum 2. Kapitel
Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse nach § 137h SGB V
Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse nach § 137h des Fünften Buches Sozialgesetzbuch
(SGB V)
< Krankenhaus >
Bezeichnung der Methode:
< Methode = < Intervention > bei < Indikation > >
Stand: < TT.MM.JJJJ >
Abschnitt Allgemeine Hinweise
Dieses Formular dient Ihnen zur Übermittlung der Informationen über den Stand der wissenschaftlichen Erkenntnisse zu einer neuen Untersuchungs- und Behandlungsmethode gemäß § 137h Absatz 1 Satz 1 SGB V an den Gemeinsamen Bundesausschuss (G-BA). Die Pflicht zur Übermittlung dieser Informationen trifft Krankenhäuser, die eine erstmalige Anfrage zu einer neuen Untersuchungs- oder Behandlungsmethode gestellt haben, deren technische Anwendung maßgeblich auf dem Einsatz eines Medizinprodukts hoher Risikoklasse im Sinne von § 137h SGB V beruht. Als "erstmalige Anfrage" gilt hier eine Anfrage nach § 6 Absatz 2 Satz 3 des Krankenhausentgeltgesetzes, die bis zum 31.12.2015 noch nicht beim Institut für das Entgeltsystem im Krankenhaus (InEK) gestellt wurde und die eine neue Untersuchungs- oder Behandlungsmethode betrifft, die noch nicht nach § 137h SGB V geprüft wurde oder wird.
Die vollständigen Angaben im Formular und die beizulegenden Unterlagen ermöglichen dem G-BA,
Bitte beachten Sie, dass eine Übermittlung dieser Informationen gemäß 2. Kapitel § 33 Absatz 1 der Verfahrensordnung des G-BA (VerfO) nur mit eben diesem Formular zulässig ist.
Die Voraussetzungen einer Bewertung nach § 137h SGB V
Ungeachtet der vorgenannten weiter reichenden Pflicht zur Übermittlung von Informationen erfolgt eine inhaltliche Bewertung nach § 137h SGB V durch den G-BA nur dann, wenn folgende Voraussetzungen erfüllt sind:
Die Kriterien "Medizinprodukt mit hoher Risikoklasse" und "neues theoretischwissenschaftliches Konzept" sind im 2. Kapitel §§ 30 und 31 VerfO konkretisiert. Sie werden vom G-BA auf Grundlage der Angaben überprüft, die vom Krankenhaus im Formular in Abschnitt II Nummer 3 und 4 gemacht werden.
Bitte berücksichtigen Sie in jedem Fall, dass es für die Erfüllung des Kriteriums "erstmalige NUB-Anfrage" nicht darauf ankommt, ob ausschließlich Ihr Krankenhaus erstmalig eine Anfrage zu der Methode stellt, sondern grundsätzlich darauf, ob bislang insgesamt keine Anfrage zu der Methode an das InEK gerichtet wurde. Konkretisierungen dazu, wann genau eine NUB-Anfrage als erstmalig gilt, können Sie dem 2. Kapitel §§ 32 Absatz 1 und 34 Absatz 6 VerfO entnehmen.
Der G-BA kann bereits im Vorfeld des Bewertungsverfahrens nach § 137h SGB V prüfen und feststellen, ob eine Methode dem Verfahren unterfällt. Hierfür werden insbesondere die Voraussetzungen "Medizinprodukt mit hoher Risikoklasse" und "neues theoretischwissenschaftliches Konzept" überprüft. Sie sollten vor diesem Hintergrund die Möglichkeit in Betracht ziehen, dass eine solche Feststellung (in Form eines Beschlusses) auch auf entsprechende Bitte eines Medizinprodukteherstellers oder Krankenhauses im Rahmen des Beratungsangebots nach § 137h Absatz 6 SGB V erfolgen kann (vgl. 2. Kapitel § 38 Absatz 2 VerfO). Falls für die gegenständliche Methode eine solche Feststellung bereits vom G-BA getroffen wurde (vgl. hierzu die Bekanntmachungen auf den Internetseiten: www.gba.de/137h) - sei es auf Ihre Anfrage oder die eines anderen Krankenhauses oder Medizinprodukteherstellers hin -, dann verweisen Sie darauf bitte in Abschnitt I Nummer 5 des Formulars. Dies verringert Ihren Aufwand für die Angaben zur Prüfung der Voraussetzungen in Abschnitt II. Hat der G-BA bereits festgestellt, dass die Methode dem Verfahren nicht unterfällt, ist auch keine Informationsübermittlung erforderlich.
Es ist ebenfalls möglich, dass Krankenhäuser Dritte zur Informationsübermittlung bevollmächtigen. In diesem Fall ist die entsprechende Vollmacht dem Formular beizulegen.
Ausfüllhinweise zum Formular
Das Formular der Anlage V gliedert sich in folgende Abschnitte:
I Administrative Informationen
II Angaben zur Methode und den Voraussetzungen einer Bewertung nach § 137h SGB V
III A Weitere medizinproduktbezogene Angaben (sofern dem Krankenhaus bekannt)
III B Weitere medizinproduktbezogene Angaben des Herstellers
(optional vom Hersteller auszufüllen, Erläuterungen dazu siehe unten)
IV Informationen über den Stand der wissenschaftlichen Erkenntnisse
V Eckpunkte einer Erprobungsstudie
(optional auszufüllen)
VI Literaturverzeichnis
VII Unterschrift
Das Formular wird auf den Internetseiten des G-BA (http://www.gba.de) in Form einer Dokumentvorlage bereitgestellt. Verwenden Sie bitte unbedingt diese Vorlage für Ihre Übermittlung. An den Texten der Vorlage selbst dürfen - soweit es sich nicht um bloße Erläuterungen/Beispiele in Platzhalterfeldern handelt - keine Änderungen vorgenommen werden. Bitte denken Sie auch daran, dass die Dokumente in deutscher Sprache abgefasst sein müssen.
Folgende Elemente sind in den Dokumentvorlagen enthalten:
Bei den grau hinterlegten Feldern handelt es sich um Pflichtfelder. Sofern ein sinnvoller Eintrag in ein Pflichtfeld nicht möglich ist, tragen Sie dort bitte eine kurze Begründung ein. Die blau hinterlegten Felder sind für optionale Eingaben vorgesehen. Wenn Sie dort keine Angaben machen möchten, können Sie das Feld einfach leer lassen.
Vergessen Sie bei Ihren Angaben nicht, dass Abkürzungen und nicht standardsprachliche oder medizinische Begriffe bei der erstmaligen Verwendung einzuführen sind.
Die Angaben im Formular sollen mit Quellen belegt werden. Die Quellen führen Sie bitte im Literaturverzeichnis unter Abschnitt VI auf. Tragen Sie unbedingt Sorge dafür, dass der jeweilige Quellenverweis in den vorherigen Abschnitten des Formulars der zugehörigen Quelle im Literaturverzeichnis in Abschnitt VI eindeutig zugeordnet werden kann. Hierfür können Sie beispielsweise wie folgt vorgehen:
Übermitteln Sie sämtliche im Formular zitierten Quellen als Volltexte (z.B. als PDF-Dateien). Die übermittelten Volltexte werden nicht veröffentlicht, sondern allein für den internen Gebrauch verwendet. Bitte seien Sie sich bewusst, dass eine Berücksichtigung der durch die entsprechende Quelle zu belegenden Angaben durch den G-BA nur gewährleistet werden kann, wenn die Volltexte zuzuordnen sind und diese dem G-BA zu Beginn der Bewertung nach § 137h SGB V vorliegen.
Der Abschnitt III B ("weitere medizinproduktbezogene Angaben des Herstellers") ist auf der Internetseite des G-BA als separates Dokument verfügbar. Die betroffenen Medizinproduktehersteller sind aufgefordert, in diesem Dokument optional weitere für den G-BA relevante Angaben und Informationen zu den Medizinprodukten mit hoher Risikoklasse darzulegen, die in Ihrem Krankenhaus bei der angefragten Methode zur Anwendung kommen. Sofern Ihrem Krankenhaus vom Hersteller der ausgefüllte und unterzeichnete Abschnitt III B zusammen mit den zugehörigen Anlagen zur Verfügung gestellt wurde, leiten Sie dies bitte unverändert im Zuge der Informationsübermittlung an den G-BA weiter.
Wie wird mit vertraulichen und hoch vertraulichen Unterlagen umgegangen?
Nehmen Sie bitte keine vertraulichen Informationen in das Formular auf, da es in seinen wesentlichen Inhalten durch den G-BA veröffentlicht wird.
Alle weiteren Unterlagen, die dem G-BA im Rahmen dieser Informationsübermittlung zugehen, unterliegen dem Verwaltungsgeheimnis. Das heißt, sie werden grundsätzlich vertraulich behandelt (§ 27 der Geschäftsordnung des G-BA [GO]).Einem gegenüber dem allgemeinen Grundsatz der Vertraulichkeit verstärkten Schutz derselben unterliegen sogenannte "hoch vertrauliche Informationen", also solche, die von Ihnen oder dem betroffenen Medizinproduktehersteller gesondert als Betriebs- und Geschäftsgeheimnisse gekennzeichnet wurden.
Der Umgang mit hoch vertraulichen Informationen ist in der Vertraulichkeitsschutzordnung des G-BA (Anlage II der GO) geregelt. Insbesondere dürfen gemäß § 2 Satz 2 der Vertraulichkeitsschutzordnung hoch vertrauliche Informationen unter besonderen Sicherungsvorkehrungen nur Personen bekannt gegeben oder zugänglich gemacht werden, die hierzu berechtigt sind und die diese aufgrund ihrer Zuständigkeit und Aufgabe kennen müssen.
Um die Kennzeichnung und Einordnung von hoch vertraulichen Informationen sicherzustellen, legen Sie die entsprechenden Unterlagen unbedingt in einem gesondert gekennzeichneten Unterordner auf der DVD ab (siehe dazu Ordnerstruktur unten). Zusätzlich ist es erforderlich, dass Sie die Dokumente auch im Dateinamen durch den Zusatz "BuG" und auf dem Deckblatt des Dokuments selbst durch den Zusatz "Dokument enthält Betriebs- und Geschäftsgeheimnisse" kennzeichnen. Behalten Sie bei Ihren Angaben stets im Blick, dass entsprechend gekennzeichnete Informationen aufgrund der Anforderungen an die Transparenz und Nachvollziehbarkeit der Entscheidungen des G-BA ebenso wie unveröffentlichte Studien möglicherweise nicht in die Nutzenbewertung nach § 137h Absatz 1 Satz 4 SGB V einbezogen werden können (Näheres dazu finden Sie im 2. Kapitel § 19 VerfO).
Zusammenstellung und Einreichung der Unterlagen
Sie können die Unterlagen - mit Ausnahme des Abschnitts zur Unterschrift - ausschließlich in elektronischer Form einreichen. Als Datenträger ist hierzu eine Digital Versatile Disc (DVD) zu verwenden, die nicht kopiergeschützt sein darf. Für alle einzureichenden Dokumente gilt, dass diese nicht geschützt sein dürfen, d. h., sie müssen ohne Kennworteingabe lesbar, speicherbar und druckbar sein. Zu den einzureichenden Unterlagen zählen:
Stellen Sie bei der Benennung der Dokumente auf der DVD sicher, dass eine eindeutige Zuordnung zu den im Formular genannten Quellen gewährleistet ist. Eine mögliche Ordnerstruktur könnte wie folgt aussehen:

Für die Unterschrift drucken Sie das auf der DVD abgelegte Formular aus, dann übermitteln Sie den unterschriebenen Ausdruck gemeinsam mit der DVD. Alternativ können Sie die Unterschrift im Formular in elektronischer Form auf der DVD unter Verwendung einer qualifizierten elektronischen Signatur nach dem Gesetz über Rahmenbedingungen für elektronische Signaturen (Signaturgesetz - SigG) in der jeweils gültigen Fassung übermitteln.
Formale Prüfung und Veröffentlichung des Formulars
Nachdem der G-BA das Formular mit den zugehörigen Unterlagen erhalten hat, werden die übermittelten Informationen zunächst auf formale Vollständigkeit überprüft. Zur Feststellung der formalen Vollständigkeit müssen folgende Voraussetzungen erfüllt sein:
Fehlt es an einer dieser Voraussetzungen, gelten die übermittelten Informationen als nicht eingegangen - und Sie werden hierüber informiert.
Bei Erfüllung der formalen Voraussetzungen wird der Eingang der übermittelten Informationen unter Nennung der angefragten Methode und des Medizinprodukts, das bei der Methode in Ihrem Krankenhaus zur Anwendung kommen soll, auf den Internetseiten des G-BA (www.gba.de/137h) bestätigt.
Innerhalb von zwei Wochen nach Zugang wird das Formular im Rahmen des Verfahrens zur Einholung weiterer Informationen gemäß § 137h Absatz 1 Satz 3 SGB V auf den Internetseiten des G-BA veröffentlicht. Daher sind die im Formular eingearbeiteten Angaben so zu machen, dass sie keine Betriebs- und Geschäftsgeheimnisse umfassen.
Von einer Veröffentlichung ausgenommen sind die Angaben zu Ihrem Krankenhaus in Abschnitt I, sofern Sie der Veröffentlichung dieser Angaben nicht zustimmen, sowie die übermittelten Anlagen.
Abschnitt I Administrative Informationen
| 1 Krankenhaus |
| 1.1 Name |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.2 Anschrift |
| Klicken Sie hier, um einen Text einzugeben. |
| ggf. Bevollmächtigter (natürliche Person / Unternehmen)* |
| 1.3 Name |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.4 Anschrift |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.5 Veröffentlichung der krankenhausbezogenen Angaben |
| [ ] Das Krankenhaus stimmt der Veröffentlichung der unter Nummer 1 gemachten Angaben zu. |
| [ ] Das Krankenhaus stimmt der Veröffentlichung der unter Nummer 1 gemachten Angaben nicht zu. |
* Vollmacht des Krankenhauses erforderlich
| 2 Ansprechpartner |
| 2.1 Name |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.2 Anschrift |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.3 E-Mail |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.4 Telefon- und Telefaxnummer |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.5 Veröffentlichung der Angaben |
| [ ] Die Kontaktperson und das Krankenhaus stimmen der Veröffentlichung der unter Nummer 2 gemachten Angaben zu. |
| [ ] Die Kontaktperson und das Krankenhaus stimmen der Veröffentlichung der unter Nummer 2 gemachten Angaben nicht zu. |
| 3 Benehmen
Sofern die Übermittlung der Informationen im Benehmen mit mehreren Herstellern erfolgt, vervielfältigen Sie die Zeilen unter Nummer 3.2 und geben Sie Namen, Kontaktdaten und Medizinprodukte aller Hersteller an. | |
| 3.1 Bestätigung des Benehmens | |
| [ ] Die Übermittlung der Informationen erfolgt im Benehmen mit den Herstellern der Medizinprodukte mit hoher Risikoklasse, auf denen die technische Anwendung der in Abschnitt II Nummer 2 beschriebenen Methode maßgeblich beruht und die im unter Nummer 1 genannten Krankenhaus bei der Methode zur Anwendung kommen sollen. Das unter Nummer 1 genannte Krankenhaus bestätigt mit seiner Unterschrift in Abschnitt VII, dass das Benehmen von ihm hergestellt wurde. | |
| 3.2 Angabe des Herstellers und des Medizinprodukts | |
| a) Hersteller 1 | b) Produkt 1 |
| Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
| c) Kontaktdaten (Anschrift und optional Ansprechpartner mit E-Mail-Adresse sowie Telefonnummer) 2 | |
| Klicken Sie hier, um einen Text einzugeben. | |
1) Diese Angaben werden bereits im Rahmen der Bestätigung des Eingangs der Informationen auf den Internetseiten des G-BA veröffentlicht.
2) Diese Angabe wird nicht veröffentlicht.
| 4 Anfrage nach § 6 Absatz 2 Satz 3 des Krankenhausentgeltgesetzes (NUB-Anfrage) |
| 4.1 Bestätigung der NUB-Anfrage |
| [ ] Das unter Nummer 1 genannte Krankenhaus hat am < TT.MM.JJJJ > eine NUB-Anfrage zu der in Abschnitt II Nummer 2 beschriebenen Methode gestellt. |
| 4.2 Angaben aus der NUB-Anfrage |
| Übertragen Sie nachfolgend die Angaben aus den entsprechenden Feldern Ihrer NUB-Anfrage, wie Sie sie auf dem InEK-Datenportal eingegeben haben. Tragen Sie weitere Angaben aus Ihrer NUB-Anfrage in den entsprechenden Feldern in Abschnitt II ein. |
| a) Angefragte Untersuchungs- und Behandlungsmethode * |
| Klicken Sie hier, um einen Text einzugeben. |
| b) Alternative Bezeichnung(en) der Methode |
| Klicken Sie hier, um einen Text einzugeben. |
*) Diese Angaben werden bereits im Rahmen der Bestätigung des Eingangs der Informationen auf den Internetseiten des G-BA veröffentlicht.
| 5 Beschluss nach § 137h Absatz 6 SGB V
Geben Sie nachstehend an, ob nach Ihrem Kenntnisstand (z.B. nach Durchsicht des entsprechenden Bereichs der Internetseiten des G-BA oder aufgrund Ihrer Beteiligung als Beratungsinteressent oder Stellungnehmer) der G-BA zu der Frage, ob die angefragte Methode dem Bewertungsverfahren nach § 137h SGB V unterfällt, im Rahmen einer Beratung gemäß § 137h Absatz 6 SGB V einen entsprechenden Beschluss gefasst hat. Falls Sie Kenntnis von einem solchen Beschluss haben, geben Sie Beschlusstitel und -datum an. |
| Zu der Frage, ob die angefragte Methode dem Bewertungsverfahren nach § 137h SGB V unterfällt, hat der G-BA im Rahmen einer Beratung von Krankenhäusern und Herstellern von Medizinprodukten gemäß § 137h Absatz 6 SGB V einen entsprechenden Beschluss gefasst. |
| [ ] Trifft zu. * |
| [ ] Trifft nicht zu. |
| Falls zutreffend: |
| Beschlusstitel |
| Klicken Sie hier, um einen Text einzugeben. |
| Beschlussdatum |
| Klicken Sie hier, um einen Text einzugeben. |
* Falls der G-BA zu der Frage, ob die angefragte Methode dem Bewertungsverfahren nach § 137h SGB V unterfällt, einen Beschluss gemäß § 137h Absatz 6 SGB V gefasst hat, sind in Abschnitt II keine Angaben in den Textfeldern unter Nummer 3.2 b), 3.2 c), 4.2 a), 4.2 b), 4.3 a) und 4.3 b) notwendig.
Abschnitt II Angaben zur Methode und den Voraussetzungen einer Bewertung nach § 137h SGB V
| 1 Allgemeine Informationen zum medizinischen Hintergrund
Fassen Sie hier die Informationen zum medizinischen Hintergrund der angefragten Methode prägnant zusammen. Ersatzweise können die Angaben unter Nummer 1.1 bis 1.3 auch durch einen Verweis auf aussagekräftige Quellen wie beispielsweise Übersichtsarbeiten oder Leitlinien erfolgen. Wie bei allen Quellen wären dann auch hier die entsprechenden Volltexte beizufügen. |
| 1.1 Angaben zur Krankheit allgemein (insbesondere Angaben zu Ätiologie, Symptomatik, Spontanverlauf und Klassifikation[en]) |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.2 Angabe der Prävalenz der Erkrankung pro 10.000 Personen der bundesdeutschen Bevölkerung |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.3 Benennung und Kurzbeschreibung der derzeit zur Therapie bzw. Diagnostik zur Verfügung stehenden Optionen, wie die Patientinnen und Patienten bislang im Rahmen der gesetzlichen Krankenversicherung versorgt werden
Bitte beachten Sie, dass eine ausführliche Darstellung der etablierten therapeutischen oder diagnostischen Verfahren im Hinblick auf die konkret angefragte Methode unter Nummer 4.2a) erfolgt. |
| Klicken Sie hier, um einen Text einzugeben. |
| 2 Angaben zur angefragten Methode
Beschreiben Sie hier möglichst konkret die Methode, die Gegenstand Ihrer in Abschnitt I Nummer 4 genannten NUB-Anfrage ist. Erläutern Sie dazu den theoretischwissenschaftlichen Begründungsansatz der angefragten Methode. Bitte beachten Sie: eine Methode im Sinne des § 137h SGB V wird durch zwei Komponenten definiert:
|
| 2.1 Angaben aus Ihrer NUB-Anfrage zur Beschreibung der Methode
Übertragen Sie zunächst nachfolgend die Angaben aus den entsprechenden Feldern Ihrer NUB-Anfrage, wie Sie sie auf dem InEK-Datenportal eingegeben haben. Wenn Sie dort eines der im Folgenden abgefragten Felder freigelassen haben, tragen Sie bitte in dem entsprechenden Feld dieses Formulars "keine Angabe in NUB-Anfrage" ein. |
| a) Beschreibung der neuen Methode |
| Klicken Sie hier, um einen Text einzugeben. |
| b) Mit welchem OPS wird die Methode verschlüsselt? |
| Klicken Sie hier, um einen Text einzugeben. |
| c) Anmerkungen zu den Prozeduren |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.2 Beschreibung des Wirkprinzips
Beschreiben Sie aufbauend auf den Angaben in Ihrer NUB-Anfrage hierbei insbesondere die einzelnen Prozessschritte, die im Rahmen der Methode bei der Patientin oder dem Patienten angewendet werden und beschreiben Sie, nach welcher Rationale das durch die Anwendung angestrebte diagnostische oder therapeutische Ziel erreicht werden soll. |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.3 Beschreibung des Anwendungsgebiets*
Beschreiben Sie die Patientengruppe, bei der das unter Nummer 2.2 beschriebene Wirkprinzip angewendet werden soll. Benennen Sie die Krankheit sowie gegebenenfalls Krankheitsstadium, Alter, Geschlecht oder Kontraindikationen. Die Angabe in diesem Feld muss deckungsgleich mit der Angabe in dem Feld des InEK-Datenportals "Bei welchen Patienten wird die Methode angewandt (Indikation)?" Ihrer in Abschnitt I Nummer 4 genannten NUB-Anfrage sein. |
| Klicken Sie hier, um einen Text einzugeben. |
* Diese Angaben werden bereits im Rahmen der Bestätigung des Eingangs der Informationen auf den Internetseiten des G-BA veröffentlicht.
| 3 Maßgebliches Medizinprodukt mit hoher Risikoklasse
Sofern Sie in Abschnitt I Nummer 3 mehrere Medizinprodukte angegeben haben, vervielfältigen Sie dieses Feld Nummer 3 und füllen Sie es je Medizinprodukt aus. |
| 3.1 Benennung und Beschreibung des in Abschnitt I Nummer 3 angegebenen Medizinprodukts und seiner Einbindung in die angefragte Methode
Erläutern Sie hierbei insbesondere den Stellenwert des Medizinprodukts im Rahmen des unter Nummer 2.2 beschriebenen Wirkprinzips unter Berücksichtigung der Frage, ob die technische Anwendung der angefragten Methode maßgeblich auf dem Medizinprodukt beruht. |
| Klicken Sie hier, um einen Text einzugeben.
Hinweis: Die technische Anwendung einer Methode beruht maßgeblich auf einem Medizinprodukt, wenn ohne dessen Einbeziehung (technische Anwendung) die Methode bei der jeweiligen Indikation ihr, sie von anderen Vorgehensweisen unterscheidendes, theoretischwissenschaftliches Konzept verlieren würde. |
| 3.2 Angaben zum Kriterium "Medizinprodukt mit hoher Risikoklasse"
a) Einordnung des Medizinprodukts [ ] aktives implantierbares Medizinprodukt gemäß Richtlinie 90/385/EWG [ ] Medizinprodukt der Klasse III gemäß Anhang IX der Richtlinie 93/42/EWG [ ] Medizinprodukt der Klasse IIb gemäß Anhang IX der Richtlinie 93/42/EWG |
| b) für Medizinprodukte der Klasse III
Geben Sie an, ob mit dem Einsatz des Medizinprodukts in Funktionen von Organen oder Organsystemen eingegriffen wird. Falls ja, beschreiben Sie, in welche Funktionen eingegriffen wird und zu welchem Ausmaß die Funktionen beeinflusst werden (bspw. Angabe von Dauer, Intensität oder Frequenz der Beeinflussung). Diese Angaben sind für den G-BA relevant um zu prüfen, ob die Anwendung des Medizinprodukts einen besonders invasiven Charakter gemäß 2. Kapitel § 30 Absatz 3 VerfO aufweist. Ein besonders invasiver Charakter liegt bei Anwendung eines Medizinprodukts der Klasse III demnach vor, wenn mit dem Einsatz des Medizinproduktes ein erheblicher Eingriff in wesentliche Funktionen von Organen oder Organsystemen, insbesondere des Herzens, des zentralen Kreislaufsystems oder des zentralen Nervensystems einhergeht. Erheblich ist ein Eingriff, der die Leistung oder die wesentliche Funktion eines Organs oder eines Organsystems langzeitig verändert oder ersetzt oder den Einsatz des Medizinprodukts in direktem Kontakt mit dem Herzen, dem zentralen Kreislaufsystem oder dem zentralen Nervensystem zur Folge hat. Für die Bestimmung, ob der Eingriff die Leistung oder die wesentliche Funktion eines Organs oder eines Organsystems verändert oder ersetzt, sind nach 2. Kapitel § 30 Absatz 3a Satz 2 VerfO auch seine beabsichtigten und möglichen Auswirkungen auf die gesundheitliche Situation des Patienten zu betrachten. |
| Klicken Sie hier, um einen Text einzugeben. |
| c) für Medizinprodukte der Klasse IIb
Erläutern Sie, ob das Medizinprodukt mittels Aussendung von Energie oder Abgabe radioaktiver Stoffe gezielt in Funktionen von Organen oder Organsystemen eingreift. Falls ja, beschreiben Sie, in welche Funktionen eingegriffen wird und zu welchem Ausmaß die Funktionen beeinflusst werden (bspw. Angabe von Dauer, Intensität oder Frequenz der Beeinflussung). Diese Angaben sind für den G-BA relevant um zu prüfen, ob die Anwendung des Medizinprodukts einen besonders invasiven Charakter gemäß 2. Kapitel § 30 Absatz 4 VerfO aufweist. Ein besonders invasiver Charakter liegt bei Anwendung eines Medizinprodukts der Klasse IIb demnach vor, wenn das Medizinprodukt mittels Aussendung von Energie oder Abgabe radioaktiver Stoffe gezielt auf wesentliche Funktionen von Organen oder Organsystemen, insbesondere des Herzens, des zentralen Kreislaufsystems oder des zentralen Nervensystems einwirkt. Für die Bestimmung, ob der Eingriff die Leistung oder die wesentliche Funktion eines Organs oder eines Organsystems verändert oder ersetzt, sind nach 2. Kapitel § 30 Absatz 4a Satz 2 VerfO auch seine beabsichtigten und möglichen Auswirkungen auf die gesundheitliche Situation des Patienten zu betrachten. |
| Klicken Sie hier, um einen Text einzugeben. |
| 4 Angaben für die Prüfung der Neuheit des theoretischwissenschaftlichen Konzepts der angefragten Methode
Gemäß 2. Kapitel § 31 Absatz 1 VerfO weist eine angefragte Methode ein neues theoretischwissenschaftliches Konzept auf, wenn sich ihr Wirkprinzip oder ihr Aufgrund Ihrer nachfolgenden Angaben prüft der G-BA, ob die von Ihnen angefragte Methode ein neues theoretischwissenschaftliches Konzept aufweist. In diesem Zusammenhang prüft der G-BA beispielsweise auch die Übertragbarkeit der vorhandenen Erkenntnisse auf den Anwendungskontext der angefragten Methode. |
| 4.1 Angaben aus Ihrer NUB-Anfrage zur Neuheit der angefragten Methode
Übertragen Sie nachfolgend die Angaben aus den entsprechenden Feldern Ihrer NUB-Anfrage, wie Sie sie auf dem InEK-Datenportal eingegeben haben. |
| a) Welche bestehende Methode wird durch die neue Methode abgelöst oder ergänzt? |
| Klicken Sie hier, um einen Text einzugeben. |
| b) Ist die Methode vollständig oder in Teilen neu, und warum handelt es sich um eine neue Untersuchungs- und Behandlungsmethode? |
| Klicken Sie hier, um einen Text einzugeben. |
| c) Welche Auswirkungen hat die Methode auf die Verweildauer im Krankenhaus? |
| Klicken Sie hier, um einen Text einzugeben. |
| d) Wann wurde diese Methode in Deutschland eingeführt? |
| Klicken Sie hier, um einen Text einzugeben. |
| 4.2 Angabe zu den bereits eingeführten Verfahren im Anwendungsgebiet der angefragten Methode
a) Benennen und beschreiben Sie in einem ersten Schritt welche medizinischen Verfahren in der Versorgung der unter Nummer 2.3 genannten Patientengruppe bereits angewendet werden. Geben Sie an, welche Informationen für die Anwendung der Verfahren vorliegen: Gibt es Informationen aus Leitlinien oder systematischen Übersichtsarbeiten? Sind für diese medizinischen Verfahren spezifische OPS-Kodes vorhanden? |
| Klicken Sie hier, um einen Text einzugeben. |
| b) Stellen Sie in einem zweiten Schritt dar, ob und wie sich die angefragte Methode von den unter a) beschriebenen Verfahren in ihrem Wirkprinzip unterscheidet. Hierbei können mitunter der theoretischwissenschaftliche Begründungsansatz der angefragten Methode, eine veränderte Form der Einwirkung auf die Patientin oder den Patienten oder andere Eigenschaften und Funktionsweisen des unter Nummer 3 beschriebenen Medizinprodukts relevant sein. |
| Klicken Sie hier, um einen Text einzugeben. |
| 4.3 Angabe zu Anwendungsgebieten, in denen das Wirkprinzip der angefragten Methode bereits angewendet wird
a) Benennen und beschreiben Sie in einem ersten Schritt, ob und falls ja bei welchen Patientengruppen das unter Nummer 2.2 genannte medizinische Verfahren der angefragten Methode bereits angewendet wird. Stellen Sie zudem den theoretischwissenschaftlichen Begründungsansatz des medizinischen Verfahrens bei der hier genannten Patientengruppe (bisheriges Anwendungsgebiet) dar. Benennen Sie die wesentliche Datengrundlage für die Anwendung des medizinischen Verfahrens der angefragten Methode bei den hier benannten Patientengruppen. Berücksichtigen Sie dabei insbesondere Informationen aus Leitlinien oder systematischen Übersichtsarbeiten. |
| Klicken Sie hier, um einen Text einzugeben. |
| b) Stellen Sie in einem zweiten Schritt dar, worin der Unterschied zwischen der unter 2.3 beschriebenen Patientengruppe und den unter a) beschriebenen Patientengruppen (beispielsweise im Hinblick auf Krankheit, Krankheitsstadium, Alter, Geschlecht, erwartete oder bezweckte Auswirkung des angewendeten medizinischen Verfahrens) besteht. Falls Sie unter a) keine Patientengruppe benannt haben, kann ein Eintrag hier entfallen. |
| Klicken Sie hier, um einen Text einzugeben. |
Abschnitt III A Weitere medizinproduktbezogene Angaben (sofern dem Krankenhaus bekannt)
Machen Sie in diesem Abschnitt III A weitere, dem Krankenhaus bekannte Angaben zum unter Abschnitt I Nummer 3 benannten Medizinprodukt. Sofern im Abschnitt I Nummer 3 mehrere Medizinprodukte benannt wurden, vervielfältigen Sie den Abschnitt III A und füllen Sie ihn je Medizinprodukt aus.
1 Angabe zur Übermittlung von Abschnitt III B
Geben Sie nachstehend an, ob vom Hersteller des unter 2.1 genannten Medizinprodukts der Abschnitt III B ("weitere medizinproduktbezogene Unterlagen des Herstellers") zur Weiterleitung an den G-BA zur Verfügung gestellt wurde.
[ ] Der Hersteller hat dem Krankenhaus den ausgefüllten und unterzeichneten Abschnitt III B zur Weiterleitung an den G-BA zur Verfügung gestellt.
[ ] Der Hersteller hat dem Krankenhaus den ausgefüllten und unterzeichneten Abschnitt III B zur Weiterleitung an den G-BA nicht zur Verfügung gestellt.
| 2 Allgemeine Angaben
Fügen Sie die technische Gebrauchsanweisung des Medizinprodukts bei und übermitteln Sie, falls verfügbar, weitere Dokumente, die die Funktionsweise des Medizinprodukts illustrieren. |
| 2.1 Name des Medizinprodukts |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.2 Zweckbestimmung |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.3 Sind Ihnen weitere Medizinprodukte bekannt, die gleichartig zum unter 2.1 genannten
Produkt sind und die im Rahmen der angefragten Methode zur Anwendung kommen können? Benennen Sie diese bitte. (optionale Angabe) |
| Klicken Sie hier, um einen Text einzugeben. |
| 3 Erfahrungen bei der Anwendung des Medizinprodukts
Beschreiben Sie nachstehend, welche Erfahrungen Sie in der bisherigen Anwendung des unter Nummer 2.1 genannten Medizinprodukts gesammelt haben: Welche Aspekte müssen bei der Handhabung beachtet werden? Haben sich bei der Anwendung besondere Vorteile oder Probleme ergeben? Gibt es bei der Anwendung des Produkts aus Ihrer Sicht spezifische Risiken für Patientinnen und Patienten? Optional: Welche Anforderungen für die Anwendung können Sie nach diesen Erfahrungen empfehlen (u. a. die Qualifikation der Ärztinnen und Ärzte und des weiteren medizinischen Personals, spezielles Training (auch des Behandlungsteams), Überwachungsbedarf der Patientinnen oder Patienten, spezielle (Notfall-)maßnahmen, erforderliche apparativtechnische Rahmenbedingungen)? Bitte begründen Sie die Anforderungen soweit möglich. |
| Klicken Sie hier, um einen Text einzugeben. |
| 4 Angabe zu Vorkommnissen und schwerwiegenden unerwünschten Ereignissen
Sind Ihnen anhand von Mitteilungen des Herstellers oder des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) Vorkommnisse oder schwerwiegende unerwünschte Ereignisse in Zusammenhang mit dem unter 2 genannten Medizinprodukt bekannt? Wenn ja, welche? Sofern in Abschnitt III B vom Hersteller die Angaben zu Vorkommnissen und schwerwiegenden unerwünschten Ereignissen übermittelt werden, sind keine Angaben in diesem Feld notwendig. |
| Klicken Sie hier, um einen Text einzugeben. |
Abschnitt IV Informationen über den Stand der wissenschaftlichen Erkenntnisse
Dieser Abschnitt dient der Darstellung der Informationsbeschaffung sowie der Benennung der ermittelten und als relevant eingestuften Informationen über den Stand der wissenschaftlichen Erkenntnisse der angefragten Methode. Dabei untergliedert sich die Informationsbeschaffung in eine Suche nach veröffentlichten Studien (Literaturrecherche), sowie eine Suche nach geplanten, noch laufenden, abgebrochenen oder abgeschlossenen Studien in mindestens einem Studienregister. Nachfolgend sind Mindestanforderungen an diese Suchschritte formuliert, die für eine Bewertung nach § 137h SGB V erfüllt sein müssen. Um die Wahrscheinlichkeit ggf. zu erhöhen, dass Sie alle für die Bewertung relevanten Informationen übermitteln, sind mögliche weitere, optionale Schritte für eine systematischere Informationsbeschaffung dargestellt. Die optionalen Anforderungen und Textfelder sind zur besseren Orientierung blau hinterlegt.
1.1 Suche in bibliographischen Datenbanken
Die Literaturrecherche soll mindestens in der frei verfügbaren Literaturdatenbank Medline (Pubmed) durchgeführt werden. Dokumentieren Sie im Folgenden die verwendete Suchstrategie und das Datum der Suche unter Nennung der Suchbegriffe (MeSH-Begriffe, Freitext-Begriffe) und deren Verknüpfungen. Einschränkungen bei der Suche (z.B. Sprach- oder Jahreseinschränkungen) sind zu beschreiben.
Fügen Sie die Gesamttreffer dieser Suche als Datei bei, die nach Möglichkeit in ein Literaturverwaltungsprogramm importiert werden kann (vorzugsweise *.ris).
OPTIONAL: Für eine systematischere Recherche führen Sie diese zusätzlich in der Cochrane Library durch. Darüber hinaus kann eine Suche in weiteren, themenspezifischen Datenbanken zweckmäßig sein, etwa wenn für die Fragestellung typischerweise Publikationen in themenspezifischen Datenbanken (z.B. CINAHL, PsycINFO, usw.) registriert werden. In diesem Fall sind die jeweils verwendeten Suchstrategien sowie das Datum der Recherche und vorgenommene Einschränkungen nachfolgend spezifisch für jede Datenbank darzustellen.
| Klicken Sie hier, um einen Text einzugeben. |
OPTIONAL: In die nachfolgende Abbildung 1 können Sie für die Darstellung der Auswahl der Publikationen die entsprechenden Textfelder nutzen. Ausgehend von der Gesamttrefferzahl ist dabei darzulegen, anhand welches Prüfschrittes (in Titel / Abstract oder anhand der Volltextpublikation) und mit welchen Auswahlkriterien Publikationen im weiteren Prozess berücksichtigt oder ausgeschlossen wurden. Publikationen, die nach Prüfung des Volltextes ausgeschlossen wurden, können mit jeweiligem Ausschlussgrund in Tabelle 1 aufgelistet werden.
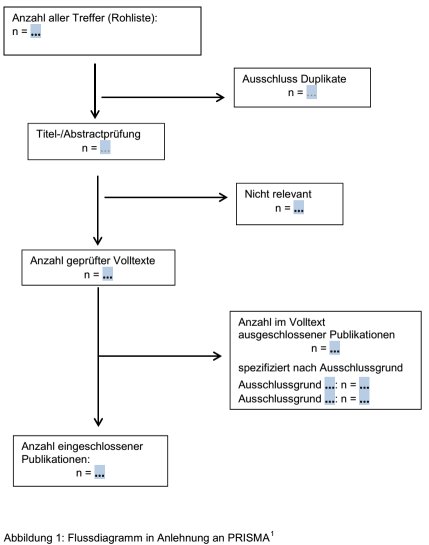
1) Preferred Reporting Items for Systematic Reviews and Meta-Analyses
OPTIONAL:
Tabelle 1: Nach Prüfung von Volltexten ausgeschlossene Publikationen
Nachfolgend können Sie die Publikationen aufführen, die in bibliographischen Datenbanken ermittelt und nach Prüfung des Volltextes ausgeschlossen wurden; dabei können die jeweiligen Ausschlussgründe angegeben werden.
| Quellenangabe | Ausschlussgrund |
| Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
1.2 Suche in Studienregistern
Die Suche in Studienregistern soll mindestens im Register WHO International Registry Trials Clinical Platform (http://www.who.int/ictrp/en/) durchgeführt und im nachfolgenden Textfeld dokumentiert werden.
OPTIONAL: Erweitern Sie die Suche auf das Register clinicaltrials.gov oder führen Sie zusätzlich eine Suche in weiteren themenspezifischen Studienregistern (z.B. krankheitsspezifische Studienregister oder Studienregister einzelner Hersteller) durch. In diesem Fall sind nachfolgend die jeweiligen Suchstrategien je Register darzustellen.
| Klicken Sie hier, um einen Text einzugeben. |
2 Benennung der Studien für die Darstellung des Standes der medizinischen Erkenntnisse
In die nachfolgenden Tabellen sind die Eckpunkte der ermittelten und als relevant eingestuften Publikationen für die Darstellung des Standes der medizinischen Erkenntnisse einzutragen. Dabei befüllen Sie bitte zu Studien, zu denen bereits Ergebnisse vorliegen, die Tabelle 2 unter 2.1 und zu Treffern in Studienregistern, zu denen noch keine Ergebnisse vorliegen, die Tabelle 3 unter 2.2. Darüber hinaus besteht die Möglichkeit, in Tabelle 4 unter 2.3 die Eckpunkte relevanter Studien aufzuführen, die Ihnen bekannt sind, die aber nicht in einem der beiden Suchschritte ermittelt wurden. Weitere relevante Publikationen, wie Leitlinien, HTA-Berichte etc., die sich nicht in Tabelle 4 extrahieren lassen, können in Tabelle 8 unter 3. dargestellt werden.
2.1 Benennung derjenigen Studien zur angefragten Methode, die im Rahmen der vorgenannten Suchschritte identifiziert wurden und zu denen Ergebnisse vorliegen
Füllen Sie bitte für die Benennung der Studien Tabelle 2 aus. Unter "Anmerkungen" besteht Raum für weitere Hinweise, z.B. wenn es zu einer Studie mehrere Publikationen gibt. Dabei ist für jede Studie eine neue Zeile einzufügen.
Tabelle 2: Eckpunkte der Studien zur angefragten Methode, zu denen Ergebnisse vorliegen
| Quelle
[ Autor, Jahr oder Studiennummer im Register] | Name der Studie | Art der Publikation (Vollpublikation oder Abstract) | Studiendesign (z.B. RCT, Fallserie) | Ort (Land) der Durchführung | Zahl der in die Studie eingeschlossenen Patientinnen und Patienten | Ggf. Nennung der Intervention/en oder diagnostischen Testverfahren, mit denen die angefragte Methode verglichen wird. | Erfasste Endpunkte | Anmerkungen |
| Mustermann et al. 2014, Musterfrau 2015, | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
2.2 Benennung von Studien zur angefragten Methode, die in Studienregister(n) ermittelt wurden
Bitte nutzen Sie Tabelle 3 für die Benennung der Treffer aus Studienregister(n) zu geplanten, noch laufenden, abgebrochenen oder abgeschlossenen Studien. Dabei ist für jede Studie eine neue Zeile einzufügen.
Tabelle 3: Eckpunkte der Studien zur angefragten Methode, die in Studienregister(n) ermittelt wurden, aber in ihren Ergebnissen noch nicht publiziert sind
| Quelle
[ Studiennummer im Register] | ggf. Name der Studie | Status der Studie
[geplant, laufend, abgebrochen, abgeschlossen] | Studiendesign, (z.B. RCT, Fallserie) | Ort (Land) der Durchführung und geplantes Studienende | Anzahl der Patientinnen und Patienten, die eingeschlossen werden sollen | Ggf. . Nennung der Intervention/en oder diagnostischen Testverfahren, mit denen die angefragte Methode verglichen wird. | Benennung der Endpunkte, die erfasst werden sollen |
| Mustermann et al. 2014, Musterfrau 2015, NCT00884711 | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
2.3 Benennung von Studien zur angefragten Methode, die nicht im Rahmen der Literaturrecherche identifiziert wurden
Hier besteht die Möglichkeit, Ihnen bekannte Studien zu benennen, die nicht in der Literaturrecherche identifiziert wurden. Dabei ist für jede Studie eine neue Zeile einzufügen.
Tabelle 4: Eckpunkte der abgeschlossenen (jedoch nicht im Rahmen der Literaturrecherche identifizierten) Studien zur angefragten Methode, zu denen Ergebnisse vorliegen
| Quelle
[ Autor, Jahr oder Studiennummer im Register] | Name der Studie | Art der Publikation (Vollpublikation oder Abstract) | Studiendesign (z.B. RCT, Fallserie) | Ort (Land) der Durchführung | Zahl der in die Studie eingeschlossenen Patientinnen und Patienten | Ggf. Nennung der Intervention/en oder diagnostischen Testverfahren, mit denen die angefragte Methode verglichen wird. | Erfasste Endpunkte | Anmerkungen |
| Mustermann et al. 2014, Musterfrau 2015, | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
OPTIONAL:
2.4 Bisherige Ergebnisse der Studien
Wenn Sie diese Option nutzen, dann tragen Sie in die nachfolgenden Tabellen die Darstellungen der Ergebnisse der eingeschlossenen Studien bitte so ein, dass für jeden für die Bewertung nach § 137h SGB V relevanten Endpunkt eine neue Tabelle mit den jeweiligen Ergebnissen der Studien entsteht, die diesen Endpunkt erhoben haben (die Tabellenvorlagen sind entsprechend zu vervielfältigen). Dabei ist zwischen dichotomen (z.B. Ereignis eingetreten ja/nein) und kontinuierlichen (z.B. Score in einem Fragebogen) Endpunkten zu unterscheiden. Ergebnisse zu unerwünschten Ereignissen sollten ebenfalls in einer eigenen Tabelle dargestellt werden.
Wenn es sich bei der angefragten Methode um ein diagnostisches Verfahren handelt, welches bereits in Studien zum Nachweis der therapeutischen Konsequenz einer diagnostischen Methode eingesetzt wurde, können die Ergebnisse dieser Studien hier ebenfalls dargestellt werden. Dies hat den Hintergrund, dass nicht nur Studien zur diagnostischen Güte, sondern auch Studien zu therapeutischen Effekten, die auf dem Einsatz des diagnostischen Verfahrens beruhen, wichtige Ergebnisse zum diagnostischtherapeutischen Pfad liefern können.
Tabelle 5: Ergebnisse von Studien zur therapeutischen Methode (bei Diagnostika: Studien zum diagnostischtherapeutischen Pfad) für dichotome Endpunkte
| Endpunkt X. | ||||
| Quellen
[ Autor, Jahr oder Studiennummer im Register] | ggf. Name der Studie | Ereignisse in der Interventionsgruppe | Ereignisse in der Vergleichsgruppe * | Maß für Unterschied, ggf. KI oder p-Wert |
| Mustermann et al. 2014 | Name | n/N | n/N | RR= 0,80;
[95% KI = 0,25 - 0,95]; p = 0,03 |
*Soweit keine Vergleichsgruppe vorhanden ist, ist "keine Vergleichsgruppe vorhanden" einzutragen. Abkürzungen: KI= Konfidenzintervall, RR="relatives" Risiko
Tabelle 6: Ergebnisse von Studien zur therapeutischen Methode (bei Diagnostika: Studien zum diagnostischtherapeutischen Pfad) für kontinuierliche Endpunkte
| Endpunkt X. | |||||
| Quellen
[ Autor, Jahr oder Studiennummer im Register] | ggf. Name der Studie | Operationalisierung des Endpunkts | Ergebnis in der Interventionsgruppe | Ergebnis in der Vergleichsgruppe* | Maß für Unterschied, ggf. 95%-KI oder p-Wert |
| Mustermann et al. 2014 | Name | XYZ-Score nach 12
Monaten | MW (SD) | MW (SD) | +0,3; p= 0,03 |
*Soweit keine Vergleichsgruppe vorhanden ist, ist "keine Vergleichsgruppe vorhanden" einzutragen. Abkürzungen: KI= Konfidenzintervall, MW=Mittelwert, SD=Standardabweichung
Tabelle 7: Ergebnisse von Studien zur diagnostischen Testgenauigkeit
| Endpunkt X. | ||||||
| Quellen
[ Autor, Jahr oder Studiennummer im Register] | ggf. Name der Studie | Test/Diagnostisches Verfahren | Anzahl Patient en. (n) | Testgenauigkeit* | in % [95%KI], n/N | Maß für Unterschied, Vergleich 95%-KI, Delta, p-Wert |
| Sensitivität | Spezifität | |||||
| Mustermann et al. 2014 | Name | Indextest | 160 | 77% [56-91%] 20/26 (n/N) | 94% [89-97%] 126/134( n/N) | Sens.: Delta 27% [5- 46%], p=0,039** Spez.: Delta -4% [-9- 1%], p=0,125** |
| (untersuchtes diagnostisches Verfahren)e | 160 | 50% [30-70%] 13/26 (n/N) | 98% [94-100%] 131/134 (n/N) | |||
*Evtl. auch positiv und negativ prädiktiver Wert. ** McNemar-Test. Abkürzungen: KI= Konfidenzintervall, Sens = Sensitivität, Sp = Spezifität
OPTIONAL:
3 Andere aussagekräftige Unterlagen für die Bewertung, jenseits der systematisch ermittelten Literatur
Nachfolgend besteht die Möglichkeit, weitere Publikationen (z.B. Leitlinien, HTA-Berichte, systematische Übersichtsarbeiten) darzustellen, die sich nicht in Tabelle 4 darstellen ließen, Ihnen jedoch bekannt sind und relevante Erkenntnisse mit Blick auf die Bewertung enthalten.
Tabelle 8: Ergebnisse/Kernaussagen anderweitiger Publikationen/Studien
| Quelle (Autor,
Jahr) | Ergebnisse/Kernaussagen |
| Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
OPTIONAL:
4 Zusammenfassende Bewertung des aktuellen Kenntnisstandes zu der Methode, einschließlich einer Einschätzung zur Ergebnissicherheit der dargestellten Studien
Nachfolgend besteht die Möglichkeit, den sich aus den genannten Angaben ergebenden Kenntnisstand zur Bewertung der Methode in kurzer Form darzustellen.
Klicken Sie hier, um einen Text einzugeben.
Abschnitt V Eckpunkte einer Erprobungsstudie (optional auszufüllen)
Ein mögliches Ergebnis der Bewertung des Nutzens durch den G-BA kann sein, dass der Nutzen zwar als noch nicht hinreichend belegt anzusehen ist, aber die Methode unter Anwendung des Medizinproduktes das Potenzial einer erforderlichen Behandlungsalternative bietet (§ 137h Absatz 1 Satz 4 Nummer 2 SGB V). In diesem Fall hat der G-BA innerhalb von sechs Monaten nach dem entsprechenden Beschluss über eine Richtlinie zur Erprobung nach § 137e SGB V zu entscheiden.
In diesem Abschnitt können Sie optional mögliche Eckpunkte einer Erprobungsstudie darlegen. Die hier dargelegten Eckpunkte werden bei der Konzeption der Erprobungsstudie berücksichtigt. Beachten Sie dabei bitte, dass die mit den Eckpunkten zu skizzierende Erprobungsstudie eine Bewertung des Nutzens der Methode auf einem für eine spätere Richtlinienentscheidung ausreichend sicheren Erkenntnisniveau (vgl. 2. Kapitel § 13 Absatz 2 VerfO) bezweckt. Für die Angaben zu den Eckpunkten sind klinischwissenschaftliche Begründungen wichtig.
Angaben in diesem Abschnitt haben keinen Einfluss auf das Ergebnis der Nutzenbewertung. Der G-BA ist jedoch sehr an Informationen in diesem Bereich interessiert, insbesondere für den Fall, dass von Fachgesellschaften, Studiengruppen oder einzelnen Krankenhäusern bereits konkrete Studienkonzepte zur angefragten Methode in der Entwicklung befindlich sind. Die Informationen können dazu beitragen, dass die Erstellung einer Erprobungs-Richtlinie erleichtert wird.
Bei der Darlegung möglicher Eckpunkte beachten Sie bitte folgende Aspekte:
Unter Punkt A können Sie daher mögliche Eckpunkte einer Studie benennen, die den Nutzenbeleg erbringen soll und unter Punkt B können Sie mögliche Eckpunkte zur Lieferung flankierender Daten zu Wirksamkeit und Sicherheit im Sinne einer Beobachtungsstudie darlegen.
A. Mögliche Eckpunkte einer Studie, die den Nutzenbeleg erbringen soll
| 1 Fragestellung |
| Formulieren Sie hier die Fragestellung der Erprobungsstudie unter kurzer Benennung der |
| Zielpopulation, der Intervention und der Kontrollintervention sowie der Endpunkte. |
| Klicken Sie hier, um einen Text einzugeben. |
| 2 Studienpopulation
Die Angaben in Abschnitt II Nummer 2.3 können hier, soweit erforderlich, konkretisiert werden; Abweichungen gegenüber des Anwendungsgebietes in Abschnitt II Nummer 2.3 bedürfen der Begründung. |
| Klicken Sie hier, um einen Text einzugeben. |
| 3 Intervention und Vergleichsintervention (Kontrolle)
Hier können Sie die in Abschnitt II Nummer 2.2 gemachten Angaben zur Intervention konkretisieren. Beschreiben und begründen Sie zudem auf Grundlage Ihrer Angaben in Abschnitt II Nummer 4.2a) die angemessene Vergleichsintervention für die mögliche Erprobungsstudie. |
| Klicken Sie hier, um einen Text einzugeben. |
| 4 Endpunkte
Benennen Sie einen patientenrelevanten primären Endpunkt. Schätzen Sie bezogen auf den primären Endpunkt den erwarteten Effekt begründet ab und legen Sie die klinische Relevanz des Effekts dar. Zudem sind mögliche weitere Endpunkte (sekundäre Endpunkte) sowie erwartete unerwünschte Ereignisse zu benennen. Beschreiben Sie für jeden Endpunkt valide Erhebungsinstrumente und -methoden. |
| Klicken Sie hier, um einen Text einzugeben. |
| 5 Studientyp
Die Studie muss geeignet sein, eine Bewertung des Nutzens der Methode auf einem für eine spätere Richtlinienentscheidung ausreichend sicheren Erkenntnisniveau zu erlauben. Hierbei soll es sich soweit möglich, um eine Studie der Evidenzstufe I gemäß 2. Kapitel § 11 VerfO mit patientenbezogenen Endpunkten (z.B. Mortalität, Morbidität, Lebensqualität) handeln. Bei seltenen Erkrankungen, bei Methoden ohne vorhandene Alternative oder aus anderen Gründen kann es unmöglich oder unangemessen sein, Studien dieser Evidenzstufe durchzuführen oder zu fordern. Soweit qualitativ angemessene Unterlagen dieser Aussagekraft nicht vorliegen, erfolgt die Nutzen-Schaden-Abwägung einer Methode aufgrund qualitativ angemessener Unterlagen niedrigerer Evidenzstufen. Die Anerkennung des medizinischen Nutzens einer Methode auf Grundlage von Unterlagen einer niedrigeren Evidenzstufe bedarf jedoch - auch unter Berücksichtigung der jeweiligen medizinischen Notwendigkeit - zum Schutz der Patientinnen und Patienten umso mehr einer Begründung je weiter von der Evidenzstufe I abgewichen wird. Dafür ist der potenzielle Nutzen einer Methode, insbesondere gegen die Risiken der Anwendung bei Patientinnen oder Patienten abzuwägen, die mit einem Wirksamkeitsnachweis geringerer Aussagekraft einhergehen. Hierbei ist insbesondere sicherzustellen, dass die methodischen Anforderungen an die Studiendurchführung unter Berücksichtigung der Versorgungsrealität so ausgestaltet werden, dass sie hinreichend praktikabel sind. Falls eine randomisierte kontrollierte Studie für die Erprobung nicht in Frage kommt, ist das zu begründen und darzulegen, wie mögliche Verzerrungen des Studienergebnissesvermieden werden sollen. Legen Sie Maßnahmen dar, mit denen eine effektive Verblindung gewährleistet werden kann. Spezifische Besonderheiten (z.B. mehr als 2 Behandlungsarme, Crossover- oder faktorielles Design, Nicht-Unterlegenheitsstudie etc.) sind spezifisch darzustellen und ggf. zu begründen. |
| Klicken Sie hier, um einen Text einzugeben. |
| 6 Sächliche, personelle und sonstige Anforderungen an die Qualität |
| Klicken Sie hier, um einen Text einzugeben. |
| 7 Fallzahlabschätzung und Studiendauer
Nehmen Sie basierend auf dem unter Nummer 3 dargestellten erwarteten Effekt bezogen auf den primären Endpunkt eine vorläufige Fallzahlschätzung vor. Geben Sie die geschätzte Studiendauer einschließlich der Nachbeobachtungszeit (ungefährer Zeitablaufplan untergliedert in Rekrutierung - Intervention - Beobachtung - Auswertung) sowie Erhebungszeitpunkte für die unter 3. benannten Endpunkte an. Das Followup ist unter Berücksichtigung des Krankheitsverlaufs und der erwarteten Effekte zu begründen. Nehmen Sie anhand der Fallzahlplanung eine Abschätzung des Rekrutierungszeitraums vor und legen Sie das Vorgehen zur Rekrutierung der Studienteilnehmer dar. |
| Klicken Sie hier, um einen Text einzugeben. |
| 8 Studienkosten
Geben Sie eine Schätzung der möglichen Studienkosten einer Erprobungsstudie unter Berücksichtigung der Ausführungen unter den Nummern 1 bis 7 an. Hierbei sind die Kosten der Erstellung des Studienprotokolls von den Kosten der Studiendurchführung und - auswertung abzugrenzen. |
| Klicken Sie hier, um einen Text einzugeben. |
B. Mögliche Eckpunkte zur Lieferung flankierender Daten zu Wirksamkeit und Sicherheit im Sinne einer Beobachtungsstudie (einschließlich Schätzung möglicher Kosten)
| Klicken Sie hier, um einen Text einzugeben. |
Abschnitt VI Literaturverzeichnis
| 1 Im Formular zitierte Literatur
Führen Sie nachfolgend sämtliche im Formular zitierten Quellen in alphabetischer Reihenfolge des Nachnamens des Erstautors auf Grundlage einer gängigen wissenschaftlichen Formatierung (zum Beispiel Vancouver System) auf. |
| Klicken Sie hier, um das Literaturverzeichnis einzugeben. |
Abschnitt VII Unterschrift
Hiermit erklärt das Krankenhaus,
| Datum | Name des Unterzeichners | Unterschrift* |
| TT.MM.JJJJ | Klicken Sie hier, um einen Text einzugeben. |
* Eine für das Krankenhaus im Umfang der vorstehenden Informationsübermittlung nach § 137h Absatz 1 SGB V vertretungsberechtigte Person oder eine von ihr bevollmächtigte Person muss die Unterschrift leisten. Fehlt es an einer solchen Unterschrift, gilt die Information als nicht eingegangen.
Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse gemäß § 137h SGB V
- Abschnitt III B -
(Weitere medizinproduktbezogene Angaben des Herstellers)
Wird hinsichtlich einer neuen Untersuchungs- oder Behandlungsmethode, deren technische Anwendung maßgeblich auf dem Einsatz eines Medizinprodukts mit hoher Risikoklasse beruht, erstmalig eine Anfrage nach § 6 Absatz 2 Satz 3 des Krankenhausentgeltgesetzes gestellt, ist das anfragende Krankenhaus gemäß § 137h SGB V verpflichtet, dem Gemeinsamen Bundesausschuss (G-BA) zugleich Informationen über den Stand der wissenschaftlichen Erkenntnisse zu dieser Methode sowie zu der Anwendung des Medizinprodukts zu übermitteln. Die Übermittlung der Unterlagen erfolgt im Benehmen mit dem Hersteller derjenigen Medizinprodukte mit hoher Risikoklasse, die in dem Krankenhaus bei der Methode zur Anwendung kommen sollen.
Dieser Abschnitt III B des Formulars zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse gemäß § 137h Absatz 1 SGB V dient der Erfassung der für den G-BA relevanten Angaben und Informationen zur Anwendung des Medizinprodukts, die dem Hersteller des Produkts, nicht jedoch dem anfragenden Krankenhaus bekannt sind.
Die Angaben in diesem Abschnitt sollen vom Hersteller desjenigen Medizinprodukts, das bei der jeweiligen Methode im Krankenhaus zur Anwendung kommen soll, gemacht werden. Sofern dem Krankenhaus vom Hersteller im Rahmen der Benehmensherstellung der ausgefüllte und unterzeichnete Abschnitt III B nebst zugehörigen Anlagen zur Verfügung gestellt wurde, leitet das Krankenhaus die Unterlagen im Rahmen der Informationsübermittlung an den G-BA weiter. Alternativ können Sie die Unterlagen auch unmittelbar an den G-BA (ohne Weitergabe an das Krankenhaus) übersenden. Stellen Sie den Abschnitt III B auch in elektronischer Form zur Verfügung.
Die vollständigen Angaben in diesem Abschnitt sind für den G-BA relevant, um zu prüfen, ob die Voraussetzungen einer Bewertung nach § 137h SGB V erfüllt sind und um vollumfängliche Informationen zur Bewertung nach § 137h SGB V der angefragten Methode vorliegen zu haben. Die Angaben des Abschnitt III B werden auf der Internetseite des G-BA im Rahmen des Verfahrens zur Einholung weiterer Informationen gemäß § 137h Absatz 1 Satz 3 SGB V veröffentlicht, sofern Sie dieser Veröffentlichung unter Nummer 8 zustimmen.
Wie wird mit vertraulichen und hoch vertraulichen Unterlagen umgegangen?
Nehmen Sie bitte keine vertraulichen Informationen in das Formular auf, sofern Sie einer Veröffentlichung durch den G-BA zustimmen.
Ansonsten gilt, dass Unterlagen, die dem G-BA zusammen mit dem ausgefüllten Abschnitt III B zugehen, dem Verwaltungsgeheimnis unterliegen. Das heißt, sie werden grundsätzlich vertraulich behandelt (§ 27 der Geschäftsordnung des G-BA [GO]).
Einem gegenüber dem allgemeinen Grundsatz der Vertraulichkeit verstärkten Schutz unterliegen sogenannte "hoch vertrauliche Informationen", also solche, die von Ihnen gesondert als Betriebs- und Geschäftsgeheimnisse gekennzeichnet wurden. Stellen Sie sicher, dass Betriebs- und Geschäftsgeheimnisse, die in Ihren eingereichten Unterlagen enthalten sind, eindeutig als solche identifiziert werden können. Behalten Sie bei Ihren Angaben stets im Blick, dass entsprechend gekennzeichnete Informationen aufgrund der Anforderungen an die Transparenz und Nachvollziehbarkeit der Entscheidungen des G-BA ebenso wie unveröffentlichte Studien möglicherweise nicht in die Nutzenbewertung nach § 137h Absatz 1 Satz 4 SGB V einbezogen werden können (Näheres dazu finden Sie im 2. Kapitel § 19 VerfO).
Anlagen, die Betriebs- und Geschäftsgeheimnisse beinhalten, können Sie auch unmittelbar an den G-BA (ohne Weitergabe an das Krankenhaus) übermitteln.
Der Umgang mit hoch vertraulichen Informationen ist in der Vertraulichkeitsschutzordnung des G-BA (Anlage II der GO) geregelt. Insbesondere dürfen gemäß § 2 Satz 2 der Vertraulichkeitsschutzordnung hoch vertrauliche Informationen unter besonderen Sicherungsvorkehrungen nur Personen bekannt gegeben oder zugänglich gemacht werden, die hierzu berechtigt sind und die diese aufgrund ihrer Zuständigkeit und Aufgabe kennen müssen.
Daher sind die im Formular eingearbeiteten Angaben so zu machen, dass sie keine Betriebs- und Geschäftsgeheimnisse enthalten.
Abschnitt III B Weitere medizinproduktbezogene Angaben des Herstellers
| 1 Angaben zum Hersteller und zum Medizinprodukt |
| 1.1 Name des Herstellers |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.2 Anschrift |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.3 Name des Medizinprodukts
Fügen Sie den Scan oder die Kopie des aktuellen Nachweises der Erfüllung der Voraussetzungen für das Inverkehrbringen und die Inbetriebnahme gemäß § 6 des Gesetzes über Medizinprodukte (MPG) mit ersichtlicher Gültigkeitsdauer und ausstellender Benannter Stelle bei. Übermitteln Sie außerdem, falls vorhanden, weitere Dokumente, die die Funktionsweise des Medizinprodukts illustrieren. |
| Klicken Sie hier, um einen Text einzugeben. |
| 2 Ansprechpartner |
| 2.1 Name |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.2 Anschrift |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.3 E-Mail |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.4 Telefon- und Telefaxnummer |
| Klicken Sie hier, um einen Text einzugeben. |
| 3 Liste aller nach § 3 MPSV gemeldeten und dem Hersteller bekannten Vorkommnisse und schwerwiegenden unerwünschten Ereignisse Nachstehend sind durch den Hersteller die Vorkommnisse und schwerwiegenden unerwünschten Ereignisse sowie ggf. die Maßnahmen, die im Zusammenhang mit einem Vorkommnis oder einem schwerwiegenden unerwünschten Ereignis (gemäß der Begriffsbestimmungen entsprechend § 2 MPSV) eingeleitet wurden sowie präventiv ergriffene Maßnahmen zum unter Nummer 1 genannten Medizinprodukt aufzulisten. Hierbei sind auch Veröffentlichungen auf der Internetseite des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) zu berücksichtigen. | |
| Vorkommnis (inklusive Bewertung [z.B. Anwender- oder Produktionsfehler]) / unerwünschtes Ereignis, Grund für präventive Maßnahme | Art der Maßnahme entsprechend der MEDDEV 2.12-1 rev 6 (einschließlich Einordnung korrektiv/präventiv) |
| Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
| 4 Zulassungsstatus international
Herstellerseitige Darstellung des internationalen Zulassungsstatus inklusive der zugelassenen Zweckbestimmung/Anwendungsgebiete mit Nachweis (ggf. unter Angabe der Ablehnungsgründe bei Versagen oder Entziehung der Zulassung). |
| Klicken Sie hier, um einen Text einzugeben. |
| 5 Angaben zur klinischen Bewertung
Fügen Sie die klinischen Daten nach § 3 Nummer 25 MPG (klinische Prüfungen inklusive Updates zur klinischen Nachbeobachtung, sonstige Studien, sonstige veröffentlichte oder unveröffentlichte Berichte) im Volltext bei. |
| 5.1 Herstellerseitige Beschreibung der klinischen Daten, die die Eignung des Medizinprodukts für den vorgesehenen Verwendungszweck zeigen (insbesondere Darstellung, ob die klinischen Daten aus einer klinischen Prüfung oder aus sonstigen in der wissenschaftlichen Fachliteratur wiedergegebenen Studien über ein ähnliches Produkt [ Literaturbewertung] entsprechend § 3 Nummer 25 MPG stammen) |
| Klicken Sie hier, um einen Text einzugeben. |
| 5.2 Herstellerseitige Beschreibung des Nutzen-/Risiko-Verhältnisses nach § 19 MPG |
| Klicken Sie hier, um einen Text einzugeben. |
| 6 Studien des Medizinprodukteherstellers
Nachfolgend sind alle Studien zum unter 1 genannten Medizinprodukt zu benennen und zu beschreiben (im Hinblick auf die Studienpopulation, Intervention(en), Studientyp und wesentliche Endpunkte), für die der Hersteller Sponsor ist oder war oder an denen er auf andere Weise finanziell beteiligt ist oder war und die ganz oder teilweise im durch die Anfrage erfassten Indikationsbereich durchgeführt wurden oder werden. Fügen Sie für jede Studie eine neue Zeile ein. Falls Ergebnisse dieser Studien vorliegen, übermitteln Sie diese. Falls keine Studien existieren, auf die diese Kriterien zutreffen, tragen Sie in der ersten Zeile "keine" ein. | |
| Studienbezeichnung und Studienbeschreibung | Sponsor(ja / nein) |
| Klicken Sie hier, um die Studienbezeichnung einzugeben. | |
| 7 Anlagen
Führen Sie nachfolgend die Anlagen auf, die Sie für eine Weiterleitung an den G-BA zur Verfügung stellen. |
| Klicken Sie hier, um einen Text einzugeben. |
| 8 Angabe zur Veröffentlichung der Angaben des Abschnitts III B |
| [ ] Der Hersteller ist mit der Veröffentlichung seiner Einträge in Abschnitt III B im Rahmen des Verfahrens zur Einholung weiterer Informationen gemäß § 137h Absatz 1 Satz 3 SGB V durch den G-BA einverstanden. Von der Veröffentlichung ausgenommen sind die mit dem Abschnitt III B übermittelten Anlagen |
| [ ] Der Hersteller ist mit der Veröffentlichung seiner Einträge in Abschnitt III B im Rahmen des Verfahrens zur Einholung weiterer Informationen gemäß § 137h Absatz 1 Satz 3 SGB V durch den G-BA nicht einverstanden. |
| Klicken Sie hier, um einen Text einzugeben. |
| 9 Unterschrift
Hiermit erklärt der unter Nummer 1 genannte Medizinproduktehersteller, - dass die Inhalte des Abschnitts III B vollständig und richtig sind,
| ||
| Datum | Name des Unterzeichners | Name des Unterzeichners |
| TT.MM.JJJJ | Klicken Sie hier, um einen
Text einzugeben. | |
Anlage VI zum 2. Kapitel
Formular zur Anforderung einer Beratung gemäß § 137h Absatz 6 SGB V
Formular zur Anforderung einer Beratung gemäß § 137h Absatz 6 SGB V
< < Krankenhaus / Medizinproduktehersteller > >
Stand: < < TT.MM.JJJJ > >
Abschnitt Allgemeine Hinweise
Allgemeine Hinweise zur Beratungsanforderung gemäß § 137h Absatz 6 SGB V
Der Gemeinsame Bundesausschuss (G-BA) berät Krankenhäuser und Hersteller von Medizinprodukten im Vorfeld des Verfahrens zur Bewertung neuer Untersuchungs- und Behandlungsmethoden mit Medizinprodukten hoher Risikoklasse gemäß § 137h SGB V über dessen Voraussetzungen und Anforderungen im Hinblick auf konkrete Methoden. Bitte beachten Sie, dass die hier mögliche Beratung sich ausschließlich auf Voraussetzungen und Anforderungen im Hinblick auf konkrete Methoden im Kontext der Bewertung neuer Untersuchungs- und Behandlungsmethoden mit Medizinprodukten hoher Risikoklasse bezieht. Für Beratungen zu den Voraussetzungen der Erbringung einer Untersuchungs- oder Behandlungsmethode zulasten der Krankenkassen ist eine kostenpflichtige Beratung gemäß § 137e Absatz 8 SGB V erforderlich.
Das hier dargestellte Verfahren sowie seine Voraussetzungen und Anforderung sind im 2. Kapitel §§ 29 - 38 der Verfahrensordnung des G-BA (VerfO) geregelt.
Dieses Formular dient der Erfassung der Angaben, die zur Anforderung einer Beratung gemäß § 137h Absatz 6 SGB V G-BA erforderlich sind. Bitte verwenden Sie zur Anforderung einer Beratung nur ebendieses Formular wie im 2. Kapitel § 38 Absatz 1 VerfO vorgegeben.
Ausfüllhinweise zum Formular
Es ist möglich, dass Krankenhäuser oder Medizinproduktehersteller Dritte zur Anforderung einer Beratung bevollmächtigen. In diesem Fall ist es erforderlich, die entsprechende Vollmacht dem Formular beizulegen.
Das Formular gliedert sich in folgende Abschnitte:
I Administrative Angaben
II Angaben zur Methode und den Voraussetzungen einer Bewertung nach § 137h SGB V
III A Weitere medizinproduktbezogene Angaben (dem Krankenhaus bekannte)
III B Weitere medizinproduktbezogene Angaben des Herstellers
IV weitere Fragen im Rahmen der Beratung
V Anlagen
VI Unterschrift
Gemäß 2. Kapitel § 38 Absatz 2 VerfO kann der G-BA im Rahmen der Beratung prüfen, ob eine Methode dem Bewertungsverfahren unterfällt und hierzu eine Feststellung in Form eines Beschlusses treffen (Prüfung der Einschlägigkeit des Bewertungsverfahrens). Für diesen Beschluss prüft der G-BA, ob
Wenn Sie eine Beratung zu dieser Frage erbitten, müssen Sie dem G-BA gemeinsam mit Ihrer Beratungsanforderung auch die relevanten Angaben zur Prüfung der Voraussetzungen für eine Bewertung nach § 137h SGB V übermitteln. Füllen Sie dafür
Die Inhalte der Abschnitte II, III A und III B dieses Formulars entsprechen in vielen Punkten den Inhalten des "Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse", die zur Prüfung der Einschlägigkeit des Bewertungsverfahrens nach § 137h SGB V relevant sind. Bei den grau hinterlegten Feldern handelt es sich um Pflichtfelder. Sofern ein sinnvoller Eintrag in ein Pflichtfeld nicht möglich ist, tragen Sie dort bitte eine kurze Begründung ein. Die blau hinterlegten Felder sind für optionale Eingaben vorgesehen. Wenn Sie dort keine Angaben machen möchten, können Sie das Feld einfach leer lassen.
Sofern Sie keine Antwort zu der Frage der Einschlägigkeit des Bewertungsverfahrens wünschen, machen Sie Ihre Angaben im Formular in dem Umfang, der zur Beantwortung Ihrer Fragen erforderlich ist. Diese weiteren Fragen können Sie in Abschnitt IV angeben. Übermitteln Sie auch die Anlagen, die zur Beantwortung dieser weiteren Fragen notwendig sind.
Wie wird mit vertraulichen und hoch vertraulichen Unterlagen umgegangen?
Nehmen Sie bitte keine vertraulichen Informationen in das Formular auf, da es in seinen wesentlichen Inhalten durch den G-BA veröffentlicht wird (Erläuterungen dazu siehe unten).
Alle weiteren Unterlagen, die dem G-BA im Rahmen dieser Informationsübermittlung zugehen, unterliegen dem Verwaltungsgeheimnis. Das heißt, sie werden grundsätzlich vertraulich behandelt (§ 27 der Geschäftsordnung des G-BA [GO]).
Einem gegenüber dem allgemeinen Grundsatz der Vertraulichkeit verstärkten Schutz derselben unterliegen sogenannte "hoch vertrauliche Informationen", also solche, die von Ihnen oder dem betroffenen Medizinproduktehersteller gesondert als Betriebs- und Geschäftsgeheimnisse gekennzeichnet wurden.
Der Umgang mit hoch vertraulichen Informationen ist in der Vertraulichkeitsschutzordnung des G-BA (Anlage II der GO) geregelt. Insbesondere dürfen gemäß § 2 Satz 2 der Vertraulichkeitsschutzordnung hoch vertrauliche Informationen unter besonderen Sicherungsvorkehrungen nur Personen bekannt gegeben oder zugänglich gemacht werden, die hierzu berechtigt sind und die diese aufgrund ihrer Zuständigkeit und Aufgabe kennen müssen. Daher sind die im Formular eingearbeiteten Angaben so zu machen, dass sie keine Betriebs- und Geschäftsgeheimnisse enthalten.
Um die Kennzeichnung und Einordnung von hoch vertraulichen Informationen sicherzustellen, legen Sie die entsprechenden Unterlagen unbedingt in einem gesondert gekennzeichneten Unterordner auf der DVD ab. Zusätzlich ist es erforderlich, dass Sie die Dokumente auch im Dateinamen durch den Zusatz "BuG" und auf dem Deckblatt des Dokuments selbst durch den Zusatz "Dokument enthält Betriebs- und Geschäftsgeheimnisse" kennzeichnen. Behalten Sie bei Ihren Angaben stets im Blick, dass entsprechend gekennzeichnete Informationen aufgrund der Anforderungen an die Transparenz und Nachvollziehbarkeit der Entscheidungen des G-BA ebenso wie unveröffentlichte Studien möglicherweise nicht in die Bewertung nach § 137h Absatz 1 Satz 4 SGB V einbezogen werden können (Näheres dazu finden Sie im 2. Kapitel § 19 VerfO).
Zusammenstellung und Einreichung der Unterlagen
Die Einreichung der Unterlagen ist - mit Ausnahme des Abschnitts zur Unterschrift - ausschließlich in elektronischer Form zulässig. Als Datenträger ist hierzu eine Digital Versatile Disc (DVD) zu verwenden, die nicht kopiergeschützt sein darf. Für alle einzureichenden Dokumente gilt, dass diese nicht geschützt sein dürfen, d. h., sie müssen ohne Kennworteingabe lesbar, speicherbar und druckbar sein.
Stellen Sie bei der Benennung der Dokumente auf der DVD sicher, dass eine eindeutige Zuordnung zu den im Formular genannten Quellen möglich ist.
Für die Unterschrift drucken Sie das Formular zusätzlich zur Ablage auf der DVD aus und übermitteln Sie das ausgedruckte und unterschriebene Formular gemeinsam mit der DVD. Alternativ können Sie die Unterschrift im Formular in elektronischer Form auf der DVD unter Verwendung einer qualifizierten elektronischen Signatur nach dem Gesetz über Rahmenbedingungen für elektronische Signaturen (Signaturgesetz - SigG) in der jeweils gültigen Fassung übermitteln.
Veröffentlichung des Formulars
Sofern der G-BA zu der Frage der Einschlägigkeit des Bewertungsverfahrens einen Beschluss fasst, gibt er zuvor im Wege einer öffentlichen Bekanntmachung im Internet weiteren betroffenen Krankenhäusern sowie den jeweils betroffenen Medizinprodukteherstellern Gelegenheit zur Stellungnahme. Hierfür wird der Abschnitt II des Formulars veröffentlicht.
Abschnitt I Administrative Angaben
| 1 Beratungsinteressent | |
| Krankenhaus | Medizinproduktehersteller |
| Name | |
| Klicken Sie hier, um einen Text einzugeben. | |
| Anschrift | |
| Klicken Sie hier, um einen Text einzugeben. | |
| Ggf. Bevollmächtigter* | |
| Name | |
| Klicken Sie hier, um einen Text einzugeben. | |
| Anschrift | |
| Klicken Sie hier, um einen Text einzugeben. | |
* Vollmacht des Beratungsinteressenten erforderlich
| 2 Ansprechpartner |
| Name |
| Klicken Sie hier, um einen Text einzugeben. |
| Anschrift |
| Klicken Sie hier, um einen Text einzugeben. |
| Klicken Sie hier, um einen Text einzugeben. |
| Telefon- und Telefaxnummer |
| Klicken Sie hier, um einen Text einzugeben. |
3 Beschlussfassung zur Einschlägigkeit des Bewertungsverfahrens nach § 137h SGB V
Geben Sie nachstehend an, ob im Rahmen Ihrer Beratung gemäß 2. Kapitel § 38 Absatz 2 VerfO eine Antwort zur Frage erbeten wird, ob die gegenständliche Methode dem Bewertungsverfahren nach § 137h SGB V unterfällt.
[ ] Der Beratungsinteressent wünscht eine Antwort zu der Frage, ob die gegenständliche Methode dem Bewertungsverfahren nach § 137h SGB V unterfällt. Da diese Frage einheitlich durch Beschluss zu entscheiden ist (vgl. 2. Kapitel § 38 Absatz 2 Satz 3 VerfO), ist eine Beschränkung auf Teilaspekte dieser Fragestellung unzulässig.
[ ] Der Beratungsinteressent wünscht keine Antwort zu der Frage, ob die gegenständliche Methode dem Bewertungsverfahren nach § 137h SGB V unterfällt.
Falls Sie eine Antwort zur Frage der Einschlägigkeit des Bewertungsverfahren nach § 137h SGB V wünschen, füllen Sie
Abschnitt II Angaben zur Methode und den Voraussetzungen einer Bewertung nach § 137h SGB V
Belegen Sie Ihre Angaben in diesem Abschnitt anhand von Quellen und übermitteln Sie die zugehörigen Volltexte als Anlagen zum Formular.
| 1 Allgemeine Informationen zum medizinischen Hintergrund
Fassen Sie hier die Informationen zum medizinischen Hintergrund der gegenständlichen Methode prägnant zusammen. Ersatzweise können die Angaben unter Nummer 1.1 bis 1.3 auch durch einen Verweis auf aussagekräftige Quellen, wie beispielsweise Übersichtsarbeiten oder Leitlinien erfolgen. Wie bei allen Quellen wären dann auch hier die entsprechenden Volltexte beizufügen. |
| 1.1 Angaben zur Krankheit allgemein (insbesondere Angaben zu Ätiologie, Symptomatik, Spontanverlauf und Klassifikation[en]) |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.2 Angabe der Prävalenz der Erkrankung pro 10.000 Personen der bundesdeutschen
Bevölkerung |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.3 Benennung und Kurzbeschreibung der derzeit zur Therapie bzw. Diagnostik zur
Verfügung stehenden Optionen wie die Patientinnen und Patienten bislang im Rahmen der gesetzlichen Krankenversicherung versorgt werden Bitte beachten Sie, dass eine ausführliche Darstellung der etablierten therapeutischen oder diagnostischen Verfahren im Hinblick auf die konkret angefragte Methode unter Nummer 4.1a) erfolgt. |
| Klicken Sie hier, um einen Text einzugeben. |
| 2 Angaben zur angefragten Methode |
| 2.1 Bezeichnung der Methode |
| Klicken Sie hier, um einen Text einzugeben. |
| Beschreiben Sie hier möglichst konkret die Methode, auf die sich die Beratung gemäß § 137h Absatz 6 SGB V bezieht.
Erläutern Sie dazu den theoretischwissenschaftlichen Begründungsansatz der angefragten Methode.
Bitte beachten Sie: eine Methode im Sinne des § 137h SGB V wird durch zwei Komponenten definiert:
a) das Wirkprinzip und b) das Anwendungsgebiet |
| 2.2 Beschreibung des Wirkprinzips
Beschreiben Sie hierbei insbesondere die einzelnen Prozessschritte, die im Rahmen der Methode bei der Patientin oder dem Patienten angewendet werden und beschreiben Sie, nach welcher Rationale das durch die Anwendung angestrebte diagnostische oder therapeutische Ziel erreicht werden soll. Mit welcher OPS wird die Methode verschlüsselt? |
| Klicken Sie hier, um einen Text einzugeben. |
| 2.3 Beschreibung des Anwendungsgebiets
Beschreiben Sie die Patientengruppe, bei der das unter Nummer 2.1 beschriebene Wirkprinzip angewendet werden soll. Benennen Sie die Krankheit sowie gegebenenfalls Krankheitsstadium, Alter, Geschlecht oder Kontraindikationen. |
| Klicken Sie hier, um einen Text einzugeben. |
| 3 Maßgebliches Medizinprodukt mit hoher Risikoklasse
Machen Sie hier Angaben zum Medizinprodukt, das bei der gegenständlichen Methode zur Anwendung kommen soll. Bei mehreren Medizinprodukten können Sie dieses Feld Nummer 3 vervielfältigen. |
| 3.1 Name des Medizinprodukts |
| Klicken Sie hier, um einen Text einzugeben. |
| 3.2 Name des Herstellers |
| Klicken Sie hier, um einen Text einzugeben. |
| 3.3 Beschreibung des Medizinprodukts und seine Einbindung in die gegenständliche
Methode Erläutern Sie hierbei insbesondere den Stellenwert des Medizinprodukts im Rahmen des unter Nummer 2.2 beschriebenen Wirkprinzips unter Berücksichtigung der Frage, ob die technische Anwendung der angefragten Methode maßgeblich auf dem Medizinprodukt beruht. |
| Klicken Sie hier, um einen Text einzugeben.
Hinweis: Die technische Anwendung einer Methode beruht maßgeblich auf einem Medizinprodukt, wenn ohne dessen Einbeziehung (technische Anwendung) die Methode bei der jeweiligen Indikation ihr, sie von anderen Vorgehensweisen unterscheidendes, theoretischwissenschaftliches Konzept verlieren würde. |
| 3.4 Angaben zum Kriterium "Medizinprodukt mit hoher Risikoklasse" |
| a) Einordnung des Medizinprodukts |
| [ ] aktives implantierbares Medizinprodukt gemäß Richtlinie 90/385/EWG |
| [ ] Medizinprodukt der Klasse III gemäß Anhang IX der Richtlinie 93/42/EWG |
| [ ] Medizinprodukt der Klasse IIb gemäß Anhang IX der Richtlinie 93/42/EWG |
| b) für Medizinprodukte der Klasse III
Geben Sie an, ob mit dem Einsatz des Medizinprodukts in Funktionen von Organen oder Organsystemen eingegriffen wird. Falls ja, beschreiben Sie, in welche Funktionen eingegriffen wird und zu welchem Ausmaß die Funktionen beeinflusst werden (bspw. Angabe von Dauer, Intensität oder Frequenz der Beeinflussung). Diese Angaben sind für den G-BA relevant um zu prüfen, ob die Anwendung des Medizinprodukts einen besonders invasiven Charakter gemäß 2. Kapitel § 30 Absatz 3 VerfO aufweist. Ein besonders invasiver Charakter liegt demnach vor, wenn mit dem Einsatz des Medizinproduktes ein erheblicher Eingriff in wesentliche Funktionen von Organen oder Organsystemen, insbesondere des Herzens, des zentralen Kreislaufsystems oder des zentralen Nervensystems einhergeht. Erheblich ist ein Eingriff, der die Leistung oder die wesentliche Funktion eines Organs oder eines Organsystems langzeitig verändert oder ersetzt oder den Einsatz des Medizinprodukts in direktem Kontakt mit dem Herzen, dem zentralen Kreislaufsystem oder dem zentralen Nervensystem zur Folge hat. Für die Bestimmung, ob der Eingriff die Leistung oder die wesentliche Funktion eines Organs oder eines Organsystems verändert oder ersetzt, sind nach 2. Kapitel § 30 Absatz 3a Satz 2 VerfO auch seine beabsichtigten und möglichen Auswirkungen auf die gesundheitliche Situation des Patienten zu betrachten. |
| Klicken Sie hier, um einen Text einzugeben. |
| c) für Medizinprodukte der Klasse IIb
Erläutern Sie, ob das Medizinprodukt mittels Aussendung von Energie oder Abgabe radioaktiver Stoffe gezielt in Funktionen von Organen oder Organsystemen eingreift. Falls ja, beschreiben Sie, in welche Funktionen eingegriffen wird und zu welchem Ausmaß die Funktionen beeinflusst werden (bspw. Angabe von Dauer, Intensität oder Frequenz der Beeinflussung). Diese Angaben sind für den G-BA relevant um zu prüfen, ob die Anwendung des Medizinprodukts einen besonders invasiven Charakter gemäß 2. Kapitel § 30 Absatz 4 VerfO aufweist. Ein besonders invasiver Charakter liegt demnach vor, wenn das Medizinprodukt mittels Aussendung von Energie oder Abgabe radioaktiver Stoffe gezielt auf wesentliche Funktionen von Organen oder Organsystemen, insbesondere des Herzens, des zentralen Kreislaufsystems oder des zentralen Nervensystems einwirkt. Für die Bestimmung, ob der Eingriff die Leistung oder die wesentliche Funktion eines Organs oder eines Organsystems verändert oder ersetzt, sind nach 2. Kapitel § 30 Absatz 4a Satz 2 VerfO auch seine beabsichtigten und möglichen Auswirkungen auf die gesundheitliche Situation des Patienten zu betrachten. |
| Klicken Sie hier, um einen Text einzugeben. |
| 4 Angaben für die Prüfung der Neuheit des theoretischwissenschaftlichen Konzepts der angefragten Methode |
| Gemäß 2. Kapitel § 31 Absatz 1 VerfO weist eine angefragte Methode ein neues theoretischwissenschaftliches Konzept auf, wenn sich ihr Wirkprinzip oder ihr Anwendungsgebiet von anderen, in der stationären Versorgung bereits systematisch eingeführten Herangehensweisen (im Folgenden: bereits eingeführte Methoden) wesentlich unterscheidet.
Die Neuheit des theoretischwissenschaftlichen Konzepts der angefragten Methode kann daher sowohl auf einem Unterschied im Wirkprinzip als auch auf einem Unterschied im Anwendungsgebiet beruhen.
Vereinfacht betrachtet bedeutet dabei ein "Unterschied im Wirkprinzip", dass im Rahmen der angefragten Methode bei der gleichen Patientengruppe nunmehr ein gegenüber dem bei den bereits eingeführten Methoden eingesetzten medizinischen Verfahren neues oder wesentlich weiterentwickeltes Verfahren (unter Einsatz des unter Nummer 3 benannten Medizinprodukts mit hoher Risikoklasse) angewendet werden soll.
Ein "Unterschied im Anwendungsgebiet" bedeutet, dass mit dem medizinischen Verfahren einer bereits eingeführten Methode (unter Einsatz des unter Nummer 3 benannten Medizinprodukts mit hoher Risikoklasse) nunmehr eine neue, bisher anderweitig behandelte Patientengruppe behandelt werden soll.
Nähere Erläuterungen insbesondere zu den Begrifflichkeiten "bereits eingeführte systematische Herangehensweisen", "Wirkprinzip" und "Anwendungsgebiet" finden Sie im 2. Kapitel § 31 VerfO.
Aufgrund Ihrer nachfolgenden Angaben prüft der G-BA, ob die gegenständliche Methode ein neues theoretischwissenschaftliches Konzept aufweist. In diesem Zusammenhang prüft der G-BA beispielsweise auch die Übertragbarkeit der vorhandenen Erkenntnisse auf den Anwendungskontext der angefragten Methode. |
| 4.1 Angabe zu den bereits eingeführten Verfahren im Anwendungsgebiet der angefragten Methode
a) Benennen und beschreiben Sie in einem ersten Schritt, welche medizinischen Verfahren in der Versorgung der unter Nummer 2.3 genannten Patientengruppe bereits angewendet werden. Geben Sie an, welche Informationen für die Anwendung der Verfahren vorliegen: Gibt es Informationen aus Leitlinien oder systematischen Übersichtsarbeiten? Sind für diese medizinischen Verfahren spezifische OPS-Kodes vorhanden? |
| Klicken Sie hier, um einen Text einzugeben. |
| b) Stellen Sie in einem zweiten Schritt dar, ob und wie sich die angefragte Methode von den unter a) beschriebenen Verfahren in ihrem Wirkprinzip unterscheidet. Hierbei können mitunter der theoretischwissenschaftliche Begründungsansatz der angefragten Methode, eine veränderte Form der Einwirkung auf die Patientin oder den Patienten oder andere Eigenschaften und Funktionsweisen des unter Nummer 3 beschriebenen Medizinprodukts relevant sein. |
| Klicken Sie hier, um einen Text einzugeben. |
| 4.2 Angabe zu Anwendungsgebieten, in denen das Wirkprinzip der angefragten Methode bereits angewendet wird
a) Benennen und beschreiben Sie in einem ersten Schritt, ob und falls ja bei welchen Patientengruppen das unter Nummer 2.2 genannte medizinische Verfahren der angefragten Methode bereits angewendet wird. Stellen Sie zudem den theoretischwissenschaftlichen Begründungsansatz des medizinischen Verfahrens bei der hier genannten Patientengruppe (bisheriges Anwendungsgebiet) dar. Benennen Sie die wesentliche Datengrundlage für die Anwendung des medizinischen Verfahrens der angefragten Methode bei den hier benannten Patientengruppen. Berücksichtigen Sie dabei insbesondere Informationen aus Leitlinien oder systematischen Übersichtsarbeiten. |
| Klicken Sie hier, um einen Text einzugeben. |
| b) Stellen Sie in einem zweiten Schritt dar, worin der Unterschied zwischen der unter 2.3 beschriebenen Patientengruppe und den unter a) beschriebenen Patientengruppen (beispielsweise im Hinblick auf Krankheit, Krankheitsstadium, Alter, Geschlecht, erwartete oder bezweckte Auswirkung des angewendeten medizinischen Verfahrens) besteht. Falls Sie unter a) keine Patientengruppe benannt haben, kann ein Eintrag hier entfallen. |
| Klicken Sie hier, um einen Text einzugeben. |
Abschnitt III A
Weitere medizinproduktbezogene Angaben (dem Krankenhaus bekannt)
Soweit der Beratungsinteressent ein Krankenhaus ist, machen Sie in diesem Abschnitt III A weitere, dem Krankenhaus bekannte Angaben zum unter Abschnitt II Nummer 3 benannten Medizinprodukt. Sofern im Abschnitt II Nummer 3 mehrere Medizinprodukte benannt wurden, vervielfältigen Sie den Abschnitt III A und füllen Sie ihn je Medizinprodukt aus.
Soweit der Beratungsinteressent ein Medizinproduktehersteller ist, füllen Sie den Abschnitt III B aus. Der Abschnitt III A ist in diesem Fall nicht auszufüllen.
| 1 Allgemeine Angaben
Fügen Sie die technische Gebrauchsanweisung des Medizinprodukts bei und übermitteln Sie, falls verfügbar, weitere Dokumente, die die Funktionsweise des Medizinprodukts illustrieren. |
| 1.1 Name des Medizinprodukts |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.2 Zweckbestimmung |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.3 Sind Ihnen weitere Medizinprodukte bekannt, die gleichartig zum unter 1.1 genannten
Produkt sind und die im Rahmen der angefragten Methode zur Anwendung kommen können? Benennen Sie diese bitte (optionale Angabe). |
| Klicken Sie hier, um einen Text einzugeben. |
| 2 Erfahrungen bei der Anwendung des Medizinprodukts
Beschreiben Sie nachstehend, welche Erfahrungen Sie in der bisherigen Anwendung des unter Nummer 2.1 genannten Medizinprodukts gesammelt haben: Welche Aspekte müssen bei der Handhabung beachtet werden? Haben sich bei der Anwendung besondere Vorteile oder Probleme ergeben? Gibt es bei der Anwendung des Produkts aus Ihrer Sicht spezifische Risiken für Patientinnen und Patienten? |
| Klicken Sie hier, um einen Text einzugeben. |
| 3 Angabe zu Vorkommnissen und schwerwiegenden unerwünschten Ereignissen
Sind Ihnen anhand von Mitteilungen des Herstellers oder des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) Vorkommnisse oder schwerwiegende unerwünschte Ereignisse in Zusammenhang mit dem unter 2 genannten Medizinprodukt bekannt? Wenn ja, welche? (optionale Angabe) |
| Klicken Sie hier, um einen Text einzugeben. |
Abschnitt III B
Weitere medizinproduktbezogene Angaben des Herstellers
Soweit der Beratungsinteressent ein Hersteller ist, machen Sie in diesem Abschnitt III B weitere Angaben zum unter Abschnitt II Nummer 3 benannten Medizinprodukt.
Soweit der Beratungsinteressent ein Krankenhaus ist, müssen Sie diesen Abschnitt nicht ausfüllen.
| 1 Allgemeine Angaben zum Medizinprodukt
Fügen Sie den Scan oder die Kopie des aktuellen Nachweises der Erfüllung der Voraussetzungen für das Inverkehrbringen und die Inbetriebnahme gemäß § 6 des Gesetzes über Medizinprodukte (MPG) mit ersichtlicher Gültigkeitsdauer und ausstellender Benannter Stelle bei. Übermitteln Sie außerdem, falls vorhanden, weitere Dokumente, die die Funktionsweise des Medizinprodukts illustrieren. |
| 1.1 Name des Medizinprodukts |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.2 Zweckbestimmung |
| Klicken Sie hier, um einen Text einzugeben. |
| 1.3 Sind Ihnen weitere Medizinprodukte bekannt, die gleichartig zum unter 1.1 genannten
Produkt sind und die im Rahmen der angefragten Methode zur Anwendung kommen können? Benennen Sie diese bitte (optionale Angabe). |
| Klicken Sie hier, um einen Text einzugeben. |
| 2 Liste aller nach § 3 MPSV gemeldeten und dem Hersteller bekannten Vorkommnisse und schwerwiegenden unerwünschten Ereignisse
Nachstehend sind durch den Hersteller die Vorkommnisse und schwerwiegenden unerwünschten Ereignisse sowie ggf. die Maßnahmen, die im Zusammenhang mit einem Vorkommnis oder einem schwerwiegenden unerwünschten Ereignis (gemäß der Begriffsbestimmungen entsprechend § 2 MPSV) eingeleitet wurden sowie präventiv ergriffene Maßnahmen zum unter Nummer 1 genannten Medizinprodukt aufzulisten. Hierbei sind auch Veröffentlichungen auf der Internetseite des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) zu berücksichtigen. (optionale Angabe) | |
| Vorkommnis (inklusive Bewertung [z.B. Anwender- oder Produktionsfehler]) / unerwünschtes Ereignis, Grund für präventive Maßnahme | Art der Maßnahme entsprechend der MEDDEV 2.12-1 rev 6 (einschließlich Einordnung korrektiv/präventiv) |
| Klicken Sie hier, um einen Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
| 3 Angaben zur klinischen Bewertung
Fügen Sie die klinischen Daten nach § 3 Nummer 25 MPG (klinische Prüfungen inklusive Updates zur klinischen Nachbeobachtung, sonstige Studien, sonstige veröffentlichte oder unveröffentlichte Berichte) im Volltext bei. |
| 3.1 Herstellerseitige Beschreibung der klinischen Daten, die die Eignung des Medizinprodukts für den vorgesehenen Verwendungszweck zeigen (insbesondere Darstellung, ob die klinischen Daten aus einer klinischen Prüfung oder aus sonstigen in der wissenschaftlichen Fachliteratur wiedergegebenen Studien über ein ähnliches Produkt [ Literaturbewertung] entsprechend § 3 Nummer 25 MPG stammen) |
| Klicken Sie hier, um einen Text einzugeben. |
| 3.2 Herstellerseitige Beschreibung des Nutzen-/Risiko-Verhältnisses nach § 19 MPG |
| Klicken Sie hier, um einen Text einzugeben. |
| 4 Studien des Medizinprodukteherstellers
Nachfolgend sind alle Studien zum unter 1 genannten Medizinprodukt zu benennen und zu beschreiben (im Hinblick auf die Studienpopulation, Intervention(en), Studientyp und wesentliche Endpunkte), für die der Hersteller Sponsor ist oder war oder an denen er auf andere Weise finanziell beteiligt ist oder war und die ganz oder teilweise im durch die Anfrage erfassten Indikationsbereich durchgeführt wurden oder werden. Fügen Sie für jede Studie eine neue Zeile ein. Falls Ergebnisse dieser Studien vorliegen, übermitteln Sie diese. Falls keine Studien existieren, auf die diese Kriterien zutreffen, tragen Sie in der ersten Zeile "keine" ein. | |
| Studienbezeichnung und Studienbeschreibung | Sponsor(ja / nein) |
| Klicken Sie hier, um die Studienbezeichnung einzugeben. | |
Abschnitt IV
Weitere Fragen im Rahmen der Beratung
| 1 Weitere Angaben zur Untersuchungs- oder Behandlungsmethode
Machen Sie nachstehend weitere Angaben zur gegenständlichen Methode, die zur Beantwortung Ihrer unter Nummer 2 genannten Fragen relevant sind. Angaben aus den vorherigen Abschnitten müssen Sie hier nicht wiederholen. Bitte übermitteln Sie auch die relevanten Anlagen, die zur Beantwortung Ihrer unter Nummer 2 genannten Fragen erforderlich sind. |
| Klicken Sie hier, um einen Text einzugeben. |
| 2 Fragen, die in der Beratung gemäß § 137h Absatz 6 SGB V erörtert werden sollen | ||
| Frage | Ggf. Position des Beratungsinteressenten mit Begründung | |
| 1 | Klicken Sie hier, um einen
Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
| 2 | Klicken Sie hier, um einen
Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
| 3 | Klicken Sie hier, um einen
Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
| 4 | Klicken Sie hier, um einen
Text einzugeben. | Klicken Sie hier, um einen Text einzugeben. |
(Bitte fügen Sie weitere Felder ein, sofern benötigt).
Abschnitt V
Anlagen
| 1. Anlagen
Geben Sie nachstehend die Anlagen an, die Sie dem G-BA im Rahmen der Beratung gemäß § 137h Absatz 6 SGB V übermitteln. Sofern Sie eine Antwort zur Frage der Einschlägigkeit des Bewertungsverfahren nach § 137h SGB V wünschen, fügen Sie in jedem Fall folgende Anlagen bei: - Volltexte zu den Quellen, auf die Sie sich in Ihren Angaben zu Abschnitt II beziehen - die erforderlichen Anlagen gemäß Abschnitt III A (für Krankenhäuser) oder III B (für Medizinproduktehersteller) Übermitteln Sie weitere Anlagen, beispielsweise solche, auf die Sie sich in Ihren Angaben unter Nummer 4 beziehen, sofern sie relevant für die Beantwortung Ihrer unter Nummer 5 angegebenen Fragen sind. |
| Klicken Sie hier, um einen Text einzugeben. |
Abschnitt VI
Unterschrift
| 2. Unterschrift
Hiermit erklärt der Beratungsinteressent, - dass die übermittelten Informationen vollständig und richtig sind, - dass die Hinweise zu Beginn des Formulars zur Kenntnis genommen wurden, - dass die übermittelten Angaben keine Betriebs- oder Geschäftsgeheimnisse beinhalten und dass Anlagen, die Betriebs- und Geschäftsgeheimnisse beinhalten, entsprechend der Allgemeinen Hinweise gekennzeichnet und auf der DVD abgespeichert wurden und - dass er der Veröffentlichung der Einträge in Abschnitt II des Formulars anlässlich des Stellungnahmeverfahrens gemäß 2. Kapitel § 38 Absatz 3 VerfO zustimmt und dass der Veröffentlichung keine Rechte Dritter (insbesondere Urheberrechte und Datenschutzrechte) entgegenstehen. | ||
| Datum | Name des Unterzeichners | Unterschrift* |
| TT.MM.JJJJ | Klicken Sie hier, um einen Text einzugeben | |
* Eine für den Beratungsinteressenten im Umfang der vorstehenden Anforderung einer Beratung gemäß § 137h Absatz 6 SGB V vertretungsberechtigte Person oder eine von ihr bevollmächtigte Person muss die Unterschrift leisten.
Berichtigung
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung des Beschlusses vom 17. März 2016 zur Änderung der Verfahrensordnung:
Verfahren für Bewertungen von Methoden mit Medizinprodukten der hohen Risikoklassen aufgrund § 137h SGB V
Vom 7. Juli 2016
(G-BA)
Der Gemeinsame Bundesausschuss (G-BA) hat in seiner Sitzung am 7. Juli 2016 beschlossen, den Beschluss vom 17. März 2016 zur Änderung der Verfahrensordnung des G-BA zu ändern:
Der Beschluss zu I.2. wird wie folgt geändert:
1. § 32 Absatz 2 Satz 2 wird wie folgt gefasst:
"Bei Bewertungen nach § 137h SGB V ergibt sich das fehlende Potenzial insbesondere dann, wenn der Gemeinsame Bundesausschuss auf Grundlage der vorliegenden Evidenz positiv feststellt, dass sie schädlich oder unwirksam ist."
2. § 37 wird wie folgt geändert:
a) In Absatz 3 wird der Satz 2 gestrichen.
b) Nach Absatz 6 wird der folgende Absatz 7 neu angefügt:
"(7) In der Erprobungsrichtlinie hat der Gemeinsame Bundesausschuss verschiedene Formen der Beteiligung an der Erprobung vorzusehen. Während es notwendig sein kann, dass eine erforderliche Anzahl von Krankenhäusern an einer randomisierten, kontrollierten Studie teilnimmt, die den Nutzenbeleg erbringen soll, können - wenn sich bereits genügend Krankenhäuser an der vom Gemeinsamen Bundesausschuss vorgesehenen Studie zum Nutzennachweis im engeren Sinne beteiligen und insoweit weitere Krankenhäuser insbesondere aus methodischen Gründen nicht an dieser Studie teilnehmen können - andere Krankenhäuser im Rahmen derselben Erprobung im Sinne einer Beobachtungsstudie flankierende Daten zu Wirksamkeit und Sicherheit liefern und damit ihrer Verpflichtung zur Teilnahme an der Erprobung nachkommen."
3. Anlage V Abschnitt V wird wie folgt geändert:
a) Nach dem dritten Spiegelstrich wird der folgende vierte Spiegelstrich eingefügt:
"- In der Erprobungsrichtlinie hat der G-BA verschiedene Formen der Beteiligung an der Erprobung vorzusehen. Während es notwendig sein kann, dass eine erforderliche Anzahl von Krankenhäusern an einer randomisierten, kontrollierten Studie teilnimmt, die den Nutzenbeleg erbringen soll, können - wenn sich bereits genügend Krankenhäuser an der vom Gemeinsamen Bundesausschuss vorgesehenen Studie zum Nutzennachweis im engeren Sinne beteiligen und insoweit weitere Krankenhäuser insbesondere aus methodischen Gründen nicht an dieser Studie teilnehmen können - andere Krankenhäuser im Rahmen derselben Erprobung im Sinne einer Beobachtungsstudie flankierende Daten zu Wirksamkeit und Sicherheit liefern und damit ihrer Verpflichtung zur Teilnahme an der Erprobung nachkommen."
b) Nach dem neuen vierten Spiegelstrich wird der folgende Satz eingefügt:
"Unter Punkt A können Sie daher mögliche Eckpunkte einer Studie benennen, die den Nutzenbeleg erbringen soll und unter Punkt B können Sie mögliche Eckpunkte zur Lieferung flankierender Daten zu Wirksamkeit und Sicherheit im Sinne einer Beobachtungsstudie darlegen."
c) Vor dem ersten Textfeld wird folgende Überschrift eingefügt:
"A. Mögliche Eckpunkte einer Studie, die den Nutzenbeleg erbringen soll"
d) Nach dem letzten Textfeld wird folgende Überschrift und ein neues, blau hinterlegtes Textfeld eingefügt:
"B. Mögliche Eckpunkte zur Lieferung flankierender Daten zu Wirksamkeit und Sicherheit im Sinne einer Beobachtungsstudie (einschließlich Schätzung möglicher Kosten)
"
Der Beschluss tritt mit Beschlussfassung in Kraft.
ID 17/0350
| ENDE |