 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. ▢ Regelwerk |  |
Wirkung hochfrequenter Felder auf das Genom:
Genotoxizität und Genregulation
- Stellungnahme der Strahlenschutzkommission -
Vom 3. April 2007
(BAnz. Nr. 135a vom 24.07.2007 S. 1)
Verabschiedet in der 213. Sitzung der Strahlenschutzkommission am 5./6. Dezember 2006
Ausgangslage und Vorgehensweise
Die Möglichkeit einer gesundheitsgefährdenden Wirkung hochfrequenter elektromagnetischer Felder (HF-Felder) wird kontrovers diskutiert. Durch die zunehmende Verbreitung von Technologien, die auf HF-Feldern beruhen, wie dem Mobilfunk, gewinnt diese Frage besondere Bedeutung. Von internationalen Gremien vorgeschlagene Expositionsgrenzwerte und darauf basierende nationale Bestimmungen dienen dem Zweck, wissenschaftlich nachgewiesene gesundheitliche Beeinträchtigungen auszuschließen. Diese Grenzwerte gründen auf wissenschaftlichen Untersuchungen der Wechselwirkungen biologischer Systeme mit HF-Feldern und werden regelmäßig überprüft. Die Strahlenschutzkommission (SSK) hat im Jahre 2001 eine ausführliche Bewertung der in diesem Zusammenhang relevanten wissenschaftlichen Literatur vorgenommen und eine Empfehlung zu "Grenzwerten und Vorsorgemaßnahmen zum Schutz der Bevölkerung vor elektromagnetischen Feldern" veröffentlicht [SSK, 2001]. Gestützt auf die Unterscheidung zwischen "wissenschaftlichem Nachweis 1, "wissenschaftlich begründetem Verdacht 2 und "wissenschaftlichem Hinweis 3 kam die SSK 2001 zu dem Schluss, "dass auch nach Bewertung der neueren wissenschaftlichen Literatur keine neuen wissenschaftlichen Erkenntnisse im Hinblick auf nachgewiesene Gesundheitsbeeinträchtigungen vorliegen, die Zweifel an der wissenschaftlichen Bewertung aufkommen lassen, die den Schutzkonzepten der ICNIRP bzw. der EU-Ratsempfehlung zugrunde liegt".
Seit 2001 ist eine Vielzahl von Publikationen erschienen, die eine neuerliche Bewertung durch die SSK notwendig gemacht hat. In einigen der Arbeiten wird über Beeinflussungen der genetischen Information durch HF-Felder auch unterhalb der geltenden Grenzwerte berichtet. Diese Publikationen haben starkes Medieninteresse gefunden und zur Beunruhigung in der Bevölkerung geführt, In der hier vorliegenden Stellungnahme wird der gegenwärtige Stand der Wissenschaft auf dem angesprochenen Gebiet erneut bewertet. Die Wertungen beruhen weitgehend auf einer kritischen Beurteilung der Literatur in wissenschaftlichen Fachzeitschriften mit Gutachterverfahren ("Peer Reviewed"). In Einzelfällen wurde aus Gründen der Aktualität von diesem Prinzip abgewichen und auch auf andere dokumentierte Quellen eingegangen. Dies betrifft die Forschungsberichte der REFLEX- und der PERFORM B-Studie, die erst teilweise wissenschaftlich publiziert sind.
Die vorliegende Stellungnahme bezieht sich auf die Frage, ob hochfrequente elektromagnetische Felder von Funkanwendungen, wie Rundfunk oder Mobilfunk, bei Feldstärken unterhalb der Grenzwerte Veränderungen im Genom und/oder der Genexpression (Genregulation) induzieren können. Es wurde die vorliegende wissenschaftliche Literatur berücksichtigt, wobei zur Bewertung älterer Arbeiten sowohl auf zusammenfassende wissenschaftliche Arbeiten als auch auf die Empfehlung der SSK aus dem Jahr 2001 zurückgegriffen wurde, in der Arbeiten zur Genotoxizität und Genexpression bis 2000 behandelt worden sind. Die damalige Bewertung lautete: "Es kann zusammenfassend festgestellt werden, dass die Untersuchungen zu krebsrelevanten Proteinen, Krebsentstehung und Krebspromotion ein sehr uneinheitliches Bild liefern. Inwieweit die einzelnen und nicht reproduzierten Hinweise eine Bedeutung für gesundheitliche Beeinflussungen haben, muss durch weitere Forschungen geklärt werden." Neuere Arbeiten zu diesem Fragenkomplex sind in der hier anhängenden wissenschaftlichen Begründung referiert und in den folgenden Themenblöcken zusammengefasst.
Expositionseinrichtungen
Die technische Weiterentwicklung von Expositionseinrichtungen und dosimetrischen Verfahren hat in den letzten Jahren große Fortschritte gemacht. Die verbesserte dosimetrische Versuchsplanung hat im Vergleich zu früheren Experimenten zu besser definierten und homogeneren Expositionen im Präparat geführt. Die derzeit gebräuchlichen Expositionseinrichtungen für Versuche an Zellen sind meist Wellenleiter. Wellenleiter mit stellenden Wellen erlauben die Erzeugung von Feldstärken im Bereich der Grenzwerte mit geringem technischen Aufwand. Die Verbesserungen haben das Artefaktrisiko verringert, sodass die meisten neueren Untersuchungen unter besser kontrollierten und reproduzierbareren Feldverhältnissen ausgeführt wurden.
Genotoxizität
Für die Untersuchung biologischer Effekte auf zellulärer Ebene wird neben den klassischen zytogenetischen Techniken, wie Bestimmungen der Chromosomenaberrationen und von Mikrokernen, zunehmend auch das Verfahren des "Comet-Assays" eingesetzt, das allerdings wesentlich empfindlicher für Artefakte ist. Einige Mutationstests, die in der Toxikologie etabliert sind, werden jedoch zur Testung der Wirkung von HF-Feldern kaum eingesetzt. Generell ist auch bei neueren Arbeiten die fehlende Stringenz bei der Versuchsplanung zu beanstanden, bei keinem Untersuchungsobjekt sind alle in der Toxikologie üblichen (und dort auch vorgeschriebenen) Verfahren eingesetzt worden.
Eine Gesamtbewertung der Arbeiten zur Induktion von DNA-Schäden durch HF-Felder ist wegen der Vielzahl der verwendeten Untersuchungsobjekte und -methoden erschwert. In den meisten Studien wurden keine genotoxischen Effekte gefunden. Die wenigen positiven Befunde sind zum Teil widersprüchlich und fügen sich nicht zu einem systematischen Gesamtbild. Auf Grund dieser unklaren wissenschaftlichen Hinweise kommt unabhängigen Replikationsversuchen eine besondere Bedeutung zu. Diese sind allerdings nur in wenigen Fällen durchgeführt worden. Wo dies geschah, konnten die ursprünglichen positiven Befunde nicht bestätigt werden. Es kann somit festgestellt werden, dass ein wissenschaftlich begründeter Verdacht für eine DNA-Schädigung durch HF-Felder nicht vorliegt.
Eine weitere Klärung und Absicherung ist nur durch sorgfältig geplante Programme möglich, bei denen verschiedene Zellarten und parallel mehrere Versuchsparameter systematisch in mehreren kompetenten Labors untersucht werden. Die bisherige Praxis erfüllt diese Anforderungen in der Regel nicht.
Genregulation
Die Zahl der Untersuchungen zur Genregulation hat in dem Zeitraum nach dem Jahr 2000 deutlich zugenommen. Positive Befunde aus der Literatur vor 2000 zur Aktivierung der Ornithindecarboxylase, einem Marker der Zellvermehrung, wurden kürzlich widerlegt. Zusätzlich wurden in den letzten Jahren Aspekte untersucht, die vorher nicht so sehr im Mittelpunkt des Interesses standen. Hier sind besonders die Nachweise von "Hegt Shock"-Proteinen und des programmierten Zelltods (Apoptose) zu nennen. Bei der Auswertung der vorliegenden Literatur zeigte sich, dass bezüglich einer Induktion von "Heat Shock"-Proteinen die überwiegende Mehrheit der Ergebnisse negativ war. Erste Replikationen der wenigen positiven Befunde haben zu keiner Bestätigung geführt. Auch die Untersuchungen zur Apoptose waren fast ausnahmslos ohne positiven Befund. Die wenigen positiven Ergebnisse waren in sich nicht konsistent. Daher ergibt sich kein wissenschaftlich begründeter Verdacht auf eine Induktion von "Hegt Shock"-Proteinen oder eine Beeinflussung der Apoptose durch HF-Felder.
Bei den Studien zur Genregulation wurden meist die etablierten Standardtechniken benutzt, die nur die Untersuchung einzelner Gene erlauben. Die moderneren Methoden zur Untersuchung der RNA wie Mikroarrays oder zur Untersuchung des Proteoms wurden nur selten verwendet. Die Technik ist noch neu und die Durchführung sowie die statistische Analyse zum Teil mit methodischen Mängeln behaftet, sodass die Ergebnisse noch keine klaren Aussagen zulassen und daher bei der weiteren Bewertung nur eine untergeordnete Rolle spielen. Obwohl in der Anwendung dieser Verfahren ein großes Potenzial liegt, den Einfluss von HF-Feldern auf die Genexpression zu untersuchen, muss darauf hingewiesen werden, dass die Möglichkeit von falsch positiven Ergebnissen hier aufgrund der großen Zahl von Variablen besonders hoch ist und daher zusätzlicher Aufwand zur Bestätigung mit anderen Methoden erforderlich ist.
Zusammenfassung
Aufgrund der Auswertung der wissenschaftlichen Literatur bis Oktober 2006 stellt die SSK fest:
- Auch aus der neueren Literatur ergibt sich kein wissenschaftlich begründeter Verdacht auf eine genotoxische Wirkung von HF-Feldern.
- Auch aus der neueren Literatur ergibt sich kein wissenschaftlich begründeter Verdacht auf einen Einfluss von HF-Feldern auf die Genregulation.
Die Ergebnisse der vorliegenden Studien geben daher insgesamt keinen Anlass, von einer gesundheitsgefährdenden Wirkung hochfrequenter elektromagnetischer Felder auf das Genom auszugehen und die geltenden Grenzwerte in Frage zu stellen.
Literatur
Strahlenschutzkommission: Grenzwerte und Vorsorgemaßnahmen zum Schutz der Bevölkerung vor elektromagnetischen Feldern, Empfehlung der Strahlenschutzkommission mit wissenschaftlicher Begründung, Berichte der SSK, Heft 29, Urban & Fischer, München, Jena 2001
Wissenschaftliche Begründung zur Stellungnahme der Strahlenschutzkommission
1 Fragestellung
1.1 Charakterisierung der Ziele und die zugehörigen Definitionen
Ziel der vorliegenden wissenschaftlichen Begründung ist die Beurteilung der möglichen Interaktion von Hochfrequenz (HF)-Feldern mit dem Genom. Dies könnte indirekt über eine Regulation der Genexpression (Genregulation) oder direkt über strukturelle Veränderungen am Genom (Genotoxizität) erfolgen. Veränderungen der Genregulation führen zu einer Verschiebung der quantitativen Zusammensetzung zellulärer Proteine und damit zu einem veränderten Phänotyp der betroffenen Zellen. Auf diesem Wege könnten HF-Felder Zellen sowohl physiologisch beeinflussen als auch pathologische Prozesse auslösen. Interaktionen von HF-Feldern mit der DNA könnten diese schädigen und somit zu genotoxischen Effekten führen. DNA-Schäden werden von zellulären Reparaturmechanismen weitgehend behoben. Einwirkungen auf Reparaturverläufe können daher die Ausprägung von dauerhaften DNA-Veränderungen begünstigen. Eine weitere Möglichkeit der Beeinflussung des Genoms ist die Störung der Verteilung der Chromosomen bei der Zellteilung (Aneuploidie).
Die hier kurz beschriebenen zellulären Veränderungen können direkt (genotoxische Effekte, mutationsbedingte Veränderungen der Genexpression) oder indirekt (über nicht mutationsbedingte Beeinflussung der Genexpression) zur Kanzerogenese beitragen. Deshalb werden in der vorliegenden Studie sowohl direkte als auch indirekte Wirkungen von HF-Feldern auf das Genom betrachtet.
1.2 Vorgehensweise und Auswahlkriterien
Die vorliegende Stellungnahme der Strahlenschutzkommission baut auf der Empfehlung der SSK aus dem Jahr 2001 auf und aktualisiert sie auf dem Gebiet der Genotoxizität und Genregulation durch die Einbeziehung seither erschienener wissenschaftlicher Arbeiten. In den letzten Jahren haben sechs sehr ausführliche Übersichtsartikel die Literatur zur genotoxischen Wirkung von HF-Feldern zusammengefasst [Heynick et al. 2003; Meltz, 2003; Vijayalaxmi und Obe, 2004; Dasenbrock, 2005; Moulder et al., 2005; Verschaeve, 2005], daher wird hier nur die Literatur ab 2004 einzeln dargestellt.
Im Prinzip wurden nur Publikationen in wissenschaftlichen Zeitschriften mit einem Gutachterverfahren (Peer Review), die bis zum Herbst 2006 erschienen sind, berücksichtigt. Zwei innerhalb des fünften Rahmenforschungsprogramms der Europäischen Union erstellte Forschungsvorhaben, nämlich REFLEX (Risk Evaluation of Potential Environmental Hazards From Low Frequency Electromagnetic Field Exposure) und PERFORM B, die die Fragestellungen dieser Stellungnahme direkt betreffen, wurden aus Gründen der Aktualität mit aufgenommen, obwohl sie noch nicht vollständig in wissenschaftlichen Zeitschriften publiziert worden sind. Die Strahlenschutzkommission hat zusätzlich die Mitglieder des REFLEX-Konsortiums zu einer Tagung nach Bonn vom 20. - 21. September 2005 eingeladen. Die im Verlauf dieser Tagung diskutierten Befunde des REFLEX-Konsortiums sind mit in die Stellungnahme eingeflossen. Während die REFLEX-Studie z. T. neue Fragestellungen bearbeitet hat, war es Ziel von PERFORM B, positive Befunde aus der Literatur, die auf mögliche Gesundheitsrisiken durch HF-Felder hinweisen könnten, zu reproduzieren.
1.3 Wirkungskette und Interaktionsmechanismen
Das Interesse an genotoxischen Wirkungen hat einen grundlagenwissenschaftlichen und einen angewandten Aspekt. Letzterer ist primär durch die möglichen Auswirkungen auf die menschliche Gesundheit begründet. Mutationen in der Keimbahn können zu erblich bedingten Krankheiten bei den Nachkommen fühlen, in somatischen Zellen können sie Ausgangspunkt für die Entstehung von Tumoren sein.
Krebs ist eine Krankheit, die darauf zurückgeführt werden kann, dass es in einzelnen Körperzellen über einen Zeitraum von Jahren zu einer Akkumulation verschiedenster Mutationstypen kommt. Genmutationen, Aneuploidie und strukturelle Chromosomenaberrationen wie Translokationen können dazu führen, dass die betroffene Zelle keiner Zellzykluskontrolle und keiner Kontaktinhibition mehr unterliegt. Primär für die Entstehung von Tumoren ist somit die Induktion von Mutationen.
Die meisten karzinogenen Agenzien haben sich in entsprechenden Testsystemen als mutagen erwiesen, das gilt sowohl für Gen- als auch für Chromosomenmutationen. Zytogenetische Tests werden weltweit zum Nachweis mutagener Wirkungen verwendet. Hierbei wird unter Einsatz entsprechender Zellsysteme untersucht, ob ein Agens zu genotoxischen Effekten wie Veränderungen im "Comet-Assay", Chromosomenaberrationen (CA 4), Schwesterchromatidaustauschen (SCE 5) oder Mikrokernen (MN 6) führt.
Die Karzinogenese erstreckt sich über einen langen Zeitraum und kann durch verschiedene Phasen charakterisiert werden. Am Beginn steht die Initiation oder (neoplastische) Transformation. Auslöser dieses Prozesses ist entweder eine Veränderung der genetischen Information oder eine dauerhafte Veränderung ihrer Expression (z.B. Aktivierung von normalerweise supprimierten Genen). Hierdurch verliert die Zelle die Eigenschaft, auf die Gewebsregulation zu reagieren (z.B. Kontaktinhibition) und erhält die Fähigkeit zu unkontrollierter Proliferation. Der Transformationsprozess kann durch genotoxische Einflüsse ausgelöst werden, jedoch führen durch sie hervorgerufene Schäden an der DNA nicht unmittelbar zur Tumorinitiation. Alle Zellen können nur überleben, wenn sie über ein intaktes System der intrazellulären Informationsverarbeitung verfügen. In der Regel führen DNA-Läsionen in unmodifizierter Form zum Zelltod, wenn nicht durch ein Reparatursystem die funktionelle DNA-Struktur wiederhergestellt wird. Dabei auftretende Fehler ("Misrepair") können zu Mutationen führen und Ausgangspunkt für eine neoplastische Transformation sein.
Änderungen der Genregulation, die nicht auf Mutationen beruhen, werden als "epigenetisch" bezeichnet. Die zugrundeliegenden Vorgänge sind nicht mit denen von "Co-Karzinogenen" zu verwechseln. Als solche werden Stoffe oder Einwirkungen bezeichnet, welche die Wirkung transformierender Einflüsse verstärken oder sie erst ermöglichen, z.B. durch Inhibierung von Reparaturprozessen.
Transformierte Zellen besitzen zwar das Potenzial zu unkontrollierter Proliferation, aber erst weitere mutationsbedingte Schritte führen zu lokalem verdrängenden Wachstum (Promotion). Den Übergang zu einer metastasierenden Ausbreitung bei soliden Tumoren bezeichnet man als Progression.
Welche externen Einflüsse bei den verschiedenen Stadien eine Rolle spielen, ist nur teilweise bekannt: UV-Strahlen, ionisierende Strahlen und eine große Zahl von Chemikalien können die Initiation bewirken. In Bezug auf die Promotion ist eine Wirkung nur bei wenigen Chemikalien nachgewiesen, ein Einfluss ionisierender Strahlen ist umstritten. Im Hinblick auf die Progression gibt es dagegen kaum gesicherte Erkenntnisse über den Einfluss exogener Faktoren.
2 Einschätzung verwendeter Methoden und Modellsysteme
Untersuchungen zu genotoxischen Wirkungen von HF-Feldern wie auch Experimente zur Interaktion von HF-Feldern mit Mechanismen der Genregulation sind mit verschiedenen Methoden an unterschiedlichsten Modellsystemen durchgeführt worden. Kritische Beurteilungen der publizierten Ergebnisse sind nur bei Kenntnis der Aussagekraft der eingesetzten Methoden und Modellsysteme möglich. Diese werden deshalb im Folgenden kurz beschrieben.
2.1 Expositionseinrichtungen und Dosimetrie
Verlässliche Expositionseinrichtungen sind für die Durchführung von biologischen Experimenten an Zellen, Pflanzen, Tieren oder Menschen im Rahmen von Untersuchungen zu möglichen Wirkungen von HF-Feldern unabdingbare Voraussetzung. In einer Expositionseinrichtung wird das Testobjekt unter möglichst kontrollierten Bedingungen einem HF-Feld ausgesetzt. Zuverlässige Einrichtungen zur kontrollierten Exposition sind zur Durchführung qualitativ hochwertiger Experimente von entscheidender Bedeutung, erfordern jedoch einen erheblichen Entwicklungsaufwand. Sogar höchstrangig publizierte Ergebnisse mussten schon wegen fehlerhafter Exposition widerrufen werden ([de Pomerai et al., 2000], widerrufen in [Dawe et al., 2006]; vgl. Kap. 6.2).
Eine wichtige Rolle bei der Charakterisierung einer Expositionseinrichtung spielt die Dosimetrie, d. h. eine exakte Bestimmung der in das Untersuchungsobjekt eingekoppelten elektromagnetischen Felder. Im Hochfrequenzbereich wird als dosimetrische Größe vorrangig die spezifische Absorptionsrate (SAR) verwendet. Diese beschreibt die absorbierte Leistung pro Körpermasse in W/kg.
Folgende Richtlinien sind bei der Konzipierung von Expositionseinrichtungen nach dem aktuellen Stand der Technik zu beachten:
- Das Testvolumen muss ausreichend groß sein. Hier spielt einerseits die Größe der Untersuchungsobjekte, im Fall von Tieren auch deren freie Beweglichkeit, eine Rolle. Andererseits erfordert die Ausbildung der gewünschten elektromagnetischen Feldeigenschaften, also beispielsweise eines definierten Wellen- oder Resonanztyps, die Einhaltung von Vorgaben bezüglich geometrischer Mindest- oder Maximalabmessungen.
- Die Einrichtung muss gegenüber äußeren elektromagnetischen Feldern ausreichend abgeschirmt sein. Anderenfalls kann nicht beurteilt werden, ob eine beobachtete Wirkung tatsächlich durch die beabsichtigte Exposition oder durch äußere Feldeinflüsse hervorgerufen wurde.
- Die Verteilung der Expositionsfelder am und im Präparat muss eindeutig definierbar sein. Nur bei einer exakten dosimetrischen Charakterisierung ist eine Interpretation der Untersuchungsergebnisse möglich. Hierzu werden meist sehr aufwändige numerische Feldberechnungen durchgeführt, die durch Messungen unterstützt werden können. In den Simulationen müssen auch Präparathalterungen und Ähnliches berücksichtigt werden.
- Zu einer definierten Exposition gehört ferner, dass im Bereich des Untersuchungsobjektes eine möglichst homogene Feldverteilung vorliegt. Bei zu großen örtlichen Variationen ist die Exposition nicht mehr eindeutig bestimmbar und die Aussagekraft des Versuchs stark eingeschränkt. Ein gewisser Grad an Inhomogenität ist jedoch unvermeidbar; er beträgt beispielsweise bei derzeit verfügbaren in-vitro-Expositionseinrichtungen nach dem Resonatorprinzip immer noch 30 - 40 % (bezogen auf die SAR, Frequenz 1.800 MHz). Bei bestimmten Anwendungen kann aber auch eine zielgerichtete Inhomogenität gewünscht sein, um nur ein bestimmtes Körperteil, z.B. den Kopf eines Tieres, zu exponieren.
- In einem global inhomogenen Expositionsfeld lässt sich die Homogenität über das Präparat verbessern, wenn man es im Bereich einer lokalen Homogenität reproduzierbar mit geeigneten Halteeinrichtungen fixiert.
- Für die Exposition von Tieren oder Menschen, aber auch von Zellen ist es wichtig, optimale Umweltbedingungen zu gewährleisten. Das betrifft Faktoren wie Licht/Dunkelheit, O2/CO2, Ernährung und Temperatur. Konstante Temperaturverhältnisse während der Exposition sind besonders wichtig. Kühleinrichtungen wie Ventilatoren oder Ähnliches können hier eingesetzt werden, wobei Zugeffekte unbedingt zu vermeiden sind. Außerdem ist zu berücksichtigen, dass aktive Kühlung im Testobjekt vorhandene Temperaturgradienten unter Umständen noch vergrößern kann.
- Wichtige physikalische Parameter, wie Temperatur oder Feldstärke, müssen während der Exposition kontinuierlich überwacht werden, um den Zustand des Testobjekts einschätzen zu können.
Zu einer optimalen Versuchsdurchführung gehört weiterhin, dass die Experimente eine scheinexponierte Kontrollgruppe enthalten und verblindet durchgeführt werden, d. h., dass zwei identische Expositionseinrichtungen mit Testobjekten beschickt werden, von denen aber nur in einer tatsächlich ein HF-Feld erzeugt wird. Beide Expositionseinrichtungen müssen, abgesehen vom HF-Feld, identische Umweltbedingungen aufweisen; dies ist oftmals nur durch räumliche Nähe zu gewährleisten. Vor und während der Anwendung des HF-Feldes und der Auswertung darf das Untersuchungspersonal nicht wissen, welche Proben exponiert und welche scheinexponiert wurden, da dies die Gefahr einer subjektiven Einflussnahme auf das Untersuchungsergebnis birgt.
Die Expositionseinrichtung ist mit einer Signalquelle zu verbinden, die Signale genau desselben Typs oder generische Signale der Art erzeugt, wie sie für die zu untersuchende Feldquelle typisch sind (Signalform, Bandbreite usw.).
In den letzten Jahren wurden häufig Signalformen eingesetzt, die auf dem GSM-Mobilfunkstandard aufbauen und "Handy-Signale" nachbilden. Daher sollen hier diese Signale etwas genauer besprochen werden.
- Beim GSM-217 Hz-Signal ist eine Sekunde in 217 gleichlange Zeitabschnitte (Zeitrahmen) von 4,61 ms aufgeteilt. Innerhalb eines jeden Zeitrahmens wird für 0,576 ms (also 1/8 der Zeit) das hochfrequente Sendesignal angeschaltet, dies entspricht einem "Duty Cycle" von 1:8. Somit ergibt sich ein mit 217 Hz (niederfrequent) gepulstes Hochfrequenzsignal. Das Verhältnis zwischen SAR im Sendepuls zur zeitlich gemittelten SAR beträgt 8 (Crestfaktor).
- Beim GSM-Basic-Signal ist jeder 26. Zeitrahmen des GSM-217 Hz-Signals inaktiv. Dies repräsentiert die Signalstruktur beim Sprechen. Der Crestfaktor beträgt 8,3.
- Der GSM-DTX-Mode (Discontinuous Transmission) ist während Sprechpausen aktiv. Um die Batterie des Mobiltelefons zu schonen, werden nur sehr wenige Rahmen gesendet. Der Crestfaktor ist hier 69,3.
- GSM-Talk ist eine Mischung aus GSM-Basic (Sprechbetrieb) und GSM-DTX (Sprechpause) und bildet ein typisches Telefonat nach. Für das Beispiel eines Telefonats mit 11 s Sprechen und 5 s Zuhören ist der Crestfaktor 11,9.
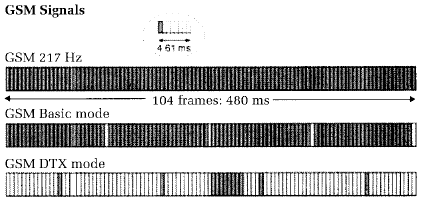
Quelle: Perform B Final Report, November 2004, Part 5
Bei der Interpretation der Untersuchungsergebnisse ist zu beachten, dass sich die Angabe der Exposition (z.B. als SAR-Wert) oft auf einen zeitlichen Mittelwert bezieht. Bei Signalen, die einen großen Unterschied zwischen Maximalwert und zeitlichem Mittelwert aufweisen, können kurzzeitig auch wesentlich höhere SAR-Werte im Untersuchungsobjekt vorliegen. Beispiele für solche Signalformen sind Radar- und UMTS-Signale, aber auch GSM-Mobilfunksignale. Beim GSM-DTX-Mode ist, wie oben beschrieben, das Verhältnis zwischen SAR im Zeitschlitz und mittlerer SAR 69,3. Unter experimentellen Bedingungen würde daher die Applikation einer mittleren SAR von 1 W/kg bedeuten, dass während des kurzen Zeitschlitzes eine SAR von 69,3 W/kg vorläge, die bei weitem über der SAR liegt, die ein Mobiltelefon bei höchster Leistungsstufe in den Kopf des Telefonierenden einbringen kann.
Je nach technischen und biologischen Anforderungen an eine Exposition, also z.B. Frequenzbereich, Feldart, Feldverteilung oder auch Größe der zu exponierenden Testobjekte, werden unterschiedliche Expositionseinrichtungen eingesetzt. Die derzeit gebräuchlichen Expositionseinrichtungen können in offene und geschlossene Systeme untergliedert werden, in denen die zur Exposition benötigte elektromagnetische Feldenergie über eine Antenne in den Raum abgestrahlt oder in einem Wellenleitersystem geführt wird.
Offene Expositionseinrichtungen, bei denen die Energie in den Raum abgestrahlt wird, dienen zur Exposition vergleichsweise großer Testobjekte im Fernfeld einer Strahlungsquelle. Im Fernfeld stehen elektrisches und magnetisches Feld senkrecht aufeinander und sind senkrecht zur Ausbreitungsrichtung orientiert. Man spricht von einer transversalelektromagnetischen (TEM) Welle. Das Untersuchungsobjekt befindet sich meistens im Abstand von einigen Metern Entfernung zur Antenne. Definierte Fernfelder sind unter Laborbedingungen nur sehr eingeschränkt erzeugbar, weswegen die Mehrzahl der derzeit verwendeten Expositionseinrichtungen auf Wellenleitersystemen beruht.
Hierbei wird die elektromagnetische Energie in Röhren mit rechteckigem oder rundem Querschnitt, so genannten Wellenleitern, zum Präparat geführt. Bei komplett metallisch umrandeten Wellenleitern wird automatisch eine Abschirmung gegenüber äußeren elektromagnetischen Feldern sowie eine Vermeidung der Abstrahlung des im Wellenleiter geführten Feldes nach außen erreicht.
Bei Wellenleitern unterscheidet man solche mit und ohne Innenleiter. In Wellenleitern mit einem Innenleiter breiten sich TEM-Wellen aus. Ein Beispiel hierfür sind TEM-Zellen, in denen eine Fernfeldexposition (also z.B. Exposition der Allgemeinbevölkerung durch Basisstationen) nachgebildet werden kann.
Gegenüber TEM-Wellenleitern sind in Wellenleitern ohne Innenleiter, so genannten Hohlleitern, nur TE- (transversalelektrische) oder TM- (transversalmagnetische) Wellentypen ausbreitungsfähig. Hierbei besitzt entweder die magnetische Feldstärke (TE-Wellentyp) oder die elektrische Feldstärke (TM-Wellentyp) eine Komponente in Ausbreitungsrichtung. Es handelt sich um inhomogene Feldstrukturen, deren Feldmuster wesentlich von der Frequenz abhängen.
Wird die Energie an einem Ende des Hohlleiters eingespeist und das andere Ende mit einem passenden Wellenwiderstand oder einem Absorber abgeschlossen, so breitet sich in seinem Inneren eine fortschreitende Welle aus. Ist der Wellenleiter jedoch am Ende mit einer Metallplatte "kurzgeschlossen", wird die elektromagnetische Welle reflektiert, läuft wieder zum Eingang des Wellenleiters zurück und überlagert sich mit der hinlaufenden Welle zu einer stehenden Welle.
Die Überhöhungen der elektrischen oder magnetischen Feldstärken in den Wellenbäuchen der stehenden Welle werden bei aktuell eingesetzten Expositionseinrichtungen zielgerichtet verwendet, um mit vergleichsweise geringen Signaleingangsleistungen in den am Ort der Maxima platzierten Präparaten vergleichsweise hohe SAR-Werte erreichen zu können. Ein Beispiel hierfür sind die im REFLEX-Projekt verwendeten Expositionseinrichtungen. Zur möglichst effizienten Einkopplung der eingespeisten Leistung werden Zellsuspensionen in die Maxima der elektrischen Feldstärke und Zellmonolayer in die Maxima der magnetischen Feldstärke platziert [Schönborn et al., 2000; Schuderer et al., 2004a; 2004b].
Die Maxima sind, sofern elektrische bzw. dielektrische Verluste im Hohlleiter minimal sind, in der Regel scharf örtlich abgegrenzt und erfordern eine sehr sorgsame und reproduzierbare Platzierung der Präparate. Geringe Positionsänderungen der Präparate, aber auch deren mengenmäßige Variationen durch unterschiedliche Befüllung oder Verdunstung des Kulturmediums, verändern die Lage der Feldmaxima und der dort herrschenden Amplituden und damit auch die Größe und Homogenität der erzielbaren SAR im Bereich des Präparates. Noch kritischer bezüglich Platzierung und Belastung sind Wellenleitungen, die auf beiden Seiten kurzgeschlossen sind und deswegen als Resonatoren betrieben werden.
Wellenleiter mit durchlaufenden Wellen hingegen sind gegenüber Fehlpositionierungen oder Befüllungsvariationen wesentlich weniger empfindlich, benötigen allerdings zum Erreichen von SAR-Werten in der Größenordnung der Grenzwerte erheblich höhere Leistungen, die sehr teure Verstärker notwendig machen.
Eine weitere häufig eingesetzte Expositionsapparatur ist die radiale Wellenleitung, die aus zwei kreisförmigen, parallel angeordneten Metallplatten besteht. Die im Zentrum platzierte Antenne regt Wellen an, die sich in radialer Richtung ausbreiten. Je nach Abstand zwischen den Metallplatten eignet sich eine radiale Wellenleitung für in-vitro- oder in-vivo-Expositionen.
2.2 Zellen und Kulturbedingungen
2.2.1 Primäre Zellen
Kulturen teilungsfähiger primärer Zellen werden durch die Isolation von Zellen aus Geweben gewonnen. Diese Zellen sind in der Regel differenziert, frei von genetischen Veränderungen und zeigen in-vitro eine begrenzte Teilungsfähigkeit.
Hierher gehören z.B. periphere menschliche Lymphozyten, die in vitro zur Teilung angeregt werden können und deshalb häufig für zytogenetische Studien eingesetzt werden. Allerdings sterben menschliche Lymphozyten in vitro schon nach wenigen Zellteilungen ab.
Primäre Zellen etwa aus Hautstanzen (Fibroblasten) oder Operationsmaterial können deutlich länger kultiviert werden als Lymphozyten.
Sie sterben nach etwa 40 Zellteilungen ab. Allerdings können einige Zellen diese Krise überleben und zu permanenten immortalisierten Zellen führen (vgl. Kap. 2.2.2 Zelllinien).
2.2.2 Zelllinien
Zelllinien bestehen entweder aus immortalisierten primären Zellen oder aus transformierten Zellen, beide sind nahezu unbegrenzt teilungsfähig.
Immortalisierte Zellen verhalten sich in mancher Hinsicht wie primäre Zellen, sie benötigen Serum, wachsen wie Fibroblasten am Boden der Kulturschalen und stellen das Wachstum ein, wenn sie Nachbarzellen berühren. Diese Kontaktinhibition führt dazu, dass die Zellen einen Zellrasen ausbilden (Monolayer). Es gibt eine Vielzahl derartiger Zelllinien. Immortalisierte Zellen sind keine Krebszellen, sie führen nicht zu Tumoren, wenn sie entsprechenden Versuchstieren injiziert werden, sie sind jedoch im Vergleich zu den Zellen, aus denen sie entstanden sind, genetisch verändert.
Transformierte Zellen sind Zellen aus Tumoren, die eine permanente Teilungsfähigkeit besitzen und darüber hinaus nicht mehr kontaktinhibiert sind. Transformierte Zellen wachsen nicht nur wie Fibroblasten am Boden der Kulturschale, sondern bilden mehrschichtige Aggregate aus abgerundeten Zellen. Hierzu gehören z.B. HeLa-Zellen, die aus einem menschlichen Tumor stammen. Transformierte Zellen können zu Tumoren führen, wenn sie geeigneten Versuchstieren injiziert werden.
Zelllinien werden weltweit für die verschiedensten Untersuchungen eingesetzt und stellen das Hauptpräparat für toxikologische und zytogenetische in-vitro-Untersuchungen dar, einige werden hier beispielhaft erwähnt.
Transformierte Linien:
Immunzellen: Humane Leukämien HL-60-Zellen [European Union, 2004a, Arbeitsgruppe Tauber; Lee et al., 2005a], Molt-4-Zellen [Hook et al., 2004a, b], Mono Mac 6 Monocyten [Lantow et al., 2006; Simko et al., 2006], Monozyten U937 [European Union, 2004a, Arbeitsgruppe Lagroye], Erythroid-Zellen [Lantow et al., 2006; Simko et al., 2006]; Maus Makrophagen J774,16 [Hook et al., 2004a].
Fibroblasten: Humane, nicht entartete fetale Lungenfibroblasten IMR-90 [Sakuma et al., 2006]; humane Fibroblasten der Line ES1 [Diem at al., 2005; Speit et al., 2007]; L929 aus C3H-Mäusen [European Union, 2004b; Penafiel et al., 1997]; C3H 10T1/2 aus C3H-Mäusen [Lagroye et al., 2004b, Whitehead et al., 2006]; V79-Zellen aus chinesischen Hamstern [Speit et al., 2007].
Neuronale Zellen: Humane Neuroblastoma Zellen NB69 [European Union, 2004a, Arbeitsgruppe Trillo], SH-SY5Y [European Union, 2004a, Arbeitsgruppe Lagroye]; humane Gliazelllinien U87 [European Union, 2004a, Arbeitsgruppe Lagroye], MO54 [Tian et al., 2002; Miyakoshi et al., 2005], A172 [Sakuma et al., 2006; Gliazellline der Ratte C6 [European Union, 2004a, Arbeitsgruppe Lagroye].
Endothelzellen: Humane Zelllinie EA.hy929 [European Union, 2004, Arbeitsgruppe Leszczynski, Arbeitsgruppe Lagroye; Leszczynski et al., 2002, 2004; Nylund und Leszczynski, 2004].
2.2.3 Stammzellen
Embryonale und adulte Stammzellen weisen im Gegensatz zu den Zellen aus Linien geringere genetische Veränderungen auf, obwohl sie über eine nahezu unbegrenzte Teilungsfähigkeit verfügen. Darüber hinaus besitzen sie ein uneingeschränktes (totipotente Zellen) oder ein eingeschränktes (pluripotente Zellen) Differenzierungspotenzial. Embryonale Stammzellen der Maus wurden bei Czyz et al. (2004) und Nikolova et al. (2005) und solche von der Ratte bei der Arbeitsgruppe Trillo im REFLEX-Report [European Union, 2004a] eingesetzt.
2.2.4 Kulturbedingungen
Zellen werden in Gegenwart von Serum in synthetischen Medien in einer kontrollierten Umgebung kultiviert. Unter diesen Bedingungen teilen sich Zellen asynchron. Die Wachstumsrate lässt sich durch Serumkonzentration, Wachstumsfaktoren und die Umgebungsbedingungen beeinflussen. Die Kontrolle des Zellzyklus ist bei experimentellen Analysen an sich teilenden Zellen wünschenswert, jedoch sehr schwierig. Synchronisation gelingt stets nur partiell.
3 Biologische Endpunkte und Methoden
3.1 Genotoxizität
3.1.1 "Comet-Assay"
Der "Comet-Assay" stellt ein im Prinzip einfaches Verfahren zur Untersuchung von DNA-Veränderungen auf Einzelzellebene dar. Die Zellen werden hierbei nach der Einwirkung der zu untersuchenden Agenzien auf Objektträgern in Agar fixiert und danach lysiert, wobei es zu einer Lockerung der DNA-Protein-Struktur im Chromatin kommt. Anschließend wird nach spezifischer Anfärbung der DNA das Verhalten des verbleibenden Komplexes im elektrischen Feld untersucht und mikroskopisch beobachtet. Dabei zeigen sich kometenartige Formationen, welche dem Verfahren den Namen gegeben haben. Je nach der Stärke der Schädigung ist dabei der "Schweif" mehr oder weniger ausgeprägt. Die Quantifizierung erfolgt heute meist mit Hilfe der computergesteuerten Bildanalyse, wobei verschiedene Kenngrößen ermittelt werden. Dazu gehören:
- "Tail Factor": Hierbei werden die Kometen in Gruppen verschiedener Länge eingeteilt, aus denen ein gewichteter Durchschnitt gebildet wird. Diese Methode kann ohne Bildanalysesysteme nach visueller Inspektion eingesetzt werden. Die Abgrenzung der verschiedenen Gruppen enthält notwendigerweise ein stark subjektives Element. Aus diesem Grund wird heute meist einem computergestützten Verfahren der Vorzug gegeben.
- "Tail Length": Entweder wird hier die Schweiflänge in um oder aber auch das Verhältnis der Schweiflänge zum Durchmesser des Kometenkopfes angegeben.
-
"Tail Moment": Leider ist diese Größe nicht einheitlich und eindeutig definiert, Grundsätzlich basiert sie auf der Bestimmung des DNA-Gehalts im Schweif. Nach einem Vorschlag von Olive et al. (1990) wird die Schweiflänge mit dem DNA-Gehalt im Schweif multipliziert, aber auch andere Definitionen sind gebräuchlich
(weitere Einzelheiten s. [Lee et al., 2004], auch unter http://www.cometassayindia.org/definitions.htm).
Eine allgemein akzeptierte Auswertemethodik gibt es noch nicht, sodass ein Vergleich der Arbeiten verschiedener Autoren nicht unmittelbar möglich ist.
Die Ergebnisse eines "Comet-Assays" hängen von der Behandlung vor der Elektrophorese ab. Unter alkalinen Bedingungen (pH >13) wird die Doppelstrangstruktur der DNA aufgelöst, sodass auch Schäden am Einzelstrang eine Rolle spielen. In neutralem Milieu führen vor allem Doppelstrangbrüche zur Kometenausbildung. Aus diesen Gründen wird sehr häufig der "Comet-Assay" als spezifische Nachweismethode für Einzel- (bei alkalinen Bedingungen) bzw. Doppelstrangbrüche angesehen. Diese Interpretation ist jedoch so nicht zutreffend: Zwar führen Strangbrifche zur Kometenbildung, jedoch ist über den Einfluss anderer primärer Läsionen nur wenig bekannt. Das gesamte Verfahren ist rein empirisch und bedarf deshalb sowohl der Standardisierung als auch (in jedem einzelnen Experiment) der Mitführung von Positivkontrollen (z.B. mit ionisierender Strahlung).
Eine umfassende und kritische Übersicht findet man bei Tice et al. (2000). Methodische Analysen zur Anwendbarkeit des "Comet-Assays" zum Nachweis strahlungsinduzierter DNA-Schäden wurden von Müller et al. (2004) veröffentlicht.
 | weiter . |  |
...
X
⍂
↑
↓
