umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (40)
 | zurück |
C.35 Sediment-Wasser-Toxizitätsstudie mit Dotiertem Sediment an Lumbriculus 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 225 (2007). Sedimentfressende endobenthische Tiere werden durch in Sedimenten gebundene Chemikalien potenziell stark belastet und verdienen folglich besonderes Augenmerk (z.B. (1)(2)(3)). Unter diesen Sedimentfressern nehmen aquatische Oligochaeten in den Sedimenten aquatischer Systeme einen bedeutenden Platz ein. Durch Bioturbation der Sedimente und als Beutetiere haben diese Tiere erheblichen Einfluss auf die Bioverfügbarkeit sedimentgebundener Chemikalien für andere Organismen (z.B. benthivore Fische). Im Gegensatz zu epibenthischen Organismen graben sich endobenthische aquatische Oligochaeten (z.B. Lumbriculus variegatus) in die Sedimente ein und nehmen Partikel unterhalb der Sedimentoberfläche auf. Dies gewährleistet, dass die Testorganismen der Prüfchemikalie über alle möglichen Aufnahmewege ausgesetzt werden (z.B. Kontakt mit kontaminierten Sedimentpartikeln und orale Aufnahme dieser Partikel, aber auch Aufnahme über Poren- und Überstandswasser).
2. Diese Prüfmethode wurde zur Bewertung der Wirkung einer längerfristigen Exposition des endobenthischen Oligochaeten Lumbriculus variegatus (Müller) gegenüber sedimentgebundenen Chemikalien entwickelt. Sie beruht auf bereits bestehenden Testprotokollen für Sedimenttoxizität und -bioakkumulation (z.B. (3)(4)(5)(6)(7)(8)(9) (10)). Die Methode wird für statische Prüfbedingungen beschrieben. Bei dem für diese Prüfmethode verwendeten Expositionsszenario wird das Sediment mit der Prüfchemikalie dotiert. Mit dotierten Sedimenten soll ein mit der Prüfchemikalie kontaminiertes Sediment simuliert werden.
3. In der Regel haben auf Toxizität bei sedimentbewohnenden Organismen zu prüfende Chemikalien eine lange Verweildauer in diesem Kompartiment. Sedimentbewohner können über verschiedene Wege exponiert werden. Die relative Bedeutung der einzelnen Expositionspfade und die Geschwindigkeit, mit der diese jeweils zu den gesamten toxischen Wirkungen beitragen, hängen von den physikalisch-chemischen Eigenschaften des betreffenden Stoffes und seinem Verhalten im tierischen Organismus ab. Für stark adsorbierende Chemikalien (z.B. log Kow > 5) oder für kovalent an das Sediment gebundene Chemikalien kann die Aufnahme über die Nahrung ein wichtiger Expositionspfad sein. Um die Toxizität dieser Chemikalien nicht unterzubewerten, wird das für die Vermehrung und das Wachstum der Testorganismen erforderliche Futter dem Sediment zugegeben, bevor es mit der Prüfchemikalie dotiert wird (11). Die beschriebene Prüfmethode ist detailliert genug, um die Prüfung durchführen und den Versuchsplan je nach Bedingungen in den einzelnen Labors und den unterschiedlichen Eigenschaften der Prüfchemikalien anpassen zu können.
4. Die Prüfmethode dient der Ermittlung der Wirkungen einer Prüfchemikalie auf die Reproduktion und die Biomasse der Testorganismen. Als biologische Parameter werden die Gesamtzahl der überlebenden Würmer und die Biomasse (Trockenmasse) am Ende der Expositionsdauer gemessen. Diese Daten werden entweder anhand eines Regressionsmodells zur Ermittlung der Konzentration analysiert, bei der eine Wirkung von x % auftreten würde (z.B. EC50, EC25 und EC10), oder es wird eine statistische Hypothesenprüfung vorgenommen, um die höchste messbare Expositionskonzentration ohne statistisch signifikante Wirkung (NOEC-Wert) und die niedrigste messbare Konzentration, bei der noch statistisch signifikante Wirkungen beobachtet werden (LOEC- Wert), zu bestimmen.
5. Kapitel C.27 dieses Anhangs ('Sediment-Wasser-Toxizitätstest mit gespiktem Sediment an Chironomiden' (6)) enthält viele wichtige und nützliche Informationen zur Durchführung der vorliegenden Sedimenttoxizitätsstudie. Dieses Dokument dient daher als Grundlage für die zur Durchführung von Sedimenttoxizitätstests mit Lumbriculus variegatus erforderlichen Modifikationen. Weitere Referenzdokumente sind z.B. der ASTM Standard Guide for Determination of the Bioaccumulation of Sediment-Associated Contaminants by Benthic Invertebrates (3), die U.S. EPA Methods for Measuring the Toxicity and Bioaccumulation of Sediment-Associated Contaminants with Freshwater Invertebrates (7) und die ASTM Standard Guide for Collection, Storage, Characterization, and Manipulation of Sediments for Toxicological Testing and for selection of samplers used to collect benthic invertebrates (12). Wichtige Informationsquellen für die Erarbeitung dieses Dokuments waren außerdem die in Ringtests der Prüfmethode ((13), Ringtest-Bericht) gewonnenen praktischen Erfahrungen sowie Informationen aus der Fachliteratur.
Voraussetzungen und praktische Hinweise
6. Vor Beginn der Studie sind Informationen zur Prüfchemikalie (z.B. Sicherheitsvorkehrungen, geeignete Lagerbedingungen und Analysemethoden) einzuholen. Für Leitlinien für Prüfchemikalien mit physikalisch- chemischen Eigenschaften, die die Durchführung des Tests erschweren, siehe (14).
7. Vor der Durchführung einer Prüfung sollte Folgendes über die Prüfchemikalie bekannt sein:
- Name, chemische Bezeichnung (vorzugsweise IUPAC-Bezeichnung), Strukturformel, CAS-Nummer, Reinheit;
- Dampfdruck;
- Wasserlöslichkeit;
8. Die folgenden zusätzlichen Informationen gelten als hilfreich:
- Octanol/Wasser-Verteilungskoeffizient, Kow;
- organischer Kohlenstoff/Wasser-Verteilungskoeffizient, ausgedrückt als Koc;
- Hydrolyse;
- Phototransformation in Wasser;
- biologische Abbaubarkeit;
- Oberflächenspannung.
9. Informationen über bestimmte Eigenschaften des zu verwendenden Sediments sollten ebenfalls vor Beginn des Versuchs vorliegen (7). Für Einzelheiten siehe Nummern 22 bis 25.
10. Würmer in vergleichbarem physiologischem Zustand (synchronisiert wie in Anlage 5 beschrieben) werden einer Reihe von Giftstoffkonzentrationen ausgesetzt, die der Sedimentphase eines Sediment-Wasser-Systems zugesetzt wurden. Als Medien sollten künstliches Sediment und rekonstituiertes Wasser verwendet werden. Als Kontrollen werden Prüfgefäße ohne Prüfchemikalie verwendet. Die Prüfchemikalie wird für jede Konzentration in einem einzigen Schritt in das Sediment dotiert, um Schwankungen zwischen Replikaten der einzelnen Konzentrationen zu minimieren; die Testorganismen werden anschließend in die Prüfgefäße gesetzt, in denen Sediment-Wasser-Konzentrationen äquilibriert wurden (siehe Nummer 29). Die Testtiere werden in den Sediment-Wasser-Systemen 28 Tage lang exponiert. Aufgrund seines niedrigen Nährstoffgehalts sollte das künstliche Sediment mit Futter angereichert werden (siehe Nummern 22 und 23 sowie Anlage 4), um sicherzustellen, dass die Würmer unter kontrollierten Bedingungen wachsen und sich vermehren. Auf diese Weise wird gewährleistet, dass die Tiere sowohl über das Wasser und das Sediment als auch über das Futter exponiert werden.
11. Bevorzugter Endpunkt bei dieser Art von Studie ist der ECx-Wert (z.B. EC50, EC25 und EC10, d. h. die Konzentration, bei der eine Wirkung von x % bei den Testorganismen beobachtet wird) für die Reproduktion bzw. die Biomasse im Vergleich zur Kontrolle. Es wird jedoch darauf hingewiesen, dass der EC50-Wert - angesichts der hohen Unsicherheit niedriger ECx-Werte (z.B. EC10 oder EC25) mit extrem hohem 95 %- Konfidenzintervall (z.B. (15)) und der durch Hypothesenprüfungen ermittelten statistischen Aussagekraft - als robustester Endpunkt betrachtet wird. Außerdem lassen sich für Biomasse und Reproduktion NOEC- und LOEC-Werte ermitteln, wenn Versuchsplan und verfügbares Datenmaterial diese Berechnungen gestatten (siehe Nummern 34 bis 38). Der Versuchsplan richtet sich nach dem Zweck der Studie, d. h. der Ableitung des ECx-Werts oder des NOEC-Wertes.
12. Es wird davon ausgegangen, dass das Verhalten der Kontrollorganismen hinreichend dokumentiert, dass ein Labor zur Durchführung der Prüfung in der Lage und - soweit historische Daten vorliegen - die Prüfung wiederholbar ist. Zusätzlich können in regelmäßigen Abständen mithilfe eines Referenzgiftstoffs Referenz-Toxizitätstests durchgeführt werden, um die Empfindlichkeit der Testorganismen zu bestimmen. Mit 96 Stunden-Referenz-Toxizitätstests ausschließlich in Wasser können Empfindlichkeit und Zustand der Versuchstiere zufriedenstellend demonstriert werden (4)(7). Informationen über die Toxizität von Pentachlorphenol (PCP) in vollständigen Tests (28-tägige Exposition gegenüber dem dotierten Sediment) sind Anlage 6 sowie dem Bericht über den Ringtest dieser Prüfmethode (13) zu entnehmen. Für die akute Toxizität von PCP in Wasser siehe beispielsweise (16). Diese Informationen können für den Vergleich der Empfindlichkeit des Testorganismus in Referenzprüfungen mit PCP als Referenzgiftstoff verwendet werden. Kaliumchlorid (KCl) oder Kupfersulfat (CuSO4) wurden als Referenzgiftstoffe für L. variegatus empfohlen (4)(7). Bislang ist es noch schwierig, Qualitätskriterien anhand von KCl-Toxizitätsdaten festzulegen, da Daten über L. variegatus in der Literatur nicht verfügbar sind. Für Informationen zur Toxizität von Kupfer für L. variegatus siehe (17) bis (21).
13. Damit der Test als gültig anerkannt werden kann, sollten die folgenden Anforderungen erfüllt sein:
- Ein Ringtest (13) hat gezeigt, dass sich die durchschnittliche Anzahl lebender Würmer (Lumbriculus variegatus) pro Replikat in den Kontrollen am Ende der Expositionsdauer gegenüber der Anzahl Würmer pro Replikat zu Beginn der Exposition mindestens um das 1,8-Fache erhöht hat.
- Der pH-Wert des Überstandswassers muss während der gesamten Prüfung zwischen 6 und 9 liegen.
- Die Sauerstoffkonzentration im Überstandswasser darf bei Testtemperatur nicht weniger als 30 % des Luftsauerstoff-Sättigungswertes (Air Saturation Value, ASV) betragen.
Prüfsystem
14. Nach Möglichkeit sollten statische Systeme verwendet werden, bei denen das Überstandswasser nicht erneuert wird. Ist das Sediment/Wasser-Verhältnis (siehe Nummer 15) angemessen, reicht im Allgemeinen eine schwache Belüftung aus, um eine annehmbare Wasserqualität für die Testorganismen zu gewährleisten (z.B. Maximierung des Anteils an gelöstem Sauerstoff und Minimierung der Anreicherung von Ausscheidungsprodukten). Semistatische Systeme oder Durchflusssysteme mit intermittierender oder ständiger Erneuerung des Überstandswassers sollten nur in Ausnahmefällen verwendet werden, denn es ist davon auszugehen, dass die regelmäßige Erneuerung des Überstandswassers das chemische Gleichgewicht beeinträchtigt (z.B. durch Verluste der Prüfchemikalie aus dem Prüfsystem).
Prüfgefäße und Apparatur
15. Die Exposition erfolgt in 250-ml-Bechergläsern mit einem Durchmesser von 6 cm. Andere Glasgefäße können verwendet werden, sofern sie eine angemessene Tiefe von Überstandswasser und Sediment gewährleisten. In jedes Gefäß wird eine Schicht von etwa 1,5-3 cm des formulierten Sediments gegeben. Das Verhältnis zwischen Sedimentschichttiefe und Überstandswasserstiefe beträgt 1:4. Die Gefäße müssen ein der Besatzrate (d. h. der Anzahl der pro Gewichtseinheit des Sediments eingesetzten Würmer) angemessenes Fassungsvermögen haben (siehe auch Nummer 39).
16. Prüfgefäße und sonstige Apparaturen, die mit der Prüfchemikalie in Berührung kommen, sollten vollständig aus Glas oder einem anderen chemisch inerten Material bestehen. Die Verwendung von Materialien, die sich auflösen können, die Prüfchemikalien absorbieren oder andere Chemikalien freisetzen bzw. den Testorganismen schaden können, sollte für alle verwendeten Teile möglichst vermieden werden. Geräte, die mit den Prüfmedien in Berührung kommen, können aus Polytetrafluorethylen (PTFE), rostfreiem Stahl und/oder Glas bestehen. Bei organischen Chemikalien, die auf Glas bekanntermaßen adsorbiert werden, kann silanisiertes Glas erforderlich sein. In solchen Fällen muss das Gerät nach der Benutzung entsorgt werden.
Testspezies
17. Die für diese Art von Studie zu verwendende Spezies ist der Süßwasser-Oligochaet Lumbriculus variegatus (Müller). Diese Art ist gegenüber einer Vielzahl von Sedimenttypen tolerant und wird allgemein für Sedimenttoxizitäts- und -bioakkumulationstests verwendet (z.B. (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34) und (35)). Die Herkunft der Testtiere, die Artbestimmung (z.B. (36)) und die Kulturbedingungen sind zu protokollieren. Die Art braucht nicht vor jeder Prüfung neu bestimmt zu werden, wenn die Organismen aus einer Laborkultur stammen.
Anzucht der Testorganismen
18. Damit eine ausreichende Anzahl Würmer für die Sediment-Toxizitätstests verfügbar ist, empfiehlt es sich, die Würmer in einer Dauerkultur vorrätig zu halten. Für Hinweise zu Laborkulturmethoden für Lumbriculus variegatus sowie Bezugsquellen für Ausgangskulturen siehe Anlage 5. Für nähere Informationen zur Kultivierung dieser Art siehe (3), (7) und (27).
19. Um sicherzustellen, dass die Tests mit Tieren derselben Art durchgeführt werden, wird die Herstellung von Monospezies-Kulturen dringend empfohlen. Dabei ist sicherzustellen, dass die Kulturen und insbesondere die in den Tests verwendeten Würmer keine erkennbaren Anzeichen von Krankheiten und Anomalien aufweisen.
Wasser
20. Als Überstandswasser für die Tests wird rekonstituiertes Wasser (siehe Kapitel C.1 dieses Anhangs) (37) empfohlen. Dieses Testwasser kann auch für die Laborzucht der Würmer verwendet werden (für die Aufbereitung des Wassers siehe Anlage 2). Falls erforderlich, kann auch natürliches Wasser verwendet werden. Das gewählte Testwasser sollte so beschaffen sein, dass die Testspezies während der Akklimatisierungs- und Testphasen weiter wachsen und sich vermehren kann, ohne Abweichungen in Aussehen oder Verhalten zu entwickeln. Es wurde nachgewiesen, dass Lumbriculus variegatus in diesem Testwasser überlebt, wächst und sich vermehrt (30), und so eine maximale Standardisierung der Test- und Kulturbedingungen gewährleistet ist. Wenn rekonstituiertes Wasser verwendet wird, sollte seine Zusammensetzung protokolliert und das Testwasser vor der Verwendung charakterisiert werden (zumindest pH-Wert, Sauerstoffgehalt und Härte, letztere ausgedrückt in mg CaCO3/l). Außerdem kann es sinnvoll sein, das Testwasser vor der Verwendung auf Mikroschadstoffe zu untersuchen (siehe z.B. Anlage 3).
21. Der pH-Wert des Überstandswassers sollte im Bereich 6,0-9,0 liegen (siehe Nummer 13). Wird mit einer verstärkten Ammoniakbildung gerechnet, sollte der pH-Wert auf 6,0-8,0 korrigiert werden. Für die Prüfung z.B. schwacher organischer Säuren empfiehlt es sich, den pH-Wert durch Puffern des Testwassers anzupassen, wie z.B. unter (16) beschrieben. Die Gesamthärte des Testwassers sollte bei natürlichem Wasser zwischen 90 und 300 mg CaCO3 pro Liter betragen. Anlage 3 enthält zusätzliche Kriterien für akzeptables Testwasser im Sinne der OECD-Prüfrichtlinie 210 (38).
Sediment
22. Da unkontaminierte natürliche Sedimente von einem bestimmten Herkunftsort möglicherweise nicht ganzjährig verfügbar sind und darin vorhandene Infauna (Endofauna) und vorhandene Mikroschadstoffe den Test beeinflussen können, ist vorzugsweise ein formuliertes Sediment (auch bezeichnet als rekonstituiertes, künstliches oder synthetisches Sediment) zu verwenden. Durch die Verwendung eines formulierten Sediments werden Schwankungen bei den Testbedingungen und die Gefahr der Eintragung von im Sediment enthaltenden Organismen (Infauna) auf ein Mindestmaß begrenzt. Das folgende formulierte Sediment basiert auf dem künstlichen Sediment gemäß (6), (39) und (40). Es wird für diese Art von Prüfung empfohlen (siehe (6), (10), (30), (41), (42), (43)):
- 4-5 % (bezogen auf die Trockenmasse) Sphagnumtorf: Wichtig ist, dass der Torf in Pulverform (Zersetzungsgrad 'mittel'), fein gemahlen (Partikelgröße ≤ 0,5 mm) und ausschließlich luftgetrocknet verwendet wird;
- 20 ± 1 % (bezogen auf die Trockenmasse) Kaolin-Ton (Kaolingehalt vorzugsweise über 30 %);
- 75-76 % (bezogen auf die Trockenmasse) Quarzsand (feiner Sand, Korngröße ≤ 2 mm, > 50 % der Partikel sollten eine Korngröße zwischen 50 und 200 µm haben);
- entionisiertes Wasser, 30-50 % bezogen auf die Trockenmasse des Sediments, zusätzlich zu den trockenen Sedimentbestandteilen;
- chemisch reines Calciumcarbonat (CaCO3), das zugegeben wird, um den pH-Wert der fertigen Mischung des Sediments einzustellen;
- der gesamte organische Kohlenstoff (TOC) der fertigen Mischung sollte 2 % (± 0,5 %), bezogen auf die Trockenmasse des Sediments, betragen und ist durch Zugabe von geeigneten Mengen Torf und Sand (siehe Buchstaben a und c) sicherzustellen;
- Futter, beispielsweise fein gemahlene Brennnesselblätter (Urtica sp., gemäß Arzneimittelstandards, für den menschlichen Verzehr), oder eine Mischung aus fein gemahlenen Blättern von Urtica sp. mit Alpha-Cellulose (1:1), in einem Anteil von 0,4-0,5 %, bezogen auf die Trockenmasse des Sediments, zusätzlich zu den trockenen Sedimentbestandteilen; für nähere Informationen siehe Anlage 4.
23. Die Herkunft von Torf, Kaolin-Ton, Futtermaterial und Sand sollte bekannt sein. Zusätzlich zu Buchstabe g sind in Kapitel C.27 dieses Anhangs (6) alternative Pflanzenmaterialien aufgelistet, die als Nährstoffe dienen können: getrocknete Maulbeerblätter (Morus alba), Weißklee (Trifolium repens), Spinat (Spinacia oleracea) oder Getreidegräser.
24. Das gewählte Futter sollte hinzugegeben werden, bevor oder während das Sediment mit der Prüfchemikalie dotiert wird. Die Futterquelle sollte zumindest eine akzeptable Vermehrung in den Kontrollen ermöglichen. Eine vor Gebrauch durchgeführte Analyse des künstlichen Sediments oder seiner Bestandteile auf Mikroschadstoffe könnte nützliche Informationen liefern. Ein Beispiel für die Herstellung des formulierten Sediments ist in Anlage 4 gegeben. Trockene Bestandteile können auch gemischt werden, sofern es nach Zugabe des Überstandswassers nachweislich nicht zu einer Auftrennung der Sedimentbestandteile (z.B. schwimmende Torfpartikel) kommt und der Torf oder das Sediment ausreichend konditioniert ist (siehe auch Nummer 25 und Anlage 4). Das künstliche Sediment sollte zumindest nach der Herkunft seiner Bestandteile, der Korngrößenverteilung (Prozentanteil an Sand, Schlick und Ton), dem gesamten organischen Kohlenstoff (TOC), dem Wassergehalt und dem pH-Wert charakterisiert werden. Die Messung des Redoxpotenzials ist fakultativ.
25. Soweit (beispielsweise für spezifische Tests) erforderlich, können auch natürliche Sedimente von unkontaminierten Standorten als Test- und/oder Kultursedimente dienen (3). Wenn natürliches Sediment verwendet wird, sollte dieses allerdings zumindest nach Herkunft (Entnahmeort), pH-Wert und Ammoniakgehalt des Porenwassers, gesamtem organischem Kohlenstoff (TOC) und Stickstoffgehalt, Partikelgrößenverteilung (Prozentanteil an Sand, Schlick und Ton) und Wassergehalt (in %) (7) charaktierisiert werden; außerdem muss das Sediment frei von Schadstoffen und sonstigen Organismen sein, die mit den Testorganismen konkurrieren oder diese fressen könnten. Die Messung des Redoxpotenzials und der Kationenaustauschkapazität ist fakultativ. Ferner wird empfohlen, natürliches Sediment vor dem Dotieren mit der Prüfchemikalie sieben Tage lang unter den Bedingungen des anschließenden Tests zu konditionieren. Nach dieser Konditionierung ist das Überstandswasser zu entfernen und zu verwerfen.
26. Das zu verwendende Sediment sollte von einer Qualität sein, die gewährleistet, dass die Kontrollorganismen während der Exposition überleben und sich vermehren können, ohne Abweichungen in Aussehen oder Verhalten zu entwickeln. Die Kontrollwürmer sollten sich in das Sediment eingraben und das Sediment aufnehmen. Die Vermehrung in den Kontrollen sollte mindestens das Validitätskriterium gemäß Nummer 13 erfüllen. Das Vorhandensein bzw. Fehlen von Fäkalpellets auf der Oberfläche des Sediments (die auf Sedimentaufnahme hinweisen), ist zu protokollieren und kann bei der Auswertung der Testergebnisse hinsichtlich der Expositionspfade nützlich sein. Weitere Informationen über die Sedimentaufnahme können durch die unter (24), (25), (44) und (45) beschriebenen Methoden eingeholt werden, die der Bestimmung der Sedimentaufnahme oder der Wahl der Partikel durch die Testorganismen dienen.
27. Verfahren für die Handhabung natürlicher Sedimente vor der Verwendung im Labor sind unter (3), (7) und (12) beschrieben. Für die Aufbereitung und Lagerung des für den Versuch mit Lumbriculus empfohlenen künstlichen Sediments siehe Anlage 4.
Applikation der Prüfchemikalie
28. Die Prüfchemikalie wird in das Sediment dotiert. Da die meisten Prüfchemikalien wahrscheinlich nur schwach wasserlöslich sind, sollten sie zur Herstellung der Stammlösung in der kleinstmöglichen Menge eines geeigneten organischen Lösungsmittels (z.B. Aceton, n-Hexan oder Cyclohexan) gelöst werden. Die Stammlösung sollte mit demselben Lösungsmittel gelöst werden, um die Testlösungen herzustellen. Hauptkriterien für die Wahl des geeigneten Lösungsvermittlers sollten die Toxizität und Flüchtigkeit des Lösungsmittels und die Löslichkeit der Prüfchemikalie in dem gewählten Lösungsmittel sein. Für jede Konzentration ist dasselbe Volumen der entsprechenden Lösung zu verwenden. Das Sediment sollte für jede Konzentration in einem einzigen Schritt dotiert werden, um Schwankungen bei den Prüfchemikalienkonzentrationen zwischen den einzelnen Replikaten zu minimieren. Die Testlösungen anschließend mit Quarzsand vermischen, wie unter Nummer 22 beschrieben (z.B. 10 g Quarzsand pro Prüfgefäß). Erfahrungsgemäß reicht ein Volumen von 0,20-0,25 ml pro g Quarzsand aus, um den Sand vollständig zu durchtränken. Das Lösungsmittel anschließend verdampfen, bis der Sand vollständig getrocknet ist. Um (je nach Dampfdruck der Chemikalie) verflüchtigungsbedingte Prüfchemikalienverluste zu vermeiden, sollte der beschichtete Sand unmittelbar nach dem Trocknen verwendet werden. Den trockenen Sand mit einer geeigneten Menge eines formulierten Sediments der gewünschten Konzentration vermischen. Bei der Aufbereitung des Sediments die in der Mischung von Prüfchemikalie und Sand enthaltene Sandmenge berücksichtigen (d. h. das Sediment sollte mit möglichst wenig Sand hergestellt werden). Wesentlicher Vorteil dieses Verfahrens ist, dass praktisch kein Lösungsmittel in das Sediment gelangt (7). Alternativ, z.B. bei Freilandsedimenten, kann die Prüfchemikalie auch hinzugegeben werden, indem ein getrockneter und fein gemahlener Anteil des Sediments dotiert wird (wie oben für Quarzsand beschrieben) oder indem die Prüfchemikalie in das feuchte Sediment eingerührt wird mit anschließender Verdampfung des verwendeten Lösungsvermittlers. Es ist darauf zu achten, dass die Prüfchemikalie mit dem Sediment gut durchmischt ist, um eine homogene Verteilung im Sediment zu gewährleisten. Erforderlichenfalls können Teilproben analysiert werden, um die Zielkonzentrationen im Sediment zu bestätigen und den Homogenitätsgrad zu bestimmen. Es kann auch sinnvoll sein, Teilproben der Testlösungen zu untersuchen, um auch dort die Zielkonzentrationen im Sediment zu bestätigen. Da zur Applikation der Prüfchemikalie auf den Quarzsand ein Lösungsmittel verwendet wird, sollte mit derselben Menge Lösungsmittel wie bei den Testsedimenten eine Lösungsmittelkontrolle angesetzt werden. Das verwendete Dotierungsverfahren und die Gründe für die Wahl eines anderen Verfahrens als oben beschrieben sollten angegeben werden. Das Dotierungsverfahren kann an die physikalisch-chemischen Eigenschaften der Prüfchemikalie angepasst werden (z.B. um Verluste durch Verflüchtigung beim Dotieren oder Äquilibrieren zu vermeiden). Für weitere Hinweise zum Dotierungsverfahren siehe Environment Canada (1995) (46).
29. Nachdem das dotierte Sediment hergestellt, in die Prüfgefäße für die Replikate gegeben und mit Testwasser aufgefüllt wurde, sollte ausreichend Zeit vorgesehen werden, damit sich die Prüfchemikalie aus dem Sediment in die wässrige Phase verteilen kann (z.B. (3)(7)(9)). Dies sollte möglichst unter den Temperatur- und Belüftungsbedingungen des Tests geschehen. Die erforderliche Äquilibrierungszeit ist sediment- und chemikalienabhängig und liegt gewöhnlich in der Größenordnung von Stunden bis Tagen, in seltenen Fällen beträgt sie mehrere Wochen (4 bis 5 Wochen) (z.B. (27)(47)). Bei diesem Test wird keine Gleichgewichtseinstellung abgewartet sondern es wird eine Äquilibrierungszeit von 48 Stunden bis zu 7 Tagen empfohlen, um die Zeit für einen Abbau der Prüfchemikalie zu minimieren. Je nach Zweck der Studie (z.B. Simulation von Umweltbedingungen) kann das dotierte Sediment für eine längere Dauer äquilibriert oder gealtert werden.
30. Nach dieser Äquilibrierungszeit sollten Proben zumindest aus dem Überstandswasser und dem Sediment entnommen werden, und zwar mindestens jeweils von der höchsten und einer niedrigeren Konzentration, um die Konzentration der Prüfchemikalie zu bestimmen. Diese analytischen Bestimmungen der Prüfchemikalie sollten die Berechnung der Massenbilanz und auf den gemessenen Ausgangskonzentrationen basierende Ergebnisse ermöglichen. In der Regel wird das Sediment-Wasser-System durch Probenahmen gestört oder zerstört. Daher können gewöhnlich für die Untersuchung von Sediment und Würmern nicht dieselben Replikate verwendet werden. Es müssen zusätzliche 'Analytikgefäße' in geeigneter Größe bereitgestellt werden, die auf dieselbe Weise (inklusive Testorganismen) behandelt, die aber nicht für biologische Untersuchungen verwendet werden. Die Gefäßgröße ist so zu wählen, dass die für das jeweilige Analyseverfahren erforderlichen Probemengen aufgenommen werden können. Für nähere Informationen siehe Nummer 53.
Vorversuch
31. Wenn keine Informationen über die Toxizität der Prüfchemikalie bei Lumbriculus variegatus verfügbar sind, kann die Durchführung eines Vorversuchs hilfreich sein, um den im Hauptversuch zu analysierenden Konzentrationsbereich zu ermitteln und die Bedingungen des endgültigen Tests zu optimieren. Zu diesem Zweck wird die Prüfchemikalie in einem breiten Konzentrationsbereich getestet. Die Würmer werden jeder Konzentration für eine bestimmte Zeit (z.B. 28 Tage wie im Hauptversuch) ausgesetzt, wodurch geeignete Testkonzentrationen ermittelt werden können. Replikate sind nicht erforderlich. Das Verhalten der Würmer (z.B. Meiden des Sediment), das durch die Prüfchemikalie und/oder das Sediment verursacht werden könnte, sollte im Vorversuch beobachtet und protokolliert werden. Konzentrationen über 1.000 mg/kg Sediment (Trockengewicht) sind im Vorversuch nicht zu untersuchen.
Hauptversuch
32. Im Hauptversuch mindestens fünf Konzentrationen verwenden, die beispielsweise nach dem Ergebnis des Vorversuchs (Nummer 31) ausgewählt werden, wie unter den Nummern 35, 36, 37 und 38 beschrieben.
33. Zusätzlich zu den Testreihen wird eine Kontrolle (für Replikate siehe Nummern 36, 37 und 38), die außer der Prüfchemikalie alle Testbestandteile enthält, angesetzt. Ein zur Applikation der Prüfchemikalie möglicherweise verwendeter Lösungsvermittler darf keine messbaren Wirkungen auf die Testorganismen haben; derartige Wirkungen lassen sich anhand einer zusätzlichen Kontrolle, die ausschließlich Lösungsmittel enthält, feststellen.
Versuchsplanung
34. Die Versuchsplanung regelt Zahl und Abstände der Testkonzentrationen, die Anzahl Prüfgefäße je Konzentration und die Zahl der auf die einzelnen Gefäße verteilten Würmer. Für die Verfahren zur Bestimmung der ECx-Werte und der NOEC-Werte und für die Durchführung eines Limit-Tests siehe Nummern 35, 36, 37 und 38.
35. Die für den Test verwendeten Konzentrationen müssen in jedem Fall die Wirkungskonzentration (z.B. EC50, EC25 und EC10) und den Konzentrationsbereich, in dem die Wirkung der Prüfchemikalie von Interesse ist, einschließen. Extrapolierungen weit unterhalb der niedrigsten Konzentration mit Wirkung auf die Testorganismen oder oberhalb der höchsten getesteten Konzentration sind zu vermeiden. Wenn - in Ausnahmefällen - trotzdem eine Extrapolierung vorgenommen wird, ist dies im Bericht umfassend zu begründen.
36. Wenn ECx-Werte bestimmt werden müssen, sollten mindestens fünf Konzentrationen und mindestens drei Replikate jeder Konzentration getestet werden. Um Schwankungen zwischen den Kontrollen besser abschätzen zu können, werden sechs Replikate für die Kontrolle bzw. - soweit verwendet - für die Lösungsmittelkontrolle empfohlen. Im Interesse einer angemessenen Modellierung ist es in jedem Fall ratsam, eine hinreichende Anzahl Konzentrationen zu testen. Die Konzentrationen sollten sich höchstens um den Faktor 2 unterscheiden (außer bei einer schwachen Steigung der Konzentrations-Wirkungs-Kurve). Die Anzahl Replikate pro Behandlung kann reduziert werden, wenn die Zahl der Prüfkonzentrationen mit Reaktionen im Bereich 5- 95 % erhöht wird. Eine Erhöhung der Zahl der Replikate oder eine Verkürzung der Intervalle zwischen den Prüfkonzentrationen führt eher zu engeren Konfidenzintervallen für den Test.
37. Wenn LOEC- und NOEC-Werte bestimmt werden müssen, sollten mindestens fünf Testkonzentrationen mit mindestens vier Replikaten verwendet werden. Um Schwankungen zwischen den Kontrollen besser abschätzen zu können, werden sechs Replikate für die Kontrolle bzw. - soweit verwendet - für die Lösungsmittelkontrolle empfohlen. Die einzelnen Konzentrationen sollten sich höchstens um den Faktor 2 unterscheiden. Für Informationen zur statistischen Aussagekraft von Hypothesenprüfungen im Rahmen des Ringtests dieser Prüfmethode siehe Anlage 6.
38. Wenn (beispielsweise aufgrund eines Vorversuchs) bis zu 1.000 mg/kg Sediment (Trockengewicht) keine Wirkungen erwartet werden oder wenn bereits eine einzige Testkonzentration zur Bestätigung des maßgeblichen NOEC-Wertes ausreicht, kann (unter Verwendung einer Testkonzentration und von Kontrollen) ein Limit-Test durchgeführt werden. Im letztgenannten Fall ist die gewählte Limit-Konzentration im Prüfbericht detailliert zu begründen. Sinn und Zweck der Limit-Tests ist die Prüfung mit einer einzigen Konzentration, die so hoch ist, dass die Prüfer mögliche toxischen Wirkungen der Chemikalie ausschließen können; dabei wird das Limit auf einen Konzentrationswert festgesetzt, der unter realen Bedingungen nicht erreicht werden dürfte. Empfohlen wird eine Konzentration von 1.000 mg/kg (Trockengewicht). In der Regel sind mindestens sechs Replikate pro Behandlung und Kontrollen erforderlich. Für Informationen zur statistischen Aussagekraft von Hypothesenprüfungen im Rahmen des Ringtests dieser Prüfmethode siehe Anlage 6.
Expositionsbedingungen
Testorganismen
39. Der Versuch wird mit mindestens 10 Würmern je Replikat durchgeführt, das zur Bestimmung biologischer Parameter verwendet wird. Diese Anzahl Würmer entspricht in etwa 50-100 mg feuchter Biomasse. Ausgehend von einem Trockengewichtsanteil von 17,1 % (48) ergeben sich daraus ungefähr 9-17 mg trockene Biomasse pro Gefäß. U.S. EPA (2000 (7)) empfiehlt ein Füllverhältnis von höchstens 1:50 (trockene Biomasse: TOC). Für das unter Nummer 22 beschriebene Sediment entspricht dies etwa 43 g Sediment (Trockengewicht) pro 10 Würmer bei einem TOC von 2,0 % Trockensediment. Wenn mehr als 10 Würmer pro Gefäß verwendet werden, muss die Menge des Sediments und des Überstandswassers entsprechend angepasst werden.
40. Die für eine Prüfung verwendeten Würmer sollten alle aus derselben Quelle stammen und einen ähnlichen physiologischen Zustand aufweisen (siehe Anlage 5). Es sind Würmer ähnlicher Größe auszuwählen (siehe Nummer 39). Es wird empfohlen, vor dem Test eine Teilprobe der Charge oder des Würmervorrats zu wiegen, um das Durchschnittsgewicht zu bestimmen.
41. Die für eine Prüfung zu verwendenden Würmer aus der Kultur nehmen (siehe Anlage 5). Große (adulte) Tiere, die keine Anzeichen einer kürzlich erfolgten Fragmentierung aufweisen, in Glasgefäße (z.B. Petrischalen) mit sauberem Wasser setzen und synchronisieren, wie in Anlage 5 beschrieben. Nach der Regeneration über einen Zeitraum von 10-14 Tagen unversehrte vollständige Würmer ähnlicher Größe, die nach einem leichten mechanischen Reiz aktiv schwimmen oder zu kriechen beginnen, für den Versuch auswählen. Wenn sich die Prüfbedingungen von den Kulturbedingungen unterscheiden (z.B. in Bezug auf Temperatur, Lichtverhältnisse und Überstandswasser) sollte eine Akklimatisierungsphase von beispielsweise 24 Stunden unter Testbedingungen bezüglich Temperatur, Lichtverhältnissen und Überstandswasser ausreichen, um die Anpassung der Würmer an die Prüfbedingungen zu ermöglichen. Die akklimatisierten Oligochaeten nach dem Zufallsprinzip auf die Prüfgefäße verteilen.
Fütterung
42. Da das Futter dem Sediment vor (oder während) der Applikation der Prüfchemikalie zugegeben wird, werden die Würmer während des Versuchs nicht weiter gefüttert.
Licht und Temperatur
43. Die Licht-/Dunkelphase bei Kultur und Prüfung beträgt gewöhnlich 16 Stunden (3)(7). Die Lichtintensität sollte gering gehalten werden (z.B. 100-500 lx), um auf der Oberfläche des Sediments natürliche Bedingungen zu simulieren; während der Exposition die Lichtintensität mindestens einmal messen. Die Temperatur sollte während der gesamten Prüfung 20 ± 2 °C betragen. An einem gegebenen Messtag sollte der Temperaturunterschied zwischen den Prüfgefäßen nicht mehr als ± 1 °C betragen. Die Prüfgefäße nach dem Zufallsprinzip in den Testinkubator oder auf die Testfläche stellen, um beispielsweise standortbedingte Reproduktionstrends auf ein Mindestmaß zu begrenzen.
Belüftung
44. Das Überstandswasser der Prüfgefäße vorsichtig belüften (z.B. mit 2-4 Blasen pro Sekunde); die dazu verwendete Pasteur-Pipette etwa 2 cm über der Oberfläche des Sediments ansetzen, um Perturbationen des Sediments zu minimieren. Dabei darauf achten, dass die Konzentration des gelösten Sauerstoffs nicht unter 30 % des Luftsauerstoff-Sättigungswerts (ASV) sinkt. Die Luftzufuhr kontrollieren und erforderlichenfalls an Werktagen mindestens einmal täglich korrigieren.
Messungen der Wasserqualität
45. Für das Überstandswasser sollten die folgenden Wasserqualitätsparameter gemessen werden:
| Temperatur: | Einmal wöchentlich sowie am Anfang und am Ende der Expositionsdauer bei mindestens einem Prüfgefäß pro Konzentration und pro Kontrolle; wenn möglich, auch die Temperatur im umgebenden Medium (Umgebungsluft oder Wasserbad) z.B. stündlich messen. |
| Gehalt an gelöstem Sauerstoff: | Einmal wöchentlich sowie am Anfang und am Ende der Expositionsdauer bei mindestens einem Prüfgefäß pro Konzentration und pro Kontrolle; ausgedrückt in mg/l und als Luftsauerstoff-Sättigungswert (in %). |
| Luftzufuhr: | An Werktagen mindestens einmal täglich kontrollieren und erforderlichenfalls korrigieren. |
| pH-Wert: | Einmal wöchentlich sowie am Anfang und am Ende der Expositionsdauer bei mindestens einem Prüfgefäß pro Konzentration und pro Kontrolle. |
| Gesamtwasserhärte: | Zu Beginn und am Ende der Expositionsdauer bei mindestens einem Kontrollreplikat und einem Prüfgefäß bei höchster Konzentration; ausgedrückt in mg/l CaCO3. |
| Gesamtammoniakgehalt: | Zu Beginn der Expositionsdauer bei mindestens einem Kontrollreplikat und einem Prüfgefäß für jede Konzentration und anschließend dreimal wöchentlich; ausgedrückt in mg/l NH4+ oder NH3 oder als Ammoniak-N gesamt. |
Wenn die Messung der Wasserqualitätsparameter die Entnahme umfangreicher Wasserproben aus den Gefäßen erforderlich macht, kann die Bereitstellung separater Gefäße für Wasserqualitätsmessungen sinnvoll sein, um das Wasser/Sediment-Volumenverhältnis nicht zu verändern.
Biologische Beobachtungen
46. Während der Expositionsdauer sollten die Prüfgefäße beobachtet werden, um Verhaltensunterschiede bei den Würmern (z.B. Meiden des Sediments, sichtbare Fäkalpellets auf der Sedimentoberfläche) feststellen zu können. Beobachtungen sind zu protokollieren.
47. Am Ende der Prüfung jedes Replikat untersuchen (für chemische Analysen vorgesehene zusätzliche Gefäße können hiervon ausgenommen werden). Alle Würmer nach einer geeigneten Methode möglichst unversehrt aus dem Prüfgefäß entnehmen. Eine Möglichkeit ist das Aussieben der Würmer aus dem Sediment. Dazu kann ein Edelstahlsieb mit geeigneter Maschenweite verwendet werden. Den Großteil des Überstandswasser vorsichtig abgießen und das verbleibende Sediment sowie das Restwasser zu einem Schlamm verrühren, der durch das Sieb passiert werden kann. Bei einer Maschenweite von 500 µm passieren die meisten Sedimentpartikel das Sieb sehr schnell. Das Sediment sollte jedoch sehr zügig gesiebt werden, damit die Würmer nicht in oder durch die Maschen kriechen können. Bei einer Maschenweite von 250 µm dürfte dies ausgeschlossen sein. Es ist jedoch darauf zu achten, dass möglichst wenig Sedimentpartikel auf den Maschen hängen bleiben. Der gesiebte Schlamm jedes Replikats kann noch ein zweites Mal gesiebt werden, um sicherzustellen, dass tatsächlich alle Würmer gefunden wurden. Alternativ könnte das Sediment auch aufgewärmt werden, indem es in ein Wasserbad mit einer Temperatur von 50-60 °C gestellt wird; die Würmer kriechen dann hervor und können mit einer feuerpolierten Glaspipette mit breiter Öffnung von der Sedimentoberfläche aufgenommen werden. Eine weitere Möglichkeit wäre die Herstellung eines Sedimentschlamms, der in eine flache Schale mit geeigneter Größe gegossen wird. Aus der flachen Schlammschicht können die Würmer mit einer Stahlnadel oder einer Juwelierpinzette (die dann eher als Gabel denn als Pinzette zu verwenden ist, damit die Würmer nicht verletzt werden) aufgenommen und in sauberes Wasser gesetzt werden. Nach dem Entfernen aus dem Sedimentschlamm die Würmer mit Prüfmedium abspülen und zählen.
48. Unabhängig von der verwendeten Methode müssen die Labors nachweisen, dass ihre Mitarbeiter in der Lage sind, durchschnittlich mindestens 90 % der Organismen im Sediment wiederzufinden. Beispielsweise könnte eine bestimmte Anzahl Testorganismen in das Kontrollsediment oder in die Prüfsedimente eingesetzt und nach einer Stunde die Wiederfindungsrate ermittelt werden (7).
49. Die Gesamtzahl der lebenden und toten Würmer pro Replikat sollte erfasst und bewertet werden. Würmer der folgenden Kategorien gelten als tot:
- nach einem leichten mechanischen Reiz erfolgt keine Reaktion;
- es zeigen sich Anzeichen von Zersetzung (in Verbindung mit Buchstabe a)
- keine Wiederfindung.
Als lebend gelten Würmer der folgenden Kategorien:
- große vollständige (adulte) Würmer ohne regenerierte Körperbereiche;
- vollständige Würmer mit regenerierten, leicht helleren Körperbereichen (d. h. mit einem neuen hinteren Teil und/oder einem neuen vorderen Teil);
- unvollständige Würmer (d. h. kürzlich fragmentierte Würmer mit nicht regenerierten Körperbereichen).
Diese zusätzlichen Beobachtungen sind nicht verbindlich, können aber für die weitere Auswertung der biologischen Ergebnisse hilfreich sein. (Eine hohe Anzahl Würmer der Kategorie c kann beispielsweise auf eine behandlungsbedingt verzögerte Reproduktion oder Regeneration hindeuten.) Festgestellte Unterschiede im Aussehen der behandelten Würmer und der Kontrollwürmer (z.B. Läsionen des Integuments, ödematöse Körperbereiche) sollten protokolliert werden.
50. Unmittelbar nach dem Zählen/Bewerten die in den einzelnen Replikaten gefundenen lebenden Würmer in getrocknete, vorgewogene und beschriftete Waagschalen (jeweils eine pro Replikat) setzen und mit einem Tropfen Ethanol pro Waagschale töten. Die Waagschalen bei einer Temperatur von 100 ± 5 °C über Nacht in einem Trockenschrank trocknen und nach dem Abkühlen in einem Exsikkator wiegen; anschließend das Trockengewicht der Würmer (vorzugsweise in g bis auf mindestens 4 Dezimalstellen) bestimmen.
51. Zusätzlich zum Gesamttrockengewicht kann auch das aschefreie Trockengewicht bestimmt werden, wie in (49) beschrieben, um auch anorganische Bestandteile aus dem aufgenommenen Sedimentmaterial im Verdauungstrakt der Würmer zu berücksichtigen.
52. Die Biomasse wird als gesamte Biomasse pro Replikat (juvenile und adulte Würmer) ermittelt. Tote Würmer sollten zur Bestimmung der Biomasse pro Replikat nicht berücksichtigt werden.
Überprüfung der Prüfchemikalienkonzentrationen
Probenahmen
53. Zumindest am Ende der Äquilibrierungsphase (d. h. vor Zugabe der Testorganismen) sowie bei Prüfungsende sollten zur chemischen Analytik Proben der Prüfchemikalie (und zwar zumindest in der höchsten und in einer niedrigeren Konzentration) entnommen werden. Untersucht werden sollten mindestens Proben des Sediments und des Überstandswassers. Pro Matrix und pro Behandlung sollten an jedem Probenahmetag jeweils mindestens zwei Proben entnommen werden. Eine der beiden Proben kann als Reserve aufbewahrt werden (die z.B. dann analysiert werden kann, wenn die erste Analyse einen Wert außerhalb des Bereichs von ± 20 % der nominalen Konzentration ergibt). Bei spezifischen chemischen Merkmalen, z.B. wenn ein rascher Abbau der Prüfchemikalie erwartet wird, können die Analysen je nach Expertenurteil verfeinert werden (z.B. häufigere Probenahmen oder Analyse weiterer Konzentrationen). Zwischenmessungen können dann vorgenommen werden (z.B. an Tag 7 nach Beginn der Exposition).
54. Das Überstandswasser vorsichtig abgießen oder absaugen, um das Sediment möglichst wenig zu perturbieren. Die entnommenen Probenvolumina protokollieren.
55. Nach dem Entfernen des Überstandswassers das Sediment homogenisieren und in ein geeignetes Behältnis geben. Das Gewicht der feuchten Sedimentprobe protokollieren.
56. Wenn zusätzlich die Prüfchemikalie im Porenwasser analysiert werden muss, homogenisierte und abgewogene Sedimentproben zentrifugieren, um das Porenwasser zu erhalten. Beispiel: Etwa 200 ml feuchtes Sediment in Zentrifugiergläser mit einem Füllinhalt von 250 ml geben. Danach die Proben ohne Filtration zentrifugieren, um das Porenwasser zu isolieren (z.B. 30-60 min. mit 10.000 ± 600 × g höchstens bei Testtemperatur). Nach dem Zentrifugieren Überstand abgießen oder mit einer Pipette aufnehmen und das Volumen protokollieren; dabei darauf achten, dass keine Sedimentpartikel eingebracht werden. Das Gewicht der verbliebenen Sedimentpellets notieren. Die Schätzung der Massenbilanz oder die Wiederfindung der Prüfchemikalie im Wasser-Sediment-System können erleichtert werden, wenn das Trockengewicht des Sediments an jedem Probenahmetag ermittelt wird. Bei zu kleinen Probenvolumina kann es vorkommen, dass sich die Konzentrationen im Porenwasser nicht analysieren lassen.
57. Wenn die Analyse nicht sofort durchgeführt wird, sind alle Proben in geeigneter Weise zu lagern, z.B. unter den empfohlenen Bedingungen, bei denen die jeweilige Prüfchemikalie am wenigsten abgebaut wird. (Umweltproben beispielsweise bei -18 °C im Dunkeln lagern.) Vor Beginn der Prüfung sind Informationen über geeignete Lagerbedingungen für die jeweilige Prüfchemikalie (z.B. Dauer, Temperatur, Extraktionsverfahren usw.) einzuholen.
Analysemethode
58. Da Genauigkeit, Präzision und Reproduzierbarkeit der für die Prüfchemikalie angewandten Analysemethode entscheidend für das gesamte Verfahren sind, muss experimentell überprüft werden, ob Präzision und Reproduzierbarkeit der chemischen Analyse sowie die Wiederfindung der Prüfchemikalie in Wasser- und Sedimentproben für die jeweilige Methode zumindest bei der niedrigsten und der höchsten Konzentration akzeptabel sind. Außerdem muss gewährleistet werden, dass die Prüfchemikalie in den Prüfkammern nicht in Konzentrationen oberhalb der Bestimmungsgrenze nachweisbar ist. Erforderlichenfalls sind die nominalen Konzentrationen für die Wiederfindung der Qualitätskontrolldotierungen zu korrigieren (z.B. wenn die Wiederfindungsrate außerhalb des Bereichs von 80-120 % des dotierten Volumens liegt). Alle Proben sind während des Tests stets so zu handhaben, dass Verunreinigungen und Verluste (z.B. infolge der Adsorption der Prüfchemikalie an das Probenahmegerät) auf ein Mindestmaß beschränkt werden.
59. Die Wiederfindung der Prüfchemikalie, die Bestimmungsgrenze und die Nachweisgrenze in Sediment und Wasser sollten protokolliert und angegeben werden.
Auswertung der Ergebnisse
60. Die wichtigsten statistisch auszuwertenden obligatorischen Endpunkte der Prüfung sind die Biomasse und die Gesamtzahl der Würmer pro Replikat. Optional könnten auch Reproduktion (Vermehrung der Würmer) und Wachstum (Zunahme der trockenen Biomasse) bewertet werden. In diesem Fall sollte das Trockengewicht der Würmer zu Beginn der Exposition bestimmt werden (z.B. durch Messung des Trockengewichts einer repräsentativen Teilprobe der für die Prüfung zu verwendenden Charge synchronisierter Würmer).
61. Die Mortalität ist bei dieser Prüfung zwar kein Endpunkt, sollte möglichst aber dennoch bewertet werden. Zur Bestimmung der Mortalität sollten Wärmer, die auf einen leichten mechanischen Reiz nicht reagieren oder die Anzeichen von Zersetzung zeigen, sowie nicht aufzufindende Würmer als tot gelten. Tote Würmer sollten zumindest protokolliert und bei der Auswertung der Testergebnisse berücksichtigt werden.
62. Wirkungskonzentrationen sind in mg/kg Sedimenttrockenmasse auszudrücken. Wenn die Wiederfindungsrate der im Sediment oder in Sediment und Überstandswasser zu Beginn der Exposition gemessenen Prüfchemikalie zwischen 80 und 120 % der nominalen Konzentrationen liegt, können die Wirkungskonzentrationen (ECx, NOEC, LOEC) bezogen auf die nominalen Konzentrationen ausgedrückt werden. Weicht die Wiederfindungsrate um mehr als ± 20 % von den nominalen Konzentrationen ab, so sind die Wirkungskonzentrationen (ECx, NOEC, LOEC) auf die zu Beginn der Exposition gemessenen Ausgangskonzentrationen zu beziehen, beispielsweise durch Berücksichtigung der Massenbilanz der Prüfchemikalie im Prüfsystem (siehe Nummer 30). In diesen Fällen können zusätzliche Informationen aus der Analyse der Stammlösungen und/oder der Applikationslösungen bezogen werden, um zu bestätigen, dass die Testsedimente ordnungsgemäß hergestellt wurden.
ECx
63. Die ECx-Werte der unter Nummer 60 beschriebenen Parameter werden nach geeigneten statistischen Methoden berechnet (z.B. durch Probit-Analysen, Logit- oder Weibull-Transformationen, mit der Trimmed-Spearman- Karber-Methode oder durch einfache Interpolation). (15) und (50) enthalten Leitlinien für die statistische Auswertung.
Ein ECx-Wert wird ermittelt, indem ein x % des Kontroll-Mittelwertes entsprechender Wert in die Gleichung eingefügt wird.
Zur Berechnung des EC50-Wertes oder einen anderen ECx-Wertes sind die Mittelwerte (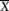 ) der jeweiligen Behandlungsgruppen einer Regressionsanalyse zu unterziehen.
) der jeweiligen Behandlungsgruppen einer Regressionsanalyse zu unterziehen.
NOEC/LOEC
64. Wenn die NOEC-/LOEC-Werte durch statistische Analyse bestimmt werden sollen, sind Ergebnisse aus den einzelnen Gefäßen erforderlich, (wobei die einzelnen Gefäße als Replikate zu betrachten sind). Es sollten geeignete statistische Methoden angewendet werden. Im Allgemeinen werden schädliche Wirkungen der Prüfchemikalie im Vergleich zur Kontrolle einer einseitigen (kleineren) Hypothesenprüfung bei p ≤ 0,05 unterzogen. In den folgenden Absätzen werden einige Beispiele gegeben. Empfehlungen für geeignete statistische Methoden finden sich unter (15) und (50).
65. Die Normalverteilung von Daten kann z.B. anhand der Kolmogorov-Smirnov-Methode (,Goodnessof-Fit'-Test), anhand einer Prüfung zur Ermittlung des Quotienten aus Spannweite und Standardabweichung (range to standard deviation ratio, R/s-Test) oder anhand des Shapiro-Wilk-Tests (zweiseitig, p ≤ 0,05) untersucht werden. Mit dem Cochran-Test, dem Levene-Test oder dem Bartlett-Test (zweiseitig, p ≤ 0,05) kann die Varianzhomogenität geprüft werden. Wenn die Bedingungen parametrischer Testverfahren (Untersuchung auf Normalverteilung und Varianzhomogenität) erfüllt sind, können eine einseitige Varianzanalyse (ANOVA) und anschließend multiple Vergleichstests durchgeführt werden. Mit paarweisen Vergleichstests (z.B. mit dem Dunnett-t-Test) oder Stepdown-Trendtests (z.B. dem Williams-Test) kann berechnet werden, ob zwischen den Kontrollen und den verschiedenen Prüfchemikalienkonzentrationen signifikante Unterschiede (p ≤ 0,05) bestehen. Andernfalls sollten nicht parametrische Methoden (z.B. ein U-Test mit Bonferroni-/Holm-Korrektur oder ein Jonckheere-Terpstra-Trendtest) verwendet werden, um den NOEC- und LOEC-Wert zu bestimmen.
Limit-Test
66. Wenn ein Limit-Test (Vergleich der Kontrolle mit einer einzigen Prüfkonzentration) durchgeführt wurde und die Voraussetzungen für parametrische Testverfahren (Normalität und Homogenität) erfüllt sind, können metrische Antworten (Gesamtzahl der Würmer und Biomasse ausgedrückt als Trockengewicht der Würmer) mit einem Student-Test (t-Test) ausgewertet werden. Sind diese Bedingungen nicht erfüllt, so kann ein t-Test für ungleiche Varianzen (Welch-Test) oder ein nichtparametrischer Test wie der Wilcoxon-Mann-Whithey-U-Test verwendet werden. Für Informationen zur statistischen Aussagekraft von Hypothesenprüfungen im Rahmen des Ringtests dieser Methode siehe Anlage 6.
67. Um signifikante Unterschiede zwischen den Kontrollen (Kontrolle und Lösungsmittelkontrolle) zu ermitteln, können die Replikate der einzelnen Kontrollen wie beim Limit-Test geprüft werden. Werden bei diesen Tests keine signifikanten Unterschiede festgestellt, können alle Replikate (Kontrolle und Lösungsmittelkontrolle) gepoolt werden. Andernfalls alle Behandlungen mit der Lösungsmittelkontrolle vergleichen.
Auswertung der Ergebnisse
68. Die Ergebnisse sind mit Vorsicht zu interpretieren, wenn von dieser Prüfmethode abgewichen wurde und wenn gemessene Testkonzentrationen nahe an der Nachweisgrenze des angewandten Analyseverfahrens liegen. Jegliche Abweichung von dieser Prüfmethode ist zu protokollieren.
Prüfbericht
69. Der Prüfbericht muss mindestens folgende Angaben enthalten:
- Prüfchemikalie:
- chemische Kenndaten (Common name, chemische Bezeichnung, Strukturformel, CAS-Nummer usw.) einschließlich Reinheitsgrad und Analyseverfahren zur Quantifizierung der Chemikalie, Herkunft der Prüfchemikalie, Identität und Konzentration etwa verwendeter Lösungsmittel;
- alle verfügbaren Informationen über die physikalische Beschaffenheit und die physikalisch-chemischen Eigenschaften, bei sie bei Beginn des Versuchs ermittelt wurden (z.B. Wasserlöslichkeit, Dampfdruck, Koeffizient der Verteilung im Boden (bzw. ggf. im Sediment), log Kow, Stabilität in Wasser usw.);
- Testspezies:
- wissenschaftlicher Name, Herkunft, etwaige Vorbehandlungen, Akklimatisierung, Kulturbedingungen usw.;
- Prüfbedingungen:
- angewandtes Testverfahren (z.B. statisch, semistatisch oder Durchfluss);
- Versuchsplan (z.B. Anzahl, Material und Größe der Prüfkammern, Wasservolumen pro Gefäß, Sedimentmasse und Volumen pro Gefäß (bei Durchflussverfahren und semistatischen Verfahren: Wasseraustauschrate), Belüftung vor und während des Versuchs, Anzahl Replikate, Anzahl Würmer je Replikat zu Beginn der Exposition, Anzahl Testkonzentrationen, Dauer der Konditionierung, Äquilibirierungs- und Expositionsdauer, Häufigkeit der Probennahmen);
- Tiefe des Sediments und des Überstandswassers;
- Methode der Vorbehandlung der Prüfchemikalie und der Dotierung/Applikation;
- nominelle Prüfkonzentrationen, Einzelheiten zur Entnahme von Proben für chemische Analysen und die Analysemethoden, mit denen die Konzentrationen der Prüfchemikalie ermittelt wurden;
- Sedimentmerkmale gemäß den Nummern 24 und 25; sonstige vorgenommene Messungen; Herstellung des formulierten Sediments;
- Aufbereitung des Prüfwassers vor Beginn des Versuchs (falls rekonstituiertes Wasser verwendet wird) und Merkmale des Wassers (Sauerstoffgehalt, pH-Wert, Leitfähigkeit, Härte und andere vorgenommene Messungen);
- Angaben zur Fütterung, einschließlich Art des Futters, Präparation, Menge und Fütterungsregime;
- Lichtintensität und Hell-/Dunkelphase(n);
- Methoden zur Ermittlung aller biologischen Parameter (z.B. Probenahme, Kontrolle, Wiegen der Testorganismen) sowie aller abiotischen Parameter (z.B. Parameter für Wasser- und Sedimentqualität);
- Volumina und/oder Gewichte aller Proben für die chemische Analyse;
- genaue Informationen über die Behandlung aller Proben für die chemische Analyse einschließlich Angaben zu Aufbereitung, Lagerung, Dotierungsverfahren, Entnahme- und Analyseverfahren (einschließlich Genauigkeit) für die jeweilige Prüfchemikalie und Wiederfindungsraten der Prüfchemikalie.
- Ergebnisse:
- Qualität des Wassers in den Prüfgefäßen (pH-Wert, Temperatur, Gehalt an gelöstem Kohlenstoff, Härte, Ammoniakkonzentrationen und andere vorgenommene Messungen);
- gesamter organischer Kohlenstoff (TOC), Verhältnis Trockenmasse/Feuchtmasse, pH-Wert des Sediments und andere vorgenommene Messungen;
- Gesamtzahl sowie - falls bestimmt - die Zahl der vollständigen und nicht mehr vollständigen Würmer in den einzelnen Prüfkammern am Ende des Versuchs;
- Trockengewicht der Würmer in den einzelnen Prüfkammern am Ende des Versuchs und - falls gemessen - Trockengewicht einer Würmer-Teilprobe zu Beginn des Versuchs;
- alle festgestellten anomalen Verhaltensweisen im Vergleich zu den Kontrollen (z.B. Meiden des Sediments, Vorkommen oder Fehlen von Fäkalpellets);
- festgestellte Todesfälle;
- Schätzwerte für toxische Endpunkte, z.B. ECx, NOEC- und/oder LOEC-Werte und die für ihre Bestimmung angewandten statistischen Methoden;
- die nominalen Prüfkonzentrationen, die gemessenen Prüfkonzentrationen und die Ergebnisse sämtlicher Analysen zur Bestimmung der Konzentration der Prüfchemikalie in den Prüfgefäßen;
- jegliche Abweichungen von den Validitätskriterien.
- Auswertung der Ergebnisse:
- Übereinstimmung der Ergebnisse mit den Validitätskriterien gemäß in Nummer 13;
- Diskussion der Ergebnisse einschließlich Auswirkungen auf das Testergebnis, die auf Abweichungen von dieser Prüfmethode zurückzuführen sind.
(1) EG (2003). Technischer Leitfaden zur Richtlinie 93/67/EWG der Kommission über die Bewertung der Risiken neu notitizierter Stoffe, zur Verordnung (EG) Nr. 1488/94 der Kommission über die Bewertung der von Altstoffen ausgehenden Risiken und zur Richtlinie 98/8/EG des Europäischen Parlaments und des Rates über das Inverkehrbringen von Biozid-Produkten; Teil I - IV. Amt für Veröffentlichungen der Europäischen Kommission), Luxemburg.
(2) OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD), Paris.
(3) ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment- associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Bd. 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
(4) ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. In ASTM International 2004 Annual Book of Standards. Bd. 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
(5) Phipps, G.L., Ankley, G.T., Benoit, D.A., und Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sedimentassociated contaminants. Environ.Toxicol. Chem. 12, 269-279.
(6) Kapitel C.27 dieses Anhangs, 'Chironomiden-Toxizitätstest in Sediment-Wasser-Systemen mit dotiertem Sediment'.
(7) U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sedimentassociated contaminants with freshwater invertebrates. Zweite Ausgabe.EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, März 2000.
(8) Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Bericht SPE 1/RM/32. Dezember 1997.
(9) Hill, I.R., Matthiessen, P., Heimbach, F. (Hrsg.), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
(10) BBA (1995). Longterm toxicity test with Chironomus riparius: Development and validation of a new test system. Hrsg. M. Streloke und H. Köpp. Berlin 1995.
(11) Riedhammer, C., u, B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
(12) ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
(13) Egeler, Ph., Meller, M., Schallnaß, H.J., und Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. in Zusammenarbeit mit R. Nagel und B. Karaoglan. Bericht an das Umweltbundesamt Berlin, FKZ 202 67.429.
(14) OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment Nr. 23.
(15) Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; 5. Fassung, März 2003; Bericht EPS 1/RM/.
(16) Nikkilä, A., Halme, A., Kukkonen, J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
(17) Baily, H.C., und Liu, D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. p. 205-215. In J.C. Eaton, P.R. Parrish, und A.C. Hendricks (Hrsg.). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
(18) Chapman, K. K., Benton, M. J., Brinkhurst, R. O., und Scheuerman, P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spikedartificial- sediment toxicity test. Environmental Toxicology. 14(2): 271-278.
(19) Meyer, J.S., Boese, C.J. und Collyard, S.A. (2002). Wholebody accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99-109.
(20) Schubauer-Berigan, M.K., Dierkes, J.R., Monson, P.D., und Ankley, G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261-1266.
(21) West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps und G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to coppercontaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
(22) Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J., und Winger, P.V. (1995). Toxicity and bioaccumulation of sedimentassociated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
(23) Kukkonen, J., und Landrum, P.F. (1994). Toxicokinetics and toxicity of sedimentassociated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
(24) Leppänen, M.T., und Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
(25) Leppänen, M.T. und Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
(26) Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., und Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch.Environ. Contam.Toxicol. 42: 292-302.
(27) Brunson, E.L., Canfield, T.J., Ingersoll, C.J., und Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using fieldcollected oligochaetes and laboratory- exposed Lumbriculus variegatus. Arch.Environ. Contam.Toxicol. 35, 191-201.
(28) Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J., und Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
(29) Rodriguez, P., und Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue und P. Mudroch (Hrsg.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
(30) Liebig, M., Egeler, Ph. Oehlmann, J., und Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
(31) Brust, K., O. Licht, V. Hultsch, D. Jungmann und R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Bd. 20, 2000-2007.
(32) Oetken, M., K.-U. Ludwichowski und R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. Im Auftrag des Umweltbundesamtes Berlin, FKZ 360 12.001, März 2000.
(33) Leppänen M.T., und Kukkonen, J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
(34) Dermott R., und Munawar, M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
(35) Drewes, C.D., und Fourtner, C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
(36) Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
(37) Kapitel C.1 dieses Anhangs, Akute Toxizität für Fische.
(38) OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Earlylife Stage Toxicity Test. OECD, Paris.
(39) Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. und Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
(40) Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel und B. Streit. (1998). Shortterm Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
(41) Egeler, Ph., Römbke, J., Knacker, Th., Franke, C., und Studinger, G. (1999). Workshop on 'Bioaccumulation: Sediment test using benthic oligochaetes', 26.-27.4.1999, Hochheim/Main, Germany. Abschlussbericht zum F +E-Vorhaben 298 67.419, Umweltbundesamt, Berlin.
(42) Suedel, B.C., und Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
(43) Naylor, C., und C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
(44) Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J., und Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
(45) Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I., und Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
(46) Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
(47) Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588-595.
(48) Brooke, L.T., Ankley, G.T., Call, D.J., und Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223-228.
(49) Mount, D.R., Dawson, T.D., und Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
(50) OECD 2006. Current approaches in the statistical analysis of ecotoxicity data: A Guidance to Application. Series on Testing and Assessment, no. 54.
(51) Liebig, M., Meller, M. und Egeler, P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten - Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Seminarunterlagen 5/2004: Statusseminar Sedimentkontakttests. 24./25. März 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Deutschland, S. 107-119.
Zusätzliche Literatur zu statistischen Verfahren:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491. Finney, D.J. (1971). Probit Analysis (3rd ed.), S. 19-76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo und R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
Sokal, R.R., und F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro, S., und Wilk, M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519.531.
| Begriffsbestimmungen | Anlage 1 |
Für diese Prüfmethode gelten folgende Definitionen:
Äquilibrierungszeitraum: die für die Verteilung der Prüfchemikalie zwischen Festphase, Porenwasser und Überstandswasser vorgesehene Zeit; die Äquilibierung erfolgt nach dem Dotieren des Sediments mit der Prüfchemikalie und vor Zugabe der Testorganismen.
Chemikalie: ein Stoff oder ein Gemisch.
Dotiertes Sediment: Sediment, dem die Prüfchemikalie hinzugefügt wurde.
ECx: Konzentration der Prüfchemikalie im Sediment, bei der es innerhalb einer gegebenen Expositionsdauer zu einer X %-Wirkung (z.B. 50 %) auf einen biologischen Parameter kommt.
Expositionsphase/Expositionsdauer: die Zeit, während der die Testorganismen der Prüfchemikalie ausgesetzt sind.
Formuliertes Sediment oder rekonstituiertes/künstliches/synthetisches Sediment: ein Gemisch aus Stoffen, das die physikalischen Bestandteile eines natürlichen Sediments simulieren soll.
Konditionierungszeitraum: die für die Stabilisierung des Mikrobenbestandteils des Sediments und die Abtrennung von beispielsweise aus Sedimentbestandteilen stammendem Ammoniak vorgesehene Zeit; die Konditionierung erfolgt vor dem Dotieren des Sediments mit der Prüfchemikalie. Gewöhnlich wird das Überstandswasser nach dem Konditionieren verworfen.
LOEC (Niedrigste messbare Konzentration mit statistisch signifikanter Wirkung): niedrigste geprüfte Konzentration einer Prüfchemikalie, bei der beobachtet wird, dass sie im Vergleich zur Kontrolle eine signifikante toxische Wirkung hat (p ≤ 0,05); allerdings müssen alle Testkonzentrationen über der LOEC eine Wirkung zeigen, die der LOEC-Wirkung gleichwertig ist oder darüber liegt. Sind diese beiden Bedingungen nicht erfüllt, ist genau zu begründen, warum die LOEC (und entsprechend die NOEC) gewählt wurde.
NOEC (Höchste messbare Konzentration ohne statistisch signifikante Wirkung): Prüfkonzentration unmittelbar unterhalb der LOEC, die im Vergleich zur Kontrolle während einer bestimmten Expositionsdauer keine statistisch signifikante Wirkung (p < 0,05) zeigt.
Octanol/Wasser-Verteilungskoeffizient (Kow; manchmal auch ausgedrückt als Pow): bezeichnet das Verhältnis der Löslichkeit einer Chemikalie in n-Octanol und Wasser im Gleichgewicht und zeigt die Fettlöslichkeit einer Chemikalie an (Kapitel A.24 in diesem Anhang). Kow oder der Logarithmus von Kow (log Kow) gilt als Maß für das Potenzial einer Chemikalie zur Anreicherung in aquatischen Organismen.
Organischer Kohlenstoff/Wasser-Verteilungskoeffiozient (Koc): bezeichnet das Verhältnis zwischen der Konzentration der Chemikalie im/am organischen Kohlenstoff im Sediment und der Konzentration der Chemikalie im Wasser im Gleichgewicht.
Porenwasser oder Interstitialwasser: Wasser in den Hohlräumen zwischen Sediment- oder Bodenpartikeln.
Prüfchemikalie: ein beliebiger Stoff oder ein beliebiges Gemisch, der bzw. das nach dieser Methode geprüft wird.
Überstandswasser: das im Prüfgefäß über dem Sediment stehende Wasser.
| Zusammensetzung des empfohlenen rekonstituierten Wassers (übernommen aus Kapitel C.1 dieses Anhangs (1)) | Anlage 2 |
- Calciumchloridlösung
11,76 g CaCl2 2H2O in entionisiertem Wasser lösen; anschließend mit entionisiertem Wasser bis auf 1 Liter auffüllen.
- Magnesiumsulfatlösung
4,93 g MgSO4 7H2O in entionisiertem Wasser lösen; anschließend mit entionisiertem Wasser bis auf 1 Liter auffüllen.
- Natriumbicarbonatlösung
2,59 g NaHCO3 in entionisiertem Wasser lösen; anschließend mit entionisiertem Wasser bis auf 1 Liter auffüllen.
- Kaliumchloridlösung
0,23 g KCl in entionisiertem Wasser lösen; anschließend mit entionisiertem Wasser bis auf 1 Liter auffüllen.
Alle Chemikalien müssen Analysequalität haben.
Die Leitfähigkeit des destillierten oder entionisierten Wassers darf höchstens 10 µ Scm- 1 betragen.
Von den Lösungen a bis d jeweils 25 ml mischen und das Gesamtvolumen mit entionisiertem Wasser bis auf 1 Liter auffüllen. Die Summe der Ca- und Mg-Ionen in diesen Lösungen beträgt 2,5 mmol/l.
Das Verhältnis der Ca- zu den Mg-Ionen beträgt 4:1 und das der Na- zu den K-Ionen 10:1. Die Gesamtalkalinität KS4,3 dieser Lösung beträgt 0,8 mmol/l.
Das Wasser bis zur Sauerstoffsättigung belüften und anschließend ohne weitere Belüftung bis zur Verwendung zwei Tage lagern.
(1) Kapitel C.1 dieses Anhangs, Akute Toxizität für Fische.
| Physikalisch-Chemische Eigenschaften eines geeigneten Testwassers | Anlage 3 |
| Bestandteil | Konzentrationen |
| Partikel | < 20 mg/l |
| Gesamtgehalt an organischem Kohlenstoff | < 2 µg/l |
| Nichtionisierter Ammoniak | < 1 µg/l |
| Restchlor | < 10 µg/l |
| Gesamtgehalt an phosphororganischen Pestiziden | < 50 ng/l |
| Gesamtgehalt an chlororganischen Pestiziden plus polychlorierten Bipheny- len | < 50 ng/l |
| Gesamtgehalt an organischem Chlor | < 25 ng/l |
| (übernommen aus OECD (1992) (1)) | |
(1) OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Earlylife Stage Toxicity Test. OECD, Paris.
| Empfohlenes künstliches Sediment - Empfehlungen für Herstellung und Lagerung | Anlage 4 |
Bestandteile des Sediments
| Bestandteil | Beschreibung | in % des Sediment- trockengewichts |
| Torf | Sphagnum-Torf, Zersetzungsgrad: 'mittel', luftgetrocknet, ohne sichtbare Pflanzenreste, fein gemahlen (Partikelgröße ≤ 0,5 mm). | 5 ± 0,5 |
| Quarzsand | Korngröße: ≤ 2 mm, aber > 50 % der Partikel sollten eine Größe im Bereich 50-200 µm haben. | 75-76 |
| Kaolin-Ton | Kaolinitgehalt ≥ 30 % | 20 ± 1 |
| Futter | z.B. Nesselpulver (Folia urticae), Blätter von Urtica dioica (Brennnessel), fein gemahlen (Partikelgröße ≤ 0,5 mm); nach Arzneimittelstandards, zum menschlichen Verzehr geeignet; zusätzlich zum trockenen Sediment | 0,4-0,5 % |
| Organischer Kohlenstoff | eingestellt durch Zugabe von Torf und Sand | 2 ± 0.5 |
| Calciumcarbonat | CaCO3, in Pulverform, chemisch rein, zusätzlich zum trockenen Sediment | 0,05-1 |
| Entionisiertes Wasser | Leitfähigkeit ≤ 10 µS/cm, zusätzlich zum trockenen Sediment | 30-50 |
Hinweis: Ist mit hohen Ammoniakkonzentrationen zu rechnen (wenn beispielsweise bekannt ist, dass die Prüfchemikalie die Nitrifikation hemmt), kann es sinnvoll sein, 50 % des stickstoffreichen Nesselpulvers durch Cellulose (z.B. α-Cellulosepulver, chemisch rein, Partikelgröße ≤ 0,5 mm (1) (2)) zu ersetzen.
Herstellung
Den Torf lufttrocknen und zu feinem Pulver vermahlen. Mithilfe eines leistungsstarken Homogenisierapparats eine Suspension der erforderlichen Menge Torfpulver in entionisiertem Wasser herstellen. Den pH-Wert dieser Suspension mit CaCO3 auf 5,5 ± 0,5 einstellen. Die Suspension bei 20 ± 2 °C für mindestens zwei Tage unter sanftem Rühren konditionieren, um den pH-Wert zu stabilisieren und einen stabilen mikrobiellen Anteil zu sichern. Den pH-Wert erneut messen; er sollte bei 6,0 ± 0,5 liegen. Anschließend die anderen Bestandteile (Sand und Kaolin-Ton) sowie entionisiertes Wasser zur Torf-Suspension hinzugeben und zu einem homogenen Sediment vermischen, dessen Wassergehalt 30-50 % des Trockengewichts des Sediments ausmachen sollte. Den pH-Wert der fertigen Mischung erneut messen und erforderlichenfalls mit CaCO3 auf 6,5-7,5 einstellen. Ist jedoch mit Ammoniakbildung zu rechnen, kann es sinnvoll sein, den pH-Wert des Sediments unter 7,0 zu halten (z.B. zwischen 6,0 und 6,5). Sedimentproben entnehmen, um das Trockengewicht und den Gehalt an organischem Kohlenstoff zu bestimmen. Ist mit Ammoniakbildung zu rechnen, kann das formulierte Sediment sieben Tage lang unter Testbedingungen konditioniert werden (z.B. Sediment/Wasser-Verhältnis von 1:4, Tiefe der Sedimentschicht wie in den Prüfgefäßen), bevor es mit der Prüfchemikalie dotiert wird, d. h. das Sediment ist mit belüftetem Wasser aufzufüllen. Nach dieser Konditionierung das Überstandswasser entfernen und verwerfen. Anschließend den dotierten Quarzsand mit dem Sediment in den verschiedenen Konzentrationen mischen; das Sediment auf die Replikatgefäße verteilen und mit Testwasser auffüllen. Die Gefäße unter den Testbedingungen inkubieren. Hier beginnt die Äquilibrierzeit. Das Überstandswasser sollte belüftet werden.
Das gewählte Futter hingegeben, bevor oder während das Sediment mit der Prüfchemikalie dotiert wird. Es kann anfänglich mit der Torfsuspension gemischt werden (s. o.). Eine allzu starke Verschlechterung der Futterqualität vor dem Einsetzen der Testorganismen (z.B. bei langer Äquilibrierzeit) kann vermieden werden, indem der Zeitraum zwischen der Futterzugabe und dem Beginn der Exposition so kurz wie möglich gehalten wird. Um sicherzustellen, dass das Futter mit der Prüfchemikalie dotiert wird, sollte das Futter spätestens am Tag der Dotierung mit dem Sediment vermischt werden.
Lagerung
Die trockenen Bestandteile des künstlichen Sediments können an einem trockenen und kühlen Ort oder bei Raumtemperatur gelagert werden. Aufbereitetes und mit der Prüfchemikalie dotiertes Sediment ist umgehend im Versuch zu verwenden. Proben des dotierten Sediments können bis zur Analyse unter den für die jeweilige Prüfchemikalie empfohlenen Testbedingungen gelagert werden.
(1) Egeler, Ph., Meller, M., Schallnaß, H.J., und Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In Zusammenarbeit mit R. Nagel und B. Karaoglan. Bericht an das Umweltbundesamt Berlin, FKZ 202 67.429, R&D Nr. 202 67.429.
(2) Liebig, M., Meller, M. und Egeler, P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten - Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Seminarunterlagen 5/2004: Statusseminar Sedimentkontakttests. 24./25. März 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Deutschland, S. 107-119.
| Kulturmethoden für Lumbriculus variegatus | Anlage 5 |
Der Glanzwurm Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta, lebt in Süßwassersedimenten und wird häufig in Ökotoxizitätsprüfungen verwendet.
Er kann unter Laborbedingungen kultiviert werden.
Im Folgenden werden die Kulturmethoden beschrieben.
Kulturmethoden
Die Kulturbedingungen für Lumbriculus variegatus sind in Phipps et al. (1993) (1), Brunson et al. (1998) (2), ASTM (2000) (3) und U.S. EPA (2000) (4) eingehend beschrieben und werden nachstehend kurz zusammengefasst. Ein großer Vorteil von L. variegatus ist seine rasche Vermehrung, die dazu führt, dass die Biomasse in laborgezogenen Populationen schnell zunimmt (z.B. (1)(3)(4)(5)).
Die Würmer können in großen Aquarien (57-80 l) bei 23 °C mit Hell-/Dunkelphasen von 16 L: 8 D (100 - 1.000 lx) in täglich erneuertem natürlichen Wasser (45-50 l pro Aquarium) gezüchtet werden. Das Substrat wird hergestellt, indem ungebleichte braune Papiertücher in Streifen geschnitten und einige Sekunden mit Kulturwasser befeuchtet werden, so dass ein Substrat aus kleinen Papierteilchen entsteht, das unverzüglich in auf dem Boden des Lumbriculus-Zuchtaquariums verteilt werden kann; es kann aber auch in entionisiertem Wasser bis zur späteren Verwendung gefriergelagert werden. Im Aquarium hält sich das frische Substrat für etwa zwei Monate.
Jede Wurmkultur wird mit 500-1.000 Würmern angesetzt, die unter Wasseraustausch- oder -durchflussbedingungen dreimal wöchentlich mit einer 10 ml-Suspension aus 6 g Forellen-Starterfutter gefüttert werden. Um Bakterien- und Pilzwachstum entgegenzuwirken, werden statische und semistatische Kulturen seltener gefüttert.
Unter diesen Bedingungen verdoppelt sich die Zahl der Tiere in der Kultur gewöhnlich in 10-14 Tagen.
Alternativ kann Lumbriculus variegatus auch in einem System bestehend aus einer 1-2 cm tiefen Schicht Quarzsand (wie im künstlichen Sediment verwendet) und rekonstituiertem Wasser kultiviert werden. Als Kulturgefäße kommen 12-20 cm hohe Glas- oder Edelstahlbehältnisse in Frage. Der Wasserkörper ist mit einer Pasteur-Pipette, die etwa 2 cm über der Sedimentoberfläche positioniert wird, sanft zu belüften (z.B. 2 Blasen pro Sekunde). Um eine Akkumulation z.B. von Ammoniak zu vermeiden, ist das Überstandswasser über ein Durchflusssystem zu erneuern oder mindestens zweimal wöchentlich manuell auszutauschen. Die Oligochaeten können bei Raumtemperatur mit Hell-/Dunkelphasen von 16 Stunden (Lichtintensität 100-1.000 lx) bzw. 8 Stunden gehalten werden. In der semistatischen Kultur (Wasseraustausch einmal pro Woche) werden die Würmer zweimal wöchentlich mit Tetra Min gefüttert (z.B. 0,6-0,8 mg pro cm2 Sedimentoberfläche); das Futter kann als Suspension aus 50 mg Tetra Min pro ml entionisiertem Wasser verabreicht werden.
Lumbriculus variegatus können beispielsweise durch Sieben des Substrats durch ein feinmaschiges Sieb in ein separates Becherglas oder durch Aufnahme (mit einer feuerpolierten Glaspipette mit weiter Öffnung von ca. 5 mm Durchmesser) aus den Kulturen entnommen werden und in ein Becherglas eingesetzt werden. Wenn gleichzeitig auch das Substrat in das Becherglas gegeben wird, dieses würmer- und substrathaltige Glas über Nacht bei kontinuierlichem Wasserdurchfluss ruhen lassen, um das Substrat auszuspülen; die Würmer bleiben auf dem Gefäßboden zurück. Anschließend können die Würmer in neu aufbereitete Kulturgefäße gesetzt oder im Test weiterverwendet werden, wie unter (3) und (4) oder in den folgenden Absätzen beschrieben.
Ein Punkt, der bei der Verwendung von L. variegatus in Sedimenttests kritisch zu bewerten ist, betrifft die Reproduktionsform der Art (Architomie oder Morphallaxis, z.B. (6)). Diese geschlechtslose Vermehrung führt zur Entstehung von zwei Fragmenten, die so lange keine Nahrung aufnehmen, bis sich das Kopf- bzw. das Schwanzende regeneriert hat (z.B. (7)(8)), d. h. es kommt nicht zur kontinuierlichen Exposition durch Aufnahme kontaminierten Sediments.
Folglich sollte eine Synchronisierung vorgenommen werden, um eine unkontrollierte Reproduktion und Regeneration und sich daraus ergebende stark variierende Testergebnisse auf ein Mindestmaß zu begrenzen. Derartige Variationen können auftreten, wenn einzelne Exemplare fragmentiert haben und über einen bestimmten Zeitraum keine Nahrung aufnehmen und der Prüfchemikalie deshalb weniger stark ausgesetzt sind als andere Exemplare, bei denen es während des Tests nicht zur Fragmentierung kam (9)(10)(11). 10-14 Tage vor Beginn der Exposition sollten die Würmer künstlich zerteilt werden (Synchronisierung). Für die Synchronisierung werden große (adulte) Würmer ausgewählt, die vorzugsweise keine Anzeichen einer kürzlich erfolgten Morphallaxis aufweisen sollten. Diese Würmer können auf einen Glasträger in einen Tropfen Kulturwasser gesetzt und in der Körpermitte mit einem Skalpell zerteilt werden. Dabei ist darauf zu achten, dass die hinteren Enden ähnlich groß sind. Es bleibt abzuwarten, bis die hinteren Enden in einem Kulturgefäß, das dasselbe Substrat wie die Testkultur und rekonstituiertes Wasser enthält, neue Köpfe bilden. Erst dann kann mit der Exposition begonnen werden. Die Kopfteile gelten dann als regeneriert, wenn die synchronisierten Würmer sich im Substrat eingraben. (Ob sich Kopfteile regeneriert haben, kann auch durch Sichtprüfung einer repräsentativen Teilprobe unter einem binokularen Mikroskop festgestellt werden.) Danach kann davon ausgegangen werden, dass sich die Testorganismen in einem physiologisch ähnlichen Zustand befinden. Wenn sich die synchronisierten Würmern dann während des Versuchs durch Morphallaxis reproduzieren, bedeutet dies, dass praktisch alle Tiere dem dotierten Sediment gleichermaßen ausgesetzt waren. Die synchronisierten Würmer sollten einmal gefüttert werden, sobald sie beginnen, sich in das Substrat einzugraben, oder 7 Tage nach dem Zerteilen. Das Fütterungsregime sollte jedoch in etwa das gleiche sein wie bei regulären Kulturen; es kann jedoch sinnvoll sein, dasselbe Futter zu verwenden wie im eigentlichen Test. Die Würmer sollten bei Testtemperatur gehalten werden (d. h. bei 20 ± 2 °C). Nach der Regeneration werden unversehrte, intakte Würmer, die nach einem leichten mechanischen Reiz aktiv schwimmen oder zu kriechen beginnen, für die Prüfung verwendet. Verletzungen und Autotomie sind zu vermeiden, indem zum Hantieren der Würmer beispielsweise Pipetten mit feuerpolierten Kanten oder Edelstahl-Zahnstocher verwendet werden.
Bezugsquellen für Starterkulturen von Lumbriculus variegatus (Anschriften in den USA übernommen aus (4))
| Europa | |
| ECT Oekotoxikologie GmbH Böttgerstr. 2-14 D-65439 Flörsheim/Main Deutschland | Bayer Crop Science AG Development - Ecotoxicology Alfred-Nobel-Str. 50 D-40789 Monheim Deutschland |
| University of Joensuu Laboratory of Aquatic Toxicology Dept. of Biology Yliopistokatu 7, P.O. Box 111 FIN-80101 Joensuu Finnland | Dresden University of Technology Institut für Hydrobiologie Fakultät für Forst-, Geo- und Hydrowissenschaften Mommsenstr. 13 D-01062 Dresden Deutschland |
| C.N.R.- I.R.S.A. Italian National Research Council Water Research Institute Via Mornera 25 I-20047 Brugherio MI | |
| USA. | |
| U.S. Environmental Protection Agency Mid-Continent Ecological Division 6201 Congdon Boulevard Duluth, MN 55804 | Michigan State University Department of Fisheries and Wildlife No. 13 Natural Resources Building East Lansing, MI 48824-1222 |
| U.S. Environmental Protection Agency Environmental Monitoring System Laboratory 26 W. Martin Luther Dr. Cincinnati, OH 45244 | Wright State University Institute for Environmental Quality Dayton, OH 45435 |
| Columbia Environmental Research center U.S. Geological Survey 4200 New Haven Road Columbia, MO 65201 | Great Lakes Environmental Research Laboratory, NOAA 2205 Commonwealth Boulevard Ann Arbor, MI 48105-1593 |
(1) Phipps, G.L., Ankley, G.T., Benoit, D.A., und Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sedimentassociated contaminants. Environ.Toxicol. Chem. 12, 269-279.
(2) Brunson, E.L., Canfield, T.J., Ingersoll, C.J., und Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using fieldcollected oligochaetes and laboratory- exposed Lumbriculus variegatus. Arch.Environ. Contam.Toxicol. 35, 191-201.
(3) ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment- associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology;Pesticides. ASTM International, West Conshohocken, PA.
(4) U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sedimentassociated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, März 2000.
(5) Kukkonen, J., und Landrum, P.F. (1994). Toxicokinetics and toxicity of sedimentassociated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
(6) Drewes, C.D., und Fourtner, C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
(7) Leppänen, M.T. und Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
(8) Leppänen, M.T. und Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
(9) Brust, K., O. Licht, V. Hultsch, D. Jungmann und R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Bd. 20, 2000-2007.
(10) Oetken, M., K.-U. Ludwichowski und R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. Im Auftrag des Umweltbundesamts Berlin, FKZ 360 12.001, März 2000.
(11) Leppänen M.T., und Kukkonen, J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
| Zusammenfassung der Ergebnisse des Ringtests | Anlage 6 |
'Sedimenttoxizitätsprüfung mit Lumbriculus variegatus'
Tabelle 1: Ergebnisse der einzelnen Ringtestdurchläufe: durchschnittliche Anzahl Würmer in den Kontrollen und in den Lösungsmittelkontrollen bei Testende; SD = Standardabweichung; CV = Variationskoeffizient
| Durchschnittliche Anzahl Würmer in den Kontrollen | SD | CV (%) | N | Durchschnittliche Anzahl Würmer in den Lösungsmittel- kontrollen | SD | CV (%) | N | |
| 32,3 | 7,37 | 22,80 | 3 | 39,0 | 3,61 | 9,25 | 3 | |
| 40,8 | 6,55 | 16,05 | 6 | 36,0 | 5,29 | 14,70 | 3 | |
| 41,5 | 3,54 | 8,52 | 2 | 38,5 | 7,05 | 18,31 | 4 | |
| 16,3 | 5,99 | 36,67 | 6 | 30,8 | 6,70 | 21,80 | 4 | |
| 24,3 | 10,69 | 43,94 | 3 | 26,3 | 3,06 | 11,60 | 3 | |
| 28,5 | 8,29 | 29,08 | 4 | 30,7 | 1,15 | 3,77 | 3 | |
| 28,3 | 3,72 | 13,14 | 6 | 28,8 | 2,56 | 8,89 | 6 | |
| 25,3 | 5,51 | 21,74 | 3 | 27,7 | 1,53 | 5,52 | 3 | |
| 23,8 | 2,99 | 12,57 | 4 | 21,3 | 1,71 | 8,04 | 4 | |
| 36,8 | 8,80 | 23,88 | 6 | 35,0 | 4,20 | 11,99 | 6 | |
| 33,0 | 3,58 | 10,84 | 6 | 33,5 | 1,73 | 5,17 | 4 | |
| 20,7 | 2,73 | 13,22 | 6 | 15,0 | 6,68 | 44,56 | 4 | |
| 42,0 | 7,07 | 16,84 | 6 | 43,7 | 0,58 | 1,32 | 3 | |
| 18,2 | 3,60 | 19,82 | 6 | 21,7 | 4,04 | 18,65 | 3 | |
| 32,0 | 3,95 | 12,34 | 6 | 31,3 | 4,79 | 15,32 | 4 | |
| Durchschnitts- werte der beteiligten Labors | 29,59 | 20,10 | 30,61 | 13,26 | ||||
| SD | 8,32 | 10,03 | 7,57 | 10,48 | ||||
| N | 15 | 15 | ||||||
| Min | 16,3 | 15,0 | ||||||
| Max | 42,0 | 43,7 | ||||||
| CV (%) | 28,1 | 24,7 |
Tabelle 2: Ergebnisse der einzelnen Ringtestdurchläufe: durchschnittliches Gesamttrockengewicht der Würmer pro Replikat in den Kontrollen und in den Lösungsmittelkontrollen bei Testende; SD = Standardabweichung; CV = Variationskoeffizient
| Gesamttrocken- gewicht der Würmer pro Replikat (Kontrollen) | SD | CV (%) | N | Gesamttrockengewicht derWürmer pro Replikat (Lösungs- mittelkontrollen) | SD | CV (%) | N | |
| 24,72 | 6,31 | 25,51 | 3 | 27,35 | 4,08 | 14,93 | 3 | |
| 30,17 | 2,04 | 6,75 | 6 | 33,83 | 10,40 | 30,73 | 3 | |
| 23,65 | 3,61 | 15,25 | 2 | 28,78 | 4,68 | 16,28 | 4 | |
| 12,92 | 6,83 | 52,91 | 6 | 24,90 | 6,84 | 27,47 | 4 | |
| 21,31 | 4,17 | 19,57 | 3 | 25,87 | 5,30 | 20,49 | 3 | |
| 22,99 | 4,86 | 21,16 | 4 | 24,64 | 5,09 | 20,67 | 3 | |
| 18,91 | 1,91 | 10,09 | 6 | 19,89 | 1,77 | 8,89 | 6 | |
| 24,13 | 1,63 | 6,75 | 3 | 25,83 | 2,17 | 8,41 | 3 | |
| 22,15 | 3,18 | 14,34 | 4 | 22,80 | 2,60 | 11,40 | 4 | |
| 35,20 | 8,12 | 23,07 | 6 | 31,42 | 8,45 | 26,90 | 6 | |
| 41,28 | 5,79 | 14,02 | 6 | 41,42 | 4,37 | 10,55 | 4 | |
| 15,17 | 5,78 | 38,09 | 6 | 10,50 | 3,42 | 32,53 | 4 | |
| 35,69 | 8,55 | 23,94 | 6 | 38,22 | 1,23 | 3,21 | 3 | |
| 19,57 | 5,21 | 26,65 | 6 | 28,58 | 6,23 | 21,81 | 3 | |
| 29,40 | 2,16 | 7,34 | 6 | 31,15 | 2,70 | 8,67 | 4 | |
| Durchschnitts- werte der beteiligten Labors | 25,15 | 20,36 | 27,68 | 17,53 | ||||
| SD | 7,87 | 12,56 | 7,41 | 9,10 | ||||
| N | 15 | 15 | ||||||
| Min | 12,9 | 10,5 | ||||||
| Max | 41,3 | 41,4 | ||||||
| CV (%) | 31,3 | 26,8 |
Tabelle 3: PCP-Toxizität: Zusammenfassung der Endpunkte im Ringtest; Durchschnittswerte der beteiligten Labors für EC50, NOEC und LOEC; SD = Standardabweichung; CV = Variationskoeffizient
| Biologischer Parameter | Durchschnittswert der beteiligten Labors (mg/kg) | min | max | Faktor der beteiligten Labors | SD | CV (%) | Geometr. Mittelwert (mg/kg) | |
| Gesamtzahl der Würmer | EC50 | 23,0 | 4,0 | 37,9 | 9,4 | 10,7 | 46,3 | 19,9 |
| NOEC | 9,9 | 2,1 | 22,7 | 10,7 | 7,2 | 72,3 | 7,6 | |
| LOEC | 27,9 | 4,7 | 66,7 | 14,2 | 19,4 | 69,4 | 20,9 | |
| MDD(%) | 22,5 | 7,1 | 39,1 | |||||
| Gesamt-Trockengewicht Würmer | EC50 | 20,4 | 7,3 | 39,9 | 5,5 | 9,1 | 44,5 | 18,2 |
| NOEC | 9,3 | 2,1 | 20,0 | 9,4 | 6,6 | 70,4 | 7,4 | |
| LOEC | 25,7 | 2,1 | 50,0 | 23,5 | 16,8 | 65,5 | 19,4 | |
| MDD(%) | 24,8 | 10,9 | 44,7 | |||||
| Mortalität/ Überlebensrate | LC50 | 25,3 | 6,5 | 37,2 | 5,7 | 9,4 | 37,4 | 23,1 |
| NOEC | 16,5 | 2,1 | 40,0 | 18,8 | 10,3 | 62,4 | 12,8 | |
| LOEC | 39,1 | 4,7 | 66,7 | 14,2 | 18,1 | 46,2 | 32,6 | |
| Reproduktion (Zunahme der Anzahl Würmer pro Replikat) | EC50 | 20,0 | 6,7 | 28,9 | 4,3 | 7,6 | 37,9 | 18,3 |
| NOEC | 7,9 | 2,1 | 20,0 | 9,4 | 5,2 | 66,0 | 6,4 | |
| LOEC | 22,5 | 2,1 | 50,0 | 23,5 | 15,4 | 68,6 | 16,0 | |
| MDD(%) | 29,7 | 13,9 | 47,9 | |||||
| Wachstum (Zunahme der Biomasse pro Replikat) | EC50 | 15,3 | 5,7 | 29,9 | 5,2 | 7,1 | 46,5 | 13,7 |
| NOEC | 8,7 | 2,1 | 20,0 | 9,4 | 6,0 | 68,1 | 6,9 | |
| LOEC | 24,0 | 2,1 | 50,0 | 23,5 | 15,7 | 65,5 | 17,3 | |
| MDD(%) | 32,2 | 13,6 | 65,2 | |||||
| MDD: Minimum Detectable Difference (kleinster nachweisbarer Unterschied) bei den Kontrollwerten während der Hypothesenprüfung; wird als Maßstab für die statistische Aussagekraft verwendet. | ||||||||
Egeler, Ph., Meller, M., Schallnaß, H.J. und Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test (Validierung eines endobenthischen Sedimenttests durch einen internationalen Ringtest). In Zusammenarbeit mit R. Nagel und B. Karaoglan. Bericht an das Umweltbundesamt Berlin, FKZ 202 67.429.
C.36 Reproduktionstest mit Raubmilben (Hypoaspis (Geolaelaps) Aculeifer) in Bodenproben 16 23
Die vollständige Beschreibung dieser Prüfmethode wurde gestrichen.
Die gleichwertige internationale Prüfmethode ist in Teil 0 Tabelle 3 aufgeführt.
| Einleitung
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 226 (2008). Sie wird zur Bewertung der Wirkung von im Boden befindlichen Chemikalien auf die Reproduktionsleistung der Bodenmilbenart Hypoaspis (Geolaelaps) aculeifer CANESTRINI (Acari: Laelapidae) verwendet und ermöglicht die Bestimmung der Hemmung der spezifischen Populationswachstumsrate (1,2). Als Reproduktionsleistung wird hier die Anzahl der juvenilen Tiere am Ende des Versuchs bezeichnet. H. aculeifer stellt eine zusätzliche trophische Ebene dar für die Art, für die Prüfmethoden bereits verfügbar sind. Ein Reproduktionstest ohne Unterscheidung und Quantifizierung der verschiedenen Stufen des Reproduktionszyklus wird für den Zweck dieser Prüfmethode als angemessen betrachtet. Für Chemikalien mit einem anderen Expositionsszenarium als die Exposition über den Boden könnten andere Ansätze geeignet sein (3). 2. Hypoaspis (Geolaelaps) aculeifer wird als relevanter Vertreter der Bodenfauna im Allgemeinen und der Raubmilben im Besonderen betrachtet. Die Art kommt weltweit vor (5) und ist leicht zu beschaffen und im Labor zu züchten. Anlage 7 enthält eine Zusammenfassung zur Biologie von H. aculeifer. Für Hintergrundinformationen zur Ökologie der Milbenart und zu ihrer Verwendung in Ökotoxizitätsprüfungen siehe (4), (5), (6), (7), (8), (9), (10), (11) und (12). 3. Adulte weibliche Tiere werden verschiedenen Konzentrationen der in den Boden gemischten Prüfchemikalie ausgesetzt. Der Versuch wird mit 10 adulten Weibchen pro Replikatgefäß begonnen. Männliche Tiere werden im Test nicht verwendet, weil sich gezeigt hat, dass sich weibliche Tiere unmittelbar oder kurz nachdem sie dem Deutonymphenstadium entwachsen sind, paaren, wenn männliche Tiere verfügbar sind. Außerdem würde die Einbeziehung männlicher Tiere den Test so verzögern, dass eine (schwierige) Unterscheidung der Altersstufen erforderlich wäre. Daher ist die Paarung der Tiere nicht Teil dieses Tests. Die weiblichen Tiere werden 28-35 Tage nach Beginn der Eiablage in der Synchronisierung in den Test eingesetzt (siehe Anlage 4); zu diesem Zeitpunkt kann nämlich davon ausgegangen werden, dass die weiblichen Tiere sich bereits gepaart und die Präovipositionsperiode bereits durchlaufen haben. Bei einer Temperatur von 20 °C endet der Test an Tag 14 nach dem Einsetzen der weiblichen Tiere (Tag 0); zu diesem Zeitpunkt können die ersten juvenilen Tiere der Kontrollgruppe bereits das Deutonymphen-Stadium durchlaufen haben (siehe Anlage 4). Als wichtigste Messgrößen werden die Zahl der juvenilen Tiere pro Prüfgefäß und zusätzlich die Zahl der überlebenden weiblichen Tiere bestimmt. Die Reproduktionsleistung der Milben, die der Prüfchemikalie ausgesetzt waren, wird mit der Reproduktionsleistung der Kontrollen verglichen, um je nach Prüfprotokoll (siehe Nummer 29) den ECx-Wert (z.B. EC10 oder EC50) oder die höchste messbare Konzentration ohne statistisch signifikante Wirkung (NOEC - Begriffsbestimmungen siehe Anlage 1) zu ermitteln. Anlage 8 enthält einen Überblick über das Prüfprotokoll. Informationen zur Prüfchemikalie 4. Die Wasserlöslichkeit, der log Kow-Wert, der Boden/Wasser-Verteilungskoeffizient und der Dampfdruck der Prüfchemikalie sollten möglichst bekannt sein. Wünschenswert sind zudem Informationen über den Verbleib der Chemikalie im Boden (z.B. biotischer und abiotischer Abbau). 5. Diese Prüfmethode kann für wasserlösliche oder nicht wasserlösliche Chemikalien verwendet werden. Allerdings ist die Prüfchemikalie je nach Chemikalientyp unterschiedlich einzubringen. Für flüchtige Chemikalien (d. h. für Chemikalien, bei denen die Henry-Konstante oder der Luft-Wasser-Verteilungskoeffizient größer als eins ist) oder für Chemikalien, bei denen der Dampfdruck bei 25 °C mehr als 0,0133 Pa beträgt, ist die Prüfmethode nicht geeignet. 6. Damit ein Testergebnis als gültig gewertet werden kann, müssen die unbehandelten Kontrollen die folgenden Kriterien erfüllen:
7. Der ECx-Wert und/oder die NOEC einer Referenzchemikalie sind zu ermitteln, um angemessene Bedingungen für den Labortest sicherzustellen und um gewährleisten zu können, dass sich die Reaktion der Testorganismen im Laufe der Zeit nicht geändert hat. Dimethoat (CAS 60-51-5) ist eine geeignete Referenzchemikalie, die sich nachweislich auf die Populationsgröße auswirkt (4). Alternativ kann als Referenzchemikalie auch Borsäure (CAS 10043-35-3) verwendet werden, für die allerdings weniger Erfahrungen vorliegen. Zwei Versuchspläne kommen in Betracht:
Prüfgefäße und Apparatur 8. Für den Versuch sollten Prüfgefäße aus Glas oder einem sonstigen chemisch inerten Material mit einem Durchmesser von 3-5 cm (bis zu einer Höhe von ≥ 1,5 cm mit Bodensubstrat befüllt) und mit dicht schließendem Deckel verwendet werden. Vorzugsweise sollten die Gefäße einen Schraubverschluss besitzen, da diese Gefäße zweimal wöchentlich belüftet werden können. Alternativ können Abdeckungen verwendet werden, die einen direkten Gasaustausch zwischen dem Substrat und der Atmosphäre zulassen (z.B. Gaze). Da während des gesamten Tests ein hinreichend hoher Feuchtegehalt gewährleistet sein muss, muss das Gewicht der einzelnen Prüfgefäße im Laufe des Tests kontrolliert und gegebenenfalls Wasser nachgefüllt werden. Besonders bei Gefäßen ohne Schraubverschluss kann dies wichtig sein. Wenn ein nicht transparentes Prüfgefäß verwendet wird, muss die Abdeckung aus einem lichtdurchlässigen Material bestehen (z.B. einer perforierten transparenten Abdeckung) und gleichzeitig dafür sorgen, dass die Milben nicht aus dem Gefäß entweichen können. Größe und Typ der Prüfgefäße hängen von der Extraktionsmethode ab (siehe Anlage 5). Wenn die Extraktion unter Wärmezufuhr unmittelbar aus dem Prüfgefäß erfolgt, kann ein Bodensieb mit geeigneter Maschenweite verwendet werden (das bis zur Extraktion verschlossen ist); der Boden muss tief genug sein, um das nötige Temperatur- und Feuchtegefälle zu gewährleisten. 9. Es wird die übliche Laborausrüstung insbesondere mit folgenden Bestandteilen benötigt:
Herstellung des künstlichen Bodens 10. Für diesen Test wird ein künstlicher Boden mit folgenden Bestandteilen verwendet (alle Angaben bezogen auf die Trockenmasse):
Hinweis 1: Wie viel CaCO3 zu verwenden ist, hängt von den Bestandteilen des Bodensubstrats ab und ist unmittelbar vor Testbeginn durch Messung des pH-Werts der Unterproben des Bodens zu ermitteln (14). Hinweis 2: Bei diesem Test hat der künstliche Boden einen anderen Torfgehalt als bei anderen Prüfmethoden mit terrestrisch lebenden Organismen, wo der Torfanteil in der Regel bei 10 % liegt (z.B. (15)). Nach EPPO (16) enthält ein typischer landwirtschaftlich genutzter Boden höchstens 5 % organische Bestandteile; die Reduzierung des Torfgehalts entspricht somit der eingeschränkten Fähigkeit eines Naturbodens zur Sorption der Prüfchemikalie an organischen Kohlenstoff. Hinweis 3: Falls erforderlich (z.B. für spezifische Testanforderungen), können auch natürliche Böden von nicht verunreinigten Bezugsorten als Test- und/oder Kultursubstrate dienen. Wird natürlicher Boden verwendet, sollten mindestens die Herkunft (Entnahmeort), der pH-Wert, die Textur (Partikelgrößenverteilung) und der Gehalt an organischen Bestandteilen charakterisiert werden. Soweit verfügbar, sind auch Typ und Name des Bodens nach der Bodenklassifikation anzugeben, und der Boden darf nicht kontaminiert sein. Handelt es sich bei der Prüfchemikalie um ein Metall oder eine metallorganische Verbindung, sollte auch die Kationenaustauschkapazität (KAK) des natürlichen Bodens ermittelt werden. Da in der Regel kaum Hintergrundinformationen über natürliche Böden vorliegen, sollte den Validitätskriterien besondere Aufmerksamkeit gewidmet werden. 11. Die trockenen Bestandteile des Bodens werden gründlich gemischt (z.B. in einem großen Labormischer). Zur Bestimmung des pH-Werts wird eine Mischung aus Boden und 1 M Calciumchlorid- (KCl) oder 0,01 M Calciumchlorid-Lösung (CaCl2) im Verhältnis 1:5 verwendet (siehe (14) und Anlage 3). Wenn der Boden saurer als erforderlich ist (siehe Nummer 10), kann der pH-Wert durch Zugabe einer geeigneten Menge CaCO3 korrigiert werden. Ist der Boden zu alkalisch, kann der pH-Wert durch Zugabe einer größeren Menge der Mischung mit den ersten drei der unter Nummer 10 beschriebenen Bestandteile (aber ohne CaCO3) korrigiert werden. 12. Die maximale Wasserhaltefähigkeit des künstlichen Bodens wird nach den in Anlage 2 beschriebenen Verfahren ermittelt. 2 bis 7 Tage vor Beginn der Prüfung wird der trockene künstliche Boden angefeuchtet, indem so viel destilliertes oder entionisiertes Wasser hinzugegeben wird, bis etwa die Hälfte des endgültigen Wasservolumens erreicht ist (40-60 % der maximalen Wasserhaltefähigkeit). Der Feuchtegehalt wird auf 40-60 % der maximalen Wasserhaltefähigkeit eingestellt, indem die Lösung mit der Prüfchemikalie und/oder destilliertes oder entionisiertes Wasser hinzugegeben wird (siehe Nummern 16-18). Eine zusätzliche grobe Prüfung des Feuchtegehalts des Bodens wird vorgenommen, indem der Boden vorsichtig in der Hand gedrückt wird; bei richtigem Feuchtegehalt sollten Wassertröpfchen zwischen den Fingern austreten. 13. Der Feuchtegehalt des Bodens wird zu Beginn und am Ende der Prüfung durch Trocknung bei 105 °C auf ein konstantes Gewicht gemäß ISO 11465 (17) gemessen; die Messung des pH-Werts erfolgt gemäß Anlage 3 oder ISO 10390 (14). Diese Messungen sind an zusätzlichen milbenfreien Proben sowohl aus den Kontrollböden als auch aus den einzelnen Böden mit Testkonzentrationen vorzunehmen. Wenn saure oder basische Chemikalien geprüft werden, sollte der pH-Wert des Bodens nicht justiert werden. Der Feuchtegehalt ist während der gesamten Prüfung durch regelmäßiges Wiegen der Gefäße zu überwachen (siehe Nummern 20 und 24). Auswahl und Vorbereitung der Testtiere 14. In diesem Versuch wird die Art Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883) verwendet. Für den Teststart werden adulte weibliche Milben aus einer synchronisierten Gruppe benötigt. Die Milben sind etwa 7-14 Tage nach Erreichen des adulten Stadiums, d. h. 28-35 Tage nach Beginn der Eiablage in der Synchronisation einzusetzen (siehe Nummer 3 und Anlage 4). Die Herkunft der Milben bzw. die Anbieter und die Kultivierungsbedingungen im Labor sind zu protokollieren. Wird eine Milbenkultur im Labor gehalten, sollte die Identität der jeweiligen Art mindestens einmal jährlich bestätigt werden. Ein Identifikationsblatt liegt als Anlage 6 bei. Herstellung der Testkonzentrationen 15. Die Prüfchemikalie wird in den Boden gemischt. Organische Lösungsmittel, die als Hilfsmittel zur Behandlung des Bodens mit der Prüfchemikalie verwendet werden, sollten aufgrund ihrer geringen toxischen Wirkung auf die Milben gewählt werden, und im Versuchsplan ist eine angemessene Lösungsmittelkontrolle vorzusehen (siehe Nummer 29). Wasserlösliche Prüfchemikalien 16. Eine Lösung der Prüfchemikalie wird in einer für alle Replikate einer Testkonzentration ausreichenden Menge in entionisiertem Wasser hergestellt. Dabei sollte möglichst so viel Wasser verwendet werden, dass der erforderliche Feuchtegehalt (d. h. 40-60 % der maximalen Wasserhaltefähigkeit (siehe Nummer 12)) erreicht wird. Jede Lösung der Prüfchemikalie wird gründlich mit einer Charge des befeuchteten Bodens gemischt und anschließend in das Prüfgefäß gegeben. Nicht wasserlösliche Prüfchemikalien 17. Prüfchemikalien, die nicht in Wasser, sondern nur in organischen Lösungsmitteln löslich sind, können in der kleinstmöglichen Menge eines geeigneten Lösungsmittels (z.B. Aceton) gelöst werden. Es sollten jedoch nur flüchtige Lösungsmittel verwendet werden. Werden derartige Lösungsmittel verwendet, müssen alle Testkonzentrationen und die Kontrolle dieselbe Mindestmenge dieses Lösungsmittels enthalten. Das Lösungsmittel wird aufgesprüht oder mit einer kleinen Menge (z.B. 10 g) Quarzsand gemischt. Der gesamte Sandgehalt des Substrats ist auf diese Menge zu korrigieren. Anschließend wird das Lösungsmittel mindestens eine Stunde lang unter einer Abzugshaube verdampft. Diese Mischung aus Quarzsand und Prüfchemikalie wird zum angefeuchteten Boden hinzugegeben und mit einer angemessenen Menge entionisierten Wassers gründlich vermischt, um den erforderlichen Feuchtegehalt zu erhalten. Die endgültige Mischung wird in die Prüfgefäße gegeben. Zu beachten ist, dass manche Lösungsmittel für Milben toxisch sein können. Wenn über die Toxizität des Lösungsmittels bei Milben nichts bekannt ist, wird empfohlen, eine zusätzliche Wasserkontrolle ohne Trägerstoff zu verwenden. Wird angemessen nachgewiesen, dass das Lösungsmittel (in den zu verwendenden Konzentrationen) keine Wirkung zeigt, braucht die Wasserkontrolle nicht berücksichtigt zu werden. In Wasser und organischen Lösungsmitteln schlecht lösliche Prüfchemikalien 18. Bei in Wasser und in organischen Lösungsmitteln schlecht löslichen Chemikalien werden 2,5 g fein gemahlener Quarzsand pro Prüfgefäß (z.B. 10 g feiner Quarzsand für vier Replikate) mit der benötigten Menge Prüfchemikalie gemischt, um die gewünschte Testkonzentration zu erhalten. Der gesamte Sandanteil des Substrats sollte auf diese Menge korrigiert werden. Diese Mischung aus Quarzsand und Prüfchemikalie wird zum angefeuchteten Boden hinzugegeben und mit einer angemessenen Menge entionisierten Wassers gründlich vermischt, um den erforderlichen Feuchtegehalt zu erhalten. Die endgültige Mischung wird auf die Prüfgefäße verteilt, das Verfahren wird für alle Testkonzentrationen wiederholt und es wird eine geeignete Kontrolle hergestellt. Testgruppen und Kontrollen 19. Für jedes Kontroll- und Prüfgefäß werden jeweils zehn adulte weibliche Tiere in 20 g künstlichem Boden (bezogen auf die Trockenmasse) empfohlen. Die Testorganismen sind innerhalb von zwei Stunden nach der Herstellung des fertigen Testsubstrats (d. h. nach Applikation der Prüfchemikalie) einzusetzen. In besonderen Fällen (z.B. wenn die Alterung ein entscheidender Faktor ist) kann die Zeitspanne zwischen der Herstellung des fertigen Testsubstrats und dem Einsetzen der Milben verlängert werden (für Einzelheiten zur Alterung siehe (18)); dies ist jedoch wissenschaftlich zu begründen. 20. Nach dem Einsetzen in den Boden werden die Milben gefüttert und das Anfangsgewicht eines jeden Testgefäßes bestimmt, welches als Bezugsgröße zur Überwachung des Feuchtegehalts des Bodens während der gesamten Prüfung dient; siehe Nummer 24. Anschließend werden die Prüfgefäße verschlossen, wie unter Nummer 8 beschrieben, und in die Prüfkammer gestellt. 21. Für jede der unter den Nummern 15-18 beschriebenen Methoden für die Applikation der Prüfchemikalie sind entsprechende Kontrollen herzustellen. Die beschriebenen Verfahren sind dieselben wie für die Herstellung der Kontrollen, außer dass keine Prüfchemikalie zugegeben wird. Folglich werden den Kontrollen gegebenenfalls organische Lösungsmittel, Quarzsand oder sonstige Trägerstoffe in denselben Konzentrationen/Mengen wie in den Prüfgefäßen zugegeben. Wird ein Lösungsmittel oder ein sonstiger Trägerstoff zur Prüfchemikalie hinzugegeben, von dem die Toxizität nicht bekannt ist, so ist eine zusätzliche Kontrolle ohne Trägerstoff bzw. ohne Prüfchemikalie herzustellen und zu testen (siehe Nummer 17). Prüfbedingungen 22. Die Prüftemperatur beträgt 20 ± 2 °C und sollte mindestens täglich erfasst und gegebenenfalls korrigiert werden. Der Test wird in kontrollierten Hell-/Dunkel-Zyklen (vorzugsweise 16 Stunden Licht und 8 Stunden Dunkelheit) mit einer Beleuchtungsstärke von 400-800 lux im Umfeld der Prüfgefäße durchgeführt. Aus Gründen der Vergleichbarkeit gelten dieselben Bedingungen wie in anderen Tests zur Bestimmung der Ökotoxizität in Böden (z.B. (15)). 23. Gasaustausch sollte gewährleistet werden, indem die (mit Schraubverschlüssen versehenen) Prüfgefäße mindestens zweimal wöchentlich belüftet werden. Sind die Gefäße mit Gaze verschlossen, muss besonders auf den Feuchtegehalt des Bodens geachtet werden (siehe Nummern 8 und 24). 24. Der Wassergehalt des Bodensubstrats in den Prüfgefäßen wird während der gesamten Prüfung durch Wiegen kontrolliert und gegebenenfalls durch regelmäßiges Nachwässern der Gefäße (z.B. einmal wöchentlich) aufrechterhalten. Verluste werden gegebenenfalls mit entionisiertem Wasser ausgeglichen. Der Feuchtegehalt während der Prüfung darf höchstens um 10 % vom Ausgangswert abweichen. Fütterung 25. Käsemilben (Tyrophagus putrescentiae (Schrank, 1781)) haben sich nachweislich als geeignete Futterquelle erwiesen. Kleine Collembolen (z.B. juvenile Folsomia candida Willem, 1902, oder Onychiurus fimatus (19), (20), Enchytraeen (z.B. Enchytraeus crypticus Westheide & Graefe, 1992) oder Nematoden (z.B. Turbatrix silusiae de Man, 1913)) könnten ebenfalls geeignet sein (21). Es wird empfohlen, das vorgesehene Futter vor Verwendung im Test zu prüfen. Um die Validitätskriterien zu erfüllen, müssen Art und Menge des Futters gewährleisten, dass sich eine angemessene Anzahl juveniler Tiere entwickelt (Nummer 6). Bei der Auswahl der Futtertiere sollte auch die Wirkungsweise der Prüfchemikalie berücksichtigt werden (beispielsweise kann ein Akarizid auch für die Futtermilben giftig sein; siehe Nummer 26). 26. Futter ist ad libitum bereitzustellen (d. h. jedes Mal eine kleine Menge, etwa eine Spatelspitze). Dazu kann auch ein Sauger mit geringer Saugwirkung, wie er für den Collembolen-Test vorgeschlagen wird, oder ein feiner Pinsel verwendet werden. Gewöhnlich reicht es, das Futter zu Beginn der Prüfung und danach zwei- bis dreimal wöchentlich anzubieten. Wenn die Prüfchemikalie für die Futtertiere eindeutig toxisch ist, sollte häufigeres Füttern und/oder ein anderes Futter in Betracht gezogen werden. Wahl der Testkonzentrationen 27. Vorkenntnis der Toxizität der Prüfchemikalie (z.B. aus Vorversuchen) erleichtert die Wahl geeigneter Testkonzentrationen. Falls erforderlich, wird ein Vorversuch mit fünf Konzentrationen der Prüfchemikalie im Bereich 0,1-1.000 mg/kg trockener Boden mit jeweils mindestens einem Replikat für die Prüf- und die Kontrollgefäße durchgeführt. Der Vorversuch dauert 14 Tage; anschließend werden die Mortalität der adulten Milben und die Zahl der juvenilen Tiere ermittelt. Der Konzentrationsbereich im endgültigen Test sollte vorzugsweise so gewählt werden, dass er Konzentrationen umfasst, die die Zahl der juvenilen Tiere beeinflussen, nicht jedoch das Überleben der Muttertiere. Bei Chemikalien, die bei fast gleichen Konzentrationen letal und subletal wirken, ist dies unter Umständen nicht möglich. Die im Test verwendeten Konzentrationen sollten in jedem Fall die Wirkungskonzentration (z.B. EC50, EC25 und EC10) und den Konzentrationsbereich, in dem die Wirkung der Prüfchemikalie von Interesse ist, einschließen. Eine Extrapolation deutlich unterhalb der niedrigsten Konzentration, bei der eine Wirkung auf die Testorganismen auftritt, oder oberhalb der höchsten geprüften Konzentration sollte nur in Ausnahmefällen stattfinden und ist im Bericht umfassend zu begründen. Versuchsplan Dosis-Wirkung-Tests 28. Gestützt auf die Empfehlungen aus einem anderen Ringtest (Enchytraeen-Reproduktionstest, (22)) werden drei Versuchspläne vorgeschlagen. Die generelle Eignung aller drei Pläne wurde durch das Ergebnis der H. aculeifer-Validierung bestätigt. 29. Bei der Festlegung der Konzentrationsspanne sollten die folgenden Aspekte berücksichtigt werden:
Limit-Test 30. Zeigen sich im Vorversuch bei der höchsten Konzentration (1.000 mg/kg trockener Boden) keine Wirkungen, kann der endgültige Reproduktionstest als Limit-Test mit der Testkonzentration 1.000 mg/kg durchgeführt werden. Mit einem Limit-Test lässt sich nachweisen, dass der NOEC- oder der EC10-Wert für die Reproduktionsleistung über der Limit-Konzentration liegt, während die Zahl der für den Test verwendeten Milben gleichzeitig auf ein Minimum begrenzt ist. Sowohl für den behandelten Boden als auch für die Kontrolle sind jeweils acht Replikate vorzusehen. Testdauer und Messungen 31. Alle beobachteten Unterschiede in Verhalten und Morphologie zwischen den Milben in der Kontrolle und den Milben in den Prüfgefäßen sind aufzuzeichnen. 32. An Tag 14 werden die überlebenden Milben unter Licht-/Wärmeeinfluss oder nach einer anderen geeigneten Methode (siehe Anlage 5) extrahiert. Juvenile (d. h. Larven, Protonymphen und Deutonymphen) und adulte Tiere werden separat gezählt. Adulte Milben, die zu diesem Zeitpunkt nicht gefunden werden, gelten als tot, wobei davon ausgegangen wird, dass die Milben vor der Bewertung abgestorben sind und sich zersetzt haben. Die Wirksamkeit der Extraktion ist ein- oder zweimal jährlich in Kontrollen mit einer bekannten Anzahl adulter und juveniler Tiere zu validieren. Sie sollte im Schnitt bei allen Entwicklungsstadien bei über 90 % liegen (siehe Anlage 5). Die Zählungen der Adulten und Juvenilen dürfen nicht mit Blick auf die Erfüllung des Wirksamkeitskriteriums angepasst werden. Auswertung der Ergebnisse 33. Für Informationen über die statistischen Methoden für die Auswertung der Testergebnisse siehe Nummern 36 bis 41 sowie OECD-Dokument 54 'Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application' (31). 34. Hauptendpunkt des Tests ist die Reproduktionsleistung, in diesem Fall die Zahl der pro Prüfgefäßreplikat (mit jeweils 10 eingesetzten adulten Weibchen) produzierten juvenilen Tiere. Für die statistische Analyse müssen für jede Testkonzentration und für jede Kontrolle das arithmetische Mittel (S) und die Varianz (s2) der Reproduktionsleistung berechnet werden. X und s2 werden für ANOVA-Verfahren wie den Student-, den Dunnett- oder den Williams-Test sowie für die Berechnung der 95 %-Konfidenzgrenzen verwendet. Hinweis: Dieser Hauptendpunkt entspricht der Fruchtbarkeit, gemessen als Zahl der während der Prüfung produzierten lebenden juvenilen Tiere geteilt durch die Zahl der bei Prüfungsbeginn eingesetzten weiblichen Elterntiere. 35. Die Zahl der in den unbehandelten Kontrollen ist ein Hauptvaliditätskriterium und muss aufgezeichnet werden. Wie schon beim Vorversuch sind im Schlussbericht auch alle anderen Anzeichen von Schadwirkungen festzuhalten. ECx 36. ECx-Werte, einschließlich ihrer entsprechenden oberen und unteren 95 %-Konfidenzgrenzen, für den Parameter gemäß Nummer 34 sind nach geeigneten statistischen Methoden (z.B. Probit-Analysen, Logit- oder Weibull- Modell, Trimmed Spearman-Karber-Methode oder einfache Interpolation (11)) zu berechnen. Ein ECx-Wert wird ermittelt, indem ein x % des Kontrollmittelwertes entsprechender Wert in die entstandene Gleichung eingesetzt wird. Um den EC50-Wert oder einen beliebigen anderen ECx-Wert zu ermitteln, sollten die für die einzelnen Prüfgefäße berechneten Mittelwerte (x) einer Regressionsanalyse unterzogen werden. NOEC/LOEC 37. Zur Bestimmung der NOEC-/LOEC-Werte durch statistische Analyse sind statistische Auswertungen für jedes Gefäß erforderlich (wobei einzelne Gefäße als Replikate gelten.) Es sollten geeignete statistische Methoden angewendet werden (gemäß OECD-Dokument 54 'Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application'). Grundsätzlich gilt, dass Schadwirkungen der Prüfchemikalie im Vergleich zur Kontrolle mit einer einseitigen (kleineren) Hypothesenprüfung bei p ≤ 0,05 zu untersuchen sind. Siehe Beispiele in den folgenden Absätzen. 38. Die Normalverteilung der Daten kann z.B. anhand der Kolmogorov-Smirnov-Methode ('Goodnessof-Fit-Test'), anhand einer Prüfung zur Ermittlung des Quotienten aus Spannweite und Standardabweichung (range to standard deviation ratio, R/s-Test) oder anhand des Shapiro-Wilk-Tests (zweiseitig, p ≤ 0,05) untersucht werden. Mit dem Cochran-Test, dem Levene-Test oder dem Bartlett-Test (zweiseitig, p ≤ 0,05) kann die Varianzhomogenität geprüft werden. Wenn die Bedingungen parametrischer Testverfahren (Untersuchung auf Normalverteilung und Varianzhomogenität) erfüllt sind, können eine einseitige Varianzanalyse (ANOVA) und anschließend Multi-Comparison-Tests durchgeführt werden. Mit paarweisen Vergleichstests (z.B. dem Dunnett- t-Test) oder Stepdown-Trendtests (z.B. mit dem Williams-Test bei monotoner Dosis-Wirkung-Beziehung) kann berechnet werden, ob zwischen den Kontrollen und den verschiedenen Prüfkonzentrationen signifikante Unterschiede (p ≤ 0,05) bestehen (Auswahl des empfohlenen Tests gemäß OECD-Dokument 54 'Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application'). Andernfalls sollten nicht parametrische Methoden (z.B. ein U-Test mit Bonferroni-/Holm-Korrektur oder ein Jonckheere-Terpstra- Trendtest) verwendet werden, um den NOEC- und den LOEC-Wert zu bestimmen. Limit-Test 39. Wurde ein Limit-Test (Vergleich der Kontrolle mit einer einzigen Testkonzentration) durchgeführt und sind die Bedingungen für parametrische Prüfverfahren (Normalität, Homogenität) erfüllt, können metrische Reaktionen mit dem Student-t-Test ausgewertet werden. Sind diese Bedingungen nicht erfüllt, so kann ein t-Test für ungleiche Varianzen (Welch-Test) oder ein nichtparametrischer Test wie der U-Test nach Mann und Whitney verwendet werden. 40. Um signifikante Unterschiede zwischen den Kontrollen (Kontrollen und Lösungsmittelkontrollen) zu ermitteln, können die Replikate der einzelnen Kontrollen wie für den Limit-Test beschrieben geprüft werden. Werden bei diesen Tests keine signifikanten Unterschiede festgestellt, können alle Replikate der Kontrolle und Lösungsmittelkontrolle gepoolt werden. Anderenfalls sind alle Testkonzentrationen mit der Lösungsmittelkontrolle zu vergleichen. Prüfbericht 40. Der Prüfbericht sollte zumindest folgende Angaben enthalten:
(1) Casanueva, M.E. (1993). Phylogenetic studies of the freeliving and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46. (2) Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274. (3) Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. und van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS - Journal of Soils and Sediments 3, 73-77. (4) Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2. Auflage, in: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 S. (5) Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). In: F. Dusbabek und V. Bukva (Hrsg.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487-492. (6) Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: S. 241-249. (7) Ruf, A. (1996). Lifehistory patterns in soilinhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: S. 621-628. (8) Krogh, P.H. und Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. In: Lokke, H. und van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, S. 239-251. (9) Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. und Van Straalen, N.M. (2002). Soil Toxicity Tests - Invertebrates. In: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. und Tarazona, J.V. (Hrsg.). SETAC Press, Pensacola, USA. 128 S. (10) Schlosser, H.-J. und Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433. (11) Schlosser, H.-J. und Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433. (12) Heckmann, L.-H., Maraldo, K. und Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154-7157. (13) Petersen, H. (1978). Some properties of two highgradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122. (14) ISO (Internationale Organisation für Normung) (1994). Bodenbeschaffenheit; Bestimmung des pH-Wertes, Nr. 10390. ISO, Genf. (15) Kapitel C.8 dieses Anhangs: Toxizität für Regenwürmer. (16) EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209. (17) ISO (Internationale Organisation für Normung) (1993). Bodenbeschaffenheit; Bestimmung des Trockenrückstandes und des Wassergehaltes auf Grundlage der Masse; Gravimetrisches Verfahren, Nr. 11465. ISO, Genf. (18) Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. und Tarazona, J.V. 2002. Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. SETAC Press, Pensacola, FL, USA. (19) Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125. (20) Schlosser, H.J. und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool. Beitr. N.F. 34(3):395-433. (21) Heckmann, L.-H., Ruf, A., Nienstedt, K. M. u Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135. (22) Kapitel C.32 dieses Anhangs - Enchyträen-Reproduktionstest. (23) ISO (Internationale Organisation für Normung) (1994). Bodenbeschaffenheit - Wirkungen von Schadstoffen auf Regenwürmer - Teil 2: Bestimmung der Wirkung auf die Reproduktionsleistung von Eisenia fetida/Eisenia andrei, Nr. 11268-2. ISO, Genf. (24) Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2. Auflage). Chapman & Hall, London, 524 S. (25) Dunger, W. und Fiedler, H.J. (1997). Methoden der Bodenbiologie (2. Aufl.). G. Fischer, Jena, 539 S. (26) Lesna, I. und Sabelis, M.W. (1999). Dietdependent female choice for males with 'good genes' in a soil predatory mite. Nature 401, 581-583. (27) Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107. (28) Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen. (29) Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59. (30) Kevan, D.K. McE. und Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), in Nordamerika scheinbar neu aufgetreten (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658. (31) OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD-Veröffentlichungen zu Gesundheit und Arbeitsschutz, Reihe 'Testing and Assessment', Nr. 54, ENV/JM/ MONO(2006)18
Die folgenden Definitionen beziehen sich auf die vorliegende Prüfmethode. (Bei dieser Prüfung werden alle Wirkungskonzentrationen als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens ausgedrückt.) Chemikalie: Stoff oder ein Gemisch. ECx (Konzentration für eine Wirkung von x %): die Konzentration, die im Vergleich zur Kontrolle innerhalb eines bestimmten Expositionszeitraums eine x %ige Wirkung auf die Testorganismen zeigt. Ein EC50-Wert ist beispielsweise eine Konzentration, bei der davon ausgegangen wird, dass sie sich innerhalb eines bestimmten Expositionszeitraums bei 50 % einer exponierten Population auf einen Prüfungsendpunkt auswirkt. LOEC (Niedrigste messbare Konzentration mit statistisch signifikanter Wirkung): niedrigste Konzentration einer Prüfchemikalie, die im Vergleich zur Kontrolle innerhalb eines bestimmten Expositionszeitraums eine statistisch signifikante Wirkung (p ≤ 0,05) zeigt. NOEC (Höchste messbare Konzentration ohne statistisch signifikante Wirkung): die Konzentration der Prüfchemikalie, bei der keine Wirkung gemessen wird. Für diesen Test zeigt die dem NOEC-Wert entsprechende Konzentration im Vergleich zur Kontrolle innerhalb eines bestimmten Expositionszeitraums keine statistisch signifikante Wirkung (p ≤ 0,05). Prüfchemikalie: beliebiger Stoff oder beliebiges Gemisch, der bzw. das nach dieser Methode geprüft wird.
Die folgende Methode hat sich zur Bestimmung der maximalen Wasserhaltekapazität des Bodens bewährt. Sie ist in Anhang C von ISO DIS 11268-2 (Bodenbeschaffenheit - Wirkungen von Schadstoffen auf Regenwürmer (Eisenia fetida). Teil 2: Bestimmung der Wirkung auf die Reproduktionsleistung (23) beschrieben. Mit einer geeigneten Vorrichtung zur Probenahme (Stechzylinder etc.) eine bestimmte Menge (z.B. 5 g) Prüfboden entnehmen. Den Zylinder auf der Unterseite mit Filterpapier abdecken, anschließend mit Wasser füllen und auf einem Gestell in ein Wasserbad setzen. Den Zylinder allmählich eintauchen, bis der Boden durch das Wasser bedeckt ist, und etwa drei Stunden im Wasser belassen. Da nicht alles durch die Bodenkapillare aufgenommene Wasser im Substrat gehalten werden kann, den Zylinder mit der Bodenprobe zur Entwässerung zwei Stunden in einem geschlossenen Gefäß (um eine Austrocknung zu verhindern) auf sehr feuchten, fein gemahlenen Quarzsand stellen. Anschließend die Probe wiegen und bei 105 °C bis zur Massekonstanz trocknen. Die Wasserhaltekapazität (Water Holding Capacity, WHC) kann dann wie folgt berechnet werden: Dabei sind: S = das wassergesättigte Substrat + Masse des Zylinders + Masse des Filterpapiers T = Tara (Masse des Zylinders + Masse des Filterpapiers) D = Trockenmasse des Substrats
Die folgende Methode zur Bestimmung des pH-Wertes von Böden beruht auf ISO DIS 10390: Bodenbeschaffenheit; Bestimmung des pH-Wertes (16). Eine vorgegebene Menge Boden für mindestens 12 Stunden bei Raumtemperatur trocknen. Eine Suspension aus (mindestens 5 g) Boden in einer 1 M Lösung analysenreinen Kaliumchlorids (KCl) oder einer 0,01 M Lösung analysenreinen Calciumchlorids (CaCl2) im Verhältnis 1:5 herstellen. Anschließend die Suspension für fünf Minuten kräftig schütteln und dann mindestens 2, aber nicht länger als 24 Stunden ruhen lassen. Der pH-Wert der flüssigen Phase wird mit einem pH-Messgerät gemessen, das vor jeder Messung mit einer geeigneten Reihe an Pufferlösungen (z.B. pH 4,0 und 7,0) kalibriert wurde.
Anzucht von Hypoaspis (Geolaelaps) aculeifer: Die Kulturen können in Kunststoffgefäßen oder in Glasgefäßen in einer Mischung aus Gips- und Holzkohlepulver im Verhältnis 9:1 gehalten werden. Der Gips kann erforderlichenfalls durch Zugabe einiger Tropfen destillierten oder entionisierten Wassers feucht gehalten werden. Die optimale Temperatur der Kultur liegt bei 20 ± 2 °C; die Photoperiode (Hell-/Dunkel-Phasen) ist für diese Art nicht von Bedeutung. Als Futter können Milben der Arten Typrophagus putrescentiae oder Caloglyphus sp. verwendet werden. (Lebensmilben sind mit Vorsicht zu handhaben, da sie bei Menschen Allergien auslösen können.) Nematoden, Enchytraeen und Collembolen sind als Futter ebenfalls geeignet. Ihre Bezugsquelle sollte protokolliert werden. Die Entwicklung der Population kann mit einem einzigen weiblichen Tier gestartet werden, denn männliche Tiere entwickeln sich in unbefruchteten Eiern. Die Generationen überschneiden sich weitgehend. Ein weibliches Tier kann mindestens 100 Tage lang leben und in diesem Zeitraum etwa 100 Eier ablegen. Die höchste Ablegeleistung wird erreicht zwischen Tag 10 und Tag 40 (nach Erreichen des adulten Stadiums) und beträgt 2,2 Eier pro Weibchen- 1 und Tag- 1. Die Ausreifung eines Eis zum adulten Weibchen dauert bei einer Temperatur von 20 °C etwa 20 Tage. Es empfiehlt sich, mehrere Kulturen anzulegen und vorrätig zu halten. Anzucht von Typrophagus putrescentiae: Die Milben werden in Glasgefäßen mit feinem Bierhefepulver gehalten, die wiederum in einen mit KNO3-Lösung gefüllten Plastikeimer gestellt werden, damit die Milben nicht entweichen können. Futtermilben werden auf das Pulver gesetzt und anschließend mit einem Spatel vorsichtig unter das Pulver gemischt. Das Pulver ist zweimal wöchentlich zu wechseln. Synchronisation der Kultur: Die Testorganismen sollten gleich alt sein (ca. 7 Tage nach Erreichen des adulten Stadiums). Bei einer Kulturtemperatur von 20 °C wird dies erreicht durch Übertragung der weiblichen Tiere in ein sauberes Kulturgefäß mit anschließender Zugabe von Futter in ausreichender Menge;
Adulte weibliche Tiere sind von männlichen Tieren und von anderen Entwicklungsstadien leicht zu unterscheiden - sie sind größer, aufgebläht und haben einen braunen Rückenschild (männliche Tiere sind schlanker und platter). Noch nicht ausgereifte Tiere sind weiß bis cremefarbig. Die Entwicklungsstadien der Milben verlaufen bei einer Temperatur 20 °C etwa wie folgt (Abbildung): Eier 5d, Larven 2d, Protonymphen 5d, Deutonymphen 7d, Präovipositionsperiode der Weibchen2d. Danach haben die Milben das adulte Stadium erreicht. Abbildung Entwicklung von Hypoaspis (Geolaelaps) aculeifer bei 20 °C (Entnahme = weibliche Testexemplare) Die adulten Testorganismen werden aus der synchronisierten Kultur entnommen und 28-35 Tage nach Beginn der Eiablage durch die Muttertiere (d. h. 7-14 Tage nach Erreichen des adulten Stadiums) in die Prüfgefäße gesetzt. Dies gewährleistet, dass die Testtiere die Präovipositionsperiode bereits durchlaufen und sich mit ebenfalls im Kulturgefäß vorhandenen männlichen Tieren gepaart haben. Beobachtungen an Laborkulturen lassen darauf schließen, dass sich weibliche Tiere unmittelbar oder kurz nach Erreichen des adulten Stadiums paaren, sofern männliche Tiere vorhanden sind (Ruf, Vaninnen, pers. Beob.). Der 7-Tage-Zeitraum wurde gewählt, um die Laborarbeit zu erleichtern und unterschiedliche Entwicklungen einzelner Exemplare abfedern zu können. Die Eiablage sollte mit mindestens ebenso vielen weiblichen Tieren begonnen werden, wie letztlich für die Prüfung benötigt werden. (Werden beispielsweise 400 weibliche Tiere benötigt, sollten auch mindestens 400 weibliche Tiere zwei bis drei Tage Zeit für die Eiablage gehabt haben.) Ausgangspunkt für die synchronisierte Population sollten mindestens 1.200 Eier sein (Geschlechterverhältnis ca. 0,5, Mortalität ca. 0,2). Um Kannibalismus zu vermeiden, sollten pro Gefäß nicht mehr als 20-30 Eier legende weibliche Tiere gehalten werden.
Bei Mikroarthropoden ist Extraktion unter Wärmeeinfluss eine geeignete Methode, um die Milben aus dem Boden/ dem Substrat zu locken (siehe folgende Abbildung). Da diese Methode auf der Aktivität der Organismen beruht, können ausschließlich bewegungsfähige Exemplare erfasst werden. Bei der Extraktion unter Wärmeeinfluss werden die Lebensbedingungen für die Organismen in den Gefäßen allmählich so verschlechtert, dass sie das Substrat verlassen und in eine Fixierflüssigkeit fallen (z.B. Ethanol). Entscheidend sind die Dauer der Extraktion und der Verlauf von guten über mäßige bis hin zu schlechten Lebensbedingungen. Für Ökotoxizitätsprüfungen muss die Extraktion so schnell wie möglich erfolgen, weil eine Populationsvermehrung während der Extraktion die Ergebnisse verfälschen würde. Andererseits müssen Temperatur und Feuchte der Probe stets in einem Bereich liegen, bei dem die Milben sich noch bewegen können. Die Erwärmung einer Bodenprobe bewirkt eine Austrocknung des Substrats. Erfolgt letztere zu rasch, können auch einzelne Milben austrocknen, bevor sie die Chance haben, das Substrat zu verlassen. Daher wird folgendes Verfahren empfohlen (24) (25): Apparatur: Tullgren-Trichter oder vergleichbare Methoden wie Extraktion nach McFadyen (Erwärmung von oben, Probe steht über einem Trichter). Erwärmung: 25 °C 12 h, 35 °C 12 h, 45 °C 24 h (insgesamt 48 h); die Temperatur ist im Substrat zu messen. Fixierflüssigkeit: Ethanol (70 %). Beschreibung: Von dem für die Prüfung verwendeten Glasgefäß Deckel abnehmen und die Öffnung mit Maschendraht oder Stoff umwickeln. Den Stoff, der eine Maschenweite von 1,0-1,5 mm haben sollte, mit einem Gummiband fixieren. Danach die Flasche vorsichtig umdrehen und in die Extraktionsapparatur setzen. Die Maschenweite des Gewebes verhindert, dass das Substrat in die Fixierflüssigkeit sickert, ist aber so groß, dass die Milben die Probe verlassen können. Nach dem Einsetzen aller Gefäße mit der Erwärmung beginnen. Die Extraktion nach 48 Stunden beenden. Fixierte Gefäße entnehmen und die Milben unter einem Stereomikroskop zählen. Die Extraktionsleistung der gewählten Methode muss ein- bis zweimal jährlich unter Verwendung von Gefäßen mit einer bekannten Anzahl juveniler und adulter Milben in einem unbehandelten Testsubstrat nachgewiesen werden und sollte für alle Entwicklungsstadien zusammengerechnet bei durchschnittlich e 90 % liegen. Extraktionsapparatur mit Tullgren-Trichter Vorbereitung des Prüfgefäßes nach Prüfungsende (vor der Extraktion)
Hypoaspis aculeifer gehört zur Familie Lealapidae, Gattung Acari (Milben), Klasse Arachnida, Stamm Arthropoda. Die Milben leben in allen Arten von Böden und ernähren sich von anderen Milben, Nematoden, Enchytraeen und Collembolen (26). Bei Futtermangel kommt es zu Kannibalismus (27). Der Körper der Raubmilbe ist untergliedert in Idiosoma und Gnathosoma. Eine klare Trennung des Idiosoma in Prosoma (Kopf) und Opisthosoma (Bauch) besteht nicht. Das Gnathosoma (der Kopfschild) trägt die Mundwerkzeuge (z.B. Palpen und Cheliceren). Die dreigliedrigen Cheliceren sind mit unterschiedlich geformten Zähnen besetzt. Außer zur Nahrungsaufnahme nutzen die männlichen Tiere ihre Cheliceren vorwiegend, um die Spermatophoren auf die Weibchen zu übertragen. Ein Dorsalschild bedeckt nahezu das gesamte Idiosoma. Ein erheblicher Teil des weiblichen Idiosomas entfällt auf die Fortpflanzungsorgane, die insbesondere kurz vor der Eiablage deutlich ausgeprägt sind. Auf der Bauchseite befinden sich ebenfalls zwei Schilde: der Sternalschild und der Genitalschild. Alle Beine weisen Borsten und Stacheln auf. Die Borsten sorgen für die nötige Haftung beim Fortbewegen im oder auf dem Boden. Das erste Beinpaar hat vorwiegend Antennenfunktion. Das zweite Beinpaar dient nicht nur zur Fortbewegung, sondern auch zum Greifen der Beute. Die Dornen des vierten Beinpaars können sowohl als Schutz als auch zum 'Antrieb' dienen (28). Männliche Tiere sind 0,55-0,65 mm lang und wiegen 10-15 µg. Weibliche Tiere haben eine Länge von 0,8-0,9 mm und ein Gewicht von 50-60 µg (8) (28) (siehe Abb. 1). Abb. 1 Weibliche und männliche Milben, Protonymphen und Larven von H. aculeifer Bei 23 °C werden die Milben nach 16 Tagen (weibliche Tiere) bzw. nach 18 Tagen (männliche Tiere) geschlechtsreif (6). Die weiblichen Tiere nehmen das Sperma über das Solenostom auf, von wo es in das Ovar gelangt. Dort werden die Spermien aufbewahrt und reifen heran. Die Befruchtung erfolgt erst nach der Ausreifung der Spermien im Ovar. Befruchtete und unbefruchtete Eier werden von den Weibchen in Klumpen oder einzeln vorzugsweise in Spalten oder Löchern abgelegt. Kopulierte Weibchen können Juvenile beider Geschlechter erzeugen; aus Eiern nicht kopulierter Weibchen gehen ausschließlich männliche Tiere hervor. Bei der Entwicklung zur adulten Phase werden der vier Stadien (Ei - Larve, Larve - Protonymphe, Protonymphe - Deutonymphe, Deutonymphe - adultes Tier) durchlaufen. Die Eier sind milchig weiß, hyalin, elliptisch und etwa 0,37 mm lang mit fester Hülle. Nach (8) sind die Larven 0,42- 0,45 mm groß. Sie haben nur drei Beinpaare. Im Kopfbereich werden Palpen und Cheliceren ausgebildet. Die Cheliceren besitzen einige wenige kleine Zähnchen; diese werden für den Schlupfvorgang genutzt. Nach der ersten Häutung, 1-2 Tage nach dem Schlüpfen, entwickeln sich die Protonymphen. Sie sind ebenfalls weiß, 0,45-0,62 mm lang (8) und haben vier Beinpaare. Die Zähne auf den Cheliceren sind vollständig ausgebildet. Ab diesem Stadium beginnen die Milben zu fressen. Dazu wird die Cuticula der Beute mit den Cheliceren durchstochen und ein Sekret für die extraintestinale Verdauung in die Beute gespritzt. Der Nahrungsbrei kann dann von der Milbe aufgesaugt werden. Die Cheliceren dienen auch dazu, größere Teilchen aus Futterklumpen zu reißen (28). Nach einer weiteren Häutung entstehen die Deutonymphen. Sie sind 0,60-0,80 mm lang (8) und gelblich bis hellbraun. Ab dieser Phase können weibliche und männliche Tiere unterschieden werden. Nach einer weiteren Ecdysis, während der die Tiere inaktiv sind und sich der braune Schild entwickelt (etwa nach 14 Tagen), ist das adulte Stadium erreicht (28) (29) (30). Die Lebenserwartung der Milben liegt bei einer Temperatur von 25 °C zwischen 48 und 100 Tagen (27).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
C.37. 21-Tage Fisch-Screening-ASSAY: Ein Kurzzeittest zur Bestimmung der Östrogenen und androgenen Aktivität und der Aromatasehemmung 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 230 (2009). Die Entwicklung und Validierung eines Fischtests, mit dem bestimmte endokrin aktive Chemikalien nachgewiesen können, geht auf die Befürchtung zurück, dass in der Umwelt vorhandene Chemikalien aufgrund ihrer Interaktion mit dem endokrinen System die Gesundheit von Mensch und Natur gefährden. 1998 hat die OECD vorrangig mit der Änderung bestehender und der Entwicklung neuer Leitlinien für Screening-Tests und die Untersuchung potenziell endokriner Disruptoren begonnen. Ein Teil dieser Arbeit bestand in der Entwicklung einer technischen Leitlinie für das Screening von Chemikalien mit Wirkung auf das endokrine System von Fischen. Der 21-Tage-Fisch- Screening-Assay wurde im Rahmen laborübergreifender Untersuchungen an ausgewählten Chemikalien umfassend validiert, um die Relevanz und die Zuverlässigkeit des Assay für den Nachweis östrogen wirksamer und aromatasehemmender Chemikalien (1)(2)(3)(4)(5) bei den drei untersuchten Fischarten (Dickkopfelritze, Japanischer Reiskärpfling und Zebrabärbling) zu demonstrieren. Bei Dickkopfelritzen und bei Japanischen Reiskärpflingen kann androgene Aktivität nachgewiesen werden, nicht aber bei Zebrabärblingen. Antiandrogen wirkende Chemikalien können mit dieser Prüfmethode nicht nachgewiesen werden. Die Validierungsarbeit wurde von einer Gruppe von Experten, die von den nationalen Koordinatoren des Prüfrichtlinien-Programms ernannt wurden, einer Peer-Review unterzogen (6). Der Test ist nicht dafür vorgesehen, spezifische endokrinschädigende Wirkmechanismen zu identifizieren, denn die getesteten Fische besitzen eine intakte Hypothalamus-Hypophysen-Gonaden-Achse (HHG-Achse), die auf unterschiedlichen Ebenen auf Chemikalien, die auf die HHG-Achse einwirken, reagieren kann. Der Kurzzeit-Reproduktionstest an Fischen (Fish Short Term Reproduction Assay, FSTRA) (OECD TG 229) umfasst Fruchtbarkeits- und gegebenenfalls histopathologische Gonaden-Untersuchungen bei Dickkopfelritzen sowie sämtliche unter diese Prüfmethode fallenden Endpunkte. Die OECD-Prüfrichtlinie TG 229 sieht ein Screening von Chemikalien vor, die die Reproduktion durch unterschiedliche Mechanismen (u. a. durch endokrine Prozesse) beeinflussen. Dem sollte Rechnung getragen werden, bevor über die geeignetste Prüfmethode entschieden wird.
2. Die vorliegende Prüfmethode entspricht einem In-vivo-Screening-Assay, bei dem geschlechtsreife männliche und weibliche Fische gemeinsam gehalten und für einen begrenzten Teil ihres Lebenszyklus (21 Tage) einer Chemikalie ausgesetzt werden. Nach dieser 21-tägigen Exposition werden je nach verwendeter Art bei männlichen und weiblichen Fischen ein oder zwei Biomarker-Endpunkte als Indikatoren einer östrogenen, aromatosehemmenden oder androgenen Wirkung der Prüfchemikalie gemessen. Diese Endpunkte sind Vitellogenin und sekundäre Geschlechtsmerkmale. Vitellogenin wird bei Dickkopfelritzen, bei Japanischen Reiskärpflingen und bei Zebrabärblingen gemessen, die sekundären Geschlechtsmerkmale hingegen nur bei Dickkopfelritzen und Japanischen Reiskärpflingen.
3. Dieser Bioassay dient dem In-vivo-Screening bestimmter endokriner Wirkungsweisen und ist im Zusammenhang mit dem 'OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals' (28) zu sehen.
Ausgangsüberlegungen und Begrenzungen
4. Vitellogenin (VTG) wird gewöhnlich von der Leber weiblicher oviparer Vertebraten in Reaktion auf im Blutkreislauf zirkulierendes endogenes Östrogen produziert. VTG ist ein Vorläufer von Eidotterproteinen und wandert, einmal in der Leber produziert, über die Blutbahn zum Eierstock, wo es aufgenommen und von sich entwickelnden Eiern modifiziert wird. Vitellogenin ist im Plasma noch nicht geschlechtsreifer weiblicher und männlicher Fische kaum nachweisbar, da sich bei diesen noch nicht genügend zirkulierendes Östrogen gebildet hat. Die Leber kann Vitellogenin jedoch in Reaktion auf eine exogene Östrogenstimulation synthetisieren und absondern.
5. Die Messung der VTG-Konzentration ermöglicht den Nachweis von Chemikalien mit unterschiedlichen östrogenen Wirkungsweisen. Östrogen wirksame Chemikalien können durch Messung der VTG-Induktion bei männlichen Fischen nachgewiesen werden, was in wissenschaftlichen Veröffentlichungen mit Peer Review umfassend dokumentiert wurde (z.B. (7)). VTG-Induktion wurde auch nach Exposition gegenüber aromatisierbaren Androgenen nachgewiesen (8)(9). Eine Reduktion des im Körper weiblicher Tiere zirkulierenden Östrogens, beispielsweise durch Hemmung der Aromatase, die endogenes Androgen in das natürliche Östrogen 17β -Östradiol umwandelt, bewirkt eine Verringerung der VTG-Konzentration, die zum Nachweis von Chemikalien mit aromatasehemmenden Eigenschaften verwendet wird (10)(11). Die biologische Relevanz der VTG-Reaktion nach einer Östrogen-/Aromatasehemmung ist erwiesen und wurde umfassend dokumentiert. Die VTG-Produktion bei weiblichen Tieren kann aber auch durch allgemeine Toxizität und nicht endokrine toxische Wirkungen (z.B. Hepatotoxizität) beeinflusst werden.
6. Für Routinemessungen haben sich verschiedene standardisierte Verfahren bewährt, so der artspezifische ELISA (Enzyme-Linked Immunosorbent Assay), bei dem das in kleinen Blut- oder Leberproben einzelner Fische produzierte Vitellogenin immundiagnostisch quantifiziert wird (12)(13)(14)(15)(16)(17)(18). Die VTG- Messungen werden an Blutproben und/oder Kopf-/Schwanz-Homogenaten von Dickkopfelritzen und Zebrabärblingen sowie an Leberproben Japanischer Reiskärpflinge vorgenommen. Bei Japanischen Reiskärpflingen besteht eine ausgeprägte Korrelation zwischen dem im Blut und in der Leber gemessenen VTG (19). Anlage 6 enthält Empfehlungen für Verfahren zur Entnahme von Proben für Vitellogenin-Analysen. Kits für Vitellogenin-Messungen sind allgemein erhältlich; sie sollten auf einem validierten artspezifischen ELISA beruhen.
7. Sekundäre Geschlechtsmerkmale männlicher Fische bestimmter Arten sind äußerlich sichtbar und quantifizierbar und reagieren auf zirkulierende Mengen endogen wirkender Androgene. Dies gilt für Dickkopfelritzen und für Japanische Reiskärpflinge, nicht aber für Zebrabärblinge, die keine quantifizierbaren sekundären Geschlechtsmerkmale besitzen. Weibliche Tiere behalten die Fähigkeit bei, sekundäre männliche Geschlechtsmerkmale zu entwickeln, wenn sie in Wasser androgen wirksamen Chemikalien ausgesetzt werden. In der Fachliteratur wird auf mehrere Studien hingewiesen, die diese Art von Reaktion bei Dickkopfelritzen (20) und Japanischen Reiskärpflingen (21) belegen. Ein Rückgang sekundärer Geschlechtsmerkmale bei männlichen Fischen sollte aufgrund der geringen statistischen Aussagekraft mit Vorsicht interpretiert werden; jede Wertung sollte sich auf Expertenurteile und die Beweiskraft der Daten stützen. Zebrabärblinge sind für diesen Test nur begrenzt geeignet, da quantifizierbare sekundäre Geschlechtsmerkmale fehlen, die auf androgen wirksame Chemikalien reagieren könnten.
8. Bei Dickkopfelritzen ist die Zahl der Laichknoten ('Nuptialtuberkel') am Maul weiblicher Fische Hauptindikator einer exogenen Androgenexposition. Wichtigster Marker einer exogenen Exposition gegenüber androgen wirkenden Chemikalien bei weiblichen Japanischen Reiskärpflingen ist die Zahl der Papillenprozesse. Die Anlagen 5A und 5B enthalten Empfehlungen für Verfahren zur Bewertung von Geschlechtsmerkmalen bei Dickkopfelritzen bzw. Japanischen Reiskärpflingen.
9. Für Begriffsbestimmungen zu dieser Prüfmethode siehe Anlage 1.
10. Beim Assay werden geschlechtsreife männliche und weibliche Fische in Prüfgefäßen gemeinsam einer Prüfchemikalie ausgesetzt. Da die Tiere ausgewachsen und geschlechtsreif sind, kann leicht zwischen den Geschlechtern unterschieden und folglich eine geschlechtsspezifische Analyse der einzelnen Endpunkte vorgenommen werden, und die Sensitivität gegenüber exogenen Chemikalien ist gewährleistet. Bei Testende wird das Geschlecht der Fische durch makroskopische Untersuchung der Gonaden nach bauchseitiger Öffnung des Abdomens mit einer Schere bestimmt. Anlage 2 fasst die wichtigsten Bedingungen des Bioassays zusammen. Der Test wird gewöhnlich mit einer Auswahl an Fischen aus einer Laichpopulation begonnen; seneszente Tiere sollten nicht verwendet werden. Der Abschnitt über die Auswahl der Fische enthält Hinweise zum Alter und zur Geschlechtsreife der Fische. Der Test wird mit drei Konzentrationen der Prüfchemikalie und einer Wasserkontrolle sowie erforderlichenfalls einer Lösungsmittelkontrolle durchgeführt. Bei Japanischen Reiskärpflingen und bei Zebrabärblingen werden je Konzentration zwei Gefäße oder Replikate verwendet (jedes Gefäß mit fünf männlichen und fünf weiblichen Fischen); bei Dickkopfelritzen sind je Konzentration vier Gefäße oder Replikate zu verwenden (jedes Gefäß mit zwei männlichen und vier weiblichen Fischen), um dem Territorialverhalten männlicher Dickkopfelritzen Rechnung zu tragen und gleichzeitig hinreichende Aussagekraft zu gewährleisten. Die Exposition erfolgt über einen Zeitraum von 21 Tagen; die Fische werden an Tag 21 nach Beginn der Exposition beprobt.
11. Am Tag der Beprobung (Tag 21) sind alle Tiere möglichst schmerzfrei zu töten. Bei Dickkopfelritzen und Japanischen Reiskärpflingen werden sekundäre Geschlechtsmerkmale gemessen (siehe Anlagen 5A und 5B). Zur Bestimmung der VTG-Konzentration werden von Zebrabärblingen und Dickkopfelritzen Blutproben entnommen; alternativ kann die VTG-Konzentration bei Zebrabärblingen auch anhand von Kopf- und Schwanzproben ermittelt werden (Anlage 6); bei Japanischen Reiskärpflinge werden zur VTG-Analyse Leberproben entnommen (Anlage 6).
12. Die Testergebnisse sind gültig, wenn folgende Bedingungen erfüllt sind:
- Die Mortalität in den Wasser- (oder Lösungsmittel-)kontrollen darf am Ende der Exposition höchstens 10 % betragen;
- die Konzentration an gelöstem Sauerstoff sollte während der gesamten Exposition mindestens 60 % des Luftsauerstoff-Sättigungswerts betragen;
- die Wassertemperatur der Prüfgefäße sollte während der Exposition zu keinem Zeitpunkt um mehr als ± 1,5 °C schwanken und bei einer Toleranz von 2 °C in dem Temperaturbereich liegen, der für die Testspezies vorgesehen ist (Anlage 2);
- es muss belegt werden, dass die Konzentrationen der Prüfchemikalie in der Lösung mit einer Toleranz von ± 20 % bezogen auf die gemessenen Mittelwerte aufrechterhalten wurden.
Apparatur
13. Übliche Laborausrüstung und insbesondere die folgenden Geräte:
- Sauerstoff- und pH-Messgeräte;
- Geräte zur Messung von Wasserhärte und Alkalität;
- geeignete Apparaturen zur Temperaturregelung und einer möglichst kontinuierlichen Überwachung;
- Becken aus chemisch inertem Material und mit für das empfohlene Besatzverhältnis und die empfohlene Besatzdichte geeignetem Fassungsvermögen (siehe Anlage 2);
- Laichsubstrat für Dickkopfelritzen und Zebrabärblinge (für Einzelheiten siehe Anlage 4);
- eine Waage mit angemessener Genauigkeit (± 0,5 mg).
Wasser
14. Als Testwasser kann jedes beliebige Wasser verwendet werden, in dem die Testspezies über einen längeren Zeitraum überleben und wachsen können. Während der gesamten Testdauer sollte eine konstante Wasserqualität gewährleistet sein. Der pH-Wert des Wassers sollte im Bereich 6,5-8,5 liegen und im Test um nicht mehr als ± 0,5 pH-Einheiten schwanken. Um sicherzustellen, dass das Verdünnungswasser das Testergebnis nicht übermäßig stark beeinflusst (beispielsweise durch Komplexierung der Prüfchemikalie), sind regelmäßig Proben zu analysieren. Das Wasser ist auf Schwermetalle (z.B. Cu, Pb, Zn, Hg, Cd und Ni), dominante Anionen und Kationen (z.B. Ca2+, Mg2+, Na+, K+, Cl- und SO42-), Pestizide (z.B. den Gesamtgehalt an phosphororganischen und chlororganischen Pestiziden), den gesamten organischen Kohlenstoff und suspendierte Feststoffe zu untersuchen (beispielsweise alle drei Monate, wenn bekannt ist, dass das Wasser qualitativ gesehen relativ konstant ist). Ist die Wasserqualität nachweislich mindestens ein Jahr lang konstant geblieben, so können die Analysen seltener durchgeführt und die Abstände zwischen den Analysen verlängert werden (beispielsweise auf sechs Monate). Einige chemische Merkmale akzeptablen Verdünnungswassers sind in Anlage 3 gegeben.
Testlösungen
15. Die Testlösungen werden durch Verdünnung einer Stammlösung in den gewünschten Konzentrationen zubereitet. Die Stammlösung sollte möglichst durch einfaches mechanisches Vermischen oder Schütteln (z.B. durch Rühren oder mit Ultraschall) der Prüfchemikalie in Verdünnungswasser hergestellt werden. Zur Herstellung einer Stammlösung in geeigneter Konzentration können Sättigungssäulen (Löslichkeitssäulen) verwendet werden. Die Verwendung von Lösungsmittelträgern wird nicht empfohlen. Ist jedoch ein Lösungsmittel erforderlich, so sollte zeitgleich in derselben Lösungsmittelkonzentration wie bei der chemischen Behandlung eine Lösungsmittelkontrolle verwendet werden. Bei schwierigen Prüfchemikalien kann die Verwendung eines Lösungsmittels aus technischer Sicht die beste Lösung darstellen (siehe OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures) (22). Welches Lösungsmittel zu verwenden ist, hängt von den chemischen Eigenschaften der Chemikalie ab. Der OECD-Leitfaden empfiehlt höchstens 100 µl/l; dieser Wert sollte eingehalten werden. In einer kürzlich durchgeführten Untersuchung (23) wurde jedoch auf weitere Bedenken hinsichtlich der Verwendung von Lösungsmitteln in Tests zur Prüfung endokriner Wirkungen verwiesen. Daher sollte die Lösungsmittelkonzentration (wenn überhaupt ein Lösungsmittel verwendet werden muss) so weit wie technisch möglich minimiert werden (je nach physikalisch-chemischen Eigenschaften der Prüfchemikalie).
16. Für den Test ist ein Durchflusssystem zu verwenden. Ein solches System gibt kontinuierlich eine Stammlösung der Prüfchemikalie ab und verdünnt diese (z.B. mit einer Dosierpumpe, einem Proportionalverdünner oder einer Sättigungsvorrichtung), damit unterschiedliche Konzentrationen in die Prüfkammern gelangen. Die Durchflussraten von Stammlösungen und Verdünnungswasser sind während des Tests regelmäßig - vorzugsweise täglich - zu kontrollieren und dürfen während des Tests um höchstens 10 % schwanken. Insbesondere sind Kunststoffleitungen aus minderwertigem Material oder sonstige Materialien zu vermeiden, die biologisch aktive Chemikalien enthalten könnten. Bei der Auswahl des Materials für das Durchflusssystem ist eine mögliche Adsorption der Prüfchemikalie an das Material zu berücksichtigen.
Halten der Fische
17. Die zu testenden Fische sollten aus einer Laborpopulation stammen, vorzugsweise aus einem einzelnen Bestand, der mindestens zwei Wochen vor dem Test bei ähnlicher Wasserqualität und ähnlichen Lichtverhältnissen wie im Test akklimatisiert wurde. Besatz(verhältnis) und Besatzdichte (Begriffsbestimmungen siehe Anlage 1) müssen der jeweils verwendeten Art entsprechen (siehe Anlage 2).
18. Nach einer 48-stündigen Akklimatisierung werden die Mortalitäten erfasst; dabei gelten die folgenden Kriterien::
- Bei Mortalitäten von mehr als 10 % der Population innerhalb von sieben Tagen: Die gesamte Charge verwerfen.
- Bei Mortalitäten zwischen 5 und 10 % der Population: Akklimatisierung der Fische für weitere sieben Tage; wenn die Mortalität auch in den zusätzlichen sieben Tagen noch über 5 % liegt: die gesamte Charge verwerfen.
- Bei Mortalitäten von weniger als 5 % der Population innerhalb sieben Tagen wird die Charge akzeptiert.
19. Während der Akklimatisierung, der Präexposition und der eigentlichen Exposition sollten Fische nicht gegen Krankheiten behandelt werden.
Präexposition und Auswahl der Fische
20. Eine einwöchige Präexposition wird empfohlen; dabei werden die Fische in prüfgefäßähnliche Becken gesetzt. Während der gesamten Haltungsdauer und während der Exposition werden die Fische ad libitum gefüttert. Die Expositionsphase beginnt mit sexuell dimorphen adulten, aktiv laichenden Fischen aus einer Laborpopulation geschlechtsreifer Tiere (z.B. mit deutlichen sekundären Geschlechtsmerkmalen bei Dickkopfelritzen und bei Japanischen Reiskärpflingen). Als Faustregel (nur im Kontext der Beobachtung des tatsächlichen Reproduktionsstatus einer bestimmten Charge anzuwenden) gilt, dass Dickkopfelritzen ca. 20 (± 2) Wochen alt sein sollten, vorausgesetzt, sie wurden während ihrer gesamten Lebensdauer bei einer Temperatur von 25 ± 2 °C gehalten. Unter denselben Bedingungen sollten Japanische Reiskärpflinge etwa 16 (± 2) Wochen alt sein. Zebrabärblinge sollten etwa 16 (± 2) Wochen alt sein, sofern sie während ihres gesamten Lebens bei 26 ± 2 °C gehalten wurden.
21. Für den Test sind drei Konzentrationen der Prüfchemikalie, eine Kontrolle (Wasser) und erforderlichenfalls eine Lösungsmittelkontrolle zu verwenden. Die Daten können analysiert werden, um statistisch signifikante Unterschiede zwischen Behandlungs- und Kontrollreaktion festzustellen. Diese Analysen dienen eher der Feststellung, ob die Chemikalie in weiteren Langzeittests auf unerwünschte Wirkungen (nämlich Überleben, Entwicklung, Wachstum und Reproduktion) untersucht werden muss, als der Verwendung für Risikobewertungen (24).
22. Bei Zebrabärblingen und bei Japanischen Reiskärpflingen werden an Tag 21 des Assay männliche und weibliche Tiere aus jeder Konzentrationsgruppe (jedes Replikat enthält 5 männliche und 5 weibliche Fische) und aus der/ den Kontrollgruppe(n) für die Untersuchung auf Vitellogenin und sekundäre Geschlechtsmerkmale beprobt; bei den Dickkopfelritzen werden an Tag 21 der Exposition männliche und weibliche Tiere (jedes der vier Replikate enthält 2 männliche und 4 weibliche Fische), auch aus der/den Kontrollgruppe(n), für die Untersuchung auf Vitellogenin und sekundäre Geschlechtsmerkmale beprobt.
Auswahl der Testkonzentrationen
23. Für die Zwecke dieses Assay sollte die höchste Testkonzentration auf die in einem Vorversuch bestimmte oder aus anderen Toxizitätsdaten hervorgehende höchste noch verträgliche Konzentration (Maximum Tolerated Concentration, MTC) oder auf 10 mg/l oder auf den Höchstwert der Wasserlöslichkeit festgesetzt werden, je nach dem, welcher Wert der niedrigere ist. Der MTC-Wert gilt als die höchste Testkonzentration der Chemikalie, bei der die Mortalität weniger als 10 % beträgt. Dieser Ansatz geht davon aus, dass empirische Daten zur akuten Toxizität oder sonstige Toxizitätsdaten vorliegen, anhand deren der MTC-Wert bestimmt werden kann. Die Schätzung des MTC-Wertes kann ungenau sein und setzt in der Regel Fachkenntnis voraus.
24. Benötigt werden drei Testkonzentrationen mit einem konstanten Abstandsfaktor von maximal 10 und eine Verdünnungswasserkontrolle (sowie bei Bedarf eine Lösungsmittelkontrolle). Empfohlen werden Abstandsfaktoren zwischen 3,2 und 10.
Auswahl und Wiegen der Testfische
25. Wichtig ist, dass die Gewichtsunterschiede der Fische zu Beginn des Tests möglichst gering sind. Für geeignete Größenbereiche für die empfohlenen Testspezies siehe Anlage 2. Bei der gesamten Charge der in diesem Test verwendeten Fische sollte bei männlichen und weiblichen Tieren das individuelle Gewicht möglichst im Bereich von ± 20 % des arithmetischen Mittelgewichts der Fische gleichen Geschlechts liegen. Um das Mittelgewicht zu bestimmen, wird empfohlen, vor dem Test eine Teilprobe des Fischbestands zu wiegen.
Expositionsbedingungen
Dauer
26. Der Test dauert 21 Tage nach vorheriger (möglichst einwöchiger) Präexposition.
Fütterung
27. Die Fische werden ad libitum so oft mit geeignetem Futter (Anlage 2) versorgt, wie für eine normale Entwicklung der Tiere nötig ist. Dabei ist darauf zu achten, dass es nicht zu einer Vermehrung von Mikroorganismen und nicht zu einer Eintrübung des Wassers kommt. Im Allgemeinen kann die Tagesration auf zwei oder drei gleiche Portionen verteilt werden, die in mindestens dreistündigem Abstand zu verabreichen sind. Insbesondere an Wochenenden kann eine einzige, größere Ration gegeben werden. 12 Stunden vor der Probenahme/Sektion sollten die Fische nicht mehr gefüttert werden.
28. Das Fischfutter ist auf Verunreinigungen wie chlororganische Pestizide, polyzyklische aromatische Kohlenwasserstoffe (PAK) und polychlorierte Biphenyle (PCB) zu untersuchen. Futter mit erhöhtem Gehalt an Phytoöstrogenen, die die Testreaktion auf bekannte Östrogenagonisten (z.B. 17-beta-Östradiol) beeinträchtigen würden, darf nicht verwendet werden.
29. Nicht aufgenommenes Futter und Fäkalien sind mindestens zweimal wöchentlich aus den Prüfgefäßen zu entfernen (etwa durch vorsichtiges Absaugen vom Beckenboden).
Licht und Temperatur
30. Die Photoperiode (Hell-/Dunkel-Phasen) und die Wassertemperatur müssen Testspezies entsprechen (siehe Anlage 2).
Häufigkeit der Analysen und Messungen
31. Vor Beginn der Exposition ist zu überprüfen, ob die Chemikalienbeschickung einwandfrei funktioniert. Es dürfen ausschließlich anerkannte Analysemethoden angewandt werden, und die Stabilität der Chemikalie im Prüfsystem muss hinreichend bekannt sein. Während des Tests sind die Konzentrationen der Prüfchemikalie in regelmäßigen Zeitabständen wie folgt zu bestimmen: Die Zuflussmengen der Verdünnungslösung und der Stammlösung der Prüfchemikalie sind regelmäßig - vorzugsweise täglich, jedoch mindestens zweimal wöchentlich - zu kontrollieren und sollten während des gesamten Tests um maximal 10 % schwanken. Die tatsächlichen Konzentrationen der Prüfchemikalie sollten zu Beginn des Tests in allen Gefäßen und danach wöchentlich gemessen werden.
32. Die Ergebnisse sollten auf gemessenen Konzentrationen basieren. Wurde die Konzentration der Chemikalienlösung während des gesamten Tests jedoch zufriedenstellend innerhalb der nominellen Konzentration ((± 20 %) gehalten, so können sich die Ergebnisse auf die nominalen oder die gemessenen Werte beziehen.
33. Unter Umständen müssen die Proben gefiltert (z.B. mit Filtern einer Porengröße von 0,45 µm) oder zentrifugiert werden. Erforderlichenfalls ist Zentrifugierung vorzuziehen. Prüfchemikalien, die sich nachweislich nicht an Filter adsorbieren, können auch filtriert werden.
34. Während des Tests sollten bei allen Prüfgefäßen mindestens einmal wöchentlich der gelöste Sauerstoff, die Temperatur und der pH-Wert gemessen werden. Die Gesamthärte und die Gesamtalkalität sollten in den Kontrollen und in einem Gefäß mit höchster Testkonzentration ebenfalls mindestens einmal wöchentlich gemessen werden. Es wird empfohlen, dass die Temperatur in mindestens einem Prüfgefäß kontinuierlich überwacht wird.
Beobachtungen
35. Im Laufe oder am Ende des Assay sind verschiedene allgemeine Reaktionen (z.B. Überleben) sowie spezifische biologische Reaktionen (z.B. Vitellogenin-Gehalt) zu bestimmen. Die Messung und Auswertung dieser Endpunkte und die Verwendbarkeit der Ergebnisse werden im Folgenden erläutert.
Überleben
36. Die Fische sind während des Tests täglich zu kontrollieren; Todesfälle sind zu protokollieren und tote Fische sobald wie möglich zu entfernen. Tote Fische dürfen weder in Kontroll- noch in Prüfgefäße eingesetzt werden. Das Geschlecht der im Test gestorbenen Fische wird durch makroskopische Gonadenuntersuchung bestimmt.
Verhalten und Aussehen
37. Jegliches anomale Verhalten (gemessen an den Kontrollen) ist zu protokollieren. Dies gilt für Anzeichen allgemeiner Toxizität ebenso wie für Hyperventilation, unkoordinierte Schwimmbewegungen, Gleichgewichtsverluste und atypische Apathie oder ungewöhnliches Fressverhalten. Zudem sind äußerliche Auffälligkeiten (z.B. Blutungen oder Verfärbungen) aufzuzeichnen. Derartige Anzeichen einer toxischen Wirkung sind bei der Datenauswertung insoweit sorgfältig zu berücksichtigen, als sie auf Konzentrationen hinweisen können, bei denen die Biomarker endokriner Wirkungen keine zuverlässigen Rückschlüsse gestatten. Diese Verhaltensauffälligkeiten können auch wertvolle qualitative Informationen liefern, an denen sich künftige Fischtests orientieren können. Bei Dickkopfelritzen wurde unter Einwirkung von Androgenen beispielsweise aggressives Territorialverhalten bei normalen Männchen oder maskulinisierten Weibchen beobachtet. Bei Zebrabärblingen hemmen Östrogene oder Anti-Androgene das typische Paarungs- und Laichverhalten bei einsetzender Morgendämmerung.
38. Da sich verschiedene äußere Merkmale (in erster Linie die Farbe) beim Hantieren der Fische rasch verändern können, sind qualitative Beobachtungen vor der Entnahme von Fischen aus dem Prüfsystem wichtig: Bisherige Erfahrungen mit Dickkopfelritzen führen zu dem Schluss, dass einige endokrin wirkende Chemikalien anfangs zu Veränderungen der folgenden äußeren Merkmale führen: Körperfarbe (hell oder dunkel), Farbmusterung (Auftreten vertikaler Streifen) und Körperform (im Kopf- oder Schwanzbereich). Daher muss im Laufe und am Ende des Tests das äußere Erscheinungsbild der Fische kontrolliert werden.
Schmerzfreies Töten
39. An Tag 21, d. h. bei Ablauf der Expositionsdauer, sind die Fische mit angemessenen Mengen Tricain (Tricainmethansulfonat, Metacain, MS-222 (CAS 886-86-2), 100-500 mg/l gepuffert mit 300 mg/l NaHCO3 (Natriumbicarbonat, CAS 144-55-8) zu töten, um Schleimhautreizungen zu begrenzen. Anschließend wird zur Vitellogenin-Bestimmung Blut oder Gewebe entnommen, wie im Abschnitt über Vitellogenin beschrieben.
Untersuchung sekundärer Geschlechtsmerkmale
40. Manche endokrin wirkende Chemikalien können Veränderungen spezifischer sekundärer Geschlechtsmerkmale (Anzahl Laichknoten ('Nuptialtuberkel') bei männlichen Dickkopfelritzen oder bei männlichen Japanischen Reiskärpflingen) zur Folge haben. Insbesondere Papillenprozesse Chemikalien mit bestimmten Wirkungsweisen können bei Tieren des jeweils anderen Geschlechts zu Anomalien der sekundären Geschlechtsmerkmale führen. So können Androgenrezeptor-Agonisten wie Trenbolon, Methyltestosteron und Dihydrotestosteron bewirken, dass weibliche Dickkopfelritzen ausgeprägten Laichausschlag ('Nuptialtuberkel') entwickeln oder dass bei weiblichen Japanischen Reiskärpflingen Papillenprozesse auftreten (11)(20)(21). Außerdem wurde berichtet, dass Östrogenrezeptor-Agonisten dazu führen können, dass sich die Zahl der Laichknoten und die Größe des dorsalen Nackenaufwuchses bei adulten Männchen verringern (25)(26). Diese wesentlichen morphologischen Beobachtungen können auch eine qualitativ und quantitativ wertvolle Informationsgrundlage für potenzielle künftige Fischtests liefern. Anzahl und Größe der Laichknoten bei Dickkopfelritzen und Papillenprozesse bei Japanischen Reiskärpflingen können entweder direkt oder - bequemer - an konservierten Exemplaren gezählt werden. Die Anlagen 5A und 5B enthalten Empfehlungen für Verfahren zur Beurteilung sekundärer Geschlechtsmerkmale bei Dickkopfelritzen bzw. Japanischen Reiskärpflingen.
Vitellogenin (VTG)
41. Das für die VTG-Bestimmung erforderliche Blut wird mit einem heparinisierten Mikrohämatokrit-Kapillarröhrchen aus der Schwanzarterie/-vene oder alternativ durch Herzpunktion mit einer Spritze entnommen. Je nach Größe der Fische werden bei Dickkopfelritzeen 5-60 µl und bei Zebrabärblingen 5-15 µl Blut (jeweils pro Fisch) benötigt. Das Plasma wird durch Zentrifugieren vom Blut getrennt und mit Proteasehemmern bis zur Vitellogenin-Analyse bei - 80 °C aufbewahrt. Alternativ kann bei Zebrabärblingen die Leber verwendet werden; bei Zebrabärblingen kommen Kopf-/Schwanz-Homogenate als Gewebematerial für die Vitellogenin-Analyse in Betracht (Anlage 6). Die VTG-Messung sollte nach einer validierten homologen ELISA-Methode mit homologem VTG-Standard und homologen Antikörpern erfolgen. Empfohlen werden Methoden, mit denen kleinste VTG-Gehalte (wenige ng/ml Plasma oder ng/mg Gewebe, die der Hintergrundkonzentration bei nicht exponierten männlichen Fischen entsprechen) ermittelt werden können.
42. Die Qualitätskontrolle der Vitellogenin-Analyse erfolgt anhand von Standards, Blindproben und zumindest Doppelanalysen. Für jede ELISA-Methode ist ein Test auf Matrixeffekte (Effekte der Probenverdünnung) vorzunehmen, um den Mindestverdünnungsfaktor zu ermitteln. Alle für VTG-Analysen verwendeten ELISA- Platten müssen zumindest auch folgende Proben für die Qualitätskontrolle enthalten: 6 Kalibrierstandards für den gesamten Bereich der erwarteten Vitellogenin-Konzentrationen und eine nicht spezifische Binding-Assay- Blindprobe (doppelt zu analysieren). Die Absorption dieser Blindproben sollte weniger als 5 % der maximalen Adsorption des Kalibrierstandards betragen. Von jeder Verdünnung sind mindestens zwei Aliquoten (Muldenduplikate) zu analysieren. Duplikatmulden mit über 20 % Differenz sollten ein zweites Mal analysiert werden.
43. Der Korrelationskoeffizient (R2) für Kalibrierkurven sollte größer als 0,99 sein. Eine hohe Korrelation reicht jedoch nicht aus, um in allen Bereichen Konzentrationen adäquat vorabzuschätzen. Neben der Notwendigkeit einer hinreichend hohen Korrelation für die Kalibrierkurve sollte alle aus der Kalibrierkurve errechneten Konzentrationen der einzelnen Standards im Bereich von 70-120 % der jeweiligen nominellen Konzentration liegen. Wenn die nominellen Konzentrationen tendenziell von der Regressionsgeraden abweichen (beispielsweise bei niedrigeren Konzentrationen), muss die Kalibrierkurve möglicherweise in niedrige und hohe Bereiche aufgeteilt oder ein nicht lineares Modell für die Adsorptionsdaten verwendet werden. Bei geteilten Kurven muss der Korrelationskoeffizient R2 bei beiden Segmenten > 0,99 sein.
44. Als Nachweisgrenze wird die Konzentration des niedrigsten Analysestandards bezeichnet; die Quantifizierungsgrenze ist die Konzentration des niedrigsten Analysestandards multipliziert mit dem niedrigsten Verdünnungsfaktor.
45. An den Tagen, an denen Vitellogenin-Analysen stattfinden, ist eine mit einem Inter-Assay-Referenzstandard hergestellte Anreicherungsprobe zu analysieren (Anlage 7). Das Verhältnis der erwarteten zur gemessenen Konzentration ist zusammen mit den Ergebnissen der am diesem Tag durchgeführten Testreihen aufzuzeichnen.
Auswertung von Biomarkerreaktionen durch Varianzanalyse (ANOVA)
46. Um die potenziell endokrine Aktivität einer Chemikalie zu ermitteln, werden die Wirkungen in den Prüf- und in den Kontrollgefäßen mittels Varianzanalyse (ANOVA) verglichen. Wird eine Lösungsmittelkontrolle verwendet, sollten Verdünnungswasser und Lösungsmittelkontrollen zur Bestimmung des jeweiligen Endpunkts nach geeigneten Methoden statistisch analysiert werden. Für Leitlinien zur Verwendung der Daten über Verdünnungswasser und Lösungsmittelkontrollen für die anschließende statistische Analyse siehe OECD 2006c (27). Alle Daten zu biologischen Reaktionen sind nach Geschlechtern zu analysieren und aufzuzeichnen. Sind die Voraussetzungen für parametrische Methoden nicht erfüllt, d. h. keine Normalverteilung (z.B. Shapiro- Wilk-Test) oder heterogene Varianz (Bartlett-Test oder Levene-Test), sollte vor der ANOVA eine Datentransformation zur Varianzhomogenisierung in Betracht gezogen oder eine gewichtete ANOVA durchgeführt werden. Bei nicht monotonen Dosis-Wirkungs-Beziehungen kann der (parametrische) Dunnett-Test (Paarvergleiche) oder ein (nicht parametrischer) Mann-Whitney-Test mit Anpassung nach Bonferroni durchgeführt werden. Andere statistische Tests kommen ebenfalls in Betracht (z.B. ein Jonckheere-Terpstra- oder ein Williams-Test), wenn die Dosis-Wirkungs-Beziehung annähernd monoton ist. Das statistische Flussdiagramm in Anlage 8 soll die Auswahl des jeweils am besten geeigneten statistischen Tests erleichtern. Für weitere Informationen siehe OECD-Dokument 'Current Approaches to Statistical Analysis of Ecotoxicity Data' (27).
Testergebnisse
47. Die Versuchsdaten sollten Folgendes umfassen:
Prüfinstitut:
- Verantwortliche Mitarbeiter und ihre jeweiligen Zuständigkeiten im Rahmen des Assay
- Jedes Labor muss seine Eignung anhand repräsentativer Chemikalien nachweisen.
Prüfchemikalie:
- Charakterisierung der Prüfchemikalie;
- physikalischer Zustand und physikalisch-chemische Eigenschaften;
- Methode und Häufigkeit der Herstellung von Prüfkonzentrationen;
- Angaben zur Stabilität und zur biologischen Abbaubarkeit.
Lösungsmittel:
- Charakterisierung des Lösungsmittels (Beschaffenheit und verwendete Konzentration);
- Gründe für die Wahl des jeweiligen Lösungsmittels (wenn nicht nur Wasser als Lösungsmittel verwendet wird).
Zu testende Tiere:
- Art und Stamm;
- Bezugsquelle und Angaben zur jeweiligen Bezugsanlage;
- Alter der Fische zu Beginn des Tests und Reproduktions- /Laichstatus;
- Angaben zur Akklimatisierungsverfahren;
- Körpergewicht der Fische zu Beginn der Exposition (aus einer Teilprobe des Fischbestands).
Prüfbedingungen:
- angewandte Prüfmethode (Testtyp, Besatz(verhältnis), Besatzdichte usw.);
- Methode für die Herstellung der Stammlösungen und Durchflussrate;
- nominelle Testkonzentrationen, wöchentlich gemessene Konzentrationen der Testlösungen und angewandte Analysemethode, mittlere Messwerte und Standardabweichungen in den Prüfgefäßen sowie Nachweis, dass sich die Messungen auf die Konzentrationen der Prüfchemikalie in der tatsächlichen Lösung beziehen;
- Merkmale des Verdünnungswassers (pH-Wert, Härte, Alkalität, Temperatur, Konzentration an gelöstem Sauerstoff, Restchlorgehalt, Gesamtgehalt an organischem Kohlenstoff, suspendierte Feststoffen und andere ermittelte Messwerte);
- Wasserqualität in den Prüfgefäßen; pH-Wert, Härte, Temperatur und Konzentration an gelöstem Sauerstoff;
- detaillierte Angaben zur Fütterung (Art des Futters, Bezugsquelle/Herkunft, verfütterte Menge und Häufigkeit der Fütterung sowie, soweit vorhanden, Analysen zur Feststellung etwaiger Schadstoffe (z.B. PCB, PAH und chlororganische Pestizide).
Ergebnisse
- Nachweis, dass die Kontrollen die Validitätskriterien des Tests erfüllen;
- Daten zu Mortalitäten für Testkonzentrationen und Kontrolle;
- angewandte statistische Analysemethoden, Datenauswertung und Gründe für die Wahl der angewandten Methoden;
- Daten zu biologischen Beobachtungen (deutliche morphologische Änderungen u. a. der sekundären Geschlechtsmerkmale und Vitellogenin-Konzentration);
- Ergebnisse der Datenanalysen, vorzugsweise in tabellarischer und in grafischer Form;
- ungewöhnliche Reaktionen der Fische sowie jegliche sichtbare Wirkungen der Prüfchemikalie.
Leitlinien für die Auswertung und Validität der Testergebnisse
48. Dieser Abschnitt enthält Empfehlungen für die Auswertung der Testergebnisse für die gemessenen Endpunkte. Die Ergebnisse sind mit Vorsicht zu interpretieren, wenn die Prüfchemikalie eindeutig toxisch wirkt oder den Allgemeinzustand der Testtiere verschlechtert.
49. Bei der Festlegung der Bandbreite der Prüfchemikalienkonzentrationen ist darauf zu achten, dass die für eine aussagekräftige Datenauswertung höchste noch verträgliche Konzentration nicht überschritten wird. Wichtig ist dabei, dass bei mindestens einer Konzentration keine Anzeichen einer toxischen Wirkung festgestellt werden. Krankheitssymptome und Anzeichen toxischer Wirkungen sind gründlich zu untersuchen und aufzuzeichnen. Beispielsweise kann die VTG-Produktion bei weiblichen Tieren auch durch allgemeine Toxizität und nichtendokrine toxische Wirkungsweisen (z.B. durch Hepatotoxizität) beeinträchtigt werden. Die Wirkungsauswertung lässt sich jedoch durch andere Konzentrationen untermauern, die nicht durch systemische Toxizität beeinträchtigt werden.
50. Um Testergebnisse als gültig anerkennen zu können, müssen bestimmte Aspekte berücksichtigt werden. Als Faustregel gilt, dass sich die VTG-Konzentrationen in Kontrollgruppen männlicher und weiblicher Fische bei Dickkopfelritzen und bei Zebrabärblingen in etwa um mindestens drei Größenordnungen und bei Japanischen Reiskärpflingen in etwa um mindestens eine Größenordnung unterscheiden müssen. Für Beispiele für den Konzentrationsbereich bei Kontroll- und Behandlungsgruppen siehe Validierungsberichte (1)(2)(3)(4). Hohe VTG-Konzentrationen bei männlichen Kontrollfischen könnten die Aussagekraft des Assay und dessen Fähigkeit zum Nachweis schwacher Östrogen-Agonisten beeinträchtigen. Und niedrige VTG-Konzentrationen bei weiblichen Kontrollfischen könnten die Aussagekraft des Assays und dessen Fähigkeit zum Nachweis von Aromatasehemmern und Östrogen-Antagonisten beeinträchtigen. Diese Leitlinien beruht auf diesen Validierungsstudien.
51. Führt ein Labor den Assay zum ersten Mal durch oder wurden wesentliche Änderungen vorgenommen (beispielsweise Änderungen des Fischstammes oder der Bezugsquelle), sollte eine technische Eignungsprüfung durchgeführt werden. Nach Möglichkeit sollten Chemikalien verwendet werden, die ein breites Spektrum an Wirkungsweisen oder Wirkungen auf mehrere Test-Endpunkte abdecken. Die Labors werden aufgefordert, für männliche und weibliche Tiere eigene historische Kontrolldaten zu sammeln und eine positive Kontrollchemikalie (z.B. 17β-Öestradiol in einer Konzentration von 100 ng/l oder einen bekannten schwachen Agonisten) auf östrogene Wirkung mit erhöhter VTG-Konzentration in männlichen Fischen, eine positive Kontrollchemikalie (z.B. Fadrozol oder Prochloraz in einer Konzentration von 300 µg/l) auf Aromatosehemmung mit reduzierter VTG-Konzentration in weiblichen Fischen und eine positive Kontrollchemikalie (z.B. 17β-Trenbolon in einer Konzentration von 5 µg/l) auf androgene Wirkung und resultierender Induktion sekundärer Geschlechtsmerkmale bei weiblichen Dickkopfelritzen und weiblichen Japanischen Reiskärpflingen zu prüfen. Diese Daten können insgesamt mit verfügbaren Daten aus den Validierungsstudien (1)(2)(3) verglichen werden, um die Eignung des jeweiligen Labors sicherzustellen.
52. Grundsätzlich gelten Vitellogenin-Messungen als positiv, wenn eine statistisch signifikante (p < 0,05) Erhöhung der VTG-Konzentration in männlichen Fischen oder eine statistisch signifikante (p < 0,05) Reduzierung bei weiblichen Fischen zumindest bei der höchsten geprüften Dosis im Vergleich zur Kontrollgruppe festgestellt wird und keine Anzeichen einer allgemeinen Toxizität vorliegen. Ein positives Ergebnis wird auch durch Nachweis einer biologisch plausiblen Beziehung zwischen der Dosis- und der Wirkungskurve bestätigt. Wie bereits erläutert, muss eine Reduzierung der VTG-Konzentration nicht unbedingt endokrinen Ursprungs sein. Ein positives Ergebnis sollte jedoch grundsätzlich als Invivo-Nachweis einer endokrinen Wirkung ausgelegt werden und zur Klärung weitere Untersuchungen nach sich ziehen.
(1) OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
(2) OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
(3) OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
(4) Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.ceficlri.org/index.php? page="projects" (accessed 18/09/08).
(5) US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Nicht veröffentlichter Bericht vom 15. Dezember 2007. US Environmental Protection Agency, Washington, DC. 104 S.
(6) OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Followup of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
(7) Sumpter und Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173-8 Review.
(8) Pawlowski, S, Sauer, A., Shears, J.A., Tyler, C.R., Braunbeck, T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alphamethyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91.
(9) Andersen, L, Goto-Kazato, R., Trant, J.M., Nash, J.P., Korsgaard, B., Bjerregaard, P. (2006). Shortterm exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52.
(10) Ankley, G.T., Kahl, M.D., Jensen, K.M., Hornung, M.W., Korte, J.J., Makynen, E.A., Leino, R.L (2002). Evaluation of the aromatase inhibitor fadrozole in a shortterm reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences;67(1):121-30.
(11) Panter, G.H., Hutchinson, T.H., Hurd, K.S., Sherren, A., Stanley, R.D., Tyler, C.R. (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in prespawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21.
(12) Parks, L.G., Cheek, A.O., Denslow, N.D., Heppell, S.A., McLachlan, J.A., LeBlanc, G.A., Sullivan, C.V. (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113-25.
(13) Panter, G.H., Tyler, C.R., Maddix, S., Campbell, P.M., Hutchinson, T.H., Länge, R., Lye, C., Sumpter, J.P., 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG-Forschungsbericht AQ001. CEFIC, Brüssel, Belgien.
(14) Fenske, M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzymelinked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217-232.
(15) Holbech, H., Andersen, L., Petersen, G.I., Korsgaard, B., Pedersen, K.L., Bjerregaard, P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119-131
(16) Rose, J., Holbech, H., Lindholst, C., Noerum, U., Povlsen, A., Korsgaard, B., Bjerregaard, P. 2002. Vitellogenin induction by 17β-estradiol and 17ßethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531-539.
(17) Brion, F., Nilsen, B.M., Eidem, J.K., Goksoyr, A., Porcher, J.M., Development and validation of an enzymelinked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699-1708.
(18) Yokota, H., Morita, H., Nakano, N., Kang, I.J., Tadokoro, H., Oshima, Y., Honjo, T., Kobayashi, K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87-98.
(19) Tatarazako, N., Koshio, M., Hori, H., Morita, M., und Iguchi, T., 2004. Validation of an enzymelinked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301-308.
(20) Ankley, G.T., Jensen, K.M., Makynen, E.A., Kahl, M.D., Korte, J.J., Homung, M.W., Henry T.R., Denny, J.S., Leino, R.L., Wilson, V.S., Cardon, M.C., Hartig, P.C., Gray, L.E. (2003). Effects of the androgenic growth promoter 17- betatrenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
(21) Seki, M., Yokota, H., Matsubara, H., Maeda, M., Tadokoro, H., Kobayashi, K. (2004). Fish full lifecycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23 (3):774-81.
(22) OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
(23) Hutchinson, T.H., Shillabeer, N., Winter, M.J., Pickford, D.B., 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; S. 69-92.
(24) Hutchinson, T.H., Ankley, G.T., Segner, H, Tyler, C.R., 2006b. Screening and testing for endocrine disruption in fishbiomarkers as ,signposts," not ,traffic lights," in risk assessment. Environmental Health Perspectives;114 Suppl 1:106-14.
(25) Miles-Richardson, S.R., Kramer, V.J., Fitzgerald, S.D., Render, J.A., Yamini, B., Barbee, S.J., Giesy, J.P. 1999. Effects of waterborne exposure to 17ßestradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129-145.
(26) Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve und G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co- treatment with an androgen to confirm an antiandrogenic mode of action. Environ. Toxicol. Chem. 27, 478- 488.
(27) OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD-Veröffentlichungen zu Gesundheit und Arbeitsschutz, Reihe ,Testing and Assessment', Nr. 54, ENV/JM/ MONO(2006)18
(28) OECD (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (geänd.). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22
| Abkürzungen und Begriffsbestimmungen | Anlage 1 |
Chemikalie: Stoff oder Gemisch.
VK: Variationskoeffizient.
ELISA: Enzyme-Linked Immunosorbent Assay.
Besatz: Verhältnis des Nassgewichts der Fische zum Wasservolumen.
Besatzdichte: Anzahl Fische je Wasservolumen.
VTG (Vitellogenin): Phospholipoglycoprotein-Vorläufer für Eidotterprotein, das in der Regel bei geschlechtlich aktiven weiblichen Tieren aller eierlegenden Arten vorkommt.
HPG-Achse: Hypothalamus-Hypophysen-Gonaden-Achse.
MTC: höchste noch verträgliche Konzentration, etwa 10 % des LC50-Werts.
Prüfchemikalie: Stoff oder Gemisch, der bzw. das nach dieser Prüfmethode getestet wird.
| Versuchsbedingungen für den Fisch-Screening-Test zur Bestimmung endokriner Wirkungen | Anlage 2 |
| 1. Empfohlene Arten |
Dickkopfelritze |
Japanischer Reiskärpfling |
Zebrabärbling |
| 2. Testtyp | Durchflusssystem | Durchflusssystem | Durchflusssystem |
| 3. Wassertemperatur | 25 ± 2 °C | 25 ± 2 °C | 26 ± 2 °C |
| 4. Beleuchtung | Leuchtstofflampen (breites Spektrum) | Leuchtstofflampen (breites Spektrum) | Leuchtstofflampen (breites Spektrum) |
| 5. Lichtintensität | 10-20 µE/m2/s, 540-1.000 lx, oder 50-100 ft-c (Laborqualität) | 10-20 µE/m2/s, 540-1.000 lx, oder 50-100 ft-c (Laborqualität) | 10-20 µE/m2/s, 540-1.000 lx, oder 50-100 ft-c (Laborqualität) |
| 6. Photoperiode (Mor- gen-/Abenddämme- rungsphasen optional; nicht unbedingt erforderlich) | 16 Std. Licht, 8 Std. Dunkelheit | 12-16 Std. Licht, 12-8 Std. Dunkelheit | 12-16 Std. Licht, 12-8 Std. Dunkelheit |
| 7. Besatz | < 5 g/l | < 5 g/l | < 5 g/l |
| 8. Größe der Prüfkammern | 10 l (mind.) | 2 l (mind.) | 5 l (mind.) |
| 9. Volumen der Testlösung | 8 l (mind.) | 1,5 l (mind.) | 4 l (mind.) |
| 10. Erneuerung der Testlösungen | Mindestens 6-mal täglich | Mindestens 5-mal täglich | Mindestens 5-mal täglich |
| 11. Alter der Testorganismen | Siehe Nummer 20 | Siehe Nummer 20 | Siehe Nummer 20 |
| 12. Ungefähres Nassgewicht der adulten Fische (g) | Weibchen: 1,5 ± 20 % Männchen: 2,5 ± 20 % | Weibchen: 0,35 ± 20 % Männchen: 0,35 ± 20 % | Weibchen: 0,65 ± 20 % Männchen: 0,4 ± 20 % |
| 13. Anzahl Fische pro Prüfgefäß | 6 (2 Männchen, 4 Weibchen) | 10 (5 Männchen, 5 Weibchen) | 10 (5 Männchen, 5 Weibchen) |
| 14. Anzahl der Behandlungen | = 3 (sowie entsprechende Kontrollen) | = 3 (sowie entsprechende Kontrollen) | = 3 (sowie entsprechende Kontrollen) |
| 15. Anzahl Gefäße je Behandlung | Mindestens 4 | Mindestens 2 | Mindestens 2 |
| 16. Anzahl der Fische je Testkonzentration | 16 adulte Weibchen und 8 Männchen (4 Weibchen und 2 Männchen pro Replikatgefäß) | 10 adulte Weibchen und 10 Männchen (5 Weibchen und 5 Männchen pro Replikatgefäß) | 10 adulte Weibchen und 10 Männchen (5 Weibchen und 5 Männchen pro Replikatgefäß) |
| 17. Fütterungsregime | Lebende oder tiefgefrorene adulte Salinenkrebse oder Salinenkrebs-Nauplien zwei- bis dreimal täglich (ad libitum), handelsübliches Futter oder beides in Kombination | Salinenkrebs-Nauplien zwei- bis dreimal täglich (ad libitum), handelsübliches Futter oder beides in Kombination | Salinenkrebs-Nauplien zwei- bis dreimal täglich (ad libitum), handelsübliches Futter oder beides in Kombination |
| 18. Belüftung | Keine, es sei denn, der Gehalt an gelöstem Sauerstoff fällt unter eine Luftsättigung von 60 % | Keine, es sei denn, der Gehalt an gelöstem Sauerstoff fällt unter eine Luftsättigung von 60 % | Keine, es sei denn, der Gehalt an gelöstem Sauerstoff fällt unter eine Luftsättigung von 60 % |
| 19. Verdünnungswasser | Sauberes Oberflächen- oder Brunnenwasser oder rekonstituiertes Wasser oder entchlortes Leitungswasser | Sauberes Oberflächen- oder Brunnenwasser oder rekonstituiertes Wasser oder entchlortes Leitungswasser | Sauberes Oberflächen- oder Brunnenwasser oder rekonstituiertes Wasser oder entchlortes Leitungswasser |
| 20. Dauer der Präexposition | möglichst 7 Tage | möglichst 7 Tage | möglichst 7 Tage |
| 21. Expositionsdauer | 21 Tage (d) | 21 Tage (d) | 21 Tage (d) |
| 22. Biologische Endpunkte | Überleben Verhalten Sekundäre Geschlechtsmerkmale VTG | Überleben Verhalten Sekundäre Geschlechtsmerkmale VTG | Überleben Verhalten VTG |
| 23. Validität des Tests | Gelöster Sauerstoff > 60 % Sättigung; mittlere Temperatur 25 ± 2 °C; 90 %ige Überlebensrate der Fische in den Kontrollen; gemessene Testkonzentrationen innerhalb von 20 % der mittleren Messwerte je Behandlungsstufe. | Gelöster Sauerstoff > 60 % Sättigung; mittlere Temperatur 24 ± 2 °C; 90 %ige Überlebensrate der Fische in den Kontrollen; gemessene Testkonzentrationen innerhalb von 20 % der mittleren Messwerte je Behandlungsstufe. | Gelöster Sauerstoff > 60 % Sättigung; mittlere Temperatur 26 ± 2 °C; 90 %ige Überlebensrate der Fische in den Kontrollen; gemessene Testkonzentrationen inneralb von 20 % der mittleren Messwerte je Behandlungsstufe. |
| Chemische Merkmale eines geeigneten Verdünnungswassers | Anlage 3 |
| Bestandteil | Konzentrationen |
| Partikel | < 20 mg/l |
| Gesamtgehalt an organischen Kohlenstoffen | < 2 mg/l |
| Nichtionisiertes Ammonium | < 1 µg/l |
| Restchlor | < 10 µg/l |
| Gesamtgehalt an phosphororganischen Pestiziden | < 50 ng/l |
| Gesamtgehalt an chlororganischen Pestiziden plus polychlorierten Bipheny- len | < 50 ng/l |
| Gesamtgehalt an organischem Chlor | < 25 ng/l |
| Laichsubstrat für Zebrabärblinge | Anlage 4A |
Laichschale: beliebige Instrumentenschale aus Glas, beispielsweise 22 × 15 × 5,5 cm (L × B × T), abgedeckt mit abnehmbarem Maschendrahtgitter aus Edelstahl (Maschenweite 2 mm); das Gitter sollte die Schale unterhalb des Randes komplett abdecken.

Auf dem Gitter das Laichsubstrat fixieren. Dabei eine Struktur gewährleisten, in die sich die Fische zurückziehen können. Geeignet sind beispielsweise Aquarienpflanzen aus grünem Kunststoff. (Hinweis: eine mögliche Adsorption der Prüfchemikalie an das Kunststoffmaterial muss in diesem Fall berücksichtigt werden.) Das Kunststoffmaterial in einer ausreichenden Menge warmen Wassers waschen, um sicherzustellen, dass etwa vorhandene Chemikalien ausgetrieben werden und nicht in das Testwasser gelangen. Bei Verwendung von Materialien aus Glas ist sicherzustellen, dass die Fische weder verletzt noch bei heftigen Schwimmbewegungen eingeengt werden.
Der Abstand zwischen der Schale und den Glasscheiben muss mindestens 3 cm betragen, damit die Laichablage nicht außerhalb der Schale erfolgt. Die in die Schale abgelegten Eier fallen durch das Gitter und können 45-60 Minuten nach Einschalten der Beleuchtung entnommen werden. Die transparenten Eier haften nicht aneinander an und können bei transversaler Beleuchtung leicht gezählt werden. Bei fünf Weibchen pro Gefäß gelten bis zu 20 Eier/ Tag als wenig, bis zu 100 Eier/Tag als mittel und über 100 Eier/Tag als viel. Die Laichschale herausnehmen, die Eier einsammeln und die Laichschale wieder in das Prüfgefäß stellen - entweder so spät wie möglich am Abend oder sehr früh am Morgen. Bis zum erneuten Einstellen darf höchstens eine Stunde vergehen, da der vom Laichsubstrat ausgehende Reiz dazu führen kann, dass es zu ungewöhnlichen Zeitpunkten zu Paarung und Laichablage kommt. Wird die Laichschale dennoch später in die das Prüfbecken gestellt, so sollte dies frühestens 9 Stunden nach dem Einschalten der Beleuchtung geschehen. Zu diesem späten Tageszeitpunkt erfolgt keine Laichablage mehr.
| Laichsubstrat für Dickkopfelritzen | Anlage 4B |
Zwei oder drei kombinierte Platten und Schalen aus Kunststoff/Keramik/Glas oder Edelstahl als Laichunterlage in die Prüfkammern (z.B. 80 mm lange graue halbrunde Rinnen, aufgesetzte auf eine gebördelte, 130 mm lange Schale) stellen (siehe Abbildung). Gut akklimatisierte PVC- oder Keramikkacheln haben sich als Laichunterlage bewährt (Thorpe et al, 2007).
Die Platten anrauhen, um die Haftung zu verbessern. Wenn nicht erwiesen ist, dass die Eier zuverlässig an der Laichunterlage haften, die Schalen außerdem mit einem Gitter abdecken, damit die Fische nicht an herabgefallene Eier gelangen.

Die Unterlage soll alle Eier aufnehmen können, die nicht an der Plattenoberfläche haften bleiben und folglich auf den Boden des Beckens fallen (sowie alle Eier, die direkt auf der flache Kunststoffunterlage abgelegt werden). Alle Laichunterlagen sind vor Gebrauch mindestens 12 Stunden mit Verdünnungswasser zu spülen, um etwa vorhandene Schadstoffe auszutreiben.
Thorpe, K.L., Benstead, R., Hutchinson, T.H., Tyler, C.R., 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90-98.
| Bewertung der sekundären Geschlechtsmerkmale bei Dickkopfelritzen zum Nachweis bestimmter Chemikalien mit endokriner Wirkung | Anlage 5A |
Übersicht
Für Tests zum Nachweis endokriner Disruptoren potenziell wichtige äußere Merkmale bei adulten Dickkopfelritzen sind die Körperfarbe (hell/dunkel), die Farbmusterung (Vorhandensein oder Nichtvorhandensein senkrechter Streifen), die Körperform (Kopf- und Rumpfform, abdominale Distension) sowie spezifische sekundäre Geschlechtsmerkmale (Zahl und Größe der Laichknoten (Nuptialtuberkel), Größe des dorsalen Nackenaufwuchses und des Ovipositors).
Laichausschlag (Nuptialtuberkel) tritt am Kopf (dorsaler Aufwuchs) paarungsbereiter männlicher Dickkopfelritzen auf, gewöhnlich beidseitig symmetrisch (Jensen et al. 2001). Bei weiblichen Kontrollfischen sowie juvenilen männlichen und weiblichen Fischen zeigen sich keine Tuberkel (Jensen et al. 2001). Um die Augen und zwischen den Nasenöffnungen männlicher Tiere können sich bis zu acht Tuberkel bilden. Die meisten und größten Tuberkel finden sich in zwei parallelen Reihen unmittelbar unter den Nasenöffnungen und über dem Maul. Bei vielen Fischen befinden sich Tuberkelgruppierungen auch unterhalb des Unterkiefers; die in unmittelbarer Nähe des Mauls befindlichen Tuberkel treten gewöhnlich als einzelnes Paar auf; ventral können sich Gruppen von bis zu vier Tuberkel entwickeln. In der Regel bilden sich selten mehr als 30 Tuberkel (typischerweise 18-28; Jensen et al. 2001). Zumeist entwickeln sich Nuptialtuberkel als einzelne, verhältnismäßig runde Ausstülpungen, deren Höhe in etwa ihrem Radius entspricht. Die meisten paarungsbereiten Männchen weisen zumindest auch einige Tuberkel auf, die derart groß und auffällig sind, dass sie als Einzelstrukturen kaum noch erkennbar sind.
Einige Arten endokrin wirkender Chemikalien können beim jeweils anderen Geschlecht zu anomalen sekundären Geschlechtsmerkmalen führen. So können Androgenrezeptor-Agonisten wie 17ß-Methyltestosteron oder 17β-Trenbolon bewirken, dass sich bei weiblichen Dickkopfelritzen Nuptialtuberkel bilden (Smith 1974; Ankley et al. 2001; 2003), während Östrogenrezeptor-Agonisten bei männlichen Tieren zu einer Verringerung der Anzahl oder Größe der Tuberkel führen können (Miles-Richardson et al. 1999; Harries et al. 2000).
Laichausschlag bei Dickkopfelritzen wird nachstehend nach Verfahren charakterisiert, wie sie im Labor der US- amerikanischen Umweltschutzbehörde (Environmental Protection Agency) in Duluth, MN, üblich sind. Spezifische Produkte und/oder Geräte können durch verfügbare vergleichbare Materialien ersetzt werden.
Eine Sichtprüfung erfolgt am besten unter einem beleuchteten Vergrößerungsglas oder einem beleuchteten Stereomikroskop mit Dreifach-Vergrößerung. Die Fische dorsal mit der vorderen Körperhälfte nach vorne zeigend (d. h. Kopf zum Betrachter hin) untersuchen.
- Fisch mit vorderen Körperhälfte nach vorne zeigend und in Bauchlage in eine kleine Petrischale (z.B. 100 mm Durchmesser) legen. Sucher scharf einstellen, damit die Tuberkel erkennbar werden. Fisch vorsichtig und langsam von einer Seite auf die andere drehen, um die Areale mit Tuberkeln zu bestimmen. Tuberkel zählen und einstufen.
- Untersuchung an der ventralen Kopfseite wiederholen; dazu den Fisch mit der dorsalen vorderen Körperhälfte nach vorne zeigend in die Petrischale legen.
- Die Untersuchung sollte pro Fisch nicht länger als 2 Minuten dauern.
Zählen und Einstufen der Laichknoten (Nuptialtuberkel)
Zur Bewertung der Ausprägung des Laichausschlags bei adulten Dickkopfelritzen wurden sechs Areale identifiziert. Zur Darstellung der Region und der Zahl vorhandener Tuberkel wurde eine Vorlage (Formular) entwickelt (siehe Ende dieses Anhangs). Die Zahl der Tuberkel aufzeichnen, und die Tuberkel der Größe nach wie folgt einstufen: 0 - keine Tuberkel, 1 - präsent, 2 - vergrößert und 3 - ausgeprägt (Abb. 1).
Bewertung 0 bedeutet, dass keine Tuberkel vorhanden sind. Bewertung 1 - Tuberkel präsent - betrifft jeden Knoten, bei dem eine einzelne Ausstülpung in etwa dem Radius des Knotens (Halbmesser) entspricht. Bewertung 2 - vergrößerter Tuberkel - betrifft Knoten mit sternförmig ausgebildetem Gewebe, das sich in der Regel durch eine große Grundfläche mit von der Mitte ausgehenden Rillen oder Furchen auszeichnet. Nach oben sind die Tuberkel häufig stärker gezackt, können aber auch abgerundet sein. Bewertung 3 - ausgeprägter Laichausschlag - bedeutet in der Regel, dass das Areal verhältnismäßig groß und abgerundet und weniger strukturiert ist. Manchmal verschmelzen diese Tuberkel entlang einer oder mehrerer Regionen (B, C und D; s. u.). Farbe und Form sind ähnlich wie bei Bewertung 2, was manchmal die Unterscheidung erschwert. Eine Einstufung nach diesem System ergibt bei normalen männlichen Kontrollexemplaren mit 18-20 Tuberkeln einen Gesamtwert von < 50 Tuberkeln (Jensen et al. 2001).

Die tatsächliche Anzahl Tuberkel kann bei bestimmten Fischen größer sein als das Formularfeld (Anlage A) für das einzustufende Ausschlagareal zulässt. In diesem Fall können rechts oder links neben dem betreffenden Feld zusätzliche Einstufungen angegeben werden. Die Vorlage muss daher nicht unbedingt Symmetrie aufzeigen. Eine weitere Methode zur Veranschaulichung paarweise auftretender oder vertikal auf der horizontalen Ebene des Mauls verbundener Tuberkel besteht in der doppelten Markierung zweier Einstufungen innerhalb eines einzigen Feldes.
Darzustellende Tuberkelregionen:
A - Augenregion:
Dorsal bis ventral um den vorderen Augenrand; in der Regel viele Tuberkel bei geschlechtsreifen männlichen Kontrollexemplaren; bei weiblichen Kontrollexemplaren nicht präsent; in der Regel paarweises Auftreten
(jeweils ein Tuberkel in der Nähe des Auges) bzw. Einzelvorkommen bei androgenexponierten weiblichen Tieren.
B - Nasenregion zwischen Nasengruben (Sensorkanalporen): bei männlichen Kontrollexemplaren in der Regel paarweises Auftreten in stärkerer Ausprägung (2 - vergrößert - oder 3 - stark ausgeprägt); bei weiblichen Kontrollexemplaren nicht präsent, jedoch vereinzeltes Vorkommen bei androgenexponierten weiblichen Tieren.
C - Nasenregion unmittelbar vor den Nasengruben, parallel zum Maul: In der Regel vergrößert oder stark ausgeprägt bei männlichen Kontrollexemplaren; bei weniger entwickelten männlichen Tieren oder androgen- exponierten weiblichen Tieren präsent oder vergrößert.
D - Maulregion (entlang der Maullinie): Bei männlichen Kontrollexemplaren in der Regel ausgeprägt; bei weiblichen Kontrollexemplaren nicht präsent; bei androgenexponierten weiblichen Tieren können jedoch Tuberkel vorkommen.
E - Unterkieferregion (nahe am Maul): gewöhnlich klein und gepaart; bei männlichen Kontroll- oder exponierten Fischen unterschiedlich ausgeprägt.
F - Rumpfregion (ventral zu E): In der Regel klein und gepaart; bei männlichen Kontrollexemplaren und androgen- exponierten weiblichen Tieren präsent.
(1) Ankley, G.T., Jensen, K.M., Kahl, M.D., Korte, J.J., Makynen. M.E.. 2001. Description and evaluation of a short- term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290.
(2) Ankley, G.T., Jensen, K.M., Makynen, E.A., Kahl, M.D., Korte, J.J., Hornung, M.W., Henry, T.R., Denny, J.S., Leino, R.L., Wilson, V.S., Cardon, M.C., Hartig, P.C., Gray, E.L. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350-1360.
(3) Harries, J.E., Runnalls, T., Hill, E., Harris, C.A., Maddix, S., Sumpter, J.P., Tyler, C.R. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pairbreeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011.
(4) Jensen, K.M., Korte, J.J., Kahl, M.D., Pasha, M.S., Ankley, G.T.. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127-141.
(5) Kahl, M.D., Jensen, K.M., Korte, J.J., Ankley, G.T. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523.
(6) Miles-Richardson, S.R., Kramer, V.J., Fitzgerald, S.D., Render, J.A., Yamini, B., Barbee, S.J., Giesy, J.P. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129-145.
(7) Smith, R.J.F. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031-1038.
| Vorlage - Einstufung des Laichausschlags (Nuptialtuberkel) | Einstufung |
| ID ________________
Datum ____________________ Gesamtbewertung _____________________ | 1 - präsent
2 - vergrößert 3 - ausgeprägt |
|
| |
| Bewertung der sekundären Geschlechtsmerkmale bei Japanischen Reiskärpflingen zum Nachweis bestimmter Chemikalien mit endokriner Wirkung | Anlage 5B |
Im Folgenden wird die Messung von Papillenprozessen * als sekundären Geschlechtsmerkmalen Japanischer Reiskärpflinge (Oryzias latipes) beschrieben.
(1) Nach Ausräumung der Leber (Anlage 6) den Fisch in ein konisches Rohr mit etwa 10 ml 10 %igem neutral gepuffertem Formalin legen (Kopf nach oben, Schwanz nach unten). Wenn die Gonaden in einer anderen Lösung als 10 %igem neutral gepuffertem Formalin fixiert werden, den Körper zwischen dem vorderen Bereich der Afterflosse und dem After mit einer Rasierklinge transversal durchtrennen, ohne die Genitalpapillen und die eigentlichen Gonaden zu beschädigen (Abb. 3). Den Fisch mit der kranialen Seite in die Fixierlösung legen, um die Gonaden zu konservieren; die Schwanzseite in die 10 %ige neutral gepufferte Formalinlösung legen (s. o.).
(3) Nach dem Spreizen der Afterflosse für etwa 30 Sekunden den Fisch bis zur Messung der Papillenprozesse in 10 %igem neutral gepuffertem Formalin bei Raumtemperatur aufbewahren. (Die Messung frühestens nach 24- stündiger Fixierung vornehmen.)
Messung
(1) Nach Fixieren des Fischkörpers in 10 %iger neutral gepufferter Formalinlösung für mindestens 24 Stunden die Körper aus dem konischen Rohr nehmen; das Formalin mit Filterpapier (oder Papiertüchern) abtupfen.
(2) Den Fisch mit der Bauchseite nach oben legen. Die Afterflosse mit einer kleinen Sezierschere vorsichtig abtrennen (vorzugsweise mit etwas Pterygiophorgewebe).
(3) Den vorderen Teil der abgetrennten Afterflosse mit einer Pinzette aufnehmen und mit einigen Tropfen Wasser auf einem Glasträger fixieren. Die Afterflosse mit einem Deckglas abdecken. Beim Fassen mit der Pinzette darauf achten, dass die Papillen nicht zerkratzt werden.
(4) Die verbundenen Flossenplatten mit Papillenprozessen mit Hilfe des Zählers unter einem Biomikroskop (aufrechtes oder Inversmikroskop) zählen. Papillenprozesse liegen vor, wenn am hinteren Rand der verbundenen Platte kleine Papillenbildungen zu erkennen sind. Die Zahl der verbundenen Platten mit Papillenprozessen für jeden einzelnen Flossenstrahl auf dem Arbeitsblatt vermerken (z.B. erster Flossenstrahl: 0, zweiter Flossenstrahl: 10, dritter Flossenstrahl: 12 usw.); die Summe dieser Zahlen, aufgeschlüsselt nach Fischen, in den Excel-Kalkulationsbogen eingetragen. Falls erforderlich, die Afterflosse fotografieren und die Zahl der verbundenen Flossenplatten mit Papillenprozessen auf dem Foto ermitteln.
(5) Nach der Messung die Afterflosse zur Konservierung und Aufbewahrung in das unter Nummer 1 beschriebene konische Rohr legen.
Abb. 1: Schaubild zur Veranschaulichung der an Form und Größe der Afterflosse erkennbaren Geschlechtsunterschiede; A - männlich; B - weiblich. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.
Abb. 2: A - Prozesse auf verbundenen Afterflossenplatten.
J.P., verbundene Platte; A.S., axialer Bereich; P., Prozess.
B - Distales Ende des Flossenstrahls; Actinotrichien (Act.) an der Spitze; Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish.
J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.
Abb. 3: Foto eines Fischkörpers mit Schnittstelle bei Fixierung der Gonaden in einer anderen Fixierlösung als 10 % iges neutral gepuffertes Formalin; in diesem Fall wird der restliche Körper zwischen der vorderen Region der Afterflosse und dem After mit einer Rasierklinge (rote Linie) abgetrennt; die Kopfseite des Fisches wird in die Fixierlösung für Gonaden, die Schwanzseite in 10 %iges neutral gepuffertes Formalin gelegt.
________
*) Zu Papillenprozessen kommt es in der Regel nur bei adulten männlichen Tieren; betroffen sind Flossenstrahlen ab dem zweiten bis zum siebten oder achten Strahl, gezählt ab dem hinteren Ende der Afterflosse (Abb. 1 und 2). Am ersten Flossenstrahl (gezählt ab dem hinteren Ende der Afterflosse) kommen die Papillenprozesse selten vor. Das nachstehend beschriebene Standardarbeitsverfahren (SOP) umfasst die Messung von Papillenprozessen am ersten Flossenstrahl (bei diesem SOP ab dem hinteren Ende der Afterflosse gezählt).
| Empfohlene Verfahren für die Entnahme von Proben für die Vitellogenin-Analyse | Anlage 6 |
Es ist darauf zu achten, dass es nicht zu Kreuzkontaminationen zwischen den VTG-Proben männlicher und weiblicher Tiere kommt.
Verfahren 1A: Dickkopfelritze, Blutentnahme aus der Schwanzvene/-arterie
Nach der Betäubung den Schwanzansatz mit einem Skalpell teilweise durchtrennen und mit einem heparinisierten Mikrohämatokrit-Kapillarröhrchen aus der Schwanzvene/-arterie Blut entnehmen. Nach der Blutentnahme das Plasma schnell durch 3-minütige Zentrifugierung mit 15.000 g (bzw. alternativ 10 min. mit 15.000 g bei einer Temperatur von 4 °C) isolieren. Soweit erwünscht, kann nach der Zentrifugierung der Hämatokritwert (in %) ermittelt werden. Anschließend das Plasma aus dem Mikrohämatokrit-Röhrchen entnehmen und in einem Zentrifugenröhrchen mit 0,13 Einheiten Aprotinin (einem Protease-Inhibitor) bei - 80 °C aufbewahren, bis die VTG- Konzentration bestimmt werden kann. Je nach (geschlechtsabhängiger) Größe der Dickkopfelritze können pro Fisch in der Regel 5-60 µl Plasma entnommen werden (Jensen et al. 2001).
Verfahren 1B: Dickkopfelritze, Blutentnahme aus dem Herzen
Alternativ kann Blut auch durch Herzpunktion mittels heparinisierter Spritze (1.000 Einheiten Heparin pro ml) entnommen werden. Das Blut anschließend in Eppendorf-Röhrchen (auf Eis) geben und zentrifugieren (5 min, 7.000 g, Raumtemperatur). Das Plasma in saubere Eppendorf-Röhrchen füllen (in Aliquoten, wenn das Plasmavolumen dies zulässt), umgehend auf - 80 °C einfrieren und bis zur Analyse aufbewahren (Panter et al., 1998).
Verfahren 2A: Japanische Reiskärpflinge, Exzision der Leber
Entnahme der Prüffische aus dem Prüfbecken
(1) Testfische mit dem kleinen Löffelsieb aus dem Prüfbecken nehmen. Dabei darauf achten, dass die Fische nicht in andere Becken fallen.(2) Die Fische grundsätzlich in nachstehender Reihenfolge entnehmen: Kontrolle, (gegebenenfalls) Lösungsmittelkontrolle, niedrigste Konzentration, mittlere Konzentration, höchste Konzentration. Außerdem aus einem Prüfbecken zunächst alle männlichen Tiere entnehmen, dann die weiblichen.
(3) Anhand der äußerlichen (sekundären) Geschlechtsmerkmale (z.B. Form der Afterflosse) das Geschlecht der Fische bestimmen.
(4) Die Prüffische in ein Transportbehältnis setzen und zur Exzision der Leber an einen Arbeitsplatz bringen. Die Beschriftung des Prüfbeckens und des Transportbehältnisses auf Genauigkeit überprüfen, um sicherzustellen, dass die Zahl der aus dem Prüfbecken entnommenen Fische mit der Zahl der noch darin verbliebenen Fische übereinstimmt.
(5) Kann das Geschlecht anhand der äußerlichen Merkmale nicht bestimmt werden, alle Fische aus dem Prüfbecken entnehmen. In diesem Fall das Geschlecht durch Sichtprüfung der Gonaden oder der sekundären Geschlechtsmerkmale unter einem Stereomikroskop bestimmen.
Exzision der Leber
(1) Die Prüffische aus dem Transportbehältnis nehmen und mit dem kleinen Löffelsieb in die Betäubungslösung setzen.(2) Nach dem Betäuben den Prüffisch mit einer (handelsüblichen) Pinzette auf Filterpapier (oder ein Papiertuch) legen. Dabei die Pinzette beidseitig am Kopf ansetzen, damit der Schwanz nicht bricht.
(3) Die Oberfläche des Fisches mit Filterpapier (oder einem Papiertuch) trockentupfen.
(4) Den Fisch mit der Bauchseite nach oben legen. Mit einer kleinen Sezierschere zwischen ventralem Halsbereich und Bauchmitte einen kleinen transversalen Einschnitt vornehmen.
(5) Die Sezierschere in diesen kleinen Einschnitt einführen und den Bauch auf ein kaudal zum Kiemenbogen angesetzten Schnittlinie entlang der Bauchmittellinie bis hin zur kranialen Seite des Afters öffnen. Um Leber und Gonaden nicht zu beschädigen, die Sezierschere nicht zu tief einführen.
(6) Unter dem Stereomikroskop folgende Schritte vornehmen:
(7) Den Fisch mit der Bauchseite nach oben auf das Papiertuch (oder eine gläserne Petrischale oder einen Glasträger) legen.
(8) Die Wände der Bauchhöhle mit Präzisionspinzetten spreizen und die inneren Organe freilegen. Falls erforderlich, kann dazu eine Seite der Bauchhöhle entfernt werden.
(9) Den anhaftenden Teil der Leber und der Gallenblase mit einer weiteren Präzisionspinzette freilegen. Den Gallengang fassen und die Gallenblase abtrennen. Dabei darauf achten, dass letztere nicht beschädigt wird.
(10) Die Speiseröhre fassen, und auf die gleiche Weise den Magen-Darm-Trakt von der Leber abtrennen. Darauf achten, dass kein Magen-Darm-Inhalt austritt. Den Magen-Darm-Trakt schwanzseitig vom After trennen und aus der Bauchhöhe nehmen.
(11) Fett und sonstiges Gewebe um die Leber entfernen. Die Leber darf dabei nicht beschädigt werden.
(12) Den Leberausgang mit der Präzisionspinzette fassen und die Leber aus der Bauchhöhle entnehmen.
(13) Die Leber auf den Glasträger legen. Mit der Präzisionspinzette erforderlichenfalls Fett und sonstiges externes Gewebe (z.B. Bauchfell) von der Leberoberfläche entfernen.
(14) Das Gewicht der Leber mit einem 1,5-ml-Mikroröhrchen (Leergewicht) und einer elektronischen Analysewaage bestimmen. Den Messwert in das Arbeitsblatt eintragen (auf 0,1 mg genau). Mit den Angaben auf dem Etikett des Mikroröhrchens abgleichen.
(15) Das Mikroröhrchen mit der Leber verschließen und in ein Kühlgestell (oder ein Eis-Rack) setzen.
(16) Nach Exzision einer Leber die Sezierinstrumente reinigen oder wechseln.
(17) Die Lebern aller Fische im Transportbehältnis entnehmen, wie oben beschrieben.
(18) Nach Exzision der Lebern aller Fische im Transportbehältnis (d. h. aller männlichen oder allen weiblichen Tieren in einem Prüfbecken) die Leberproben in ein etikettiertes Reagenzglasgestell setzen und in einen Gefrierschrank stellen. Sind die Lebern kurz nach der Exzision einer Vorbehandlung zu unterziehen, die Proben in einem Kühlgestell (oder Eis-Rack) zum nächsten Arbeitsplatz bringen.
Nach Exzision der Lebern steht der Fischkörper zur Messung der sekundären Geschlechtsmerkmale zu Verfügung.
Leberproben
Die von den Prüffischen entnommenen Leberproben bei ≤ - 70 °C lagern, sofern sie nicht kurz nach der Exzision vorbehandelt werden sollen.
Abb. 1 Unmittelbar vor den Brustflossen einen Schereneinschnitt vornehmen.
Abb. 2 Auf der Bauchmittellinie bis zu einem Punkt etwa 2 mm kranial vor dem After einen Scherenschnitt durchführen.
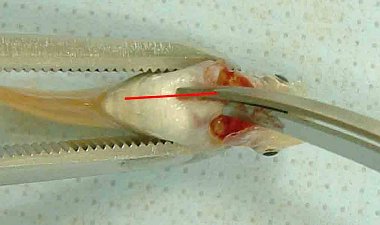
Abb. 3 Die Bauchwände mit einer Pinzette spreizen, um die Leber und die anderen inneren Organe freizulegen. (Alternativ können die Bauchwände seitlich festgesteckt werden.)
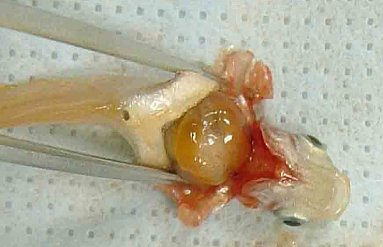
Abb. 4 Die Leber grob sezieren und mit einer Pinzette entnehmen.
Abb. 5 Darm mit der Pinzette vorsichtig herausziehen.

Abb. 6 Beide Darmenden und etwaiges mesenteriales Gewebe mit einer Schere durchtrennen.
Abb. 7 (Weibchen)
Das Verfahren ist bei männlichen und weiblichen Fischen dasselbe.
Abb. 8 Verfahren abgeschlossen.
 Verfahren 2B: Japanische Reiskärpflinge (Oryzias latipes), Vorbehandlung der Leber für die Vitellogenin- Analyse:
Verfahren 2B: Japanische Reiskärpflinge (Oryzias latipes), Vorbehandlung der Leber für die Vitellogenin- Analyse:
Die Flasche mit dem Homogenatpuffer aus dem ELISA-Kit nehmen und mit zerstoßenem Eis kühlen (Temperatur der Lösung: ≤ 4 °C). Wird Homogenatpuffer aus dem EnBio-ELISA verwendet, die Lösung zunächst bei Raumtemperatur auftauen und die Flasche anschließend auf zerstoßenem Eis kühlen.
Das Volumen des Homogenatpuffers für die Leber richtet sich nach dem Lebergewicht. (pro mg Leber je 50 µl Homogenatpuffer.) Wiegt die Leber beispielsweise 4,5 mg, so beträgt das Volumen des Homogenatpuffers 225 µl. Die Volumina der Homogenatpuffer für sämtliche Lebern in einer Liste erfassen.
Vorbereitung der Lebern zur Vorbehandlung
(1) Das 1,5-ml-Mikroröhrchen mit der Leber erst unmittelbar vor der Vorbehandlung aus dem Gefrierschrank nehmen.(2) Um Vitellogenin-Kontaminationen zu vermeiden, die Lebern männlicher Fische vor den Lebern der weiblichen Fische vorbehandeln. Die Vorbehandlung der Testgruppen sollte zudem in der folgenden Reihenfolge ablaufen: Kontrolle, (gegebenenfalls) Lösungsmittelkontrolle, niedrigste Konzentration, mittlere Konzentration, höchste Konzentration.
(3) Aus dem Gefrierschrank immer nur so viel 1,5-ml-Mikroröhrchen mit Leberproben entnehmen, wie auch gleichzeitig zentrifugiert werden können.
(4) Die 1,5-ml-Mikroröhrchen mit den Leberproben in der Reihenfolge der Nummern der Proben aus dem Eis- Rack anordnen. (Die Lebern brauchen nicht aufgetaut zu werden.)
Vorbehandlung
1. Zugabe des Homogenatpuffers
(1) Nachdem anhand der Liste geprüft wurde, welches Volumen des Homogenatpuffers jeweils für ein Leberpräparat zu verwenden ist, die Mikropipette (Volumenbereich 100-1.000 µl) auf das entsprechende Volumen einstellen. Eine saubere Spitze aufsetzen.(2) Homogenatpuffer aus der Reagenzflasche entnehmen und in die 1,5-ml-Mikroröhrchen mit Leber geben.
(3) Homogenatpuffer allen leberhaltigen 1,5-ml-Mikroröhrchen wie oben beschrieben zugeben. Die Spitze der Mikropipette braucht nicht gewechselt zu werden. Ist die Spitze jedoch verunreinigt oder wird vermutet, dass sie verunreinigt ist, muss sie jedoch ausgewechselt werden.
2. Homogenisieren der Leber
(1) Am Homogenisator ein neues Pistill befestigen.(2) Das Pistill in das 1,5-ml-Mikroröhrchen einführen. Dabei den Mikroröhrchen-Homogenisator so halten, dass die Leber zwischen Pistill-Oberfläche und innere Wand des 1,5-ml-Mikroröhrchens gedrückt wird.
(3) Den Mikroröhrchen-Homogenisator für 15-20 Sekunden bedienen. Danach das 1,5-ml-Mikroröhrchen auf zerstoßenem Eis abkühlen.
(4) Das Pistill aus dem 1,5-ml-Mikroröhrchen nehmen und die Probe etwa 10 Sekunden ruhen lassen. Anschließend eine Sichtprüfung des Suspensionszustands vornehmen.
(5) Sind Leberstückchen in der Suspension zu erkennen, die Schritte (3) und (4) wiederholen, um ein zufriedenstellendes Leberhomogenat zu erhalten.
(6) Das suspendierte Leberhomogenat bis zum Zentrifugieren auf dem Eis-Rack abkühlen.
(7) Das Pistill bei jedem neuen Homogenat auswechseln.
(8) Alle Lebern mit dem Homogenatpuffer homogenisieren, wie oben beschrieben.
3. Zentrifugen des suspendierten Leberhomogenats
(1) Sicherstellen, dass die gekühlte Zentrifugierkammer eine Temperatur von ≤ 5 °C aufweist.(2) Die 1,5-ml-Mikroröhrchen mit dem suspendierten Leberhomogenat in die gekühlte Zentrifuge stellen (erforderlichenfalls nach einer Ausbalancierung).
(3) Das suspendierte Leberhomogenat für 10 Minuten bei einer Temperatur von ≤ 5 °C mit 13.000 g zentrifugieren. Wird der Überstand in geeigneter Weise abgetrennt, können Zentrifugalkraft und Zeitdauer jedoch nach Bedarf eingestellt werden.
(4) Nach der Zentrifugierung kontrollieren, ob der Überstand angemessen abgetrennt wurde (Oberfläche: lipid; Zwischenschicht: Überstand, untere Schicht: Lebergewebe). Bei unangemessener Trennung die Suspension unter denselben Bedingungen erneut zentrifugieren.
(5) Alle Proben aus der gekühlten Zentrifuge nehmen und in der Reihenfolge der Nummern der Proben auf dem Eis-Rack anordnen. Dabei darauf achten, dass die getrennten Schichten nach dem Zentrifugen nicht resuspendieren.
4. Entnahme des Überstands
(1) Vier 0,5-ml-Mikroröhrchen zur Entnahme des Überstands in das Reagenzglasgestell setzen.(2) Jeweils 30 µl Überstand (als Zwischenschicht abgetrennt) mit der Mikropipette entnehmen und in eines der 0,5-ml-Mikroröhrchen geben. Dabei darauf achten, dass kein Lipidmaterial (Oberfläche) oder Lebergewebe (untere Schicht) aufgenommen werden.
(3) Den Überstand entnehmen und wie oben beschrieben in zwei weitere 0,5-ml-Mikroröhrchen dispensieren.
(4) Übrigen Überstand mit der Mikropipette entnehmen (möglichst ≥ 100 µl) und in das verbleibende 0,5-ml- Mikroröhrchen geben. Dabei darauf achten, dass kein Lipidmaterial (Oberfläche) oder Lebergewebe (untere Schicht) aufgenommen wird.
(5) Das 0,5-ml-Mikroröhrchen verschließen und auf dem Etikett das Volumen des Überstands notieren. Danach die Mikroröhrchen sofort auf dem Eis-Rack kühlen.
(6) Für jeden Überstand die Spitze der Mikropipette wechseln. Haftet sehr viel Lipidmaterial an der Spitze an, die Spitze umgehend auswechseln, um den das Leberextrakt nicht mit Fett zu kontaminieren.
(7) Den gesamten zentrifugierten Überstand wie oben beschrieben in vier 0,5-ml-Mikroröhrchen geben.
(8) Danach alle etikettierten Mikroröhrchen in das Reagenzglasgestell setzen und im Gefrierfach einfrieren. Werden die VTG-Konzentrationen unmittelbar nach der Vorbehandlung gemessen, ein 0,5-ml- Mikroröhrchen (mit 30 µl des Überstands) im Reagenzglasgestell abkühlen und an den Arbeitsplatz bringen, an dem der ELISA durchgeführt werden soll. In diesem Fall die übrigen Mikroröhrchen in die Reagenzglasgestelle setzen und im Gefrierschrank einfrieren.
(9) Nach Entnahme des Überstands den verbleibenden Rückstand angemessen entsorgen.
Lagerung der Probe
Die 0,5-ml-Mikroröhrchen mit dem Überstand des Leberhomogenats bis zur Durchführung des ELISA bei ≤ - 70 °C lagern.
Verfahren 3A: Zebrabärblinge, Blutentnahme aus der Schwanzvene/-arterie
Unmittelbar nach der Betäubung den Schwanzansatz mit einem Skalpell teilweise durchtrennen und mit einem heparinisierten Mikrohämatokrit-Kapillarröhrchen aus der Schwanzvene/-arterie Blut entnehmen. Die Blutvolumen betragen je nach Größe der Fische 5 bis 15 µl. In das Mikrokapillarrohr die gleiche Menge Aprotininpuffer (6 µgml in PBS) geben, und das Plasma durch Zentrifugieren (5 Minuten bei 600 g) vom Blut trennen. Das Plasma in den Teströhrchen auffangen und bis zur Bestimmung der Vitellogenin-Konzentration oder anderer relevanter Proteine bei - 20 °C lagern.
Verfahren 3B: Zebrabärblinge, Blutentnahme durch Herzpunktion
Um eine Koagulierung des Bluts und einen Proteinabbau zu vermeiden, die Proben mit heparinisierter (1.000 Einheiten/ml) phosphatgepufferter Salzlösung (PBS) und dem Proteasehemmer Aprotinin (2 TIU/ml) entnehmen. Als Pufferbestandteile werden Heparin- ammoniumsalz und lyophilisiertes Aprotinin, für die Blutentnahme Spritzen (1 ml) mit fixierter dünner Nadel (z.B. Braun Omnikan-F) empfohlen. Die Spritze muss mit der Pufferlösung vorgefüllt sein (ca. 100 µl), damit die geringen Blutvolumina der einzelnen Fische vollständig eluiert werden können. Die Blutproben durch Herzpunktion entnehmen. Dazu die Fische zunächst mit MS-222 (100 mg/l) betäuben. Bei angemessener Betäubung ist der Herzschlag der Zebrabärblinge wahrnehmbar. Beim Punktieren des Herzens den Spritzenkolben unter leichter Spannung halten. Die zu entnehmendem Blutvolumina liegen zwischen 20 und 40 µl. Nach der Herzpunktion das Blut-/Puffer-Gemisch in die Teströhrchen geben. Das Plasma durch Zentrifugieren (20 min mit 5.000 g) vom Blut trennen und bis zur Analyse bei - 80 °C lagern.
Verfahren 3C: Standardarbeitsverfahren (SOP): Zebrabärblinge, Homogenisierung von Kopf- und Schwanzgewebe
(1) Die Fische betäuben und töten, wie für den Test beschrieben.(2) Kopf und Schwanz der Fische abtrennen, siehe Abbildung 1.
Wichtig: Alle Sezierinstrumente und das Sezierbrett sind nach jedem Fisch abzuspülen und ordnungsgemäß zu reinigen (z.B. mit 96 %igem Ethanol), um VTG-'Kontaminationen' nicht induzierter Männchen durch weibliche Fische oder induzierte Männchen zu vermeiden.
(3) Das Gewicht der gepoolten Kopf- und Schwanzteile auf 1 mg genau abmessen.
(4) Nach dem Wiegen die Teile in geeignete Röhrchen (z.B. 1,5 ml Eppendorf) geben und bei - 80 °C bis zur Homogenisierung einfrieren oder unmittelbar mit zwei Kunststoff-Pistillen auf Eis homogenisieren. (Alternativ können auch andere Methoden angewendet werden, sofern sie auf Eis durchgeführt werden und eine homogene Masse entsteht.) Wichtiger Hinweis: Die Röhrchen sind ordnungsgemäß zu nummerieren, damit die Kopf- und Schwanzteile für die histologische Gonadenuntersuchung dem jeweiligen Rumpf zugeordnet werden können.
(5) Nach Herstellung einer homogenen Masse das Vierfache des Gewebegewichts des eisgekühlten Homogenisierungspuffers * hinzugeben. Mit den Pistillen weiterarbeiten, bis eine homogene Mischung entsteht. Wichtiger Hinweis: Für jeden Fisch ist ein frisches Pistill zu verwenden.
(6) Die Proben bis zur Zentrifugierung (4 °C, 50.000 g, 30 Minuten) auf Eis legen.
(7) Mit einer Pipette 20 µl-Portionen des Überstands in mindestens zwei Röhrchen geben; dabei die Spitze der Pipette durch die oberflächige Fettschicht führen und den Überstand vorsichtig ansaugen, ohne jedoch Fett- oder Pelletfraktionen mitaufzunehmen.
(8) Die Röhrchen bis zur Verwendung bei - 80 °C lagern.
__________
*) Homogenisierungspuffer:
- (50 mm Tris-HCl pH 7,4; Proteasehemmer-Cocktail (1 %) (Sigma): 12 ml Tris-HCl pH 7,4 + 120 µl Proteasehemmer-Cocktail.
- TRIS: TRIS-ULTRA PURE (ICN) z.B. Bie & Berntsen, Dänemark.
- Proteasehemmer-Cocktail: Sigma (Säugetiergewebe) Produktnummer P 8340.
- Hinweis: Der Homogenisierungspuffer ist am Tag der Herstellung zu verbrauchen. Während der Verwendung muss die Pufferlösung auf Eis liegen.
| Vitellogeninangereicherte Proben und Inter-Assay-Referenzstandard | Anlage 7 |
An jedem Tag, an dem Vitellogenin-Bestimmungen vorgenommen werden, ist eine nach einem Inter-Assay- Referenzstandard hergestellte Anreicherungsprobe zu analysieren. Das für den Inter-Assay-Referenzstandard verwendete Vitellogenin muss aus einer anderen Charge als das Vitellogenin stammen, das zur Herstellung der Kalibrierstandards für den durchzuführenden Assay verwendet wurde.
Die Anreicherungsprobe wird hergestellt, indem eine bekannte Menge des Inter-Assay-Standards einer Plasmaprobe männlicher Kontrollfische zugegeben wird. Die Probe anreichern, bis eine Vitellogenin-Konzentration erreicht wird, die 10- bis 100-mal höher ist als die bei männlichen Kontrollfischen erwartete VTG-Konzentration. Die so angereicherte Probe kann von einem einzelnen Fisch oder von mehreren Fischen stammen.
In mindestens zwei Mulden eine Teilprobe nicht angereicherten Plasmas männlicher Kontrolltiere analysieren. Die angereicherte Probe auch in mindestens zwei Duplikatmulden analysieren. Die mittlere VTG-Menge in den beiden nicht angereicherten Plasmaproben männlicher Kontrollfische der berechneten Vitellogenin-Menge hinzurechnen, die zur Anreicherung der Proben zugegeben wurde, um die erwartete Konzentration zu bestimmen. Das Verhältnis dieser erwarteten zur gemessenen Konzentration zusammen mit den Ergebnissen der an dem betreffenden Tag durchgeführten Assays protokollieren.
| Flussdiagramm als Entscheidungshilfe fiir die statistischen Analyse | Anlage 8 |
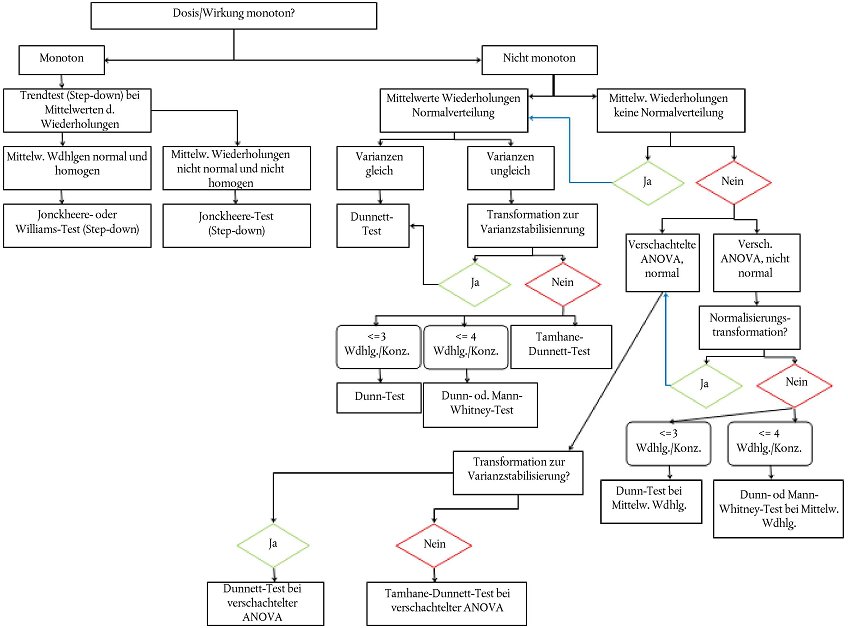
 | weiter . |  |
...
X
⍂
↑
↓