umwelt-online: Verordnung (EU) 2016/266 zur Änderung der Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der Verordnung (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) zwecks Anpassung an den technischen Fortschritt (2)
 | zurück |  |
(6) Die folgenden Kapitel C.31 bis C.46 werden angefügt:
"C.31. Wachstumstest bei Landpflanzen: Untersuchung von Auflauf und Wachstum von Keimlingen
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 208 (2006). Die Prüfmethoden werden regelmäßig unter Berücksichtigung des wissenschaftlichen Fortschritts und der Anwendbarkeit in Rechtsvorschriften überarbeitet und aktualisiert. Diese aktualisierte Prüfmethode dient zur Beurteilung potenzieller Auswirkungen von Chemikalien auf das Auflaufen und das Wachstum von Keimlingen. Insoweit erstreckt sie sich weder auf chronische Wirkungen noch auf Wirkungen auf die Reproduktion (d. h. Samenansatz, Blütenbildung, Reifung der Früchte). Die Expositionsbedingungen und die Eigenschaften der zu prüfenden Chemikalie müssen berücksichtigt werden, um sicherzustellen, dass geeignete Prüfmethoden verwendet werden. (Bei der Prüfung von Metallen/Metallverbindungen sind die Wirkung des pH-Wertes und entsprechender Gegenionen zu berücksichtigen) (1). Diese Prüfmethode ist nicht für Pflanzen vorgesehen, die Chemikaliendämpfen ausgesetzt sind. Sie ist anzuwenden bei allgemeinen Chemikalien, Bioziden und Pflanzenschutzprodukten (auch als Pflanzenschutzmittel oder Pestizide bezeichnet). Die Methode wurde ausgehend von bestehenden Methoden entwickelt (2)(3)(4)(5)(6)(7). Außerdem wurden verschiedene weitere Quellen im Zusammenhang mit Prüfungen an Pflanzen berücksichtigt (8)(9)(10). Definitionen der verwendeten Begriffe sind Anlage 1 zu entnehmen.
2. Mit der Prüfung werden die Wirkungen auf den Saatauflauf und das frühe Wachstum höherer Pflanzen beurteilt, die im Boden (oder in einer sonstigen geeigneten Bodenmatrix) der Prüfchemikalie ausgesetzt waren. Das Saatgut wird mit dem mit der Prüfchemikalie behandelten Boden in Berührung gebracht und gewöhnlich 14 bis 21 Tage nach dem Auflauf von 50 % der Samen in der Kontrollgruppe auf Wirkungen untersucht. Die gemessenen Endpunkte bestehen in der visuellen Beurteilung des Auflaufs, der Ermittlung der Sprosstrockenmasse (alternativ der Sprossfrischmasse) sowie in manchen Fällen der Sprosslänge und in einer Bewertung der sichtbaren schädlichen Wirkungen auf verschiedene Teile der Pflanze. Diese Messungen und Beobachtungen werden mit denen bei unbehandelten Kontrollpflanzen verglichen.
3. Je nach erwartetem Expositionspfad wird die Prüfchemikalie entweder in den Boden (bzw. in eine künstliche Bodenmatrix) eingearbeitet oder auf die Bodenoberfläche aufgebracht, so dass der potenzielle Expositionspfad der Chemikalie angemessen nachgebildet wird. Die Prüfchemikalie wird in die Bodenmasse eingearbeitet. Nach der Einarbeitung wird der Boden in Töpfe gefüllt; anschließend wird das Saatgut der betreffenden Pflanzenarten gesät. Bei der Applikation auf die Oberfläche wird die Chemikalie auf den in die Töpfe eingefüllten Boden ausgebracht, in den bereits die Samen gesät wurden. Danach werden die Versuchseinheiten (Kontrollen und behandelte Böden mit Saatgut) unter Bedingungen gehalten, die die Keimung/das Wachstum der Pflanzen fördern.
4. Je nach Ziel der Untersuchung kann die Prüfung zur Bestimmung der Dosis-Wirkungs-Kurve oder als Limit-Test mit nur einer Konzentration/Dosierung durchgeführt werden. Wenn die Ergebnisse des Limit-Tests ein bestimmtes Toxizitätsniveau überschreiten (z.B. wenn Wirkungen von mehr als x % beobachtet werden), wird ein Vorversuch zur Bestimmung der Ober- und der Untergrenze der Toxizität durchgeführt. Darauf folgt ein Test mit mehreren Konzentrationen/Dosierungen zur Erstellung einer Dosis-Wirkungs-Kurve. Mit einer geeigneten statistischen Analyse werden die wirksame Konzentration ECx oder die wirksame Dosierung ERx (z.B. EC25, ER25, EC50, ER50) für die empfindlichsten relevanten Parameter bestimmt. Außerdem können mit diesem Test die höchste geprüfte Konzentration ohne beobachtete schädliche Wirkung (NOEC) und die niedrigste Konzentration mit beobachteter Wirkung (LOEC) berechnet werden.
Informationen zur Prüfchemikalie
5. Die folgenden Informationen sind hilfreich zur Bestimmung des voraussichtlichen Expositionspfads der jeweiligen Chemikalie und zur Konzeption der Prüfung: Strukturformel, Reinheit, Wasserlöslichkeit, Löslichkeit in organischen Lösungsmitteln, 1-Octanol/Wasser-Verteilungskoeffizient, Sorptionsverhalten des Bodens, Dampfdruck, chemische Beständigkeit in Wasser und Licht und biologische Abbaubarkeit.
6. Damit ein Test als valide gewertet werden kann, müssen die Kontrollen die folgenden Kriterien erfüllen:
- Es muss eine Auflaufrate von mindestens 70 % erzielt werden.
- Die Keimlinge weisen keine sichtbaren phytotoxischen Wirkungen auf (z.B. Chlorose, Nekrose, Welken, Verformungen von Blättern und Stängeln), und bei den Pflanzen treten hinsichtlich Wachstumsentwicklung und Morphologie nur solche Unterschiede auf, die für die jeweilige Art normal sind.
- Die mittlere Überlebensrate der aufgelaufenen Kontrollkeimlinge liegt während der Dauer der Untersuchung bei mindestens 90 %.
- Die Umweltbedingungen für alle Pflanzen einer bestimmten Art sind identisch, und die Nährmedien enthalten die gleiche Menge Bodenmatrix, Trägermaterial oder Substrat derselben Herkunft.
7. Eine Referenzchemikalie kann regelmäßig getestet werden, um sicherzustellen, dass sich die Leistungsfähigkeit des Tests, die Reaktion der jeweiligen Testpflanzen und die Testbedingungen im Laufe der Zeit nicht erheblich geändert haben. Die Leistungsfähigkeit des Prüfsystems in bestimmten Labors kann auch anhand historischer Messungen der Biomasse und des Wachstums von Kontrollpflanzen beurteilt werden; diese Messungen können auch als laborinterne Qualitätskontrollmaßnahme dienen.
Naturboden - künstliches Substrat
8. Pflanzen können in Töpfen mit sandigem Lehm, lehmigem Sand oder sandiger Lehm-/Tonerde mit einem Anteil von bis zu 1,5 % organischem Kohlenstoff (ca. 3 % organische Bestandteile) gezogen werden. Alternativ können auch handelsübliche Pflanzenerde oder eine künstliche Bodenmischung mit bis zu 1,5 % organischem Kohlenstoff verwendet werden. Tonböden sollten nicht verwendet werden, wenn bekannt ist, dass die Prüfchemikalie eine hohe Tonaffinität besitzt.. Feldboden ist bis auf eine Teilchengröße von 2 mm zu sieben, um eine gleichmäßige Struktur herzustellen und grobe Partikel abzutrennen. Art und Beschaffenheit, der prozentuale Anteil an organischem Kohlenstoff, der pH-Wert und der Salzgehalt (gemessen an der elektrischen Leitfähigkeit des fertig aufbereiteten Bodens) werden erfasst. Der Boden ist nach einer Standard-Klassifizierung einzustufen (11). Um die Wirkung von im Boden befindlichen Erregern zu reduzieren, kann der Boden pasteurisiert oder wärmebehandelt werden.
9. Naturboden kann wegen unterschiedlicher physikalisch-chemischer Eigenschaften und unterschiedlicher Mikrobenpopulationen die Interpretation der Ergebnisse erschweren und zu stärkeren Schwankungen führen. Diese Variablen wirken sich auf die Fähigkeit des Bodens zur Aufnahme von Feuchtigkeit, auf die chemische Bindungsfähigkeit, auf die Belüftung sowie auf den Gehalt an Nährstoffen und Spurenelementen aus. Über diese Unterschiede bei den physikalischen Faktoren hinaus bestehen Unterschiede auch im Hinblick auf chemische Eigenschaften wie z.B. den pH-Wert und das Redoxpotenzial, die die Bioverfügbarkeit der Prüfchemikalie beeinträchtigen können (12)(13)(14).
10. Für die Versuche mit Pflanzenschutzprodukten werden in der Regel keine künstlichen Substrate verwendet; sie können aber bei der Untersuchung allgemeiner Chemikalien hilfreich sein sowie dann, wenn die Unterschiede natürlicher Böden minimiert und eine bessere Vergleichbarkeit der Testergebnisse erzielt werden sollen. Die verwendeten Substrate müssen aus inertem Material bestehen, bei dem es nur zu minimalen Wechselwirkungen mit der Prüfchemikalie und/oder dem Lösungsmittelträger kommt. Mit Säure gereinigter Quarzsand, Mineralwolle und Glasperlen (z.B. mit einem Durchmesser von 0,35 bis 0,85 mm) haben sich als geeignete inerte Materialien erwiesen, die die Prüfchemikalie nur minimal absorbieren (15) und eine maximale Verfügbarkeit der Chemikalie zur Aufnahme durch die Wurzeln des Keimlings gewährleisten. Vermiculit, Perlit oder sonstige stark absorbierende Materialien sind ungeeignet. Um Stress durch Nährstoffmangel zu vermeiden, sind Nährstoffe zur Förderung des Pflanzenwachstums bereitzustellen; hierzu sollten nach Möglichkeit chemische Analysen durchgeführt oder Kontrollpflanzen visuell geprüft werden.
Kriterien für die Auswahl von Arten für die Prüfungen
11. Die ausgewählten Arten müssen in Bezug auf ihre taxonomische Diversität im Pflanzenreich, ihre Verbreitung, ihre Abundanz, die artenspezifischen Lebenszyklusmerkmale und ihren natürlichen Lebensraum ein angemessen breites Spektrum abdecken, um eine entsprechende Reihe von Reaktionen zu ermitteln (8)(10)(16) (17)(18)(19)(20). Bei der Auswahl sind folgende Merkmale der möglicherweise im Test zu verwendenden Arten zu berücksichtigen:
- die Arten haben einheitliche Samen, die aus zuverlässigen Standardquellen für Saatgut leicht zu beschaffen sind und die regelmäßig, zuverlässig und gleichmäßig keinem; die Keimlinge wachsen einheitlich;
- die Pflanzen sind für Labortests geeignet und führen zu verlässlichen und reproduzierbaren Ergebnissen innerhalb von Testanlagen sowie in unterschiedlichen Testanlagen;
- die Empfindlichkeit der geprüften Arten muss sich mit den Reaktionen der Pflanzen decken, die in der durch die jeweilige Chemikalie belasteten Umgebung vorkommen;
- die Arten wurden in gewissem Umfang bereits in anderen Toxizitätstests verwendet und ihr Verhalten in Herbizid-Bioassays, Schwermetall-Screenings, Tests auf Salz- oder Mineralienbelastung oder in Allelopathie- Untersuchungen deutet auf Empfindlichkeit gegenüber vielfältigen Belastungsfaktoren hin;
- sie sind mit den Wachstumsbedingungen der Prüfung kompatibel;
- sie erfüllen die Validitätskriterien der Prüfung.
Anlage 2 enthält einige in Tests bislang am häufigsten verwendeten Arten, Anlage 3 eine Liste potenzieller Nichtkulturpflanzen.
12. Wie viele Arten zu prüfen sind, hängt von den jeweiligen Regulierungsanforderungen ab; daher enthält diese Prüfmethode hierzu keine Angaben.
Applikation der Prüfchemikalie
13. Die Chemikalie wird in einen geeigneten Träger (z.B. Wasser, Aceton, Ethanol, Polyethylenglykol, Gummiarabikum oder Sand) gegeben. Gemische (Fertigprodukte oder Formulierungen) mit Wirkstoffen und mit verschiedenen Hilfsstoffen können ebenfalls geprüft werden.
Einarbeitung in den Boden/in künstliches Substrat
14. In Wasser lösliche oder suspendierbare Chemikalien können in Wasser gegeben werden; anschließend wird die Lösung mithilfe einer geeigneten Mischvorrichtung mit dem Boden vermischt. Dieser Prüfungstyp kommt dann in Betracht, wenn eine Belastung durch die Chemikalie über den Boden oder über im Boden enthaltenes Porenwasser gegeben ist und die Gefahr der Aufnahme über die Wurzeln besteht. Die zugegebene Menge der Prüfchemikalie darf die Wasserhaltekapazität des Bodens nicht überschreiten. Bei allen Testkonzentrationen muss das gleiche Volumen Wasser zugegeben werden, jedoch nur so viel, dass das Bodensubstrat nicht verklumpt.
15. Schlecht wasserlösliche Chemikalien sind in einem geeigneten flüchtigen Lösungsmittel (z.B. Aceton oder Ethanol) aufzulösen und mit Sand zu mischen. Das Lösungsmittel kann dann aus dem Sand abgetrennt werden, indem ein Luftstrom auf den kontinuierlich durchmischten Sand geleitet wird. Der so behandelte Sand wird mit dem für den Versuch vorgesehenen Boden gemischt. Eine zweite Kontrolle wird ausschließlich aus Sand und Lösungsmittel hergestellt. Bei allen Dosierungsstufen und bei der zweiten Kontrolle werden gleiche Mengen Sand, dem zunächst Lösungsmittel beigemischt und dann entzogen wurde, hinzugegeben. Für feste, unlösliche Prüfchemikalien wird trockener Boden in einer geeigneten Mischvorrichtung mit der Chemikalie gemischt. Anschließend wird der Boden in Töpfe gefüllt, und das Saatgut wird umgehend eingesät.
16. Wenn anstelle von Naturboden ein künstliches Substrat verwendet wird, können wasserlösliche Chemikalien unmittelbar vor Beginn des Tests in der Nährlösung aufgelöst werden. Chemikalien, die nicht wasserlöslich sind, aber mit einem Lösungsmittelträger in Wasser suspendiert werden können, sind mit dem Träger zur Nährlösung hinzuzugeben. Nicht wasserlösliche Chemikalien, für die es auch keinen nicht toxischen wasserlöslichen Träger gibt, sind in einem geeigneten flüchtigen Lösungsmittel aufzulösen. Die Lösung wird mit Sand oder Glasperlen gemischt und in einem Vakuum-Rotationstrockner verdampft, so dass eine gleichmäßige Schicht der Chemikalie auf dem Sand oder den Perlen verbleibt. Vor der Befüllung der Töpfe ist eine gewogene Menge der Perlen mithilfe des gleichen organischen Lösungsmittels und der Prüfchemikalie zu extrahieren.
Ausbringung auf die Oberfläche
17. Im Fall von Pflanzenschutzprodukten wird die Prüfchemikalie häufig ausgebracht, indem die Oberfläche des Bodens mit der Testlösung besprüht wird. Alle bei den Tests verwendeten Geräte einschließlich der Ausrüstung zur Herstellung und Applikation der Prüfchemikalie muss eine solche Konstruktion und Kapazität aufweisen, dass die Tests mit der betreffenden Ausrüstung in der erforderlichen Genauigkeit und mit reproduzierbarer Abdeckung ausgeführt werden können. Die Bodenoberfläche muss gleichmäßig abgedeckt werden. Insbesondere ist darauf zu achten, dass Chemikalien nicht von der Ausrüstung adsorbiert werden und nicht mit der Ausrüstung reagieren können (z.B. Kunststoffschläuche und lipophile Chemikalien oder Stahlbauteile und Komponenten). Die Prüfchemikalie wird in gleicher Weise wie bei einem typischen Sprühbehälter auf die Bodenoberfläche aufgesprüht. Im Allgemeinen bewegen sich die Sprühvolumina im Bereich der normalen landwirtschaftlichen Praxis, und die Volumina (Wassermenge usw.) sind zu protokollieren.) Die Düsen sind so zu wählen, dass der Boden gleichmäßig abgedeckt wird. Wenn Lösungsmittel und Träger verwendet werden, ist eine zweite Gruppe von Kontrollpflanzen ausschließlich mit dem Lösungsmittel/Träger zu behandeln. Bei Pflanzenschutzprodukten, die als Formulierungen geprüft werden, ist dies nicht erforderlich.
Verifizierung der Konzentration/Dosierung der Prüfchemikalie
18. Die angewendeten Konzentrationen/Dosierungen sind durch eine geeignete Analyse zu bestätigen. Bei löslichen Chemikalien können sämtliche Testkonzentrationen/-dosierungen bestätigt werden, indem die Testlösung mit der höchsten Konzentration analysiert wird und Aufzeichnungen über anschließende Verdünnungen und über die Verwendung kalibrierter Ausrüstung (z.B. kalibrierter Glasgeräte oder kalibrierte Sprühausrüstung) geführt werden. Bei unlöslichen Chemikalien muss das Gewicht der in den Boden eingebrachten Prüfchemikalie zugrunde gelegt werden. Wenn ein Homogenitätsnachweis erforderlich ist, muss der Boden unter Umständen analysiert werden.
Versuchsaufbau
19. Saatgut derselben Art wird in Töpfe eingesät. Die Anzahl der Samen pro Topf hängt von der Art, der Größe des Topfs und der Testdauer ab. In den Töpfen sollten sich so viele Pflanzen befinden, dass angemessene Wachstumsbedingungen gegeben sind und die Töpfe während der Testdauer nicht zu voll werden. Die maximale Dichte dürfte je nach Samengröße bei drei bis zehn Samen pro 100 cm2 liegen. Zu empfehlen sind beispielsweise ein bis zwei Mais-, Soja-, Tomaten-, Gurken- oder Zuckerrübenpflanzen pro 15-cm-Topf, drei Raps- oder Erbsenpflanzen pro 15-cm-Topf und fünf bis zehn Zwiebeln oder Weizenhalme oder sonstige Pflanzen mit kleinen Samen pro 15-cm-Topf. Die Anzahl der Töpfe mit dem Saatgut und die der Replikate (ein Replikat ist als ein Topf definiert, deshalb stellen Pflanzen in demselben Topf kein Replikat dar) muss für eine optimale statistische Analyse ausreichend sein (21). Wenn im Test Arten mit wenigen großen Samen je Topf (Replikat) verwendet werden, ist eine größere Variabilität zu erwarten als bei Arten, bei denen eine größere Anzahl kleiner Samen pro Topf gesät werden kann. Diese Variabilität kann minimiert werden, indem in alle Töpfe die gleiche Anzahl Samen gesät wird.
20. Mit Kontrollgruppen wird sichergestellt, dass die beobachteten Wirkungen ausschließlich mit der Exposition gegenüber der Prüfchemikalie in Zusammenhang stehen bzw. ausschließlich der Prüfchemikalie zuzurechnen sind. Die Kontrollgruppe muss mit Ausnahme der Exposition gegenüber der Prüfchemikalie in jeder Hinsicht mit der Prüfgruppe identisch sein. In einem Test müssen alle verwendeten Pflanzen einschließlich der Kontrollen aus derselben Quelle stammen. Um Verzerrungen zu vermeiden, sind Test- und Kontrolltöpfe zu randomisieren.
21. Mit einem Insektizid oder einem Fungizid behandeltes Saatgut (d. h. gebeiztes Saatgut) darf nicht verwendet werden. Einige Regulierungsbehörden erlauben jedoch die Verwendung bestimmter nicht systemischer Kontaktfungizide (z.B. Captan, Thiram) (22). Wenn Bedenken hinsichtlich der Eintragung von Erregern über das Saatgut bestehen, kann das Saatgut kurz in eine schwache Hypochloritlösung (5 %) gegeben, gründlich unter fließendem Wasser gewaschen und getrocknet werden. Es dürfen keine Behandlungen mit anderen Pflanzenschutzprodukten vorgenommen werden.
Prüfbedingungen
22. Die Prüfbedingungen müssen etwa den Bedingungen entsprechen, die für ein normales Wachstum der geprüften Arten und Sorten erforderlich sind. (Beispiele für Prüfbedingungen sind Anlage 4 zu entnehmen.) Die auflaufenden Pflanzen sind entsprechend guter gärtnerischer Praxis in Klimakammern, Phytotronanlagen oder Gewächshäusern zu halten. In Pflanzenwachstumsanlagen umfasst diese gute Praxis beispielsweise die Regelung sowie die Aufzeichnung von Temperatur, Feuchtigkeit, Kohlendioxid-Konzentration, Lichtverhältnissen (Intensität, Wellenlänge, photosynthetisch aktive Strahlung), Beleuchtungsdauer und Bewässerung in angemessener Häufigkeit (z.B. täglich), um ein gutes Wachstum der Pflanzen (gemessen an der Entwicklung der Kontrollpflanzen der ausgewählten Arten) sicherzustellen. Die Temperaturen in Gewächshäusern müssen durch Belüftungs-, Heiz- und/oder Kühlsysteme geregelt werden. Für Tests in Gewächshäusern werden im Allgemeinen die folgenden Bedingungen empfohlen:
- Temperatur: 22 ± 10 °C;
- Feuchtigkeit: 70 ± 25 %;
- Photoperiode: mindestens 16 Stunden;
- Lichtintensität: 350 ± 50 µE/m2/s. Zusätzliche Beleuchtung kann erforderlich sein, wenn die Intensität unter 200 µE/m2/s, Wellenlänge 400-700 nm, absinkt (außer bei bestimmten Arten mit geringerem Lichtbedarf).
Im Laufe der Prüfung sind die Umgebungsbedingungen zu überwachen und zu protokollieren. Die Pflanzen müssen in nicht porösen Kunststofftöpfen oder in glasierten Töpfen mit einer Schale oder einem Untersetzer unter dem Topf gezogen werden. Die Töpfe können regelmäßig umgestellt werden, um Wachstumsunterschiede (infolge unterschiedlicher Prüfbedingungen in den Wachstumsanlagen) zu minimieren. Außerdem müssen die Töpfe so groß sein, dass die Pflanzen normal wachsen können.
23. Zur Erhaltung der Wuchskraft können den Böden bei Bedarf Nährstoffe zugeführt werden. Notwendigkeit und Zeitpunkt der Gabe zusätzlicher Nährstoffe lassen sich durch Beobachtung der Kontrollpflanzen ermitteln. Die Testbehältnisse sollten von unten bewässert werden (z.B. mit Glasfaserdochten). Anfänglich kann aber auch von oben bewässert werden, um die Keimung anzuregen und um bei Oberflächenapplikation das Eindringen der Chemikalie in den Boden zu erleichtern.
24. Die spezifischen Wachstumsbedingungen sollten für die zu prüfende Art und die jeweilige Prüfchemikalie angemessen sein. Die Pflanzen der Kontrollgruppe und die behandelten Pflanzen sind unter den gleichen Umgebungsbedingungen zu halten; es sollten jedoch geeignete Maßnahmen getroffen werden, um Kreuzexpositionen (z.B. gegen flüchtige Chemikalien) zwischen den verschiedenen Behandlungsgruppen sowie der Kontrollgruppen gegen die Prüfchemikalie zu vermeiden.
Prüfung mit einer einzigen Konzentration/Dosierung
25. Bei der Bestimmung der Konzentration/Dosierung einer Chemikalie zur Durchführung eines Tests mit einer einzigen Konzentration/Dosierung (Challenge- oder Limit-Test) sind eine Reihe von Faktoren zu beachten. Bei allgemeinen Chemikalien gehören dazu die physikalisch-chemischen Eigenschaften der betreffenden Chemikalie. Bei Pflanzenschutzprodukten sind die physikalisch-chemischen Eigenschaften und die Art der Verwendung der Prüfchemikalie, die maximale Konzentration/Dosierung, die Anzahl der Aufbringungen pro Saison und/oder die Persistenz der Prüfchemikalie zu berücksichtigen. Um festzustellen, ob eine allgemeine Chemikalie phytotoxische Eigenschaften besitzt, kann eine Prüfung mit maximal 1.000 mg/kg trockenem Boden angemessen sein.
Vorversuch
26. Erforderlichenfalls kann ein Vorversuch durchgeführt werden, um die in der definitiven Dosis-Wirkungs-Studie zu testenden Konzentrationen/Dosierungen zu bestimmen. Im Vorversuch sollten die Testkonzentrationen/- dosierungen weit auseinander liegen (z.B. 0,1, 1,0, 10, 100 and 1.000 mg/kg trockener Boden). Im Fall von Pflanzenschutzprodukten kann von der empfohlenen oder maximalen Konzentration oder Dosierung ausgegangen werden (z.B. 1/100, 1/10, 1/1 der empfohlenen/maximalen Konzentration oder Dosierung).
Prüfung mit mehreren Konzentrationen/Dosierungen
27. Ziel der Prüfung mit mehreren Konzentrationen/Dosierungen sind entsprechend den Anforderungen der Regulierungsbehörden die Ermittlung einer Dosis-Wirkungs-Beziehung und die Bestimmung eines ECx- bzw. ERx-Werts für Auflauf, Biomasse und/oder sichtbare Wirkungen im Vergleich zu nicht exponierten Kontrollen.
28. Die Abstände zwischen den Konzentrationen oder Dosierungen und ihre Anzahl sollten hinreichend sein, um eine Dosis-Wirkungs-Beziehung zuverlässig feststellen, eine Regressionsgleichung aufstellen und die Werte für ECx oder ERx bestimmen zu können. Die ausgewählten Konzentrationen/Dosierungen müssen die zu ermittelnden ECx- oder ERx-Werte einschließen. Wenn beispielsweise ein EC50-Wert benötigt wird, sollten die Prüfungen bei Dosierungen durchgeführt werden, bei denen eine Wirkung im Bereich von 20-80 % zu erwarten ist. Hierzu werden mindestens fünf Testkonzentrationen/-dosierungen mit einer geometrischen Reihe sowie eine unbehandelte Kontrolle empfohlen, wobei sich die Konzentrationen/Dosierungen höchstens um den Faktor 3 unterscheiden sollten. Für jede Behandlungsgruppe und für jede Kontrollgruppe sind mindestens vier Replikate vorzusehen, und insgesamt sind mindestens 20 Samen zu verwenden. Bei bestimmten Pflanzen mit schlechter Keimung oder unterschiedlicher Wachstumsentwicklung sind unter Umständen auch mehr Replikate erforderlich, um die statistische Aussagekraft der Prüfung zu erhöhen. Wenn eine größere Anzahl an Testkonzentrationen/-dosierungen verwendet wird, kann die Anzahl der Replikate reduziert werden. Muss die NOEC bestimmt werden, sind unter Umständen mehr Replikate erforderlich, um die erwünschte statistische Aussagekraft zu erzielen (23).
Beobachtungen
29. Während der Beobachtungsdauer (d. h. 14 bis 21 Tage nach Auflauf von 50 % der Kontrollpflanzen sowie gegebenenfalls auch der Kontrollen mit Lösungsmitteln) werden die Pflanzen häufig (mindestens wöchentlich, möglichst sogar täglich) auf Auflaufen und sichtbare Anzeichen von Phytotoxizität und Mortalität kontrolliert. Am Ende der Prüfung werden der Prozentanteil der aufgelaufenen Pflanzen und die Biomasse der überlebenden Pflanzen sowie sichtbare Schädigungen an verschiedenen Pflanzenteilen protokolliert. Zu Letzteren zählen Anomalien im Aussehen der aufgelaufenen Keimlinge, Wachstumshemmungen, Chlorose, Entfärbungen, Mortalität und Wirkungen auf die Entwicklung der Pflanzen. Die endgültige Biomasse kann anhand der endgültigen durchschnittlichen Spross-Trockenmasse der überlebenden Pflanzen ermittelt werden, indem die Pflanzen am Boden abgeschnitten und dann bei 60 °C auf ein konstantes Gewicht getrocknet werden. Alternativ kann die endgültige Biomasse auch anhand der Spross-Frischmasse bestimmt werden. Die Länge der Triebe kann ein weiterer Endpunkt sein, wenn von den Regulierungsbehörden gefordert. Es muss ein einheitliches System für die Beurteilung sichtbarer Schäden verwendet werden, um feststellbare toxische Reaktionen bewerten zu können. Beispiele für qualitative und quantitative visuelle Beurteilungen sind den Quellen (23) und (24) zu entnehmen.
Statistische Analyse
Prüfung mit einer einzigen Konzentration/Dosierung
30. Für jede Pflanzenart sind die ermittelten Daten mithilfe einer geeigneten statistischen Methode zu analysieren (21). Die Wirkung bei der Testkonzentration/-dosierung ist ebenso zu protokollieren wie gegebenenfalls die Tatsache, dass bei der Testkonzentration/-dosierung eine bestimmte Wirkung nicht eintritt (z.B. festgestellte Wirkung <x % bei Konzentration oder Dosierung y).
Prüfung mit mehreren Konzentrationen/Dosierungen
31. Eine Dosis-Wirkungs-Beziehung wird mithilfe einer Regressionsgleichung aufgestellt. Dabei können verschiedene Modelle zur Anwendung kommen. Für die Bestimmung der ECx- oder ERx-Werte (etwa EC25, ER25, EC50 oder ER50) und der entsprechenden Konfidenzintervalle für das Auflaufen als quantale Daten beispielsweise könnten u. a. das Logit-, das Probitmodell, die Weibull-, die Spearman-Karber- oder die Trimmed Spearman- Karber-Methode geeignet sein. Das Wachstum der Keimlinge (Gewicht und Länge) als kontinuierliche Endpunkte ECx oder ERx und die entsprechenden Konfidenzintervalle können mit geeigneten Regressionsanalysen (z.B. durch nicht lineare Regressionsanalyse nach Bruce-Versteeg (25)) bestimmt werden. Nach Möglichkeit sollte R2 bei den empfindlichsten Arten mindestens 0,7 betragen, und die Testkonzentrationen/- dosierungen sollten Wirkungen im Bereich von 20-80 % einschließen. Zur Ermittlung der NOEC sind leistungsfähige statistische Tests zu empfehlen, die auf Basis der Datenverteilung ausgewählt werden sollten (21) (26).
Prüfbericht
32. Der Prüfbericht muss die Ergebnisse der Untersuchungen sowie eine detaillierte Beschreibung der Prüfbedingungen, eine eingehende Diskussion der Ergebnisse, eine Datenanalyse und die Schlussfolgerungen der Analyse enthalten. Eine tabellarische Übersicht und eine Zusammenfassung der Ergebnisse ist beizufügen. Der Bericht muss folgende Angaben enthalten:
Prüfchemikalie:
- chemische Kenndaten, relevante Eigenschaften der geprüften Chemikalie (z.B. log Pow, Wasserlöslichkeit, Dampfdruck und gegebenenfalls Angaben zum Verbleib und zum Verhalten in der Umwelt);
- Angaben zur Herstellung der Testlösung und zur Verifizierung von Testkonzentrationen wie unter Nummer 18 beschrieben.
Im Test verwendete Art:
- Angaben zum Testorganismus; Art/Sorte, Pflanzenfamilien, wissenschaftliche und allgemeine Bezeichnung, möglichst genaue Angaben zu Quelle und Herkunft des Saatguts (d. h. Name des Lieferanten, Keimrate, Größenklasse der Samen, Chargen- oder Losnummer, Saatjahr oder Wachstumssaison, Datum der Bewertung der Keimung), Lebensfähigkeit usw.;
- Anzahl der geprüften ein- und zweikeimblättrigen Arten;
- Gründe für die Auswahl der Arten;
- Beschreibung der Lagerung, der Behandlung und der Erhaltung des Saatguts.
Prüfbedingungen:
- Prüfanlage (z.B. Wachstumskammer, Phytotron und Gewächshaus);
- Beschreibung des Prüfsystems (z.B. Abmessungen der Töpfe, Topfmaterial und Bodenmenge);
- Merkmale des Bodens (Textur oder Typ: Partikelverteilung und Klassifizierung, physikalische und chemische Eigenschaften einschließlich Prozentanteil organischer Materie und organischen Kohlenstoffs sowie pH- Wert);
- Vorbereitung des Bodens/Substrats vor der Prüfung (natürlicher und künstlicher Boden, Sand usw.);
- Beschreibung des Nährmediums, falls verwendet;
- Applikation der Prüfchemikalie: Beschreibung der Applikationsmethode, Beschreibung der Ausrüstung, der Exposition (Dosierung und Volumina) einschließlich chemischer Verifizierung, Beschreibung der Kalibrierungsmethode und der Umgebungsbedingungen während der Applikation;
- Wachstumsbedingungen: Lichtintensität (z.B. photosynthetisch aktive Strahlung), Photoperiode, Temperaturen (max./min.), Bewässerungsplan und -methode, Düngung;
- Anzahl der Samen pro Topf, Anzahl der Pflanzen pro Dosis, Anzahl der Replikate (Töpfe) pro Expositionsrate;
- Typ und Anzahl der Kontrollen (negative und/oder positive Kontrollen sowie Lösungsmittelkontrollen, falls verwendet);
- Dauer der Prüfung.
Ergebnisse:
- Tabelle mit allen Endpunkten für alle Replikate, Testkonzentrationen/-dosierungen und Arten;
- Anzahl und Prozentsatz aufgelaufener Pflanzen im Vergleich zu den Kontrollen;
- Messungen der Biomasse (Spross-Trockenmasse oder -Frischmasse) der Pflanzen ausgedrückt als Prozentsatz der Kontrollen;
- Länge der Pflanzentriebe als Prozentsatz der Kontrollen, falls gemessen;
- Prozentanteil sichtbarer Schäden sowie qualitative und quantitative Beschreibung der sichtbaren Schäden (Chlorose, Nekrose, Welken, Verformungen von Blättern und Stängeln sowie gegebenenfalls des Ausbleiben von Wirkungen) durch die Prüfchemikalie im Vergleich zu Kontrollpflanzen;
- Beschreibung der Skala zur Beurteilung sichtbarer Schäden, wenn eine visuelle Beurteilung vorliegt;
- bei Untersuchungen mit einer einzigen Dosierung ist der Prozentanteil der Schäden zu protokollieren;
- ECx- oder ERx-Werte (z.B. EC50, ER50, EC25, ER25) und entsprechende Konfidenzintervalle. Wenn Regressionsanalysen vorgenommen werden, sind der Standardfehler für die Regressionsgleichung und der Standardfehler der einzelnen Parameterschätzungen (z.B. Steigung und Schnittpunkt) anzugeben;
- NOEC (und LOEC), falls berechnet;
- Beschreibung der statistischen Verfahren und der zugrunde gelegten Annahmen;
- grafische Darstellung dieser Daten und der Dosis-Wirkungs-Beziehung der im Test verwendeten Art;
Abweichungen von den für diese Prüfmethode beschriebenen Verfahren und außergewöhnliche Vorkommnisse während der Prüfung.
(1) Schrader, G., Metge, K., und Bahadir, M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
(2) Internationale Organisation für Normung (1993). ISO 11269-1. Bodenbeschaffenheit - Bestimmung der Wirkungen von Schadstoffen auf die Bodenflora - Teil 1: Verfahren zur Messung der Wurzelwachstumshemmmung.
(3) Internationale Organisation für Normung (1995). ISO 11269-2. Bodenbeschaffenheit - Bestimmung der Wirkungen von Schadstoffen auf die Bodenflora - Teil 2: Wirkung von verunreinigten Böden auf Saatauflauf und frühes Wachstum höherer Pflanzen.
(4) American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
(5) U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
(6) US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
- 850.4000: Background - Nontarget Plant Testing;
- 850.4025: Target Area Phytotoxicity;
- 850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
- 850.4200: Seed Germination/Root Elongation Toxicity Test;
- 850.4225: Seedling Emergence, Tier II;
- 850.4230: Early Seedling Growth Toxicity Test.
(7) AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31- 203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
(8) Boutin, C., Freemark, K.E. and Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-Target Plant Testing and Evaluation.Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Kanada.
(9) Forster, R., Heimbach, U., Kula, C., und Zwerger, P. (1997). Auswirkungen von Pflanzenschutzmitteln auf Nichtzielorganismen. Diskussionspapier zur Risikoabschätzung und Risikominimierung für terrestrische Nichtzielorganismen (Flora und Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. Nr. 48.
(10) Hale, B., Hall, J.C., Solomon, K., und Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario, Kanada.
(11) Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Proc. 26:305 (1962).
(12) Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, Chapter 5, S. 163-206.
(13) Beall, M.L., Jr., und Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
(14) Beetsman, G.D., Kenney, D.R., und Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
(15) U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 S., FDA, Washington, DC.
(16) McKelvey, R.A., Wright, J.P., Honegger, J.L., und Warren, L.W. (2002). A Comparison of Crop and Noncrop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174.
(17) Boutin, C.; Elmegaard, N., und Kjær, C. (2004). Toxicity testing of fifteen noncrop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349-369.
(18) Boutin, C., und Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides - An analysis with two databases. Ecotoxicology vol.9(4):255-271.
(19) Boutin, C., und Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
(20) Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P., und Maguire, R.J. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
(21) OECD (2006). Draft Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No 54, Organisation for Economic Cooperation and Development, Paris.
(22) Hatzios, K.K., und Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
(23) Hamill, P.B., Marriage, P.B., und G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
(24) Frans, R.E., und Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
(25) Bruce, R.D., und Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
(26) Kapitel C.33: Reproduktionstest mit Regenwürmern (Eisenia fetida/Eisenia andrei).
| Begriffsbestimmungen | Anlage 1 |
Chemikalie: ein Stoff oder eine Mischung.
Pflanzenschutzmittel oder Pestizide: Stoffe mit spezifischer biologischer Wirkung, die gezielt zum Schutz von Pflanzen gegen Schädlinge (z.B. Pilze, Insekten und konkurrierende Pflanzen) eingesetzt werden.
ECx, Konzentration mit einer Wirkung von x %, oder ERx, Dosis mit einer Wirkung von x %: die Konzentration oder Dosis, bei der es in einem Test zu einer unerwünschten Änderung des Endpunkts um x % gegenüber der jeweiligen Kontrolle kommt (z.B. Reduzierung des Auflaufs, des Sprossgewichts, der endgültigen Anzahl vorhandener Pflanzen oder Zunahme sichtbarer Schäden um 25 % oder 50 %, entsprechend einer EC25/ER25 bzw. EC50/ER50).
Auflauf: Austreten der Koleoptile (Keimscheide) oder der Kotyledone (Keimblatt) aus dem Boden.
Formulierung: für den Handel hergestelltes Produkt mit dem Wirkstoff; auch als Endpräparat 1 oder für den typischen Verwendungszweck bestimmtes Endprodukt bezeichnet.
LOEC (Lowest Observed Effect Concentration): niedrigste geprüfte Konzentration der Prüfchemikalie, bei der eine Wirkung beobachtet wurde. Bei dieser Prüfung hat die der LOEC entsprechende Konzentration innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle eine statistisch signifikante Wirkung (p < 0,05) und ist höher als die NOEC.
Nichtzielpflanzen: Pflanzen außerhalb des Zielpflanzenbereichs. Bei Pflanzenschutzmitteln bezieht diese Bezeichnung sich gewöhnlich auf Pflanzen außerhalb des behandelten Bereichs.
NOEC (No observed Effect Concentration): Die höchste Konzentration der Prüfchemikalie, bei der keine Wirkung beobachtet wurde. Bei diesem Test hat die der NOEC entsprechende Konzentration innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle keine statistisch signifikante Wirkung (p < 0,05).
Phytotoxizität: in Messungen und visuellen Prüfungen festgestellte schädliche Abweichungen vom normalen Aussehen und Wachstum der Pflanzen aufgrund der Wirkung einer bestimmten Chemikalie.
Replikat: Versuchseinheit, die die Kontrollgruppe und/oder die Behandlungsgruppe repräsentiert. Bei diesen Untersuchungen ist der Topf als Replikat definiert.
Visuelle Prüfung: Beurteilung des sichtbaren Schadens anhand von Beobachtungen zur Haltung der Pflanze, zur Wuchskraft, zu Missbildungen, Chlorose, Nekrose sowie zum Gesamteindruck im Vergleich zu einer Kontrolle.
Prüfchemikalie: ein Stoff oder eine Mischung, der bzw. die nach dieser Methode geprüft wird.
| Liste der Üblicherweise für Pflanzentests verwendeten Arten | Anlage 2 |
| Familie | Art | Gewöhnliche Bezeichnung |
| DICOTYLEDONAE | ||
| Apiaceae (Umbelliferae) | Daucus carota | Möhre |
| Asteraceae (Compositae) | Helianthus annuus | Sonnenblume |
| Asteraceae (Compositae) | Lactuca sativa | Gartensalat |
| Brassicaceae (Cruciferae) | Sinapis alba | Weißer Senf |
| Brassicaceae (Cruciferae) | Brassica campestris var. chinensis | Chinakohl |
| Brassicaceae (Cruciferae) | Brassica napus | Raps |
| Brassicaceae (Cruciferae) | Brassica oleracea var. capitata | Kohl |
| Brassicaceae (Cruciferae) | Brassica rapa | Rübsen |
| Brassicaceae (Cruciferae) | Lepidium sativum | Gartenkresse |
| Brassicaceae (Cruciferae) | Raphanus sativus | Rettich |
| Chenopodiaceae | Beta vulgaris | Rübe |
| Cucurbitaceae | Cucumis sativus | Gurke |
| Fabaceae (Leguminosae) | Glycine max (G. soja) | Sojabohne |
| Fabaceae (Leguminosae) | Phaseolus aureus | Mungobohne |
| Fabaceae (Leguminosae) | Phaseolus vulgaris | Gartenbohne |
| Fabaceae (Leguminosae) | Pisum sativum | Erbse |
| Fabaceae (Leguminosae) | Trigonella foenumgraecum | Bockshornklee |
| Fabaceae (Leguminosae) | Lotus corniculatus | Gewöhnlicher Hornklee |
| Fabaceae (Leguminosae) | Trifolium pratense | Wiesenklee |
| Fabaceae (Leguminosae) | Vicia sativa | Futterwicke |
| Linaceae | Linum usitatissimum | Flachs |
| Polygonaceae | Fagopyrum esculentum | Buchweizen |
| Solanaceae | Solanum lycopersicon | Tomate |
| MONOCOTYLEDONAE | ||
| Liliaceae (Amarylladaceae) | Allium cepa | Zwiebel |
| Poaceae (Gramineae) | Avena sativa | Hafer |
| Poaceae (Gramineae) | Hordeum vulgare | Gerste |
| Poaceae (Gramineae) | Lolium perenne | Deutsches Weidelgras |
| Poaceae (Gramineae) | Oryza sativa | Reis |
| Poaceae (Gramineae) | Secale cereale | Roggen |
| Poaceae (Gramineae) | Sorghum bicolor | Körner-Sorghum, Mohrenhirse |
| Poaceae (Gramineae) | Triticum aestivum | Weichweizen |
| Poaceae (Gramineae) | Zea mays | Mais |
| Liste potenzieller Nichtkulturpflanzen | Anlage 3 |
OECD-Liste potenzieller Arten für Toxizitätsprüfungen an Pflanzen
Hinweis: Die folgende Tabelle enthält Informationen zu 52 Nichtkulturpflanzen (Literaturangaben sind jeweils in Klammern nachgestellt). Die genannten Auflaufraten stammen aus der veröffentlichten Literatur und dienen nur als Anhaltspunkt. In Abhängigkeit von der Herkunft des Saatguts und anderen Faktoren kann es im Einzelfall zu Abweichungen kommen.
| FAMILIE Botanischer Name der Art (gemeiner deutscher Name) | Lebensdauer 1 und Lebensraum | Samenge- wicht (mg) | Photoperiode für Keimung oder Wachstum 2 | Saattiefe (mm) 3 | Keimzeit (Tage) 4 | Spezialbehandlungen 5 | Toxizitäts- test 6 | Saatgut- Anbieter 7 | Sonstige Lite- ratur 8 |
| APIACEAE Torilis japónica (Gewöhnlicher Klettenkerbel) | A, B gestörte Flächen, Hecken, Weiden (16, 19) | 1,7 - 1,9 (14, 19) | L = D (14) | 0 (1, 19) | 5 (50 %) (19) | Stratifikation (Kälte) (7, 14, 18, 19); unter Umständen ist eine Reifung erforderlich (19); Keimung durch Dunkelheit gehemmt (1, 19); keine Spezialbehandlungen (5) | NACH (5) | ||
| ASTERACEAE Bellis perennis (Gänseblümchen) | P Grasflächen, Äcker, Rasen (16, 19) | 0,09-0,17 (4, 19) | L = D (14) | 0 (4) | 3 (50 %) (19) 11 (100 %) | Keimung durch Bestrahlung nicht beeinträchtigt (18, 19); keine Spezialbehandlungen (4, 14) | NACH (4) | A, D, F | 7 |
| Centaurea cyanus
(Kornblume) | A Felder, Straßenränder, offene Lebensräume (16) | 4,1-4,9 (4, 14) | L = D (14) | 0-3 (2, 4, 14) | 14-21 (100 %) (14) | keine Spezialbehandlungen (2, 4) | NACH (2,4) | A, D, E, F | 7 |
| Centaurea nigra
(Schwarze Flockenblume) | P Felder, Straßenränder, offene Lebensräume (16, 19) | 2,4-2,6 (14, 19) | L = D (14) | 0 (19) | 3 (50 %) (19) 4 (97 %) | Reifung kann erforderlich sein (18, 19); Keimung durch Dunkelheit gehemmt (19); keine Spezialbehandlungen (5, 14, 26) | NACH (5, 22, 26) | a | |
| Inula helenium
Alant | P feuchte, gestörte Standorte (16) | 1 - 1,3 (4, 14, 29) | 0 (4, 29) | keine Spezialbehandlungen (4) | NACH (4) | A, F | |||
| Leontodon hispidus (Steifhaariger Löwenzahn) | P Felder, Straßenränder, gestörte Flächen (16, 19) | 0,85 -1,2 (14, 19) | L = D (14) | 0 (19) | 4 (50 %) (19) 7 (80 %) | Keimung durch Bestrahlung gehemmt (17, 18, 19); keine Spezialbehandlungen (5, 23) | NACH (5, 22, 23) | ||
| Rudbeckia hirta (Rudbeckie | B, P gestört (16) | 0,3 (4, 14) | L = D (14) | 0 (4, 33) | < 10 (100 %) (33) | keine Spezialbehandlungen (4, 14, 33) | NACH (4, 33) | C, D, E, F | |
| Solidago canadensi
Kanadische Goldrute | P Weiden, offene Flächen (16) | 0,06-0,08 (4, 14) | L = D (11) | 0 (4) | 14-21 (11) | zu gleichen Teilen mit Sand mischen und 24 h in 500 ppm GA einweichen (11); keine Spezialbehandlungen (4) | NACH (4) | E, F | |
| Xanthium pensylvanicum
(Spitzklette) | A Felder, offene Lebensräume (16) | 25-61 (14, 29) | 0(1) 5(29) | Keimung kann durch Dunkelheit gehemmt werden (1); 12 h in warmem Wasser einweichen (29) | VOR UND NACH (31) | a | |||
| Xanthium spinosum
(Dornige Spitzklette) | A offene Lebensräume (16) | 200 (14) | L = D (14) L > D (6) | 10(6) | Skarifikation (14); keine Spezialbehandlungen (6) | VOR UND NACH (6) | a | ||
| Xanthium strumarium
(Gewöhnliche Spitzklette) | A Felder, offene Lebensräume (16) | 67,4 (14) | L = D (14) | 10-20 (6, 21) | keine Spezialbehandlungen (6, 14, 21) | VOR UND NACH (6, 21, 28, 31) | a | ||
| BRASSICACEAE Cardamine pratensis
| P Felder, Straßenränder, Rasen (16, 19) | 0,6 (14, 19) | L = D (14) | 0 (19) | 5 (50 %) (19) 15 (98 %) (18) | Keimung durch Bestrahlung gehemmt (18, 19); keine Spezialbehandlungen (5, 14, 22) | NACH (5, 22) | F | |
| CARYOPHYLLACEAE Lychnis floscuculi (Kuckucks-Lichtnelke) | P (16) | 0,21 (14) | L = D (14) | < 14 (100 %) (14, 25) | Reifung kann erforderlich sein (18); keine Spezialbehandlungen (5, 14, 15, 22-26) | NACH (5, 15, 22-26) | F | ||
| Chenopodiaceae Chenopodium album (Weißer Gänsefuß) | a Feldränder, gestörte Flächen (16, 19) | 0,7-1,5 (14, 19, 34) | L = D (14) | 0 (1, 19) | 2 (50 %)(19) | Behandlung je nach Farbe der Samen unterschiedlich (19); trockene Keimruhe (19); Keimung durch Dunkelheit gehemmt (1, 18, 19); Stratifikation (Kälte) (18); keine Spezialbehandlungen (14, 34) | VOR UND NACH (28, 31, 34) | a | 32 |
| CLUSIACEAE Hypericum perforatum (Echtes Johanniskraut) | P Felder, Äcker, offene Lebensräume (16, 19) | 0,1-0,23 (14, 19) | L= D (14) | 0 (1, 19) | 3 (19) 11 (90 %) (18) | Keimung durch Dunkelheit gehemmt (1, 18, 19) keine Spezialbehandlungen (5, 14, 15, 25, 27) | NACH (5, 15, 25, 27) | A, E, F | |
| CONVOLVULACEAE Ipomoea hederacea (Efeu-Prunkwinde) | a Straßenränder, offene Lebensräume, Maisfelder (16) | 28,2 (14) | L > D (6, 10) | 10-20 (6, 10, 21) | 4 (100 %) (10) | Keimung durch Bestrahlung nicht beeinträchtigt (1) keine Spezialbehandlungen (6, 21) | VOR UND NACH (6, 12, 21, 28) | a | |
| CYPERACEAE Cyperus rotundus (Knolliges Zypergras) | P Äcker, Weiden, Straßenränder (16, 30) | 0,2 (14) | L= D (14) | 0 (1) 10-20 (6, 10) | 12 (91 %) (10) | Keimung durch Dunkelheit gehemmt (1) keine Spezialbehandlungen (6, 10, 14) | VOR UND NACH (6, 28, 31) | B | 7 |
| FABACEAE Lotus corniculatus (Gewöhnlicher Hornklee) | P Grasflächen, Straßenränder, offene Lebensräume (16, 19) | 1-1,67 (14, 19) | L = D (14) | 1 (50 %) (19) | Skarifikation (14, 19) Keimung durch Bestrahlung nicht beeinträchtigt (18, 19); keine Spezialbehandlungen (23, 25) | NACH (5, 23, 25) | A, D, E, F | ||
| Senna obtusifolia
(Senna) | A feuchte Wälder (16) | 23-28 (9) | L = D (14) L > D (9) | 10-20 (6,9) | Samen 24 h in Wasser einweichen (9)
Skarifikation (14); je nach Farbe unterschiedliche Lebensfähigkeit der Samen (1); keine Spezialbehandlungen (6) | NACH (6,9) | a | ||
| Sesbania exaltata
(Hanf) | A Schwemmboden (16) | 11-13 (9, 14) | L > D (9) | 10-20 (9, 21) | Samen 24 h in Wasser einweichen (9)
Keimung durch Bestrahlung nicht beeinträchtigt (1); keine Spezialbehandlungen (21) | VOR UND NACH | a | ||
| Trifolium pratense
(Wiesenklee) | P Felder, Straßenränder, Äcker (16, 19) | 1,4-1,7 (14, 19) | L= D (14) | 1 (50 %) (19) | Skarifikation (14, 18)
unter Umständen Reifung erforderlich (19); Keimung durch Bestrahlung nicht beeinträchtigt (1, 19); keine Spezialbehandlungen (5) | NACH (5) | A, E, F | ||
| LAMIACEAE Leonurus cardiaca (Echtes Herzgespann) | P offene Flächen (16) | 0,75-1,0 (4, 14) | L= D (14) | 0 (4) | keine Spezialbehandlungen (4, 14) | NACH (4) | F | ||
| Mentha spicata
(Grüne Minze) | P feuchte Gebiete (16) | 2,21 (4) | 0 (4) | keine Spezialbehandlungen (4) | NACH (4) | F | |||
| Nepeta cataria
(Echte Katzenminze) | P gestörte Flächen (16) | 0,54 (4, 14) | L= D (14) | 0 (4) | keine Spezialbehandlungen (2, 4, 14) | NACH (2,4) | F | ||
| Prunella vulgaris
(Gewöhnliche Braunelle) | P Äcker, Grasflächen, gestörte Standorte (16,19) | 0,58 -1,2 (4, 14, 19) | L= D (14) | 0 (4, 19) | 5 (50 %) (19) 7 (91 %) | Keimung durch Dunkelheit gehemmt (18, 19)
stärkere Keimung bei größeren Samen (1); keine Spezialbehandlungen (4, 14, 22) | NACH (4, 22) | A, F | |
| Stachys officinalis
(Echte Betonie) | P Grasflächen, Feldränder (19) | 14-18 (14, 19) | L= D (14) | 7 (50 %) (19) | keine Spezialbehandlungen | NACH (5, 22) | F | ||
| MALVACEAE Abutilon theophrasti (Europäische Samtpappel) | A Felder, offene Lebensräume (16) | 8,8 (14) | L= D (14) | 10-20 (6, 10, 21) | 4 (84 %) (10) | Skarifikation (14) | VOR UND NACH (6, 22, 28, 31) | A, F | |
| Sida spinosa
Sida spinosa | a Felder, Straßenränder (16) | 3,8 (14) | L= D (14) | 10-20 (6, 21) | Skarifikation (14)
Keimung durch Bestrahlung nicht beeinträchtigt (1); keine Spezialbehandlungen (6, 21) | VOR UND NACH (6, 21, 28, 31) | A, F | ||
| PAPAVERACEAE Papaver rhoeas (Klatschmohn) | a Felder, Äcker, gestörte Standorte (16, 19) | 0,1 -0,3 (4, 14, 19, 29) | L= D (14) | 0 (4, 29) | 4 (50 %) (19) | Stratifikation (Kälte) und Skarifikation (1, 19, 32) | NACH (4) | A, D, E, F, G |
| FAMILIE Botanischer Name der Art (gemeiner deutscher Name) | Lebensdauer 1 und Lebensraum | Samenge- wicht (mg) | Photoperiode für Keimung oder Wachstum 2 | Saattiefe (mm) 3 | Keimzeit (Tage) 4 | Spezialbehandlungen 5 | Toxizitäts- test 6 | Saatgut- Anbieter 7 | Sonstige Lite- ratur 8 |
| POACEAE Agrostis tenuis (Rotes Straußgras) | Rasen, Weiden (16) | 0,07 (14) | L > D (I-O) | 20 (10) | 10 (62 %) (10) | Keimung durch Bestrahlung gehemmt (1, 17-19); keine Spezialbehandlungen (10) | NACH (10) | A, E | |
| Alopecurus myosuroides
(Acker-Fuchsschwanzgras) | A Felder, offene Lebensräume (16) | 0,9-1,6 (29, 34) | L = D (14) | 2 (29) | < 24 (30 %) (34) | Skarifikation (14); Behandlung mit 101 mg/l
KNO3 (14); Stratifikation (Wärme) (1) Keimung durch Dunkelheit gehemmt (1); keine Spezialbehandlungen (34) | VOR UND NACH (28, 34) | a | 32 |
| Avena fatua
(Flughafer) | A Anbaugebiete, offene Lebensräume (16) | 7-37,5 (14, 30) | L = D (14)
L > D (6) | 10-20 (6, 10) | 3 (70 %) (18) | Skarifikation (7, 32); Keimung durch Dunkelheit gehemmt (1)
Stratifikation (Kälte) (1, 18); keine Spezialbehandlungen (6, 10, 14) | VOR UND NACH (6, 10, 28, 31) | a | |
| Bromus tectorum
(Dach-Trespe) | A Felder, Straßenränder, Äcker (16) | 0,45-2,28 (14, 29) | L = D (14) | 3 (29) | Reifungsperiode (1, 7, 32); Keimung durch Licht gehemmt (1); keine Spezialbehandlungen (14) | VOR UND NACH (28, 31) | a | ||
| Cynosurus cristatus
(Kammgras) | P Felder, Straßenränder, offene Lebensräume (16, 19) | 0,5-0,7 (14, 19, 29) | L = D (14) | 0 (29) | 3 (50 %) (19) | Keimung durch Bestrahlung nicht beeinträchtigt (19); keine Spezialbehandlungen (14, 29) | NACH (5) | a | |
| Digitaria sanguinalis
(Blutrote Fingerhirse) | A Felder, Rasen, offene Lebensräume (16) | 0,52-0,6 (14, 30) | L = D (14) | 10-20 (21) | 7 (75 %) 14 (94 %) (7) | Skarifikation, Stratifikation (Kälte) und Reifung (1, 7, 14, 32); Behandlung mit 101 mg/l KNO3 (14); Keimung durch Dunkelheit gehemmt (1); keine Spezialbehandlungen (21) | VOR UND NACH (18, 25, 31) | a | |
| Echinochloa crusgalli
(Hühnerhirse) | A (16) | 1,5 (14) | L = D (14) L > D (3) | 10-20 (7, 21) | Skarifikation (7, 32); Keimung durch Bestrahlung nicht beeinträchtigt (1); keine Spezialbehandlungen (3, 14, 21) | VOR UND NACH (3, 21, 28, 31) | a | ||
| Elymus canadensis
(Kanada-Quecke) | P Uferzonen, gestörte Standorte (16) | 4-5 (14, 30) | L = D (11) | 1 (11) | 14-28 (11) | keine Spezialbehandlungen | NACH (2) | C, D, E | |
| Festuca pratensis
(Wiesenschwingel) | P Felder, feuchte Gebiete (16, 19) | 1,53-2,2 (16, 19) | L = D (14) L > D (10) | 20 (10) | 9 (74 %) (10) 2 (50 %) (19) | keine Spezialbehandlungen | NACH (10) | a | 7 |
| Hordeum pusillum
(Gerste) | A Weiden, Straßenränder, offene Lebensräume (16) | 3,28 (14) | Stratifikation (Wärme) (1); Keimung durch Bestrahlung nicht beeinträchtigt (1) | VOR (31) | 7 | ||||
| Phieum pratense
(Wiesenlieschgras) | P Weiden, Äcker, gestörte Standorte (16, 19) | 0,45 (14, 19) | L > D (10, 14) | 0-10 (10, 19) | 2 (74 %) (10) 8 (50 %) (19) | Keimung durch Dunkelheit gehemmt (19); Keimung durch Bestrahlung nicht beeinträchtigt (17); keine Spezialbehandlungen (10, 14, 17, 19) | NACH (10) | A, E | |
| POLYGONACEAE Polygonum convolvulus (Windenknöterich) | A offene Lebensräume, Straßenränder (16) | 5-8 (4, 14, 29) | L = D (20) | 0-2 (4, 29) | Stratifikation (Kälte) über 4-8 Wochen (1, 2, 4, 20, 29); Keimung durch Bestrahlung nicht gehemmt (1) | VOR UND NACH (1, 2, 20, 28, 31) | a | 32 | |
| Polygonum lapathifolium
(Ampfer-Knöterich) | A feuchter Boden (16) | 1,8-2,5 (14) | L > D (6) | 5 (94 %) (18) | Keimung durch Bestrahlung nicht beeinträchtigt (1); Keimung durch Dunkelheit gehemmt (18); Stratifikation (Kälte) (1); keine Spezialbehandlungen (5) | VOR UND NACH (6) | A, E | ||
| Polygonum pennsylvanicum
(Vogelknöterich) | A Felder, offene Lebensräume (16) | 3,6-7 (14, 29) | 2 (29) | Stratifikation (Kälte) über 4 Wochen bei 0-5 °C (1, 29); Keimung durch Dunkelheit gehemmt (1) | VOR (31) | A, E | |||
| Polygonum periscaria
(Floh-Knöterich) | A gestörte Flächen, Äcker (16, 19) | 2,1 -2,3 (14, 19) | L > D (13) | 0 (19) | < 14 (13) 2 (50 %) (19) | Skarifikation, Stratifikation (Kälte), Behandlung mit GA (14); Stratifikation (Kälte), Reifung (17-19); Keimung durch Dunkelheit gehemmt (19); keine Spezialbehandlungen (13) | NACH (13) | a | 32 |
| Rumex crispus
(Krauser Ampfer) | P Äcker, Straßenränder, offene Flächen (16, 19) | 1,3-1,5 (4, 14, 19) | L = D (14, 33) | 0 (4, 19, 33) | 3 (50 %) (19) 6 (100 %) (33) | Keimung durch Dunkelheit gehemmt (18, 19); Reifung kann erforderlich sein (18); keine Spezialbehandlungen (4, 14, 33) | NACH (4, 33) | A, E | 32 |
| PRIMULACEAE Anagallis arvensis (Acker-Gauchheil) | A Äcker, Grasflächen, gestörte Standorte | 0,4-0,5 (4, 14, 19) | L = D (14) | 1 (50 %) (19) | Stratifikation (Kälte), Behandlung mit GA (1,14, 18, 19, 32); Licht zur Keimung erforderlich (1); keine Spezialbehandlungen (2, 4) | NACH (2,4) | A, F | ||
| RANUNCULACEAE Ranunculus acris (Scharfer Hahnenfuß) | P Äcker, Straßenränder, offene Flächen (16, 19) | 1,5-2 (14, 19, 29) | L = D (14) | 1 (29) | 41 -56 (19, 29) | keine Spezialbehandlungen | NACH (5, 22, 24-26) | 32 | |
| ROSACEAE Geum urbanum (Echte Nelkenwurz) | P Hecken, feuchte Gebiete (16, 19) | 0,8-1,5 (14, 19) | L = D (14) | 0 (19) | 5 (50 %) (19) 16 (79 %) (18) | Keimung durch Dunkelheit gehemmt (18, 19); Stratifikation (Wärme) (1); keine Spezialbehandlungen (5, 14, 22, 25, 26) | NACH (5, 22, 25, 26) | a | |
| RUBIACEAE Galium aparine (Kletten-Labkraut) | A Äcker, feuchte Gebiete, gestörte Standorte (16, 19) | 7-9 (14, 19) | L = D (14) | 5 (50 %) (19) 6 (100 %) (18) | Stratifikation (Kälte) (1, 18, 19); Keimung durch Bestrahlung nicht beeinträchtigt (18, 19); Keimung durch Licht gehemmt (1); keine Spezialbehandlungen (6, 14) | VOR UND NACH (6, 28) | a | 32 | |
| Galium mollugo
(Wiesen-Labkraut) | P Wallhecken, offene Flächen (8) | 7 (29) | L = D (14) | 2 (29) | keine Spezialbehandlungen | NACH (5, 22, 24, 26) | a | ||
| SCROPHULARIACEAE Digitalis purpurea (Roter Fingerhut) | B, P Hecken, offene Flächen (16, 19) | 0,1-0,6 (4, 14, 19) | L = D (14) | 0 (4, 19) | 6 (50 %) (19) 8 (99 %) (18) | Keimung durch Dunkelheit gehemmt (1, 17-19); keine Spezialbehandlungen (4, -26, 22) | NACH (4, 22-26) | D, G, F | |
| Veronica persica
(Persischer Ehrenpreis) | A Äcker, Grasflächen, gestörte Standorte (16, 19) | 0,5-0,6 (14, 19) | L = D (14) | 0 (19) | 3(19) 5 (96 %) (18) | Keimung durch Dunkelheit gehemmt (18, 19); Stratifikation (Kälte) (18); keine Spezialbehandlungen (14) | VOR UND NACH (28) | a | 32 |
| 1) A = einjährig, B = zweijährig, P = ausdauernd.
2) Die Quellen 11, 14 und 33 beziehen sich auf das Licht (L) und die Dunkelheit (D), die zur Keimung benötigt werden. Die Quellen 3, 6, 9, 10, 13 und 20 haben die Wachstumsbedingungen in Gewächshäusern zum Gegenstand. 3) 0 mm bedeutet, dass die Samen auf die Oberfläche des Bodens gesät wurden oder dass zur Keimung Licht benötigt wird. 4) Die Zahlen bezeichnen die Anzahl der Tage, nach denen der genannten Quelle zufolge ein bestimmter Prozentanteil der Samen gekeimt ist (z.B. 3 Tage Keimrate 50 % (Quelle 19)). 5) Angaben zur Dauer der Reifung und/oder Stratifikation sind nicht immer verfügbar. Außer wenn eine Kältebehandlung erforderlich ist, werden die Temperaturbedingungen nicht angegeben, da die Temperatur bei Prüfungen in Gewächshäusern nur in eingeschränktem Umfang geregelt werden kann. Die meisten Samen keimen bei den normalen Temperaturfluktuationen in Gewächshäusern. 6) Die betreffende Art wurde einer Vorauflauf- (VOR) und/oder Nachauflaufprüfung auf Phytotoxizität mit Herbiziden unterzogen. 7) Beispiele gewerblicher Saatgutanbieter. 8) Zwei alternative Quellen, die ebenfalls berücksichtigt wurden. | |||||||||
Genannte Saatgutanbieter
| Anbieter | Anbieterinformationen |
| A | Herbiseed New Farm, Mire Lane, West End, Twyford RG10 0NJ, ENGLAND +44 1189.349 464 www.herbiseed.com |
| B | Tropilab Inc. 8240 Ulmerton Road, Largo, FL 33771-3948, USA +1.727 344 - 4050 www.tropilab.com |
| C | Pterophylla - Native Plants & Seeds #316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0, KANADA +1.519 586 - 3985 |
| D | Applewood Seed Co. 5380 Vivian St., Arvada, CO 80002, USA +1.303 431 - 7333 www.applewoodseed.com |
| E | Ernst Conservation Seeds 9006 Mercer Pike, Meadville, PA 16335, USA +1.800 873 - 3321 www.ernstseed.com |
| F | Chiltern Seeds Bortree Stile, Ulverston, Cumbria LA12 7PB, ENGLAND +44 1229 581137 www.chiltemseeds.co.uk |
| G | Thompson & Morgan P.O. Box 1051, Fort Erie, ON L2A 6C7, KANADA +1.800 274 - 7333 www.thompsonmorgan.com |
(1) Baskin, C.C., und Baskin, J.M. 1998. Seeds. Academic Press, Toronto
(2) Blackburn, L.G., und Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
(3) Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., und Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
(4) Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen noncrop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology, 13:349-369.
(5) Breeze, V., Thomas, G., und Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
(6) Brown, R.A., und Farmer, D. 1991. Tracksprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W. Wang, und M.A. Lewis, Hrsg. American Society for Testing & Materials, Philadelphia. S. 197-208.
(7) Buhler, D.D., und Hoffman, M.L., 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
(8) Clapham, A.R., Tutin, T.G., und Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge
(9) Clay, P.A., und Griffin, J.L. 2000. Weed seed production and seedling emergence response to lateseason glyphosate applications. Weed Science, 48:481-486.
(10) Cole, J.F.H., und Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial nontarget plants. BCPC - Weeds. S. 151-156.
(11) Fiely, M. (Ernst Conservation Seeds). 2004. Personal communication. (www.ernstseed.com)
(12) Fletcher, J.S., Johnson, F.L., und McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
(13) Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., und Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15 (7):1189-1196.
(14) Flynn, S., Turner, R.M., und Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
(15) Franzaring, J., Kempenaar, C., und van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
(16) Gleason, H.A., und Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY
(17) Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
(18) Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., und Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
(19) Grime, J.P., Hodgson, J.G., und Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
(20) Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
(21) Klingaman, T.E., King, C.A., und Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
(22) Marrs, R.H., Williams, C.T., Frost, A.J., und Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
(23) Marrs, R.H., Frost, A.J., und Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
(24) Marrs, R.H., Frost, A.J., und Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
(25) Marrs, R.H., Frost, A.J., Plant, R.A., und Lunnis, P. 1993. Determination of buffer zones to protect seedlings of nontarget plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283- 293.
(26) Marrs, R.H., und Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
(27) Marshall, E.J.P. und Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC - Weeds. S. 1021-1028.
(28) McKelvey, R.A., Wright, J.P., und Honegger, J.L. 2002. A comparison of crop and noncrop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
(29) Morton, S. (Herbiseed). 2004. Personal communication. (http://www.herbiseed.com)
(30) USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
(31) USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
(32) Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
(33) White, A. L., und Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Persönliche Auskunft.
(34) Zwerger, P., und Pestemer, W., 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non- target plants using a plant lifecycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
| Beispiele für geeignete Wachstumsbedingungen für bestimmte Pflanzenarten | Anlage 4 |
Die folgenden Bedingungen haben sich für zehn Pflanzenarten als geeignet erwiesen und können als Orientierung auch für Prüfungen bestimmter anderer Arten in Wachstumskammern dienen:
Kohlendioxid-Konzentration: 350 ± 50 ppm;
Relative Feuchte: 70 % ± 5 % in Lichtperioden und 90 % ± 5 % in Dunkelperioden
Temperatur: 25 ± 3 °C am Tag und 20 ± 3 °C in der Nacht;
Photoperiode: 16 Stunden Licht/8 Stunden Dunkelheit; Licht mit einer Wellenlänge von durchschnittlich 400 bis 700 nm;
Licht: Leuchtdichte 350 ± 50 µE/m2/s, gemessen an der Vegetationsoberfl´che.
Die Kulturpflanzenarten sind:
- Tomate (Solanum lycopersicon);
- Gurke (Cucumis sativus);
- Salat (Lactuca sativa);
- Sojabohne (Glycine max);
- Kohl (Brassica oleracea var. capitata);
- Möhre (Daucus carota);
- Hafer (Avena sativa);
- Deutsches Weidelgras (Lolium perenne);
- Mais (Zea mays);
- Zwiebel (Allium cepa).
C.32. Enchytraeen-Reproduktionstest
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 220 (2004). Sie soll eingesetzt werden, um die Wirkung von Chemikalien auf die Reproduktionsleistung von Enchytraeen (Enchytraeus albidus, Henle 1873) im Boden zu beurteilen. Die Prüfung beruht im Wesentlichen auf einer vom deutschen Umweltbundesamt entwickelten (1) und in einem Ringtest (2) geprüften Methode. Darüber hinaus wurden noch weitere Methoden zur Untersuchung der Toxizität von Chemikalien für Enchytraeen und Regenwürmer in Betracht gezogen (3)(4) (5)(6)(7)(8).
2. Bodenbewohnende Anneliden der Gattung Enchytraeus sind ökologisch relevante Arten für Ökotoxizitätsprüfungen. Enchytraeen kommen zwar häufig in Böden vor, in denen auch Regenwürmer leben; bei vielen Böden treten sie aber auch dann in großer Anzahl auf, wenn keine Regenwürmer vorkommen. Enchytraeen können sowohl in Labortests als auch in Halbfreiland- und in Freilandtests verwendet werden. Aus praktischer Sicht ist festzustellen, dass viele Enchytraeus-Arten leicht zu handhaben und zu züchten sind; außerdem ist ihre Regenerationszeit erheblich kürzer als die von Regenwürmern. Ein Reproduktionstest mit Enchytraeen dauert nur 4 bis 6 Wochen (gegenüber 8 Wochen bei Regenwürmern (Eisenia fetida)).
3. Allgemeine Informationen zur Ökologie und zur Ökotoxikologie von Enchytraeen in der terrestrischen Umwelt sind den Quellen (9), (10), (11) und (12) zu entnehmen.
4. Adulte Enchytraeen werden verschiedenen Konzentrationen der in künstlichen Boden eingemischten Prüfchemikalie ausgesetzt. Die Prüfung kann in zwei Schritte unterteilt werden: a) einen Vorversuch zur Feststellung des geeigneten Konzentrationsbereichs (falls keine hinreichenden Informationen verfügbar sind), in dem die Mortalität nach zweiwöchiger Exposition als wesentlicher Endpunkt beurteilt wird, und b) einen definitiven Reproduktionstest, bei dem die Gesamtzahl an juvenilen Tieren eines Elterntiers und das Überleben der Elterntiere bewertet werden. Der definitive Test dauert sechs Wochen. Nach den ersten drei Wochen werden die adulten Würmer herausgenommen und die morphologischen Änderungen protokolliert. Nach weiteren drei Wochen werden die juvenilen Tiere gezählt, die aus den von den adulten Tieren hergestellten Kokons geschlüpft sind. Die Reproduktionsleistung der Tiere, die der Prüfchemikalie ausgesetzt waren, wird mit der Reproduktionsleistung der Kontrollgruppe(n) verglichen, um i) die NOEC (höchste geprüfte Konzentration ohne beobachtete schädliche Wirkung) und/oder ii) mit dem ECx-Wert (z.B. EC10 oder EC50) (mithilfe eines Regressionsmodells) die Konzentration zu ermitteln, bei der die Reproduktionsleistung um x % reduziert wird. Die Testkonzentrationen müssen den ECx-Bereich einschließen (z.B. EC10 und EC50), damit der ECx-Wert durch Interpolation anstelle einer Extrapolation ermittelt werden kann.
Informationen zur Prüfchemikalie
5. Die Wasserlöslichkeit, der log-Kow-Wert, der Boden-Wasser-Verteilungskoeffizient (z.B. Kapitel C.18 oder C.19) und der Dampfdruck der Prüfchemikalie sollten bekannt sein. Wünschenswert sind zudem Informationen über den Verbleib der Chemikalie im Boden (z.B. die Photolyse- und die Hydrolyserate).
6. Die Prüfmethode kann sowohl für wasserlösliche als auch für nicht lösliche Chemikalien verwendet werden. Allerdings ist die Prüfchemikalie entsprechend unterschiedlich einzubringen. Für flüchtige Chemikalien ist die Prüfmethode nicht geeignet (d. h. für Chemikalien, bei denen die Henry-Konstante oder der Luft-Wasser- Verteilungskoeffizient größer als eins ist, oder für Chemikalien, bei denen der Dampfdruck bei 25 °C mehr als 0,0133 Pa beträgt.
7. Damit ein Test als valide gewertet werden kann, sollten die Kontrollen die folgenden Kriterien erfüllen:
- Die Mortalität der adulten Tiere darf am Ende des Vorversuchs und nach den ersten drei Wochen des Reproduktionstests nicht mehr als 20 % betragen;
- wenn bei der Vorbereitung des Tests 10 adulte Tiere pro Gefäß verwendet wurden, sollten sich am Ende des Tests durchschnittlich mindestens 25 juvenile Tiere pro Gefäß entwickelt haben;
- der Variationskoeffizient um die durchschnittliche Anzahl an juvenilen Tieren sollte am Ende des Reproduktionstests höchstens 50 % betragen.
Wenn ein Test die genannten Validitätskriterien nicht erfüllt, ist er zu beenden, sofern keine besonderen Gründe für seine Fortsetzung vorliegen. Die Begründung ist in den Prüfbericht aufzunehmen.
8. Eine Referenzchemikalie ist entweder regelmäßig zu prüfen oder in jeden einzelnen Test mit einzubeziehen, um sicherzustellen, dass sich die Reaktion der Testorganismen im Laufe der Zeit nicht signifikant geändert hat. Eine geeignete Referenzchemikalie ist Carbendazim, für das gezeigt wurde, dass es die Lebens- und Reproduktionsfähigkeit von Enchytraeen beeinträchtigt (13)(14); außerdem können Chemikalien mit gut bekannten Toxizitätsdaten verwendet werden. AgrEvo Company (Frankfurt, Deutschland) bietet unter dem Handelsnamen DerosalTM eine Carbendazim-Formulierung mit einem Wirkstoffanteil von 360 g/l (32,18 %) an. Diese Formulierung wurde in einem Ringtest verwendet (2). Der im Ringtest ermittelte EC50-Wert der Reproduktionsleistung lag bei 1,2 ± 0,8 mg Wirkstoff/kg Trockenmasse (2). Wenn ein positiver toxischer Standard in die Testreihe aufgenommen wird, ist eine einzige Konzentration zu verwenden, und die Anzahl der Replikate muss mit der Anzahl der Kontrollen übereinstimmen. Bei Carbendazim wird die Prüfung von 1,2 mg Wirkstoff/kg Trockenmasse (getestet in einer flüssigen Formulierung) empfohlen.
Ausrüstung
9. Die Prüfgefäße müssen aus Glas oder einem sonstigen chemisch inertem Material bestehen. Geeignet sind Glasgefäße (z.B. mit einem Volumen von 0,20 bis 0,25 l und einem Durchmesser von H 6 cm). Die Gefäße müssen transparente Deckel haben (z.B. aus Glas oder Polyethylen), die so ausgeführt sind, dass sie die Wasserverdampfung reduzieren und gleichzeitig den Gasaustausch zwischen dem Bodensubstrat und der Atmosphäre erlauben. Die Deckel müssen transparent sein, damit die erforderliche Lichtdurchlässigkeit gegeben ist.
10. Es wird eine übliche Laborausrüstung insbesondere mit folgenden Bestandteilen benötigt:
- Trockenschrank;
- Stereomikroskop;
- pH-Messgerät und Photometer;
- Waagen mit geeigneter Genauigkeit;
- geeignete Vorrichtungen zur Temperaturregelung;
- geeignete Ausrüstung zur Feuchtigkeitsregelung (bei Expositionsgefäßen mit Deckel nicht wesentlich);
- Inkubator oder kleiner Raum mit Klimaanlage;
- Pinzette, Haken oder Schlaufen;
- Fotoschalen.
Herstellung des künstlichen Bodens
11. In diesem Test wird künstlicher Boden (5)(7) mit folgender Zusammensetzung verwendet (bezogen auf Trockenmassen, bei 105 °C bis zur Massekonstanz getrocknet):
- 10 % Sphagnum-Torf, luftgetrocknet und fein gemahlen (eine Partikelgröße von 2 ± 1 mm ist akzeptabel); vor der Verwendung in einem Test sollte sichergestellt werden, dass mit einer frischen Torf-Charge hergestellter Boden für die Zucht der Würmer geeignet ist;
- 20 % Kaolin-Ton (Kaolinit-Anteil vorzugsweise über 30 %);
- ca. 0,3 bis 1,0 % Calciumcarbonat (CaCO3, pulverisiert, Analysequalität), um einen pH-Wert von 6,0 ± 0,5 zu erzielen; wie viel Calciumcarbonat hinzuzugeben ist, kann vor allem von der Qualität/Beschaffenheit des Torfs abhängen;
- ca. 70 % luftgetrockneter Quarzsand (je nach erforderlichem CaCO3-Anteil), hauptsächlich Feinsand mit mehr als 50 % Partikeln mit einer Größe von 50 bis 200 µm.
Vor der Verwendung eines künstlichen Bodens in einem definitiven Test ist seine Eignung für die Zucht von Würmern und zur Erfüllung der Validitätskriterien des Tests nachzuweisen. Die entsprechende Prüfung wird insbesondere empfohlen, um sicherzustellen, dass die Aussagekraft des Tests bei reduziertem Kohlenstoffgehalt des künstlichen Bodens, z.B. durch Verringerung des Torfanteils auf 4-5 % und entsprechende Erhöhung des Sandanteils, nicht beeinträchtigt wird. Durch eine solche Reduzierung des Gehalts an organischem Kohlenstoff kann die Bindung der Prüfchemikalie an den Boden (d. h. an organischen Kohlenstoff) verringert werden und die Verfügbarkeit der Prüfchemikalie für die Würmer zunehmen. Es wurde nachgewiesen, dass Enchytraeus albidus den Validitätskriterien hinsichtlich der Reproduktion bei Versuchen mit Feldböden mit geringerem Gehalt an organischem Kohlenstoff als oben angegeben (z.B. 2,7 %) (15) genügen, und es gibt (wenngleich in begrenztem Umfang) Hinweise darauf, dass diese Ergebnisse auch mit künstlichem Boden mit 5 %igem Torfanteil erzielt werden können.
Hinweis: Wenn in weiteren (z.B. höherstufigen) Tests natürlicher Boden verwendet wird, sind auch die Eignung dieses Bodens und die Erfüllung der Validitätskriterien des Tests nachzuweisen.
12. Die trockenen Bestandteile des Bodens werden gründlich gemischt (z.B. in einem großen Labormischer). Der Mischvorgang wird mindestens eine Woche vor Prüfbeginn durchgeführt. Der gemischte Boden muss zwei Tage ruhen, damit sich der Säurepegel ausgleichen/stabilisieren kann. Zur Bestimmung des pH-Werts wird eine Mischung aus Boden und einer 1 M Kaliumchlorid- (KCl) oder einer 0,01 M Calciumchloridlösung (CaCl2) im Verhältnis 1:5 verwendet (siehe (16) und Anlage 3). Wenn der Säuregrad des Bodens außerhalb des spezifizierten Bereichs liegt (siehe Nummer 11), kann der pH-Wert durch Zugabe einer geeigneten Menge CaCO3 eingestellt werden. Ist der Boden zu alkalisch, kann der pH-Wert durch Zugabe eines größeren Anteils des Gemischs (siehe Nummer 11) ohne CaCO3 eingestellt werden.
13. Die maximale Wasserhaltekapazität des künstlichen Bodens wird mit den in Anlage 2 beschriebenen Verfahren ermittelt. Ein oder zwei Tage vor Beginn des Tests wird der trockene künstliche Boden mit so viel entionisiertem Wasser befeuchtet, dass etwa die Hälfte des endgültigen Wassergehalts erreicht wird (40-60 % der maximalen Wasserhaltekapazität). Zu Beginn des Tests wird der befeuchtete Boden entsprechend der Anzahl der im Test zu verwendenden Testkonzentrationen (sowie gegebenenfalls der Referenzchemikalie) und Kontrollen aufgeteilt. Der Feuchtegehalt wird auf 40-60 % der maximalen Wasserhaltekapazität eingestellt, indem die Lösung mit der Prüfchemikalie und/oder destilliertes oder entionisiertes Wasser hinzugegeben wird (siehe Nummern 19, 20 und 21). Der Feuchtegehalt wird zu Beginn und am Ende des Tests ermittelt (durch Trocknen bei 105 °C bis zur Massekonstanz) und sollte im optimalen Bereich für die Lebensfähigkeit der Würmer liegen. Für eine grobe Prüfung des Feuchtegehalts des Bodens kann der Boden vorsichtig in der Hand gedrückt werden; bei richtigem Feuchtegehalt sollten Wassertröpfchen zwischen den Fingern austreten.
Auswahl und Vorbereitung der Versuchstiere
14. Die empfohlene Art für den Test ist Enchytraeus albidus (Henle 1837, weißer Topfwurm), ein Mitglied der Familie Enchytraeidae (Ordnung Oligochaeta, Stamm Annelida). E. albidus ist eine der größten Enchytraeen-Arten; bei einzelnen Exemplaren wurde eine Länge von bis zu 35 mm gemessen (17)(18). E. albidus ist weltweit in marinen, limnischen und terrestrischen Habitaten zu finden, hauptsächlich in faulendem organischem Material (Seetang, Kompost), seltener auch in Wiesen (9). Die breite ökologische Toleranz und gewisse morphologische Variationen deuten darauf hin, dass es unterschiedliche Rassen geben könnte.
15. E. albidus wird im Handel als Fischfutter angeboten. Es ist zu prüfen, ob die Kultur durch andere, normalerweise kleinere Arten kontaminiert ist (1) (19). Ist dies der Fall, sind alle Würmer in einer Petrischale mit Wasser zu waschen. Mithilfe eines Stereomikroskops werden große adulte Exemplare von E. albidus für eine neue Kultur aussortiert, und alle anderen Würmer sind zu verwerfen. E. albidus lässt sich leicht in einer Vielzahl organischer Materialien züchten (siehe Anlage 4). Der Lebenszyklus von E. albidus ist kurz, da die Tiere ihre Geschlechtsreife zwischen dem 33. Lebenstag (bei 18 °C) und dem 74. Lebenstag (bei 12 1 °C) erreichen. Für die Prüfung sollten ausschließlich Wurmkulturen verwendet werden, die mindestens fünf Wochen lang (eine Generation) ohne Probleme im Labor gehalten wurden.
16. Andere Enchytraeus-Arten kommen ebenfalls in Betracht; z.B. E. buchholzi Vejdovsky 1879 oder E. crypticus Westheide und Graefe 1992 (siehe Anlage 5). Werden andere Enchytraeus-Arten verwendet, so sind diese eindeutig zu identifizieren, und die Wahl der Art ist zu begründen.
17. Für die Tests sind adulte Tiere zu verwenden. In der Clitellum-Region sollten Eier (weiße Flecken) erkennbar sein, und die Tiere müssen alle etwa gleich groß sein (ca. 1 cm lang). Die Zuchtkultur braucht nicht synchronisiert zu werden.
18. Wenn die Enchytraeen nicht in demselben Bodentyp und unter denselben Bedingungen (einschließlich Fütterung) gehältert werden wie im endgültigen Test, muss eine Akklimatisierung erfolgen (mindestens 24 Stunden bis drei Tage). Zunächst sollten mehr adulte Tiere als zur Durchführung des Tests benötigt akklimatisiert werden, damit beschädigte oder anderweitig ungeeignete Exemplare verworfen werden können. Am Ende des Akklimatisierungszeitraums werden für den Test ausschließlich Würmer ausgewählt, die Eier enthalten und keine Verhaltensauffälligkeiten zeigen (z.B. Versuche, den Boden zu verlassen). Die Würmer werden mit einer Juwelierpinzette, mit Haken oder Schlaufen vorsichtig herausgenommen und in eine Petrischale mit einer kleinen Menge Süßwasser gesetzt. Für diesen Zweck ist rekonstituiertes Süßwasser zu empfehlen, wie in Kapitel C.20 (Daphnia magna Reproduktionstest) beschrieben, da entionisiertes oder entmineralisiertes Wasser oder Leitungswasser für die Würmer schädlich sein könnte. Die Würmer werden unter einem Stereomikroskop untersucht, und Würmer ohne Eier werden verworfen. Es ist sorgfältig darauf zu achten, dass auch Milben und Springschwänze entfernt und verworfen werden, die in die Kulturen geraten sein könnten. Für den Test nicht benötigte gesunde Würmer werden in die Stammkultur zurückgegeben.
Herstellung der Testkonzentrationen
Wasserlösliche Prüfchemikalie
19. Eine Lösung der Prüfchemikalie wird in entionisiertem Wasser in ausreichender Menge für alle Replikate einer Testkonzentration hergestellt. Vorzugsweise sollte eine angemessene Menge Wasser verwendet werden, um den erforderlichen Feuchtegehalt (d. h. 40 bis 60 % der maximalen Wasserhaltekapazität (siehe Nummer 13)) zu erzielen. Jede Lösung mit der Prüfchemikalie wird gründlich mit einer Charge des angefeuchteten Bodens gemischt und dann in das Prüfgefäß gegeben.
Wasserunlösliche Prüfchemikalien
20. Chemikalien, die in Wasser unlöslich, aber in organischen Lösungsmitteln löslich sind, können in der kleinstmöglichen Menge eines geeigneten Lösungsvermittlers (z.B. Aceton) gelöst werden. Hierzu sind ausschließlich flüchtige Lösungsmittel zu verwenden. Der Trägerstoff wird auf eine kleine Menge (z.B. 2,5 g) Quarzsand gesprüht oder mit dem Sand vermischt. Anschließend wird der Sand mindestens eine Stunde unter einem Abzug gestellt, damit das Lösungsmittel verdunsten kann. Diese Mischung aus Quarzsand und Prüfchemikalie wird zum angefeuchteten Boden hinzugegeben und nach Hinzugabe von entionisiertem Wasser in ausreichender Menge gründlich gemischt, um den erforderlichen Feuchtegehalt zu erzielen. Die endgültige Mischung wird in die Prüfgefäße gegeben.
21. Bei Chemikalien, die sowohl in Wasser als auch in organischen Lösungsmitteln schlecht löslich sind, wird das Äquivalent von 2,5 g fein gemahlenem Quarzsand pro Prüfgefäß mit der Menge der Prüfchemikalie vermischt, die erforderlich ist, um die gewünschte Testkonzentration zu erhalten. Diese Mischung aus Quarzsand und Prüfchemikalie wird zum angefeuchteten Boden hinzugegeben und nach Hinzugabe von entionisiertem Wasser in ausreichender Menge gründlich vermischt, um den erforderlichen Feuchtegehalt zu erzielen. Die endgültige Mischung wird auf die Prüfgefäße verteilt. Dieses Verfahren wird für alle Testkonzentrationen wiederholt, und es wird eine geeignete Kontrolle hergestellt.
22. Die Chemikalien werden im Allgemeinen höchstens bis zu einer Konzentration von 1.000 mg/kg Boden (Trockenmasse) geprüft. Je nach Zielsetzung eines bestimmten Tests können Prüfungen allerdings auch mit höheren Konzentrationen vorgenommen werden.
Test- und Kontrollgruppen
23. Für jede Testkonzentration werden 20 g (Trockenmasse) Testboden in das Prüfgefäß gegeben (siehe Nummern 19, 20 und 21). Außerdem werden Kontrollen ohne die Prüfchemikalie hergestellt. In alle Prüfgefäße wird Futter gegeben, wie unter Nummer 29 beschrieben. In jedes Prüfgefäß werden zehn zufällig ausgewählte Würmer gesetzt. Die Würmer werden vorsichtig in die einzelnen Prüfgefäße gegeben und auf dem Boden abgesetzt (z.B. mit einer Juwelierpinzette, mit Haken oder mit Schlaufen. Die Anzahl der Replikate der Testkonzentrationen und der Kontrollen hängt vom jeweiligen Prüfprotokoll ab (siehe Nummer 34). Die Prüfgefäße werden nach dem Zufallsprinzip in den Testinkubator gestellt, und die Positionen werden wöchentlich neu randomisiert.
24. Wenn zur Applikation der Prüfchemikalie ein Lösungsvermittler verwendet wird, ist zusätzlich zu den Testreihen eine Kontrollreihe mit Quarzsand mit aufgesprühtem oder untergemischtem Lösungsmittel zu prüfen. Die Konzentration des Lösungsmittels oder des Dispergiermittels muss mit der Konzentration übereinstimmen, die auch in den Prüfgefäßen mit der Prüfchemikalie verwendet wird. Bei Chemikalien, die gemäß den unter Nummer 21 beschriebenen Verfahren zu applizieren sind, muss eine Kontrollreihe mit zusätzlichem Quarzsand (2,5 g pro Gefäß) geprüft werden.
Prüfbedingungen
25. Die Testtemperatur beträgt 20 ± 2 °C. Damit die Würmer den Boden nicht verlassen, wird die Prüfung bei einem geregelten Licht-Dunkel-Zyklus (vorzugsweise 16 Stunden Licht und 8 Stunden Dunkelheit) mit einer Lichtstärke von 400 bis 800 lux im Bereich der Prüfgefäße durchgeführt.
26. Um die Feuchte des Bodens zu ermitteln, werden die Gefäße zu Beginn des Tests und danach jeweils einmal pro Woche gewogen. Gewichtsverluste werden durch Zugabe von entionisiertem Wasser in ausreichender Menge aufgefüllt. Wasserverluste können durch Aufrechterhaltung einer hohen Luftfeuchtigkeit ( > 80 %) im Testinkubator reduziert werden.
27. Der Feuchtegehalt und der pH-Wert sind jeweils zu Beginn und am Ende sowohl des Vorversuchs als auch des definitiven Tests zu messen. Die Messungen sind an allen Kontrollen und an allen mit der Prüfchemikalie (in allen Konzentrationen) behandelten Bodenproben vorzunehmen, die zwar in der gleichen Weise wie die Testkulturen hergestellt und gehandhabt werden, aber keine Würmer enthalten. Zu diesen Bodenproben ist nur zu Beginn des Tests Futter hinzuzugeben, um die Aktivität der vorhandenen Mikroorganismen anzuregen. Es sollte die gleiche Menge Futter hinzugegeben werden, wie zu den Testkulturen. Während des Tests braucht in diese Gefäße allerdings kein weiteres Futter mehr gegeben zu werden.
Fütterung
28. Es wird Futter verwendet, das die Lebensfähigkeit der Enchytraeen-Population gewährleistet. Haferflocken, vorzugsweise vor der Verwendung autoklaviert, um Verunreinigungen durch Mikroorganismen zu verhindern (auch Erwärmung ist möglich), haben sich als geeignetes Futter erwiesen.
29. Bei der ersten Fütterung werden 50 mg gemahlene Haferflocken mit dem Boden in jedem Gefäß vermischt, bevor die Würmer eingesetzt werden. Anschließend wird bis zum 21. Tag Futter einmal wöchentlich hinzugegeben. An Tag 28 wird nicht gefüttert, da die adulten Tiere in diesem Stadium bereits herausgenommen wurden und die juvenilen Würmer ab diesem Zeitpunkt verhältnismäßig wenig zusätzliches Futter brauchen. Die Fütterung während des Tests besteht aus 25 mg gemahlenen Haferflocken pro Gefäß, die wird vorsichtig auf die Bodenoberfläche gelegt werden, damit die Würmer nicht verletzt werden. Um Schimmelpilzbefall zu verhindern, sind die Haferflocken mit einer kleinen Menge Boden zu bedecken. Wenn das Futter nicht aufgezehrt wird, sollte die Futtermenge verringert werden.
Protokoll des Vorversuchs zur Konzentrationsbereichs-Bestimmung
30. Wenn erforderlich, wird ein Vorversuch beispielsweise mit fünf Konzentrationen der Prüfchemikalie (0,1, 1,0, 10, 100 und 1.000 mg/kg (Boden Trockenmasse)) durchgeführt. Ein Replikat für jede Behandlung und jede Kontrolle ist ausreichend.
31. Der Vorversuch dauert zwei Wochen. Am Ende des Versuchs wird die Mortalität der Würmer ermittelt. Ein Wurm wird dann als tot erfasst, wenn er am vorderen Ende nicht mehr auf mechanische Reize reagiert. Über die Mortalität hinaus können auch weitere Informationen hilfreich sein, um die im definitiven Test zu verwendenden Konzentrationen festzulegen. Änderungen im Verhalten der adulten Würmer (die Würmer können sich nicht mehr in den Boden eingraben, sie liegen reglos an der Glaswand des Prüfgefäßes usw.) sowie morphologische Änderungen (z.B. offene Wunden) sind daher ebenso zu protokollieren wie das Vorhandensein juveniler Würmer. Letzteres kann mit der in Anlage 6 beschriebenen Färbemethode ermittelt werden.
32. Der ungefähre LC50-Wert kann bestimmt werden, indem der geometrische Mittelwert der Mortalitätsdaten berechnet wird. Bei der Festlegung des Konzentrationsbereichs für den definitiven Test wird davon ausgegangen, dass die Wirkungen auf die Reproduktionsleistungen maximal um den Faktor 10 geringer sind als der LC50-Wert. Dies ist jedoch eine empirische Beziehung; jeder Einzelfall kann anderes aussehen. Weitere Beobachtungen im Vorversuch (z.B. das Vorkommen juveniler Tiere) können helfen, den Konzentrationsbereich der Prüfchemikalie für den definitiven Test noch genauer einzugrenzen.
33. Um den LC50-Wert genau zu bestimmen, wird empfohlen, den Test mit mindestens vier Replikaten für jede Konzentration der Prüfchemikalie und mit einer geeigneten Anzahl Konzentrationen zu wiederholen, damit sich mindestens vier statistisch signifikante mittlere Reaktionen für die jeweiligen Konzentrationen ergeben. Eine ähnliche Anzahl an Konzentrationen und Replikaten ist gegebenenfalls auch für die Kontrollen zu verwenden.
Protokoll des definitiven Reproduktionstests
34. Entsprechend den Empfehlungen aufgrund eines Ringtests werden drei Protokolle vorgeschlagen (2):
- Zur Bestimmung der NOEC sind mindestens fünf Konzentrationen in einer geometrischen Reihe zu prüfen. Zu empfehlen sind vier Replikate je Testkonzentration und acht Kontrollen. Die Konzentrationen dürfen sich maximal um den Faktor 1,8 unterscheiden.
- Zur Ermittlung des ECx-Werts (z.B. EC10 oder EC50) müssen mindestens fünf Konzentrationen geprüft werden; diese Konzentrationen müssen den ECx einschließen, damit der ECx interpoliert werden kann und nicht extrapoliert werden muss. Mindestens vier Replikate je Testkonzentration und vier Kontrollreplikate werden empfohlen. Der Abstandsfaktor kann unterschiedlich sein (d. h. im erwarteten Wirkungsbereich maximal 1,8 und bei den höheren und niedrigeren Konzentrationen mehr als 1,8).
- Ein kombinierter Ansatz ermöglicht die Bestimmung sowohl der NOEC als auch des ECx-Werts. Es sind acht Testkonzentrationen in einer geometrischen Reihe zu verwenden. Zu empfehlen sind vier Replikate je Behandlung und acht Kontrollen. Die Konzentrationen dürfen sich maximal um den Faktor 1,8 unterscheiden.
35. Pro Prüfgefäß sind zehn adulte Würmer zu verwenden (siehe Nummer 23). Zu Beginn des Tests und danach einmal wöchentlich bis zum 21. Tag einschließlich wird Futter in die Prüfgefäße gegeben (siehe Nummer 29). An Tag 21 werden die Bodenproben sorgfältig manuell abgesucht, und die lebenden adulten Würmer werden erfasst und gezählt; Verhaltensänderungen (die Würmer graben sich nicht mehr in den Boden; sie liegen reglos an der Glaswand des Prüfgefäßes usw.) und morphologische Veränderungen (z.B. offene Wunden) werden protokolliert. Anschließend werden alle adulten Würmer aus den Prüfgefäßen und aus dem Boden herausgenommen. Der Testboden mit etwa gebildeten Kokons wird nochmals drei Wochen unter den genannten Prüfbedingungen inkubiert, wobei allerdings nur noch einmal an Tag 35 gefüttert wird (25 mg gemahlene Haferflocken pro Gefäß).
36. Nach sechs Wochen werden die neu geschlüpften Würmer gezählt. Hierzu wird die auf der Färbung mit Bengalrot beruhende Methode (siehe Anlage 6) empfohlen, wenngleich sich auch andere Verfahren zur Entnahme und Flotation unter Zufuhr von Flüssigkeit (aber nicht von Wärme) als geeignet erwiesen haben (4) (10)(11)(20). Die Einfärbung mit Bengalrot wird empfohlen, weil die Nassextraktion aus einem Bodensubstrat durch Trübungen aufgrund suspendierter Tonpartikel erschwert sein könnte.
Limit-Test
37. Wenn im Vorversuch auch bei der höchsten Konzentration (d. h. bei 1.000 mg/kg) keine Wirkungen festzustellen sind, kann der Reproduktionstest als Limit-Test durchgeführt werden, bei dem mit einer Konzentration von 1.000 mg/kg nachgewiesen wird, dass die NOEC im Hinblick auf die Reproduktionsleistung noch über diesem Wert liegt.
Zusammenfassung und Zeitplan des Tests
38. Im Einzelnen umfasst der Test folgende Schritte:
|
Zeitpunkt |
Vorversuch |
Definitiver Test |
| Tag - 7 oder früher | - Herstellen des künstlichen Bodens (Mischen trockener Bestandteile) | - Herstellen des künstlichen Bodens (Mischen trockener Bestandteile) |
| Tag - 5 | - Prüfung des pH-Werts des künstlichen Bodens - Messung der maximalen Wasserhaltekapazität des Bodens | - Prüfung des pH-Werts des künstlichen Bodens - Messung der maximalen Wasserhaltekapazität des Bodens |
| Tag - 5 bis - 3 | - Sortieren der Würmer zur Akklimatisierung | - Sortieren der Würmer zur Akklimatisierung |
| Tag - 3 bis 0 | - Akklimatisieren der Würmer über mindestens 24 Stunden | - Akklimatisieren der Würmer über mindestens 24 Stunden |
| Tag - 1 | - Befeuchten des künstlichen Bodens und Aufteilung in Chargen | - Befeuchten des künstlichen Bodens und Aufteilung in Chargen |
| Tag 0 | - Herstellen der Stammlösungen - Applikation der Prüfchemikalie - Einwiegen des Prüfsubstrats in die Prüfgefäße - Einmischen des Futters - Einsetzen der Würmer - Messung pH-Werts und des Feuchtigkeitsgehalts des Bodens | - Herstellen der Stammlösungen - Applikation der Prüfchemikalie - Einwiegen des Prüfsubstrats in die Prüfgefäße - Einmischen des Futters - Einsetzen der Würmer - Messung des pH-Werts und des Feuchtigkeitsgehalts des Bodens |
| Tag 7 | - Prüfen des Feuchtigkeitsgehalts des Bodens | - Prüfen des Feuchtigkeitsgehalts des Bodens - Füttern |
| Tag 14 | - Bestimmen der Mortalität der adulten Tiere - Schätzung der Anzahl der juvenilen Tiere - Messung des pH-Werts und des Feuchtigkeitsgehalts des Bodens | - Prüfen des Feuchtigkeitsgehalts des Bodens - Füttern |
| Tag 21 | - Beobachten des Verhaltens der adulten Tiere - Entnahme der adulten Tieren - Bestimmung der Mortalität der adulten Tiere - Prüfen des Feuchtigkeitsgehalts des Bodens - Füttern | |
| Tag 28 | - Prüfen des Feuchtigkeitsgehalts des Bodens - Keine Fütterung | |
| Tag 35 | - Prüfen des Feuchtigkeitsgehalts des Bodens - Füttern | |
| Tag 42 | - Zählen der juvenilen Würmer - Messung des pH-Werts und des Feuchtigkeitsgehalts des Bodens |
Auswertung der Ergebnisse
39. Anlage 7 enthält zwar eine Übersicht, doch bei dieser Prüfmethode ist keine statistische Vorgehensweise für die Analyse der Prüfergebnisse vorgeschrieben.
40. Der wesentliche Endpunkt des Vorversuchs ist die Mortalität. Änderungen im Verhalten der adulten Würmer (die Würmer können sich nicht mehr in den Boden eingraben, sie liegen reglos an der Glaswand des Prüfgefäßes usw.) sowie morphologische Änderungen (z.B. offene Wunden) sind jedoch ebenso zu protokollieren wie das Vorhandensein juveniler Würmer. Der LC50-Wert wird normalerweise mit Probit- Analysen (21) oder durch logistische Regressionsanalysen bestimmt. Wenn diese Analysemethode jedoch ungeeignet ist (z.B. weil weniger als drei Konzentrationen verfügbar sind, bei denen ein Teil der Tiere gestorben ist), können auch alternative Methoden verwendet werden. In Betracht kommen etwa gleitende Durchschnitte (22), die Trimmed-Spearman-Karber-Methode (23) oder eine einfache Interpolation (z.B. geometrischer Mittelwert von LC0 und LC100, berechnet als Quadratwurzel von LC0 multipliziert mit LC100).
41. Endpunkt beim definitiven Test ist die Vermehrungsrate (d. h. die Anzahl der entstandenen juvenilen Tiere). Ebenso wie im Vorversuch sind jedoch im Abschlussbericht auch alle Anzeichen für sonstige schädliche Wirkungen zu erfassen. Für die statistische Analyse müssen für jede Textkonzentration und jede Kontrolle im Reproduktionstest das arithmetische Mittel und die Standardabweichung berechnet werden.
42. Wenn eine Varianzanalyse vorgenommen wurde, können die Standardabweichung, s, und die Freiheitsgrade, df, durch die nach der ANOVA geschätzte gepoolte Varianz bzw. durch die entsprechenden Freiheitsgrade ersetzt werden (wenn die Varianz nicht von der Konzentration abhängig ist). In diesem Fall sind die einzelnen Varianzen der Kontrollen und der Gefäße mit den Testkonzentrationen zu verwenden. In der Regel werden die betreffenden Werte mit kommerzieller Statistik-Software berechnet, wobei die Ergebnisse der einzelnen Gefäße als Replikate angenommen werden. Wenn die Zusammenfassung von Daten der negativen Kontrollen und der Lösungsmittelkontrollen sinnvoller erscheint als die Prüfung mit einer einzelnen Kontrolle, werden die Kontrollen getestet, um sicherzustellen, dass sich die Ergebnisse nicht signifikant unterscheiden (entsprechende Tests siehe Nummer 45 und Anlage 7).
43. Ob weitere statistische Tests vorzunehmen und statistische Rückschlüsse zu ziehen sind, hängt davon ab, ob bei den Replikaten eine Normalverteilung und eine homogene Varianz der Werte gegeben ist.
Schätzung der NOEC
44. Vorzugsweise sollten leistungsfähige Tests durchgeführt werden. Dabei könnten Informationen (z.B. frühere Erfahrungen mit Ringtests oder sonstige historische Daten) herangezogen werden, um zu beurteilen, ob die Daten in etwa normal verteilt sind. Entscheidender ist die Varianzhomogenität (Homoskedastizität). Erfahrungsgemäß steigt die Varianz häufig mit zunehmendem Mittelwert. In diesem Fall könnte eine Datentransformation eine Homoskedastizität zur Folge haben. Eine entsprechende Transformation sollte aber eher auf Erfahrungen mit historischen Daten als auf den Daten der aktuellen Untersuchung beruhen. Bei homogenen Daten sind multiple t-Tests (z.B. ein Williams-Test (α = 0,05, einseitig) (24)(25) oder in bestimmten Fällen auch ein Dunnett-Test (26)(27)) durchzuführen. Bei uneinheitlichen Replikaten müssen die t-Werte in der Tabelle korrigiert werden, wie von Dunnett und Williams empfohlen. Bei einer starken Variation steigen/sinken die Ergebnisse nicht regelmäßig. Bei derart starken Monotonieabweichungen ist der Dunnett-Test besser geeignet. Bei Abweichungen von der Homoskedastizität kann es angebracht sein, mögliche Wirkungen in Bezug auf Varianzen näher zu untersuchen, um dann zu entscheiden, ob die t-Tests durchgeführt werden können, ohne zu viel an Aussagekraft einzubüßen (28). Alternativ kann ein multipler U-Test (z.B. der Bonferroni-U-Test nach Holm (29)) oder - wenn bei diesen Daten zwar eine Homoskedastizität festzustellen ist, die Daten ansonsten aber mit der zugrunde liegenden monotonen Dosis-Wirkungs-Kurve übereinstimmen - ein weiterer nicht parametrischer Test (z.B. Jonckheere-Terpstra (30)(31) oder Shirley) (32)(33) vorgenommen werden; dies wäre im Allgemeinen sinnvoller als t-Tests für ungleiche Varianzen (siehe auch Flussdiagramm in Anlage 7).
45. Wenn ein Limit-Test durchgeführt wurde und die Voraussetzungen für parametrische Prüfverfahren (Normalität, Homogenität) erfüllt sind, kann der paarige Student-t-Test verwendet werden; ansonsten ist der -U-Test nach Mann und Whitney durchzuführen (29).
Schätzung von ECx
46. Zur Berechnung eines ECx-Werts wird eine Regressionsanalyse (linear oder nicht linear) mit den Mittelwerten aus der Vorbehandlung vorgenommen, nachdem eine geeignete Dosis-Wirkungs-Beziehung ermittelt wurde. Für das Wachstum der Würmer als kontinuierliche Reaktion können ECx-Werte mit einer geeigneten Regressionsanalyse geschätzt werden (35). Geeignete Funktionen für quantale Daten (Mortalität/Überleben und Anzahl der Nachkommen) sind die normale sigmoide Funktion, die Logit- oder die Weibull-Funktion mit zwei bis vier Parametern, die teilweise auch hormetische Effekte abbilden können. Wenn eine Dosis-Wirkungs- Funktion mithilfe einer linearen Regressionsanalyse angepasst wurde, müssten in der Regressionsanalyse ein signifikanter r2-Wert (Bestimmungskoeffizient) und/oder eine Steigung festzustellen sein; anschließend wird der ECx-Wert abgeschätzt, indem in die nach der Regressionsanalyse erstellte Gleichung ein Wert entsprechend x % des Mittelwerts der Kontrollgruppe eingesetzt wird. 95- %-Konfidenzintervalle werden nach Fieller (zitiert in Finney (21)) oder mit sonstigen modernen geeigneten Methoden berechnet.
47. Alternativ wird die Reaktion als Anteil oder Prozentanteil eines Modellparameters nachgebildet, der dann als mittlere Reaktion der Kontrollgruppe angenommen wird. In diesen Fällen kann die normale (Logit, Weibull) sigmoide Kurve häufig leicht durch eine Probit-Regression an die Ergebnisse angepasst werden (21). In diesen Fällen ist die Gewichtungsfunktion entsprechend den metrischen Antworten anzupassen, wie bei Christensen (36) beschrieben. Wenn allerdings eine Hormesis festgestellt wurde, ist die Probit-Analyse durch eine 4- Parameter-Funktion (Logit oder Weibull) zu ersetzen, die mit einem nicht linearen Regressionsverfahren angepasst wird (36). Kann keine geeignete Dosis-Wirkungs-Funktion an die Daten angepasst werden, können alternative Methoden zur Abschätzung von ECx und der entsprechenden Konfidenzintervalle verwendet werden (beispielsweise gleitende Durchschnitte nach Thompson (22) und das Trimmed-Spearman-Karber-Verfahren (23)).
48. Der Prüfbericht muss folgende Informationen enthalten:
Prüfchemikalie:
- physikalische Beschaffenheit und - wenn relevant - physikalisch-chemische Eigenschaften (z.B. Wasserlöslichkeit oder Dampfdruck);
- chemische Bezeichnung der Prüfchemikalie nach der IUPAC-Nomenklatur, CAS-Nummer, Charge, Los, Strukturformel und Reinheit;
- Verfallsdatum der Probe;
Im Test verwendete Art:
- eingesetzte Testtiere: Art, wissenschaftlicher Name, Bezugsquelle der Testorganismen und Zuchtbedingungen.
Prüfbedingungen:
- Bestandteile und Herstellung des künstlichen Bodens;
- Methode der Applikation der Prüfchemikalie;
- Beschreibung der Prüfbedingungen (Temperatur, Feuchtegehalt, pH-Wert usw.);
- vollständige Beschreibung des Prüfprotokolls und der Verfahren.
Prüfergebnisse:
- Mortalität adulter Würmer nach zwei Wochen und Anzahl der juvenilen Tiere am Ende des Vorversuchs;
- Mortalität adulter Würmer nach dreiwöchiger Exposition und vollständige Anzahl der juvenilen Tiere am Ende des definitiven Tests;
- alle beobachteten physischen oder pathologischen Symptome und Verhaltensänderungen der Testorganismen;
- der LC50-Wert, die NOEC und/oder der ECx-Wert (z.B. EC50 oder EC10) für die Reproduktionsleistung, gegebenenfalls mit Konfidenzintervallen, und eine Grafik des angepassten Modells der Berechnung sowie sämtliche Informationen und Feststellungen, die für die Interpretation der Ergebnisse hilfreich sein können;
Abweichungen von den für diese Prüfmethode beschriebenen Verfahren und außergewöhnliche Vorkommnisse während der Prüfung.
(1) Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen - Enchytraeen. Abschlussbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03.051/01.
(2) Römbke, J., und Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 S.
(3) Westheide, W., und Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Hrsg. Esser, G., und Overdieck, D., S. 497-508. Elsevier, Amsterdam.
(4) Dirven-Van Breemen, E., Baerselmann, R., und Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 S.
(5) Kapitel C.8: Toxizität bei Regenwürmern.
(6) ISO (Internationale Organisation für Normung) (1993). Bodenbeschaffenheit - Wirkungen von Schadstoffen auf Regenwürmer (Eisenia fetida) - Teil 1: Verfahren zur Bestimmung der akuten Toxizität unter Verwendung von künstlichem Bodensubstrat, Nr. 11268-1. ISO, Genf.
(7) ISO (Internationale Organisation für Normung) (1996). Bodenbeschaffenheit - Wirkungen von Schadstoffen auf Regenwürmer - Teil 2: Bestimmung der Wirkung auf die Reproduktionsleistung von Eisenia fetida/Eisenia andrei, Nr. 11268-2. ISO, Genf.
(8) Rundgren, S., und A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). In: Løkke, H., und C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73-94.
(9) Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
(10) Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF - Z. Umweltchem. Ökotox. 7, 246-249.
(11) Dunger, W., und Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
(12) Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
(13) Becker, H. (1991). Bodenorganismen - Prüfungskategorien der Forschung. UWSF - Z. Umweltchem. Ökotox. 3, 19-24.
(14) Römbke, J., und Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
(15) Römbke, J., Riepert, F. und Achazi R. (2000): Enchytraeen als Testorganismen. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. und Eisentraeger, A. (Hrsg.). Spektrum Verl., Heidelberg. 59-81.
(16) ISO (Internationale Organisation für Normung) (1994). Bodenbeschaffenheit - Bestimmung des pH-Wertes, Nr. 10390. ISO, Genf.
(17) Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
(18) Nielsen, C.O. und Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
(19) Bouguenec, V., und Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
(20) Korinkova, J., und Sigmund, J. (1968). The colouring of bottomfauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
(21) Finney, D.J. (1971). Probit Analysis (3rd ed.), S. 19-76. Cambridge Univ. Press.
(22) Finney, D.J. (1978). Statistical Method in Biological Assay. - Charles Griffin & Company Ltd, London.
(23) Hamilton, M.A., R.C. Russo und R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
(24) Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
(25) Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519- 531.
(26) Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
(27) Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
(28) Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
(29) Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
(30) Jonckheere, A. R. (1954); A Distributionfree k-Sample Test Against Ordered Alternatives, Biometrika 41, 133- 145.
(31) Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
(32) Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
(33) Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
(34) Sokal, R.R., und F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
(35) Christensen, E.R., (1984). Doseresponse functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
(36) Van Ewijk, P.H., und J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when subtoxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
| Begriffsbestimmungen | Anlage 1 |
Für diese Prüfmethode gelten folgende Begriffsbestimmungen:
Chemikalie: ein Stoff oder eine Mischung.
ECx (Konzentration mit einer Wirkung von x %): Konzentration, bei der es innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle zu einer Wirkung von x % auf die Testorganismen kommt; bei diesem Test werden die Wirkungskonzentrationen als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens ausgedrückt.
LC0 (Konzentration ohne letale Wirkung): die Konzentration einer Prüfchemikalie, bei der Testorganismen innerhalb einer bestimmten Expositionsdauer nicht getötet werden; bei diesem Test wird LC0 als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens ausgedrückt.
LC50 (mediane letale Konzentration): die Konzentration einer Prüfchemikalie, bei der innerhalb einer bestimmten Expositionsdauer 50 % der Testorganismen getötet werden; bei diesem Test wird LC50 als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens ausgedrückt.
LC100 (absolut tödliche Konzentration): die Konzentration einer Prüfchemikalie, bei der innerhalb einer bestimmten Expositionsdauer 100 % der Testorganismen getötet werden; bei diesem Test wird LC100 als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens ausgedrückt.
LOEC (niedrigste Konzentration, bei der noch eine schädliche Wirkung zu beobachten ist): niedrigste Konzentration der Prüfchemikalie mit statistisch signifikanter Wirkung (p < 0,05); bei diesem Test wird die LOEC als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens ausgedrückt. Bei allen Testkonzentrationen oberhalb der LOEC müsste normalerweise eine Wirkung auftreten, die sich statistisch von der jeweiligen Kontrolle unterscheidet. Alle Abweichungen von den vorstehenden Beschreibungen bei der Ermittlung der LOEC sind im Prüfbericht zu begründen.
NOEC (höchste Konzentration ohne beobachtete Wirkung): Die höchste Konzentration der Prüfchemikalie unmittelbar unterhalb der LOEC, bei der keine Wirkung beobachtet wird; bei diesem Test hat die der NOEC entsprechende Konzentration innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle keine statistisch signifikante Wirkung (p < 0,05).
Reproduktionsrate: mittlere Anzahl der juvenilen Würmer, die im Testzeitraum aus einer bestimmten Anzahl an adulten Tieren hervorgegangen sind.
Prüfchemikalie: ein Stoff oder eine Mischung, der bzw. die nach dieser Methode geprüft wird.
| Bestimmung der maximalen Wasserhaltekapazität | Anlage 2 |
Bestimmung der Wasserhaltekapazität des künstlichen Bodens
Die folgende Methode hat sich als geeignet erwiesen. Eine nähere Beschreibung ist ISO DIS 11268-2 Anhang C zu entnehmen.
Mit einer geeigneten Vorrichtung (Stechzylinder usw.) eine bestimmte Menge (z.B. 5 g) des Prüfbodens entnehmen. Den Zylinder auf der Unterseite mit Filterpapier abdecken, anschließend mit Wasser füllen und auf einem Gestell in ein Wasserbad setzen. Den Zylinder allmählich eintauchen, bis der Boden durch das Wasser bedeckt ist, und etwa drei Stunden im Wasser belassen. Da nicht alles durch die Bodenkapillare aufgenommene Wasser im Substrat gehalten werden kann, den Zylinder mit der Bodenprobe zur Entwässerung für zwei Stunden in einem geschlossenen Gefäß (um eine Austrocknung zu verhindern) auf sehr feuchten, fein gemahlenen Quarzsand stellen. Anschließend wird die Probe gewogen und bei 105 °C auf eine konstante Masse getrocknet. Die Wasserhaltekapazität (WHC = Water Holding Capacity) kann dann wie folgt berechnet werden:
![]()
Dabei sind:
S = das wassergesättigte Substrat + Masse des Zylinders + Masse des Filterpapiers
T = Tara (Masse des Zylinders + Masse des Filterpapiers)
D = Trockenmasse des Substrats
ISO (Internationale Organisation für Normung) (1996). Bodenbeschaffenheit - Wirkungen von Schadstoffen auf Regenwürmer - Teil 2: Bestimmung der Wirkung auf die Reproduktionsleistung von Eisenia fetida/Eisenia andrei, Nr. 11268-2. ISO, Genf.
| Bestimmung des pH-Wertes von Böden | Anlage 3 |
Eine gegebene Menge Boden mindestens 12 Stunden bei Raumtemperatur trocknen. Eine Suspension aus (mindestens 5 g) Boden in einer 1-M-Lösung analysenreines Kaliumchlorid (KCl) oder einer 0,01-M-Lösung analysenreines Calciumchlorid (CaCl2) im Verhältnis 1:5 herstellen. Anschließend die Suspension fünf Minuten kräftig schütteln und dann mindestens 2, aber nicht länger als 24 Stunden ruhen lassen. Der pH-Wert der flüssigen Phase wird mit einem pH-Meter gemessen, das vor jeder Messung mit einer geeigneten Reihe an Pufferlösungen (z.B. pH 4,0 und 7,0) kalibriert wurde.
ISO (Internationale Organisation für Normung) (1994). Bodenbeschaffenheit - Bestimmung des pH-Wertes, Nr. 10390. ISO, Genf.
| Kulturbedingungen für Enchytraeus sp. | Anlage 4 |
Enchytraeen der Art Enchytraeus albidus (und anderer Enchytraeus-Arten) können in großen Kunststoffkästen (z.B. 30 × 60 × 10 cm) gezüchtet werden, die mit einer Mischung aus künstlichem Boden und natürlicher, nicht kontaminierter Gartenerde im Verhältnis 1:1 gefüllt werden. Kompostmaterial könnte toxische Chemikalien (etwa Schwermetalle) enthalten und ist daher zu vermeiden. Vor der Verwendung des Bodens ist sämtliche Fauna zu entfernen (z.B. durch Gefrieren). Es kann auch ein Substrat ausschließlich aus künstlichem Boden verwendet werden, aber die Reproduktionsrate ist dann unter Umständen geringer als in einem gemischten Bodensubstrat. Der pH-Wert des Substrats muss im Bereich von 6,0 ± 0,5 liegen.
Die Kultur wird bei einer Temperatur von 15 bis 20 ± 2 °C im Dunkeln aufbewahrt. Temperaturen über 23 °C sind zu vermeiden. Der Boden muss feucht gehalten werden, darf aber nicht nass sein. Die richtige Feuchte ist dann gegeben, wenn bei vorsichtigem Ausdrücken des Bodens zwischen den Fingern kleine Wassertropfen austreten. Die Entstehung anoxischer Bedingungen ist zu vermeiden, indem sichergestellt wird, dass die Abdeckungen der Kulturgefäße einen angemessenen Gasaustausch mit der Atmosphäre ermöglichen. Um die Belüftung des Substrats zu erleichtern, ist der Boden wöchentlich vorsichtig zu lockern.
Die Würmer können mit Haferflocken gefüttert werden. Diese sind in verschlossenen Behältnissen zu lagern und vor Gebrauch zu autoklavieren oder zu erwärmen, um Befall mit Mehlmilben (z.B. Glyzyphagus sp., Astigmata, Acarina) oder Raubmilben (z.B. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina) zu vermeiden. Nach der Wärmebehandlung wird das Futter gemahlen, damit es leichter auf dem Boden ausgestreut werden kann. Von Zeit zu Zeit können die Haferflocken mit Vitaminen, Milch und Lebertran angereichert werden. Als Futter kommen auch Backhefe und das Fischfutter "Tetra Min" in Betracht.
Die Fütterung erfolgt etwa zweimal pro Woche. Eine angemessene Menge Haferflocken wird auf dem Boden ausgestreut oder beim Lockern des Bodens zur besseren Belüftung vorsichtig in das Substrat gemischt. Die absolute Futtermenge hängt von der Anzahl Würmer im Substrat ab. Allgemein gilt, dass die Futtermenge zu erhöhen ist, wenn das gesamte Futter binnen eines Tages nach Bereitstellung aufgezehrt ist. Wenn dagegen bei der zweiten Fütterung (nach einer Woche) noch Futter auf der Bodenoberfläche liegt, muss die Futtermenge reduziert werden. Futter mit Schimmelpilzbefall ist zu entfernen und zu ersetzen. Nach drei Monaten sind die Würmer in frisch hergestelltes Substrat umzusetzen.
Die Kulturbedingungen gelten als zufriedenstellend, wenn die Würmer a) nicht versuchen, das Bodensubstrat zu verlassen, b) sich rasch im Boden bewegen, c) eine glänzende Oberfläche haben, an der keine Bodenpartikel anhaften, d) eine mehr oder weniger weißliche Farbe haben, e) in unterschiedlichen Altersstufen in der Kultur vertreten sind und f) sich kontinuierlich vermehren.
| Durchführung der Prüfung mit anderen Enchytraeus-Arten | Anlage 5 |
Wahl der Arten
Außer E. albidus können auch andere Arten verwendet werden, dann sind Prüfverfahren und Validitätskriterien entsprechend anzupassen. Da viele Enchytraeus-Arten leicht zu beschaffen sind und im Labor gut gehalten werden können, sind die wichtigsten Kriterien für die Auswahl einer anderen Art als E. albidus die ökologische Relevanz und die Empfindlichkeit der jeweiligen Art. Es kann allerdings auch praktische Gründe für die Umstellung auf eine andere Art geben. In Ländern beispielsweise, in denen E. albidus nicht vorkommt und auch nicht eingeführt werden darf (z.B. aufgrund von Quarantänebestimmungen) müssen andere Enchytraeus-Arten verwendet werden.
Beispiele für geeignete alternative Arten)
- Enchytraeus crypticus (Westheide und Graefe 1992): Diese Art wurde in den letzten Jahren häufig in ökotoxologischen Untersuchungen verwendet, weil sie sich leicht züchten und untersuchen lässt. Die Würmer sind allerdings klein und entsprechend schwieriger zu handhaben als E. albidus (besonders in den Phasen vor Durchführung der Färbemethode). Das Vorkommen von E. crypticus im Freiland konnte nicht sicher nachgewiesen werden, da diese Art bisher nur in Zusammenhang mit Regenwurmkulturen beschrieben wurde. Seine ökologischen Anforderungen sind daher nicht bekannt.
- Enchytraeus buchholzi (Vejdovsky 1879): Unter dieser Bezeichnung wird vermutlich eine Gruppe eng verwandter Arten erfasst, die morphologisch schwer voneinander zu unterscheiden sind. Diese Art sollte nur dann für Prüfungen verwendet werden, wenn die für eine Untersuchung vorgesehenen Tiere jeweils einer bestimmten Art zugeordnet werden können. E. buchholzi kommt gewöhnlich in Wiesen und an gestörten Standorten (z.B. an Straßenrändern) vor.
- Enchytraeus luxuriosus: Diese Art wurde ursprünglich als E. ,minutus' bezeichnet; sie wurde erst vor Kurzem näher beschrieben (1). E. minutus wurde von U. Graefe (Hamburg) erstmals in einer Wiese in der Nähe von St. Peter- Ording (Schleswig-Holstein) entdeckt. E. luxuriosus ist etwa halb so groß wie E. albidus, aber größer als die übrigen hier behandelten Arten. Insoweit könnte diese Art eine gute Alternative zu E. albidus darstellen.
- Enchytraeus bulbosus (Nielsen und Christensen 1963): Bislang wurde diese Art in mineralischen Böden in Deutschland und in Spanien dokumentiert, wo wie allgemein verbreitet ist, aber keine sehr großen Populationen aufweist. Im Vergleich zu anderen kleinen Arten dieser Gattung ist diese Art verhältnismäßig leicht zu bestimmen. Über ihr Verhalten in Laborversuchen oder über ihre Empfindlichkeit gegenüber Chemikalien ist nichts bekannt. Allerdings hat sich gezeigt, dass die Art leicht zu kultivieren ist (E. Belotti, persönliche Mitteilung).
Zuchtbedingungen
Alle oben genannten Enchytraeus-Arten können in den Substraten kultiviert werden, die auch für E. albidus verwendet werden. Wegen der geringeren Größe der Tiere können auch die Kulturgefäße kleiner sein, und es kann zwar das gleiche Futter verwendet werden, aber die Futtermengen sind zu reduzieren. Der Lebenszyklus dieser Arten ist kürzer als der von E. albidus, und die Tiere müssen häufiger gefüttert werden.
Prüfbedingungen
Im Allgemeinen werden die Prüfungen unter den gleichen Bedingungen vorgenommen wie bei E. albidus; die folgenden Unterschiede sind allerdings zu beachten:
- Die Prüfgefäße können (müssen aber nicht) kleiner sein;
- der Reproduktionstest kann (muss aber nicht) verkürzt werden (etwa von sechs Wochen auf vier Wochen); die Dauer eines Vorversuchs sollte allerdings nicht geändert werden;
- in Anbetracht der geringen Größe der juvenilen Tiere wird nachdrücklich die Färbemethode zum Zählen der Tiere empfohlen;
- das Validitätskriterium bezüglich der , Anzahl der juvenilen Tiere pro Prüfgefäß in der Kontrollgruppe" ist auf ,50" zu ändern.
(1) Schmelz, R.M, und Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93-100.
| Detaillierte Beschreibung der Entnahmeverfahren | Anlage 6 |
Färbung mit Bengalrot
Diese ursprünglich in der limnischen Ökologie (1) entwickelte Methode wurde für die Zählung juveniler Enchytraeen im Enchytraeen-Reproduktionstest erstmals von W. de Coen (Universität Gent, Belgien) beschrieben. Unabhängig davon wurde von RIVM Bilthoven eine modifizierte Version entwickelt (Bengalrot gemischt mit Formaldehyd statt mit Ethanol) (2)(3).
Am Ende des definitiven Tests (d. h. nach sechs Wochen) wird der Boden aus den Prüfgefäßen in ein flaches Behältnis umgefüllt. Geeignet ist beispielsweise ein Bellaplast-Gefäß oder ein Fotoschale mit geripptem Boden, weil die Rippen die Beweglichkeit der Würmer im Beobachtungsbereich einschränken. Die juvenilen Tiere werden mit Ethanol fixiert (ca. 5 ml pro Replikat). Anschließend werden die Gefäße 1-2 cm hoch mit Wasser befüllt. Einige Tropfen (200-300 µl) Bengalrot (1 %ige Lösung in Ethanol) werden hinzugegeben (alternativ 0,5 % Eosin), und die beiden Bestandteile werden sorgfältig gemischt. Nach zwölf Stunden sollten die Würmer eine rötliche Farbe aufweisen und leicht zu zählen sein, weil sie auf der Oberfläche des Substrats liegen. Alternativ kann die Substrat- Alkoholmischung durch ein Sieb gegeben werden (Maschenweite 0,250 mm), bevor die Würmer gezählt werden. Bei diesem Verfahren werden Kaolinit, Torf und (teilweise) Sand ausgewaschen; die rötlich eingefärbten Würmer sind dann leichter zu erkennen und zu zählen. Die Verwendung beleuchteter Lupen (Größe der Lupe mindestens 100 × 75 mm mit 2- oder 3-facher Vergrößerung) erleichtert das Zählen ebenfalls.
Die Färbetechnik verkürzt den Zeitaufwand beim Zählen auf wenige Minuten pro Gefäß; in der Regel müsste eine Person alle in einem Test verwendeten Gefäße in höchstens zwei Tagen auszählen können.
Nassextraktion
Mit der Nassextraktion sollte unmittelbar nach Testende begonnen werden. Der Boden aus den Prüfgefäßen wird in Kunststoffsiebe mit einer Maschenweite von etwa 1 mm gegeben. Anschließend werden die Siebe so auf Kunststoffschalen gesetzt, dass sie den Boden nicht berühren. Die Schalen werden vorsichtig mit Wasser gefüllt, bis die Proben in den Sieben vollständig von Wasser bedeckt sind. Um eine Wiederfindungsrate von mehr als 90 % aller vorhandenen Würmer sicherzustellen, ist für die Entnahme eine Zeitraum von 3 Tagen bei 20 ± 2 °C vorzusehen. Am Ende des Extraktionszeitraums werden die Siebe herausgenommen, und das Wasser wird (bis auf einen kleinen Anteil) langsam dekantiert, wobei darauf zu achten ist, dass die Sedimente am Boden der Gefäße nicht aufgewirbelt werden. Die Kunststoffschalen werden dann leicht geschwenkt, um die Sedimente im Überstandswasser zu suspendieren. Danach wird das Wasser in eine Petrischale gegeben. Nach dem Absetzen der Bodenpartikel sind die Enchytraeen erkennbar und können mit einer Stahlpinzette mit weichen Spitzen unter einem Stereomikroskop entnommen und gezählt werden.
Flotation
Eine Flotationsmethode wurde in einer Anmerkung von R. Kuperman (4) beschrieben. Nach dem Fixieren des Inhalts eines Prüfgefäßes mit Ethanol wird der Boden bis zu einer Höhe von 10-15 mm über der Bodenoberfläche mit kolloidalem Siliciumdioxid Ludox AM-30 (30 Gew.- % Suspension in Wasser) bedeckt. Nachdem der Boden 2-3 Minuten gründlich mit dem Flotationsmittel gemischt wurde, können die auf der Oberfläche schwimmenden juvenilen Würmer leicht gezählt werden.
(1) Korinkova, J., und Sigmund, J. (1968). The colouring of bottomfauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
(2) Dirven-Van Breemen, E., Baerselmann, R., und Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 S.
(3) Posthuma, aL., Baerselmann, R., Van Veen, R.P.M., und Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108-121.
(4) Phillips, C.T., Checkai, R.T., und Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, S. 157.
| Überblick über die statistische Auswertung der Daten (NOEC-Bestimmung) | Anlage 7 |
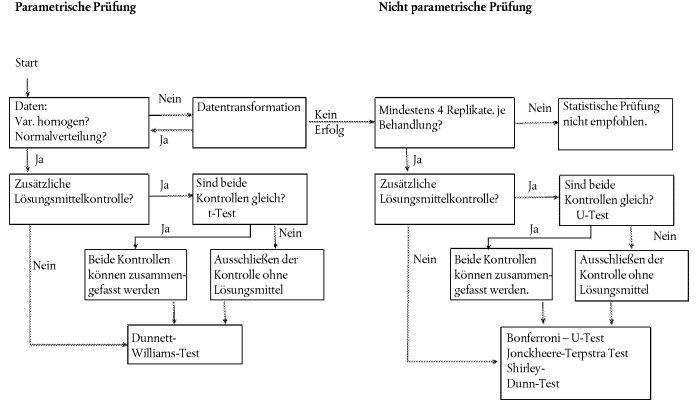
C.33. Reproduktionstest mit Regenwürmern (Eisenia Fetida/Eisenia Andrei)
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 222 (2004). Sie wird zur Beurteilung der Wirkungen von Chemikalien im Boden auf die Reproduktionsleistung (sowie zur Beurteilung sonstiger subletaler Endpunkte) der Regenwurm-Arten Eisenia fetida (Savigny 1826) und Eisenia andrei (Andre 1963) verwendet (1)(2). Die Methode wurde einem Ringtest unterzogen (3). Eine Methode zur Prüfung der akuten Toxizität bei Regenwürmern ist verfügbar (4). Außerdem wurde eine Reihe weiterer internationaler und nationaler Leitlinien zur Prüfung der akuten und der chronischen Toxizität bei Regenwürmern veröffentlicht (5) (6)(7)(8).
2. Eisenia fetida /Eisenia andrei werden als Vertreter der Bodenfauna und insbesondere der Familie der Regenwürmer betrachtet. Hintergrundinformationen zur Ökologie der Regenwürmer und ihre Verwendung bei Ökotoxizitätsprüfungen sind verfügbar (7)(9)(10)(11)(12).
3. Adulte Würmer werden einer Reihe von Konzentrationen der entweder in den Boden gemischten oder - bei Pestiziden - auf oder in den Boden applizierten Prüfchemikalie ausgesetzt; dabei ist entsprechend den Anwendungsformen der jeweiligen Chemikalie zu verfahren. Das Applikationsverfahren hängt von den Prüfzielen ab. Die Konzentrationsspanne wird so gewählt, dass die Konzentrationen abgedeckt sind, bei denen über einen Zeitraum von acht Wochen mit subletalen und letalen Wirkungen zu rechnen ist. Nach vierwöchiger Exposition werden die Wirkungen auf die Mortalität und das Wachstum der adulten Würmer ermittelt. Die adulten Würmer werden aus dem Boden entfernt, und nach weiteren vier Wochen werden durch Auszählen der im Boden vorhandenen juvenilen Tiere die Wirkungen auf die Reproduktionsleistung beurteilt. Die Reproduktionsleistung der Tiere, die der Prüfchemikalie ausgesetzt waren, wird mit der Reproduktionsleistung der Kontrollgruppe(n) verglichen, um (i) die NOEC (höchste messbare Konzentration ohne statistisch signifikante Wirkung) und/oder (ii) mithilfe eines Regressionsmodells den ECx-Wert (z.B. EC10 oder EC50), d. h. die Konzentration zu ermitteln, bei der die Reproduktionsleistung um x % reduziert wird. Die Testkonzentrationen müssen den ECx-Bereich einschließen (z.B. EC10 und EC50), damit der ECx-Wert nicht extrapoliert werden muss, sondern durch Interpolation bestimmt werden kann (Begriffsbestimmungen siehe Anlage 1).
4. Die folgenden Angaben zur Prüfchemikalie müssen verfügbar sein, um geeignete Prüfverfahren aufstellen zu können:
- Wasserlöslichkeit,
- log Kow,
- Dampfdruck
- und möglichst Informationen zu Verbleib und Verhalten in der Umwelt (z.B. Photolyse- und Hydrolyserate soweit für die jeweilige Auf- oder Einbringung von Bedeutung).
5. Diese Prüfmethode ist bei allen Chemikalien unabhängig von ihrer Wasserlöslichkeit anzuwenden. Für flüchtige Chemikalien ist die Prüfmethode nicht geeignet (d. h. für Chemikalien, bei denen die Henry-Konstante oder der Luft-Wasser-Verteilungskoeffizient größer als 1 ist, oder für Chemikalien, bei denen der Dampfdruck bei 25 °C mehr als 0,0133 Pa beträgt).
6. Bei dieser Prüfmethode wird ein möglicher Abbau der Prüfchemikalie im Laufe des Versuchs nicht berücksichtigt. Entsprechend kann nicht davon ausgegangen werden, dass die anfänglichen Expositionskonzentrationen während der gesamten Prüfung aufrechterhalten werden. In diesem Fall sind chemische Analysen der Prüfchemikalie zu Beginn und am Ende der Prüfung zu empfehlen.
Referenzchemikalie
7. Der NOEC- und/oder der ECx-Wert einer Referenzchemikalie sind zu ermitteln, um angemessene Bedingungen für den Labortest sicherstellen und nachweisen zu können, dass sich die Reaktion der Testorganismen im Laufe der Zeit nicht statistisch relevant ändert. Referenzchemikalien sollten mindestens einmal jährlich bzw. - wenn die Tests seltener durchgeführt werden - parallel zur Bestimmung der Toxizität einer Prüfchemikalie getestet werden. Bei Carbendazim oder Benomyl wird die Reproduktionsleistung nachweislich beeinträchtigt; entsprechend sind beide Chemikalien als Referenzchemikalien geeignet (3). Signifikante Wirkungen müssten bei (a) 1 bis 5 mg Wirkstoff/kg Trockenmasse oder (b) 250-500 g/ha oder 25-50 mg/m2 festzustellen sein. Wenn ein positiver toxischer Standard in die Testreihe aufgenommen wird, ist eine einzige Konzentration zu verwenden, und die Anzahl der Replikate muss mit der Anzahl in den Kontrollen übereinstimmen.
Validität des Tests
8. Damit ein Testergebnis als valide gewertet werden kann, müssen die Kontrollen die folgenden Kriterien erfüllen:
- Aus jedem Replikat (mit jeweils 10 adulten Würmern) müssen bis zum Ende des Tests ≥ 30 juvenile Tiere hervorgegangen sein;
- der Variationskoeffizient der Reproduktionsleistung liegt bei < 30% ;
- die Mortalität adulter Tiere in den ersten vier Wochen des Tests beträgt < 10 %.
Wenn ein Test die genannten Validitätskriterien nicht erfüllt, ist der Test zu beenden, sofern keine besonderen Gründe für seine Fortsetzung vorliegen. Die Begründung ist in den Bericht aufzunehmen.
Ausrüstung
9. Zu verwenden sind Prüfbehälter aus Glas oder einem sonstigen chemisch inerten Material mit einem Fassungsvermögen von etwa 1 bis 2 l. Die Behälter sollten eine Querschnittsfläche von etwa 200 cm2 haben, damit bei Zugabe von 500 bis 600 g Substrat (Trockenmasse) eine Tiefe des feuchten Substrats von etwa 5 bis 6 cm erreicht wird. Die Abdeckung des Behälters muss den Gasaustausch zwischen dem Substrat und der Atmosphäre zulassen, lichtdurchlässig sein (z.B. kann eine perforierte transparente Abdeckung verwendet werden) und ein Entweichen der Würmer verhindern. Wenn erheblich mehr Testsubstrat als die genannten 500 bis 600 g pro Prüfbehälter verwendet wird, ist die Anzahl der Würmer entsprechend zu erhöhen.
10. Es wird eine übliche Laborausrüstung insbesondere mit folgenden Bestandteilen benötigt:
- Trockenschrank;
- Stereomikroskop;
- pH-Messgerät und Photometer;
- Waagen mit geeigneter Genauigkeit;
- geeignete Vorrichtungen zur Temperaturregelung;
- geeignete Ausrüstung zur Feuchtigkeitsregelung (bei Expositionsgefäßen mit Deckel nicht wesentlich);
- Inkubator oder kleiner Raum mit Klimaanlage;
- Pinzette, Haken oder Schlaufen;
- Wasserbad.
Herstellung des künstlichen Bodens
11. In diesem Test wird künstlicher Boden (5)(7) mit folgender Zusammensetzung verwendet (bezogen auf Trockenmassen, bei 105 °C bis zur Massekonstanz getrocknet):
- 10 % Sphagnum-Torf (pH-Wert möglichst im Bereich 5,5-6,0, keine sichtbaren Pflanzenreste, fein gemahlen und auf einen bestimmten Feuchtegehalt getrocknet);
- 20 % Kaolin-Ton (Kaolinit-Anteil vorzugsweise über 30 %);
- 0,3 bis 1,0 % Calciumcarbonat (CaCO3, pulverisiert, analysenrein), um einen pH-Ausgangswert von 6,0 ± 0,5 zu erzielen;
- 70 % luftgetrockneter Quarzsand (je nach erforderlichem CaCO3-Anteil), hauptsächlich Feinsand mit mehr als 50 % Partikeln mit einer Größe von 50-200 µm.
Hinweis 1: Wie viel CaCO3 benötigt wird, hängt von der Zusammensetzung des Bodensubstrats einschließlich des Futters ab und ist unmittelbar vor der Untersuchung durch Messung von Teilproben des Bodens zu ermitteln. Der pH-Wert in einer gemischten Probe wird in einer Kaliumchlorid-Lösung (1 mol) oder einer Calciumchlorid-Lösung (CaCl2) (0,01 mol) bestimmt (13).
Hinweis 2: Der Gehalt des künstlichen Bodens an organischem Kohlenstoff kann reduziert werden, z.B. indem der Torfgehalt auf 4 bis 5 % verringert und der Sandanteil entsprechend erhöht wird. Durch eine solche Reduzierung des Gehalts an organischem Kohlenstoff kann die Adsorption der Prüfchemikalie an den Boden (organischen Kohlenstoff) verringert werden und die Bioverfügbarkeit der Prüfchemikalie für die Würmer zunehmen. Es wurde nachgewiesen, dass Eisenia fetida den Validitätskriterien hinsichtlich der Vermehrung bei Versuchen mit Feldböden mit geringerem Gehalt an organischem Kohlenstoff (z.B. 2,7 % (14)) genügt, und es hat sich gezeigt, dass diese Ergebnisse auch mit künstlichem Boden mit 5 %igem Torfgehalt erzielt werden können. Daher ist es zur Erfüllung der Validitätskriterien vor der Verwendung des künstlichen Bodens in einer Hauptprüfung nicht notwendig, seine Eignung für die Prüfung nachzuweisen, wenn der Torfgehalt nicht stärker als oben angegeben reduziert wird.
Hinweis 3: Wenn in weiteren (z.B. höherstufigen) Tests natürlicher Boden verwendet wird, sind auch die Eignung dieses Bodens und die Erfüllung der Validitätskriterien des Tests nachzuweisen.
12. Die trockenen Bestandteile des Bodens werden in einem gut belüfteten Bereich gründlich durchmischt (z.B. in einem großen Labormischer). Vor Prüfbeginn wird der trockene künstliche Boden mit so viel entionisiertem Wasser befeuchtet, bis etwa die Hälfte des endgültigen Wassergehalts erreicht ist, die 40 bis 60 % der maximalen Wasserhaltekapazität (50 ± 10 % Feuchte bezogen auf die Trockenmasse) entspricht. Dabei entsteht ein Substrat, das kein überstehendes oder freies Wasser mehr enthält (durch Ausdrücken mit der Hand festzustellen). Die maximale Wasserhaltekapazität des künstlichen Bodens wird mit den in Anlage 2, ISO 11274 (15) oder der entsprechenden EU-Norm beschriebenen Verfahren ermittelt.
13. Wird die Prüfchemikalie auf die Bodenoberfläche aufgebracht oder ohne Wasser in den Boden gemischt, so kann die endgültige Menge des Wassers bei der Herstellung des Substrats in den künstlichen Boden gemischt werden. Wird die Prüfchemikalie zusammen mit etwas Wasser in den Boden gemischt, kann das zusätzliche Wasser zusammen mit der Prüfchemikalie hinzugegeben werden (siehe Nummer 19).
14. Der Feuchtegehalt des Bodens wird zu Beginn und am Ende des Tests gemäß ISO 11465 (16) oder nach der entsprechenden EU-Norm und der pH-Wert nach Anlage 3 oder ISO 10390 (13) bzw. der entsprechenden EU- Norm bestimmt. Diese Parameter sind an einer Probe des Kontrollbodens und jeweils an einer Probe des Bodens mit den einzelnen Testkonzentrationen zu ermitteln. Wenn saure oder basische Chemikalien geprüft werden, braucht der pH-Wert des Bodens nicht korrigiert zu werden. Der Feuchtegehalt ist während des gesamten Tests durch regelmäßiges Wiegen der Behältnisse zu kontrollieren (siehe Nummern 26 und 30).
Auswahl und Vorbereitung der Testtiere
15. Als Testspezies werden Eisenia fetida oder Eisenia andrei verwendet (1)(2). Für den Prüfbeginn werden adulte, zwei bis zwölf Monate alte Würmer mit Clitellum benötigt. Die Würmer sind aus einer synchronisierten Kultur mit verhältnismäßig homogener Altersstruktur auszuwählen (Anlage 4). Der Altersunterschied zwischen den Tieren einer Testgruppe darf höchstens vier Wochen betragen.
16. Die ausgewählten Würmer werden mindestens einen Tag lang an den für die Prüfung zu verwendenden künstlichen Boden gewöhnt. Sie erhalten dabei das gleiche Futter, das auch im Test verwendet werden soll (siehe Nummern 31-33).
17. Zu Prüfbeginn werden Gruppen von je 10 Würmern einzeln gewogen und nach dem Zufallsprinzip auf die Prüfbehälter verteilt. Vor dem Wiegen werden die Würmer mit entionisiertem Wasser gewaschen und zum Abtropfen kurz auf Filterpapier gesetzt. Die Feuchtmasse der Würmer sollte jeweils zwischen 250 und 600 mg betragen.
Herstellung der Testkonzentrationen
18. Für die Applikation der Prüfchemikalie kommen zwei Methoden in Betracht: Die Prüfchemikalie kann in den Boden gemischt (siehe Nummern 19-21) oder auf die Bodenoberfläche aufgebracht werden (siehe Nummern 22-24). Welche Methode jeweils zu verwenden ist, hängt von den Prüfzielen ab. Im Allgemeinen wird empfohlen, die Prüfchemikalie in den Boden zu mischen. Es können allerdings Applikationsverfahren erforderlich sein, die der gängigen landwirtschaftlichen Praxis (z.B. Aufsprühen einer flüssigen Formulierung oder Verwendung spezieller Pestizidformulierungen wie z.B. Granulate oder Saatgutbeizen) entsprechen. Als Hilfsmittel zur Aufbereitung des Bodens mit der Prüfchemikalie sollten Lösungsmittel ausgewählt werden, die gegenüber Regenwürmern wenig toxisch sind, und im Prüfprotokoll ist eine geeignete Lösungsmittelkontrolle vorzusehen (siehe Nummer 27).
Mischen der Prüfchemikalie in den Boden
Wasserlösliche Prüfchemikalien
19. Unmittelbar vor Prüfbeginn wird eine Lösung der Prüfchemikalie in entionisiertem Wasser in der für alle Replikate einer Testkonzentration erforderlichen Menge hergestellt. Um die Herstellung der Testlösung zu erleichtern, wird unter Umständen ein zweites Lösungsmittel benötigt. Aus praktischen Gründen sollte so viel Lösung hergestellt werden, wie zur Erzielung des endgültigen Feuchtegehalts (40 bis 60 % der maximalen Wasserhaltekapazität) erforderlich ist. Die Lösung wird gründlich mit dem Bodensubstrat gemischt, bevor die Mischung in die Prüfbehälter gegeben wird.
Wasserunlösliche Prüfchemikalien
20. Die Prüfchemikalie wird in einem kleinen Volumen eines geeigneten organischen Lösungsmittels (z.B. Aceton) gelöst und dann auf eine kleine Menge feinen Quarzsand aufgesprüht oder mit dem Sand vermischt. Anschließend wird sie einige Minuten unter einen Abzug gestellt, damit das Lösungsmittel verdunsten kann. Der so behandelte Sand wird gründlich mit dem angefeuchteten künstlichen Boden gemischt. Danach wird entionisiertes Wasser in der erforderlichen Menge hinzugegeben und mit dem Substrat gemischt, um einen endgültigen Feuchtegehalt von 40 bis 60 % der maximalen Wasserhaltekapazität zu erzielen. Der Boden kann dann in die Prüfbehälter gegeben werden. Dabei ist zu beachten, dass manche Lösungsmittel für Regenwürmer toxisch sein können.
In Wasser und organischen Lösungsmitteln unlösliche Prüfchemikalien
21. 10 g fein gemahlener Industrie-Quarzsand werden mit der Menge der Prüfchemikalie gemischt, die zur Erzielung der Testkonzentration im Boden benötigt wird. Anschließend wird diese Mischung gründlich mit dem angefeuchteten künstlichen Boden gemischt. Danach wird entionisiertes Wasser in der erforderlichen Menge hinzugegeben und mit dem Substrat gemischt, um einen endgültigen Feuchtegehalt von 40 bis 60 % der maximalen Wasserhaltekapazität zu erhalten. Der Boden kann dann in die Prüfbehälter gegeben werden.
Applikation der Prüfchemikalie auf die Bodenoberfläche
22. Der Boden wird nach dem Einsetzen der Würmer behandelt. Die Prüfbehälter werden zunächst mit dem angefeuchteten Bodensubstrat gefüllt; anschließend werden die gewogenen Würmer auf die Oberfläche gesetzt. Gesunde Würmer graben sich in der Regel sofort in das Substrat ein; nach 15 Minuten noch an der Oberfläche verbliebene Würmer werden entsprechend als beschädigt betrachtet und sind zu ersetzen. Wenn Würmer ersetzt werden, sind die neuen Würmer und die zu ersetzenden Würmer zu wiegen, damit zu Prüfbeginn das Lebendgewicht der gesamten exponierten Gruppe und das Gesamtgewicht des Behälters mit den Würmern bekannt sind.
23. Danach wird die Prüfchemikalie hinzugegeben. In der ersten halben Stunde nach dem Einsetzen der Würmer (oder wenn sich noch Würmer an der Oberfläche befinden) darf die Prüfchemikalie noch nicht hinzugegeben werden, um einen unmittelbaren Hautkontakt mit der Prüfchemikalie zu vermeiden. Handelt es sich bei der Prüfchemikalie um ein Pestizid, kann es angebracht sein, die Chemikalie auf den Boden aufzusprühen. Die Prüfchemikalie ist mit einem geeigneten Labor-Sprühgerät möglichst gleichmäßig auf den Boden aufzubringen, um die Sprühapplikation im Freiland zu simulieren. Vor der Applikation die Abdeckung des Prüfbehälters abnehmen und den Behälter auskleiden, um die Seitenwände des Behälters vor Spritzern zu schützen. Zur Auskleidung kann ein Prüfbehälter ohne Boden verwendet werden. Die Applikation muss bei einer Temperatur von 20 ± 2 °C und, bei wässrigen Lösungen, Emulsionen oder Dispersionen, mit einem Wasserdurchsatz von 600-800 µl/m2 erfolgen. Die Wassermenge ist mit einem geeigneten Kalibrierungsverfahren zu kontrollieren. Spezielle Formulierungen (z.B. Granulate oder Saatgutbeizen) sind entsprechend der landwirtschaftlichen Praxis aufzubringen.
24. Die Prüfbehälter bleiben eine Stunde geöffnet, damit zur Applikation der Prüfchemikalie verwendete flüchtige Lösungsmittel verdunsten können. Dabei ist darauf zu achten, dass in diesem Zeitraum keine Würmer die Prüfgefäße verlassen.
Test- und Kontrollgruppen
25. Empfohlen werden 10 Regenwürmer je 500 bis 600 g künstlichen Bodens (Trockenmasse) (d. h. 50 bis 60 g Boden pro Wurm). Wenn größere Mengen an Boden verwendet werden (etwa bei der Prüfung von Pestiziden in Verbindung mit besonderen Applikationsverfahren (z.B. bei Saatgutbeizen)) muss das Verhältnis von 50 bis 60 g Boden pro Wurm durch Erhöhung der Anzahl der Würmer ausgeglichen werden. Für jeden Kontrollbehälter und jeden Prüfbehälter sind 10 Würmer vorzubereiten. Die Würmer werden gewaschen, abgewischt und dann kurz auf saugfähiges Papier gelegt, um überschüssiges Wasser zu entfernen.
26. Um systematische Fehler beim Verteilen der Würmer auf die Prüfbehälter zu vermeiden, ist die Homogenität der Prüfpopulation zu bestimmen, indem aus der Population, aus der die Versuchstiere zu entnehmen sind, eine Probe von 20 Würmern nach dem Zufallsprinzip entnommen wird. Diese werden einzeln gewogen. Nachdem die nötige Homogenität sichergestellt ist, werden Gruppen von Würmern gebildet, gewogen und nach dem Zufallsprinzip den Prüfbehältern zugeordnet. Nach dem Einsetzen der Versuchstiere ist jeder einzelne Prüfbehälter zu wiegen, um ein Ausgangsgewicht zu erhalten, das als Grundlage für die Überwachung des Feuchtegehalts des Bodens während des gesamten Versuchs dienen kann (siehe Nummer 30). Anschließend werden die Prüfbehälter, wie unter Nummer 9 beschrieben, abgedeckt und in die Prüfkammer gestellt.
27. Für jede der unter den Nummern 18-24 beschriebenen Methoden zur Applikation der Prüfchemikalie werden geeignete Kontrollen hergestellt. Die beschriebenen Verfahren sind auch bei Herstellung der Kontrollen einzuhalten, allerdings wird keine Prüfchemikalie hinzugegeben. Gegebenenfalls werden also organische Lösungsmittel, Quarzsand oder sonstige Trägerstoffe in Konzentrationen/Mengen entsprechend den Anteilen in den Prüfbehältern hinzugegeben. Soweit ein Lösungsmittel oder ein sonstiger Trägerstoff verwendet wird, um eine Prüfchemikalie aufzubringen, ist eine zusätzliche Kontrolle ohne den Trägerstoff und ohne die Prüfchemikalie herzustellen und zu untersuchen, um sicherzustellen, dass der Trägerstoff keine Auswirkungen auf das Ergebnis hat.
Prüfbedingungen
28. Die Testtemperatur beträgt 20 ± 2 °C. Der Test wird bei einem geregelten Licht-Dunkel-Zyklus (vorzugsweise 16 Stunden Licht und 8 Stunden Dunkelheit) mit einer Lichtstärke von 400 bis 800 lx im Bereich der Prüfbehälter durchgeführt.
29. Die Prüfbehälter werden während des Versuchs nicht belüftet; die Deckel der Prüfgefäße sollten jedoch so beschaffen sein, dass ein Gasaustausch ermöglicht und die Verdunstung von Feuchtigkeit begrenzt wird (siehe Nummer 9).
30. Der Wassergehalt des Bodensubstrats in den Prüfbehältern ist während des gesamten Versuchs aufrechtzuerhalten, indem die Prüfbehälter (ohne Abdeckung) regelmäßig gewogen und Verluste gegebenenfalls mit entionisiertem Wasser ausgeglichen werden. Der Wassergehalt sollte um höchstens 10 % vom Anfangswassergehalt abweichen.
Fütterung
31. Akzeptabel ist jedes Futter, das nachweislich dafür sorgt, während der Dauer des Versuchs das Gewicht der Würmer aufrechtzuerhalten. Erfahrungsgemäß sind Haferflocken sowie Rinder- und Pferdedung geeignet. Es muss sichergestellt werden, dass die Rinder oder Pferde, von denen der Dung stammt, nicht mit Arzneimitteln oder Chemikalien wie z.B. wachstumsfördernden Mitteln, Nematiziden oder sonstigen veterinärmedizinischen Produkten behandelt wurden, die die Entwicklung der Würmer während des Versuchs beeinträchtigen könnten. Nach Möglichkeit sollte selbstgesammelter Rinderdung verwendet werden, da sich gezeigt hat, dass im Handel als Gartendünger angebotener Rinderdung nachteilige Wirkungen auf die Würmer haben kann. Der Dung sollte luftgetrocknet und fein gemahlen sein und vor seiner Verwendung pasteurisiert werden.
32. Jede frische Futtercharge ist vor der Verwendung im Versuch an eine nicht für den Versuch vorgesehene Wurmkultur zu verfüttern, um sicherzustellen, dass es von geeigneter Qualität ist. Das Wachstum und die Kokonbildung dürfen bei den Würmern im Vergleich zu Würmern in einem Substrat, das kein Futter aus der neuen Charge enthält (Bedingungen siehe Prüfmethode C.8 (4)), nicht beeinträchtigt sein.
33. Das Futter wird erstmals einen Tag nach dem Einsetzen der Würmer und nach Applikation der Prüfchemikalie auf den Boden bereitgestellt. In jedem Behälter werden etwa 5 g des Futters auf der Bodenoberfläche verteilt und mit entionisiertem Wasser befeuchtet (etwa 5 bis 6 ml pro Behälter). Danach wird während der vierwöchigen Testdauer einmal pro Woche frisches Futter hinzugegeben. Wenn das Futter nicht verzehrt wird, ist die Ration zu reduzieren, um Pilz- und Schimmelbildung zu vermeiden. Die adulten Würmer werden an Tag 28 des Versuchs aus dem Boden genommen. Danach werden nochmals weitere 5 g Futter in die Prüfbehälter gegeben. Während der übrigen vier Wochen des Tests wird nicht mehr gefüttert.
Auswahl der Testkonzentrationen
34. Bereits bekannte Informationen über die Toxizität der Prüfchemikalie bieten einen Anhaltspunkt für die Auswahl angemessener Testkonzentrationen (z.B. Erfahrungswerte aus einem Test zur Prüfung der akuten Toxizität (4) und/oder Ergebnisse von Vorversuchen). Wenn erforderlich, wird ein Vorversuch beispielsweise mit fünf Konzentrationen der Prüfchemikalie (0,1, 1,0, 10, 100 und 1.000 mg/kg (Trockenmasse des Bodens)) vorgenommen. Ein Replikat pro Gefäß mit Testkonzentration und pro Kontrolle ist ausreichend. Der Vorversuch dauert zwei Wochen; am Ende des Tests wird die Mortalität ermittelt.
Prüfprotokoll
35. Da für diesen Versuch keine allgemeingültige Statistik vorgegeben werden kann, wird im Zusammenhang mit dieser Prüfmethode die Ermittlung der NOEC- und ECx-Werte beschrieben. In absehbarer Zukunft werden die zuständigen Behörden wahrscheinlich die Angabe der NOEC vorschreiben. Ebenfalls in näherer Zukunft könnten ECx-Werte aus statistischen und ökologischen Gründen umfassender berücksichtigt werden. Entsprechend den Empfehlungen aufgrund eines Ringtests im Zusammenhang mit einem Prüfverfahren zur Ermittlung der Reproduktionsleistung von Enchytraeen werden daher drei Protokolle vorgeschlagen (17).
36. Bei der Festlegung der Konzentrationen sind die folgenden Aspekte zu berücksichtigen:
- Zur Bestimmung der NOEC sind mindestens fünf/zwölf Konzentrationen in einer geometrischen Reihe zu prüfen. Zu empfehlen sind vier Replikate je Testkonzentration und acht Kontrollen. Die Konzentrationen dürfen sich maximal um den Faktor 2,0 unterscheiden.
- Zur Ermittlung der ECx-Werte (z.B. EC10 oder EC50) wird eine angemessene Anzahl an Konzentrationen empfohlen, die mindestens vier statistisch signifikant unterschiedliche mittlere Reaktionen hervorrufen. Zu empfehlen sind mindestens zwei Replikate pro Testkonzentration und sechs Replikate pro Kontrolle. Der Abstandsfaktor kann unterschiedlich sein (d. h. im erwarteten Wirkungsbereich maximal 1,8 und bei den höheren und niedrigeren Konzentrationen mehr als 1,8).
- Ein kombinierter Ansatz ermöglicht die Bestimmung sowohl der NOEC als auch des ECx-Werts. Es sind acht Behandlungskonzentrationen in einer geometrischen Reihe zu verwenden. Zu empfehlen sind vier Replikate je Behandlung und acht Kontrollen. Die Konzentrationen dürfen sich maximal um den Faktor 1,8 unterscheiden.
Testdauer und Messungen
37. An Tag 28 werden die lebenden adulten Würmer ermittelt und gezählt. Verhaltensauffälligkeiten bei adulten Tiere (die Tiere können sich nicht mehr in den Boden eingraben oder liegen unbeweglich auf dem Boden) und morphologische Änderungen (z.B. offene Wunden) werden ebenfalls protokolliert. Anschließend werden alle adulten Würmer aus den Prüfgefäßen herausgenommen, gezählt und gewogen. Die Entnahme der adulten Würmer kann erleichtert werden, indem der Boden mit den Würmern vor der Beurteilung in eine saubere Schale umgefüllt wird. Vor dem Wiegen werden die aus dem Boden entnommenen Würmer gewaschen (mit entionisiertem Wasser); zur Entfernung des überschüssigen Wassers werden die Würmer kurz auf Filterpapier gelegt. Nicht wiedergefundene Würmer sind als tot zu erfassen; es wird davon ausgegangen, dass diese Würmer gestorben sind und sich vor der Bewertung zersetzt haben.
38. Wenn der Boden aus den Behältern genommen wurde, wird er nun (ohne die adulten Würmer, aber gegebenenfalls mit gebildeten Kokons) in die Behälter zurückgegeben. Anschließend wird der Boden weitere vier Wochen unter den genannten Prüfbedingungen inkubiert; gefüttert wird allerdings nur noch einmal zu Beginn dieser Testphase (siehe Nummer 33).
39. Nach Ablauf der zweiten 4-wöchigen Phase werden die Anzahl der aus den in dem Boden befindlichen Kokons geschlüpften juvenilen Tiere und die Anzahl der Kokons mit den in Anlage 5 beschriebenen Verfahren ermittelt. Außerdem sind sämtliche Anzeichen von Beschädigungen oder Verletzungen der Würmer während der Testphase zu erfassen.
Limit-Test
40. Wenn im Vorversuch bei der höchsten Konzentration (1.000 mg/kg) keine Wirkungen festzustellen sind, wird der Reproduktionstest als Limit-Test mit der Testkonzentration 1.000 mg/kg durchgeführt. Mit einem Limit- Test kann unter Minimierung der im Versuch zu verwendenden Würmer nachgewiesen werden, dass die NOEC für die Reproduktionsleistung größer ist als die Limit-Konzentration. Sowohl für den behandelten Boden als auch für die Kontrollen sind jeweils acht Replikate zu verwenden.
Auswertung der Ergebnisse
41. Anlage 6 enthält zwar eine Übersicht, doch bei dieser Prüfmethode ist keine statistische Vorgehensweise für die Analyse der Prüfergebnisse vorgeschrieben.
42. Ein Endpunkt ist die Mortalität. Änderungen im Verhalten der adulten Tiere (die Würmer können sich nicht mehr in den Boden eingraben, sie liegen reglos an der Glaswand des Prüfgefäßes usw.) sowie morphologische Änderungen (z.B. offene Wunden) sind jedoch ebenso zu protokollieren wie das Vorhandensein juveniler Würmer. Der LC50-Wert wird normalerweise mit Probit-Analysen (18) oder durch logistische Regressionsanalysen bestimmt. Wenn diese Analysemethode jedoch ungeeignet ist (z.B. wenn weniger als drei Konzentrationen verfügbar sind, bei denen Tiere gestorben sind), können auch alternative Methoden verwendet werden. In Betracht kommen etwa gleitende Durchschnitte (19), die Trimmed-Spearman-Karber-Methode (20) oder eine einfache Interpolation (z.B. geometrischer Mittelwert von LC0 und LC100, berechnet als Quadratwurzel von LC0 multipliziert mit LC100).
43. Der andere Endpunkt ist die Vermehrungsrate (d. h. die Anzahl der entstandenen juvenilen Tiere). Ebenso wie im Vorversuch sind jedoch im Abschlussbericht auch alle sonstigen Anzeichen für schädliche Wirkungen zu erfassen.
Für die statistische Analyse müssen für jede Testkonzentration und für jede Kontrolle im Reproduktionstest das arithmetische Mittel ![]() und die Standardabweichung berechnet werden.
und die Standardabweichung berechnet werden.
44. Wenn eine Varianzanalyse vorgenommen wurde, können die Standardabweichung, s, und die Freiheitsgrade, df, durch die nach der ANOVA geschätzte gepoolte Varianz und durch die entsprechenden Freiheitsgrade ersetzt werden (wenn die Varianz nicht von der Konzentration abhängig ist). In diesem Fall sind die einzelnen Varianzen der Kontrollen und der Gefäße mit den Testkonzentrationen zu verwenden. In der Regel werden die betreffenden Werte mit kommerzieller Statistik-Software berechnet, wobei die Ergebnisse der einzelnen Gefäße als Replikate angenommen werden. Wenn die Zusammenfassung von Daten der negativen Kontrollen und der Lösungsmittelkontrollen sinnvoller erscheint als die Prüfung mit einer einzelnen Kontrolle, werden die Kontrollen getestet, um sicherzustellen, dass sich die Ergebnisse nicht signifikant unterscheiden (entsprechende Tests siehe Nummer 47 und Anlage 6).
45. Ob weitere statistische Tests vorzunehmen und statistische Rückschlüsse zu ziehen sind, hängt davon ab, ob bei den Replikaten eine Normalverteilung und eine homogene Varianz der Werte gegeben sind.
NOEC-Schätzung
46. Vorzugsweise sollten leistungsfähige Tests durchgeführt werden. Dabei könnten Informationen (z.B. frühere Erfahrungen mit Ringtests oder sonstige historische Daten) herangezogen werden, um zu beurteilen, ob die Daten in etwa normal verteilt sind. Entscheidender ist die Varianzhomogenität (Homoskedastizität). Erfahrungsgemäß steigt die Varianz häufig mit zunehmendem Mittelwert. In diesem Fall könnte eine Datenumwandlung eine Homoskedastizität zur Folge haben. Eine entsprechende Umwandlung sollte aber eher auf Erfahrungen mit historischen Daten als auf den Daten der aktuellen Untersuchung beruhen. Bei homogenen Daten sind multiple t-Tests (z.B. ein Williams-Test (α = 0,05, einseitig) (21)(22) oder in bestimmten Fällen auch ein Dunnett-Test (23)(24)) durchzuführen. Bei uneinheitlichen Replikaten müssen die t-Werte in der Tabelle korrigiert werden, wie von Dunnett und Williams empfohlen. Bei einer starken Variation steigen/sinken die Ergebnisse nicht regelmäßig. Bei derart starken Monotonieabweichungen ist der Dunnett-Test besser geeignet. Bei Abweichungen von der Homoskedastizität kann es angebracht sein, mögliche Wirkungen in Bezug auf Varianzen näher zu untersuchen, um dann zu entscheiden, ob die t-Tests durchgeführt werden können, ohne zu viel an Aussagekraft einzubüßen (25). Alternativ kann ein multipler U-Test (z.B. der Bonferroni-U-Test nach Holm (26)) oder - wenn bei diesen Daten zwar eine Homoskedaszität festzustellen ist, die Daten ansonsten aber mit der zugrunde liegenden monotonen Dosis-Wirkungs-Kurve übereinstimmen - ein weiterer nicht parametrischer Test (z.B. Jonckheere-Terpstra (27) (28) oder Shirley (29) (30)) vorgenommen werden; dies wäre im Allgemeinen sinnvoller als t-Tests für ungleiche Varianzen (siehe auch Flussdiagramm in Anlage 6).
47. Wenn ein Limit-Test durchgeführt wurde und die Voraussetzungen für parametrische Prüfverfahren (Normalität, Homogenität) erfüllt sind, kann der paarige Student-t-Test verwendet werden; ansonsten ist der U-Test nach Mann und Whitney durchzuführen (31).
ECx-Schätzung
48. Zur Berechnung eines ECx-Werts wird eine Regressionsanalyse (linear oder nicht linear) mit den Mittelwerten aus der Vorbehandlung vorgenommen, nachdem eine geeignete Dosis-Wirkungs-Beziehung ermittelt wurde. Für das Wachstum der Würmer als kontinuierliche Reaktion können ECx-Werte aufgrund einer geeigneten Regressionsanalyse geschätzt werden (32). Geeignete Funktionen für quantale Daten (Mortalität/Überleben und Anzahl der Nachkommen) sind die normale sigmoide Funktion, die Logit-Funktion oder die Weibull-Funktion mit zwei bis vier Parametern, die teilweise auch hormetische Effekte abbilden können. Wenn eine Dosis- Wirkungs-Funktion mithilfe einer linearen Regressionsanalyse angepasst wurde, müssten in der Regressionsanalyse ein signifikanter r2-Wert (Bestimmungskoeffizient) und/oder eine Steigung festzustellen sein; anschließend wird der ECx-Wert abgeschätzt, indem in die nach der Regressionsanalyse erstellte Gleichung ein Wert entsprechend x % des Mittelwerts der Kontrollgruppe eingesetzt wird. 95- %-Konfidenzintervalle werden nach Fieller (zitiert in Finney (18)) oder mit sonstigen modernen geeigneten Methoden berechnet.
49. Alternativ wird die Reaktion als Anteil oder Prozentanteil eines Modellparameters nachgebildet, der dann als mittlere Reaktion der Kontrollgruppe angenommen wird. In diesen Fällen kann die normale (Logit, Weibull) Sigmakurve durch eine Probit-Regression häufig leicht an die Ergebnisse angepasst werden (18). In diesen Fällen ist die Gewichtungsfunktion entsprechend den metrischen Antworten anzupassen, wie bei Christensen (33) beschrieben. Wenn allerdings eine Hormesis festgestellt wurde, ist die Probit-Analyse durch eine 4- Parameter-Funktion (Logit oder Weibull) zu ersetzen, die mit einem nicht linearen Regressionsverfahren angepasst wird (34). Kann keine geeignete Dosis-Wirkungs-Funktion an die Daten angepasst werden, können alternative Methoden zur Abschätzung von ECx und der entsprechenden Konfidenzintervalle verwendet werden (beispielsweise gleitende Durchschnitte nach Thompson (19) und das Trimmed-Spearman-Karber-Verfahren (20)).
50. Der Prüfbericht muss folgende Angaben enthalten:
Prüfchemikalie:
- eine genaue Beschreibung der Prüfchemikalie (Charge, Los, CAS-Nummer und Reinheit);
- Merkmale der Prüfchemikalie (z.B. log Kow, Wasserlöslichkeit, Dampfdruck, Henry-Konstante (H) und Angaben zu Verbleib und Verhalten).
Testorganismen:
- eingesetzte Testtiere: Art, wissenschaftlicher Name, Bezugsquelle und Zuchtbedingungen;
- Alter, Größenbereich (Masse) der Testorganismen.
Prüfbedingungen
- Angaben zur Herstellung des Prüfbodens;
- maximale Wasserhaltekapazität des Bodens;
- Beschreibung des Verfahrens zur Einbringung der Prüfchemikalie in den Boden;
- nähere Angaben zu chemischen Hilfsstoffen, die zur Applikation der Prüfchemikalie verwendet wurden;
- (gegebenenfalls) Angaben zur Kalibrierung der Sprühvorrichtung;
- Beschreibung des Versuchsaufbaus und des Prüfverfahrens;
- Größe der Prüfbehälter und Volumen des Prüfsubstrats;
- Prüfbedingungen: Lichtintensität, Dauer der Licht-Dunkel-Zyklen, Temperatur;
- Beschreibung der Fütterung; Typ und Menge des im Versuch verwendeten Futters; Zeitpunkte der Fütterung;
- pH-Wert und Wassergehalt des Bodens zu Beginn und am Ende des Versuchs.
Prüfergebnisse:
- Mortalität der adulten Tiere (%) in jedem Prüfbehälter nach den ersten vier Wochen des Versuchs;
- Gesamtmasse der adulten Würmer in den einzelnen Prüfbehältern zu Beginn des Versuchs;
- Gewichtsveränderungen der lebenden adulten Würmer (% des Ausgangsgewichts) in den einzelnen Prüfbehältern nach den ersten vier Wochen des Versuchs;
- Anzahl der in den einzelnen Prüfbehältern entstandenen juvenilen Tiere am Ende des Versuchs;
- Beschreibung deutlicher oder pathologischer Symptome oder ausgeprägter Verhaltensänderungen;
- Ergebnisse mit der Referenzchemikalie;
- der LC50-Wert, die NOEC und/oder der ECx-Wert (z.B. EC50 oder EC10) für die Reproduktionsleistung, gegebenenfalls mit Konfidenzintervallen, und eine Grafik des angepassten Modells für die Berechnung sowie sämtliche Informationen und Feststellungen, die für die Interpretation der Ergebnisse hilfreich sein könnten;
- grafische Darstellung der Dosis-Wirkungs-Beziehung;
- Ergebnisse der einzelnen Prüfbehälter;
Abweichungen von den für diese Prüfmethode beschriebenen Verfahren und außergewöhnliche Vorkommnisse während der Prüfung.
(1) Jaenicke, J. (1982). ,Eisenia fetida' is two biological species. Megadrilogica 4, 6-8.
(2) Oien, N. und J. Stenerson (1984). Esterases of earthworm - III. Electrophoresis reveals that Eisenia fetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277 - 282.
(3) Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei - comparison of two ringtests. In: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamt. f. Land- Forstwirtsch. Berlin-Dahlem, 320, S. 50-82.
(4) Kapitel C.8 dieses Anhangs; Toxizität für Regenwürmer.
(5) ISO (Internationale Organisation für Normung) (1996). Bodenbeschaffenheit - Wirkungen von Schadstoffen auf Regenwürmer Teil 2: Bestimmung der Wirkung auf die Reproduktionsleistung von Eisenia fetida/Eisenia andrei, Nr. 11268-2. ISO, Genf.
(6) ISO (Internationale Organisation für Normung) (1993). Bodenbeschaffenheit - Wirkungen von Schadstoffen auf Regenwürmer (Eisenia Fetida) - Teil 1: Verfahren zur Bestimmung der akuten Toxizität unter Verwendung von künstlichem Bodensubstrat, Nr. 11268-1. ISO, Genf.
(7) SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M. und Posthuma, L. (Hrsg.). SETAC Press, 456 S.
(8) EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
(9) Bouché, M.B. (1972). Lombriciens de France, Ecologie et systématique.Institut National de la Recherche Agronomique.
(10) Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Kommission der Europäischen Gemeinschaften.
(11) Greig-Smith, P.W., Becker, H., Edwards, P.J. und Heimbach, F. (Hrsg.) (1992). Ecotoxicology of Earthworms. Intercept.
(12) Edwards, C.A. und Bohlen, J. P. (1996). Biology and ecology of Earthworms, Dritte Ausgabe. Chapman and Hall, London.
(13) ISO (Internationale Organisation für Normung) (1994). Bodenbeschaffenheit - Bestimmung des pH-Wertes, Nr. 10390. ISO, Genf.
(14) Hund-Rinke, K, Römbke, J., Riepert, F. und Achazi, R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. und Eisentraeger, A. (Hrsg.). Spektrum Verl., Heidelberg. 59-81.
(15) ISO (Internationale Organisation für Normung) (1992). Bodenbeschaffenheit - Bestimmung des Wasserrückhaltevermögens - Laborverfahren, Nr. 11274. ISO, Genf.
(16) ISO (Internationale Organisation für Normung) (1993). Bodenbeschaffenheit; Bestimmung des Trockenrückstandes und des Wassergehaltes auf Grundlage der Masse; Gravimetrisches Verfahren, Nr. 11465. ISO, Genf.
(17) Römbke, J. und Moser, Th. (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, S. 150+ 223.
(18) Finney, D.J. (1971). Probit Analysis (Dritte Ausgabe), S. 19-76. Cambridge Univ. Press.
(19) Finney, D.J. (1978). Statistical Method in Biological Assay. - Charles Griffin & Company Ltd, London.
(20) Hamilton, M.A., Russo, R.C. und Thurston, R.V. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; berichtigte Fassung Environ. Sci. Technol. 12(1998), 417.
(21) Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
(22) Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519- 531.
(23) Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
(24) Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
(25) Hoeven, N. van der (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361.
(26) Holm, S. (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
(27) Jonckheere, A. R. (1954). A distributionfree ksample test against ordered alternatives. Biometrika 41, 133- 145.
(28) Terpstra, T. J. (1952). The asymptotic normality and consistency of Kendall's test against trend, when ties are present in one ranking. Indagationes Math. 14, 327-333.
(29) Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies. Applied Statistics 28, 144-151.
(30) Williams, D.A. (1986).; A note on Shirley's nonparametric test for comparing several dose levels with a zero- dose control. Biometrics 42, 183-186.
(31) Sokal, R.R. und Rohlf, F.J. (1981). Biometry. The Principle and practice of statistics in biological research. Zweite Ausgabe. W.H. Freeman and Company. New York.
(32) Bruce, R.D. und Versteeg, D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494.
(33) Christensen, E.R. (1984). Doseresponse functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
(34) Van Ewijk, P.H. und Hoekstra, J.A. (1993). Calculation of the EC50 and its confidence interval when subtoxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
| Begriffsbestimmungen | Anlage 1 |
Für diese Prüfmethode gelten folgende Definitionen:
Chemikalie: ein Stoff oder ein Gemisch.
ECx (Konzentration mit einer Wirkung von x %): Konzentration, bei der es innerhalb einer gegebenen Expositionsdauer im Vergleich zur Kontrolle zu einer x %- Wirkung auf die Testorganismen kommt; EC50 beispielsweise ist die Konzentration, bei der bei 50 % einer exponierten Population während einer bestimmten Expositionsdauer von einer Wirkung auf einen Endpunkt der Prüfung ausgegangen wird. Bei diesem Test werden die Wirkungskonzentrationen als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens oder als Masse der Prüfchemikalie pro Flächeneinheit des Bodens ausgedrückt.
LC0 (Konzentration ohne letale Wirkung): die Konzentration einer Prüfchemikalie, bei der Testorganismen innerhalb einer bestimmten Expositionsdauer nicht getötet werden; bei diesem Test wird LC0 als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens ausgedrückt.
LC50 (mittlere letale Konzentration): die Konzentration einer Prüfchemikalie, bei der Testorganismen innerhalb einer bestimmten Expositionsdauer zu 50 % getötet werden; bei diesem Test wird LC50 als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens oder als Masse der Prüfchemikalie pro Flächeneinheit des Bodens ausgedrückt.
LC100 (absolut tödliche Konzentration): die Konzentration einer Prüfchemikalie, bei der Testorganismen innerhalb einer bestimmten Expositionsdauer zu 100 % getötet werden; bei diesem Test wird LC100 als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens ausgedrückt.
LOEC: die niedrigste Konzentration der Prüfchemikalie mit statistisch signifikanter Wirkung (p < 0,05); in diesem Test wird die LOEC als Masse der Prüfchemikalie bezogen auf die Trockenmasse des Testbodens oder als Masse der Prüfchemikalie pro Flächeneinheit des Bodens ausgedrückt. Bei allen Testkonzentrationen oberhalb der LOEC müsste normalerweise eine Wirkung auftreten, die sich statistisch von der jeweiligen Kontrolle unterscheidet. Jegliche Abweichungen von diesen Vorgaben sind im Prüfbericht zu begründen.
NOEC: die höchste messbare Konzentration der Prüfchemikalie (unmittelbar unterhalb der LOEC) ohne statistisch signifikante Wirkung; bei diesem Test hat die der NOEC entsprechende Konzentration innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle keine statistisch signifikante Wirkung (p < 0,05).
Prüfchemikalie: jeder Stoff oder jedes Gemisch, der bzw. das mit dieser Methode geprüft wird.
Reproduktionsrate: durchschnittliche Anzahl der juvenilen Würmer, die im Testzeitraum aus einer bestimmten Anzahl an adulten Tieren hervorgegangen sind.
| Bestimmung der maximalen Wasserhaltekapazität des künstlichen Bodens | Anlage 2 |
Mit einer geeigneten Vorrichtung zur Probenahme (Stechzylinder etc.) eine bestimmte Menge (z.B. 5 g) des Prüfbodens entnehmen. Den Zylinder auf der Unterseite mit Filterpapier abdecken, anschließend mit Wasser füllen und auf einem Gestell in ein Wasserbad setzen. Den Zylinder allmählich eintauchen, bis der Boden durch das Wasser bedeckt ist, und etwa drei Stunden im Wasser belassen. Da nicht alles durch die Bodenkapillare aufgenommene Wasser im Substrat gehalten werden kann, den Zylinder mit der Bodenprobe zur Entwässerung für zwei Stunden in einem geschlossenen Gefäß (um eine Austrocknung zu verhindern) auf sehr feuchten, fein gemahlenen Quarzsand stellen. Anschließend die Probe wiegen und bei 105 °C bis zur Massekonstanz trocknen. Die Wasserhaltekapazität (Water Holding Capacity, WHC) kann dann wie folgt berechnet werden:
![]()
Dabei sind:
S = das wassergesättigte Substrat + Masse des Zylinders + Masse des Filterpapiers
T = Tara (Masse des Zylinders + Masse des Filterpapiers)
D = Trockenmasse des Substrats
(1) ISO (Internationale Organisation für Normung) (1996). Bodenbeschaffenheit - Wirkungen von Schadstoffen auf Regenwürmer - Teil 2: Bestimmung der Wirkung auf die Reproduktionsleistung von Eisenia fetida/Eisenia andrei, Nr. 11268-2. ISO, Genf.
| Bestimmung des pH-Wertes von Böden | Anlage 3 |
Eine gegebene Menge Boden mindestens 12 Stunden bei Raumtemperatur trocknen. Eine Suspension aus (mindestens 5 g) Boden in einer 1-M-Lösung analysenreines Kaliumchlorid (KCl) oder einer 0,01-M-Lösung analysenreines Calciumchlorid (CaCl2) im Verhältnis 1:5 herstellen. Anschließend die Suspension fünf Minuten kräftig schütteln und dann mindestens 2, aber nicht länger als 24 Stunden ruhen lassen. Der pH-Wert der flüssigen Phase wird mit einem pH-Messgerät gemessen, das vor jeder Messung mit einer geeigneten Reihe an Pufferlösungen (z.B. pH 4,0 und 7,0) kalibriert wurde.
(1) ISO (Internationale Organisation für Normung) (1994). Bodenbeschaffenheit; Bestimmung des pH-Wertes, Nr. 10390. ISO, Genf.
| Anzucht von Eisenia fetida /Eisenia andrei | Anlage 4 |
Die Anzucht sollte vorzugsweise in einer Klimakammer bei einer Temperatur von 20 °C ± 2 °C erfolgen.
Bei dieser Temperatur und mit hinreichend Futter sind die Würmer nach 2 bis 3 Monaten geschlechtsreif.
Beide Arten können in vielfältigen tierischen Exkrementen angezogen werden. Als Anzuchtmedium wird eine Mischung aus Pferde- oder Rinderdung und Torf im Verhältnis 50:50 empfohlen. Es muss sichergestellt werden, dass die Rinder oder Pferde, von denen der Dung stammt, nicht mit Arzneimitteln oder Chemikalien wie z.B. wachstumsfördernden Mitteln, Nematiziden oder sonstigen veterinärmedizinischen Produkten behandelt wurden, die die Entwicklung der Würmer während des Versuchs beeinträchtigen könnten. Nach Möglichkeit sollte selbstgesammelter Dung ,organischer" Herkunft verwendet werden, da sich gezeigt hat, dass im Handel als Gartendünger angebotener Dung nachteilige Wirkungen auf die Würmer haben kann. Das Medium sollte einen pH-Wert von etwa 6 bis7 (eingestellt mit Calciumcarbonat) sowie eine niedrige Ionenleitfähigkeit (weniger als 6 mS/cm oder 0,5 % Salzkonzentration) haben und nicht übermäßig mit Ammonium oder tierischem Urin verunreinigt sein. Das Substrat sollte feucht, jedoch nicht zu nass sein. Zur Anzucht eignen sich Kästen mit einem Fassungsvermögen von 10 bis 50 l.
Zur Gewinnung von Würmern gleichen Alters und gleicher Größe (Masse) ist es am besten, die Kultur mit Kokons zu beginnen. Sobald die Kultur etabliert ist, werden zur Aufrechterhaltung der Kultur adulte Würmer zur weiteren Kokonablage für 14 bis 28 Tage in einen Anzuchtkasten mit frischem Substrat gesetzt. Danach werden die adulten Würmer herausgenommen; die aus den Kokons geschlüpften juvenilen Tiere werden als Grundstamm für die nächste Kultur verwendet. Die Würmer werden kontinuierlich mit tierischen Exkrementen gefüttert und von Zeit zu Zeit in frisches Substrat umgesetzt. Erfahrungsgemäß sind luftgetrockneter und fein gemahlener Rinder- und Pferdedung sowie Haferflocken als Futter geeignet. Es ist sicherzustellen, dass die Rinder oder Pferde, von denen der Dung stammt, nicht mit Chemikalien wie z.B. wachstumsfördernden Mitteln behandelt wurden, die in der Langzeitkultur nachteilige Wirkungen auf die Würmer haben könnten. Die aus den Kokons geschlüpften Würmer werden für den Versuch verwendet, wenn sie ein Alter von 2 bis 12 Monaten erreicht haben und als adult gelten.
Die Würmer können als ges- und betrachtet werden, wenn sie sich durch das Substrat bewegen, nicht versuchen, das Substrat zu verlassen und sich regelmäßig vermehren. Das Substrat ist dann erschöpft, wenn die Würmer sich sehr langsam bewegen und das hintere Ende gelblich aussieht. In diesem Fall sollte frisches Substrat bereitgestellt und/ oder die Besatzdichte verringert werden.
| Verfahren zum Zählen der aus den Kokons geschlüpften juvenilen Würmer | Anlage 5 |
Da die Handverlesung von Würmern aus dem Bodensubstrat sehr zeitaufwendig ist, werden zwei alternative Methoden empfohlen:
- Die Prüfbehälter werden in ein Wasserbad mit einer Temperatur von anfänglich 40 °C gesetzt, die danach auf 60 °C erhöht wird. Nach etwa 20 Minuten müssten die juvenilen Würmer an die Bodenoberfläche kommen; von dort können sie leicht abgelesen und gezählt werden.
- Der Testboden kann nach der von van Gestel u. a. entwickelten Methode (1) durch ein Sieb gespült werden, sofern der Torf, der Dung oder das Haferflockenmehl, der bzw. das dem Boden hinzugegeben wurde, fein gemahlen wurden. Zwei Siebe mit einer Maschenweite von 0,5 mm (Durchmesser 30 cm) werden aufeinander gesetzt. Der Inhalt eines Prüfbehälters wird mit einem kräftigen Leitungswasserstrahl durch die Siebe gespült, wobei die juvenilen Würmer und die Kokons hauptsächlich auf dem oberen Sieb verbleiben. Die gesamte Oberfläche des oberen Siebs ist während des Siebvorgangs feucht zu halten, damit die juvenilen Würmer auf einem Wasserfilm schwimmen und nicht durch die Maschen des Siebs kriechen. Am besten wird dazu ein Brauseaufsatz verwendet.
Nachdem das gesamte Bodensubstrat durch das Sieb gespült wurde, können die juvenilen Tiere und die Kokons vom oberen Sieb in eine Schale gespült werden. Der Inhalt der Schale wird stehen gelassen, damit leere Kokons zur Wasseroberfläche steigen und volle Kokons und juvenile Würmer auf den Boden sinken können. Danach kann das überstehende Wasser abgegossen werden, und die juvenilen Würmer und die Kokons können in eine Petrischale mit etwas Wasser gesetzt werden. Zur Auszählung können die Würmer mit einer Nadel oder einer Pinzette entnommen werden.
Erfahrungsgemäß ist Methode (a) besser für die Entnahme juveniler Würmer geeignet, die sogar durch ein Sieb mit einer Maschenweite von 0,5 mm gespült werden können.
Grundsätzlich ist zu ermitteln, welche Methode für die Entnahme der Würmer (sowie ggf. der Kokons) aus dem Bodensubstrat geeignet ist. Wenn juvenile Tiere von Hand abgesammelt werden, sollte der Vorgang bei allen Proben zweimal durchgeführt werden.
(1) Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
| Übersicht über die statistische Auswertung der Daten (NOEC-Bestimmung) | Anlage 6 |
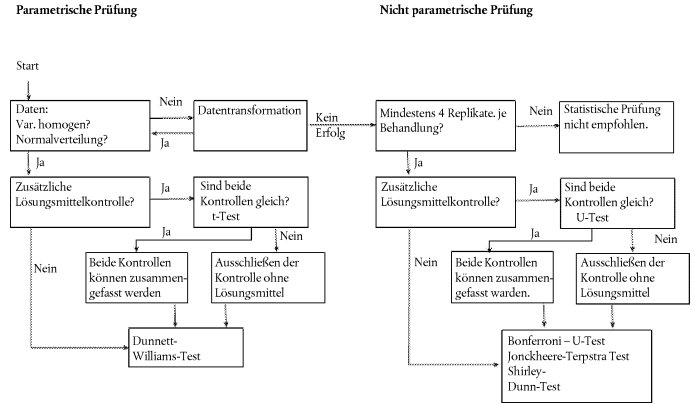
C.34. Bestimmung der Hemmung Anaerober Bakterien - Reduktion der Gasproduktion von anaerobem Faulschlamm
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 224 (2007). In Gewässer eingeleitete Chemikalien passieren sowohl aerobe als auch anaerobe Zonen, in denen sie abgebaut werden und/oder die Aktivität von Bakterien hemmen können; in bestimmten Fällen können sie über Jahrzehnte oder noch länger unverändert in anaeroben Zonen verbleiben. Bei der Abwasserbehandlung ist die erste Stufe (Vorklärung) im Überstandswasser aerob und im abgesetzten Schlamm anaerob. Es folgt die zweite Stufe mit einer aeroben Zone im Belebtschlamm-Belüftungsbecken und einer anaeroben Zone im nachfolgenden Absetzbecken (Nachklärung). Schlamm aus beiden Stufen wird in der Regel einer anaeroben Behandlung unterzogen; dabei entstehen Methan und Kohlenstoffdioxid, die gewöhnlich zur Stromerzeugung genutzt werden. In der natürlichen Umwelt verbleiben Chemikalien, die sich in Sedimenten in Buchten, Ästuarien und im Meer ablagern, wahrscheinlich auf unbestimmte Zeit in diesen anaeroben Zonen, wenn sie nicht biologisch abbaubar sind. Große Anteile dieser Chemikalien gelangen hauptsächlich aufgrund ihrer physikalischen Eigenschaften (z.B. schlechte Wasserlöslichkeit, starke Adsorption an suspendierte Feststoffe und keine biologische Abbaubarkeit unter aeroben Bedingungen) in diese Zonen.
2. In die Umwelt eingeleitete Chemikalien sollten zwar sowohl unter aeroben als auch unter anaeroben Bedingungen abbaubar sein, doch ist es wichtig, dass in beiden Zonen die mikrobielle Aktivität durch diese Chemikalien nicht gehemmt wird. Im Vereinigten Königreich kam es in einigen Fällen zu einer vollständigen Hemmung der Methanproduktion, beispielsweise verursacht durch Pentachlorphenol in Industrieabwässern; hier mussten die betreffenden Schlämme aus den Faultürmen unter hohem Kostenaufwand an 'sichere' Standorte gebracht und es musste gesunder Faulschlamm aus benachbarten Anlagen importiert werden. Es gab jedoch viele weniger drastische Fälle der Faulschlammhemmung durch andere Chemikalien, darunter aliphatische Halogenkohlenwasserstoffe (aus der chemischen Reinigung) und Reinigungsmittel), die den Faulungsprozess dennoch erheblich beeinträchtigten.
3. Nur eine Prüfmethode (C.11) (1) befasst sich mit der Hemmung der Bakterienaktivität (Atmung von Belebtschlamm) und bewertet die Wirkung von Prüfchemikalien auf die Sauerstoffzehrung bei Vorhandensein von Substrat. Die Methode wird allgemein angewandt, um die mögliche schädliche Wirkung chemischer Stoffe auf die aerobe Behandlung von Abwässern möglichst frühzeitig zu erkennen und nicht hemmende Konzentrationen der Prüfchemikalien zur Verwendung in verschiedenen Bioabbaubarkeitstests abzuschätzen. Mit der Prüfmethode C.43 (2) ist es begrenzt möglich, die toxische Wirkung einer Prüfchemikalie auf die Gasproduktion anaeroben Schlamms zu bestimmen, der auf ein Zehntel seiner normalen Feststoffkonzentration verdünnt wurde, um bei der Bewertung des Zersetzungsprozentsatzes die erforderliche Genauigkeit zu gewährleisten. Da verdünnter Schlamm empfindlicher auf hemmende Chemikalien regieren könnte, entschied sich die zuständige ISO-Gruppe für die Entwicklung einer Methode mit unverdünntem Schlamm. Mindestens drei Texte wurden geprüft (aus Dänemark, Deutschland und dem Vereinigten Königreich), und schließlich wurden zwei ISO-Normen erarbeitet - eine für unverdünnten Schlamm (ISO 13.641-1) (3) und eine für hundertfach verdünnten Schlamm (ISO 13.641-2) (4), um Schlämme und Sedimente mit geringen Bakterienpopulationen zu repräsentieren. Beide Methoden wurden im Ringtest geprüft (5), wobei Teil 1 als akzeptable Norm bestätigt wurde, bei Teil 2 jedoch Uneinigkeit bestand. Das Vereinigte Königreich war der Auffassung, diese Methode müsse weiter untersucht werden, da ein erheblicher Anteil der Teilnehmerlabors von sehr wenig oder keinerlei Gasproduktion berichtete, was zum Teil darauf zurückgeführt wurde, dass der Test aufgrund des zu hohen Gasanteils (75 %) nicht empfindlich genug war.
4. In früheren Arbeiten aus dem Vereinigten Königreich (6)(7) wurde ein manometrisches Verfahren beschrieben, bei dem unverdünnter Faulschlamm (plus roher Klärschlamm als Substrat) in 500-ml-Gefäßen verwendet wurde; die Apparatur war sperrig, und der Rohschlamm ging mit einer erheblichen Geruchsbelästigung einher. Später wurde die kompaktere und einfacher zu handhabende Apparatur von Shelton und Tiedje (8) (in der von Battersby und Wilson (9) entwickelten Form) von Wilson et al. (10) erfolgreich angewendet. Kawahara et al. (11) gelang im Labor die Herstellung weiterer Standardschlämme, die zur Verwendung in Tests auf anaerobe biologische Abbaubarkeit und die Hemmwirkung bestimmter Chemikalien geeignet sind. Außerdem wurde der Rohschlamm durch anaerobem Schlamm in hundertfacher Verdünnung bzw. durch Schlämme oder Sedimente bzw. vergleichbare Substrate mit niedriger bakterieller Aktivität als Testsubstrat ersetzt.
5. Mit dieser Prüfmethode können Daten generiert werden, die für die Prognostizierung der wahrscheinlichen Wirkung einer Prüfchemikalie auf die Gasproduktion in anaeroben Faultürmen hilfreich sind. Nur Langzeittests, bei denen aktive Faultürme realistischer simuliert werden, können jedoch Aufschluss darüber geben, ob es zu einer Anpassung der Mikroorganismen an die Prüfchemikalie kommen kann oder ob sich Chemikalien, mit hoher Adsorptionsneigung, die an den Schlamm adsorbiert werden, über einen über die Versuchsdauer hinausgehenden Zeitraum zu einer toxischen Konzentration anreichern können.
6. Aliquoten einer Mischung aus anaerobem Faulschlamm (20-40 g/l Gesamtfeststoffgehalt) und einer abbaubaren Substratlösung einzeln und gleichzeitig in verschiedenen Prüfchemikalienkonzentrationen drei Tage lang in geschlossenen Gefäßen inkubieren. Die erzeugte Gasmenge (Methan und Kohlenstoffdioxid) anhand des Druckanstiegs (Pa) in den Flaschen messen. Die prozentuale Hemmung der Gaserzeugung durch die verschiedenen Prüfchemikalienkonzentrationen anhand der in den jeweiligen Prüf- und Kontrollgefäßen erzeugten Mengen berechnen. Den EC50-Wert und andere Wirkkonzentrationen anhand von Kurven der prozentualen Hemmung bezogen auf die verschiedenen Prüfchemikalienkonzentrationen oder (häufiger) ihre Logarithmen berechnen.
7. Prüfchemikalien sollten im Allgemeinen in der reinsten erhältlichen Form verwendet werden; denn Verunreinigungen in bestimmten Chemikalien (z.B. bei Chlorphenolen) können sehr viel toxischer wirken als die Prüfchemikalie als solche. Die Prüfchemikalien sollten jedoch in der Form untersucht werden, in der sie hergestellt/im Handel angeboten werden. Die Verwendung von Formulierungen wird in der Regel nicht empfohlen, kann aber bei schlecht löslichen Prüfchemikalien angemessen sein. Folgende Eigenschaften der Prüfchemikalie sollten bekannt sein: Löslichkeit in Wasser und in einigen organischen Lösungsmitteln, Dampfdruck, Adsorptionskoeffizient, Hydrolyse und biologische Abbaubarkeit unter anaeroben Bedingungen.
8. Der Test kann mit wasserlöslichen, wasserunlöslichen und mit flüchtigen Chemikalien durchgeführt werden. Besondere Vorsicht ist bei Materialien mit geringer Wasserlöslichkeit (siehe Literaturangabe (12)) und von hoher Flüchtigkeit geboten. Es können auch Inokula aus anderen anaeroben Quellen (z.B. Schlämme, wassergesättigte Böden und Sedimente) verwendet werden. Anaerobe Bakteriensysteme, die zuvor toxischen Chemikalien ausgesetzt waren, können sich so angepasst haben, dass sie auch unter Einwirkung xenobiotischer Chemikalien noch aktiv sind. Inokula aus angepassten Bakteriensystemen können eine höhere Toleranz gegenüber Prüfchemikalien aufweisen als Inokula aus nicht angepassten Systemen.
9. Zur Verfahrenskontrolle wird eine Referenzchemikalie in parallel zu den normalen Testdurchläufen aufgestellten geeigneten Gefäßen getestet. 3,5-Dichlorphenol hat sich als eine Chemikalie erwiesen, die die anaerobe Gaserzeugung sowie die Sauerstoffzehrung des Belebtschlamms und diverse andere biochemische Reaktionen konsistent hemmt. Es konnte außerdem gezeigt werden, dass zwei weitere Chemikalien, Methylenbis- thiocyanat und Pentachlorphenol, die Methanerzeugung stärker hemmen als 3,5-Dichlorphenol. Die mit diesen Chemikalien erzielten Ergebnisse wurden aber noch nicht validiert. Pentachlorphenol wird nicht empfohlen, weil es in reiner Form schwer zu beschaffen ist.
Reproduzierbarkeit von Testergebnissen
10. In einem internationalen Ringtest (5) konnten die 10 beteiligten Labore EC50-Werte der für 3,5-Dichlorphenol und 2-Bromethansulfonsäure nur hinreichend reproduzieren. (Der Wertebereich für Dichlorphenol lag bei 32- 502 mg/l und für Bromethansulfonsäure bei 220-2.190 mg/l.)
| Zahl der Teil nehmerlabors | mg/l | mg/g Schlamm | ||||
| Mittelwert | Standard- abweichung | VK (%) | Mittelwert | Standard- abweichung | VK (%) | |
| 3,5-Dichlorphenol | ||||||
| 10 | 153 | 158 | 103 | 5 | 4,6 | 92 |
| 2-Bromethansulfonsäure | ||||||
| 10 | 1.058 | 896 | 85 | 34 | 26 | 76 |
EC50-Daten aus dem Ringtest - unverdünnter Schlamm
11. Die hohen Variationskoeffizienten zwischen den Labors spiegeln zu einem großen Teil die unterschiedliche Empfindlichkeit der im Schlamm enthaltenen Mikroorganismen wider, die durch eine Präexposition oder eine fehlende Präexposition gegenüber der Prüfchemikalie oder anderen chemisch verwandten Chemikalien verursacht wurde. Die Genauigkeit, mit der der EC50-Wert anhand der Schlammkonzentration bestimmt wurde, war kaum besser als der 'volumetrische' Wert (mg/l). Die Variationskoeffizienten (22, 9 und 18 % für EC50 mg/g) der EC50-Werte für 3,5-Dichlorphenol der drei Labore, die Angaben zur Genauigkeit Ihrer EC50 Werte übermittelten, waren erheblich niedriger als die Mittelwerte aller zehn Labors zusammen. Die Mittelwerte der drei Labors waren jeweils 3,1; 3,2 und 2,8 mg/g. Die niedrigeren, annehmbaren Variationskoeffizienten innerhalb der Labors zeigen im Vergleich zu den erheblich höheren Variationskoeffizienten zwischen den Labors (9-22 % gegenüber 92 %) erhebliche Unterschiede bei den Eigenschaften der einzelnen Schlämme.
Apparatur
12. Benötigt werden die übliche Laborausrüstung sowie die folgenden Geräte und Hilfsmittel:
- Inkubator - funkensicher und auf 35 ± 2 °C geregelt;
- druckbeständige Prüfgefäße aus Glas in angemessener Nenngröße 1, jeweils mit gasdicht beschichtetem Septum, belastbar bis zu 2 bar oder 2 × 105 Pa (Beschichtung beispielsweise mit PTFE (Polytetrafluorethen)). Empfohlen werden gläserne Serumflaschen mit einem nominellen Volumen von 125 ml und einem tatsächlichen Volumen von etwa 160 ml mit Durchstichseptum 2 und gebördelten Aluminiumringen; es können aber auch Flaschen mit einem Gesamtinhalt von 0,1-1 l verwendet werden;
-
Präzisionsdruckmesser 3 mit Nadelanschluss;
Druckmesser, eingestellt für die Messung und Entlüftung des gesamten erzeugten Gases (Methan und Kohlenstoffdioxid); geeignet ist beispielsweise ein tragbarer Präzisionsdruckmesser mit Spritzennadelanschluss; ein gasdichtes 3-Wege-Ventil gestattet zum Ablassen von überschüssigem Druck (Anlage 1). Das Innenvolumen von Schlauch und Ventil des Druckmessgeräts muss möglichst gering sein, damit Fehler wegen Nichtbeachtung des Gerätevolumens nicht ins Gewicht fallen;
- Isolationsbehälter zum Transportieren des Faulschlamms;
- 3-Wege-Druckventile;
- Sieb, 1 mm Quadratmaschen;
- Behälter zur Aufnahme des Faulschlamms; ein Glas oder eine Flasche aus hochdichtem Polyethylen; Inhalt etwa 5 l, ausgestattet mit Rührer und der Möglichkeit zur Belüftung des Kopfraumes mit Stickstoffgas (siehe Nummer 13);
- Membranfilter (0,2 µm) zum Sterilisieren des Substrats;
- Mikrospritzen zum gasdichten Anschluss des Druckmessgeräts (siehe Nummer 12(c)) an den Kopfraum in den Flaschen (siehe Nummer 12(b)); auch für die Zugabe nicht löslicher flüssiger Testmaterialien in die Flaschen;
- Handschuhkasten (Glovebox), optional, aber empfohlen, mit leichtem Stickstoffüberdruck.
Reagenzien
13. Für die Prüfung sind ausschließlich Reagenzien in Analysequalität zu verwenden. Es muss grundsätzlich Stickstoffgas hoher Reinheit mit weniger als 5 µl/l Sauerstoff verwendet werden.
Wasser
14. Wenn in einer Prüfungsphase eine Verdünnung vorgenommen werden muss, ist entlüftetes entionisiertes Wasser zu verwenden. Eine Analyse dieses Wassers zur Kontrolle ist nicht notwendig; es ist jedoch sicherzustellen, dass die Entionisierungsvorrichtung regelmäßig gewartet wird. Entionisiertes Wasser wird auch für die Herstellung von Stammlösungen verwendet. Vor der Zugabe des anaeroben Inokulums zu einer Lösung oder zu einer Verdünnung des Prüfmaterials ist sicherzustellen, dass die Lösung bzw. die Verdünnung frei von Sauerstoff ist. Dazu wird entweder eine Stunde vor Zugabe des Inokulums Stickstoffgas durch das Verdünnungswasser (bzw. durch die Verdünnungen) geblasen oder das Verdünnungswasser wird in sauerstofffreier Atmosphäre bis zum Siedepunkt erhitzt und anschließend weiterhin unter sauerstofffreier Atmosphäre auf Raumtemperatur abgekühlt.
Faulschlamm
15. Aktiven Faulschlamm aus einem Faulbehälter einer Kläranlage (oder aus einem Laborfermenter) entnehmen, in der vorwiegend Schlamm aus häuslichen Abwässern behandelt wird. Praktische Informationen zu Schlämmen aus Laborfermentern sind anderen Quellen zu entnehmen (11). Wenn ein adaptiertes Inokulum verwendet werden soll, kann der Faulschlamm auch aus einer Anlage zur Klärung von Industrieabwässern entnommen werden. Zur Entnahme des Schlamms Flaschen mit weitem Hals aus hochdichtem Polyethylen oder ähnlich dehnbarem Material verwenden. Den Schlamm bis zu einer Höhe von etwa 1 cm unter der Oberkante der Flaschen einfüllen; anschließend die Flaschen dicht verschließen, vorzugsweise mit einem Druckventil (Nummer 12(e)), und in isolierte Behälter stellen (Nummer 12(d)), um Temperaturschocks zu minimieren, bis die Flaschen in einen Inkubator mit konstanter Temperatur von 35 ± 2 °C überführt werden. Beim Öffnen der Flaschen darauf achten, dass der überschüssige Gasdruck entweder durch vorsichtiges Lösen des Verschlusses oder über das 3-Wege-Druckventil (Nummer 12(e)) entweichen kann. Den Schlamm möglichst innerhalb weniger Stunden nach der Entnahme verwenden; ist dies nicht möglich, kann er bis zu drei Tage bei 35 ± 2 °C unter Stickstoffatmosphäre im Kopfraum aufbewahrt werden. (In dieser Zeit wird die Aktivität der Mikroorganismen normalerweise nur geringfügig beeinträchtigt.)
Achtung! - Faulschlamm erzeugt entzündbare Gase, die einen Brand oder eine Explosion auslösen können. Da der Schlamm außerdem potenziell pathogene Organismen enthält, sind beim Umgang mit Faulschlamm entsprechende Vorsichtsmaßnahmen zu treffen. Aus Sicherheitsgründen dürfen zur Entnahme des Schlamms keine Glasgefäße verwendet werden.
Inokulum
16. Unmittelbar vor der Verwendung den Schlamm vorsichtig umrühren und durch ein Sieb mit einer Maschenweite von 1 mm2 (Nummer 12(f)) in eine geeignete Flasche passieren (Nummer 12(g)), deren Kopfraum mit einem Stickstoffstrom begast wird. Für die Messung der Konzentration des gesamten Trockenstoffes (siehe z.B. ISO 11.923 (13) bzw. die entsprechende EU-Norm) eine Probe zur Seite stellen. Im Allgemeinen wird der Schlamm unverdünnt verwendet. Die Feststoffkonzentration liegt gewöhnlich zwischen 2 und 4 % (w/w). Den pH-Wert des Schlamms prüfen und erforderlichenfalls auf 7 ± 0,5 einstellen.
Prüfsubstrat
17. 10 g Nährbouillon (z.B. Oxoid), 10 g Hefeextrakt und 10 g D-Glucose in entionisiertem Wasser lösen und auf 100 ml verdünnen. Die Lösung durch Filtration durch einen 0,2-µm-Membranfilter (Nummer 12(h)) sterilisieren und entweder sofort verwenden oder höchstens einen Tag lang bei 4 °C lagern.
Prüfchemikalie
18. Für jede wasserlösliche Prüfchemikalie eine separate Stammlösung, z.B. mit 10 g/l der Chemikalie in sauerstofffreiem Verdünnungswasser, herstellen (Nummer 14). Von dieser Stammlösung geeignete Mengen für die Herstellung der Testmischungen in abgestuften Konzentrationen verwenden. Alternativ kann von jeder Stammlösung eine Verdünnungsreihe so hergestellt werden, dass die in die Testflaschen hinzuzugebende Menge für alle benötigten Endkonzentrationen gleich ist. Der pH-Wert der Stammlösungen erforderlichenfalls auf 7 ± 0,2 einstellen.
19. Bei Prüfchemikalien, die in Wasser nicht hinreichend löslich sind, nach den Anweisungen in ISO 10.634 (12) bzw. der entsprechenden EU-Norm verfahren. Wenn ein organisches Lösungsmittel verwendet werden muss, sind Lösungsmittel wie etwa Chloroform oder Tetrachlorkohlenstoff zu vermeiden, da diese die Methanproduktion erfahrungsgemäß deutlich hemmen. In einem geeigneten flüchtigen Lösungsmittel (z.B. Aceton oder Diethylether) eine Lösung mit einer geeigneten Konzentration einer nicht wasserlöslichen Chemikalie herstellen. In die leeren Testflaschen die benötigten Mengen an in Lösungsmittel gelöster Chemikalie geben (Nummer 12(b)) und das Lösungsmittel vor Zugabe des Faulschlamms verdampfen lassen. Bei anderen Methoden gemäß ISO 10.634 (12) bzw. nach der entsprechenden EU-Norm verfahren; dabei ist allerdings zu berücksichtigen, dass zur Herstellung von Emulsionen verwendete Tenside die anaerobe Gasproduktion hemmen können. Wenn davon ausgegangen wird, dass das Vorhandensein organischer Lösungsmittel und Emulgatoren Artefakte verursachen könnte, kann die Prüfchemikalie auch als Pulver oder Flüssigkeit direkt in das Prüfgemisch gegeben werden. Flüchtige Chemikalien und wasserunlösliche flüssige Prüfchemikalien können mit Mikrospritzen in beimpfte Serumflaschen eingespritzt werden (Nummer 12(i)).
20. Die Prüfchemikalien werden so in die Flaschen gegeben, dass eine geometrische Konzentrationsreihe entsteht (z.B. 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l and 15,6 mg/l). Wenn der Toxizitätsbereich nicht von ähnlichen Chemikalien her bekannt ist, sollte zunächst einen Vorversuch mit Konzentrationen von 1.000 mg/l, 100 mg/l und 10 mg/l durchführt werden, um den benötigten Konzentrationsbereich zu ermitteln.
Referenzchemikalie
21. Zur Herstellung einer wässrigen Lösung mit 3,5-Dichlorphenol (10 g/l) schrittweise Natriumhydroxidlösung in einer Mindestmenge von 5 mol/l zu dem Feststoff geben und dabei die Lösung so lange schütteln, bis dieser sich aufgelöst hat. Anschließend die Lösung bis zum benötigten Volumen mit sauerstofffreiem Verdünnungswasser (Nummer 14) auffüllen; der Lösungsvorgang kann durch eine Ultraschallbehandlung unterstützt werden. Wenn der mittlere Bereich der EC50-Werte in mindestens drei Tests mit unterschiedlichen Inokula (unterschiedliche Herkunft oder zu verschiedenen Zeitpunkten entnommen) bestimmt wurde, können auch andere Referenzchemikalien verwendet werden.
22. Manche Bestandteile des Schlamms können mit potenziellen Hemmstoffen reagieren, die dann für Mikroorganismen nicht mehr verfügbar sind; die Hemmung wird dadurch entsprechend reduziert oder völlig unterbunden. Wenn der Schlamm bereits eine hemmende Chemikalie enthält, kann es bei der Prüfung ebenfalls zu falschen Ergebnissen kommen, wenn dieser Stoff getestet wird. Daneben gibt es noch eine Reihe weiterer Faktoren, die Ergebnisse verfälschen können. Diese sind (zusammen mit Methoden zur Vermeidung oder zumindest zur Reduzierung von Fehlern) in Anlage 3 aufgelistet.
23. Die Zahl der erforderlichen Replikate hängt vom erforderlichen Genauigkeitsgrad der Inhibitionsindizes ab. Sind die Verschlüsse der Flaschen während der gesamten Versuchsdauer gasdicht genug, ist nur eine Charge (mindestens drei Replikate) Testflaschen pro getesteter Konzentration notwendig. Ebenso wird auch für jede Referenzchemikalie und für jede Kontrollreihe nur jeweils eine Charge Flaschen benötigt. Wenn die Verschlüsse der Flaschen jedoch nach ein- oder mehrmaligem Durchstechen nicht mehr dicht sind, muss für jede Zeitspanne (t), für die Ergebnisse ermittelt werden sollen, und für alle zu prüfenden Konzentrationen einer Prüfchemikalie eine Charge Testflaschen (z.B. drei Flaschen) bereitgestellt werden. Gleichermaßen sind 't'- Chargen von Flaschen für die Referenzchemikalie und für die Kontrollen vorzubereiten.
24. Die Verwendung einer Glove-Box (Nummer 12(j)) wird empfohlen. Mindestens 30 Minuten vor Beginn des Versuchs wird mit der Einleitung eines Stickstoffstroms durch die Glove-Box, die die gesamte erforderliche Ausrüstung enthält, begonnen. Beim Handhaben und Verschließen der Flaschen ist sicherzustellen, dass die Temperatur des Schlamms im Bereich 35 ± 2 °C bleibt.
Vorversuch
25. Wenn über die Aktivität des Faulschlamms nichts bekannt ist, sollte ein Vorversuch durchgeführt werden. Dazu Kontrollen beispielsweise mit Feststoffkonzentrationen von 10 g/l, 20 g/l und 40 g/l und mit einem Substrat, jedoch ohne die Prüfchemikalie herstellen. Zudem verschiedene Mengen an Reaktionsgemisch verwenden, um drei oder vier verschiedene Verhältnisse an Kopfraum- zu Flüssigkeitsvolumen- zu erhalten. Anhand der Gasvolumina, die in den verschiedenen Zeitintervallen erzeugt werden, die optimalen Bedingungen ermitteln, unter denen zweimal täglich signifikante Gasvolumina und eine Druckentlastung pro Tag bei optimaler Empfindlichkeit 4 und ohne Explosionsgefahr gemessen werden können.
Zugabe der Prüfchemikalien
26. Wasserlösliche Prüfchemikalien als wässrige Lösungen (Nummer 18) in leere Testflaschen (Nummer 12(b)) geben. Jeden Konzentrationsbereich mindestens in dreifacher Ausführung ansetzen (Nummer 20). Bei nicht oder schlecht löslichen Prüfchemikalien Lösungen der Prüfchemikalie in organischen Lösungsmitteln mit einer Mikrospritze in leere Flaschen injizieren, um Replikate von jeweils fünf Konzentrationen der Prüfchemikalie herzustellen. Das Lösungsmittel verdampfen, indem Stickstoffgas über die Oberfläche der Lösungen in die Testflaschen geleitet wird. Alternativ können nicht lösliche feste Chemikalien als abgewogene Feststoffmengen auch direkt in die Testflaschen gegeben werden.
27. Werden wasserunlösliche oder schlecht wasserlösliche flüssige Prüfchemikalien mithilfe eines Lösungsmittels hinzugegeben, so sind sie nach Zugabe des Inokulums und des Prüfsubstrats (siehe Nummer 30) mit einer Mikrospritze direkt in die Testflaschen zu injizieren. Flüchtige Prüfchemikalien können auf dieselbe Weise hinzugegeben werden.
Zugabe von Inokulum und Substrat
28. Eine geeignete Menge gesiebten Faulschlamms (siehe Nummer 16) in einer 5-l-Flasche (Nummer 12(g)) rühren; dabei gleichzeitig den Kopfraum mit Stickstoffgas begasen. Testflaschen mit wässrigen Lösungen oder mit verdampften Lösungsmittellösungen der Prüfchemikalien etwa zwei Minuten mit gasförmigem Stickstoff spülen, um vorhandene Luft zu entfernen. Aliquoten (z.B. 100 ml) des gut durchmischten Schlamms mit einer Pipette mit weiter Öffnung oder mit einem Messzylinder in die Testflaschen geben. Wichtig ist, dass die Pipette in einem einzigen Schritt mit der exakt benötigten Schlammmenge gefüllt wird, da sich die im Schlamm enthaltenen Feststoffe leicht absetzen können. Wenn eine zu große Menge aufgenommen wird, muss die Pipette entleert und neu befüllt werden.
29. Anschließend so viel Substratlösung (Nummer 17) hinzugeben, dass sich in dem Gemisch eine Konzentration von jeweils 2 g/l Nährbouillon, Hefeextrakt und D-Glucose ergibt; die Testflaschen dabei kontinuierlich mit gasförmigem Stickstoff spülen. Die Testchargen könnten z.B. so aussehen:
| Endgültige Massekonzentration der Prüfchemikalie in den Prüfgefäßen (mg/l) | Volumen der Prüfchemikalie (ml) | Reagenzien und Medien (ml) | |||
| Stammlösung a) 10 g/l Nr. 18 | Stammlösung b) 1 g/l Nr. 18 | Verdünnungs- wasser Nr. 14 | Inokulum Nr. 16 | Substrat Nr. 17 | |
| 0 | - | 0 | 1,0 | 100 | 2 |
| 1 | - | 0,1 | 0,9 | 100 | 2 |
| 3,3 | - | 0,33 | 0,67 | 100 | 2 |
| 10 | 0,1 | - | 0,9 | 100 | 2 |
| 33 | 0,33 | - | 0,67 | 100 | 2 |
| 100 | 1,0 | - | 0 | 100 | 2 |
| Gesamtinhalt der Flasche = 160 ml, Flüssigkeitsvolumen = 103 ml, Gasvolumen = 57 ml oder 35,6 % des Gesamtvolumens. | |||||
30. Gleichermaßen ausreichend leere Testflaschen mit gasförmigem Stickstoff ausspülen, um flüchtige und unlösliche flüssige Prüfchemikalien zu entfernen (siehe Nummer 27).
Kontrollen und Referenzchemikalie
31. Mindestens drei Replikate an Flaschen, die jeweils nur Schlamm und Substrat enthalten, als Kontrollen ansetzen. Des Weiteren Replikate an Flaschen mit Schlamm, Substrat und hinreichend Stammlösung der Referenzchemikalie - 3,5-Dichlorphenol (Nummer 21) - mit einer Endkonzentration von 150 mg/l vorbereiten. Diese Konzentration sollte die Gasproduktion um etwa 50 % hemmen. Alternativ kann eine Konzentrationsreihe mit der Referenzchemikalie hergestellt werden. Zudem vier zusätzliche Flaschen mit Schlamm, sauerstofffreiem Wasser und Substrat für pH-Messungen ansetzen. In zwei der Flaschen die Prüfchemikalie in der höchsten zu prüfenden Konzentration geben; zu den beiden übrigen Flaschen sauerstofffreies Wasser geben.
32. Es ist sicherzustellen, dass alle Flaschen - die Flaschen mit der Prüfchemikalie und die Kontrollen - dasselbe Flüssigkeitsvolumen (VR) enthalten; erforderlichenfalls die Flüssigkeit mit sauerstofffreiem entionisiertem Wasser (Nummer 14) auffüllen. Der Kopfraum sollte zwischen 10 % und 40 % des Flaschenvolumens ausmachen; der tatsächliche Wert richtet sich nach den Ergebnissen des Vorversuchs. Nach Zugabe aller Bestandteile in die Flaschen die Nadel, mit der das Gas injiziert wurde, herausziehen, und die Flaschen mit einem Gummistopfen und einer Aluminiumkappe (Nummer 12(b)) verschließen; hierzu den Stopfen mit einem Tropfen entionisiertem Wasser anfeuchten, damit er leichter eingeschoben werden kann. Den Inhalt der einzelnen Flaschen durch Schütteln vermischen.
Inkubation der Flaschen
33. Die Flaschen in einen thermostatgeregelten Inkubator stellen, der möglichst mit einer Schüttelvorrichtung ausgestattet sein sollte; die Temperatur auf 35 ± 2 °C einstellen. Die Flaschen im Dunkeln inkubieren. Nach etwa einer Stunde den Druck in den Flaschen mit dem Atmosphärendruck abgleichen. Dazu die mit dem Druckmesser (Nummer 12(c)) verbundene Spritzennadel durch die einzelnen Flaschenverschlüsse stechen und das Ventil so lange öffnen, bis der Druckmesser auf Null steht; danach das Ventil wieder schließen. Die Nadel ist im Winkel von etwa 45° einzuführen, damit kein Gas aus den Flaschen austreten kann. Wenn der Inkubator nicht über eine Schüttelvorrichtung verfügt, müssen die Flaschen während der gesamten Inkubationsdauer zweimal täglich manuell geschüttelt werden, um das System zu äquilibrieren. Die Flaschen inkubieren und umdrehen, damit kein Gas durch das Septum austreten kann. Falls nicht lösliche Prüfchemikalien am Boden der Flasche anhaften könnten, sollten die Flaschen nicht umgedreht werden.
Druckmessung
34. Wenn die Flaschen eine Temperatur von 35 ± 2 °C erreicht haben, den pH-Wert des Inhalts von zwei der vier für diesen Zweck angesetzten Flaschen messen und aufzeichnen; den Flascheninhalt anschließend entsorgen. Die restlichen Flaschen weiter im Dunkeln inkubieren. Den Druck in den Flaschen in den nächsten 48 bis 72 Stunden zweimal täglich messen; dazu die Nadel des Druckmessers durch den Verschluss der einzelnen Flaschen stechen und die Nadel zwischen den Messungen trocknen. Während der Messung, die möglichst zügig erfolgen sollte, sollte die Inkubationstemperatur in allen Bereichen der Flaschen aufrechterhalten werden. Sobald der angezeigte Druck stabil ist, den angezeigten Wert aufzeichnen. Danach das Ventil zur Entlüftung öffnen und wieder schließen, wenn der Druckmesser auf Null steht. Der Versuch wird nach dem Zeitpunkt des ersten Druckausgleichs (' Zeit 0') gewöhnlich für 48 Stunden fortgesetzt. Bei flüchtigen Chemikalien sind nur eine Messung und nur eine Entlüftung (am Ende der Inkubationszeit) bzw. höchstens zwei Messungen und Entlüftungen vorzunehmen, um einen Verlust der Prüfchemikalie zu vermeiden (10).
35. Bei negativer Druckanzeige darf das Ventil nicht geöffnet werden. Manchmal sammelt sich Feuchtigkeit in der Spritzennadel und in der Schlauchleitung, was durch einen geringen Unterdruck angezeigt wird. In diesen Fall die Nadel herausziehen, den Schlauch schütteln, mit einem Papiertuch trocknen und eine neue Nadel aufsetzen.
Messung des pH-Werts
36. Nach der letzten Druckmessung die pH-Werte der Flascheninhalte lesen und aufzeichnen.
Darstellung der Ergebnisse
37. Für jeden Satz Replikatflaschen Summe und Mittelwert der nach jedem Zeitintervall aufgezeichneten Druckergebnisse und für jedes Replikat nach jedem Zeitintervall den mittleren kumulativen Bruttogasdruck berechnen. Dazu Kurven der mittleren kumulativen Gasproduktion (Pa) gegen die Zeit für die Kontrollen, die Flaschen mit den Prüfchemikalien und die Referenzflaschen zeichnen. Auf dem linearen Abschnitt der Kurve einen Zeitpunkt (gewöhnlich 48 Stunden) wählen und für jede Konzentration mit der Gleichung [1] die Hemmung (I) in Prozent bestimmen:
I = (1 - Pt/PC) × 100 [1],
Dabei sind:
I = Hemmung in Prozent (%);
Pt = der erzeugte Gasdruck in Pascal (Pa) in den Flaschen mit Prüfmaterial zum gewählten Zeitpunkt;
Pc = der erzeugte Gasdruck in Pascal (Pa) in der Kontrolle zum selben Zeitpunkt.
Nach Möglichkeit sollten zur Bestimmung von I zwei Kurven gezeichnet werden, d. h. eine Kurve bezogen auf die Konzentration und eine bezogen auf den Logarithmus der Konzentration, um die Kurve mit der besseren Linearität wählen zu können. Den EC50-Wert (mg/l) visuell oder durch Regressionsanalyse anhand der Kurve mit der besseren Linearität bestimmen. Zu Vergleichszwecken kann es hilfreich sein, die Konzentration der Chemikalie in mg Chemikalie/g der gesamten Trockenfeststoffe auszudrücken. Um diese Konzentration zu erhalten, die Volumenkonzentration (mg/l) durch die Volumenkonzentration der trockenen Feststoffe des Schlamms (g/l) (Nummer 16) dividieren.
38. Berechnet wird entweder die durch die Konzentration der Referenzchemikalie bewirkte prozentuale Hemmung (wenn nur eine Konzentration verwendet wurde) oder der EC50-Wert (wenn eine hinreichende Anzahl an Konzentrationen untersucht wurde).
39. Den mittleren Druck des in der Kontrolle erzeugten Gases Pc(Pa) mit Hilfe der Kalibrierkurve des Druckmessers (Anlage 2) in Volumen umrechnen; aus dem erhaltenen Wert sodann die Gasproduktioninnerhalb von 48 Stunden als für 100 ml unverdünntem Schlamm mit einer Feststoffkonzentration von 2 % (20 g/l) bis 4 % (40 g/l) erzeugtes Volumen berechnen.
Validitätskriterien
40. Die Ergebnisse des ISO-Interlabortests (5) haben gezeigt, dass die Referenzchemikalie (3,5-Dichlorphenol) die Gasproduktion bei Konzentrationen von 32 mg/l bis 510 mg/l (Mittelwert 153 mg/l) um 50 % hemmt (Nummer 10). Diese Konzentrationsspanne ist so breit, dass keine genauen Grenzwerte für die Hemmung als zuverlässige Validitätskriterien festgesetzt werden können; dies sollte jedoch möglich sein, sobald Verfahren für die Herstellung einheitlicherer Inokula entwickelt wurden. Die in Kontrollflaschen innerhalb von 48 Stunden erzeugten Gasvolumina reichten von 21 ml/g bis zu 149 ml/g Schlammfeststoff (Mittelwert 72 ml/g). Ein offensichtlicher Zusammenhang zwischen dem erzeugten Gasvolumen und dem entsprechenden EC50-Wert bestand nicht. Beim Abschluss der Tests lag der pH-Wert zwischen 6,1 und 7,5.
41. Der Test wird als gültig betrachtet, wenn es in der Referenzkontrolle mit 150 mg/l 3,5-Dichlorphenol zu einer Hemmung von über 20 % kommt, in der Blindkontrolle mehr als 50 ml Gas pro g Trockenmasse produziert werden und der pH-Wert bei Testende im Bereich zwischen 6,2 und 7,5 liegt.
Prüfbericht
42. Der Prüfbericht muss folgende Informationen enthalten:
Prüfchemikalie
- Handelsüblicher Name, chemische Bezeichnung, CAS-Nummer, Strukturformel und relevante physikalisch- chemische Eigenschaften;
- Reinheit (Verunreinigungen) der Prüfchemikalie.
Prüfbedingungen
- Volumina der flüssigen Bestandteile und des Kopfraums in den Prüfgefäßen;
- Beschreibungen der Prüfgefäße und der Gasmessung (z.B. Druckmessertyp);
- Einbringung der Prüfchemikalie und der Referenzchemikalie in das Testsystem, verwendete Testkonzentrationen und Verwendung von Lösungsmitteln;
- Angaben zum verwendeten Inokulum: Name der Kläranlage, Beschreibung der Herkunft (Bezugsquelle) des behandelten Abwassers (z.B. Betriebstemperatur, Rückhaltezeit des Schlamms, vorwiegend häusliche oder vorwiegend industrielle Abwässer usw.), Konzentration der Feststoffe, Gasproduktion im anaeroben Faulturm, vorherige Exposition oder vielleicht bereits erfolgte Anpassung an toxische Chemikalien, Ort der Entnahme des Schlamms, Sediments usw.;
- Inkubationstemperatur und Temperaturspanne;
- Zahl der Replikate.
Ergebnisse
- pH-Werte bei Versuchsende;
- alle gemessenen Daten aus den Prüf-, Kontroll- und Referenzgefäßen (z.B. in Pa oder in Millibar) in tabellarischer Form;
- prozentuale Hemmung in den Test- und Referenzflaschen und Darstellung der Hemmungs-Konzentrations- Kurven;
- Berechnung der EC50-Werte, ausgedrückt in mg/l und mg/g;
- Gasproduktion pro g Schlamm innerhalb von 48 Stunden;
- Angabe von Gründen, falls die Prüfergebnisse verworfen werden;
- Diskussion der Ergebnisse einschließlich sämtlicher Abweichungen von den Verfahren im Rahmen dieser Prüfmethode sowie Diskussion aller durch Interferenzen und Fehler bedingten Abweichungen der Testergebnisse von den erwarteten Ergebnissen;
- Angabe, ob in dem Test die Toxizität gegenüber präexponierten oder nicht präexponierten Mikroorganismen gemessen werden sollte.
(1) Kapitel C.11 dieses Anhangs: Belebtschlamm, Prüfung der Atmungshemmung.
(2) Kapitel C.43 dieses Anhangs: Anaerobe biologische Abbaubarkeit organischer Verbindungen in Klärschlamm: durch Messung der Gaserzeugung.
(3) Internationale Organisation für Normung (2003) ISO 13.641-1 Wasserbeschaffenheit - Bestimmung der Hemmwirkung der Gasproduktion auf anaerobe Bakterien - Teil 1: Allgemeiner Test [EN]
(4) Internationale Organisation für Normung (2003) ISO 13.641-2 Wasserbeschaffenheit - Bestimmung der Hemmwirkung der Gasproduktion auf anaerobe Bakterien - Teil 2: Untersuchung bei niedrigen Biomassekonzentrationen. [EN]
(5) ISO (2000) Ring test of ISO 13.641-1 and ISO 13.641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, Astra Zeneca UK Ltd., Brixham, TQ5 8BA UK.
(6) Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58-70.
(7) HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK.
(8) Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47.850-857.
(9) Battersby NS., und Wilson, V. (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
(10) Wilson V., Painter, HA., und Battersby, NS. (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Deutschland (1990). Verlag: Steinberg, C., und Kettrup, A, S. 117-132 (1992).
(11) Kawahara K, Yakabe Y, Chida T, und Kida K (1999). Evaluation of laboratorymade sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
(12) Internationale Organisation für Normung (1995) ISO 10634, Wasserbeschaffenheit - Anleitung für die Vorbereitung und Behandlung von in Wasser schwer löslichen organischen Verbindungen für die nachfolgende Bestimmung ihrer biologischen Abbaubarkeit in einem wässrigen Medium,
(13) Internationale Organisation für Normung (1997) ISO 11.923 Wasserbeschaffenheit - Bestimmung der Schwebstoffe mittels Filtration durch ein Glasfaserfilter.
2) Zu empfehlen sind gasdichte Silikon-Septa. Außerdem sollte die Gasdichtheit der Verschlüsse, insbesondere bei Septa aus Butylkautschuk, geprüft werden, denn mehrere im Handel erhältliche Septa sind in Bezug auf Methan nicht ausreichend gasdicht, und einige Septa bleiben nicht dicht, wenn sie unter Testbedingungen mit einer Nadel durchstochen werden.
- Gasdicht beschichtete Septa werden empfohlen und sind bei flüchtigen Chemikalien unbedingt zu verwenden. (Einige handelsübliche Septa sind verhältnismäßig dünn (weniger als 0,5 cm) und werden undicht, wenn sie mit einer Spritzennadel durchstochen werden.)
- Septa aus Butylkautschuk (etwa 1 cm) werden für nicht flüchtige Prüfchemikalien empfohlen (denn sie bleiben normalerweise auch nach dem Durchstechen gasdicht).
- Vor dem Versuch sind die Septa sorgfältig auf Gasdichtheit nach dem Durchstechen zu prüfen.
3) Der Druckmesser ist nach Herstelleranweisungen zu verwenden und regelmäßig zu kalibrieren. Wird ein Druckmesser der vorgeschriebenen Qualität verwendet (z.B. mit einer Stahlmembran verkapselt), ist eine Kalibrierung im Labor nicht mehr erforderlich. Der Druckmesser sollte allerdings regelmäßig von einem zugelassenen Institut kalibriert werden. Die Genauigkeit der Kalibrierung kann im Labor durch eine punktuelle Messung bei 1 × 105 Pa durch Vergleich mit einem Druckmesser mit mechanischer Anzeige geprüft werden. Wenn der betreffende Punkt richtig gemessen wird, bleibt auch die Linearität unverändert. Werden sonstige Messgeräte eingesetzt (ohne zertifizierte Herstellerkalibrierung), ist in regelmäßigen Abständen eine Umrechnung über den gesamten Messbereich zu empfehlen (Anlage 2).
4) Dies gilt für die Versuchsplanung und für die Versuchsbedingungen, wobei die - aus Blindkontrollen und aus Gefäßen mit einer Hemmung von 70-80 % - erzeugten Gasvolumina innerhalb annehmbarer Fehlergrenzen geschätzt werden können.
| Muster einer Apparatur zur Messung der Biogasproduktion anhand des Gasdrucks | Anlage 1 |
Legende:
1 - Druckmesser
2 - Gasdichtes 3-Wege-Ventil
3 - Spritzennadel
4 - Gasdichter Verschluss (gebördelte Kappe und Septum)
5 - Kopfraum
6 - Faulschlamm-Inokulum
Prüfgefäße in einem Temperaturumfeld von 35 ± 2 °C
| Umrechnung der Druckmesswerte | Anlage 2 |
Die Messwerte des Druckmessers können mithilfe einer Standardkurve zum Gasvolumen in Bezug gesetzt werden. Anhand dieser Kurve lässt sich das Volumen des innerhalb von 48 Stunden pro Gramm Trockenschlamm erzeugten Gases berechnen. Dieser Aktivitätsindex wird als eines der Kriterien für die Validitätsbewertung der Testergebnisse verwendet. Die Kalibrierkurve wird erstellt, indem bekannte Gasvolumina bei 35 ± 2 °C in Serumflaschen injiziert werden, die mit einer Wassermenge entsprechend dem Volumen des Reaktionsgemischs VR gefüllt sind:
- Auf 35 ± 2 °C temperierte Wasseraliquoten mit einem Volumen von VR ml in fünf Serumflaschen geben. Die Flaschen verschließen und 1 Stunde zum Äquilibrieren in ein Wasserbad mit einer Temperatur von 35 ± 2 °C stellen;
- den Druckmesser einschalten; nach Stabilisierung der Anzeige das Gerät auf Null stellen;
- die Spritzennadel durch den Verschluss einer der Flaschen stechen und das Ventil öffnen. Wenn der Druckmesser den Wert Null anzeigt, das Ventil wieder schließen;
- dieses Verfahren mit den übrigen Flaschen wiederholen;
- in jede Flasche 1 ml Luft einer Temperatur von 35 ± 2 °C injizieren. Die am Druckmesser befestigte Nadel durch den Verschluss einer Flasche stechen und abwarten, bis sich die Druckanzeige stabilisiert hat. Nach Aufzeichnung des Druckwertes das Ventil so lange öffnen, bis die Anzeige wieder auf Null steht. Danach das Ventil schließen;
- dieses Verfahren mit den übrigen Flaschen wiederholen;
- anschließend das gesamte Verfahren mit 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml und 50 ml Luft wiederholen;
- die Konversionskurve als Druck (Pa) gegen das injizierte Gasvolumen (ml) zeichnen. Das Messgerät reagiert im Bereich von 0-70.000 Pa und bei einer Gasproduktion von 0-50 ml linear.
| Bekannte Faktoren, die Ergebnisse verfälschen können | Anlage 3 |
a) Qualität der Flaschenverschlüsse
Für die Serumflaschen sind im Handel verschiedene Septa erhältlich. Viele Septa (u. a. aus Butylkautschuk) sind nicht mehr dicht, wenn sie unter den Bedingungen dieses Versuchs mit einer Nadel durchstochen wurden. Manchmal fällt der Druck nach dem Durchstechen sehr langsam ab. Um Dichtheitsproblemen vorzubeugen, wird die Verwendung gasdichter Septa empfohlen (Nummer 12(b)).
b) Feuchtigkeit in der Spritzennadel
Manchmal sammelt sich Feuchtigkeit in Spritzennadel und Schlauchleitung, was sich durch einen geringen Unterdruck angezeigt wird. Um das Problem zu beheben, die Nadel herausziehen und die Schlauchleitung schütteln, mit Zellstoffpapier abtrocknen und eine neue Nadel aufsetzen (Nummern 12(c) und 35).
c) Verunreinigung durch Sauerstoff
Die Ergebnisse anaerober Methoden können durch Kontamination mit Sauerstoff verfälscht werden, da dies die Gasproduktion beeinträchtigen kann. Bei dieser Methode sollte dieses Risiko durch Anwendung strikt anaerober Verfahren (u. a. unter Verwendung einer Glove-Box) minimiert werden.
d) Grobe Substratpartikel im Schlamm
Die anaerobe Gasproduktion und die Empfindlichkeit des Schlamms werden durch Substrate beeinflusst, die mit dem Inokulum in die Testflaschen gelangen können. Faulschlamm aus anaeroben Faultürmen zur Behandlung häuslicher Abwässer enthält oft noch erkennbare Partikel (wie Haare und Zelluloserückstände), die die Entnahme repräsentativer Proben erschweren. Durch Sieben des Schlamms können größere nicht lösliche Bestandteile abgetrennt werden; auf diese Weise wird die Repräsentativität der Proben verbessert (Nummer 16).
e) Flüchtige Prüfchemikalien
Flüchtige Prüfchemikalien werden im Kopfraum der Testflaschen freigesetzt. Dadurch können beim Entlüften nach den Druckmessungen geringe Anteile des Prüfmaterials verloren gehen, was zu fehlerhaft hohen EC50-Werte führt. Durch Wahl eines geeigneten Kopfraum-/Flüssigkeitsvolumen-Verhältnisses und durch Verzicht auf die Entlüftung nach den Druckmessungen kann dieser Fehler minimiert werden (10).
f) Nichtlinearität der Gasproduktion
Ist die Kurve der mittleren kumulativen Gasproduktion bezogen auf die Inkubationszeit über den Zeitraum von 48 Stunden nicht mehr oder weniger linear, so kann dies die Genauigkeit der Prüfung beeinträchtigen. Um dies zu vermeiden, empfiehlt es sich unter Umständen, Faulschlamm anderer Herkunft zu verwenden und/oder die Lösung aus Testsubstrat/Nährbouillon, Hefeextrakt und Glucose (Nummer 29) in höherer Konzentration zu verwenden.
| Anwendung auf Umweltproben mit niedriger Biomassekonzentration - Anaerobe Schlämme, Sedimente usw. | Anlage 4 |
A.1 Im Allgemeinen ist die spezifische mikrobielle Aktivität (erzeugtes Gasvolumen pro g trockener Feststoffe) in natürlich vorkommenden anaeroben Schlämmen, Sedimenten, Böden usw. deutlich geringer als bei anaeroben Faulschlämmen aus Abwässern. Wenn die Hemmwirkung von Chemikalien bei diesen weniger aktiven Proben gemessen werden soll, müssen daher einige Versuchsparameter modifiziert werden. Bei diesen weniger aktiven Proben kommen zwei allgemeine Vorgehensweisen in Betracht:
- Um eine genauere Simulation (siehe ISO 13.641, Teil 1) zu ermöglichen, einen modifizierten Vorversuch (Nummer 25) mit der unverdünnten Probe Schlamm, Boden usw. bei 35 ± 2 °C oder der am Ort der Probenahme vorherrschenden Temperatur durchführen;
- oder die Prüfung mit einem (im Verhältnis 1:100) verdünnten Faulschlamm durchführen, um die von der Umweltprobe erwartete geringere Aktivität zu simulieren; dabei allerdings die Temperatur von 35 ± 2 °C beibehalten (siehe ISO 13.641, Teil 2).
A.2 Option a) kann nach der hier beschriebenen Methode (wie ISO 13.641, Teil 1) durchgeführt werden; entscheidend ist jedoch, dass im Vorversuch (Nummer 25) optimale Bedingungen bestimmt werden (wenn diese nicht bereits aus früheren Versuchen bekannt sind). Die Schlamm- oder die Sedimentprobe gründlich mischen (z.B. in einem Mischer) und falls notwendig mit einer kleinen Menge entlüfteten Verdünnungswassers (Nummer 14) so verdünnen, dass sie flüssig genug ist, um von einer Pipette mit großer Öffnung oder von einem Messzylinder aufgenommen zu werden. Ist davon auszugehen, dass Nährstoffe fehlen könnten, kann die Schlammprobe (unter anaeroben Bedingungen) zentrifugiert und in dem mit dem Hefeextrakt versetzten mineralischen Medium (A.11) neu suspendiert werden.
A.3 Option b): Dieses Vorgehen gewährleistet die Simulation von schwach aktiven Umweltproben in ausreichender Art und Weise, allerdings fehlt bei diesen Proben die hohe Konzentration an suspendierten Feststoffen. Die Bedeutung dieser Feststoffe im Hinblick auf die Hemmung ist nicht bekannt, die Reaktion zwischen den Prüfchemikalien und den Schlammbestandteilen sowie die Adsorption der Prüfchemikalien an die Feststoffe könnte jedoch die Toxizität der Prüfchemikalie verringern.
A.4 Ein weiterer wichtiger Faktor ist die Temperatur: Im Interesse einer genauen Simulation sollten die Tests bei der am Ort der Probenahme vorherrschenden Temperatur durchgeführt werden, da andere Gruppen methanproduzierender Bakteriengemeinschaften bekanntermaßen innerhalb anderer Temperaturbereiche aktiv sind; so z.B. thermophile Bakterien bei ~30-35 °C, mesophile Bakterien bei 20-25 °C und psychrophile Bakterien bei < 20 °C; entsprechend können sich unterschiedliche Verläufe der Hemmungseffekte ergeben.
A.5 Dauer: Bei der allgemeinen Prüfung, Teil 1, (mit unverdünntem Schlamm) wurde in den vorgesehenen 2-4 Tagen stets genügend Gas produziert, während die Gasproduktion bei Teil 2 (mit hundertfach verdünntem Schlamm) im Ringtest nicht ausreichend war (soweit überhaupt Gas produziert wurde). Madsen et. al. (1996) erklären in ihrer Beschreibung des letztgenannten Tests, dass mindestens 7 Tage vorgesehen werden sollten.
Test mit niedriger Biomassekonzentration (Option b)
Es sollten folgende Änderungen und Ergänzungen vorgenommen werden, d. h. einige Absätze und Unterabsätze des Haupttexts sind zu ergänzen bzw. zu ersetzen.
A.6 Unter Nummer 6 ist der folgende Absatz anzufügen: Testprinzip:
'Dieses Verfahren kann mit hundertfach verdünntem anaerobem Schlamm angewendet werden, u. a., um die geringe Aktivität von Schlämmen und Sedimenten zu simulieren. Die Inkubation erfolgt entweder bei 35 °C oder bei der am Probenahmeort vorherrschenden Temperatur. Da die bakterielle Aktivität erheblich geringer ist als bei unverdünntem Faulschlamm, sollte die Inkubationsdauer auf mindestens 7 Tage verlängert werden.'
A.7 Unter Nummer 12 Buchstabe a ist folgender Satz anzufügen:
'Der Inkubator sollte auch bei Temperaturen von 15 °C noch betrieben werden können.'
A.8 Nummer 13 ist um ein weiteres Reagenz zu ergänzen:
,Phosphorsäure (H3PO4), 85 Masse- % in Wasser.'
A.9 Am Ende von Nummer 16 ist folgender Satz anzufügen:
'Für diesen Test ist eine Endkonzentration von 0,20 ± 0,05 g/l Gesamttrockenfeststoff insgesamt zu verwenden.'
A.10 Nummer 17. Prüfsubstrat
Dieses Substrat darf nicht verwendet werden; es ist durch Hefextrakt zu ersetzen (siehe Nummern 17, A.11, A.12, A.13).
A.11 Zur Verdünnung des anaeroben Schlamms muss ein mineralisches Medium mit Spurenelementen verwendet werden; der Einfachheit halber wird das organische Substrat (Hefeextrakt) diesem Medium hinzugegeben.
Nach Nummer 17 ist folgender Text anzufügen:
'a) Mineralisches Prüfmedium, mit Hefeextrakt
Die Herstellung erfolgt aus 10-fach konzentriertem Prüfmedium (Nummer 17 Buchstabe b; A.12) mit einer Lösung aus Spurenelementen (Nummer 17 Buchstabe c, A.13). Dazu ist Natriumsulfid-Nonahydrat (Nummer 17 Buchstabe b; A.12) verwenden, das entweder erst vor Kurzem erworben oder vor der Verwendung gewaschen und getrocknet wurde, um eine hinreichende Reduzierungswirkung zu gewährleisten. Wenn der Test nicht mit einer Glove-Box (Nummer 12 Buchstabe j) durchgeführt wird, sollte die Konzentration des Natriumsulfids in der Stammlösung (von 1 g/l) auf 2 g/l erhöht werden. Natriumsulfid kann bis zu einer Endkonzentration von 0,2 g/l auch aus einer geeigneten Stammlösung durch das Septum der verschlossenen Testflaschen injiziert werden, weil dadurch das Oxidationsrisiko reduziert wird. Alternativ kann Titan-(III)-citrat (Nummer 17 Buchstabe b) verwendet werden. Die Chemikalie bis zu einer Endkonzentration von 0,8 bis 1,0 mmol/l durch das Septum der verschlossenen Testflaschen injizieren. Titan-(III)-citrat ist ein hochwirksames Reduziermittel mit geringer Toxizität, das wie folgt hergestellt wird: 2,94 g Trinatriumcitrat-Dihydrat in 50 ml sauerstofffreiem Verdünnungswasser (Nummer 14) lösen (resultierende Konzentration = 200 mmol/l); danach 5 ml einer Titan-(III)-chlorid- Lösung (15 g/100 l Verdünnungswasser) hinzugeben. Den pH-Wert mit Natriumcarbonat auf 7 ± 0,5 neutralisieren und die Lösung unter einem Stickstoff-Gasstrom in eine geeignete Serumflasche geben. Die Konzentration des Titan-(III)-citrats in dieser Stammlösung beträgt 164 mmol/l. Das Prüfmedium entweder umgehend verwenden oder höchstens einen Tag lang bei einer Temperatur von 4 °C lagern.
A.12 b) 10-fach konzentriertes Prüfmedium, hergestellt aus:
| wasserfreiem Kaliumdihydrogenphosphat (KH2PO4) | 2,7 g |
| Dinatriumhydrogenphosphat (Na2HPO4) | 4,4 g |
| (oder 11,2 g Dodecahydrat) | 5,3 g |
| Ammoniumchlorid (NH4Cl) | |
| Calciumchlorid-Dihydrat (CaCl2 2H2O) | 0,75 g |
| Magnesiumchlorid-Hexahydrat (MgCl2 6H2O) | 1,0 g |
| Eisen(II)-Chloridtetrahydrat (FeCl2 4H2O) | 0,2 g |
| Resazurin (Redoxindikator) | 0,01 g |
| Natriumsulfid-Nonahydrat (Na2S.9H2O) | 1,0 g |
| (oder Titan-(III)-citrat) Endkonzentration | 0,8 mmol/l bis 1,0 mmol/l |
| Spurenelementelösung (siehe Nummer 17 Buchstabe c; A.13) | 10,0 ml |
| Hefeextrakt | 100 g |
In Verdünnungswasser lösen (Nummer 14) und auf 1.000 ml auffüllen.
A.13 c) Spurenelementelösung, hergestellt aus:
| Mangan-(II)-chlorid-Tetrahydrat (MnCl2.4H2O) | 0,5 g |
| Orthoborsäure (H3BO3) | 0,05 g |
| Zinkchlorid (ZnCl2) | 0,05 g |
| Kupfer-(II)-chlorid (CuCl2) | 0,03 g |
| Natriummolybdat-Dihydrat (Na2MoO4.2H2O) | 0,01 g |
| Kobalt-(II)-chlorid-Hexahydrat (CoCl2.6H2O) | 1,0 g |
| Nickel-(II)-chlorid-Hexahydrat (NiCl2.6H2O) | 0,1 g |
| Dinatriumselenit (Na2SeO3) | 0,05 g |
| In Verdünnungswasser lösen (Nummer 14) und auf 1.000 ml auffüllen.' |
A.14 Nummer 25: Vorversuch
Ein Vorversuch, wie unter Nummer 24 beschrieben, ist unerlässlich; allerdings sollte die Feststoffkonzentration des Schlamms ein Hundertstel der dort genannten Konzentration betragen (d. h. 0,1g/l, 0,2g/l und 0,4g/l). Die Inkubation sollte mindestens 7 Tage dauern.
Hinweis: Im Ringtest (5) war das Volumen des Kopfraums mit 75 % des Gesamtvolumens erheblich zu groß; es sollte im empfohlenen Bereich von 10 bis 40 % liegen. Das Volumen des Kopfraums sollte so gewählt werden, dass die produzierte Gasmenge bei einer Hemmung von etwa 80 % noch mit annehmbarer Genauigkeit (z.B. ± 5 bis ± 10 %) gemessen werden kann.
A.15 Nummern 26 bis 30: Zugabe der Prüfchemikalie, des Inokulums und des Substrats
Die Zugabe erfolgt wie unter den genannten Nummern beschrieben; die Substratlösung (Nummer 17) wird jedoch durch das Prüfmedium mit dem Hefeextrakt-Substrat ersetzt (A.11).
Außerdem wird die Endkonzentration der trockenen Schlammfeststoffe von 2-4 g/l auf 0,2 ± 0,05 g/l (A.9) reduziert. Tabelle A.1 enthält zwei Beispiele für die Zugabe von Bestandteilen zum Prüfgemisch; diese Tabelle ersetzt die Tabelle unter Nummer 29.
A.16 Nummer 33: Inkubation der Flaschen
Da eine geringere Gasproduktion zu erwarten ist, sollte die Inkubationsdauer auf mindestens 7 Tage verlängert werden.
A.17 Nummer 34: Druckmessungen
Die Messung des Drucks im Kopfraum der Flaschen erfolgt nach dem unter Nummer 34 beschriebenen Verfahren, wenn die Mengenangaben in der gasförmige Phase benötigt werden. Sollen die CO2- plus CH4- Gesamtmengen gemessen werden, zunächst den pH-Wert der flüssigen Phase auf etwa pH 2 reduzieren, indem H3PO4 in die jeweiligen Flaschen injiziert wird; anschließend nach 30-minütigem Schütteln bei Testtemperatur der Druck messen. Mehr Informationen zur Qualität des Inokulums können allerdings ermittelt werden, indem der Druck in den einzelnen Flaschen vor und nach der Reduzierung des pH-Werts gemessen wird. Wenn beispielsweise die CO2-Produktionrate erheblich über der Methan-Produktionsrate liegt, kann dies die Empfindlichkeit der fermentativen Bakterien verändern und/oder die Prüfchemikalie wirkt vor allem auf methanogene Bakterien.
A.18 Nummer 36: Messung des pH-Werts
Wenn H3PO4 verwendet werden soll, sind speziell für die pH-Messungen einige zusätzliche Flaschen ohne H3PO4 vorzubereiten.
Madsen, T, Rasmussen, H.B., und Nilsson, L. (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Dänische Umweltagentur, Kopenhagen.
Tabelle A.1. Versuchspläne für Testchargen - Beispiele
| Bestandteile des Reaktionsgemischs | Beispiel 1 | Beispiel 2 | Normale Reihenfolge der Zugabe |
| Konzentration des präparierten Inokulums (g/l) | 0,42 | 2,1 | - |
| Volumen des zugegebenen Inokulums (ml) | 45 | 9 | 4 |
| Konzentration des Inokulums in den Testflaschen (g/l) | 0,20 | 0,20 | - |
| Volumen des zugegebenen Prüfmediums (ml) | 9 | 9 | 2 |
| Volumen des zugegebenen Verdünnungswassers (ml) | 36 | 72 | 3 |
| Konzentration des Hefeextrakts in den zu Testflaschen (g/l) | 9,7 | 9,7 | - |
| Volumen der Stammlösung mit der Prüfchemikalie (ml) | 3 | 3 | 1 |
| Gesamtflüssigkeitsvolumen (ml) | 93 | 93 | - |
| Begriffsbestimmungen | Anlage 5 |
Chemikalie: ein Stoff oder ein Gemisch.
Prüfchemikalie: ein beliebiger Stoff oder ein beliebiges Gemisch, der bzw. das nach dieser Methode geprüft wird.
 | weiter. |  |
...
X
⍂
↑
↓
