umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (42)
 | zurück |
C.41. Fish Sexual Development Test (Test zur Geschlechtsentwicklung bei Fischen) 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 234 (2011). Sie beruht auf dem 1998 gefassten Beschluss, neue Prüfmethoden zur Untersuchung und zum Testen von Stoffen mit potenziell endokriner Wirkung zu entwickeln bzw. bestehende Methoden zu aktualisieren. Der Test zur Geschlechtsentwicklung bei Fischen - Fish Sexual Development Test (FSDT) - wurde als viel versprechende Methode zur Berücksichtigung eines empfindlichen Stadiums im Lebenszyklus von Fischen bewertet, die gleichermaßen auf östrogen und auf androgen wirkende Chemikalien anspricht. Die Prüfmethode wurde in den Jahren 2006 bis 2010 einem Ringtest unterzogen, in dem Japanische Reiskärpflinge (Oryzias latipes), Zebrabärblinge (Danio rerio) und Dreistachlige Stichlinge (Gasterosteus aculeatus) vollständig und Dickkopfelritzen (Pimephales promelas) teilweise validiert wurden (41)(42)(43). Das hier beschriebene Protokoll umfasst Japanische Reiskärpflinge (Medakas), Dreistachlige Stichlinge und Zebrabärblinge. Das Protokoll ist im Prinzip eine Verlängerung der OECD-Prüfrichtlinie 210, Fish, Early Life Stage Toxicity Test (FELS-Test) (1); die Exposition wird fortgesetzt, bis die sexuelle Differenzierung erfolgt ist, d. h. bei Japanischen Reiskärpflingen, bei Dreistachligen Stichlingen und bei Zebrabärblingen etwa 60 Tage nach dem Schlüpfen (wobei die Expositionsdauer bei anderen künftig zu validierenden Arten noch länger oder kürzer sein kann); außerdem werden endokrinsensitive Endpunkte einbezogen. Im FSDT werden Wirkungen in frühen Lebensstadien und potenzielle nachteilige Folgen mutmaßlich endokrin wirkender Chemikalien (z.B. Östrogene, Androgene und Steroidogenese-Inhibitoren) auf die Geschlechtsentwicklung beurteilt. Aufgrund der Kombination der beiden wesentlichen endokrin relevanten Endpunkte (der VTG-Konzentration und des phänotypischen Geschlechterverhältnisses) kann die Wirkungsweise der Prüfchemikalie ermittelt werden. Wegen der populationsrelevanten Änderung des phänotypischen Geschlechterverhältnisses kann der FSDT zur Gefahren- und Risikobewertung verwendet werden. Wenn der Test allerdings zur Gefahren- oder Risikobewertung durchgeführt wird, dürfen keine Stichlinge verwendet werden, weil die bislang verfügbaren Validierungsdaten gezeigt haben, dass bei dieser Art ohnehin nur selten durch die Prüfchemikalien induzierte Änderungen des phänotypischen Geschlechterverhältnisses auftreten.
2. Gemäß dem Prüfprotokoll werden die Fische in der für die Geschlechtsentwicklung labilen Phase, in der die Fische wahrscheinlich am empfindlichsten auf Chemikalien mit endokriner Wirkung reagieren, über das Wasser Chemikalien ausgesetzt, die Einfluss auf ihre Geschlechtsentwicklung haben. Zwei wichtige Endpunkte werden als Indikatoren für mit endokrinen Wirkungen verbundene Entwicklungsstörungen bewertet: die VTG- Konzentration und das Geschlechterverhältnis; die betreffenden Daten werden durch histologische Gonadenuntersuchungen ermittelt. Histopathologische Gonadenuntersuchungen (Bewertung und Bestimmung des Entwicklungsstadiums von Oozyten und von Spermatogenesezellen) können zusätzlich durchgeführt werden. Außerdem wird möglichst eine Bestimmung des genetischen Geschlechts vorgenommen (z.B. bei Japanischen Reiskärpflingen und bei Dreistachligen Stichlingen). Die Tatsache, dass ein Marker für die Bestimmung des genetischen Geschlechts verfügbar ist, stellt insoweit einen erheblichen Vorteil dar, als sie die Aussagekraft der Statistiken zum Geschlechterverhältnis erhöht und die Erkennung einer phänotypischen Geschlechtsumkehr bei einzelnen Exemplaren ermöglicht. Weitere ebenfalls zu messende apikale Endpunkte sind die Schlupfrate, die Überlebensrate, die Länge und das Körpergewicht. Die Prüfmethode kann an andere Arten als die oben genannten angepasst werden, wenn diese Arten einer Validierung entsprechend der Validierung für den Japanischen Reiskärpfling, den Dreistachligen Stichling und den Zebrabärbling unterzogen werden, wenn die Kontrollfische am Ende des Tests sexuell differenziert sind, wenn die VTG-Werte hinreichend hoch sind, um signifikante auf die betreffende Chemikalie zurückzuführende Variationen zu erkennen und wenn die Empfindlichkeit des Prüfsystems mit Referenzchemikalien mit endokriner Wirkung ((Anti-)Östrogene, (Anti-) Androgene, Aromatasehemmer usw.) nachgewiesen wurde. Außerdem müssen sämtliche Validierungsberichte, die auf FSDT-Daten anderer Arten Bezug nehmen, von der OECD geprüft worden sein. Wenn diese Voraussetzungen erfüllt sind, ist das Ergebnis der Validierung als zufriedenstellend zu betrachten.
Ausgangserwägungen und Einschränkungen
3. Vitellogenin (VTG) wird gewöhnlich in der Leber weiblicher oviparer Vertebraten infolge des im Blutkreislauf zirkulierenden endogenen Östrogens produziert (2). VTG ist eine Vorstufe verschiedener Eidotter-Proteine und bewegt sich, einmal in der Leber produziert, durch die Blutbahn bis zum Ovar, wo es aufgenommen und unter Entwicklung von Eiern modifiziert wird. Die VTG-Synthese erfolgt auch bei unreifen Fischen und bei adulten Männchen, wenn auch in sehr beschränktem Umfang, ist aber nachweisbar. Die Leber kann VTG aber auch aufgrund einer exogenen Östrogenstimulation synthetisieren und sekretieren (3)(4)(5).
4. Die Messung der VTG-Konzentration ermöglicht den Nachweis von Chemikalien mit östrogener, anti- östrogener und androgener Wirkung und die Erkennung von Chemikalien, die die Steroidogenese beeinträchtigen (beispielsweise Aromatasehemmer). Der Nachweis östrogener Chemikalien kann über die VTG- Induktion bei männlichen Fischen erfolgen und wurde in peer reviewed wissenschaftlichen Veröffentlichungen umfassend dokumentiert. Außerdem wurde eine VTG-Induktion infolge der Exposition gegenüber aromatisierbaren Androgenen nachgewiesen (6)(7). Eine Reduktion des im Blutkreislauf weiblicher Tiere zirkulierenden Östrogens beispielsweise durch Hemmung der Aromatase, die endogene Androgene in natürliches öströgenes 17β-Östradiol umwandelt, bewirkt eine Verringerung der VTG-Konzentration. Anhand dieser Reduzierung der VTG-Konzentration können Chemikalien mit Aromatase hemmender Wirkung oder Steroidogenese-Inhibitoren im Allgemeinen nachgewiesen werden (33). Die biologische Relevanz der VTG- Reaktion aufgrund einer Östrogen-/Aromatasehemmung wurde nachgewissen und umfassend dokumentiert (8) (9). Allerdings kann die VTG-Produktion bei weiblichen Tieren auch durch eine allgemeine Toxizität und durch toxische Wirkungsweisen unabhängig vom endokrinen System beeinträchtigt werden.
5. Mehrere Messverfahren wurden entwickelt und für die regelmäßige Verwendung standardisiert, um die VTG-Konzentration im Blut, in der Leber, im gesamten Körper oder in Homogenatproben aus dem Kopf-/Schwanzgewebe einzelner Exemplare zu quantifizieren. Dies gilt für Zebrabärblinge, Dreistachlige Stichlinge und Japanische Reiskärpflinge, aber auch für die nur teilweise validierte Dickkopfelritze. Zur Bestimmung der VTG-Konzentration können auch artspezifische, auf Immunchemie gestützte ELISA-Verfahren (ELISA = Enzyme- Linked Immunosorbent Assay) verwendet werden (5)(10)(11)(12)(13)(14)(15)(16). Bei Japanischen Reiskärpflingen und bei Zebrabärblingen besteht eine ausgeprägte Korrelation zwischen der im Blutplasma, in der Leber und in Homogenatproben gemessenen VTG-Konzentration, wenn auch Homogenate allerdings leicht niedrigere Werte als Plasmabestimmungen (17)(18)(19) ergeben. In Anlage 5 werden empfohlene Verfahren zur Probenahme für VTG-Analysen beschrieben.
6. Die Änderung des phänotypischen Geschlechterverhältnisses ist ein Endpunkt für eine Geschlechtsumkehr. Grundsätzlich können Östrogene, Antiöstrogene, Androgene, Antiandrogene und die Steroidogenese hemmende Chemikalien das Geschlechterverhältnis bei in der Entwicklung befindlichen Fischen beeinträchtigen (20). Es wurde nachgewiesen, dass diese Geschlechtsumkehr nach der Exposition gegenüber einer östrogenen Chemikalie bei Zebrabärblingen teilweise reversibel ist (21); eine Geschlechtsumkehr infolge der Exposition gegenüber einer androgenen Chemikalie ist hingegen irreversibel (30). Die Geschlechter werden erfasst als weiblich, männlich, intersexuell (in einer Gonade sowohl Oozyten als auch Spermatogenesezellen) oder nicht differenziert jeweils bezogen auf ein einzelnes Exemplar und ermittelt durch histologische Untersuchung der Gonaden. Nähere Informationen sind Anlage 7 sowie dem OECD Guidance Document on the Diagnosis of Endocrine-Related Histopathology of Fish Gonads (22) zu entnehmen.
7. Das genetische Geschlecht wird mit genetischen Markern untersucht - soweit diese bei der jeweiligen Fischart vorkommen. Bei Japanischen Reiskärpflingen sind die beiden X-Chromosome (bei weiblichen Tieren) bzw. das X- und das Y-Chromosom (bei männlichen Tieren) durch Polymerase-Kettenreaktion (PCR) nachweisbar, oder das männliche Determinationsgen DMY kann wie in den Quellen (23) und (24) beschrieben analysiert werden (DMY negativ oder positiv). Beim Dreistachligen Stichling kann das genetische Geschlecht durch ein entsprechendes PCR-Verfahren bestimmt werden (siehe Anlage 10). Wenn das genetische Geschlecht individuell dem phänotypischen Geschlecht zugeordnet werden kann, hat der Test eine höhere Aussagekraft; entsprechend sollte bei Arten mit dokumentierten Markern für das genetische Geschlecht auch eine Bestimmung des genetischen Geschlechts vorgenommen werden.
8. Die endokrine Wirksweise einer Chemikalie lässt sich durch eine Kombination der beiden wesentlichen endokrin relevanten Endpunkte (die VTG-Konzentration und das Geschlechterverhältnis) nachweisen (Tabelle1). Das Geschlechterverhältnis ist ein populationsbezogener Biomarker (25)(26), und bei einigen gut definierten Wirkungsweisen können die Ergebnisse eines Fish Sexual Development Test (FSDT) für die Gefahren- und Risikobewertung verwendet werden, wenn die zuständige Behörde diesen Ansatz als geeignet betrachtet. Diese Wirkungsweisen sind bei Östrogenen, Androgenen und bei Steroidogenesehemmern gegeben.
Tabelle 1: Reaktion der endokrin relevanten Endpunkte auf unterschiedliche Wirkungsweisen von Chemikalien
↑ = zunehmend, ↓ = abnehmend, __ = nicht untersucht
| Wirkungsmechanismus | VTG 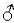 | VTG 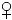 | Geschlechterverhältnis | Quellen |
| Schwacher Östrogenagonist | ↑ | ↑ | ↑ 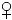 oder ↑ nicht diff. oder ↑ nicht diff. | (27) (40) |
| Starker Östrogenagonist | ↑ | ↑ | ↑ 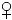 oder ↑ nicht diff., oder ↑ nicht diff.,kein 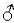 | (28) (40) |
| Östrogenantagonist | - | - | ↓ 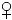 , ↑ nicht diff. , ↑ nicht diff. | (29) |
| Androgenagonist | ↓ oder __ | ↓ oder __ | ↑ 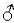 , kein , kein  | (28) (30) |
| Androgenantagonist | - | - | ↑  intersex. | (31) |
| Aromatasehemmer | ↓ | ↓ | ↓ | (33) |
9. Im FSDT wird die Reproduktionsphase im Lebenszyklus der Fische nicht berücksichtigt; daher sind Chemikalien, bei denen der Verdacht besteht, dass sie bereits in geringeren Konzentrationen als bei der Geschlechtsentwicklung die Reproduktionsfähigkeit beeinträchtigen, einem Reproduktionstest zu unterziehen.
10. Begriffsbestimmungen im Zusammenhang mit dieser Prüfmethode sind Anlage 1 zu entnehmen.
11. Mit dem Invivo-FSDT sollen Chemikalien mit androgenen und östrogenen Eigenschaften sowie Antiandrogene, Antiöstrogene und die Steroidogenese hemmende Chemikalien nachgewiesen werden. Beim FSDT wurden in den Validierungsphasen (1 und 2) östrogene, androgene und die Steroidogenese hemmende Chemikalien berücksichtigt. Die Wirkung von Östrogen- und Androgenantagonisten im FSDT wird in Tabelle 1 dargestellt; die entsprechenden Wirkmechanismen sind aber gegenwärtig noch nicht umfassend dokumentiert.
12. In der Prüfung werden Fische aus frisch befruchteten Eiern bis zum Abschluss der Geschlechtsdifferenzierung mindestens drei Konzentrationen der in Wasser gelösten Prüfchemikalie ausgesetzt. Wenn die Verfügbarkeit bzw. die Beschaffenheit (z.B. eine begrenzte Löslichkeit) der Prüfchemikalie dies zulassen, wird der Test in einem Durchflusssystem vorgenommen. Die Prüfung beginnt mit dem Einsetzen frisch befruchteter Eier (vor dem Blastula-Stadium) in die Versuchsbecken. Wie das Einsetzen in die Versuchsbecken erfolgt, wird in Nummer 27 für die verschiedenen Arten beschrieben. Bei den validierten Fischarten japanischer Reiskärpfling, Dreistachliger Stichling und Zebrabärbling) wird die Prüfung 60 Tage nach dem Schlüpfen beendet. Am Ende der Prüfung werden alle Fische getötet. Für die VTG-Analyse wird von jedem Fisch eine Probe von biologischem Material (Blutplasma oder Leber oder Kopf-/Schwanz-Homogenat) entnommen; der verbleibende Teil der Fische wird zur histologischen Gonadenuntersuchung zur Bestimmung des phänotypischen Geschlechts fixiert. Optional kann eine histopathologische Untersuchung vorgenommen werden (z.B. Entwicklungsstadium der Gonaden oder Grad der Intersexualität). Bei Arten mit geeigneten Markern (siehe Anlagen 9 und 10) wird zur Bestimmung des genetischen Geschlechts eine Probe von biologischem Material (Schwanz- oder Rückenflosse) genommen.
13. Anlage 2 bietet einen Überblick über die Prüfbedingungen der validierten Arten japanischer Reiskärpfling, Dreistachliger Stichling und Zebrabärbling).
Informationen zur Prüfchemikalie
14. Ergebnisse einer Prüfung der akuten Toxizität oder eines sonstigen kurzzeitigen Toxizitätstests (z.B. Prüfmethode C.14 (34) und OECD-Prüfrichtlinie 210 (1)), vorzugsweise für die in diesem Test verwendete Art, sollten vorliegen. Dafür müssen die Wasserlöslichkeit und der Dampfdruck der Prüfchemikalie bekannt und eine zuverlässige Analysemethode zur quantitativen Erfassung der Chemikalie in den Versuchsbecken mit bekannter und dokumentierter Genauigkeit und Nachweisgrenze verfügbar sein.
15. Weitere hilfreiche Informationen sind die Strukturformel, die Reinheit der Chemikalie, die Stabilität in Wasser und die Lichtbeständigkeit, pKa, Pow und die Ergebnisse einer Prüfung auf leichte biologische Abbaubarkeit (Prüfmethode C.4) (35).
Validitätskriterien
16. Die Prüfergebnisse sind dann akzeptabel, wenn folgende Bedingungen erfüllt sind:
- Die Konzentration an gelöstem Sauerstoff liegt während der gesamten Prüfung mindestens bei 60 % des Luftsauerstoff-Sättigungswerts.
- Die Wassertemperaturen der Versuchsbecken dürfen sich während der Expositionsdauer zu keinem Zeitpunkt um mehr als ± 1,5 °C unterscheiden und müssen in dem Temperaturbereich liegen, der für die jeweils im Test zu verwendenden Arten vorgesehen ist (Anlage 2);
- eine validierte Methode zur Analyse der Prüfchemikalie mit einer Nachweisgrenze deutlich unter der niedrigsten nominellen Konzentration muss verfügbar sein, und es müssen hinreichende Belege dafür vorliegen, dass die Konzentrationen der Prüfchemikalie in der Lösung im Bereich von ± 20 % der mittleren Messwerte aufrechterhalten wurden;
- insgesamt muss die Anzahl der überlebenden befruchteten Eier in den Kontrollen sowie ggf. in den Lösungsmittelkontrollen mindestens mit den in Anlage 2 genannten Grenzwerten übereinstimmen;
- die Validitätskriterien im Zusammenhang mit dem Wachstum und dem Geschlechterverhältnis am Ende des Tests beruhen auf Daten der Kontrollgruppen (gepoolte Lösungsmittel- und Wasserkontrollen bzw. - wenn beide sich erheblich unterscheiden - ausschließlich der Lösungsmittelkontrolle):
| Japanischer Reiskärpfling | Zebrabärbling | Dreistachliger Stichling | ||
| Wachstum | Feuchtmasse der Fische, trockengetupft | > 150 mg | > 75 mg | > 120 mg |
| Länge (Standardlänge) | > 20 mm | > 14 mm | > 20 mm | |
| Geschlechterverhältnis (% männliche oder weibliche Tiere) | 30-70 % | 30-70 % | 30-70 % | |
- Ein verwendetes Lösungsmittel darf keine statistisch signifikante Wirkung auf das Überleben und keine endokrine oder in sonstiger Weise beeinträchtigende Wirkung auf die frühen Lebensstadien haben; dass diese Wirkungen nicht zu erwarten sind, ist anhand einer Lösungsmittelkontrolle nachzuweisen.
Wenn eine Abweichung von den Annahmekriterien des Tests festgestellt wird, sind die Konsequenzen im Hinblick auf die Zuverlässigkeit der Testdaten zu prüfen; die Ergebnisse dieser Prüfung sind in den Bericht aufzunehmen.
Versuchsbecken
17. Für den Test können beliebige Becken aus Glas, Edelstahl oder sonstigem chemisch inertem Material verwendet werden. Die Kammern müssen so groß bemessen sein, dass die im Folgenden genannten Besatzkriterien erfüllt werden. Vorzugsweise werden die Versuchsbecken im Prüfbereich randomisiert aufgestellt. Eine randomisierte Aufstellung, bei der jeweils sämtliche Konzentrationen in jedem Block enthalten sind, ist gegenüber einer vollständig randomisierten Aufstellung zu bevorzugen. Die Versuchsbecken sind gegen unerwünschte Störungen abzuschirmen.
Auswahl der im Test zu verwendenden Art
18. In Anlage 2 werden empfohlene Fischarten genannt. Die Verfahren zur Einbeziehung neuer Arten werden in Nummer 2 erläutert.
Haltung der Elternfische
19. Nähere Informationen zur Haltung der Elternfische sind der OECD-Prüfrichtlinie 210(1) zu entnehmen. Die Elternfische sind ein- oder zweimal täglich mit geeignetem Futter zu versorgen.
Handhabung von Embryos und Larven
20. Zunächst können Embryos und Larven in einer Hauptkammer mit kleineren Glas- oder Edelstahlkammern ausgesetzt werden, die seitlich oder auf den Stirnseiten mit einem Sieb versehen sind, damit die Prüfchemikalie hindurchströmen kann. Um einen nicht verwirbelnden Strom durch diese kleinen Versuchsbecken zu erzeugen, können die Becken an einem Arm aufgehängt werden, mit dem sie angehoben und abgesenkt werden; die Organismen befinden sich dabei ständig unter Wasser.
21. Wenn Eibehälter, Gitter oder Siebe verwendet wurden, um die Eier im Haupt-Versuchsbecken zu halten, sind die Behälter, Gitter oder Siebe nach dem Schlüpfen der Larven zu entfernen, es sei denn die Behälter werden benötigt, um ein Verlassen der Fische aus dem großen Behälter zu verhindern. Wenn die Larven umgesetzt werden, dürfen sie nicht mit der Umgebungsluft in Berührung kommen, und die Fische dürfen nicht mit einem Netz aus den Eierbehältern entnommen werden. Wann und ob überhaupt eine Umsetzung erfolgt, hängt von der jeweiligen Art ab.
Wasser
22. Als Testwasser ist jedes Wasser geeignet, in dem die im Test verwendete Art unter kontrollierten Bedingungen nachweislich mindestens ebenso gut wie in dem in Anlage 3 beschriebenen Wasser überlebt. Während der gesamten Testdauer muss eine konstante Wasserqualität aufrechterhalten werden. Um sicherzustellen, dass das Wasser die Testergebnisse nicht unangemessen beeinträchtigt (indem es beispielsweise mit der Prüfchemikalie reagiert) oder dass das Wasser sich nicht auf das Verhalten des Zuchtbestands auswirkt, sind regelmäßig Proben zu nehmen. Zu messen sind der gesamte organisch gebundene Kohlenstoff (TOC), die Leitfähigkeit, der pH- Wert und die suspendierten Feststoffe, beispielsweise alle drei Monate, wenn das Wasser bekanntermaßen von verhältnismäßig konstanter Qualität ist. Bei zweifelhafter Wasserqualität müssen die Anteile an Schwermetallen (z.B. Cu, Pb, Zn, Hg, Cd und Ni) sowie an wichtigen Anionen und Kationen (z.B. Ca2+, mg2+, Na+, K+, Cl- und SO4 2-) und Pestiziden gemessen werden. Nähere Informationen zu chemischen Analysen und zur Entnahme des Wassers sind Nummer 34 zu entnehmen.
Prüflösungen
23. Nach Möglichkeit sollten Durchflusssysteme verwendet werden. Für Durchflusstests wird für die Versorgung der Versuchsbecken mit unterschiedlichen Konzentrationen ein System benötigt, das kontinuierlich eine Stammlösung der Prüfchemikalie abgibt und verdünnt (z.B. eine Dosierpumpe, ein Proportionalverdünner oder eine Sättigungsvorrichtung). Die Durchflussraten von Stammlösungen und Wasser sind während des Tests regelmäßig zu prüfen und dürfen während des Tests höchstens um 10 % schwanken. Ein Durchfluss entsprechend mindestens fünf Becken-Volumina in 24 Stunden hat sich als angemessen erwiesen (1). Leitungen aus Kunststoff oder aus sonstigen Materialien, die zum Teil biologisch aktive Chemikalien enthalten oder die Prüfchemikalie adsorbieren können, sind zu vermeiden.
24. Die Stammlösung wird vorzugsweise ohne Lösungsmittel hergestellt, indem die Prüfchemikalie einfach mechanisch (z.B. durch Rühren oder mit Ultraschall) in das Wasser gemischt wird. Wenn die Prüfchemikalie in Wasser schwer löslich ist, wird verfahren, wie im OECD Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures beschrieben (36). Der Einsatz von Lösungsmitteln sollte vermieden werden, ist aber unter Umständen in Einzelfällen erforderlich, um eine Stammlösung von geeigneter Konzentration zu erzielen. In (36) werden einige geeignete Lösungsmittel genannt.
25. Semistatische Testbedingungen sollten vermieden werden, wenn keine zwingenden Gründe im Zusammenhang mit der jeweiligen Prüfchemikalie (Stabilität, eingeschränkte Verfügbarkeit, hohe Kosten oder Risiken usw.) gegeben sind. Bei semistatischen Tests können zwei unterschiedliche Verfahren zur Erneuerung des Wassers verwendet werden. Entweder werden neue Testlösungen in sauberen Kammern hergestellt, und die überlebenden Eier und Larven werden vorsichtig in die neuen Kammern umgesetzt, oder die Testorganismen werden in den Versuchsbecken belassen, und ein Teil des Testwassers (mindestens zwei Drittel) wird täglich erneuert.
Expositionsbedingungen
Entnahme der Eier und Dauer der Prüfung
26). Um einen Bias durch genetische Effekte zu vermeiden, werden für den Beginn des Tests Eier von mindestens drei Brutpaaren oder Gruppen entnommen, gemischt und zufällig ausgewählt. Bei Dreistachligen Stichlingen ist die Beschreibung der künstlichen Befruchtung in Anlage 11 zu beachten. Der Test sollte möglichst bald nach der Befruchtung der Eier beginnen; die Embryos werden vorzugsweise vor dem Blastula-Stadium oder zumindest möglichst bald nach diesem Stadium und spätestens 12 h nach der Befruchtung in die Testlösungen eingesetzt. Der Test wird fortgesetzt, bis die Geschlechtsdifferenzierung in der Kontrollgruppe abgeschlossen ist (bei Japanischen Reiskärpflingen, Dreistachligen Stichlingen und Zebrabärblingen 60 Tage nach dem Schlüpfen).
Besatz
27. Zu Beginn des Tests müssen mindestens 120 befruchtete Eier pro Konzentration auf mindestens 4 Replikate verteilt werden. (Eine Aufteilung auf die Kontrollen nach dem Quadratwurzelgesetz von Penrose ist annehmbar.) Die Eier werden randomisiert (mithilfe statistischer Tabellen) auf die verschiedenen Konzentrationen verteilt. Die Besatzrate (Begriffsbestimmung siehe Anlage 1) muss so gering sein, dass ein Gehalt an gelöstem Sauerstoff von mindestens 60 % des Luftsauerstoff-Sättigungswerts ohne direkte Belüftung der Kammern aufrechterhalten werden kann. Bei Durchflusstests ist eine Besatzrate von 0,5 g/l in 24 Stunden und ständig höchstens 5 g/l Lösung zu empfehlen. Spätestens 28 Tage nach der Befruchtung sind die Fische so auf die einzelnen Replikate umzuverteilen, dass die Replikate jeweils möglichst genau die gleiche Anzahl an Fischen enthalten. Wenn es zu expositionsbedingter Mortalität kommt, ist die Anzahl der Replikate entsprechend zu reduzieren, damit die Besatzdichte immer möglichst einheitlich ist.
Licht und Temperatur
28. Die Photoperiode und die Wassertemperatur müssen auf die jeweilige Testspezies abgestimmt sein. (Zu den Versuchsbedingungen des FSDT siehe Anlage 2.)
Fütterung
29). Die Futterqualität und die Bereitstellung des Futters sind von entscheidender Bedeutung; für jedes Entwicklungsstadium muss das richtige Futter in den richtigen Intervallen und in hinreichender Menge angeboten werden, damit die Tiere sich normal entwickeln können. Die Fütterung erfolgt ad libitum; ein Überangebot sollte aber möglichst vermieden werden. Um ein hinreichendes Wachstum zu ermöglichen, müssen die Fische mindestens zweimal (bzw. an Wochenenden auch nur einmal) täglich gefüttert werden; zwischen den Fütterungszeiten sollten jeweils mindestens drei Stunden liegen. Nicht verzehrtes Futter und Kot sind gegebenenfalls zu entfernen, damit sich keine Verunreinigungen ansammeln. Mit zunehmender praktischer Erfahrung werden Futterqualität und Fütterungszeiten kontinuierlich optimiert, um bestmögliche Überlebens- und Wachstumsbedingungen zu erzielen. Daher müssen anerkannte Fachleute das vorgeschlagene Fütterungsprotokoll bestätigen. 24 Stunden vor Ende des Tests ist die Fütterung einzustellen. In Anlage 2 werden einige Beispiele für geeignetes Futter genannt (siehe auch OECD-Rahmenleitlinien für Fischtests) (39).
Prüfkonzentrationen
30. Die Prüfchemikalien sind in den in Anlage 4 genannten Konzentrationen zu verwenden. Bei mindestens vier Replikaten sind mindestens drei Prüfkonzentrationen zu verwenden. Die Kurve der LC50-Werte im Verhältnis zur Expositionsdauer in den verfügbaren akuten Toxizitätstests ist bei der Auswahl des Spektrums der Prüfkonzentrationen zu berücksichtigen. Wenn die Daten zur Risikobewertung verwendet werden sollen, werden fünf Prüfkonzentrationen empfohlen.
31). Konzentrationen von mehr als 10 % des LC50-Werts für akute Toxizität bei adulten Tieren bzw. von mehr als 10 mg/l brauchen nicht geprüft zu werden. (Maßgeblich ist der jeweils niedrigere Wert.) Die maximale Prüfkonzentration sollte bei 10 % des LC50-Wertes für die Larven/juvenilen Tiere liegen.
Kontrollgefäße
32. Zusätzlich zu den Prüfkonzentrationen werden eine Kontrolle mit Wasser (≥ 4 Replikate) sowie gegebenenfalls eine Lösungsmittelkontrolle (≥ 4 Replikate) benötigt. Im Test sind ausschließlich Lösungsmittel zu verwenden, die nachweislich keine statistisch signifikante Wirkung auf die Endpunkte des Tests haben.
33. Wenn ein Lösungsmittel verwendet wird, darf die Endkonzentration nicht mehr als 0,1 ml/l (36) betragen; außerdem muss die Konzentration in allen Versuchsbecken mit Ausnahme der Kontrolle mit dem Wasser gleich sein. Allerdings sollte die Verwendung der Lösungsmittel möglichst unbedingt vermieden werden, und die Konzentrationen der Lösungsmittel sollten auf ein Minimum begrenzt werden.
Häufigkeit der analytischen Bestimmungen und Messungen
34. Vor Beginn des Tests ist durch chemische Analysen der Konzentrationen der Prüfchemikalie zu prüfen, ob die Validitätskriterien erfüllt sind. Alle Replikate sind zu Beginn und am Ende des Tests einzeln zu analysieren. Pro Prüfkonzentration wird während der Testdauer mindestens einmal wöchentlich ein Replikat analysiert; dabei sind die Replikate regelmäßig abzuwechseln (1, 2, 3, 4, 1, 2...). Wenn Proben für eine Analyse zu einem späteren Zeitpunkt aufbewahrt werden, muss die Methode zur Lagerung der Proben zuvor validiert worden sein. Um sicherzustellen, dass die zu analysierende Chemikalie tatsächlich vollständig gelöst ist, sind die Proben zu filtern (z.B. mit einer Porengröße von 0,45 µm) oder zu zentrifugieren.
35. Während des Tests werden der gelöste Sauerstoff, der pH-Wert, die Gesamthärte, die Leitfähigkeit, der Salzgehalt (soweit von Bedeutung) und die Temperatur in allen Becken gemessen. Der Anteil an gelöstem Sauerstoff, der Salzgehalt (soweit von Bedeutung) und die Temperatur sind mindestens wöchentlich und der pH-Wert, die Leitfähigkeit und die Härte jeweils zu Beginn und am Ende des Tests zu messen. Die Temperatur sollte vorzugsweise in mindestens einem Prüfgefäß kontinuierlich überwacht werden.
36). Die Ergebnisse sollten auf gemessene Konzentrationen bezogen werden. Wenn die Konzentration der gelösten Prüfchemikalie während der gesamten Testdauer zufriedenstellend aufrechterhalten wurde (± 20 % der nominellen Konzentration), können auch die Nennwerte oder die gemessenen Werte zugrunde gelegt werden.
Beobachtungen und Messungen
Embryonale Entwicklungsstadien
37. Die Exposition beginnt möglichst bald nach der Befruchtung, vor dem Balstula -Stadium und spätestens 12 h nach der Befruchtung, damit eine Exposition auch bereits im frühen Embryonalstadium gegeben ist.
Schlupfrate und Überlebensrate
38. Mindestens einmal täglich wird geprüft, ob Jungtiere geschlüpft sind und wie viele noch leben; die entsprechenden Zahlen werden protokolliert. Tote Embryos, Larven und juvenile Fische sind möglichst zu entfernen, nachdem sie bemerkt wurden; sonst könnten sie sich rasch zersetzen und unter Einwirkung der übrigen Fische zerstört werden. Beim Entfernen toter Tiere ist mit höchster Sorgfalt vorzugehen, damit andere Eier bzw. Larven (die äußerst empfindlich sind) nicht durch Stöße oder auf sonstige Weise mechanisch beschädigt werden. Je nach Lebensstadium gibt es unterschiedliche Kriterien für die Mortalität:
- Eier: insbesondere in den frühen Stadien eine ausgeprägte Verringerung der Lichtdurchlässigkeit sowie Farbänderungen durch Koagulation und/oder ausgefällte Proteine und entsprechend weißliches und opakes Aussehen der Eier;
- Larven und juvenile Fische: Unbeweglichkeit und/oder Fehlen von Atembewegungen und/oder Herzschlägen und/oder opake weiße Verfärbung des zentralen Nervensystems und/oder fehlende Reaktion auf mechanische Reize.
Anomales Aussehen
39. Die Anzahl der Larven oder Fische mit anomaler Körperform ist zu protokollieren; außerdem ist die Art der Anomalität zu beschreiben. Anomale Embryos und Larven kommen auch natürlich vor und können in den Kontrollen bei einigen Arten im Bereich von mehreren Prozent liegen. Anomale Tiere sind erst nach dem Tod aus den Becken zu entfernen. Nach Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere sind diese Tiere jedoch wie in Nummer 44 beschrieben zu betäuben und zu töten, wenn die Anomalien, Schmerzen, Leiden oder Stressbelastung oder anhaltende Schäden zur Folge haben und der Tod der Tiere zuverlässig absehbar ist; in der Datenanalyse sind die Tiere dann als gestorben zu behandeln.
Anomales Verhalten
40. Festgestellte Anomalien (z.B. Hyperventilation, unkoordiniertes Schwimmverhalten, untypisch ruhiges Verhalten und untypisches Fressverhalten) sind zu protokollieren.
Gewicht
41. Am Ende des Tests werden alle überlebenden Fische getötet (betäubt, wenn Blutproben genommen werden müssen); anschließend wird jeweils die Feuchtmasse (trockengetupft) gemessen.
Länge
42. Am Ende des Tests ist die Länge (Standardlänge) der einzelnen Fische zu messen.
43. Aufgrund dieser Beobachtungen können die folgenden Daten teilweise oder vollständig in den Berichten erfasst werden:
- kumulative Mortalität;
- Anzahl gesunder Fische am Ende des Tests;
- Dauer des Schlupfprozesses (Beginn und Ende);
- Länge und Gewicht der überlebenden Tiere;
- Anzahl der Larven mit Fehlbildungen;
- Anzahl der Fische mit Verhaltensauffälligkeiten.
Entnahme von Fischen
44. Das Beproben der Fische wird am Ende des Tests durchgeführt. Die Fische werden z.B. mit MS-222 (100- 500 mg/l gepuffert mit 200 mg NaHCO3/l) oder mit FA-100 (4-Allyl-2-methoxyphenol: Eugenol) getötet und einzeln gemessen und gewogen (Feuchtmasse, trockengetupft) bzw. betäubt, wenn eine Blutprobe genommen werden soll (siehe Nummer 49).
Probenahme für die VTG-Analyse und für die Geschlechtsbestimmung durch histologische Untersuchung
45. Zur Probenahme sind alle Fische zu entnehmen und für die VTG-Analyse und die Geschlechtsbestimmung vorzubereiten. Zur Geschlechtsbestimmung werden alle Fische histologisch untersucht. Für die VTG-Messungen ist eine Teilprobe von mindestens 16 Fischen aus den einzelnen Replikaten annehmbar. Wenn die Ergebnisse der Teilproben sich als nicht eindeutig herausstellen, ist eine größere Anzahl an Fischen einer VTG-Analyse zu unterziehen.
46. Die Verfahren zur Probenahme für VTG-Analysen und Geschlechtsbestimmungen hängen von der jeweils eingesetzten Methode zur VTG-Analyse ab:
VTG-Analyse mit der Kopf-/Schwarz-Homogenat-Methode
47. Die Fische werden getötet. Kopf und Schwanz werden jeweils durch Schnitte unmittelbar hinter den Brustflossen und unmittelbar hinter der Rückenflosse mit einem scharfen Skalpell vom Körper getrennt (siehe Abbildung 1). Köpfe und Schwänze der Fische werden gepoolt, gewogen, einzeln nummeriert, in flüssigem Stickstoff gefroren und bei mindestens - 70 °C zur VTG-Analyse aufbewahrt. Der Körper der Fische wird ebenfalls nummeriert und in einer geeigneten Fixierlösung zur histologischen Untersuchung fixiert (22). Bei dieser Methode wird jedes einzelne Exemplar einer VTG-Analyse und einer histopathologischen Untersuchung unterzogen; eine mögliche Änderung des VTG-Wertes kann dann in Beziehung zum phänotypischen oder zum genotypischen Geschlecht (Japanischer Reiskärpfling und Dreistachliger Stichling) gesetzt werden. Weitere Informationen sind den Leitlinien zur Homogenisierung (Anlage 5) sowie den Leitlinien für eine quantitative Bestimmung des VTG-Wertes (Anlage 6) zu entnehmen.
VTG-Analyse mit der Leber-Homogenat-Methode
48. Die Fische werden getötet. Die Leber wird herauspräpariert und bei mindestens - 70 °C gelagert. Empfohlene Verfahren zum Herauspräparieren und zur Vorbehandlung der Leber sind OECD-Prüfrichtlinie 229 (37) oder OECD-Prüfrichtlinie 230 zu entnehmen (38). Anschließend werden die Lebern einzeln homogenisiert, wie in den OECD-Prüfrichtlinien 229 oder 230 beschrieben. Der Überstand wird zur VTG-Messung mit einem homologen ELISA-Verfahren entnommen. (Ein Beispiel für die quantitative Bestimmung bei Zebrabärblingen wird in Anlage 6 beschrieben; die quantitative Bestimmung beim Japanischen Reiskärpfling wird in der OECD- Prüfrichtlinie 229 (37) erläutert.) Bei diesem Verfahren können auch Daten zu einzelnen Fischen sowohl aus der VTG-Analyse als auch aus der histologischen Gonadenuntersuchung ermittelt werden.
VTG-Analyse mit der Blutplasma-Methode
49. Den betäubten Fischen wird mit einer Herzpunktion oder durch einen Schnitt in die Schwanzvene oder in den Schwanz Blut entnommen; das Blut wird zur Plasmagewinnung bei 4 °C zentrifugiert. Bis zur Verwendung wird das Plasma bei mindestens - 70 °C gelagert. Die Fische werden getötet und zur histologischen Untersuchung fixiert. Die Plasmaproben und die Fische werden einzeln nummeriert, um VTG-Konzentrationen dem Geschlecht der Fische zuordnen zu können.
Abbildung 1 Sezieren der Fische zur VTG-Messung an einem Kopf-/Schwanz-Homogenat und zur histologischen Analyse des mittleren Abschnitts

Bestimmung des genetischen Geschlechts
50. Von einzelnen Fischen von Arten mit geeigneten Markern wird eine biologische Probe zur Bestimmung des genetischen Geschlechts entnommen. Bei Japanischen Reiskärpflingen werden die Afterflosse und die Rückenflosse verwendet. Eine detaillierte Beschreibung einschließlich Erläuterungen zur Entnahme von Gewebeproben und zur Geschlechtsbestimmung mit einem PCR-Verfahren (PCR = Polymerase-Kettenreaktion) ist Anlage 9 zu entnehmen. Die Entnahme von Gewebeproben und die Geschlechtsbestimmung durch PCR bei Dreistachligen Stichlingen werden in Anlage 10 beschrieben.
VTG-Messung
51. Die Messung der VTG-Konzentration muss auf einer quantitativen und einer analytisch validierten Methode bestehen. Informationen zur Intra- und Inter-Assay-Variabilität der Methode sollten verfügbar sein. Ursache der Intra- und Inter-Assay-Variabilität sind (sehr wahrscheinlich) die verschiedenen Entwicklungsstadien der Fischpopulation. Angesichts der Variabilität bei den VTG-Messungen sind allein mit diesem Endpunkt ermittelte NOECs mit erheblicher Vorsicht zu bewerten. Die Bewertung der VTG-Produktion bei der in diesem Test berücksichtigten Fischart kann auf unterschiedliche Weise erfolgen. Ein sowohl verhältnismäßig empfindliches als auch hinreichend spezifisches Messverfahren besteht in der Bestimmung von Proteinkonzentrationen mit einem ELISA-Verfahren (ELISA = Enzyme-Linked Immuno Sorbent Assay). Im Test sind homologe Antikörper (gebildet gegen VTG der jeweiligen Art) sowie die wichtigsten homologen Standards zu verwenden.
Geschlechtsbestimmung
52. Je nach Probenahmeverfahren bei VTG-Bestimmungen wird der gesamte Fisch oder der verbleibende mittlere Abschnitt der einzelnen Fische in eine bereits gekennzeichnete Bearbeitungskassette gelegt und in einer geeigneten Lösung zur histologischen Geschlechtsbestimmung (sowie optional auch zur Bewertung des Entwicklungszustands der Gonaden) fixiert. Nähere Informationen zum Fixieren und zum Einbetten sind Anlage 7 sowie dem OECD Guidance Document on the Diagnosis of Endocrine-Related Histopathology of Fish Gonads (22) zu entnehmen. Nach der Vorbereitung wird der Fisch in Paraffinblöcke eingebettet. Die einzelnen Tiere sind der Länge nach in einen Paraffinblock zu legen. Von jedem Fisch werden mindestens sechs Längsschnitte (mit einer Stärke von 3-5 µm) in der Frontalebene einschließlich des Gewebes aus beiden Gonaden hergestellt. Diese Schnitte sollten im Abstand von etwa 50 µm bei männlichen Tieren und von 250 µm bei weiblichen Tieren erfolgen. Da jeder Block häufig sowohl männliche als auch weibliche Tiere enthält (wenn in einen Block mehrere Fische eingebettet wurden), sollte der Abstand zwischen den einzelnen Schnitten etwa 50 µm betragen, bis von jedem männlichen Exemplar mindestens sechs Schnitte aus dem Gonadengewebe hergestellt wurden. Anschließend kann der Abstand zwischen den Schnitten bis auf etwa 250 µm bei weiblichen Fischen erhöht werden. Die Schnitte werden mit Hämatoxylin und Eosin angefärbt und unter einem Lichtmikroskop unter schwerpunktmäßiger Berücksichtigung des Geschlechts (männlich, weiblich, intersexuell oder nicht differenziert) untersucht. Eine Intersexualität ist dann festzustellen, wenn bei sechs analysierten Schnitten in den Hoden mehr als ein Oozyt erkannt wird, oder wenn in den Ovarien Spermatogenesezellen nachgewiesen werden (ja/nein). Die histopathologische Untersuchung und die Bewertung des Entwicklungsstadiums von Ovarien und Hoden ist fakultativ; wenn eine Untersuchung vorgenommen wird, müssen die Ergebnisse statistisch analysiert und im Bericht erfasst werden. Bei einigen Fischarten sind die Gonadenpaare von Natur aus nicht vollständig entwickelt; diese Fische verfügen vielleicht nur über eine einzelne Gonade (z.B. Japanische Reiskärpflinge und gelegentlich Zebrabärblinge). Die entsprechenden Beobachtungen sind zu protokollieren.
53. Zur Bestimmung des genetischen Geschlechts bei einzelnen Japanischen Reiskärpflingen wird geprüft, ob das männliche Determinationsgen DMY auf dem Y-Chromosom vorhanden ist. Das genotypische Geschlecht der Reiskärpflinge kann durch Sequenzieren des DMY-Gens aus DNA bestimmt werden, die beispielsweise aus einem Stück der After- oder der Rückflosse gewonnen wurde. Unabhängig vom Phänotyp kennzeichnet das DMY-Gen die männlichen Tiere (XY); entsprechend ist das Fehlen des DMY-Gens unabhängig vom Phänotyp als Beleg für das Vorliegen eines weiblichen Tieres (XX) anzunehmen (23). Leitlinien zur Präparation der Gewebe und zur PCR-Methode sind Anlage 9 zu entnehmen. Die Bestimmung des genetischen Geschlechts bei einzelnen Dreistachligen Stichlingen erfolgt mit einer PCR-Methode (siehe Anlage 10).
54. Eine festgestellte Intersexualität (Begriffsbestimmung siehe Anlage 1) ist im Bericht zu vermerken.
Sekundäre Geschlechtsmerkmale
55. Sekundäre Geschlechtsmerkmale werden bei Arten wie dem Japanischen Reiskärpfling hormonell gesteuert. Daher ist am Ende der Expositionsdauer möglichst auch das physische Aussehen der Fische zu prüfen. Bei Japanischen Reiskärpflingen reagiert die Papillenbildung im hinteren Teil der Afterflosse bei Weibchen androgensensitiv. In diesem Anhang enthält Kapitel C.37 (38) Fotos sekundärer männlicher Geschlechtsmerkmale und maskulinisierter Weibchen.
Auswertung der Ergebnisse
56. Wichtig ist, dass der Endpunkt mit dem gültigen statistischen Test mit der höchsten Aussagekraft bestimmt wird. Die Replikate werden jeweils als Versuchseinheit behandelt; Variabilität innerhalb eines Replikats ist in den statistischen Tests zu berücksichtigen. Anlage 8 enthält ein Flussdiagramm, das die Auswahl des angesichts der Merkmale der zu ermittelnden Daten jeweils am besten geeigneten statistischen Tests erleichtern soll. Das Signifikanzniveau beträgt für alle Endpunkte 0,05.
Geschlechterverhältnisse und genetisches Geschlecht
57. Bei einer monotonen Dosis-Wirkungs-Beziehung sind die Geschlechterverhältnisse mit dem Jonckheere- Terpstra-Test (Trend-Test) im Hinblick auf signifikante Expositionswirkungen zu analysieren (NOEC-/LOEC- Ansatz). Wenn keine Monotonie festgestellt wird, kann ein paarweiser Test durchgeführt werden. Der Dunnett- Test ist bei Normalverteilung und Varianzhomogenität vorzunehmen. Bei heterogener Varianz wird der Tamhane-Dunnett-Test durchgeführt. Ansonsten ist der Exakt Mann-Whitney-Test mit Anpassung nach Bonferroni-Holm vorzunehmen. Anlage 8 enthält ein Flussidagramm mit statistischen Angaben zu den Geschlechterverhältnissen. Die Geschlechterverhältnisse sind tabellarisch als Konzentrationsverhältnisse ± Standardabweichung der männlichen, weiblichen, intersexuellen und nicht differenzierten Tiere darzustellen. Die statistische Signifikanz ist besonders hervorzuheben. Beispiele sind dem Validierungsbericht über den FSDT Phase 2 zu entnehmen (42). Das genetische Geschlecht ist als Prozentanteil der Umwandlung des phänotypischen Geschlechts bei männlichen, weiblichen, intersexuellen und nicht differenzierten Tieren zu protokollieren.
VTG-Konzentrationen
58. VTG-Konzentrationen sind auf signifikante Expositionswirkungen zu untersuchen (NOEC-/LOEC-Ansatz). Der Dunnett-Test ist dem t-Test mit Bonferroni-Korrektur vorzuziehen. Wenn eine Bonferroni-Korrektur vorgenommen wird, ist eine Anpassung nach Bonferroni-Holm vorzuziehen. Zur Erzielung einer Normalverteilung und der nötigen Varianzhomogenität wird eine Log-Transformation der VTG-Werte vorgesehen. Wenn dann eine monoton ansteigende Dosis-Wirkungsbeziehung festgestellt werden kann, sollte anstelle aller oben genannten Tests der Jonckheere-Terpstra-Test vorgenommen werden. Wenn t-Tests oder der Dunnett-Test durchgeführt werden, können die folgenden Schritte ausgeführt werden, ohne im Rahmen einer ANOVA zunächst einen F-Test zur Prüfung auf Signifikanz durchzuführen. Nähere Informationen sind Anlage 8 zu entnehmen. Die Ergebnisse werden in einer Tabelle als mittlere Konzentrationen ± Standardabweichung für männliche, weibliche, intersexuelle und nicht differenzierte Fische getrennt dargestellt. Die statistische Signifikanz phänotypischer Weibchen und phänotypischer Männchen ist besonders hervorzuheben. Beispiele sind dem Validierungsbericht über den FSDT Phase 2 zu entnehmen (42).
Tatsächliche Konzentrationen der Prüfchemikalie
59. Die tatsächlichen Konzentrationen der Prüfchemikalie in den Aquarien sind in den in Nummer 34 genannten Intervallen zu bestimmen. Die Ergebnisse werden in Tabellen als mittlere Konzentration ± Standardabweichung bezogen auf die Replikate sowie bezogen auf Konzentrationen unter Angabe der Anzahl der Proben erfasst; Ausreißer gegenüber der mittleren Prüfkonzentration ± 20 % sind besonders hervorzuheben. Beispiele sind dem Validierungsbericht über den FSDT Phase 2 zu entnehmen (42).
Interpretation der Ergebnisse
60. Die Testergebnisse sind mit Vorsicht zu bewerten, wenn sich die gemessenen Konzentrationen der Prüfchemikalie in Testlösungen in der Nähe der Nachweisgrenze der jeweiligen Analysemethode bewegen.
Prüfbericht
61. Das Prüfprotokoll enthält die folgenden Informationen:
Prüfchemikalie
- relevante physikalisch-chemische Merkmale; chemischer Name; Daten u. a. zur Reinheit und zur Analysemethode zur Quantifizierung der Prüfchemikalie.
Prüfbedingungen
- verwendetes Testverfahren (z.B. Durchfluss, semistatisch oder Erneuerung); Prüfprotokoll einschließlich Prüfkonzentrationen, Methode zur Herstellung der Stammlösungen (in einem Anhang), Häufigkeit der Erneuerung (wenn verwendet, sind das Lösungsmittel und die Konzentration des Lösungsmittels anzugeben);
- die nominellen Prüfkonzentrationen, die Mittelwerte der gemessenen Werte und die jeweiligen Standardabweichungen in den Becken sowie die Methode zur Ermittlung dieser Werte (die verwendete Analysemethode ist in einem Anhang zu beschreiben); Nachweise dafür, dass sich die Messungen der Konzentrationen auf die vollständig gelöste Prüfchemikalie beziehen;
- Wasserqualität in den Becken; pH-Wert, Härte, Temperatur und Anteil des gelösten Sauerstoffs;
- detaillierte Angaben zur Fütterung (z.B. Art des Futters, Herkunft, Menge und Häufigkeit der Fütterung sowie gegebenenfalls Analysen auf Verunreinigungen (z B. PCB, PAH und chlororganische Pestizide)).
Ergebnisse
- Belege dafür, dass die Kontrollen die Validitätskriterien erfüllt haben: Daten zur Schlupfrate sind in Tabellen als Prozentanteile pro Replikat und pro Konzentration anzugeben. Ausreißer bezogen auf die Validitätskriterien (in den Kontrollen) sind besonders hervorzuheben. Die Überlebensrate ist als Prozentanteil pro Replikat und pro Konzentration anzugeben. Ausreißer bezogen auf die Validitätskriterien (in den Kontrollen) sind besonders hervorzuheben.
- klare Angaben der ermittelten Ergebnisse zu den verschiedenen Endpunkten: Überlebensrate der Embryos und Schlupfrate; äußerliche Anomalien; Länge und Gewicht; VTG-Messungen (ng/g Homogenat, ng/ml Plasma oder ng/mg Leber); histologische Gonadenuntersuchung, Geschlechterverhältnis; Daten zum genetischen Geschlecht; ungewöhnliche Reaktionen der Fische sowie jegliche sichtbare Wirkungen der Prüfchemikalie.
62. Die Ergebnisse sind als Mittelwerte ± Standardabweichung (SD) bzw. Standardfehler anzugeben. Die Statistiken müssen mindestens die NOEC und die LOEC sowie die Konfidenzintervalle enthalten. Das statistische Flussdiagramm (Anlage 8) ist zu berücksichtigen.
(1) OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paris.
(2) Jobling, S., D. Sheahan, J.A. Osborne, P. Matthiessen und J.P. Sumpter, 1996, 'Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals', Environmental Toxicology and Chemistry 15, pp. 194-202.
(3) Sumpter, J.P., und S. Jobling, 1995, 'Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment' , Environmental Health Perspectives 103, S. 173-178.
(4) Tyler, C.R., R. van Aerle, T.H. Hutchinson, S. Maddix und H. Trip (1999), 'An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin', Environmental Toxicology and Chemistry 18, S. 337-347.
(5) Holbech, H., L. Andersen, G.I. Petersen, B. Korsgaard, K.L. Pedersen und P. Bjerregaard (2001a), 'Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)', Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, S. 119-131.
(6) Andersen, L., P. Bjerregaard und B. Korsgaard (2003), 'Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters', Fish Physiology and Biochemistry 28, S. 319- 321.
(7) Orn, S., H. Holbech, T.H. Madsen, L. Norrgren und G.I. Petersen (2003), 'Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone', Aquatic Toxicology 65, S. 397-411.
(8) Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla und C.R. Tyler (2002), 'Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances', Environmental Toxicology and Chemistry 21, S. 319-326.
(9) Sun, L.W., J.M. Zha, P.A. Spear und Z.J. Wang (2007), 'Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults', Comparative Biochemistry and Physiology C- Toxicology & Pharmacology 145, S. 533-541.
(10) Parks, L.G., A.O. Cheek, N.D. Denslow, S.A. Heppell, J.A. McLachlan, G.A. LeBlanc und C.V. Sullivan (1999), 'Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds', Comparative Biochemistry and Physiology C- Toxicology & Pharmacology 123, S. 113-125.
(11) Brion, F., B.M. Nilsen, J.K. Eidem, A. Goksoyr und J.M. Porcher (2002), 'Development and validation of an enzymelinked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)', Environmental Toxicology and Chemistry 21, S. 1699-1708.
(12) Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara und E. Tamiya (2002), 'Development and application of a monoclonal antibodybased sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin', Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, S. 161-169.
(13) Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James und B.E. Bengtsson (2004), 'The juvenile three- spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption - II - kidney hypertrophy, vitellogenin and spiggin induction', Aquatic Toxicology 70, S. 311-326.
(14) Tatarazako, N., M. Koshio, H. Hori, M. Morita und T. Iguchi (2004), 'Validation of an enzymelinked immunosorbent assay method for vitellogenin in the medaka', Journal of Health Science 50, S. 301-308.
(15) Eidem, J.K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson und A. Goksoyr (2006), 'Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology', 78, S. 202-206.
(16) Jensen, K.M., und G.T. Ankley (2006), 'Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)', Ecotoxicology and Environmental Safety 64, S. 101-105.
(17) Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L., und Bjerregaard, P (2001b), 'Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)', Nordic Council of Ministers, TemaNord 2001:597, S. 48-51.
(18) Nilsen, B.M., K. Berg, J.K. Eidem, S.I. Kristiansen, F. Brion, J.M. Porcher und A. Goksoyr (2004), 'Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening', Analytical and Bioanalytical Chemistry 378, S. 621-633.
(19) Orn, S., S. Yamani und L. Norrgren (2006), 'Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alphaethinylestradiol and 17 beta- trenbolone', Archives of Environmental Contamination and Toxicology 51, S. 237-243.
(20) Scholz, S., und N. Kluver (2009), 'Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development 3', S. 136-151.
(21) Fenske, M., G. Maack, C. Schafers und H. Segner (2005), 'An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio', Environmental Toxicology and Chemistry 24, S. 1088-1098.
(22) OECD (2010), Guidance Document on the Diagnosis of Endocrinerelated Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paris.
(23) Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, und Y. Nagahama (2004), 'Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes', Developmental Dynamics 231, S. 518-526.
(24) Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi und M. Sakaizumi (2004), 'Field survey of sexreversals in the medaka, Oryzias latipes: genotypic sexing of wild populations', Zoological Science 21, S. 613-619.
(25) Kidd, K.A., P.J. Blanchfield, K.H. Mills, V.P. Palace, R.E. Evans, J.M. Lazorchak und R.W. Flick (2007), 'Collapse of a fish population after exposure to a synthetic estrogen', Proceedings of the National Academy of Sciences of the United States of America 104, S. 8897-8901.
(26) Palace,V.P., R.E. Evans, K.G. Wautier, K.H. Mills, P.J. Blanchfield, B.J. Park, C.L. Baron und K.A. Kidd (2009), 'Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake', Canadian Journal of Fisheries and Aquatic Sciences 66, S. 1920-1935.
(27) Panter, G.H., T.H. Hutchinson, K.S. Hurd, J. Bamforth, R.D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno und C. R. Tyler (2006), 'Development of chronic tests for endocrine active chemicals - Part 1. An extended fish early- life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)', Aquatic Toxicology 77, S. 279-290.
(28) Holbech, H., K. Kinnberg, G.I. Petersen, P. Jackson, K. Hylland, L. Norrgren und P. Bjerregaard (2006), 'Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)', Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, S. 57-66.
(29) Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard und P. Bjerregaard (2004), 'Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an antiestrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)' , Fish Physiology and Biochemistry 30, S. 257- 266.
(30) Morthorst, J.E., H. Holbech und P. Bjerregaard (2010), 'Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations', Aquatic Toxicology 98, S. 336-343.
(31) Kiparissis,Y., T.L. Metcalfe, G.C. Balch, and C.D. Metcalf (2003), 'Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)', Aquatic Toxicology 63, S. 391-403.
(32) Panter, G.H., T.H. Hutchinson, K.S. Hurd, A. Sherren, R.D. Stanley und C.R. Tyler (2004), 'Successful detection of (anti-) androgenic and aromatase inhibitors in prespawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development', Aquatic Toxicology 70, S. 11-21.
(33) Kinnberg, K., H. Holbech, G.I. Petersen und P. Bjerregaard (2007), 'Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)', Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, S. 165-170.
(34) Kapitel C.14 dieses Anhangs, Wachstumstest an Jungfischen.
(35) Kapitel C.4 in diesem Anhang, Leichte biologische Abbaubarkeit.
(36) OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Paris.
(37) OECD (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Paris.
(38) Kapitel C.37 in diesem Anhang, 21-Tage-Fischtest: eine Kurzzeitprüfung auf Östrogen- und Androgenaktivität und auf Aromatasehemmung.
(39) OECD (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Paris
(40) Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), 'Concentration- and time- dependent effects of the synthetic estrogen, 17 alphaethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio' Journal of Toxicology and Environmental Health-Part A, 70, 9-10, S 768-779.
(41) OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paris.
(42) OECD (2011), Validation Report (Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paris.
(43) OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paris.
(44) Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere. ABl. Nr. L 276 vom 20.10.2010 S. 33.
| Abkürzungen und Begriffsbestimmungen | Anlage 1 |
Apikaler Endpunkt: Punkt, an dem eine Wirkung auf Populationsebene verursacht wird.
ASV: Air Saturation Value (Luftsauerstoff-Sättigungswert)
Biomarker: Punkt, an dem eine Wirkung auf individueller Ebene verursacht wird.
Chemikalie: ein Stoff oder ein Gemisch
Dph: Days post hatch (Tage nach dem Schlüpfen)
DMY: Y-spezifisches Determinationsgen; wichtig für die Entwicklung männlicher Japanischer Reiskärpflinge
ELISA: Enzyme-Linked Immunosorbent Assay
Fischmasse: Feuchtmasse der Fische, trockengetupft
FSDT: Fish Sexual Development Test
HPG-Achse: Hypothalamus-Hypophysen-Gonaden-Achse
Intersexueller Fisch: Fisch mit mehr als einem Oozyten in den Hoden bei 6 analysierten Schnitten bzw. mit Spermatogenesezellen in den Ovarien (ja/nein)
Besatzrate: Feuchtmasse eines Fischs pro Wasservolumen
MOA: Mode Of Action (Wirkmechanismus)
RT-PCR: Reverse Transcriptase Polymerase Chain-Reaction (Reverse Transkriptase-Polymerase-Kettenreaktion)
Prüfchemikalie: Stoff oder Gemisch, der/das mit dieser Prüfmethode getestet wird.
Nicht differenzierter Fisch: Fisch mit Gonaden ohne identifizierbare (männlich/weiblich) Keimzellen.
VTG: Vitellogenin
| Versuchtsbedingungen des FSDT (Süsswasser-Arten) | Anlage 2 |
| 1. Empfohlene Arten | Japanischer Reiskärpfling (Oryzias latipes) | Zebrabärbling (Danio rerio) | Dreistachliger Stichling (Gasterostreus aculeatus) |
| 2. Prüftyp | Durchfluss oder semista- tisch: | Durchfluss oder semistatisch: | Durchfluss oder semistatisch: |
| 3. Wassertemperatur | 25 ± 2 °C | 27 ± 2 °C | 20 ± 2 °C |
| 4. Beleuchtung | Leuchtstofflampen (breites Spektrum) | Leuchtstofflampen (breites Spektrum) | Leuchtstofflampen (breites Spektrum) |
| 5. Lichtintensität | 10-20 µE/m2/s, 540-1.080 lx, oder 50-100 ft-c (Werte für Laborumgebung) | 10-20 µE/m2/s, 540-1.080 lx, oder 50-100 ft-c (Werte für Laborumgebung) | 10-20 µE/m2/s, 540-1.080 lx, oder 50-100 ft-c (Werte für Laborumgebung) |
| 6. Photoperiode | 12-16 h Licht, 8-12 h Dunkelheit | 12-16 h Licht, 8-12 h Dunkelheit | 16 h Licht, 8 h Dunkelheit |
| 7. Mindestgröße der Aquarien | Die einzelnen Aquarien müssen ein Fassungsvermögen von mindestens 7 l haben. | Die einzelnen Aquarien müssen ein Fassungsvermögen von mindestens 7 l haben. | Die einzelnen Aquarien müssen ein Fassungsvermögen von mindestens 7 l haben. |
| 8. Erneuerung der Prüflösungen (im Durchfluss) | Mindestens 5-mal täglich | Mindestens 5-mal täglich | Mindestens 5-mal täglich |
| 9. Alter der Prüforganismen bei Beginn der Exposition | Frisch befruchtete Eier (frühes Blastula-Stadium) | Frisch befruchtete Eier (frühes Blastula-Stadium) | Frisch befruchtete Eier |
| 10. Anzahl der Eier pro Behandlung | Mind. 120 | Mind. 120 | Mind. 120 |
| 11. Anzahl der Behandlungen | Mind. 3 (sowie entsprechende Kontrollen) | Mind. 3 (sowie entsprechende Kontrollen) | Mind. 3 (sowie entsprechende Kontrollen) |
| 12. Anzahl der Replikate pro Behandlung | Mind. 4 (wenn keine Aufteilung auf die Kontrollen nach dem Quadratwurzelgesetz von Penrose vorgenommen wird) | Mind. 4 (wenn keine Auftei- lung auf die Kontrollen nach dem Quadratwurzelgesetz von Penrose vorgenommen wird) | Mind. 4 (wenn keine Aufteilung auf die Kontrollen nach dem Quadratwurzelgesetz von Penrose vorgenommen wird) |
| 13. Fütterungsprotokoll | Lebende Artemia, tiefgefrorene adulte Salinenkrebse, Flockenfutter usw., möglichst zweimal täglich | Spezielle Jungfische, lebende Artemia, tiefgefrorene adulte Salinenkrebse, Flockenfutter usw., möglichst zweimal täglich | Lebende Artemia, tiefgefrorene adulte Salinenkrebse, Flockenfutter usw., möglichst zweimal täglich |
| 14. Belüftung | Keine, wenn der Gehalt an gelöstem Sauerstoff nicht unter eine Sättigung von 60 % fällt | Keine, wenn der Gehalt an gelöstem Sauerstoff nicht unter eine Sättigung von 60 % fällt | Keine, wenn der Gehalt an gelöstem Sauerstoff nicht unter eine Sättigung von 70 % fällt |
| 15. Wasser | Sauberes Oberflächen- oder Brunnenwasser oder rekonstituiertes Wasser | Sauberes Oberflächen- oder Brunnenwasser oder rekonstituiertes Wasser | Sauberes Oberflächen- oder Brunnenwasser oder rekonstituiertes Wasser |
| 16. Dauer der Exposition gegenüber der Prüfchemikalie | 60 Tage nach dem Schlüpfen | 60 Tage nach dem Schlüpfen | 60 Tage nach dem Schlüpfen |
| 17. Biologische Endpunkte | Schlupfrate, Überlebensrate, Gesamtmorphologie, VTG histologische Gonadenunter- suchungen, genetisches Ge- schlecht, Geschlechterver- hältnis | Schlupfrate, Überlebensrate, Gesamtmorphologie, VTG histologische Gonadenunter- suchungen, Geschlechterver- hältnis | Schlupfrate, Überlebensrate, Gesamtmorphologie, VTG histologische Gonadenuntersuchungen, Geschlechterverhältnis |
| 18. Validitätskriterien der Prüfung bei gepoolten Replikaten der Kontrollen | Schlupfrate > 80 % | Schlupfrate > 80 % | Schlupfrate > 80 % |
| Überlebensrate nach dem Schlüpfen > | Überlebensrate nach dem Schlüpfen > | Überlebensrate nach dem Schlüpfen > | |
| Wachstum (Feuchtmasse der Fische, trockengetupft) > 150 mg | Wachstum (Feuchtmasse der Fische, trockengetupft) > 75 mg | Wachstum (Feuchtmasse der Fische, trockengetupft) > 120 mg | |
| Länge (Standardlänge) > 20 mm | Länge (Standardlänge) > 14 mm | Länge (Standardlänge) > 20 mm | |
| Geschlechterverhältnis (% männliche oder weibliche Fische) 30-70 % | Geschlechterverhältnis (% männliche oder weibliche Fische) 30-70 % | Geschlechterverhältnis (% männliche oder weibliche Fische) 30-70 % |
| Chemische Eigenschaften eines geeigneten Wassers | Anlage 3 |
| Bestandteile | Konzentration |
| Partikelmaterial | < 20 mg/l |
| Gesamtgehalt an organischen Kohlenstoffen | < 2 mg/l |
| Nichtionisiertes Ammonium | < 1 l µg |
| Restchlor | < 10 µg/l |
| Gesamtgehalt an phosphororganischen Pestiziden | < 50 ng/l |
| Gesamtgehalt an chlororganischen Pestiziden und polychloriertem Biphenylen | < 50 ng/l |
| Gesamtgehalt an organischem Chlor | < 25 ng/l |
| Aus Prüfmethode C.14 / Leitlinien zu Prüfkonzentrationen | Anlage 4 |
| Spalte (Anzahl der Konzentrationen zwischen 100 und 10 oder zwischen 10 und 1) * | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| 32 | 46 | 56 | 63 | 68 | 72 | 75 |
| 10 | 22 | 32 | 40 | 46 | 52 | 56 |
| 3,2 | 10 | 18 | 25 | 32 | 37 | 42 |
| 1,0 | 4,6 | 10 | 16 | 22 | 27 | 32 |
| 2,2 | 5,6 | 10 | 15 | 19 | 24 | |
| 1,0 | 3,2 | 6,3 | 10 | 14 | 18 | |
| 1,8 | 4,0 | 6,8 | 10 | 13 | ||
| 1,0 | 2,5 | 4,6 | 7,2 | 10 | ||
| 1,6 | 3,2 | 5,2 | 7,5 | |||
| 1,0 | 2,2 | 3,7 | 5,6 | |||
| 1,5 | 2,7 | 4,2 | ||||
| 1,0 | 1,9 | 3,2 | ||||
| 1,4 | 2,4 | |||||
| 1,0 | 1,8 | |||||
| 1,3 | ||||||
| 1,0 | ||||||
| *) Aus einer Spalte kann eine Reihe von drei (oder mehr) aufeinanderfolgenden Konzentrationen ausgewählt werden. Die Mittelpunkte zwischen den Konzentrationen in Spalte (x) sind Spalte (2x + 1) zu entnehmen. Die aufgeführten Konzentrationen können Volumen- oder Masseprozent (mg/l oder µg/l) darstellen. Die Werte können gegebenenfalls mit jeder beliebigen Zehnerpotenz multipliziert bzw. durch sie dividiert werden. Spalte 1 kann verwendet werden, wenn erhebliche Unsicherheit hinsichtlich des Toxizitätsgrads besteht. | ||||||
| Leitlinien zur Herstellung von Kopf- und Schwanz-Homogenaten von juvenilen Zebrabärblingen, Dickkopfelritzen, Dreistachligen Stichlingen und japanischen Reiskärpflingen | Anlage 5 |
In diesem Abschnitt werden die Verfahren vor der Quantifizierung der VTG-Konzentration beschrieben. Es können jedoch auch andere Verfahren eingesetzt werden, mit denen die VTG-Konzentration in vergleichbarer Weise quantifiziert werden kann. Mit diesem Verfahren kann die VTG-Konzentration auch in Blutplasma oder in Leberpräparaten (statt in Kopf- oder Schwanz-Homogenaten) bestimmt werden.
Verfahren
1. Die Fische werden betäubt und getötet, wie für den Test beschrieben.
2. Kopf und Schwanz der Fische werden abgeschnitten, wie im Test erläutert. Wichtig: Jeweils nach der Präparation eines Fischs sind die Sezierinstrumente und das Sezierbrett abzuwaschen und ordnungsgemäß zu reinigen (z.B. mit 96 %igem Ethanol), um VTG- 'Kontaminationen' bei weiblichen Fischen oder Kontaminationen von induzierten Männchen auf nicht induzierte Männchen zu vermeiden.
3. Das Gewicht der gepoolten Kopf- und Schwanz-Präparate der einzelnen Fische wird auf 1 mg genau gemessen.
4. Nach dem Wiegen werden die Präparate in geeignete Röhrchen (z.B. 1,5 ml Eppendorf) gegeben und bei - 80 ° C bis zur Homogenisierung gefroren oder unmittelbar mit zwei Kunststoff-Pistillen auf Eis homogenisiert. (Alternativ können auch andere Methoden verwendet werden, sofern sie auf Eis durchgeführt werden und eine homogene Masse entsteht.) Wichtig: Die Röhrchen sind ordnungsgemäß zu nummerieren, damit die Kopf- und Schwanz-Präparate der Fische für die histologische Gonadenuntersuchung dem jeweiligen Rumpf zugeordnet werden können.
5. Wenn die Masse homogen ist, wird die eisgekühlte Homogenisierungs-Pufferlösung * (das 4- bis 10-Fache des Gewebegewichts) hinzugegeben. (Der Verdünnungsfaktor ist zu protokollieren.) Das Präparat wird weiter mit den Pistillen bearbeitet, bis eine homogene Mischung entstanden ist. Wichtiger Hinweis: Für jeden Fisch ist ein frisches Pistill zu verwenden.
6. Die Proben werden bis zur Zentrifugierung (4 °C, 50.000 g, 30 Minuten) auf Eis gelegt.
7. Mit einer Pipette werden Anteile von 20-50 µl (Volumen protokollieren) des Überstands in mindestens zwei Röhrchen gefüllt, indem die Spitze der Pipette unter die Fettschicht des Überstands getaucht und der Überstand vorsichtig eingesaugt wird, ohne jedoch Fett- oder Pelletfraktionen aufzunehmen.
8). Die Röhrchen werden bis zur Verwendung bei - 80 °C gelagert.
_____
*) Homogenisierungs-Pufferlösung:
50)mM Tris-HCl pH 7,4; Proteasehemmer-Cocktail (1 %) (Sigma): 12 ml Tris-HCl pH 7,4 + 120 µl Proteasehemmer-Cocktail (oder entsprechende Proteasehemmer-Cocktails).TRIS: TRIS, ULTRA PURE (ICN)
Proteasehemmer-Cocktail: Sigma (Säugetiergewebe) Produktnummer P 8340.
Hinweis: Die Homogenisierungs-Pufferlösung ist am Tag der Herstellung zu verbrauchen. Während der Verwendung muss die Pufferlösung auf Eis gelegt werden.
| Leitlinien zur Bestimmung der Vitellogenin-Konzentration in Kopf- und Schwanz- Homogenaten von Zebrabärblingen (Danio rerio) (modifiziert nach Holbech et al., 2001); alternativ können auch andere Verfahren unter Verwendung homologer Antikörper und andere Standards angewendet werden. | Anlage 6 |
1. Mit 5 µg/ml Anti-Zebrabärbling-Lipovitellin-IgG beschichtete Mikrotiterplatten (zertifiziert Maxisorp F96, Nunc, Roskilde, Dänemark) werden aufgetaut und dreimal mit Waschpuffer gewaschen *.
2. Gereinigter Zebrabärblings-Vitellogenin-Standard 1 wird in einem Verdünnungspuffer ** seriell auf 0,2, 0,5, 1, 2, 5, 10 und 20 ng/ml verdünnt; anschließend werden die Proben nochmals mindestens 200-mal in einem Verdünnungspuffer verdünnt (um Matrixeffekte zu verhindern) und in die Platten gegeben. Außerdem werden duplizierte Assay-Kontrollen hergestellt. In die Vertiefungen werden jeweils 150 µl gefüllt. Die Standards werden dupliziert und die Proben tripliziert. Die Inkubation erfolgt über Nacht bei 4 °C in einer Schüttelvorrichtung.
3. Die Platten werden 5-mal mit Waschpuffer gewaschen *.
4. HRP gekoppelt an eine Dextrankette (z.B. AMDEX A/S, Dänemark) und konjugierte Antikörper werden im Waschpuffer verdünnt. Die Verdünnung ist je nach Charge und Alter unterschiedlich. In jede Vertiefung werden 150 µl gegeben; anschließend werden die Platten 1 Stunde bei Raumtemperatur in einer Schüttelvorrichtung inkubiert.
5. Die Platten werden fünfmal mit Waschpuffer * gewaschen; die Unterseite der Platten wird sorgfältig mit Ethanol gereinigt.
6. In die Vertiefungen werden jeweils 150 µl TMB plus *** gegeben. Die Platte ist mit Alufolie gegen Lichteinfall zu schützen; in einer Schüttelvorrichtung wird die Farbentwicklung beobachtet.
7. Wenn sich die Standardkurve vollständig entwickelt hat, wird die Enzymaktivität gestoppt, indem in die Vertiefungen jeweils 150 µl 0,2 M H2SO4 gegeben werden.
8. Die Absorption wird bei 450 nm gemessen (z.B. auf einem Photometer für Mikrotiterplatten (Molecular Devices Thermomax Microplate Reader). Die Daten werden mit der dazugehörigen Software (z.B. Softmax) analysiert.
_________________
*) Waschpuffer:
| PBS-Stammlösung **** | 500,0 ml |
| BSA | 5,0 g |
| Tween 20 | 5,0 ml |
Der pH-Wert wird auf 7,3 eingestellt; anschließend wird mit Millipore-H2O auf 5 l aufgefüllt. Die Proben werden bei 4 °C gelagert.
**) Verdünnungspuffer:
| PBS-Stammlösung **** | 10,0 ml |
| BSA | 30 g |
| 1 | 5,0 ml |
Der pH-Wert wird auf 7,3 eingestellt; anschließend wird mit Millipore-H2O auf 1 l aufgefüllt. Die Proben werden bei 4 °C gelagert.
***) TMB plus ist ein 'gebrauchsfertiges' Substrat von KemEnTec (Dänemark). Das lichtempfindliche Substrat wird bei 4 °C gelagert.
****) PBS-Stammlösung
| NaCl | 60,0 g |
| KH2PO4 | 40 g |
| Na2HPO4, 2H2O | 6,6 g |
| KCl | 4,0 g |
Der pH-Wert wird auf 6,8 eingestellt; anschließend wird mit Millipore-H2O auf 2 l aufgefüllt. Die Proben werden bei Raumtemperatur gelagert.
______
1) Battelle AP4.6.04 (1,18 mg/ml (AAA)), gereinigt nach Denslow, N.D., Chow, M.C., Kroll, K.J., Green, L. (1999). Vitellogenin as a biomarker of exposure for estrogen or estrogen mimics.
Ecotoxicology 8: 385-398.
| Leitlinien zur Präparation von Gewebeschnitten zur Geschlechtsbestimmung und zur Beurteilung des Stadiums der Gonadenentwicklung | Anlage 7 |
In diesem Abschnitt werden die Verfahren vor der Untersuchung der histologischen Schnitte beschrieben. Alternativ können auch andere Verfahren verwendet werden, mit denen eine Geschlechtsbestimmung vorgenommen und das Stadium der Gonadenentwicklung festgestellt werden kann.
Mit einigen wenigen Ausnahmen sind diese Verfahren bei Japanischen Reiskärpflingen (JMD = Japanische Medaka) und Zebrabärblingen (ZF = Zebrafish) ähnlich.
Tötung, Sektion und Gewebefixierung
Ziele:
1. Gewährleistung einer schmerzlosen Tötung der Fische;
2. Ermittlung der benötigten Körpergewichte und Durchführung der erforderlichen Messungen;
3. Beurteilung sekundärer Geschlechtsmerkmale;
4. Herstellung von Gewebesektionen für VTG-Analysen;
5. Fixierung der Gonaden;
Verfahren:
1. Die Fische sind unmittelbar vor der Sektion zu töten. Wenn nicht mehrere Prosektoren verfügbar sind, dürfen daher nicht mehrere Fische gleichzeitig getötet werden.
2. Mit dem kleinen Kescher wird ein Fisch aus der Versuchskammer entnommen und in einem Transportbehältnis in den Sektionsbereich gebracht.
3. Der Fisch wird in die Tötungslösung gesetzt. Wenn die Atmung zum Stillstand gekommen ist und der Fisch auf äußere Reize nicht mehr reagiert, wird der Fisch aus der Lösung genommen.
4. Danach wird die Feuchtmasse des Fischs ermittelt.
5. Für die Präparation der Gewebe zur VTG-Analyse kann der Fisch auf eine Korkplatte auf dem Tisch eines Präpariermikroskops gelegt werden.
- Bei Zebrabärblingen wird der Kopf unmittelbar hinter der Brustflosse und der Schwanz unmittelbar hinter der Rückenflosse abgeschnitten.
- Bei Japanischen Reiskärpflingen wird der Bauch mit einem sorgfältigen Schnitt entlang der Bauchmittellinie vom Schultergürtel bis zu einem Punkt unmittelbar kranial zum After aufgetrennt. Mit der kleinen Pinzette und mit einer kleinen Schere wird vorsichtig die Leber entnommen.
6. Proben für die VTG-Analyse werden in Eppendorf-Röhrchen gegeben und umgehend in flüssigem Stickstoff gefroren.
7. Der Fischkörper wird einschließlich der Gonaden in eine gekennzeichnete Gewebe-Kassette gelegt, die anschließend in eine Fixierlösung (Davidson oder Bouin) gestellt wird. Von der Fixierlösung wird mindestens das zehnfache Volumen des ungefähren Gewebevolumens benötigt. Das Behältnis mit der Fixierlösung wird fünf Sekunden lang vorsichtig geschüttelt, um Luftblasen vollständig aus der Kassette zu entfernen.
8. ...
- Alle Gewebe verbleiben über Nacht in der Davidson-Fixierlösung; am folgenden Tag werden sie in einzelne Behältnisse mit 10 %igem neutral gepuffertem Formalin gegeben. Die Behältnisse mit den Kassetten werden fünf Sekunden lang vorsichtig geschüttelt, um eine angemessene Durchdringung der Kassette mit dem Formalin sicherzustellen.
- Die Gewebe werden 24 h in der Bouin-Fixierlösung belassen; anschließend werden sie in 70 %iges Ethanol gelegt.
Präparation der Gewebe
Ziele:
1. Dehydrieren der Gewebe, damit eine angemessene Durchdringung mit Paraffin ermöglicht wird;
2. Imprägnieren der Gewebe mit Paraffin, um die Gewebe unversehrt zu konservieren und eine feste Oberfläche für die Mikrotomie zu schaffen;
Verfahren:
3. Die gekennzeichneten Kassetten werden aus der Formalin-/Ethanol-Lösung genommen und in die Einbettungskörbe gesetzt. Diese werden in den Gewebeeinbetter gestellt.
4. Danach wird das Einbettungsprogramm ausgewählt.
5. Nach Abschluss des Einbettungsvorgangs können die Körbe im Aufbewahrungsbereich abgelegt werden.
Einbettung
Ziel:
Ordnungsgemäße Ausrichtung der Proben in verfestigtem Paraffin zur anschließenden Mikrotomie.
Verfahren:
1. Die Körbe mit den Kassetten werden aus dem Gewebeeinbetter genommen und in die mit Paraffin gefüllte Frontkammer der Heizkonsole der Einbettungsstation oder separat in einen Paraffin-Erwärmer gestellt.
2. Die erste einzubettende Kassette wird aus der Frontkammer der Heizkonsole des Paraffin-Erwärmers genommen. Der Deckel der Kassette wird geöffnet und entsorgt; die Kennzeichnung der Kassette wird mit den Daten des jeweiligen Tiers verglichen, um mögliche Diskrepanzen noch vor dem Einbetten festzustellen.
3. Danach wird eine Einbettungsform mit geeigneter Größe ausgewählt.
4. Die Form wird unter den Auslass der Gießkonsole gestellt und mit geschmolzenem Paraffin gefüllt.
5. Danach wird die Probe aus der Kassette genommen und in die Form in das geschmolzene Paraffin gelegt. Dieser Vorgang wird für jede Paraffinform mit 4-8 Proben wiederholt. Die Fische werden so eingelegt, dass Fisch Nr. 1 im Winkel von 180° zu den Fischen 2-4/8 liegt.
6. Anschließend wird weiteres Paraffin eingefüllt, bis die gesamte Probe abgedeckt ist.
7. Die Form mit der Kassette wird auf die Abkühlplatte der Kryokonsole gestellt.
8. Nach dem Aushärten des Paraffins wird der Block (d. h. das feste Paraffin mit den Geweben und mit der Kassette) aus der Form herausgenommen.
Mikrotomie
Ziel:
Herstellen und Aufziehen der Gewebeschnitte zur Beurteilung der Entwicklungsphasen.
Verfahren:
1. Die Anfangsphase der Mikrotomie ('Facing') gestaltet sich wie folgt:
- Der Paraffinblock wird in das Spannfutter des Mikrotoms gesetzt.
- Das Spannfutter wird durch Drehen des Mikrotomrads vorgeschoben, und aus der Paraffinfläche des Blocks werden dicke Schnitte abgetragen, bis das Messer zu den eingebetteten Geweben gelangt.
- Das Mikrotom wird auf eine Schnittstärke von 3-5 µm eingestellt. Anschließend wird das Futter vorgeschoben, und aus dem Block werden mehrere Schnitte hergestellt, um bei den Grobschnitten eventuell entstandene Verunreinigungen an der Schnittfläche des Gewebes zu entfernen.
- Danach kann der Block aus dem Spannfutter genommen und mit der Oberseite nach unten auf Eis gelegt werden, damit das Gewebe Feuchtigkeit aufnehmen kann.
2. In der nächsten Phase der Mikrotomie werden die endgültigen Schnitte hergestellt und die Gewebeschnitte auf Objektträger aufgezogen. Diese Schritte werden wie folgt durchgeführt:
- Wenn der Block auf Eis gesetzt wurde, wird er heruntergenommen und wieder in das Futter des Mikrotoms gespannt.
- Nachdem das Mikrotom auf eine Schnittstärke von 3-5 µm eingestellt wurde, wird das Spannfutter durch Drehen des Mikrotomrads vorgeschoben. Von dem Block werden Schnitte abgetragen, bis ein Schnittband mit mindestens einem annehmbaren Schnitt einschließlich der Gonaden vorliegt. (Während des Schneidvorgangs kann der Block aus dem Spannfutter genommen und erneut auf Eis gesetzt werden, damit das Gewebe die Feuchtigkeit aufnehmen kann; anschließend wird der Block wieder in das Mikrotom gespannt.)
- Die Schnitte schwimmen im Wasserbad flach auf der Wasseroberfläche auf. Es wird versucht, mindestens einen Schnitt ohne Falten und ohne eingeschlossene Luftblasen zu erhalten.
- Unter den besten Schnitt wird ein Objektträger geschoben, um den Schnitt dann mit dem Objektträger aus dem Wasser zu heben. Dieser Schritt wird als 'Aufziehen' des Schnitts bezeichnet.
- Für die Proben eines Fischs werden jeweils drei Schnitte angefertigt. Der zweite und der dritte Schnitt werden in Abständen von 50 µm vom ersten Schnitt angesetzt. Wenn die Fische nicht mit den Gonaden auf derselben Schnittebene eingebettet wurden, müssen mehrere Schnitte angefertigt werden, um sicherzustellen, dass von jedem Fisch mindestens sechs Schnitte mit den Gonaden verfügbar sind.
- Mit einem Folienstift wird auf dem Objektträger die Nummer des Blocks notiert, aus dem der Schnitt stammt.
- Danach wird der Objektträger in ein Färbegestell gesetzt.
- Nun wird der Block aus dem Spannfutter genommen und zur Lagerung mit der Oberseite nach unten gedreht.
Färben, Eindecken und Kennzeichnen der Objektträger
Ziele:
- Färben der Schnitte zur histopathologischen Untersuchung;
- Permanentversiegeln der aufgezogenen und gefärbten Gewebe;
- Permanente Kennzeichnung der gefärbten Schnitte, um eine uneingeschränkte Rückverfolgbarkeit zu gewährleisten;
Verfahren:
1. Färben
- Die Objektträger werden vor dem Färben über Nacht an der Luft getrocknet.
- Zur Färbung der Schnitte wird Hematoxylin-Eosin verwendet.
2. Eindecken
- Die Deckel können von Hand oder automatisch aufgesetzt werden.
- Die Objektträger werden in Xylol oder Tissue Clear getaucht; anschließend wird das überschüssige Xylol/ Tissue Clear vorsichtig abgeklopft.
- Zum Ende des Objektträgers hin werden auf die der gefrorenen Seite gegenüberliegende Seite oder auf das Deckglas etwa 0,1 ml Eindeckmedium gegeben.
- Das Deckglas wird in spitzem Winkel gekippt auf den Objektträger aufgesetzt.
3. Kennzeichnung
- Die Objektträger müssen jeweils mit folgenden Informationen gekennzeichnet werden:
- Name des Labors
- Arten
- Proben-Nr. / Objektträger-Nr.
- Chemikalie / Behandlungsgruppe
- Datum
| Anlage 8 |
Statistisches Flussdiagramm zur Vitellogenin-Analyse
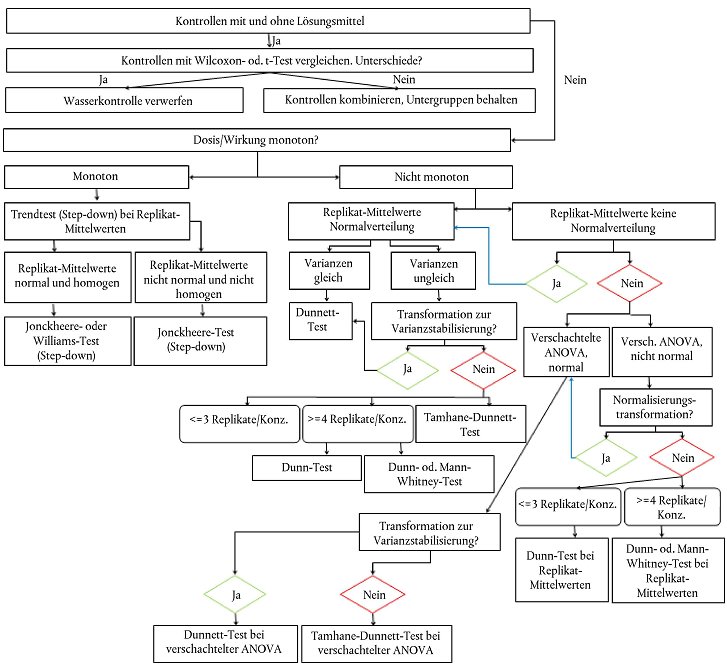
Statistisches Flussdiagramm zur Analyse des Geschlechterverhältnisses
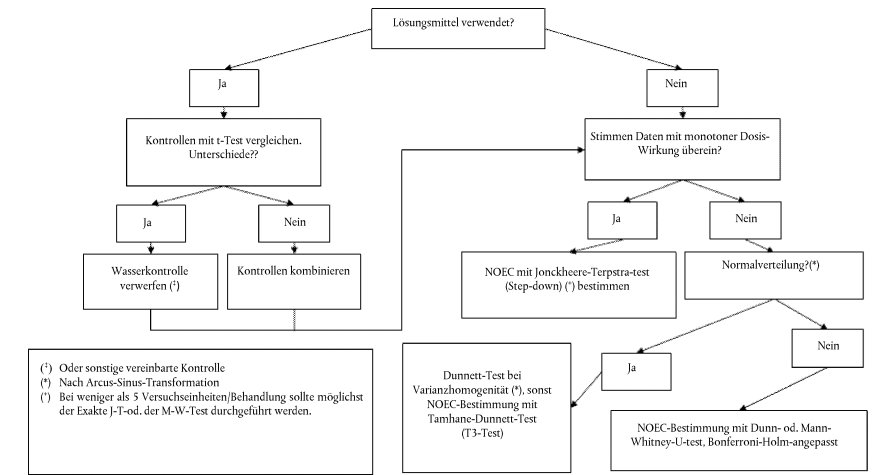
| Leitlinien zur Bestimmung des genetischen Geschlechts mit Gewebeproben und durch Polymerase-Kettenreaktion | Anlage 9 |
Entnahme, Präparation und Lagerung von Gewebeproben vor der Bestimmung des genetischen Geschlechts durch Polymerase-Kettenreaktion (PCR) bei Medakas (erstellt vom Labor für aquatische Organismen der Bayer CropScience AG)
1. Mit einer feinen Schere wird bei den einzelnen Fischen die After- oder die Rückenflosse abgeschnitten und in ein Röhrchen mit 100 µl Extraktionspuffer 1 gegeben (Informationen zur Herstellung der Pufferlösung s. u.). Nach jedem Fisch wird die Schere in einem mit destilliertem H2O gefüllten Becherglas gereinigt und mit einem Papiertuch getrocknet.
2. Danach wird das Flossengewebe mit einem Teflon-Mikro-Pistill homogenisiert, um die Zellen aufzuschließen. Um Kontaminationen zu vermeiden, wird für jedes Röhrchen ein neues Pistill verwendet. Die Pistillen werden über Nacht in 0,5 M NaOH gestellt, anschließend 5 Minuten in destilliertem H2O gewaschen und bis zum Gebrauch in Ethanol bzw. (nach dem Autoklavieren) steril aufbewahrt.
3. Das Flossengewebe kann auch ohne den Extraktionspuffer 1 auf Trockeneis aufbewahrt und dann bei - 80 °C gefroren gelagert werden, um eine Beeinträchtigung der DNA zu vermeiden. Die Extraktion gelingt jedoch besser, wenn die DNA gleichzeitig extrahiert wird (Handhabung s. o.; bei - 80 °C gelagerte Proben sind auf Eis aufzutauen, bevor die Pufferlösung in die Röhrchen gefüllt wird).
4. Nach dem Homogenisieren werden alle Röhrchen in ein Wasserbad gesetzt und 15 Minuten bei 100 °C aufgekocht.
5. Anschließend werden jeweils 100 µl des Extraktionspuffers 2 (Hinweise zur Herstellung der Pufferlösung s. u.) in die Röhrchen pipettiert. Die Proben werden 15 Minuten bei Raumtemperatur belassen; während dieser 15 Minuten werden sie vorsichtig von Hand geschüttelt.
6. Dann werden alle Röhrchen in das Wasserbad gesetzt und nochmals 15 Minuten bei 100 °C aufgekocht.
7. Bis zur Durchführung der Analysen werden die Röhrchen bei - 20 °C gefroren. Herstellen der Pufferlösung
PCR-Puffer 1:
500 mg N-Lauroylsarcosine (z.B. Merck KGaA, Darmstadt, DE)2 ml 5M NaCl
ad 100 ml dest. H2O
→ autoklavieren
PCR-Puffer 2:
20 g Chelex (z.B.. Biorad, München, DE)In 100 ml dest. H2O quellen lassen.
→ autoklavieren
Bestimmung des genetischen Geschlechts durch Polymerase-Kettenreaktion (PCR) bei Medakas (erstellt vom Labor für aquatische Organismen der Bayer CropScience AG)
Die präparierten und gefrorenen Röhrchen (siehe Beschreibung im vorstehenden Abschnitt) werden auf Eis aufgetaut. Anschließend werden sie mit einer Eppendorf-Zentrifuge zentrifugiert (30 s mit maximaler Drehzahl bei Raumtemperatur). Für die PCR wird der vom Niederschlag getrennte klare Überstand verwendet. Es ist unbedingt zu vermeiden, dass Spuren von Chelex (aus dem Niederschlag) in die PCR gelangen, da sonst die Taq-Polymerase gestört wird. Der Überstand ist umgehend zu verwenden oder gefroren (bei - 20 °C) aufzubewahren und in mehreren Schritten aufzutauen (damit bei später durchzuführenden Analysen die DNA nicht beeinträchtigt ist).
1. Herstellung des , Reaktionsgemischs' (25 µl pro Probe):
| Menge | Endkonzentration | |
| Template-DNA | 0,5-2 µl | |
| 10 x PCR-Puffer mit MgCl2 | 2,5 µl | 1 x |
| Nukleotide (jeweils dATP, dCTP, dGTP, dTTP) | 4 µl (5 mM) | 200 µM |
| Vorwärtsprimer (10 µM) (s. u. 3-5) | 0,5 µl | 200 nM |
| Rückwärtsprimer (10 µM) (s. u. 3-5) | 0,5 µl | 200 nM |
| DMSO | 1,25 µl | |
| Wasser (PCR-Qualität) | bis zu 25 µl | |
| Taq-E-Polymerase | 0,3 µl | 1.5U |
| 10 x PCR-Puffer mit MgCl2: 670mM Tris/HCl (pH 8,8 bei 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20 | ||
Bei jeder PCR (s. u. 3-5) werden für jede einzelne Probe (s. o.) der Spezialprimer als neue 'Reaktionsmischung' und die entsprechende Menge an Template-DNA benötigt. Die betreffenden Mengen werden in frische Röhrchen pipettiert. Danach werden alle Röhrchen verschlossen, gerührt (ca. 10 s) und zentrifugiert (10 s bei Raumtemperatur). Anschließend kann mit den jeweiligen PCR-Programmen begonnen werden. Für jedes PCR- Programm werden außerdem eine positive Kontrolle (eine exemplarische DNA-Probe mit bekannter Aktivität und eindeutigen Ergebnissen) und eine negative Kontrolle (1µl dest. H2O) benötigt.
2. Herstellung des Agarosegels (1 %) - während der PCR-Programme:
- 3 g Agarose werden in 300 ml 1 × TAE-Puffer gelöst (1- %-Agarosegel).
- Diese Lösung wird in einem Mikrowellengerät aufgekocht (ca. 2-3 min).
- Die heiße Lösung wird in einen auf Eis stehenden speziellen Gießkasten gegeben.
- Nach etwa 20 min kann das Agarosegel verwendet werden.
- Das Agarosegel wird bis zum Ende der PCR-Programme in 1 × TAE-Puffer aufbewahrt.
3. Actin-PCR-Programm:
Mit dieser PCR soll nachgewiesen werden, dass die DNA der Probe nicht beschädigt ist.
- Spezialprimer:
'Mact1(aufwärts/vorwärts)' → TTC AAC AGC CCT GCC ATG TA
'Mact2(abwärts/rückwärts)' → GCA GCT CAT AGC TCT TCT CCA GGG AG
- Programm:
5 min bei 95 °C
Zyklus (35-mal):
Denaturierung → 45 s bei 95 °C
Annealing → 45 s bei 56 °C
Verlängerung → 1 min bei 68 °C
15 min bei 68 °C
4. X- und Y-Gen-PCR-Programm:
Bei diesem PCR-Programm werden die X- und Y-Gene anhand der Proben mit unversehrter DNA nachgewiesen. Proben männlicher Tiere müssen eine doppelsträngige und weiblicher Tiere eine einsträngige DNA aufweisen (nach dem Färben und nach der Gel-Elektrophorese). Bei diesem Programmdurchlauf ist jeweils eine positive Kontrolle für männliche (XY-Probe) und für weibliche Tiere (XX-Probe) zu berücksichtigen.
- Spezialprimer:
,PG 17,5' (aufwärts/vorwärts)
→ CCG GGT GCC CAA GTG CTC CCG CTG'PG 17,6'(abwärts/rückwärts)
→ GAT CGT CCC TCC ACA GAG AAG AGA - Programm:
5 min bei 95 °C
Zyklus (40-mal):
Denaturierung
→ 45 s bei 95 °CAnnealing
→ 45 s bei 55 °CVerlängerung
→ 1 min 30 s bei 68 °C15 min bei 68 °C
5. Y-Gen-PCR-Programm als ,Kontrolle' für das X- und Y-Gen-PCR-Programm:
Mit diesem PCR-Programm werden die Ergebnisse des 'X- und Y-Gen-PCR-Programms' verifiziert. Die 'männlichen' Proben müssen einen Strang aufweisen, in den 'weiblichen' Proben darf kein Strang enthalten sein (nach dem Färbern und der Gel-Elektrophorese).
- Spezialprimer:
'DMTYa (aufwärts/vorwärts)'
→ GGC CGG GTC CCC GGG TG'DMTYd (abwärts/rückwärts)'
→ TTT GGG TGA ACT CAC ATG G - Programm:
5 min bei 95 °C
Zyklus (40-mal):
Denaturierung → 45 s bei 95 °C
Annealing → 45 s bei 56 °C
Verlängerung → 1 min bei 68 °C
15 min bei 68 °C
6. Färben der PCR-Proben:
Färbelösung:
50 % Glycerol100 mM EDTA
1 % SDS
0,25 % Bromphenolblau
0,25 % Xylencyanol
In die Röhrchen wird jeweils 1 µl der Färbelösung pipettiert.
7. Beginn der Gel-Elektrophorese:
- Das hergestellte 1 %ige Agarosegel wird in eine mit 1 × TAE-Puffer gefüllte Gel-Elektrophoresekammer gegeben.
- Von den gefärbten PCR-Proben werden jeweils 10-15 µl in einen Agarosegel-Slot pipettiert.
- Außerdem werden 5-15 µl der 1kb-Ladder (in-vitrogen) in einen eigenen Slot pipettiert.
- Die Elektrophorese wird mit 200 V begonnen.
- Nach 30-45 min wird die Elektrophorese beendet.
8. Bestimmung der Banden:
- Das Agarosegel wird in destilliertem H2O gereinigt.
- Anschließend wird das Agarosegel 15-30 min in Ethidiumbromid gegeben.
- Danach ist in einem UV-Lichtschrank eine Aufnahme des Agarosegels herzustellen.
- Zum Schluss werden die Proben im Vergleich zum positiven Kontrollband (bzw. den positiven Kontrollbanden) und zur DNA-Leiter analysiert.
| Leitlinien zur Herstellung von Gewebeproben zur Bestimmung des genetischen Geschlechts durch PCR beim Dreistachligen Stichling | Anlage 10 |
Herstellung von Gewebeproben und DNA-Extraktion
Die DNA kann mit verschiedenen handelsüblichen Reagenzien und mit manuellen oder automatischen Systemen extrahiert werden. Im Folgenden wird das Protokoll des CEFAS-Labors (CEFAS = Centre for Environment, Fisheries and Aquaculture Science) in Weymouth beschrieben; gegebenenfalls werden auch alternative Methoden erläutert.
1. Bei jedem einzelnen Fisch wird mit einer feinen Schere jeweils etwas Gewebematerial (10-20 mg) aus dem Rückenbereich (dorsolateral) entnommen (nachdem der Kopf und der Schwanz für die VTG-Analyse abgetrennt wurden). Das Gewebe wird in ein Röhrchen gegeben und entweder sofort in flüssigen Stickstoff gestellt (zur Lagerung bei - 80 °C) oder mit 70 %igem Ethanol gefüllt (zum Transport und zur anschließenden Aufbewahrung bei 4 °C). Jeweils nach Entnahme der Gewebeprobe bei einem Fisch wird die Schere zunächst mit 70 %igem Ethanol und dann mit destilliertem Wasser gereinigt und mit Hygienepapier trockengetupft.
2. Das Ethanol wird (soweit vorhanden) abgesaugt und das Gewebe über Nacht mit Proteinase K in 400 µl ATL- Pufferlösung (Qiagen) gelöst. Eine Aliquote (200 µl) des gelösten Gewebes wird in einen S-Block (Qiagen) mit 96 Vertiefungen gegeben, und die DNA wird in mit Qiagen Universal BioRobot und dem QIamp-Investigator- BioRobot-Kit mit 96 Vertiefungen Qlamp-Ivestigator-BioRobot-Kit extrahiert. Die DNA wird in 50 µl DNase- und RNase-freies Wasser eluiert. Wenn feste Gewebe zur DNA-Extraktion verwendet werden (z.B. die Wirbelsäule oder eine Brustflosse), muss die Probe unter Umständen mit einem FastPrep®-Tissue-Lyser oder mit einem gleichwertigen Aufschlusssystem im Lysepuffer homogenisiert werden.
Alternativ kann wie folgt verfahren werden:
- Das Gewebe wird über Nacht mit Proteinase K in 400 µl G2-Lysepuffer (Qiagen) gelöst, und die DNA wird entweder mit dem EZ-1-DNA-Easy-Tissue-Kit und dem EZ-1-Biorobot oder mit dem DNA-Easy-Tissue- Mini-Kit aus 200 µl des gelösten Gewebes extrahiert. Anschließend wird die DNA in ein Flüssigkeitsvolumen von 50 µl eluiert.
- Die Gewebe werden mit DNAzol-Reagens verarbeitet. Die Gewebeproben werden 10 Minuten lang in einem Mikrozentrifugen-Röhrchen (1,5 ml) in 1 ml DNAzol gelöst und dann 5 Minuten mit 13.000 U/min zentrifugiert, um vorhandene Partikel vollständig abzutrennen. Die gelöste Probe wird dann in ein frisches 1,5-ml-Mikrozentrifugen-Röhrchen mit 500 µl 100 % molekular reinem Ethanol gegeben und dann 10 Minuten mit 13.000 U/min zentrifugiert, um die DNA auszufällen. Das Ethanol wird entfernt, durch 400 µl molekular reines Ethanol (70 %) ersetzt und nochmals 5 Minuten mit 13.000 U/min zentrifugiert. Anschließend wird das DNA-Pellet in 50 µl molekularem DNase- und RNasefreiem Wasser gelöst. Auch in diesem Fall muss die Probe unter Umständen mit einem FastPrep®-Tissue-Lyser oder mit einem gleichwertigen Aufschlusssystem im Lysepuffer homogenisiert werden, wenn feste Gewebe zur DNA- Extraktion verwendet werden (z.B. die Wirbelsäule oder eine Brustflosse),
3. Die DNA wird bis zur Verwendung bei - 20 °C gespeichert.
Wichtiger Hinweis: Während der Verfahren sind Handschuhe zu tragen.
Analyse durch Polymerase-Kettenreaktion (PCR)
Mit 2,5 µl des DNA-Extrakts in 50 µl Reaktionsvolumen wurden unter Verwendung der IDH-Locus-Primer (nach Peichel et al., 2004. Current Biology 1:1416-1424) Amplifikationen vorgenommen:
Vorwärtsprimer 5' GGG ACG AGC AAG ATT TAT TGG 3'
Rückwärtsprimer 5' TAT AGT TAG CCA GGA GAT GG 3'
Geeignete PCR-Reagenzien werden von zahlreichen Herstellern angeboten. Die im Folgenden beschriebene Methode wird im CEFAS-Labor in Weymouth praktiziert.
1. Herstellung des ,Reaktionsgemischs'(50 µl pro Probe):
Im Folgenden wird die Herstellung eines Mastermix erläutert. Die Herstellung kann vorab erfolgen; anschließend wird der Mastermix bis zur Verwendung bei - 20 °C gelagert. Der hergestellte Mastermix muss auch für eine negative Kontrolle (nur Wasser in für die Molekularbiologie geeigneter Qualität) ausreichen.
| Menge (Konz. Stammlösung) /Probe | Endkonzentration | |
| 5xGoTaq® Reaktionspuffer | 10 µl | 1 x |
| MgCl2 | 5 µl (25 mM) | 2,5 mm |
| Nukleotide (dATP, dCTP, dGTP, dTTP) | 0,5 µl (jeweils 25 mM) | jeweils 250 µM |
| Vorwärtsprimer | 0,5 µl (0,1 nmol/µl) | 2,0 µM |
| Rückwärtsprimer | 0,5 µl (0,1 nmol/µl) | 2,0 µM |
| Wasser in für die Molekularbiologie geeigneter Qualität | 30,75 µl | |
| GoTaq-Polymerase | 0,25 µl | 1,25 U |
- 47,5 µl werden in ein gekennzeichnetes dünnwandiges 0,5 ml-PCR-Röhrchen gegeben.
- 2,5 µl der gereinigten DNA werden in das entsprechend gekennzeichnete Röhrchen geben. Dieser Schritt ist für alle Proben und für die negative Kontrolle zu wiederholen.
- Mit 2 Tropfen Mineralöl wird ein Überstand erzeugt. Alternativ kann ein Thermocycler mit beheiztem Deckel verwendet werden.
- Die Proben werden verschlossen.
- Die Proben wurden 5 Minuten in einem Thermocycler (Peltier PTC-225) bei 94 ± 2 °C denaturiert; danach folgen weitere 39 Zyklen von jeweils 1 Minute bei 94 ± 2 °C, 1 Minute bei 55 ± 2 °C, 1 Minute bei 72 ± 2 °C und schließlich nochmals 10 Minuten bei 72 ± 2 °C.
2. Herstellung des Agarosegels (2 %):
Traditionell werden die PCR-Produkte auf einem 20 %igen Agarosegel mit Ethidiumbromid gelöst.
Alternativ können auch Kapillar-Elektrophoresesysteme verwendet werden.
- 2 g Agarose werden in 100 ml 1 × TAE-Puffer eingewogen.
- Die Agarose wird unter Erwärmung in einem Mikrowellengerät (ca. 2-3 min) aufgelöst.
- 2 Tropfen Ethidiumbromid werden hinzugegeben (Endkonzentration 0,5 µg/ml).
- Die heiße Lösung wird in den Gießstand gegossen.
- Anschließend muss gewartet werden, bis das Gel sich verfestigt hat.
3. Gel-Electrophorese:
- Das Agarosegel wird in das Elektrophorese-Gerät gegeben und mit 1 × TAE-Puffer bedeckt.
- Von den Proben werden jeweils 20 µl in jeweils eine Vertiefung gefüllt; außerdem wird ein Molekulargewichtsmarker (100 bp DNA-Leiter, Promega) in eine freie Vertiefung gegeben.
- Die Elektrophorese erfolgt über einen Zeitraum von 30-45 Minuten mit einer Spannung von 120 V.
4. Visualisierung der Amplifikationsprodukte
Wenn das Ethidiumbromid mit dem Agarosegel gemischt wurde, wie oben beschrieben, werden die DNA-Produkte unter einer UV-Quelle sichtbar gemacht. Alternativ kann das Agarosegel angefärbt werden, indem das Gel vor der Visualisierung 30 Minuten mit einer Ethidiumbromid-Verdünnungslösung (0,5 µg/ml in Wasser) bedeckt wird.
| Leitlinien zur künstlichen Befruchtung bei Dreistachligen Stichlingen | Anlage 11 |
In diesem Abschnitt wird beschrieben, wie Laich des Dreistachligen Stichlings zur anschließenden Verwendung im FSDT befruchtet wird.
Verfahren
Gewinnung des Spermas von den männlichen Fischen
1. Ein kräftig gefärbtes Männchen der gewünschten Population wird getötet.
2. Auf beiden Seiten werden die Hoden entnommen. Die Hoden sind gewöhnlich als stark pigmentierte, rote Strukturen an der seitlichen Mittellinie des Körpers gut erkennbar. Dabei kann eine der folgenden Methoden verwendet werden:
3. Mit einer feinen Schere wird von der Kloake im Winkel von etwa 45° mit einem einzigen Schnitt ein 1-1,5 cm langer Einschnitt vorgenommen.
4. Mit einem Skalpell wird ein kurzer seitlicher Schnitt hinter dem Becken und ventral zu den Knochenplatten entlang der Seitenlinie geführt.
5. Die Hoden werden mit einer feinen Pinzette entnommen und in eine Petrischale gelegt.
6. Jeder Hoden wird mit 100 µl frisch hergestellter Hankscher Lösung * bedeckt.
7. Die Hoden werden mit einer Rasierklinge oder einem Skalpell fein geschnitten. Dadurch wird das Sperma freigesetzt, und die Hanksche Lösung erhält ein milchiges Aussehen.
8. Die Flüssigkeit mit dem Sperma wird in ein Röhrchen gefüllt; beim Pipettieren ist darauf zu achten, dass kein Hodengewebe aufgenommen wird.
9. 800 µl Hankscher Lösung werden in das Röhrchen gegeben und gut gemischt.
10. Wenn erforderlich, kann das Männchen mit 100 %igem Ethanol oder einer sonstigen Fixierlösung fixiert und aufbewahrt werden. Dies ist besonders wichtig, wenn die juvenilen Fische bei der Untersuchung den Elterntieren zugeordnet werden sollen.
_________
*) Gepufferte Hanksche Salzlösung (HBSS):
HBSS wird benötigt, um das Sperma zu konservieren, während die Befruchtung vorbereitet wird.
Wichtiger Hinweis: Die meisten benötigten Stammlösungen können im Voraus hergestellt werden; nur Stammlösung 5 und schließlich die endgültige Lösung müssen am Tag der Verwendung frisch hergestellt werden.
| Stammlösung 1 | |
| NaCl | 8,00 g |
| KCl | 0,40 g |
| Destilliertes Wasser (DW) | 100 ml |
| Stammlösung 2 | |
| Na2HPO4 (wasserfrei) | 0,358 g |
| KH2PO4 | 0,60 g |
| DW | 100 ml |
| Stammlösung 3 | |
| CaCl2 | 0,72 g |
| DW | 50 ml |
| Stammlösung 4 | |
| MgSO4,7H2O | 1,23 g |
| DW | 50 ml |
| Stammlösung 5 (frisch hergestellt) | |
| NaHCO3 | 0,35 g |
| DW | 10 ml |
Hinweis: Wenn einige der vorstehenden Salze bereits hergestellt wurden, aber einen anderen Wasseranteil aufweisen (d. h. statt wasserfrei 2H2O), können auch diese verwendet werden, sofern sie vor der Verwendung auf das richtige Gewicht (bezogen Molekulargewicht) gebracht werden.
Die Hanksche Lösung wird in der nachstehenden Reihenfolge hergestellt:
| Stammlösung 1 | 1,0 ml |
| Stammlösung 2 | 0,1 ml |
| Stammlösung 3 | 0,1 ml |
| DW | 8,6 ml |
| Stammlösung 4 | 0,1 ml |
| Stammlösung 5 | 0,1 ml |
Vor der Verwendung müssen die Lösungen gut gemischt werden.
Befruchtung
1. Aus der betreffenden Population werden große gravide Weibchen ausgewählt. Die Weibchen sind nur dann zum Herausdrücken des Laichs geeignet, wenn Eier aus der Kloake hervortreten. Typisch für laichbereite Weibchen ist der 'angehobene' Kopf.
2. Mit dem Daumen oder mit einem anderen Finger wird seitlich zum Schwanz über den Fisch gestrichen, um die Abgabe eines Eiersacks in eine frische Petrischale zu provozieren. Diese Behandlung wird auf der anderen Seite wiederholt. Anschließend wird der Fisch wieder in das Becken zurückgesetzt.
3. Die Eier können mit einem feinen Pinsel (zu einer Monolage) verteilt werden. Wichtig ist, dass möglichst viele Eier mit dem Sperma in Berührung gebracht werden; hilfreich ist daher die Ausbreitung der Eier über eine möglichst große Fläche. Wichtiger Hinweis: Um die Eier herum müssen feuchte Tücher gelegt werden, damit sie nicht austrocknen. (Dabei ist darauf zu achten, dass die Eier nicht unmittelbar mit Wasser in Berührung kommen, damit das Chorion nicht vorzeitig verhärtet und eine Befruchtung verhindern würde.) Die Anzahl der von einem Weibchen produzierten Eier kann erheblich schwanken; in der Regel werden aber von einem einzigen graviden Weibchen leicht etwa 150 Eier gewonnen.
4. 25 µl Sperma in der Hankschen Lösung werden mit einem Pinsel gleichmäßig über die gesamte Fläche der Eier verteilt. Die Eier verhärten rasch und ändern (innerhalb einer Minute) ihre Farbe, sobald die Befruchtung begonnen hat. Wenn geschätzt mehr als 150 Eier entnommen wurden, ist der Schritt zu wiederholen. Verhärten die Eier nicht binnen einer Minute, ist etwas mehr Sperma hinzugeben. Wichtiger Hinweis: Die Zugabe einer größeren Spermamenge erhöht nicht zwangsläufig die Befruchtungsrate.
5. Die Eier und die Spermalösung müssen mindestens 15 Minuten miteinander 'reagieren' können; anschließend sind die befruchteten Eier spätestens 1,5 Stunden nach der Befruchtung in das Expositionsbecken zu bringen.
6. Das Verfahren wird mit einem anderen Weibchen wiederholt, bis die benötigte Anzahl an Eiern entnommen wurde.
7. Vom letzten Entnahmeschritt sind einige Eier aufzubewahren und in 10 %iger Essigsäure zu fixieren.
Zählen und Verteilen der Eier im Prüfbecken
1. Um einen Bias durch genetische Effekte zu vermeiden, werden die Eier gleichmäßig auf die einzelnen Konzentrationen verteilt. Die Chargen der befruchteten Eier sind mit einem stumpfen Instrument (d. h. mit einer breiten Entomologiepinzette oder mit einer Inokulationsöse) jeweils in gleich große Gruppen zu teilen (entsprechend der Anzahl der Konzentrationen). Wenn 4 Replikate mit jeweils 20 Eiern pro Konzentration vorgesehen sind, müssen in jedes Expositionsbecken mindestens 80 Eier gegeben werden. Wichtiger Hinweis: Eine Zugabe von 20 % (d. h. insgesamt 96 Eier pro Konzentration) ist empfehlenswert, bis mit Sicherheit davon ausgegangen werden kann, dass die Eier zu 100 % befruchtet sind.
2. Stichling-Eier entwickeln außerhalb des von den Männchen bewachten Nests sehr leicht Pilzinfektionen. Daher ist entscheidend, dass alle Eier während der ersten 5 Tage des Tests mit Methylenblau behandelt werden. Methylenblau-Stammlösung wird mit einer Konzentration von 1 mg/ml hergestellt und in das Expositionsbecken gegeben, bis eine endgültige Konzentration von höchstens 2,125 mg/l erreicht ist. Wichtiger Hinweis: Stichlinge dürfen nicht mit Methylenblau in Berührung kommen; nach dem Schlüpfen muss das Methylenblau entfernt werden, und an Tag 6 darf sich kein Methylenblau mehr im Becken befinden.
3. Die Eier werden täglich geprüft; die Anzahl der abgestorbenen und nicht befruchteten Eier wird protokolliert. Wichtiger Hinweis: Die Eier müssen bis zum Schlüpfen ständig unter Wasser bleiben und dürfen auch kurzzeitig nicht aus dem Wasser genommen werden
C.42 Biologische Abbaubarkeit in Meerwasser 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 306 (1992). Als die ursprünglichen Prüfmethoden entwickelt wurden, war nicht bekannt, in welchem Umfang Ergebnisse der Screening-Tests zur Prüfung auf leichte biologische Abbaubarkeit in Süßwasser mit Abwässern oder Belebtschlamm als Inokulum auf die Meeresumwelt übertragbar waren. In diesem Zusammenhang wurde über unterschiedliche Ergebnisse berichtet (z.B. (1)).
2. Viele industrielle Abwässer enthalten zahlreiche Chemikalien. Diese gelangen entweder über direkte Einleitung oder über Ästuarien und Flüsse, in denen die Verweilzeiten gemessen an den für einen vollständigen biologischen Abbau erforderlichen Zeiträumen vieler Chemikalien verhältnismäßig kurz sind, in die Meere. Da die Notwendigkeit des Schutzes der Meeresumwelt vor steigenden Belastungen durch Chemikalien zunehmend ins Bewusstsein rückt und da die wahrscheinlichen Konzentrationen von Chemikalien im Meer abgeschätzt werden müssen, wurden Methoden zur Prüfung der biologischen Abbaubarkeit in Meerwasser entwickelt.
3. In den hier beschriebenen Methoden wird natürliches Meerwasser sowohl als wässrige Phase als auch als Bezugsquelle für Mikroorganismen genutzt. Analog zu den Methoden zur Prüfung der leichten biologischen Abbaubarkeit in Süßwasser wurde ultragefiltertes und zentrifugiertes Meerwasser untersucht, und Meeressedimente wurden als Inokulum verwendet. Diese Untersuchungen führten nicht zum Ziel. Als Prüfmedium wird daher natürliches Meerwasser verwendet, aus dem grobe Partikel abgetrennt wurden.
4. Um die vollständige biologische Abbaubarkeit mit der Schüttelmethode zu ermitteln, müssen angesichts der geringen Empfindlichkeit der analytischen Methode für gelösten organischen Kohlenstoff (DOC Die-Away-Tests) verhältnismäßig hohe Konzentrationen des Prüfstoffes verwendet werden. Dazu wiederum müssen zum Meerwasser mineralische Nährstoffe (N und P) hinzugegeben werden; ansonsten würden die betreffenden niedrigen Konzentrationen den Abbau des gelösten organischen Kohlenstoffs beeinträchtigen. Es ist auf Grund der Konzentration des verwendeten Prüfstoffes ebenfalls erforderlich, Nährstoffe in den geschlossenenen Flaschentest (Closed Bottle-Method) hinzuzugeben.
5. Insoweit handelt es sich bei den Methoden nicht um Tests auf leichte biologische Abbaubarkeit, da über die bereits im Meerwasser befindlichen Mikroorganismen hinaus kein Inokulum zugegeben wird. In den Tests wird auch die Meeresumwelt nicht simuliert, weil Nährstoffe hinzugegeben werden und weil die Konzentration des Prüfstoffes wesentlich höher ist als in natürlicher Umgebung. Aus diesen Gründen werden die Methoden unter dem neuen Unterabschnitt 'Biologische Abbaubarkeit in Meerwasser' vorgeschlagen.
Anwendung
6. Die Ergebnisse der Prüfungen, die für Stoffe durchgeführt werden, die aufgrund ihrer Verwendungsformen und ihrer Entsorgung letztlich ins Meer gelangen können, vermitteln einen ersten Eindruck von der biologischen Abbaubarkeit in Meerwasser. Bei positivem Ergebnis (Abbau des gelösten organischen Kohlenstoffs (DOC) > 70 %; theoretischer Sauerstoffbedarf (ThSB) > 60 %) kann ein Potenzial für den biologischen Abbau in der Meeresumwelt festgestellt werden. Ein negatives Ergebnis schließt ein solches Potenzial jedoch nicht zwangsläufig aus, sondern bedeutet nur, dass weitere Untersuchungen vorgenommen werden müssen (beispielsweise mit einer möglichst niedrigen Konzentration des Prüfstoffes).
7. Wenn ein definitiverer Wert für die Rate des biologischen Abbaus in Meerwasser an einem bestimmten Standort benötigt wird, müssen in beiden Fällen komplexere, aufwendigere und entsprechend kostspieligere Methoden verwendet werden. Beispielsweise könnte ein Simulationstest mit einer Konzentration des Prüfstoffs durchgeführt werden, die näher an der wahrscheinlichen Konzentration in der Umwelt liegt. Auch nicht angereichertes, nicht behandeltes Meerwasser, das am betreffenden Standort entnommen wurde, kann verwendet werden, und nach dem primären biologischen Abbau kann eine spezifische chemische Analyse vorgenommen werden. Zur Prüfung der vollständigen biologischen Abbaubarkeit werden 14C markierte Stoffe benötigt, damit der Abbau von löslichem organischem 14C sowie die Entstehung von 14CO2 bei umweltrelevanten Konzentrationen gemessen werden können.
8. Die Wahl der zu verwendenden Methode hängt von verschiedenen Faktoren ab. Die folgende Tabelle vermittelt einen Überblick, der die Wahl erleichtern soll. Während Stoffe mit einer Wasserlöslichkeit unterhalb eines Wertes von etwa 5 mg C/l mit der Schüttelmethode nicht getestet werden können, lassen sich schlecht lösliche Stoffe prinzipiell zumindest mit einem geschlossenen Flaschen-Test untersuchen.
Tabelle Vorteile und Nachteile des Schüttelkolben-Tests und des geschlossenen Flaschentests
| Methode | Vorteile | Nachteile |
| Schüttelkolben |
|
|
| Geschlossene Flasche |
|
|
1. Diese Methode ist die Meerwasser-Variante des in diesem Anhang in Kapitel C.4B beschriebenen modifizierten OECD-Screening-Tests (2). Der Test wurde nach einem vom Dänischen Institut für Wasserqualität im Auftrag der Europäischen Kommission durchgeführten Ringtest abschließend beschrieben (3).
2. Wie beim begleitenden geschlossenen Flaschen-Test für Meerwasser sind auch die Ergebnisse dieses Tests nicht als Indikatoren für eine leichte biologische Abbaubarkeit zu betrachten, sondern vielmehr zur Ermittlung weiterer Informationen über die biologische Abbaubarkeit von Stoffen in der Meeresumwelt zu verwenden.
3. Eine vorher festgelegte Menge des Prüfstoffes wird im Testmedium so gelöst, dass sich eine Konzentration von 5-40 mg gelöstem organischem Kohlenstoff (DOC)/l ergibt. Wenn die Nachweisgrenzen der Analysen auf organischen Kohlenstoff verbessert werden, kann die Verwendung geringerer Konzentrationen des jeweiligen Prüfstoffes von Vorteil sein, insbesondere bei Stoffen mit hemmender Wirkung. Die Lösung des Prüfstoffes im Prüfmedium wird unter Schütteln im Dunkeln oder bei diffuser Beleuchtung unter aeroben Bedingungen bei einer konstanten Temperatur (gewöhnlich im Bereich von 15-20 °C,), geregelt auf ± 2 °C inkubiert. Wenn mit der Untersuchung Umweltbedingungen simuliert werden sollen, können die Tests auch außerhalb dieses normalen Temperaturbereichs durchgeführt werden. Der Test sollte im Allgemeinen höchstens etwa 60 Tage dauern. Der Abbau wird durch DOC-Messungen überwacht (endgültiger Abbau); in manchen Fällen erfolgt die Überwachung durch spezifische Analysen (primärer Abbau).
4. Um festzustellen, welcher Test bei einem bestimmten Stoff durchzuführen ist, müssen einige Merkmale des Stoffes bekannt sein. Der Gehalt des Stoffes an organischen Kohlenstoffen ist zu ermitteln; die Flüchtigkeit muss so weit begrenzt sein, dass es während des Tests nicht zu erheblichen Verlusten kommt, und die Löslichkeit in Wasser muss einem Wert von mehr als 25-40 mg C/l entsprechen. Außerdem darf der Prüfstoff nicht erheblich auf Glasflächen adsorbieren. Informationen zur Reinheit oder zu den relativen Anteilen der Hauptkomponenten des Prüfstoffes werden benötigt, damit die Testergebnisse entsprechend interpretiert werden können. Dies gilt insbesondere bei sehr knappem Testergebnis im Bereich des 'Pass'-Levels.
5. Informationen über die Toxizität des Prüfstoffes für Bakterien (beispielsweise gemessen anhand des Kurzzeit- Atemfrequenztests (4)) können für die Wahl geeigneter Prüfkonzentrationen zweckdienlich und für die korrekte Interpretation niedriger Abbaubarkeitswerte erforderlich sein. Diese Informationen sind jedoch nicht immer hinreichend für die Interpretation der Ergebnisse von Tests zur Prüfung der biologischen Abbaubarkeit; eher geeignet ist gegebenenfalls das in Nummer 18 beschriebene Verfahren.
6. Zur Prüfung der mikrobiologischen Aktivität der Meerwasserproben sind geeignete Referenzstoffe zu verwenden, beispielsweise Natriumbenzoat, Natriumacetat und Anilin. Die Referenzstoffe müssen in einer relativ kurzen Zeitspanne abgebaut sein; ansonsten sollte der Test mit einer anderen Meerwasserprobe wiederholt werden.
7. Im Ringtest der Europäischen Kommission, bei dem Meerwasserproben an unterschiedlichen Standorten und zu unterschiedlichen Zeitpunkten im Laufe eines Jahres genommen wurden (3), betrugen bei Natriumbenzoat die 'Lag'-Phase (tL) 1 bis 4 Tage und die Zeitdauer bis zu einem Abbau von 50 % (t50) (ohne 'Lag'-Phase) 1 bis 7 Tage. Bei Anilin belief sich tL auf 0-10 Tage; t50 lag bei 1-10 Tagen.
Reproduzierbarkeit und Empfindlichkeit der Methode
8. Die Reproduzierbarkeit der Methode wurde im Ringtest nachgewiesen (3). Die niedrigste Konzentration des Prüfstoffes, bei der diese Methode noch in Verbindung mit einer DOC-Analyse verwendet werden kann, hängt weitgehend von der Nachweisgrenze bei der Ermittlung des Gehalts an organischen Kohlenstoff (gegenwärtig etwa 0,5 mg C/l) und von der Konzentration des gelösten organischen Kohlenstoffs im verwendeten Meerwasser (gewöhnlich 3-5 mg/l bei Proben aus dem offenen Meer) ab. Die Hintergrundkonzentration an gelöstem organischem Kohlenstoff darf nicht mehr als etwa 20 % der gesamten DOC-Konzentration nach Zugabe des Prüfstoffes betragen. Wenn dies nicht möglich ist, kann die DOC-Hintergrundkonzentration manchmal durch Alterung des Meerwassers vor dem Testen reduziert werden. Wird diese Methode ausschließlich in Verbindung mit bestimmten chemischen Analysen verwendet (um den primären Abbau zu messen), muss der Prüfer anhand zusätzlicher Informationen angeben, ob ein vollständiger Abbau zu erwarten ist. Diese zusätzlichen Informationen können aus den Ergebnissen anderer Tests zum Nachweis einer leichten oder inhärenten biologischen Abbaubarkeit bestehen.
Apparatur
9. Übliche Laborausrüstung und folgende Geräte:
- Schüttelmaschine für 0,5- bis 2-l-Erlenmeyer-Kolben, entweder mit automatischer Temperaturregelung oder zur Verwendung in einem Raum mit konstanter Temperatur von 15-20 °C (geregelt auf ± 2 °C);
- 0,5- bis 2-l-Erlenmeyer-Kolben mit engem Hals;
- Membranfiltrationsgerät oder Zentrifuge;
- Membranfilter, 0,2-0,45 µm;
- Kohlenstoffanalysator;
- Ausrüstung für spezifische Analysen (optional).
Meerwasser
10. In einem gründlich gereinigten Behältnis wird eine Meerwasserprobe genommen und möglichst innerhalb von ein bis zwei Tagen nach der Entnahme ins Labor gebracht. Während des Transports darf die Probentemperatur die Testtemperatur nicht erheblich überschreiten. Der Entnahme-Standort ist genau zu bezeichnen und hinsichtlich seines Verschmutzungsgrads und des Nährstoffgehalts zu beschreiben. Insbesondere bei Proben aus Küstengewässern werden zudem die Koloniezahl heterotropher Mikroorganismen und die Konzentrationen an gelöstem Nitrat, Ammonium und Phosphat angegeben.
11. Für die eigentliche Meerwasserprobe sind folgende Informationen anzugeben:
- Entnahmedatum:
- Tiefe der Probenahme;
- Aussehen der Probe - z.B. trüb;
- Temperatur zum Entnahmezeitpunkt;
- Salzgehalt;
- DOC;
- Zeitspanne zwischen der Probenahme und der Verwendung im Test.
12. Wenn der DOC-Gehalt der Meerwasserprobe zu hoch ist (Nummer 8), wird vor der Verwendung eine Alterung des Meerwassers um etwa eine Woche empfohlen. Die Alterung erfolgt durch Aufbewahrung unter aeroben Bedingungen bei Testtemperatur im Dunkeln oder bei diffuser Beleuchtung. Erforderlichenfalls ist durch mäßige Belüftung Sauerstoff zuzuführen. Bei der Alterung verringert sich der Anteil leicht abbaubaren organischen Materials. Im Ringtest (3) wurde kein Unterschied zwischen dem Abbaupotenzial gealterter und frisch entnommener Meerwasserproben festgestellt. Vor der Verwendung werden grobe Partikel aus dem Meerwasser abgetrennt (beispielsweise unter Filtration durch einen Nylonfilter oder ein grobes Papier (jedoch keine Membran- und keine GF-C-Filter) oder durch Ausfällen und Dekantieren). Das verwendete Verfahren wird im Bericht vermerkt. Eine Vorbehandlung wird ggf. nach der Alterung durchgeführt.
Stammlösungen mit mineralischen Nährstoffen
13. Die folgenden Stammlösungen werden mit Reagenzien in Analysequalität hergestellt:
| (a) | Kaliumdihydrogenorthophosphat, KH2PO4 | 8,50 g |
| Dikaliummonohydrogenorthophosphat, K2HPO4 | 21,75 g | |
| Dinatriummonohydrogenorthophosphat-Dihydrat, Na2HPO4.2H2O | 33,30 g | |
| Ammoniumchlorid, NH4Cl | 0,50 g | |
| In Wasser lösen und mit destilliertem Wasser auf 1 l auffüllen. | ||
| (b) | Calciumchlorid, CaCl2 | 27,50 g |
| In Wasser lösen und mit destilliertem Wasser auf 1 l auffüllen. | ||
| (c) | Magnesiumsulfat-Heptahydrat, MgSO4 7H2O | 22,50 g |
| In Wasser lösen und mit destilliertem Wasser auf 1 l auffüllen. | ||
| (d) | Eisen (III)chlorid-Hexahydrat, FeCl3 6H2O | 0,25 g |
| In Wasser lösen und mit destilliertem Wasser auf 1 l auffüllen. |
Das Ausfällen aus Lösung (d) kann verhindert werden, indem ein Tropfen konzentrierter Salzsäure oder 0,4 g Ethylendiamintetraessigsäure (EDTA, Dinatriumsalz) pro Liter hinzugegeben werden. Wenn es in einer Stammlösung zu einer Ausfällung kommt, ist die Lösung durch eine frisch hergestellte Lösung zu ersetzen.
Herstellung des Prüfmediums
14. Pro Liter vorbehandeltes Meerwasser wird jeweils 1 ml der oben genannten Stammlösungen hinzugegeben.
Inokulum
15. Zusätzlich zu den bereits im Meerwasser vorhandenen Mikroorganismen darf kein spezifisches Inokulum hinzugegeben werden. Die Anzahl der koloniebildenden Heterotrophe im Meerwasser-Prüfmedium (sowie vorzugsweise auch in den ursprünglichen Meerwasserproben) kann fakultativ (beispielsweise durch Plattenzählung mit Meerwasseragar) bestimmt werden. Dies ist insbesondere bei Proben aus Küstengewässern oder aus verschmutzten Standorten wünschenswert. Die heterotrophe mikrobiologische Aktivität des Meerwassers wird anhand eines Tests mit einem Referenzstoff geprüft.
Ansetzen der Flaschen
16. Um Kontaminationen durch Rückstände aus früheren Tests zu vermeiden, müssen sämtliche Glasgeräte äußerst sauber, wenn auch nicht unbedingt steril, sein (beispielsweise kann alkoholische Salzsäure verwendet werden) und vor der Verwendung gewaschen und getrocknet werden. Auch vor der erstmaligen Verwendung sind die Kolben zu reinigen.
17. Die Prüfstoffe werden jeweils in zwei Kolben (Duplikate) zusammen mit einer einzelnen Flasche mit dem Referenzstoff untersucht. Zur Bestimmung des analytischen Blindwerts wird ein doppelter Blindtest durchgeführt, bei dem weder der Prüfstoff noch ein Referenzstoff verwendet werden. Die Prüfstoffe werden so im Prüfmedium gelöst (einfache Zugabe über eine konzentrierte Stammlösung), dass die gewünschten Ausgangskonzentrationen von gewöhnlich 5-40 mg DOC/l erhalten wird. Die Referenzstoffe werden in der Regel bei einer Ausgangskonzentration von 20 mg DOC/l getestet. Wenn Stammlösungen der Prüfstoffe und/ oder der Referenzstoffe verwendet werden, ist sicherzustellen, dass der Salzgehalt des Meerwassermediums nicht erheblich verändert wird.
18. Wenn toxische Wirkungen zu erwarten sind oder nicht ausgeschlossen werden können, kann es empfehlenswert sein, im Versuchsaufbau einen Inhibitionstest in doppelter Ausführung vorzusehen. Die Prüfstoffe und die Referenzstoffe werden in das gleiche Gefäß gegeben. Die Konzentration des Referenzstoffes sollte identisch sein wie im Kontrollansatz (d. h. 20 mg DOC/l).
19. In die Erlenmeyer-Kolben werden geeignete Mengen an Testlösungen gegeben (bewährt hat sich eine Füllung bis etwa zur Hälfte des Fassungsvermögens); und diese anschließend lose verschlossen (z.B. mit einer Alufolie), damit noch ein Gasaustausch zwischen dem Kolben und der Umgebungsluft stattfinden kann. (Baumwollstopfen sind für DOC-Analysen ungeeignet.) Die Gefäße werden in die Schüttelmaschine gestellt und während des gesamten Tests kontinuierlich mit mäßiger Bewegung (z.B. 100 U/min) geschüttelt. Die Temperatur wird geregelt auf 15-20 (± 2 °C), und die Gefäße werden vor Lichteinfall geschützt, damit sich keine Algen bilden. Die Umgebungsluft muss frei von toxischen Materialien sein.
Physikalisch-chemische Kontrolle (optional)
20. Wenn ein abiotischer Abbau oder andere Verlustprozesse, wie Hydrolyse (ein Problem nur bei der spezifischen Analyse), eine Verflüchtigung oder eine Adsorption zu erwarten sind, ist anzuraten, eine physikalisch- chemische Kontrolle durchzuführen. Das kann durch Zugabe von Quecksilber(II)-chlorid (HgCl2) 1 (50- 100 mg/l) in die Gefäße erfolgen, um die mikrobielle Aktivität zu unterbinden. Ein erheblicher Rückgang des DOC oder eine spezifische Konzentration eines Stoffes in der physikalisch-chemischen Kontrolle deutet auf abiotische Abbaumechanismen hin. (Wenn Quecksilberchlorid verwendet wird, ist bei der DOC-Analyse auf etwaige Störungen oder die Freisetzung von Katalysatorgiften zu achten.)
Anzahl der Kolben
21. Bei einem typischen Test werden die folgenden Flaschen verwendet:
Kolben 1 und 2 - Prüfstoff (Testsuspension);
Kolben 3 und 4 - nur Meerwasser (Blindprobe);
Kolben 5 - Referenzstoff (Verfahrenskontrolle);
Kolben 6 - Prüfstoff und Referenzstoff (Toxizitätskontrolle) - optional;
Kolben 7 - Prüfstoff und Sterilisationsmittel (abiotische sterile Kontrolle) - optional.
DOC-Analyse
22. Im Laufe des Tests werden in geeigneten Intervallen Proben zur DOC-Analyse entnommen (Anlage 1). Grundsätzlich muss eine Entnahme zu Beginn des Tests (Tag 0) und an Tag 60 erfolgen. Insgesamt werden mindestens fünf Proben benötigt, um den zeitlichen Verlauf des Abbaus beschreiben zu können. Ein bestimmter zeitlicher Rahmen für die Probenahme kann nicht vorgegeben werden, da die Geschwindigkeit des biologischen Abbaus stark variiert. Die DOC-Analyse wird für die einzelnen Proben jeweils doppelt vorgenommen.
Probenahme
23. Das benötigte Probenvolumen hängt von der Analysemethode (spezifische Analyse) sowie vom verwendeten Kohlenstoffanalysator und vom gewählten Verfahren (Membranfiltration oder Zentrifugierung) zur Behandlung der Probe vor der Bestimmung des Kohlenstoffgehalts ab (Nummern 25 und 26). Vor der Probenahme ist sicherzustellen, dass das Prüfmedium gut gemischt wird und dass jegliches an den Wänden der Kolben anhaftende Material gelöst oder suspendiert wird.
24. Unmittelbar nach der Probenahme wird eine Membranfiltration oder eine Zentrifugierung vorgenommen. Erforderlichenfalls werden die gefilterten oder zentrifugierten Proben bis zu 48 Stunden bei 2-4 °C oder über längere Zeiträume bei - 18 °C aufbewahrt. (Wenn bekannt ist, dass der Stoff dadurch nicht beeinträchtigt wird, wird die Probe vor der Lagerung auf einen pH-Wert von 2 eingestellt.)
25. Membranfilter (0,2-0,45 µm) können verwendet werden, wenn gewährleistet ist, dass sie bei der Filtration weder Kohlenstoff freisetzen noch den Stoff adsorbieren (z.B. Polycarbonat-Filter). Manche Membranfilter werden mit Tensiden imprägniert und können beträchtliche Mengen an gelöstem Kohlenstoff freisetzen. Diese Filter sind dreimal nacheinander jeweils für eine Stunde in entionisiertem Wasser auszukochen. Nach dem Auskochen werden die Filter in entionisiertem Wasser aufbewahrt. Die ersten 20 ml des Filtrats werden verworfen.
26. Alternativ zur Membranfiltration können die Proben auch zentrifugiert werden. Die Zentrifugierung erfolgt über 15 Minuten bei 40.000 m.s- 2 (~ 4.000 g), vorzugsweise in einer Kühlzentrifuge.
Hinweis: Beim Zentrifugieren mit sehr niedrigen Konzentrationen scheint die Unterscheidung zwischen TOC (Total Organic Carbon = gesamter organisch gebundener Kohlenstoff) und DOC (Dissolved Organic Carbon = gelöster Kohlenstoff) nicht möglich zu sein, da entweder nicht alle Bakterien abgetrennt werden oder da der im Bakterienplasma enthaltene Kohlenstoff wieder gelöst wird. Bei höheren Prüfkonzentrationen (> 10 mg C/l) scheint der Fehler beim Zentrifugieren verhältnismäßig gering zu sein.
Häufigkeit der Probenahme
27. Wenn Analysen unmittelbar nach der Probenahme vorgenommen werden, richtet sich der Zeitpunkt der nächsten Probenahme nach dem Ergebnis der Analyse.
28. Werden Proben zur Analyse zu einem späteren Zeitpunkt aufbewahrt (Nummer 24), sind mehr als die mindestens erforderlichen fünf Proben zu nehmen. Die zuletzt entnommenen Proben werden zuerst analysiert; durch eine schrittweise 'rückwärts'- Auswahl der entsprechenden Proben für die Analyse ist es möglich, eine gute Beschreibung der Bioabbaukurve mit einer relativ geringen Anzahl analytischer Bestimmungen zu erhalten. Wenn am Ende des Tests kein biologischer Abbau erfolgt ist, brauchen keine weiteren Proben analysiert zu werden. In diesem Fall kann die Strategie der 'Rückwärtszählung' Analysekosten in erheblichem Umfang einsparen.
29. Wenn die Abbaukurve vor Tag 60 ein Plateau erreicht, wird der Test beendet. Findet der Abbau am Tag 60 offensichtlich statt, aber ist noch kein Plateau erreicht, ist der Versuch zu verlängern.
Auswertung der Ergebnisse
30. Die Ergebnisse der Analyse werden auf dem beigefügten Datenblatt (Anlage 2) protokolliert; anschließend wird der biologische Abbau des Prüfstoffes und der Referenzstoffe mit folgender Gleichung ermittelt:
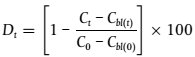
Dabei sind:
Dt = Abbau in Prozent DOC oder spezifischer Stoffabbau zum Zeitpunkt t,
Co = Ausgangskonzentration DOC oder des spezifischen Stoffs im Prüfmedium,
Ct = Konzentration DOC oder des spezifischen Stoffs im Prüfmedium zum Zeitpunkt t,
Cbl(0) = Ausgangskonzentration DOC oder des spezifischen Stoffs in der Blindprobe,
Cbl(t) = Konzentration DOC oder des spezifischen Stoffs in der Blindprobe zum Zeitpunkt t,
31. Der Abbau ist als prozentualer Abbau des gelösten organischen Kohlenstoffs (vollständiger Abbau) oder als Abbau spezifischer Stoffe (primärer Abbau) zum Zeitpunkt t anzugeben. Die DOC-Konzentrationen werden auf 0,1 mg/l berechnet; die Mittelwerte von Dt werden auf volle Prozentwerte gerundet.
32. Der Verlauf des biologischen Abbaus wird grafisch dargestellt (siehe Abbildung 'Validität und Interpretation der Ergebnisse'. Wenn hinreichende Daten vorliegen, werden aus der Kurve die 'Lag'-Phase (tL) und der Zeitpunkt berechnet, zu dem seit dem Ende der 'Lag'-Phase ein Abbau um 50 % erreicht ist (t50).
Prüfbericht
33. Der Prüfbericht muss folgende Informationen enthalten:
Prüfstoff:
- physikalischer Zustand und, soweit relevant, physikalisch-chemische Eigenschaften.
- Kenndaten;
Prüfbedingungen:
- Lage und Beschreibung des Standorts der Probenahme; Verschmutzungsgrad und Nährstoffgehalt (ggf. Koloniezahl, Nitrat, Ammonium, Phosphat);
- Merkmale der Probe (Datum der Probenahme, Tiefe, Aussehen, Temperatur, Salzgehalt, DOC (optional), Zeitraum zwischen Probenahme und Verwendung im Test;
- verwendete Methode (ggf.) zur Alterung des Meerwassers;
- Methode zur Vorbehandlung (Filtration/Sedimentation) des Meerwassers;
- Methode zur DOC-Bestimmung;
- Ausrüstung für spezifische Analysen (optional);
- Methode zur Bestimmung der Anzahl der Heterotrophen im Meerwasser (Plattenzählung oder alternatives Verfahren) (optional);
- sonstige Methoden (optional) zur Beschreibung des Meerwassers (ATP-Messungen usw.).
Ergebnisse:
- auf einem Datenblatt eingetragene Analysedaten (Anlage 2);
- Der Verlauf des Abbautests wird in einem Diagramm dargestellt, aus dem die 'Lag'-Phase (tL), die Steigung und die Dauer (ab dem Ende der 'Lag'-Phase) bis zu einem Abbau von 50 % (t50) hervorgehen. Die 'Lag'- Phase kann aufgrund der grafischen Darstellung abgeschätzt (siehe Abbildung im Abschnitt ,Validität und Interpretation der Ergebnisse') oder auch einfach als Dauer bis zu einem Abbau von 10 % angenommen werden.
- gemessener Abbau in Prozent nach 60 Tagen oder am Ende des Tests
Diskussion der Ergebnisse.
Validität und Interpretation der Ergebnisse
34. Die mit den Referenzstoffen (z.B. Natriumbenzoat, Natriumacetat oder Anilin) ermittelten Ergebnisse sollten mit den im Ringtest erhaltenen Ergebnissen (3) vergleichbar sein (siehe Abschnitt ,Referenzstoffe', Nummer 7). Wenn mit Referenzstoffen untypische Ergebnisse ermittelt werden, ist der Test mit einer anderen Meerwasserprobe zu wiederholen. Obwohl die Ergebnisse von Inhibitionstests auf Grund der Beteiligung von DOC durch den Prüfstoff nicht immer einfach zu interpretieren sind, ist eine signifikante Verringerung des gesamten gelösten Kohlenstoffs gegenüber der Kontrolle ein klares Anzeichen für toxische Effekte.
35. Wegen der Verwendung verhältnismäßig hoher Prüfkonzentrationen im Vergleich zu den meisten natürlichen Systemen (und entsprechend einem ungünstigen Verhältnis zwischen den Konzentrationen der Prüfstoffe und sonstiger Kohlenstoffquellen) wird diese Methode als Vorversuch betrachtet, mit dem ermittelt werden kann, ob ein Stoff grundsätzlich leicht biologisch abbaubar ist. Ein niedriges Ergebnis bedeutet daher nicht unbedingt, dass der Prüfstoff in der Meeresumwelt nicht biologisch abbaubar wäre, sondern ist Anzeichen dafür, dass zur Klärung weitere Arbeiten durchgeführt werden müssen.
In der folgenden Abbildung ist ein Beispiel zur Ermittlung des theoretischen Abbaus als Möglichkeit zur Abschätzung von tL (Dauer der 'Lag'-Phase) und t50 (Zeitdauer ab tL bis zu einem Abbau von 50 %) dargestellt:
________
1) Quecksilber(II)-chlorid (HgCl2) ist ein stark toxischer Stoff, die mit entsprechender Vorsicht zu handhaben ist. Wässrige Abfälle mit dieser Chemikalie sind entsprechend zu entsorgen und dürfen nicht unmittelbar in das Abwassersystem gelangen.
1. Diese Methode ist eine für Meerwasser angepasste Variante des geschlossenen Flaschen-Tests (5); sie beruht auf einem von der Europäischen Kommission organisierten und vom Dänischen Institut für Wasserqualität durchgeführten Ringtest (3).
2. Analog zur beschriebenen Schüttelmethode sind auch die Ergebnisse dieses Tests nicht als Indikatoren für eine leichte biologische Abbaubarkeit zu betrachten, sondern vielmehr zum Erhalt weiterer Informationen über die biologische Abbaubarkeit von Stoffen in der Meeresumwelt zu verwenden.
3. Eine zuvor festgelegte Menge des Prüfstoffes wird im Prüfmedium in einer Konzentration von gewöhnlich 2-10 mg/l gelöst. (Es können eine oder auch mehrere Konzentrationen verwendet werden.) Die Lösung wird in einer geschlossenen Flasche im Dunkeln in einem Bad mit konstanter Temperatur oder in einem Schrank bei einer auf ± 1 °C geregelten Temperatur von 15-20 °C aufbewahrt. Wenn mit der Untersuchung Umweltbedingungen simuliert werden sollen, können die Tests auch außerhalb dieses normalen Temperaturbereichs durchgeführt werden, sofern eine geeignete Temperaturregelung gegeben ist. Der Abbau wird über einen Zeitraum von 28 Tagen mithilfe von Sauerstoffanalysen überwacht.
4. Der Ringtest hat gezeigt, dass durch eine Ausdehnung des Tests auf mehr als 28 Tage wegen der dann meist auftretenden erheblichen Störungen keine verwendbaren Informationen erhalten wurden. Der biologische Sauerstoffbedarf (BSB) der Blindkontrolle war wahrscheinlich wegen des Wachstums an den Wänden (wegen fehlender Schüttelung) und aufgrund der Nitrifikation übermäßig hoch. Daher wird eine Dauer von 28 Tagen empfohlen. Wenn jedoch der BSB-Wert einen Anteil von 30 % nicht übersteigt (Nummern 15 und 40), kann der Test auch über einen längeren Zeitraum fortgesetzt werden.
5. Um festzustellen, ob ein Test bei einem bestimmten Stoff durchzuführen ist, müssen einige Eigenschaften des Stoffes bekannt sein. Die Summenformel wird benötigt, um den theoretischen Sauerstoffbedarf (ThSB) zu berechnen (siehe Anlage 3). Ansonsten ist als Referenzwert der chemische Sauerstoffbedarf (CSB) des jeweiligen Stoffes zu bestimmen. Die Verwendung des CSB ist weniger zufriedenstellend, da manche Stoffe beim CSB-Test nicht vollständig oxidieren.
6. Die Löslichkeit des Stoffes muss mindestens bei 2 mg/l liegen, wenngleich grundsätzlich auch weniger lösliche Stoffe (z.B. unter Ultraschallbehandlung) und flüchtige Stoffe getestet werden könnten. Informationen zur Reinheit oder zu den relativen Anteilen der Hauptkomponenten des Prüfstoffes werden benötigt, damit die Testergebnisse entsprechend interpretiert werden können. Dies gilt insbesondere bei sehr Testergebnissen nahe am 'Pass'-Level.
7. Informationen über die Toxizität des Prüfstoffes für Bakterien (beispielsweise gemessen im Kurzzeit- Atemfrequenztests (4)) können für die Wahl geeigneter Prüfkonzentrationen sehr hilfreich und für die korrekte Auswertung niedriger Abbaubarkeitswerte ausschlaggebend sein. Diese Informationen sind jedoch nicht immer hinreichend für die Interpretation der Ergebnisse von Tests zur Prüfung der biologischen Abbaubarkeit; eher geeignet ist gegebenenfalls das in Nummer 27 beschriebene Verfahren.
8. Zur Prüfung der mikrobiologischen Aktivität der Meerwasserproben sind geeignete Referenzstoffe zu verwenden. Geeignet sind beispielsweise Anilin, Natriumacetat und Natriumbenzoat. Diese Stoffe müssen in einer angemessen kurzen Zeitspanne zu mindestens 60 % ihres jeweiligen ThSB abgebaut werden; ansonsten sollte der Test mit einer anderen Meerwasserprobe wiederholt werden.
9. Im Ringtest der Europäischen Kommission, bei dem Meerwasserproben an unterschiedlichen Standorten und zu unterschiedlichen Zeitpunkten im Laufe eines Jahres genommen wurden, betrug bei Natriumbenzoat die , Lag'-Phase (tL) 0-2 Tage und die Zeitdauer bis zu einem Abbau von 50 % (t50) (ohne 'Lag'-Phase) 1-4 Tage. Für Anilin betrugen die tL-Werte 0-7 Tage und die t50-Werte 2-12 Tage.
10. Die Reproduzierbarkeit der Methode wurde im Ringtest der Europäischen Kommission nachgewiesen (3).
Apparatur
11. Übliche Laborausrüstung und folgende Geräte:
- 250-300 ml-BSB-Flaschen mit Glasstopfen oder 250-ml-Flaschen mit engem Hals und mit Glasstopfen;
- mehrere 2-, 3- und 4-l-Flaschen mit Literteilung zur Vorbereitung des Versuchs und zum Füllen der BSB- Flaschen;
- Wasserbad oder Raum mit konstanter Temperatur zur Aufbewahrung der Flaschen bei einer konstanten Temperatur (± 1 °C) unter Lichtabschluss;
- Ausrüstung zur Analyse des gelösten Sauerstoffs;
- Membranfilter, 0,2-0,45 µm (optional);
- Ausrüstung für spezifische Analysen (optional).
Meerwasser
12. Eine Meerwasserprobe wird in einem gründlich gereinigten Behältnis genommen und möglichst innerhalb von ein bis zwei Tagen nach der Entnahme ins Labor gebracht. Während des Transports darf die Probentemperatur die Testtemperatur nicht erheblich überschreiten.
13. Der Entnahme-Standort ist genau zu bezeichnen und hinsichtlich seines Verschmutzungsgrads und des Nährstoffgehalts zu beschreiben. Insbesondere bei Proben aus Küstengewässern und bei verschmutzten Gewässern werden zudem die Koloniezahl heterotropher Mikroorganismen und die Konzentrationen an gelöstem Nitrat, Ammonium und Phosphat angegeben.
14. Für die eigentliche Meerwasserprobe sind folgende Informationen anzugeben:
- Entnahmedatum:
- Tiefe der Probenahme;
- Aussehen der Probe - z.B. trüb;
- Temperatur zum Entnahmezeitpunkt;
- Salzgehalt;
- gelöster organischer Kohlenstoff (DOC = Dissolved organic Carbon);
- Zeitspanne zwischen der Probenahme und der Verwendung im Test.
15. Wenn der DOC-Gehalt der Probe zu hoch ist oder wenn vermutet wird, dass der BSB der Blindkontrolle nach 28 Tagen mehr als 30 % über dem BSB des Referenzstoffes liegt, wird vor der Verwendung eine Alterung des Meerwassers um etwa eine Woche empfohlen.
16. Die Alterung der Probe erfolgt durch Lagerung unter aeroben Bedingungen bei Testtemperatur im Dunkeln oder bei diffuser Beleuchtung. Bei Bedarf ist Sauerstoff durch mäßige Belüftung zuzuführen. Bei der Alterung verringert sich der Anteil leicht abbaubaren organischen Materials. Im Ringtest (3) wurden keine Unterschiede zwischen dem Abbaupotenzial gealterter und frisch entnommener Meerwasserproben festgestellt.
17. Vor der Verwendung werden grobe Partikel aus dem Meerwasser abgetrennt, beispielsweise unter Filtration durch einen Nylonfilter oder ein grobes Papier (jedoch keine Membran oder GF-C-Filter) oder durch Ausfällen und Dekantieren. Das verwendete Verfahren ist zu protokollieren. Diese Vorbehandlung erfolgt nach der Alterung, falls verwendet.
Stammlösungen mit mineralischen Nährstoffen
18. Die folgenden Stammlösungen werden mit Reagenzien in Analysequalität hergestellt:
| (a) | Kaliumdihydrogenorthophosphat, KH2PO4 | 8,50 g |
| Dikaliummonohydrogenorthophosphat, K2HPO4 | 21,75 g | |
| Dinatriummonohydrogenorthophosphat-Dihydrat, Na2HPO4.2H2O | 33,30 g | |
| Ammoniumchlorid, NH4Cl | 0,50 g | |
| In Wasser lösen und mit destilliertem Wasser auf 1 l auffüllen. | ||
| (b) | Calciumchlorid, CaCl2 | 27,50 g |
| In Wasser lösen und mit destilliertem Wasser auf 1 l auffüllen. | ||
| (c) | Magnesiumsulfat-Heptahydrat, MgSO4 7H2O | 22,50 g |
| In Wasser lösen und mit destilliertem Wasser auf 1 l auffüllen. | ||
| (d) | Eisen(III)chlorid-Hexahydrat, FeCl3 6H2O | 0,25 g |
| In Wasser lösen und mit destilliertem Wasser auf 1 l auffüllen. |
Das Ausfällen in der Lösung (d) kann verhindert werden, indem ein Tropfen konzentrierter Salzsäure oder 0,4 g Ethylendiamintetraessigsäure (EDTA, Dinatriumsalz) pro Liter hinzugegeben werden. Wenn es in einer Stammlösung zu einer Ausfällung kommt, ist die Lösung durch eine frisch hergestellte Lösung zu ersetzen.
Herstellung des Prüfmediums
19. Pro Liter vorbehandeltes Meerwasser wird jeweils 1 ml der oben genannten Stammlösungen hinzugegeben. Das Prüfmedium wird mit Luft (auf Testtemperatur) gesättigt, indem es etwa 20 Minuten mit sauberer Druckluft belüftet wird. Danach wird die Konzentration des gelösten Sauerstoffs für Kontrollzwecke ermittelt. Die gesättigte Konzentration an gelöstem Sauerstoff in Abhängigkeit vom Salzgehalt und von der Temperatur kann dem dieser Prüfmethode beigefügten Nomogramm entnommen werden (Anlage 4).
Inokulum
20. Zusätzlich zu den bereits im Meerwasser vorhandenen Mikroorganismen darf kein spezifisches Inokulum hinzugegeben werden. Die Anzahl der koloniebildenden Heterotrophe im Meerwasser-Prüfmedium (sowie vorzugsweise auch in der ursprünglichen Meerwasserprobe) wird beispielsweise durch Plattenzählung mit Meerwasseragar (fakultativ) bestimmt. Dies ist insbesondere bei Proben aus Küstengewässern oder aus verschmutzten Standorten wünschenswert. Die heterotrophe mikrobiologische Aktivität des Meerwassers wird anhand eines Tests mit einem Referenzstoff geprüft.
Ansetzen der Testflaschen
21. Alle erforderlichen Schritte einschließlich des Alterns und der Vorbehandlung des Meerwassers sind bei der gewählten Testtemperatur im Bereich von 15-20 °C durchzuführen; die verwendeten Glasgeräte müssen sauber sein, brauchen aber nicht sterilisiert zu werden.
22. Zur Bestimmung des BSB der Prüfstoffe und der Referenzstoffe werden mehrere Gruppen von BSB-Flaschen für gleichzeitige Versuchsreihen vorbereitet. Sämtliche Analysen sind an jeweils zwei Flaschen (Blindkontrollen, Referenzstoffe und Prüfstoffe) vorzunehmen, d. h. für jede Messung werden jeweils zwei Flaschen vorbereitet. Die Analysen werden mindestens an den Tagen 0, 5, 15 und 28 vorgenommen (4 Messungen). Für die Analysen des Sauerstoffbedarfs werden insgesamt 3 × 2 × 4 = 24 Flaschen (Blindprobe, Referenzstoff und Prüfstoff) und entsprechend etwa 8 l Prüfmedium (pro Konzentration des Prüfstoffes) benötigt.
23. Von den Prüfstoffen und den Referenzstoffen werden in großen Flaschen mit hinreichendem Fassungsvermögen (siehe Nummer 11) getrennte Lösungen hergestellt, indem die Prüfstoffe bzw. die Referenzstoffe zunächst entweder direkt oder über eine konzentrierte Stammlösung in die teilweise gefüllten großen Flaschen gegeben werden. Danach wird weiteres Prüfmedium hinzugefügt, bis die gewünschte Endkonzentration erreicht ist. Wenn Stammlösungen der Prüfstoffe und/oder der Referenzstoffe verwendet werden, ist sicherzustellen, dass der Salzgehalt des Meerwassermediums nicht erheblich verändert wird.
24. Bei der Auswahl der Prüfstoffe und der Referenzstoffe sind die folgenden Punkte zu berücksichtigen:
- die Löslichkeit des gelösten Sauerstoffs im Meerwasser bei der jeweiligen Testtemperatur und beim jeweiligen Salzgehalt (siehe beigefügtes Nomogramm, Anlage 4);
- der BSB der Blindprobe des Meerwassers und
- der erwartete biologische Abbau des Prüfstoffes.
25. Bei einer Temperatur von 15 °C bzw. 20 °C und einem Salzgehalt von 32 ppm (Meerwasser) liegt die Löslichkeit des gelösten Sauerstoffs etwa bei 8,1 bzw. 7,4 mg/l. Der Sauerstoffbedarf des eigentlichen Meerwassers (Sauerstoffzehrung der Blindprobe) kann 2 mg O2/l oder mehr betragen, wenn das Meerwasser nicht gealtert ist. Um eine signifikante Sauerstoffkonzentration nach der Oxidation des Prüfstoffes sicherzustellen, wird bei Stoffen, bei denen (ebenso wie bei den Referenzstoffen) unter den Testbedingungen ein vollständiger Abbau erwartet wird, mit einer Ausgangskonzentration des Prüfstoffes von etwa 2-3 mg/l (je nach ThSB) begonnen. Weniger leicht abbaubare Stoffe werden mit höheren Konzentrationen (bis zu etwa 10 mg/l) getestet, wenn keine toxischen Wirkungen eintreten. Es kann vorteilhaft sein, Tests gleichzeitig mit einer niedrigen (ca. 2 mg/l) und einer hohen (ca. 10 mg/l) Konzentration des Prüfstoffesdurchzuführen.
26. Parallel muss eine Sauerstoff-Kontrolle in Flaschen geprüft werden, die weder den Prüfstoff noch einen Referenzstoff enthalten.
27. Wenn Inhibitionswirkungen festgestellt werden sollen, sind die folgenden Reihen von Lösungen in getrennten großen Flaschen herzustellen (Nummer 13):
- 2 mg/l eines leicht abbaubaren Stoffs (z.B. eine der genannten Referenzstoffe);
- x mg/l Prüfstoff (x ist gewöhnlich 2);
- 2 mg/l leicht abbaubarer Stoff und x mg/l Prüfstoff.
Physikalisch-chemische Kontrolle (optional)
28. Wenn spezifische Analysen durchgeführt werden sollen, kann mit einem physikalisch-chemischen Versuch geprüft werden, ob der Prüfstoff durch abiotische Prozesse (z.B. Hydrolyse oder Adsorption) abgebaut wird. Ein physikalisch-chemischer Kontrolltest kann durchgeführt werden durch Zugabe von Quecksilber(II)-chlorid (HgCl2) 1(50-100 mg/l) zu zwei Gefäßen mit dem Prüfstoff, um das Wachstum von Mikroorganismen zu unterbinden. Ein signifikanter Rückgang der Konzentration des spezifischen Stoffs im Laufe des Tests ist Anzeichen für die Wirkung abiotischer Abbaumechanismen.
Anzahl der BSB-Flaschen bei einem typischen Testdurchlauf
29. Bei einem typischen Test werden die folgenden Flaschen verwendet:
- mindestens 8 Flaschen mit des Prüfstoffs,
- mindestens 8 Flaschen mit Meerwasser, das nur mit Nährstoffen angereichert wurde,
- mindestens 8 Flaschen mit dem Referenzstoff und (erforderlichenfalls)
- 6 Flaschen mit Prüfstoffen und Referenzstoffen (zur Toxizitätskontrolle).
30. Nach der Herstellung werden die einzelnen Lösungen umgehend aus dem unteren Viertel (aber nicht ganz vom Boden) der jeweiligen großen Flasche abgesaugt, um die entsprechende Gruppe von BSB-Flaschen zu füllen. Unmittelbar danach wird der Anteil des gelösten Sauerstoffs in den Null-Kontrollen (d. h. den Kontrollen zum Zeitpunkt 0) geprüft (Nummer 33), oder die Kontrollen werden für eine spätere chemische Analyse durch Ausfällung mit MnCl2 (Mangan(II)-chlorid) und NaOH (Natriumhydroxid) aufbewahrt.
31. Die übrigen parallelen BSB-Flaschen werden bei Testtemperatur (15-20 °C) im Dunkeln inkubiert; in regelmäßigen Zeitabständen werden sie aus dem Inkubationsbereich genommen (mindestens z.B. nach 5, 15 und 28 Tagen) und auf den Anteil an gelöstem Sauerstoff geprüft (Nummer 33).
32. Die Proben werden einer Membranfilteration (0,2-0,45 µm) unterzogen oder 15 Minuten lang zentrifugiert, um spezifische Analysen durchzuführen (optional). Werden die Analysen nicht unmittelbar danach durchgeführt, sind die gefilterten oder zentrifugierten Proben bis zu 48 Stunden bei 2-4 °C oder über längere Zeiträume bei - 18 °C aufzubewahren. (Wenn bekannt ist, dass der Prüfstoff dadurch nicht beeinträchtigt wird, wird die Probe vor der Lagerung auf einen pH-Wert von 2 eingestellt.)
Bestimmung der Konzentration des gelösten Sauerstoffs
33. Die Konzentration des gelösten Sauerstoffs wird mit einer national oder international anerkannten chemischen oder elektrochemischen Methode ermittelt.
Auswertung der Ergebnisse
34. Die Analyseergebnisse werden auf den beigefügten Datenblättern protokolliert (Anlage 5).
35. Der BSB wird als Unterschied zwischen dem Sauerstoffabbau einer Blindprobe und einer Lösung des Prüfstoffs unter den Testbedingungen ermittelt. Der Nettoabbau des Sauerstoffs wird durch die Konzentration (w/w) des jeweiligen Stoffs geteilt, um den BSB als mg BSB/mg Prüfsubstanz auszudrücken. Als Abbau wird das Verhältnis des biochemischen Sauerstoffbedarfs entweder (vorzugsweise) zum theoretischen Sauerstoffbedarf (ThSB) oder zum chemischen Sauerstoffbedarf (CSD) in Prozent bezeichnet (siehe Nummer 36).
36. Der biologische Abbau wird für die Prüfstoffe und die Referenzstoffe bezogen auf die einzelnen Zeitpunkte der Probenahme mit einer der folgenden Gleichungen ermittelt:
Dabei sind:
ThSB = theoretischer Sauerstoffbedarf (Berechnung, Anlage 3)
CSB = chemischer Sauerstoffbedarf; experimentell zu bestimmen
Hinweis: Manchmal führen die zwei Berechnungsmethoden (prozentualer ThSB oder prozentualer CSB) zu unterschiedlichen Ergebnissen. In diesen Fällen ist vorzugsweise vom ThSB auszugehen, da manche Stoffe im CSB-Test nicht vollständig oxidiert werden.
37. Der Verlauf des Tests zum biologischen Abbau wird grafisch dargestellt (siehe z.B. Abbildung 'Validität und Interpretation der Ergebnisse'). Wenn hinreichende Daten vorliegen, werden aus der Kurve die 'Lag'-Phase (tL) und der Zeitpunkt berechnet, zu dem seit dem Ende der 'Lag'-Phase ein Abbau um 50 % erreicht ist (t50
38. Wenn spezifische Analysen durchgeführt werden (optional), ist der prozentuale primäre Abbau als Prozentanteil des Abbaus eines spezifischen Stoffs während der Prüfdauer (bereinigt um Blindproben) anzugeben.
Prüfbericht
39. Der Prüfbericht muss folgende Informationen enthalten:
Prüfstoff:
- physikalischer Zustand und, soweit relevant, physikalisch-chemische Eigenschaften.
- Kenndaten;
Prüfbedingungen:
- Lage und Beschreibung des Standorts der Probenahme; Verschmutzungsgrad und Nährstoffgehalt (ggf. Koloniezahl, Nitrat, Ammonium, Phosphat);
- Merkmale der Probe (Datum der Probenahme, Tiefe, Aussehen, Temperatur, Salzgehalt, DOC (optional), Zeitraum zwischen Probenahme und Verwendung im Test;
- verwendete Methode (ggf.) zur Alterung des Meerwassers;
- Methode zur Vorbehandlung (Filtration/Sedimentation) des Meerwassers;
- Methode zur CSB-Bestimmung (wenn durchgeführt);
- Methode für die Sauerstoffmessungen;
- Verfahren zur Dispergierung von unter den Testbedingungen schlecht löslichen Stoffen;
- Methode zur Bestimmung der Anzahl der Heterotrophen im Meerwasser (Plattenzählung oder alternatives Verfahren);
- Methode zur Bestimmung des Meerwasser-DOC (optional);
- Ausrüstung für spezifische Analysen (optional);
- sonstige optionale Methoden zur Beschreibung des Meerwassers (ATP-Messungen usw.).
Ergebnisse:
- auf einem Datenblatt eingetragene Analysedaten (beigefügt, Anlage 5);
- der Verlauf des Abbautests wird in einem Diagramm dargestellt, aus dem die ,Lag'-Phase (tL)die Steigung und die Dauer (ab dem Ende der ,Lag'-Phase) bis zu einem Anteil von 50 % der durch die Oxidation des Prüfstoffes bewirkten endgültigen Sauerstoffzehrung (t50) hervorgehen. Die 'Lag'-Phase kann aufgrund der grafischen Darstellung (in der beigefügten Abbildung) abgeschätzt werden oder einfach aufgrund des Zeitbedarfs für einen Abbau um 10 % ermittelt werden;
- prozentualer Abbau, gemessen nach 28 Tagen. Diskussion der Ergebnisse.
Validität und Interpretation der Ergebnisse
40. Die Sauerstoffzehrung der Blindprobe muss sich auf 30 % des Sauerstoffs in der Testflasche beschränken. Wenn dieses Kriterium mit frisch entnommenem Meerwasser nicht erfüllt werden kann, muss das Meerwasser vor der Verwendung altern (stabilisiert werden).
41. Zu berücksichtigen ist, dass stickstoffhaltige Stoffe die Ergebnisse beeinträchtigen können.
42. Mit den Referenzstoffen Natriumbenzoat und Anilin ermittelte Ergebnisse müssen mit den Ergebnissen des Ringtests (3) (Nummer 9) vergleichbar sein. Wenn mit Referenzstoffen untypische Ergebnisse ermittelt werden, ist der Test mit einer anderen Meerwasserprobe zu wiederholen.
43. Es kann davon ausgegangen werden, dass der Prüfstoff das Bakterienwachstum (bei der verwendeten Konzentration) hemmt, wenn der BSB des Referenzstoffs und des Prüfstoffes geringer ist als die Summe der BSB-Werte der getrennten Lösungen der beiden Stoffe.
44. Wegen der verhältnismäßig hohen Prüfkonzentrationen im Vergleich zu den meisten natürlichen Systemen (und entsprechend einem ungünstigen Verhältnis zwischen den Konzentrationen des Prüfstoffes und sonstiger Kohlenstoffquellen) wird diese Methode als Vorversuch betrachtet, mit dem ermittelt werden kann, ob ein Stoff grundsätzlich leicht biologisch abbaubar ist. Ein niedriges Ergebnis bedeutet entsprechend nicht unbedingt, dass der Prüfstoff in der Meeresumwelt nicht biologisch abbaubar wäre, sondern ist Anzeichen dafür, dass zur Klärung weitere Arbeiten durchgeführt werden müssen.
In der folgenden Abbildung ist ein Beispiel zur Ermittlung des theoretischen Abbaus als Möglichkeit zur Abschätzung von tL (Dauer der ,Lag'-Phase) und t50 (Zeitdauer ab tL bis zu einem Anteil von 50 % der endgültigen Sauerstoffzehrung infolge der Oxidation des Prüfstoffs) dargestellt:
(1) de Kreuk J.F., und Hanstveit A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561-573.
(2) Kapitel C.4-B in diesem Anhang: Bestimmung der 'leichten' biologischen Abbaubarkeit, Teil III, Modifizierter OECD-Screening-Test.
(3) Nyholm N., und Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, März 1987, Kommission der Europäischen Gemeinschaften.
(4) Kapitel C.11 in diesem Anhang: Biologische Abbaubarkeit - Belebtschlamm-Atmungshemmungstest
(5) Kapitel C.4-E in diesem Anhang: Bestimmung der 'leichten' biologischen Abbaubarkeit, Teil IV: Geschlossener Flaschen-Test.
________
1) Quecksilber(II)-chlorid (HgCl2) ist ein stark toxischer Stoff, die mit entsprechender Vorsicht zu handhaben ist. Wässrige Abfälle mit dieser Chemikalie sind entsprechend zu entsorgen und dürfen nicht in das Abwassersystem gelangen.
| Bestimmung des Gehalts an organischem Kohlenstoff in Meerwasser | Anlage 1 |
Schüttelmethode
Zur Ermittlung des Anteils an organischem Kohlenstoff in einer Wasserprobe werden die organischen Bestandteile der Probe mit einem der folgenden Verfahren zu Kohlendioxid oxidiert:
- Nassoxidation durch Persulfat/UV-Bestrahlung;
- Nassoxidation durch Persulfat/höhere Temperatur (116-130 °C);
- Verbrennung.
Die Menge des entstandenen CO2 wird durch Infrarotspektrometrie oder Titrimetrie ermittelt. Alternativ wird das CO2 zu Methan reduziert; dieses wird auf einem Flammenionisations-Detektor (FID) quantifiziert.
Die Methode mit Persulfat/UV-Bestrahlung ist bei der Analyse von 'sauberem' Wasser mit geringem Partikelgehalt allgemein üblich. Die beiden letztgenannten Methoden können bei den meisten Wasserproben angewendet werden; die Methode der Oxidation mit Persulfat und einer höheren Temperatur ist besonders für Proben mit niedriger Konzentration geeignet, und die Verbrennung empfiehlt sich für Verfahren mit nicht flüchtigen organischen Kohlenstoffen (NVOC = Non-Volatile Organic Carbon) in einer Konzentration von deutlich über 1 mg C/l.
Störungen
Bei allen drei Verfahren muss in den Proben vorhandener anorganischer Kohlenstoff entfernt oder kompensiert werden. Die für die Entfernung von anorganischem Kohlenstoff am häufigsten verwendete Methode ist die Ausschleusung von CO2, auch wenn dabei flüchtige organische Verbindungen verloren gehen (1). Die vollständige Entfernung oder Kompensation des anorganischen Kohlenstoffs ist für jede einzelne Probenmatrix sicherzustellen; je nach Probentyp muss zusätzlich zum NVOC der Anteil an flüchtigem Kohlenstoff (VOC = Volatile Organic Carbon) bestimmt werden.
Bei Verwendung der Persulfat-/UV-Methode (2) führen hohe Chloridkonzentrationen zu einer Verringerung der Oxidationseffizienz. Mit einem durch Zusatz von Quecksilber-(II)-nitrat modifizierten Oxidationsreagens kann diese Störung jedoch verhindert werden. Es wird empfohlen, dass zur Untersuchung der verschiedenen Typen chloridhaltiger Proben das maximal zulässige Probenvolumen verwendet wird. Hohe Salzkonzentrationen der mit der Verbrennungsmethode analysierten Proben können zur Bildung einer Salzschicht auf dem Katalysator und zu übermäßiger Korrosion des Verbrennungsrohrs führen. Daher sind die entsprechenden Sicherheitsvorkehrungen gemäß den Herstelleranweisungen (Handbuch) zu treffen.
Stark getrübte Proben sowie Proben mit Partikelmaterial können mit der Persulfat-/UV-Methode unter Umständen nicht vollständig oxidieren.
Beispiel einer geeigneten Methode
Der Anteil an nicht flüchtigem organischem Kohlenstoff wird durch Oxidation mit Persulfat/UV-Bestrahlung und anschließende Quantifizierung des entstandenen CO2 durch nichtdispersive Infrarotspektronomie ermittelt.
Das Oxidationsreagens wird nach den Vorschlägen in (2) und gemäß den Herstelleranweisungen modifiziert:
- 8,2 g HgCl2 und 9,6 g Hg(NO3)2.H2O werden in mehreren Hundert Millilitern Reagenzwasser mit niedriger Kohlenstoffkonzentration gelöst.
- 20 g K2S2O8 werden in Quecksilbersalzlösung gelöst.
- 5 ml HNO3 (konz.) werden zum Gemisch hinzugegeben.
- Das Reagens wird auf 1.000 ml verdünnt.
Die Störung durch das Chlorid wird unterbunden, indem für 10 %iges Chlorid ein Probenvolumen von 40 µl und für 1,9 %iges Chlorid ein Probenvolumen von 200 ¼l verwendet wird. Proben mit hohen Chloridkonzentrationen und/oder größere Probenvolumina können mit dieser Methode analysiert werden, wenn eine Chloridakkumulation im Oxidationsgefäß verhindert wird. Anschließend kann (wenn für den betreffenden Probentyp von Bedeutung) der Anteil an flüchtigem organischem Kohlenstoff ermittelt werden.
(1) ISO, Water quality - determination of total organic carbon. Draft International Standard ISO/DIS 8245, 16. Januar 1986.
(2) American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Ebenfalls von Interesse (Beschreibung eines automatischen Analysesystems):
(3) Schreurs W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137-142.
| Biologischer abbau in Meerwasser | Anlage 2 |
SchüttelmethodeDatenblatt
1. Labor:
2. Datum des Testbeginns:
3. Prüfstoff:
| Name: | |
| Konzentration der Stammlösung: | mg/l als Stoff |
| Ausgangskonzentration im Medium, to: | mg/l als Stoff |
| : | mg DOC/l |
4. Meerwasser:
| Herkunft: | |
| Entnahmedatum: | |
| Tiefe der Probenahme: | |
| Aussehen zum Entnahmezeitpunkt (z.B. trüb): | |
| Salzgehalt bei Entnahme: | ‰ |
| Temperatur bei Entnahme: | °C |
| DOC 'x' Stunden nach der Entnahme: | mg/l |
| Vorbehandlung vor dem Test (Filtration, Sedimentation, Alterung usw.): | |
| Mikrobenkoloniezahl | - ursprüngliche Probe: Kolonien/ml |
| - zu Beginn des Tests: Kolonien/ml | |
| Sonstige Merkmale: |
5. Ermittlung des Kohlenstoffgehalts:
Kohlenstoffanalysator:
| Kolben Nr. | DOC nach n Tagen (mg/l) | ||||||
| 0 | n1 | n2 | n3 | nx | |||
| Test: mit Nährstoffen angereichertes Meerwasser mit Prüfstoff | 1 | a1 | |||||
| a2 | |||||||
| mittlere Ca(t) | |||||||
| 2 | b1 | ||||||
| b2 | |||||||
| mittlere Cb(t) | |||||||
| Blindprobe: mit Nährstoffen angereichertes Meerwasser ohne Prüfstoff | 1 | c1 | |||||
| c2 | |||||||
| mittlere Cc(t) | |||||||
| 2 | D1 | ||||||
| d2 | |||||||
| mittlere Cd(t) | |||||||
 | |||||||
6. Evaluierung der Rohdaten:
| Kolben Nr. | Berechnung der Ergebnisse: | % Abbau nach n Tagen | ||||
| 0 | n1 | n2 | n3 | nx | ||
| 1 |  | 0 | ||||
| 2 |  | 0 | ||||
| Mittelwert * | 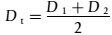 | 0 | ||||
| *) Bei erheblichen Unterschieden darf kein Mittelwert aus D1 und D2 gebildet werden. | ||||||
Hinweis: Ähnliche Formate können bei Durchführung einer spezifischen Analyse sowie für die Referenzstoffe und für Toxizitätskontrollen verwendet werden.
7. Abiotischer Abbau (optional)
| Zeit (Tage) | ||
| 0 | T | |
| Konzentration DOC (mg/l) in steriler Kontrolle | Cs(o) | Cs(t) |
| Berechnung des theoretischen biochemischen Sauerstoffbedarfs | Anlage 3 |
Geschlossener Flaschen-Test
Der ThSB des Stoffs CcHhClclNnNanaOoPpSs mit der Molekülmasse MW wird wie folgt berechnet:
Diese Berechnung geht davon aus, dass C in CO2, H in H2O, P in P2O5 und Na in Na2O umgewandelt wird. Halogene werden zu Halogenwasserstoff und Stickstoff zu Ammoniak abgebaut.
Beispiel:
Glucose C6H12O6, MW = 180
Die Molekülmassen von Salzen (mit Ausnahme der Alkalimetalle) werden unter der Annahme berechnet, dass die Salze durch Hydrolyse aufgelöst wurden.
Es wird angenommen, dass Schwefel bis auf Stufe +6 oxidiert wurde. Beispiel:
Natrium ndodecylbenzolsulfonat C18H29SO3Na, MW = 348
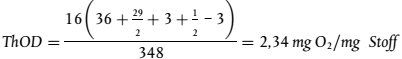
Bei stickstoffhaltigen Stoffen kann der Stickstoff entsprechend dem jeweiligen theoretischen biochemischen Sauerstoffbedarf zu Ammoniak, Nitrit oder Nitrat abgebaut werden.
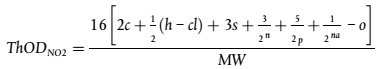
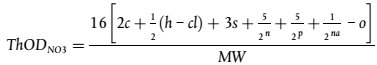
Annahme: Bei einem sekundären Amin wurde durch Analyse eine vollständige Nitratbildung festgestellt:
(C12H25)2 NH, MW = 353
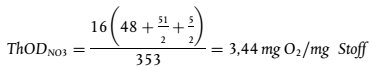
| Anlage 4 |
| Biologischer Abbau in Meerwasser | Anlage 5 |
| Geschlossener Flaschen-Test |
| Datenblatt |
1. Labor:
2. Datum des Prüfbeginns:
3. Prüfstoff:
| Name: | |
| Konzentration der Stammlösung: | mg/l |
| Ausgangskonz. in Meerwassermedium: | mg/l |
| ThSB oder CSB: | mg O2/mg Prüfstoff |
4. Meerwasser:
| Herkunft: | ||
| Entnahmedatum: | ||
| Tiefe der Probenahme: | ||
| Aussehen zum Entnahmezeitpunkt (z.B. trüb): | ||
| Salzgehalt bei Entnahme: | ‰ | |
| Temperatur bei Entnahme: | °C | |
| DOC 'x' Stunden nach der Entnahme: | mg/l | |
| Vorbehandlung vor dem Test (Filtration, Sedimentation, Alterung usw.): | ||
| Mikrobenkoloniezahl | - ursprüngliche Probe: | Kolonien/ml |
| - zu Beginn des Tests: | Kolonien/ml | |
| Sonstige Merkmale: | ||
5. Prüfmedium:
| Temperatur nach Belüftung: | °C |
| O2-Konzentration nach Belüftung und Stand vor Beginn des Tests: | mg O2/l |
6. Bestimmung des gelösten Sauerstoffs:
Methode:
Winkler/Elektrode
| Kolben Nr. | mg O2/l nach n Tagen | |||||
| 0 | 5 | 15 | 28 | |||
| Test: Nährstoff angereichertes Meerwasser mit Prüfstoff | 1 | a1 | ||||
| 2 | a2 | |||||
| Mittelwert Blindkontrolle | 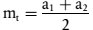 | |||||
| Blindprobe:
Nährstoff - angereichertes Meerwasser ohne Prüfstoff | 1 | c1 | ||||
| 2 | c2 | |||||
| Mittelwert Test | 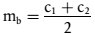 | |||||
Hinweis: Ein ähnliches Format kann für den Referenzstoff und für die Toxizitätskontrollen verwendet werden.
7. Abbau des gelösten Sauerstoffs (DO): Prozentualer Abbau (% D):
| DO-Abbau nach n Tagen | |||
| 5 | 15 | 28 | |
| (mb - mt) 1 | |||
|
| |||
1) Es wird angenommen mb(o) = mt(o), Dabei sind:
mb(o) = Wert der Blindprobe an Tag 0, | |||
C.43. Anaerobe biologische Abbaubarkeit organischer Stoffe in Faulschlamm: Bestimmung durch Messung der Gasproduktion 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 311 (2006). Es gibt eine Reihe von Screening-Tests zur Bewertung der aeroben biologischen Abbaubarkeit organischer Stoffe (Prüfmethoden C.4, C.9, C.10 und C.11 (1) und OECD-Prüfrichtlinie TG 302C (2)). Die Ergebnisse dieser Tests konnten erfolgreich zur Vorhersage des Verhaltens von Chemikalien in der aeroben Umwelt, insbesondere in den aeroben Stufen der Abwasserbehandlung, verwendet werden. Verschiedene Anteile von wasserunlöslichen Chemikalien, sowie jene Stoffanteile, die an Feststoffe gebunden sind, werden aerob umgewandelt. Der größere Anteil dieser Stoffe wird jedoch an den primär ausgefällten Schlamm gebunden, der in den Absetzbecken vom Rohabwasser getrennt wird, bevor der abgesetzte Schlamm bzw. der Überstand aerob umgewandelt wird. Der Schlamm, der einige der löslichen Stoffe im Porenwasser enthält, wird dann zur anaeroben Umwandlung in die beheizten Faulbehälter geführt. Bislang gibt es in dieser Reihe noch keine Tests zur Bewertung der anaeroben biologischen Abbaubarkeit in anaeroben Faulbehältern; der hier beschriebene Test soll diese Lücke schließen. Der Test ist nicht zwangsläufig auf andere, anoxische Umweltkompartimente übertragbar.
2. Respirometrische Verfahren zur Messung der Mengen an produzierten Gasen - vorwiegend Methan (CH4) und Kohlendioxid (CO2) unter anaeroben Bedingungen - wurden erfolgreich zur Bewertung der anaeroben biologischen Abbaubarkeit eingesetzt. Birch et al. (3) haben diese Verfahren untersucht und bezeichnen die auf früheren Studien (5)(6)(7) beruhende Arbeit von Shelton und Tiedje (4) als die umfassendste Untersuchung. Die von anderen (8) weiterentwickelte Methode (4) hat sich in den USA als Standard etabliert (9)(10); mit dieser Methode wurden die Probleme im Zusammenhang mit den unterschiedlichen Löslichkeiten von CO2 und CH4 im Prüfmedium und in Verbindung mit der Berechnung der theoretischen Gasproduktion eines Prüfstoffs aber nicht gelöst. Im ECETOC-Bericht (3) wurde die zusätzliche Messung des gelösten anorganischen Kohlenstoffs (DIC = Dissolved Inorganic Carbon) im flüssigen Überstand empfohlen; dadurch wurde das Verfahren in größerem Umfang einsetzbar. Die ECETOC-Methode wurde einer internationalen Kalibrierungsuntersuchung (einem Ringtest) unterzogen und zur ISO-Norm 11734 entwickelt (11).
3. Die hier beschriebene Prüfmethode beruht auf ISO 11734 (11) und beschreibt ein Screeningverfahren zur Bewertung der potenziellen anaeroben biologischen Abbaubarkeit organischer Stoffe unter bestimmten Gegebenheiten (d. h. in einem anaeroben Faulbehälter zu einem bestimmten Zeitpunkt und mit verschiedenen Konzentrationen von Mikroorganismen). Da ein verdünnter Schlamm mit verhältnismäßig hoher Konzentration des Prüfstoffes verwendet wird und da die Prüfdauer in der Regel nicht mit der Retentionszeit in anaeroben Faulbehältern übereinstimmt, decken sich die Prüfbedingungen nicht unbedingt mit den Bedingungen in anaeroben Faulbehältern; außerdem kann die Prüfung nicht zur Beurteilung der anaeroben biologischen Abbaubarkeit organischer Stoffe unter verschiedenen Umweltbedingungen verwendet werden. Der Schlamm wird dem Prüfstoff bis zu 60 Tage lang ausgesetzt; dieser Zeitraum ist länger als die normale Rententionszeit des Schlamms (25-30 Tage) in anaeroben Faulbehältern; in Industrieanlagen können die Rententionszeiten unter Umständen allerdings erheblich länger sein. Die Prognosen aufgrund der Ergebnisse dieser Prüfung sind weniger zuverlässig als beim aeroben biologischen Abbau, denn die Hinweise, die über das Verhalten von Prüfstoffen in Tests zur ,leichten' biologischen Abbaubarkeit und in Simulationstests sowie in der aeroben Umwelt gewonnen wurden, reichen aus, um von einem Zusammenhang ausgehen zu können. Für die anaeroben Umweltbedingungen liegen wenig vergleichbare Erfahrungen vor. Ein vollständiger anaerober biologischer Abbau kann als erfolgt betrachtet werden, wenn 75-80 % der theoretischen Gasproduktion erreicht sind. Aufgrund der hohen Konzentrationen des Prüfstoffs im Vergleich zur Biomasse in diesen Prüfungen kann davon ausgegangen werden, dass ein Stoff, der als aerob abbaubar eingestuft wird, eher auch in einem anaeroben Faulbehälter abgebaut wird. Wenn Stoffe im Test nicht zu Gas umgewandelt werden, sind diese nicht zwangsläufig auch bei realistischeren Umweltbedingungen (Konzentration Stoff: Biomasse) persistent. Außerdem kommt es zu weiteren anaeroben Reaktionen, durch die Stoffe mindestens teilweise abgebaut werden können (z.B. durch Dechlorierung); diese Reaktionen werden mit diesem Test aber nicht nachgewiesen. Mit spezifischen Analysemethoden zum Nachweis des Prüfstoffs kann auch ihr Verschwinden überwacht werden (siehe Nummern 6, 30, 44 und 53).
4. Gewaschener Faulschlamm 1 mit niedrigen (< 10 mg/l) Konzentrationen an anorganischem Kohlenstoff (IC, inorganic carbon) wird etwa zehnfach auf eine Feststoffkonzentration von insgesamt 1-3 g/l verdünnt und bis zu 60 Tage bei 35 °C ± 2 °C in verschlossenen Gefäßen mit dem Prüfstoff in einer Konzentration von 20- 100 mg C/l inkubiert. Um die Aktivität des Schlamms zu berücksichtigen, werden parallel Blindkontrollen mit einem Schlamm-Inokulum (aber ohne den Prüfstoff) im Medium geprüft.
5. Der durch die Kohlendioxid- und Methanproduktion verursachte Druckanstieg im Gasraum (headspace) der Prüfgefäße wird gemessen. Das erzeugte CO2 wird unter Prüfbedingungen zu einem erheblichen Teil in der flüssigen Phase gelöst oder in Karbonat oder Hydrogencarbonat umgewandelt. Dieser Anteil an anorganischem Kohlenstoff wird am Ende der Prüfung gemessen.
6. Der Kohlenstoffanteil (anorganisch und Methan) infolge des biologischen Abbaus des Prüfstoffs wird aus der Netto-Gasproduktion und der Netto-Produktion an anorganischem Kohlenstoff in der flüssigen Phase berechnet, die über die Produktion in der Blindkontrolle hinausgeht. Der Umfang des biologischen Abbaus wird aus dem insgesamt produzierten anorganischen Kohlenstoff und dem Methan-C als Prozentanteil des gemessenen oder berechneten Anteils des als Prüfstoff hinzugefügten Kohlenstoffs ermittelt. Der Verlauf des biologischen Abbaus kann durch Zwischenmessungen der Gasproduktion allein gemessen werden. Außerdem kann durch spezifische Analysen zu Beginn und am Ende der Prüfung der biologische Primärabbau ermittelt werden.
7. Die Reinheit, Wasserlöslichkeit, Flüchtigkeit und das Adsorptionsverhalten des Prüfstoffs müssen bekannt sein, damit die Ergebnisse korrekt ausgewertet werden können. Der Gehalt des Prüfstoffs an organischem Kohlenstoff (% w/w) muss entweder aufgrund ihrer chemischen Struktur oder aus Messungen bekannt sein. Bei flüchtigen Prüfstoffen bietet die gemessene oder berechnete Henry-Konstante einen Anhaltspunkt dafür, ob die Prüfung geeignet ist. Angaben über die Toxizität des Prüfstoffs gegenüber anaeroben Bakterien sind wichtig für die Auswahl einer geeigneten Prüfkonzentration und die Interpretationg der Ergebnisse bei einem geringen Abbau. Es wird empfohlen, eine Hemmkontrolle vorzusehen, außer wenn bekannt ist, dass der Prüfstoff keine Hemmung der Aktivität anaerober Mikroorganismen bewirkt (siehe Nummer 21 und ISO 13641-1 (12)).
8. Die Prüfmethode kann bei wasserlöslichen Stoffen angewendet werden. Bei schlecht löslichen und nicht löslichen Stoffen ist sie anwendbar, wenn eine Methode mit exakter Dosierung verwendet wird (siehe z.B. ISO 10634 (13)). Generell ist bei flüchtigen Stoffen im Einzelfall zu entscheiden. Beispielsweise müssen besondere Schritte eingeleitet werden, damit während der Prüfung kein Gas freigesetzt wird.
9. Um das Verfahren zu überprüfen, wird ein Referenzstoff getestet; dazu werden im Rahmen der normalen Testdurchläufe parallel geeignete Gefäße bereitgestellt. Beispiele sind etwa Phenol, Natriumbenzoat und Polyethylenglykol 400; bei diesen Stoffen ist innerhalb von 60 Tagen ein Abbau um mehr als 60 % der theoretischen Gasproduktion (d.h. Methan und anorganischer Kohlenstoff) zu erwarten (3)(14).
Reproduzierbarkeit von Prüfergebnissen
10. In einem internationalen Ringtest (14) wurde eine gute Reproduzierbarkeit bei den Messungen des Gasdrucks in drei Replikaten festgestellt. Die relative Standardabweichung (Variationskoeffizient) lag überwiegend unter 20 %; allerdings stieg dieser Wert in Verbindung mit toxischen Stoffen sowie gegen Ende der 60-tägigen Inkubationsdauer häufig auf über 20 %. Stärkere Abweichungen wurden auch bei Gefäßen mit einem Fassungsvermögen von < 150 ml festgestellt. Die endgültigen pH-Werte der Prüfmedien lagen zwischen 6,5 und 7,0.
11. Im Ringtest wurden folgende Ergebnisse ermittelt:
| Prüfstoff | Daten insg. n1 | Mittlerer Abbau (bezogen auf die Gesamtdaten (%) | Relative Standardabweichung (bezogen auf die Gesamtdaten) | Valide Daten n2 | Mittlerer Abbau (aus validen Daten)
(%) | Relative Standardabweichung (aus validen Daten (%) | Daten > 60 % Abbau in validen Tests n3 |
| Palmitinsäure | 36 | 68,7 + 30,7 | 45 | 27 | 72,2 + 18,8 | 26 | 19 = 70 % (*) |
| Polyethylen Glycol 400 | 38 | 79,8 + 28,0 | 35 | 29 | 77,7 + 17,8 | 23 | 24 = 83 % (*) |
| *) Anteil n2 | |||||||
12. Die Variationskoeffizienten des Mittelwerts aller mit Palmitinsäure und Polyethylenglykol 400 ermittelten Werte lagen bei 45 % (n = 36) bzw. 35 % (n = 38). Wenn Werte von < 40 % und > 100 % weggelassen werden (wobei erstere auf suboptimale Bedingungen und letztere auf unbekannte Gründe zurückgeführt wurden), reduzierten sich die Variationskoeffizienten auf 26 % bzw. 23 %. Die Anteile ,valider' Werte (Abbau von mindestens 60 %) betrugen 70 % bei Palmitinsäure und 83 % bei Polyethylenglykol 400. Der prozentuale biologische Abbau, der aus dem Anteil an gelöstem anorganischem Kohlenstoff (DIC) ermittelt wurde, war verhältnismäßig gering, aber variabel. Bei Palmitinsäure bewegte der Wert sich zwischen 0-35 % (Mittelwert 12 %) bei einem Variationskoeffizienten von 92 %; für Polyethyleneglykol 400 wurden 0-40 % (Mittelwert 24 %) bei einem Variationskoeffizienten von 54 % ermittelt.
Apparatur
13. Benötigt werden die übliche Laborausrüstung sowie die folgenden Geräte und Hilfsmittel:
- Inkubator - funkensicher und auf 35 °C ± 2 °C geregelt
- Druckbeständige Glasgefäße mit geeigneter Nenngröße 2 jeweils mit einem gasdichten Septum, das bis zu etwa 2 bar druckbeständig ist; das Volumen des Gasraums (Headspace) muss etwa 10-30 % des Gesamtvolumens betragen. Wenn regelmäßig Biogas freigesetzt wird, sind ca. 10 % Gasraum (Headspace) angemessen. Wird das Gas aber erst am Ende des Tests freigesetzt, werden 30 % benötigt. Wenn bei jeder Probenahme der Druck abgebaut wird, sind gläserne Serumflaschen mit einem nominellen Inhalt von 125 ml, einem tatsächlichen Volumen von etwa 160 ml, mit Serumseptum 3 und gepressten Aluminiumringen zu empfehlen;
- Druckmesser 4, angepasst zur Messung und zum Ablassen des erzeugten Gases, beispielsweise ein handgeführter Präzisionsdruckmesser, der mit einer geeigneten Spritzennadel verbunden wurde; ein gasdichtes 3-Wege-Ventil erleichtert das Ablassen des überschüssigen Drucks (Anlage 1). Das Innenvolumen der Leitung und des Ventils des Druckaufnehmers muss möglichst gering sein, damit Fehler infolge der Vernachlässigung des Volumens der Ausrüstung nicht erheblich ins Gewicht fallen;
Hinweis - Die Druckwerte werden direkt zur Berechnung des erzeugten Kohlenstoffs im Gasraum verwendet (Nummern 42-44). Alternativ können aus den angezeigten Druckwerten mithilfe eines Umrechnungsdiagramms die Volumina des (bei 35 °C, Atmosphärendruck) erzeugten Gases ermittelt werden. Das Diagramm wird ausgehend von Daten erstellt, die nach Injektion bekannter Volumina an Stickstoffgas bei 35 +/- 2 °C in verschiedene Prüfgefäße (z.B. Serumflaschen) nach Stabilisierung der Druckanzeigen ermittelt wurden (siehe Anlage 2). Die durchzuführende Berechnung wird im Hinweis in Nummer 44 erläutert.
Achtung! - Die Mikroinjektionsspritzen sind vorsichtig zu handhaben, damit es nicht zu Stichverletzungen kommt.
- Kohlenstoffanalysator, geeignet für die direkte Bestimmung des Gehalts an anorganischem Kohlenstoff im Bereich 1-200 mg/l;
- Präzisionsspritzen für Gas- und Flüssigproben;
- Magnetrührer und Rührfische (optional);
- Gasdichter Handschuhkasten (Glove Box) (empfohlen).
Reagenzien
14. In der gesamten Prüfung sind ausschließlich Reagenzien in Analysequalität zu verwenden.
Wasser
15. Destilliertes oder deionisiertes Wasser (dessen Sauerstoffkonzentration durch Besprühen mit Stickstoffgas auf weniger als 5 µl/l reduziert wurde) mit weniger als 2 mg/l gelöstem organischem Kohlenstoff (DOC).
Prüfmedium
16. Das Verdünnungsmedium wird so vorbereitet, dass die folgenden Bestandteile in den jeweils genannten Anteilen enthalten sind:
| Wasserfreies Kaliumdihydrogenorthophosphat (KH2PO4) | 0,27 g |
| Dinatriumhydrogenphosphat Dodecahydrat (Na2HPO4·12H2O)) | 1,12 g |
| Ammoniumchlorid (NH4Cl) | 0,53 g |
| Calciumchlorid-Dihydrat (CaCl2·2H2O) | 0,075 g |
| Magnesiumchlorid-Hexahydrat (MgCl2·6H2O) | 0,10 g |
| Eisen(II)-Chloridtetrahydrat (FeCl2·4H2O) | 0,02 g |
| Resazurin (Sauerstoffindikator) | 0.001 g |
| Natriumsulfid-Nonahydrat (Na2S·9H2O) | 0,10 g |
| Stammlösung mit Spurenelementen (optional, Nummer 18) | 10 ml. |
| Deoxygeniertes Wasser wird hinzugegeben (Nummer 15). | auf 1 l |
Hinweis: Um eine hinreichende Reduktionsfähigkeit zu gewährleisten, ist frisches Natriumsulfid zu verwenden oder das zu verwendende Natriumsulfid vor der Verwendung zu waschen und zu trocknen. Der Test kann auch ohne Glove Box durchgeführt werden (siehe Nummer 26). In diesem Fall ist die Endkonzentration im Medium auf 0,20 g Na2S·9H2O/l zu erhöhen. Natriumsulfid kann auch aus einer geeigneten anaeroben Stammlösung durch das Septum der verschlossenen Prüfgefäße gegeben werden, da bei diesem Verfahren das Oxidationsrisiko verringert wird. Statt Natriumsulfid kann Titan-(III)-citrat verwendet werden; der Stoff ist durch das Septum der verschlossenen Prüfgefäße bis zu einer Endkonzentration von 0,8-1,0 mmol/l hinzuzugeben. Titan-(III)-citrat ist ein hoch wirksames Reduziermittel mit geringer Toxizität, das wie folgt hergestellt wird: 2,94 g
Trinatriumcitrat-Dihydrat wird in 50 ml deoxygeniertem Wasser gelöst (bis zu einer Konzentration von 200 mmol/l); anschließend werden 5 ml einer 15 %igen (w/v) Titan-(III)-chlorid-Lösung hinzugegeben. Mit Natriumcarbonat wird der pH-Wert mit mineralischem Alkali auf 7 ± 0,2 eingestellt; danach wird die Lösung unter einem Stickstoff-Gasstrom in ein geeignetes Gefäß gegeben. Die Konzentration des Titan-(III)-citrats in dieser Stammlösung beträgt 164 mmol/l.
17. Die Bestandteile des Prüfmediums mit Ausnahme des Reduziermittels (Natriumsulfid bzw. Titan-(III)-citrat) werden gemischt; anschließend wird die Lösung unmittelbar vor der Verwendung etwa 20 Minuten lang mit Stickstoffgas besprüht, um den vorhandenen Sauerstoff abzubauen. Danach wird unmittelbar vor der Verwendung des Mediums eine geeignete Menge an frisch hergestellter Lösung des Reduziermittels (mit deoxygeniertem Wasser zubereitet) hinzugegeben. Das Medium wird erforderlichenfalls mit verdünnter Mineralsäure oder Lauge auf einen pH-Wert von 7 ± 0,2 eingestellt.
Stammlösung mit Spurenelementen (optional)
18. Das Prüfmedium sollte die folgenden Spurenelemente enthalten, um anaerobe Abbauprozesse insbesondere bei niedrigen Inokulum-Konzentrationen (z.B. 1 g/l) zu unterstützen (11):
| Manganchlorid-Tetrahydrat (MnCl2·4H2O) | 50 mg |
| Borsäure (H3BO3) | 5 mg |
| Zinkchlorid (ZnCl2) | 5 mg |
| Kupfer(II)-chlorid (CuCl2) | 3 mg |
| Dinatriummolybdat-Dihydrat (Na2MoO4·2H2O) | 1 mg |
| Kobaltchlorid-Hexahydrat (CoCl2·6H2O) | 100 mg |
| Nickelchlorid-Hexahydrat (NiCl2·6H2O) | 10 mg |
| Dinatriumselenit (Na2SeO3) | 5 mg |
| Deoxygeniertes Wasser wird hinzugegeben (Nummer 15). | auf 1 l |
Prüfstoff
1. Der Prüfstoff wird als Stammlösung, Suspension oder Emulsion oder unmittelbar als Feststoff oder Flüssigkeit oder absorbiert auf Glasfaserfilter bis zu einer Konzentration von höchstens 100 mg/l organischem Kohlenstoff hinzugegeben. Wenn Stammlösungen verwendet werden, ist mit Wasser (Nummer 15) (das zuvor durch Besprühen mit Stickstoffgas deoxygeniert wurde) eine geeignete Lösung in einer Konzentration herzustellen, bei der das hinzugefügte Volumen weniger als 5 % des Gesamtvolumens des Reaktionsgemischs ausmacht. Die Stammlösung kann erforderlichenfalls auf einen pH-Wert von 7 ± 0,2 eingestellt werden. Bei in Wasser nicht hinreichend löslichen Prüfsubstanzen ist ISO 10634 (13) zu beachten. Wenn ein Lösungsmittel verwendet wird, muss eine zusätzliche Kontrolle hergestellt werden, bei der ausschließlich das Lösungsmittel zum geimpften Medium hinzugegeben wird. Organische Lösungsmittel, die erfahrungsgemäß die Methanproduktion hemmen (z.B. Chloroform und Tetrachlorkohlenstoff), sind zu vermeiden.
Achtung! - Toxische Prüfstoffe und Prüfstoffe mit unbekannten Eigenschaften sind mit Vorsicht zu handhaben.
Referenzstoffe
20. Referenzstoffe wie z.B. Natriumbenzoat, Phenol und Polyethylenglykol 400 sind innerhalb von 60 Tagen zu mehr als 60 % abbaubar und haben sich zur Prüfung des Verfahrens bewährt. Von dem ausgewählten Referenzstoff wird auf die gleiche Weise wie für den Prüfstoff eine Stammlösung (in deoxygeniertem Wasser) hergestellt; die Stammlösung ist erforderlichenfalls auf einen pH-Wert von 7 ± 0,2 einzustellen.
Inhibitionskontrolle (bedingt)
21. Um Informationen über die Toxizität des Prüfstoffs für anaerobe Mikroorganismen zu erhalten und entsprechend die am besten geeignete Prüfkonzentration zu ermitteln, werden der Prüfstoff und der Referenzprüfstoff in ein Gefäß mit dem Prüfmedium gegeben (siehe Nummer 16); dabei sind jeweils die gleichen Konzentrationen hinzuzufügen (siehe Nummern 19 und 20 und ISO 13641-1 (12)).
Faulschlamm
22. Der Faulschlamm wird aus einem Faulbehälter einer Kläranlage entnommen, in der vorwiegend häusliche Abwässer aufbereitet werden. Der Schlamm muss vollständig charakterisiert werden; entsprechende Hintergrundinformationen sind zu protokollieren (siehe Nummer 54). Wenn ein modifiziertes Inokulum verwendet werden soll, kann der Faulschlamm auch aus einer Anlage zur Klärung von Industrieabwässern entnommen werden. Zur Entnahme des Faulschlamms werden Flaschen mit weitem Hals aus hochdichtem Polyethylen oder ähnlichem dehnbarem Material verwendet. Der Schlamm wird bis zu einer Höhe von etwa 1 cm unter der Oberkante in die Flaschen gegeben; anschließend werden die Flaschen luftdicht verschlossen - vorzugsweise mit einem Druckventil. Nach der Beförderung ins Labor kann der entnommene Schlamm entweder sofort verwendet oder in einen Laborkocher gegeben werden. Überschüssiges Biogas wird unter vorsichtigem Öffnen der Flaschen freigesetzt. Alternativ kann im Labor gereifter anaerober Schlamm als Inokulum verwendet werden; in diesem Fall kann das Aktivitätsspektrum allerdings beeinträchtigt sein.
Achtung! - Faulschlamm erzeugt entzündbare Gase; die Gase können verbrennen oder eine Explosion verursachen. Außerdem enthalten die Gase potenziell pathogene Organismen. Daher sind beim Umgang mit Faulschlamm entsprechende Vorsichtsmaßnahmen zu treffen. Aus Sicherheitsgründen dürfen zur Entnahme des Schlamms keine Glasgefäße verwendet werden.
23. Um die Hintergrundgasproduktion und den Einfluss der Blindkontrollen zu reduzieren, kann eine Vorfaulung des Schlamms in Betracht gezogen werden. Wenn eine Vorfaulung erforderlich ist, muss die Faulung ohne Zugabe von Nährstoffen oder Substraten über einen Zeitraum von höchstens 7 Tagen bei einer Temperatur von 35 ± 2 °C erfolgen. Mit einer Vorfaulung von etwa 5 Tagen wird (Erfahrungen mit einer geringen Anzahl an Stoffen zufolge) gewöhnlich eine optimale Reduzierung der Gasproduktion der Blindkontrolle ohne unannehmbare Erhöhung der 'Lag' -Phase oder der Inkubationszeiten in der Prüfung und ohne Beeinträchtigung der Aktivität erzielt.
24. Bei biologisch nur schwer abbaubaren Prüfsstoffen bzw. bei Prüfstoffen, bei denen davon ausgegangen wird, dass sie biologisch schwer abzubauen sind, kann eine Vorexposition des Schlamms gegenüber dem Prüfstoff vorgenommen werden, um ein besser angepasstes Inokulum zu erhalten. In diesem Fall ist der Prüfstoff mit einer Konzentration von 5-20 mg/l an organischem Kohlenstoff in den Faulschlamm zu geben und bis zu 2 Wochen zu inkubieren. Nach dieser Vorexposition ist der Schlamm vor der Verwendung sorgfältig zu waschen (siehe Nummer 25); im Prüfprotokoll werden die Bedingungen der Vorexposition vermerkt.
Inokulum
25. Unmittelbar vor der Verwendung wird der Schlamm gewaschen (siehe Nummern 22 bis 24), um die Konzentration an anorganischem Kohlenstoff in der endgültigen Testsuspension auf weniger als 10 mg/l zu reduzieren. Der Schlamm wird in verschlossenen Röhrchen zentrifugiert (z.B. 5 Minuten mit 3.000 g); anschließend wird der Überstand entsorgt. Das entstandene Pellet wird in deoxygeniertem Medium (Nummern 16 und 17) suspendiert. Danach wird die Suspension nochmals zentrifugiert und wiederum die überstehende Flüssigkeit abgegossen. Wenn der Anteil an anorganischem Kohlenstoff nicht ausreichend verringert wurde, kann der Waschvorgang noch höchstens zweimal wiederholt werden. Dadurch scheint die Aktivität der Mikroorganismen nicht beeinträchtigt zu werden. Schließlich wird das Pellet auf das benötigte Volumen des Prüfmediums suspendiert und die Konzentration der Gesamtfeststoffe ermittelt (siehe z.B. ISO 11923 (15)). Die Endkonzentration der Gesamtfeststoffe in den Prüfgefäßen muss bei 1-3 g/l (oder ca. 10 % der Konzentration des nicht verdünnten Faulschlamms) liegen. Die vorstehenden Schritte sind so durchzuführen, dass der Schlamm möglichst wenig mit Sauerstoff in Berührung kommt (beispielsweise, indem in einer Stickstoffatmosphäre gearbeitet wird).
26. Zunächst sind die folgenden Schritte mit Verfahren durchzuführen, bei denen der Faulschlamm möglichst wenig mit Sauerstoff in Berührung kommt. Beispielsweise kann die Verwendung einer Glove-Box in einer Stickstoffatmosphäre und/oder eine Stickstoffspülung der Flaschen erforderlich sein (4).
Vorbereitung der Prüfgefäße und der Kontrollen
27. Es werden jeweils mindestens drei Prüfgefäße (siehe Nummer 13-b) für den Prüfstoff, die Blindkontrollen, den Referenzstoff und die Inhibitionskontrollen (bedingt) sowie Kammern mit Druckregelung (optionales Verfahren) vorbereitet (siehe Nummern 7 und 19-21). Außerdem können Gefäße zur Prüfung des primären biologischen Abbaus mit für den jeweiligen Prüfstoff spezifischen Analysen vorbereitet werden. Innerhalb einer Prüfung können für mehrere Prüfstoffe dieselben Blindkontrollen verwendet werden, sofern die Gasraumvolumina einheitlich sind.
28. Das verdünnte Inokulum wird hergestellt und in die Gefäße gegeben (z.B. mit einer Pipette mit großer Öffnung). Aliquote des gut gemischten Inokulums (Nummer 25) werden hinzugegeben, bis in allen Gefäßen die gleiche Konzentration an Gesamtfeststoffen besteht (1-3 g/l). Stammlösungen des Prüfstoffes und des Referenzstoffes werden erforderlichenfalls auf einen pH-Wert von 7 ± 0,2 eingestellt und hinzugefügt. Die Prüfsubstanz und der Referenzstoff sind in der jeweils geeignetsten Weise hinzuzugeben (Nummer 19).
29. Die Prüfkonzentration an organischem Kohlenstoff sollte üblicherweise zwischen 20 und 100 mg/l (Nummer 4) liegen. Wenn der Prüfstoff toxisch ist, muss die Prüfkonzentration auf 20 mg C/l reduziert werden; diese Konzentration kann noch unterschritten werden, wenn mit speziellen Analysen nur der primäre biologische Abbau ermittelt werden soll. Es gilt zu beachten, dass es bei niedrigeren Prüfkonzentrationen zu größeren Unterschieden zwischen den Prüfergebnissen kommt.
30. In die Gefäße mit den Blindkontrollen ist anstelle einer Stammlösung, Suspension oder Emulsion eine entsprechende Menge der zur Dosierung des Prüfstoffes verwendeten Trägerlösung hinzuzugeben. Wenn der Prüfstoff absorbiert auf einem Glasfaserfilter oder mit organischen Lösungsmitteln hinzugegeben wurde, ist auch bei den Blindkontrollen ein Filter zu verwenden bzw. eine den verdunsteten Lösungsmitteln entsprechende Menge hinzuzugeben. Zur Messung des pH-Werts wird ein zusätzliches Replikat mit dem Prüfstoff hergestellt. Das Medium ist erforderlichenfalls mit geringen Mengen an verdünnter Mineralsäure oder Lauge auf einen pH-Wert von 7 ± 0,2 einzustellen. In alle Prüfgefäße wird die gleiche Menge an Neutralisierungsmitteln gegeben. Diese Zugaben dürften allerdings nicht erforderlich sein, weil der pH-Wert der Stammlösungen des Prüfstoffes und des Referenzstoffes bereits eingestellt wurde (siehe Nummern 19 und 20). Wenn der biologische Primärabbau gemessen werden soll, ist eine geeignete Probe aus dem Gefäß zur pH- Kontrolle oder aus einem zusätzlichen Prüfgefäß zu entnehmen; die Konzentration des Prüfstoffes ist dann mit spezifischen Analysen zu messen. In alle Gefäße können beschichtete Magnetrührstäbchen gegeben werden, wenn die Reaktionsgemische umgerührt werden sollen (optional).
31. Das Gesamtvolumen der Flüssigkeit V1 und das Volumen des Gasraums Vh müssen in allen Gefäßen gleich sein. Die Werte für V1 und Vh sind zu messen und zu protokollieren. Die Gefäße werden mit gasdichten Septa verschlossen und in der Glove-Box (siehe Nummer 26) in den Inkubator gestellt (siehe Nummer 13-a).
Nicht lösliche Prüfstoffe
32. Wenn Stoffe in Wasser schwer löslich sind, werden die betreffenden Mengen direkt in die vorbereiteten Gefäße eingewogen. Muss ein Lösungsmittel verwendet werden (siehe Nummer 19), wird die Lösung oder Suspension mit dem Prüfstoff in die leeren Gefäße gegeben. Wenn möglich, wird das Lösungsmittel verdampft, indem Stickstoffgas durch die Gefäße geleitet wird; anschließend werden die anderen Bestandteile (verdünnter Klärschlamm (Nummer 25) und - nach Bedarf - deoxygeniertes Wasser) hinzugegeben. Außerdem wird eine zusätzliche Lösungsmittelkontrolle hergestellt (siehe Nummer 19). Bezüglich anderer Methoden zur Zugabe unlöslicher Stoffe wird auf ISO 10634 (13) verwiesen. Flüssige Prüfstoffe können mit einer Spritze in die entsprechend vorbereiteten und verschlossenen Gefäße injiziert werden, wenn davon ausgegangen wird, dass der pH-Ausgangswert bei 7 ± 1 liegt; ansonsten ist die Dosierung vorzunehmen, wie oben beschrieben (siehe Nummer 19).
Inkubation und Gasdruckmessungen
33. Die vorbereiteten Gefäße werden etwa 1 Stunde bei 35 ± 2 °C inkubiert, um die Gleichgewichtseinstellung zu ermöglichen. Um die Freisetzung von überschüssigem Gas in die Umgebungsluft zu ermöglichen, kann beispielsweise wie folgt verfahren werden: Die Gefäße werden nacheinander geschüttelt; die Nadel des Druckmessers (Nummer 13-c) wird durch den Verschluss gestochen und das Ventil geöffnet, bis der Druckmesser auf 0 steht. Wenn bei diesem Schritt oder bei Zwischenmessungen der Druck im Gasraum unter den Atmosphärendruck fällt, sollte Stickstoffgas zugeführt werden, um den Atmosphärendruck wiederherzustellen. Das Ventil wird geschlossen (siehe Nummer 13-c); danach wird die Inkubation im Dunkeln fortgesetzt. Dabei ist sicherzustellen, dass in allen Bereichen der Gefäße die nötige Faultemperatur aufrechterhalten wird. Nach einer Inkubationsdauer von 24-48 h Stunden werden die Gefäße kontrolliert. Gefäße, bei denen die überstehende Flüssigkeit deutlich rosa gefärbt ist, sind zu verwerfen. (Wenn sich das Resazurin (siehe Nummer 16) verfärbt hat, ist Sauerstoff vorhanden (siehe Nummer 50)). Im System sind kleine Mengen an Sauerstoff annehmbar; höhere Konzentrationen können den anaeroben biologischen Abbau aber erheblich hemmen. Die Verwerfung einzelner Gefäße (von jeweils drei gleichen Gefäßen) ist annehmbar. Wenn jedoch mehr Gefäße verworfen werden müssen, sind die Versuchsverfahren zu prüfen; außerdem muss der betreffende Test wiederholt werden.
34. Der Inhalt der einzelnen Gefäße wird sorgfältig gemischt, indem der Inhalt der Gefäße mindestens 2- oder 3-mal wöchentlich sowie kurz vor den Druckmessungen einige Minuten gerührt oder geschüttelt wird. Beim Schütteln wird das Inokulum neu suspendiert, und das erforderliche Gleichgewicht der Gase hergestellt. Alle Druckmessungen sind rasch vorzunehmen, da die Messergebnisse infolge der sinkenden Temperatur der Prüfgefäße beeinträchtigt werden könnten. Bei den Druckmessungen muss im gesamten Prüfgefäß (einschließlich des Gasraums) die Faultemperatur aufrechterhalten werden. Der Gasdruck wird gemessen, indem beispielsweise die mit dem Druckmesser verbundene Spritzennadel durch das Septum gestochen wird (Nummer 13-c). Dabei ist darauf zu achten, dass kein Wasser in die Spritzennadel gelangt. Ansonsten müssen die feuchten Teile getrocknet und eine frische Nadel verwendet werden. Der Druck ist in Millibar zu messen (siehe Nummer 42). Der Gasdruck in den Gefäßen kann regelmäßig (z.B. wöchentlich) gemessen werden; das überschüssige Gas kann in die Umgebungsluft freigesetzt werden. Alternativ wird der Gasdruck erst am Ende der Prüfung gemessen, um die Menge des erzeugten Biogases zu ermitteln.
35. Zwischenmessungen des Gasdrucks sind zu empfehlen, da ein Druckanstieg einen Anhaltspunkt dafür bietet, wann die Prüfung beendet werden kann; außerdem kann die Kinetik der Prüfung überwacht werden (siehe Nummer 6).
36. Normalerweise wird die Prüfung nach einer Inkubationsdauer von 60 Tagen beendet, wenn die aufgrund der Druckmessungen erstellte Kurve des biologischen Abbaus nicht bereits vorher ein Plateau erreicht hat. Dann ist der maximale Abbaugrad erreicht, und die Abbaukurve flacht ab. Wird ein Plateau bei weniger als 60 % erreicht, ist die Bewertung schwierig, weil davon auszugehen ist, dass die vorhandenen Moleküle nur teilweise mineralisiert wurden oder bei der Durchführung des Versuchs ein Fehler gemacht wurde. Wenn am Ende der normalen Inkubationsdauer Gas erzeugt wird, aber offensichtlich kein Plateau erreicht wurde, ist eine Verlängerung der Prüfung in Betracht zu ziehen, um zu prüfen, ob sich vielleicht doch noch ein Plateau (> 60 %) einstellt.
Messung des anorganischen Kohlenstoffs
37. Am Ende des Tests nach der letzten Messung des Gasdrucks wird abgewartet, bis der Faulschlamm sich gesetzt hat. Die Gefäße werden nacheinander geöffnet; anschließend wird umgehend eine Probe zur Bestimmung der Konzentration an anorganischem Kohlenstoff in der überstehenden Flüssigkeit (in mg/l) entnommen. Die überstehende Flüssigkeit ist weder zu zentrifugieren noch zu filtern; ansonsten würde es zu einem inakzeptablen Verlust an gelöstem Kohlendioxid kommen. Wenn eine Analyse der Flüssigkeit unmittelbar nach der Probenahme nicht möglich ist, ist die Flüssigkeit bei etwa 4 °C bis zu 2 Tage in einem gedichteten Probengefäß ohne Gasraum aufzubewahren. Nach der Messung der Konzentration an anorganischem Kohlenstoff wird der pH-Wert bestimmt und protokolliert.
38. Alternativ kann die Konzentration des anorganischen Kohlenstoffs auch unmittelbar bestimmt werden; dazu wird der gelöste anorganische Kohlenstoff als Kohlendioxid freigesetzt und dann im Gasraum gemessen. Nach der letzten Messung des Gasdrucks wird in den einzelnen Prüfgefäßen der Atmosphärendruck hergestellt. Der Inhalt der einzelnen Gefäße wird etwa auf den pH-Wert 1 eingestellt, indem durch das Septum der verschlossenen Gefäße konzentrierte Mineralsäure (z.B. H2SO4) hinzugegeben wird. Die geschüttelten Gefäße werden etwa 24 Stunden bei 35 ± 2 °C inkubiert. Anschließend wird der durch die Freisetzung von Kohlendioxid entstandene Gasdruck mit dem Druckmesser ermittelt.
39. Für die entsprechende Blindkontrolle sowie für den Referenzstoff und (soweit vorhanden) für die Gefäße zur Inhibitionskontrolle werden ähnliche Messungen vorgenommen (siehe Nummer 21).
40. Manchmal, insbesondere wenn für mehrere Prüfstoffe dieselben Kontrollgefäße verwendet werden, können Zwischenmessungen der Konzentrationen an anorganischem Kohlenstoff in den Gefäßen mit dem Prüfstoff und mit den Kontrollen in Betracht gezogen werden. In diesem Fall ist eine hinreichende Anzahl an Gefäßen für alle vorgesehenen Zwischenmessungen vorzubereiten. Dieses Verfahren wird gegenüber der Entnahme sämtlicher Proben aus einem einzigen Gefäß bevorzugt. Letzteres kommt nur dann in Betracht, wenn für die Analyse des gelösten anorganischen Kohlenstoffs kein allzu großes Volumen benötigt wird. Die Messung der Konzentration des gelösten anorganischen Kohlenstoffs ist nach der Messung des Gasdrucks, ohne das Ablassen von überschüssigem Gas, wie im Folgenden beschrieben vorzunehmen:
- Mit einer durch das Septum gestochenen Spritze wird eine möglichst geringe Menge des Überstands entnommen, ohne die Gefäße zu öffnen; anschließend wird die Konzentration des anorganischen Kohlenstoffs in der Probe ermittelt;
- nach der Probenahme kann das überschüssige Gas freigesetzt werden;
- selbst bei einer geringen Reduzierung der Menge des Überstands (z.B. um etwa 1 %) kann sich das Gasvolumen im Gasraum (Vh) beträchtlich erhöhen;
- die Gleichungen (siehe Nummer 44) werden gegebenenfalls korrigiert, indem in Gleichung 3 der Wert für Vh erhöht wird.
Spezifische Analysen
41. Wenn der primäre anaerobe Abbau (siehe Nummer 30) bestimmt werden soll, wird am Anfang und am Ende der Prüfung aus den Gefäßen mit dem Prüfstoff eine geeignete Menge der Probe für spezifische Analysen entnommen. Dadurch ändern sich die Volumina des Gasraums (Vh) und der Flüssigkeit (Vl). Dies ist bei der Berechnung der Gasproduktion zu berücksichtigen. Alternativ können Proben für spezifische Analysen auch aus zusätzlichen Gemischen entnommen werden, die zuvor für diesen Zweck hergestellt wurden (Nummer 30).
Auswertung der Ergebnisse
42. Aus praktischen Gründen werden der Gasdruck in Millibar (1 mbar = 1h Pa = 102 Pa; 1 Pa = 1 N/m2), das Volumen in Litern und die Temperatur in Grad Celsius gemessen.
Kohlstoff im Gasraum
43. Da 1 mol Methan und 1 mol Kohlendioxid jeweils 12 g Kohlenstoff enthalten, kann die Masse des Kohlenstoffs in einem bestimmten Volumen eines entstandenen Gases wie folgt ausgedrückt werden:
| m = 12 × 103 × n | Gleichung [1] |
Dabei sind:
m = Masse des Kohlenstoffs (mg) in einem bestimmten Volumen des entwickelten Gases;
12 = relative Atommasse des Kohlenstoffs;
n = Molzahl des Gases in einem bestimmten Volumen.
Wenn ein anderes Gas als Methan oder Kohlendioxid) (z.B. N2O) in erheblichen Mengen entsteht, ist die Formel [1] entsprechend abzuändern, um mögliche Effekte der enstehenden Gase abzubilden.
44. Nach den Gasgesetzen kann n ausgedrückt werden als:
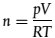 | Gleichung [2] |
Dabei sind:
p = Gasdruck (Pascal);
V = Gasvolumen (m3);
R = molare Gaskonstante [8,314 J/(mol K)];
T = Inkubationstemperatur (Kelvin).
Durch Kombination der Gleichungen [1] und [2] und durch Rationalmachen ergibt sich für die Berechnung der Gasproduktion der Blindkontrolle:
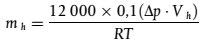 |
Gleichung [3] |
Dabei sind:
mh = Nettomasse des im Gasraum erzeugten gasförmigen Kohlenstoffs (mg);
ΔP = Mittelwert des Unterschieds zwischen Ausgangs- und Enddruck in den Prüfgefäßen abzüglich des entsprechenden Mittelwerts der Blindgefäße (Millibar);
Vh = Gasraumvolumen (l);
0,1 = Umrechnung Newton/m2 in Millibar und m3 in l.
Gleichung [4] ist für die normale Inkubationstemperatur von 35 °C (308 K) zu verwenden:
|
mh = 0,468(Δp · Vh) | Gleichung [4] |
Hinweis: Alternative Volumenberechnung: Aus den auf dem Druckmesser angezeigten Werten wird anhand der erstellten Standardkurve (injiziertes Volumen (ml) vs. angezeigter Messwert) in ml das produzierte Gasvolumen berechnet (Anlage 2). Die Molzahl (n) des Gases im Gasraum der einzelnen Gefäße wird berechnet, indem die gesamte Gasproduktion (ml) durch 25.286 ml/mol geteilt wird. (Dies ist das von einem mol des Gases bei einer Temperatur von 35 °C und dem normalen Atmosphärendruck beanspruchte Volumen.) Da 1 mol CH4 und 1 mol CO2 jeweils 12 g Kohlenstoff enthalten, kann die Menge des Kohlenstoffs (mg) im Gasraum (mh) mit der folgenden Gleichung [5] ermittelt werden:
| mh = 12 × 103 × n | Gleichung [5] |
Durch Rationalmachen wird die Gasproduktion in der Blindkontrolle berechnet
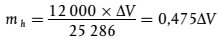 | Gleichung [3] |
Dabei sind:
mh = Nettomasse des im Gasraum erzeugten gasförmigen Kohlenstoffs (mg);
ΔV = Mittelwert des Unterschieds zwischen dem Volumen des im Gasraum der Prüfgefäße und der Gefäße mit den Blindkontrollen erzeugten Gases;
25.286 = von 1 mol Gas bei 35 °C, 1 atm beanspruchtes Volumen.
45. Der biologische Abbau kann verfolgt werden, indem der kumulierte Druckanstieg Δp (millibar), ggf. zeitbezogen, grafisch dargestellt wird. Aus der entsprechenden Kurve kann die lag-Phase (in Tagen) ermittelt und protokolliert werden. Als lag-Phase wird der Zeitraum vom Beginn der Prüfung bis zum Einsetzen eines signifikanten Abbaus bezeichnet (siehe z.B. Anlage 3). Wenn Zwischenproben des Überstands genommen und analysiert wurden (siehe Nummern 40, 46 und 47), kann anstelle des bloßen Gesamtdrucks auch die Summe des erzeugten Kohlenstoffs (gasförmig und flüssig) dargestellt werden.
Kohlstoff im Gasraum
46. Die Menge des Methans in der Flüssigkeit ist unerheblich, da sich Methan in Wasser sehr schlecht löst. Mit der folgenden Gleichung [7] wird die Masse des anorganischen Kohlenstoffs in der Flüssigkeit der Prüfgefäße ermittelt:
| ml = Cnet × Vl | Gleichung [7] |
Dabei sind:
ml = Masse des anorganischen Kohlenstoffs in der Flüssigkeit (mg);
Cnet = Konzentration des anorganischen Kohlenstoffs in den Prüfgefäßen abzüglich des organischen Kohlenstoffs in den Kontrollgefäßen am Ende des Tests (mg/l);
Vl = Volumen der Flüssigkeit im Gefäß (l).
Gasförmiger Kohlenstoff insgesamt
47. Die Gesamtmasse des gasförmigen Kohlenstoffs im Gefäß wird mit der folgenden Gleichung [8] berechnet:
| mt = mh + ml | Gleichung [8] |
Dabei sind:
mt = Gesamtmasse des gasförmigen Kohlenstoffs (mg);
mh und ml wie oben angegeben.
Kohlstoff im Prüfstoff
48. Mit der folgenden Gleichung [9] wird die Masse des Kohlenstoffs in den Prüfgefäßen ermittelt, die sich aus dem hinzugegebenen Prüfstoff ableitet:
| mv = Cc × Vl | Gleichung [9] |
Dabei sind:
mv = Masse des Kohlenstoffs im Prüfstoff (mg);
Cc = Konzentration des im Prüfstoff enthaltenen Kohlenstoffs im Prüfgefäß (mg/l)
Vl = Volumen der Flüssigkeit im Prüfgefäß (l).
Umfang des biologischen Abbaus
49. Der prozentuale biologische Abbau, ermittelt anhand des Gases im Gasraum, wird mit der folgenden Gleichung [10] berechnet; mit Gleichung [11] wird die prozentuale Gesamtsumme für den biologischen Abbau ermittelt:
| Dh = (mh/mv) × 100 | Gleichung [10] | |
| Dt = (mt/mv) × 100 | Gleichung [11] |
Dabei sind:
Dh = biologischer Abbau anhand des Gases im Gasraum (%);
Dt = Gesamtsumme biologischer Abbau (%);
mh, mv und mt wie oben angegeben.
Der Umfang des primären biologischen Abbaus wird mit der folgenden Gleichung [12] aus den (optionalen) Messungen der Konzentration des Prüfstoffs zu Beginn und am Ende der Inkubationsdauer berechnet:
| Dp = (1 - Se/Si) × 100 | Gleichung [12] |
Dabei sind:
Dp = primärer Abbau des Prüfstoffs (%);
Si = Ausgangskonzentration des Prüfstoffs (mg/l);
Se = Konzentration des Prüfstoffs am Ende der Inkubationsdauer (mg/l).
Wenn die Analysemethode ergibt, dass sich im unbehandelten anaeroben Schlamm-Inokulum erhebliche Konzentrationen des Prüfstoffs befinden, ist Gleichung [13] zu verwenden:
| Dp1 = [1 - (Se - Seb)/(Si - Sib)] × 100 | Gleichung [13] |
Dabei sind:
Dp1 = korrigierter primärer Abbau des Prüfstoffs (%);
Sib = ,scheinbare' Ausgangskonzentration des Prüfstoffs in den Blindkontrollen (mg/l);
Seb = ,scheinbare' Konzentration des Prüfstoffs in den Blindkontrollen am Ende (mg/l).
Gültigkeit der Ergebnisse
50. Angezeigte Druckwerte sind nur von den Gefäßen zu berücksichtigen, die sich nicht rosa verfärbt haben (siehe Nummer 33). Die Kontamination durch Sauerstoff wird durch die Verwendung geeigneter Verfahren zur anaeroben Handhabung minimiert.
51. Ein Test ist dann als gültig zu betrachten, wenn die Kurve des Referenzstoffes ein Plateau erreicht, das einem biologischen Abbau von mehr als 60 % entspricht 5.
52. Wenn der pH-Wert am Ende der Prüfung nicht mehr im Bereich 7 ± 1 liegt und kein ausreichender biologischer Abbau erfolgt ist, wird die Pufferkapazität des Mediums erhöht und der Test wiederholt.
Hemmung des Abbaus
53. In den Gefäßen, die sowohl den Prüfstoff als auch den Referenzstoff enthalten, muss mindestens die gleiche Menge an Gas produziert werden wie in den Gefäßen ausschließlich mit dem Referenzstoff. Ansonsten ist eine Inhibition der Gasproduktion festzustellen. Manchmal ist die Gasproduktion in Gefäßen mit dem Prüfstoff ohne den Referenzstoff geringer als in den Blindkontrollen; auch in diesem Fall ist eine hemmende Wirkung des Prüfstoffs festzustellen.
Prüfbericht
54. Der Prüfbericht muss folgende Informationen enthalten:
Prüfstoff:
- Trivialname, chemische Bezeichnung, CAS-Nummer, Strukturformel und relevante physikalisch-chemische Eigenschaften;
- Reinheit (Verunreinigungen) des Prüfstoffs.
Prüfbedingungen:
- Volumina der verdünnten Flüssigkeit (Vl) und des Gasraums (Vh) im Gefäß;
- Beschreibung der Prüfgefäße, der wesentlichen Merkmale der Biogasmessung (z.B. Druckmessertyp) und des Geräts zur Analyse des Gehalts an anorganischem Kohlenstoff;
- Applikation der Prüf- und der Referenzsubstanz in das Prüfsystem: verwendete Prüfkonzentration und Verwendung von Lösungsmitteln;
- nähere Angaben zum verwendeten Inokulum: Name der Kläranlage, Angaben zur Herkunft des behandelten Abwassers (Betriebstemperatur, Verweilzeit des Abwassers in der Kläranlge, vorwiegend häusliche Abwässer usw.), Konzentration, erforderliche Belege für diese Angaben und Informationen zu Vorbehandlungen des Inokulums (Vorfaulung, Vorexposition usw.);
- Inkubationstemperatur;
- Anzahl der Replikate.
Ergebnisse:
- pH-Werte und Konzentration des anorganischen Kohlenstoffs am Ende des Tests;
- Konzentration des Prüfstoffs zu Beginn und am Ende des Tests, wenn eine spezifische Messung vorgenommen wurde;
- alle gemessenen Daten zu den Prüfgefäßen und Blindgefäßen sowie zu den Gefäßen mit dem Referenzstoff und den Inhibitionskontrollen (soweit verwendet) (z.B. Druck in Millibar und Konzentration des anorganischen Kohlenstoffs (mg/l)) in tabellarischer Form (unter getrennter Angabe der Messwerte für den Gasraum und für die Flüssigkeit);
- statistische Aufbereitung der Daten, Prüfdauer und grafische Darstellung des biologischen Abbaus (Prüfstoff, Referenzstoff und Inhibitionskontrolle);
- prozentualer biologischer Abbau des Prüfstoffs und des Referenzstoffs;
- Angabe von Gründen, falls die Prüfergebnisse verworfen werden;
- Diskussion der Ergebnisse.
(1) Die folgenden Kapital in diesem Anhang:
C.4, Bestimmung leichter biologischer Abbaubarkeit;C.9, Biologische Abbaubarkeit - Zahn-Wellens-Test;
C.10, Simulationstest - Aerobe Abwasserbehandlung: A: Belebtschlamm-Anlagen, B: Biofilme
C.11, Biologische Abbaubarkeit - Belebtschlamm-Atmungshemmungstest
(2) OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Paris
(3) Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H., und Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. (veröffentlicht auch als ECETOC Technical Report Nr. 28, Juni 1988).
(4) Shelton, D.R., und Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, 850-857.
(5) Owen, W.F., Stuckey, D.C., Healy, J.B., Jr, Young, L.Y., und McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485-492.
(6) Healy, J.B. Jr., und Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84-89.
(7) Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
(8) Battersby, N.S., und Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441-2460.
(9) E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
(10) US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
(11) Internationale Organisation für Normung (1995) ISO 11734 Wasserbeschaffenheit - Bestimmung der vollständigen anaerobischen Abbaubarkeit organischer Verbindungen in Belebtschlamm - Verfahren durch Messung der Biogasproduktion
(12) Internationale Organisation für Normung (2003) ISO 13.641-1 Wasserbeschaffenheit - Bestimmung der Hemmwirkung der Gasproduktion auf anaerobe Bakterien - Teil 1: Allgemeiner Test.
(13) Internationale Organisation für Normung (1995) ISO 10634, Wasserbeschaffenheit - Anleitung für die Vorbereitung und Behandlung von in Wasser schwer löslichen organischen Verbindungen für die nachfolgende Bestimmung ihrer biologischen Abbaubarkeit in einem wässrigen Medium.
(14) Pagga, U., und Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499-1509.
(15) Internationale Organisation für Normung (1997) ISO 11.923 Wasserbeschaffenheit - Bestimmung der Schwebstoffe mittels Filtration durch ein Glasfaserfilter.
______________
1) Faulschlamm besteht aus einem Gemisch der ausgefällten Phasen des Abwassers und Belebtschlamm, das in einem anaeroben Faulbehälter bei etwa 35 °C inkubiert wurde, um die Biomasse und Geruchsbelästigungen zu reduzieren und die Entwässerbarkeit des Schlamms zu verbessern. Das Gemisch besteht aus anaeroben fermentativen Bakterien und methanogenen Bakterien, die Kohlendioxid und Methan erzeugen (11).
2) Die empfohlene Größe liegt bei 0,1-1 l.
3) Zu empfehlen sind gasdichte Silikon-Septa. Außerdem sollte die Gasdichtheit der Verschlüsse, insbesondere bei Septa aus Butylkautschuk, geprüft werden; mehrere im Handel erhältliche Septa sind nämlich nicht hinreichend dicht gegenüber Methan, und manche Septa bleiben nicht dicht, wenn sie unter den Bedingungen dieses Versuchs mit einer Nadel durchstochen werden.
4) Das Gerät ist regelmäßig entsprechend den Herstelleranweisungen zu verwenden und zu kalibrieren. Wenn ein Druckmesser der vorgeschriebenen Qualität verwendet wird (z.B. gekapselt mit einer Stahlmembran), ist eine Kalibrierung im Labor nicht mehr erforderlich. Die Genauigkeit der Kalibrierung kann im Labor durch eine punktuelle Messung bei 1 × 105 Pa anhand eines Druckmessers mit mechanischer Anzeige geprüft werden. Wenn der betreffende Punkt richtig gemessen wird, bleibt auch die Linearität konstant. Werden sonstige Messgeräte eingesetzt (ohne zertifizierte Herstellerkalibrierung), ist in regelmäßigen Abständen eine Kalibrierung über den gesamten Bereich zu empfehlen.
5) Die Bewertung ist zu wiederholen, wenn adsorptive und nicht lösliche Referenzstoffe verwendet werden.
| Beispiel einer Apparatur zur Messung der Biogasproduktion anhand des Gasdrucks | Anlage 1 |
 Legende:
Legende:
1 - Druckmesser
2 - Gasdichtes 3-Wege-Ventil
3 - Spritzennadel
4 - Gasdichter Verschluss (gepresster Deckel und Septum)
5 - Gasraum (Headspace) (Vh)
6 - Faulschlamm-Inokulum, Volumen der Flüssigkeit (Vl)
Inkubation der Prüfgefäße bei einer Temperatur von 35 °C ± 2 °C
| Umrechnung der Messwerte des Druckmessers | Anlage 2 |
Anhand einer Standardkurve, die nach Injektion bekannter Luftvolumina bei einer Temperatur von mindestens 35 ± 2 °C in Serumflaschen mit einem Wasseranteil entsprechend dem Reaktionsgemisch (VR) erstellt wurde, können die angezeigten Druckwerte Gasvolumina zugeordnet werden:
- Auf 35 ± 2 °C temperierte Wasseraliquote mit einem Volumen von VR ml werden in fünf Serumflaschen gegeben. Die Flaschen werden verschlossen und 1 Stunde zum Ausgleichen in ein Wasserbad mit einer Temperatur von 35 °C gestellt;
- der Druckmesser wird eingeschaltet, und nach der Stabilisierung der Anzeige wird das Gerät auf null gestellt;
- die Spritzennadel wird durch den Verschluss in eine der Flaschen gestochen, und das Ventil wird geöffnet; wenn der Druckmesser den Wert null anzeigt, wird das Ventil wieder geschlossen;
- dieses Verfahren ist mit den übrigen Flaschen zu wiederholen;
- In jede Flasche wird 1 ml Luft mit einer Temperatur von 35 ± 2 °C injiziert. Die Nadel (am Druckmesser) wird durch den Verschluss einer Flasche gestochen; danach muss abgewartet werden, bis sich die Druckanzeige stabilisiert hat. Nachdem der Druckwert protokolliert wurde, wird das Ventil geöffnet, bis die Anzeige wieder auf null steht. Danach wird das Ventil geschlossen;
- dieses Verfahren ist mit den übrigen Flaschen zu wiederholen;
- anschließend wird das gesamte Verfahren mit 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml und 50 ml Luft wiederholt;
- die Kurve der umgerechneten Druckwerte (Pa) wird bezogen auf das injizierte Gasvolumen Vb (ml) grafisch dargestellt. Das Messgerät reagiert im Bereich von 0-70.000 Pa und bei einer Gasproduktion von 0-50 ml linear.
| Beispiel einer Abbaukurve (Kumulativer Netto-Druckanstieg) | Anlage 3 |
| Datenblätter zur Prüfung der anaeroben biologischen Abbaubarkeit (Beispiel) - Datenblatt zum Prüfstoff | Anlage 4 |
| Labor: ..... | Prüfstoff: ....... | Test Nr.: ....... | ||||||||||
| Prüftemperatur: (°C): ..... | Volumen des Gasraums (Vh): ..... (l) | Volumen der Flüssigkeit (Vl): ....... (l) | ||||||||||
| Kohlenstoff im Prüfstoff Cc,v: ........(mg/l) | mv 1: .... (mg) | |||||||||||
| Tag | p1 (Test) (mbar) | p2 (Test) (mbar) | p3 (Test) (mbar) | p (Test) Mittelwert (mbar) | p4 (Blind) (mbar) | p5 (Blind) (mbar) | p6 (Blind) (mbar) | p (Blind) Mittelwert (mbar) | p (Netto) Test - Blind- kontrolle Mittelwert (mbar) | Δp (Netto) Kumulativ (mbar) | mh Kohlenstoff im Gas- raum, C 2 (mg) | Dh Biologischer Abbau 3 (%) |
| CIC, 1 Prüfung (mg) | CIC, 2 Prüfung (mg) | CIC, 3 Prüfung (mg) | CIC Mittelwert Prüfung (mg) | CIC, 4 Blindkon- trolle (mg) | CIC, 5 Blindkon- trolle (mg) | CIC, 6 Blindkon- trolle (mg) | CIC Mittelwert Blindkon- trolle (mg) | CIC, net Test - Blind- kontrolle Mittelwert (mg) | ml Flüssiger Kohlen- stoff 4 (mg) | MT Kohlenstoff insgesamt 5 (mg) | Dt Biologischer Abbau 6 (%) | |
| Anorganischer Kohlenstoff (Ende) | ||||||||||||
| pH-Wert (Ende) | ||||||||||||
| 1) Kohlenstoff im Prüfgefäß, mv (mg): mv = CC,v × Vl
2) Kohlenstoff im Gasraum, mh (mg) bei normaler Inkubationstemperatur (35 °C): mh = 0,468 Δp × Vh 3) Biologischer Abbau berechnet aus dem Gas im Gasraum, Dh (%): Dh = (mh × 100) / mv 4) Kohlenstoff in der Flüssigkeit, ml (mg): ml = CIC,net × Vl 5) Gasförmger Kohlenstoff insgesamt, mt (mg): mt + ml 6) Biolpgischer Abbau insgesamt, Dt (%): Dt = (mt × 100) / mv | ||||||||||||
| Labor: ... | Referenzstoff: ..... | Test Nr.: ..... | ||||||||||
| Testtemperatur: (°C): .... | Volumen des Gasraums (Vh): .... (l) | Volumen der Flüssigkeit (Vl) (l): ...... | ||||||||||
| Kohlenstoff im Prüfstoff Cc,v (mg/l): ..... | mv 1 (mg):..... | |||||||||||
| Tag | p1 (Ref.) (mbar) | p2 (Ref.) (mbar) | p3 (Ref.) (mbar) | p (Ref.) Mittelwert (mbar) | p4 (Inhib.) (mbar) | p5 (Inhib.) (mbar) | p6 (Inhib.) (mbar) | p (Inhib.) Mittelwert (mbar) | p (Ref.) Ref. - Blind (mbar) | Δp (Ref.) Kumulativ (mbar) | MH Kohlenstoff im Gas- raum, C 2 (mg) | Dh Biologi- scher Ab- bau 3 (%) |
| CIC, 1 Ref. (mg) | CIC, 2 Ref. (mg) | CIC, 3 Ref. (mg) | CIC Mittelwerte Ref. (mg) | CIC, 4 Inhib. (mg) | CIC, 5 Inhib. (mg) | CIC, 6 Inhib. (mg) | CIC Mittelwerte Inhib. (mg) | CIC, net Ref. - In- hib. (mg) | ml Flüssiger Kohlen- stoff (4) (mg) | MT Kohlenstoff insgesamt (5) (mg) | Dt Biologischer Abbau (6) (%) | |
| Anorganischer Kohlenstoff (Ende) | ||||||||||||
| pH-Wert (Ende) | ||||||||||||
| 1) Kohlenstoff im Prüfgefäß, mv (mg): mv = CC,v × Vl
2) Kohlenstoff im Gasraum, mh (mg) bei normaler Inkubationstemperatur (35 °C): mh = 0,468 Δp × Vh 3) Biologischer Abbau, berechnet aus dem Gas im Gasraum, Dh (%): Dh = (mh × 100) / mv 4) Kohlenstoff in der Flüssigkeit, ml (mg): ml = CIC,net × Vl 5) Gasförmiger Kohlenstoff insgesamt, mt (mg): mt + ml 6) Biologischer Abbau insgesamt, Dt (%): Dt = (mt × 100) / mv | ||||||||||||
 | weiter . |  |
...
X
⍂
↑
↓