umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (20)
 | zurück |
B.53. Prüfung auf Entwicklungsneurotoxizität 14
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 426 (2007). Im Juni 1995 traf sich eine OECD-Arbeitsgruppe aus dem Bereich Reproduktions- und Entwicklungstoxizität in Kopenhagen, um zu erörtern, ob eine Aktualisierung der bestehenden diesbezüglichen OECD-Prüfrichtlinien sowie die Ausarbeitung neuer Leitlinien für bislang noch nicht abgedeckte Endpunkte erforderlich ist (1). Die Arbeitsgruppe empfahl, auf der Grundlage einer inzwischen überarbeiteten Richtlinie der amerikanischen Umweltschutzbehörde (EPA) (2) eine Prüfrichtlinie für Entwicklungsneurotoxizität auszuarbeiten. Im Juni 1996 fand ein zweites Beratungstreffen in Kopenhagen statt, bei dem das Sekretariat über den Entwurf einer neuen Prüfrichtlinie zur Entwicklungsneurotoxizität einschließlich der wichtigsten Eckpunkte mit Angaben zur Auswahl der Versuchstierarten, zur Dosierungsphase, zur Prüfphase, zu den zu bewertenden Endpunkten und zu den Kriterien für die Auswertung der Ergebnisse informiert werden sollte. 1998 wurde eine US-amerikanische Richtlinie für die Bewertung des Neurotoxizitätsrisikos veröffentlicht (3). Im Oktober 2000 wurden nacheinander ein Beratungstreffen von OECD-Sachverständigen und ein Workshop des ILSI Risk Science Institute abgehalten. 2005 fand in Tokio ein Sachverständigen-Beratungstreffen statt. Ziel dieser Veranstaltungen war die Erörterung der wissenschaftlichen und technischen Fragen im Zusammenhang mit der aktuellen Prüfrichtlinie, und die Empfehlungen aus diesen Treffen (4)(5)(6)(7) wurden bei der Ausarbeitung der vorliegenden Prüfmethode berücksichtigt. Weitere Informationen zu Durchführung, Interpretation und Terminologie dieser Prüfmethode finden sich in den Guidance Documents der OECD Nr. 43 (, Reproductive Toxicity Testing and Assessment") (8) und Nr. 20 (, Neurotoxicity Testing") (9).
2. Viele Chemikalien schädigen bekanntermaßen beim Menschen und anderen Arten das in der Entwicklung befindliche Nervensystem (10)(11)(12)(13). Für die Bewertung und Beurteilung der toxischen Eigenschaften einer Chemikalie ist unter Umständen eine Bestimmung ihres entwicklungsneurotoxischen Potenzials erforderlich. Anhand von Prüfungen auf Entwicklungsneurotoxizität sollen Daten - einschließlich einer Charakterisierung der Dosis- Wirkungs-Beziehung - zu den potenziellen funktionalen und morphologischen Wirkungen auf das in der Entwicklung befindliche Nervensystem der Nachkommen gewonnen werden, die möglicherweise aus der Exposition in utero und während der frühen Lebensphasen resultieren.
3. Eine Entwicklungsneurotoxizitätsstudie kann als Einzelstudie durchgeführt werden, im Rahmen einer Reproduktionstoxizitätsstudie und/oder einer Neurotoxizitätsstudie am adulten Tier erfolgen (z.B. Prüfmethoden B.34 (14), B.35 (15), B.43 (16)) oder mit einer Studie zur Prüfung auf pränatale Entwicklungstoxizität gekoppelt werden (z.B. Prüfmethode B.31 (17)). Wenn die Entwicklungsneurotoxizitätsstudie im Rahmen einer anderen Studie oder gekoppelt mit einer anderen Studie durchgeführt wird, ist unbedingt darauf zu achten, dass die Integrität beider Studienarten gewahrt bleibt. Bei sämtlichen Prüfungen sind die geltenden Rechtsvorschriften sowie staatliche und institutionelle Leitlinien für die Verwendung von Versuchstieren zu Forschungszwecken einzuhalten (z.B. 18).
4. Das Prüflabor muss sich vor der Durchführung der Studie umfassend über alle zu der Prüfsubstanz vorliegenden Daten informieren. Dazu gehören die Identität und chemische Struktur der Chemikalie, ihre physikalisch-chemischen Eigenschaften, die Ergebnisse jeglicher anderer mit der Chemikalie durchgeführten Invitro- oder Invivo-Toxizitätsprüfungen, toxikologische Daten zu strukturverwandten Chemikalien und die vorgesehene(n) Verwendung (en) der Chemikalie. Diese Angaben sind notwendig, um für alle betroffenen Kreise sicherzustellen, dass die Prüfung für den Schutz der menschlichen Gesundheit maßgeblich ist, und sie erleichtern die Auswahl einer geeigneten Anfangsdosis.
5. Die Prüfsubstanz wird den Tieren während der Trächtigkeit und der Laktationsperiode verabreicht. Anhand der Prüfung der Muttertiere können die Wirkungen auf trächtige und laktierende Weibchen bewertet und vergleichende Informationen (Muttertier versus Nachkommen) gewonnen werden. Die Nachkommen der einzelnen Würfe werden im randomisierten Verfahren für die Neurotoxizitätsbeurteilung ausgewählt. Die Versuchstiere werden bei der Beurteilung auf schwere neurologische und Verhaltensanomalien hin beobachtet. Dies schließt die Bewertung der physischen Entwicklung, der Verhaltensontogenese, der motorischen Aktivität, der motorischen und sensorischen Funktionen sowie der Lernfähigkeit und der Gedächtnisleistung ebenso ein wie die Beurteilung des Hirngewichts und neuropathologischer Veränderungen während der postnatalen Entwicklung und am adulten Tier.
6. Wenn die Prüfmethode als Einzelstudie durchgeführt wird, können zusätzliche verfügbare Tiere der einzelnen Gruppen für spezifische neuropathologische, neurochemische oder elektrophysiologische Verfahren oder Verfahren zur Erforschung des neurologisch bedingten Verhaltens verwendet werden, anhand deren die Daten der gemäß vorliegender Prüfmethode empfohlenen Prüfungen ergänzt werden können (16)(19)(20)(21). Die Zusatzverfahren können insbesondere dann sinnvoll sein, wenn die empirische Beobachtung, die erwarteten Wirkungen oder der Wirkmechanismus/die Wirkungsweise auf eine bestimmte Art von Neurotoxizität hindeuten. Diese Zusatzverfahren können sowohl auf die Muttertiere als auch die Jungtiere angewendet werden. Des Weiteren können Exvivo- oder Invitro-Verfahren angewendet werden, sofern dadurch die Integrität der Invivo-Verfahren nicht verändert wird.
Vorbereitungen für die Prüfung
Auswahl der Versuchstierarten
7. Bevorzugtes Versuchstier ist die Ratte; gegebenenfalls können andere Versuchstierarten verwendet werden. Dabei ist jedoch zu beachten, dass die für diese Prüfmethode angegebenen Gestations- und postnatalen Tage für typischerweise verwendete Rattenstämme spezifisch sind. Im Falle der Verwendung anderer Arten oder eines ungewöhnlichen Stamms sind vergleichbare Tage zu wählen. Die Verwendung anderer Arten ist auf der Grundlage toxikologischer, pharmakokinetischer und/oder anderer Daten zu begründen. Bei der Begründung sollten unter anderem möglicherweise vorliegende artenspezifische postnatale neuropathologische Bewertungen und Bewertungen zum neurologisch bedingten Verhalten berücksichtigt werden. Wenn bei einem früheren Test Bedenken aufgetreten sind, sollte die Art/der Stamm, der die Bedenken hervorgerufen hat, in Betracht gezogen werden. Da verschiedene Rattenstämme unterschiedliche Eigenschaften und Merkmale haben, sollte der ausgewählte Stamm nachweislich über eine adäquate Fekundität und Empfindlichkeit verfügen. Inwiefern andere Arten aufgrund ihrer Empfindlichkeit geeignet sind, eine Entwicklungsneurotoxizität zuverlässig nachzuweisen, sollte dokumentiert werden.
Haltungs- und Fütterungsbedingungen
8. Die Temperatur im Versuchstierraum sollte 22 °C ± 3 °C betragen. Die relative Luftfeuchtigkeit sollte mindestens 30 % betragen und - außer beim Reinigen des Raums - 70 % nicht überschreiten, anzustreben ist ein Wert von 50-60 %. Die Beleuchtung sollte künstlich sein und die Hell- und Dunkelphasen sollten sich im Abstand von 12 Stunden abwechseln. Der Hell-Dunkel-Zyklus kann auch vor der Paarung und für den Verlauf der Studie umgekehrt werden, um die Bewertung der funktionalen und verhaltensbezogenen Endpunkte während der Dunkelphase (unter Rotlicht), also wenn die Tiere normalerweise aktiv sind (22), durchzuführen. Bei jeglicher Änderung des Hell-Dunkel-Zyklus ist ausreichend Zeit für die Akklimatisierung der Tiere einzuplanen, damit diese sich an den neuen Zyklus gewöhnen können. An die Versuchstiere kann herkömmliches Laborfutter verfüttert werden, und eine unbegrenzte Trinkwasserversorgung ist zu gewährleisten. Die Art des Futters und Wassers ist zu protokollieren und jeweils auf den Schadstoffgehalt hin zu analysieren.
9. Die Tiere können entweder einzeln oder in kleinen gleichgeschlechtlichen Gruppen in Käfigen untergebracht werden. Die Verpaarung erfolgt in für diese Zwecke geeigneten Käfigen. Wenn die Paarung nachweislich stattgefunden hat oder spätestens an Tag 15 der Trächtigkeit sind die verpaarten Tiere einzeln in Wurfkäfigen oder speziellen Käfigen für Muttertiere zu halten. Die Käfige sollten so angeordnet werden, dass etwaige Einflüsse der Käfigplatzierung minimiert werden. Verpaarte Weibchen sind mit bestimmten geeigneten Nestmaterialien zu versorgen, wenn die Geburt bevorsteht. Bekanntermaßen können sich eine unangemessene Handhabung oder Stress während der Gravidität nachteilig auswirken, da dies unter anderem zu pränatalen Verlusten und einer veränderten fetalen und postnatalen Entwicklung führen kann. Zum Schutz vor pränatalen Verlusten durch nicht behandlungsbedingte Faktoren ist bei der Handhabung der trächtigen Tiere Sorgfalt angebracht, und Stress infolge von äußeren Faktoren, wie übermäßiger Lärm, ist zu vermeiden.
Vorbereitung der Tiere
10. Es sind gesunde Tiere zu verwenden, die an die Laborbedingungen gewöhnt und zuvor nicht für andere Experimente verwendet wurden, außer wenn die Studie Teil einer anderen Studie ist (siehe Nummer 3). Art, Stamm, Herkunft, Geschlecht, Gewicht und Alter der Versuchstiere sind anzugeben. Jedes Versuchstier wird zur sicheren Identifizierung durch eine eigene Nummer gekennzeichnet. Die Tiere der einzelnen Testgruppen sollten so weit wie möglich ein einheitliches Gewicht und Alter haben und sich im normalen Schwankungsbereich der untersuchten Tierart/des Tierstamms bewegen. Für jede Dosisstufe sind junge adulte Weibchen zu verwenden, die noch nicht geworfen haben. Es ist sicherzustellen, dass Geschwister nicht verpaart werden. Tag 0 der Gravidität ist der Tag, an dem ein Vaginalpfropf und/oder Sperma beobachtet wird. Wenn terminiert trächtige Tiere von einem Lieferanten gekauft werden, ist eine angemessene Akklimatisierungszeit (z.B. 2-3 Tage) einzuplanen. Verpaarte Weibchen sind nach dem Zufallsprinzip den Kontroll- und Behandlungsgruppen zuzuteilen und möglichst gleichmäßig auf die Gruppen zu verteilen (für die gleichmäßige Verteilung auf alle Gruppen wird z.B. eine stratifizierte Randomisierung, beispielsweise auf der Grundlage des Körpergewichts, empfohlen). Vom selben Männchen besamte Weibchen sind gleichmäßig auf die Gruppen zu verteilen.
Zahl und Geschlecht der Versuchstiere
11. In jeder Prüf- und Kontrollgruppe sollte sich eine ausreichende Zahl trächtiger Weibchen befinden, die der Prüfsubstanz ausgesetzt werden, damit sichergestellt ist, dass eine angemessene Zahl an Nachkommen für die Neurotoxizitätsbeurteilung zur Verfügung steht. Es wird empfohlen, insgesamt 20 Würfe auf jeder Dosisstufe zu verwenden. Wiederholungsgaben und zeitversetzte Dosierungsschemata sind zulässig, wenn die Gesamtzahlen der Würfe pro Gruppe erreicht und geeignete statistische Modelle zur Berücksichtigung der Wiederholungsgaben verwendet werden.
12. Spätestens am postnatalen Tag 4 (PND 4) (der Tag der Geburt ist PND 0) ist die Größe der einzelnen Würfe durch Eliminierung zufällig ausgewählter überzähliger Jungtiere anzupassen, damit alle Würfe gleich groß sind (23). Die Wurfgröße sollte die durchschnittliche Wurfgröße des verwendeten Nagerstamms nicht überschreiten (8-12). In dem Wurf sollten sich möglichst gleich viele männliche und weibliche Jungtiere befinden. Eine selektive Eliminierung der Jungtiere, z.B. auf der Grundlage des Körpergewichts, ist nicht angebracht. Nach Vereinheitlichung der Würfe (Auslese) und vor der weiteren Prüfung funktionaler Endpunkte sollten einzelne Jungtiere, die für Tests vor bzw. nach dem Absetzen bestimmt sind, eindeutig gekennzeichnet werden, wobei eine beliebige geeignete humane Methode für die Jungtierkennzeichnung anzuwenden ist (z.B. 24).
Zuteilung von Tieren zu funktionalen Prüfungen, Verhaltensprüfungen, zur Bestimmung des Hirngewichts und zu neuropathologischen Beurteilungen
13. Im Rahmen der Prüfmethode gibt es mehrere Ansätze für die Zuteilung der in utero oder während des Säugens exponierten Tiere zu den funktionalen Prüfungen, den Verhaltensprüfungen, der Beurteilung der Geschlechtsreife, der Bestimmung des Hirngewichts und der neuropathologischen Beurteilung (25). Im Einzelfall können zusätzlich noch weitere Prüfungen zum neurologisch bedingten Verhalten (z.B. Sozialverhalten), zur Neurochemie oder Neuropathologie durchgeführt werden, sofern die Integrität der ursprünglich erforderlichen Prüfungen dadurch nicht gefährdet wird.
14. Die Jungtiere werden frühestens am PND 4 aus jeder der einzelnen Dosisgruppen ausgewählt und Endpunktbewertungen zugewiesen. Die Jungtiere sollten möglichst so ausgewählt werden, dass bei sämtlichen Prüfungen Jungtiere beider Geschlechter aus allen Würfen und aus jeder einzelnen Dosisgruppe zu gleichen Teilen vertreten sind. Bei der Prüfung der motorischen Aktivität sind dieselben Paare männlicher und weiblicher Jungtiere in sämtlichen Entwicklungsphasen vor dem Absetzen zu prüfen (siehe Nummer 35). Bei allen anderen Prüfungen können dieselben oder andere Paare männlicher und weiblicher Tiere verschiedenen Verhaltensprüfungen zugeteilt werden. Bei der Prüfung der kognitiven Funktionen müssen für die Prüfungen abgesetzter Jungtiere gegenüber adulten Tieren möglicherweise unterschiedliche Jungtiere zugeteilt werden, um Störeinflüsse aufgrund des Alters und durch Lerneffekte zu vermeiden (26)(27). Beim Absetzen (PND 21) können die nicht für die Prüfungen ausgewählten Jungtiere auf humane Art und Weise entsorgt werden. Alle Änderungen bei der Jungtierzuteilung sind festzuhalten. Die statistische Maßeinheit ist der Wurf (oder das Muttertier), nicht das Jungtier.
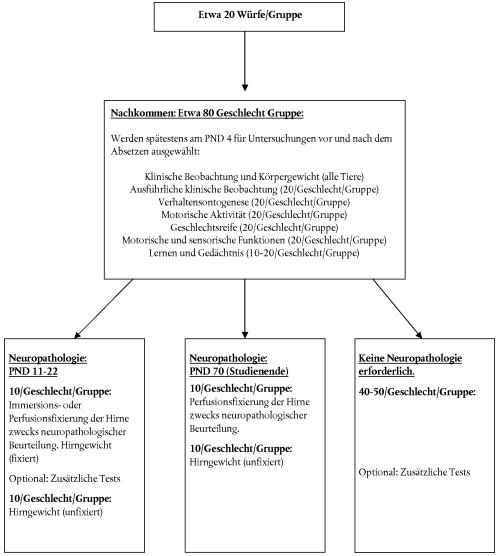
15. Die Zuteilung der Jungtiere zu den Untersuchungen vor dem Absetzen, den Untersuchungen nach dem Absetzen, den kognitiven Prüfungen, pathologischen Untersuchungen usw. kann auf verschiedene Weise erfolgen (siehe Abbildung 1 für die allgemeine Planung und Anlage 1 für Zuteilungsbeispiele). Die empfohlenen Mindestanzahlen an Tieren in jeder einzelnen Dosisgruppe lauten jeweils für Untersuchungen vor bzw. nach dem Absetzen wie folgt:
|
Klinische Beobachtungen und Körpergewicht | Alle Tiere |
| Ausführliche klinische Beobachtungen | 20/Geschlecht (1/Geschlecht/ Wurf) |
| Hirngewicht (nach Fixierung) PND 11-22 | 10/Geschlecht (1/Wurf) |
| Hirngewicht (unfixiert) ~ PND 70 | 10/Geschlecht (1/Wurf) |
| Neuropathologie (Immersions- oder Perfusionsfixierung) PND 11-22 | 10/Geschlecht (1/Wurf) |
| Neuropathologie (Perfusionsfixierung) ~ PND 70 | 10/Geschlecht (1/Wurf) |
| Geschlechtsreife | 20/Geschlecht (1/Geschlecht/ Wurf) |
| Andere Entwicklungsparameter (optional) | Alle Tiere |
| Verhaltensontogenese | 20/Geschlecht (1/Geschlecht/ Wurf) |
| Motorische Aktivität | 20/Geschlecht (1/Geschlecht/ Wurf) |
| Motorische und sensorische Funktionen | 20/Geschlecht (1/Geschlecht/ Wurf) |
| Lernen und Gedächtnis | 10/Geschlecht a (1/Wurf) |
| a) Je nach Empfindlichkeit der kognitiven Funktionsprüfungen sollte die Untersuchung einer wesentlich größeren Anzahl an Tieren in Erwägung gezogen werden, z.B. bis zu ein Männchen und ein Weibchen pro Wurf (bezüglich Tierzuteilung siehe Anlage 1) (für weiterführende Hinweise zur Stichprobengröße siehe OECD Guidance Document Nr. 43 (8)). | |
Dosierung
16. Es sollten mindestens drei Dosisstufen und eine gleichzeitige Kontrolle verwendet werden. Die Dosisstufen sollten so gewählt werden, dass es zu einer graduellen Abstufung der toxischen Wirkungen kommt. Außer bei Beschränkungen aufgrund der physikalisch-chemischen oder der biologischen Eigenschaften der Chemikalie sollte die höchste Dosierungsstufe so gewählt werden, dass dadurch irgend eine Form von maternaler Toxizität auftritt (z.B. klinische Anzeichen, verminderte Körpergewichtszunahme (maximal 10 %) und/oder eine nachweisliche dosislimitierende Toxizität in einem Zielorgan). Die Hochdosis kann mit einigen Ausnahmen auf 1.000 mg/kg/Tag Körpergewicht begrenzt werden. Zum Beispiel kann aufgrund der erwarteten menschlichen Exposition die Verwendung einer höheren Dosisstufe erforderlich sein. Alternativ sollten Pilotstudien oder Vorstudien zur Dosisfindung durchgeführt werden, um die höchste einzusetzende Dosis zu bestimmen, bei der es zu minimaler maternaler Toxizität kommt. Wenn sich entweder in einer standardmäßigen Entwicklungstoxizitätsstudie oder in einer Pilotstudie herausgestellt hat, dass die Prüfsubstanz entwicklungstoxisch wirkt, sollte die höchste Dosisstufe diejenige Maximaldosis sein, bei der keine übermäßige Toxizität bei den Nachkommen auftritt bzw. bei der in utero oder am Neugeborenen weder Tod noch Missbildungen in einem Maße feststellbar sind, dass eine Bewertung der Neurotoxizität behindert würde. Bei der niedrigsten Dosisstufe sollte möglichst keine maternale Toxizität oder Entwicklungstoxizität einschließlich Neurotoxizität nachweisbar sein. Es ist eine absteigende Folge von Dosisstufen zu wählen, um dosisabhängige Wirkungen und die niedrigste Dosisstufe ohne zu beobachtende unerwünschte Wirkungen (NOAEL) nachzuweisen oder Dosen in der Nähe der Nachweisgrenze zu bestimmen, anhand deren die Festlegung einer Benchmark-Dosis (BMD) erfolgen kann. Zwei- bis vierfache Abstände erweisen sich häufig als optimale Dosisabstufungen, und meist ist eine zusätzliche vierte Dosisgruppe der Verwendung von sehr großen Dosisabständen (z.B. um mehr als den Faktor 10) vorzuziehen.
17. Bei der Wahl der Dosisstufen sind sämtliche für die Prüfsubstanz oder verwandte Stoffe vorliegenden Daten zur Toxizität sowie zusätzliche Informationen zu Verstoffwechselung und Toxikokinetik zu berücksichtigen. Diese Angaben sind gegebenenfalls für den Nachweis der Angemessenheit des Dosierungsplans hilfreich. Eine direkte Verabreichung an die Jungtiere sollte unter Berücksichtigung der Daten zu Exposition und Pharmakokinetik erfolgen (28)(29). Vor der Durchführung von Studien mit direkter Verabreichung sind die Vor- und Nachteile sorgfältig gegeneinander abzuwägen (30).
18. Die gleichzeitige Kontrollgruppe sollte eine scheinbehandelte Gruppe oder eine Vehikelkontrollgruppe sein, sofern ein Vehikel zur Verabreichung der Prüfsubstanz verwendet wird. Allen Tieren soll normalerweise dieselbe Menge der Prüfsubstanz oder des Vehikels entsprechend ihrem Körpergewicht verabreicht werden. Wird ein Vehikel oder ein anderes Additiv zur Erleichterung der Dosierung verwendet, sollten folgende Aspekte berücksichtigt werden: Auswirkungen auf die Resorption, die Verteilung, die Verstoffwechselung oder die Retention der Prüfsubstanz, Auswirkungen auf die chemischen Eigenschaften der Prüfsubstanz, die deren toxische Eigenschaften verändern können, und ferner Auswirkungen auf die Futter- oder Wasseraufnahme oder den Ernährungszustand der Versuchstiere. Das Vehikel sollte weder Wirkungen verursachen, die die Auswertung der Studie beeinflussen könnten, noch darf es toxisch auf das neurologisch bedingte Verhalten wirken oder zu einer Beeinflussung von Reproduktion oder Entwicklung führen. Bei neuen Vehikeln ist zusätzlich zu einer Vehikelkontrollgruppe eine scheinbehandelte Kontrollgruppe zu verwenden. Die Tiere der Kontrollgruppe(n) sind genauso zu behandeln wie die Tiere der Prüfgruppe(n).
Verabreichung der Dosen
19. Der Verabreichungsweg der Prüfsubstanz bzw. des Vehikels richtet sich nach der vorherrschenden Art der Exposition beim Menschen und den vorliegenden Daten zu Verstoffwechselung und Verteilung bei den Versuchstieren. Die Verabreichung erfolgt üblicherweise auf oralem Weg (z.B. Schlundsonde, Nahrung, Trinkwasser), andere Wege (z.B. dermal, inhalativ) sind jedoch je nach Eigenschaften und den voraussichtlichen oder bekannten menschlichen Expositionswegen ebenfalls möglich (weitere Informationen dazu im Guidance Document Nr. 43(8)). Der gewählte Verabreichungsweg ist zu begründen. Die Prüfsubstanz sollte täglich ungefähr zur selben Zeit verabreicht werden.
20. Die den einzelnen Tieren verabreichte Dosis orientiert sich normalerweise an der letzten Bestimmung des jeweiligen Körpergewichts. Im letzten Graviditätsdrittel ist bei der Anpassung der Dosen jedoch Vorsicht geboten. Wenn bei den behandelten Muttertieren übermäßige Toxizität festgestellt wird, sind die Tiere auf humane Art und Weise zu töten.
21. Die Prüfsubstanz bzw. das Vehikel ist den verpaarten Weibchen ab dem Implantationszeitpunkt (Tag 6 der Gravidität - GD 6) und während der gesamten Säugephase (PND 21) mindestens einmal täglich zu verabreichen, sodass die Jungtiere der Prüfsubstanz während ihrer prä- und postnatalen neurologischen Entwicklung ausgesetzt sind. Das Alter, ab dem die Verabreichung beginnt, und die Verabreichungsdauer und -häufigkeit können angepasst werden, wenn sich herausstellt, dass ein anderer Versuchsplan für die menschliche Exposition maßgeblicher ist. Die Dauer der Dosisgaben ist bei anderen Arten so anzupassen, dass eine Exposition während aller frühen Phasen der Hirnentwicklung sichergestellt ist (d. h. entsprechend dem pränatalen und frühen postnatalen Hirnwachstum beim Menschen). Mit der Verabreichung kann bereits bei Beginn der Trächtigkeit (GD 0) begonnen werden. Es gilt jedoch zu bedenken, dass die Prüfsubstanz potenziell zu einem Abgang vor der Einnistung führen kann. Dieses Risiko ließe sich zwar durch eine Verabreichung erst ab GD 6 vermeiden, doch dann würden die Entwicklungsphasen zwischen Tag GD 0 und Tag GD 6 nicht in die Behandlung einbezogen. Wenn ein Labor bereits geplant verpaarte Tiere erwirbt, ist ein Verabreichungsbeginn an Tag GD 0 gar nicht möglich, sodass der Tag GD 6 für den Verabreichungsbeginn gut geeignet wäre. Das Prüflabor sollte sich bei der Festlegung des Dosierungsplans an einschlägigen Informationen zu den Wirkungsweisen der Prüfsubstanz, früheren Erfahrungen und logistischen Überlegungen orientieren; dazu gehört gegebenenfalls auch eine Verlängerung der Dosisgabe bis nach dem Absetzen. Die Verabreichung ist am Tag der Geburt auszusetzen, wenn das gebärende Tier noch nicht alle Nachkommen geboren hat. Im Allgemeinen wird davon ausgegangen, dass die Exposition der Jungtiere über die Muttermilch erfolgt, eine Direktverabreichung bei den Jungtieren ist jedoch in denjenigen Fällen in Betracht zu ziehen, wenn der Nachweis für eine kontinuierliche Exposition der Nachkommen fehlt. Der Nachweis für eine kontinuierliche Exposition kann z.B. pharmakokinetischen Daten, Toxizitätszeichen bei den Nachkommen oder veränderten Biomarkern entnommen werden (28).
Beobachtungen an Muttertieren
22. Sämtliche Muttertiere sind mindestens einmal täglich sorgfältig auf ihren Gesundheitszustand einschließlich Anzeichen für Morbidität und Mortalität zu beobachten.
23. Während der Behandlungs- und Beobachtungsphasen sind regelmäßig unter Einbeziehung von mindestens zehn Muttertieren pro Dosisstufe eingehendere klinische Beobachtungen durchzuführen (mindestens zweimal während der Verabreichung in der Graviditätsphase und zweimal während der Verabreichung in der Säugephase). Die Tiere sind außerhalb des Käfigs, in dem sie gehalten werden, von qualifiziertem technischem Personal zu beobachten, denen die Behandlung des jeweiligen Tieres nicht bekannt ist. Dabei sind standardisierte Verfahren anzuwenden, um den Stress des Tieres zu minimieren, die Voreingenommenheit des Beobachters so gering wie möglich zu halten und die Zuverlässigkeit bei Beobachtungen durch mehrere Personen zu maximieren. Die Beobachtungen innerhalb einer bestimmten Studie sollten möglichst durch ein und denselben Untersucher erfolgen.
24. Die bei der Beobachtung festgestellten Anzeichen sind zu dokumentieren. Wenn irgend möglich, ist darüber hinaus die Größenordnung der beobachteten Anzeichen festzuhalten. Bei den klinischen Beobachtungen ist insbesondere auf Veränderungen an Haut, Fell, Augen, Schleimhäuten, auf Sekrete sowie autonome Körperfunktionen (z.B. Tränensekretion, Piloerektion, Pupillengröße, ungewöhnliche Atemmuster und/oder Mundatmung sowie ungewöhnliche Harnentleerung oder Defäkation) zu achten.
25. Ungewöhnliche Reaktionen hinsichtlich Körperhaltung, Aktivitätsgrad (z.B. verminderte oder verstärkte Erkundung der üblichen Untersuchungsumgebung) und Bewegungskoordination sind ebenfalls zu vermerken. Veränderungen des Gangs (z.B. watschelnder Gang, Ataxie), der Haltung (z.B. Buckelhaltung) und des Reaktionsverhaltens beim Aufnehmen oder Umsetzen des Versuchstiers oder anderen Umgebungsstimuli sowie Auftreten von klonischen oder tonischen Bewegungen, Krämpfen oder Tremors, Stereotypien (z.B. übermäßige Fellpflege, ungewöhnliche Kopfbewegungen, repetitives Laufen im Kreis) oder auffälliges Verhalten (z.B. Beißen oder übermäßiges Lecken, Selbstverstümmelung, Rückwärtslaufen, Lautäußerungen) oder Aggressionen sollen protokolliert werden.
26. Sämtliche Toxizitätszeichen sind mit Tag des Einsetzens, Tageszeit, Schweregrad und Dauer zu notieren.
27. Die Tiere sind zum Zeitpunkt der Dosierung mindestens einmal wöchentlich während der Dauer der Studie und am oder um den Tag der Geburt herum sowie am PND 21 (Absetzen) zu wiegen. In Studien mit Substanzverabreichung per Schlundsonde sind die Muttertiere mindestens zweimal wöchentlich zu wiegen. Die Dosis ist jeweils nach jeder Bestimmung des Körpergewichts entsprechend anzupassen. Die Futteraufnahme ist wöchentlich mindestens während der Trächtigkeit und der Säugeperiode zu messen. Die Wasseraufnahme ist mindestens wöchentlich zu messen, wenn die Exposition über die Wasserversorgung erfolgt.
Beobachtungen an Nachkommen
28. Sämtliche Nachkommen sind mindestens einmal täglich sorgfältig auf Toxizitätszeichen sowie auf Morbidität und Mortalität hin zu beobachten.
29. Während der Behandlungs- und Beobachtungsphasen sollten eingehendere klinische Beobachtungen an den Nachkommen durchgeführt werden. Die Nachkommen (mindestens ein Jungtier pro Geschlecht und Wurf) sind von medizinisch-technischen Assistenten (MTA) zu beobachten, denen die Behandlung des jeweiligen Tieres nicht bekannt ist. Dabei sind standardisierte Verfahren anzuwenden, um die Voreingenommenheit des Beobachters so gering wie möglich zu halten und die Zuverlässigkeit bei Beobachtungen durch mehrere Personen zu maximieren. Die Beobachtungen sollten möglichst durch ein- und denselben Untersucher erfolgen. Es sind entsprechend dem untersuchten Entwicklungsstadium mindestens die unter den Nummern 24 und 25 beschriebenen Endpunkte zu überwachen.
30. Sämtliche bei den Nachkommen auftretenden Toxizitätszeichen sind mit Tag des Einsetzens, Tageszeit, Schweregrad und Dauer zu notieren.
Physische Merkmale und Entwicklungsparameter
31. Veränderungen bei Entwicklungsparametern vor dem Absetzen (z.B. Ohrmuschelentfaltung, Augenöffnung, Schneidezahndurchbruch) korrelieren eng mit dem Körpergewicht (30)(31). Das Körpergewicht ist möglicherweise der beste Indikator für die physische Entwicklung. Eine Messung von Entwicklungsparametern empfiehlt sich daher nur dann, wenn bereits im Vorfeld nachgewiesen ist, dass diese Endpunkte zusätzliche Informationen liefern werden. Die zeitliche Planung für die Bewertung dieser Parameter ist Tabelle 1 zu entnehmen. In Abhängigkeit von den erwarteten Wirkungen und den Ergebnissen der ersten Messungen sollten gegebenenfalls weitere Zeitpunkte hinzugefügt oder die Messungen in anderen Entwicklungsstadien durchgeführt werden.
32. Für die Bewertung der physischen Entwicklung sollte eher das postkoitale Alter als das postnatale Alter zugrunde gelegt werden (33). Wenn die Jungtiere am Tag des Absetzens getestet werden, sollte die Prüfung vor dem eigentlichen Absetzen erfolgen, um die Ergebnisse nicht durch den Stress zu verzerren, der beim Absetzen entsteht. Prüfungen, die nach dem Absetzen an den Jungtieren erfolgen, sollten zudem nicht innerhalb der ersten zwei Tage nach dem Absetzen durchgeführt werden.
Zeitliche Planung für die Bewertung der physischen Merkmale und Entwicklungsparameter und der funktionalen Endpunkte/Verhaltensendpunkte a.
|
Altersphasen Endpunkte | Vor Absetzen b | Adoleszenz b | Junge adulte Tiere b |
| Physische Merkmale und Entwicklungsparameter | |||
| Körpergewicht und klinische Beobachtungen | Wöchentlich c | mindestens vier- zehntägig | mindestens vierzehntägig |
| Hirngewicht | PND 22 d | bei Beendigung | |
| Neuropathologie | PND 22 d | bei Beendigung | |
| Geschlechtsreife | - | zu gegebener Zeit | - |
| Andere Entwicklungsparameter e | gegebenenfalls | - | - |
| Funktionale Endpunkte/Verhaltensendpunkte | |||
| Verhaltensontogenese | Mindestens zwei Messungen | ||
| Motorische Aktivität (einschließlich Habituation) | 1-3 Mal f | - | einmal |
| Motorische und sensorische Funktionen | - | einmal | einmal |
| Lernen und Gedächtnis | - | einmal | einmal |
| a) Dieser Tabelle ist zu entnehmen, wie oft die Messungen mindestens durchgeführt werden sollten.
In Abhängigkeit von den erwarteten Wirkungen und den Ergebnissen der ersten Messungen sollten gegebenenfalls weitere Zeitpunkte (z.B. alte Tiere) hinzugefügt oder die Messungen in anderen Entwicklungsstadien durchgeführt werden.
b) Es wird empfohlen, die Jungtiere nicht in den ersten zwei Tagen nach dem Absetzen zu testen (vgl. Nummer 32). Das empfohlene Lebensalter für die Prüfung der adoleszenten Tiere ist jeweils: Lernen und Gedächtnis = PND 25 ± 2; motorische und sensorische Funktionen = PND 25 ± 2. Das empfohlene Lebensalter für die Prüfung junger adulter Tiere ist PND 60-70. c) Wenn die Prüfsubstanz den Jungtieren direkt verabreicht wird, sollte das Körpergewicht mindestens zweimal wöchentlich bestimmt werden, um die Dosis in Zeiten rascher Gewichtszunahme anpassen zu können. d) Hirngewicht und Neuropathologie können gegebenenfalls zu einem früheren Zeitpunkt bewertet werden (z.B. PND 11) (vgl. Nummer 39). e) Gegebenenfalls sind neben dem Körpergewicht auch andere Parameter der Entwicklung (z.B. Augenöffnung) zu dokumentieren (vgl. Nummer 31). f) Vgl. Nummer 35. | |||
33. Die lebenden Jungtiere sind zu zählen und ihr Geschlecht ist zu bestimmen, z.B. durch Sichtkontrolle oder Messung des anogenitalen Abstands (34)(35); jedes Jungtier eines Wurfs ist einzeln zu wiegen, und zwar so bald wie möglich nach der Geburt, danach wöchentlich während der Laktation und im Anschluss daran mindestens vierzehntägig. Bei der Beurteilung der Geschlechtsreife sollten pro Wurf bei mindestens einem Weibchen und einem Männchen Alter und Körpergewicht bestimmt werden, wenn die Öffnung der Vagina (36) bzw. die Präputialseparation (37) beobachtet werden.
Verhaltensontogenese
34. Die Ontogenese ausgewählter Verhaltensweisen sollte bei mindestens einem Jungtier pro Geschlecht und Wurf während der entsprechenden Altersphase gemessen werden, wobei an allen Prüftagen und bei jedem bewerteten Verhalten jeweils dieselben Jungtiere zu verwenden sind. Die Messtage sind gleichmäßig über diesen Zeitraum zu verteilen, um entweder die normale oder die behandlungsbedingte Veränderung der Ontogenese des jeweiligen Verhaltens bestimmen zu können (38). Nachfolgend sind einige Beispiele für Verhalten aufgeführt, deren Ontogenese bewertet werden kann: Aufrichtungsreflex, negative Geotaxis und motorische Aktivität (38)(39)(40).
Motorische Aktivität
35. Die motorische Aktivität ist in den Lebensphasen vor dem Absetzen und in späteren Phasen beim adulten Tier zu beobachten (41)(42)(43)(44)(45). Bezüglich Prüfungen vor dem Absetzen siehe Nummer 32. Die Prüfsitzung sollte so lange dauern, dass bei unbehandelten Kontrolltieren eine Habituation innerhalb der Sitzung nachgewiesen werden kann. Es wird dringend empfohlen, bei der Bewertung der Verhaltensontogenese die motorische Aktivität zu berücksichtigen. Wenn bei einem Test die Verhaltensontogenese geprüft werden soll, sollten für alle vor dem Absetzen stattfindenden Prüfsitzungen dieselben Tiere eingesetzt werden. Die Prüfungen sollten so häufig stattfinden, dass die Ontogenese einer Habituation innerhalb einer Sitzung bewertet werden kann (44). Dafür sind gegebenenfalls drei oder mehr Prüfzeitpunkte vor dem Tag des Absetzens und einschließlich dieses Tags erforderlich (z.B. PND 13, 17 und 21). Dieselben Tiere oder Wurfgeschwister sollten darüber hinaus als adulte Tiere gegen Ende der Studie geprüft werden (z.B. PND 60-70). Nach Bedarf können die Prüfungen an weiteren Zusatztagen durchgeführt werden. Die motorische Aktivität sollte mittels eines automatischen Aktivitätsmessgeräts beobachtet werden, das in der Lage ist, sowohl ein Ansteigen als auch ein Abfallen der Aktivität zu erfassen (d. h. die vom Gerät gemessene Basisaktivität sollte weder so niedrig sein, dass dadurch die Erfassung eines Abfalls verhindert wird, noch so hoch, dass dadurch die Erfassung von Aktivitätsanstiegen unmöglich gemacht wird). Jedes der Geräte sollte im Rahmen standardisierter Verfahren geprüft worden sein, um bei Betrieb mehrerer Geräte an mehreren Tagen eine möglichst hohe Betriebssicherheit zu gewährleisten. Die Behandlungsgruppen sollten soweit wie möglich gleichmäßig auf die Geräte verteilt werden. Jedes Tier ist einzeln zu testen. Bei der Beobachtung der Behandlungsgruppen über die Prüfzeiträume hinweg ist auf Ausgewogenheit zu achten, um Störeinflüsse aufgrund des zirkadianen Aktivitätsrhythmus zu vermeiden. Es ist nach Möglichkeit sicherzustellen, dass die Prüfbedingungen nur geringfügig variieren und diese Variationen nicht systematisch mit der Behandlung zusammenhängen. Zu den Variablen, die die Messung zahlreicher Verhaltensweisen, einschließlich der motorischen Aktivität, beeinflussen können, gehören Geräuschpegel, Testkäfigform und -größe, Temperatur, relative Luftfeuchte, Lichtverhältnisse, Gerüche, Verwendung des vertrauten Haltungskäfigs oder eines neuen Testkäfigs und Ablenkungen aus der Umgebung.
Motorische und sensorische Funktionen
36. Die motorischen und sensorischen Funktionen sind mindestens einmal während der Adoleszenzphase und einmal beim jungen adulten Tier eingehend zu untersuchen (z.B. PND 60-70). Bezüglich Prüfungen zum Zeitpunkt des Absetzens siehe Nummer 32. Es sollte eine ausreichende Anzahl an Tests durchgeführt werden, um eine aussagekräftige Stichprobenmenge zu den sensorischen Modalitäten (z.B. somatosensorisch, vestibulär) und den motorischen Funktionen (z.B. Kraft, Koordination) sicherzustellen. Die motorischen und sensorischen Funktionen können unter anderem mittels des generalisierten Streckreflexes (extensorthrust) (46), des Aufrichtungsreflexes (47)(48), der akustischen Schreckreflex-Habituation (40)(49)(50)(51)(52)(53)(54) und evozierter Potenziale (55) untersucht werden.
Lern- und Gedächtnisprüfungen
37. Nach dem Absetzen (beispielsweise an Tag 25 ± 2 Tage) und beim jungen adulten Tier (PND 60 oder älter) sollte ein Test für assoziatives Lernen und Gedächtnis durchgeführt werden. Bezüglich Prüfungen vor dem Absetzen siehe Nummer 32. Bei diesen beiden Entwicklungsphasen können derselbe Test oder andere Tests verwendet werden. Bei der Auswahl der Prüfung(en), anhand deren die Lern- und Gedächtnisfähigkeit bei abgesetzten Tieren und adulten Ratten untersucht werden kann, besteht ein gewisser Handlungsspielraum. Die Prüfungen sollten jedoch so aufgebaut sein, dass sie die folgenden beiden Kriterien erfüllen: Erstens sollte die Lernfähigkeit entweder als Veränderung über mehrere wiederholte Lernexperimente oder -sitzungen hinweg oder, in Prüfungen mit nur einem Versuch, durch Verwendung einer Versuchsbedingung, die nichtassoziative Wirkungen der Trainingserfahrung kontrolliert, beurteilt werden. Zweitens sollten die Prüfungen eine Gedächtnismessung (Kurzzeit- oder Langzeitgedächtnis) zusätzlich zum ursprünglichen Lernen (Aneignung) beinhalten, doch diese Gedächtnismessung ist nur dann dokumentierbar, wenn innerhalb derselben Prüfung auch eine Messung der Aneignung stattgefunden hat. Wenn die Lern- und Gedächtnisprüfungen eine Wirkung der Prüfsubstanz ergeben, sind gegebenenfalls Zusatztests in Erwägung zu ziehen, um auszuschließen, dass das Versuchsergebnis auf alternative Ursachen, zum Beispiel geänderte sensorische, motivationale und/oder motorische Fähigkeiten, zurückzuführen ist. Zusätzlich zu den beiden oben genannten Kriterien wird empfohlen, die Lern- und Gedächtnistests danach auszuwählen, ob bei ihnen in Bezug auf die zu untersuchende Chemikalienklasse nachweislich eine Prüfempfindlichkeit vorliegt, sofern sich entsprechende Hinweise in der Fachliteratur finden. Falls sich in der Literatur keine Hinweise finden, können unter anderem folgende Prüfungen unter Einhaltung der oben genannten Kriterien durchgeführt werden: passive Vermeidung (43)(56)(57), Delayedmatchingto-Position-Aufgaben für die adulte Ratte (58) und die infantile Ratte (59), olfaktorische Konditionierung (43)(60), Morris-Wasserlabyrinth (61)(62)(63), Biel-Maze-Test oder Cincinnati-Maze-Test (64)(65), Radial Arm-Maze (66), T-Maze (43) und Aneignung und Beibehaltung von zeitplangesteuertem Verhalten (26)(67)(68). In der Literatur sind zusätzliche Tests für abgesetzte Jungtiere (26)(27) und adulte Ratten (19)(20) beschrieben.
Nekropsie
38. Die Muttertiere können nach dem Absetzen der Nachkommen getötet werden.
39. Die neuropathologische Beurteilung der Nachkommen wird unter Verwendung der Gewebe von auf humane Art am Tag PND 22 oder zu einem früheren Zeitpunkt zwischen PND 11 und PND 22 getöteten Nachkommen sowie am Ende der Studie durchgeführt. Bei am PND 22 getöteten Nachkommen sind die Hirngewebe zu untersuchen; bei am Ende der Prüfung getöteten Tieren sind sowohl die Gewebe des Zentralnervensystems (ZNS) als auch die des peripheren Nervensystems (PNS) zu beurteilen. Tiere, die am PND 22 oder früher getötet werden, können durch Immersion oder Perfusion fixiert werden. Am Ende der Prüfung getötete Tiere sind durch Perfusion zu fixieren. Bei allen die Gewebepräparation betreffenden Aspekten sollte auf Ausgewogenheit geachtet werden, d. h. von der Perfusion der Tiere über das Schneiden der Gewebeproben und die Probenvorbereitung bis hin zur Färbung der Objektträger sollte jeder Satz repräsentative Proben jeder Dosisgruppe enthalten. Eine weiterführende neuropathologische Anleitung findet sich im OECD Guidance Document Nr. 20 (9), siehe auch (103).
Probenvorbereitung
40. Alle zum Zeitpunkt der Nekropsie offenkundigen schwerwiegenden Abnormitäten sind zu dokumentieren. Es sind Gewebeproben von allen wichtigen Regionen des Nervensystems zu entnehmen. Die Gewebeproben sind in einem geeigneten Fixativ aufzubewahren und im Einklang mit allgemein bekannten histologischen Standardprotokollen (69)(70)(71)(103) aufzubereiten. Für ZNS- und PNS-Gewebe ist die Paraffineinbettung geeignet, doch wenn ein höherer Auflösungsgrad erforderlich ist (z.B. bei peripheren Nerven bei Verdacht auf periphere Neuropathie und/ oder bei der morphometrischen Analyse peripherer Nerven), ist gegebenenfalls eine Nachfixierung mit Osmium in Kombination mit Epoxydeinbettung angezeigt. Für die morphometrische Analyse gewonnenes Hirngewebe ist bei allen Dosisstufen zur gleichen Zeit in ein geeignetes Medium einzubetten, um ein Schrumpfen der Prüfgegenstände zu vermeiden, das bei zu langer Aufbewahrung im Fixativ auftreten kann (6).
Neuropathologische Untersuchung
41. Bei der qualitativen Untersuchung sollen
- Regionen innerhalb des Nervensystems ermittelt werden, die Anzeichen für neuropathologische Veränderungen zeigen,
- diejenigen Arten neuropathologischer Veränderungen ermittelt werden, die auf die Exposition gegenüber der Prüfsubstanz zurückzuführen sind, und
- der Schweregrad der neuropathologischen Veränderungen bestimmt werden.
Repräsentative histologische Schnitte der Gewebeproben sind von einem entsprechend geschulten Pathologen mikroskopisch auf das Vorliegen neuropathologischer Veränderungen zu untersuchen. Alle neuropathologischen Veränderungen sind subjektiv nach Schweregrad einzuteilen. Eine Hämatoxylin-Eosin-Färbung ist für die Hirnschnitt-Beurteilung von Tieren, die spätestens am PND 22 auf humane Weise getötet wurden, gegebenenfalls ausreichend. Bei ZNS- und PNS-Geweben von am Ende der Prüfung getöteten Tieren sollte jedoch eine Myelinfärbung (z.B. Luxol Fast Blue/Kresylviolett) und eine Silberfärbung (z.B. nach Bielschowsky oder Bodian) durchgeführt werden. Je nach professioneller Einschätzung des Pathologen und in Abhängigkeit von den beobachteten Veränderungen können auch andere Färbungen zur Identifizierung und Charakterisierung bestimmter Veränderungstypen in Betracht kommen (z.B. histochemischer Nachweis des sauren Gliafaserproteins (Glial fibrillary acidic protein, GFAP) oder Lektinhistochemie zur Bewertung glialer und mikroglialer Veränderungen (72), Fluoro-Jade-Färbung zur Feststellung von Nekrosen (73)(74) oder Silberfärbungen speziell für neuronale Degenerationen (75)).
42. Es sollte eine morphometrische (quantitative) Bewertung durchgeführt werden, da diese Daten für den Nachweis einer behandlungsbedingten Wirkung relevant sein können und hilfreich sind für die Beurteilung der behandlungsbedingten Unterschiede bei Hirngewicht und Morphologie (76)(77). Von den Nervengeweben sind Proben herzustellen und für die morphometrische Untersuchung aufzubereiten. Die morphometrischen Bewertungen können z.B. lineare oder flächige Messungen bestimmter Hirnregionen umfassen (78). Bei den linearen oder flächigen Messungen müssen gleichwertige, sorgfältig auf der Grundlage zuverlässiger mikroskopischer Messpunkte ausgewählte Schnitte verwendet werden (6). Mithilfe der Stereologie können behandlungsbedingte Wirkungen auf bestimmte Parameter wie Volumen oder Zellzahl für bestimmte neuroanatomische Regionen festgestellt werden (79)(80)(81)(82)(83)(84).
43. Die Gehirne sind auf Hinweise für behandlungsbedingte neuropathologische Veränderungen hin zu untersuchen, und von allen wichtigen Hirnregionen sind geeignete Proben zu nehmen (z.B. Riechkolben, Großhirnrinde (Cortex cerebri), Hippocampus, Basalganglien, Thalamus, Hypothalamus, Mittelhirn (Tectum, Tegmentum und Pedunculus cerebri), Pons, Medulla oblongata, Kleinhirn), um eine gründliche Untersuchung zu gewährleisten. Die Schnitte müssen unbedingt bei allen Tieren in derselben Ebene entnommen werden. Bei adulten Tieren, die am Ende der Prüfung auf humane Art getötet werden, sind repräsentative Schnitte des Rückenmarks und des PNS als Proben zu entnehmen. Die untersuchten Bereiche sollten das Auge mit Sehnerv und Netzhaut, das Rückenmark an den zervikalen und lumbalen Verdickungen, die dorsalen und ventralen Nervenwurzelfasern, den proximalen Ischiasnerv, den proximalen Schienbeinnerv (am Knie) und die Wadenmuskel-Äste des Schienbeinnervs umfassen. Die Gewebeschnitte durch Rückenmark und peripheres Nervengewebe sollen sowohl Quer- als auch Längsschnitte umfassen.
44. Bei der neuropathologischen Beurteilung sollte zusätzlich zu Zellveränderungen (z.B. neuronale Vakuolisierung, Degeneration, Nekrose) und Gewebeveränderungen (z.B. Gliose, Leukozyteninfiltration, Zystenbildung) auch nach Hinweisen auf Entwicklungsschäden am Nervensystem gesucht werden (6)(85)(86)(87)(88)(89). Diesbezüglich sind behandlungsbedingte Wirkungen unbedingt von normalen Entwicklungsereignissen zu unterscheiden, die üblicherweise in der mit dem Tötungszeitpunkt zusammenfallenden Entwicklungsphase auftreten (90). Beispiele für signifikante Veränderungen, die auf eine Entwicklungsschädigung hindeuten, sind unter anderem:
- Veränderungen der Größe oder Form bei Riechkolben, Großhirn oder Kleinhirn,
- Veränderungen der relativen Größe verschiedener Hirnregionen einschließlich Vergrößerungen oder Verkleinerungen von Regionen, die aus dem Verlust oder der Fortdauer von normalerweise kurzlebigen Zellpopulationen oder axonalen Projektionen resultieren (z.B. externes Keimlager des Kleinhirns, Gehirnbalken),
- Veränderungen der Proliferation, Migration und Differenzierung, wie sie in Bereichen mit ausgeprägter Apoptose oder Nekrose vorkommen, Cluster oder zerstreute Populationen ektopischer, fehlplatzierter oder fehlgebildeter Neuronen oder Änderungen an der relativen Größe verschiedener Schichten kortikaler Strukturen,
- Veränderungen beim Entstehungsmuster der Myelinhülle einschließlich einer globalen Größenverminderung oder veränderte Färbung der myelinisierten Strukturen,
- Feststellung eines Wasserkopfs, insbesondere Erweiterung der Ventrikel, Stenose des Aquaeductus cerebri und Verdünnung der Großhirnhemisphären.
Analyse der Dosis-Wirkungs-Beziehung neuropathologischer Veränderungen
45. Das folgende, schrittweise aufgebaute Verfahren wird für die qualitative und quantitative neuropathologische Analyse empfohlen. Als erstes werden die Schnitte der Gruppe mit der höchsten Dosis mit denjenigen der Kontrollgruppe verglichen. Wenn bei den Tieren der Gruppe, die die höchste Dosis erhalten hat, keine neuropathologischen Veränderungen feststellbar sind, ist keine weitere Analyse erforderlich. Wenn neuropathologische Veränderungen bei der Hochdosisgruppe nachweisbar sind, werden auch die Tiere der mittleren und der niedrigsten Dosisgruppen untersucht. Wenn die Hochdosisgruppe aufgrund einer anderen konfundierenden Toxizität oder des Todes der Tiere abgeschlossen ist, sind die Gruppen mit hoher und mittlerer Dosis auf neuropathologische Veränderungen hin zu analysieren. Wenn es in den niedrigeren Dosisgruppen Hinweise auf Neurotoxizität gibt, ist bei diesen Gruppen eine neuropathologische Analyse durchzuführen. Wenn bei der qualitativen oder quantitativen Untersuchung behandlungsbedingte neuropathologische Veränderungen gefunden werden, sind die Dosisabhängigkeit des Auftretens, die Häufigkeit und der Schweregrad der Läsionen oder der morphometrischen Veränderungen auf der Grundlage einer Beurteilung aller Tiere aus sämtlichen Dosisgruppen zu bestimmen. In die Beurteilung sind alle Hirnregionen einzubeziehen, bei denen sich neuropathologische Veränderungen gleich welcher Art finden. Für jede Läsionsart sind die zur Festlegung der einzelnen Schweregrade verwendeten Eigenschaften zu beschreiben und die zur Unterscheidung der Schweregrade verwendeten Merkmale anzugeben. Anhand der Häufigkeit der einzelnen Läsionsarten und ihres Schweregrads ist eine statistische Analyse zur Beurteilung der Art der Dosis-Wirkungs-Beziehung durchzuführen. Es wird empfohlen, codierte Objektträger zu verwenden (91).
Daten
46. Die Daten sind sowohl einzeln zu protokollieren als auch in tabellarischer Form zusammenzufassen, wobei ersichtlich sein muss, bei welcher der einzelnen Prüfgruppen welche Arten von Veränderungen aufgetreten sind und bei wie vielen Muttertieren, nach Geschlecht gegliederten Nachkommen und Würfen diese Veränderungen feststellbar waren. Wenn eine direkte postnatale Exposition der Nachkommen erfolgt ist, sind Verabreichungsweg, -dauer und -zeitraum in den Bericht aufzunehmen.
Beurteilung und Auswertung der Ergebnisse
47. Eine Prüfung auf Entwicklungsneurotoxizität liefert Informationen darüber, wie sich eine Chemikalie bei wiederholter Exposition in utero und während der frühen postnatalen Entwicklung auswirkt. Da der Schwerpunkt sowohl auf die allgemeine Toxizität als auch auf entwicklungsneurotoxische Endpunkte gelegt wird, lassen die Prüfungsergebnisse eine Unterscheidung zu zwischen den Wirkungen auf die neurologische Entwicklung, die ohne allgemeine maternale Toxizität auftreten, und Veränderungen, die nur bei Dosen auftreten, die auch beim Muttertier toxisch wirken. Da die Wechselbeziehung zwischen Prüfungsdesign, statistischer Analyse und biologischer Signifikanz der Daten äußerst komplex ist, können die Entwicklungsneurotoxizitätsdaten nur unter Hinzuziehung eines Experten korrekt ausgewertet werden (107)(109). Bei der Auswertung der Testergebnisse sollte ein WoE-Ansatz angewendet werden (20)(92)(93)(94). Die Muster der verhaltensbedingten oder morphologischen Befunde sollten, sofern vorhanden, ebenso erörtert werden wie eine nachweisliche Dosis-Wirkungs-Beziehung. In diese Analyse sollten Daten aus allen Studien einfließen, die für die Beurteilung der Entwicklungsneurotoxizität relevant sind, dazu gehören unter anderem epidemiologische Studien oder Fallberichte am Menschen sowie tierexperimentelle Studien (z.B. toxikokinetische Daten, Daten zur Struktur-Wirkungs-Beziehung, Daten aus anderen Toxizitätsstudien). Dies schließt auch die Beziehung zwischen den Dosen der Prüfsubstanz und dem Auftreten/Nichtauftreten neurotoxischer Wirkungen bzw. deren Häufigkeit und Ausprägung bei beiden Geschlechtern mit ein (20)(95).
48. Die Datenauswertung sollte ferner eine Diskussion sowohl der biologischen als auch der statistischen Signifikanz beinhalten. Die statistische Analyse sollte bei der Datenauswertung unterstützend herangezogen werden, aber nicht allein bestimmend dafür sein. Allein aus dem Fehlen einer statistischen Signifikanz sollte ebenso wenig automatisch geschlossen werden, dass keine behandlungsbedingten Wirkungen vorliegen, wie das Vorhandensein einer statistischen Signifikanz nicht als einzige Begründung für das Vorliegen einer behandlungsbedingten Wirkung herangezogen werden darf. Um mögliche falschnegative Ergebnisse zu vermeiden und den Schwierigkeiten vorzubeugen, die naturgemäß mit einem,negativen Beweis" verbunden sind, sollten vorhandene positive und historische Kontrolldaten in die Diskussion einbezogen werden, insbesondere dann, wenn keine behandlungsbedingten Wirkungen gefunden werden (102)(106). Die Wahrscheinlichkeit falschpositiver Ergebnisse sollte vor dem Hintergrund der statistischen Gesamtauswertung der Daten erörtert werden (96). Sofern ein Zusammenhang zwischen neuropathologischen Veränderungen und Verhaltensänderungen beobachtet wurde, sollte dieser in die Beurteilung einbezogen werden.
49. Sämtliche Ergebnisse sind mithilfe zum Prüfungsdesign passender statistischer Modelle zu analysieren (108). Die Entscheidung für eine parametrische bzw. eine parameterfreie Analyse ist anhand bestimmter Faktoren wie zum Beispiel der Art der Daten (umgewandelte/nicht umgewandelte Daten) und deren Verteilung sowie der relativen Robustheit der gewählten statistischen Analyse zu begründen. Bei der Auswahl der statistischen Analysemethoden sollten Prüfungszweck und Prüfungsdesign als Orientierungshilfe dienen, um das Auftreten von Typ-I- Fehlern (falschpositive Ergebnisse) und Typ-II-Fehlern (falschnegative Ergebnisse) so gering wie möglich zu halten (96)(97)(104)(105). Bei Entwicklungsstudien, bei denen jeweils mehrere Jungtiere desselben Wurfs geprüft werden, sollte der Wurf als solcher in das statistische Modell einbezogen werden, um aufgeblähte Typ-I-Fehlerquoten zu vermeiden (98)(99)(100)(101). Die statistische Maßeinheit sollte der Wurf sein, nicht das Jungtier. Die Experimente sollten so ausgestaltet sein, dass Wurfgeschwister nicht als unabhängige Beobachtungsobjekte behandelt werden. Jeder am selben Versuchstier wiederholt gemessene Endpunkt sollte anhand statistischer Modelle analysiert werden, die der Tatsache Rechnung tragen, dass diese Messungen nicht unabhängig sind.
Prüfbericht
50. Der Prüfbericht sollte folgende Angaben enthalten:
Prüfsubstanz:
- physikalische Beschaffenheit und gegebenenfalls physikalisch-chemische Eigenschaften,
- Identifizierungsdaten einschließlich Quelle und
- Reinheit der Zubereitung und bekannte und/oder erwartete Verunreinigungen.
Vehikel (falls verwendet):
- Begründung für die Wahl des Vehikels (falls nicht Wasser oder physiologische Kochsalzlösung).
Versuchstiere:
- Art und Stamm und Begründung für die Verwendung einer anderen Art als der Ratte,
- Anbieter, von dem die Versuchstiere stammen,
- Zahl, Alter bei Beginn und Geschlecht der Versuchstiere,
- Herkunft, Haltungsbedingungen, Nahrung, Wasser usw. und
- Gewicht der einzelnen Tiere bei Versuchsbeginn.
Prüfbedingungen:
- Begründung der gewählten Dosisstufen,
- Begründung des Verabreichungswegs und -zeitraums,
- Angabe der verabreichten Dosen einschließlich Einzelheiten zu Vehikel, Volumen und physikalischer Form des verabreichten Stoffs,
- Angaben zur Zubereitungsform der Prüfsubstanz/des Futters, der erreichten Konzentration, Stabilität und Homogenität der Zubereitung,
- Methode zur eindeutigen Kennzeichnung der Muttertiere und der Nachkommen,
- genaue Beschreibung der Randomisierungsmethode(n) für die Zuteilung der Muttertiere zu Behandlungsgruppen, für die Auswahl von Jungtieren zwecks Auslese und für die Zuteilung von Jungtieren zu Prüfgruppen,
- Einzelheiten zur Verabreichung der Prüfsubstanz,
- gegebenenfalls Angaben zur Umrechnung der Konzentration der Prüfsubstanz im Futter/Wasser bzw. im Inhalat (ppm) in die entsprechende Dosis (mg pro kg Körpergewicht und Tag),
- Umgebungsbedingungen
- Einzelheiten zu Futter- und Wasserqualität (z.B. Leitungswasser, destilliertes Wasser) und - Datum des Beginns und des Endes der Prüfung.
Beobachtungen und Prüfverfahren:
- ausführliche Beschreibung der zur Standardisierung von Beobachtungen und Verfahren angewendeten Vorgehensweise sowie operative Festlegungen für die Auswertung der Beobachtungen,
- Verzeichnis aller verwendeten Prüfverfahren und Begründung für deren Anwendung,
- ausführliche Beschreibung der verhaltensbezogenen/funktionalen, pathologischen, neurochemischen oder elektrophysiologischen Verfahren einschließlich detaillierter Angaben zu automatischen Geräten,
- Kalibrierungsverfahren und Verfahren zur Gewährleistung der Gleichwertigkeit der verwendeten Geräte und der ausgewogenen Zusammensetzung der Prüfgruppen während der Prüfverfahren und
- kurze Begründung, warum einzelne Entscheidungen die Hinzuziehung eines Sachverständigen erfordern.
Ergebnisse (Einzelergebnisse und Zusammenfassung, gegebenenfalls einschließlich Durchschnittswert und Varianz):
- Zahl der Tiere zu Beginn und am Ende der Prüfung,
- Zahl der bei den einzelnen Prüfmethoden eingesetzten Tiere und Würfe,
- Kennzeichnungsnummern der einzelnen Tiere und der Würfe, aus denen sie stammen,
- Wurfgröße und mittleres Geburtsgewicht nach Geschlecht,
- Körpergewicht und Daten zur Änderung des Körpergewichts einschließlich des terminalen Körpergewichts der Muttertiere und der Nachkommen
- Nahrungsaufnahmedaten und gegebenenfalls Wasseraufnahmedaten (z.B. wenn die Prüfsubstanz mit dem Wasser verabreicht wird),
- Daten für toxische Reaktion, aufgeschlüsselt nach Geschlecht und Dosisstufe, einschließlich Zeichen für Toxizität oder Mortalität, gegebenenfalls einschließlich Todeszeitpunkt und -ursache,
- Art, Schweregrad, Dauer, Tag des Einsetzens, Tageszeit und weiterer Verlauf der ausführlichen klinischen Beobachtungen,
- Bewertung der einzelnen Entwicklungsparameter (Gewicht, Geschlechtsreife und Verhaltensontogenese) zu jedem Beobachtungzeitpunkt,
- ausführliche Beschreibung der nach Geschlecht aufgeschlüsselten verhaltensbezogenen, funktionalen, neuropathologischen, neurochemischen und elektrophysiologischen Befunde einschließlich Zunahmen und Abnahmen im Vergleich zu Kontrollgruppen,
- Ergebnisse der Nekropsie,
- Hirngewichte,
- sämtliche Diagnosen aus neurologischen Anzeichen und Läsionen einschließlich natürlicherweise aufgetretener Krankheiten oder Zustände,
- Abbildungen von Beispielbefunden,
- niedrig aufgelöste Bilder zur Bewertung der Homologie der für die Morphometrie verwendeten Schnitte,
- Resorptions- und Metabolismusdaten einschließlich ergänzender Daten aus einer separaten Toxikokinesestudie (falls vorhanden),
- statistische Aufarbeitung der Ergebnisse einschließlich statistischer Modelle für die Daten- und Ergebnisanalyse, und zwar unabhängig davon, ob diese signifikant waren oder nicht, und
- Verzeichnis der an der Prüfung beteiligten Personen einschließlich ihrer Berufsausbildung.
Diskussion der Ergebnisse:
- Dosis-Wirkungs-Beziehungen, aufgeschlüsselt nach Geschlecht und Gruppe,
- Einfließen etwaiger anderer toxischer Wirkungen in die Schlussfolgerung bezüglich des neurotoxischen Potenzials der Prüfsubstanz, aufgeschlüsselt nach Geschlecht und Gruppe,
- Auswirkung etwaiger toxikokinetischer Informationen auf die Schlussfolgerung,
- Abgleich mit anderen bekannten Neurotoxinen auf ähnliche Wirkungen,
- Daten zur Untermauerung der Zuverlässigkeit und Empfindlichkeit der Prüfmethode (d. h. positive Daten und historische Kontrolldaten),
- Zusammenhänge zwischen neuropathologischen und funktionalen Wirkungen (sofern diese vorliegen) und
- NOAEL oder Benchmark-Dosis für Muttertiere und Nachkommen, aufgeschlüsselt nach Geschlecht und Gruppe.
Schlussfolgerungen:
- Diskussion der Gesamtauswertung der Daten auf Grundlage der Ergebnisse, einschließlich der Bestimmung des NOAEL und einer Schlussfolgerung darüber, ob die Prüfsubstanz eine entwicklungsneurotoxische Wirkung hat oder nicht.
(1) OECD (1995). Draft Report of the OECD Ad Hoc Working Group on Reproduction and Developmental Toxicity. Copenhagen, Denmark, 13.-14. Juni 1995.
(2) US EPA (1998). U.S. Environmental Protection Agency Health Effects Test Guidelines. OPPTS 870.6300. Developmental Neurotoxicity Study. US EPA 712-C-98-239. Abrufbar unter [http://www.epa.gov/opptsfrs/OPPTS_ Harmonized/870_Health_Effects_Test_Guidelines/Series/].
(3) US EPA (1998). Guidelines for Neurotoxicity Risk Assessment. US EPA 630/R-95/001F. Abrufbar unter [http://cfpub.epa.gov/ncea/cfm/recordisplay.cfm? Print Version=True&deid=12479].
(4) Cory-Slechta, D.A., Crofton, K.M., Foran, J.A., Ross, J.F., Sheets, L.P., Weiss, B., Mileson, B. (2001). Methods to identify and characterize developmental neurotoxicity for human health risk assessment: I. Behavioral effects. Environ. Health Perspect., 109:79-91.
(5) Dorman, D.C., Allen, S.L., Byczkowski, J.Z., Claudio, L., Fisher, J.E. Jr., Fisher, J.W., Harry, G.J., Li, A.A., Makris, S.L., Padilla, S., Sultatos, L.G., Mileson, B.E. (2001). Methods to identify and characterize developmental neurotoxicity for human health risk assessment: III. Pharmacokinetic and pharmacodynamic considerations. Environ. Health Perspect., 109:101-111.
(6) Garman, R.H., Fix,A.S., Jortner, B.S., Jensen, K.F., Hardisty, J.F., Claudio, L., Ferenc, S. (2001). Methods to identify and characterize developmental neurotoxicity for human health risk assessment: II. Neuropathology. Environ. Health Perspect., 109:93-100.
(7) OECD (2003). Report of the OECD Expert Consultation Meeting on Developmental Neurotoxicity Testing. Washington D.C., US, 23.-25. Oktober 2000.
(8) OECD (2008). OECD Environment, Health and Safety Publications Series on Testing and Assessment No. 43. Guidance Document on Mammalian Reproductive Toxicity Testing and Assessment. Environment Directorate, OECD, Paris. July 2008. Abrufbar unter [http://search.oecd.org/officialdocuments/displaydocumentpdf/?cote=env/jm/ mono(2008)16&doclanguage=en].
(9) OECD (2003). OECD Environment, Health and Safety Publications Series on Testing and Assessment No. 20. Guidance Document for Neurotoxicity Testing. Environment Directorate, OECD, Paris, September 2003. Abrufbar unter [http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html].
(10) Kimmel, C.A., Rees, D.C., Francis, E.Z. (1990) Qualitative and quantitative comparability of human and animal developmental neurotoxicity. Neurotoxicol. Teratol., 12: 173-292.
(11) Spencer, P.S., Schaumburg, H.H., Ludolph, A.C. (2000) Experimental and Clinical Neurotoxicology, 2nd Edition, ISBN 0195084772, Oxford University Press, New York.
(12) Mendola, P., Selevan, S.G., Gutter, S., Rice, D. (2002) Environmental factors associated with a spectrum of neurodevelopmental deficits. Ment. Retard. Dev. Disabil. Res. Rev. 8:188-197.
(13) Slikker, W.B., Chang, L.W. (1998) Handbook of Developmental Neurotoxicology, 1st Edition, ISBN 0126488606, Academic Press, New York.
(14) Kapitel B.34 dieses Anhangs, Prüfung auf Reproduktionstoxizität während einer Generation.
(15) Kapitel B.35 dieses Anhangs, Zweigenerationenstudie zur Prüfung auf Reproduktionstoxizität.
(16) Kapitel B.43 dieses Anhangs, Prüfung auf Neurotoxizität bei Nagetieren.
(17) Kapitel B.31 diese Anhangs, Studie zur Prüfung auf pränatale Entwicklungstoxizität.
(18) Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (ABl. Nr. L 276 vom 20.10.2010 S. 33).
(19) WHO (1986) Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals, (Environmental Health Criteria 60), Albany, New York: World Health Organization Publications center, USA. Abrufbar unter [http://www.inchem.org/documents/ehc/ehc/ehc060.htm].
(20) WHO (2001) Neurotoxicity Risk Assessment for Human Health: Principles and Approaches, (Environmental Health Criteria 223), World Health Organization Publications, Geneva. Abrufbar unter [http://www.intox.org/databank/ documents/supplem/supp/ehc223.htm].
(21) Chang, L.W., Slikker, W. (1995) Neurotoxicology: Approaches and Methods, 1st Edition, ISBN 012168055X, Academic Press, New York.
(22) De Cabo, C., Viveros, M.P. (1997) Effects of neonatal naltrexone on neurological and somatic development in rats of both genders. Neurotoxicol. Teratol., 19:499-509.
(23) Agnish, N.D., Keller, K.A. (1997) The rationale for culling of rodent litters. Fundam. Appl. Toxicol., 38:2-6.
(24) Avery, D.L., Spyker, J.M. (1977) Foot tattoo of neonatal mice. Lab. Animal Sci., 27:110-112.
(25) Wier, P.J., Guerriero, F.J., Walker, R.F. (1989) Implementation of a primary screen for developmental neurotoxicity. Fundam. Appl. Toxicol., 13:118-136.
(26) Spear, N.E., Campbell, B.A. (1979) Ontogeny of Learning and Memory. ISBN 0470268492, Erlbaum Associates, New Jersey.
(27) Krasnegor, N.A., Blass, E.M., Hofer, M.A., Smotherman, W. (1987) Perinatal Development: A Psychobiological Perspective. Academic Press, Orlando.
(28) Zoetis, T., Walls, I. (2003) Principles and Practices for Direct Dosing of Pre-Weaning Mammals in Toxicity Testing and Research. ILSI Press, Washington, DC.
(29) Moser, V., Walls, I., Zoetis, T. (2005) Direct dosing of preweaning rodents in toxicity testing and research: Deliberations of an ILSI RSI expert working group. Int. J. Toxicol., 24:87-94.
(30) Conolly, R.B., Beck, B.D., Goodman, J.I. (1999) Stimulating research to improve the scientific basis of risk assessment. Toxicol. Sci., 49:1-4.
(31) ICH (1993) ICH Harmonised Tripartite Guideline: Detection of Toxicity to Reproduction for Medical Products (S5A). International Conference on Harmonisation of Technical Requirements for Registration of Phamaceuticals for Human Use.
(32) Lochry, E.A. (1987) Concurrent use of behavioral/functional testing in existing reproductive and developmental toxicity screens: Practical considerations. J. Am. Coll. Toxicol., 6:433-439.
(33) Tachibana, T., Narita, H., Ogawa, T., Tanimura, T. (1998) Using postnatal age to determine test dates leads to misinterpretation when treatments alter gestation length, results from a collaborative behavioral teratology study in Japan. Neurotoxicol. Teratol., 20:449-457.
(34) Gallavan, R.H. Jr., Holson, J.F., Stump, D.G., Knapp, J.F., Reynolds, V.L. (1999) Interpreting the toxicologic significance of alterations in anogenital distance: potential for confounding effects of progeny body weights. Reprod. Toxicol., 13:383-390.
(35) Gray, L.E. Jr., Ostby, J., Furr, J., Price, M., Veeramachaneni, D.N., Parks, L. (2000) Perinatal exposure to the phthalates DEHP, BBP, and DINP, but not DEP, DMP, or DOTP, alters sexual differentiation of the male rat. Toxicol. Sci., 58:350-365.
(36) Adams, J., Buelke-Sam, J., Kimmel, C.A., Nelson, C.J., Reiter, L.W., Sobotka, T.J., Tilson, H.A., Nelson, B.K. (1985) Collaborative behavioral teratology study: Protocol design and testing procedure. Neurobehav. Toxicol. Teratol., 7:579-586.
(37) Korenbrot, C.C., Huhtaniemi, I.T., Weiner, R.W. (1977) Preputial separation as an external sign of pubertal development in the male rat. Biol. Reprod., 17:298-303.
(38) Spear, L.P. (1990) Neurobehavioral assessment during the early postnatal period. Neurotoxicol. Teratol., 12:489-95.
(39) Altman, J., Sudarshan, K. (1975) Postnatal development of locomotion in the laboratory rat. Anim. Behav., 23:896-920.
(40) Adams, J. (1986) Methods in Behavioral Teratology. In: Handbook of Behavioral Teratology. Riley, E.P., Vorhees, C.V. (eds.) Plenum Press, New York, S. 67-100.
(41) Reiter, L.W., MacPhail, R.C. (1979) Motor activity: A survey of methods with potential use in toxicity testing. Neurobehav. Toxicol., 1:53-66.
(42) Robbins, T.W. (1977) A critique of the methods available for the measurement of spontaneous motor activity, Handbook of Psychopharmacology, Vol. 7, Iverson, L.L., Iverson, D.S., Snyder, S.H., (eds.) Plenum Press, New York, S. 37-82.
(43) Crofton, K.M., Peele, D.B., Stanton, M.E. (1993) Developmental neurotoxicity following neonatal exposure to 3,32-iminodipropionitrile in the rat. Neurotoxicol. Teratol., 15:117-129.
(44) Ruppert, P.H., Dean, K.F., Reiter, L.W. (1985) Development of locomotor activity of rat pups in figureeight mazes. Dev. Psychobiol., 18:247-260.
(45) Crofton, K.M., Howard, J.L., Moser, V.C., Gill, M.W., Reiter, L.W., Tilson, H.A., MacPhail, R.C. (1991) Interlaboratory comparison of motor activity experiments: Implications for neurotoxicological assessments. Neurotoxicol. Teratol., 13:599-609.
(46) Ross, J. F., Handley, D. E., Fix, A. S., Lawhorn, G. T., Carr, G. J. (1997) Quantification of the hindlimb extensor thrust response in rats. Neurotoxicol. Teratol., 19:1997. 405-411.
(47) Handley, D.E., Ross, J.F., Carr, G.J. (1998) A force plate system for measuring lowmagnitude reaction forces in small laboratory animals.Physiol. Behav., 64:661-669.
(48) Edwards, P.M., Parker, V.H. (1977) A simple, sensitive, and objective method for early assessment of acrylamide neuropathy in rats. Toxicol. Appl. Pharmacol., 40:589-591.
(49) Davis, M. (1984) The mammalian startle response. In: Neural Mechanisms of Startle Behavior, Eaton, R.C. (ed.), Plenum Press, New York, S. 287-351
(50) Koch, M. (1999) The neurobiology of startle. Prog. Neurobiol., 59:107-128.
(51) Crofton, K.M. (1992) Reflex modification and the assessment of sensory dysfunction. In Target Organ Toxicology Series: Neurotoxicology, Tilson, H., Mitchell, C. (eds.). Raven Press, New York, S. 181-211.
(52) Crofton, K.M., Sheets, L.P. (1989) Evaluation of sensory system function using reflex modification of the startle response. J. Am. Coll. Toxicol., 8:199-211.
(53) Crofton, K.M, Lassiter, T.L, Rebert, C.S. (1994) Solventinduced ototoxicity in rats: An atypical selective midfrequency hearing deficit. Hear. Res.,80:25-30.
(54) Ison, J.R. (1984) Reflex modification as an objective test for sensory processing following toxicant exposure. Neurobehav. Toxicol. Teratol., 6:437-445.
(55) Mattsson, J.L., Boyes, W.K., Ross, J.F. (1992) Incorporating evoked potentials into neurotoxicity test schemes. In: Target Organ Toxicology Series: Neurotoxicity, Tilson, H., Mitchell, C., (eds.), Raven Press, New York, S. 125-145.
(56) Peele, D.B., Allison, S.D., Crofton, K.M. (1990) Learning and memory deficits in rats following exposure to 3,32-iminopropionitrile. Toxicol. Appl. Pharmacol., 105:321-332.
(57) Bammer, G. (1982) Pharmacological investigations of neurotransmitter involvement in passive avoidance responding: A review and some new results. Neurosci. Behav. Rev., 6:247-296.
(58) Bushnell, P.J. (1988) Effects of delay, intertrial interval, delay behavior and trimethyltin on spatial delayed response in rats. Neurotoxicol. Teratol., 10:237-244.
(59) Green, R.J., Stanton, M.E. (1989) Differential ontogeny of working memory and reference memory in the rat. Behav. Neurosci., 103:98-105.
(60) Kucharski, D., Spear, N.E. (1984) Conditioning of aversion to an odor paired with peripheral shock in the developing rat. Develop. Psychobiol., 17:465-479.
(61) Morris, R. (1984) Developments of a watermaze procedure for studying spatial learning in the rat. J. Neurosci. Methods, 11:47-60.
(62) Brandeis, R., Brandys, Y., Yehuda, S. (1989) The use of the Morris water maze in the study of memory and learning. Int. J. Neurosci., 48:29-69.
(63) D'Hooge, R., De Deyn, P.P. (2001) Applications of the Morris water maze in the study of learning and memory. Brain Res. Rev, 36:60-90.
(64) Vorhees, C.V. (1987) Maze learning in rats: A comparison of performance in two water mazes in progeny prenatally exposed to different doses of phenytoin. Neurotoxicol. Teratol., 9:235-241.
(65) Vorhees, C.V. (1997) Methods for detecting longterm CNS dysfunction after prenatal exposure to neurotoxins. Drug Chem. Toxicol., 20:387-399.
(66) Akaike, M., Tanaka, K., Goto, M., Sakaguchi, T. (1988) Impaired Biel and Radial arm maze learning in rats with methylnitrosurea induced microcephaly. Neurotoxicol. Teratol., 10:327-332.
(67) Cory-Slechta, D.A., Weiss, B., Cox, C. (1983) Delayed behavioral toxicity of lead with increasing exposure concentration. Toxicol. Appl. Pharmacol., 71:342-352.
(68) Campbell, B.A., Haroutunian, V. (1981) Effects of age on longterm memory: Retention of fixed interval responding. J. Gerontol., 36:338-341.
(69) Fix, A.S, Garman, R.H. (2000) Practical aspects of neuropathology: A technical guide for working with the nervous system. Toxicol. Pathol., 28:122-131.
(70) Prophet, E.B., Mills, B., Arrington, J.B., Sobin, L.H. (1994) Laboratory Methods in Histotechnology, American Registry of Pathology, Washington, DC, S. 84-107.
(71) Bancroft, J.D., Gamble, M. (2002) Theory and Practice of Histological Techniques, 5th edition, Churchill Livingstone, London.
(72) Fix, A.S., Ross, J.F., Stitzel, S.R., Switzer, R.C. (1996) Integrated evaluation of central nervous system lesions: stains for neurons, astrocytes, and microglia reveal the spatial and temporal features of MK-801-induced neuronal necrosis in the rat cerebral cortex. Toxicol. Pathol., 24: 291-304.
(73) Schmued, L.C., Hopkins, K.J. (2000) Fluoro-Jade B: A high affinity tracer for the localization of neuronal degeneration. Brain Res., 874:123-130.
(74) Krinke, G.J., Classen, W., Vidotto, N., Suter, E., Wurmlin, C.H. (2001) Detecting necrotic neurons with fluorojade stain. Exp. Toxic. Pathol., 53:365-372.
(75) De Olmos, I.S., Beltramino, C.A., and de Olmos de Lorenzo, S. (1994) Use of an aminocupricsilver technique for the detection of early and semiacute neuronal degeneration caused by neurotoxicants, hypoxia and physical trauma. Neurotoxicol. Teratol., 16, 545-561.
(76) De Groot, D.M.G., Bos-Kuijpers, M.H.M., Kaufmann, W.S.H., Lammers, J.H.C.M., O'Callaghan, J.P., Pakkenberg, B., Pelgrim, M.T.M., Waalkens-Berendsen, I.D.H., Waanders, M.M., Gundersen, H.J. (2005a) Regulatory developmental neurotoxicity testing: A model study focusing on conventional neuropathology endpoints and other perspectives. Environ. Toxicol. Pharmacol., 19:745-755.
(77) De Groot, D.M.G., Hartgring, S., van de Horst, L., Moerkens, M., Otto, M., Bos-Kuijpers, M.H.M., Kaufmann, W.S.H., Lammers, J.H.C.M., O'Callaghan, J.P., Waalkens-Berendsen, I.D.H., Pakkenberg, B., Gundersen, H.J. (2005b) 2D and 3D assessment of neuropathology in rat brain after prenatal exposure to methylazoxymethanol, a model for developmental neurotoxicity. Reprod. Toxicol., 20:417-432.
(78) Rodier, P.M., Gramann, W.J. (1979) Morphologic effects of interference with cell proliferation in the early fetal period. Neurobehav. Toxicol., 1:129-135.
(79) Howard, C.V., Reed, M.G. (1998) Unbiased Stereology: Three-Dimensional Measurement in Microscopy, Springer-Verlag, New York.
(80) Hyman, B.T., Gomez-Isla, T., Irizarry, M.C. (1998) Stereology: A practical primer for neuropathology. J. Neuropathol. Exp. Neurol., 57:305-310.
(81) Korbo, L., Andersen, B.B., Ladefoged, O., Møller, A. (1993) Total numbers of various cell types in rat cerebellar cortex estimated using an unbiased stereological method. Brain Res., 609:262-268.
(82) Schmitz, C. (1997) Towards more readily comprehensible procedures in disector stereology. J. Neurocytol., 26:707-710.
(83) West, M.J. (1999) Stereological methods for estimating the total number of neurons and synapses: Issues of precision and bias. Trends Neurosci., 22:51-61.
(84) Schmitz, C., Hof, P.R. (2005) Designbased stereology in neuroscience. Neuroscience, 130:813-831.
(85) Gavin, C.E., Kates, B., Gerken, L.A., Rodier, P.M. (1994) Patterns of growth deficiency in rats exposed in utero to undernutrition, ethanol, or the neuroteratogen methylazoxymethanol (MAM). Teratology, 49:113-121.
(86) Ohno, M., Aotani, H., Shimada, M. (1995) Glial responses to hypoxic/ischemic encephalopathy in neonatal rat cerebrum. Develop. Brain Res., 84:294-298.
(87) Jensen KF, Catalano SM. (1998) Brain morphogenesis and developmental neurotoxicology. In: Handbook of Developmental Neurotoxicology, Slikker, Jr. W., Chang, L.W. (eds.) Academic Press, New York, S. 3-41.
(88) Ikonomidou, C., Bosch, F., Miksa, M., Bittigau, P., Vöckler, J., Dikranian, K., Tenkova, T.I., Stefovska, V., Turski, L., Olney, J.W. (1999) Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain. Science, 283:70-74.
(89) Ikonomidou, C., Bittigau, P., Ishimaru, M.J., Wozniak, D.F., Koch, C., Genz, K., Price, M.T., Sefovska, V., Hörster, F., Tenkova, T., Dikranian, K., Olney, J.W. (2000) Ethanolinduced apoptotic degeneration and fetal alcohol syndrome. Science, 287:1056-1060.
(90) Friede, R. L. (1989) Developmental Neuropathology. Second edition. Springer-Verlag, Berlin.
(91) House, D.E., Berman, E., Seeley, J.C., Simmons, J.E. (1992) Comparison of open and blind histopathologic evaluation of hepatic lesions. Toxicol. Let., 63:127-133.
(92) Tilson, H.A., MacPhail, R.C., Crofton, K.M. (1996) Setting exposure standards: a decision process. Environ. Health Perspect., 104:401-405.
(93) US EPA (2005) Guidelines for Carcinogen Risk Assessment. US EPA NCEA-F-0644A.
(94) US EPA (1996) Guidelines for Reproductive Toxicity Risk Assessment, Federal Register 61(212): 56274-56322.
(95) Danish Environmental Protection Agency (1995) Neurotoxicology. Review of Definitions, Methodology, and Criteria. Miljøprojekt nr. 282. Ladefoged, O., Lam, H.R., Østergaard, G., Nielsen, E., Arlien-Søborg, P.
(96) Muller, K.E., Barton, C.N., Benignus, V.A. (1984). Recommendations for appropriate statistical practice in toxicologic experiments. Neurotoxicology, 5:113-126.
(97) Gad, S.C. (1989) Principles of screening in toxicology with special emphasis on applications to Neurotoxicology. J. Am. Coll. Toxicol., 8:21-27.
(98) Abby, H., Howard, E. (1973) Statistical procedures in developmental studies on a species with multiple offspring. Dev. Psychobiol., 6:329-335.
(99) Haseman, J.K., Hogan, M.D. (1975) Selection of the experimental unit in teratology studies. Teratology, 12:165-172.
(100) Holson, R.R., Pearce, B. (1992) Principles and pitfalls in the analysis of prenatal treatment effects in multiparous species. Neurotoxicol. Teratol., 14:221-228.
(101) Nelson, C.J., Felton, R.P., Kimmel, C.A., Buelke-Sam, J., Adams, J. (1985) Collaborative Behavioral Teratology Study: Statistical approach. Neurobehav. Toxicol. Teratol., 7:587-90.
(102) Crofton, K.M., Makris, S.L., Sette, W.F., Mendez, E., Raffaele, K.C. (2004) A qualitative retrospective analysis of positive control data in developmental neurotoxicity studies. Neurotoxicol. Teratol., 26:345-352.
(103) Bolon, B., Garman, R., Jensen, K., Krinke, G., Stuart, B., and an ad hoc working group of the STP Scientific and Regulatory Policy Committee. (2006) A,best practices" approach to neuropathological assessment in developmental neurotoxicity testing - for today. Toxicol. Pathol. 34:296-313.
(104) Tamura, R.N., Buelke-Sam, J. (1992) The use of repeated measures analysis in developmental toxicology studies. Neurotoxicol. Teratol., 14(3):205-210.
(105) Tukey, J.W., Ciminera, J.L., Heyse, J.F. (1985) Testing the statistical certainty of a response to increasing doses of a drug. Biometrics, 41:295-301.
(106) Crofton, K.M., Foss, J.A., Haas, U., Jensen, K., Levin, E.D., and Parker, S.P. (2008) Undertaking positive control studies as part of developmental neurotoxicity testing: report from the ILSI Research Foundation/Risk Science Institute expert working group on neurodevelopmental endpoints. Neurotoxicology and Teratology, 30(4):266-287.
(107) Raffaele, K.C., Fisher, E., Hancock, S., Hazelden, K., and Sobrian, S.K. (2008) Determining normal variability in a developmental neurotoxicity test: report from the ILSI Research Foundation/Risk Science Institute expert working group on neurodevelopmental endpoints. Neurotoxicology and Teratology, 30(4):288-325.
(108) Holson, R.R., Freshwater, L., Maurissen, J.P.J., Moser, V.C., and Phang, W. (2008) Statistical issues and techniques appropriate for developmental neurotoxicity testing: a report from the ILSI Research Foundation/Risk Science Institute expert working group on neurodevelopmental endpoints. Neurotoxicology and Teratology, 30(4):326-348.
(109) Tyl, R.W., Crofton, K.M., Moretto, A., Moser, V.C., Sheets, L.P., and Sobotka, T.J. (2008) Identification and interpretation of developmental neurotoxicity effects: a report from the ILSI Research Foundation/Risk Science Institute expert working group on neurodevelopmental endpoints Neurotoxicology and Teratology, 30(4):349-381.
Allgemeines Prüfschema für funktionale Prüfungen/Verhaltensprüfungen, neuropathologische Beurteilung und Hirngewichte. Dieses Diagramm basiert auf der Beschreibung unter den Nummern 13, 14 und 15 (PND = postnataler Tag). Beispiele für die Zuteilung der Versuchstiere sind Anlage 1 zu entnehmen.
| Anlage 1 |
1. Beispiele für mögliche Zuteilungen sind in nachstehender Tabelle beschrieben. Diese Beispiele sollen veranschaulichen, dass die Versuchstiere den verschiedenen Prüfparadigmen auf unterschiedliche Art und Weise zugeteilt werden können.
2. Bei einem Satz von 20 Jungtieren pro Geschlecht und Dosisstufe (ein Männchen und ein Weibchen pro Wurf) wird die Verhaltensontogenese vor dem Absetzen geprüft. Von diesen Tieren werden 10 Jungtiere pro Geschlecht und Dosisstufe (ein Männchen oder ein Weibchen pro Wurf) am PND 22 auf humane Weise getötet. Die Gehirne werden entfernt, gewogen und für die histopathologische Beurteilung aufbereitet. Zusätzlich werden die am unfixierten Hirn erhobenen Hirngewichtsdaten der verbleibenden 10 Männchen und 10 Weibchen pro Dosisstufe gesammelt.
3. Bei einem weiteren Satz von 20 Jungtieren pro Geschlecht und Dosisstufe (ein Männchen und ein Weibchen pro Wurf) werden funktionale und Verhaltenstests nach dem Absetzen durchgeführt (ausführliche klinische Beobachtungen und Prüfung der motorischen Aktivität, der akustischen Schreckreaktion und der kognitiven Funktionen am adoleszenten Tier), und das Alter der Geschlechtsreife wird bewertet. Von diesen Tieren werden 10 Jungtiere pro Geschlecht und Dosisstufe (ein Männchen oder ein Weibchen pro Wurf) bei Studienende betäubt und per Perfusion fixiert (etwa PND 70). Die Gehirne werden, nachdem sie zusätzlich in situ fixiert wurden, entfernt und für die neuropathologische Beurteilung aufbereitet.
4. Für die kognitiven Funktionsprüfungen an jungen adulten Tieren (z.B. PND 60-70) wird ein dritter Satz von 20 Jungtieren pro Geschlecht und Dosisstufe verwendet (ein Männchen und ein Weibchen pro Wurf). Von diesen Tieren werden 10 Jungtiere pro Geschlecht und Gruppe (ein Männchen oder ein Weibchen pro Wurf) bei Studienende getötet und die Gehirne entfernt und gewogen.
5. Die verbleibenden 20 Tiere pro Geschlecht und Gruppe werden für möglicherweise durchzuführende zusätzliche Prüfungen zurückbehalten.
| Jungtier Nr. a | Anzahl der Jungtiere für die Prüfung | Untersuchung/Prüfung | |
| M | W | ||
| 1 | 5 | 20 M + 20 W 10 M + 10 W 10 M + 10 W | Verhaltensontogenese PND 22: Hirngewicht/Neuropathologie/Morphometrie PND 22: Hirngewicht |
| 2 | 6 | 20 M + 20 W 20 M + 20 W 20 M + 20 W 20 M + 20 W 20 M + 20 W 10 M + 10 W | Ausführliche klinische Beobachtungen Motorische Aktivität Geschlechtsreife Motorische und sensorische Funktionen Lernen und Gedächtnis (PND 25) Hirngewicht des jungen adulten Tiers/Neuropathologie/Morphometrie ~ PND 70 |
| 3 | 7 | 20 M + 20 W 10 M + 10 W | Lernen und Gedächtnis (junge adulte Tiere) Hirngewicht des jungen adulten Tiers ~ PND 70 |
| 4 | 8 | - | Tiere, die als Ersatz oder für Zusatzprüfungen vorbehalten sind |
| a) Für dieses Beispiel werden die Würfe auf vier Männchen und vier Weibchen verkleinert; die männlichen Jungtiere werden von eins bis vier durchnummeriert, die weiblichen von fünf bis acht. | |||
6. Bei einem Satz von 20 Jungtieren pro Geschlecht und Dosisstufe (ein Männchen und ein Weibchen pro Wurf) wird die Verhaltensontogenese vor dem Absetzen geprüft. Von diesen Tieren werden 10 Jungtiere pro Geschlecht und Dosisstufe (ein Männchen oder ein Weibchen pro Wurf) am PND 11 auf humane Weise getötet. Die Gehirne werden entfernt, gewogen und für die histopathologische Beurteilung aufbereitet.
7. Bei einem weiteren Satz von 20 Jungtieren pro Geschlecht und Dosisstufe (ein Männchen und ein Weibchen pro Wurf) werden Untersuchungen nach dem Absetzen durchgeführt (ausführliche klinische Beobachtungen, Prüfung der motorischen Aktivität, Bewertung des Alters der Geschlechtsreife und Prüfung der motorischen und sensorischen Funktionen). Von diesen Tieren werden 10 Jungtiere pro Geschlecht und Dosisstufe (ein Männchen oder ein Weibchen pro Wurf) bei Studienende betäubt und per Perfusion fixiert (etwa PND 70). Die Gehirne werden, nachdem sie zusätzlich in situ fixiert wurden, entfernt, gewogen und für die neuropathologische Beurteilung aufbereitet.
8. Für kognitive Funktionsprüfungen an adoleszenten und jungen adulten Tieren werden 10 Jungtiere pro Geschlecht und Dosisstufe verwendet (ein Männchen oder ein Weibchen pro Wurf). Bei den kognitiven Funktionsprüfungen werden für die Prüfungen am PND 23 und an jungen adulten Tieren unterschiedliche Tiere verwendet. Nach Beendigung werden die für die Prüfungen am adulten Tier verwendeten 10 Tiere pro Geschlecht und Gruppe getötet. Ihre Gehirne werden entfernt und gewogen.
9. Die verbleibenden, nicht für die Prüfungen ausgewählten 20 Tiere pro Geschlecht und Gruppe werden beim Absetzen getötet und entsorgt.
| Jungtier Nr. a | Anzahl der Jungtiere für die Prüfung | Untersuchung/Prüfung | |
| M | W | ||
| 1 | 5 | 20 M + 20 W 10 M + 10 W | Verhaltensontogenese PND 11: Hirngewicht/Neuropathologie/Morphometrie |
| 2 | 6 | 20 M + 20 W 20 M + 20 W 20 M + 20 W 20 M + 20 W 10 M + 10 W | Ausführliche klinische Beobachtungen Motorische Aktivität Geschlechtsreife Motorische und sensorische Funktionen Hirngewicht des jungen adulten Tiers/Neuropathologie/Morphometrie ~ PND 70 |
| 3 | 7 | 10 M + 10 W b | Lernen und Gedächtnis (PND 23) |
| 3 | 7 | 10 M + 10 W b | Lernen und Gedächtnis (junge adulte Tiere) Hirngewicht des jungen adulten Tiers |
| 4 | 8 | - | Tiere werden am PND 21 getötet und entsorgt. |
| a) Für dieses Beispiel werden die Würfe auf vier Männchen und vier Weibchen verkleinert; die männlichen Jungtiere werden von eins bis vier durchnummeriert, die weiblichen von fünf bis acht.
b) Bei der Prüfung der kognitiven Fähigkeiten sind für die Tests am PND 23 und die Tests an jungen adulten Tieren unterschiedliche Tiere zu verwenden (z.B. gerade/ungerade Würfe von insgesamt 20 Jungtieren). | |||
10. Bei einem Satz von 20 Jungtieren pro Geschlecht und Dosisstufe (ein Männchen und ein Weibchen pro Wurf) wird am PND 11 das Gehirngewicht bestimmt und eine neuropathologische Bewertung durchgeführt. Von diesen Tieren werden 10 Jungtiere pro Geschlecht und Dosisstufe (ein Männchen oder ein Weibchen pro Wurf) am PND 11 auf humane Weise getötet, und die Gehirne werden entfernt, gewogen und für die histopathologische Beurteilung aufbereitet. Zusätzlich werden die am unfixierten Hirn erhobenen Hirngewichtsdaten der verbleibenden 10 Männchen und 10 Weibchen pro Dosisstufe gesammelt.
11. Bei einem weiteren Satz von 20 Jungtieren pro Geschlecht und Dosisstufe (ein Männchen und ein Weibchen pro Wurf) wird die Verhaltensontogenese (motorische Aktivität) beurteilt, es werden Untersuchungen nach dem Absetzen durchgeführt (motorische Aktivität und Bewertung des Alters der Geschlechtsreife), und an den adoleszenten Tieren werden kognitive Funktionsprüfungen durchgeführt.
12. Bei einem weiteren Satz von 20 Tieren pro Geschlecht und Dosisstufe (ein Männchen und ein Weibchen pro Wurf) werden die motorischen und sensorischen Funktionen (akustische Schreckreaktion) geprüft und ausführliche klinische Beobachtungen vorgenommen. Von diesen Tieren werden 10 Jungtiere pro Geschlecht und Dosisstufe (ein Männchen oder ein Weibchen pro Wurf) bei Studienende betäubt und per Perfusion fixiert (etwa PND 70). Die Gehirne werden, nachdem sie zusätzlich in situ fixiert wurden, entfernt, gewogen und für die neuropathologische Beurteilung aufbereitet.
13. Bei einem weiteren Satz von 20 Jungtieren pro Geschlecht und Dosisstufe (ein Männchen und ein Weibchen pro Wurf) werden kognitive Funktionsprüfungen an den jungen adulten Tieren durchgeführt. Von diesen Tieren werden 10 Jungtiere pro Geschlecht und Gruppe (ein Männchen oder ein Weibchen pro Wurf) bei Studienende getötet und die Gehirne entfernt und gewogen.
| Jungtier Nr. a | Anzahl der Jungtiere für die Prüfung | Untersuchung/Prüfung | |
| M | W | ||
| 1 | 5 | 10 M + 10 W 10 M + 10 W | PND 11: Hirngewicht/Neuropathologie/Morphometrie PND 11: Hirngewicht |
| 2 | 6 | 20 M + 20 W 20 M + 20 W 20 M + 20 W 20 M + 20 W | Verhaltensontogenese (motorische Aktivität) Motorische Aktivität Geschlechtsreife Lernen und Gedächtnis (PND 27) |
| 3 | 7 | 20 M + 20 W 20 M + 20 W 10 M + 10 W | Akustische Schreckreaktion (adoleszente und junge adulte Tiere) Ausführliche klinische Beobachtungen Hirngewicht des jungen adulten Tiers/Neuropathologie/ Morphometrie ~ PND 70 |
| 4 | 8 | 20 M + 20 W 10 M + 10 W | Lernen und Gedächtnis (junge adulte Tiere) Hirngewicht des jungen adulten Tiers |
| a) Für dieses Beispiel werden die Würfe auf vier Männchen und vier Weibchen verkleinert; die männlichen Jungtiere werden von eins bis vier durchnummeriert, die weiblichen von fünf bis acht. | |||
| Anlage 2 |
Chemikalie: ein Stoff oder eine Mischung.
Prüfsubstanz: jede(r) mittels dieser Prüfmethode getestete Stoff bzw. Mischung
B.54. Uterotropher Bioassay mit Nagern: Ein Kurzzeit-Screening-Test auf östrogene Eigenschaften 14
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 440 (2007). Die OECD setzte sich 1998 zur Priorität, bestehende Prüfrichtlinien für Screening und Testung potenzieller endokriner Disruptoren zu überarbeiten und neue Richtlinien zu entwickeln (1). Ein Aspekt dieser Maßnahme war die Ausarbeitung einer Prüfrichtlinie für die Invivo-Uterusgewichtsprüfung (Uterotrophic Bioassay) mit Nagern. Der uterotrophe Bioassay mit Nagern wurde nachfolgend einem umfassenden Validierungsprogramm unterzogen, in dessen Rahmen unter anderem ein ausführliches Hintergrunddokument erstellt (2)(3) und umfassende Intra- und Interlaborstudien durchgeführt wurden, um die Relevanz und Reproduzierbarkeit der Invivo-Prüfung anhand eines wirksamen Referenzöstrogens, schwacher Östrogen-Rezeptoragonisten, eines starken Östrogen-Rezeptorantagonisten und einer negativen Referenzchemikalie (4)(5)(6)(7)(8)(9) nachzuweisen. Die vorliegende Prüfmethode B.54 ist das Resultat der bei der Validierung des Prüfprogramms gewonnenen Erfahrungen und Ergebnisse im Bereich Östrogenagonisten.
2. Der uterotrophe Bioassay ist ein Kurzzeit-Screening-Test, der auf die 1930er-Jahre zurückgeht (27)(28) und durch einen Fachausschuss erstmals 1962 für Screeningzwecke standardisiert wurde (32)(35). Der Test basiert auf einer Zunahme des Uterusgewichts, die auch als uterotrophe Reaktion bezeichnet wird (vgl. Literaturhinweis 29). Dabei wird untersucht, ob eine Chemikalie biologische Abläufe auslöst, die der Wirkung von Agonisten oder Antagonisten natürlicher Östrogene (z.B. 17β-Östradiol) entsprechen; die Methode wird allerdings wesentlich häufiger für den Nachweis von Agonisten als für den Nachweis von Antagonisten eingesetzt. Der Uterus reagiert auf zweierlei Art auf Östrogen: Zunächst erhöht sich das Gewicht aufgrund von Wassereinlagerung. Darauf folgt eine Gewichtszunahme aufgrund von Gewebewachstum (30). Die Uterusreaktionen sind bei Ratten und Mäusen qualitativ vergleichbar.
3. Dieser Bioassay wird als Invivo-Screening-Test durchgeführt und sollte im Zusammenhang mit dem Rahmenkonzept der OECD, Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals" (Testung und Bewertung endokrin wirksamer Stoffe) (Anlage 2) angewendet werden. In diesem Rahmenkonzept ist der uterotrophe Bioassay ein Invivo-Test der Stufe 3, mit dem Daten über einen einzelnen endokrinen Mechanismus, nämlich die östrogene Wirkung, gewonnen werden sollen.
4. Der uterotrophe Bioassay ist als Teil einer Reihe von Invitro- und Invivo-Tests zur Bestimmung von Chemikalien, die mit dem endokrinen System in Wechselwirkung treten können, konzipiert und soll letztendlich der Bewertung des Risikos für die Umwelt und die menschliche Gesundheit dienen. Im Rahmen des Validierungsprogramms der OECD wurde sowohl anhand von starken als auch von schwachen Östrogenagonisten untersucht, wie gut sich die Prüfung zur Erkennung von Chemikalien mit östrogener Wirkung eignet (4)(5)(6)(7)(8). Dabei konnte die Empfindlichkeit des Prüfverfahrens bezüglich Östrogenagonisten ebenso fundiert nachgewiesen werden wie eine gute Intra- und Interlabor-Reproduzierbarkeit.
5. Was negative Verbindungen anbelangt, wurde nur eine,negative" Referenzchemikalie (deren Wirkungslosigkeit bereits im Rahmen von Uterusgewichtsprüfungen sowie bei in vitro durchgeführten Rezeptorbindungs- und Rezeptorprüfungen belegt worden war) in das Validierungsprogramm aufgenommen, aber es wurden zusätzliche, vom Validierungsprogramm der OECD unabhängige Prüfdaten ausgewertet, die die Spezifizität des uterotrophen Bioassays beim Screening von Östrogenagonisten weiter untermauern (16).
Ausgangsüberlegungen und Begrenzungen
6. Östrogenagonisten und -antagonisten können an die Östrogenrezeptoren a und b binden und die transkriptionelle Aktivität der Rezeptoren aktivieren bzw. hemmen. Dies ist potenziell mit gesundheitlichen Risiken verbunden und schließt auch negative Auswirkungen auf Reproduktion und Entwicklung mit ein. Aus diesem Grund müssen Chemikalien möglichst schnell daraufhin geprüft und beurteilt werden können, ob es sich um potenzielle Östrogenagonisten oder -antagonisten handelt. Die in vitro bestimmte Affinität eines Liganden für einen Östrogenrezeptor oder die transkriptionelle Aktivierung von Reportergenen liefert zwar wertvolle Informationen, ist aber nur eine von mehreren Determinanten für das Gefahrenpotenzial. Andere Determinanten können die metabolische Aktivierung und Deaktivierung beim Eintritt in den Körper, die Verteilung auf die Zielgewebe und die Ausscheidung aus dem Körper sein, was zumindest teilweise vom Verabreichungsweg und von der geprüften Chemikalie abhängig ist. Daraus ergibt sich die Notwendigkeit, die potenzielle Wirkung einer Chemikalie in vivo unter einschlägigen Bedingungen zu prüfen, sofern die Eigenschaften der Chemikalie hinsichtlich Resorption, Verteilung, Metabolismus und Ausscheidung (ADME) nicht bereits entsprechende Informationen liefern. Die Uterusgewebe reagieren mit starkem und raschem Wachstum auf die Stimulation mit Östrogenen, was insbesondere für Labornager gilt, deren Östruszyklus etwa vier Tage dauert. Die Verwendung von Nagerarten, insbesondere Ratten, ist zudem bei Toxizitätsstudien zur Beurteilung des Gefahrenpotenzials weit verbreitet. Aus diesem Grund ist der Nageruterus das geeignete Zielorgan für das Invivo-Screening von Östrogenagonisten und -antagonisten.
7. Der vorliegenden Prüfmethode liegen die Prüfpläne der OECD-Validierungsstudie zugrunde, die sich in Intra- und Interlaborstudien als zuverlässig und wiederholbar erwiesen haben (5)(7). Derzeit sind zwei Methoden verfügbar, und zwar die Methode am adulten ovarektomierten Weibchen (Methode mit adulten OVX-Tieren) und die Methode am unreifen, nicht ovarektomierten Weibchen (Methode mit unreifen Tieren). Das Validierungsprogramm der OECD hat ergeben, dass die Empfindlichkeit und Reproduzierbarkeit beider Methoden vergleichbar ist. Die Methode mit unreifen Ratten, deren Hypothalamus-Hypophysen-Gonaden-Achse (HPG-Achse) intakt ist, ist in gewissen Punkten weniger spezifisch, deckt dafür aber eine größere Bandbreite an Untersuchungsmöglichkeiten ab als die am ovarektomierten Tier, weil sie für Chemikalien empfindlich ist, die auch mit der HPG-Achse interagieren und nicht nur mit dem Östrogenrezeptor. Die HGP-Achse ist etwa ab dem 15. Lebenstag funktionsfähig. Vorher kann die Pubertät nicht - zum Beispiel durch Behandlung mit GnRH - beschleunigt werden. Beim Eintritt in die Pubertät haben die Weibchen vor der Vaginalöffnung mehrere stumme Zyklen, die nicht zu einer Vaginalöffnung oder Ovulation führen, bei denen es jedoch zu einigen hormonellen Schwankungen kommt. Wenn die HPG-Achse direkt oder indirekt durch eine Chemikalie stimuliert wird, hat das eine frühzeitige Pubertät und Ovulation sowie eine beschleunigte Vaginalöffnung zur Folge. Dies wird nicht nur durch Chemikalien hervorgerufen, die auf die HPG-Achse wirken; auch bestimmte Nahrung mit einem höheren Niveau metabolisierbarer Energie stimuliert das Wachstum und beschleunigt die Vaginalöffnung, ohne dass eine östrogene Wirkung vorliegt. Solche Chemikalien würden bei adulten OVX-Tieren keine uterotrophe Reaktion hervorrufen, weil deren HPG-Achse nicht funktionsfähig ist.
8. Aus Tierschutzgründen sollte der Methode, bei der unreife Ratten verwendet werden, der Vorzug eingeräumt werden, weil dadurch eine chirurgische Vorbehandlung der Tiere entfällt und eine mögliche Nichtverwendung derjenigen Tiere vermieden wird, die Anzeichen für einen beginnenden Östruszyklus aufweisen (siehe Nummer 30).
9. Eine Zunahme des Uterusgewichts ist nicht ausschließlich östrogenen Ursprungs, d. h. auch Chemikalien, die keine Östrogenagonisten oder -antagonisten sind, können eine uterotrophe Reaktion hervorrufen. Beispielsweise können auch relativ hohe Dosen von Progesteron, Testosteron oder verschiedenen synthetischen Progestinen ebenfalls stimulierend wirken (30). Jede Reaktion kann histologisch auf Keratinisation und Kornifikation der Vagina analysiert werden (30). Ein positives Ergebnis eines uterotrophen Bioassays sollte unabhängig vom möglichen Ursprung der Reaktion weitere Abklärungsmaßnahmen nach sich ziehen. Weitere Nachweise für die östrogene Wirkung könnten durch Invitro-Prüfungen, wie zum Beispiel ER-Bindungstests und Tests auf transkriptionelle Aktivierung oder andere Invivo-Prüfungen, wie zum Beispiel die Prüfung an pubertären Weibchen, gewonnen werden.
10. Unter Berücksichtigung der Tatsache, dass der uterotrophe Bioassay ein Invivo-Screening-Test ist, wurde der gewählte Validierungsansatz sowohl Tierschutzbelangen als auch einer mehrstufigen Prüfstrategie gerecht. Zu diesem Zweck lag der Schwerpunkt darauf, die beiden Hauptaspekte zu validieren, auf die es bei zahlreichen Chemikalien ankommt, nämlich die Reproduzierbarkeit und die Empfindlichkeit für die östrogene Wirkung, während der Antiöstrogenwirkungskomponente der Prüfung dagegen nur wenig Aufmerksamkeit gewidmet wurde. Es wurde nur ein Antiöstrogen mit starker Wirkung getestet, da die Anzahl an Chemikalien mit eindeutig antiöstrogenem Profil (bei denen die antiöstrogene Wirkung nicht durch eine teilweise vorhandene östrogene Wirkung verschleiert wird) ausgesprochen begrenzt ist. Der vorliegenden Prüfmethode liegt folglich der Prüfplan für den Nachweis der östrogenen Wirkung zugrunde, während der Prüfplan für die Prüfung auf Antagonisten in einem Guidance Document der OECD (37) enthalten ist. Die Reproduzierbarkeit und Empfindlichkeit der Prüfung von Chemikalien mit rein antiöstrogener Wirkung werden zu einem späteren Zeitpunkt klarer definiert, wenn das Prüfverfahren eine Zeit lang routinemäßig im Einsatz war und mehr Chemikalien mit dieser Wirkungsart ermittelt worden sind.
11. Es wird darauf hingewiesen, dass bei allen tierexperimentellen Verfahren die örtlichen Standards der Versuchstierpflege einzuhalten sind. Die nachfolgend ausgeführten Pflege- und Behandlungsbeschreibungen stellen Mindestanforderungen dar; Vorrang vor diesen Standards haben lokale Bestimmungen, zum Beispiel die Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (38). Eine weiterführende Anleitung für die tierschutzgerechte Behandlung von Versuchstieren ist in dem OECD Guidance Document (25) enthalten.
12. Wie bei allen Prüfungen, bei denen lebende Tiere verwendet werden, ist vor Testbeginn sicherzustellen, dass die Daten wirklich benötigt werden. Zum Beispiel werden die Daten möglicherweise zur weiteren Abklärung der folgenden beiden Szenarien gebraucht:
- wenn ein hohes Expositionspotenzial (Stufe 1 des Rahmenkonzepts, Anlage 2) oder Anzeichen für eine östrogene Wirkung (Stufe 2) vorliegen, um zu untersuchen, ob solche Wirkungen in vivo vorkommen können;
- wenn die Ergebnisse der Invivo-Tests der Stufen 4 und 5 auf eine östrogene Wirkung hindeuten, um zu untermauern, dass diese Ergebnisse mit einem Östrogenmechanismus zusammenhängen, der nicht mit einem In-vitro-Test erklärt werden kann.
13. Die für die Zwecke dieser Prüfmethode verwendeten Begriffe sind in Anlage 1 definiert.
14. Die Empfindlichkeit des uterotrophen Bioassays beruht auf einer Versuchsanordnung, bei der die Hypothalamus- Hypophysen-Eierstock-Achse nicht funktionsfähig ist, was zu einem niedrigen endogenen Östrogenspiegel führt. Dadurch werden ein niedriges Ausgangsgewicht des Uterus zu Anfang der Prüfung und das größtmögliche Spektrum an Reaktionen auf die verabreichten Östrogene sichergestellt. Diese Anforderung ist bei weiblichen Nagern in zwei Fällen erfüllt:
- bei unreifen Weibchen nach dem Absetzen und vor Einsetzen der Pubertät und
- bei jungen, adulten, ovarektomierten Weibchen mit ausreichend Zeit für die Rückbildung des Uterusgewebes.
15. Die Prüfsubstanz wird täglich oral per Schlundsonde oder durch subkutane Injektion verabreicht. Die abgestuften Dosen der Prüfsubstanz werden mindestens zwei Versuchsgruppen (vgl. Nummer 33 für weitere Informationen) verabreicht, wobei pro Gruppe eine Dosisstufe gegeben wird und der Verabreichungszeitraum bei der Methode mit unreifen Tieren drei aufeinanderfolgende Tage und bei der Methode mit unreifen OVX-Tieren mindestens drei aufeinanderfolgende Tage beträgt. Die Tiere werden etwa 24 Stunden nach der letzten Dosisgabe seziert. Bei Östrogenagonisten wird das mittlere Uterusgewicht der behandelten Versuchstiergruppen im Vergleich zur Vehikelgruppe auf eine statistisch signifikante Erhöhung hin bewertet. Eine statistisch signifikante Erhöhung des mittleren Uterusgewichts einer Prüfgruppe deutet auf eine positive Reaktion in diesem Bioassay hin.
Auswahl der Versuchstierarten
16. Es können die üblichen Labornagerstämme verwendet werden. Bei der Validierung wurden beispielsweise Stämme der Sprague-Dawley- und der Wistar-Ratte eingesetzt. Es sollten keine Stämme verwendet werden, von denen ein weniger gutes Ansprechen der Uteri bekannt ist oder vermutet wird. Das Labor sollte die Empfindlichkeit des verwendeten Stamms wie unter den Nummern 26 und 27 beschrieben nachweisen.
17. Ratten und Mäuse werden seit den 1930er-Jahren routinemäßig für den uterotrophen Bioassay verwendet. Die Validierungsprüfungen der OECD wurden nur anhand von Ratten durchgeführt, und zwar aufgrund der Überlegung, dass bei zwei aller Voraussicht nach gleichwertigen Spezies eine Art für eine weltweit gültige Validierung ausreichen sollte und so Ressourcen und Tiere eingespart werden können. Die Ratte ist bei den meisten Prüfungen auf Reproduktions- und Entwicklungstoxizität die Spezies der Wahl. Da es bereits eine umfangreiche Sammlung historischer Daten zu Mäusen gibt, wurde eine Followup-Validierungsstudie mit einer begrenzten Anzahl an Mäusen durchgeführt (16), um den Anwendungsbereich der Prüfmethode des uterotrophen Bioassays mit Nagern auf die Verwendung von Mäusen als Prüfspezies auszudehnen. Getreu der ursprünglichen Absicht, Ressourcen und Tiere einzusparen, wurde der Ansatz einer Überbrückungsstudie mit einer begrenzten Anzahl an Prüfsubstanzen und teilnehmenden Laboratorien und ohne codierte Probentestung gewählt. Diese Überbrückungsstudie ergab für den uterotrophen Bioassay mit jungen adulten, ovarektomierten Mäusen, dass die an Ratten und Mäusen gewonnenen Daten sich sowohl qualitativ als auch quantitativ gut decken. Wenn das Ergebnis des uterotrophen Bioassays gegebenenfalls als Vorstudie für eine Langzeitstudie verwendet wird, können somit Tiere desselben Stamms und derselben Herkunft für beide Studienarten verwendet werden. Der Überbrückungsansatz war auf OVX-Mäuse beschränkt, und der Bericht enthält keine robusten Daten, die eine Validierung des Modells mit unreifen Tieren erlauben würden. Daher fällt das Tiermodell mit unreifen Mäusen nicht in den Anwendungsbereich der aktuellen Prüfmethode.
18. Demnach können in bestimmten Fällen Mäuse anstelle von Ratten verwendet werden. Die Wahl dieser Versuchstierart ist auf der Grundlage toxikologischer, pharmakokinetischer und/oder anderer Kriterien zu begründen. Bei Mäusen muss gegebenenfalls der Prüfplan geändert werden. Zum Beispiel ist die Nahrungsaufnahme im Verhältnis zum Körpergewicht bei Mäusen höher als bei Ratten, und der Phytoöstrogengehalt der Nahrung sollte daher bei Mäusen niedriger sein als bei Ratten (9)(20)(22).
Haltungs- und Fütterungsbedingungen
19. Bei allen Verfahren sind die örtlichen Standards der Versuchstierpflege einzuhalten. Bei diesen Pflege- und Behandlungsbeschreibungen handelt es sich um Mindestanforderungen; Vorrang haben lokale Rechtsvorschriften, wie zum Beispiel die Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (38). Die Temperatur im Versuchstierraum sollte 22 °C (± 3 °C) betragen. Die relative Luftfeuchtigkeit sollte mindestens 30 % betragen und - außer beim Reinigen des Raums - 70 % nicht überschreiten. Angestrebt werden sollte eine Luftfeuchtigkeit von 50-60 %. Die Beleuchtung sollte künstlich sein. Die Hell- und Dunkelphasen sollten sich im Abstand von 12 Stunden abwechseln.
20. Labornahrung und Trinkwasser sind ad libitum bereitzustellen. Die jungen adulten Tiere können entweder einzeln oder in Gruppen von bis zu drei Tieren pro Käfig untergebracht werden. Da die unreifen Tiere noch sehr jung sind, ist die Unterbringung in der Gruppe aus sozialen Gründen empfehlenswert.
21. Ein hoher Gehalt an Phytoöstrogenen in der Labornahrung führt bei Nagern erwiesenermaßen zu einer Erhöhung des Uterusgewichts, die für eine Verfälschung der Ergebnisse des uterotrophen Bioassays ausreichend ist (13)(14)(15). Hohe Gehalte an Phytoöstrogenen und ein hohes Niveau metabolisierbarer Energie in der Labornahrung können ferner bei unreifen Tieren einen vorzeitigen Pubertätseintritt zur Folge haben. Phytoöstrogene in der Nahrung sind vorwiegend auf Soja- und Alfalfaprodukte als Zutaten im Laborfutter zurückzuführen, wobei die Phytoöstrogenkonzentrationen in der Standard-Labornahrung zwischen den einzelnen Chargen variieren (23). Das Körpergewicht ist eine wichtige Variable, da die aufgenommene Futtermenge in Relation zum Körpergewicht steht. Die tatsächlich aus demselben Futter aufgenommene Phytoöstrogendosis kann daher zwischen verschiedenen Tierarten und, innerhalb einer Art, je nach Alter abweichen (9). Bei unreifen Rattenweibchen kann die Futteraufnahme in Relation zum Körpergewicht ungefähr doppelt so hoch ausfallen wie bei ovarektomierten jungen adulten Weibchen. Bei jungen adulten Mäusen kann die Futteraufnahme in Relation zum Körpergewicht ungefähr viermal so hoch ausfallen wie bei ovarektomierten jungen adulten Rattenweibchen.
22. Die Ergebnisse anderer uterotropher Bioassays (9)(17)(18)(19) haben jedoch gezeigt, dass begrenzte Mengen an Phytoöstrogenen in der Nahrung akzeptabel sind und sich nicht negativ auf die Aussagekraft des Assays auswirken. Zur Orientierung: Der Phytoöstrogengehalt sollte 350 µg Genistein-Äquivalente pro Gramm Labornahrung bei unreifen Sprague Dawley- und Wistar-Rattenweibchen nicht überschreiten (6)(9). Diese Nahrung sollte auch dann geeignet sein, wenn junge adulte ovarektomierte Ratten getestet werden, weil die Nahrungsaufnahme in Relation zum Körpergewicht bei jungen adulten Ratten geringer ist als bei unreifen Tieren. Wenn adulte ovarektomierte Mäuse oder stärker auf Phytoöstrogene reagierende Ratten verwendet werden sollen, muss eine proportionale Reduzierung der Phytoöstrogengehalte in der Nahrung in Erwägung gezogen werden (20). Ferner können Unterschiede bei der verfügbaren verstoffwechselbaren Energie bei verschiedenen Arten von Labornahrung das Einsetzen der Pubertät beeinflussen (21)(22).
23. Vor Beginn des Versuchs ist bei der Auswahl der Labornahrung sorgfältig darauf zu achten, dass diese keinen erhöhten Gehalt an Phytoöstrogenen (siehe (6) und (9)) oder an metabolisierbarer Energie aufweist, denn beides kann zu einer Verzerrung der Ergebnisse führen (15)(17)(19)(22)(36). Die Gewährleistung der ordnungsgemäßen Durchführung des vom Labor verwendeten Prüfsystems gemäß den Nummern 26 und 27 stellt eine wichtige Kontrolle dieser beiden Faktoren dar. Sicherheitshalber sollten im Einklang mit der Guten Laborpraxis (GLP) repräsentative Stichproben von allen im Laufe der Prüfung verabreichten Nahrungschargen genommen werden, um bei Bedarf den Phytoöstrogengehalt zu analysieren (z.B. wenn im Vergleich zu historischen Kontrolldaten ein hohes Uterus-Kontrollgewicht vorliegt oder bei ungenügendem Ansprechen auf das Referenzöstrogen 17α-Ethinylestradiol). Die Aliquote sind im Rahmen der Prüfung zu analysieren oder so aufzubewahren, dass sich die Probe nicht vor der Analyse zersetzen kann (zum Beispiel durch Einfrieren bei - 20 °C).
24. Einige Arten von Einstreu können natürlicherweise Chemikalien mit östrogener oder antiöstrogener Wirkung enthalten (zum Beispiel beeinflusst Maiseinstreu bekanntermaßen den Zyklus von Ratten und hat vermutlich antiöstrogene Eigenschaften). Der Phytoöstrogengehalt der gewählten Einstreu sollte so gering wie möglich sein.
Vorbereitung der Tiere
25. Die Versuchstiere, die keine Krankheitszeichen oder physischen Abnormitäten aufweisen, werden randomisiert auf die Kontroll- und Behandlungsgruppen aufgeteilt. Die Käfige sollten so angeordnet werden, dass etwaige Einflüsse der Käfigplatzierung minimiert werden. Jedes Tier ist eindeutig zu kennzeichnen. Unreife Tiere sind bis zum Absetzen möglichst gemeinsam mit Muttertieren oder Ammen zu halten, bis sie sich akklimatisiert haben. Die Akklimatisierungszeit vor Versuchsbeginn sollte sowohl für junge adulte Tiere als auch für unreife, mit Muttertieren oder Ammen gelieferte Tiere etwa fünf Tage betragen. Wenn gerade abgesetzte, unreife Tiere ohne Muttertiere erworben werden, ist gegebenenfalls eine Verkürzung der Akklimatisierungszeit notwendig, da mit der Dosierung sofort nach dem Absetzen begonnen werden sollte (vgl. Nummer 29).
Eignungsprüfung des Prüflabors
26. Für die Eignungsprüfung des Prüflabors gibt es zwei Optionen:
- Regelmäßige Verifizierung durch Abgleich mit einer zu Anfang durchgeführten positiven Kontrollstudie/Baselinestudie (vgl. Nummer 27). Mindestens alle sechs Monate sowie immer dann, wenn eine Veränderung eingetreten ist, die die Prüfleistung beeinflussen könnte (z.B. neue Futterzubereitung, Änderung des Sektionspersonals, Änderung des Tierstamms, geänderter Lieferant usw.), ist die Empfindlichkeit des Prüfsystems (das Tiermodell) anhand einer (mit Hilfe der unter Nummer 27 beschriebenen positiven Kontrollstudie/Baselinestudie bestimmten) geeigneten Dosis des Referenzöstrogens 17a-Ethinylestradiol (CAS Nr. 57-63-6) (EE) zu verifizieren.
- Verwendung gleichzeitiger Kontrollgruppen, indem bei jeder Prüfung eine Gruppe hinzugefügt wird, die eine geeignete Dosis des Referenzöstrogens erhält.
Wenn das Tiermodell nicht wie erwartet reagiert, sind die Versuchsbedingungen zu überprüfen und entsprechend zu ändern. Die bei jedem der Ansätze verwendete Dosis des Referenzöstrogens sollte etwa die ED70 bis 80 sein.
27. Baselinestudie/positive Kontrollstudie - Bevor ein Labor anhand der vorliegenden Prüfmethode erstmals eine Studie durchführt, sollte seine Eignung nachgewiesen werden, und zwar durch Prüfung der Empfindlichkeit des Tiermodells und Festlegung der Dosis-Wirkungs-Beziehung für das Referenzöstrogen 17a-Ethinylestradiol (CAS Nr. 57-63-6) (EE) bei einem Minimum von vier Dosen. Die Reaktion des Uterusgewichts wird mit bekannten historischen Daten abgeglichen (vgl. Literaturhinweis (5)). Wenn diese Baseline- bzw. positive Kontrollstudie nicht zu den erwarteten Ergebnissen führt, sind die Versuchsbedingungen zu überprüfen und entsprechend zu modifizieren.
Zahl und Zustand der Versuchstiere
28. Jede Behandlungs- und Kontrollgruppe sollte aus mindestens sechs Tieren zusammengesetzt sein (sowohl beim Prüfplan für die Methode mit unreifen Tieren als auch bei dem für die Methode mit adulten OVX-Tieren).
Alter der unreifen Tiere
29. Beim uterotrophen Bioassay mit unreifen Tieren ist der Tag der Geburt anzugeben. Mit der Dosierung sollte so früh begonnen werden, dass sichergestellt ist, dass der mit der Pubertät assoziierte natürliche Anstieg der endogenen Östrogene am Ende der Prüfsubstanzverabreichung noch nicht stattgefunden hat. Andererseits gibt es Hinweise darauf, dass sehr junge Tiere möglicherweise weniger empfindlich reagieren. Zur Festlegung des optimalen Alters sollte jedes Labor seine eigenen Hintergrunddaten zur Geschlechtsreife heranziehen.
Als Faustregel kann mit der Dosierung bei Ratten unmittelbar nach einem frühen Absetzen am postnatalen Tag 18 (PND 18) begonnen werden (PND 0 ist der Tag der Geburt). Die Dosierung sollte bei Ratten möglichst am PND 21 abgeschlossen sein, spätestens jedoch vor PND 25, weil nach diesem Alter die Hypothalamus-Hypophysen-Eierstock-Achse funktionsfähig wird und die endogenen Östrogenspiegel unter Umständen zu steigen beginnen, was mit einer Erhöhung der mittleren Baseline-Uterusgewichte und einem Ansteigen der Gruppen-Standardabweichungen einhergeht (2)(3)(10)(11)(12).
Ovarektomieverfahren
30. Bei Prüfungen mit ovarektomierten Ratten- und Mäuseweibchen (Behandlungs- und Kontrollgruppen) ist die Ovarektomie im Alter zwischen sechs und acht Wochen durchzuführen. Bei Ratten sollte zwischen der Ovarektomie und dem ersten Verabreichungstag mindestens ein Zeitraum von 14 Tagen liegen, damit der Uterus sich wieder auf eine stabile Mindestgröße (die Ausgangsgröße für die Prüfung) zurückbilden kann. Bei Mäusen sollten mindestens sieben Tage zwischen der Ovarektomie und dem ersten Verabreichungstag liegen. Da bereits kleine Mengen Ovarialgewebe für eine signifikante Erhöhung der Östrogenspiegel ausreichen (3), sollten die Tiere vor ihrer Verwendung mittels Beobachtung der bei Vaginalabstrichen an fünf aufeinanderfolgenden Tagen (z.B. Tage 10-14 nach der Ovarektomie bei Ratten) gewonnenen Epithelzellen getestet werden. Tiere, die Anzeichen für einen beginnenden Östruszyklus zeigen, sollten nicht verwendet werden. Später, bei der Nekropsie, sind die Ovarialstümpfe auf Reste von Ovarialgewebe zu untersuchen. Wird Ovarialgewebe gefunden, sollte das Tier nicht in die Berechnungen mit einbezogen werden (3).
31. Zu Beginn der Ovarektomie liegt das ordnungsgemäß narkotisierte Tier in Bauchlage. Der Längsschnitt zur Eröffnung der dorsolateralen Bauchwand sollte etwa 1 cm betragen und in der Mitte zwischen unterem Rippenbogenrand und Beckenkamm sowie einige Millimeter neben dem lateralen Rand des Lendenmuskels verlaufen. Das Ovar wird der Bauchhöhle entnommen und auf einem sterilen Feld abgelegt. Dann wird es an der Verbindungsstelle von Eileiter und Gebärmutterkörper abgetrennt. Wenn sichergestellt ist, dass keine starke Blutung auftritt, ist die Bauchwand zuzunähen und die Haut mit Klammern oder einer entsprechenden Naht zu schließen. Die Ligaturpunkte sind schematisch in Abbildung 1 dargestellt. In Absprache mit einem auf Nager spezialisierten Veterinärmediziner sollte eine geeignete postoperative Schmerzlinderung erfolgen.
Körpergewicht
32. Bei der Methode mit adulten OVX-Tieren korreliert das Uterusgewicht nicht mit dem Körpergewicht, weil das Uterusgewicht durch Hormone, zum Beispiel Östrogene, nicht aber durch Wachstumsfaktoren, die die Körpergröße regulieren, beeinflusst wird. Beim Modell mit unreifen Tieren dagegen ist ein Zusammenhang zwischen Uterusgewicht und Körpergewicht gegeben, so lange das Tier noch nicht voll entwickelt ist (34). Zu Beginn des Versuchs sollten die Gewichtsunterschiede bei den unreifen Tieren möglichst gering sein und ± 20 % des Durchschnittsgewichts nicht überschreiten. Das bedeutet, dass die Wurfgröße durch den Züchter standardisiert werden sollte, sodass sichergestellt ist, dass Nachkommen verschiedener Muttertiere ungefähr gleich gefüttert werden. Die Tiere werden durch randomisierte Gewichtsverteilung so den Kontroll- und Behandlungsgruppen zugewiesen, dass das durchschnittliche Körpergewicht der einzelnen Gruppen sich statistisch nicht von dem der anderen Gruppen unterscheidet. Eine Zuteilung von Wurfgeschwistern zur selben Behandlungsgruppe ist zu vermeiden, sofern das ohne Erhöhung der Anzahl der für die Untersuchung verwendeten Würfe möglich ist.
Dosierung
33. Um festzustellen, ob eine Prüfsubstanz in vivo eine östrogene Wirkung entfalten kann, sind normalerweise zwei Dosisgruppen und eine Kontrollgruppe ausreichend, weshalb dieser Versuchsanordnung aus Tierschutzgründen der Vorrang eingeräumt werden sollte. Wenn der Zweck des Versuchs entweder die Erstellung einer Dosis-Wirkungs-Kurve oder die Umrechnung auf niedrigere Dosen ist, sind mindestens drei Dosisgruppen erforderlich. Wenn Informationen gewonnen werden sollen, die über das Vorhandensein einer östrogenen Aktivität hinausgehen (wie zum Beispiel eine Einschätzung der Wirkstärke), sollte ein anderer Dosierungsplan in Betracht gezogen werden. Abgesehen von der Behandlung mit der Prüfsubstanz sollten die Tiere der Kontrollgruppe genauso behandelt werden wie die Tiere in den Prüfgruppen. Wird die Prüfsubstanz mit einem Vehikel verabreicht, muss die Kontrollgruppe dieselbe Menge des Vehikels erhalten wie die behandelten Gruppen (bzw. das höchste verwendete Volumen, wenn die verschiedenen Gruppen unterschiedliche Volumina erhalten).
34. Das Ziel des uterotrophen Bioassays ist die Auswahl von Dosen, bei denen die Tiere auf jeden Fall überleben und die nach drei aufeinanderfolgenden Tagen mit einer Chemikaliengabe von maximal 1.000 mg pro Kilogramm und Tag nicht mit signifikanter Toxizität oder einem Leiden der Tiere einhergehen. Bei der Auswahl sämtlicher Dosisstufen sind alle zu der Prüfsubstanz oder verwandten Stoffen verfügbaren toxikologischen und (toxiko-)kinetischen Daten zu berücksichtigen. Bei der Festlegung der Höchstdosis sollten insbesondere die LD50 und/oder Angaben zur akuten Toxizität berücksichtigt werden, um den Tod der Tiere oder starkes Leiden und Qualen zu vermeiden (24)(25)(26). Die höchste Dosis sollte die maximal verträgliche Dosis (MTD) darstellen; eine auf einer Dosisstufe, die eine positive uterotrophe Reaktion hervorgerufen hat, durchgeführte Studie wäre ebenfalls akzeptabel. Für Screeningzwecke sind große Intervalle (z.B. eine halbe logarithmische Einheit, entsprechend einer Dosissteigerung um den Faktor 3,2, oder sogar bis zu einer vollen logarithmischen Einheit) zwischen den Dosisstufen allgemein akzeptabel. Liegen keine geeigneten Daten vor, kann eine Dosisfindungsstudie zur Bestimmung der zu verwendenden Dosen durchgeführt werden.
35. Wenn die Stärke der östrogenen Wirkung eines Agonisten aufgrund von Invitro- (oder Insilico-)Daten beurteilt werden kann, können alternativ auch diese Daten für die Dosiswahl herangezogen werden. Zum Beispiel wird die Menge der Prüfsubstanz, die uterotrophe Reaktionen vergleichbar mit denjenigen des Referenzagonisten (Ethinylestradiol) hervorrufen würde, anhand ihrer Invitro-Wirkstärke im Verhältnis zu Ethinylestradiol abgeschätzt. Die höchste Prüfdosis ergibt sich aus der Multiplikation dieser Äquivalenzdosis mit einem geeigneten Faktor, zum Beispiel 10 oder 100.
Ausführungen zur Dosisfindung
36. Falls notwendig, kann eine Vorstudie zur Dosisfindung mit wenigen Tieren durchgeführt werden. Diesbezüglich kann das OECD Guidance Document Nr. 19 (25) konsultiert werden, in dem klinische Anzeichen für Toxizität oder Leiden der Tiere festgelegt sind. Sofern es im Rahmen dieser Dosisfindungsstudie nach drei Verabreichungstagen praktikabel ist, können die Uteri etwa 24 Stunden nach der letzten Dosisgabe operativ entfernt und gewogen werden. Diese Daten können dann zur Planung der Hauptstudie herangezogen werden (Auswahl der akzeptablen Höchstdosis und der niedrigeren Dosen sowie Empfehlung für die Anzahl an Dosisgruppen).
Verabreichung der Dosen
37. Die Prüfsubstanz wird oral per Schlundsonde oder durch subkutane Injektion verabreicht. Bei der Wahl des Verabreichungswegs sind Tierschutzaspekte sowie toxikologische Aspekte wie die Art der Humanexposition gegenüber der Chemikalie (z.B. Schlundsonde, um eine Exposition über die Nahrungsaufnahme zu simulieren; subkutane Injektion, um Einatmen oder Aufnahme über die Haut am Modell zu testen), die physikalisch-chemischen Eigenschaften der Prüfsubstanz und insbesondere verfügbare toxikologische Angaben und Daten zu Verstoffwechselung und Kinetik (z.B. die Notwendigkeit, eine Firstpass-Metabolisierung zu vermeiden; bessere Effizienz über einen bestimmten Verabreichungsweg) mit einzubeziehen.
38. Als Erstes sollte möglichst immer die Verwendung einer wässrigen Lösung/Suspension in Erwägung gezogen werden. Da aber die meisten Östrogenliganden beziehungsweise ihre metabolischen Vorläufer eher hydrophob sind, ist der gängigste Ansatz die Verwendung einer Lösung/Suspension auf Ölbasis (z. 8. Mais-, Erdnuss-, Sesam- oder Olivenöl). Diese Öle unterscheiden sich jedoch in ihrem Energie- und Fettgehalt, sodass das Vehikel die Menge der insgesamt aufgenommenen metabolisierbaren Energie (ME) beeinflussen kann, was sich wiederum - insbesondere bei der Methode mit unreifen Tieren - auf die gemessenen Endpunkte, beispielsweise das Uterusgewicht, auswirken kann (33). Aus diesem Grund sollte vor dem Versuch jedes geplante Vehikel mit Kontrollen ohne Vehikel verglichen werden. Die Prüfsubstanzen können in einer sehr kleinen Menge von 95 %igem Ethanol oder anderen geeigneten Lösungsmitteln gelöst und im Prüfvehikel auf ihre endgültigen Arbeitskonzentrationen verdünnt werden. Die toxischen Eigenschaften des Lösungsmittels müssen bekannt sein und sollten in einer separaten Kontrollgruppe, in der nur das Lösungsmittel geprüft wird, getestet werden. Wenn die Prüfsubstanz als stabil erachtet wird, kann der Lösungsvorgang durch schonende Erwärmung und kräftige mechanische Einwirkung unterstützt werden. Die Stabilität der Prüfsubstanz im Vehikel sollte bestimmt werden. Ist die Prüfsubstanz für die Dauer des Versuchs stabil, kann eine Start-Aliquote der Substanz vorbereitet werden und die spezifizierten Dosierungsverdünnungen können täglich zubereitet werden.
39. Die zeitliche Planung der Dosisgaben ist abhängig vom verwendeten Tiermodell (vgl. Nummer 29 für das Modell mit unreifen Tieren und Nummer 30 für das Modell mit adulten OVX-Tieren). Unreife Rattenweibchen erhalten täglich an drei aufeinanderfolgenden Tagen eine Gabe der Prüfsubstanz. Auch für ovarektomierte Rattenweibchen wird eine dreitägige Behandlungsdauer empfohlen, aber eine längere Exposition ist akzeptabel und kann den Nachweis schwach aktiver Chemikalien erleichtern. Im Falle von ovarektomierten Mäuseweibchen ist bei starken Östrogen-Agonisten eine Verabreichungsdauer von drei Tagen im Allgemeinen ausreichend und eine Verlängerung auf sieben Tage nicht mit signifikanten Vorteilen verbunden; für schwache Östrogene wurde diese Beziehung allerdings in der Validierungsstudie (16) nicht nachgewiesen, weshalb eine verlängerte Dosisgabe von sieben aufeinanderfolgenden Tagen bei adulten OVX-Mäusen angeraten ist.Die Dosis sollte täglich ungefähr zur selben Zeit verabreicht werden. Die Dosisgaben sind bei Bedarf anzupassen, um eine konstante Dosierung in Relation zum Körpergewicht des Tiers (z.B. mg Prüfsubstanz pro kg Körpergewicht und Tag) sicherzustellen. Das Prüfvolumen sollte im Verhältnis zum Körpergewicht möglichst konstant gehalten werden, indem die Konzentration der Lösung, die die Dosierung enthält, angepasst wird, um so bei allen Dosisstufen und Verabreichungswegen ein im Verhältnis zum Körpergewicht konstantes Volumen sicherzustellen.
40. Wird die Prüfsubstanz über eine Sonde verabreicht, so sollte dies in einer täglichen Einmaldosis unter Verwendung einer Schlundsonde oder einer geeigneten Intubationskanüle erfolgen. Das maximale Flüssigkeitsvolumen, das jeweils verabreicht werden kann, hängt von der Größe des Versuchstiers ab. Es sind die örtlichen Tierschutzrichtlinien zu befolgen, das Volumen sollte jedoch 5 ml pro kg Körpergewicht nicht überschreiten, außer bei wässrigen Lösungen, von denen 10 ml pro kg Körpergewicht gegeben werden können.
41. Wird die Prüfsubstanz durch subkutane Injektion verabreicht, so sollte dies über eine tägliche Einmaldosis geschehen. Die Dosen sind mittels steriler Nadel (z.B. 23 oder 25 Gauge) und Tuberkulinspritze dorsal im Bereich der Schulterblätter oder in die Lendenregion zu injizieren. Die Injektionsstelle kann rasiert werden. Wenn Injektionsflüssigkeit verloren geht, an der Injektionsstelle ausläuft oder unvollständig verabreicht wird, ist dies zu protokollieren. Das Gesamtvolumen, das pro Ratte und Tag injiziert wird, sollte 5 ml pro kg Körpergewicht, aufgeteilt auf zwei Injektionsstellen, nicht überschreiten; dies gilt nicht für wässrige Lösungen, von denen 10 ml pro kg Körpergewicht gegeben werden können.
Allgemeine und klinische Beobachtungen
42. Allgemeine klinische Beobachtungen sollten mindestens einmal täglich durchgeführt werden, bei Anzeichen für Toxizität häufiger. Die Beobachtungen sind möglichst immer zur selben Tageszeit/zu denselben Tageszeiten und unter Berücksichtigung des Zeitraums nach der Verabreichung, in dem die Wirkungsgipfel zu erwarten sind, durchzuführen. Alle Tiere sind auf Anzeichen von Mortalität, Morbidität und allgemeine klinische Zeichen wie Verhaltensänderungen, Änderungen an Haut, Fell, Augen und Schleimhäuten, Sekrete und Exkrete sowie autonome Körperfunktionen (z.B. Tränensekretion, Piloerektion, Pupillengröße, ungewöhnliche Atemmuster) zu beobachten.
Körpergewicht und Futteraufnahme
43. Alle Tiere sind täglich auf 0,1 g genau zu wiegen, wobei unmittelbar vor Behandlungsbeginn, also wenn die Tiere den Gruppen zugeteilt werden, mit dem Wiegen zu beginnen ist. Optional kann die aufgenommene Futtermenge während des Behandlungszeitraums pro Käfig durch Wiegen der Futterspender bestimmt werden. Die Daten zur Futteraufnahme sind in Gramm pro Ratte und Tag auszudrücken.
Sektion und Bestimmung des Uterusgewichts
44. Die Ratten sind 24 Stunden nach der letzten Behandlung auf humane Weise zu töten. Idealerweise werden die Nekropsien über die Gruppen hinweg randomisiert durchgeführt, um ein unmittelbares Abarbeiten der Dosisgruppen nach oben oder unten zu vermeiden, da dies die Daten geringfügig beeinflussen könnte. Ziel des Bioassays ist die Bestimmung sowohl des Uterusfeuchtgewichts als auch des geblotteten Uterusgewichts. Das Feuchtgewicht beinhaltet den Uterus und den Gehalt an Uterusflüssigkeit. Das geblottete Gewicht wird bestimmt, nachdem die Uterusflüssigkeit ausgedrückt und beseitigt wurde.
45. Vor der Sektion wird die Vagina bei unreifen Tieren auf ihren Öffnungsstatus hin untersucht. Die Sektion beginnt mit der Eröffnung der Bauchwand von der Schambeinfuge an. Anschließend werden das Uterushorn und die Ovarien, sofern vorhanden, von der dorsalen Bauchwand gelöst. Dann werden Harnblase und Harnleiter von der ventralen und lateralen Seite des Uterus und der Vagina entfernt. Die fibröse Adhäsion zwischen Rektum und Vagina wird gelöst, bis die Verbindung zwischen Vaginalöffnung und Perinealhaut erkennbar ist. Uterus und Vagina werden vom Körper gelöst, indem die Vaginalwand genau oberhalb der Verbindung zur Perinealhaut abgeschnitten wird (siehe Abbildung 2). Der Uterus sollte durch vorsichtiges Abtrennen des Mesometriums an der Stelle, an der es jeweils dorsolateral mit der Längsseite eines Uterushorns verbunden ist, von der Körperwand gelöst werden. Sobald der Uterus aus dem Körper entfernt ist, sollten die weiteren Arbeiten rasch genug erfolgen, um ein Austrocknen der Gewebe zu vermeiden. Ein Gewichtsverlust durch Austrocknen fällt bei kleinen Geweben wie dem Uterus stärker ins Gewicht (23). Wenn Ovarien vorhanden sind, werden sie so am Ovidukt entfernt, dass keine Gebärmutterflüssigkeit aus dem Uterushorn verloren geht. Bei ovarektomierten Tieren sind die Ovarialstümpfe auf Reste von Ovarialgewebe zu untersuchen. Überschüssiges Fett- und Bindegewebe ist abzuschaben. Die Vagina wird genau unterhalb des Gebärmutterhalses vom Uterus getrennt, sodass der Gebärmutterhals mit dem Uteruskörper verbunden bleibt (siehe Abbildung 2).
46. Die Uteri werden einzeln in eindeutig gekennzeichneten und gewogenen Behälter verbracht (z.B. Petrischale oder Wägeschiffchen aus Kunststoff) und kontinuierlich gegen Austrocknung vor dem Wiegen geschützt (beispielsweise indem ein leicht mit Kochsalzlösung angefeuchtetes Filterpapier in den Behälter gelegt wird). Der Uterus wird mit der Uterusflüssigkeit auf 0,1 mg genau gewogen (Uterusfeuchtgewicht).
47. Anschließend wird jeder Uterus einzeln weiterverarbeitet, um die Gebärmutterflüssigkeit zu entfernen. Beide Uterushörner werden durchstochen oder längs aufgeschnitten. Der Uterus wird auf leicht angefeuchtetes Filterpapier (z.B. Whatman Nr. 3) gelegt und vorsichtig mit einem zweiten Stück leicht angefeuchteten Filterpapiers ausgedrückt, bis die Uterusflüssigkeit vollständig entfernt ist (Blotten). Der Uterus wird ohne die Gebärmutterflüssigkeit auf 0,1 mg genau gewogen (Uterusgewicht nach Blotten, nachfolgend Uterustrockengewicht).
48. Am Uterusgewicht bei Studienende lässt sich ablesen, ob das geeignete Alter bei der unreifen intakten Ratte tatsächlich nicht überschritten wurde, ausschlaggebend sind in dieser Hinsicht jedoch die historischen Daten des vom Labor verwendeten Rattenstamms (vgl. Nummer 56 bezüglich der Interpretation der Ergebnisse).
Optionale Untersuchungen
49. Nach dem Wiegen können die Uteri in 10 % neutral gepuffertem Formalin fixiert und nach Hämatoxylin-Eosin- Färbung (HE-Färbung) histopathologisch untersucht werden. Die Vagina kann ebenfalls entsprechend untersucht werden (siehe Nummer 9). Für einen quantitativen Vergleich kann ferner eine morphometrische Untersuchung des Epithelgewebes der Gebärmutterschleimhaut durchgeführt werden.
Daten
50. Folgende Daten über die Prüfung sind anzugeben:
- die Anzahl der Tiere zu Beginn des Assays,
- die Anzahl und Identität der während der Prüfung tot aufgefundenen oder aus humanen Gründen getöteten Tiere sowie Datum und Uhrzeit des Todes oder der Tötung der Tiere,
- die Anzahl und Identität der Tiere, die Toxizitätszeichen aufweisen, und eine Beschreibung der beobachteten Toxizitätszeichen einschließlich Zeitpunkt des Einsetzens, Dauer und Schweregrad der toxischen Wirkungen und
- die Anzahl und Identität der Tiere, bei denen Läsionen festgestellt werden, und eine Beschreibung der Art der Läsionen.
51. Zu den einzelnen Tieren sollten die Daten bezüglich Körpergewicht, Uterusfeuchtgewicht und Uterustrockengewicht protokolliert werden. Um festzustellen, ob die Verabreichung der Prüfsubstanz zu einer statistisch signifikanten (p < 0,05) Erhöhung des Uterusgewichts geführt hat, sollten einseitige statistische Analysen für die Agonisten durchgeführt werden. Es sind geeignete statistische Analysen durchzuführen, um die Trocken- und Feuchtgewichte der Uteri auf behandlungsbedingte Veränderungen zu überprüfen. Zum Beispiel können die Daten anhand einer Kovarianzanalyse mit dem Körpergewicht bei Nekropsie als Kovariate beurteilt werden. Vor der Datenanalyse kann eine varianzstabilisierende logarithmische Transformation der Uterusdaten durchgeführt werden. Der Dunnett-Test und der Hsu-Test sind für paarweise Vergleiche jeder Dosisgruppe mit Vehikelkontrollgruppen und die Berechnung der Konfidenzintervalle geeignet. Es können studentisierte Residuenplots zur Erfassung möglicher Ausreißer und zur Bewertung der Homogenität der Varianzen eingesetzt werden. Diese Verfahren kamen im Rahmen des Validierungsprogramms der OECD unter Verwendung von PROC GLM (GLM-Verfahren) im Statistik-Softwaresystem SAS (Statistisches Analysesystem, SAS Institute, Cary, NC), Version 8 (6)(7) zum Einsatz.
52. Der Abschlussbericht muss Folgendes beinhalten:
Prüfeinrichtung:
- verantwortliches Personal und Zuständigkeiten während der Studie,
- Daten der Baselinestudie/positiven Kontrollstudie und in regelmäßigen Abständen gewonnene positive Kontrolldaten (vgl. Nummern 26 und 27).
Prüfsubstanz:
- Beschreibung der Prüfsubstanzen,
- physikalische Beschaffenheit und gegebenenfalls physikalisch-chemische Eigenschaften,
- Zubereitungsverfahren von Verdünnungen und Häufigkeit der Zubereitung,
- etwaige Daten über die Stabilität,
- etwaige Analysen der Dosierungslösungen.
Vehikel:
- Beschreibung des Prüfvehikels (Art, Lieferant und Charge),
- Begründung der Wahl des Vehikels (sofern anders als Wasser).
Versuchstiere:
- Tierart und -stamm und Begründung der getroffenen Wahl,
- Lieferant und genaue Angabe der Einrichtung, aus der die Tiere stammen,
- Alter bei Lieferung und Geburtsdatum,
- bei unreifen Tieren, Angabe, ob diese mit Mutter- oder Ammentier geliefert werden, und Datum des Absetzens,
- Angaben zum Akklimatisierungsverfahren für die Tiere,
- Anzahl der Tiere pro Käfig,
- Angaben/Methode zur eindeutigen Kennzeichnung der einzelnen Tiere und der Gruppe.
Prüfbedingungen:
- Angaben zum Randomisierungsverfahren (angewendete Methode),
- Begründung der Dosiswahl,
- Angaben zur Formulierung der Prüfsubstanz, ihrer erreichten Konzentration, Stabilität und Homogenität,
- Angaben zur Verabreichung der Prüfsubstanz und Begründung des gewählten Expositionswegs,
- Futter (Bezeichnung, Art, Lieferant, Inhalt und, sofern bekannt, Phytoöstrogengehalte),
- Trinkwasserversorgung (z.B. Leitungswasser oder gefiltertes Wasser) und Art der Tränkung (Großbehälter mit Trinkschläuchen, Flaschentränkung usw.),
- Einstreu (Bezeichnung, Art, Lieferant, Inhalt),
- Protokoll der Haltungsbedingungen, Beleuchtungsintervalle, Raumtemperatur, Luftfeuchtigkeit, Raumreinigung,
- ausführliche Beschreibung der Nekropsie und der Uterusgewichtsbestimmung,
- Beschreibung der statistischen Verfahren.
Ergebnisse
Bezüglich der einzelnen Tiere:
- sämtliche Angaben zum Körpergewicht pro Tier und Tag (von der Gruppenzuteilung bis zur Nekropsie) (auf 0,1 g genau),
- Alter jedes einzelnen Tiers (ausgedrückt in Tagen; Tag der Geburt = Tag 0) ab der Verabreichung der Prüfsubstanz,
- Datum und Uhrzeit der einzelnen Dosisgaben,
- berechnetes Volumen und verabreichte Dosierung sowie beobachtete Dosierungsverluste während oder nach der Verabreichung,
- täglicher Bericht zum Zustand der Tiere einschließlich einschlägiger Symptome und Beobachtungen,
- vermutete Todesursache (bei während der Studie in moribundem Zustand oder tot aufgefundenen Tieren),
- Datum und Uhrzeit der schmerzlosen Tötung einschließlich des Zeitabstands zur letzten Dosisgabe,
- Uterusfeuchtgewicht (auf 0,1 mg genau) und etwaige Beobachtungen zu Uterusflüssigkeitsverlusten während der Sektion und Vorbereitung zum Wiegen,
- Uterustrockengewicht (auf 0,1 mg) genau.
Bezüglich der einzelnen Tiergruppen:
- mittleres Körpergewicht pro Tag (auf 0,1 g genau) und Standardabweichungen (von der Gruppenzuteilung bis zur Nekropsie),
- mittleres Uterusfeuchtgewicht und mittleres Uterustrockengewicht pro Gruppe (auf 0,1 mg genau) und Standardabweichungen,
- Futterverbrauch pro Tag, falls gemessen (berechnet in Gramm verzehrtes Futter pro Tier),
- Ergebnisse der statistischen Analysen zum Vergleich der Uterusfeucht- und -trockengewichte der Behandlungsgruppen mit denselben Maßnahmen in den Vehikelkontrollgruppen,
- Ergebnisse der statistischen Analysen zum Vergleich des Körpergewichts insgesamt und der Körpergewichtszunahme der Behandlungsgruppen mit denselben Maßnahmen in den Vehikelkontrollgruppen.
53. Zusammenfassung der wichtigsten Elemente der Prüfmethode
|
Ratte |
Maus | ||
| Versuchstiere | |||
| Stamm | Allgemein üblicher Labornagerstamm | ||
| Anzahl der Tiere | Mindestens sechs Tiere pro Dosisgruppe | ||
| Anzahl der Gruppen | Mindestens zwei Prüfgruppen (für weitere Hinweise siehe Nummer 33) und eine negative Kontrollgruppe
Für Hinweise zu positiven Kontrollgruppen siehe Nummern 26 und 27 | ||
| Haltungs- und Fütterungsbedingungen | |||
| Temperatur im Versuchstierraum | 22 °C ± 3 °C | ||
| Relative Luftfeuchtigkeit | 50-60 %, mind. 30 %, max. 70 % | ||
| Tägliche Beleuchtungsintervalle | 12 h hell/12 h dunkel | ||
| Nahrung und Trinkwasser | Ad libitum | ||
| Unterbringung | Einzeln oder in Gruppen von bis zu drei Tieren (unreife Tiere sollten aus sozialen Gründen in der Gruppe untergebracht werden) | ||
| Futter und Einstreu | Futter und Einstreu sollten möglichst niedrige Phytoöstrogengehalte aufweisen | ||
| Prüfplan | |||
| Methode | Methode mit unreifen, nicht ovarektomierten Tieren (bevorzugtes Verfahren)
Methode mit ovarektomierten adulten Weibchen | Methode mit ovarektomierten adulten Weibchen | |
| Alter der unreifen Tiere bei Dosisgabe | Beginn frühestens PND 18; letzte Dosisgabe vor PND 25 | Bei dieser Prüfmethode nicht relevant | |
| Alter bei Ovarektomie | Zwischen der 6. und 8. Lebenswoche | ||
| Alter der ovarektomierten Tiere bei Dosisgabe | Es sollten mindestens 14 Tage zwischen der Ovarektomie und dem ersten Verabreichungstag liegen. | Es sollten mindestens sieben Tage zwischen der Ovarektomie und dem ersten Verabreichungstag liegen. | |
| Körpergewicht | Das Körpergewicht sollte nur minimal variieren und nicht mehr als ± 20 % vom Durchschnittsgewicht abweichen. | ||
| Dosierung | |||
| Verabreichungsweg | Schlundsonde oder subkutane Injektion | ||
| Häufigkeit der Verabreichung | Tägliche Einmaldosis | ||
| Flüssigkeitsvolumen bei Schlundsonde und Injektion | ≤5 ml/kg Körpergewicht (bzw. bis zu 10 ml/kg Körpergewicht bei wässrigen Lösungen) (bei subkutaner Gabe an zwei Injektionsstellen) | ||
| Verabreichungsdauer | Drei aufeinanderfolgende Tage beim Modell mit unreifen Tieren Mindestens drei aufeinanderfolgende Tage beim OVX-Modell | Sieben aufeinanderfolgende Tage beim OVX-Modell | |
| Zeitpunkt der Nekropsie | Etwa 24 Stunden nach der letzten Dosisgabe | ||
| Ergebnisse | |||
| Positive Reaktion | Statistisch signifikante Erhöhung des durchschnittlichen Uterusgewichts (Feuchtgewicht und/oder Trockengewicht) | ||
| Referenzöstrogen | 17α-Ethinylestradiol | ||
Leitfaden für die Interpretation und Akzeptanz der Ergebnisse
54. Im Allgemeinen ist das Ergebnis einer Prüfung auf östrogene Wirkung dann als positiv anzusehen, wenn zumindest bei der höchsten Dosisstufe im Vergleich zu der nur mit dem Lösungsmittel behandelten Kontrollgruppe eine statistisch signifikante Erhöhung des Uterusgewichts (p < 0,05) zu verzeichnen ist. Ein positives Testergebnis wird ferner durch den Nachweis einer biologisch plausiblen Beziehung zwischen Dosis und Wirkstärke untermauert, wobei zu beachten ist, dass eine Prüfsubstanz sowohl östrogene als auch antiöstrogene Wirkungen haben kann, die sich gegenseitig überlagern, was sich unter Umständen auf den Verlauf der Dosis-Wirkungs-Kurve auswirkt.
55. Es ist darauf zu achten, dass die maximal verträgliche Dosis nicht überschritten wird, weil die Interpretation der Daten sonst nicht aussagekräftig ist. Vor diesem Hintergrund sind ein verringertes Körpergewicht, klinische Anzeichen und andere Befunde sorgfältig zu prüfen.
56. Ein wesentliches Kriterium für die Akzeptanz der bei dem uterotrophen Bioassay gewonnenen Daten sind die Uterusgewichte der Vehikelkontrollgruppe. Hohe Kontrollwerte können die Empfindlichkeit des Bioassays und die Fähigkeit zur Feststellung sehr schwacher Östrogenagonisten beeinträchtigen. Die Auswertung der Fachliteratur und die im Laufe der Validierung des uterotrophen Bioassays erhobenen Daten legen die Vermutung nahe, dass hohe Durchschnittswerte bei Kontrollgruppen, insbesondere wenn unreife Tiere verwendet werden, spontan vorkommen können (2)(3)(6)(9). Da das Uterusgewicht bei unreifen Ratten von zahlreichen Variablen abhängig ist - wie zum Beispiel von Stamm und Körpergewicht -, kann keine allgemeingültige Obergrenze für das Uterusgewicht angegeben werden. Als Faustregel gilt, dass Uterustrockengewichte bei unreifen Kontrollratten zwischen 40 und 45 mg als verdächtig einzustufen sind, und dass Uterusgewichte über 45 mg Anlass zu einer Wiederholung der Prüfung geben können. Dies muss jedoch von Fall zu Fall entschieden werden (3)(6)(8). Wenn bei adulten Ratten die Ovarektomie nicht vollständig durchgeführt wurde, führt das ovariale Restgewebe unter Umständen zu einer endogenen Östrogenproduktion, was eine Verzögerung bei der Rückbildung des Uterusgewichts zur Folge hat.
57. Bei der Vehikelkontrollgruppe scheint ein Uterustrockengewicht von unter 0,09 % des Körpergewichts unreifer Rattenweibchen und von unter 0,04 % des Körpergewichts ovarektomierter junger adulter Weibchen akzeptable Ergebnisse zu liefern [siehe Tabelle 31 (2)]. Liegen die Uterusgewichte der Kontrollgruppe über diesen Werten, sind verschiedene Faktoren, darunter das Alter der Tiere, die vollständige Entfernung der Ovarien, Phytoöstrogene im Futter usw. zu überprüfen, und negative Prüfergebnisse (also kein Anzeichen für östrogene Wirkung) mit Vorsicht zu verwenden.
58. Historische Daten der Vehikelkontrollgruppen sollten vom Labor in dessen Datenbestand aufgezeichnet werden. Die historischen Daten zur Wirkung positiver Referenzöstrogene, zum Beispiel 17a-Ethinylestradiol, sind ebenfalls vom Labor einzupflegen. Die Labore können ferner die Reaktion auf bekannte schwache Östrogenagonisten testen. Alle diese Daten können mit Daten aus der Fachliteratur (2)(3)(4)(5)(6)(7)(8) abgeglichen werden. So kann sichergestellt werden, dass die Methoden des Labors in ausreichendem Maße empfindlich sind.
59. Die Uterustrockengewichte zeigten im Laufe der Validierungsprüfung der OECD eine geringere Variabilität als die Uterusfeuchtgewichte (6)(7). Eine signifikante Reaktion bei einer der Bestimmungsarten würde allerdings auf ein positives Testergebnis, also eine Östrogenwirkung der Prüfsubstanz, hindeuten.
60. Die uterotrophe Reaktion ist nicht ausschließlich östrogenen Ursprungs. Ein positives Testergebnis des uterotrophen Bioassays sollte jedoch allgemein als Nachweis für ein östrogenes Potenzial im lebenden Organismus gewertet werden und normalerweise den Anstoß für weitere Abklärungsmaßnahmen liefern (siehe Nummer 9 und OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals, Anlage 2).
Abbildung 1 Schematische Darstellung der operativen Entfernung der Ovarien
Die Operation beginnt mit der Eröffnung der dorsolateralen Bauchwand in der Mitte zwischen unterem Rippenbogenrand und Beckenkamm sowie einige Millimeter neben dem lateralen Rand des Lendenmuskels. Die Ovarien sind innerhalb der Bauchhöhle zu lokalisieren. Anschließend werden die Ovarien jeweils auf einem sterilen Feld aus der Bauchhöhle vorgelagert, der Bereich zwischen Ovar und Uterus wird zur Blutstillung ligiert, und die Ovarien werden jeweils oberhalb der Ligatur an der Verbindungsstelle zwischen Ovidukt und Uterushorn abgeschnitten. Wenn sichergestellt ist, dass keine starke Blutung mehr besteht, ist die Bauchhöhle zuzunähen und die Haut mit Klammern oder einer Naht zu schließen. Die Tiere sollten sich, bevor sie verwendet werden, mindestens 14 Tage lang erholen können; in dieser Zeit kann sich auch der Uterus zurückbilden.
Abbildung 2 Entfernung und Vorbereitung der Uterusgewebe für die Gewichtsbestimmung
Die Sektion beginnt mit der Eröffnung der Bauchwand ab der Schambeinfuge. Anschließend werden die Ovarien (sofern vorhanden) und die Uterushörner von der dorsalen Bauchwand gelöst. Harnblase und Harnleiter werden von der ventralen und lateralen Seite des Uterus und der Vagina entfernt. Die fibröse Adhäsion zwischen Rektum und Vagina wird gelöst, bis die Verbindung zwischen Vaginalöffnung und Perinealhaut erkennbar ist. Uterus und Vagina werden vom Körper getrennt, indem die Vaginalwand genau oberhalb der Verbindung zur Perinealhaut abgeschnitten wird (siehe Abbildung). Der Uterus sollte durch vorsichtiges Abtrennen des Mesometriums an der Stelle, an der es jeweils dorsolateral mit der Längsseite eines Uterushorns verbunden ist, von der Körperwand gelöst werden. Nach Entfernung aus dem Körper ist überschüssiges Fett- und Bindegewebe abzuschaben. Wenn Ovarien vorhanden sind, werden sie so am Ovidukt entfernt, dass keine Gebärmutterflüssigkeit aus dem Uterushorn verloren geht. Bei ovarektomierten Tieren sind die Ovarialstümpfe auf Reste von Ovarialgewebe zu untersuchen. Die Vagina wird genau unterhalb des Gebärmutterhalses vom Uterus getrennt, sodass der Gebärmutterhals mit dem Uteruskörper verbunden bleibt. Der Uterus kann nun gewogen werden.
| Anlage 1 |
Antiöstrogene Wirkung: die Fähigkeit einer Chemikalie, die Wirkung von Östradiol 17ß in einem Säugetierorganismus zu unterdrücken.
Chemikalie: ein Stoff oder eine Mischung.
Dosierung: ein allgemeiner Begriff, der die Dosis, ihre Häufigkeit und die Dauer der Verabreichung umfasst.
Dosis: die Menge der verabreichten Prüfsubstanz. Für die Zwecke des uterotrophen Bioassays wird die Dosis ausgedrückt als Masse der Prüfsubstanz je Einheit Körpergewicht des Versuchstiers pro Tag (z.B. mg pro kg Körpergewicht und Tag).
Empfindlichkeit: der Anteil aller positiven/wirkenden Chemikalien, die durch den Test korrekt eingestuft werden. Die Empfindlichkeit ist ein Maß für die Genauigkeit einer Prüfmethode mit kategorialen Ergebnissen und ein wichtiger Aspekt bei der Bewertung ihrer Relevanz.
Maximal verträgliche Dosis (MTD): die höchstmögliche Dosis der Prüfsubstanz, die nach Einbringen in den Körper nicht zum Tod von Versuchstieren führt (bezeichnet als LD0) (IUPAC, 1993).
Östrogene Wirkung: die Fähigkeit einer Chemikalie, in einem Säugetierorganismus wie Östradiol 17ß zu wirken.
Postnataler Tag X: der xte Lebenstag nach der Geburt.
Prüfsubstanz: jede(r) mittels dieser Prüfmethode getestete Stoff bzw. Mischung.
Spezifizität: der Anteil aller negativen/wirkungslosen Stoffe, die durch den Test korrekt eingestuft werden. Die Spezifizität ist ein Maß für die Genauigkeit einer Prüfmethode mit kategorialen Ergebnissen und ein wichtiger Aspekt bei der Bewertung ihrer Relevanz.
Tag der Geburt: der postnatale Tag 0.
Uterotroph: Begriff zur Beschreibung einer positiven Wirkung auf das Gewicht der Uterusgewebe.
Validierung: wissenschaftlicher Prozess zur Beschreibung der operationellen Anforderungen und Grenzen einer Prüfmethode und zum Nachweis ihrer Zuverlässigkeit und Eignung für einen bestimmten Zweck.
| Anlage 2 |
Anmerkung: Diese Dokument wurde vom Sekretariat des Prüfrichtlinienprogramms auf der Gmndlage einer beim 6. Treffen der EDTA-Taskforce getroffenen Vereinbarung ausgearbeitet.
Rahmenkonzept der OECD für die Testung und Bewertung endokriner Disruptoren
| Ein Einstieg in das Rahmenkonzept und ein Ausstieg sind auf allen Stufen möglich und abhängig davon, welche Informationen für Gefahren- und Risikobeurteilungszwecke benötigt werden. | |
| Anmerkung 2: | Bei Stufe 5 sollte der Aspekt der Ökotoxikologie Endpunkte beinhalten, die Hinweise auf schädliche Wirkmechanismen und eine potenzielle Schädigung der Population liefern. |
| Anmerkung 3: | Wenn ein multimodales Modell mehrere Assays mit nur einem Endpunkt (Single-Endpoint-Assays) umfasst, ersetzt dieses Modell die Durchführung der Single-Endpoint-Assays. |
| Anmerkung 4: | Die Bewertung der einzelnen Chemikalien sollte von Fall zu Fall und unter Berücksichtigung aller verfügbaren Daten sowie vor dem Hintergrund des Zwecks der Stufen des Rahmenkonzepts erfolgen. |
| Anmerkung 5: | Das Rahmenkonzept ist derzeit noch nicht als vollständig anzusehen. Auf Stufe 3, 4 und 5 beinhaltet es Assays, die entweder schon verfügbar sind oder sich gerade in der Validierungsphase befinden. Bei Letzteren ist die Aufnahme in das Rahmenkonzept noch vorläufig. Sobald ihre Entwicklung und Validierung abgeschlossen ist, werden sie offizieller Bestandteil des Konzepts. |
| Anmerkung 6: | Stufe 5 ist nicht so zu verstehen, dass es sich bei den darin enthaltenen Tests nur um endgültige Prüfungen handelt. Die Prüfungen dieser Stufe sollen vielmehr einen Beitrag zur allgemeinen Gefahren- und Risikobewertung leisten. |
(1) OECD (1998). Report of the First Meeting of the OECD Endocrine Disrupter Testing and Assessment (EDTA) Task Force, 10.-11. März 1998, ENV/MC/CHEM/RA(98)5.
(2) OECD (2003). Detailed Background Review of the Uterotrophic Bioassay: Summary of the Available Literature in Support of the Project of the OECD Task Force on Endocrine Disrupters Testing and Assessment (EDTA) to Standardise and Validate the Uterotrophic Bioassay. OECD Environmental Health and Safety Publication Series on Testing and Assessment No. 38. ENV/JM/MONO(2003)1.
(3) Owens JW, Ashby J. (2002). Critical Review and Evaluation of the Uterotrophic Bioassay for the Identification of Possible Estrogen Agonists and Antagonists: In Support of the Validation of the OECD Uterotrophic Protocols for the Laboratory Rodent. Crit. Rev. Toxicol. 32:445-520.
(4) OECD (2006). OECD Report of the Initial Work Towards the Validation of the Rodent Uterotrophic Assay - Phase 1. OECD Environmental Health and Safety Publication Series on Testing and Assessment No. 65. ENV/JM/MONO(2006)33.
(5) Kanno, J, Onyon L, Haseman J, Fenner-Crisp P, Ashby J, Owens W. (2001). The OECD program to validate the rat uterotrophic bioassay to screen compounds for in vivo estrogenic responses: Phase 1. Environ Health Perspect. 109:785-94.
(6) OECD (2006). OECD Report of the Validation of the Rodent Uterotrophic Bioassay: Phase 2 - Testing of Potent and Weak Oestrogen Agonists by Multiple Laboratories. OECD Environmental Health and Safety Publication Series on Testing and Assessment No. 66. ENV/JM/MONO(2006)34.
(7) Kanno J, Onyon L, Peddada S, Ashby J, Jacob E, Owens W. (2003). The OECD program to validate the rat uterotrophic bioassay: Phase Two - Dose Response Studies. Environ. Health Persp.111:1530-1549
(8) Kanno J, Onyon L, Peddada S, Ashby J, Jacob E, Owens W. (2003). The OECD program to validate the rat uterotrophic bioassay: Phase Two - Coded Single Dose Studies. Environ. Health Persp.111:1550-1558.
(9) Owens W, Ashby J, Odum J, Onyon L. (2003). The OECD program to validate the rat uterotrophic bioassay: Phase Two - Dietary phytoestrogen analyses. Environ. Health Persp. 111:1559-1567.
(10) Ogasawara Y, Okamoto S, Kitamura Y, Matsumoto K. (1983). Proliferative pattern of uterine cells from birth to adulthood in intact, neonatally castrated, and/or adrenalectomized mice assayed by incorporation of [I125]iododeoxyuridine. Endocrinology 113:582-587.
(11) Branham WS, Sheehan DM, Zehr DR, Ridlon E, Nelson CJ. (1985). The postnatal ontogeny of rat uterine glands and agerelated effects of 17bestradiol. Endocrinology 117:2229-2237.
(12) Schlumpf M, Berger L, Cotton B, Conscience-Egli M, Durrer S, Fleischmann I, Haller V, Maerkel K, Lichtensteiger W. (2001). Estrogen active UV screens. SÖFW-J. 127:10-15.
(13) Zarrow MX, Lazo-Wasem EA, Shoger RL. (1953). Estrogenic activity in a commercial animal ration. Science, 118:650-651.
(14) Drane HM, Patterson DSP, Roberts BA, Saba N. (1975). The chance discovery of oestrogenic activity in laboratory rat cake. Fd. Cosmet. Toxicol. 13:425-427.
(15) Boettger-Tong H, Murphy L, Chiappetta C, Kirkland JL, Goodwin B, Adlercreutz H, Stancel GM, Makela S. (1998). A case of a laboratory animal feed with high estrogenic activity and its impact on in vivo responses to exogenously administered estrogens. Environ. Health Perspec.106:369-373.
(16) OECD (2007). Additional data supporting the Test Guideline on the Uterotrophic Bioassay in rodents. OECD Environmental Health and Safety Publication Series on Testing and Assessment No. 67.
(17) Degen GH, Janning P, Diel P, Bolt HM. (2002). Estrogenic isoflavones in rodent diets. Toxicol. Lett. 128:145-157.
(18) Wade MG, Lee A, McMahon A, Cooke G, Curran I. (2003). The influence of dietary isoflavone on the uterotrophic response in juvenile rats. Food Chem. Toxicol. 41:1517-1525.
(19) Yamasaki K, Sawaki M, Noda S, Wada T, Hara T, Takatsuki M. (2002). Immature uterotrophic assay of estrogenic compounds in rats given different phytoestrogen content diets and the ovarian changes in the immature rat uterotrophic of estrogenic compounds with ICI 182,780 or antide. Arch. Toxicol. 76:613-620.
(20) Thigpen JE, Haseman JK, Saunders HE, Setchell KDR, Grant MF, Forsythe D. (2003). Dietary phytoestrogens accelerate the time of vaginal opening in immature CD-1 mice. Comp. Med. 53:477-485.
(21) Ashby J, Tinwell H, Odum J, Kimber I, Brooks AN, Pate I, Boyle CC. (2000). Diet and the aetiology of temporal advances in human and rodent sexual development. J. Appl. Toxicol.20:343-347.
(22) Thigpen JE, Lockear J, Haseman J, Saunders HE, Caviness G, Grant MF, Forsythe DB. (2002). Dietary factors affecting uterine weights of immature CD-1 mice used in uterotrophic bioassays. Cancer Detect. Prev. 26:381-393.
(23) Thigpen JE, Li L-A, Richter CB, Lebetkin EH, Jameson CW. (1987). The mouse bioassay for the detection of estrogenic activity in rodent diets: I. A standardized method for conducting the mouse bioassay. Lab. Anim. Sci.37:596-601.
(24) OECD (2008). Acute oral toxicity - upanddown procedure. OECD Guideline for the testing of chemicals No 425.
(25) OECD (2000). Guidance document on the recognition, assessment and use of clinical signs as humane endpoints for experimental animals used in safety evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment No 19. ENV/JM/MONO(2000)7.
(26) OECD (2001). Guidance document on acute oral toxicity. Environmental Health and Safety Monograph Series on Testing and Assessment No 24. ENV/JM/MONO(2001)4.
(27) Bulbring, E., and Burn, J.H. (1935). The estimation of oestrin and of male hormone in oily solution. J. Physiol. 85:320-333.
(28) Dorfman, R.I., Gallagher, T.F. and Koch, F.C (1936). The nature of the estrogenic substance in human male urine and bull testis. Endocrinology 19:33-41.
(29) Reel, J.R., Lamb IV, J.C. and Neal, B.H. (1996). Survey and assessment of mammalian estrogen biological assays for hazard characterization. Fundam. Appl. Toxicol. 34:288-305.
(30) Jones, R.C. and Edgren, R.A. (1973). The effects of various steroid on the vaginal histology in the rat. Fertil. Steril. 24:284-291.
(31) OECD (1982). Organization for Economic Cooperation and Development - Principles of Good Laboratory Practice, ISBN 92-64-12367-9, Paris.
(32) Dorfman R.I. (1962). Methods in Hormone Research, Vol. II, Part IV: Standard Methods Adopted by Official Organization. New York, Academic Press.
(33) Thigpen J.E. et al. (2004). Selecting the appropriate rodent diet for endocrine disruptor research and testing studies. ILAR J 45(4):401-416.
(34) Gray L.E. and Ostby J. (1998). Effects of pesticides and toxic substances on behavioral and morphological reproductive development: endocrine versus nonendocrine mechanism. Toxicol Ind Health. 14(1-2):159-184.
(35) Booth AN, Bickoff EM and Kohler GO. (1960). Estrogenlike activity in vegetable oils and mill byproducts. Science, 131:1807-1808.
(36) Kato H, Iwata T, Katsu Y, Watanabe H, Ohta Y, Iguchi T (2004). Evaluation of estrogenic activity in diets for experimental animals using in vitro assay. J. Agric Food Chem. 52, 1410-1414.
(37) OECD (2007). Guidance Document on the Uterotrophic Bioassay Procedure to Test for Antioestrogenicity. Series on Testing and Assessment. No. 71.
(38) Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (ABl. Nr. L 276 vom 20.10.2010 S. 33).
B.55. Hershberger-Bioassay mit Ratten: Ein Kurzzeit-Screening-Test auf (Anti-)androgene Eigenschaften 14
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 441 (2009). Die OECD setzte sich 1998 zur Priorität, bestehende Prüfrichtlinien für Screening und Testung potenzieller endokriner Disruptoren zu überarbeiten und neue Richtlinien zu entwickeln (1). Ein Aspekt der Maßnahme war die Ausarbeitung einer Prüfrichtlinie für den Hershberger-Bioassay (Hershberger-Test) mit Ratten. Diese Prüfung wurde, nachdem sie über mehrere Jahrzehnte hinweg von der pharmazeutischen Industrie angewendet worden war, erstmals 1962 durch einen offiziellen Fachausschuss als Screening-Instrument für androgene Chemikalien standardisiert (2). Im Zeitraum 2001-2007 wurde der Hershberger-Test mit Ratten einem umfassenden Validierungsprogramm unterzogen, in dessen Rahmen ein Hintergrunddokument (23), ein ausführliches Methodikpapier (3) und ein Sektionsleitfaden (21) erstellt sowie umfassende Intra- und Interlaborstudien durchgeführt wurden, um die Zuverlässigkeit und Reproduzierbarkeit des Bioassays nachzuweisen. Diese Validierungsstudien wurden mit einem starken Referenzandrogen (Testosteronpropionat, TP), zwei starken synthetischen Androgenen (Trenbolonacetat und Methyltestosteron), einem stark antiandrogenen Arzneistoff (Flutamid), einem starken Inhibitor (Finasterid) der Synthese des natürlichen Androgens (Dihydrotestosteron, DHT), mehreren schwach antiandrogenen Pestiziden (Linuron, Vinclozolin, Procymidon, p,p2-DDE), einem starken Inhibitor der 5α-Reduktase (Finasterid) und zwei bekannt negativen Chemikalien (Dinitrophenol und Nonylphenol) (4)(5)(6)(7)(8) durchgeführt. Die vorliegende Prüfmethode ist das Resultat der jahrzehntelangen Anwendung des Bioassays in der Praxis und der bei der Validierung des Prüfprogramms gewonnenen Erfahrungen und Ergebnisse auf diesem Gebiet.
2. Der Hershberger-Test ist ein in vivo durchgeführter Kurzzeit-Screening-Test, bei dem akzessorische Gewebe des männlichen Reproduktionstrakts untersucht werden. Der Test wurde erstmals in den 1930er-Jahren durchgeführt und in den 1940er-Jahren um die Anwendung auf Muskeln des männlichen Fortpflanzungstrakts erweitert, die auf Androgene reagieren (2)(9-15). In den 1960er-Jahren wurden über 700 potenzielle Androgene anhand eines standardisierten Prüfplans (2)(14) beurteilt; die Verwendung des Tests galt damals sowohl für Androgene als auch für Antiandrogene als Standardmethode (2)(15). Bei der vorliegenden Invivo-Prüfung werden die Gewichtsveränderungen bei fünf Arten androgenabhängiger Gewebe an kastrierten, peripubertären Rattenmännchen untersucht. Es wird beurteilt, ob eine Chemikalie biologische Abläufe auslöst, die der Wirkung von Androgenagonisten, Androgenantagonisten oder 5α-Reduktaseinhibitoren entsprechen. Bei den fünf androgenabhängigen Zielgeweben der vorliegenden Prüfmethode handelt es sich um die ventrale Prostata (VP), das Samenbläschen (SB) (einschließlich Flüssigkeiten und Koagulationsdrüse), den Muskelkomplex Musculus levator ani und bulbospongiosus (LABC), die paarigen Cowperschen Drüsen (COW) und die Glans penis (GP). Bei der kastrierten, peripubertären männlichen Ratte reagieren alle diese fünf Gewebe mit einer Erhöhung ihres absoluten Gewichts auf Androgene. Wird bei denselben fünf Geweben eine Gewichtszunahme durch Verabreichung eines starken Referenzandrogens stimuliert, so reagieren diese auf die Gabe von Antiandrogenen mit einer Verringerung ihres absoluten Gewichts. Das primäre Modell für den Hershberger-Test, das in den Phasen 1, 2 und 3 des Hershberger-Validierungsprogramms validiert wurde, war das chirurgisch kastrierte, peripubertäre Rattenmännchen.
3. Der Hershberger-Bioassay wird als mechanistischer Invivo-Screening-Test auf Androgenagonisten, Androgenantagonisten und 5a-Reduktaseinhibitoren eingesetzt und ist im Kontext des Rahmenkonzepts der OECD, Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals" (Testung und Bewertung endokrin wirksamer Substanzen (endokrine Disruptoren) (Anlage 2) zu sehen. In diesem Rahmenkonzept ist der Hershberger-Test ein Invivo-Test der Stufe 3, mit dem Daten über einen einzelnen endokrinen Mechanismus gewonnen werden sollen, nämlich die (anti-)androgene Wirkung. Die Prüfung ist als Teil einer Reihe von Invitro- und Invivo- Tests zur Bestimmung von Chemikalien konzipiert, die das Potenzial haben, mit dem endokrinen System in Wechselwirkung zu treten, und soll letztendlich der Bewertung des Risikos für die Umwelt und die menschliche Gesundheit dienen.
4. Da aus Tierschutzgründen Bedenken gegen das Kastrationsverfahren bestanden, wurde als alternatives Modell für den Hershberger-Test die Verwendung des intakten (unkastrierten) abgesetzten, stimulierten männlichen Jungtiers angestrebt, damit die Kastration vermieden werden kann. Die Prüfmethode mit dem stimulierten, abgesetzten Tier wurde einer Validierung unterzogen (24), bei der sich allerdings herausstellte, dass diese Variante des Hershberger- Tests offenbar nicht geeignet ist, die Auswirkungen schwach wirksamer Antiandrogene in den geprüften Dosierungen auf das Gewicht androgenabhängiger Organe zuverlässig nachzuweisen. Daher wurde sie nicht in die vorliegende Prüfmethode aufgenommen. Da diese Prüfvariante jedoch nicht nur unter Tierschutzgesichtspunkten sinnvoll ist, sondern möglicherweise auch Aufschluss über andere Wirkungsweisen geben kann, ist sie im OECD Guidance Document Nr. 115 (25) beschrieben.
Ausgangsüberlegungen und Begrenzungen
5. Androgenagonisten und -antagonisten können an die Androgenrezeptoren binden und die vom Rezeptor gesteuerte Gentranskription aktivieren bzw. hemmen. Darüber hinaus hemmen manche Chemikalien bei einigen androgenempfindlichen Zielgeweben die Umwandlung von Testosteron in das stärker wirksame natürliche Androgen Dihydrotestosteron (5a-Reduktasehemmer). Solche Chemikalien sind potenziell gesundheitsschädlich und können unter anderem negative Auswirkungen auf Reproduktion und Entwicklung haben. Aus diesem Grund müssen Chemikalien möglichst schnell daraufhin geprüft und beurteilt werden können, ob es sich um potenzielle Androgenagonisten, -antagonisten oder 5a-Reduktaseinhibitoren handelt. Die Affinität eines Liganden für einen Androgenrezeptor, die in vitro durch Rezeptorbindungstests oder transkriptionelle Aktivierung von Reportergenen bestimmt werden kann, liefert zwar wertvolle Informationen, ist aber nur eine von mehreren Determinanten für das Gefahrenpotenzial. Andere Determinanten können die metabolische Aktivierung und Deaktivierung beim Eintritt in den Körper, die Verteilung auf die Zielgewebe und die Ausscheidung aus dem Körper sein. Daraus ergibt sich die Notwendigkeit, die potenzielle Wirkung einer Chemikalie in vivo unter einschlägigen Bedingungen und bei entsprechender Exposition zu prüfen. Die Invivo-Beurteilung ist weniger kritisch, wenn die Eigenschaften der Chemikalie hinsichtlich Resorption, Verteilung, Metabolismus und Ausscheidung (ADME) bekannt sind. Androgenabhängige Gewebe reagieren mit schnellem und starkem Wachstum auf eine Stimulation mit Androgenen, was insbesondere für kastrierte, peripubertäre Rattenmännchen gilt. Die Verwendung von Nagerarten, insbesondere Ratten, ist zudem bei Toxizitätsstudien zur Beurteilung des Gefahrenpotenzials weit verbreitet. Daher ist die vorliegende Variante der Prüfmethode, bei der die fünf genannten Zielgewebe an kastrierten, peripubertären Ratten untersucht werden, für das Invivo-Screening von Androgenagonisten, Androgenantagonisten und 5a-Reduktaseinhibitoren geeignet.
6. Dieser Prüfmethode liegen die Prüfpläne der OECD-Validierungsstudie zugrunde, sich in Intra- und Interlaborstudien als zuverlässig und wiederholbar erwiesen haben (4)(5)(6)(7)(8). Die Prüfmethode umfasst Nachweisverfahren sowohl für eine androgene als auch für eine antiandrogene Wirkung.
7. Obgleich die verschiedenen Laboratorien, die den Hershberger-Bioassay im Rahmen des Validierungsprogramms der OECD durchgeführt haben, relativ unterschiedliche TP-Dosen für den Nachweis von Antiandrogenen verwendeten (0,2 versus 0,4 mg pro kg und Tag, subkutane Injektion), unterschieden sich diese beiden Prüfplanvarianten in Bezug auf die Eignung für den Nachweis schwacher oder starker antiandrogener Wirkungen nur geringfügig. Selbstverständlich darf jedoch die TP-Dosis weder so hoch sein, dass die Wirkungen von schwachen Androgenrezeptor-Antagonisten (AR-Antagonisten) blockiert werden, noch so niedrig, dass die androgenen Gewebe selbst dann kaum Wachstum zeigen, wenn nicht gleichzeitig Antiandrogene verabreicht werden.
8. Die Wachstumsreaktion der einzelnen androgenabhängigen Gewebe ist nicht ausschließlich androgenen Ursprungs, d. h. auch Chemikalien, die keine Androgenagonisten sind, können das Gewicht bestimmter Gewebe beeinflussen. Wenn mehrere Gewebe gleichzeitig mit Wachstum reagieren, erhärtet das jedoch den Verdacht, dass ein überwiegend androgenspezifischer Mechanismus vorliegt. Beispielsweise können hohe Dosen starker Östrogene zu einer Gewichtszunahme der Samenbläschen führen; die anderen androgenabhängigen Gewebe des Tests reagieren jedoch nicht in ähnlicher Weise. Antiandrogene Chemikalien können entweder als Androgenrezeptorantagonisten oder als 5a-Reduktaseinhibitoren wirken. 5a-Reduktaseinhibitoren wirken unterschiedlich, weil die Umwandlung in das wirksamere Dihydrotestosteron von Gewebe zu Gewebe variiert. Antiandrogene, die die 5a-Reduktase hemmen, wie zum Beispiel Finasterid, wirken sich im Vergleich zu einem starken AR-Antagonisten wie Flutamid stärker auf die ventrale Prostata aus als auf andere Gewebe. Diese unterschiedliche Gewebereaktion kann für eine Differenzierung zwischen AR-vermittelter und 5a-Reduktasevermittelter Wirkungsweise herangezogen werden. Ferner ist der Androgenrezeptor evolutionsbedingt mit den Rezeptoren anderer Steroidhormone verwandt, und einige andere Hormone können in hohen, supraphysiologischen Dosen die wachstumsfördernden Effekte von TP binden und ihnen entgegenwirken (13). Des Weiteren leuchtet es ein, dass ein verbesserter Steroidmetabolismus und eine darauf folgende Senkung des Testosterons im Serum das Wachstum androgenabhängiger Gewebe verringern kann. Jedes positive Ergebnis des Hershberger-Tests sollte daher normalerweise anhand eines WoE-Ansatzes beurteilt werden; dazu gehören Invitro-Tests wie die AR- und ER-Bindungstests (ER - Östrogenrezeptor) und entsprechende Tests zur transkriptionellen Aktivierung oder die Ergebnisse anderer Invivo-Tests, bei denen ähnliche androgene Zielgewebe untersucht werden, zum Beispiel der Test am pubertären Männchen, die 15-Tage-Untersuchung am intakten Männchen oder Studien mit wiederholter Gabe über 28 oder 90 Tage.
9. Die Erfahrung hat gezeigt, dass xenobiotische Androgene seltener vorkommen als xenobiotische Antiandrogene. Es ist daher davon auszugehen, dass der Hershberger-Bioassay überwiegend für das Screening von Antiandrogenen eingesetzt werden wird. Die Prüfung auf androgene Wirkungen wäre dennoch für steroidale oder steroidähnliche Chemikalien oder auch für Chemikalien zu empfehlen, bei denen die Prüfungen der Stufe 1 oder 2 des Rahmenkonzepts (Anlage 2) Hinweise auf ein androgenes Potenzial ergeben haben. Ebenso können bei Prüfungen der Stufe 5 unerwünschte Wirkungen beobachtet werden, die mit (anti-)androgenen Profilen assoziiert sind, sodass bewertet werden muss, ob eine Chemikalie eine endokrine Wirkungsweise hat.
10. Es wird darauf hingewiesen, dass bei allen tierexperimentellen Verfahren die örtlichen Standards der Versuchstierpflege einzuhalten sind; die folgenden Pflege- und Behandlungsbeschreibungen sind Mindestanforderungen; Vorrang vor diesen Standards haben lokale Bestimmungen, zum Beispiel die Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (26). Eine weiterführende Anleitung für tierschutzgerechte Behandlung von Versuchstieren ist in dem OECD Guidance Document (17) enthalten.
11. Wie bei allen Bioassays mit Versuchstieren ist sorgfältig abzuwägen, ob die Durchführung der Studie notwendig ist. Grundsätzlich sprechen die folgenden beiden Gründe für eine Durchführung:
- Es liegt ein hohes Expositionspotenzial (Stufe 1 des Rahmenkonzepts) vor, oder bei Invitro-Tests (Stufe 2) werden Anzeichen für eine (anti-)androgene Wirkung festgestellt, aufgrund deren abgeklärt werden muss, ob solche Effekte auch in vivo vorkommen können.
- Bei den Invivo-Tests der Stufe 4 oder 5 werden Effekte festgestellt, die einer (anti-)androgenen Wirkung entsprechen; in diesem Fall sollte bei weiteren Untersuchungen die spezifische Wirkungsweise untersucht bzw. bestimmt werden, ob die Effekte auf einen (anti-)androgenen Mechanismus zurückzuführen sind.
12. Die für die Zwecke dieser Prüfmethode verwendeten Begriffe sind in Anlage 1 definiert.
13. Die Empfindlichkeit des Hershberger-Bioassays beruht auf der Verwendung männlicher Tiere mit minimaler endogener Androgenproduktion. Dies wird durch den Einsatz kastrierter Männchen erreicht, denen nach der Kastration ausreichend Zeit eingeräumt wurde, damit die Zielgewebe sich wieder auf eine einheitliche Mindestgröße, die Baseline- bzw. Ausgangsgröße des Versuchs, zurückbilden können. Dadurch ist beim Screening auf ein androgenes Potenzial der Spiegel an zirkulierenden endogenen Androgenen niedrig, die Hypothalamus-Hypophysen-Gonaden- Achse kann dies nicht über Feedbackmechanismen kompensieren, die Reaktionsfähigkeit der Gewebe ist maximiert, und das Gewebegewicht bei Studienbeginn schwankt so wenig wie möglich. Wenn das antiandrogene Potenzial untersucht werden soll, kann durch die Stimulation mit einem Referenzandrogen eine konsistentere Gewebegewichtszunahme erreicht werden. Folglich sind beim Hershberger-Bioassay nur sechs Tiere pro Dosisgruppe erforderlich, während bei anderen Tests mit intakten pubertären oder adulten Männchen 15 Tiere pro Dosisgruppe verwendet werden sollten.
14. Die peripubertären Rattenmännchen werden in geeigneter Weise unter Verwendung zugelassener Narkosemittel und steriler Arbeitstechniken kastriert. In den ersten Tagen nach dem Eingriff sollten zur Vermeidung postoperativer Beschwerden Analgetika verabreicht werden. Durch eine Kastration wird die Genauigkeit der Prüfung verbessert: schwache Androgene und Antiandrogene sind leichter nachweisbar, weil kompensatorische endokrine Feedbackmechanismen ausgeschaltet werden, die beim intakten Tier die Wirkungen der verabreichten Androgene und Antiandrogene abschwächen können, und weil die starken Schwankungen der Serumtestosteronspiegel zwischen den einzelnen Tieren beseitigt werden. Demzufolge wird durch die Kastration die Anzahl der Tiere verringert, die für das Screening dieser endokrinen Wirkungen benötigt werden.
15. Beim Screening auf eine potenzielle androgene Wirkung ist die Prüfsubstanz täglich über einen Zeitraum von zehn aufeinanderfolgenden Tagen per Schlundsonde oder durch subkutane Injektion zu verabreichen. Es sind mindestens zwei Versuchstiergruppen mit den Prüfsubstanzen zu behandeln, wobei pro Gruppe eine Dosisstufe getestet wird. Etwa 24 Stunden nach der letzten Dosisgabe werden die Tiere seziert. Eine statistisch signifikante Gewichtszunahme bei mindestens zwei Zielorganen der Prüfsubstanzgruppen im Vergleich zur Vehikelkontrollgruppe ist ein Hinweis darauf, dass die Prüfsubstanz potenziell eine androgene Wirkung hat (vgl. Nummer 60). Androgene wie Trenbolon, die nicht durch die 5a-Reduktase umgewandelt werden können, haben ausgeprägtere Wirkungen auf den LABC-Komplex und die GP als TP, doch sollte bei allen Geweben eine Gewichtszunahme zu verzeichnen sein.
16. Beim Screening auf eine potenzielle antiandrogene Wirkung ist die Prüfsubstanz täglich über einen Zeitraum von zehn aufeinanderfolgenden Tagen per Schlundsonde oder durch subkutane Injektion zu verabreichen, und zwar bei gleichzeitiger subkutaner Gabe von TP (0,2 bzw. 0,4 mg pro kg und Tag). Im Laufe des Validierungsverfahrens wurde festgelegt, dass entweder 0,2 oder 0,4 mg TP pro kg und Tag gegeben werden können, da Antiandrogene mit beiden Dosen wirksam nachgewiesen werden konnten und deshalb nur eine der beiden Dosen zur Verwendung bei der Prüfung ausgewählt werden sollte. Die abgestuften Dosen der Prüfsubstanz werden mindestens drei Behandlungsgruppen verabreicht, wobei pro Gruppe eine Dosisstufe getestet wird. Etwa 24 Stunden nach der letzten Dosisgabe werden die Tiere seziert. Eine statistisch signifikante Gewichtsabnahme bei mindestens zwei Zielorganen der Gruppen, die die Prüfsubstanz plus TP erhalten haben, im Vergleich zur Kontrollgruppe, die nur TP erhalten hat, ist ein Hinweis darauf, dass die Prüfsubstanz potenziell eine antiandrogene Wirkung hat (vgl. Nummer 61).
Auswahl der Tierart und des Stamms
17. Ratten werden seit den 1930er-Jahren routinemäßig für den Hershberger-Bioassay verwendet. Obwohl aus biologischer Sicht plausibel ist, dass Ratten und Mäuse ähnliche Reaktionen zeigen würden, ist die Ratte nach 70 Jahren Erfahrung mit dem Rattenmodell die Spezies der Wahl für den Hershberger-Test. Da die anhand des Hershberger- Tests erhobenen Daten gegebenenfalls später als Vorstudie für eine mehrere Generationen umfassende Langzeitstudie dienen, können somit ferner Tiere derselben Art, desselben Stamms und derselben Herkunft für beide Studienarten verwendet werden.
18. Laut dem vorliegenden Prüfplan können die Labore den für die Prüfung zu verwendenden Rattenstamm selbst auswählen, wobei es sich im Allgemeinen um den bereits in der Vergangenheit üblicherweise von dem teilnehmenden Labor verwendeten Stamm handeln sollte. Es können üblicherweise verwendete Laborrattenstämme eingesetzt werden; allerdings ist von der Verwendung von Stämmen abzusehen, bei denen die Geschlechtsreife wesentlich später als am 42. Lebenstag einsetzt, da die Kastration dieser Männchen am 42. Lebenstag die Gewichtsbestimmung der Glans Penis, die nur nach der Separation des Präputiums vom Penisschaft erfolgen kann, unmöglich machen kann. Aus diesem Grund sollten, außer in Ausnahmefällen, keine von der Fisher-344-Ratte abstammenden Stämme eingesetzt werden. Bei der Fisher-344-Ratte hat die sexuelle Entwicklung einen anderen zeitlichen Verlauf als bei anderen häufiger verwendeten Stämmen wie zum Beispiel Sprague Dawley oder Wistar (16). Wenn ein solcher Stamm verwendet werden soll, sollte das Labor die Tiere zu einem etwas späteren Zeitpunkt kastrieren und es sollte die Empfindlichkeit des eingesetzten Stamms belegen können. Das Labor muss die Wahl des Rattenstamms klar begründen. Dient der Screening-Test gegebenenfalls als Vorstudie zu einer Prüfung mit wiederholter oraler Gabe, einer Prüfung auf Reproduktions- und Entwicklungstoxizität oder einer Langzeitstudie, sollten für alle Prüfungen möglichst Tiere desselben Stamms und derselben Herkunft verwendet werden.
Haltungs- und Fütterungsbedingungen
19. Bei allen Verfahren sind die örtlichen Standards der Versuchstierpflege einzuhalten. Bei diesen Pflege- und Behandlungsbeschreibungen handelt es sich um Mindestanforderungen; Vorrang haben strengere lokale Rechtsvorschriften, wie zum Beispiel die Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (26). Die Temperatur im Versuchstierraum sollte 22 °C (± 3 °C) betragen. Die relative Luftfeuchtigkeit sollte mindestens 30 % betragen und - außer beim Reinigen des Raums - 70 % nicht überschreiten. Angestrebt werden sollte eine Luftfeuchtigkeit von 50-60 %. Die Beleuchtung sollte künstlich sein. Die Hell- und Dunkelphasen sollten sich im Abstand von 12 Stunden abwechseln.
20. Eine Unterbringung in der Gruppe ist aufgrund des geringen Alters der Tiere und der Tatsache, dass Ratten soziale Wesen sind, einer Haltung im Einzelkäfig vorzuziehen. Durch eine Unterbringung von zwei oder drei Tieren pro Käfig werden Enge und damit verbundener Stress vermieden, der sich wiederum auf die hormonelle Steuerung der Entwicklung der akzessorischen Gewebe des Reproduktionstrakts auswirken kann. Die Käfige sollten gründlich gereinigt werden, um etwaige Schad- und Schmutzstoffe zu beseitigen, und so angeordnet werden, dass etwaige Einflüsse der Käfigplatzierung minimiert werden. Eine Überbelegung ist durch angemessen große Käfige (~ 2.000 cm2) zu vermeiden.
21. Die Tiere sind einzeln und auf möglichst schmerzlose Weise zu kennzeichnen (z.B. durch eine Ohrmarke). Die Kennzeichnungsmethode ist zu protokollieren.
22. Labornahrung und Trinkwasser sind ad libitum bereitzustellen. Laboratorien, die den Hershberger-Bioassay durchführen, sollten die Labornahrung verfüttern, die sie üblicherweise bei Chemikalienprüfungen verwenden. Im Laufe der Validierungsstudien zu dem Bioassay traten keine Wirkungen oder Schwankungen auf, die der Nahrung zugeschrieben werden konnten. Die verwendete Nahrung ist zu protokollieren, und eine Probe des Laborfutters ist für potenzielle zukünftige Analysezwecke aufzubewahren.
Leistungskriterien für androgenabhängige Organgewichte
23. Während der Validierungsstudie gab es keinerlei Anzeichen dafür, dass sich eine Verringerung des Körpergewichts auf die Erhöhung oder Verringerung der Gewichte der Zielgewebe (also der im Laufe des Tests zu wiegenden Gewebe) auswirkt.
24. Bei den verschiedenen, im Rahmen des Validierungsprogramms erfolgreich eingesetzten Rattenstämmen waren die Gewichte der androgenabhängigen Organe bei den schwereren Rattenstämmen höher als bei den leichteren Stämmen. Daher beinhalten die Leistungskriterien des Hershberger-Bioassays keine absoluten erwarteten Organgewichte für die positiven und negativen Kontrollen.
25. Da der Variationskoeffizient (VK) für ein Gewebe umgekehrt proportional zur Teststärke ist, basieren die Leistungskriterien des Hershberger-Bioassays auf maximalen VK-Werten für jedes Gewebe (Tabelle 1). Die VK-Werte stammen aus den Validierungsstudien der OECD. Bei negativen Ergebnissen sollten die Laboratorien die VK der Kontrollgruppe und der Behandlungsgruppe mit der höchsten Dosis prüfen, um feststellen zu können, ob die maximalen VK-Leistungskriterien überschritten wurden.
26. Die Studie sollte wiederholt werden, wenn 1) mindestens drei der zehn möglichen Einzel-VK in der Kontroll- und in der Hochdosisgruppe die für Prüfungen auf Agonisten und Antagonisten in Tabelle 1 festgelegten Höchstwerte überschreiten und 2) wenn mindestens zwei Zielgewebe marginal nicht signifikant sind (d. h. r-Werte zwischen 0,05 und 0,10).
Tabelle 1: Maximal zulässige VK für akzessorische Zielgewebe des Reproduktionstrakts im Modell mit kastrierten Tieren laut OECD-Validierungsstudien 1
| Gewebe | Antiandrogene Wirkungen | Androgene Wirkungen |
| Samenbläschen | 40 % | 40 % |
| Ventrale Prostata | 40 % | 45 % |
| LABC | 20 % | 30 % |
| Cowpersche Drüsen | 35 % | 55 % |
| Glans penis | 17 % | 22 % |
_______
1) Der Schwellenwert des Variationskoeffizienten für ein gegebenes Gewebe wurde anhand einer (fortlaufend vom kleinsten zum größten Wert aufgebauten) VK-Kurve ermittelt, in der alle Durchschnittswerte aller Versuche der Validierungsprüfung unter Verwendung eines spezifischen Modells (Agonisten oder Antagonisten) enthalten waren. Der VK-Schwellenwert wurde vom, Bruchpunkt" abgeleitet, also dem Punkt, ab dem die Abstände zu den nächsthöheren VK in der Reihe erheblich größer sind als zu den vorhergehenden VK. Es ist anzumerken, dass mit dieser Analyse zwar relativ zuverlässige, Bruchpunkte" für das antagonistische Prüfmodell ermittelt werden konnten, dass die VK-Kurven für die Prüfung auf Agonisten allerdings einen einheitlicheren Anstieg zeigten, was dazu führte, dass die Festlegung eines Schwellen-VK mittels dieser Methode in gewisser Weise willkürlich erfolgte.
Konformität mit Vorschriften und Eignungsprüfung des Prüflaboratoriums
27. Anders als bei dem Uterotrophie-Test (Kapitel B.54 dieses Anhangs) ist ein Nachweis der Laborkompetenz vor Studienbeginn beim Hershberger-Test nicht notwendig, weil gleichzeitige Positivkontrollen (mit Testosteronpropionat und Flutamid) und Negativkontrollen integraler Bestandteil der Prüfung sind.
Zahl und Zustand der Versuchstiere
28. Die Behandlungs- und Kontrollgruppen bestehen jeweils aus mindestens sechs Tieren. Dies gilt sowohl für den Prüfplan zur Untersuchung androgener Wirkungen als auch für den zur Untersuchung antiandrogener Wirkungen.
Kastration
29. Den Tieren sollte nach ihrer Ankunft mehrere Tage Zeit gegeben werden, sich zu akklimatisieren, um sicherzugehen, dass sie ges- und sind und gut gedeihen. Da Tiere, die vor dem 42. Lebenstag bzw. dem postnatalen Tag 42 (PND 42) kastriert werden, gegebenenfalls noch keine Präputialseparation zeigen, sollte die Kastration frühestens am PND 42 durchgeführt werden, nicht vorher. Die Tiere werden unter Narkose durch Aufschneiden des Skrotums und Entfernung beider Hoden und Nebenhoden kastriert; die Blutgefäße und Samenleiter werden ligiert. Wenn sichergestellt ist, dass keine Blutung besteht, sollte das Skrotum vernäht oder mit chirurgischen Klammern geschlossen werden. In den ersten Tagen nach dem Eingriff sollten die Tiere Analgetika erhalten, um die postoperativen Beschwerden zu lindern. Wenn bereits kastrierte Tiere von einem Versuchstieranbieter erworben werden, sind Alter und Stadium der Geschlechtsreife vom Anbieter zu bescheinigen.
Akklimatisierung nach der Kastration
30. Die Anpassung der Tiere an die Laborbedingungen sollte nach der Kastration mindestens sieben Tage lang fortgesetzt werden, damit sich das Gewicht der Zielorgane zurückbilden kann. Die Tiere sollten täglich beobachtet werden, und Tiere, die Anzeichen für eine Krankheit oder physische Abnormitäten zeigen, sind aus der Studie zu nehmen. Mit der Behandlung bzw. der ersten Dosisgabe (der Studie) kann somit zwischen PND 49 (frühester Termin) und PND 60 (spätester Termin) begonnen werden. Die Nekropsie sollte spätestens am Tag PND 70 durchgeführt werden. Diese Flexibilität lässt den Laboratorien genügend Raum für eine effiziente Versuchsplanung.
Körpergewicht und Randomisierung der Gruppen
31. Unterschiede beim individuellen Körpergewicht tragen zu Schwankungen der Gewebegewichte bei, und zwar sowohl innerhalb der Tiergruppen als auch zwischen den Gruppen. Verstärkte Gewebegewichtsschwankungen führen zu einem höheren Variationskoeffizienten (VK) und verringern die (manchmal auch als Testempfindlichkeit bezeichnete) Teststärke der Prüfung. Daher sollten Schwankungen des Körpergewichts sowohl experimentell als auch statistisch begrenzt werden.
32. Auf experimenteller Ebene sollte angestrebt werden, die Schwankungen der Körpergewichte sowohl innerhalb der Prüfgruppen als auch zwischen ihnen zu verringern. Erstens ist die Verwendung ungewöhnlich kleiner oder großer Tiere zu vermeiden. Diese sollten nicht in die Studienkohorte aufgenommen werden. Zu Beginn der Studie sollte das Gewicht der Versuchstiere nicht um mehr als ± 20 % des Durchschnittsgewichts schwanken (z.B. 175 g ± 35 g bei kastrierten, peripubertären Ratten). Zweitens sollten die Tiere durch randomisierte Gewichtsverteilung den Kontroll- und Behandlungsgruppen zugewiesen werden, sodass das durchschnittliche Körpergewicht der einzelnen Gruppen sich statistisch nicht von dem der anderen Gruppen unterscheidet. Das angewendete Block-Randomisierungsverfahren ist zu protokollieren.
33. Da Toxizität zu einer Abnahme des Körpergewichts bei den Behandlungsgruppen im Vergleich zur Kontrollgruppe führen kann, könnte statt des Körpergewichts bei Nekropsie das Körpergewicht am ersten Verabreichungstag der Prüfsubstanz als statistische Kovariate herangezogen werden.
Dosierung
34. Um festzustellen, ob eine Prüfsubstanz in vivo eine androgene Wirkung entfalten kann, sind normalerweise zwei Dosisgruppen mit Prüfsubstanz plus positive Kontrollgruppe und Vehikelkontrollgruppe (negative Kontrollgruppe) (siehe Nummer 43) ausreichend, weshalb dieser Versuchsanordnung aus Tierschutzgründen der Vorrang eingeräumt werden sollte. Wenn der Zweck des Versuchs entweder die Erstellung einer Dosis-Wirkungs-Kurve oder die Umrechnung auf niedrigere Dosen ist, sind mindestens drei Dosisgruppen erforderlich. Wenn Informationen gewonnen werden sollen, die über das Vorhandensein einer androgenen Wirkung hinausgehen (wie zum Beispiel eine Einschätzung der Wirkstärke), sollte ein anderer Dosierungsplan in Betracht gezogen werden. Bei einem Test auf antiandrogene Eigenschaften wird die Prüfsubstanz zusammen mit einem Referenz-Androgenagonisten verabreicht. Es sind mindestens drei Prüfgruppen mit verschiedenen Dosen der Prüfsubstanz sowie eine positive und eine negative Kontrollgruppe (vgl. Nummer 44) zu verwenden. Abgesehen von der Behandlung mit der Prüfsubstanz sollten die Tiere der Kontrollgruppe genauso behandelt werden wie die Tiere in den Prüfgruppen. Wird die Prüfsubstanz mit einem Vehikel verabreicht, erhält die Kontrollgruppe das Vehikel im höchsten bei den Prüfgruppen verwendeten Volumen.
35. Bei der Wahl der Dosisstufen sind sämtliche für die Prüfsubstanz oder verwandte Stoffe vorliegenden Daten zur Toxizität und (Toxiko-)Kinetik zu berücksichtigen. Bei der Festlegung der höchsten Dosisstufe sollten erstens der LD50-Wert und/oder Angaben zu einer akuten Toxizität berücksichtigt werden, um den Tod oder starkes Leiden und Qualen der Tiere zu vermeiden (17)(18)(19)(20), und zweitens sind Daten zu Prüfungen auf subchronische und chronische Toxizität heranzuziehen. Im Allgemeinen sollte die höchste Dosis nicht zu einer Verringerung des finalen Körpergewichts der Tiere um mehr als 10 % im Vergleich zur Kontrollgruppe führen. Die höchste Dosis sollte entweder 1) die höchste Dosis sein, bei der die Tiere auf jeden Fall überleben und nach Verabreichung an zehn aufeinanderfolgenden Tagen von bis zu 1.000 mg pro kg und Tag (Höchstdosis) (vgl. Nummer 36) keine signifikanten Toxizitäts- oder Leidenszeichen aufweisen, oder 2) eine Dosis, die (anti-)androgene Wirkungen hervorruft, je nachdem, welche der beiden Dosen niedriger ist. Für Screeningzwecke sind große Intervalle, z.B. eine halbe logarithmische Einheit (entsprechend einer Dosissteigerung um den Faktor 3,2) oder sogar eine volle logarithmische Einheit zwischen den Dosierungen akzeptabel. Liegen keine geeigneten Daten vor, kann unterstützend eine Dosisfindungsstudie (siehe Nummer 37) zur Bestimmung der zu verwendenden Dosen durchgeführt werden.
Grenzdosisstufe
36. Treten bei der Grenzdosis von 1.000 mg pro kg Körpergewicht und Tag und bei einer niedrigeren Dosis unter Anwendung der für diese Studie beschriebenen Verfahren keine statistisch signifikanten Änderungen bei den Gewichten der Reproduktionsorgane auf, so kann auf zusätzliche Dosisstufen gegebenenfalls verzichtet werden. Vom Konzept der Grenzdosis ist nur dann abzuweichen, wenn die Daten zur menschlichen Exposition darauf hindeuten, dass eine höhere Dosisstufe notwendig ist.
Ausführungen zur Dosisfindung
37. Sofern erforderlich können die geeigneten Dosisgruppen in einer Dosisfindungsstudie mit wenigen Tieren ausgewählt [unter Anwendung der Methoden für die Prüfung auf akute Toxizität (Kapitel B.1 bis und B.1 tris des vorliegenden Anhangs (27), OECD TG 425 (19))]. Das Ziel beim Hershberger-Test ist die Auswahl von Dosen, bei denen die Tiere auf jeden Fall überleben und nach zehn aufeinanderfolgenden Tagen mit einer Chemikaliengabe von maximal 1.000 mg pro Kilogramm und Tag (siehe Nummern 35 und 36) keine signifikante Toxizität oder sonstiges Leiden aufweisen. Für eine Definition der klinischen Toxizitäts- oder Leidenszeichen bei den Tieren wird auf das OECD Guidance Document (17) verwiesen. Sofern es im Rahmen dieser Dosisfindungsstudie nach zehn Verabreichungstagen praktikabel ist, können die Zielgewebe etwa 24 Stunden nach der letzten Dosisgabe operativ entfernt und gewogen werden. Diese Daten können dann bei der Dosiswahl für die Hauptstudie unterstützend herangezogen werden.
Referenzchemikalien und Vehikel
38. Als Referenzandrogenagonist sollte Testosteronpropionat (TP), CAS Nr. 57-82-5, dienen. Die TP-Dosierungsmenge kann entweder 0,2 mg pro kg Körpergewicht und Tag oder 0,4 mg pro kg Körpergewicht und Tag betragen. Als Referenzandrogenantagonist sollte Flutamid (FT), CAS Nr. 1311-84-7, verwendet werden. Die FT-Dosierungsmenge sollte 3 mg pro kg Körpergewicht und Tag betragen, und FT sollte gleichzeitig mit der TP-Dosierung verabreicht werden.
39. Als Erstes sollte möglichst immer die Verwendung einer wässrigen Lösung/Suspension in Erwägung gezogen werden. Da aber viele Androgenliganden beziehungsweise ihre metabolischen Vorläufern eher hydrophob sind, ist der gängigste Ansatz die Verwendung einer Lösung/Suspension auf Ölbasis (z. 8. Mais-, Erdnuss-, Sesam- oder Olivenöl). Die Prüfsubstanzen können in einer sehr kleinen Menge 95 %igem Ethanol oder anderen geeigneten Lösungsmitteln gelöst und im Prüfvehikel auf ihre endgültigen Arbeitskonzentrationen verdünnt werden. Die toxischen Eigenschaften des Lösungsmittels sollten bekannt sein und in einer separaten Kontrollgruppe, in der nur das Lösungsmittel geprüft wird, getestet werden. Wenn die Prüfsubstanz als stabil erachtet wird, kann der Lösungsvorgang durch schonende Erwärmung und kräftige mechanische Einwirkung unterstützt werden. Die Stabilität der Prüfsubstanz im Vehikel sollte bestimmt werden. Ist die Prüfsubstanz für die Dauer der Studie stabil, kann eine Start-Aliquote der Substanz vorbereitet werden und die spezifizierten Dosierungsverdünnungen können täglich zubereitet werden, wobei darauf zu achten ist, dass die Proben nicht verunreinigt werden.
Verabreichung der Dosen
40. TP sollte durch subkutane Injektion verabreicht werden, FT über eine Schlundsonde.
41. Die Prüfsubstanz wird oral per Schlundsonde oder durch subkutane Injektion verabreicht. Bei der Wahl des Verabreichungswegs sind Tierschutzaspekte und die physikalisch-chemischen Eigenschaften der Prüfsubstanz zu berücksichtigen. Zusätzlich sind toxikologische Aspekte wie die Art der Humanexposition gegenüber der Chemikalie (z.B. Schlundsonde, um eine Aufnahme mit der Nahrung zu simulieren; subkutane Injektion, um Einatmen oder Aufnahme über die Haut am Modell zu testen) und die in der Fachliteratur genannten toxikologischen Angaben und Daten zu Verstoffwechselung und Kinetik (z.B. die Notwendigkeit, eine Firstpass-Metabolisierung zu vermeiden; bessere Effizienz über einen bestimmten Verabreichungsweg) in die Planung mit einzubeziehen, bevor umfassende Langzeitprüfungen durchgeführt werden, wenn durch Injektion positive Ergebnisse erzielt werden.
42. Die Tiere sollten die Dosierung an zehn aufeinanderfolgenden Tagen jeweils auf die gleiche Art und Weise, in der gleichen zeitlichen Abfolge und im Abstand von jeweils etwa 24 Stunden erhalten. Die Dosierungsstufe ist täglich auf der Grundlage des ebenfalls täglich bestimmten Körpergewichts anzupassen. Für jeden Expositionstag sind Dosisvolumen und Verabreichungszeit zu notieren. Es ist sorgfältig darauf zu achten, dass die unter Nummer 35 genannte Höchstdosis nicht überschritten wird, weil die Interpretation der Daten sonst nicht aussagekräftig ist. Vor diesem Hintergrund sind ein verringertes Körpergewicht, klinische Anzeichen und andere Befunde sorgfältig zu prüfen. Wird die Prüfsubstanz über eine Sonde verabreicht, sollte eine Schlundsonde oder eine geeignete Intubationskanüle verwendet werden. Das maximale Flüssigkeitsvolumen, das jeweils verabreicht werden kann, hängt von der Größe des Versuchstiers ab. Es sind die örtlichen Tierschutzrichtlinien zu befolgen, das Volumen sollte jedoch 5 ml pro kg Körpergewicht nicht überschreiten, außer bei wässrigen Lösungen, von denen 10 ml pro kg Körpergewicht gegeben werden können. Die subkutanen Injektionen sind mittels steriler Nadel (z.B. 23 oder 25 Gauge) und Tuberkulinspritze dorsal im Bereich der Schulterblätter oder in die Lendenregion zu applizieren. Die Injektionsstelle kann rasiert werden. Wenn Injektionsflüssigkeit verloren geht, an der Injektionsstelle ausläuft oder unvollständig verabreicht wird, ist dies zu protokollieren. Das insgesamt pro Ratte und Tag injizierte Volumen sollte 0,5 ml pro kg Körpergewicht nicht überschreiten.
Spezifische Vorgehensweise für Androgenagonisten
43. Bei der Prüfung auf Androgenagonisten ist die Vehikelkontrollgruppe die negative Kontrollgruppe und die mit TP behandelte Gruppe die positive Kontrollgruppe. Für die Untersuchung auf biologische Abläufe, die der Wirkung von Androgenagonisten entsprechen, werden den Behandlungsgruppen an zehn aufeinanderfolgenden Tagen ausgewählte Dosen einer Prüfsubstanz verabreicht wird. Die Gewichte der fünf akzessorischen Gewebe des Reproduktionstrakts der Tiere der Prüfgruppen werden mit denen der Vehikelgruppe verglichen, um zu untersuchen, ob statistisch signifikante Gewichtserhöhungen feststellbar sind.
Spezifische Vorgehensweise für Androgenantagonisten und 5α-Reduktaseinhibitoren
44. Bei der Prüfung auf Androgenantagonisten und 5α-Reduktaseinhibitoren ist die mit TP behandelte Gruppe die negative Kontrollgruppe und die Gruppe, die gleichzeitig Referenzdosen von TP und FT erhält, ist die positive Kontrollgruppe. Für die Untersuchung auf biologische Abläufe, die der Wirkung von Androgenantagonisten und 5a-Reduktaseinhibitoren entsprechen, werden den Behandlungsgruppen an zehn aufeinanderfolgenden Tagen ausgewählte Dosen einer TP-Referenzdosis und einer Prüfsubstanz verabreicht. Die Gewichte der fünf akzessorischen Gewebe des Reproduktionstrakts der Tiere der Prüfgruppen, die TP plus die Prüfsubstanz erhalten haben, werden mit denen der Referenzgruppe verglichen, die nur TP erhalten hat, um zu untersuchen, ob statistisch signifikante Gewichtsverringerungen feststellbar sind.
Klinische Beobachtungen
45. Allgemeine klinische Beobachtungen sollten mindestens einmal täglich durchgeführt werden, bei Anzeichen für Toxizität häufiger. Die Beobachtungen sind möglichst immer zur selben Tageszeit/zu denselben Tageszeiten und unter Berücksichtigung des Zeitraums nach der Verabreichung, in dem voraussichtlich die Wirkungsgipfel zu erwarten sind, durchzuführen. Alle Tiere sind auf Anzeichen von Mortalität, Morbidität und allgemeine klinische Zeichen wie Verhaltensänderungen, Änderungen an Haut, Fell, Augen und Schleimhäuten, Sekrete und Exkrete sowie autonome Körperfunktionen (z.B. Tränensekretion, Piloerektion, Pupillengröße, ungewöhnliche Atemmuster) zu beobachten.
46. Tot aufgefundene Tiere sind zu entfernen und ohne weitere Datenanalyse zu beseitigen. Vor der Nekropsie verendete Tiere sind mit den offenkundigen Todesursachen zu protokollieren. Moribunde Tiere sind auf humane Weise zu töten. Vor der Nekropsie in moribundem Zustand aufgefundene und anschließend getötete Tiere sind mit den offenkundigen Krankheitsursachen zu protokollieren.
Körpergewicht und Futteraufnahme
47. Alle Tiere sind täglich auf 0,1 g genau zu wiegen, wobei unmittelbar vor Behandlungsbeginn, also wenn die Tiere den Gruppen zugeteilt werden, mit dem Wiegen zu beginnen ist. Optional kann die aufgenommene Futtermenge während des Behandlungszeitraums pro Käfig durch Wiegen der Futterspender bestimmt werden. Die Daten zur Futteraufnahme sind in Gramm pro Ratte und Tag auszudrücken.
Sektion und Bestimmung der Gewebe- und Organgewichte
48. Die Ratten sollten etwa 24 Stunden nach der letzten Prüfsubstanzgabe nach der üblichen Vorgehensweise des durchführenden Labors getötet und ausgeblutet und anschließend seziert werden. Die humane Tötungsmethode ist im Laborbericht zu protokollieren.
49. Idealerweise werden die Nekropsien über die Gruppen hinweg randomisiert durchgeführt, um ein unmittelbares Abarbeiten der Dosisgruppen nach oben oder unten zu vermeiden, da dies die Daten geringfügig beeinflussen könnte. Alle Nekropsiebefunde, d. h. pathologische Veränderungen/sichtbare Läsionen, sind zu notieren und zu protokollieren.
50. Die fünf androgenabhängigen Gewebe (VP, SB, LABC, COW, GP) sind zu wiegen. Diese Gewebe sollten herausgeschnitten, sorgfältig von überschüssigem anhaftendem Gewebe und Fett befreit und ihr frisches (unfixiertes) Gewicht einzeln bestimmt werden. Jedes Gewebe ist mit besonderer Umsicht zu behandeln, um Flüssigkeitsverluste zu vermeiden und so ein Austrocknen zu verhindern, da dies zu niedrigeren Gewichten und damit zu signifikanten Fehlern und Schwankungen der dokumentierten Werte führen kann. Bestimmte Gewebe können sehr klein oder schwierig zu sezieren sein, was zwangsläufig zu Schwankungen führt. Daher sollte die Sektion der akzessorischen Gewebe des Reproduktionstrakts unbedingt von Personen durchgeführt werden, die mit den Standard-Sektionsverfahren für diese Gewebe vertraut sind. Eine Standardarbeitsanweisung (SOP) für Sektionen ist in Form eines Handbuchs bei der OECD erhältlich (21). Mit einer gründlichen Schulung nach diesem SOP-Handbuch lässt sich diese potenzielle Schwankungsquelle der Studie minimieren. Um eine unterschiedliche Aufbereitung der Gewebe zu vermeiden, sollte eine bestimmte Gewebeart immer von demselben Prosektor bearbeitet werden. Ist dies nicht möglich, sollte die Nekropsie so geplant werden, dass jeder Prosektor bei allen Behandlungsgruppen ein bestimmtes Gewebe seziert, und nicht so, dass eine Person alle Gewebe einer Kontrollgruppe seziert, während eine andere Person für die Gewebe der behandelten Gruppen zuständig ist. Jedes akzessorische Gewebe des Reproduktionstrakts ist ohne vorheriges Blotten auf 0,1 mg genau zu wiegen, und das Gewicht ist für jedes Tier einzeln zu dokumentieren.
51. Bestimmte Gewebe können sehr klein oder schwierig zu sezieren sein, was zwangsläufig zu Schwankungen führt. Frühere Arbeiten haben einen Bereich von Variationskoeffizienten (VK) ergeben, der anscheinend je nach Befähigung des Labors unterschiedlich ist. In einigen wenigen Fällen wurden große Unterschiede bei absoluten Gewebegewichten, zum Beispiel der VP und der COW, innerhalb ein und desselben Labors beobachtet.
52. Optional können die Gewichte von Leber, paarigen Nieren und paarigen Nebennieren bestimmt werden. Auch hier sind die Gewebe von anhaftendem Bindegewebe und Fett zu befreien. Die Leber ist zu wiegen und der Messwert auf 0,1 g genau zu dokumentieren; die paarigen Nieren und paarigen Nebennieren sind jeweils zu wiegen und die Messwerte auf 0,1 mg genau zu dokumentieren. Leber, Nieren und Nebennieren werden nicht nur durch Androgene beeinflusst, sie liefern auch nützliche Hinweise auf systemische Toxizität.
53. Eine Bestimmung des luteinisierenden Hormons (LH), des follikelstimulierenden Hormons (FSH) und des Testosterons (T) im Serum ist optional. Mithilfe der T-Spiegel im Serum kann bestimmt werden, ob die Prüfsubstanz eine Metabolisierung des Testosterons durch die Leber induziert, was zu niedrigeren Serumspiegeln führt. Ohne die T-Daten kann ein solcher Effekt auf einen antiandrogenen Mechanismus zurückzuführen sein. Die LH-Spiegel liefern Informationen darüber, ob ein Antiandrogen nicht nur in der Lage ist, Organgewichte zu verringern, sondern auch die hypothalamischhypophysäre Funktion zu beeinflussen, was in Langzeitstudien zu Hodentumoren führen kann. FSH ist ein wichtiges Hormon für die Spermatogenese. Bestimmungen von T4 und T3 im Serum sind ebenfalls optionale Messungen, die nützliche Zusatzhinweise über die Fähigkeit zur Störung der Schilddrüsenhormon- Homöostase liefern können. Wenn Hormonwerte bestimmt werden sollen, ist den Ratten vor der Nekropsie unter Narkose per Herzpunktion Blut zu entnehmen, wobei bei der Wahl der Narkosemethode darauf zu achten ist, dass sie die Hormonmessung nicht beeinflusst. Die Methode der Serumgewinnung, die Herkunft von Kits für Radioimmunassays (RIA) oder andere Messverfahren, die Analyseverfahren und die Ergebnisse sind zu dokumentieren. Die Serumspiegel von LH und T sind als ng/ml Serum zu dokumentieren.
54. Die nachstehend beschriebene Sektion der Gewebe basiert auf einem ausführlichen Sektionsleitfaden mit Fotos, der im Rahmen des Validierungsprogramms als zusätzliches Informationsmaterial veröffentlicht wurde (21). Darüber hinaus ist ein Video zur Sektion über die Website der koreanischen Nahrungs- und Arzneimittelbehörde erhältlich (22).
- Bei dem mit der ventralen Seite nach oben gelagerten Tier wird bestimmt, ob sich das Präputium des Penis von der Glans penis getrennt hat. Wenn das der Fall ist, wird das Präputium zurückgeschoben und die Glans penis entfernt, auf 0,1 mg genau gewogen und das Gewicht aufgezeichnet.
- Die abdominale Haut und Bauchwand werden eröffnet und die Eingeweide freigelegt. Wenn die optionalen Organe gewogen werden sollen, ist die Leber zu entnehmen und auf 0,1 g genau zu wiegen; Magen und Eingeweide sind zu entnehmen, dann sind die paarigen Nieren und die paarigen Nebennieren zu entnehmen und auf 0,1 mg genau zu wiegen. Nach diesen Sektionsschritten ist die Blase freigelegt und die Sektion der akzessorischen männlichen Zielgewebe beginnt.
- Für die Sektion der VP ist die Blase durch Schneiden des Bindegewebes entlang der Mittellinie von der ventralen Muskelschicht zu trennen. Die Blase ist nach anterior in Richtung der Samenbläschen (SB) zu verlagern, sodass der linke und der rechte Lappen der ventralen Prostata (die von einer Fettschicht bedeckt sind) freigelegt werden. Das Fett wird vorsichtig vom rechten und linken Lappen der VP gelöst. Der rechte Lappen der VP wird vorsichtig von der Harnröhre weggelagert und von der Harnröhre abgetrennt. Während der rechte Lappen der VP noch gehalten wird, wird vorsichtig der linke Lappen der VP von der Harnröhre weggelagert und abgeschnitten; das Gewicht wird auf 0,1 mg genau bestimmt und dokumentiert.
- Um Samenbläschen und Koagulationsdrüse (SBKD) zu sezieren, wird die Blase nach kaudal verlagert und so der Samenleiter sowie der rechte und linke Lappen der Samenbläschen plus Koagulationsdrüsen freigelegt. Um Flüssigkeitsverluste zu vermeiden, ist an der Basis der SBKD, an der Stelle, an der der Samenleiter auf die Harnröhre trifft, eine Gefäßklemme zu befestigen. Die SBKD sind vorsichtig abzuschneiden, und Fett und Adnexe sind bei noch befestigter Gefäßklemme abzuschaben und in ein tariertes Wägeschiffchen zu legen. Anschließend wird die Gefäßklemme abgenommen, das Gewicht auf 0,1 mg genau bestimmt und das Ergebnis dokumentiert.
- Um den Komplex Musculus levator ani und bulbospongiosus (LABC) zu sezieren, werden die Muskeln und die Penisbasis freigelegt. Die LA-Muskeln umschlingen das Kolon, während die anterioren LA- und BC-Muskeln mit dem Bulbus penis verbunden sind. Die Haut und Adnexe der Perianalregion, die sich von der Penisbasis zum anterioren Ende des Anus erstreckt, werden entfernt. Die BC-Muskeln werden nach und nach vom Bulbus penis und den Geweben freigelegt. Das Kolon wird durchgeschnitten, dann können die vollständigen LABC-Muskeln seziert und entnommen werden. Die LABC-Muskeln sind von Fett und Adnexen zu befreien, auf 0,1 mg genau zu wiegen, und die Ergebnisse sind festzuhalten.
- Nach Entfernung der LABC-Muskeln sind die runden Cowperschen oder Bulbourethraldrüsen (COW) an der Basis und leicht dorsal des Bulbus penis sichtbar. Sie sind vorsichtig zu sezieren, um eine Beschädigung der dünnen Kapsel und damit einen Flüssigkeitsverlust zu vermeiden. Die paarigen COW sind auf 0,1 mg genau zu wiegen, und das Ergebnis ist festzuhalten.
- Wenn während der Nekropsie bzw. des Sezierens Flüssigkeitsverluste aus einer Drüse auftreten, sind diese ebenfalls zu dokumentieren.
55. Wenn zur Beurteilung der einzelnen Chemikalien mehr Tiere seziert werden müssen als pro Tag angemessen wäre, kann der Studienbeginn auf zwei aufeinanderfolgende Tage verteilt werden, sodass sowohl die Nekropsie als auch die damit zusammenhängenden Arbeiten auf zwei Tage verteilt werden. Bei einer derart gestaffelten Vorgehensweise ist pro Tag jeweils die Hälfte der Tiere pro Behandlungsgruppe zu verwenden.
56. Die Tierkörper sind nach der Nekropsie auf geeignete Weise zu entsorgen.
Daten
57. Die Daten sind einzeln zu protokollieren (d. h. Körpergewicht, Gewichte der akzessorischen Gewebe des Reproduktionstrakts, optionale Messungen sowie andere Wirkungen und Beobachtungen) und für jede Tiergruppe (Durchschnittswerte und Standardabweichungen aller Messungen) zu dokumentieren. Die Daten sind in tabellarischer Form zusammenzufassen. Aus den Daten muss Folgendes hervorgehen: Anzahl der Tiere zu Beginn der Prüfung, Anzahl der Tiere, die während der Prüfung tot aufgefunden werden oder die Toxizitätszeichen aufweisen, und eine Beschreibung der beobachteten Toxizitätszeichen einschließlich Zeitpunkt des Einsetzens, Dauer und Schweregrad.
58. Der Abschlussbericht sollte Folgendes enthalten: Prüfeinrichtung
- Name und Ort der Einrichtung,
- Prüfungsleiter und anderes Personal sowie Zuständigkeiten während der Prüfung,
- Beginn und Ende der Prüfung, d. h. Datum der ersten Verabreichung der Prüfsubstanz, und Datum der letzten Nekropsie.
Prüfsubstanz
- Herkunft, Los-/Chargennummer, Identität, Reinheit, vollständige Anschrift des Lieferanten und Eigenschaften der Prüfsubstanz(en),
- physikalische Beschaffenheit und, sofern zutreffend, physikalisch-chemische Eigenschaften,
- Lagerungsbedingungen und Methode und Häufigkeit der Verdünnungszubereitung,
- etwaige Daten über die Stabilität,
- etwaige Analysen der Dosierungslösungen/Suspensionen.
Vehikel
- Beschreibung des Vehikels (Art, Lieferant und Chargennr.),
- Begründung der Wahl des Vehikels (sofern anders als Wasser).
Versuchstiere und Tierhaltungsverfahren
- Tierart und -stamm und Begründung der getroffenen Wahl,
- Herkunft oder Lieferant der Versuchstiere mit vollständiger Anschrift,
- Anzahl und Alter der gelieferten Tiere,
- Haltungsbedingungen (Temperatur, Beleuchtung usw.)
- Futter (Bezeichnung, Art, Lieferant, Chargennr., Inhalt und, sofern bekannt, Phytoöstrogengehalte),
- Einstreu (Bezeichnung, Art, Lieferant, Inhalt),
- Käfighaltungsbedingungen und Anzahl der Tiere pro Käfig.
Prüfbedingungen
- Alter bei Kastration und Dauer der Akklimatisierung nach Kastration,
- Gewicht der einzelnen Tiere bei Prüfungsbeginn (auf 0,1 g genau),
- Randomisierungsverfahren und Protokoll der Zuteilung zu Vehikel-, Referenzchemikalien- und Prüfsubstanzgruppen und Käfigen,
- Durchschnittswerte und Standardabweichungen der Körpergewichte der einzelnen Gruppen pro Wägetag während der Prüfung,
- Begründung der Dosiswahl,
- Art und Weise der Verabreichung der Prüfsubstanz und Begründung des gewählten Expositionswegs,
- Falls es sich um eine Prüfung auf antiandrogene Wirkungen handelt, die Behandlung mit TP (Dosis und Volumen),
- Behandlung mit der Prüfsubstanz (Dosis und Volumen),
- Zeitpunkt der Dosierung,
- Nekropsieverfahren einschließlich Angaben zu Entblutung und Narkosemitteln,
- wenn Serumanalysen durchgeführt werden, sind Angaben zum Analyseverfahren zu machen. Wenn zum Beispiel RIA angewendet wird, sind das RIA-Verfahren, die Herkunft der RIA-Kits, die Ablaufdaten der Kits, das Szintillationszählungsverfahren und das Standardisierungsverfahren zu protokollieren.
Ergebnisse
- tägliche Beobachtungen für jedes Tier während der Dosierung einschließlich:
- Körpergewicht (auf 0,1 g genau),
- klinische Zeichen (falls vorhanden),
- etwaige Messungen oder Aufzeichnungen zur Nahrungsaufnahme.
- Nekropsiebefunde für jedes Tier einschließlich:
- Datum der Nekropsie,
- Behandlungsgruppe,
- Kennziffer des Tiers,
- Prosektor,
- Uhrzeit der Nekropsie/Sektion,
- Alter des Tiers,
- finales Körpergewicht bei Nekropsie, wobei etwaige statistisch signifikante Erhöhungen oder Verringerungen zu vermerken sind,
- Reihenfolge des Entblutens und Sezierens der einzelnen Tiere bei der Nekropsie,
- Gewichte der fünf androgenabhängigen Zielgewebe:
- ventrale Prostata (auf 0,1 mg genau),
- Samenbläschen plus Koagulationsdrüsen einschließlich Flüssigkeit (paarig, auf 0,1 mg genau),
- Muskelkomplex Levator ani/bulbospongiosus (auf 0,1 mg genau),
- Cowpersche Drüsen (Frischgewicht - paarig, auf 0,1 mg genau),
- Glans penis (Frischgewicht, auf 0,1 mg genau),
- Gewichte der optionalen Gewebe, falls bestimmt:
- Leber (auf 0,1 g genau),
- Niere (paarig, auf 0,1 mg genau),
- Nebenniere (paarig, auf 0,1 mg genau),
- Allgemeine Bemerkungen und Kommentare,
- Analyse von Serumhormonen, falls bestimmt
- Serum-LH (optional - ng pro ml Serum) und
- Serum-T (optional - ng pro ml Serum),
- Allgemeine Bemerkungen und Kommentare.
Datenzusammenfassung
Die Daten sind in tabellarischer Form zusammenzufassen, und zwar mit Stichprobengröße für jede Gruppe, Mittelwert und Standardfehler des Mittelwerts oder Standardabweichung. Ebenfalls in tabellarischer Form aufgeführt sein müssen die Körpergewichte bei Nekropsie, Körpergewichtsänderungen ab Dosierungsbeginn bis Nekropsie, Gewichte der akzessorischen Zielgewebe des Reproduktionstrakts und optional bestimmte Organgewichte.
Diskussion der Ergebnisse
Analyse der Ergebnisse
59. Das Körpergewicht und das Gewicht der einzelnen Organe bei Nekropsie sind statistisch auf Parameter wie die Varianzhomogenität mit entsprechender bedarfsgerechter Datentransformation zu analysieren. Die Behandlungsgruppen sind anhand einer Varianzanalyse oder ähnlicher Analysetechniken mit einer Kontrollgruppe zu vergleichen, gefolgt von paarweisen Vergleichen (z.B. dem einseitigen Test nach Dunnett) und dem Kriterium der statistischen Differenz, z.B. p ≤ 0,05. Es ist zu ermitteln, welche Gruppen eine statistische Signifikanz aufweisen., Relative Organgewichte" sind jedoch aufgrund der dieser Datenbearbeitung zugrunde liegenden ungültigen statistischen Hypothesen zu vermeiden.
60. Bei der Prüfung auf Androgenagonismus sollte die Prüfgruppe, die nur das Vehikel erhält, die Kontrollgruppe sein. Die Parameter der Wirkungsweise einer Prüfsubstanz können bei den Zielgeweben zu unterschiedlichen relativen Reaktionen führen; so kann z.B. Trenbolon, das nicht durch die 5α-Reduktase umgewandelt werden kann, eine stärkere Wirkung auf den LABC-Komplex und die GP haben als TP. Eine statistisch signifikante Gewichtserhöhung (p ≤ 0,05) bei mindestens zwei der fünf androgenabhängigen Zielgewebe (VP, LABC, GP, KD und SBKD) ist als positives Ergebnis im Sinne einer Wirkung als Androgenagonist zu werten; ferner sollte bei allen Zielgeweben ein gewisses erhöhtes Wachstum zu beobachten sein. Eine kombinierte Beurteilung der Reaktionen aller akzessorischen Gewebe des Reproduktionstrakts kann mittels geeigneter multivariater Datenanalysemethoden erfolgen. Dies kann zu besseren Analyseergebnissen führen, insbesondere dann, wenn nur bei einem einzigen Gewebe eine statistisch signifikante Reaktion feststellbar ist.
61. Bei der Prüfung auf Androgenantagonismus sollte die Prüfgruppe, die das Referenzandrogen (also nur Testosteronpropionat) erhält, die Kontrollgruppe sein. Die Parameter der Wirkungsweise einer Prüfsubstanz können bei den Zielgeweben zu unterschiedlichen relativen Reaktionen führen; so haben z.B. 5α-Reduktaseinhibitoren wie Finasterid im Vergleich zu wirksamen AR-Antagonisten wie Flutamid eine stärkere Wirkung auf die ventrale Prostata als auf andere Gewebe. Eine statistisch signifikante Gewichtsverringerung (p ≤ 0,05) bei mindestens zwei der fünf androgenabhängigen Zielgewebe (VP, LABC, GP, KD und SBKD) im Verhältnis zu der nur mit TP behandelten Gruppe ist als positives Ergebnis im Sinne einer Wirkung als Androgenantagonist zu werten; ferner sollte bei allen Zielgeweben eine gewisse Wachstumsverringerung zu beobachten sein. Eine kombinierte Beurteilung der Reaktionen aller akzessorischen Gewebe des Reproduktionstrakts kann mittels geeigneter multivariater Datenanalysemethoden erfolgen. Dies kann zu besseren Analyseergebnissen führen, insbesondere dann, wenn nur bei einem einzigen Gewebe eine statistisch signifikante Reaktion feststellbar ist.
62. Die Daten sind in tabellarischer Form zusammenzufassen, und zwar mit Mittelwert, Standardfehler des Mittelwerts (Standardabweichung wäre ebenfalls akzeptabel) und Stichprobengröße für jede Gruppe. Es sollten auch Tabellen mit Einzeldaten beigefügt werden. Die Einzelwerte, Mittelwerte und die Werte für Standardfehler (Standardabweichung) und Variationskoeffizienten für die Kontrolldaten sind daraufhin zu prüfen, ob sie die akzeptablen Kriterien für die Konsistenz mit erwarteten historischen Werten erfüllen. Übersteigen die Variationskoeffizienten (VK) die Werte in Tabelle 1 (vgl. Nummern 25 und 26) für die einzelnen Organgewichte, so ist zu prüfen, ob Fehler bei der Datenerfassung oder -eingabe vorliegen oder ob das Labor die Sektion der androgenabhängigen Gewebe noch nicht exakt beherrscht, sodass weitere Schulungsmaßnahmen/praktische Erfahrung gerechtfertigt sind. Im Allgemeinen sind die VK (die Standardabweichung geteilt durch das mittlere Organgewicht) von Labor zu Labor und von Prüfung zu Prüfung reproduzierbar. Die vorgelegten Daten sollten mindestens umfassen: ventrale Prostata, Samenbläschen, Musculus levator ani plus bulbospongiosus, Cowpersche Drüsen, Glans penis, Leber und Körpergewichte sowie Körpergewichtsänderungen von Dosierungsbeginn bis Nekropsie. Die Daten können auch nach Kovarianzanpassung für das Körpergewicht eingereicht werden, doch dies sollte eine Einreichung der nicht angepassten Daten nicht ersetzen. Zusätzlich sollte die Präputialseparation, wenn sie bei einer der Gruppen nicht erfolgt ist, bei ihrem Eintreten erfasst und statistisch anhand des exakten Tests nach Fisher mit der Kontrollgruppe verglichen werden.
63. Wenn beim Vergleich der Computerdateneinträge mit den ursprünglichen Datenblättern Organgewichtswerte auffallen, die nicht biologisch plausibel sind oder um mehr als drei Standardabweichungen vom Behandlungsgruppendurchschnitt abweichen, sollten diese sorgfältig auf ihre Richtigkeit überprüft und gegebenenfalls verworfen werden, da es sich wahrscheinlich um Erfassungsfehler handelt.
64. Ein Vergleich der Prüfungsergebnisse mit den VK-Werten der OECD (siehe Tabelle 1) ist häufig ein wichtiger Schritt bei der Interpretation der Validität der Prüfungsergebnisse. Die historischen Daten der Vehikelkontrollgruppen sollten vom Labor in dessen Datenbestand eingepflegt werden. Die historischen Daten zur Wirkung positiver Referenzchemikalien, zum Beispiel TP und FT, sind ebenfalls vom Labor einzupflegen. Die Laboratorien können ferner die Reaktion auf bekannt schwache Androgenagonisten und -antagonisten in regelmäßigen Abständen testen und diese Daten einpflegen. Diese Daten können mit den verfügbaren OECD-Daten verglichen werden, um sicherzustellen, dass mit den Methoden des Labors eine ausreichende statistische Präzision und Aussagekraft erzielt wird.
| Anlage 1 |
Androgen (Adj.): Begriff zur Beschreibung einer positiven Wirkung auf das Wachstum androgenabhängiger Gewebe.
Antiandrogen (Adj.): die Fähigkeit einer Chemikalie, die Wirkung von TP in einem Säugetierorganismus zu unterdrücken.
Chemikalie: ein Stoff oder eine Mischung.
Dosierung: ein allgemeiner Begriff, der die Dosis, ihre Häufigkeit und die Dauer der Verabreichung umfasst.
Dosis: die Menge der verabreichten Prüfsubstanz. Für die Zwecke des Hershberger-Bioassays wird die Dosis ausgedrückt als Masse der Prüfsubstanz je Einheit Körpergewicht des Versuchstiers pro Tag (z.B. mg pro kg Körpergewicht und Tag).
Empfindlichkeit: die Fähigkeit einer Prüfmethode, Chemikalien korrekt anhand derjenigen Eigenschaft zu erkennen, auf die diese getestet werden.
Moribund (Adj.): Begriff zur Beschreibung des Zustands eines sterbenden, todgeweihten Tiers. Postnataler Tag X: der xte Lebenstag nach der Geburt.
Prüfsubstanz: jede(r) mittels dieser Prüfmethode getestete Stoff bzw. Mischung.
Spezifizität: die Fähigkeit einer Prüfmethode, Chemikalien korrekt anhand des Fehlens derjenigen Eigenschaft zu erkennen, auf die diese getestet werden.
Tag der Geburt: der postnatale Tag 0.
Validierung: wissenschaftlicher Prozess zur Beschreibung der operationellen Anforderungen und Grenzen einer Prüfmethode und zum Nachweis ihrer Zuverlässigkeit und Eignung für einen bestimmten Zweck.
| Anlage 2 |
Anmerkung: Diese Dokument wurde vom Sekretariat des Prüfrichtlinienprogramms auf der Gmndlage einer beim 6. Treffen der EDTA-Taskforce getroffenen Vereinbarung ausgearbeitet.
Rahmenkonzept der OECD für die Testung und Bewertung endokriner Disruptoren
| Anmerkung 1: | Ein Einstieg in das Rahmenkonzept und ein Ausstieg sind auf allen Stufen möglich und abhängig davon, welche Informationen für Gefahren- und Risikobeurteilungszwecke benötigt werden. |
| Anmerkung 2: | Bei Stufe 5 sollte der Aspekt der Ökotoxikologie Endpunkte beinhalten, die Hinweise auf schädliche Wirkmechanismen und eine potenzielle Schädigung der Population liefern. |
| Anmerkung 3: | Wenn ein multimodales Modell mehrere Assays mit nur einem Endpunkt (Single-Endpoint-Assays) umfasst, ersetzt dieses Modell die Durchführung der Single-Endpoint-Assays. |
| Anmerkung 4 | Die Bewertung der einzelnen Chemikalien sollte von Fall zu Fall und unter Berücksichtigung aller verfügbaren Daten sowie vor dem Hintergrund des Zwecks der Stufen des Rahmenkonzepts erfolgen. |
| Anmerkung 5: | Das Rahmenkonzept ist derzeit noch nicht als vollständig anzusehen. Auf Stufe 3, 4 und 5 beinhaltet es Assays, die entweder schon verfügbar sind oder sich gerade in der Validierungsphase befinden. Bei Letzteren ist die Aufnahme in das Rahmenkonzept noch vorläufig. Sobald ihre Entwicklung und Validierung abgeschlossen ist, werden sie offizieller Bestandteil des Konzepts. |
| Anmerkung 6: | Stufe 5 ist nicht so zu verstehen, dass es sich bei den darin enthaltenen Tests nur um endgültige Prüfungen handelt. Die Prüfungen dieser Stufe sollen vielmehr einen Beitrag zur allgemeinen Gefahren- und Risikobewertung leisten. |
(1) OECD (1998). Report of the First Meeting of the OECD Endocrine Disrupter Testing and Assessment (EDTA) Task Force, 10.-11. März 1998, ENV/MC/CHEM/RA(98)5.
(2) Dorfman RI (1962). Standard methods adopted by official organization. Academic Press, NY.
(3) Gray LE Jr, Furr J and Ostby JS (2005). Hershberger assay to investigate the effects of endocrine disrupting compounds with androgenic and antiandrogenic activity in castrateimmature male rats. In: Current Protocols in Toxicology 16.9.1-16.9.15. J Wiley and Sons Inc.
(4) OECD (2006). Final OECD report of the initial work towards the validation of the rat Hershberger assay. Phase 1. Androgenic response to testosterone propionate and antiandrogenic effects of flutamide. Environmental Health and Safety, Monograph Series on Testing and Assessment No 62. ENV/JM/MONO(2006)30.
(5) OECD (2008). Report of the OECD Validation of the Rat Hershberger Bioassay: Phase 2: Testing of Androgen Agonists, Androgen Antagonists and a 5a-Reductase Inhibitor in Dose Response Studies by Multiple Laboratories. Environmental Health and Safety, Monograph Series on Testing and Assessment No 86. ENV/JM/MONO(2008)3.
(6) OECD (2007). Report of the Validation of the Rat Hershberger Assay: Phase 3: Coded Testing of Androgen Agonists, Androgen Antagonists and Negative Reference Chemicals by Multiple Laboratories. Surgical Castrate Model Protocol. Environmental Health and Safety, Monograph Series on Testing and Assessment No 73. ENV/JM/MONO(2007)20.
(7) Owens, W, Zeiger E, Walker M, Ashby J, Onyon L, Gray, Jr, LE (2006). The OECD programme to validate the rat Hershberger bioassay to screen compounds for in vivo androgen and antiandrogen responses. Phase 1: Use of a potent agonist and a potent antagonist to test the standardized protocol. Env. Health Persp. 114:1265-1269.
(8) Owens W, Gray LE, Zeiger E, Walker M, Yamasaki K, Ashby J, Jacob E (2007). The OECD program to validate the rat Hershberger bioassay to screen compounds for in vivo androgen and antiandrogen responses: phase 2 dose- response studies. Environ Health Perspect. 115(5):671-8.
(9) Korenchevsky V (1932). The assay of testicular hormone preparations. Biochem J 26:413-422.
(10) Korenchevsky V, Dennison M, Schalit R (1932). The response of castrated male rats to the injection of the testicular hormone. Biochem J26:1306-1314.
(11) Eisenberg E, Gordan GS (1950). The levator ani muscle of the rat as an index of myotrophic activity of steroidal hormones. J Pharmacol Exp Therap 99:38-44.
(12) Eisenberg E, Gordan GS, Elliott HW (1949). Testosterone and tissue respiration of the castrate male rat with a possible test for mytrophic activity. Endocrinology 45:113-119.
(13) Hershberger L, Shipley E, Meyer R (1953). Myotrophic activity of 19-nortestosterone and other steroids determined by modified levator ani muscle method. Proc Soc Exp Biol Med 83:175-180.
(14) Hilgar AG, Vollmer EP (1964). Endocrine bioassay data: Androgenic and myogenic. Washington DC: United States Public Health Service.
(15) Dorfman RI (1969). Androgens and anabolic agents. In: Methods in Hormone Research, volume IIA. (Dorfman RI, ed.) New York:Academic Press, 151-220.
(16) Massaro EJ (2002). Handbook of Neurotoxicology, volume I. New York: Humana Press, S. 38.
(17) OECD (2000). Guidance document on the recognition, assessment and use of clinical signs as humane endpoints for experimental animals used in safety evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment No 19. ENV/JM/MONO(2000)7.
(18) OECD (1982). Organization for Economic Cooperation and Development - Principles of Good Laboratory Practice, ISBN 92-64-12367-9, Paris.
(19) OECD (2008). Acute oral toxicity - upanddown procedure. OECD Guideline for the testing of chemicals No 425.
(20) OECD (2001). Guidance document on acute oral toxicity. Environmental Health and Safety Monograph Series on Testing and Assessment No 24. ENV/JM/MONO(2001)4.
(21) Supplemental materials for Owens et al. (2006). The OECD programme to validate the rat Hershberger bioassay to screen compounds for in vivo androgen and antiandrogen responses. Phase 1: Use of a potent agonist and a potent antagonist to test the standardized protocol. Env. Health Persp. 114:1265-1269. Siehe Abschnitt II, Sektionsleitfaden für die Laboratorien, abrufbar unter: [http://www.ehponline.org/docs/2006/8751/suppl.pdf].
(22) Koreanische Nahrungs- und Arzneimittelbehörde. Visueller Referenzleitfaden zur Verfahrensweise beim Hershberger-Test einschließlich Sektionsvideo. [http://rndmoa.kfda.go.kr/endocrine/reference/education_fr.html].
(23) OECD (2008). Background Review Document on the Rodent Hershberger Bioassay. Environmental Health and Safety Monograph Series on Testing and Assessment No 90. ENV/JM/MONO(2008)17.
(24) OECD (2008). Draft Validation report of the Intact, Stimulated, Weanling Male Rat Version of the Hershberger Bioassay.
(25) OECD (2009). Guidance Document on the Weanling Hershberger Bioassay in rats: A shortterm screening assay for (anti)androgenic properties. Series on Testing and Assessment, Number 115.
(26) Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (ABl. Nr. L 276 vom 20.10.2010 S. 33).
(27) Die folgenden Kapitel des vorliegenden Anhangs:
B.1 bis, Akute orale Toxizität - Fest-Dosis-MethodeB.1.tris, Akute orale Toxizität - Akut toxische Klassenmethode
 | weiter . |  |
...
X
⍂
↑
↓
