 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2013, Lebensmittel - Futtermittel
 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2013, Lebensmittel - Futtermittel |
Verordnung (EU) Nr. 51/2013 der Kommission vom 16. Januar 2013 zur Änderung der Verordnung (EG) Nr. 152/2009 im Hinblick auf die Analysemethoden zur Bestimmung der Bestandteile tierischen Ursprungs bei den amtlichen Futtermittelkontrollen
(Text von Bedeutung für den EWR)
(ABl. Nr. L 20 vom 23.01.2013 S. 33)
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über amtliche Kontrollen zur Überprüfung der Einhaltung des Lebensmittel- und Futtermittelrechts sowie der Bestimmungen über Tiergesundheit und Tierschutz 1, insbesondere auf Artikel 11 Absatz 4,
in Erwägung nachstehender Gründe:
(1) Nach Artikel 7 Absatz 1 der Verordnung (EG) Nr. 999/2001 des Europäischen Parlaments und des Rates vom 22. Mai 2001 mit Vorschriften zur Verhütung, Kontrolle und Tilgung bestimmter transmissibler spongiformer Enzephalopathien 2 ist die Verfütterung tierischen Proteins an Nutztiere verboten. Dieses Verbot wird auf andere Tiere als Wiederkäuer ausgedehnt und bezüglich der Fütterung dieser Tiere mit Erzeugnissen tierischen Ursprungs beschränkt, und zwar gemäß Anhang IV der genannten Verordnung.
(2) Artikel 11 Absatz 1 der Verordnung (EG) Nr. 1069/2009 des Europäischen Parlaments und des Rates vom 21. Oktober 2009 mit Hygienevorschriften für nicht für den menschlichen Verzehr bestimmte tierische Nebenprodukte und zur Aufhebung der Verordnung (EG) Nr. 1774/2002 3 verbietet die Fütterung von Landtieren einer bestimmten Art außer Pelztieren mit verarbeitetem tierischem Protein, das aus Körpern oder Teilen von Körpern von Tieren derselben Art gewonnen wurde, und die Fütterung von Zuchtfisch mit verarbeitetem tierischem Protein, das aus Körpern oder Teilen von Körpern von Zuchtfischen derselben Art gewonnen wurde.
(3) In Anhang VI der Verordnung (EG) Nr. 152/2009 der Kommission vom 27. Januar 2009 zur Festlegung der Probenahmeverfahren und Analysemethoden für die amtliche Untersuchung von Futtermitteln 4 sind die Analysemethoden zur Bestimmung der Bestandteile tierischen Ursprungs bei der amtlichen Untersuchung von Futtermitteln beschrieben. Die derzeit einzige validierte Methode zum Nachweis tierischer Proteine in Futtermitteln basiert auf der Mikroskopie; mit ihr lässt sich bestimmen, ob Bestandteile von Landtieren oder von Fischen stammen, nicht aber mit ausreichender Genauigkeit, in welcher Menge tierische Bestandteile in Futtermitteln vorhanden sind. Für diesen Zweck sollte sie daher nicht eingesetzt werden.
(4) Das EU-Referenzlabor für tierische Proteine in Futtermitteln hat eine neue Methode für den Nachweis tierischer Bestandteile entwickelt, die auf der Polymerase-Kettenreaktion (PCR) basiert. Anhand einer mit den nationalen Referenzlaboratorien der Mitgliedstaaten organisierten Durchführungsstudie wurde gezeigt, dass die neue Methode verlässlich genug ist, um als amtliche Kontrollmethode in der Union angewendet werden zu können. Mit der neuen Methode lassen sich tierische Bestandteile in Futtermitteln nachweisen und die Tierart bestimmen, von der diese stammen. Für die Überwachung der vorschriftsmäßigen Durchführung der mit den Verordnungen (EG) Nr. 999/2001 und (EG) Nr. 1069/2009 verfügten Fütterungsverbote wäre es von großem Nutzen, wenn diese neue Methode angewandt werden könnte, um die Mikroskopie-Methode zu ergänzen oder gegebenenfalls zu ersetzen.
(5) Anhang VI der Verordnung (EG) Nr. 152/2009 sollte daher entsprechend ersetzt werden.
(6) Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit, und weder das Europäische Parlament noch der Rat haben ihnen widersprochen
- hat folgende Verordnung erlassen:
Anhang VI der der Verordnung (EG) Nr. 152/2009 erhält die Fassung des Anhangs der vorliegenden Verordnung.
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 16. Januar 2013
2) ABl. Nr. L 147 vom 31.05.2001 S. 1.
3) ABl. Nr. L 300 vom 14.11.2009 S. 1.
4) ABl. Nr. L 54 vom 26.02.2009 S. 1.
.
| Anhang |
"Anhang VI
Analysemethoden zur Bestimmung der Bestandteile tierischen Ursprungs bei der amtlichen Untersuchung von Futtermitteln
1. Zweck und Anwendungsbereich
Die Bestimmung von Bestandteilen tierischen Ursprungs in Futtermitteln wird nach den Bestimmungen dieses Anhangs mit Hilfe der Lichtmikroskopie oder der Polymerase-Kettenreaktion (PCR) erbracht.
Mit diesen beiden Methoden können Bestandteile tierischen Ursprungs in Einzelfuttermitteln und Mischfuttermitteln nachgewiesen werden. Die Berechnung der Menge solcher Bestandteile in Einzelfuttermitteln und Mischfuttermitteln ist mit ihnen jedoch nicht möglich. Bei beiden Methoden liegt die Nachweisgrenze unter 0,1 % (m/m).
Mit der PCR-Methode lässt sich die taxonomische Gruppe der in Einzelfuttermitteln und Mischfuttermitteln vorhandenen Bestandteile tierischen Ursprungs ermitteln.
Die Methoden werden eingesetzt, um die Anwendung der Verbote gemäß Artikel 7 Absatz 1 und Anhang IV der Verordnung (EG) Nr. 999/2001 sowie Artikel 11 Absatz 1 der Verordnung (EG) Nr. 1069/2009 zu überwachen.
Abhängig von der Art des zu untersuchenden Futtermittels können diese Methoden für eine Untersuchung entweder einzeln oder kombiniert nach der Standardarbeitsanweisung (SOP) angewandt werden, die das EU-Referenzlabor für tierische Proteine in Futtermitteln (EURL-AP) aufgestellt und auf seiner Website 1 veröffentlicht hat.
2. Methoden
2.1. Lichtmikroskopie
2.1.1. Grundsatz
Die tierischen Bestandteile, die in Einzelfuttermitteln und Mischfuttermitteln durch Analyse nachzuweisen sind, werden anhand charakteristischer und mikroskopisch erkennbarer Merkmale wie Muskelfasern und andere Fleischpartikel, Knorpel, Knochen, Horn, Haare, Borsten, Blut, Federn, Eierschalen, Gräten und Schuppen identifiziert.
2.1.2. Reagenzien und Geräte
2.1.2.1. Reagenzien
2.1.2.1.1. Konzentrationsmittel
2.1.2.1.1.1. Tetrachlorethylen (Dichte 1,62)
2.1.2.1.2. Nachweisreagenz
2.1.2.1.2.1. Alizarinrot-Lösung (2,5 ml 1 M Salzsäure in 100 ml Wasser lösen und dieser Lösung 200 mg Alizarinrot zufügen),
2.1.2.1.3. Einbettungsmedien
2.1.2.1.3.1. Lauge (NaOH, Massenkonzentration = 2,5 %, oder KOH, Massenkonzentration = 2,5 %)
2.1.2.1.3.2. Glycerin (unverdünnt, Viskosität: 1 490 cP)
2.1.2.1.3.3. Norland ® Optical Adhesive 65 (Viskosität: 1 200 cP) oder ein Harz mit gleichwertigen Eigenschaften für Dauerpräparate
2.1.2.1.4. Färbende Einbettungsmedien
2.1.2.1.4.1. Lugolsche Lösung (2 g Kaliumiodid in 100 ml Wasser lösen und unter häufigem Schütteln 1 g Iod zufügen)
2.1.2.1.4.2. Cystin-Reagenz (2 g Bleiacetat, 10 g NaOH/100 ml Wasser)
2.1.2.1.4.3. Fehlingsche Lösung (vor Gebrauch aus äquivalenten Teilen zweier Stammlösungen A und B zubereitet. Lösung A: 6,9 g Kupfer(II)-sulfatpentahydrat in 100 ml Wasser lösen. Lösung B: 34,6 g Kaliumnatriumtartrat-Tetrahydrat und 12 g NaOH in 100 ml Wasser lösen)
2.1.2.1.4.4. Tetramethylbenzidin/Wasserstoffperoxid (1 g 3,3',5,5' Tetramethylbenzidin (TMB) in 100 ml Eisessig und 150 ml Wasser lösen. Vor Gebrauch 4 Teile dieser TMB-Lösung mit 1 Teil 3 %igem Wasserstoffperoxid mischen)
2.1.2.1.5. Spülmittel
2.1.2.1.5.1. Ethanol > 96 % (technische Qualität)
2.1.2.1.5.2. Aceton (technische Qualität)
2.1.2.1.6. Bleichmittel
2.1.2.1.6.1. Handelsübliche Natriumhypochlorit-Lösung (9-14 % aktives Chlor)
2.1.2.2. Geräte
2.1.2.2.1. Analysenwaage mit einer Genauigkeit von 0,001 g
2.1.2.2.2. Zerkleinerungsgeräte: Mühle oder Mörser
2.1.2.2.3. Siebe mit rechteckigen Maschen von 0,25 und 1 mm Weite
2.1.2.2.4. Gläserner Scheidetrichter von 250 ml mit konischem Boden, unten verschlossen mit einem Absperrhahn aus Teflon oder Schliffglas. Öffnung im Absperrhahn > 4 mm Durchmesser. Alternativ kann auch ein Absetzbecher mit konischem Boden verwendet werden, wenn das Labor bewiesen hat, dass die Nachweisgrenzen denjenigen bei Verwendung des Scheidetrichters gleichwertig sind.
Scheidetrichter
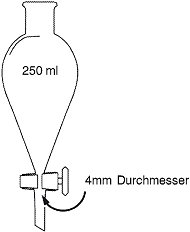
2.1.2.2.5. Stereo-Auflicht-Mikroskop mit 6,5- bis 40-facher Vergrößerung
2.1.2.2.6. Zusammengesetztes Mikroskop mit mindestens 100- bis 400-facher Vergrößerung, mit Hellfeld-Durchlicht. Zusätzlich können auch Verfahren mit polarisiertem Licht und Differenzial-Interferenzkontrast eingesetzt werden
2.1.2.2.7. Standardmäßige Laborglasausrüstung
2.1.2.2.8. Ausrüstung für die Objektträgervorbereitung: herkömmliche Objektträger, Hohlschliff-Objektträger, Deckgläser (20x20 mm), Pinzette, feiner Spatel
2.1.3. Probenahme und Probenvorbereitung
2.1.3.1. Probenahme
Untersucht wird eine repräsentative Probe, die nach der Beschreibung in Anhang I entnommen wurde.
2.1.3.2. Vorsichtsmaßnahmen
Um eine Kreuzkontamination im Labor zu vermeiden, sind sämtliche wiederverwendbaren Geräte sorgfältig zu reinigen. Scheidetrichter werden vor dem Reinigen in ihre Einzelteile zerlegt. Glas- und sonstige Teile der Scheidetrichter werden von Hand vorgewaschen und dann in der Spülmaschine gewaschen. Siebe sind mit einer Bürste mit steifen Synthetikborsten zu reinigen. Nach dem Sieben von fetthaltigem Material wie Fischmehl ist eine abschließende Reinigung der Siebe mit Aceton und Druckluft zu empfehlen.
2.1.3.3. Vorbereitung von anderen Proben als Fett und Öl
2.1.3.3.1. Trocknung der Proben: Proben mit einem Feuchtigkeitsgehalt > 14 % werden vor Gebrauch getrocknet.
2.1.3.3.2. Vorsieben der Proben: Es wird empfohlen, pelletierte Futtermittel und Kerne bis zu einer Größe von 1 mm vorzusieben und die beiden Fraktionen dann als unterschiedliche Proben zu präparieren und zu untersuchen.
2.1.3.3.3. Herstellung von Teilproben und Zerkleinern: Von mindestens 50 g der Probe werden Teilproben für die Untersuchung hergestellt und anschließend zerkleinert.
2.1.3.3.4. Extraktion und Vorbereitung des Sediments: 10 g (bis auf 0,01 g genau) der zerkleinerten Teilprobe werden in den Scheidetrichter bzw. Absetzbecher mit konischem Boden gegeben und mit 50 ml Tetrachlorethylen ergänzt. Bei Fischmehl oder anderen reinen Tierprodukten, mineralischen Zutaten oder Vormischungen mit mehr als 10 % Sediment wird nur eine Menge von 3 g in den Trichter gegeben. Das Gemisch mindestens 30 s lang kräftig schütteln; dann vorsichtig mindestens 50 ml Tetrachlorethylen hinzufügen, wobei darauf zu achten ist, dass von der Innenwand des Trichters sämtliche anhaftenden Partikel abgespült werden. Die entstandene Lösung mindestens 5 min stehen lassen und dann das Sediment durch Öffnen des Absperrhahns abscheiden.
Bei Gebrauch eines Absetzbechers mit konischem Boden das Gemisch mindestens 15 s kräftig schütteln; an der Innenseite des Bechers haftende Partikel mit mindestens 10 ml reinem Tetrachlorethylen sorgfältig in das Gefäß hineinspülen. Die Lösung 3 min stehen lassen und wieder 15 s schütteln; noch an der Innenseite des Bechers haftende Partikel mit mindestens 10 ml reinem Tetrachlorethylen sorgfältig hineinspülen. Die entstandene Lösung mindestens 5 min stehen lassen; dann die flüssige Fraktion durch vorsichtiges Abgießen trennen und beseitigen, wobei das Sediment vollständig erhalten bleiben muss.
Das Sediment wird getrocknet und anschließend ausgewogen (auf 0,001 g genau). Bestehen mehr als 5 % des Sediments aus Partikeln über 0,50 mm, wird es auf eine Partikelgröße von 0,25 mm heruntergesiebt; beide Fraktionen werden untersucht.
2.1.3.3.5. Extraktion und Vorbereitung des Flotats Nach Erhalt des Sediments mit der oben beschriebenen Methode sollten zwei Phasen im Scheidetrichter verbleiben: eine aus Tetrachlorethylen bestehende flüssige Phase und eine aus aufschwimmendem Material bestehende feste Phase. Diese feste Phase ist das Flotat, das gewonnen wird, indem man das Tetrachlorethylen durch Öffnen des Absperrhahns vollständig ablaufen lässt. Das Flotat wird aus dem Scheidetrichter in eine große Petrischale gekippt und im Abzug luftgetrocknet. Bestehen mehr als 5 % des Flotats aus Partikeln über 0,50 mm, wird es auf eine Partikelgröße von 0,25 mm heruntergesiebt; beide Fraktionen werden untersucht.
2.1.3.3.6. Vorbereitung von Ausgangsmaterial: Eine Menge von mindestens 5 g der zerkleinerten Teilprobe präparieren. Bestehen mehr als 5 % des Materials aus Partikeln über 0,50 mm, wird es auf eine Partikelgröße von 0,25 mm heruntergesiebt; beide Fraktionen werden untersucht.
2.1.3.4. Vorbereitung von Proben aus Fett und Öl
Für die Vorbereitung von Proben aus Fett oder Öl gilt folgender Ablauf:
2.1.3.5. Gebrauch von Nachweisreagenzien
Zur korrekten Bestimmung der Bestandteile tierischen Ursprungs kann der Untersucher bei der Probenvorbereitung Färbereagenzien verwenden, wie das EURL-AP dies in den auf seiner Website veröffentlichten Leitlinien beschrieben hat.
Bei Verwendung von Alizarinrot-Lösung zum Färben des Sediments gilt folgender Ablauf:
2.1.4. Mikroskopische Untersuchung
2.1.4.1. Vorbereitung der Objektträger
Von dem Sediment und, je nach Präferenz des Untersuchers, von dem Flotat oder dem Ausgangsmaterial werden Objektträger präpariert. Wurde die Probe bei der Vorbereitung gesiebt, werden die beiden entstandenen Fraktionen (fein und grob) präpariert. Die zur Untersuchung auf die Träger gestrichenen Teile der Fraktionen sind repräsentativ für die gesamte Fraktion.
Die Zahl der präparierten Träger muss ausreichen, um einen kompletten Untersuchungsablauf nach 2.1.4.2 ausführen zu können.
Die Objektträger werden nach der vom EURL-AP ausgearbeiteten und auf seiner Website veröffentlichten
SOP mit dem passenden Einbettungsmedium eingedeckt.
Auf den Trägern werden Deckgläser platziert.
2.1.4.2. Untersuchungsablauf für den Nachweis tierischer Partikel in Mischfuttermitteln und Einzelfuttermitteln
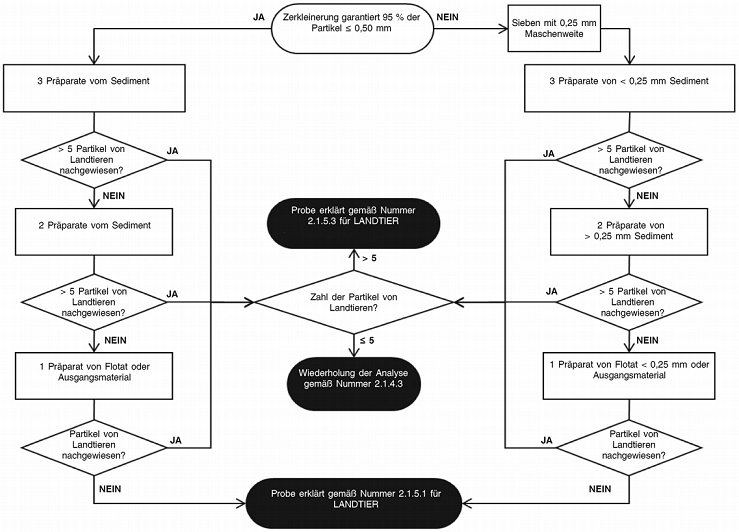
Die präparierten Objektträger werden nach den in den Abbildungen 1 (Mischfuttermittel und Einzelfuttermittel, außer reines Fischmehl) und 2 (reines Fischmehl) festgelegten Abläufen untersucht.
Die mikroskopische Untersuchung des Sediments und, je nach Präferenz des Untersuchers, des Flotats oder des Ausgangsmaterials wird mit dem zusammengesetzten Mikroskop durchgeführt. Für die groben Fraktionen kann zusätzlich auch ein Stereomikroskop benutzt werden. Jedes Präparat wird mit unterschiedlicher Vergrößerung vollständig abgesucht.
In jedem Schritt des Ablaufs ist die festgelegte Mindestzahl von Präparaten zu untersuchen, es sei denn, das gesamte Material der Fraktion reicht dafür nicht aus. Bei jeder Bestimmung werden höchstens 6 Präparate untersucht.
Für die Bestimmung von Art und Ursprung der Partikel kann der Untersucher Hilfsinstrumente wie Systeme zur Unterstützung der Entscheidungsfindung, Bildarchive und Referenzproben hinzuziehen.
Abbildung 1:
Untersuchungsabläufe für den Nachweis tierischer Partikel in Mischfuttermitteln und Einzelfuttermitteln, außer Fischmehl
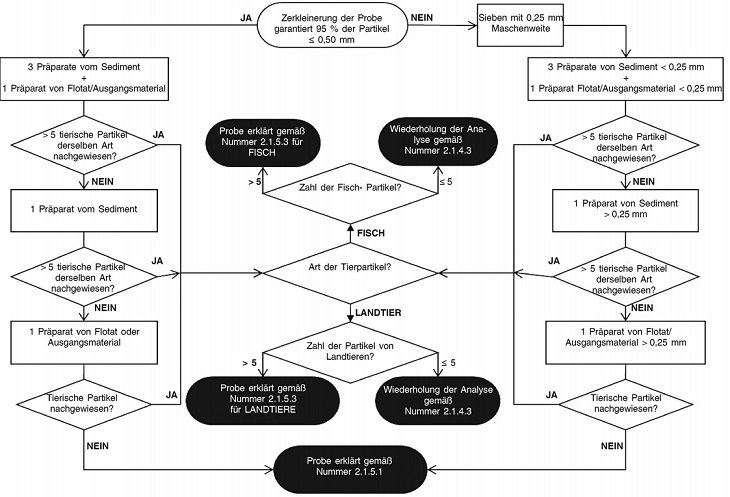
Abbildung 2:
Untersuchungsablauf für den Nachweis tierischer Partikel in Fischmehl
2.1.4.3. Anzahl der Bestimmungen
Wird im ersten Durchgang gemäß dem in den Abbildungen 1 bzw. 2 beschriebenen Ablauf kein tierisches Partikel spezifischer Art (d. h. von Landtier oder Fisch) nachgewiesen, sind keine weiteren Bestimmungen erforderlich, und über das Ergebnis der Analyse wird unter Verwendung der Formulierung in Nummer 2.1.5.1 berichtet.
Werden im ersten Durchgang gemäß dem in den Abbildungen 1 bzw. 2 beschriebenen Ablauf insgesamt zwischen 1 und 5 tierische Partikel spezifischer Art (d. h. von Landtier oder Fisch) nachgewiesen, wird eine zweite Bestimmung mit einer neuen Teilprobe von 50 g durchgeführt. Werden im zweiten Durchgang zwischen 0 und 5 tierische Partikel dieser spezifischen Art nachgewiesen, wird über das Ergebnis der Analyse unter Verwendung der Formulierung in Nummer 2.1.5.2 berichtet; anderenfalls wird eine dritte Bestimmung mit einer neuen Teilprobe von 50 g durchgeführt. Liegt nach der ersten und zweiten Bestimmung die Summe der in beiden Durchgängen nachgewiesenen Partikel spezifischer Art jedoch über 15, ist keine weitere Bestimmung erforderlich und über das Ergebnis der Analyse wird unter Verwendung der Formulierung in Nummer 2.1.5.3 direkt berichtet. Liegt nach der dritten Bestimmung die Summe der in den drei Durchgängen nachgewiesenen tierischen Partikel spezifischer Art jedoch über 15, wird über das Ergebnis der Analyse unter Verwendung der Formulierung in Nummer 2.1.5.3 berichtet. Anderenfalls wird über das Ergebnis der Analyse unter Verwendung der Formulierung in Nummer 2.1.5.2 berichtet.
Werden im ersten Durchgang gemäß dem in den Abbildungen 1 bzw. 2 beschriebenen Ablauf mehr als 5 tierische Partikel spezifischer Art (d. h. von Landtier oder Fisch) nachgewiesen, wird über das Ergebnis der Analyse unter Verwendung der Formulierung in Nummer 2.1.5.3 berichtet.
2.1.5. Formulierung der Ergebnisse
In seinem Bericht über die Ergebnisse gibt das Labor an, welche Art von Material (Sediment, Flotat oder Ausgangsmaterial) analysiert und wieviele Bestimmungen durchgeführt wurden.
Der Laborbericht enthält zumindest Informationen über das Vorhandensein von Bestandteilen, die von Landtieren oder von Fisch stammen.
Die verschiedenen Fälle werden wie folgt dargestellt:
2.1.5.1. Kein tierisches Partikel spezifischer Art nachgewiesen:
2.1.5.2. Im Schnitt zwischen 1 und 5 tierische Partikel spezifischer Art nachgewiesen:
Oder gegebenenfalls:
Wurde die Probe zuvor gesiebt, gibt das Labor an, in welcher Fraktion (gesiebt, pelletiert oder Kerne) die tierischen Partikel nachgewiesen wurden, da nur in der gesiebten Fraktion nachgewiesene tierische Partikel auf eine Umweltkontamination hindeuten können.
2.1.5.3. Im Schnitt mehr als 5 tierische Partikel spezifischer Art nachgewiesen:
Oder gegebenenfalls:
Wurde die Probe zuvor gesiebt, gibt das Labor an, in welcher Fraktion (gesiebt, pelletiert oder Kerne) die tierischen Partikel nachgewiesen wurden, da nur in der gesiebten Fraktion nachgewiesene tierische Partikel auf eine Umweltkontamination hindeuten können.
2.2. PCR
2.2.1. Grundsatz
Aus Desoxyribonucleinsäure (DNA) bestehende Fragmente tierischen Ursprungs, die in Einzelfuttermittel und Mischfuttermitteln vorhanden sein können, werden durch PCR mit einer Genamplifikationstechnik nachgewiesen, die nach tierartspezifischen DNA-Sequenzen sucht.
Für die PCR-Methode muss zunächst DNA extrahiert werden. Der Amplifikationsschritt wird anschließend an dem so erhaltenen DNA-Extrakt durchgeführt, um die Tierart nachzuweisen, auf die untersucht wird.
2.2.2. Reagenzien und Geräte
2.2.2.1. Reagenzien
2.2.2.1.1. Reagenzien für die DNA-Extraktion
Nur vom EURL-AP genehmigte und auf dessen Website veröffentlichte Reagenzien dürfen verwendet werden.
2.2.2.1.2. Reagenzien für die genetische Amplifikation
2.2.2.1.2.1. Primer und Sonden
Nur Primer und Sonden mit vom EURL-AP validierten Oligonucleotid-Sequenzen dürfen verwendet werden 2.
2.2.2.1.2.2. Master Mix
Nur Master-Mix-Lösungen ohne Reagenzien, die zu falschen Ergebnissen führen können, dürfen verwendet werden 3.
2.2.2.1.2.3. Dekontaminations-Reagenzien
2.2.2.1.2.3.1. Salzsäure-Maßlösung (0,1 N)
2.2.2.1.2.3.2. Bleichmittel (Natriumhypochlorit-Lösung, 0,15 % aktives Chlor)
2.2.2.1.2.3.3. Nicht ätzende Reagenzien für die Dekontamination kostspieliger Geräte wie Analysewaagen (z.B. DNA EraseTM von MP Biomedicals)
2.2.2.2. Geräte
2.2.2.2.1. Analysenwaage mit einer Genauigkeit von 0,001 g
2.2.2.2.2. Zerkleinerungsgeräte
2.2.2.2.3. Thermocycler für Echtzeit-PCR
2.2.2.2.4. Mikrozentrifuge für entsprechende Reaktionsgefäße
2.2.2.2.5. Satz von Mikropipetten für das Pipettieren von 1 bis 1 000 µl
2.2.2.2.6. In der Molekularbiologie übliche Verbrauchsmaterialien: Mikrozentrifugen-Röhrchen, Kunststofffilterspitzen für Mikropipetten, geeignete Reaktionsgefäße für den Thermocycler
2.2.2.2.7. Kühlschränke für die Lagerung von Proben und Reagenzien
2.2.3. Probenahme und Probenvorbereitung
2.2.3.1. Probenahme
Untersucht wird eine repräsentative Probe, die nach der Beschreibung in Anhang I entnommen wurde.
2.2.3.2. Probenvorbereitung
Die Vorbereitung von Laborproben bis hin zur Extraktion der DNA entspricht den Anforderungen in Anhang II. Von mindestens 50 g der Probe werden Teilproben für die Untersuchung hergestellt und anschließend zerkleinert.
Die Proben werden gemäß ISO 24276 in einem anderen als den Räumen vorbereitet, in denen DNA extrahiert und vermehrt wird.
Es werden zwei Testmengen zu je mindestens 100 mg vorbereitet.
2.2.4. Extraktion der DNA
Die DNA wird nach der vom EURL-AP ausgearbeiteten und auf seiner Website veröffentlichten SOP aus beiden Testmengen extrahiert.
Für jede Extraktionsserie werden nach ISO 24276 zwei Extraktionskontrollen vorbereitet:
2.2.5. Genetische Amplifikation
Die genetische Amplifikation geschieht anhand von Methoden, die für die zu bestimmenden Tierarten validiert wurden. Diese Methoden sind in der vom EURL-AP ausgearbeiteten und auf seiner Website veröffentlichten SOP beschrieben. Jedes DNA-Extrakt ist in mindestens zwei unterschiedlichen Verdünnungen zu untersuchen, um die Inhibition zu bewerten.
Für jede Zieltierart werden nach ISO 24276 zwei Amplifikationskontrollen vorbereitet:
2.2.6. Interpretation und Formulierung der Ergebnisse
Bei der Berichterstattung über die Ergebnisse gibt das Labor zumindest das Gewicht der Testmengen, die Extraktionstechnik, die Zahl der durchgeführten Bestimmungen und die Nachweisgrenze der Methode an.
Ergebnisse werden nicht interpretiert und berichtet, wenn die positive DNA-Extraktionskontrolle und die positiven DNA-Zielkontrollen keine positiven Ergebnisse für das gesuchte Ziel ergeben und die Amplifikationsreagenz-Kontrolle gleichzeitig negativ ist.
Stimmen die Ergebnisse der beiden Testmengen nicht überein, ist zumindest die genetische Amplifikation zu wiederholen. Geht das Labor davon aus, dass dies an den DNA-Extrakten liegen kann, wird vor der Interpretation der Ergebnisse erneut DNA extrahiert und vermehrt.
Die abschließende Formulierung der Ergebnisse stützt sich auf die Integration und Interpretation der Ergebnisse der beiden Testmengen nach der vom EURL-AP ausgearbeiteten und auf seiner Website veröffentlichten SOP.
2.2.6.1. Negatives Ergebnis
Über ein negatives Ergebnis wird wie folgt berichtet:
In der vorliegenden Probe wurde keine DNA von X nachgewiesen (wobei X die Tierart oder Gruppe von Tierarten ist, auf die untersucht wird).
2.2.6.2. Positives Ergebnis
Über ein positives Ergebnis wird wie folgt berichtet:
In der vorliegenden Probe wurde DNA von X nachgewiesen (wobei X die Tierart oder Gruppe von Tierarten ist, auf die untersucht wird)."
_______
1) http://eurl.craw.eu/
2) Die Liste dieser Primer und Sonden für die einzelnen gesuchten Tierarten findet sich auf der Website des EURL-AP.
3) Beispiele brauchbarer Master Mixes finden sich auf der Website des EURL-AP.
 | ENDE |