 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2024, Wasser - EU Bund

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2024, Wasser - EU Bund |  |
Durchführungsbeschluss (EU) 2024/365 der Kommission vom 23. Januar 2024 mit Durchführungsbestimmungen zur Richtlinie (EU) 2020/2184 des Europäischen Parlaments und des Rates in Bezug auf Methoden für die Prüfung und Akzeptanz von Ausgangsstoffen, Zusammensetzungen und Bestandteilen, die in die europäischen Positivlisten aufzunehmen sind
(Text von Bedeutung für den EWR)
(ABl. L 2024/365 vom 23.04.2024, ber. L 2024/90353)
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Richtlinie (EU) 2020/2184 des Europäischen Parlaments und des Rates vom 16. Dezember 2020 über die Qualität von Wasser für den menschlichen Gebrauch 1, insbesondere auf Artikel 11 Absatz 2 Buchstabe a,
in Erwägung nachstehender Gründe:
(1) Es sollten Prüf- und Akzeptanzmethoden für die Bewertung der sicheren Verwendung von Ausgangsstoffen, Zusammensetzungen und Bestandteilen festgelegt werden.
(2) Die Aufnahme eines Eintrags in eine europäische Positivliste oder dessen Streichung sollte auf der Grundlage der Identifizierung des Ausgangsstoffs, der Zusammensetzung oder des organischen zementgebundenen Bestandteils und der Identifizierung des vorgesehenen Verwendungszwecks erfolgen. Die physikalisch-chemischen Eigenschaften des Ausgangsstoffs, der Zusammensetzung oder des zementgebundenen organischen Bestandteils, die für die Durchführung der Migrationsprüfung erforderlich sind, sollten ermittelt werden. Der Ausgangsstoff, die Zusammensetzung oder der organische zementgebundene Bestandteil sollte auf Migration geprüft werden.
(3) Die Aufnahme eines Eintrags in eine europäische Positivliste oder dessen Streichung sollte auf der Identifizierung von chemischen Spezies beruhen, die für die Akzeptanzmethode oder die Risikobewertung relevant sind, da sie sich auf die sichere Verwendung eines Materials bzw. Werkstoffs oder Produkts auswirken können, wie etwa eine Verunreinigung, der Bestandteil eines Ausgangsstoffs oder ein Abbauprodukt. Diese relevanten chemischen Spezies sollten auf der Grundlage der Informationen zur Identifizierung des Ausgangsstoffs, der Zusammensetzung oder des Bestandteils und auf der Grundlage der vorgesehenen Verwendung sowie der Ergebnisse von Migrationsprüfungen bestimmt werden. Die toxikologischen Eigenschaften dieser relevanten chemischen Spezies sollten ebenfalls ermittelt werden.
(4) Aus Gründen der Verhältnismäßigkeit und Effizienz sollten die Prüfungen auf physikalisch-chemische Eigenschaften und toxikologische Eigenschaften sowie die Risikobewertung weniger umfangreich sein, wenn bereits innerhalb eines angemessenen Zeitraums eine ähnliche Bewertung auf Unionsebene durchgeführt wurde, der Stoff eine strenge Einstufung in Anhang VI Teil 3 der Verordnung (EU) Nr. 1272/2008 des Europäischen Parlaments und des Rates 2 aufweist oder der Antragsteller eine solche Einstufung vorschlägt. Aus Gründen der Verhältnismäßigkeit sollten die Prüfanforderungen für toxikologische Eigenschaften strenger sein, wenn eine hohe Exposition gegenüber einem bestimmten Stoff durch Migration besteht.
(5) Um dem Vorsorgeprinzip und der potenziell erheblichen Exposition über einen langen Zeitraum Rechnung zu tragen, sollte die Akzeptanzmethode auf einer Worst-Case-Risikobewertung für jede relevante chemische Spezies beruhen. Bei der Risikobewertung sollte die Migration, einschließlich Freisetzung, unter den ungünstigsten vorhersehbaren Verwendungsbedingungen berücksichtigt werden. Bei der Risikobewertung sollten insbesondere die erwartete langfristige Exposition gegenüber Materialien bzw. Werkstoffen oder Produkten, die mit Wasser für den menschlichen Gebrauch in Berührung kommen, und - im Falle von metallenen Zusammensetzungen - die Unterschiede bei den Eigenschaften, wie Zusammensetzung und Ätzwirkung, für das gesamte für den menschlichen Gebrauch bestimmte Wasser in der Union berücksichtigt werden.
(6) Den Wirtschaftsteilnehmern und den zuständigen Behörden sollte ausreichend Zeit eingeräumt werden, um ihre nationalen Methoden an die in diesem Beschluss festgelegten Methoden anzupassen. Dieser Beschluss sollte daher erst nach einer gewissen Zeit in Kraft treten.
(7) Die in diesem Beschluss vorgesehenen Maßnahmen entsprechen der Stellungnahme des in Artikel 22 Absatz 1 der Richtlinie (EU) 2020/2184 genannten Ausschusses
- hat folgenden Beschluss erlassen:
Artikel 1 Begriffsbestimmungen
Für die Zwecke dieses Beschlusses bezeichnet der Ausdruck
1. "unbeabsichtigt eingebrachte Spezies" entweder
- eine Verunreinigung eines Ausgangsstoffs oder eines organischen zementgebundenen Bestandteils oder einer Zusammensetzung,
- ein Reaktions- oder Abbauprodukt eines Ausgangsstoffs oder eines organischen zementgebundenen Bestandteils, das bei der Verarbeitung oder Verwendung des Materials bzw. des Werkstoffs entsteht oder
- ein Reaktions- oder Abbauprodukt eines Ausgangsstoffs oder eines organischen zementgebundenen Bestandteils, das bei der Verwendung des Materials bzw. Werkstoffs bei Kontakt mit Wasser entsteht;
2. "Nanoform" eeinen natürlichen oder hergestellten Stoff, der Partikel in ungebundenem Zustand, als Aggregat oder als Agglomerat enthält und bei dem mindestens 50 % der Partikel in der Anzahlgrößenverteilung ein oder mehrere Außenmaße im Bereich von 1 nm bis 100 nm haben, sowie abweichend auch Fullerene, Graphenflocken und einwandige Kohlenstoffnanoröhren mit einem oder mehreren Außenmaßen unter 1 nm. Für diese Definition gilt Folgendes:
- "Partikel" ein sehr kleines Teilchen einer Substanz mit definierten physikalischen Grenzen;
- "Aggregat" ein Partikel aus fest gebundenen oder verschmolzenen Partikeln;
- "Agglomerat" eine Ansammlung schwach gebundener Partikel oder Aggregate, in der die resultierende externe Oberfläche ähnlich der Summe der Oberflächen der einzelnen Bestandteile ist;
3. "Migration" die Übertragung von Stoffen aus einem Material bzw. Werkstoff in Wasser für den menschlichen Gebrauch.
Artikel 2 Prüfung und Akzeptanz von Ausgangsstoffen, Zusammensetzungen und Bestandteilen
(1) Die in Artikel 11 Absatz 2 Buchstabe a der Richtlinie (EU) 2020/2184 genannten Methoden gelten für
(2) Ist ein Polymer zur Verwendung in einem organischen Material oder einem zementgebundenen Werkstoff bestimmt, so sind die Prüf- und Akzeptanzmethoden auf das Monomer, Prepolymer oder Polymer gemäß den Bestimmungen in Anhang I Ziffern v bis viii und Anhang III Ziffern iii und iv des Durchführungsbeschlusses (EU) 2024/367 3 anzuwenden.
Artikel 3 Prüfmethode
(1) Ausgangsstoffe, Zusammensetzungen und organische zementgebundene Bestandteile werden gemäß den Anforderungen in Anhang I identifiziert.
(2) Der vorgesehene Verwendungszweck von Ausgangsstoffen, Zusammensetzungen, Bestandteilen sowie Materialien bzw. Werkstoffen und Produkten wird gemäß den Anforderungen in Anhang II angegeben.
(3) Die physikalisch-chemischen Eigenschaften der relevanten chemischen Spezies werden gemäß den Anforderungen in Anhang III bestimmt.
(4) Die Migration in Wasser für den menschlichen Gebrauch wird gemäß den Anforderungen in Anhang IV bestimmt.
(5) Die relevanten chemischen Spezies werden gemäß Anhang IV Nummer 3 identifiziert.
(6) Die toxikologischen Eigenschaften der in Absatz 5 genannten relevanten chemischen Spezies werden gemäß den Anforderungen in Anhang V bestimmt.
Artikel 4 Akzeptanzmethode in den europäischen Positivlisten
(1) Ausgangsstoffe, Zusammensetzungen und Bestandteile werden gemäß Anhang VI auf der Grundlage einer Bewertung der Risiken akzeptiert, die von den für den jeweiligen Ausgangsstoff, die jeweilige Zusammensetzung oder den jeweiligen organischen zementgebundenen Bestandteil identifizierten chemischen Spezies ausgehen.
(2) Ausgangsstoffe und organische zementgebundene Bestandteile, die eine biozide Wirkung haben und der Verordnung (EU) Nr. 528/2012 des Europäischen Parlaments und des Rates 4 unterliegen, werden nur akzeptiert, wenn sie der Produktart 6 (Schutzmittel für Produkte während der Lagerung) gemäß Anhang V der genannten Verordnung angehören.
Artikel 5 Inkrafttreten
Dieser Beschluss tritt am zwanzigsten Tag nach seiner Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Er gilt ab dem 31. Dezember 2026.
Brüssel, den 23. Januar 2024
2) Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen, zur Änderung und Aufhebung der Richtlinien 67/548/EWG und 1999/45/EG und zur Änderung der Verordnung (EG) Nr. 1907/2006 (ABl. L 353 vom 31.12.2008 S. 1).
3) Durchführungsbeschluss (EU) 2024/367 der Kommission vom 23. Januar 2024 zur Festlegung von Durchführungsbestimmungen zur Richtlinie (EU) 2020/2184 des Europäischen Parlaments und des Rates durch Erstellung der europäischen Positivlisten von Ausgangsstoffen, Zusammensetzungen und Bestandteilen, die für die Verwendung bei der Herstellung von Materialien bzw. Werkstoffen oder Produkten, die mit Wasser für den menschlichen Gebrauch in Kontakt kommen, zugelassen sind (ABl. L, 2024/367, 23.04.2024, ELI: http://data.europa.eu/eli/dec_impl/2024/367/oj).
4) Verordnung (EU) Nr. 528/2012 des Europäischen Parlaments und des Rates vom 22. Mai 2012 über die Bereitstellung auf dem Markt und die Verwendung von Biozidprodukten (ABl. L 167 vom 27.06.2012 S. 1).
| Identifizierung von Ausgangsstoffen, Zusammensetzungen und Bestandteilen | Anhang I |
Es sind ausreichende Informationen zu erstellen, die die Identifizierung von Ausgangsstoffen, Zusammensetzungen und Bestandteilen sowie die Charakterisierung von Nanoformen ermöglichen, einschließlich der in der Tabelle aufgeführten Angaben. Falls es technisch nicht möglich oder aus wissenschaftlicher Sicht unnötig ist, Angaben zu einem oder mehreren der in der Tabelle genannten Punkte zu machen, so ist dies ausreichend zu begründen.
Tabelle: Standardinformationen und -prüfungen im Hinblick auf die Identifizierung eines Ausgangsstoffs, einer Zusammensetzung oder eines Bestandteils
| Ausgangsstoffe von organischen Materialien/organischen zementgebundenen Bestandteilen | Zusammensetzung metallener Werkstoffe | Zusammensetzung von Emails, keramischen Werkstoffen und anderen anorganischen Materialien | ||
| Standardinformationen und -prüfungen | ||||
| 1.1. | Bezeichnung oder sonstige Kennung: | |||
| 1.1.1. | Bezeichnung laut der Nomenklatur der Internationalen Union für reine und angewandte Chemie (IUPAC) und/oder andere internationale chemische Bezeichnungen, sofern verfügbar | |||
| 1.1.2. | Sonstige Bezeichnungen (z.B. allgemeine Bezeichnung, Handelsname, Abkürzung) (sofern verfügbar) | |||
| 1.1.3. | Nummer im Europäischen Verzeichnis der im Handel erhältlichen Stoffe (Einecs), der Europäischen Liste der angemeldeten chemischen Stoffe (ELINCS) oder der Nicht-länger-Polymer-Liste (NLP) oder Nummer, die von der ECHA gemäß der Verordnung (EG) Nr. 1907/2006 vergeben wurde, sofern verfügbar | Nummer im Europäischen Verzeichnis der im Handel erhältlichen Stoffe (Einecs) oder der Europäischen Liste der angemeldeten chemischen Stoffe (ELINCS) oder Nummer, die von der Agentur gemäß der Verordnung (EG) Nr. 1907/2006 vergeben wurde, sofern verfügbar | ||
| 1.1.4. | Bezeichnung und Nummer im Chemical Abstracts Service (CAS), sofern verfügbar | |||
| 1.1.5. | Nummer auf Positivliste der Europäischen Union, sofern vorhanden. | Nummer auf Positivliste der Europäischen Union, sofern vorhanden. | Nummer auf Positivliste der Europäischen Union, sofern vorhanden. | |
| 1.1.6. | Bezeichnung:
| Bezeichnung der Material- bzw. Werkstoffkategorie und Bezeichnung des Emails, der keramischen oder anderen anorganischen Zusammensetzung. | ||
| 1.1.7. | Identität der bestehenden Kategorie metallener Zusammensetzungen, zu der die Zusammensetzung gehört | |||
| 1.1.8. | Identität und Bezeichnung der neuen Kategorie metallener Zusammensetzungen, zu der die Zusammensetzung gehört | |||
| 1.1.9. | Identität der metallenen Bestandteile der neuen Kategorie metallener Zusammensetzungen und entsprechende Konzentrationsbereiche (minimaler und maximaler Massenanteil, w) | |||
| 1.1.10. | Identität der metallenen Verunreinigungen der neuen Kategorie metallener Zusammensetzungen mit einem Massenanteil von über 0,02 % in der Zusammensetzung und entsprechender maximaler Massenanteil, w) | |||
| 1.1.11. | Identität der metallenen Bestandteile des Referenzwerkstoffs für die neue Kategorie metallener Zusammensetzungen und entsprechende Konzentrationsbereiche (minimaler und maximaler Massenanteil, w) | |||
| 1.1.12. | Identität der metallenen Verunreinigungen des Referenzwerkstoffs für die neue Kategorie metallener Zusammensetzungen mit einem Massenanteil von über 0,02 % in der Zusammensetzung und deren entsprechenden Konzentrationsbereichen (minimaler und maximaler Massenanteil, w) | |||
| 1.2. | Angaben zur Molekular- und Strukturformel des Stoffs oder der Kristallstruktur: | |||
| 1.2.1. | Molekular- und Strukturformel (einschließlich IUPAC International Chemical Identifier (InChI), Notation im Simplified Molecular Input Line Entry System (SMILES) und sonstige Darstellungen, sofern verfügbar) | Beschreibung der Kristallstrukturen, einschließlich kristalliner Phasen, sofern vorhanden | Beschreibung der Kristallstrukturen, einschließlich kristalliner Phasen, sofern vorhanden | |
| 1.2.2. | Informationen zur optischen Aktivität und zum typischen (Stereo-)Isomerverhältnis, sofern verfügbar | |||
| 1.2.3. | Molekülmasse oder Molekülmassenbereich, sofern verfügbar | |||
| 1.3. | Chemische Charakterisierung. Umfasst sie eine Nanoform, so ist diese Nanoform gemäß Nummer 1.4 zu charakterisieren: | |||
| 1.3.1. | Reinheitsgrad (%), d. h. typische Konzentration und typischer Konzentrationsbereich (in Prozent, minimaler und maximaler Wert) der Stoffbestandteile | |||
| 1.3.2. | Bezeichnungen (EG-, CAS-Nummern und andere Kennungen, sofern verfügbar) der Stoffbestandteile mit einem Massenanteil von über 0,02 % in der Formulierung und mit einem Massenanteil von ≥ 0,1 % im Stoff (unter Berücksichtigung der gemäß den Nummern 1.1.1, 1.1.2 und 1.1.3 sowie gemäß Anhang II Tabelle 1 Nummer 2.4.1 vorgelegten Informationen). Jeweils typische Konzentration und typischer Konzentrationsbereich (minimaler und maximaler Massenanteil, w) | Bezeichnungen (und andere Kennungen, z.B. EG-, CAS-Nummern) der Zusammensetzungsbestandteile, d. h. die Elemente in jeder Form (z.B. gebunden oder ungebunden) und die entsprechenden Konzentrationsbereiche (minimaler und maximaler Massenanteil, w). | Bezeichnungen (und andere Kennungen, z.B. EG-, CAS-Nummern) der Zusammensetzungsbestandteile, d. h. die Elemente in jeder Form (z.B. gebunden oder ungebunden) und die entsprechenden Konzentrationsbereiche (minimaler und maximaler Massenanteil, w). | |
| 1.3.3. | Bezeichnungen (und andere Kennungen, z.B. EG-, CAS-Nummern) von Verunreinigungen mit einem Massenanteil von über 0,02 % in der Formulierung des endgültigen Materials bzw. Werkstoffs und mit einem Massenanteil von ≥ 0,1 % im Stoff (unter Berücksichtigung der gemäß Anhang II Tabelle 1 Nummern 2.4.1 und 2.4.2 vorgelegten Informationen)Jeweils typische Konzentration und typischer Konzentrationsbereich (minimaler und maximaler Massenanteil, w) | Bezeichnungen (und andere Kennungen, z.B. EG-, CAS-Nummern) von Verunreinigungen mit einem Massenanteil von über 0,02 % in der Zusammensetzung und entsprechender maximaler Massenanteil (w) |
| |
| 1.3.4. | Alle für die Identifizierung des Stoffs erforderlichen qualitativen und quantitativen Analysedaten, wie Ultraviolett-, Infrarot- und Kernmagnetresonanzdaten, Massenspektrometriedaten, Daten aus der chromatographischen, titrimetrischen oder Elementaranalyse oder Diffraktionsdaten | Alle erforderlichen qualitativen und quantitativen Analysedaten, die speziell für die Identifizierung der Zusammensetzung und der Bestandteile der Zusammensetzung erforderlich sind, z.B. aus der Elementaranalyse, Massenspektrometrie mit induktiv gekoppeltem Plasma, Atomabsorptionsspektroskopie, Ionenchromatografie, titrimetrische und/oder Diffraktionsdaten (z.B. Röntgenfluoreszenz (XRF) oder Röntgenpulverdiffraktion (XRD)). | ||
| 1.3.5. | Beschreibung der Analysemethoden oder der geeigneten bibliografischen Angaben, die zur Identifizierung des Ausgangsstoffs, des organischen zementgebundenen Bestandteils (einschließlich der Identifizierung und Quantifizierung von Verunreinigungen und Stoffbestandteilen), der metallenen Zusammensetzungsbestandteile und des Emails sowie der keramischen oder anderen anorganischen Werkstoffe erforderlich sind Die Beschreibung besteht aus den zugrunde liegenden Versuchsprotokollen und der entsprechenden Auswertung der unter den Nummern 1.3.1 bis 1.3.4 genannten Ergebnisse. Die Informationen müssen die Reproduktion der Methoden ermöglichen. | |||
| 1.4. | Charakterisierung einer Nanoform: | |||
| 1.4.1. | Gegebenenfalls Bezeichnungen oder andere Kennungen der Nanoform des Ausgangsstoffs oder des organischen zementgebundenen Bestandteils | |||
| 1.4.2. | Zahlenbasierte Partikelgrößenverteilung mit Angabe des Zahlenanteils der Nanoformpartikel in der Größenordnung zwischen 1 nm und 100 nm | |||
| 1.4.3. | Beschreibung der Oberflächenfunktionalisierung oder -behandlung und Identifizierung jedes Agens, einschließlich IUPAC-Bezeichnung und CAS- oder EG-Nummer | |||
| 1.4.4. | Form, Aspektverhältnis und sonstige morphologische Charakterisierung: Kristallinität, Informationen über den Aufbau, einschließlich z.B. schalenförmige Strukturen oder Hohlstrukturen, sofern verfügbar | |||
| 1.4.5. | Oberfläche (spezifisches Oberflächen-Volumen-Verhältnis und/oder spezifisches Oberflächen-Masse-Verhältnis) | |||
| 1.4.6. | Beschreibung der Analysemethoden oder geeignete bibliografische Angaben zu den Informationselementen unter Nummer 1.4 Die Informationen müssen die Reproduktion der Methoden ermöglichen. | |||
| 1.5. | Zusätzlich erforderliche Informationen für Ausgangsstoffe und organische zementgebundene Bestandteile, bei denen es sich um a) Polymere oder b) Prepolymere handelt: | |||
| 1.5.1. | Bezeichnung (und andere Kennungen, z.B. EG-, CAS-Nummern) von Monomeren und anderen Reaktanten, aus denen der Stoff hergestellt wird | |||
| 1.5.2. | Beschreibung des Herstellungsverfahrens (einschließlich Informationen über die Verwendung von Monomeren und Reaktanten sowie deren Verhältnis) | |||
| 1.5.3. | Zusatzstoffe zu (Pre-)Polymeren | |||
| 1.5.4. | Strukturinformation des (Pre-) Polymers | |||
| 1.5.5. | Molekülmasseverteilung; Prüfbericht über Molekülmasseverteilung erforderlich. | |||
| 1.5.6. | Zahlengemittelte Molekülmasse | |||
| 1.5.7. | Molekülmassebereich (Minimum und Maximum) | |||
| 1.5.8. | Identität der Bestandteile des Stoffs mit Molekülmasse < 1000 Da und ihr Massenanteil (w) | |||
| 1.5.9. | Restmonomere und deren Konzentrationen (%) | |||
| 1.5.10. | Viskosität | |||
| 1.5.11. | Schmelzindex | |||
| Vorgesehene Verwendung | Anhang II |
Es sind ausreichende Informationen über die vorgesehene Verwendung von Ausgangsstoffen, Zusammensetzungen, Bestandteilen sowie endgültigen Materialien bzw. Werkstoffen und Produkten zu erstellen, einschließlich der in Tabelle 1 aufgeführten Informationen.
Tabelle 1: Standardinformationen und -prüfungen im Hinblick auf die vorgesehene Verwendung
| Ausgangsstoffe von organischen Materialien/organischen zementgebundenen Bestandteilen | Zusammensetzung metallener Werkstoffe | Zusammensetzung von Emails, keramischen Werkstoffen und anderen anorganischen Materialien | ||
| Standardinformationen und -prüfungen | ||||
| 2. | Verwendung: | |||
| 2.1. | Art, Kategorie und Unterkategorie des Materials bzw. Werkstoffs: | Identifizierung der Art, Kategorie und Unterkategorie des Materials bzw. Werkstoffs | ||
| 2.2. | Identität und Verwendung des endgültigen Materials bzw. Werkstoffs und Produkts: | |||
| 2.2.1. | Spezifikation des Produkts/Bestandteils Definition des Anwendungsbereichs: Installationen innerhalb oder außerhalb von Gebäuden | |||
| 2.2.2. | Relevante Produktgruppen für organische Materialien oder zementgebundene Werkstoffe (siehe Anhang I Tabelle 5 des Durchführungsbeschlusses (EU) 2024/368 der Kommission 1 | Relevante Produktgruppen für metallene Zusammensetzungen (siehe Tabelle 2 dieses Anhangs) | Relevante Produktgruppen für Email, keramische Werkstoffe oder andere anorganische Materialien (siehe Anhang IV Tabelle 5 des Durchführungsbeschlusses (EU) 2024/368 der Kommission) | |
| 2.2.3. | Verwendung in Kaltwasser (= 25 °C)/Warmwasser (25-65 °C) oder Heißwasser (= 65 °C) | Verwendung in Kaltwasser (= 25 °C)/Warmwasser (25-65 °C) oder Heißwasser (= 65 °C) | Verwendung in Kaltwasser (= 25 °C)/Warmwasser (25-65 °C) oder Heißwasser (= 65 °C) | |
| 2.3. | Technische Funktion: | Spezifikation der technischen Funktion | ||
| 2.4. | Bedingungen für die Verwendung des Ausgangsstoffs, der Zusammensetzung oder des organischen zementgebundenen Bestandteils, des endgültigen Materials bzw. Werkstoffs und des Produkts: | |||
| 2.4.1. | Für Ausgangsstoffe von organischen Materialien: Maximaldosis des Ausgangsstoffs in der Formulierung zur Herstellung des endgültigen Materials bzw. Werkstoffs | |||
| 2.4.2. | Für organische Bestandteile zementgebundener Werkstoffe:
| |||
| 2.4.3. | Vorgeschlagene Beschränkungen oder sonstige Verwendungsbedingungen für die Aufnahme des Ausgangsstoffs, der Zusammensetzung oder des Bestandteils in die europäische Positivliste | |||
| 2.5. | Informationen zur Verarbeitung und zur internen Struktur des Materials bzw. Werkstoffs, des endgültigen Materials bzw. Werkstoffs und des Produkts: | |||
| 2.5.1. | Informationen zur Verarbeitung des Materials bzw. Werkstoffs, des endgültigen Materials bzw. Werkstoffs und des Produkts, einschließlich Behandlung des Materials bzw. Werkstoffs, des endgültigen Materials bzw. Werkstoffs oder des Produkts vor der Verwendung | |||
| 2.5.2. | Verarbeitungstemperaturen des endgültigen Materials bzw. Werkstoffs |
| Verarbeitungstemperaturen des endgültigen Materials bzw. Werkstoffs | |
| 2.5.3. | Informationen zur internen Struktur des endgültigen Materials bzw. Werkstoffs | |||
| 2.6. | Bewertungen und Zulassungen auf Unions- und Mitgliedstaatenebene: | |||
| 2.6.1. | Einzelheiten zu Zulassungen, Risikobewertungen und sonstigen einschlägigen Vorschriften auf Ebene der Europäischen Union oder der Mitgliedstaaten für die Verwendung in endgültigen Materialien bzw. Werkstoffen, die mit Wasser für den menschlichen Gebrauch in Kontakt kommen | |||
| 2.6.2. | Einzelheiten zu Zulassungen, Risikobewertungen und sonstigen einschlägigen Vorschriften auf Ebene der Europäischen Union oder der Mitgliedstaaten für die Verwendung in endgültigen Materialien bzw. Werkstoffen, die mit Lebensmitteln in Kontakt kommen | |||
| 2.7. | EU-Zulassung von Biozidwirkstoffen | |||
| 2.7.1. | Genehmigungs-/Bewertungsstatus des Ausgangsstoffs oder des organischen zementgebundenen Bestandteils gemäß der Verordnung (EU) Nr. 528/2012 | |||
| 2.7.2. | Für den Ausgangsstoff oder organischen zementgebundenen Bestandteil relevanter Produkttyp gemäß der Verordnung (EU) Nr. 528/2012 | |||
| 2.7.3. | Beginn der Genehmigung gemäß der Verordnung (EU) Nr. 528/2012 | |||
| 2.7.4. | Ende der Genehmigung gemäß der Verordnung (EU) Nr. 528/2012 | |||
| 3. | Identifizierung unbeabsichtigt eingebrachter Spezies außer Verunreinigungen: | |||
| 3.1. | Bewertung der Gegenwart unbeabsichtigt eingebrachter Spezies außer Verunreinigungen und von Stoffbestandteilen, die aus dem Material bzw. Werkstoff migrieren, wobei mindestens Folgendes zu berücksichtigen ist:
| |||
| 3.2. | Reaktionen des Ausgangsstoffs oder des organischen zementgebundenen Bestandteils während der Verarbeitung des Materials bzw. Werkstoffs und des endgültigen Materials bzw. Werkstoffs sowie gebildete Reaktions- oder Abbauprodukte (auch unter Berücksichtigung der thermischen Stabilität, die durch eine obligatorische Prüfung der thermischen Stabilität des Stoffs nachgewiesen wurde) | |||
| 3.3. | Reaktionen des Ausgangsstoffs oder des organischen zementgebundenen Bestandteils während der Verwendung des endgültigen Materials bzw. Werkstoffs in Kontakt mit Wasser für den menschlichen Gebrauch und gebildete Reaktions- oder Abbauprodukte (auch unter Berücksichtigung von Hydrolyse, die durch eine obligatorische Hydrolysestudie des Stoffs nachgewiesen wurde) | |||
| 3.4. | Identifizierung anderer Stoffe, die bei Verwendung von Ausgangsstoffen und organischen zementgebundenen Bestandteilen, bei denen es sich um Monomere oder andere Reaktanten handelt, in das Trinkwasser migrieren können: | |||
| 3.4.1. | Bewertung der Gegenwart eines polymerisierten Teils unter 1000 Da, der für die Verwendung des Ausgangsstoffs oder des organischen zementgebundenen Bestandteils relevant ist | |||
| 3.4.2. | Beschreibung des Verfahrens, das zur Bildung des polymerisierten Teils unter 1000 Da führt | |||
| 3.4.3. | Molekülmasseverteilung des polymerisierten Teils unter 1000 Da; Prüfbericht über Molekülmasseverteilung erforderlich. | |||
| 3.4.4. | Zahlengemittelte Molekülmasse des polymerisierten Teils unter 1000 Da | |||
| 3.4.5. | Molekülmassebereich (Minimum und Maximum) des polymerisierten Teils unter 1000 Da | |||
| 3.4.6. | Polymerisierter Restteil unter 1000 Da und seine Konzentration (%) | |||
| 3.5. | Bezeichnung (und andere Kennungen, z.B. EG-, CAS-Nummern) unbeabsichtigt eingebrachter Spezies gemäß den Nummern 3.1 bis 3.4 | |||
| 1) Durchführungsbeschluss (EU) 2024/368 der Kommission vom 23. Januar 2024 mit Durchführungsbestimmungen zur Richtlinie (EU) 2020/2184 des Europäischen Parlaments und des Rates in Bezug auf die Verfahren und Methoden für die Prüfung und Akzeptanz endgültiger, in Produkten verwendeter Materialien bzw. Werkstoffe, die mit Wasser für den menschlichen Gebrauch in Kontakt kommen (ABl. L, 2024/368, 23.04.2024, ELI: http://data.europa.eu/eli/dec_impl/2024/368/oj). | ||||
Tabelle 2: Produktgruppe für metallene Zusammensetzungen
| Produktgruppe | Beispiele für metallene Produkte oder Bestandteile | Angenommene Kontaktoberfläche "a" |
| A | Rohre | 100 % |
| B | Rohrverbinder, Bauteile in Installationen in Gebäuden | 10 % |
| C |
| 1 % |
| D | Bestandteile von Rohrverbindern und Bauteilen in Wasserhauptleitungen und in Wasseraufbereitungsanlagen wie für die Produktgruppe C Unterkategorie 2 beschrieben | < 0,1 % |
| Physikalisch-Chemische Eigenschaften | Anhang III |
Abschnitt 1. Keine Standardinformationen oder -prüfungen erforderlich
Für Ausgangsstoffe und organische zementgebundene Bestandteile sind keine Standardinformationen oder -prüfungen erforderlich, wenn eine der folgenden Bedingungen erfüllt ist:
Abschnitt 2. Standardinformationen oder -prüfungen erforderlich
2.1. Prüfungen gemäß diesem Abschnitt sind im Einklang mit den Grundsätzen der Guten Laborpraxis gemäß der Richtlinie 2004/10/EG des Europäischen Parlaments und des Rates 4 oder anderen internationalen Normen, die von der Kommission oder der ECHA als der Richtlinie 2004/10/EG gleichwertig anerkannt wurden, durchzuführen.
2.2. Prüfungen gemäß diesem Abschnitt sind im Einklang mit der von der ECHA festgelegten und spezifizierten und auf ihrer Website veröffentlichten Prüfmethode durchzuführen, wobei insbesondere die Anforderungen gemäß Nummer 2.5 zu berücksichtigen sind.
2.3. Tabelle 1 Spalte 1 enthält die erforderlichen Standardinformationen und -prüfungen für einen Ausgangsstoff oder einen organischen zementgebundenen Bestandteil.
Tabelle 1 Spalte 1 Nummern 4.7 und 4.8 enthält die erforderlichen Standardinformationen und -prüfungen für relevante chemische Spezies, ausgenommen Ausgangsstoffe oder organische zementgebundene Bestandteile.
Tabelle 1 Spalte 1 Nummern 4.1.3, 4.2 und 4.4 enthält die erforderlichen Standardinformationen und -prüfungen für eine Zusammensetzung aus metallenen Werkstoffen, Email und keramischen Werkstoffen oder anderen anorganischen Materialien.
Tabelle 1 Spalte 2 enthält besondere Vorschriften, nach denen die Standardinformationen und -prüfungen der Spalte 1 entfallen, durch andere Angaben ersetzt oder auf andere Weise angepasst werden können.
2.4. Alle anderen relevanten physikalisch-chemischen Informationen sind festzulegen und zusätzlich zu berücksichtigen.
2.5. Bietet eine Prüfmethode Flexibilität bei der Festlegung oder Wahl des Prüfschemas, auch indem bestimmte Spezifikationen nicht verboten werden, so muss mit dem gewählten Prüfschema sichergestellt werden, dass die erstellten Daten für die Migrationsprüfung und die Risikobewertung geeignet sind.
2.6. Die allgemeinen Vorschriften für Abweichungen in Anhang XI Abschnitte 1 und 2 der Verordnung (EG) Nr. 1907/2006 5 gelten entsprechend.
Tabelle 1: Standardinformationen und -prüfungen sowie besondere Vorschriften für Abweichungen von diesen Angaben und Prüfungen in Bezug auf physikalisch-chemische Eigenschaften
| Spalte 1 Standardinformationen und -prüfungen | Spalte 2 Besondere Vorschriften für Abweichungen von Standardinformationen und -prüfungen | |
| 4.1. | Erscheinungsform bei 20 °C und 101,3 kPa | |
| 4.1.1. | Aggregatzustand | |
| 4.1.2. | Aggregatstruktur (z.B. viskos, kristallin, pulverförmig) | |
| 4.1.3. | Farbe | |
| 4.1.4. | Geruch | |
| 4.2. | Schmelz-/Gefrierpunkt | Diese Informationen müssen nicht vorgelegt werden, wenn der Wert unter der Untergrenze von -20 °C liegt. |
| 4.3. | Siedepunkt | Diese Informationen müssen nicht vorgelegt werden für
|
| 4.4. | Dichte | Die Dichteprüfung ist nicht erforderlich, wenn einer der folgenden Fälle vorliegt:
|
| 4.5. | Dampfdruck | Diese Informationen müssen nicht vorgelegt werden, wenn der Schmelzpunkt über 300 °C liegt. Liegt der Schmelzpunkt zwischen 200 °C und 300 °C, so genügt ein gemessener oder nach einer anerkannten Rechenmethode ermittelter Grenzwert. |
| 4.5.1. | Für Feststoffe und Flüssigkeiten ist, sofern berechenbar, stets die Henry-Konstante anzugeben. | |
| 4.6. | Oberflächenspannung einer wässrigen Lösung | Diese Informationen müssen nur in folgenden Fällen vorgelegt werden:
Keine Prüfung erforderlich, wenn die Wasserlöslichkeit bei 20 °C unter 1 mg/l beträgt. |
| 4.7. | Wasserlöslichkeit | Diese Informationen müssen in folgenden Fällen nicht vorgelegt werden:
Erscheint der Stoff "wasserunlöslich", so ist ein Limit-Test bis an die Nachweisgrenze der Analysemethode durchzuführen. |
| 4.8. | Verteilungskoeffizient (n-Octanol/Wasser) und seine Abhängigkeit vom pH-Wert | Diese Informationen müssen nicht vorgelegt werden, wenn es sich um einen anorganischen Stoff handelt. Ist die Prüfung nicht durchführbar (z.B., weil der Stoff zerfällt, stark oberflächenaktiv ist, bei der Prüfung heftig reagiert oder nicht in Wasser oder Octanol löslich ist oder weil er nicht in der erforderlichen Reinheit hergestellt werden kann), sind der errechnete Wert für den Verteilungskoeffizienten und Einzelheiten der Berechnungsmethode anzugeben. |
| 4.9. | Granulometrie | Keine Studie erforderlich, wenn der Stoff in nicht festem oder nicht körnigem Zustand in Verkehr gebracht oder verwendet wird. |
| 4.10. | Dissoziationskonstante | Diese Informationen müssen in folgenden Fällen nicht vorgelegt werden:
|
2) Delegierte Verordnung (EU) 2024/369 der Kommission vom 23. Januar 2024 zur Ergänzung der Richtlinie (EU) 2020/2184 des Europäischen Parlaments und des Rates durch die Festlegung des Verfahrens für die Aufnahme von Ausgangsstoffen, Zusammensetzungen und Bestandteilen in die europäischen Positivlisten oder deren Streichung daraus (ABl. L, 2024/369, 23.04.2024, ELI: http://data.europa.eu/eli/reg_del/2024/369/oj).
3) Verordnung (EU) Nr. 10/2011 der Kommission vom 14. Januar 2011 über Materialien und Gegenstände aus Kunststoff, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen (ABl. L 12 vom 15.01.2011 S. 1).
4) Richtlinie 2004/10/EG des Europäischen Parlaments und des Rates vom 11. Februar 2004 zur Angleichung der Rechts- und Verwaltungsvorschriften für die Anwendung der Grundsätze der Guten Laborpraxis und zur Kontrolle ihrer Anwendung bei Versuchen mit chemischen Stoffen (ABl. L 50 vom 20.02.2004 S. 44).
5) Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates vom 18. Dezember 2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH), zur Schaffung einer Europäischen Chemikalienagentur, zur Änderung der Richtlinie 1999/45/EG und zur Aufhebung der Verordnung (EWG) Nr. 793/93 des Rates, der Verordnung (EG) Nr. 1488/94 der Kommission, der Richtlinie 76/769/EWG des Rates sowie der Richtlinien 91/155/EWG, 93/67/EWG, 93/105/EG und 2000/21/EG der Kommission (ABl. L 396 vom 30.12.2006 S. 1).
| Migration und Bestätigung relevanter chemischer Spezies | Anhang IV |
Abschnitt 1. Allgemeine Anforderungen, Standardinformationen und -prüfungen zur Bestimmung der Migration
1.1. Alle Prüfungen gemäß diesem Abschnitt sind im Einklang mit den Grundsätzen der Guten Laborpraxis gemäß der Norm EN ISO/IEC 17025 oder anderen internationalen Normen, die von der Kommission oder der ECHA als gleichwertig anerkannt wurden, durchzuführen.
1.2. Bei allen Prüfungen oder Modellierungen ist die geeignete Prüfmethode anzuwenden, die von der ECHA festgelegt und auf ihrer Website veröffentlicht wurde oder nachstehend aufgeführt ist. Diese Prüfungen oder Modellierungen folgen auch den von der ECHA festgelegten und auf ihrer Website veröffentlichten Spezifikationen, um eine geeignete und zuverlässige Schlussfolgerung zur Migration zu gewährleisten, wobei die Anforderung an die Bestimmung der Migration auf der Grundlage der ungünstigsten vorhersehbaren Verwendungsbedingungen zu berücksichtigen ist.
1.3. Jede Prüfung oder Modellierung nach diesem Abschnitt ist auf der Grundlage der vorgesehenen Verwendung des Ausgangsstoffs, der Zusammensetzung oder des Bestandteils durchzuführen, und das Prüfmuster muss für die ungünstigsten vorhersehbaren Verwendungsbedingungen repräsentativ sein.
1.4. Es sind ausreichende Informationen über die Bestimmung der Migration aller folgenden Stoffe zu erstellen, zumindest einschließlich der in Tabelle 1 aufgeführten Informationen:
1.5. Bei Ausgangsstoffen, bei denen es sich um Metalle oder Legierungen handelt, die nicht in der europäischen Positivliste von Zusammensetzungen als metallene Werkstoffe aufgeführt sind, ist das Migrationswasser aus der Prüfung einer repräsentativen Prüfmusters des endgültigen Materials bzw. Werkstoffs gemäß den Vorschriften in Nummer 1.4 Buchstabe b zu analysieren.
1.6. Alle anderen verfügbaren relevanten Migrationsinformationen sind anzugeben und zu berücksichtigen.
Tabelle 1: Standardinformationen und -prüfungen im Hinblick auf Migration
| Ausgangsstoffe oder organische Materialien/organische zementgebundene Bestandteile | Zusammensetzung metallener Werkstoffe | Zusammensetzung von Emails, keramischen Werkstoffen und anderen anorganischen Materialien | ||
| 5. | Migration: | |||
| 5.1. | Prüfmuster | |||
| 5.1.1. | Ausführliche Beschreibung der Prüfmuster, einschließlich Abmessungen, der Produktion der Prüfmuster und der Lagerung der Prüfmuster zwischen Produktion und Probenahme, einschließlich des Namens des Herstellers der Prüfmuster | |||
| 5.1.2. | Dosis des Ausgangsstoffs/organischen zementgebundenen Bestandteils zur Herstellung der Prüfmuster | |||
| 5.1.3. | Konzentration des Ausgangsstoffs/organischen zementgebundenen Bestandteils in den Prüfmustern | |||
| 5.1.4. | Zusammensetzung der Prüfmuster | Zusammensetzung der Prüfmuster | ||
| 5.1.5. | Rauheit der Innenfläche der Prüfmuster | |||
| 5.2. | Prüfung der hygienischen Sicherheit der Stoffe gemäß Anhang IV Abschnitt 1.4 durch Migrationsmethoden oder elektrochemische Methoden. | Prüfverfahren für werksmäßige Produkte und vor Ort aufgebrachte Produkte, die aus organischen Materialien hergestellt wurden oder diese enthalten, gemäß den Normen in Anhang I des Durchführungsbeschlusses (EU) 2024/368 der Kommission. |
| Prüfverfahren für Produkte, die aus glasartigen Werkstoffen (Porzellan/Glasemail) hergestellt wurden oder diese enthalten, gemäß der Norm in Anhang IV des Durchführungsbeschlusses (EU) 2024/368 der Kommission. |
| 5.3. | Analysemethoden und -techniken | Für die Prüfung gemäß Nummer 5.2 (mit Ausnahme des Prüfverfahrens zur Beurteilung des Passivverhaltens von nichtrostenden Stählen und anderen passiven metallenen Zusammensetzungen): Beschreibung und Einzelheiten der Analysemethoden und -techniken zur Analyse der Konzentrationen potenziell relevanter chemischer Spezies oder Elemente aus Migration und/oder Kontaktwasser aus Migrationsprüfungen. Bei Oberflächenschichten (Beschichtungen, Überzüge) umfasst dies relevante chemische Spezies oder Elemente aus der Oberflächenschicht und dem Substrat. Die Methoden und Techniken sind zu validieren und müssen Mindestverfahrenskennwerten genügen. Die Beschreibung besteht aus den zugrunde liegenden Versuchsprotokollen und der entsprechenden Auswertung der Ergebnisse. Die Informationen müssen die Reproduktion der Methoden ermöglichen. | ||
Abschnitt 2. Allgemeine Vorschriften für Abweichungen von Informationen und Prüfungen in Bezug auf die Migration
2.1. Eine Vorhersage der Migration in organischen Materialien durch mathematische Modellierung gemäß der Migrationsprüfnorm in Anhang I des Durchführungsbeschlusses (EU) 2024/368 der Kommission kann die Prüfung eines in einem organischen Material verwendeten Stoffes gemäß Anhang IV Abschnitt 1.4 ersetzen, wenn auf der Grundlage einer wissenschaftlichen Erklärung eine der folgenden Bedingungen erfüllt ist:
2.2. Auf die physikalische Prüfung einer metallenen Zusammensetzung kann verzichtet werden, wenn ihre Migration aufgrund einer ähnlichen Zusammensetzung oder Struktur wahrscheinlich der einer anderen metallenen Zusammensetzung gleicht und die folgenden Bedingungen erfüllt sind:
In jedem Fall ist eine geeignete und zuverlässige Dokumentation über die angewandte Methode vorzulegen. In dieser Dokumentation ist zu erläutern, warum die Migration der metallenen Zusammensetzung auf der Grundlage der Informationen über die ähnliche metallene Zusammensetzung und der unterstützenden Informationen, die diese Erklärung wissenschaftlich begründen, bestimmt werden kann.
Abschnitt 3. Kriterien für die Identifizierung relevanter chemischer Spezies
Relevante chemische Spezies sind die Spezies, die unter die Anforderungen des Anhangs V fallen, um nachzuweisen, dass der Ausgangsstoff, die Zusammensetzung oder der Bestandteil die Akzeptanzkriterien des Anhangs VI erfüllt. Zu den relevanten chemischen Spezies gehören
| Toxikologische Eigenschaften | Anhang V |
Abschnitt 1. Keine Standardinformationen oder -prüfungen
1.1. Für eine relevante chemische Spezies sind keine Standardinformationen oder -prüfungen erforderlich, wenn eine der folgenden Bedingungen erfüllt ist:
1.2. Für eine relevante chemische Spezies sind keine Standardinformationen oder -prüfungen erforderlich, sofern für einen Zeitraum von weniger als 15 Jahren ab dem Datum der Einreichung des Antrags gemäß Artikel 3 der Delegierten Verordnung (EU) 2024/369 der Kommission in der Verordnung (EU) Nr. 10/2011 der Kommission ein spezifischer Migrationsgrenzwert festgelegt ist.
Abschnitt 2. Standardinformationen oder -prüfungen erforderlich
Teil 1. Allgemeine und besondere Vorschriften
1.1. Prüfungen in diesem Abschnitt werden nach den in der Richtlinie 2004/10/EG festgelegten Grundsätzen der Guten Laborpraxis oder anderen internationalen Standards, die von der Kommission oder von der ECHA als gleichwertig anerkannt sind, und, soweit einschlägig, nach den Vorschriften der Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates 2 durchgeführt.
1.2. Jeder Antragsteller stellt sicher, dass Versuche an Wirbeltieren nur durchgeführt werden, wenn keine alternativen Methoden verfügbar sind, die in diesem Abschnitt aufgeführt sind. Sind Versuche an Wirbeltieren unvermeidbar, so sind diese Versuche gegebenenfalls unter Berücksichtigung der Möglichkeit zu konzipieren, im Rahmen einer Studie in dem nach der entsprechenden Prüfmethode zulässigen Umfang mehrere Parameter zu untersuchen (z.B. Gewinnung kinetischer Daten sowie von Daten zur Mikrokernbildung, Neurotoxizität, Immuntoxizität) oder zwei Studien zu kombinieren (z.B. Studie der Langzeittoxizität und Karzinogenität).
1.3. Prüfungen gemäß diesem Abschnitt sind im Einklang mit der von der ECHA festgelegten und spezifizierten und auf ihrer Website veröffentlichten geeigneten Prüfrichtlinie durchzuführen, wobei insbesondere die Anforderungen gemäß Abschnitt 1.6 zu berücksichtigen sind.
1.4. Für toxikologische Untersuchungen wird ein schrittweiser Ansatz auf der Grundlage des Ctap-Werts einer relevanten chemischen Spezies in Wasser für den menschlichen Gebrauch angewandt. Für das niedrigste Migrationskonzentrationsband sind die Standardinformationen in Tabelle 1 aufgeführt, und bei jedem erreichten neuen Migrationskonzentrationsband werden die Standardinformationen in den entsprechenden Tabellen 2 und 3 hinzugefügt.
Spalte 1 der Tabellen 1, 2 und 3 enthält die Standardinformationen für relevante chemische Spezies.
Spalte 2 der Tabellen 1, 2 und 3 enthält besondere Vorschriften, nach denen Standardinformationen und -prüfungen entfallen können.
Standardinformationen und -prüfungen können nach der allgemeinen Vorschrift in Teil 2 angepasst werden.
1.5. Alle anderen verfügbaren toxikologischen Informationen sind anzugeben und zu berücksichtigen.
1.6. Bietet eine Prüfmethode Flexibilität bei der Festlegung oder Wahl des Prüfschemas, auch indem bestimmte Studienspezifikationen nicht verboten werden, beispielsweise in Bezug auf die Wahl der Dosierung, so muss mit dem gewählten Prüfschema sichergestellt werden, dass die erstellten Daten für die Ermittlung der Gefahren und die Risikobewertung ausreichen. Zu diesem Zweck müssen die Versuche mit ausreichend hoher Dosierung durchgeführt werden. Wird die Wahl der Dosis (Konzentration) durch die physikalisch-chemischen Eigenschaften oder die biologischen Wirkungen des zu prüfenden Stoffs eingeschränkt, muss der Antragsteller eine wissenschaftlich solide Begründung vorlegen.
Tabelle 1: Standardinformationen und -prüfungen - Ctap unter 2,5 μg/l
| Spalte 1 Standardinformationen und -prüfungen | Spalte 2 Besondere Vorschriften für Abweichungen von Standardinformationen und -prüfungen | |
| 6.1. | Gentoxizität/Mutagenität: | |
| 6.1.1. | In-vitro-Gentoxizität | |
| 6.1.1.1. | In-vitro-Genmutationsstudie an Bakterien | Die In-vitro-Genmutationsstudie an Bakterien muss nicht durchgeführt werden, wenn diese Prüfung für die relevante chemische Spezies nicht anwendbar ist. In diesem Fall hat der Antragsteller eine Begründung vorzulegen und eine In-vitro-Studie gemäß Nummer 6.1.1.3 durchzuführen. Keine Studie für Nanoformen erforderlich, für die sie nicht geeignet ist. In diesem Fall sind weitere Studien mit In-vitro-Mutagenitätsversuchen an Säugetierzellen vorzulegen. |
| 6.1.1.2. | In-vitro-Chromosomenaberrationsstudie an Säugetierzellen oder In-vitro-Mikronukleustest an Säugetierzellen | Es muss keine Studie durchgeführt werden, wenn ausreichende Daten aus einem In-vivo-Zytogenitätsversuch vorliegen. |
| 6.1.1.3. | In-vitro-Genmutationstest an Säugetierzellen | Diese Studie wird in folgenden Fällen durchgeführt:
Es muss keine Studie durchgeführt werden, wenn ausreichende Daten aus einem In-vivo-Mutagenitätsversuch an Säugetierzellen vorliegen. |
| 6.1.2. | In-vivo-Gentoxizität | |
| 6.1.2.1. | Eine geeignete In-vivo- Studie der Genotoxizität an somatischen Säugetierzellen | Die Studie ist durchzuführen, wenn eine der in Nummer 6.1.1 genannten In-vitro-Studien auf Genotoxizität ein positives Ergebnis aufweist, das Anlass zur Besorgnis gibt. Die Studie hat sich mit Bedenken hinsichtlich einer Chromosomenaberration oder einer Genmutation oder beider Wirkungen wie jeweils anwendbar zu befassen. |
| 6.1.2.2. | Eine geeignete In-vivo-Studie der Genotoxizität an Säugetier-Keimzellen | Die Studie ist durchzuführen, wenn eine verfügbare In-vivo-Prüfung auf Genotoxizität an somatischen Säugetier-Keimzellen ein positives Ergebnis aufweist, das Anlass zur Besorgnis gibt. Die Studie hat sich mit Bedenken hinsichtlich einer Chromosomenaberration oder einer Genmutation oder beider Wirkungen wie jeweils anwendbar zu befassen. Die Studie ist nicht erforderlich, wenn eindeutig nachgewiesen ist, dass weder die relevante chemische Spezies noch ihre Metaboliten die Keimzellen erreichen. |
| 6.2. | Geeignete Toxikokinetik- und Metabolismusstudien an Säugetieren, geeignete Studie der Toxizität bei wiederholter Applikation, geeignete Reproduktionstoxizitätstudie, geeignete Karzinogenitätsstudie oder geeignete zusätzliche Studien gemäß den Tabellen 2 und 3 | Die Studie ist durchzuführen, wenn Informationen vorliegen, die für mindestens eine der folgenden in Anhang I der Verordnung (EG) Nr. 1272/2008 festgelegten Gefahrenklassen Anlass zur Besorgnis geben:
Spezifische Zielorgan-Toxizität - wiederholte Exposition (STOT RE), Karzinogenität, Mutagenität oder Reproduktionstoxizität (CMR) oder endokrine Disruption mit Wirkung auf die menschliche Gesundheit. In der Studie sind alle festgestellten Bedenken zu behandeln. |
Tabelle 2: Standardinformationen und -prüfungen - Ctap mindestens 2,5 μg/l und höchstens 250 μg/l
| Spalte 1 Standardinformationen und -prüfungen | Spalte 2 Besondere Vorschriften für Abweichungen von Standardinformationen und -prüfungen | |
| 7.1. | Toxikokinetik- und Metabolismusstudien an Säugetieren: | |
| 7.1.1. | Daten zum Nachweis des Nichtvorhandenseins von Akkumulationspotenzial beim Menschen | |
| 7.2. | Toxizität bei wiederholter Applikation: | |
| 7.2.1. | Studie der subchronischen Toxizität bei wiederholter Applikation (90 Tage) an einer Tierart (Nagetiere), männlich und weiblich, auf oralem Verabreichungsweg | Die Studie ist nicht erforderlich, wenn eine der folgenden Bedingungen erfüllt ist:
|
| 7.3. | Reproduktionstoxizität: | |
| 7.3.1. | Screeningstudie zur Reproduktions-/Entwicklungstoxizität | Die Studie ist nicht erforderlich, wenn eine der folgenden Bedingungen erfüllt ist:
|
| 7.4. | Geeignete Toxikokinetik- und Metabolismusstudien, geeignete Studie der Toxizität bei wiederholter Applikation, geeignete Reproduktionstoxizitätstudie, geeignete Karzinogenitätsstudie oder geeignete zusätzliche Studien gemäß der Tabelle 3 | Die Studie ist durchzuführen, wenn Informationen vorliegen, die für mindestens eine der folgenden in Anhang I der Verordnung (EG) Nr. 1272/2008 festgelegten Gefahrenklassen Anlass zur Besorgnis geben:
STOT RE oder CMR oder endokrine Disruption mit Wirkung auf die menschliche Gesundheit. In der Studie sind alle festgestellten Bedenken zu behandeln. |
Tabelle 3: Standardinformationen und -prüfungen - Ctap mindestens 250 μg/l
| Spalte 1 Standardinformationen und -prüfungen | Spalte 2 Besondere Vorschriften für Abweichungen von Standardinformationen und -prüfungen | |
| 8.1. | Toxikokinetik- und Metabolismusstudien an Säugetieren: | |
| 8.1.1. | Studie zur Absorption, Verteilung, Metabolisierung und Ausscheidung | |
| 8.1.2. | Überlegungen zum möglichen Bedarf an zusätzlichen toxikokinetischen Informationen | Je nach den Ergebnissen der an Ratten durchgeführten Toxikokinetik- und Metabolismusstudie oder der Bewertung des toxikologischen und physikalisch-chemischen Profils der betreffenden chemischen Spezies könnten zusätzliche Informationen erforderlich sein. |
| 8.2. | Toxizität bei wiederholter Applikation: | |
| 8.2.1. | Langzeittoxizität bei wiederholter Applikation (≥ 12 Monate), oraler Verabreichungsweg | Diese Studie ist nicht erforderlich, wenn die kombinierte Studie auf chronische Toxizität/Karzinogenitätsstudie gemäß Nummer 8.4.1 vorgelegt wird. |
| 8.3. | Reproduktionstoxizität: | Die Studien sind nicht erforderlich, wenn die relevante chemische Spezies nur geringe toxische Aktivität besitzt (kein Anzeichen für Toxizität in den vorliegenden Prüfergebnissen, sofern ein ausreichend umfassender und aussagekräftiger Datensatz verwendet wurde) und wenn anhand toxikokinetischer Daten belegt werden kann, dass es auf dem oralen Expositionsweg zu keiner systemischen Absorption kommt (wenn z.B. die Konzentration im Plasma/Blut bei Anwendung einer empfindlichen Analysemethode unter der Nachweisgrenze liegt und die relevante chemische Spezies und ihre Metaboliten im Urin oder in der Gallenflüssigkeit nicht nachweisbar sind). |
| 8.3.1. | Erweiterte Eingenerationen-Studie auf Reproduktionstoxizität, oraler Verabreichungsweg | Eine erweiterte Eingenerationen-Studie auf Reproduktionstoxizität mit Ausweitung der Kohorte 1B auf die F2-Generation, sofern eine der folgenden Bedingungen erfüllt ist:
Eine erweiterte Eingenerationen-Studie auf Reproduktionstoxizität einschließlich der Kohorten 2A/2B (Entwicklungsneurotoxizität) und/oder Kohorte 3 (Entwicklungsimmunotoxizität) ist in Fällen durchzuführen, in denen besondere Bedenken in Bezug auf die (Entwicklungs-) Neurotoxizität oder die (Entwicklungs-) Immunotoxizität bestehen, die begründet sind durch:
Zweigenerationen-Studien auf Reproduktionstoxizität, die vor dem 13. Mai 2015 begonnen wurden, sind als geeignet anzusehen, um diese Standardinformationsanforderung zu erfüllen. |
| 8.3.2. | Studie zur Prüfung auf pränatale Entwicklungstoxizität an Ratten, es sei denn, eine andere Tierart ist nachweislich geeigneter, oraler Verabreichungsweg | |
| 8.3.3. | Weitere Studie zur Prüfung auf pränatale Entwicklungstoxizität an einer zweiten Tierart, oraler Verabreichungsweg oder mechanistische Studie | Über die Notwendigkeit zusätzlicher Prüfungen an einer weiteren Tierart oder von mechanistischen Studien ist in Abhängigkeit vom Ergebnis der ersten Prüfung (Nummer 8.3.2) sowie unter Berücksichtigung aller sonstigen relevanten verfügbaren Daten zu entscheiden (insbesondere Studien zur Reproduktionstoxizität bei Nagetieren). |
| 8.4. | Karzinogenität: Siehe Abschnitt 8.4.1 für neue Studienanforderungen | Die Studie muss nicht vorgelegt werden, sofern alle folgenden Bedingungen erfüllt sind:
|
| 8.4.1. | Kombinierte Studie auf chronische Toxizität/Karzinogenitätsstudie, oraler Verabreichungsweg | Keine Prüfung erforderlich, wenn ausreichende Daten aus einer zuverlässigen Karzinogenitätsstudie (oraler Verabreichungsweg) vorliegen: In diesem Fall ist die Prüfung der Langzeittoxizität bei wiederholter Applikation gemäß Nummer 8.2.1 vorzulegen. |
| 8.5. | Zusätzliche Toxizitätseigenschaften: | Bei Hinweisen auf einen oder mehrere Wirkungsmechanismen/Wirkungsweisen der betreffenden chemischen Spezies in Verbindung mit (Entwicklungs-)Neurotoxizität und/oder endokriner Disruption und/oder (Entwicklungs-)Immunotoxizität sind entsprechende zusätzliche Daten gemäß dieser Nummer zu erstellen, es sei denn, diese sind in den Informationen in Nummer 8.3.1 bereits vollständig abgedeckt. |
| 8.5.1. | Geeignete Informationen oder Studien zur Neurotoxizität, einschließlich Entwicklungsneurotoxizität, an Ratten, es sei denn, eine andere Tierart ist nachweislich geeigneter (z.B. erwachsene Hennen für eine verzögerte Neurotoxizitätsstudie), oraler Expositionsweg | Wird eine Cholinesterasehemmung entdeckt, sollte eine Untersuchung über das Ansprechen auf Reaktivatoren durchgeführt werden. |
| 8.5.2. | Geeignete Informationen oder Studien zu endokriner Disruption, gegebenenfalls auf oralem Expositionsweg | Diese Standardinformationen oder -studien müssen erstellt werden, wenn aus In-vitro-Studien, Studien bei wiederholter Applikation oder Reproduktionstoxizitätsstudien hervorgeht, dass die relevante chemische Spezies endokrinschädliche Eigenschaften in Bezug auf die menschliche Gesundheit haben kann, um die Wirkungsweise/den Wirkungsmechanismus zu klären und ausreichende Nachweise für relevante schädliche Wirkungen zu liefern. |
| 8.5.3. | Geeignete Informationen oder Studien zur Immuntoxizität, einschließlich Entwicklungsimmuntoxizität | Diese Standardinformationen oder -studien müssen erstellt werden, wenn aus Studien zur Hautsensibilisierung, Studien mit wiederholter Verabreichung oder Studien zur Toxizität bei wiederholter Verabreichung oder Reproduktionstoxizitätsstudien hervorgeht, dass die relevante chemische Spezies immuntoxische Eigenschaften haben kann, um die Wirkungsweise/den Wirkungsmechanismus zu klären und ausreichende Nachweise für relevante schädliche Wirkungen zu liefern. |
| 8.5.4. | Geeignete mechanistische Daten oder Studien | Diese Standardinformationen oder -prüfungen sind erforderlichenfalls zu erstellen, um etwaige in Toxizitätsstudien berichtete Wirkungen zu klären. |
Teil 2.Allgemeine Vorschriften für Abweichungen von Spalte 1 der Tabellen 1, 2 und 3
2.1. Die allgemeinen Vorschriften für Abweichungen in Anhang XI Abschnitte 1 und 2 der Verordnung (EG) Nr. 1907/2006 gelten entsprechend, wobei die Ausnahme gemäß Abschnitt 2.2 gilt.
2.2. Die allgemeinen Vorschriften für Abweichungen in Anhang XI Abschnitte 1.3 (Quantitative oder qualitative Struktur-Wirkungs-Beziehung ((Q)SAR)) und 1.5 (Stoffgruppen- und Analogiekonzept) der Verordnung (EG) Nr. 1907/2006 gelten für die in Tabelle 1 Nummer 6.1.1 genannten Standardinformationen und -prüfungen nur im Falle eines Stoffbestandteils oder einer unbeabsichtigt eingebrachten Spezies, für die experimentelle Prüfungen technisch nicht möglich sind (z.B. kann nicht isoliert und so getestet werden).
2) Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (ABl. L 276 vom 20.10.2010 S. 33).
| Akzeptanzmethode | Anhang VI |
Abschnitt 1. Methode für beschränkte Akzeptanz
1.1. Abschnitt 2 gilt nicht für eine relevante chemische Spezies, bei der es sich um einen Ausgangsstoff, einen organischen zementgebundenen Bestandteil, einen Stoffbestandteil oder eine unbeabsichtigt eingebrachte Art handelt, wenn ein solcher Stoff oder Bestandteil
In beiden Fällen werden die in Absatz 1 genannten Ausgangsstoffe oder organischen zementgebundenen Bestandteile unter folgenden Verwendungsbedingungen in die europäische Positivliste aufgenommen:
1.2. Abschnitt 2 Teil 2.4 gilt nicht für den Fall, dass Bedenken bestehen, dass eine relevante chemische Spezies, bei der es sich um einen Ausgangsstoff, einen organischen zementgebundenen Bestandteil, einen Stoffbestandteil oder eine unbeabsichtigt eingebrachte Spezies handelt, genotoxische, karzinogene oder endokrinschädigende Eigenschaften für die menschliche Gesundheit ohne Schwellenwert für die Wirkungsweise aufweist.
In diesem Fall können die in Absatz 1 genannten Ausgangsstoffe oder organischen zementgebundenen Bestandteile in die europäische Positivliste aufgenommen werden, sofern der Ctap-Wert niedriger ist als der allgemeine Grenzwert von 0,1 μg/l oder der relevante MTCtap-Wert, der anhand eines Parameterwerts gemäß Anhang I der Richtlinie (EU) 2020/2184 unter Anwendung eines geeigneten ALF berechnet wird, um neben der Exposition durch Materialien bzw. Werkstoffe, die in Produkten verwendet werden, die mit Wasser für den menschlichen Gebrauch in Kontakt kommen, mehrere Expositionswege gegenüber den relevanten chemischen Spezies zu berücksichtigen.
1.3. Abschnitt 2 Teil 2 findet in den folgenden Fällen keine Anwendung auf die relevante chemische Spezies:
1.4. Abschnitt 2 Teil 2.4 findet in den folgenden Fällen keine Anwendung:
Abschnitt 2. Methode für umfassende Akzeptanz
Teil 1. Einführung
1.1. Die Akzeptanzmethode für Ausgangsstoffe, Zusammensetzungen und Bestandteile beruht auf einer Risikobewertung. Diese Risikobewertung dient zu Folgendem:
1.2. Zusätzlich zu den gemäß den Anhängen I, II und III erforderlichen Informationen werden bei der Risikobewertung alle anderen einschlägigen technischen oder wissenschaftlichen Informationen über die ungünstigsten vorhersehbaren Verwendungsbedingungen berücksichtigt. Gegebenenfalls sind die Verwendungsbedingungen umzusetzen.
1.3. Anhand der in der Risikobewertung enthaltenen Informationen kann der ECHA-Ausschuss für Risikobeurteilung entscheiden, ob der Ausgangsstoff, die Zusammensetzung oder der Bestandteil die Kriterien gemäß Artikel 11 Absatz 1 der Richtlinie (EU) 2020/2184 erfüllt, und eine Stellungnahme dazu abgeben.
Teil 2. Gefahrenbewertung
2.1. Grundsätze
2.1.1. Für die Akzeptanz eines Ausgangsstoffs, einer Zusammensetzung oder eines Bestandteils umfasst das Verfahren zur Gefahrenbewertung in Bezug auf die menschliche Gesundheit eine Bewertung der Auswirkungen, zu der die folgenden Schritte gehören:
2.1.2. Bei der Bewertung der Gefahren für die menschliche Gesundheit werden die folgenden potenziellen toxischen Wirkungen für die allgemeine Bevölkerung und der orale Expositionsweg berücksichtigt:
2.1.3. Bei der Ermittlung der Gefahren sind die Eigenschaften und potenziell schädlichen Wirkungen der relevanten chemischen Spezies, die aus dem Material bzw. Werkstoff migrieren, zu berücksichtigen.
2.2.Bewertung der Dosis-Wirkungs-Beziehung
2.2.1. Die Dosis-(Konzentration-)Wirkung-Beziehung muss bestimmt werden, und wenn möglich, ist ein NOAEL-Wert (no observed adverse effect level - Dosis ohne beobachtbare schädliche Wirkung) zu ermitteln. Sofern die Bestimmung eines NOAEL-Wertes nicht möglich ist, wird ein LOAEL-Wert (lowest-observed-adverse-effect-level - niedrigste Dosis mit beobachtbarer schädlicher Wirkung) bestimmt. Gegebenenfalls können andere Dosis-Wirkung-Deskriptoren als Referenzwerte verwendet werden.
2.2.2. Bei der Durchführung der Risikobewertung sind Toxizitätsdaten, die aus Beobachtungen der Exposition des Menschen hergeleitet werden (z.B. Informationen aus der Herstellung, aus Giftnotrufzentralen oder epidemiologischen Erhebungen), besonders zu berücksichtigen.
2.3.Abgeleitete Expositionshöhe ohne Beeinträchtigung
2.3.1. Die Ableitung eines DNEL-Werts (derived no effect level - abgeleitete Expositionshöhe ohne Beeinträchtigung) erfolgt gemäß Anhang I Abschnitt 1.4 der Verordnung (EG) Nr. 1907/2006.
2.4. Maximal zulässige Konzentration an der Zapfstelle (MTCtap)
2.4.1. In Abhängigkeit von Teil 2.4.2. entspricht MTCtap einem Wert, der auf der Grundlage der sicheren oralen Dosis (DNEL), des Körpergewichts (60 kg), einer Trinkwasseraufnahme von 2 l (Liter) pro Tag und eines geeigneten ALF (ausgedrückt in Prozent) berechnet wird, um neben der Exposition durch Materialien bzw. Werkstoffe, die in Produkten verwendet werden, die mit Wasser für den menschlichen Gebrauch in Kontakt kommen, mehrere Expositionswege gegenüber den relevanten chemischen Spezies zu berücksichtigen.
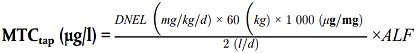
2.4.2. Abweichend von Teil 2.4.1:
Teil 3. Migrationsbewertung
3.1. Der mit dem MTCtap-Wert zu vergleichende Ctap-Wert wird auf der Grundlage der ungünstigsten vorhersehbaren Verwendungsbedingungen bestimmt, auch im Hinblick auf die Repräsentativität der Konzentration in der Material- bzw. Werkstoffmatrix und auf das Verhältnis Wasseroberfläche zu Wasservolumen und -temperatur, die von der ECHA für jede Prüfmethode festgelegt und auf ihrer Website veröffentlicht wurde, wobei insbesondere die Anforderungen an die Bestimmung auf der Grundlage der ungünstigsten vorhersehbaren Verwendungsbedingungen und die entsprechende EN-Norm zu berücksichtigen sind.
Teil 4. Risikoakzeptanz
4.1.Risikoakzeptanz für Ausgangsstoffe für organische Materialien, zementgebundene organische Bestandteile und Zusammensetzungen von Emails, keramischen Werkstoffen und anderen anorganischen Materialien
Der Ausgangsstoff, die Zusammensetzung oder der Bestandteil werden akzeptiert, wenn am 10. Tag der Prüfung gemäß Anhang IV Tabelle 1 Nummer 5.2 für jede relevante chemische Spezies Ctap < MTCtap ist.
4.2.Risikoakzeptanz für metallene Werkstoffe
Bei der Bewertung der Prüfstandsergebnisse (gemäß der Norm EN 15664-1) ist das arithmetische Mittel der äquivalenten Rohrkonzentrationen MEPn(T) aus der Analyse relevanter Kontaktwässer (siehe Anhang IV Abschnitt 1.1) zu berücksichtigen.
Die Zusammensetzung kann für eine Produktgruppe mit der angenommenen Kontaktoberfläche a (siehe Anhang II Tabelle 2) akzeptiert werden, wenn für alle erforderlichen Prüfwässer die folgenden Kriterien erfüllt sind:
 | ENDE |  |