 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 1978, Lebensmittel - Futtermittel

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 1978, Lebensmittel - Futtermittel |  |
Achte Richtlinie 78/633/EWG der Kommission vom 15. Juni 1978 zur Festlegung gemeinschaftlicher Analysemethoden für die amtliche Untersuchung von Futtermitteln
(ABl. Nr. L 206 vom 29.07.1978 S. 43;
RL 81/680/EWG - ABl. Nr. L 246 vom 29.08.1981 S. 32;
RL 84/4/EWG - ABl. Nr. L 15 vom 18.01.1984 S. 28;
VO (EG) 152/2009 - ABl. Nr. L 54 vom 26.02.2009 S. 1 aufgehoben)
aufgehoben/ersetzt gem. Art. 6 der VO (EG) 152/2009 - Entsprechungstabelle
Die Kommission der Europäischen Gemeinschaften -
gestützt auf den Vertrag zur Gründung der Europäischen Wirtschaftsgemeinschaft,
gestützt auf die Richtlinie 70/373/EWG des Rates vom 20. Juli 1970 über die Einführung gemeinschaftlicher Probenahmeverfahren und Analysemethoden für die amtliche Untersuchung von Futtermitteln 1,
zuletzt geändert durch die Beitrittsakte, insbesondere auf Artikel 2,
in Erwägung nachstehender Gründe:
Die obengenannte Richtlinie bestimmt, dass die amtlichen Untersuchungen von Futtermitteln zur Feststellung, ob die aufgrund der Rechts- oder Verwaltungsvorschriften festgelegten Anforderungen hinsichtlich Beschaffenheit und Zusammensetzung der Futtermittel erfüllt sind, nach gemeinschaftlichen Probenahmeverfahren und Analysemethoden durchgeführt werden.
Mit den Richtlinien der Kommission 71/250/EWG vom 15. Juni 1971 2, 71/393/EWG vom 18. November 1971 3, 72/199/EWG vom 27. April 1972 4, 73/46/EWG vom 5. Dezember 1972 5, 74/203/EWG vom 25. März 1974 6, 75/84/EWG vom 20. Dezember 1974 7 und 76/372/EWG vom 1. März 1976 8 wurde bereits eine Reihe von Analysemethoden festgelegt. Der Stand der seitdem durchgeführten Arbeiten ermöglicht es nunmehr, eine achte Reihe von Analysemethoden festzulegen.
Die in dieser Richtlinie vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Futtermittelausschusses
- hat folgende Richtlinie erlassen:
(1) Die Mitgliedstaaten schreiben vor, dass die Analysen für die amtliche Untersuchung von Futtermitteln auf ihren Gehalt an Zink-Bacitracin, Flavophospholipol, Eisen, Kupfer, Mangan und Zink nach den in der Anlage zu dieser Richtlinie beschriebenen Methoden durchgeführt werden.
Die Mitgliedstaaten setzen zum 1. Januar 1979 die erforderlichen Rechts- oder Verwaltungsvorschriften in Kraft, um den Bestimmungen dieser Richtlinie nachzukommen. Sie setzen die Kommission unverzüglich hiervon in Kenntnis.
Diese Richtlinie ist an alle Mitgliedstaaten gerichtet.
| Anlage |
1. Bestimmung von Zink-Bacitracin
- durch Diffusion in Agarnährboden -
1. Zweck und Anwendungsbereich
Die Methode dient zur Bestimmung von Zink-Bacitracin in Futtermitteln und Vormischungen. Die untere Grenze der Bestimmbarkeit beträgt 5 mg/kg (5 ppm) 9
2. Prinzip
Die Probe wird bei pH 2 mit einer Mischung aus Methanol/Wasser/ Salzsäure unter Zusatz einer Natriumsulfidlösung extrahiert. Natriumsulfid wird zugefügt, um etwa vorhandene lösliche Kupfersalze, die den Test stören würden, auszufällen. Der Extrakt wird erforderlichenfalls auf pH 6,5 gebracht, konzentriert und verdünnt. Die antibiotische Aktivität wird durch Messung der Diffusion des Zink-Bacitracin in einem mit Micrococcus luteus (flavus) beimpften Agarnährboden bestimmt. Die Diffusion wird durch die entstehenden Hemmzonen des Testorganismus nachgewiesen. Der Durchmesser dieser Hemmzonen wird für den Bereich der angewandten Konzentrationen als dem Logarithmus der Konzentration an Antibiotikum direkt proportional angesehen.
3. Testorganismus: Micrococcus Luteus (Flavus) ATCC 10240
3.1. Haltung der Stammkultur
Agarschrägröhrchen mit Kulturnährboden (4.1) werden mit Micrococcus luteus (flavus) beimpft und 24 Stunden lang bei 30 °C bebrütet. Die Kultur wird im Kühlschrank bei etwa 4 °C aufbewahrt und alle zwei Wochen neu überimpft.
3.2. Herstellung der Bakteriensuspensionen a
Eine junge Kultur auf Agarschrägröhrchen (3.1) wird mit 2 bis 3 ml Natriumchloridlösung (4.3) abgewaschen. Mit dieser Suspension wird eine Rouxflasche, die 250 ml des Nährbodens (4.1) enthält, beimpft und 18 bis 20 Stunden lang bei 30 °C bebrütet. Die Kultur wird in 25 ml Natriumchloridlösung (4.3) aufgenommen und gemischt.
Die Suspension wird 1:10 mit Natriumchloridlösung (4.3) verdünnt. Die Lichtdurchlässigkeit der Suspension soll bei 650 nm und 1 cm Schichtdichte gegen Natriumchloridlösung (4.3) bei 75 v. H. liegen. Diese Suspension kann eine Woche lang bei ungefähr 4 °C aufbewahrt werden.
4. Nährböden und Reagenzien
| Fleischpepton | 6,0 g, |
| Caseinpepton | 4,0 g, |
| Hefeextrakt | 3,0 g, |
| Fleischextrakt | 1,5 g, |
| Glukose | 1,0 g, |
| Agar | 10,0 bis 20,0 g |
| Wasser pH 6,5 - 6,6 (nach Sterilisation) | 1.000 ml, |
| Trypton | 10,0 g, |
| Hefeextrakt | 3,0 g, |
| Fleischextrakt | 1,5 g, |
| Glukose | 1,0 g, |
| Agar | 10,0 bis 20,0 g, |
| Tween 80 | 1 ml, |
| Wasser pH 6,5 (nach Sterilisation) | 1.000 ml, |
4.3. Natriumchloridlösung 0,8 v. H. (G/V): 8 g Natriumchlorid werden in Wasser aufgelöst, auf 1.000 ml verdünnt und sterilisiert.
4.4. Mischung aus Methanol/Wasser/Salzsäure (4.6): 80: 17,5: 2,5 (V/V/V).
4.5. Phosphatpuffer, pH 6,5
| Di-Kaliumhydrogenphosphat, K2HPO4 | 22,15 g, |
| Kaliumdihydrogenphosphat, KH2PO4 | 27,85 g, |
| Wasser | 1.000 ml. |
4.6. Salzsäure, d: 1,18 - 1,19.
4.7. Salzsäure, 0,1 M.
4.8. Natronlauge, 1 M.
4.9. Natriumsulfid, ca. 0,5 M Lösung.
4.10 Bromkresol-Purpurlösung 0,04 v. H. (G/V): 0,1 g Bromkresol-Purpur werden in 18,5 ml 0,01 M Natronlauge aufgelöst und mit Wasser auf 250 ml aufgefüllt und gemischt.
4.11. Standardsubstanz: Zink-Bacitracin mit bekannter Aktivität (in IE).
5. Standardlösung
Eine Menge der Standardsubstanz (4.11), die 1050 IE (gemäß der angegebenen Aktivität) entspricht, wird abgewogen, mit 5 ml 0,1 M Salsäure versetzt und 15 Minuten stehengelassen. Dann werden 30 ml Wasser hinzugefügt, der pH-Wert auf 4,5 mit Phosphatpuffer (4.5) (ungefähr 4 ml) eingestellt, die Lösung mit Wasser auf 50 ml aufgefüllt und gut gemischt (1 ml = 21 IE).
Aus dieser Lösung werden durch aufeinanderfolgende Verdünnungen mit Phosphatpuffer (4.5) folgende Lösungen hergestellt:
| S8 | 0,42 | IE/ml, |
| S4 | 0,21 | IE/ml, |
| S2 | 0,105 | IE/ml, |
| S1 | 0,0525 | IE/ml. |
6. Herstellung des Extrakts und der Testlösungen
6.1. Extraktion
6.1.1. Vormischungen und mineralische Futtermittel
Eine Menge von 2,0 bis 5,0 g der Probe wird abgewogen und mit 29,0 ml der Mischung (4.4) und 1,0 ml Natriumsulfidlösung (4.9) versetzt und kurz geschüttelt. Es ist darauf zu achten, dass der pH-Wert bei 2 liegt. Die Mischung wird 10 Minuten lang geschüttelt und mit 30 ml des Phosphatpuffers (4.5) versetzt, dann erneut 15 Minuten geschüttelt und zentrifugiert. Ein angemessener Anteil des Überstands wird entnommen und der pH-Wert durch eine Zugabe von 1 M Natronlauge (4.8) mit einem pH-Meter oder mit Bromkresol-Purpurlösung (4.10) als Indikator auf 6,5 eingestellt.
Anschließend wird mit Phosphatpuffer (4.5) verdünnt, um einen erwarteten Zink-Bacitracingehalt von 0,42 IE/ml (= U8) zu erhalten.
6.1.2. Eiweißkonzentrate
Eine Menge von 10,0 g der Probe wird abgewogen, mit 49,0 ml der Mischung (4.4) und 1,0 ml Natriumsulfidlösung (4.9) versetzt und kurz geschüttelt. Es ist darauf zu achten, dass der pH-Wert bei 2 liegt. Die Mischung wird 10 Minuten lang geschüttelt. Dann werden 50 ml des Phosphatpuffers (4.5) zugesetzt, 15 Minuten lang geschüttelt und zentrifugiert. Anschließend wird eine angemessene Menge der überstehenden Lösung entnommen und der pH-Wert durch Zugabe von 1 M Natronlauge (4.8) mit einem pH-Meter oder mit Bromkresolpurpurlösung (4.10) als Indikator auf 6,5 eingestellt. Die Mischung wird in einem Vakuum-Rotationsverdampfer bei höchstens 35 °C auf ungefähr die Hälfte eingedampft.
Der Rückstand wird mit Phosphatpuffer (4.5) verdünnt, um einen erwarteten Zink-Bacitracingehalt von 0,42 IE/ml (= U8) zu erhalten.
6.1.3. Sonstige Futtermittel
Eine Menge von 10,0 g (20,0 g für einen erwarteten Zink-Bacitracingehalt von 5 mg/kg) der Probe wird abgewogen, mit einer Mischung aus 24,0 ml der Mischung (4.4) und 1,0 ml Natriumsulfidlösung (4.9) versetzt und 10 Minuten lang homogenisiert. Anschließend werden 25 ml Phosphatpuffer (4.5) zugesetzt und 15 Minuten lang geschüttelt und zentrifugiert. Von der überstehenden Lösung werden 20 ml entnommen und der pH-Wert mit Hilfe einer 1 M Natronlauge (4.8) mit einem pH-Meter oder mit Bromkresolpurpurlösung (4.10) als Indikator auf 6,5 eingestellt. Die Mischung wird in einem Vakuum-Rotationsverdampfer bei höchstens 35 °C auf ungefähr 4 ml eingedampft. Der Rückstand wird mit Phosphatpuffer verdünnt (4.5), um einen erwarteten Zink-Bacitracingehalt von 0,42 IE/ml (= U8) zu erhalten.
6.2. Testlösungen
Von der Lösung U8 werden die Lösungen U4 (erwarteter Gehalt: 0,21 IE/ ml), U2 (erwarteter Gehalt: 0,105 IE/ml) und U1 (erwarteter Gehalt: 0,0525 IE/ml) durch aufeinanderfolgende Verdünnung (1: 1) mit Phosphatpuffer (4.5) hergestellt.
7. Testverfahren
7.1. Beimpfung des Nährbodens
Der Testnährboden (4.2) wird mit der Bakteriensuspension (3.2) bei ungefähr 50 °C beimpft. Bei Vorversuchen auf Platten mit dem Testnährboden (4.2) wird die Menge des Inokulums ermittelt, die möglichst große, aber noch scharfe Hemmzonen mit den verschiedenen Zink-Bacitracin-Konzentrationen ergibt.
7.2. Herstellung der Platten
Der Test ist als Diffusionstest auf Platten mit je vier Konzentrationsstufen der Standardlösung (S8, S4, S2, S1) und der Testlösungen (U8, U4, U2, U1) angelegt. Jede Platte erhält unbedingt alle vier Konzentrationen des Standards und des Extrakts. Daher muss die Plattengröße so bemessen sein, dass mindestens acht Löcher mit einem Durchmesser von 10-13 mm und mindestens 30 mm zwischen den Lochzentren in die Nährbodenschicht gestanzt werden können. Der Test sollte vorzugsweise auf Platten durchgeführt werden, die aus einer Glasscheibe mit einem daraufgelegten plangedrehten Aluminium- oder Kunstoffring von 20 mm Höhe und 200 mm Durchmesser hergestellt werden.
Auf die Platten wird eine Menge des nach 7.1 beimpften Testnährbodens (4.1) gegossen, so dass sich eine ca. 2 mm dicke Schicht ergibt (60 ml für eine Platte von 200 mm Durchmesser). Nachdem die Schicht festgeworden ist, werden die Löcher gestanzt und genau abgemessene Mengen der Standard- und Testlösungen einpipettiert. (Zwischen 0,10 und 0,15 ml pro Loch, je nach Lochdurchmesser). Jede Konzentration muss mindestens in vierfacher Wiederholung angewendet werden, so dass für jeden Test 32 Hemmzonen ausgewertet werden.
7.3. Inkubation
Die Inkubation erfolgt während 16 bis 18 Stunden bei 30° C ± 2° C.
8. Auswertung
Der Durchmesser der Hemmzonen wird auf 0,1 mm genau gemessen. Für jede Konzentration werden die Mittelwerte auf Semilogarithmenpapier aufgetragen, wobei der Logarithmus der Konzentrationen gegen den Durchmesser der Hemmzonen eingetragen wird. Für die Standardlösung sowie für den Extrakt werden die geeignetsten Geraden - wie beispielsweise nachstehend berechnet - gezogen. Der geeignetste Punkt für das niedrigste Niveau der Standardlösung (SL) wird nach folgender Formel ermittelt:
(a) SL = (7s1 + 4s2 + s4 - 2s8) / 10
Der geeignetste Punkt für das höchste Niveau der Standardlösung (SH) wird nach folgender Formel ermittelt:
(b) SH = (7s8 + 4s4 + s2 - 2s1) / 10
Genauso werden durch die geeignetsten Punkte für das niedrigste (UL) und höchste Niveau (UH) des Extrakts errmittelt, indem in der obigen Formel - anstelle von s1, s2, s4 und s8 - u1, u2, u4 und u8 eingesetzt werden.
Die ermittelten SL- und SH-Werte werden auf dasselbe Diagramm aufgetragen. Indem man die beiden Punkte miteinander verbindet, erhält man die geeignetste Gerade für die Standardlösung. Ebenso wird mit den UL- und UH-Werten verfahren, um die geeignetste Gerade für den Extrakt zu erhalten.
In Abwesenheit von Störfaktoren sollten die Geraden parallel sein. Die Geraden können als parallel angesehen werden, wenn die Werte (SHSL) und (UH-UL) nicht mehr als 10 v. H. vom Mittelwert abweichen.
Falls die Geraden nicht parallel sind, kann man entweder u1 und s1 oder u8 und s8 ausschalten. Dann sind die Werte, SL, SH, UL und UH mit folgenden Formeln zu ermitteln, um die geeignetste Gerade zu erhalten:
(a") SL = (5s1 +2s2 -s4) / 6 oder (5s2 +2s4 - s8) / 6
(b") SH = (5s4 + 2s2 -s1) / 6 oder (5s8 +2s4 - s2) / 6
Ebenso wird für UL und UH verfahren. Auch hier gelten dieselben Parallelitätsanforderungen. Falls das Ergebnis aus drei Niveaus ermittelt wurde, sollte dies im Analyseprotokoll vermerkt werden.
Wenn die Geraden als parallel anzusehen sind wird der Logarithmus der relativen Aktivität (log A) durch eine der folgenden Formeln ermittelt, je nachdem, ob 3 oder 4 Niveaus für die Beurteilung der Parallelität verwendet wurden.
Für 4 Niveaus
(c) log A = 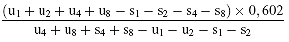
Für 3 Niveaus
(d) log A = 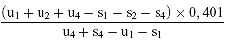
oder
(d") log A = 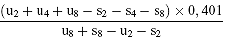
Tätigkeit des Probenextrakts = Aktivität der jeweiligen Standardlösung × A:
(U8 = S8 × A)
Wenn die relative Aktivität außerhalb des Bereichs der Werte 0,5 bis 2,0 liegt, wird die Bestimmung bei entsprechender Anpassung der Extraktkonzentrationen, bzw. der Standardlösungen wiederholt. Falls die relative Aktivität nicht in den Bereich der erforderlichen Werte gebracht werden kann, ist das Ergebnis als annähernd anzusehen. Dies sollte im Analyseprotokoll vermerkt werden.
Wenn die Geraden nicht als parallel anzusehen sind, wird die Bestimmung wiederholt. Wenn noch keine Parallelität erreicht wurde, ist die Bestimmung als unbefriedigend anzusehen.
Die Ergebnisse werden in Milligramm Zink-Bacitracin je kg Futtermittel ausgedrückt.
9. Wiederholbarkeit
Der Unterschied zwischen den Ergebnissen zweier Bestimmungen eines Analytikers sollte bei ein- und derselben Probe bei Gehalten von
2. Bestimmung von Flavophospholipol
- durch Diffusion in Agarnährboden -
1. Zweck und Anwendungsbereich
Die Methode erlaubt die Bestimmung von Flavophospholipol in Futtermitteln, Konzentraten und Vormischungen. Die untere Grenze der Bestimmbarkeit beträgt 1 mg/kg (1 ppm).
2. Prinzip
Die Probe wird mit verdünntem Methanol durch Erhitzen am Rückfluss extrahiert. Nach Zentrifugieren wird der Extrakt (falls erforderlich) durch Behandlung mit Ionenaustauschern gereinigt und verdünnt. Seine antibiotische Aktivität wird durch Messung der Diffusion des Flavophospholipols in einem mit Staphylococcus aureus beimpften Agarnährboden bestimmt. Die Diffusion wird durch die entstehenden Hemmzonen mit dem Testorganismus nachgewiesen. Der Durchmesser dieser Hemmzonen wird für den Bereich der angewandten Konzentrationen als dem Logarithmus der Konzentration an Antibiotikum direkt proportional angesehen.
3. Testorganismus: Staphylococcus Aureus ATCC 6538 P
3.1. Haltung der Stammkultur
Agarschrägröhrchen mit Kulturnährboden (4.1) werden mit Staphylococcus aureus beimpft und 24 Stunden bei 37° C bebrütet. Die Kultur wird im Kühlschrank bei etwa 4° C aufbewahrt und jeden Monat neu überimpft.
3.2. Herstellung der Keimsuspension c
Von der Stammkultur (3.1) werden 2 Schrägröhrchen wöchentlich überimpft, 24 Stunden bei 37° C bebrütet und im Kühlschrank bei etwa 4° C aufbewahrt.
24 Stunden vor dem Test werden mit dieser Kultur 2 bis 4 Schrägröhrchen mit Kulturnährboden (4.1) beimpft und 16 bis 18 Stunden bei 37° C bebrütet. Dann werden die Keime mit Natriumchloridlösung (4.3) aufgenommen und die Suspension verdünnt, um eine Lichtdurchlässigkeit bei 578 nm und 1 cm Schichtdicke gegen Natriumchloridlösung (4.3) von etwa 40 v. H. zu erhalten.
4. Nährböden und Reagenzien
| Fleischpepton | 6,0 g |
| Trypton | 4,0 g |
| Hefeextrakt | 3,0 g |
| Fleischextrakt | 1,5 g |
| Glukose | 1,0 g |
| Agar | 15,0 g |
| Wasser pH 6,5 (nach Sterilisation) | 1.000 ml |
4.2. Testnährboden
| Fleischpepton | 6,0 g |
| Hefeextrakt | 3,0 g |
| Fleischextrakt | 1,5 g |
| Agar | 10,0 g |
| Wasser pH 6,5 (nach Sterilisation) | 1.000 ml |
4.2.2. Keimschicht
Wie unter 4.1 mit Zusatz von 2,0 g Silikon-Antischaum-Emulsion f
4.3. Natriumchloridlösung 0,4 v. H. (G/V): 4 g Natriumchlorid p. a. werden in Wasser aufgelöst und auf 1.000 ml verdünnt; die Lösung wird sterilisiert.
4.4. Methanol, rein
4.5. Methanol 50 v. H. (V/V): 500 ml Methanol (4.4) werden mit 500 ml Wasser verdünnt
4.6. Methanol 80 v. H. (V/V): 800 ml Methanol (4.4) werden mit 200 ml Wasser verdünnt
4.7. Tris (hydroxymethyl)-aminomethan p. a.
4.8. Kaliumchlorid-Methanollösung 1,5 v. H. (G/V): 1,5 g Kaliumchlorid p. a. werden in 20 ml Wasser aufgelöst und bis 100 ml mit Methanol (4.4) aufgefüllt.
4.9. Kationenaustauscher: Dowex 50 WX 8, 20 bis 50 mesh, Na-Form (Serva Kat. Nr. 41 600) oder gleichwertiges
4.10. Anionenaustauscher: Dowex 1×2, 50 bis 100 mesh, CI-Form (Serva Kat. Nr. 41 010) oder gleichwertiges
4.11. Glaswolle
4.12. pH-Indikatorpapier (pH 6,6 bis 8,1)
4.13. Ascorbinsäure
4.14. Standardsubstanz: Flavophospholipol von bekannter Aktivität.
5. Geräte
5.1. Glasrohr für Chromatographie, Innendurchmesser: 9 mm, Länge: 150 bis 200 mm, mit einem Hahn am unteren engeren Ende und Schliff (für den Anschluss des Tropftrichters 5.2) am oberen Ende
5.2. Tropftrichter mit Behälter vom 250 ml, Hahn und Schliff
5.3. Erlenmeyerkolben, 250 ml Inhalt, mit Schliff
5.4. Rückflusskühler mit Schliff.
6. Standardlösungen
Eine genau abgewogene Menge der Standardsubstanz (4.14) wird in 50 v. H. Methanol (4.5) aufgelöst und verdünnt, um eine Stammlösung, die 100 µ g Flavophospholipol pro ml enthält, zu erhalten. In verschlossenen Flaschen und bei 4° C aufbewahrt, bleibt diese Lösung 2 Monate lang haltbar.
Aus dieser Stammlösung werden durch aufeinanderfolgende Verdünnungen mit 50 v. H. Methanol (4.5) folgende Lösungen hergestellt:
| S8 | 0,2 | µg/ml |
| S4 | 0,1 | µ g/ml |
| S2 | 0,05 | µ g/ml |
| S1 | 0,025 | µ g/ml. |
7. Herstellung des Extrakts
7.1. Extraktion
7.1.1. Konzentrate, Vormischungen und Mineralfutter
Einer abgewogenen Menge von 2,0 bis 5,0 g der Probe werden 150 mg Ascorbinsäure (4.13) zugesetzt und in einem Erlenmeyerkolben (5.3) mit 150 ml 50 v. H. Methanol (4.5) gemischt. Der pH-Wert wird auf 8,1 bis 8,2 mit ca. 400 mg Tris(hydroxymethyl)-aminomethan (4.7) eingestellt und mit Indikatorpapier (4.12) kontrolliert. Nach 15 Minuten wird der pH-Wert mit Tris(hydroxymethyl)-aminomethan (4.7) erneut auf 8,1 bis 8,2 eingestellt und die Mischung 10 Minuten am Rückfluss (5.4) unter ständigem Rühren gekocht. Nach Abkühlen wird abzentrifugiert und der Exakt dekantiert.
7.1.2. Sonstige Futtermittel
Eine Menge von 5,0 bis 30,0 g der Probe, die mindestens 30 µg Flavophospholipol enthält, wird eingewogen und in einem Erlenmeyerkolben (5.3) mit 150 ml 50 v. H. Methanol (4.5) gemischt. Der pH-Wert wird auf 8,1 bis 8,2 mit ca. 400 mg Tris(hydroxymethyl)-aminomethan (4.7) eingestellt und mit Indikatorpapier (4.12) kontrolliert. Nach 15 Minuten wird der pH-Wert mit Tris(thydroxymethyl)-aminomethan (4.7) erneut auf 8,1 bis 8,2 eingestellt und die Mischung 10 Minuten am Rückfluss (5.4) unter ständigem Rühren gekocht. Nach Abkühlen wird abzentrifugiert und der Extrakt dekantiert.
7.2. Reinigung (bei Konzentraten, Vormischungen und Mineralfutter nicht erforderlich)
110 ml des Extraktes werden mit 11 g Kationenaustauscher (4.9) versetzt und eine Minute am Rückfluß (5.4) unter ständigem Rühren gekocht.
Nach Abtrennung des Kationenaustauschers durch Zentrifugieren oder Filtrieren werden 100 ml des Extraktes mit 150 ml Methanol (4.4) versetzt und die Lösung 12 bis 15 Stunden bei 4 °C aufbewahrt. Die Abtrennung der Ausflockung erfolgt durch Filtration der gekühlten Lösung.
Am unteren Ende eines Glasrohrs (5.1) wird ein Glaswollstopfen (4.11) eingeführt, anschließend werden 5 ml des Anionenaustauschers (4.10) in das Rohr gegossen und die Säule mit 100 ml 80 v. H. Methanol (4.6) gewaschen. Mit Hilfe des Trichters (5.2) werden mindestens 100 ml des Filtrats, das 16 µg Flavophospholipol enthalten sollte (200 ml für 30 g Futtermittelprobe mit 1 ppm) auf die Säule gegeben. Falls erforderlich, wird das Filtrat vor Aufbringen auf die Säule mit 80 v. H. Methanol (4.6) verdünnt, um einen erwarteten Flavophospholipolgehalt von 16 µg/100 ml zu erhalten. Die Durchflussgeschwindigkeit wird auf ca. 2 ml/Minute eingestellt, der Durchlauf verworfen. Die Säule wird dann mit 50 ml 80 v. H. Methanol (4.6) gewaschen und der Durchlauf verworfen.
Das Flavophospholipol wird mit der Kaliumchlorid-Methanollösung (4.8) bei einer Durchflussgeschwindigkeit von ca. 2 ml/Minute eluiert. 50 ml des Eluats werden in einem Messzylinder aufgefangen und mit 30 ml Wasser gemischt. Diese Lösung sollte 0,2 µg/ml (= U8) Flavophospholipol enthalten.
7.3. Testlösungen
Falls erforderlich (d. h. wenn keine Reinigung vorgenommen wurde), wird der in 7.1.1 erhaltene Extrakt mit 50 v. H. Methanol (4.5) verdünnt, um einen erwarteten Flavophospholipolgehalt von 0,2 µg/ml (= U8) zu erhalten.
Von der Lösung U8 werden die Lösungen U4 (erwarteter Gehalt: 0,1 µg/ ml), U2 (erwarteter Gehalt: 0,05 µg/ml) und U1 (erwarteter Gehalt: 0,025 µg/ml) durch aufeinanderfolgende Verdünnung (1+1) mit 50 v. H. Methanol (4.5) hergestellt.
8. Testverfahren
8.1. Beimpfung des Nährbodens
Der Testnährboden (4.2.2) wird mit der Keimsuspension (3.2) bei ca. 50° C beimpft. Bei Vorversuchen auf Platten mit dem Testnährboden (4.2.2) wird die Menge der Keimsuspension ermittelt, die möglichst große, aber noch scharfe Hemmzonen mit den verschiedenen verwendeten Konzentrationen an Flavophospholipol ergibt (etwa 30 ml pro Liter).
8.2. Herstellung der Platten
Der Test ist als Diffusionstest auf Platten mit je vier Konzentrationsstufen der Standardlösung (S8, S4, S2, S1) und der Testlösung (U8, U4, U2, U1) angelegt. Jede Platte erhält unbedingt alle vier Konzentrationen des Standards und des Extrakts. Daher muss die Plattengröße so bemessen sein, dass mindestens acht Löcher mit einem Durchmesser von 10 bis 13 mm und mindestens 30 mm zwischen den Lochzentren in die Nährbodenschicht gestanzt werden können. Der Test sollte vorzugsweise auf Platten durchgeführt werden, die aus einer Glasscheibe mit einem darauf gelegten plangedrehten Aluminium- oder Kunststoffring von 20 mm Höhe und 200 mm Durchmesser hergestellt werden.
Auf die Platten wird eine Menge der Basalschicht (4.2.1) gegossen, dass sich eine 1,5 mm dicke Schicht ergibt (45 ml für eine Platte von 200 mm Durchmesser). Nachdem die Schicht fest geworden ist, wird mit einer Menge der Keimschicht (4.2.2) - beimpft wie unter 8.1 - überschichtet, um eine Schicht von 1 mm zu erhalten (30 ml für eine Platte von 200 mm Durchmesser). Nachdem auch diese Schicht fest geworden ist, werden die Löcher gestanzt und genau abgemessene Mengen der Standard- und Testlösungen einpipettiert (zwischen 0,10 und 0,15 ml pro Loch, je nach Lochdurchmesser).
Jede Konzentration muss mindestens in 4facher Wiederholung angewendet werden, so dass für jeden Test 32 Hemmzonen ausgewertet werden.
8.3. Inkubation
Die Inkubation erfolgt während 16 bis 18 Stunden bei 28 bis 30° C.
9. Auswertung
Der Durchmesser der Hemmzonen wird auf 0,1 mm genau gemessen. Für jede Konzentration werden die Mittelwerte auf Semilogarithmenpapier aufgetragen, wobei der Logarithmus der Konzentrationen gegen den Durchmesser der Hemmzonen eingetragen wird. Für die Standardlösung sowie für den Extrakt werden die geeignetsten Geraden - wie beispielsweise nachstehend berechnet - gezogen.
Der geeignetste Punkt für das niedrigste Niveau der Standardlösung (SL) wird nach folgender Formel ermittelt:
(a) SL = (7s1 + 4s2 + s4 - 2s8) / 10
Der geeigneste Punkt für das höchste Niveau der Standardlösung (SH) wird nach folgender Formel ermittelt:
(b) SH = (7s8 + 4s4 + s2 - 2s1) / 10
Genauso werden auch die geeignetsten Punkte für das niedrigste (UL) und höchste Niveau (UH) des Extraktes ermittelt, indem in der obigen Formel - anstelle von s1, s2, s4 und s8 - u1, u2, u4 und u8 eingesetzt werden.
Die ermittelten SL- und SH-Werte werden auf dasselbe Diagramm aufgetragen. Indem man die beiden Punkte miteinander verbindet, erhält man die geeignetste Gerade für die Standardlösung. Ebenso wird mit den UL- und UH-Werten verfahren, um die geeignetste Gerade für den Extrakt zu erhalten.
In Abwesenheit von Störfaktoren sollten die Geraden parallel sein. Die Geraden können als parallel angesehen werden, wenn die Werte (SH-SL) und (UH-UL) nicht mehr als 10 v. H. vom Mittelwert abweichen.
Falls die Geraden nicht parallel sind, kann man entweder u1 und s1 oder u8 und s8 ausschalten. Dann sind die Werte SL, SH, UL und UH mit folgenden Formeln zu ermitteln, um die geeignetste Gerade zu erhalten:
(a") SL = (5s1 +2s2 -s4) / 6 oder (5s2 +2s4 -s8) / 6
(b") SH = (5s4 +2s2 -s1) / 6 oder (5s8 +2s4 -s2) / 6
Ebenso wird für UL und UH verfahren. Mit diesen Alternativen soll auch die Parallelität der Geraden überprüft werden. Ergebnisse, die aus drei Niveaus ermittelt wurden, sollen in dem Analyseprotokoll vermerkt sein.
Wenn die Geraden als parallel anzusehen sind, wird der Logarithmus der relativen Aktivität (log. A) durch eine der folgenden Formeln ermittelt:
Für 4 Niveaus
(c) log. A = 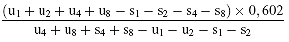
Für 3 Niveaus
(d) log. A = 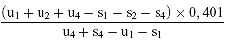
oder
(d") log. A = 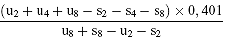
Tatsächliche Aktivität = angenommene Aktivität × relative Aktivität.
Wenn die Geraden nicht als parallel anzusehen sind, wird die Bestimmung wiederholt. Wenn auch dann keine Parallelität erreicht wurde, ist der Logarithmus der relativen Aktivität (log. A) mit der Formel (c) zu ermitteln. Das erhaltene Ergebnis ist als angenähert anzusehen; dies sollte im Analysenprotokoll vermerkt werden.
10. Wiederholbarkeit
Der Unterschied zwischen den Ergebnissen zweier Bestimmungen eines Analytikers sollte bei ein- und derselben Probe bei Gehalten von:
1 bis 2 mg/kg Flavophospholipol 0,5 mg/kg absolut,
mehr als 2 bis 10 mg/kg 25 v. H. des höheren Resultats,
mehr als 10 bis 25 mg/kg 20 v. H. des höheren Resultats,
mehr als 25 bis 50 mg/kg 5 mg/kg absolut,
mehr als 50 mg/kg 10 v. H. des höheren Resultats
nicht überschreiten.
3. Bestimmung der Spurenelemente Eisen, Kupfer, Mangan und Zink
1. Zweck und Anwendungsbereich
Die Methode erlaubt die Bestimmung der Spurenelemente Eisen, Kupfer, Mangan und Zink in Futtermitteln. Die unteren Grenzen der Bestimmbarkeit betragen:
Eisen (Fe): 20 mg/kg
Kupfer (Cu): 10 mg/kg
Mangan (Mn): 20 mg/kg
Zink (Zn): 20 mg/kg
2. Prinzip
Die Probe wird nach Zerstörung eventuell vorhandener organischer Substanz in Salzsäure gelöst. Die Elemente Eisen, Kupfer, Mangan und Zink werden nach entsprechender Verdünnung der Analysenlösung mittels Atomabsorptionsspektrometrie bestimmt.
3. Reagenzien
Vorbemerkungen
Das zur Herstellung der Reagenzien und Analysenlösungen verwendete Wasser muss "frei" von den zu bestimmenden Kationen sein. Hierfür kann Wasser verwendet werden, das, entweder in einer Borsilikatglas oder Quarzapparatur zweifach destilliert oder durch doppelten Ionenaustausch gereinigt wurde.
Die zur Analyse verwendeten Reagenzien müssen mindestens von p.a. - Qualität sein. Die Abwesenheit des zu bestimmenden Elements wird mittels eines Blindversuchs kontrolliert. Falls erforderlich, sind die Reagenzien einer zusätzlichen Reinigung zu unterziehen.
Anstelle der nachfolgend beschriebenen Standardlösungen können auch handelsübliche Standardlösungen verwendet werden, deren Reinheit garantiert und vor Verwendung kontrolliert wurde.
3.1. Salzsäure p.a., d: 1,19
3.2. Salzsäure p.a., 6 N
3.3. Salzsäure p.a., 0,5 N
3.4. Fluorwasserstoffsäure, 38 bis 40 %ig (v/v); Eisengehalt: weniger als 1 mg/l Glührückstand (als Sulfat): weniger als 10 mg/l
3.5. Schwefelsäure p.a., d: 1,84
3.6. Wasserstoffperoxid p.a., ca. 100 Vol. Sauerstoff (30 % Gew. %)
3.7. Eisen-Standardlösung (1000 µg Fe/ml): 1 g Eisendraht p.a. wird in 200 ml 6 N Salzsäure (3.2) gelöst, es werden 16 ml Wasserstoffperoxid (3.6) zugegeben, dann wird mit Wasser auf 1 l aufgefüllt.
3.7.1. Eisen-Gebrauchsstandardlösung (100 µ g Fe/ml): Die Standardlösung (3.7) wird im Verhältnis 1 + 9 mit Wasser verdünnt.
3.8. Kupfer-Standardlösung (1.000 µ g Cu/ml): 1 g Kupfer p.a. in Pulverform wird in 25 ml 6 N Salzsäure (3.2) gelöst, es werden 5 ml Wasserstoffperoxid (3.6) zugegeben, dann wird mit Wasser auf 1 l aufgefüllt.
3.8.1. Kupfer-Gebrauchsstandardlösung (10 µ g Cu/ml): Die Standardlösung (3.8) wird im Verhältnis 1 + 9 mit Wasser verdünnt und anschließend die entstehende Lösung wiederum im Verhältnis 1 + 9 mit Wasser verdünnt.
3.9. Mangan-Standardlösung (1000 µ g Mn/ml): 1 g Mangan p.a. in Pulverform wird in 23 ml 6 N Salzsäure (3.2) gelöst, dann wird mit Wasser auf 1 l aufgefüllt.
3.9.1. Mangan-Gebrauchsstandardlösung (10 µ g Mn/ml): Die Standardlösung (3.9) wird im Verhältnis 1 + 9 mit Wasser verdünnt und anschließend die entstehende Lösung wiederum im Verhältnis 1 + 9 mit Wasser verdünnt.
3.10. Zink-Standardlösung (1000 µg Zn/ml): 1 g Zink p.a. in Streifen- oder Plattenform wird in 25 ml 6 N Salzsäure (3.2) gelöst; dann wird mit Wasser auf 1 l aufgefüllt.
3.10.1. Zink-Gebrauchsstandardlösung (10 µ g Zn/ml): die Standardlösung (3.10) wird im Verhältnis 1 + 9 mit Wasser verdünnt und die entstehende Lösung wiederum im Verhältnis 1 + 9 mit Wasser verdünnt.
3.11. Lanthanchloridlösung: Es werden 12 g Lanthanoxid in 150 ml Wasser aufgelöst, 100 ml 6 N Salzsäure (3.2) zugegeben und mit Wasser auf 1 l aufgefüllt.
4. Geräte
4.1. Muffelofen mit Regelvorrichtung und Temperaturanzeige.
4.2. Glasgeräte müssen aus resistentem Borsilikatglas sein. Empfohlen wird, Glasgeräte zu benutzen, die ausschließlich der Bestimmung von Spurenelementen vorbehalten bleiben.
4.3. Platin- und eventuell Quarzschalen.
4.4. Atomabsorptions-Spektrophotometer; das Gerät muss hinsichtlich seiner Empfindlichkeit und Genauigkeit innerhalb des vorgesehenen Messbereichs den Methodenanforderungen genügen.
5. Ausführung
5.1. Proben mit organischen Bestandteilen
5.1.1. Veraschung und Herstellung der Analysenlösung *
Hinweise:
(a) Bei der Bestimmung von Spurenelementen ist unbedingt auf die Gefahr von Verunreinigungen, insbesondere durch Zink, Kupfer und Eisen zu achten. Deshalb müssen die bei der Probenvorbereitung benutzten Geräte frei von diesen Metallen sein.
Um die Verunreinigungsrisiken einzuschränken, ist in staubfreier Luft, mit absolut reinen Geräten und sorgfältig gewaschenen Glasgeräten zu arbeiten. Die Zinkbestimmung ist für Verunreinigungen durch Glasgeräte, Reagenzien, Staub usw. besonders empfindlich.
(b) Die Einwaage wird nach dem etwa zu erwartenden Gehalt des Futtermittels an Spurenelementen unter Berücksichtigung der Empfindlichkeit des verwendeten Spektrophotometers berechnet. Bei Futtermitteln, die einen sehr niedrigen Gehalt an Spurenelementen aufweisen, kann es erforderlich sein, eine Probe von 10 bis 20 g einzuwägen und das Volumen der Analysenlösung auf 100 ml zu begrenzen.
(c) Die Veraschung erfolgt im geschlossenen Muffelofen ohne Einblasen von Luft oder Sauerstoff.
(d) Die vom Pyrometer angezeigte Temperatur darf 475° C nicht überschreiten.
5.1.2. Spektrophotometrische Bestimmung
5.1.2.1. Herstellen der Eichlösungen
Aus den Gebrauchsstandardlösungen 3.7.1, 3.8.1, 3.9.1 und 3.10.1 werden für jedes der zu bestimmenden Spurenelemente eine Reihe von Eichlösungen hergestellt. Jede dieser Eichlösungen hat eine etwa 0,5 N HCl-Konzentration und (im Falle von Eisen, Mangan und Zink) eine Lanthanchlorid-Konzentration, die 0,1 % La (g/v) entspricht. Die gewählten Spurenelementkonzentrationen müssen im Empfindlichkeitsbereich des verwendeten Spektrophotometers liegen. Die nachfolgenden Tabellen zeigen als Beispiel die Zusammensetzung typischer Reihen von Eichlösungen. Je nach Typ und Empfindlichkeit des verwendeten Spektrophotometers kann es jedoch erforderlich sein, für die Eichlösungen eine andere Konzentration zu wählen.
| Eisen | ||||||||
| µg Fe/ml | 0 | 0,5 | 1 | 2 | 3 | 4 | 5 | |
| ml Gebrauchsstandardlösung (3.7.1) (1 ml = 100 µg Fe) + ml 6 N HCl (3.2) | 0 7 | 0,5 7 | 1 7 | 2 7 | 3 7 | 4 7 | 5 7 | |
| + 10 ml Lanthanchloridlösung (3.11) und mit Wasser auf 100 ml auffüllen | ||||||||
| Kupfer | ||||||||
| µg Cu/ml | 0 | 0,1 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | |
| ml GebrauchsstandardLösung (3.8.1) (1 ml = 10 µ g Cu) + ml 6 N HCL (3.2) | 0 8 | 1 8 | 2 8 | 4 8 | 6 8 | 8 8 | 10 8 | |
| mit Wasser auf 100 ml auffüllen | ||||||||
| Mangan | ||||||||
| µg Mn/ml | 0 | 0,1 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | |
| ml Gebrauchsstandardlösung (3.9.1) (1 ml = 10 µg Mn) + ml 6 N HCl (3.2) | 0 7 | 1 7 | 2 7 | 4 7 | 6 7 | 8 7 | 10 7 | |
| + 10 ml Lanthanchoridlösung (3.11) und mit Wasser auf 100 ml auffüllen | ||||||||
| Zink | ||||||||
| µg Zn/ml | 0 | 0,05 | 0,1 | 0,2 | 0,4 | 0,6 | 0,8 | |
| ml verdünnte Standardlösung (3.10.1) (1 ml = 10 µg Zn) + ml 6 N HCl (3.2) | 0 7 | 0,5 7 | 1 7 | 2 7 | 4 7 | 6 7 | 8 7 | |
| + 10 ml Lanthanchloridlösung (3.11) und mit Wasser auf 100 ml auffüllen | ||||||||
5.1.2.2. Herstellen der Messlösungen
Für die Kupferbestimmung kann die nach 5.1.1 hergestellte Analysenlösung in der Regel direkt verwendet werden. Gegebenenfalls wird ein aliquoter Teil dieser Analysenlösung in einen 100-ml-Meßkolben pipettiert und mit 0,5 N Salzsäure (3.3) zur Marke aufgefüllt, um ihre Konzentration in den Bereich der Eichlösungen zu bringen.
Für die Bestimmung der Elemente Eisen, Mangan und Zink wird ein aliquoter Teil nach 5.1.1 hergestellten Analysenlösung in einen 100-ml-Meßkolben pipettiert. Man gibt 10 ml Lanthanchloridlösung (3.11) hinzu und füllt mit 0,5 N Salzsäure (3.3) zur Marke auf (siehe 8 "Bemerkung").
5.1.2.3. Blindversuch
Es wird ein Blindversuch ausgeführt, der alle Verfahrensschritte umfassen muss, nur dass das Probematerial selbst weggelassen wird. Die Eichlösung "0" ersetzt nicht den Blindversuch.
5.1.2.4. Messung der Atomabsorption
Die Absorption der Eichlösungen und der zu analysierenden Lösungen ist mit oxydierender Luft-Azetylenflamme bei folgenden Wellenlängen zu messen:
Fe: 248,3 nm Cu: 324,8 nm Mn: 279,5 nm Zn: 213,8 nm
Jede Messung ist viermal auszuführen.
5.2. Mineralische Futtermittel
Enthält die Probe keine organischen Substanzen, so erübrigt sich eine vorherige Veraschung. Man verfährt dann wie unter 5.1.1 (i) ab 2. Absatz beschrieben. Ein Abrauchen mit Fluorwasserstoffsäure kann entfallen.
6. Berechnung der Ergebnisse
Die Spurenelement-Konzentration in der Analysenlösung wird mit Hilfe einer Eichkurve berechnet und das Ergebnis in mg Spurenelement/kg Probe (ppm) ausgedrückt.
7. Wiederholbarkeit
Die Differenz zwischen den Ergebnissen zweier paralleler Bestimmungen eines Analytikers sollte an derselben Probe bei Gehalten an dem betreffenden Spurenelement von:
8. Bemerkung
Die Anwesenheit größerer Mengen Phosphat kann bei der Bestimmung von Eisen, Mangan und Zink zu Interferenzen führen, die durch Zugabe von Lanthanchloridlösung (3.11) beseitigt werden. Ist jedoch in der Probe das Gewichtsverhältnis Ca +P Mg größer als 2, so kann auf den Zusatz von Lanthanchloridlösung verzichtet werden.
___________________
1) ABl. Nr. L 170 vom 03.08.1970 S. 2.
2) ABl. Nr. L 155 vom 12.07.1971 S. 13.
3) ABl. Nr. L 279 vom 20.12.1971 S. 7.
4) ABl. Nr. L 123 vom 29.05.1972 S. 6.
5) ABl. Nr. L 83 vom 30.03.1973 S. 21.
6) ABl. Nr. L 108 vom 22.04.1974 S. 7.
7) ABl. Nr. L 32 vom 05.02.1975 S. 26.
8) ABl. Nr. L 102 vom 15.04.1976 S. 8.
9) 1 mg Zink-Bacitracin entspricht 42 internationalen Einheiten (IE).
a) Andere Methoden, die entsprechende Bakteriensuspensionen ergeben, können angewendet werden.
b) Jeder handelsübliche Nährboden entsprechender Zusammensetzung, der dieselben Ergebnisse erbringt, kann verwendet werden.
c) Andere Methoden, die entsprechende Bakteriensuspensionen ergeben, können verwendet werden.
d) Jeder handelsübliche Nährboden entsprechender Zusammensetzung, der dieselben Ergebnisse erbringt, kann verwendet werden, z.B. Oxoid Antibioticum Medium 1 (CM 327) mit Zusatz von Oxoid Agar Nr. 3 (L 13).
e) Jeder handelsübliche Nährboden entsprechender Zusammensetzung, der dieselben Ergebnisse erbringt, kann verwendet werden, z.B. Oxoid Antibioticum Medium 2 (CM 335) mit Zusatz von Oxoid Agar Nr. 3 (L 13).
f) z.B. SE 2 (Wacker Chemie GmbH, München).
*) Grünfutter (frisch oder getrocknet) kann größere Mengen pflanzlicher Kieselsäure enthalten, welche Spurenelemente binden kann und daher entfernt werden muss.
Für Proben dieser Futtermittel muss also nach folgendem geändertem Verfahren vorgegangen werden:
Das Verfahren 5.1.1 (i) wird bis zur Filtration durchgeführt. Das den unlöslichen Rückstand enthaltende Filterpapier wird zweimal mit kochendem Wasser ausgewaschen, in eine Platinschale (4.3) gegeben und im Muffelofen bei weniger als 550 °C bis zum Vollständigen Verschwinden aller Kohleteilchen verascht.
Nach dem Abkühlen werden einige Tropfen Wasser, danach 10 bis 15 ml Fluorwasserstoffsäure (3.4) zugegeben und bei circa 150 °C zur Trockne eingedampft.
Verbleibt im Rückstand noch Kieselsäure, so wird diese erneut in einigen ml Fluorwasserstoffsäure (3.4) gelöst und anschließend zur Trockne eingedampft.
Dann werden 5 Tropfen Schwefelsäure (3.5) zugesetzt und so lange erhitzt, bis keine weißen Dämpfe mehr auftreten Nach Zugabe von 5 ml 6 N Salzsäure (3.2) und etwa 30 ml Wasser wird erhitzt, die Lösung in den 250-ml-Meßkolben filtriert und dieser mit Wasser bis zur Marke aufgefüllt (HCI-Konzentration etwa 0,5 N). Man verfährt dann ab 5.1.3.
 | ENDE |  |