umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (37)
 | zurück |
C.24 Aerobe und anaerobe Transformation in Wasser-Sediment-Systemen
1. Methode
Diese Testmethode entspricht der Prüfrichtlinie OECD TG 308 (2002).
1.1 Einleitung
Chemikalien gelangen in flache oder tiefe Oberflächengewässer auf folgenden Wegen: direkte Applikation, Sprühmittelabdrift, Ablauf, Entwässerung, Abfallentsorgung, Industrie-, Haushalts- oder Landwirtschaftsabwässer und über atmosphärische Ablagerung. Die Testmethode beschreibt eine Labormethode zur Beurteilung der aeroben und anaeroben Transformation von organischen Chemikalien in Wasser-Sediment-Systemen. Sie basiert auf bestehenden Richtlinien (1) (2) (3) (4) (5) (6). Auf einem OECD-Workshop zur Boden/ Sedimentauswahl, der 1995 im italienischen Belgirate stattfand (7), wurden insbesondere die Anzahl und Arten der bei diesem Test zu verwendenden Sedimente vereinbart. Des Weiteren gab der Workshop Empfehlungen zur Entnahme, Handhabung und Lagerung von Sedimentproben basierend auf den ISO-Hinweisen (8). Derartige Untersuchungen sind bei Chemikalien erforderlich, bei denen davon auszugehen ist, dass sie unmittelbar in Wasser angewandt werden oder auf den oben aufgeführten Eintragspfaden in den aquatischen Bereich gelangen.
Die Bedingungen in natürlichen Wasser-Sediment-Systemen sind in der oberen Wasserphase häufig aerob. Die Oberflächenschicht des Sediments kann entweder aerob oder anaerob sein, während die tieferen Sedimentschichten in der Regel anaerob sind. Um sämtlichen Möglichkeiten Rechnung zu tragen, werden in diesem Dokument sowohl aerobe als auch anaerobe Tests beschrieben. Der aerobe Test simuliert eine aerobe Wassersäule über einer aeroben Sedimentschicht, die mit einem anaeroben Gradienten unterschichtet ist. Der anaerobe Test simuliert ein vollständig anaerobes Wasser-Sediment-System. Deuten die Umstände darauf hin, dass es notwendig ist, von diesen Empfehlungen deutlich abzuweichen, indem z.B. intakte Sedimentkerne oder Sedimente verwendet werden, die möglicherweise gegenüber der Testsubstanz exponiert waren, können andere, zu diesem Zweck verfügbare Methoden zur Anwendung kommen (9).
1.2 Definitionen
In jedem Falle ist das Internationale Einheitensystem (SI-System) anzuwenden.
Testsubstanz: jede Substanz, ob Ausgangsverbindung oder relevante Transformationsprodukte.
Transformationsprodukte: alle Substanzen, die das Ergebnis von biotischen oder abiotischen Transformationsreaktionen der Testsubstanz sind, einschließlich CO2 und Reaktionsprodukte in gebundenen Rückständen.
Gebundene Rückstände: Verbindungen in Böden, Pflanzen oder Tieren, die nach einer Extraktion in der Matrix in Form der Ausgangssubstanz oder deren Metaboliten verbleiben. Die Extraktionsmethode darf die Verbindungen selbst oder die Matrix Struktur nicht wesentlich verändern. Die Art der Bindung kann zum Teil durch matrixverändernde Extraktionsmethoden und hochentwickelte Analysenverfahren geklärt werden. Bislang werden z.B. kovalente Ionen- und Sorptionsbindungen sowie Einschlüsse auf diese Weise nachgewiesen. In aller Regel bedeutet die Bildung von gebundenen Rückständen eine deutliche Verminderung der Bioverfügbarkeit (10) (modifiziert nach IUPAC 1984 (11)).
Aerobe Transformation (oxidierend): in Gegenwart von molekularem Sauerstoff ablaufende Reaktionen (12).
Anaerobe Transformation (reduzierend): unter Ausschluss von molekularem Sauerstoff ablaufende Reaktionen (12).
Natürliche Gewässer: Oberflächengewässer, die aus Teichen, Flüssen, Strömen usw. stammen.
Sediment: ein Gemisch mineralischer und organischchemischer Bestandteile. Letztere enthalten Verbindungen mit hohem Kohlenstoff- und Stickstoffgehalt und mit hoher Molekularmasse. Das Sediment lagert sich in natürlichen Gewässern ab und bildet eine Grenzfläche zu diesem Wasser.
Mineralisation: vollständiger Abbau einer organischen Verbindung zu CO2 und H2O unter aeroben Bedingungen, und zu CH4, CO2 und H2O unter anaeroben Bedingungen. Im Zusammenhang mit dieser Testmethode, bei der eine radioaktiv markierte Verbindung verwendet wird, bedeutet Mineralisation einen extensiven Abbau eines Moleküls, wobei ein markiertes Kohlenstoffatom unter Freisetzung der entsprechenden Menge 14CO2 bzw. 14CH4 quantitativ oxidiert oder reduziert wird.
Halbwertszeit t0,5: die für die 50 %ige Transformation einer Testsubstanz ermittelte Zeit, wenn die Transformation mittels Kinetik erster Ordnung beschrieben werden kann; sie ist unabhängig von der Ausgangskonzentration.
Abbauzeit DT50: Zeitspanne, in der sich die Ausgangskonzentration der Testsubstanz um 50 % reduziert hat.
Abbauzeit DT75: Zeitspanne, in der sich die Ausgangskonzentration der Testsubstanz um 75 % reduziert hat.
Abbauzeit DT90: Zeitspanne, in der sich die Ausgangskonzentration der Testsubstanz um 90 % reduziert hat.
1.3 Referenzsubstanzen
Referenzsubstanzen sollten zur Identifizierung und Quantifizierung von Transformationsprodukten mittels spektroskopischer und chromatografischer Verfahren verwendet werden.
1.4 Informationen zur Testsubstanz
Zur Messung der Transformationsrate kann eine nicht markierte oder markierte Testsubstanz verwendet werden, jedoch werden markierte Substanzen bevorzugt. Markierte Substanzen sind notwendig zur Untersuchung des Transformationsweges und zur Aufstellung einer Massenbilanz. Empfohlen wird die 14C-Markierung, doch auch der Einsatz anderer Isotope wie 13C, 15N, 3H oder 32P kann sinnvoll sein. Die Markierung sollte möglichst im stabilsten Teil/in den stabilsten Teilen des Moleküls positioniert sein 1. Die chemische und/oder radiochemische Reinheit der Testsubstanz sollte mindestens 95 % betragen.
Vor der Durchführung eines Tests sollten folgende Informationen zur Testsubstanz vorliegen:
- Wasserlöslichkeit (Methode A.6);
- Löslichkeit in organischen Lösungsmitteln;
- Dampfdruck (Methode A.4) und Henry-Konstante;
- n-Oktanol/Wasser-Verteilungskoeffizient (Methode A.8);
- Adsorptionskoeffizient (Kd, KF oder Koc) (Methode C.18);
- Hydrolyse (Methode C.7);
- Dissoziationskonstante (pKa) (OECD Guideline 112) (13);
- chemische Struktur der Testsubstanz und Ort der Isotopenmarkierung(en), falls zutreffend.
Hinweis: Die Temperatur, bei der diese Messungen vorgenommen werden, sollte angegeben werden.
Sinnvoll können u. a. auch folgende Angaben sein: Toxizität der Testsubstanz gegenüber Mikroorganismen, Daten zur leichten und/oder potenziellen biologischen Abbaubarkeil sowie Daten zur aeroben und anaeroben Transformation im Boden.
Analysenmethoden (einschließlich Extraktions- und Reinigungsverfahren) zur Identifizierung und Quantifizierung der Testsubstanz und ihrer Transformationsprodukte in Wasser und Sediment sollten verfügbar sein (siehe 1.7.2).
1.5 Prinzip der Testmethode
Bei der hier beschriebenen Methode werden ein aerobes und ein anaerobes Wassersediment verwendet (siehe Anlage 1), das folgende Untersuchungen erlaubt:
- Messung der Transformationsrate der Testsubstanz in einem Wasser-Sediment-System,
- Messung der Transformationsrate der Testsubstanz im Sediment,
- Messung der Mineralisationsrate der Testsubstanz und/oder ihrer Transformationsprodukte (bei Verwendung einer 14C-markierten Testsubstanz),
- Identifizierung und Quantifizierung von Transformationsprodukten in Wasser- und Sedimentphasen einschließlich einer Massenbilanz (bei Verwendung einer markierten Testsubstanz),
- Messung der Verteilung der Testsubstanz und ihrer Transformationsprodukte auf die beiden Phasen während einer Inkubation im Dunkeln (um z.B. Algenblüten zu vermeiden) bei konstanter Temperatur. Halbwertszeiten, DT50-, DT75- und DT90-Werte werden bestimmt, wenn es die entsprechenden Daten hergeben, sollten jedoch nicht weit über den Versuchszeitraum hinaus extrapoliert werden (siehe 1.2).
Sowohl für die aerobe als auch für die anaerobe Untersuchung sind jeweils mindestens zwei Sedimente sowie die dazugehörigen Wasserphasen erforderlich (7). In bestimmten Fällen sollten jedoch mehr als zwei Sedimente verwendet werden, z.B. bei Chemikalien, die in Binnengewässern und/oder in Meeresgewässern vorkommen können.
1.6 Anwendbarkeit des Tests
Die Methode ist allgemein anwendbar auf chemische Substanzen (nicht markiert oder markiert), für die ein Analysenverfahren mit hinreichender Genauigkeit und Empfindlichkeit zur Verfügung steht. Es ist anwendbar auf schwach flüchtige, nichtflüchtige, wasserlösliche oder schlecht wasserlösliche Verbindungen. Der Test sollte nicht angewendet werden bei Chemikalien, die aus Wasser stark flüchtig sind (z.B. Begasungsmittel oder organische Lösungsmittel) und somit unter den Versuchsbedingungen dieses Tests nicht im Wasser und/oder Sediment gehalten werden können.
Bisher wird diese Methode zur Untersuchung der Transformation von Chemikalien in Binnengewässern und Sedimenten genutzt, aber im Prinzip ist sie auch für Ästuar-/Meeressysteme anwendbar. Sie ist nicht geeignet zur Simulation von Bedingungen in strömendem Wasser (z.B. Flüssen) oder auf hoher See.
1.7 Qualitätskriterien
1.7.1 Wiederfindungsraten
Die Extraktion und Analyse von mindestens jeweils zwei parallel angesetzten Wasser- und Sedimentproben unmittelbar nach Zugabe der Testsubstanz geben einen ersten Hinweis auf die Wiederholbarkeit der Analysenmethode und die gleichmäßige Verteilung der Testsubstanz bei der Applikation. Die Wiederfindungsraten für spätere Versuchsphasen ergeben sich aus den jeweiligen Massenbilanzen (bei Verwendung markierter Substanzen). Die Wiederfindungsraten sollten im Bereich von 90-110 % für markierte Chemikalien (6) und von 70-110 % für nicht markierte Chemikalien liegen.
1.7.2 Wiederholbarkeit und Empfindlichkeit der Analysenmethode
Die Wiederholbarkeit der Analysenmethode (ausgenommen die Effizienz der Extraktion im Anfangsstadium) zur Quantifizierung der Testsubstanz und der Transformationsprodukte kann durch eine parallele Analyse desselben Extrakts der Wasser- bzw. der Sedimentproben, die hinreichend lange zur Bildung von Transformationsprodukten inkubiert wurden, überprüft werden.
Die Nachweisgrenze (limit of detection - LOD) der Analysenmethode für die Testsubstanz und für die Transformationsprodukte sollte mindestens 0,01 mg· kg-1 in Wasser oder Sediment (als Testsubstanz) oder - falls dieser Wert niedriger ist - 1 % der in ein Testsystem applizierten. Ausgangsmenge betragen. Die Quantifizierungsgrenze ("limit of quantification - LOQ") sollte ebenfalls spezifiziert werden.
1.7.3 Genauigkeit der Transformationsdaten
Geeignete Informationen über die Zuverlässigkeit der Transformationskurve lassen sich mittels einer Regressionsanalyse aus den Testsubstanzkonzentrationen in Abhängigkeit von der Zeit gewinnen, die auch die Berechnung des Vertrauensbereiche für Halbwertszeiten (im Falle einer Kinetik pseudoerster Ordnung) bzw. DT50-Werte und ggf. für DT75 und DT90-Werte ermöglicht.
1.8 Beschreibung der Methode
1.8.1 Testsystem und Geräte
Die Untersuchung sollte in Glasgefäßen (z.B. Flaschen oder Zentrifugengläsern) durchgeführt werden, sofern nicht bereits vorliegende Informationen (wie der n-Oktanol/Wasser-Verteilungskoeffizient, Sorptionsdaten usw.) darauf hindeuten, dass die Testsubstanz möglicherweise an Glas anhaftet. In diesem Fall kann es erforderlich sein, andere Materialien (wie Teflon) in Betracht zu ziehen. Wenn bekannt ist, dass die Testsubstanz an Glas anhaftet, könnte eine Lösung darin bestehen, eine oder mehrere der folgenden Methoden anzuwenden:
- Bestimmung der Masse der am Glas sorbierten Testsubstanz und Transformationsprodukte,
- obligatorische Spülung aller Glasgegenstände mit einem Lösungsmittel zu Testende,
- Verwendung formulierter Handelsprodukte (siehe auch 1.9.2),
- Verwendung einer größeren Menge eines Hilfslösungsmittels für die Zugabe der Testsubstanz in das System; das eingesetzte Hilfslösungsmittel sollte die Testsubstanz nicht durch Solvolyse aufspalten,
Beispiele für typische Testgeräte, d. h. Durchfluss- und Biometersysteme, sind in Anlage 2 bzw. 3 dargestellt (14). Weitere geeignete Inkubationssysteme sind in der Literaturangabe (15) beschrieben. Die Anordnung der Versuchsgeräte sollte den Austausch von Luft oder Stickstoff und das Auffangen flüchtiger Produkte ermöglichen. Die Geräte müssen so bemessen sein, dass sie den Anforderungen des Tests entsprechen (siehe 1.9.1), Die Belüftung kann entweder durch schonendes Durchperlen oder durch das Leiten von Luft oder Stickstoff über die Wasseroberfläche erfolgen. In letzterem Fall kann ein vorsichtiges Umrühren des Wassers von oben angeraten sein, um eine bessere Verteilung des Sauerstoffs bzw. Stickstoffs im Wasser zu erreichen. CO2-freie Luft sollte nicht verwendet werden, da dies zu einem Anstieg des pH-Werts des Wassers führen kann. In jedem Falle ist eine Störung des Sediments nicht wünschenswert und sollte weitestgehend vermieden werden. Schwach flüchtige Chemikalien sollten in einem Biometersystem unter vorsichtigem Rühren der Wasseroberfläche getestet werden. Ebenfalls können geschlossene Gefäße mit einer Gasphase aus atmosphärischer Luft oder Stickstoff sowie mit innen befindlichen Röhrchen zum Auffangen flüchtiger Produkte verwendet werden (16). Beim aeroben Test ist ein regelmäßiger Austausch der Gasphase im oberen Teil des Gefäßes erforderlich, um den Sauerstoffverbrauch durch die Biomasse auszugleichen.
Geeignete Abscheider für das Sammeln flüchtiger Transformationsprodukte sind u. a. Kaliumhydroxid- oder Natriumhydroxidlösungen (1 mol · dm-3) für Kohlendioxid 2 und Ethylenglykol, Ethanolamin oder 2 %iges Paraffin in Xylol für organische Verbindungen. Flüchtige Verbindungen wie Methan, die unter anaeroben Bedingungen entstehen, können z.B. mittels Molekularsieben aufgefangen werden. Solche flüchtigen Verbindungen können z.B. zu CO2 verbrannt werden, indem das Gas bei einer Temperatur von 900 °C durch eine CuO enthaltende Quarzröhre geführt und das gebildete CO2 in einem Abscheider mit Alkali aufgefangen wird (17).
Erforderlich ist eine Laborausstattung für die chemische Analyse der Testsubstanz und von Transformationsprodukten (z.B. Gas-Flüssigchromatografie (GLC), Hochleistungsflüssigchromatografie (HPLC), Dünnschichtchromatografie (TLC), Massenspektroskopie (MS), Gaschromatografie-Massenspektroskopie (GC-MS), Flüssigchromatografie-Massenspektrometrie (LC-MS), kernmagnetische Resonanz (NMR) u. a.), sowie ggf. Detektionssysteme für radioaktiv markierte oder nicht markierte Chemikalien. Bei Verwendung radioaktiv markierter Substanzen werden darüber hinaus ein Flüssigkeitsszintillationszähler und ein Oxidationsmittel (für die Verbrennung von Sedimentproben vor der Analyse auf Radioaktivität) benötigt.
Weitere Standardlaborgeräte für physikalischchemische und biologische Bestimmungen (siehe Tabelle 1 in Abschnitt 1.8.2.2), Glasgegenstände, Chemikalien und Reagenzien sind je nach Bedarf erforderlich;
1.8.2 Auswahl und Anzahl von Wassersedimenten
Die Probenahmestellen sollten entsprechend dem Zweck des Tests je nach gegebener Situation gewählt werden. Bei der Auswahl der Probenahmestellen ist die Vorgeschichte möglicher landwirtschaftlicher, industrieller oder häuslicher Einträge in das Einzugsgebiet und die Oberläufe zu berücksichtigen. Es sollten nur Sedimente verwendet werden, die in den 4 vorhergehenden Jahren nicht mit der Testsubstanz oder ihren Struktur-Analoga verunreinigt worden sind.
1.8.2.1 Sedimentauswahl
Für die aeroben Tests werden üblicherweise zwei Sedimente verwendet (7). Die beiden ausgewählten Sedimente sollten sich hinsichtlich ihres organischen Kohlenstoffgehalts und ihrer Textur voneinander unterscheiden. Ein Sediment sollte einen hohen organischen Kohlenstoffgehalt (2,5-7,5 %) aufweisen und feinkörnig sein, das andere Sediment sollte einen niedrigen organischen Kohlenstoffgehalt (0,5-2,5 %) haben und grobkörnig sein. Der Unterschied zwischen den organischen Kohlenstoffgehalten sollte im Regelfall mindestens 2 % betragen. "Feinkörnigkeit" wird definiert als ein [Ton und Schluff] 3-Gehalt von > 50 %, und "Grobkörnigkeit" wird definiert als ein [Ton und Schluff]-Gehalt von < 50 %, Die Differenz zwischen den [Ton und Schluff]-Gehalten beider Sedimente sollte in aller Regel mindestens 20 % betragen. In Fällen, in denen eine Chemikalie auch in Meerwasser gelangen kann, sollte mindestens eines der Wasser-Sediment-Systeme marinen Ursprungs sein.
Für die strikt anaerobe Untersuchung sollten Proben von zwei Sedimenten (einschließlich des jeweils dazugehörigen Wassers) aus den anaeroben Bereichen der Oberflächenwasserkörper genommen werden (7). Handhabung und Transport von Sediment- und Wasserphasen sollten vorsichtig unter Ausschluss von Sauerstoff erfolgen.
Für die Auswahl von Sedimenten können noch andere Parameter von Bedeutung sein und sollten je nach Ausgangslage berücksichtigt werden. So wäre z.B. der pH-Bereich von Sedimenten wichtig für die Untersuchung von Chemikalien, bei denen die Transformation und/oder Sorption pH-abhängig sein könnte. Die pH-Abhängigkeit der Sorption kann im pKa-Wert der Testsubstanz zum Ausdruck kommen.
1.8.2.2 Charakterisierung von Wasser-Sediment-Proben
In der folgenden Tabelle sind die wichtigsten Parameter, die für Wasser und Sediment zu messen und zu protokollieren sind (unter Verweis auf die verwendete Methode), sowie die Testphase, in der diese Parameter zu bestimmen sind, aufgeführt. Informationen über die Methoden zur Bestimmung dieser Parameter sind in der Literatur (18) (19) (20) (21) zu finden.
Unter Umständen sind je nach Ausgangslage noch weitere Parameter zu messen und zu protokollieren (z.B. für Süßwasser: Partikel, Alkalinität, Harte, Leitfähigkeit, NO3/PO4 (Verhältnis und Einzelwerte); für Sedimente: Kationenaustauschkapazität, Wasserhaltekapazität, Carbonat, Gesamtstickstoff und -phosphor; und für Meeressysteme: Salzgehalt). Zur Messung der Redoxbedingungen, insbesondere im Hinblick auf die anaerobe Transformation, kann auch eine Analyse von Sedimenten und Wasser auf Nitrat, Sulfat, bioverfügbares Eisen und evtl. andere Elektronenakzeptoren sinnvoll sein.
Messung von Parametern zur Charakterisierung von Wasser-Sediment-Proben (7) (22) (23)
|
Phase des Testverfahrens | ||||||
| Parameter | Feldprobenahme | Handhabung | Beginn der Akklimatisierung | Testbeginn | Laufender Test | Testende |
| Wasser | ||||||
| Herkunft/Quelle | x | |||||
| Temperatur | x | |||||
| pH-Wert | x | x | x | x | x | |
| TOC | x | x | x | |||
| O2-Konzentration * | x | x | x | x | x | |
| Redoxpotenzial * | x | x | x | x | ||
| Sediment | ||||||
| Herkunft/Quelle | x | |||||
| Tiefe der Schicht | x | |||||
| pH-Wert | x | x | x | x | x | |
| Korngrößenverteilung | x | |||||
| TOC | x | x | x | x | ||
| Mikrobielle Biomasse * | x | x | x | |||
| Redoxpotenzial ** | Beobachtung (Farbe / Geruch) | x | x | x | x | |
| *) Aktuelle Forschungsergebnisse haben gezeigt, dass Messungen der Sauerstoffkonzentrationen im Wasser und der Redoxpotenziale für das Wachstum und die Entwicklung von mikrobiellen Populationen in Oberflächengewässern weder einen mechanistischen noch einen prognostischen Wert besitzen (24) (25). Zur Interpretation und Beurteilung der aeroben biologischen Transformationsraten und -pfade besser geeignete Hilfsmittel sind möglicherweise die Bestimmung des biochemischen Sauerstoffbedarfs (BSB) (bei der Feldprobenahme sowie zu Testbeginn und -ende) ) und die Konzentrationsbestimmung der Mikro-/Makronährstoffe Ca2+, Mg2+ und Mn2+ (zu Testbeginn und -ende) in Wasser sowie die Messung des Gesamt-N und Gesamt-P in Sedimenten (bei der Feldprobenahme und zu Testende).
**) Die Methode der mikrobiellen Respirationsrate (26), die Fumigationsmethode (27) oder die Bestimmung der Lebendkeimzahl (z.B. Bakterien, Aktinomyceten, Pilze und Gesamtzahl der Kolonien) für aerobe Untersuchungen; Methanogeneserate bei anaeroben Untersuchungen. | ||||||
1.8.3 Probenahme, Handhabung und Lagerung
1.8.3.1 Probenahme
Für die Entnahme von Sedimentproben sollte der Entwurf der ISO-Hinweise zur Probenahme von Sedimenten (8) herangezogen werden. Sedimentproben sollten von der gesamten oberen, 5 bis 10 cm starken Sedimentschicht genommen werden. Am selben Standort und zum selben Zeitpunkt sollte das dazugehörige Wasser entnommen werden. Für die anaerobe Studie sollte die Probenahme und der Transport des Sediments und des dazugehörigen Wassers unter Ausschluss von Sauerstoff erfolgen (28) (siehe 1.8.2.1). Einige Probenahmegeräte sind in der Literatur beschrieben (8) (23).
1.8.3.2 Handhabung
Das Sediment wird durch Filtration vom Wasser getrennt und dann mit überschüssigem Standortwasser, das anschließend verworfen wird, durch ein Sieb mit einer Maschenweite von 2 mm feucht gesiebt. Dann werden bekannte Mengen Sediment und Wasser im gewünschten Verhältnis (siehe 1.9.1) in Inkubationsgefäßen vermischt und für die Akklimatisierung vorbereitet (siehe 1.8.4). Bei der anaeroben Studie sind alle Schritte unter Ausschluss von Sauerstoff durchzuführen (29) (30) (31) (32) (33).
1.8.3.3 Lagerung
In jedem Falle wird die Verwendung frischer Sediment- und Wasserproben empfohlen; ist jedoch eine Lagerung erforderlich, sollten Sediment und Wasser wie zuvor beschrieben gesiebt und zusammen gelagert werden, und zwar mit einem Wasserüberstand (6 10 cm Wassersäule), im Dunkeln, bei 4 ± 2 °C 4 und für einen Zeitraum von höchstens vier Wochen (7) (8) (23). Für aerobe Untersuchungen vorgesehene Proben sollten bei freiem Luftzutritt gelagert werden (z.B. in offenen Behältern), die für anaerobe Untersuchungen vorgesehenen Proben hingegen unter Ausschluss von Sauerstoff. Während des Transports and der Lagerung dürfen Sediment und Wasser nicht gefrieren und das Sediment darf nicht austrocknen.
1.8.4 Vorbereitung der Sediment-/Wasserproben für den Test
Der Testsubstanzzugabe sollte eine Akklimatisierungsperiode vorangehen, während der sich jede Sediment-/ Wasserprobe in dem im Haupttest zu verwendenden Inkubationsgefäß befindet. Die Bedingungen der Akklimatisierungsperiode müssen exakt denen der Inkubation beim Haupttest entsprechen (siehe 1.9.1). Die Akklimatisierungsperiode ist die Zeit, die benötigt wird, um eine hinreichende Stabilität des Systems zu erreichen, die sich am pH-Wert, an der Sauerstoffkonzentration im Wasser, am Redoxpotenzial des Sediments und Wassers sowie an der makroskopischen Phasentrennung ablesen lässt. Die Akklimatisierungsperiode beträgt in aller Regel ein bis zwei Wochen und sollte vier Wochen nicht überschreiten. Die Ergebnisse der während dieser Zeit durchgeführten Bestimmungen sind zu protokollieren.
1.9 Durchführung des Tests
1.9.1 Testbedingungen
Der Test sollte im Inkubationsgefäß (siehe 1.8.1) mit einem Wasser-Sediment-Volumenverhältnis zwischen 3:1 und 4:1 und einer Sedimentschicht von 2,5 cm (± 0,5 cm) durchgeführt werden 4. Eine Mindestmenge von 50 g Sediment (Trockengewicht) pro Inkubationsgefäß wird empfohlen.
Der Test sollte im Dunkeln bei einer konstanten Temperatur im Bereich von 10 bis 30 °C durchgeführt werden. Angemessen ist eine Temperatur von (20 ± 2) °C. Falls notwendig, kann zusätzlich eine niedrigere Temperatur (im Allgemeinen 10 °C) gewählt werden, als Einzelfallentscheidung in Abhängigkeit von den zu ermittelnden Testergebnissen. Die Inkubationstemperatur sollte überwacht und protokolliert werden.
1.9.2 Behandlung und Applikation der Testsubstanz
Es wird eine Testkonzentration der Chemikalie verwendet 5. Für Pflanzenschutzmittel, die direkt auf den Wasserkörper appliziert werden, sollte die auf dem Etikett angegebene Höchstdosierung als maximale Applikationsrate, die bezogen auf die Wasseroberfläche des Testgefäßes errechnet wird, eingesetzt werden. In allen anderen Fällen sollte die einzusetzende Konzentration auf Berechnungen aus Umweltemissionen basieren. Es ist darauf zu achten, dass eine ausreichende Testsubstanzkonzentration appliziert wird, um den Transformationspfad und die Bildung und den Rückgang der Transformationsprodukte erfassen zu können. Es kann erforderlich sein, höhere Dosen zu applizieren (z.B. das 10-fache), wenn z.B. die Testsubstanzkonzentration zu Testbeginn dicht an der Nachweisgrenze liegt und/oder wenn die Haupttransformationsprodukte nicht ohne weiteres nachgewiesen werden können, obwohl ihr Anteil 10 % der Applikationsrate der Testsubstanz ausmacht. Werden höhere Testkonzentrationen verwendet, sollten diese allerdings keine erhebliche Beeinträchtigung der mikrobiellen Aktivität des Wasser-Sediment-Systems bewirken. Um eine konstante Testsubstanzkonzentration in verschieden großen Gefäßen zu erreichen, kann eine Anpassung der applizierten Substanzmenge als sinnvoll angesehen werden, basierend auf der Höhe der Wassersäule im Gefäß im Verhältnis zur Höhe der Wassersäule am Probenahmestandort (die mit 100 cm angenommen wird, doch auch andere Höhen sind möglich). Siehe die Beispielrechnung in Anlage 4.
Idealerweise sollte die Testsubstanz als wässrige Lösung in die Wasserphase des Testsystems gegeben werden. Falls es sich nicht vermeiden lässt, ist der Einsatz geringer Mengen von mit Wasser mischbaren Lösungsmitteln (wie Aceton oder Ethanol) für die Applikation und Verteilung der Testsubstanz zulässig, sollte jedoch 1 % v/v nicht überschreiten und die mikrobielle Aktivität des Testsystems nicht beeinträchtigen. Die Herstellung der wässrigen Lösung der Testsubstanz ist mit Sorgfalt vorzunehmen - zur Sicherstellung einer vollständigen Homogenität können die Verwendung von Generatorsäulen und das Mischen vor Testbeginn sinnvoll sein. Nach Zugabe der wässrigen Lösung in das Testsystem wird ein vorsichtiges Mischen der Wasserphase empfohlen, wobei das Sediment so wenig wie möglich gestört werden sollte.
Die Verwendung von formulierten Handelsprodukten wird routinemäßig nicht empfohlen, da die Formulierungsbestandteile die Verteilung der Testsubstanz und/oder der Transformationsprodukte zwischen der Wasser- und der Sedimentphase beeinflussen können. Bei schlecht wasserlöslichen Testsubstanzen kann der Einsatz von formulierten Handelsprodukten jedoch eine geeignete Alternative darstellen.
Die Anzahl der Inkubationsgefäße richtet sich nach der Anzahl der Probenahmezeitpunkte (siehe 1.9.3). Es sollte eine ausreichende Anzahl von Testansätzen vorgesehen werden, so dass zwei Ansätze zu jedem Probenahmezeitpunkt ausgewertet werden können. Werden Kontrollansätze für die verschiedenen Wasser-Sediment-Systeme eingesetzt, sollten sie nicht mit der Testsubstanz behandelt werden. Die Kontrollansätze können zur Bestimmung der mikrobiellen Biomasse des Sediments und der Gesamtmenge an organisch gebundenem Kohlenstoff des Wassers und Sedimentes zu Testende herangezogen werden. Zwei der Kontrollansätze (d. h. ein Kontrollansatz pro Wassersedimentansatz) können zur Überwachung der erforderlichen Parameter im Sediment und im Wasser während der Akklimatisierungsphase genutzt werden (siehe Tabelle in Abschnitt 1.8.2.2). Es sind zwei zusätzliche Kontrollansätze für den Fall vorzusehen, dass die Testsubstanz mittels eines Lösungsmittels appliziert wird, um Beeinträchtigungen der mikrobiellen Aktivität des Testsystems zu erfassen.
1.9.3 Testdauer und Probenahme
Der Versuch sollte im Normalfall nicht länger als 100 Tage dauern (6), sollte jedoch so lange fortgesetzt werden, bis der Abbauweg und das Wasser-/Sedimentverteilungsmuster ermittelt sind bzw. der Verlust der Testsubstanz durch Transformation und/oder Verflüchtigung 90 % erreicht hat. Die Anzahl der Probenahmezeitpunkte sollte mindestens sechs (einschließlich des Nullzeitpunkts) betragen, wobei fakultativ eine Voruntersuchung (siehe 1.9.4) durchgeführt werden kann, um ein geeignetes Probenahmeschema und die optimale Testdauer zu ermitteln, sofern nicht genügend Daten zur Testsubstanz aus früheren Untersuchungen vorliegen. Bei hydrophoben Testsubstanzen können zusätzliche Probenahmen während der Anfangsphase der Untersuchung erforderlich sein, um die Verteilungsrate zwischen der Wasser-/Sedimentphase zu bestimmen.
Zu entsprechenden Probenahmezeitpunkten werden komplette Inkubationsgefäße (im Replikat) zur Analyse entnommen. Das Sediment und das darüber liegende Wasser werden getrennt analysiert 6. Das Oberflächenwasser sollte vorsichtig entnommen werden, um das Sediment so wenig wie möglich zu stören. Die Extraktion und Charakterisierung der Testsubstanz und der Transformationsprodukte sollte nach geeigneten Analysenverfahren erfolgen. Substanzen, die sich unter Umständen am Inkubationsgefäß oder an den Verbindungsleitungen, die zum Auffangen flüchtiger Verbindungen dienen, angelagert haben, sollten vorsichtig abgelöst und gesammelt werden.
1.9.4 Fakultative Voruntersuchung
Können Dauer und Probenahmeschema nicht auf der Grundlage anderer relevanter Untersuchungen zur Testsubstanz abgeschätzt werden, kann fakultativ eine Voruntersuchung als sinnvoll angesehen werden, die unter den gleichen Testbedingungen durchzuführen ist, wie sie für den endgültigen Hauptversuch geplant sind. Die relevanten Versuchsbedingungen und Ergebnisse aus der Voruntersuchung, falls sie durchgeführt wurde, sollten in Kurzform protokolliert werden.
1.9.5 Messungen und Analyse
Die Konzentration der Testsubstanz und der Transformationsprodukte ist zu jedem Probenahmezeitpunkt im Wasser und im Sediment zu messen und zu protokollieren (als Konzentrationsangabe und als prozentualer Anteil der Applikationsmenge). Allgemein sollten Transformationsprodukte, die > 10 % der applizierten Radioaktivität im gesamten Wasser-Sediment-System zu irgendeinem Probenahmezeitpunkt aufweisen, identifiziert werden, sofern nicht hinreichende Gründe dagegen sprechen. Ebenfalls für eine Identifizierung in Betracht gezogen werden sollten Transformationsprodukte, deren Konzentrationen während des Tests kontinuierlich steigen, da dies ein Hinweis auf Persistenz ist, auch wenn ihre Konzentrationen die oben genannten Grenzen nicht überschreiten. Dieses Vorgehen sollte im Einzelfall erwogen und im Abschlussbericht begründet werden.
Zu jedem Probenahmezeitpunkt sollten die Ergebnisse aus den Abscheidesystemen für Gase/flüchtige Verbindungen (CO2 und andere, d. h. flüchtige organische Verbindungen) protokolliert werden. Die Mineralisationsraten sind zu protokollieren. Nicht extrahierbare (gebundene) Rückstände im Sediment sind zu jedem Probenahmezeitpunkt zu protokollieren.
2. Daten
2.1 Aufbereitung der Ergebnisse
Die Gesamtmassenbilanz bzw. die Wiederfindungsrate (siehe 1.7.1) der zugegebenen Radioaktivität ist zu jedem Probenahmezeitpunkt zu berechnen. Die Ergebnisse sind als Anteile (in %) der applizierten Radioaktivität zu protokollieren. Die Verteilung der Radioaktivität im Wasser und Sediment sollte als Konzentration und prozentualer Anteil zu jedem Probenahmezeitpunkt protokolliert werden.
Die Halbwertszeit, DT50- und ggf. DT75- und DT90-Werte der Testsubstanz sollten zusammen mit ihren Vertrauensbereichen berechnet werden (siehe 1.7.3). Informationen zur Verlustrate der Testsubstanzkonzentration im Wasser und im Sediment lassen sich mittels geeigneter Berechnungsprogramme gewinnen. Dazu können gehören: die Anwendung einer Kinetik nach pseudoerster Ordnung, empirische Kurvenanpassungsverfahren unter Anwendung grafischer oder numerischer Lösungen sowie komplexere Berechnungen z.B. unter Anwendung von Einzel- oder Mehrkompartimentmodellen. Weitere Einzelheiten sind in der relevanten Literatur zu finden (35) (36) (37).
Alle Ansätze haben Stärken und Schwächen und weisen hinsichtlich ihrer Komplexität erhebliche Unterschiede auf. Die Annahme einer Kinetik erster Ordnung kann eine zu starke Vereinfachung der Abbau- und Verteilungsprozesse bedeuten, ergibt jedoch - falls möglich - einen Wert (die Geschwindigkeitskonstante oder Halbwertszeit), der leicht zu verstehen und für Simulationsmodellierungen und Berechnungen von Umweltkonzentrationen relevant ist. Empirische Ansätze oder lineare Transformationen können bessere Anpassungen von Kurven an Daten und damit eine optimalere Abschätzung von Halbwertszeiten, DT50- und ggf. DT75- und DT90-Werten ermöglichen. Allerdings ist der Nutzen dieser abgeleiteten Konstanten begrenzt. Mit Kompartimentmodellen lassen sich eine Reihe nützlicher Konstanten berechnen, die wichtig für die Risikoabschätzung sind und die die Abbaugeschwindigkeit in den verschiedenen Kompartimenten sowie die Verteilung der Chemikalie beschreiben. Sie sollten ferner zur Ermittlung der Geschwindigkeitskonstanten für die Bildung und den Abbau von Haupttransformationsprodukten herangezogen werden. In allen Fällen muss die Auswahl der Methode begründet werden, und der Versuchsleiter sollte die Güte der Anpassung grafisch und/oder statistisch nachweisen.
3. Abschlussbericht
3.1 Testbericht
Der Testbericht muss folgende Angaben enthalten: Testsubstanz:
- Common Name (Handelsname von Pflanzenschutzmitteln), systematischer chemischer Name, CAS-Nummer, Strukturformel (bei Verwendung radioaktiv markierter Chemikalien mit Angabe des Markierungsorts) und relevante physikalischchemische Eigenschaften;
- Reinheit (Verunreinigungen) der Testsubstanz;
- radiochemische Reinheit der markierten Chemikalie und molare Aktivität (falls zutreffend).
Referenzsubstanzen:
- Systematischer chemischer Name und Struktur von Referenzsubstanzen, die zur Charakterisierung und/oder zur Identifizierung von Transformationsprodukten verwendet werden.
Testsedimente und -wasser:
- Ort und Beschreibung der Probenahmestelle(n) für das Wassersediment, einschließlich etwaiger früherer Kontaminationen;
- alle Informationen zur Probenahme, (ggf.) Lagerung und Akklimatisierung von Wasser-Sediment-Systemen;
- Eigenschaften der Wasser-Sediment-Proben gemäß der Tabelle in Abschnitt 1.8.2.2.
Testbedingungen:
- Verwendetes Testsystem (z.B. Durchflusssystem, Biometersystem, Art der Belüftung, Rührmethode, Wasservolumen, Sedimentmasse, Höhe der Wasser- und der Sedimentschicht, Abmessungen der Testgefäße usw.);
- Applikation der Testsubstanz in das Testsystem: verwendete Testkonzentration, Anzahl der Replikat- und Kontrollproben, Art der Applikation der Testsubstanz (z.B. Verwendung eines Lösungsmittels, falls zutreffend) usw.;
- Inkubationstemperatur;
- Probenahmezeitpunkte;
- Extraktionsmethoden und -effizienz sowie Analysenmethoden und Nachweisgrenzen;
- Verfahren für die Charakterisierung/Identifizierung von Transformationsprodukten;
- Abweichungen vor der Testvorschrift oder den Testbedingungen während der Untersuchung.
Ergebnisse:
- Rohdaten-Zahlenwerte repräsentativer Analysen (sämtliche Rohdaten sind im GLP-Archiv zu speichern);
- Wiederholbarkeit und Empfindlichkeit der herangezogenen Analysenverfahren;
- Wiederfindungsraten (prozentuale Werte für eine valide Studie sind in 1.7.1 angegeben);
- tabellarische Darstellung der Ergebnisse, ausgedrückt in % der applizierten Menge und in mgkg-1 im Wasser, im Sediment und im Gesamtsystem (nur in %) für die Testsubstanz und ggf. für Transformationsprodukte und nicht extrahierbare Radioaktivität;
- Massenbilanz während und am Ende der Untersuchungen;
- grafische Darstellung der Transformation in den Wasser- und Sedimentfraktionen sowie im Gesamtsystem (einschließlich Mineralisation);
- Mineralisationsraten;
- Halbwertszeit, DT50- sowie ggf. DT75- und DT90-Werte für die Testsubstanz und ggf. Haupttransformationsprodukte einschließlich der Vertrauensbereiche im Wasser, Sediment und im Gesamtsystem;
- Beurteilung der Transformationskinetik der Testsubstanz und ggf. der Haupttransformationsprodukte;
- Vorschlag für einen Transformationspfad, falls möglich;
- Diskussion der Ergebnisse.
4. Literaturangaben
(1) BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment system. Germany.
(2) Commission for registration of pesticides: Application for registration of a pesticide, (1991). Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands.
(3) MAFF Pesticides Safety Directorate. (1992), Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046, United-Kingdom.
(4) Agriculture Canada: Environmental chemistry and fate. (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) - Anaerobic and aerobic. Canada, 35-37.
(5) US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162-3, Anaerobic aquatic metabolism.
(6) SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels.
(7) OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/ sediments, Belgirate, Italy, 18-20 January 1995.
(8) ISO/DIS 5667-12. (1994). Water quality - Sampling - Part 12: Guidance on sampling of bottom sediments.
(9) US-EPA (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-9B-O8O.
(10) DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998).
(11) T.R. Roberts: Nonextractable pesticide residues in soils and plants. Pure Appl. Chem, 56, 945-956 (IUPAC 1984).
(12) OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981).
(13) OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
(14) Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC Pests and Diseases, 3B 4, 149 158.
(15) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons.
(16) Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and nonionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil Environ. Toxicol. Chem. 16, 631-637.
(17) Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Sludies with 14C-labelled model surfactants. Water Research 21, 661-667.
(18) Black, CA. (1965). Methods of Soil Analysis. Agronomy Monograph No 9. American Society of Agronomy, Madison.
(19) APHA (1989). Standard Methods for Examination of Water and Wastewater (17 edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C.
(20) Rowell, D.L. (1994). Soil Science Methods and Applications. Longman.
(21) Light, T.S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, 1038-1039.
(22) SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the WorkshopA Meeting of Experts on Guidelines for Static Field Mesocosms Tests ", 3-4 July 1991.
(23) SETAC-Europe publication. (1993). Guidance document on sediment toxicity tests and bioassays for. freshwater and marine environments. From the Workshop On Sediment.Toxicity Assessment (WOSTA), 8-10. November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach.
(24) Vink, J.P.M., van der Zee, S.E.A.T.M. (1997). Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, 2858-2868,
(25) Vink, J.P.M., Schraa, G., van der Zee, S.E.A.T.M. (1999). Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, 329-338.
(26) Anderson, T.H., Domsch, K.H. (1985). Maintenance carbon requirements of activelymetabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, 197-203.
(27) ISO-14240-2. (1997). Soil quality - Determination of soil microbial biomass - Part 2: Fumigationextraction method.
(28) Beelen, P. Van and F. Van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), 13-21.
(29) Shelton, D.R. and Tiedje, J.M. (1984). General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, 850-857.
(30) Birch, R.R., Biver, C, Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550.
(31) Pagga, U. and Beimbom, D.B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, 1499-1509.
(32) Nuck, B.A. and Federle, T.W. (1986). A baten test for assessing the mineralisation of l4C-radiolabelled compounds under realistic anaerobic conditions, Environ. Sci. Technol. 30, 3597-3603,
(33) US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090.
(34) Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, 961-968.
(35) Timme, G., Frehse H. and Laska V. (1986) Statistical Interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz - Nachrichten Bayer, 39, 187-203.
(36) Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz - Nachrichten Bayer, 33, 47-60.
(37) Carlton, R.R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water Systems. Brighton Crop Protection Conference - Pest and Diseases, 1349-1354.
...
1) Wenn beispielsweise die Testsubstanz einen Ring enthält, muss sich die Markierung auf diesem Ring befinden; enthält die Testsubstanz zwei oder mehr Ringe, können gesonderte Untersuchungen erforderlich sein, um den Verbleib jedes markierten Rings zu erfassen und sachgerechte Informationen zur Bildung von Transformationsprodukten zu gewinnen.
2) Da diese basischen Absorptionslösungen auch das Kohlendioxid aus der Belüftungsluft und das bei den aeroben Versuchen durch die Atmung gebildete Kohlendioxid absorbieren können, müssen sie in regelmäßigen Zeitabständen ausgewechselt werden, um ihre Sättigung und damit einen Verlust ihres Absorptionsvermögens zu verhindern.
3) [Ton und Schluff] ist die mineralische Fraktion des Sediments mit einer Partikelgröße von < 50 µm.
4) Aktuelle Studien haben gezeigt, dass eine Lagerung bei 4 °C zu einer Verminderung des organischen Kohlenstoffgehalts des Sediments führen kann, was unter Umständen einen Rückgang der mikrobiellen Aktivität zur Folge hat (34).
5) Ein Test mit einer zweiten Konzentrationsstufe kann bei Chemikalien von Nutzen sein, die auf verschiedenen Eintragspfaden in Oberflächengewässer gelangen und somit signifikant unterschiedliche Konzentrationen aufweisen, sofern die niedrigere Konzentration mit hinreichender Genauigkeit analytisch bestimmt werden kann.
6) Falls es ohne weiteres zu einer schnellen Reoxidation anaerober Transformationsprodukte kommen kann, sollten während der Probenahme und Analyse anaerobe Bedingungen sichergestellt werden.
| Anleitung zu den aeroben und den anaeroben Testsystemen | Anlage 1 |
Aerobes Testsystem
Das in dieser Testmethode beschriebene aerobe Testsystem besteht aus einer aeroben Wassersäule (typische Sauerstoffkonzentrationen im Bereich von 7 bis 10 mgl-1) und einer Sedimentschicht, die an der Oberfläche aerob und unter der Oberfläche anaerob ist. (Typische mittlere Redoxpotenziale (Eh) der anaeroben Sedimentzone liegen im Bereich von - 80 bis - 190 mV.) In jedem Inkubationsgefäß wird angefeuchtete Luft über die Wasseroberfläche geführt, um im oberen Teil des Gefäßes eine ausreichende Menge Sauerstoff zu gewährleisten.
Anaerobes Testsystem
Das Testverfahren des anaeroben Testsystems gleicht im Wesentlichen dem für das aerobe System beschriebenen, mit dem Unterschied, dass in jedem Inkubationsgefäß angefeuchteter Stickstoff über die Wasseroberfläche geführt wird, um eine ausreichende Stickstoffmenge im oberen Gefäßteil zu gewährleisten. Sediment und Wasser werden als anaerob betrachtet, wenn das Redoxpotenzial (Eh) niedriger ist als - 100 mV.
Im anaeroben Test beruht die Beurteilung der Mineralisation auf der Messung des gebildeten Kohlendioxids und Methans.
| Beispiel eines Durchflusssystems | Anlage 2 |

Sicherheitsabscheider, leer
Abscheider 1:
Ethylenglykol für die Abscheidung flüchtiger organischer Stoffe
Abscheider 2:
0,1M Schwefelsäure für die Abscheidung flüchtiger alkalischer Stoffe
Abscheider 3 und 4:
2M Natriumhydroxid für die Abscheidung von CO2 und anderen flüchtigen sauren Stoffen
| Beispiel eines Biometersystems | Anlage 3 |

| Beispielrechnung für die Applikationsdosis in Testgefäßen | Anlage 4 |
| Zylinderinnendurchmesser: | = 8 cm |
| Höhe der Wassersäule ohne Sediment: | = 12 cm |
| Oberfläche: 3,142 x 42 Applikationsrate: 500 g Testsubstanz/ha entspricht 5 | = 50,3 cm2 |
| µg/cm2 Gesamtmenge (µg): 5 x 50,3 Bezug der Gesamtmenge auf eine Wassersäulenhöhe von 100 cm: | = 251,5 µg |
| 12 x 251,5 ÷ 100 | = 30,18 g |
| Volumen der Wassersäule: 50,3 x 12 | = 603 ml |
| Konzentration in Wasser: 30,18 ÷ 603 | = 0,050 µg/ml oder 50 µg/l |
C.25 Aerobe Mineralisation in Oberflächenwasser - Simulationstest zur biologischen Abbaubarkeit
1. Methode
Diese Methode entspricht der Prüfrichtlinie OECD TG 309 (2004) (1).
1.1 Einleitung
Mit diesem Test sollen der zeitliche Verlauf des biologischen Abbaus einer niedrig konzentrierten Prüfsubstanz in aerobem natürlichem Wasser gemessen und die Beobachtungen als kinetische Geschwindigkeit quantifiziert werden. Dieser Simulationstest besteht aus einem im Labor durchgeführten Schüttelkolben-Batch-Test, in dem die Rate des aeroben biologischen Abbaus organischer Substanzen in Proben natürlichen Oberflächenwassers (Süßwasser, Brackwasser oder Meerwasser) ermittelt wird. Der Test beruht auf ISO/DIS 14592-1 (2) und beinhaltet außerdem Elemente der Prüfmethoden C.23 und C.24 (3)(4). Bei langer Testdauer wird anstelle der Batch-Untersuchung ein semikontinuierlicher Test durchgeführt, um den Abbau der Testorganismen zu verhindern. Das Hauptziel des Simulationstests besteht in der Mineralisation der Prüfsubstanz in Oberflächenwasser, aufgrund der Mineralisation wird dann die Abbaukinetik beschrieben. Ein fakultatives untergeordnetes Ziel des Tests besteht in der Ermittlung von Informationen zum primären Abbau und zur Bildung wesentlicher Transformationsprodukte. Die Bestimmung der Transformationsprodukte sowie nach Möglichkeit die Quantifizierung der jeweiligen Konzentrationen sind besonders wichtig bei Substanzen, die sehr langsam mineralisiert werden (z.B. wenn die Halbwertszeiten für den Abbau sämtlicher 14C-Rückstände mehr als 60 Tage betragen). Zur Bestimmung und Quantifizierung wichtiger Transformationsprodukte sollten aus analytischen Gründen die Prüfsubstanzen im Allgemeinen in höheren Konzentrationen (z.B. > 100 µg/l) verwendet werden.
Niedrige Konzentrationen sind in diesem Test Konzentrationen (z.B. von weniger als 1 µg/l auf 100 µg/l), die so gering sind, dass sichergestellt ist, dass die Kinetik des biologischen Abbaus im Test die in der natürlichen Umgebung zu erwartende Kinetik widerspiegelt. Gegenüber der Gesamtmasse an biologisch abbaubaren Kohlenstoffsubstraten, die in im Test verwendetem natürlichem Wasser vorkommen, fungiert die niedrig konzentrierte Prüfsubstanz als untergeordnetes Substrat. Dies bedeutet, dass die zu erwartende Kinetik des biologischen Abbaus als Kinetik erster Ordnung einzustufen ist (Kinetik "ohne Wachstum") und dass die Prüfsubstanz durch "Cometabolismus" abgebaut werden kann. Eine Kinetik erster Ordnung impliziert, dass die Abbaurate (mg/l/Tag) proportional zur im Laufe der Zeit abnehmenden Substratkonzentration ist. Bei echter Kinetik erster Ordnung ist die Konstante der spezifischen Abbaurate (k) unabhängig von der Dauer und von der Konzentration. Die Konstante k ändert sich also während eines Versuchs nicht nennenswert, und wesentliche Änderungen treten auch nach Konzentrationssteigerungen von einem Versuch zum nächsten nicht auf. Per Definition entspricht die Konstante der spezifischen Abbaurate der relativen Konzentrationsänderung pro Zeiteinheit: k = (1/C) ×(dC/dt). Unter den vorgegebenen Bedingungen ist im Allgemeinen eine Kinetik erster Ordnung zu erwarten; unter gewissen Bedingungen kann jedoch auch eine sonstige Kinetik gegeben sein. Abweichungen von der Kinetik erster Ordnung können z.B. festzustellen sein, wenn die Geschwindigkeit der biologischen Transformation stärker durch ein Massentransfer-Phänomen wie z.B. die Diffusionsrate als durch die Geschwindigkeit der biologischen Reaktion begrenzt wird. Die Daten können jedoch nahezu immer durch eine Pseudo-Kinetik erster Ordnung beschrieben werden, wobei eine konzentrationsabhängige Konstante für die Abbaurate angenommen wird.
Informationen zur biologischen Abbaubarkeit der Prüfsubstanz bei höheren Konzentrationen (z.B. aufgrund von Standard-Screening-Tests) sowie Informationen zur abiotischen Abbaubarkeit, zu Transformationsprodukten und zu maggeblichen physikalisch-chemischen Merkmalen sollten vor dem Test verfügbar sein, um den Versuch planen und die Ergebnisse auswerten zu können. Die Verwendung von mit 14C-markierten Prüfsubstanzen und die Bestimmung der Phasenverteilung von 14C am Ende des Tests ermöglichen die Bestimmung der biologischen Endabbaubarkeit. Bei nicht markierten Prüfsubstanzen kann der biologische Endabbau nur geschätzt werden, wenn eine höhere Konzentration getestet wird und alle wesentlichen Transformationsprodukte bekannt sind.
1.2 Begriffsbestimmungen
Primärer biologischer Abbau Strukturänderung (Transformation) einer chemischen Substanz durch Mikroorganismen infolge des Verlusts der chemischen Identität.
Funktionaler biologischer Abbau Strukturänderung (Transformation) einer chemischen Substanz durch Mikroorganismen infolge des Verlusts eines spezifischen Merkmals.
Aerober biologischer Endabbau: Zersetzung einer chemischen Substanz durch Mikroorganismen unter Sauerstoffeinwirkung in Kohlendioxid und Wasser sowie in Mineralsalze sonstiger vorhandener Elemente (Mineralisation) und Erzeugung neuer Biomasse und organischer mikrobiologischer Biosyntheseprodukte.
Mineralisation Zersetzung einer chemischen Substanz oder eines organischen Materials durch Mikroorganismen unter Sauerstoffeinwirkung in Kohlendioxid und Wasser sowie in Mineralsalze sonstiger vorhandener Elemente.
"Lag"-Phase: Zeitraum vom Beginn eines Tests bis zur Anpassung der abbauenden Mikroorganismen und bis der biologische Abbau einer chemischen Substanz oder eines organischen Materials einen nachweisbaren Umfang angenommen hat (z.B. 10 % des maximalen theoretischen biologischen Abbaus bzw. je nach Genauigkeit des Messverfahrens auch weniger).
Maximaler Umfang des biologischen Abbaus: In Prozent erfasster Umfang des biologischen Abbaus einer chemischen Substanz oder eines organischen Materials in einem Test, über den hinaus während des Tests kein weiterer biologischer Abbau mehr erfolgt.
Primärsubstrat: Zusammenstellung natürlichen Kohlenstoffs und natürlicher Energiequellen, in der eine mikrobiologische Biomasse wachsen und kultiviert werden kann.
Sekundärsubstrat: Niedrig konzentrierte Substratkomponente, durch deren Abbau den maßgeblichen Mikroorganismen im Vergleich zur Kohlenstoff- und Energieversorgung infolge des Abbaus der wesentlichen Substratkomponenten (Primärsubstrate) nur unerhebliche Mengen an Kohlenstoff und Energie zugeführt werden.
Konstante der Abbaurate: Konstante der Abbaukinetik erster Ordnung k (d-"); diese Konstante gibt Aufschluss über die Geschwindigkeit von Abbauprozessen; bei Batch-Versuchen wird k aufgrund des anfänglichen Abschnitts der Abbaukurve geschätzt, die am Ende der "Lag"-Phase ermittelt wird.
Halbwertszeit, t1/2 (d): Parameter zur Beschreibung der Geschwindigkeit einer Reaktion erster Ordnung; Zeitabstand, der einem Konzentrationsrückgang um den Faktor 2 entspricht. Der Zusammenhang zwischen der Halbwertszeit und der Konstante der Abbaurate lässt sich mit der Formel t1/2 =1n2/k beschreiben.
Abbauzeit, DT50 (d): Parameter zur Quantifizierung des Ergebnisses von Tests zur Ermittlung der biologischen Abbaubarkeit; Zeitintervall einschließlich der "Lag"-Phase, in dem ein biologischer Abbau von 50 % erreicht wird.
Nachweisgrenze (LOD = Limit of Detection) und Quantifizierungsgrenze (LOQ = Limit of Quantification): Als Nachweisgrenze (LOD) wird die Konzentration einer Substanz bezeichnet, unter der die Substanz nicht mehr von analytischen Artefakten unterschieden werden kann. Als Quantifizierungsgrenze (LOQ) gilt die Konzentration einer Substanz, unter der die Konzentrationen nicht mehr mit annehmbarer Genauigkeit bestimmt werden kann.
Gelöster organischer Kohlenstoff (DOC = Dissolved organic Carbon): Der Anteil des in einer Wasserprobe enthaltenen organischen Kohlenstoffs, der nicht durch die spezifizierte Phasentrennung entfernt werden kann (etwa durch 15-minütiges Zentrifugieren mit 40.000 ms-2 oder durch Membranfiltration mit einer Porengröße von 0,2 µm-0,45 µm).
TOA (Total organic 14C Activity): 14C-Gesamtaktivität von organischem Kohlenstoff
DOA (Dissolved organic 14C Activity): 14C-Aktivität von gelöstem organischem Kohlenstoff
POA (Particulate organic 14C Activity): 14C-Aktivität von als Feststoff vorliegendem organischem Kohlenstoff
1.3 Anwndbarkeit der Prüfmethode
Dieser Simulationstest ist bei nicht flüchtigen oder leicht flüchtigen organischen Substanzen durchzuführen, die bei niedrigen Konzentrationen getestet werden. Bei Verwendung von zur Atmosphäre offenen Kolben (z.B. nur mit einem Wattepropf verschlossen) können Substanzen mit Henry-Konstanten von unter etwa 1 Pa × m3/mol (ca. 10-5 atm × m3/mol) in der Praxis als nicht flüchtig betrachtet werden. Mit geschlossenen Kolben mit einem gewissen Luftraum können leicht flüchtige Substanzen (mit Henry-Konstanten < 100 Pa × m3/mol bzw. < 10-3 atm × m3/mol) verlustfrei getestet werden. Bei mit 14C markierten Substanzen können Verluste auftreten, wenn beim Abtrennen des CO2 nicht die erforderlichen Vorsichtsmaßnahmen getroffen werden. In diesen Fällen muss unter Umständen CO2 in einem internen Absorber mit Alkali gebunden oder ein externes CO2-Absorbersystem verwendet werden (direkte 14CO2-Bestimmung, wie in Anhang 3 beschrieben). Damit die Kinetik des biologischen Abbaus bestimmt werden kann, muss die Konzentration der Prüfsubstanz unter der Wasserlöslichkeit der Prüfsubstanz liegen. Es wird jedoch darauf hingewiesen, dass die in der FachLiteratur genannten Werte für die Wasserlöslichkeit erheblich höher sein können als die Löslichkeit der Prüfsubstanz in natürlichen Gewässern. Fakultativ kann die Löslichkeit von Prüfsubstanzen mit besonders schlechter Wasserlöslichkeit auch unter Verwendung von Material aus den zu prüfenden natürlichen Gewässern bestimmt werden.
Die Methode kann zur Simulierung des biologischen Abbaus in von groben Partikeln freiem Oberflächenwasser ("pelagischer Test") oder in trübem Oberflächenwasser z.B. an einem Wasser-/Sediment-Übergang ("Test mit suspendierten Sedimenten") eingesetzt werden.
1.4 Prinzip der Prüfmethode
Der Test wird als Batch-Test durchgeführt, indem die Prüfsubstanz entweder ausschließlich mit Oberflächenwasser ("pelagischer Test") oder in mit suspendierten Feststoffen/Sedimenten mit 0,01 bis 1 gjl Trockengewicht aufbereitetem Oberflächenwasser ("Test mit suspendierten Sedimenten") inkubiert wird, um ein Wasservolumen mit suspendierten Feststoffen oder neu suspendierten Sedimenten zu simulieren. Die Konzentration der suspendierten Feststoffe/Sedimente im unteren Bereich dieses Intervalls ist typisch für die meisten Oberflächengewässer. Die Testkolben werden im Dunkeln bei Umgebungstemperatur unter Schütteln bei aeroben Bedingungen inkubiert. Die Prüfsubstanz sollte in mindestens zwei Konzentrationen verwendet werden, um die Abbaukinetik zu bestimmen. Die Konzentrationen sollten sich um den Faktor 5 bis 10 voneinander unterscheiden und den in der Umwelt zu erwartenden Konzentrationsbereich abdecken. Die maximale Konzentration der Prüfsubstanz sollte höchstens 100 µg/l betragen; maximale Testkonzentrationen unter 10 µg/l sind jedoch zu bevorzugen, um sicherzustellen, dass beim biologischen Abbau eine Kinetik erster Ordnung gegeben ist. Die niedrigste Konzentration sollte höchstens 10 µg/l betragen; niedrigste Konzentrationen von 1-2 µg/l oder von weniger als 1 µg/l sind zu bevorzufen. Im Allgemeinen kann eine angemessene Analyse derart niedriger Konzentrationen mit handelsüblichen mit" C markierten Substanzen durchgeführt werden. Aus analysetechnischen Gründen kann die Konzentration der Prüfsubstanz häufig nicht mit der erforderlichen Genauigkeit gemessen werden, wenn die Prüfsubstanz in einer Konzentration von <100 µg/l vorliegt (siehe Abschnitt 1.7.2 Absatz 2). Höhere Konzentrationen der Prüfsubstanz (> 100 µg/l und gelegentlich > 1 mg/l) können zur Bestimmung und zur Quantifizierung wichtigerer Transformationsprodukte sowie dann verwendet werden, wenn ein spezifisches Analyseverfahren mit niedriger Nachweisgrenze nicht verfügbar ist. Wenn hohe Konzentrationen einer Prüfsubstanz getestet werden sollen, können die Ergebnisse unter Umständen nicht zur Schätzung der Konstante des Abbaus erster Ordnung und zur Schätzung der Halbwertszeit verwendet werden, weil der Abbau wahrscheinlich nicht der Kinetik erster Ordnung folgt.
Nach dem Abbau werden in geeigneten Zeitabständen entweder die 14C-Restwerte oder die Restkonzentration der Prüfsubstanz gemessen, wenn eine spezifische chemische Analyse erfolgt. Die 14C-Markierung der stabilsten Molekülbereiche gewährleistet, dass die Gesamtmineralisation bestimmt wird; erfolgt die Markierung mit 14C bei weniger stabilen Molekülbereichen oder werden spezifische Analyseverfahren eingesetzt, kann nur der primäre biologische Abbau ermittelt werden. Der stabilste Bereich beinhaltet jedoch nicht zwangsläufig den funktionsrelevanten Teil des Moleküls (der einem spezifischen Merkmal wie z.B. der Toxizität oder der Bioakkumulation zugeordnet werden kann). In diesem Fall ist unter Umständen die Verwendung einer im funktionsrelevanten Teil mit 14C markierten Prüfsubstanz angemessen, wenn die Aufhebung eines spezifischen Merkmals überwacht werden soll.
1.5 Informationen zur Prüfsubstanz
Für diesen Test können sowohl radioaktiv markierte als auch nicht markierte Prüfsubstanzen verwendet werden. Die Markierung mit 14C wird empfohlen; markiert werden sollten im Allgemeinen die stabilsten Bereiche der jeweiligen Moleküle (siehe auch Abschnitt 1.4). Bei Substanzen mit mehreren aromatischen Ringen sollte vorzugsweise mindestens ein Kohlenstoffmolekül pro Ring mit 14C markiert werden. Außerdem sollte vorzugsweise mindestens ein Kohlenstoffmolekül auf beiden Seiten leicht abbaubarer Brücken mit 14C markiert werden. Die chemische und/oder radiochemische Reinheit der Prüfsubstanz sollte > 95 % sein. Bei radioaktiv markierten Substanzen ist eine spezifische Aktivität von mindestens ca. 50 µCi/mg (1,85 MBq) zu bevorzugen, um die 14C-Messungen in Tests mit niedrigen Ausgangskonzentrationen zu erleichtern. Zu den Prüfsubstanzen sollten folgende Informationen verfügbar sein:
- Löslichkeit in Wasser (Methode A.6);
- Löslichkeit in organischen Lösungsmitteln (mit Lösungsmitteln behandelte Substanzen oder Substanzen mit geringer Wasserlöslichkeit),
- Dissoziationskonstante (pKa), wenn die betreffende Substanz zur Protonierung oder Deprotonierung neigt (OECD TG 112) (5);
- Dampfdruck (Methode A.4] und Henry-Konstante;
- chemische Stabilität in Wasser und im Dunkeln (Hydrolyse) (Methode C.7).
Wenn Substanzen mit geringer Wasserlöslichkeit in Meerwasser getestet werden, kann die Kenntnis der Aussalzungskonstante (oder "Setschenow-Konstante") Ks von Vorteil sein; diese Konstante wird mit folgender Formel definiert: log (S/S") = Ks Cm; dabei stehen S und S" für die Löslichkeit der Substanz in Süßwasser bzw. in Meerwasser und Cm für die molare Salzkonzentration.
Wenn der Test als "Test mit suspendierten Sedimenten" durchgeführt wird, sollten auch die folgenden Informationen vorliegen:
- n-Oktanol/Wasser-Verteilungskoeffizient (Methode A.8);
- Adsorptionskoeffizient (Methode C.18);
Außerdem können die folgenden Informationen hilfreich sein:
- Umweltkonzentration (wenn bekannt oder geschätzt);
- Toxizität der Prüfsubstanz für Mikroorganismen (Methode C.11);
- leichte und/oder inhärente biologische Abbaubarkeit (Methoden C.4 A-F, C.12, C.9, OECD TG 302 (5));
- aerobe bzw. anaerobe biologische Abbaubarkeit im Boden sowie Studien zur Sediment-/Wasser-Transformation (Methoden C.23, C.24).
1.6 Referenzsubstanz
Als Referenzsubstanz sollte eine unter aeroben Bedingungen im Allgemeinen leicht abzubauende Substanz (z.B. Anilin oder Natriumbenzoat) verwendet werden. Gewöhnlich werden Anilin und Natriumbenzoat in weniger als zwei Wochen.abgebaut. Mit den Referenzsubstanzen soll sichergestellt werden, dass die mikrobiologische Aktivität des Testwassers in einem bestimmten Rahmen liegt, d. h. dass das Wasser eine aktive mikrobiologische Population enthält.
1.7 Qualitätskriterien
1.7.1 Wiederfindungsraten
Unmittelbar nach der Zugabe der Prüfsubstanz sollte durch Messungen der 14C-Aktivität bzw. - bei nicht markierten Substanzen - durch chemische Analysen in jeweils mindestens zwei Proben jeweils die Ausgangs-Testkonzentration geprüft werden. Die entsprechenden Messungen geben Aufschluss über die Anwendbarkeit und über die Wiederholbarkeit der Analysemethode sowie über die Homogenität der Verteilung der Prüfsubstanz. Im Allgemeinen wird in den anschließenden Datenanalysen eher die gemessene 14C-Ausgangsaktivität oder die Prüfsubstanzkonzentration gemessen als die Nennkonzentration, da bei den Messungen der 14C-Ausgangsaktivität oder der Prüfsubstanzkonzentration die auftretenden Sorptions- und Dosierungsfehler kompensiert werden. Bei mit" 4C markierten Prüfsubstanzen wird der Umfang der Wiederfindung am Ende des Versuchs als Massenbilanz angegeben (siehe Abschnitt 1.8.9.4 letzter Absatz). Im Idealfall sollte die Massenbilanz bei radioaktiver Markierung im Bereich 90 % bis 110 % liegen; die erforderliche Analysegenauigkeit sollte bei nicht markierten Prüfsubstanzen durch eine anfängliche Wiederfindung von 70 % bis 110 % gegeben sein. Diese Bereiche sollten jedoch als Idealbereiche betrachtet und nicht als Kriterien für die Annehmbarkeit eines Tests angenommen werden. Die Analysegenauigkeit kann für die Prüfsubstanz auch bei einer niedrigeren Konzentration als der Ausgangskonzentration sowie für wichtigere Transformationsprodukte bestimmt werden.
1.7.2 Wiederholbarkeit und Empfindlichkeit der Analysemethode
Die Wiederholbarkeit der zur Quantifizierung der Prüfsubstanz sowie ggf. der Transformationsprodukte eingesetzten Analysemethode (einschließlich der Methoden zur Überprüfung der Wirksamkeit der Erstextraktion) sollte durch fünf Wiederholungsanalysen der einzelnen Extrakte des Oberflächenwassers geprüft werden.
Die Nachweisgrenze (LOD) der zur Analyse der Prüfsubstanz und der Transformationsprodukte verwendeten Methode sollte nach Möglichkeit bei mindestens 1 % der in das Testsystem eingebrachten Ausgangsmenge liegen. Die Quantifizierungsgrenze (LOQ) sollte kleiner oder gleich 10 % der verwendeten Konzentration sein. Die chemischen Analysen vieler organischer Substanzen und der jeweiligen Transformationsprodukte setzen häufig voraus, dass die Prüfsubstanz in verhältnismäßig hohen Konzentrationen (d. h. > 100 µg/l) eingebracht wird.
1.8 Beschreibung der Prüfmethode
1.8.1 Apparatur
Der Test kann in konischen oder zylindrischen Kolben mit geeignetem Fassungsvermögen (z.B. 0,5 oder 1,01) durchgeführt werden, die mit Silikon- oder Gummistopfen verschlossen sind; alternativ können auch Serumflaschen mit CO2-dichten Deckeln (z.B. mit Butylkautschuk-Septum) verwendet werden. Eine weitere Möglichkeit besteht in der Durchführung der Tests mit mehreren Kolben und in der Entnahme des gesamten Inhalts von jeweils mindestens zwei Kolben je Probenintervall (siehe Abschnitt 1.8.9.1 letzter Absatz). Für nicht flüchtige Prüfsubstanzen, die nicht radioaktiv markiert wurden, sind gasdichte Stopfen oder Deckel nicht erforderlich. Lose Wattepfropfen, die eine Verunreinigung aus der Luft verhindern, können verwendet werden (siehe Abschnitt 1.8.9.1 Absatz 2). Leicht flüchtige Substanzen sollten in einem Biometersystem unter leichten Rühren der Wasseroberfläche getestet werden. Um sicherzustellen, dass keine Verunreinigung durch Bakterien erfolgt, können die Gefäße auch durch Erwärmen oder durch Autoklavieren vor der Verwendung sterilisiert werden. Außerdem wird die folgende Standard-Laborausrüstung verwendet:
- ein Schütteltisch oder Magnetrührer zum kontinuierlichen Rühren der Testkolben;
- eine Zentrifuge;
- ein pH-Messgerät;
- ein Trübungsmesser für nephelometrische Trübungsmessungen;
- ein Ofen oder eine Mikrowelle zur Bestimmung der Trockengewichte;
- Geräte zur Membranfiltration;
- ein Autoklav oder ein Ofen zur Sterilisierung der Glasgeräte durch Erwärmen;
- Instrumente zur Handhabung von mit 14C markierten Substanzen;
- Geräte zur Quantifizierung der 14C-Aktivität der Proben aus CO2-Abscheidelösungen sowie ggf. aus Sedimentproben;
- Analysegeräte zur Bestimmung der Prüfsubstanz (und der Referenzsubstanz), wenn spezifische chemische Analysen (z.B. mit einem Gaschromatographien oder durch HPLC) vorgenommen werden.
1.8.2 Stammlösungen der Prüfsubstanz
Zur Herstellung von Stammlösungen der Prüfsubstanzen und der Referenzsubstanzen wird entionisiertes Wasser verwendet (siehe Abschnitt 1.8.7 Absatz 1). Das entionisierte Wasser sollte frei von Substanzen sein, die auf Mikroorganismen toxisch wirken könnten; außerdem sollte der Anteil an gelöstem organischem Kohlenstoff (DOC) höchstens 1 mg/l betragen (6).
1.8.3 Entnahme und Transport von Oberflächenwasser
Die Stellen, an denen das Oberflächenwasser entnommen wird, sollten grundsätzlich abhängig vom Zweck des jeweiligen Tests ausgewählt werden. Bei der Auswahl von Entnahmestellen sind mögliche Einträge aus Landwirtschaft, Industrie und Haushalten zu berücksichtigen. Wenn bekannt ist, dass eine aquatische Umgebung in den letzten vier Jahren mit der Prüfsubstanz oder mit analog aufgebauten Substanzen verunreinigt wurde, sollte dort nur dann Wasser für die Tests entnommen werden, wenn ausdrücklich die Abbauraten an bereits belasteten Stellen untersucht werden sollen. An der Entnahmestelle sollten der pH-Wert und die Temperatur des Wassers gemessen werden. Die Tiefe, in der das Wasser entnommen wurde, sowie das Aussehen der Wasserproben (z.B. Farbe und Trübung) sollten ebenfalls protokolliert werden (siehe Abschnitt 3). Die Sauerstoffkonzentration und/oder das Redoxpotenzial in Wasser und in der Sedimentoberfläche sollten gemessen werden, um die aerobe Qualität der Proben nachzuweisen, wenn diese nicht aufgrund des Aussehens oder bereits vorliegender Erfahrungen mit der Entnahmestelle offensichtlich bm bekannt sind. Das Oberflächenwasser sollte in einem gründlich gespülten Behälter transportiert werden. Während des Transports sollte die Probentemperatur die Testtemperatur nicht erheblich überschreiten. Bei einer Transportdauer von mehr als 2-3 Stunden wird eine Kühlung auf 4 °C empfohlen. Die Wasserprobe darf nicht gefroren sein.
1.8.4 Lagerung und Vorbereitung des Oberflächenwassers
Der Test sollte vorzugsweise binnen eines Tages nach der Probenahme begonnen werden. Die ggf. erforderliche Lagerung des Wassers sollte auf ein Minimum beschränkt werden; Lagerzeiten von mehr als vier Wochen sind unter keinen Umständen annehmbar. Die Wasserprobe sollte bis zur Verwendung bei einer Temperatur von 4 °C aufbewahrt werden. Vor der Verwendung sollten grobe Teilchen entfernt werden (z.B. durch Filtration durch einen Nylonfilter mit einer Maschenweite von 100 µm oder mit einem groben Papierfilter oder durch Ausfällung).
1.8.5 Vorbereitung von mit Sedimenten aufbereitetem Wasser (fakultativ)
Für den Test mit dem suspendierten Sediment wird ein Oberflächensediment zu den Kolben mit dem wie in Abschnitt 1.8.4 beschrieben zur Abtrennung grober Teilchen gefilterten natürlichen Wasser hinzugegeben, um eine Suspension herzustellen; die Konzentration der suspendierten Feststoffe sollte zwischen 0,01 und 1 g/l betragen. Das Oberflächensediment sollte aus der Stelle stammen, aus der auch die Wasserprobe genommen wurde. Abhängig von der jeweiligen aquatischen Umgebung kann das Oberflächensediment entweder durch einen hohen Anteil an organischem Kohlenstoff (2,5-7,5 %) und durch eine feine Textur oder durch einen geringen Anteil an organischem Kohlenstoff (0,5-2,5 %) und eine grobe Textur gekennzeichnet sein (3). Das Oberflächensediment kann wie folgt hergestellt werden: Mit einem durchsichtigen Kunststoffröhrchen werden mehrere Sedimentkerne gezogen; unmittelbar nach der Probenahme werden anschließend die oberen aeroben Schichten abgeschnitten (von der Oberfläche bis zu einer Tiefe von maximal 5 mm) und zusammengegeben. Die so hergestellte Sedimentprobe sollte in einem Behälter mit großem Luftraum transportiert werden, um die aerobe Umgebung des Sediments aufrechtzuerhalten. (Bei einer Transportdauer von mehr als 2-3 Stunden ist das Sediment auf 4 °C zu kühlen.) Die Sedimentprobe sollte dann im für den Test zu verwendenden Wasser im Verhältnis 1:10 suspendiert und bis zur Verwendung belüftet bei einer Temperatur von 4 °C gelagert werden. Die ggf. erforderliche Lagerung des Sediments sollte auf ein Minimum beschränkt werden; Lagerzeiten von mehr als vier Wochen sind unter keinen Umständen annehmbar.
1.8.6 Semikontinuierliches Verfahren (fakultativ)
Eine längere Inkubation (über mehrere Monate) kann erforderlich sein, wenn ein erheblicher Abbau der Prüfsubstanz erst nach einer langen Verzögerung messbar ist. Wenn die Notwendigkeit einer längeren Inkubation aus früheren Tests einer Substanz bekannt ist, kann der Test mit einem semikontinuierlichen Verfahren begonnen werden, bei dem regelmäßig ein Teil des im Test verwendeten Wassers bzw. der Suspension erneuert wird (siehe Anhang 2). Alternativ kann auch der normale Batch-Test zu einem semikontinuierlichen Test abgewandelt werden, wenn binnen einer Testdauer von etwa 60 Tagen im Batch-Test (siehe Abschnitt 1.8.8.3 Absatz 2) kein Abbau der Priifsubstanz festgestellt wurde.
1.8.7 Zugabe der Prüfsubstanz (bzw. der Referenzsubstanz)
Bei Substanzen mit hoher Wasserlöslichkeit (> 1 mg/l) und geringer Flüchtigkeit (Henry-Konstanten < 1 Pa × m3/mol oder < 10-5 atm × m3/mol) kann eine Stammlösung in entionisiertem Wasser hergestellt werden (siehe Abschnitt 1.8.2); die jeweils erforderliche Menge der Stammlösung wird zu den Prüfgefäßen hinzugegeben, bis die gewünschte Konzentration erreicht ist. Das Volumen einer hinzugefügten Stammlösung sollte auf das geringstmögliche Mag begrenzt werden (möglichst < 10 % des endgültigen Flüssigkeitsvolumens). Ein weiteres Verfahren besteht in der Auflösung der Prüfsubstanz in einem größeren Volumen des im Test verwendeten Wassers; diese Möglichkeit kommt als Alternative zur Verwendung organischer Lösungsmittel in Betracht.
Wenn zwingend erforderlich, sollten Stammlösungen nicht flüchtiger Substanzen mit geringer Wasserlöslichkeit unter Einsatz eines flüchtigen organischen Lösungsmittels hergestellt werden; die Menge des zum Testsystem hinzugegebenen Lösungsmittels sollte jedoch maximal 1 % (v/v) betragen und die mikrobiologische Aktivität nicht beeinträchtigen. Außerdem sollte das Lösungsmittel keine Auswirkungen auf die Stabilität der Prüfsubstanz im Wasser haben. Das Lösungsmittel sollte bis zu einem äußerst geringen Volumen so weit abgetrennt werden, dass die DOC-Konzentration des im Test verwendeten Wassers bzw. der verwendeten Suspension nicht erheblich erhöht wird. Dies sollte durch eine substanzspezifische Analyse bzw. nach Möglichkeit durch eine DOC-Analyse sichergestellt werden (6). Dabei ist sorgfältig darauf zu achten, dass die Menge des übertragenen Lösungsmittels auf das absolut erforderliche Minimum begrenzt wird; außerdem muss gewährleistet sein, dass sich die vorhandene Prüfsubstanz im Endvolumen des im Test verwendeten Wassers auflösen kann. Für die Einbringung der Prüfsubstanz in die Prüfgefäße können auch andere Verfahren verwendet werden (siehe Quellen (7) und (8)). Wenn zur Einbringung der Prüfsubstanz ein organisches Lösungsmittel verwendet wird, sollten Lösungsmittelkontrollen mit dem im Test verwendeten Wasser (ohne weitere Zusätze) sowie das im Test verwendete Wasser unter Zugabe einer Referenzsubstanz in ähnlicher Weise wie die aktiven Prüfgefäße behandelt werden, zu denen die Prüfsubstanz in einem Trägerlösungsmittel hinzugegeben wurde. Mit den Lösungsmittelkontroollen sollen anhand des Abbaus der Referenzsubstanz mögliche Beeinträchtigungen der mikrobiologischen Population durch das Lösungsmittel untersucht werden.
1.8.8 Prüfbedingungen
1.8.8.1 Testtemperatur
Die Inkubation sollte (vorzugsweise) im Dunkeln oder bei diffuser Beleuchtung und kontrollierter Temperatur (± 2 °C) erfolgen; dies kann die in der betreffenden Außenumgebung gegebene Temperatur oder eine Standardtemperatur von 20-25 °C sein. Die in der Außenumgebung gegebene Temperatur kann entweder die tatsächliche Probentemperatur zum Zeitpunkt der Probenahme oder eine durchschnittliche Temperatur in der Außenumgebung der Entnahmestelle sein.
1.8.8.2 Vermischung
Durch Vermischung unter kontinuierlichem Schütteln oder Rühren muss sichergestellt werden, dass die Teilchen und Mikroorganismen suspendiert bleiben. Außerdem begünstigt die ständige Mischung den Sauerstoffeintrag aus dem Luftraum über der Flüssigkeit und somit die Aufrechterhaltung angemessener aerober Bedingungen. Dazu können die Kolben auf einen Schütteltisch (mit einer Frequenz von etwa 100 Umdrehungen pro Minute) gebracht oder mit einem Magnetrührer gerührt werden: Die Proben sind in einem kontinuierlichen Prozess zu schütteln. Das Schütteln oder Rühren muss möglichst vorsichtig erfolgen; trotzdem muss eine homogene Suspension aufrechterhalten werden.
1.8.8.3 Testdauer
Die Testdauer sollte im Allgemeinen höchstens 60 Tage betragen, wenn nicht das semikontinuierliche Verfahren unter regelmäßiger Erneuerung der Testsuspension eingesetzt wird (siehe Abschnitt 1.8.6 und Anhang 2). Die Testdauer des Batch-Tests kann jedoch auf maximal 90 Tage ausgedehnt werden, wenn binnen der ersten 60 Tage der Abbau der Prüfsubstanz begonnen hat. Der Abbau wird in geeigneten Zeitabständen aufgrund der 14C-Restaktivität oder der gebildeten 14CO2-Menge (siehe Abschnitt 1.8.9.4) und/oder durch chemische Analyse (Abschnitt 1.8.9.5) überwacht. Die Inkubationsdauer muss so lange sein, dass der Abbauprozess bewertet werden kann. Der Abbau sollte vorzugsweise in einem Umfang von über 50 % erfolgt sein; bei langsam abbauenden Substanzen muss der Umfang des Abbaus hinreichend sein (im Allgemeinen mehr als 20 %), um die Schätzung einer Konstante der kinetischen Abbaurate zu ermöglichen.
Der pH-Wert und die Sauerstoffkonzentration des Testsystems sind regelmäßig zu messen, wenn nicht aus ähnlichen Tests mit Wasser- und Sedimentproben, die aus derselben Stelle entnommen wurden, Erfahrungen vorliegen und diese Messungen daher nicht mehr erforderlich sind. Unter gewissen Bedingungen kann der Metabolismus von Primärsubstraten in stark erhöhten Konzentrationen im Wasser bzw. im Sediment dazu führen, dass so viel CO2 entwickelt und so viel Sauerstoff abgebaut wird, dass sich die Versuchsbedingungen während der Testdauer erheblich ändern.
1.8.9 Verfahren
1.8.9.1 Vorbereitung der Kolben für den pelagischen Test
Ein geeignetes Volumen des im Test zu verwendenden Wassers wird in die Testkolben gebracht; die Kolben sind bis zu etwa einem Drittel zu füllen. Eine Füllmenge von etwa 100 ml darf nicht unterschritten werden. Auch wenn mehrere Kolben verwendet werden (um ggf. auch den gesamten Inhalt eines Kolbens prüfen zu können), beträgt das Volumen des zu verwendenden Wassers etwa 100 ml, da sich zu geringe Probenvolumina auf die Dauer der "Lag"-Phase auswirken könnten. Die Prüfsubstanz wird aus einer Stammlösung hinzugegeben, wie in den Abschnitten 1.8.2 und 1.8.7 beschrieben. Die Prüfsubstanz sollte in mindestens zwei Konzentrationen verwendet werden, die sich mindestens um den Faktor 5 bis 10 unterscheiden; anhand dieser Konzentrationen sollte die Abbaukinetik bestimmt und die Konstante der kinetischen Abbaurate ermittelt werden. Die beiden ausgewählten Konzentrationen sollten unter 100 µg/l liegen und sich vorzugsweise im Bereich < 1-10 µg/l bewegen.
Die Kolben sind mit für Luft und für CO2 undurchlässigen Stopfen oder Deckeln zu verschließen. Bei nicht flüchtigen und nicht mit 14C markierten Prüfchemikalien können lose Wattepropfen zum Schutz vor Verunreinigungen aus der Luft verwendet werden (siehe Abschnitt 1.8.1), wenn alle wichtigeren Abbauprodukte bekanntermaßen nicht flüchtig sind und wenn die CO2 -Konzentration indirekt bestimmt wird (siehe Anhang 3).
Die Kolben werden bei der jeweils ausgewählten Temperatur inkubiert (siehe Abschnitt 1.8.8.1). Proben zur chemischen Analyse oder für 14C-Messungen sind am Anfang des Tests zu entnehmen (d. h. noch vor Beginn des biologischen Abbaus; siehe Abschnitt 1.7.1); anschließend folgen während der Testdauer weitere Probenahmen in geeigneten Zeitabständen. Die Probenahme kann entweder durch Entnahme von Teilproben (z.B. 5-ml-Aliquoten) aus den einzelnen Wiederholungen oder durch Entnahme jeweils des gesamten Inhalts eines Kolbens bei der Probenahme erfolgen. Die Mineralisation der Prüfsubstanz kann wahlweise direkt oder indirekt bestimmt werden (siehe Anhang 3). In der Regel werden während der Abbauphase (d. h. nach Ende der "Lag"-Phase) mindestens fünf Probenahmestellen benötigt, um die Konstante der Abbaurate zuverlässig bestimmen zu können, wenn nicht bei rasch abbaubaren Substanzen begründet werden kann, dass drei Probenahmestellen hinreichend sind. Bei Substanzen, die nicht schnell abgebaut werden, können leicht weitere Messungen während der Abbauphase vorgenommen werden; daher sollten mehr Datenpunkte zur Bestimmung von k verwendet werden. Ein bestimmter zeitlicher Rahmen für die Probenahme kann nicht vorgegeben werden, da sich der biologische Abbau von Fall zu Fall unterschiedlich vollzieht; bei langsamem Abbau wird allerdings empfohlen, wöchentlich eine Probe zu entnehmen. Wenn die Prüfsubstanz rasch abbaubar ist, sollten Proben während der ersten drei Tage einmal täglich und anschließend jeden zweiten oder dritten Tag entnommen werden. Unter gewissen Umständen (z.B. bei sehr rasch hydrolysierenden Substanzen) müssen Proben unter Umständen stündlich genommen werden. Eine Vorstudie vor Durchführung des eigentlichen Tests wird empfohlen, um die geeigneten Intervalle für die Probenahme zu bestimmen. Wenn Proben für weitere spezifische Analysen verfügbar sein müssen, sollten mehr Proben entnommen und dann am Ende des Versuchs in rückläufiger Reihenfolge (d. h. die letzten Proben zuerst) die zu analysierenden Proben ausgewählt werden. (Hinweise zur Stabilität der Proben während der Lagerung sind Abschnitt 1.8.9.5 Absatz 2 zu entnehmen.).
1.8.9.2 Anzahl der Kolben und Proben
Testkolben werden in folgendem Umfang benötigt:
- Testkolben; mindestens jeweils zwei Kolben für jede Konzentration der Prüfsubstanz (vorzugsweise mindestens 3) bzw. mehrere Testkolben pro Konzentration, wenn jeweils der gesamte Kolbeninhalt als Probe genommen werden soll (Kurzbezeichnung FT);
- Testkolben für die Berechnung der Massenbilanz; jeweils mindestens zwei Kolben pro Testkonzentration (Kurzbezeichnung FM);
- Testkolben für die unbehandelte Blindprobe (ohne Prüfsubstanz); mindestens ein Blindproben-Testkolben ausschließlich mit dem im Test verwendeten Wasser (Kurzbezeichnung FB);
- Testkolben für die Referenzkontrolle; zwei Kolben mit der Referenzsubstanz (z.B. Anilin oder Natriumbenzoat in einer Konzentration von 10 µg/l) (Kurzbezeichnung FC); mit der Referenzkontrolle soll sichergestellt werden, dass eine gewisse mikrobiologische Mindestaktivität gegeben ist. Wenn ohne Weiteres praktikabel, kann eine radioaktiv markierte Referenzsubstanz verwendet werden. Diese Möglichkeit kommt auch in Betracht, wenn der Abbau der Prüfsubstanz durch chemische Analysen überwacht werden soll);
- Testkolben für die sterile Kontrolllösung; ein oder zwei Kolben mit im Test verwendetem sterilisiertem Wasser zur Untersuchung eines möglichen abiotischen Abbaus oder sonstiger nicht biologischer Abtrennungen der Prüfsubstanz (Kurzbezeichnung FS); die biologische Aktivität kann durch Autoklavieren (121 °C; 20 min) des im Test verwendeten Wassers oder durch Zugabe eines Giftstoffs (z.B. Natriumazid (NaN3) in einer Konzentration von 10-20 g/l, Quecksilberchlorid (HgCl2) in einer Konzentration von 100 mg/l oder Formalin in einer Konzentration von 100 mg/l) oder durch Gammabestrahlung beendet werden. HgCl2 sollte als Sonderabfall entsorgt werden. Bei Wasser mit starker Segmentzugabe sind sterile Bedingungen schwer herzustellen; in diesem Fall wird mehrfaches Autoklavieren (z.B. dreimal) empfohlen. Dabei ist allerdings zu beachten, dass sich das Sorptionsverhalten durch Autoklavieren ändern kann.
- Testkolben für die Lösungsmittelkontrolllösungen mit dem im Test zu verwendenden Wasser und mit dem zu verwendenden Wasser in Verbindung mit der Referenzsubstanz; jeweils zwei Kolben, die mit der gleichen Lösungsmittelmenge behandelt und demselben Verfahren unterzogen wurden, wie die Kolben mit der Prüfsubstanz; mit diesen Lösungen sollen aufgrund des Abbaus der Referenzsubstanz mögliche Beeinträchtigungen durch das Lösungsmittel bestimmt werden.
Bei der Gestaltung des Prüfprotokolls sollte die relative Bedeutung häufigerer Wiederholungen bei einer höheren Anzahl an Probenahmen berücksichtigt werden. Die genaue Anzahl der erforderlichen Kolben hängt von der jeweiligen Methode zur Messung des Abbaus ab (siehe Abschnitt 1.8.9.1 Absatz 3 und Abschnitt 1.8.9.4 sowie Anhang 3).
Aus allen Testkolben sollten bei der Probenahme jeweils zwei Teilproben (z.B. 5-ml-Aliquoten) genommen werden. Wenn mehrere Kolben eingesetzt werden, um den gesamten Inhalt eines Kolbens als Probe verwenden zu können, sollten mindestens zwei Kolben pro Probenahme entnommen werden (siehe Abschnitt 1.8.9.1 Absatz 1).
1.8.9.3 Vorbereitung der Kolben für Tests mit suspendierten Sedimenten (fakultativ)
Die erforderliche Menge des im Test zu verwendenden Wassers und das ggf. erforderliche Sediment werden zum Prüfgefäß hinzugegeben (siehe Abschnitt 1.8.5). Die Vorbereitung der Kolben für Tests mit suspendierten Sedimenten unterscheidet sich nicht von der Vorbereitung für den pelagischen Test (siehe Abschnitte 1.8.9.1 und 1.8.9.2). Vorzugsweise sind Serumflaschen oder ähnlich geformte Kolben zu verwenden. Die geschlossenen Kolben werden horizontal auf eine Schüttelvorrichtung gesetzt. Offene Kolben zur Untersuchung von nicht mit 14C markierten und nicht flüchtigen Substanzen müssen selbstverständlich aufrecht eingesetzt werden. In diesem Fall werden ein Magnetrührer sowie der Einsatz von glasbeschichteten Magnetrührstäben empfohlen. Wenn erforderlich, sind die Flaschen zu belüften, um die erforderlichen aeroben Bedingungen herzustellen.
1.8.9.4 Radiochemische Bestimmungen
Die entstandene 14CO2-Menge wird indirekt und direkt gemessen (siehe Anhang 3). Indirekt wird der 14CO2-Anteil aufgrund der Differenz zwischen der anfänglichen 14C-Aktivität des im Test verwendeten Wassers bzw. der verwendeten Suspension und der gesamten Restaktivität zum Zeitpunkt der Probenahme bestimmt, nachdem die Probe auf einen pH-Wert von 2-3 angesäuert und das enthaltene CO2 abgetrennt wurde. Auf diese Weise wird anorganischer Kohlenstoff entfernt, und die Restaktivität ergibt sich aus dem gemessenen organischen Material. Die indirekte 14CO2 Bestimmung kommt nicht in Betracht, wenn während der Transformation der Prüfsubstanz wichtigere flüchtige Transformationsprodukte entstehen (siehe Anhang 3). Nach Möglichkeit sollte die 14CO2 Bildung direkt gemessen werden; die Messung sollte bei der Probenahme für mindestens einen Testkolben erfolgen. So können die Massenbilanz und der biologische Abbau überprüft werden; diese Vorgehensweise beschränkt sich allerdings auf Tests mit verschlossenen Kolben.
Wenn das entstandene 14CO2 während des Tests direkt emessen wird, sollten bei Beginn des Tests mehrere Kolben für diesen Zweck vorgesehen werden. Die direkte 14CO2-Bestimmung wird empfohlen, wenn während der Transformation der Prüfsubstanz wichtigere flüchtige Transformationsprodukte entstehen. Bei jeder Messung werden die zusätzlichen Testkolben auf einen pH-Wert von 2-3 angesäuert, und das 14CO2 wird in einem internen oder externen Absorber gebunden (siehe Anhang 3).
Fakultativ können auch die Konzentrationen von mit 14C markierten Prüfsubstanzen sowie von wichtigeren Transformationsprodukten durch Radiochromatographie (z.B. Dünnschichtchromatographie, RAD-TLC) oder HPLC unter radiochemischem Nachweis bestimmt werden.
Die Phasenverteilung der verbliebenen Radioaktivität (siehe Anhang 1) und die verbliebene Prüfsubstanz sowie die noch vorhandenen Transformationsprodukte können ebenfalls bestimmt werden.
Am Ende des Tests sollte die Massenbilanz durch direkte 14CO2-Messung mit eigenen Testkolben bestimmt werden, aus denen während des Tests die benötigten Proben entnommen werden.
1.8.9.5 Spezifische chemische Analyse
Wenn eine empfindliche spezifische Analysemethode verfügbar ist, kann der primäre biologische Abbau statt durch radioaktive Markierung auch aufgrund einer Messung der gesamten Restkonzentration der Prüfsubstanz ermittelt werden. Wird eine radioaktiv markierte Prüfsubstanz eingesetzt (um die Gesamtmineralisation zu messen), können spezifische chemische Analysen parallel durchgeführt werden, um weitere hilfreiche Informationen zu erhalten und das Verfahren bewerten zu können. Ferner können spezifische chemische Analysen zur Messung der beim Abbau der Prüfsubstanz gebildeten Transformationsprodukte eingesetzt werden; dies wird für Substanzen empfohlen, bei denen die Mineralisation mit Halbwertszeiten von über 60 Tagen erfolgt ist. Die Konzentration der Prüfsubstanz und die Transformationsprodukte sollten jeweils bei der Probenahme gemessen und protokolliert werden (als Konzentration und als Prozentanteil). Im Allgemeinen sollten die Transformationsprodukte bestimmt werden, die bei > 10 % der verwendeten Konzentration jeweils bei der Probenahme nachgewiesen werden; ansonsten ist in angemessener Weise zu begründen, warum die Transformationsprodukte nicht bestimmt wurden. Transformationsprodukte, deren Konzentration während der Studie kontinuierlich ansteigt, sollten ebenfalls bestimmt werden, selbst wenn die jeweiligen Konzentrationen den genannten Höchstwert nicht überschreiten, da aus diesen Transformationsprodukten auf eine Persistenz geschlossen werden könnte. Analysen der Transformationsprodukte in sterilen Kontrolllösungen sollten in Erwägung gezogen werden, wenn eine rasche abiotische Transformation der Prüfsubstanz (z.B. durch Hydrolyse) für möglich gehalten wird. Die Notwendigkeit einer Quantifizierung und Bestimmung von Transformationsprodukten sollte im Einzelfall geprüft werden; die entsprechenden Begründungen sind zu protokollieren. Extraktionen unter Verwendung organischer Lösungsmittel sollten gemäß den Anweisungen zum betreffenden Analyseverfahren durchgeführt werden.
Alle Proben sollten bei 2 bis 4 °C luftdicht gelagert werden, wenn die Analyse binnen 24 Stunden (vorzugsweise) durchgeführt wird. Für eine längere Lagerung sollten die Proben auf Temperaturen unter -18 °C gefroren oder chemisch konserviert werden. Eine Ansäuerung zur Konservierung der Proben wird nicht empfohlen, da angesäuerte Proben unter Umständen instabil sind. Wenn die Proben nicht binnen 24 Stunden analysiert und länger gelagert werden, sollte eine Untersuchung zur Stabilität unter Lagerungsbedingungen durchgeführt werden, um die Stabilität der maßgeblichen Chemikalien bei einer Temperatur von -18 °C oder bei sonstiger Konservierung der Chemikalien nachzuweisen. Erfolgt die Analyse unter Extraktion mit einem Lösungsmittel oder durch Festphasenextraktion (SPE), sollte die Extraktion unmittelbar nach der Probenahme oder nach maximal 24-stündiger Lagerung der gekühlten Probe vorgenommen werden:
Je nach Empfindlichkeit der Analysemethode können größere Probenvolumina erforderlich sein als in Abschnitt 1.8.1 genannt. Der Test kann auf bequeme Weise mit Testvolumina von einem Liter in Kolben mit einem Volumen von 2-3 Litern durchgeführt werden, aus denen dann Proben mit einem Volumen von etwa 100 ml entnommen werden.
2. Daten und Abschlussbericht
2.1 Behandlung der Ergebnisse
2.1.1 Grafische Darstellung der Daten
Die Zeitpunkte der Probenahme sind jeweils auf volle Stunden zu runden (sofern die betreffenden Substanzen nicht binnen Minuten oder weniger Stunden abgebaut werden); eine Rundung auf Tage ist nicht zulässig. Die geschätzte Restaktivität der Prüfsubstanzen (mit`C markierte Substanzen) bzw. die Restkonzentration (nicht markierte Substanzen) ist bezogen auf den zeitlichen Verlauf sowohl linear als auch semilogarithmisch darzustellen (siehe Abbildungen 1a und 1b). Wenn ein Abbau erfolgt ist, sind die Ergebnisse der Kolben FT mit den Ergebnissen der Kolben Fs zu vergleichen. Wenn die Mittelwerte der Ergebnisse der Kolben mit der Prüfsubstanz (FT) und der sterilen Kolben (Fs) um weniger als 10 % voneinander abweichen, kann davon ausgegangen werden, dass der festgestellte Abbau vorwiegend abiotisch erfolgt. Wird in den Kolben Fs ein geringerer Abbau beobachtet, können die Zahlen verwendet werden, um die bei den Kolben FT ermittelten Werte zu korrigieren (durch Subtraktion) und entsprechend den Umfang des biologischen Abbaus zu schätzen. Wenn fakultative Analysen der wichtigeren Transformationsprodukte vorgenommen werden, sollten ergänzend zur grafischen Darstellung des Abbaus der Prüfsubstanz auch die Entstehung und der Abbau dieser Transformationsprodukte grafisch dargestellt werden.
Die Dauer der "Lag"-Phase tL wird aufgrund der Abbaukurve (semilogarithmische Darstellung) durch Extrapolierung des linearen Abschnitts bis zum Abbau null oder alternativ durch Bestimmung der Zeit bis zu einem Abbau von etwa 10 % geschätzt (siehe Abbildungen la und lb). Aus der semilogarithmischen Darstellung sind die Konstante der Rate erster Ordnung (k) sowie die betreffende Standardabweichung durch lineare Regression der In (14C-Restaktivität oder Prüfsubstanzkonzentration) bezogen auf den zeitlichen Verlauf zu schätzen. Insbesondere bei 14C-Messungen sind ausschließlich Daten aus dem anfänglichen linearen Bereich der Kurve im Anschluss an die beendete "Lag"-Phase zu verwenden; dabei sollten vorzugsweise eher einige wenige repräsentative Daten als umfangreichere, aber unsicherere Daten ausgewählt werden. Unsicherheitsfaktoren sind unter anderem auch die der empfohlenen direkten Messung der 14C-Restaktivität inhärenten Fehler (siehe folgende Erläuterungen). Unter Umständen kann die Berechnung von zwei unterschiedlichen Konstanten für die Abbaurate erforderlich sein, wenn der Abbau in zwei Phasen erfolgt. In diesem Fall werden zwei getrennte Phasen der Abbaukurve definiert. Für die Kolben mit den einzelnen Wiederholungen sollten die Konstante der Abbaurate (k) und die Halbwertszeit (t, = ln2jk) berechnet werden, wenn aus einem Kolben mehrere Teilproben entnommen werden; alternativ können die Durchschnittswerte verwendet werden, wenn jeweils der vollständige Inhalt eines Kolbens als Probe entnommen wird (siehe Abschnitt 1.8.9.2 letzter Absatz). Beim erstgenannten Verfahren sollten die Konstante der Abbaurate und die Halbwertszeit für alle Kolben mit den einzelnen Wiederholungen sowie ein Durchschnittswert mit einer Standardabweichung protokolliert werden. Bei hohen Prüfsubstanzkonzentrationen kann die Abbaukurve beträchtlich von einer Gerade abweichen (semilogarithmische Darstellung), und die Kinetik erster Ordnung ist unter Umständen nicht gültig. Die Definition einer Halbwertszeit wäre daher nicht sinnvoll. Für einen begrenzten Datenbereich kann jedoch die Pseudo-Kinetik erster Ordnung angenommen und die Halbwertszeit des Abbaus DT50 (Dauer bis zu einem Abbau von 50 %) geschätzt werden. Dabei ist jedoch zu berücksichtigen, dass der zeitliche Verlauf des Abbaus über den ausgewählten Datenbereich hinaus nicht mit DT50 prognostiziert werden kann, da dieser Parameter ausschließlich einen vorgegebenen Datensatz beschreibt. Analyse-Tools zur einfacheren statistischen Berechnung und zur Kurvenanpassung sind allgemein zugänglich; der Einsatz dieser Software wird empfohlen.
Wenn spezifische chemische Analysen durchgeführt werden, sind die Konstanten der Abbaurate und die Halbwertszeiten des primären Abbaus wie oben beschrieben für die Gesamtmineralisation zu schätzen. Gelegentlich können Datenpunkte aus der gesamten Abbauphase verwendet werden, wenn der Prozess durch den primären Abbau eingeschränkt wird. (Im Gegensatz zu Messungen der 14C-Aktivität werden diese Messungen direkt durchgeführt.)
Wenn mit 14C markierte Substanzen verwendet werden, sollte eine Massenbilanz ausgedrückt als Prozentanteil der eingesetzten Ausgangskonzentration zumindest am Ende des Tests protokolliert werden.
2.1.2 Restaktivität
Beim biologischen Abbau des mit 14C markierten Anteils einer organischen Substanz wird das 14C größtenteils in 14CO2 umgewandelt; ein weiterer Anteil des 14C wird beim Wachstum der Biomasse und/oder bei der Synthese extrazellulärer Metaboliten verbraucht. Entsprechend wird der Kohlenstoff auch bei biologischem "Endabbau" einer Substanz nicht zu 100 % in 14CO2 umgewandelt. Das in den durch Biosynthese gebildeten Produkten enthaltene 14C wird anschließend infolge "sekundärer Mineralisation" langsam als 14CO2 freigesetzt. Aus diesen Gründen weisen grafische Darstellungen der organischen 14C-Restaktivität (gemessen nach der Abtrennung des CO2) oder des erzeugten 14CO2 bezogen auf den zeitlichen Verlauf auch nach Abschluss des Abbaus noch "Tailings" auf. Dies erschwert die Auswertung der Daten unter kinetischen Gesichtspunkten; daher sollte im Allgemeinen nur der erste Abschnitt der Kurve (nach dem Ende der "Lag"-Phase und vor Erreichen eines Abbaus von etwa 50 %) für die Schätzung der Abbaurate-Konstante berücksichtigt werden. Beim Abbau der Prüfsubstanz ist die gesamte 14C-Restaktivität immer höher als die 14C-Aktivität in Verbindung mit der verbliebenen noch unveränderten Prüfsubstanz. Wird die Prüfsubstanz durch eine Reaktion erster Ordnung abgebaut und erfolgt eine Mineralisation einer konstanten Fraktion a in CO2, beträgt die anfängliche Steigung der 14C-Abbaukurve (Gesamtanteil an organischem 14C bezogen auf den zeitlichen Verlauft das afache der Steigung der entsprechenden Kurve der Prüfsubstanzkonzentration (bzw. genauer gesagt des mit 14C markierten Anteils der Prüfsubstanz). Die Konstante der Abbaurate wird ausgehend von unkorrigierten Messungen der 14C-Gesamtaktivität daher eher mit einem Sicherheitszuschlag berechnet. Verfahren zum Schätzen der Prüfsubstanzkonzentrationen aus der gemessenen radiochemischen Aktivität aufgrund verschiedener vereinfachender Annahmen wurden in der Literatur beschrieben (2)(9)(10)(11). Diese Verfahren sind bei rasch abbaubaren Substanzen am leichtesten anzuwenden.
2.2 Auswertung der Ergebnisse
Wenn festgestellt wird, dass k unabhängig von der hinzugegebenen Konzentration ist (d. h. wenn die berechnete Konstante k bei unterschiedlichen Konzentrationen der Prüfsubstanz etwa gleich ist), kann angenommen werden, dass die Konstante des Abbaus erster Ordnung repräsentativ für die betreffenden Testbedingungen sowie für die Wasserprobe und die Testtemperatur ist. In welchem Umfang die Ergebnisse verallgemeinert oder auf andere Systeme extrapoliert werden können, ist von Fachleuten zu beurteilen. Wenn eine hohe Prüfsubstanzkonzentration eingesetzt wird und der Abbau daher nicht nach der Kinetik erster Ordnung verläuft, können die Daten nicht zur direkten Schätzung einer Rate für den Abbau erster Ordnung oder einer entsprechenden Halbwertszeit verwendet werden. Aus einem Test mit einer hohen Prüfsubstanzkonzentration abgeleitete Daten können jedoch trotzdem für eine Schätzung des Umfangs der Gesamtmineralisation und/oder für den Nachweis und die Quantifizierung von Transformationsprodukten geeignet sein.
Wenn statt des biologischen Abbaus die Raten sonstiger Verlustprozesse bekannt sind (z.B. Hydrolyse- oder Verflüchtigungsdaten), können diese Daten von der im Test festgestellten Nettoverlustrate abgezogen werden, um die Rate des biologischen Abbaus zu schätzen. Hydrolysedaten können z.B. aus sterilen Kontrollen oder aus Paralleltests mit höheren Prüfsubstanzkonzentrationen ermittelt werden.
Die indirekte und die direkte Bestimmung von 14CO2 (Abschnitt 1.8.9.4 und Anhang 3) kommt ausschließlich für die Messung des Umfangs der Mineralisation der Prüfsubstanz in CO2 in Betracht. Die Analyse der Konzentrationen von mit 14C markierten Prüfsubstanzen und der Bildung wichtigerer Transformationsprodukte kann durch Radiochromatographie (RAD-TLC) oder HPLC erfolgen (Abschnitt 1.8.9.4 Absatz 3). Voraussetzung für eine direkte Schätzung der Halbwertszeit ist, dass keine wichtigeren Transformationsprodukte (definiert als >_ 10 % der eingesetzten Menge der Prüfsubstanz) enthalten sind. Wenn wichtigere Transformationsprodukte in einem größeren Umfang als im vorstehenden Satz genannt vorkommen, ist eine detaillierte Auswertung der Daten vorzunehmen. Die detaillierte Auswertung kann Testwiederholungen und/oder Bestimmungen der Transformationsprodukte beinhalten (siehe Abschnitt 1.8.9.5 Absatz 1), wenn das Verhalten der Transformationsprodukte nicht aufgrund von Erfahrungswerten (z.B. Informationen zu den Abbauwegen) mit angemessener Zuverlässigkeit beurteilt werden kann. Da das Verhältnis des in der Prüfsubstanz enthaltenen und in CO2 umgewandelten Kohlenstoffs nicht immer gleich ist (weitgehend von der Konzentration der Prüfsubstanz und sonstiger vorhandener Substrate sowie von den Testbedingungen und den jeweiligen Mikroorganismen abhängig), lässt dieser Test (im Gegensatz zu einem DOC-Die-Away-Test) eine direkte Schätzung des biologischen Endabbaus nicht zu; das Ergebnis ist jedoch ähnlich dem Ergebnis einer Respirometer-Untersuchung. Der Umfang der Mineralisation wird entsprechend kleiner oder gleich dem Mindestumfang des biologischen Endabbaus sein. Um ein umfassenderes Bild vom biologischen Endabbau (Mineralisation und Aufnahme in die vorhandene Biomasse) zu erhalten, sollte am Ende des Tests die Phasenverteilung des 14C analysiert werden (siehe Anhani 1). Das in den vorhandenen Feststoffen enthaltene 14C beinhaltet das in die Bakterienmasse aufgenommene 4C sowie das in organische Partikel sorbierte 14C.
2.3 Validität des Tests
Wenn die Referenzsubstanz binnen des erwarteten Zeitraums nicht abgebaut wird (bei Anilin und Natriumbenzoat gewöhnlich unter zwei Wochen), ist die Validität des Tests zu bezweifeln und weiter zu überprüfen; alternativ kann der Test auch mit einer frischen Wasserprobe wiederholt werden. Bei einem ISO-Ringtest der Methode, an dem sieben europäische Labors beteiligt waren, lagen die angepassten Abbaurate-Konstanten zwischen 0,3 und 1,7 d-1 bei durchschnittlich 0,8 d-1, einer Temperatur von 20 °C und einer Standardabweichung von ± 0,4 d-1 (t1/2 = 0,9 Tage). Typisch waren "Lag`-Phasen von 1 bis 7 Tagen. Für das untersuchte Wasser wurde eine bakterielle Biomasse von 103 - 104 KBE (koloniebildenden Einheiten) pro ml protokolliert. Die Abbauraten in nährstoffreichen mitteleuropäischen Gewässern waren höher als in nordischen oligotrophen Gewässern; dies könnte auf die unterschiedlichen Trophiezustände oder auf eine vorherige Belastung mit chemischen Stoffen zurückzuführen sein.
Die Gesamtwiederfindung (Massenbilanz) am Ende des Versuchs sollte zwischen 90 % und 110 % bei radioaktiv markierten Substanzen liegen; bei nicht radioaktiv markierten Substanzen sollte die anfängliche Rückgewinnung am Anfang des Versuchs zwischen 70 % und 110 % betragen. Die angegebenen Bereiche sind als Idealbereiche zu verstehen und sollten nicht als Kriterien für die Annehmbarkeit eines Tests betrachtet werden.
3. Prüfbericht
Der Typ der Studie (z.B. pelagischer Test oder Test mit suspendiertem Sediment) ist im Prüfbericht klar anzugeben; außerdem enthält der Bericht mindestens folgende Informationen:
Prüfsubstanz und Referenzsubstanz(en):
- Common Names (allgemeine Bezeichnungen und Handelsnamen), systematische chemische Namen (möglichst IUPAC- und/oder CAS-Bezeichnungen), CAS-Nummern, Strukturformeln (bei Einsatz radioaktiv markierter Substanzen zur Beschreibung der Position des 14C) sowie maßgebliche physikalisch-chemische Merkmale der Prüfsubstanz und der Referenzsubstanz (siehe Abschnitte 1.5 und 1.6),
- systematische chemische Namen, CAS-Nummern, Strukturformeln (bei Verwendung radioaktiv markierter Substanzen zur Beschreibung der Position des 14C) sowie maßgebliche physikalisch-chemische Merkmale der Prüfsubstanz und der Referenzsubstanz, die als Standards für den Nachweis und die Quantifizierung von Transformationsprodukten angenommen werden,
- Reinheit (Verunreinigungen) der Prüfsubstanzen und der Referenzsubstanzen,
- radiochemische Reinheit markierter Chemikalien und (ggf.) spezifische Aktivität.
Oberflächenwasser:
Für Wasserproben sind mindestens die folgenden Informationen anzugeben:
- Standort und Beschreibung der Entnahmestelle möglichst einschließlich Informationen über frühere Verunreinigungen,
- Datum und Zeitpunkt der Probenahme,
- Nährstoffe (N gesamt; Ammonium, Nitrit, Nitrat, P gesamt; gelöstes Orthophosphat),
- Tiefe der Probenahme,
- Aussehen der Probe (z.B. Farbe und Trübung),
- DOC und TOC,
- BOD,
- Temperatur und pH-Wert an der Entnahmestelle zum Zeitpunkt der Probenahme,
- Sauerstoff- oder Redoxpotenzial (erforderlich nur dann, wenn die aerobe Qualität nicht offensichtlich ist),
- Salzgehalt oder Leitfähigkeit (bei Meer- und Brackwasser),
- suspendierte Feststoffe (bei trüben Proben),
- nach Möglichkeit sonstige maßgebliche Informationen über die Entnahmestelle zum Zeitpunkt der Probenahme (z.B. aktuelle oder frühere Daten zur Fließgeschwindigkeit von Flüssen oder Meeresströmungen, in der Nähe befindliche Abwassereinleitungen und Typ der Abwässer, Witterungsbedingungen vor dem Zeitpunkt der Probenahme),
fakultativ:
- mikrobiologische Biomasse (z.B. AODC (Acridine Orange Direct Count oder KBE (koloniebildende Einheiten)),
- anorganischer Kohlenstoff,
- Chlorophyll-a-Konzentration als spezifisches Maß für die Algenbiomasse.
Bei Tests mit suspendierten Sedimenten sollten außerdem die folgenden Informationen zu den Sedimenten angegeben werden:
- Tiefe der Sedimententnahm,
- Aussehen des Sediments (farbig, schlammig, schluffig oder sandig),
- Textur (z.B. % grober Sand, feiner Sand, Schluff und Ton),
- Trockengewicht in g/l der suspendierten Feststoffe, TOC-Konzentration oder Gewichtsverlust nach Entzündung als Maß für den Anteil an organischem Material,
- pH-Wert,
- Sauerstoff- oder Redoxpotenial (erforderlich nur dann, wenn die aerobe Qualität nicht offensichtlich ist).
Testbedingungen:
- Zeitabstand zwischen Probenahme und Verwendung im Labortest; Dauer der Probenlagerung und Vorbereitung der Proben; Zeitpunkte der Durchführung der Tests,
- Menge der verwendeten Prüfsubstanz, Testkonzentration und Referenzsubstanz,
- Methode zur Einbringung der Prüfsubstanz einschließlich ggf. verwendeter Lösungsmittel,
- Volumen des verwendeten Oberflächenwassers und (wenn verwendet) der Sedimente sowie jeweils zur Analyse entnommenes Probenvolumen,
- Beschreibung des eingesetzten Testsystems,
wenn der Test nicht im Dunkeln durchgeführt werden muss, Informationen zur Qualität des "diffusen Lichts";
- Informationen zu den Methoden zur Herstellung steriler Kontrollen (z.B. Temperatur, Dauer und Anzahl der Autoklavierungen),
- Inkubationstemperatur,
- Informationen zu Analyseverfahren und Methoden für radiochemische Messungen sowie zur Prüfung der Massenbilanz und für Messungen der Phasenverteilung (wenn durchgeführt),
- Anzahl der Wiederholungen.
Ergebnisse:
- Wiederfindung in Prozent (siehe Abschnitt 1.7.1),
- Wiederholbarkeit und Empfindlichkeit der Analysemethoden einschließlich der Nachweisgrenze (LOD) und der Quantifizierungsgrenze (LOQ) (siehe Abschnitt 1.7.2),
- Darstellung aller gemessenen Daten (einschließlich der Zeitpunkte der Probenahmen) sowie der berechneten Werte in Tabellen und entsprechenden Abbaukurven; für jede Testkonzentration und für jeden Kolben mit einer Wiederholungslösung sind für die logarithmische Darstellung der lineare Korrelationskoeffizient der Steigung sowie die geschätzte "Lag"-Phase und eine Konstante für die Pseudo-Rate erster Ordnung (wenn möglich) und die entsprechende Abbauzeit (bzw. die Halbwertszeit tso) anzugeben,
- die entsprechenden Werte sind als Durchschnittswerte der in den einzelnen Wiederholungen festgestellten Ergebnisse zu protokollieren (z.B. Dauer der "Lag"-Phase, Konstante der Abbaurate und Abbauzeit (bzw. tso),
- das System ist aufgrund der Beschaffenheit der Abbaukurve sowie unter Berücksichtigung der möglichen Auswirkungen der Testkonzentration als angepasst oder als nicht angepasst zu bewerten,
- Ergebnisse der Endmassenbilanz und Ergebnisse der Messungen zur Bestimmung der Phasenverteilungen (wenn vorhanden);
- Anteil des mineralisierten 14C sowie - bei spezifischen Analysen - Endumfang des primären Abbaus,
- (ggf.) Nachweis, Molkonzentration und Prozentanteil zugegebener wichtigerer Transformationsprodukte (siehe Abschnitt 1.8.9.5 Absatz 1),
- (ggf.) angenommener Transformationsweg,
- Diskussion der Ergebnisse.
4. Literatur
1. OECD TG 309 (2004) Aerobic Mineralisation in surface water - Simulation Biodegradation Test.
2. ISO/DIS 14592-1 (1999) Water quality - Evaluation of the aerobic biodegradability of organic compounds at low concentrations - Part 1: Shake flask batch test with surface water or surface waterisediment suspensions.
3. Prüfmethode C.23. Aerobic and anaerobic transformation in soil.
4. Prüfmethode C.24. Aerobic and anaerobic transformation in aquatic sediments.
5. OECD (1993). Leitlinien für die Prüfung von Chemikalien OECD, Paris.
6. ISO 8245 (1999). Water quality - Guidelines an the determination of total organic carbon (TOC) and dissolved organic carbon (DOC).
7. ISO 10634 (1995). Water quality - Guidance for the preparation and treatment of poorly watersoluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
8. OECD-Entwurf (2000). Guidance Document an aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series an Testing and Assessment. No 22.
9. Simkins, S. und Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol. 47, S. 394-401.
10. Ingerslev, F. und N. Nyholm. (2000). Shakeflask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, S. 274-283.
11. ISO/CD 14592-1 (1999). Ring test report: Water Quality - Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1-report of 19981999 ringtest. Shake flask batch test with surface water or surface waterisediment suspensions.
| Phasenverteilung 14C | Anhang 1 |
Um das Verfahren zu überprüfen, sollten die Routinemessungen der 14C-Gesamtaktivität von organischem Kohlenstoff (TOA) um Massenbilanzmessungen unter direkter Bestimmung des entwickelten 14CO2 nach Bindung in einem Absorber ergänzt werden (siehe Anhang 3). Eine positive 14CO2 Bildung ist an sich schon als direkter Nachweis für einen biologischen Abbau zu betrachten (im Gegensatz zum abiotischen Abbau oder zu sonstigen Verlustprozessen wie z.B. Verflüchtigung oder Sorption). Weitere hilfreiche Informationen zur Beschreibung des biologischen Abbauverhaltens sind aus Messungen der TOA-Verteilung zwischen dem gelösten Stadium (14C-Aktivität von gelöstem organischem Kohlenstoff, DOA) und dem Partikelstadium (14C-Aktivität von als Feststoff vorliegendem organischem Kohlenstoff, POA) nach Abtrennung der Feststoffe durch Membranfiltration oder Zentrifugierung zu entnehmen. Die POA besteht aus der in der mikrobiologischen Biomasse und auf sonstigen Feststoffen sorbierten Prüfsubstanz sowie dem in der Prüfsubstanz enthaltenen Kohlenstoff, der zur Synthese neuen Zellmaterials verwendet und dadurch in die Feststoff-Biomasse aufgenommen wurde. Die Bildung gelösten organischen 14C-Materials kann als DOA am Ende des biologischen Abbaus (Plateau der Abbau-/Zeit-Kurve) geschätzt werden.
Die Phasenverteilung des 14C-Restanteils, der auf den ausgewählten Proben nach Filtration auf einem Membranfilter (etwa aus Polycarbonat) mit einer Porengröße von 0,22 µm oder 0,45 µm verblieben ist, wird geschätzt. Wenn die Sorption der Prüfsubstanz auf dem Filter nicht vernachlässigbar gering ist (vor der Durchführung des Versuchs festzustellen), kann anstelle der Filtration eine Zentrifugierung mit hoher Geschwindigkeit (2.000 g; 10 min) erfolgen.
Anschließend ist das Filtrat bm das Zentrifugat wie in Anhang 3 für ungefilterte Proben beschrieben zu behandeln. Membranfilter sind in einer geeigneten Szintillationsflüssigkeit zu lösen; die Zählung erfolgt dann in der üblichen Weise; im Allgemeinen werden Korrekturen der jeweiligen Querempfindlichkeit unter Anwendung eines externen Standardverhältnisverfahrens vorgenommen; alternativ kann auch ein Oxydationsmittel verwendet werden. Wenn eine Zentrifugierung erforderlich ist, muss das aus der Partikelfraktion gebildete Pellet in 1-2 ml destilliertem Wasser aufgelöst und in ein Szintillationsfläschchen gegeben werden. Anschließend werden zwei Spülungen mit 1 ml destilliertem Wasser vorgenommen und das Spülwasser in das Fläschchen gebracht. Wenn erforderlich, kann die Suspension zur Flüssigkeitsszintillationszählung in ein Gel eingebettet werden.
| Semikontinuierliches Verfahren | Anhang 2 |
Eine Inkubation über maximal mehrere Monate kann erforderlich sein, um einen hinreichenden Abbau von persistenten Substanzen zu erzielen. Die Testdauer sollte im Allgemeinen höchstens 60 Tage betragen, wenn die Merkmale der ursprünglichen Wasserprobe nicht auch nach einer Erneuerung der Testsuspension unverändert erhalten bleiben. Hat allerdings binnen der ersten 60 Tage der Abbau der Prüfsubstanz noch immer nicht begonnen, kann die Testdauer auf maximal 90 Tage ohne Erneuerung der Testsuspension ausgedehnt werden.
Während der Inkubation über längere Zeiträume kann die Diversität des mikrobiologischen Materials durch verschiedene Verlustprozesse sowie durch den möglichen Verbrauch wesentlicher Nährstoffe und primärer Kohlenstoffsubstrate aus der Wasserprobe reduziert werden. Daher wird empfohlen, mit einem semikontinuierlichen Test in angemessener Weise die Abbaurate langsam abbauender Substanzen zu bestimmen. Der Test sollte mit dem semikontinuierlichen Verfahren begonnen werden, wenn erfahrungsgemäß eine Inkubationsdauer von drei Monaten erforderlich ist, um die Substanz zu 20 % abzubauen. Alternativ kann der normale Batch-Test in einen seminkontinuierlichen Test abgewandelt werden, wenn während der Prüfung im Batch-Test binnen etwa 60 Tagen kein Abbau der Prüfsubstanz erfolgt ist. Das semikontinuierliche Verfahren kann ausgesetzt und der Test als Batch-Test fortgesetzt werden, wenn ein erheblicher Abbau verzeichnet wurde (z.B. > 20 %).
Beim semikontinuierlichen Test wird alle zwei Wochen etwa ein Drittel des Volumens der Testsuspension durch frisch entnommenes Wasser ersetzt, zu dem die Prüfsubstanz in der Ausgangskonzentration hinzugegeben wurde: Sedimentmaterial wird ebenso in der Ausgangskonzentration (zwischen 0,01 und 1 g/l) zum zur Erneuerung zu verwendenden Wasser hinzugegeben, wenn der fakultative Test mit dem suspendierten Sediment durchgeführt wird. Bei der Durchführung des Tests mit den suspendierten Sedimentpartikeln muss gewährleistet sein, dass auch während der Erneuerung des Wassers ein System mit vollständiger Suspension besteht und dass die Verweildauer für Feststoffe und Wasser gleich ist; ansonsten kann die erwünschte Ähnlichkeit mit einem homogenen wässerigen System ohne feste Phasen beeinträchtigt werden kann. Aus diesen Gründen wird für das semikontinuierliche Verfahren eine Ausgangskonzentration der suspendierten Sedimente im unteren Segment des vorgegebenen Konzentrationsbereichs bevorzugt.
Die vorgesehene Zugabe der Prüfsubstanz setzt voraus, dass die Ausgangskonzentration der Prüfsubstanz nicht durch eine teilweise Erneuerung der Testsuspension überschritten und entsprechend - wie häufig bei hohen Prüfsubstanzkonzentrationen festzustellen - eine Anpassung vermieden wird. Da das Verfahren sowohl eine Neubeimpfung als auch einen Ausgleich für abgebaute Nährstoffe und Primärsubstrate beinhaltet, wird die ursprüngliche mikrobiologische Diversität wiederhergestellt, und die Testdauer kann theoretisch unendlich ausgedehnt werden. Beim semikontinuierlichen Verfahren ist darauf zu achten, dass die Restkonzentration der Prüfsubstanz unter Berücksichtigung der jeweiligen Mengen der hinzugegebenen und der entnommenen Prüfsubstanz korrigiert wird. Die Gesamtkonzentration und die Konzentration der gelösten Prüfsubstanz sind für Verbindungen mit schwachem Sorptionsverhalten beliebig austauschbar. Die Sorption ist unter den vorgegebenen Bedingungen (0,1-1 g Feststoffel) bei Substanzen mit log Kow < 3 (für neutrale, lipophile Verbindungen) unerheblich (< 5 %). Dies wird aus dem folgenden Berechnungsbeispiel deutlich: 0,1 g/l Feststoffe entsprechen etwa 10 mg Kohlenstoff pro Liter (Kohlenstofffraktion, fc = 0,01). Wenn angenommen wird, dass
Log Kow(der Prüfsubstanz) = 3,
Koc = 0,42 x Kow und
der Verteilungskoeffizient Kd = fc x Koc ist,
beträgt die gelöste Fraktion der Gesamtkonzentration (C-Wasser (Cw)/C-Gesamt (Ct):
Cw/Ct = 1/(1 + Kd x SS) = 1(1 + Koc x fc x SS) = 1/(1 + 0,42 x 103 x 0,01 x 0,1 x 10-3) = 0,999
| Bestimmung des 14CO2-Anteils | Anhang 3 |
Indirekte 14CO2-Bestimmung
Bei Routinemessungen ist die indirekte Methode im Allgemeinen am wenigsten zeitaufwändig und am präzisesten, wenn die Prüfsubstanz nicht flüchtig ist und wenn aus der Prüfsubstanz keine flüchtigen Transformationsprodukte gebildet werden. Dazu sind einfach ungefilterte Proben (z.B. 5 ml in Szintillationsfläschchen) zu geben. Für die Tests geeignet ist eine anfängliche Probenaktivität von 5000 dpm-10.000 dpm (80-170 Bq) die änfängliche Aktivität sollte mindestens etwa 1000 dpm betragen. Das CO2 sollte nach dem Ansäuern auf einen pH-Wert von 2-3 mit 1-2 Tropfen konzentriertem H3 PO4 oder HCl erfolgen. Die CO2-Abtrennung kann durch Sprudeln mit Luft über etwa 1/2-1 Stunde erfolgen. Alternativ können die Fläschchen auch 1-2 Stunden heftig geschüttelt werden (z.B. auf einem Mikroplatten-Schüttler) oder vorsichtiger über Nacht geschüttelt werden. Die Wirksamkeit der CO2-Abtrennung ist zu überprüfen (durch Verlängerung der Belüftung oder der Dauer des Schüttelns). Anschließend sollte eine zur Zählung wässeriger Proben geeignete geeignete Szintillationsflüssigkeit hinzugegeben, die Probe in einem Wirbelmischer homogenisiert und die Radioaktivität mit einem Flüssigkeitsszintillationszähler bestimmt werden; dabei ist die in den Blindproben festgestellte Hintergrundaktivität (FB abzuziehen. Wenn das im Test verwendete Wasser stark gefärbt ist oder hohe Feststoffkonzentrationen enthält, weisen die Proben im Allgemeinen eine einheitliche Querempfindlichkeit auf, in diesem Fall sind Querempfindlichkeitskorrekturen mit einem externen Standard hinreichend. Ist das im Test verwendete Wasser stark gefärbt, müssen die Querempfindlichkeitskorrekturen unter Umständen durch Zugabe eines internen Standards vorgenommen werden. Bei hoher Feststoffkonzentration kann unter Umständen keine homogene Lösung bzw. kein homogenes Gel hergestellt werden, oder die Proben, weisen sehr unterschiedliche Querempfindlichkeiten auf. In diesem Fall kann die im Folgenden beschriebene Methode zum Zählen von Testschlämmen verwendet werden. Wenn der Test mit einem suspendierten Sediment durchgeführt wird, sollte die 14CO2-Messung indirekt durch Entnahme einer homogenen 10-ml-Probe des im Test verwendeten Wassers bzw. der im Test verwendeten Suspension und anschließende Trennung der Phasen durch Zentrifugieren bei geeigneter Geschwindigkeit (z.B. 40.000 m/s2, 15 min) erfolgen. Danach sollte die wässerige Phase wie oben beschrieben behandelt werden. Die 14C-Aktivität von als Feststoff vorliegendem organischem Kohlenstoff (POA) sollte durch erneute Suspendierung des Sediments in einer kleinen Menge destillierten Wassers, Einbringung in Szintillationsfläschchen und Zugabe einer Szintillationsflüssigkeit zur Bildung eines Gels ermittelt werden. (Für diesen Zweck geeignete Szintillationsflüssigkeiten sind verfügbar.) Je nach Beschaffenheit der Feststoffe (z.B. Anteil an organischem Material) kann die Probe unter Umständen über Nacht mit einem Gewebelöser verarbeitet und dann in einem Wirbelmischer homogenisiert werden, bevor die Szintillationsflüssigkeit hinzugegeben wird. Alternativ kann die POA durch Verbrennung des überschüssigen Sauerstoffs mit einem Oxydationsmittel bestimmt werden. Beim Zählen sollten grundsätzlich interne Standards einbezogen werden; unter Umständen müssen Querempfmdlichkeitskorrekturen unter Zugabe eines internen Standards zu den einzelnen Proben vorgenommen werden.
Direkte 14CO2 Bestimmung
Wenn das entstandene 14CO2 direkt gemessen werden soll, sind bei Beginn des Tests zusätzliche Kolben vorzubereiten. Bei der Probenahme wird jeweils der gesamte Inhalt der Kolben entnommen. Die Kolben werden auf einen pH-Wert von 2-3 angesäuert und das 14CO2 in einem internen (bereits bei Beginn des Tests in die Testkolben gebrachten) Absorber oder einem externen Absorber gebunden. Als Absorptionsmedium kann wahlweise Alkali (z.B. 1 N NaOH-Lösung oder ein NaOH-Pellet), Ethanolamin oder ein im Handel erhältlicher Absorber auf Ethanolaminbasis verwendet werden. Für direkte Messungen des 14CO2-Gehalts sollten die Kolben z.B. mit Butylkautschuk-Septen verschlossen werden.
Abbildung 1a Beispiel einer arithmetischen Darstellung der Daten (Restaktivität/Zeit)

Abbildung 1b Beispiel einer semilogarithmischen Darstellung der Daten (In Restaktivität/Zeit)
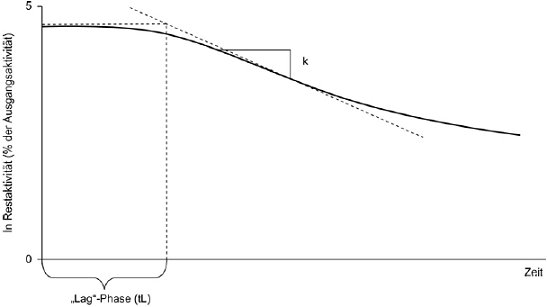
C.26
LEMNA SP. - Wachstumsinhibitionstest 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 221 (2006). Sie dient zur Beurteilung der Toxizität von Chemikalien bei Süßwasserpflanzen der Gattung Lemna (Wasserlinse). Die Methode beruht auf bestehenden Methoden (1)(2)(3)(4)(5)(6), sieht aber Änderungen der entsprechenden Methoden vor, die neueren Forschungsergebnissen und Anhörungen bezüglich einer Reihe wesentlicher Aspekte Rechnung tragen. Die Prüfmethode wurde in einem internationalen Ringversuch validiert (7).
2. Die Prüfmethode beschreibt Toxizitätstests mit Lemna gibba und Lemna minor, die beide umfassend untersucht wurden und Gegenstand der genannten Standards waren. Die Taxonomie von Lemna spp. ist schwierig; problematisch sind die zahlreichen Phänotypen. Lemna können zwar genetisch bedingt unterschiedlich auf Giftstoffe reagieren, doch es liegen noch keine ausreichenden Daten zu den Ursachen für diese Variabilität vor, um einen speziellen Klon zur Verwendung bei dieser Prüfmethode empfehlen zu können. Es wird darauf hingewiesen, dass der Test nicht axenisch durchgeführt wird; in verschiedenen Stadien während der Durchführung des Tests wird jedoch mit geeigneten Maßnahmen versucht, Verunreinigungen durch andere Organismen auf ein Minimum zu begrenzen.
3. Die Durchführung von Tests sowohl mit Erneuerung der Testlösung (semistatische Tests und Durchflusstests) als auch ohne Erneuerung der Testlösung (statische Tests) wird detailliert beschrieben. Abhängig von den Zielsetzungen der Tests sowie von rechtlichen Anforderungen wird empfohlen, den Einsatz von semistatischen Methoden sowie von Durchflussmethoden zu prüfen (z.B. für Stoffe, die durch Verflüchtigung, Photoabbau, Ausfällung oder biologischen Abbau rasch verloren gehen). Weitere Informationen sind Quelle (8) zu entnehmen.
4. Definitionen der verwendeten Begriffe sind Anlage 1 zu entnehmen.
5. Exponentiell wachsende Pflanzenkulturen der Gattung Lemna werden über einen Zeitraum von sieben Tagen als Monokulturen in unterschiedlichen Konzentrationen der Prüfchemikalie kultiviert. Ziel des Tests ist es, die durch den Stoff bedingten Auswirkungen auf das Pflanzenwachstum während dieses Zeitraums zu quantifizieren, basierend auf der Auswertung ausgewählter Messvariablen. Die Frondzahl ist die primäre Messvariable. Außerdem wird mindestens eine weitere Messvariable (gesamte Frondfläche, Trockenmasse oder Frischmasse) gemessen, da sich einige Stoffe erheblich stärker auf diese Messvariablen auswirken als auf die Frondzahlen. Um die stoffabhängigen Auswirkungen zu quantifizieren, wird das Wachstum der Testlösungen mit dem Wachstum der Kontrolllösungen verglichen, und die Konzentration, die eine spezifizierte Wachstumshemmung von x % (z.B. 50 %) verursacht, wird bestimmt und als ECx (z.B. EC50) angegeben.
6. Der Endpunkt des Tests ist die Wachstumshemmung, ausgedrückt als logarithmische Zunahme der Messvariablen (durchschnittliche spezifische Wachstumsrate) während der Expositionsdauer. Aus den in einer Reihe von Testlösungen erfassten durchschnittlichen spezifischen Wachstumsraten wird die Konzentration bestimmt, bei der sich eine spezifizierte Hemmung der Wachstumsrate von x % (z.B. 50 %) ergibt; diese Konzentration wird als ErCx bezeichnet (z.B. ErC50).
7. Eine weitere Reaktionsvariable bei dieser Prüfmethode ist der Zellertrag (Yield); diese Variable kann erforderlich sein, damit in manchen Ländern bestimmte Rechtsvorschriften erfüllt werden. Die Variable ergibt sich aus den Messvariablen am Ende der Expositionsdauer abzüglich der Messvariablen bei Beginn der Expositionsdauer. Aus dem in einer Reihe von Testlösungen ermittelten Zellertrag wird die Konzentration berechnet, bei der sich eine festgelegte Zellertrag-Hemmung von x % (z.B. 50 %) ergibt; diese Konzentration wird als EyCx bezeichnet (z.B. EyC50).
8. Außerdem können die niedrigste Konzentration mit beobachteter Wirkung (LOEC) und die höchste geprüfte Konzentration ohne beobachtete schädliche Wirkung (NOEC) statistisch bestimmt werden.
Informationen zur Prüfchemikalie
9. Eine Analysemethode mit geeigneter Empfindlichkeit für die Quantifizierung des im Prüfmedium enthaltenen Stoffs sollte verfügbar sein.
10. Zur Festlegung der Testbedingungen hilfreiche Informationen zur Prüfchemikalie sind die Strukturformel, die Reinheit, die Wasserlöslichkeit, die Stabilität in Wasser, die Lichtbeständigkeit, pKa, Kow, der Dampfdruck und die biologische Abbaubarkeit. Aus der Wasserlöslichkeit und dem Dampfdruck kann die Henry-Konstante berechnet werden, aus der zu entnehmen ist, ob während der Testdauer erhebliche Verluste der Prüfchemikalie zu erwarten sind. Die Konstante gibt Aufschluss darüber, ob bestimmte Maßnahmen zur Überwachung dieser Verluste durchgeführt werden sollten. Wenn Informationen zur Löslichkeit und zur Stabilität der Prüfchemikalie nicht zuverlässig sind, sollten diese unter den Testbedingungen (Nährmedium, Temperatur und Beleuchtung) untersucht werden.
11. Wenn der Einhaltung des pH-Wertes des Prüfmediums besondere Bedeutung zukommt (z.B. beim Testen von Metallen oder sonstigen hydrolytisch instabilen Chemikalien), wird die Zugabe einer Pufferlösung zum Nährmedium empfohlen (siehe Nummer 21). Weitere Hinweise zur Prüfung von Chemikalien mit physikalisch- chemischen Merkmalen, welche die Durchführung des Tests erschweren, sind Quelle (8) zu entnehmen.
12. Die Tests sind nur valide, wenn die Zeit bis zur Verdopplung der Frondzahl der Kontrolle weniger als 2,5 Tage (60 h) beträgt, was in etwa einer Erhöhung um das Siebenfache in sieben Tagen und einer durchschnittlichen spezifischen Wachstumsrate von 0,275 d- 1 entspricht. Für die Medien und Testbedingungen gemäß dieser Methode kann dieses Kriterium mit dem Prüfprotokoll des statischen Tests (5) erfüllt werden. Außerdem wird angenommen, dass dieses Kriterium auch bei den Bedingungen des semistatischen Tests und des Durchflusstests erfüllt wird. Wie die Verdopplungszeit zu berechnen ist, wird unter Nummer 49 beschrieben.
13. Um das Prüfverfahren zu testen, können Referenzstoffe wie z.B. das im internationalen Ringtest (7) verwendete 3,5-Dichlorphenol geprüft werden. Die Referenzchemikalien sollten mindestens zweimal jährlich bzw. - wenn die Tests seltener durchgeführt werden - gleichzeitig mit der Bestimmung der Toxizität einer Prüfchemikalie getestet werden.
Apparatur
14. Sämtliche Geräte, die mit dem Prüfmedium in Berührung kommen, müssen aus Glas oder einem sonstigen chemisch inerten Material bestehen. Die zur Kultivierung und für die Tests verwendeten Glasgeräte müssen steril sein und von chemischen Verunreinigungen befreit werden, die in das Prüfmedium gelangen könnten. Die Prüfgefäße müssen so groß sein, dass die Fronds der verschiedenen Kolonien in den Kontrollgefäßen wachsen können, ohne sich am Ende der Testdauer zu überlagern. Es ist unerheblich, ob die Wurzeln den Boden der Prüfgefäße berühren, in jedem Fall sind jedoch eine Mindesttiefe von 20 mm und ein Mindestvolumen von 100 ml pro Prüfgefäß zu empfehlen. Die Art der Prüfgefäße ist nicht entscheidend, sofern diese Anforderungen erfüllt sind. Bewährt haben sich Bechergläser, Kristallisierungsschalen und Petrischalen mit geeigneten Abmessungen. Die Prüfgefäße werden abgedeckt, um die Verdunstung und zufällige Verunreinigungen zu minimieren und trotzdem den erforderlichen Luftaustausch zu ermöglichen. Die Prüfgefäße und insbesondere die verwendeten Abdeckungen dürfen keine Schatten erzeugen und keine Änderungen des Lichtspektrums bewirken.
15. Kulturen und Prüfgefäße dürfen nicht zusammen gelagert werden. Daher werden am besten getrennte Wachstumskammern bzw. getrennte Inkubatoren verwendet oder getrennte Räume genutzt. Beleuchtung und Temperatur müssen kontrolliert werden können, und für Beleuchtung und Temperatur müssen gleichbleibende Werte aufrechterhalten werden können (siehe Nummern 35 und 36).
Testorganismus
16. Für diesen Test wird entweder Lemna gibba oder Lemna minor verwendet. In Anlage 2 sind Kurzbeschreibungen von in Toxizitätstests verwendeten Wasserlinsenarten zusammengestellt. Das Pflanzenmaterial kann aus einer Kultursammlung oder aus einem anderen Labor bezogen oder aus der Natur entnommen werden. Bei Entnahme aus der Natur sollten die Pflanzen mindestens acht Wochen vor der Verwendung in dem Medium kultiviert werden, das auch für die Tests verwendet wird. Orte in der freien Natur, aus denen die Ausgangskulturen entnommen werden, dürfen keinen offensichtlichen Quellen von Verunreinigungen ausgesetzt sein. Wenn die Kulturen aus einem anderen Labor oder aus einer Kultursammlung bezogen werden, sollten sie ebenfalls mindestens drei Wochen unter ähnlichen Bedingungen kultiviert werden. Angegeben werden sollten auch die Herkunft des Pflanzenmaterials, der Arten und des Klons (wenn bekannt), die für die Tests verwendet werden.
17. Für die Tests werden Monokulturen verwendet, die keine sichtbaren Verunreinigungen durch andere Organismen als Algen und Protozoen aufweisen. Gesunde Pflanzen der Art L. minor bestehen aus Kolonien mit zwei bis fünf Fronds; gesunde L.-gibba-Kolonien können bis zu sieben Fronds umfassen.
18. Qualität und Einheitlichkeit der für die Tests verwendeten Pflanzen haben erhebliche Auswirkungen auf das Ergebnis der Tests; entsprechend sorgfältig müssen die Pflanzen ausgewählt werden. Nach Möglichkeit sollten junge, rasch wachsende Pflanzen ohne sichtbare Läsionen oder Verfärbungen (Chlorose) verwendet werden. Hochwertige Kulturen weisen einen hohen Anteil an Kolonien mit mindestens zwei Fronds auf. Zahlreiche einzelne Fronds deuten auf Umweltstress hin (z.B. auf Nährstoffmangel); Pflanzenmaterial aus diesen Kulturen sollte für die Tests nicht verwendet werden.
Kultivierung
19. Um den Kultivierungsaufwand zu reduzieren (z.B. wenn über einen bestimmten Zeitraum keine Tests mit Lemna vorgesehen sind), können die Kulturen bei verringerter Beleuchtung und niedrigerer Temperatur (4-10 ° C) gelagert werden. Nähere Informationen zur Kultivierung sind Anlage 3 zu entnehmen. Bei offensichtlichen Anzeichen für Verunreinigungen durch Algen oder sonstige Organismen muss eine Oberflächensterilisation einer Teilprobe der Lemna-Fronds vorgenommen werden und anschließend eine Übertragung in ein frisches Medium erfolgen (siehe Anlage 3). In diesem Fall sollte die verbleibende verunreinigte Kultur verworfen werden.
20. Mindestens sieben Tage vor Durchführung der Tests wird eine hinreichende Anzahl an Kolonien keimfrei in ein frisches steriles Medium gebracht und 7-10 Tage bei Testbedingungen kultiviert.
Prüfmedium
21. Für Lemna minor und Lemna gibba werden jeweils die im Folgenden genannten Medien empfohlen. Wenn vermutet wird, dass das Medium mit der Prüfchemikalie reagieren und die Toxizitätswirkung beeinflussen könnte, ist sorgfältig zu prüfen, ob eine pH-Pufferlösung zum Prüfmedium gegeben werden muss (beim L.- minor-Medium MOPS (4-Morpholinpropan-Sulfonsäure, CAS-Nr: 1132-61-2) und beim L.-gibba-Medium NaHCO3). Das Steinberg-Medium (9) ist ebenfalls akzeptabel, wenn die Validitätskriterien erfüllt werden.
22. Zur Kultivierung von L. minor und für Tests mit L. minor wird eine Modifizierung des SIS-Lemna-Nährmediums (SIS = schwedisches Standardmedium) empfohlen. Die Zusammensetzung dieses Mediums ist Anlage 4 zu entnehmen.
23. Zur Kultivierung von L. gibba und für Tests mit L. gibba wird das Nährmedium 20X - AAP (siehe Anlage 4) empfohlen.
24. Das in Anlage 4 beschriebene Steinberg-Medium ist für L. minor ebenfalls geeignet, kann aber auch für L. gibba verwendet werden, wenn die Validitätskriterien erfüllt sind.
Testlösungen
25. Die Testlösungen werden gewöhnlich durch Verdünnung einer Stammlösung hergestellt. Zum Herstellen von Stammlösungen der Prüfchemikalie wird die Chemikalie im Allgemeinen im Nährmedium gelöst.
26. Die höchste getestete Konzentration der Prüfchemikalie sollte in der Regel die Wasserlöslichkeit der Chemikalie bei den jeweiligen Testbedingungen nicht überschreiten. Allerdings wird darauf hingewiesen, dass Lemna spp. auf der Oberfläche treiben und Chemikalien ausgesetzt werden könnten, die sich am Übergang zwischen Wasser und Umgebungsluft sammeln (z.B. schlecht wasserlösliche oder hydrophobe Chemikalien oder oberflächenaktive Chemikalien). Unter diesen Umständen besteht eine Belastung durch nicht in der Lösung enthaltene Materialien, und die Testkonzentrationen können je nach den Merkmalen der Prüfchemikalie die Wasserlöslichkeit überschreiten. Bei Prüfchemikalien mit geringerer Wasserlöslichkeit muss unter Umständen mit einem organischen Lösungsmittel oder einem Dispergiermittel eine konzentrierte Stammlösung oder eine Dispersion der Chemikalie hergestellt werden, damit leichter die exakten Mengen der Prüfchemikalie zum Prüfmedium hinzugegeben werden können und damit die Dispergierung und die Auflösung der Chemikalie begünstigt wird. Die Verwendung dieser Materialien sollte unbedingt vermieden werden. Durch die Verwendung der Lösungsmittel oder Dispergiermittel sollte keine Phytotoxizität entstehen. Häufig verwendete Lösungsmittel, die bei Konzentrationen bis zu 100 µl/l keine phototoxische Wirkung haben, sind z.B. Aceton und Dimethylformamid. Wenn ein Lösungsmittel oder ein Dispergiermittel verwendet wird, muss die Endkonzentration protokolliert und auf ein Minimum (< 100 µl/l) beschränkt werden; alle behandelten Proben und die Kontrollproben müssen das Lösungsmittel bzw. das Dispergiermittel in derselben Konzentration enthalten. Weitere Informationen zur Verwendung von Dispergiermitteln sind Quelle (8) zu entnehmen.
Test- und Kontrollgruppen
27. Die vorherige Kenntnis der Toxizität der Prüfchemikalie für Lemna (z.B. aufgrund eines Vorversuchs) erleichtert die Auswahl geeigneter Testkonzentrationen. Beim definitiven Toxizitätstest werden in der Regel mindestens fünf Testkonzentrationen in einer geometrischen Reihe angeordnet. Der Abstandsfaktor zwischen den Testkonzentrationen beträgt höchstens 3,2; bei flachen Konzentrations-Reaktionskurven kommen jedoch auch höhere Werte in Betracht. Die Verwendung von weniger als fünf Konzentrationen muss begründet werden. Für jede Testkonzentration sind mindestens drei Replikate zu verwenden.
28. Beim Festlegen des Testkonzentrationsbereichs (zur Bereichsermittlung und/oder für den definitiven Toxizitätstest) sind folgende Punkte zu berücksichtigen:
- Um ein angemessenes Konfidenzintervall sicherzustellen, müssen bei der Bestimmung eines ECx-Wertes die Testkonzentrationen so gewählt werden, dass der ECx-Wert eingeschlossen ist. Bei der Ermittlung von EC50 beispielsweise muss die höchste Testkonzentration größer als EC50 sein. Wenn der EC50-Wert außerhalb des Testkonzentrationsbereichs liegt, sind die entsprechenden Konfidenzintervalle groß, und das verwendete statistische Modell ist eventuell nicht geeignet.
- Wenn die LOEC oder die NOEC bestimmt werden sollen, muss die niedrigste Testkonzentration so gering sein, dass das Wachstum nicht signifikant kleiner als das Wachstum der Kontrollgruppe ist. Außerdem muss die höchste Testkonzentration so hoch sein, dass das Wachstum signifikant geringer ist als das Wachstum der Kontrollgruppe. Ansonsten muss der Test mit einem anderen Konzentrationsbereich wiederholt werden (wenn die höchste Konzentration nicht an der Löslichkeitsgrenze bzw. bei der höchstens erforderlichen Grenzkonzentration [z.B. 100 mg/l- 1] liegt).
29. Die Tests beinhalten jeweils Kontrollen, bei denen das gleiche Nährmedium, die gleiche Anzahl an Fronds und Kolonien und die gleichen Umgebungsbedingungen wie in den Prüfgefäßen gegeben sind und nur die Prüfchemikalie fehlt. Wenn ein zusätzliches Lösungsmittel oder Dispergiermittel verwendet wird, muss eine zusätzliche Kontrolle mit der gleichen Konzentration des Lösungsmittel/Dispergiermittel wie in den Prüfansätzen getestet werden. Die Anzahl der Kontrollgefäße zur Durchführung von Replikaten (sowie ggf. der Lösungsmittelgefäße) muss mindestens identisch mit der Anzahl der für die verschiedenen Testkonzentrationen verwendeten Gefäße sein; im Idealfall sollten sogar doppelt so viele Gefäße verwendet werden.
30. Wenn die NOEC nicht bestimmt werden muss, kann das Prüfprotokoll geändert werden, indem die Anzahl der Konzentrationen erhöht und die Anzahl der Replikate verringert wird. Allerdings müssen mindestens drei Kontrollreplikate verwendet werden.
Exposition
31. Kolonien mit zwei bis vier sichtbaren Fronds werden unter keimfreien Bedingungen aus der Impfkultur übertragen und zufällig den Prüfgefäßen zugewiesen. Die Prüfgefäße enthalten insgesamt jeweils neun bis zwölf Fronds. Die Anzahl der Fronds und Kolonien muss in allen Prüfgefäßen identisch sein. Erfahrungen mit dieser Methode sowie Daten aus Ringtests haben gezeigt, dass drei Replikate pro Behandlung, wobei jedes Replikat anfänglich neun bis zwölf Fronds enthält, hinreichend sind, um Unterschiede hinsichtlich der Wachstumshemmungen in der Größenordnung von ca. 4 bis 7 % aufgrund der Wachstumsrate (pro Zellertrag 10 bis 15 % berechnet) zwischen den Behandlungen feststellen zu können (7).
32. Die Prüfgefäße müssen randomisiert im Inkubator angeordnet werden, um die Auswirkungen räumlich unterschiedlicher Lichtintensitäten und Temperaturen zu minimieren. Außerdem sind die Gefäße blockweise anzuordnen oder zufällig umzustellen, wenn die Messungen vorgenommen werden (bzw. noch häufiger).
33. Wenn aufgrund eines vorläufigen Stabilitätstests anzunehmen ist, dass die Prüfchemikalienkonzentration nicht über die gesamte Testdauer (7 Tage) aufrechterhalten werden kann (d. h. wenn die gemessene Konzentration unter 80 % der gemessenen Ausgangskonzentration fällt), wird ein semistatischer Test empfohlen. In diesem Fall werden die Kolonien während der Testdauer mindestens zweimal (z.B. an den Tagen 3 und 5) in frisch hergestellte Test- und Kontrolllösungen gegeben. Wie häufig die Lösungen dem frischen Medium ausgesetzt werden, hängt von der Stabilität der Prüfchemikalie ab. Bei sehr instabilen oder flüchtigen Chemikalien ist unter Umständen eine häufigere Exposition erforderlich, um die Konzentrationen annähernd konstant zu halten. Unter gewissen Umständen kann auch die Durchführung eines Durchflusstests erforderlich sein (8)(10).
34. Das Expositionsszenario beim Besprühen wird in dieser Prüfmethode nicht berücksichtigt; diesbezüglich wird auf Quelle (11) verwiesen.
Inkubationsbedingungen
35. Durch kontinuierliche fluoreszierende Beleuchtung mit warmem oder kaltweißem Licht wird eine Lichtintensität hergestellt, die bei Messung unter photosynthetisch aktiver Strahlung (400-700 nm) an Punkten jeweils in demselben Abstand von der Lichtquelle wie die Lemna-Fronds bei 85-135 µE·m- 2s- 1 liegt (entsprechend etwa 6.500-10.000 lx). Abweichungen von der gewählten Lichtintensität dürfen im Testbereich höchstens ± 15 % betragen. Dabei ist zu beachten, dass die Messwerte von der Methode zur Feststellung und zur Messung der Lichtintensität (insbesondere vom Sensortyp) abhängen. Kugelförmige Sensoren (die auf Licht aus allen Winkeln über und unter der Messebene reagieren) sowie "Kosinus"-Sensoren (die auf Licht aus allen Winkeln über der Messebene ansprechen) sind gegenüber unidirektionalen Sensoren zu bevorzugen, da diese Sensoren bei Mehrpunkt-Lichtquellen des hier beschriebenen Typs höhere Messwerte ergeben.
36. Die Temperatur der Prüfgefäße beträgt 24 ± 2 °C. Der pH-Wert des Kontrollmediums darf während des Tests höchstens um 1,5 Einheiten ansteigen. Auch bei Abweichungen von mehr als 1,5 Einheiten sind Testergebnisse dann nicht ungültig, wenn nachgewiesen werden kann, dass die Validitätskriterien erfüllt sind. Erhöhte Sorgfalt ist bei der Beurteilung von Verschiebungen des pH-Wertes in Sonderfällen geboten (z.B. beim Testen instabiler Chemikalien oder beim Testen von Metallen). Weitere Informationen in diesem Zusammenhang sind Quelle (8) zu entnehmen.
Dauer
37. Der Test wird sieben Tage nach Einsetzen der Pflanzen in die Prüfgefäße beendet.
Messungen und analytische Bestimmungen
38. Bei Beginn des Tests wird die Anzahl der in den Prüfgefäßen enthaltenen Fronds ermittelt und protokolliert; zu zählen sind alle herausragenden, deutlich erkennbaren Fronds. Die Anzahl der normal oder anomal aussehenden Fronds ist bei Beginn des Tests, alle drei Tage während der Expositionsdauer (d. h. binnen des Zeitraums von sieben Tagen mindestens zweimal) und am Ende des Tests zu bestimmen. Änderungen in der Entwicklung der Pflanzen (z.B. Änderungen der Größe oder des Aussehens der Fronds, Anzeichen für eine Nekrose, Chlorose oder Aufwölbungen, das Aufbrechen von Kolonien oder der Verlust der Schwimmfähigkeit sowie Veränderungen der Wurzellänge oder der sonstigen Beschaffenheit der Wurzeln) sind zu protokollieren. Wesentliche Merkmale des Prüfmediums (z.B. Vorliegen nicht gelösten Materials oder Algenwachstum im Prüfgefäß) werden ebenfalls vermerkt.
39. Ergänzend zur Ermittlung der Frondzahl während des Tests sind auch die Auswirkungen der Prüfchemikalie auf eine (oder mehrere) der folgenden Messvariablen zu bewerten:
- Gesamtfläche der Fronds,
- Trockenmasse,
- Frischmasse.
40. Die Gesamtfläche der Fronds hat den Vorteil, dass sie für jedes einzelne Prüfgefäß und für jedes einzelne Kontrollgefäß jeweils bei Beginn des Tests, während der Durchführung des Tests und am Ende des Tests bestimmt werden kann. Die Trockenmasse und die Frischmasse werden bei Beginn des Tests an einer Probe der Impfkultur ermittelt, die typisch für das bei Beginn des Tests verwendete Material ist; eine weitere Feststellung erfolgt am Ende des Tests anhand des Pflanzenmaterials jeweils aus den Prüfgefäßen und aus den Kontrollgefäßen. Wenn die Frondfläche nicht gemessen wird, ist eher die Trockenmasse als die Frischmasse zu ermitteln.
41. Die Gesamtfläche der Fronds, die Trockenmasse und die Frischmasse können wie folgt bestimmt werden:
- Gesamtfläche der Fronds: Die Gesamtfläche der Fronds aller Kolonien kann durch Bildanalyse ermittelt werden. Eine Silhouette des Prüfgefäßes und der Pflanzen kann mit einer Videokamera erfasst werden. Dazu wird das Gefäß auf einen Leuchtkasten gestellt; das dort aufgenommene Bild wird anschließend digitalisiert. Durch die Kalibrierung mit flachen Verläufen bekannter Flächen kann dann die Gesamtfläche der Fronds im Prüfgefäß bestimmt werden. Dabei ist darauf zu achten, dass Störungen durch den Rand des Prüfgefäßes ausgeschlossen werden. Ein alternatives, aber aufwendigeres Verfahren besteht darin, Prüfgefäße und Pflanzen zu fotokopieren und die entsprechenden Silhouetten der Kolonien auszuschneiden; anschließend wird die jeweilige Fläche mit einem Blattflächen-Analysator oder mit Millimeterpapier bestimmt. Geeignet sind unter Umständen aber auch andere Verfahren (z.B. die Ermittlung des Papiergewicht-Verhältnisses zwischen der Fläche der Kolonie-Silhouette und der Fläche der jeweils zugrunde gelegten Einheit).
- Trockenmasse: Alle Kolonien werden aus den Prüfgefäßen entnommen und mit destilliertem oder entionisiertem Wasser gespült. Durch anschließendes Ablöschen wird überschüssiges Wasser entfernt; danach werden die Proben bei 60 °C auf ein konstantes Gewicht getrocknet. Wurzelreste werden einbezogen. Die Trockenmasse wird mit einer Genauigkeit von mindestens 0,1 mg angegeben.
- Frischmasse: Alle Kolonien werden in zuvor gewogene Röhrchen aus Polystyrol (oder einem sonstigen inerten Material) mit feinen Löchern (1 mm) im gerundeten Boden gesetzt. Anschließend werden die Röhrchen bei Raumtemperatur 10 Minuten mit 3.000 Umdrehungen/min. zentrifugiert. Die Röhrchen mit den nun getrockneten Kolonien werden noch einmal gewogen; danach wird die Frischmasse durch Subtraktion des Gewichts der leeren Röhrchen bestimmt.
Häufigkeit der Messungen und der analytischen Bestimmungen
42. Bei statischen Tests wird jeweils bei Beginn und am Ende des Tests der pH-Wert der behandelten Lösungen gemessen. Bei semistatischen Tests wird für alle Batches der ,frischen" Testlösung jeweils vor den Erneuerungen der pH-Wert ermittelt; außerdem ist der pH-Wert der ,verbrauchten" Lösungen zu bestimmen.
43. Die Lichtintensität wird in der Wachstumskammer, im Inkubator oder im jeweiligen Raum in dem Abstand von der Lichtquelle gemessen, der auch bei den Lemna-Fronds gegeben ist. Während des Tests wird mindestens eine Messung vorgenommen. Die Temperatur des Mediums in einem Surrogatgefäß unter den gleichen Bedingungen wie in der Wachstumskammer bzw. im Inkubator oder im jeweiligen Raum ist mindestens täglich zu protokollieren.
44. Während des Tests wird die Konzentration der Prüfchemikalie in geeigneten Intervallen bestimmt. Bei statischen Tests ist die Konzentration mindestens bei Beginn des Tests und am Ende des Tests zu ermitteln.
45. Bei semistatischen Tests, bei denen davon ausgegangen wird, dass die Konzentration der Prüfchemikalie nicht im Bereich von ± 20 % der Nominalkonzentration aufrechterhalten werden kann, müssen alle frisch hergestellten Testlösungen sowie alle Lösungen jeweils nach der Erneuerung analysiert werden (siehe Nummer 33). Bei Tests, bei denen die gemessene Ausgangskonzentration der Prüfchemikalie zwar nicht ± 20 % der Nominalkonzentration beträgt, für die aber hinreichend nachgewiesen werden kann, dass die Ausgangskonzentrationen wiederholbar und stabil sind (d. h. dass die Konzentrationen im Bereich von 80-120 % der Ausgangskonzentration liegen), sind chemische Bestimmungen nur bei der höchsten und der niedrigsten Konzentration erforderlich. In jedem Fall brauchen die Prüfchemikalienkonzentrationen für alle Testkonzentrationen vor der Erneuerung jeweils nur bei einem einzigen Replikat (bzw. bei Gefäßen mit zusammengefassten Replikaten jeweils bei nur einem Gefäß) erneut bestimmt zu werden.
46. Bei Durchflusstests ist ähnlich zu verfahren, wie bei den semistatischen Tests, d. h. Analysen sind jeweils bei Beginn des Tests, in der Mitte und am Ende des Tests durchzuführen; Messungen der ,verbrauchten" Lösungen sind jedoch nicht erforderlich. Bei diesem Testtyp wird der Durchfluss des Verdünnungsmittels und der Prüfchemikalie oder der Prüfchemikalien-Stammlösung täglich geprüft.
47. Wenn nachgewiesen wird, dass die Konzentration der Prüfchemikalie während der gesamten Testdauer zufriedenstellend in Höhe von ± 20 % der Nominalkonzentration oder der gemessenen Ausgangskonzentration aufrechterhalten werden konnte, können die Ergebnisse auch ausgehend von den Nominalwerten bzw. von den gemessenen Ausgangswerten analysiert werden. Beträgt die Abweichung von der Nominalkonzentration oder von der gemessenen Ausgangskonzentration mehr als ± 20 %, sollte bei der Analyse der Ergebnisse vom geometrischen Mittel der Konzentration während der Expositionsdauer oder von Modellen ausgegangen werden, die den Rückgang der Prüfchemikalienkonzentration beschreiben (8).
Limit-Test
48. Unter bestimmten Umständen, z.B. wenn ein vorläufiger Test darauf hindeutet, dass die Prüfchemikalie bei Konzentrationen bis zu 100 mg/l bzw. bis zur Löslichkeitsgrenze im Prüfmedium (maßgeblich ist die jeweils niedrigere Konzentration) keine toxische Wirkung hat, kann ein Limit-Test durchgeführt werden, in dem die Reaktionen einer Kontrollgruppe und einer Behandlungsgruppe (100 mg/l bzw. eine mit der Löslichkeitsgrenze identische Konzentration) verglichen werden. Es wird nachdrücklich empfohlen, diese Tests durch Analysen der Expositionskonzentration zu verifizieren. Alle oben beschriebenen Testbedingungen und Validitätskriterien beziehen sich auf einen Limit-Test; allerdings sollte die Anzahl der behandelten Replikate mindestens doppelt so hoch sein. Das Wachstum der Kontrollgruppe und der Behandlungsgruppe kann mit einem statistischen Test zum Vergleich der Mittelwerte analysiert werden (z.B. mit einem Student-t-Test).
Verdopplungszeit
49. Um die Dauer bis zur Verdopplung der Frondzahl (Td) zu bestimmen und um sicherzustellen, dass dieses Validitätskriterium von der Studie erfüllt wird (siehe Nummer 12), sind die Daten der Kontrollgefäße in die folgende Gleichung einzusetzen:
Td = ln 2/µ
Dabei steht µ für die durchschnittliche spezifische Wachstumsrate, die wie unter den Nummern 54 und 55 beschrieben bestimmt wurde.
Reaktionsvariablen
50. Mit der Prüfung sollen die Auswirkungen der Prüfchemikalie auf das vegetative Wachstum von Lemna bestimmt werden. Diese Prüfmethode beschreibt zwei Reaktionsvariablen, da in unterschiedlichen Rechtsordnungen unterschiedliche Präferenzen und rechtliche Anforderungen bestehen. Damit die Testergebnisse in allen Rechtsordnungen anerkannt werden können, sind die Auswirkungen mithilfe der beiden im Folgenden beschriebenen Reaktionsvariablen a und b zu auszuwerten.
- Durchschnittliche spezifische Wachstumsrate: Diese Reaktionsvariable wird aufgrund von Veränderungen der Frondzahlen-Logarithmen sowie ausgehend von den Veränderungen der Logarithmen sonstiger Messparameter der Kontrollen und der einzelnen Behandlungsgruppen (gesamte Frondfläche, Trockenmasse oder Frischmasse) während eines bestimmten Zeitraums (jeweils pro Tag ausgedrückt) berechnet. Gelegentlich wird diese Wachstumsrate auch als relative Wachstumsrate bezeichnet (12).
- Zellertrag: Diese Reaktionsvariable wird ausgehend von Änderungen der Frondzahl sowie aufgrund von Änderungen anderer Messparameter der Kontrollen und der einzelnen Behandlungsgruppen (gesamte Frondfläche, Trockenmasse oder Frischmasse) bis zum Ende der Testdauer berechnet.
51. Es wird darauf hingewiesen, dass die mit diesen beiden Reaktionsvariablen berechneten Toxizitätswerte nicht vergleichbar sind; der entsprechende Unterschied muss bei der Verwendung der Testergebnisse berücksichtigt werden. Die mit der durchschnittlichen spezifischen Wachstumsrate (ErCx) berechneten Werte für ECx werden im Allgemeinen höher sein als die anhand des Zellertrags (EyCx) ermittelten Werte, wenn die für diese Testmethode vorgesehenen Bedingungen eingehalten werden; dies ist auf die unterschiedliche mathematische Grundlage der beiden Berechnungsverfahren zurückzuführen. Die auftretenden Unterschiede sollten jedoch nicht als Anzeichen für eine unterschiedliche Empfindlichkeit der beiden Reaktionsvariablen betrachtet werden; beide Werte sind einfach mathematisch verschieden. Das Konzept der durchschnittlichen spezifischen Wachstumsrate beruht auf dem im Allgemeinen exponentiellen Verlauf des Wasserlinsenwachstums bei nicht beschränkten Kulturen, bei denen die Toxizität aufgrund der Auswirkungen auf die Wachstumsrate ermittelt wird, ohne jedoch von der absoluten Höhe der jeweiligen Wachstumsrate der Kontrollprobe, von der Steigung der Konzentrations-Reaktionskurve oder von der Testdauer abhängig zu sein. Auf der Reaktionsvariable "Zellertrag" beruhende Ergebnisse hingegen hängen von allen übrigen genannten Variablen ab. EyCx ist von der spezifischen Wachstumsrate der in den einzelnen Tests verwendeten Wasserlinsenarten sowie von der maximalen spezifischen Wachstumsrate abhängig, die je nach Art sowie sogar zwischen den einzelnen Klonen unterschiedlich sein kann. Diese Reaktionsvariable darf nicht verwendet werden, um die Empfindlichkeit von Algenarten oder auch nur verschiedener Klone gegenüber Giftstoffen zu vergleichen. Die Verwendung der durchschnittlichen spezifischen Wachstumsrate zur Schätzung der Toxizität wird in der Wissenschaft bevorzugt; bei dieser Prüfmethode werden jedoch auch Toxizitätsschätzungen aufgrund des Zellertrags berücksichtigt, um den derzeitigen rechtlichen Anforderungen einiger Rechtsordnungen Rechnung zu tragen.
52. Toxizitätsschätzungen müssen auf der Frondzahl sowie auf einer weiteren Messvariablen (gesamte Frondfläche, Trockenmasse oder Frischmasse) beruhen, da sich manche Chemikalien erheblich stärker auf andere Messvariablen auswirken können als die Frondzahl. Diese Auswirkungen würden nicht festgestellt, wenn ausschließlich die Frondzahl berechnet würde.
53. Die Anzahl der Fronds sowie alle sonstigen protokollierten Messvariablen (gesamte Frondfläche, Trockenmasse oder Frischmasse) werden zusammen mit den Konzentrationen der Prüfchemikalie für jede Messung tabellarisch zusammengestellt. Anschließende Datenanalysen z.B. zur Schätzung von LOEC-, NOEC- oder ECx- Werten sollten auf den Werten der einzelnen Replikate, nicht aber auf berechneten Mittelwerten der einzelnen Behandlungsgruppen beruhen.
Durchschnittliche spezifische Wachstumsrate
54. Die durchschnittliche spezifische Wachstumsrate in einem bestimmten Zeitraum wird als logarithmische Zunahme der Wachstumsvariablen (d. h. der Frondzahl und einer sonstigen Messvariablen (gesamte Frondfläche, Trockenmasse oder Frischmasse)) für die einzelnen Replikate der Kontrolllösungen und der behandelten Lösungen mit der nachstehenden Formel berechnet:
![]()
Dabei sind:
- µ i - j: durchschnittliche spezifische Wachstumsrate vom Zeitpunkt i bis zum Zeitpunkt j
- Ni: Messvariable im Prüfgefäß bzw. im Kontrollgefäß zum Zeitpunkt i
- Nj: Messvariable im Prüfgefäß bzw. im Kontrollgefäß zum Zeitpunkt j
- t: Zeitraum vom Zeitpunkt i bis zum Zeitpunkt j
Für jede Behandlungsgruppe und für jede Kontrollgruppe sind die mittlere Wachstumsrate und die Varianzschätzungen zu berechnen.
55. Die durchschnittliche spezifische Wachstumsrate wird für die gesamte Testdauer berechnet. (In der vorstehenden Formel bezeichnet "i" den Beginn des Tests und der Zeitpunkt "j" das Ende des Tests.) Für alle Konzentrationen der Testlösungen und der Kontrolllösungen sind ein Mittelwert für die durchschnittliche spezifische Wachstumsrate zu berechnen und die entsprechenden Varianzschätzungen vorzunehmen. Außerdem muss die abschnittsbezogene Wachstumsrate bestimmt werden, um die Auswirkungen der Prüfchemikalie während der Expositionsdauer beurteilen zu können (z.B. durch Prüfung der logarithmisch transformierten Wachstumskurven). Erhebliche Unterschiede zwischen der abschnittsbezogenen Wachstumsrate und der durchschnittlichen Wachstumsrate deuten auf Abweichungen vom konstanten exponentiellen Wachstum hin und erfordern eine genaue Überprüfung der Wachstumskurve. In diesem Fall würde ein vorsichtigerer Ansatz in einem Vergleich der spezifischen Wachstumsraten der behandelten Kulturen während der Dauer der maximalen Hemmung mit den spezifischen Wachstumsraten der Kontrolllösungen im selben Zeitraum bestehen.
56. Die Hemmung der Wachstumsrate in Prozent (Ir) kann anschließend für jede Testkonzentration (Behandlungsgruppe) nach der folgenden Formel berechnet werden:
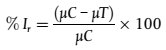
Dabei sind:
- % Ir: Hemmung der durchschnittlichen spezifischen Wachstumsrate in Prozent
- µC: Mittelwert für µ in der Kontrollgruppe
- µT: Mittelwert für µ in der Behandlungsgruppe Zellertrag
57. Die Auswirkungen auf den Zellertrag werden ausgehend von zwei Messvariablen, d. h. der Frondzahl und einer sonstigen Messvariablen (der gesamten Frondfläche, der Trockenmasse oder der Frischmasse) der jeweiligen Prüfgefäße am Anfang und am Ende des Tests bestimmt. Für die Trockenmasse und die Frischmasse wird die Ausgangsbiomasse bezogen auf eine Frond-Probe aus dem betreffenden Batch bestimmt, aus der die Prüfgefäße geimpft wurden (siehe Nummer 20). Für die Testkonzentrationen und für die Kontrolllösungen ist jeweils ein mittlerer Zellertrag zu berechnen; die Varianzen sind jeweils zu schätzen. Die prozentuale Hemmung des Zellertrags (% Iy) kann für die Behandlungsgruppen wie folgt berechnet werden:
![]()
Dabei sind:
- % Iy: Verringerung des Zellertrags in Prozent
- bC: Biomasse am Ende des Tests abzüglich der Biomasse der Kontrollgruppe am Anfang des Tests
- bT: Biomasse am Ende des Tests abzüglich der Biomasse der Behandlungsgruppe am Anfang des Tests Darstellung der Konzentrations-Reaktionskurven
58. Die Konzentrations-Reaktionskurven der mittleren Hemmung der Reaktionsvariablen in Prozent (Ir bzw. Iy berechnet gemäß der Anweisung unter Nummer 56 bzw. Nummer 57) bezogen auf die logarithmische Konzentration der Prüfchemikalie werden grafisch dargestellt.
Schätzung von ECx
59. Schätzungen der ECx-Werte (z.B. EC50) sollten sowohl auf der mittleren spezifischen Wachstumsrate (ErCx) als auch auf dem Zellertrag (EyCx) beruhen, und beide Werte sollten ihrerseits von der Frondzahl und von einer weiteren Messvariablen (gesamte Frondfläche, Trockenmasse oder Frischmasse) ausgehen, weil sich manche Prüfchemikalien unterschiedlich auf die Frondzahl und sonstige Messvariablen auswirken. Die gewünschten Toxizitätsparameter bestehen entsprechend aus vier ECx-Werten für alle berechneten Hemmkonzentrationen x: ErCx (Frondzahl); ErCx (gesamte Frondfläche, Trockenmasse oder Frischmasse); EyCx (Frondzahl) und EyCx (gesamte Frondfläche, Trockenmasse oder Frischmasse).
Statistische Verfahren
60. Ziel ist die Ermittlung einer quantitativen Konzentrations-Wirkungsbeziehung durch Regressionsanalyse. Im Anschluss an eine linearisierte Transformation der Reaktionsdaten (z.B. in Einheiten nach dem Probit-, Logit- oder Weibull-Modell) (13) kann eine gewichtete lineare Regression vorgenommen werden; nichtlineare Regressionsverfahren, mit denen die unvermeidlichen Unregelmäßigkeiten der Daten und Abweichungen von gleichförmigen Verteilungen besser verarbeitet werden können, werden jedoch bevorzugt. Im Bereich von null bzw. der vollständigen Hemmung können diese Unregelmäßigkeiten durch die Transformation vergrößert werden und die Analyse beeinträchtigen (13). Es wird darauf hingewiesen, dass Standard-Analysemethoden mit Probit-, Logit- oder Weibull-Transformationen für quantale Daten (z.B. Mortalität oder Überlebensraten) vorgesehen sind und zur Verwendung in Verbindung mit Wachstums- oder Zellertragsdaten entsprechend modifiziert werden müssen. Spezifische Verfahren zur Bestimmung von ECx-Werten aus kontinuierlichen Daten sind den Quellen (14), (15) und (16) zu entnehmen.
61. Für jede zu analysierende Reaktionsvariable sind aufgrund der Konzentrations-Wirkungsbeziehung ECx-Werte zu ermitteln. Nach Möglichkeit sollten für jeden ECx-Wert die 95- %-Konfidenzintervalle bestimmt werden. Die Qualität der Übereinstimmung der Reaktionsdaten mit dem Regressionsmodell sollte grafisch oder statistisch bewertet werden. Die Regressionsanalyse wird mit den Reaktionen der einzelnen Replikate (und nicht mit den Mittelwerten der Behandlungsgruppe) durchgeführt.
62. Schätzwerte für EC50 und für die Konfidenzintervalle können auch durch lineare Interpolation mit einem Bootstrapping-Algorithmus (17) erzielt werden, wenn die verfügbaren Regressionsmodelle/-methoden für die betreffenden Daten nicht geeignet sind.
63. Für eine Schätzung der LOEC und entsprechend auch der NOEC müssen die Mittelwerte der behandelten Lösungen durch Varianzanalyseverfahren (ANOVA) verglichen werden. Der Mittelwert der einzelnen Konzentrationen ist dann mit einer geeigneten Methode zur Durchführung von Mehrfachvergleichen bzw. zur Durchführung von Trendtests mit dem Mittelwert der Kontrollgruppe zu vergleichen. Dunnett- und Williams- Tests können hilfreich sein (18)(19)(20)(21). Die ANOVA-Annahme der Varianzhomogenität muss einer Überprüfung unterzogen werden. Die entsprechende Bewertung kann anhand einer grafischen Darstellung oder aufgrund eines formalen Tests vorgenommen werden (22). Geeignet sind Levene- und Bartlett-Tests. Wenn die Annahme der Varianzhomogenität nicht erfüllt ist, kann gelegentlich eine Korrektur durch logarithmische Datentransformation erfolgen. Bei außerordentlicher Varianzheterogenität, die durch Transformation nicht korrigiert werden kann, sollten Analysen durch Methoden wie z.B. Jonckheere-Trendtests (Stepdown) erwogen werden. Weitere Hinweise zur Bestimmung von NOEC-Werten sind Quelle (16) zu entnehmen.
64. Aufgrund neuer Forschungsergebnisse wird empfohlen, das Konzept der NOEC aufzugeben und durch Punktschätzungen von ECx-Werten zu ersetzen, die durch Regression ermittelt wurden. Für diesen Lemna-Test wurde noch kein geeigneter Wert für x definiert. Ein Bereich von 10 bis 20 % scheint jedoch geeignet (abhängig von der auswählten Reaktionsvariablen); vorzugsweise sollten sowohl EC10 als auch EC20 protokolliert werden.
Abschlussbericht
65. Der Prüfbericht muss folgende Informationen enthalten:
Prüfchemikalie:
- physikalische Beschaffenheit und physikalisch-chemische Eigenschaften einschließlich der Wasserlöslichkeitsgrenze;
- chemische Kenndaten (z.B. CAS-Nummer) einschließlich der Reinheit (Verunreinigungen).
Im Test verwendete Art:
- wissenschaftliche Bezeichnung, Klon (wenn bekannt) und Herkunft.
Prüfbedingungen:
- verwendetes Testverfahren (statisch, semistatisch oder Durchfluss);
- Datum des Testbeginns und Dauer des Tests;
- Prüfmedium;
- Beschreibung des Prüfprotokolls: Prüfgefäße und Abdeckungen, Lösungsvolumina, Anzahl der Kolonien und Fronds pro Prüfgefäß am Anfang des Tests;
- Testkonzentrationen (Nominalkonzentrationen bzw. gemessene Konzentrationen) und Anzahl der Replikate pro Konzentration;
- Methoden zur Herstellung von Stamm- und Testlösungen einschließlich der Verwendung von Lösungsmitteln und Dispergiermitteln;
- Temperatur während des Tests;
- Lichtquelle, Lichtintensität und Homogenität des Lichts;
- pH-Werte der Prüfmedien und der Kontrollmedien;
- Prüfchemikalienkonzentrationen und Analysemethode mit geeigneten Daten zur Qualitätsbewertung (Validierungsstudien, Standardabweichungen oder Konfidenzgrenzen der Analysen);
- Methoden zur Bestimmung der Frondzahl und sonstiger Messvariablen (z.B. Trockenmasse, Frischmasse oder Frondfläche);
- sämtliche Abweichungen von dieser Prüfmethode.
Ergebnisse:
- Ausgangsdaten: Anzahl der Fronds und sonstige Messvariablen der einzelnen Prüfgefäße und der Kontrollgefäße jeweils bei einer Beobachtung und Analyse;
- Mittelwerte und Standardabweichungen der einzelnen Messvariablen;
- Wachstumskurven bei den verschiedenen Konzentrationen (möglichst mit logarithmisch transformierter Messvariable, siehe Nummer 55);
- Verdopplungszeit/Wachstumsrate in der Kontrolllösung bezogen auf die Frondzahl;
- berechnete Reaktionsvariablen für alle behandelten Replikate mit Mittelwerten und dem Variationskoeffizienten für Replikate;
- grafische Darstellung der Beziehung zwischen Konzentration und Wirkung;
- Schätzungen der Endpunkte der Toxizität für die verschiedenen Reaktionsvariablen (z.B. EC50, EC10 und EC20) und entsprechende Konfidenzintervalle; wenn berechnet, sind die LOEC und/oder die NOEC sowie die zur jeweiligen Berechnung verwendeten statistischen Methoden anzugeben;
- bei Durchführung von Varianzanalysen (ANOVA) der Umfang der nachzuweisenden Auswirkungen (z.B. geringster signifikanter Unterschied);
- jegliche in behandelten Proben festgestellte Wachstumsstimulation;
- alle offensichtlichen Anzeichen einer Phytotoxizität sowie Beobachtungen an den Testlösungen;
- Diskussion der Ergebnisse einschließlich aller Auswirkungen auf das Testergebnis, die auf Abweichungen von dieser Prüfmethode zurückzuführen sind.
(1) ASTM International.(2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415- 91 (neu genehmigt 1998). S. 733-742. In: Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA.
(2) US EPA - United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., "Public draft". EPA 712-C-96-156.8 S.
(3) AFNOR - Association Française de Normalisation.(1996). XP T 90-337: Détermination de l"inhibition de la croissance de Lemna minor. 10 S.
(4) SSI - Swedish Standards Institute.(1995). Water quality - Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13.15 S. (Schwedisch).
(5) Environment Canada.(1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37 - 120 S.
(6) Environment Canada.(1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation.Canadian Wildlife Service, Technical Report Series No. 145.
(7) Sims, I., Whitehouse, P., und Lacey, R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ringtesting of draft OECD Test Guideline.R&D Technical Report EMA 003.WRc plc - Environment Agency.
(8) OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 23.Organisation for Economic Cooperation and Development, Paris.
(9) Internationale Organisation für Normung. ISO DIS 20079. Wasserbeschaffenheit - Bestimmung der toxischen Wirkung von Wasserinhaltsstoffen und Abwasser gegenüber Wasserlinsen (Lemna minor) - Wasserlinsen- Wachstumshemmtest.
(10) Walbridge C. T. (1977). A flowthrough testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory - Duluth, Minnesota 55804.US EPA Report No. EPA-600/3-77.108. September 1977.
(11) Lockhart, W.L., Billeck, B. N., und Baron, C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353 - 359.
(12) Huebert, D.B. and Shay J.M.(1993) Considerations in the assessment of toxicity using duckweeds.Environmental Toxicology and Chemistry, 12, 481-483.
(13) Christensen, E.R., , Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713-718.
(14) Nyholm, N. Sørensen, P.S., Kusk, K.O., und Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157-167.
(15) Bruce, R.D., und Versteeg, D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485-1494.
(16) OECD. (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Organisation for Economic Cooperation and Development, Paris.
(17) Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity:The ICp approach. National Effluent Toxicity Assessment center Technical Report 05-88. US EPA, Duluth, MN.
(18) Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096-1121.
(19) Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482-491.
(20) Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
(21) Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 519- 531.
(22) Brain, P., und Cousens, R. (1989). An equation to describe doseresponses where there is stimulation of growth at low doses. Weed Research, 29, 93-96.
| Begriffsbestimmungen | Anlage 1 |
Bei dieser Prüfmethode werden die folgenden Begriffsbestimmungen zugrunde gelegt und folgende Abkürzungen verwendet:
Biomasse: Trockenmasse des in einer Population enthaltenen lebenden Materials; bei diesem Test werden typischerweise Surrogate für die betreffende Biomasse (z.B. Frondzahl oder Frondfläche) gemessen; entsprechend bezieht sich der Begriff ,Biomasse" auch auf diese Surrogatparameter.
Chemikalie: ein Stoff oder eine Mischung. Chlorose: Gelbfärbung des Blattmaterials.
Klon: ein Organismus oder eine Zelle, der bzw. die durch geschlechtslose Reproduktion aus einem einzelnen Organismus gewonnen wurde; aus demselben Klon gewonnene Organismen sind entsprechend genetisch identisch.
Kolonie: Gesamtheit der miteinander verbundenen Mutter- und Tochter-Fronds (gewöhnlich 2 bis 4); gelegentlich auch als Pflanze bezeichnet.
ECx: Konzentration der im Prüfmedium aufgelösten Prüfchemikalie, bei der sich binnen einer festgelegten Expositionsdauer eine Reduzierung des Wachstums von Lemna um x % (z.B. 50 %) ergibt. (Die Expositionsdauer ist ausdrücklich zu nennen, wenn die Dauer von der vollständigen oder normalen Testdauer abweicht.) Um einen von der Wachstumsrate oder vom Zellertrag abweichenden EC-Wert eindeutig zu kennzeichnen, wird die Bezeichnung ,ErC" für die Wachstumsrate und ,EyC" für den Zellertrag jeweils gefolgt von der verwendeten Messvariablen (z.B. ErC [ Frondzahl]) verwendet.
Durchflusstest: ein Test, bei dem die Testlösungen kontinuierlich ersetzt werden.
Frond: eine separate/einzelne ,blattartige" Struktur einer Wasserlinsen-Pflanze; kleinste reproduktionsfähige Einheit (d. h. einzelner Organismus).
Aufwölbungen: Fronds mit einer Wölbung oder Schwellung.
Wachstum: Zunahme der Messvariablen, z.B. Frondzahl, Trockenmasse, Feuchtmasse oder Frondfläche während der Testdauer.
Wachstumsrate (durchschnittliche spezifische Wachstumsrate): logarithmische Zunahme der Biomasse während der Expositionsdauer.
Niedrigste Konzentration mit beobachteter Wirkung (LOEC): niedrigste geprüfte Konzentration, bei der beobachtet wurde, dass die Chemikalie binnen einer bestimmten Expositionsdauer gegenüber der Kontrollprobe eine statistisch signifikante Wachstumsreduzierung bewirkt (bei p < 0,05); allerdings müssen sämtliche Testkonzentrationen über der LOEC schädliche Folgen haben, die mindestens den bei der LOEC beobachteten schädlichen Folgen gleichwertig sind. Wenn diese beiden Bedingungen nicht erfüllt werden können, ist umfassend darzulegen, warum die LOEC (und entsprechend die NOEC) gewählt wurde.
Messvariablen: alle Variablentypen, die gemessen werden, um mit mindestens einer Reaktionsvariablen den Endpunkt des Tests zu beschreiben; Messvariablen bei dieser Methode sind Frondzahl, Frondfläche, Frischmasse und Trockenmasse.
Monokultur: Kultur mit einer Pflanzenart.
Nekrose: totes (d. h. weißes oder mit Wasser durchfeuchtetes) Blattmaterial.
Höchste geprüfte Konzentration ohne beobachtete schädliche Wirkung (NOEC): Testkonzentration unmittelbar unterhalb der LOEC.
Phänotyp: zu beobachtende Merkmale eines Organismus, die durch Interaktion der Gene dieses Organismus mit seiner Umgebung bestimmt werden.
Reaktionsvariablen: Variablen für die geschätzte Toxizität, abgeleitet aus beliebigen gemessenen Variablen zur Beschreibung der Biomasse durch verschiedene Berechnungsmethoden; bei dieser Prüfmethode sind die Wachstumsraten und der Zellertrag Reaktionsvariablen, die aus Messvariablen wie z.B. Frondzahl, Frondfläche, Frischmasse oder Trockenmasse abgeleitet werden.
Semistatischer (Erneuerungs-)test: Test, bei dem die Testlösung während der Testdauer regelmäßig in bestimmten Intervallen erneuert wird.
Statischer Test: Testmethode, bei der die Testlösung während der Testdauer nicht erneuert wird. Prüfchemikalie: ein beliebiger Stoff oder eine Mischung, der bzw. die nach dieser Methode geprüft wird.
Endpunkt des Tests: beschreibt den allgemeinen Faktor, der bezogen auf die Kontrolle als Testziel durch die Prüfchemikalie verändert wird; bei dieser Prüfmethode wird als Endpunkt des Tests die Wachstumshemmung angenommen; diese kann durch verschiedene Reaktionsvariablen ausgedrückt werden, die jeweils auf mindestens einer Messvariablen beruhen.
Prüfmedium: gesamtes synthetisches Nährmedium, in dem die zu prüfenden Pflanzen wachsen, wenn sie der Prüfchemikalie ausgesetzt werden; die Prüfchemikalie wird im Allgemeinen im Prüfmedium aufgelöst.
Zellertrag: Wert einer Messvariablen zur Beschreibung der Biomasse am Ende der Expositionsdauer abzüglich der Messvariablen am Anfang der Expositionsdauer.
| Beschreibung Lemna spp. | Anlage 2 |
Die gemeinsprachlich als Wasserlinse (Lemna spp.) bezeichnete Wasserpflanze zählt zur Familie der Lemnaceae, die weltweit in vier Gattungen mit verschiedenen Arten vorkommt. Das jeweilige Aussehen und die Taxonomie wurden umfassend dokumentiert (1)(2). Lemna gibba und L. minor sind für gemäßigte Regionen typische Arten; diese Arten werden häufig in Toxizitätstests verwendet. Beide Arten besitzen einen treibenden oder auch untergetauchten Stängel (Frond); von der Mitte der Unterseite der Fronds geht jeweils eine sehr dünne Wurzel aus. Lemna spp. bilden selten Blüten aus; die Pflanzen vermehren sich durch Austrieb neuer Fronds (3). Im Vergleich zu älteren Pflanzen sind jüngere Pflanzen eher blasser, besitzen kürzere Wurzeln und bestehen aus zwei bis drei Fronds unterschiedlicher Größe. Dank der geringen Größe, des einfachen Aufbaus, der geschlechtslosen Reproduktion und der kurzen Generationsdauer ist Lemna für Labortests in besonderer Weise geeignet (4)(5).
Da von unterschiedlichen Empfindlichkeiten der verschiedenen Arten auszugehen ist, sind ausschließlich Vergleiche der Empfindlichkeit jeweils einer einzigen Art annehmbar.
Beispiele für Lemna-Arten, die in Tests verwendet wurden: Artenreferenz
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2.Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys.Chem., 29: 935-941.
Lemna minor: United States Environmental Protection Agency (US EPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., "Public draft". EPA 712-C-96-156.8 S.
Association Française de Normalisation (AFNOR).(1996). XP T 90-337: Détermination de l"inhibition de la croissance de Lemna minor. 10 S.
Swedish Standards Institute (SIS).(1995). Water quality - Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13.15 S. (Schwedisch).
Lemna gibba: ASTM International.(2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415-91 (neu genehmigt 1998). S. 733-742.
United States Environmental Protection Agency (US EPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., , Public draft". EPA 712-C-96-156. 8 S.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch.Environ. Contam.Toxicol., 10:1959-1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol.Environ. Saf., 5:87-96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481- 483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds.Verh.-Int.Ver.Limnol., 19:2102-2111.
Bezugsquellen für Lemna-Arten
University of Toronto Culture Collection of Algae and Cyanobacteria
Department of Botany, University of Toronto
Toronto, Ontario, Kanada, M5S 3 B2
Telefon: +1-416-978-3641
Telefax:+1-416-978-5878
E-Mail: jacreman@botany.utoronto.ca
North Carolina State University
Forestry Dept
Duckweed Culture Collection Campus Box 8002
Raleigh, NC 27695-8002 United States
Telefon +1.919 515-7572 astomp@unity.ncsu.edu
Institute of Applied Environmental Research (ITM) Stockholm University
SE-106 91
Stockholm
SCHWEDEN
Telefon: +46 8.674 7240
Fax +46 8.674 7636
Umweltbundesamt (UBA)
FG III 3.4
Schichauweg 58 12307 Berlin
DEUTSCHLAND E-Mail: Lemna@uba.de
(1) Hillman, W.S.(1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221-287.
(2) Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanisches Inst. ETH, Stiftung Rubel, Zürich, Schweiz.
(3) Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82-991150-0-0. The Agricultural Research Council of Norway, University of Oslo.
(4) Wang, W.(1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1-14.
(5) Wang, W.(1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7-22.
| Haltung der Stammkultur | Anlage 3 |
Die Stammkulturen können über längere Zeiträume bei niedrigeren Temperaturen (4-10 °C) gebrauchsfähig gelagert werden. Das Lemna-Nährmedium kann identisch mit dem für die Tests verwendeten Nährmedium sein; für Stammkulturen können jedoch auch andere nährstoffreiche Medien verwendet werden.
Regelmäßig wird eine gewisse Anzahl junger, hellgrüner Pflanzen entnommen und mit einem keimfreien Verfahren in neue Kulturgefäße mit einem frischen Medium gebracht. Unter den hier empfohlenen kühleren Bedingungen können in Intervallen von bis zu drei Monaten Teilkulturen hergestellt werden.
In den Prüfungen werden chemische reine (mit Säure gereinigte) und sterile gläserne Kulturgefäße verwendet, die keimfrei zu handhaben sind. Bei einer Verunreinigung der Stammkultur (z.B. durch Algen oder Pilze) sind entsprechende Schritte zur Entfernung der verunreinigenden Organismen erforderlich. Algen und die meisten sonstigen verunreinigenden Organismen können durch eine Oberflächensterilisation entfernt werden. Von dem verunreinigten Pflanzenmaterial wird eine Probe genommen, und die Wurzeln werden abgeschnitten. Das Material wird kräftig in sauberem Wasser geschüttelt und dann 30 Sekunden bis 5 Minuten in eine 0,5 %ige Natriumhypochloridlösung (v/v) getaucht. Danach wird das Pflanzenmaterial mit sterilem Wasser gespült und in mehreren Schritten in Kulturgefäße jeweils mit frischem Nährmedium gebracht. Bei dieser Behandlung werden viele Fronds sterben, besonders bei längerer Expositionsdauer; einige der überlebenden Fronds sollten jedoch frei von Verunreinigungen sein. Diese Fronds können zur Impfung neuer Kulturen verwendet werden.
| Medien | Anlage 4 |
Für L. minor und L. gibba werden unterschiedliche Nährmedien empfohlen. Für L. minor sollte ein modifiziertes schwedisches Standardmedium (SIS) verwendet werden; für L. gibba ist das Medium 20X AAP zu empfehlen. Die Zusammensetzungen beider Medien werden im Folgenden beschrieben. Bei der Herstellung dieser Medien sind chemische Stoffe in Reagenzien- oder Analysequalität und entionisiertes Wasser zu verwenden.
Schwedisches Standard-Lemna-Nährmedium (SIS)
- Die Stammlösungen I-V werden durch Autoklavieren (120 °C, 15 Minuten) oder durch Membranfiltration (Porengröße ca. 0,2 µm) sterilisiert.
- Die Stammlösung VI (sowie optional Stammlösung VII) ist ausschließlich durch Membranfiltration zu sterilisieren; diese Lösungen sollten nicht autoklaviert werden.
- Sterile Stammlösungen werden kühl und dunkel gelagert. Die Stammlösungen I-V sind nach sechs Monaten zu entsorgen; die Stammlösung VI (sowie optional Stammlösung VII) kann einen Monat gelagert werden.
| Stamm- lösung Nr. | Stoff | Konzentration in der Stammlösung (g/l) | Konzentration im hergestellten Medium(mg/·l) | Hergestelltes Medium | |
| Element | Konzentration (mg/·l) | ||||
| I | NaNO3 | 8,50 | 85 | Na; N | 32; 14 |
| KH2PO4 | 1,34 | 13,4 | K; P | 6,0; 2,4 | |
| II | MgSO4·7H2O | 15 | 75 | Mg; S | 7,4; 9,8 |
| III | CaCl2·2H2O | 7,2 | 36 | Ca; Cl | 9,8; 17,5 |
| IV | Na2CO3 | 4,0 | 20 | C | 2,3 |
| V | H3BO3 | 1,0 | 1,00 | B | 0,17 |
| MnCl2·4H2O | 0,20 | 0,20 | Mn | 0,056 | |
| Na2MoO4·2H2O | 0,010 | 0,010 | Mo | 0,0040 | |
| ZnSO0·7H2O | 0,050 | 0,050 | Zn | 0,011 | |
| CuSO4·5H2O | 0,0050 | 0,0050 | Cu | 0,0013 | |
| Co(NO3)2·6H2O | 0,010 | 0,010 | Co | 0,0020 | |
| VI | FeCl3·6H2O | 0,17 | 0,84 | Fe | 0,17 |
| Na2-EDTA 2H2O | 0,28 | 1,4 | - | - | |
| VII | MOPS (Puffer) | 490 | 490 | - | - |
Um einen Liter SIS-Medium herzustellen, werden die folgenden Inhaltsstoffe zu 900 ml entionisiertem Wasser hinzugegeben:
- 10 ml Stammlösung I
- 5 ml Stammlösung II
- 5 ml Stammlösung III
- 5 ml Stammlösung IV
- 1 ml Stammlösung V
- 5 ml Stammlösung VI
- 1 ml Stammlösung VII (optional)
Hinweis: Bei bestimmten Prüfchemikalien kann eine weitere Stammlösung VII (MOPS-Pufferlösung) erforderlich sein (siehe Nummer 11).
Der pH-Wert wird wahlweise mit 0,1 oder 1 mol HCl oder NaOH auf 6,5 ± 0,2 eingestellt; durch Zugabe von entionisiertem Wasser wird ein Volumen von einem Liter hergestellt.
Nährmedium 20X AAP
Die Stammlösungen werden in sterilem destilliertem oder entionisiertem Wasser hergestellt.
Sterile Stammlösungen werden kühl und dunkel gelagert. Unter diesen Bedingungen beträgt die Lagerfähigkeit der Stammlösungen mindestens 6-8 Wochen.
Für das Medium 20X AAP werden fünf Stamm-Nährlösungen (A1, A2, A3, B und C) hergestellt; dabei sind chemische Stoffe mit Reagenzienqualität zu verwenden. Jeweils 20 ml der Stamm-Nährlösungen werden zu etwa 850 ml entionisiertem Wasser hinzugegeben, um das Nährmedium herzustellen. Der pH-Wert wird wahlweise mit 0,1 oder 1 mol HCl oder NaOH auf 7,5 ± 0,1 eingestellt; durch Zugabe von entionisiertem Wasser wird ein Volumen von einem Liter hergestellt. Anschließend wird das Medium durch einen Membranfilter mit einer Porengröße von (etwa) 0,2 µm in ein steriles Behältnis gefiltert.
Das für die Prüfung vorgesehene Nährmedium ist 1-2 Tage vor der Verwendung herzustellen, damit sich der pH- Wert stabilisieren kann. Der pH-Wert des Nährmediums muss vor der Verwendung geprüft und ggf. durch Zugabe von 0,1 oder 1 mol NaOH oder HCl wie oben beschrieben korrigiert werden.
| Stamm- lösung Nr. | Stoff | Konzentration in der Stammlösung (g/·l) (*) | Konzentration im hergestellten Medium (mg/·l) * | Hergestelltes Medium | |
| Element | Konzentration (mg/·l) * | ||||
| A1 | NaNO3 | 26 | 510 | Na; N | 190; 84 |
| MgCl2·6H2O | 12 | 240 | Mg | 58,08 | |
| CaCl2·2H2O | 4.4 | 90 | Ca | 24,04 | |
| A2 | MgSO4·7H2O | 15 | 290 | S | 38,22 |
| A3 | K2HPO4·3H2O | 1,4 | 30 | K; P | 9,4; 3,7 |
| B | H3BO3 | 0,19 | 3,7 | B | 0,65 |
| MnCl2·4H2O | 0,42 | 8,3 | Mn | 2,3 | |
| FeCl3·6H2O | 0,16 | 3,2 | Fe | 0,66 | |
| Na2EDTA·2H2O | 0,30 | 6,0 | - | - | |
| ZnCl2 | 3,3 mg/l | 66 µg/l | Zn | 31 µg/l | |
| CoCl2·6H2O | 1,4 mg/l | 29 µg/l | Co | 7,1 µg/l | |
| Na2MoO4·2H2O | 7,3 mg/l | 145 µg/l | Mo | 58 µg/l | |
| CuCl2·2H2O | 0,012 mg/l | 0,24 µg/l | Cu | 0,080 µg/l | |
| C | NaHCO3 | 15 | 300 | Na; C | 220; 43 |
| *) Wenn nicht anders angegebe
Fußnote: Die theoretisch geeignete Bicarbonat-Endkonzentration (bei der eine nennenswerte Anpassung des pH-Werts nicht erforderlich ist) liegt bei 15 mg/l (und nicht bei 300 mg/l). Trotzdem wird das Medium 20X-AAP - auch im Ringtest dieser Leitlinie - in einer Konzentration von 300 mg/l verwendet. (I. Sims, P. Whitehouse und R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ringtesting of draft OECD Test Guideline. R&D Technical Report EMA 003.WRc plc - Environment Agency.) | |||||
STEINBERG-Medium (nach ISO 20079)
Konzentrationen und Stammlösungen
Das modifizierte Steinberg-Medium ist in ISO 20079 nur für Lemna minor vorgesehen (da dort ausschließlich Lemna minor zugelassen wird); in Tests wurden gute Ergebnisse aber auch mit Lemna gibba erzielt.
Bei der Herstellung des Mediums werden chemische Stoffe in Reagenzien- oder Analysequalität und entionisiertes Wasser verwendet.
Das Nährmedium ist aus Stammlösungen oder aus dem 10fach konzentrierten Medium herzustellen, damit ohne Ausfällungen eine größtmögliche Konzentration des Mediums erzielt werden kann.
Tabelle 1: STEINBERG-Medium mit stabilisiertem pH-Wert (modifiziert nach Altenburger)
| Bestandteil | Nährmedium | ||
| Makroelemente | Molmasse | mg/l | mmol/l |
| KNO3 | 101,12 | 350,00 | 3,46 |
| Ca(NO3)2 · 4H2O | 236,15 | 295,00 | 1,25 |
| KH2PO4 | 136,09 | 90,00 | 0,66 |
| K2HPO4 | 174,18 | 12,60 | 0,072 |
| MgSO4 · 7H2O | 246,37 | 100,00 | 0,41 |
| Bestandteil | Nährmedium | ||
| Mikroelemente | Molmasse | µg/l | µmol/l |
| H3BO3 | 61,83 | 120,00 | 1,94 |
| ZnSO4 · 7H2O | 287,43 | 180,00 | 0,63 |
| Na2MoO4 · 2H2O | 241,92 | 44,00 | 0,18 |
| MnCl2 · 4H2O | 197,84 | 180,00 | 0,91 |
| FeCl3 · 6H2O | 270,21 | 760,00 | 2,81 |
| EDTA-Dinatrium-Dihydrat | 372,24 | 1.500,00 | 4,03 |
Tabelle 2: Stammlösungen (Makroelemente)
| 1. Makroelemente (50fach konzentriert) | g/l |
| Stammlösung 1: | |
| KNO3 | 17,50 |
| KH2PO4 | 4,5 |
| K2HPO4 | 0,63 |
| Stammlösung 2: | |
| MgSO4 · 7H2O | 5,00 |
| Stammlösung 3: | |
| Ca(NO3)2 · 4H2O | 14,75 |
Tabelle 3: Stammlösungen (Mikroelemente)
| 2. Mikroelemente (1.000fach konzentriert) | mg/l |
| Stammlösung 4: | |
| H3BO3 | 120,0 |
| Stammlösung 5: | |
| ZnSO4 · 7H2O | 180,0 |
| Stammlösung 6: | |
| Na2MoO4 · 2H2O | 44,0 |
| 2. Mikroelemente (1.000fach konzentriert) | mg/l |
| Stammlösung 7: | |
| MnCl2 · 4H2O | 180,0 |
| Stammlösung 8: | |
| FeCl3 · 6H2O | 760,00 |
| EDTA-Dinatrium-Dihydrat | 1.500,00 |
- Die Stammlösungen 2 und 3 sowie getrennt auch die Stammlösungen 4 bis 7 können gepoolt werden. (Dabei sind die jeweils erforderlichen Konzentrationen zu berücksichtigen.)
- Um die Lagerfähigkeit zu verlängern, sind die Stammlösungen 20 Minuten bei 121 °C zu autoklavieren oder einer Sterilfiltration (Porengröße 0,2 µm) zu unterziehen. Für die Stammlösung 8 wird eine Sterilfiltration (0,2 µm) nachdrücklich empfohlen.
Herstellung der Endkonzentration des STEINBERG-Mediums (modifiziert)
- Zu 20 ml der Stammlösungen 1, 2 und 3 (siehe Tabelle 2) werden etwa 900 ml entionisiertes Wasser zugegeben, um eine Ausfällung zu vermeiden.
- Von den Stammlösungen 4, 5, 6, 7 und 8 wird jeweils 1,0 ml hinzugegeben (siehe Tabelle 3).
- Der pH-Wert wird durch Zugabe eines minimalen Volumens einer NaOH- oder HCl-Lösung auf 5,5 ± 0,2 eingestellt.
- Anschließend werden die Lösungen mit Wasser auf ein Volumen von 1.000 ml aufgefüllt.
- Wenn die Stammlösungen sterilisiert werden und geeignetes Wasser verwendet wird, ist eine weitere Sterilisierung nicht mehr erforderlich. Wird das endgültige Medium sterilisiert, wird nach dem Autoklavieren (20 Minuten bei 121 °C) die Stammlösung 8 hinzugegeben.
Herstellung des 10fach konzentrierten STEINBERG-Mediums (modifiziert) zur Zwischenlagerung
- Zu 20 ml der Stammlösungen 1, 2 und 3 (siehe Tabelle 2) werden etwa 30 ml entionisiertes Wasser zugegeben, um eine Ausfällung zu vermeiden.
- Von den Stammlösungen 4, 5, 6, 7 und 8 wird jeweils 1,0 ml hinzugegeben (siehe Tabelle 3). Anschließend werden die Lösungen mit Wasser auf ein Volumen von 100 ml aufgefüllt.
- Wenn die Stammlösungen sterilisiert werden und geeignetes Wasser verwendet wird, ist eine weitere Sterilisierung nicht mehr erforderlich. Wird das endgültige Medium sterilisiert, wird nach dem Autoklavieren (20 Minuten bei 121 °C) die Stammlösung 8 hinzugegeben.
- Der pH-Wert des Mediums in der Endkonzentration beträgt 5,5 ± 0,2.
 | weiter . |  |
...
X
⍂
↑
↓
