umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (27)
 | zurück |
C.5 Abbaubarkeit - Biochemischer Sauerstoffbedarf
1. Methode
1.1 Einleitung
Zweck des Verfahrens ist die Messung des biochemischen Sauerstoffbedarfs (BSB) fester oder flüssiger organischer Substanzen.
Die mit diesem Verfahren erzielbaren Prüfergebnisse gelten in erster Linie für wasserlösliche Substanzen; flüchtige und in Wasser schwer lösliche Verbindungen können zumindest grundsätzlich auch mit diesem Verfahren geprüft werden.
Die Methode ist nur für solche organischen Substanzen anwendbar, die bei den im Test verwendeten Konzentrationen keine bakterienhemmende Wirkung haben. Ist eine Substanz bei der Prüfkonzentration nicht löslich, so sind gegebenenfalls besondere Verfahren wie Ultraschalldispersion anzuwenden, um eine ausreichende Dispersion der Prüfsubstanz sicherzustellen.
Angaben zur Toxizität der Prüfsubstanz können bei der Interpretation niedriger Ergebnisse und bei der Auswahl der geeigneten Testkonzentrationen von Nutzen sein.
1.2 Definitionen und Einheiten
Der biochemische Sauerstoffbedarf (BSB) wird definiert als die Menge an gelöstem Sauerstoff, die zur biochemischen Oxidation einer bestimmten Menge einer gelösten Substanz unter den vorgeschriebenen Bedingungen notwendig ist.
Die Ergebnisse werden dargestellt als g biochemischer Sauerstoffbedarf (BSB) pro g Prüfsubstanz.
1.3 Referenzsubstanzen
Es wird empfohlen, eine geeignete Referenzsubstanz zur Überprüfung der Inokulumaktivität zu verwenden.
1.4 Prinzip der Methode
Eine vorher bestimmte Menge der Prüfsubstanz wird in einem geeigneten sauerstoffreichen Medium gelöst oder dispergiert und anschließend mit einem Inokulum angeimpft sowie bei einer konstanten Umgebungstemperatur im Dunkeln inkubiert.
Der BSB wird aus der Differenz des Gehalts an gelöstem Sauerstoff vor Beginn und nach Ende des Tests bestimmt. Die Testdauer muss mindestens 5 Tage, darf jedoch nicht mehr als 28 Tage betragen.
Parallel zu diesem Test ist ein Blindversuch ohne die Prüfsubstanz durchzuführen.
1.5 Qualitätskriterien
Die BSB-Bestimmung kann nicht als valide Bestimmung der biologischen Abbaubarkeit eines Stoffes angesehen werden. Dieser Test ist nur als "Screening"-Test zu betrachten.
1.6 Beschreibung der Methode
Je nach Prüfverfahren wird eine Lösung oder Dispersion der Prüfsubstanz in einer geeigneten Konzentration vorbereitet. Dann wird der BSB nach einem geeigneten national oder international standardisierten Verfahren ermittelt.
2. Daten und Auswertung
Der in der Lösung enthaltene BSB wird entsprechend dem gewählten Standardverfahren berechnet und in g Sauerstoffbedarf/g Prüfsubstanz umgerechnet.
3. Abschlussbericht
Die angewandte Methode ist anzugeben.
Als biochemischer Sauerstoffbedarf ist der Mittelwert von mindestens drei gültigen Messergebnissen anzugeben.
Alle für die Interpretation der Ergebnisse wichtigen Informationen und Bemerkungen sind anzugeben, insbesondere hinsichtlich Verunreinigungen, Aggregatzustand, toxischer Wirkungen und inhärenter Zusammensetzung der Prüfsubstanz, die die Ergebnisse beeinflussen können.
Wird ein Zusatz zur Hemmung der biologischen Nitrifikation verwendet, muss dies angegeben werden.
4. Literatur
Verzeichnis der standardisierten Verfahren, z.B.
NF T 90-103: Determination of the Biochemical Oxygen Demand.
NBN 407: Biochemical Oxygen Demand.
NEN 3235 5.4: Bepaling van het biochemisch zuurstofverbruik (BZV).
The Determination of Biochemical Oxygen Demand (Methods for the examination of Water and Associated Materials, HMSO, London).
ISO 5815: Determination of biochemical oxygen demand after n days.
C.6 Abbaubarkeit - Chemischer Sauerstoffbedarf
1. Methode
1.1 Einleitung
Zweck des Verfahrens ist die Messung des chemischen Sauerstoffbedarfs (CSB) fester oder flüssiger organischer Stoffe unter bestimmten standardisierten Laborbedingungen.
Zur Durchführung dieses Tests sowie zur Interpretation der Testergebnisse sind Angaben über die chemische Formel der Prüfsubstanz von Nutzen (z.B. der Gehalt an Halogensalzen, Eisensalze organischer Substanzen oder chlorierten Kohlenwasserstoffen).
1.2 Definitionen und Einheiten
Der chemische Sauerstoffbedarf ist ein Maß für die Oxidierbarkeit einer Substanz, ausgedrückt als diejenige Sauerstoffmenge eines oxidierenden Reagenzmittels, die eine Prüfsubstanz unter definierten Laborbedingungen verbraucht.
Das Testergebnis wird in g chemischer Sauerstoffverbrauch/g Prüfsubstanz angegeben.
1.3 Referenzsubstanzen
Referenzsubstanzen müssen nicht immer bei der Prüfung neuer Stoffe eingesetzt werden. Sie sollten jedoch von Zeit zu Zeit primär zur Eichung der Messmethode benutzt werden, um auf diese Weise eine Vergleichbarkeit der Ergebnisse, die mit anderen Methoden erzielt wurden, zu ermöglichen.
1.4 Prinzip der Methode
Eine vorher bestimmte Menge in Wasser gelöster oder dispergierter Substanz wird mit Kaliumdichromat in einem starken Schwefelsäuremedium in Gegenwart von Silbersulfat als Katalysator unter Rückfluss über zwei Stunden lang oxidiert. Das restliche Dichromat wird durch Titration mit standardisiertem Ammoniumeisen(II) sulfat bestimmt.
Im Falle chlorhaltiger Substanzen wird zur Vermeidung von Störungen durch Chloride Quecksilbersulfat * zugefügt.
1.5 Qualitätskriterien
Wegen der willkürlichen Art des Nachweises ist der chemische Sauerstoffbedarf ein "Oxidierbarkeitsindikator" und wird als solcher als praktischer Parameter zur Messung des Gehalts an organischer Substanz verwendet.
Chloride können das Testergebnis verfälschen. Anorganische Reduktions- oder Oxidationsmittel können die Bestimmung des chemischen Sauerstoffbedarfs ebenfalls stören.
Einige zyklische Verbindungen und zahlreiche flüchtige Substanzen (z.B. niedere Fettsäuren) werden in diesem Test nicht vollständig oxidiert.
1.6 Beschreibung der Methode
Zuerst wird eine Lösung oder eine Dispersion der Testsubstanz hergestellt, um einen CSB zwischen 250 und 600 mg/l zu erzielen.
Bemerkung:
Im Falle schwerlöslicher oder nicht dispergierbarer Substanzen kann eine bestimmte Menge pulverförmiger oder flüssiger Prüfsubstanz entsprechend einem CSB von 5 mg abgewogen werden und in die Versuchsgefäße mit Wasser gegeben werden.
Der chemische Sauerstoffbedarf (CSB) wird häufig und besonders bei schwerlöslichen Substanzen vorzugsweise mit Hilfe einer Variante des Verfahrens bestimmt, d. h. in einem geschlossenen System mit Druckausgleich (H. Kelkenberg, 1975). Mit diesem modifiziertem Verfahren können Substanzen, die mit dem herkömmlichen Verfahren nur schwer zu bestimmen sind - wie z.B. Essigsäure, in vielen Fällen erfolgreich quantifiziert werden. Diese Methode versagt jedoch im Fall von Pyridin. Wird die Kaliumdichromatkonzentration, wie in (1) vorgeschrieben, auf 0,25 N (0,0416 M) erhöht, wird die Direkteinwaage von 5-10 mg Substanz erleichtert, was für die CSB-Bestimmung schwer wasserlöslicher Substanzen wichtig ist (2).
Ansonsten kann der CSB nach jedem geeigneten nationalen oder internationalen standardisierten Verfahren bestimmt werden.
2. Daten und Auswertung
Der in den Versuchsflaschen auftretende CSB-Wert wird mit Hilfe der jeweils gewählten standardisierten Methode berechnet und in g chemischen Sauerstoffbedarfs pro g Testsubstanz ausgedrückt.
3. Abschlussbericht
Die verwendete Referenzmethode ist anzugeben.
Der chemische Sauerstoffbedarf sollte aus mindestens drei Messwerten gemittelt werden. Der Bericht sollte alle für die Interpretation der Messergebnisse relevanten Informationen und Bemerkungen enthalten, die die Testergebnisse beeinflussen könnten, z.B. Verunreinigungen der Prüfsubstanz, physikalischer Zustand und die Zusammensetzung der Substanz (falls bekannt).
Die Verwendung von Quecksilbersulfat zur Verminderung von Störungen durch Chlorid muss erwähnt werden.
4. Literatur
(1) Kelkenberg, H. Z. von Wasser und Abwasserforschung, 1975, vol. 8, 146.
(2) Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13,169.
Liste der standardisierten Verfahren, z.B.:
NBN T 91-201 Determination of the chemical oxygen demand.
ISBN 0 11 7512494 Chemical oxygen demand (dichromate value) of polluted and waste waters.
NF T 90-101 Determination of the chemical oxygen demand.
DS 217 - water analysis Determination of the chemical oxygen demand.
DIN 38409-H-41 Determination of the chemical oxygen demand (COD) within the range above 15 mg per litre.
NEN 3235 5.3 Bepaling von het chemisch zuurstofverbruik.
ISO 6060 Water quality: chemical oxygen demand dichromate methods.
...
*) Nach der Verwendung sollten Quecksilbersalz enthaltende Lösungen zur Vermeidung des Eintrags von Quecksilber in die Umwelt behandelt werden.
C.7 Abbaubarkeit - Abiotischer Abbau: Hydrolyse in Abhängigkeit vom pH-Wert
1. Methode
Diese Testmethode entspricht OECD TG 111 (2004).
1.1 Einleitung
Chemikalien können auf unterschiedlichen Wegen in Oberflächengewässer gelangen, z.B. durch direkte Applikation, Sprühmittelabtrift, Ablauf, Entwässerung, Abfallentsorgung, Industrie-, Haushalts- oder Landwirtschaftsabwässer oder über atmosphärische Deposition, und können in diesen Gewässern durch chemische (z.B. Hydrolysereaktionen, Oxidation), fotochemische und/oder mikrobielle Prozesse umgewandelt werden. In der vorliegenden Richtlinie wird eine Labortestmethode zur Beurteilung der abiotischen hydrolytischen Umwandlung von Chemikalien in Wassersystemen bei pH-Werten beschrieben, wie sie normalerweise in der Umwelt vorkommen (pH 4-9); diese Richtlinie stützt sich auf bestehende Richtlinien (1) (2) (3) (4) (5) (6) (7).
Durch diese Tests soll i) die Hydrolysegeschwindigkeit der Testsubstanz in Abhängigkeit vom pH-Wert und ii) die Beschaffenheit bzw. Art sowie die Geschwindigkeit der Entstehung und des Rückgangs von Hydrolyseprodukten ermittelt werden, denen die Organismen ausgesetzt sein können. Derartige Studien sind für Chemikalien erforderlich, die direkt dem Wasser zugesetzt werden oder voraussichtlich durch die sonstigen oben beschriebenen Wege in die Umwelt gelangen.
1.2 Definitionen und Einheiten
Siehe Anlage 2.
1.3 Anwendungsbereich der Testmethode
Die Testmethode ist generell auf (markierte oder unmarkierte) chemische Substanzen anwendbar, für die eine Analysemethode mit ausreichender Genauigkeit und Empfindlichkeit zur Verfügung steht. Sie kann Anwendung finden für leicht flüchtige und nichtflüchtige Verbindungen mit ausreichender Wasserlöslichkeit. Der Test darf dagegen an Chemikalien, die in Wasser hochgradig flüchtig sind (z.B. Fumiganzien, organische Lösungsmittel) und daher unter den Versuchsbedingungen dieses Tests nicht in Lösung gehalten werden können, nicht durchgeführt werden. Die Durchführung des Tests an Substanzen, die in Wasser nur minimal löslich sind, ist möglicherweise nur erschwert möglich (8).
1.4 Prinzip der Testmethode
Sterile wässrige Pufferlösungen mit unterschiedlichen pH-Werten (pH 4, 7 und 9) werden mit der Testsubstanz behandelt und im Dunkeln unter kontrollierten Laborbedingungen (bei konstanter Temperatur) inkubiert. Nach entsprechenden Zeitintervallen werden die Pufferlösungen auf die Testsubstanz und Hydrolyseprodukte analysiert. Bei Verwendung einer markierten Testsubstanz (z.B. mit 14C) lässt sich die Stoffbilanz leichter erstellen.
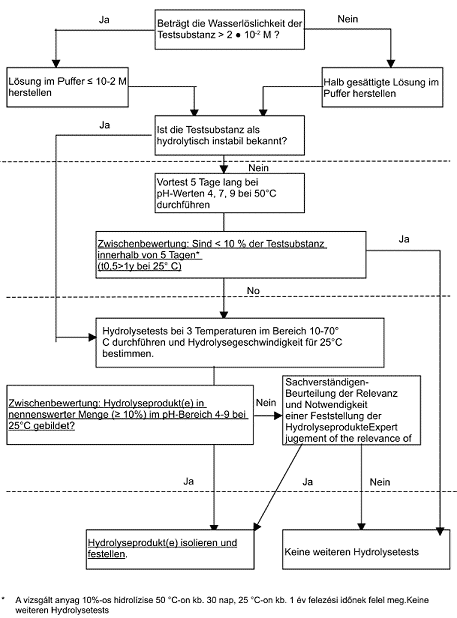
Diese Testmethode ist als mehrstufiges Konzept angelegt (siehe Darstellung und Erläuterung in Anlage 1). Die einzelnen Stufen des Tests werden durch die Ergebnisse der jeweils vorherigen Stufe gestartet.
1.5 Informationen zur Testsubstanz
Für die Messung der Hydrolysegeschwindigkeit können markierte oder nicht markierte Testsubstanzen verwendet werden. Normalerweise sollte vorzugsweise markiertes Material zur Messung der Hydrolysewege und zur Ermittlung der Stoffbilanz verwendet werden; in bestimmten Sonderfällen ist eine Markierung allerdings nicht unbedingt notwendig. Die Markierung mit 14C wird empfohlen, andere Isotope wie 13C, 15N oder 3H sind jedoch ggf. ebenfalls geeignet. Die Markierung ist - soweit möglich - im stabilsten Teil des Moleküls anzuordnen. Enthält die Testsubstanz beispielsweise einen Ring, muss die Markierung auf dem Ring erfolgen; enthält die Testsubstanz zwei oder mehr Ringe, sind evtl. separate Untersuchungen zum Verhalten der einzelnen markierten Ringe und zur Ermittlung geeigneter Informationen zur Bildung von Hydrolyseprodukten notwendig. Die Testsubstanz muss eine Reinheit von mindestens 95 % aufweisen.
Vor der Durchführung von Hydrolysetests müssen folgende Informationen zur Testsubstanz vorliegen:
- Löslichkeit in Wasser (Testmethode A.6),
- Löslichkeit in organischen Lösungsmitteln,
- Dampfdruck (Testmethode A.4) und/oder Konstante des Henryschen Gesetzes,
- Verteilungskoeffizient n-Oktanol/Wasser (Testmethode A.8);
- Dissoziationskonstante (pKa) (OECD-Richtlinie 112) (9);
- direkte und indirekte Fototransformationsgeschwindigkeit in Wasser (soweit relevant).
Es müssen Analysemethoden für die Quantifizierung der Testsubstanz sowie - sofern relevant - für die Identifizierung und Quantifizierung der Hydrolyseprodukte in wässrigen Lösungen zur Verfügung stehen (siehe auch Abschnitt 1.7.2).
1.6 Referenzsubstanzen
Soweit möglich, sollten Referenzsubstanzen zur Identifizierung und Quantifizierung von Hydrolyseprodukten durch Spektroskopie- und Chromatografieverfahren oder andere ausreichend genaue Methoden verwendet werden.
1.7 Qualitätskriterien
1.7.1 Wiederfindungsrate
Die Analyse von mindestens zwei Pufferlösungen oder deren Extrakten unmittelbar nach der Zugabe der Testsubstanz gibt einen ersten Hinweis auf die Wiederholbarkeit der Analysemethode und die gleichmäßige Verteilung der Testsubstanz bei der Applikation der Testsubstanz. Die Wiederfindungsraten für spätere Versuchsphasen ergeben sich aus den jeweiligen Massenbilanzen (bei Verwendung markierter Substanzen). Die Wiederfindungsraten müssen bei markierten und unmarkierten Chemikalien zwischen 90 % und 110 % liegen (7). Falls es sich als technisch schwierig erweist, diese Wiederfindungsrate zu erreichen, ist bei unmarkierten Chemikalien eine Wiederfindungsrate von 70 % zulässig, allerdings ist dies entsprechend zu begründen.
1.7.2 Wiederholbarkeit und Empfindlichkeit der Analysemethoden
Die Wiederholbarkeit der Analysemethode(n), die zur späteren Quantifizierung der Testsubstanz und der Hydrolyseprodukte verwendet werden, kann durch eine parallele Analyse derselben Pufferlösungen (oder ihrer Extrakte) überprüft werden, nachdem sich ausreichende Mengen an Hydrolyseprodukten für die Quantifizierung gebildet haben.
Die Analysemethode muss eine ausreichende Empfindlichkeit aufweisen, mit der die Quantifizierung der Konzentrationen der Testsubstanz bis auf 10 % der Anfangskonzentration oder weniger möglich ist. Sofern relevant, müssen die Analysemethoden außerdem eine ausreichende Empfindlichkeit für die Quantifizierung von Hydrolyseprodukten aufweisen, die 10 % der (zu einem beliebigen Zeitpunkt während der Studie) eingebrachten Konzentration oder mehr oder aber 25 % oder weniger der Spitzenkonzentration darstellt.
1.7.3 Konfidenzintervalle für Kinetikdaten der Hydrolyse
Die Konfidenzintervalle sind für sämtliche Regressionskoeffizienten, Geschwindigkeitskonstanten, Halbwertszeiten und sonstigen kinetischen Parameter rechnerisch zu ermitteln und darzustellen (z.B. DT50).
1.8 Beschreibung der Testmethode
1.8.1 Geräte und Apparatur
Die Untersuchung ist in Glasgefäßen (z.B. Reagenzgläser, kleine Kolben) unter abgedunkelten und sterilen Bedingungen (sofern erforderlich) durchzuführen, sofern nicht bereits vorliegende Informationen (wie der n-Oktanol-Wasser-Verteilungskoeffizient) darauf hindeuten, dass die Testsubstanz möglicherweise am Glas anhaftet. In diesen Fällen sollte die Verwendung alternativer Materialien (wie Teflon) geprüft werden. Mitunter lässt sich das Problem der Anhaftung an Glas auch durch eine oder mehrere der folgenden Methoden mildern:
- Bestimmung der Masse der am Glas sorbierten Testsubstanz und Hydrolyseprodukte,
- Verwendung eines Ultraschallbades,
- Waschen sämtlicher Glasartikel mit Lösungsmittel bei jedem Probenahmeintervall,
- Verwendung formulierter Produkte,
- Verwendung einer größeren Menge an Zusatzlösungsmittel für die Zugabe der Testsubstanz zum System; wird ein Zusatzlösungsmittel verwendet, sollte dieses so beschaffen sein, dass es keine Hydrolysierung der Testsubstanz verursacht.
Normalerweise werden temperaturgeregelte Wasserbad-Schüttelvorrichtungen oder thermostatgeregelte Inkubatoren für die Inkubation der verschiedenen Testlösungen benötigt.
Außerdem werden Standard-Laborgeräte benötigt, insbesondere folgende Geräte:
- pH-Messgerät,
- Analyseinstrumente wie GC-, HPLC-, TLC-Geräte einschließlich der entsprechenden Detektionssysteme zur Analyse radioaktiv markierter und unmarkierter Substanzen oder für die inverse Isotopenverdünnungsmethode,
- Instrumente zu Identifikationszwecken (z.B. MS, GC-MS, HPLC-MS, NMR usw.),
- Flüssigkeits-Szintillationszähler,
- Trenntrichter für Flüssig-Flüssig-Extraktionen,
- Instrumentierung für die Konzentration von Lösungen und Extrakten (z.B. Rotationsverdampfer),
- Temperaturregelungsvorrichtung (z.B. Wasserbad).
Zu den chemischen Reagenzien gehören unter anderem:
- organische Lösungsmittel (analysenrein) wie Hexan, Dichlormethan usw.,
- Szintillationsflüssigkeit,
- Pufferlösungen (Details siehe Abschnitt 1.8.3).
Sämtliche Glasgeräte sowie das analysenreine Wasser und die Pufferlösungen, die in den Hydrolysetests verwendet werden, sind zu sterilisieren.
1.8.2 Applikation der Testsubstanz
Die Testsubstanz ist als wässrige Lösung in die verschiedenen Pufferlösungen einzugeben (siehe Anlage 3). Soweit zur Herstellung einer ausreichenden Auflösung erforderlich, ist die Verwendung geringer Mengen wassermischbarer Lösungsmittel (wie Acetonitril, Aceton, Ethanol) für die Applikation und Verteilung der Testsubstanz zulässig, allerdings darf dies normalerweise 1 % v/v nicht überschreiten. Falls eine höhere Lösungsmittelkonzentration erwogen wird (beispielsweise bei schlecht löslichen Testsubstanzen), ist dies nur zulässig, wenn nachgewiesen werden kann, dass das Lösungsmittel die Hydrolyse der Testsubstanzen nicht beeinflusst.
Die Verwendung formulierter Produkte wird nicht grundsätzlich empfohlen, da nicht ausgeschlossen werden kann, dass die Bestandteile der Formulierung den Hydrolysevorgang beeinflussen. Bei schlecht wasserlöslichen Testsubstanzen oder Substanzen, die an Glas anhaften (siehe Abschnitt 1.8.1), bietet sich jedoch die Verwendung formulierter Substanzen als geeignete Alternative an.
Die Testsubstanz ist in einer einzigen Konzentration zu verwenden; diese darf 0,01 M oder die Hälfte der Sättigungskonzentration nicht überschreiten (siehe Anlage 1).
1.8.3 Pufferlösungen
Der Hydrolyseversuch wird bei drei pH-Werten durchgeführt: 4, 7 und 9. Hierzu sind Pufferlösungen unter Verwendung von analysenreinen Chemikalien und Wasser vorzubereiten. Geeignete Beispiele für Puffersysteme sind in Anlage 3 dargestellt. Dabei ist darauf zu achten, dass das verwendete Puffersystem die Hydrolysegeschwindigkeit beeinflussen kann; werden entsprechende Erscheinungen festgestellt, ist eine andere Pufferlösung zu verwenden 1.
Der pH-Wert der einzelnen Pufferlösungen ist mit einem kalibrierten pH-Messgerät mit einer Messgenauigkeit von mindestens 0,1 bei der Solltemperatur zu kontrollieren.
1.8.4 Testbedingungen
1.8.4.1 Testtemperatur
Die Hydrolyseversuche sind bei konstanter Temperatur durchzuführen. Zur Extrapolation ist es wichtig, die Temperatur auf mindestens ± 0,5 °C zu halten.
Ist das Hydrolyseverhalten der Testsubstanz unbekannt, ist ein vorbereitender Test (Stufe 1) bei einer Temperatur von 50 °C durchzuführen. Kinetische Tests auf höherer Stufe sind bei mindestens drei Temperaturen (die auch den Test bei 50 °C einschließen) durchzuführen, sofern die Testsubstanz sich - wie bei den Tests auf Stufe 1 ermittelt - bei Hydrolyse stabil verhält. Es wird ein Temperaturbereich von 10-70 °C empfohlen (wobei möglichst mindestens eine der Temperaturen unter 25 °C liegen sollte), der sowohl die für die Berichterstellung zugrunde gelegte Temperatur von 25 °C als auch die meisten der in der Praxis vorkommenden Temperaturen umfasst.
1.8.4.2 Licht und Sauerstoff
Alle Hydrolyseversuche sind mit geeigneten Methoden durchzuführen, mit denen fotolytische Effekte vermieden werden können. Durch geeignete Maßnahmen ist außerdem eine Sauerstoffbildung (z.B. durch 5-minütiges Einblasen von Helium, Stickstoff oder Argon vor der Zubereitung der Lösung) zu vermeiden.
1.8.4.3 Testdauer
Der Vortest ist über einen Zeitraum von 5 Tagen durchzuführen, die Tests auf höherer Stufe sind durchzuführen, bis eine 90 %ige Hydrolyse der Testsubstanz erreicht ist oder ein Zeitraum von 30 Tagen abgelaufen sind (je nachdem, welcher Zeitpunkt zuerst erreicht ist).
1.8.5 Durchführung des Tests
1.8.5.1 Vortest (Stufe 1)
Der Vortest wird bei 50 ± 0,5 °C und pH-Werten von 4,0, 7,0 und 9,0 durchgeführt. Wird nach 5 Tagen eine Hydrolyse von weniger als 10 % festgestellt (t0,5 25 °C > 1 Jahr), gilt die Testsubstanz als hydrolytisch stabil, und es sind normalerweise keine weiteren Tests erforderlich. Ist bekannt, dass die Substanz bei umwelttechnisch relevanten Temperaturen instabil ist, braucht kein Vortest durchgeführt zu werden. Die Analysemethode muss so präzise und empfindlich sein, dass eine Reduktion der ursprünglichen Konzentration um 10 % festgestellt werden kann.
1.8.5.2 Hydrolyse instabiler Substanzen (Stufe 2)
Der (fortgeschrittene) Test auf höherer Stufe ist bei den pH-Werten durchzuführen, bei denen gemäß den Vorgaben des oben beschriebenen Vortests eine Instabilität der Testsubstanz festgestellt wurde. Die Pufferlösungen der Testsubstanzen sind durch Thermostatregelung auf den gewählten Temperaturen zu halten. Zur Durchführung der Tests auf Reaktionen erster Ordnung ist jede Reaktionslösung in zeitlichen Intervallen zu analysieren, die so angesetzt sein müssen, dass sich mindestens sechs zwischen 10 % und 90 % Hydrolyse der Testsubstanz normal verteilte Bezugspunkte ergeben. Die einzelnen Proben der wiederholten Gleichtests (eine Mindestanzahl von Doppelproben, die in separaten Reaktionsgefäßen enthalten sind) sind zu entfernen und der Inhalt ist bei jedem der mindestens sechs Probenahmepunkte zu analysieren (für mindestens zwölf Wiederholungs-Bezugspunkte). Die Verwendung einer einzigen Sammelprobe, aus der bei jedem Probenahmeintervall einzelne Probenanteile der Testlösung entnommen werden, gilt als unzureichend, da damit keine Analyse der Datenvariabilität möglich ist und Probleme durch Kontaminierung der Testlösung auftreten können. Tests zum Nachweis der Sterilität sind am Ende des höherrangigen Tests durchzuführen (z.B. bei 90 % Hydrolyse bzw. 30 Tage). Wird allerdings keine Zersetzung (d. h. Transformation) festgestellt, sind keine weiteren Sterilitätstests notwendig.
1.8.5.3 Feststellung der Hydrolyseprodukte (Stufe 3)
Umfangreichere Hydrolyseprodukte, zumindest jene, die > 10 % der eingebrachten Dosis entsprechen, sind durch entsprechende Analysemethoden festzustellen.
1.8.5.4 Zusätzliche Tests
Bei hydrolytisch instabilen Testsubstanzen sind evtl. weitere Tests bei anderen pH-Werten als 4, 7 und 9 erforderlich. So ist für physiologische Zwecke möglicherweise ein Test unter saureren Bedingungen (z.B. pH-Wert 1,2) bei einer einzigen physiologisch relevanten Temperatur (37 °C) notwendig.
2. Daten
Die Mengen der Testsubstanz und der Hydrolyseprodukte sind - soweit relevant - als Prozentsatz der eingebrachten Anfangskonzentration sowie in mg/l für jedes Probenahmeintervall und für jeden pH-Wert und jede Testtemperatur anzugeben. Darüber hinaus ist eine Stoffbilanz als Prozentanteil der eingebrachten Anfangskonzentration anzugeben, wenn eine markierte Testsubstanz verwendet wurde.
In den Bericht ist eine grafische Darstellung der logtransformierten Daten der Testsubstanzkonzentrationen im zeitlichen Verlauf aufzunehmen. Umfangreichere Hydrolyseprodukte, zumindest jene, die > 10 % der eingebrachten Dosis repräsentieren, sind anzugeben und ihre logtransformierten Konzentrationen sind in gleicher Weise wie die Muttersubstanz grafisch darzustellen, so dass sich eine Darstellung der Bildungs- und Verfallgeschwindigkeiten ergibt.
2.1 Aufbereitung der Ergebnisse
Eine genauere Bestimmung der Halbwertszeiten oder DT50-Werte dürfte mithilfe geeigneter kinetischer Modellberechnungen möglich sein. Die Halbwertszeit und/oder die DT50-Werte (einschließlich der Vertrauensgrenzen) sind für jeden pH-Wert und jede Temperatur zusammen mit einer Beschreibung des verwendeten Modells, der kinetischen Ordnung und des Bestimmungskoeffizienten (r2) in den Bericht aufzunehmen. Erforderlichenfalls sind die Berechnungen auch für die Hydrolyseprodukte zu übernehmen.
Dabei sind Ai und Bi Regressionskonstanten des Abschnitts bzw. der Steigung der Geraden der besten Anpassung, die aus einem linear regressiven ln ki zur Reziproken der Absoluttemperatur in Kelvin (T) generiert wurden. Mithilfe der Arrhenius-Beziehungen für

Bei Geschwindigkeitsuntersuchungen, die bei unterschiedlichen Temperaturen durchgeführt werden, sind die Hydrolyse-Geschwindigkeitskonstanten pseudoerster Ordnung (kobs) in Abhängigkeit von der Temperatur zu beschreiben. Die Berechnung muss sich dabei auf die Trennung von kobs in Geschwindigkeitskonstanten für säurekatalysierte, neutrale und basenkatalysierte Hydrolyse (kH, kneutral bzw. kOH) sowie auf die Arrhenius-Gleichung stützen: säure-, neutral und basenkatalysierte Hydrolyse können Geschwindigkeitskonstanten pseudoerster Ordnung und somit die Halbwertszeiten für andere Temperaturen berechnet werden, bei denen die direkte experimentelle Ermittlung einer Geschwindigkeitskonstante nicht praktikabel ist (10).
2.2 Evaluierung und Interpretation der Ergebnisse
Die meisten Hydrolysereaktionen folgen scheinbaren Reaktionsgeschwindigkeiten erster Ordnung; die Halbwertszeiten sind daher von der Konzentration unabhängig (siehe Gleichung 4 in Anlage 2). Auf diese Weise können normalerweise Laborergebnisse, die bei 10-2 bis 10-3 M ermittelt wurden, auf Umgebungsbedingungen (<10-6 M) angewandt werden (10). Von Mabey und Mill wurden verschiedene Beispiele genauer Übereinstimmung zwischen Hydrolysegeschwindigkeiten dargestellt, die für unterschiedliche Chemikalien in reinem und natürlichem Wasser gemessen wurden (11), sofern pH-Wert und Temperatur gemessen wurden.
3. Abschlussbericht
3.1 Testbericht
Der Testbericht muss mindestens folgende Informationen enthalten:
Testsubstanz:
- Common name, chemischer Name, CAS-Nummer, Strukturformel (zur Angabe der Lage der Markierung bei Verwendung radioaktiv markierten Materials) und relevante physikalischchemische Eigenschaften (siehe Abschnitt 1.5),
- Reinheit (Verunreinigungen) der Testsubstanz,
- Reinheit der Markierung von markierten Chemikalien und molare Aktivität (soweit relevant).
- Pufferlösungen:
- Datum und Einzelheiten der Zubereitung,
- verwendete Puffersubstanzen und Wasser,
- Molarität und pH-Wert der Pufferlösungen.
Testbedingungen:
- Durchführungsdatum der Studien,
- Menge der eingebrachten Testsubstanz,
- Methode und Lösungsmittel (Art und Menge), die für die Einbringung der Testsubstanz verwendet wurden,
- Volumen der inkubierten gepufferten Testsubstanzlösungen,
- Beschreibung des verwendeten Inkubationssystems,
- pH-Wert und Temperatur während der Studie,
- Probenahmezeiten,
- Extraktionsverfahren,
- Verfahren zur Quantifizierung und Identifizierung der Testsubstanz und ihrer Hydrolyseprodukte in den Pufferlösungen,
- Zahl der Wiederholungen.
Ergebnisse:
- Wiederholbarkeit und Empfindlichkeit der verwendeten Analysemethoden,
- Wiederfindungsraten (Prozentwerte für eine gültige Studie sind in Abschnitt 1.7.1 angegeben),
- Wiederholungsdaten und -mittel in Tabellenform,
- Stoffbilanz während und am Ende der Untersuchung (wenn markierte Testsubstanzen verwendet werden),
- Ergebnisse des Vortests,
- Diskussion und Interpretation der Ergebnisse,
- sämtliche ursprünglichen Daten und Abbildungen.
Die folgenden Angaben werden nur zur Bestimmung der Hydrolysegeschwindigkeit benötigt:
- zeitabhängige grafische Darstellung der Konzentrationen der Testsubstanzen und - soweit relevant - der Hydrolyseprodukte für die einzelnen pH-Werte und für jede Temperatur,
- Tabellen der Ergebnisse der Arrhenius-Gleichung für die Temperaturen 20 °C/25 °C mit pH-Werten, Geschwindigkeitskonstanten [h-1 oder Tag-1], Halbwertszeiten oder DT50, Temperaturen (°C) einschließlich der Vertrauensgrenzen und der Korrelationskoeffizienten (r2) oder vergleichbarer Informationen,
- vorgeschlagener Hydrolyseweg.
4. Literatur
(1) OECD (1981). Hydrolysis as a Function of pH. OECD Guideline for Testing of Chemicals Nr. 111, angenommen am 12. Mai 1981.
(2) US-Environmental Protection Agency (1982). 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 °C. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
(3) Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
(4) Europäische Union (EU) (1995). Richtlinie 95/36/EG der Kommission zur Änderung der Richtlinie 91/ 414/EWG des Rates über das Inverkehrbringen von Pflanzenschutzmitteln. Anhang V: Verbleib und Verhalten in der Umwelt.
(5) Dutch Commission for Registration of Pesticides (Niederländische Kommission für die Eintragung von Pestiziden) (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air (Antrag auf Eintragung eines Pestizids - Teil G. Verhalten des Produkts und seiner Stoffwechselprodukte im Boden, in Wasser und in der Luft).
(6) BBA (1980). Merkblatt Nr. 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (Oktober 1980).
(7) SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
(8) OECD (2000). Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment Nr. 23.
(9) OECD (1993). Guidelines for the Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
(10) Nelson, H, Laskowski D, Thermes S, and Hendley P. (1997) Recommended changes in pesticide fate study guidelines for improving input to computer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental Toxicology and Chemistry, Dallas TX, November 1993).
(11) Mabey, W. and Mill, T. (1978). Critical review of hydrolysis of organic compounds in water under environmental conditions. J. Phys. Chem. Ref. Data 7, 383-415.
...
1) Mabey und Mill empfehlen die Verwendung von Borat- oder Acetatpuffern statt Phosphat (11).
| Mehrstufiger Hydrolyse-Testablauf | Anlage 1 |
| Definitionen und Einheiten | Anlage 2 |
Es sind grundsätzlich SI-Einheiten (der Standard-International-Organisation) zu verwenden.
Testsubstanz: Eine beliebige Substanz (Mutterverbindung oder die entsprechenden Umwandlungsprodukte).
Umwandlungsprodukte: Alle Substanzen, die aus biotischen oder abiotischen Umwandlungsreaktionen der Testsubstanz entstehen.
Hydrolyseprodukte: Alle Substanzen, die aus hydrolytischen Umwandlungsreaktionen der Testsubstanz entstehen.
Hydrolyse bezeichnet die Reaktion einer Testsubstanz RX mit Wasser, die sich durch den Austausch der Gruppe X mit OH im Reaktionszentrum darstellen lässt:
| RX + HOH -> ROH + HX | [1] |
Die Geschwindigkeit, mit der die Konzentration von RX in diesem vereinfachten Prozess sinkt, wird wie folgt angegeben:
| Geschwindigkeit = k [H2 O] [RX] | Reaktion zweiter Ordnung |
| oder | |
| Geschwindigkeit = k [RX] | Reaktion erster Ordnung |
Dies ist vom geschwindigkeitsbestimmenden Schritt abhängig. Da Wasser gegenüber der Testsubstanz in erheblichem Überschuss vorhanden ist, wird dieser Reaktionstyp gewöhnlich als Reaktion pseudoerster Ordnung beschrieben, in der die ermittelte Geschwindigkeitskonstante durch die Beziehung
| kobs = k [H2 O] | [2] |
ausgedrückt wird und aus der folgenden Formel ermittelt werden kann *:
| kobs = 1/t ln Co/Ct | [3] |
Dabei sind:
t = Zeit
und Co, Ct = Konzentrationen von RX zum Zeitpunkt 0 und t.
Die Einheiten dieser Konstanten weisen die Dimension (Zeit)-1 auf; die Halbwertszeit der Reaktion (Zeitdauer für die Reaktion von 50 % RX) wird ausgedrückt durch:
| t0,5 = ln2/kobs | [4] |
Halbwertszeit: (t0,5) bezeichnet die Zeitdauer für eine 50 %ige Hydrolyse einer Testsubstanz, wenn die Reaktion durch Kinetik erster Ordnung beschrieben werden kann: Sie ist von der Konzentration unabhängig.
DT50 (Disappearance Time 50 bzw. Abbauzeit 50): Die Zeitdauer, innerhalb deren die Konzentration der Testsubstanz um 50 % reduziert wird; sie differiert von der Halbwertszeit t0,5, wenn die Reaktion nicht nach einer Kinetik erster Ordnung verläuft.
Schätzung von k bei unterschiedlichen Temperaturen
Wenn die Geschwindigkeitskonstanten für zwei Temperaturen bekannt sind, können die Geschwindigkeitskonstanten bei anderen Temperaturen nach der Arrhenius-Gleichung berechnet werden:

Eine grafische Darstellung von ln k in Abhängigkeit von 1/T ergibt eine Gerade mit einer Steigung von -E/R
Dabei ist:
k = Geschwindigkeitskonstante, bei unterschiedlichen Temperaturen gemessen
E = Aktivierungsenergie (kJ/mol)
T = Absoluttemperatur (K)
R = Gaskonstante (8,314 J/mol.K)
Die Aktivierungsenergie wurde durch Regressionsanalyse oder durch die folgende Gleichung berechnet:

Dabei ist:T2 > T1.
...
*) Lässt die grafische Darstellung der logarithmisch umgewandelten Daten über der Zeit keine lineare Funktion erkennen (gleich einer Reaktionsgeschwindigkeit erster Ordnung gesetzt), eignet sich Gleichung [3] nicht für die Ermittlung der Hydrolyse-Geschwindigkeitskonstante der Testverbindung.
| Puffersysteme | Anlage 3 |
A. CLARK and LUBS:
Puffergemische von CLARK and LUBS *
| Zusammensetzung | pH |
| 0,2 N HCl UND 0,2 N KCl BEI 20 °C | |
| 47,5 ml HCl + 25 ml KCl dil. auf 100 ml | 1,0 |
| 32,25 ml HCl + 25 ml KCl dil. auf 100 ml | 1,2 |
| 20,75 ml HCl + 25 ml KCl dil. auf 100 ml | 1,4 |
| 13,15 ml HCl + 25 ml KCl dil. auf 100 ml | 1,6 |
| 8,3 ml HCl + 25 ml KCl dil. auf 100 ml | 1,8 |
| 5,3 ml, HCl + 25 ml KCl dil. auf 100 ml | 2,0 |
| 3,35 ml HCl + 25 ml KCl dil. auf 100 ml | 2,2 |
| 0,1 M Kaliumhydrogenphthalat + 0,1 N HCl bei 20 °C | |
| 46,70 ml 0,1 N HCl + 50 ml Hydrogenphthalat auf 100 ml | 2,2 |
| 39,60 ml 0,1 N HCl + 50 ml Hydrogenphthalat auf 100 ml | 2,4 |
| 32,95 ml 0,1 N HCl + 50 ml Hydrogenphthalat auf 100 ml | 2,6 |
| 26,42 ml 0,1 N HCl + 50 ml Hydrogenphthalat auf 100 ml | 2,8 |
| 20,32 ml 0,1 N HCl + 50 ml Hydrogenphthalat auf 100 ml | 3,0 |
| 14,70 ml 0,1 N HCl + 50 ml Hydrogenphthalat auf 100 ml | 3,2 |
| 9,90 ml 0,1 N HCl + 50 ml Hydrogenphthalat auf 100 ml | 3,4 |
| 5,97 ml 0,1 N HCl + 50 ml Hydrogenphthalat auf 100 ml | 3,6 |
| 2,63 ml 0,1 N HCl + 50 ml Hydrogenphthalat auf 100 ml | 3,8 |
| 0,1 M Kaliumhydrogenphthalat + 0,1 N NaOH bei 20 °C | |
| 0,40 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 4,0 |
| 3,70 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 4,2 |
| 7,50 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 4,4 |
| 12,15 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 4,6 |
| 17,70 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 4,8 |
| 23,85 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 5,0 |
| 29,95 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 5,2 |
| 35,45 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 5,4 |
| 39,85 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 5,6 |
| 43,00 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 5,8 |
| 45,45 ml 0,1 N NaOH + 50 ml Hydrogenphthalat auf 100 ml | 6,0 |
| 0,1 M Monokaliumphosphat + 0,1 N NaOH bei 20 °C | |
| 5,70 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 6,0 |
| 8,60 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 6,2 |
| 12,60 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 6,4 |
| 17,80 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 6,6 |
| 23,45 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 6,8 |
| 29,63 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 7,0 |
| 35,00 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 7,2 |
| 39,50 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 7,4 |
| 42,80 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 7,6 |
| 45,20 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 7,8 |
| 46,80 ml 0,1 N NaOH + 50 ml Phosphat auf 100 ml | 8,0 |
| 0,1 M H3 BO3 in 0,1 M KCl + 0,1 N NaOH bei 20 °C | |
| 2,61 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 7,8 |
| 3,97 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 8,0 |
| 5,90 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 8,2 |
| 8,50 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 8,4 |
| 12,00 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 8,6 |
| 16,30 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 8,8 |
| 21,30 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 9,0 |
| 26,70 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 9,2 |
| 32,00 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 9,4 |
| 36,85 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 9,6 |
| 40,80 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 9,8 |
| 43,90 ml 0,1 N NaOH + 50 ml Borsäure auf 100 ml | 10,0 |
| (*) Die in diesen Tabellen aufgeführten pH-Werte wurden ausgehend von den Potenzialmessungen unter Verwendung der Sörensen'schen Standardgleichungen (1909) errechnet. Die entsprechenden pH-Werte liegen um 0,04 Einheiten über den Werten in dieser Tabelle. | |
B. KOLTHOFF und VLEESCHHOUWER:
Zitratpuffer von KOLTHOFF und VLEESCHHOUWER
| Zusammensetzung | pH |
| 0,1 M Monokaliumzitrat und 0,1 N HCl bei 18 °C (*) | |
| 49,7 ml 0,1 N HCl + 50 ml Zitrat auf 100 ml | 2,2 |
| 43,4 ml 0,1 N HCl + 50 ml Zitrat auf 100 ml | 2,4 |
| 36,8 ml 0,1 N HCl + 50 ml Zitrat auf 100 ml | 2,6 |
| 30,2 ml 0,1 N HCl + 50 ml Zitrat auf 100 ml | 2,8 |
| 23,6 ml 0,1 N HCl + 50 ml Zitrat auf 100 ml | 3,0 |
| 17,2 ml 0,1 N HCl + 50 ml Zitrat auf 100 ml | 3,2 |
| 10,7 ml 0,1 N HCl + 50 ml Zitrat auf 100 ml | 3,4 |
| 4,2 ml 0,1 N HCl + 50 ml Zitrat auf 100 ml | 3,6 |
| 0,1 M Monokaliumzitrat und 0,1 N NaOH bei 18 °C (*) | |
| 2,0 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 3,8 |
| 9,0 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 4,0 |
| 16,3 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 4,2 |
| 23,7 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 4,4 |
| 31,5 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 4,6 |
| 39,2 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 4,8 |
| 46,7 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 5,0 |
| 54,2 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 5,2 |
| 61,0 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 5,4 |
| 68,0 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 5,6 |
| 74,4 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 5,8 |
| 81,2 ml 0,1 N NaOH + 50 ml Zitrat auf 100 ml | 6,0 |
| *) Zur Vermeidung von Pilzbildung ist ein kleiner Kristall Thymol oder einer ähnlichen Substanz zuzusetzen. | |
C. SÖRENSEN:
Boratgemische von Sörensen
| Zusammensetzung | Sörensen 18 °C | Walbum, pH bei | |||
| ml Borax | ml HCl / NaOH | 10 °C | 40 °C | 70 °C | |
| 0,05 M Borax + 0,1 NHCl | |||||
| 5,25 | 4,75 | 7,62 | 7,64 | 7,55 | 7,47 |
| 5,50 | 4,50 | 7,94 | 7,98 | 7,86 | 7,76 |
| 5,75 | 4,25 | 8,14 | 8,17 | 8,06 | 7,95 |
| 6,00 | 4,00 | 8,29 | 8,32 | 8,19 | 8,08 |
| 6,50 | 3,50 | 8,51 | 8,54 | 8,40 | 8,28 |
| 7,00 | 3,00 | 8,08 | 8,72 | 8,56 | 8,40 |
| 7,50 | 2,50 | 8,80 | 8,84 | 8,67 | 8,50 |
| 8,00 | 2,00 | 8,91 | 8,96 | 8,77 | 8,59 |
| 8,50 | 1,50 | 9,01 | 9,06 | 8,86 | 8,67 |
| 9,00 | 1,00 | 9,09 | 9,14 | 8,94 | 8,74 |
| 9,50 | 0,50 | 9,17 | 9,22 | 9,01 | 8,80 |
| 10,00 | 0,00 | 9,24 | 9,30 | 9,08 | 8,86 |
| 0,05 M Borax + 0,1 N NaOH | |||||
| 10,0 | 0,0 | 9,24 | 9,30 | 9,08 | 8,86 |
| 9,0 | 1,0 | 9,36 | 9,42 | 9,18 | 8,94 |
| 8,0 | 2,0 | 9,50 | 9,57 | 9,30 | 9,02 |
| 7,0 | 3,0 | 9,68 | 9,76 | 9,44 | 9,12 |
| 6,0 | 4,0 | 9,97 | 10,06 | 9,67 | 9,28 |
Phosphatgemische von SÖRENSEN
| Zusammensetzung | pH |
| 0,0667 M Monokaliumphosphat + 0,0667 M Dinatriumphosphat bei 20 °C | |
| 99,2 ml KH2 PO4+ 0,8 ml Na2 HPO4 | 5,0 |
| 98,4 ml KH2 PO4+ 1,6 ml Na2 HPO4 | 5,2 |
| 97,3 ml KH2 PO4+ 2,7 ml Na2 HPO4 | 5,4 |
| 95,5 ml KH2 PO4+ 4,5 ml Na2 HPO4 | 5,6 |
| 92,8 ml KH2 PO4+ 7,2 ml Na2 HPO4 | 5,8 |
| 88,9 ml KH2 PO4+ 11,1 ml Na2 HPO4 | 6,0 |
| 83,0 ml KH2 PO4+ 17,0 ml Na2 HPO4 | 6,2 |
| 75,4 ml KH2 PO4+ 24,6 ml Na2 HPO4 | 6,4 |
| 65,3 ml KH2 PO4+ 34,7 ml Na2 HPO4 | 6,6 |
| 53,4 ml KH2 PO4+ 46,6 ml Na2 HPO4 | 6,8 |
| 41,3 ml KH2 PO4+ 58,7 ml Na2 HPO4 | 7,0 |
| 29,6 ml KH2 PO4+ 70,4 ml Na2 HPO4 | 7,2 |
| 19,7 ml KH2 PO4+ 80,3 ml Na2 HPO4 | 7,4 |
| 12,8 ml KH2 PO4+ 87,2 ml Na2 HPO4 | 7,6 |
| 7,4 ml KH2 PO4+ 92,6 ml Na2 HPO4 | 7,8 |
| 3,7 ml KH2 PO4+ 96,3 ml Na2 HPO4 | 8,0 |
C.8 Toxizität für Regenwürmer
Prüfung in künstlichem Boden
1. Methode
1.1 Einleitung
Bei dieser Laborprüfung wird die Prüfsubstanz einem künstlichen Boden zugesetzt; in diesem Boden werden die Würmer 14 Tage lang gehalten. Nach 14 Tagen (wahlweise nach 7 Tagen) wird die tödliche Wirkung der Substanz auf die Regenwürmer überprüft. Dieser Test ist eine Methode zur relativ schnellen Überprüfung der Wirkung von Chemikalien auf Regenwürmer bei Aufnahme über die Haut und die Nahrung.
1.2 Definition und Messgröße
LC50: Die Konzentration einer Substanz, durch die 50 % der Versuchstiere während der Versuchszeit getötet werden.
1.3 Referenzsubstanz
Mit einer Referenzsubstanz wird regelmäßig überprüft, dass sich die Empfindlichkeit des Prüfsystems nicht wesentlich geändert hat.
Als Referenzsubstanz wird Chloracetamid p. a. empfohlen.
1.4 Prinzip der Prüfmethode
Der Boden ist ein sehr variables Medium; daher wird bei dieser Prüfung ein sorgfältig definierter künstlicher Lehmboden verwendet. Adulte Regenwürmer der Art Eisenia foetida (siehe Anmerkung in der Anlage) werden in einem definierten künstlichen Boden gehalten, der mit verschiedenen Konzentrationen der Prüfsubstanz behandelt wird. 14 Tage (wahlweise 7 Tage) nach Prüfbeginn wird der Gefäßinhalt in einer flachen Schale ausgebreitet. Die bei der jeweiligen Konzentration überlebenden Regenwürmer werden gezählt.
1.5 Qualitätskriterien
Die Prüfmethode muss hinsichtlich Prüfsubstanz und Prüforganismus so reproduzierbar wie möglich sein. Die Mortalität in den Kontrollen darf am Ende der Prüfung 10 % nicht überschreiten oder aber die Prüfung ist ungültig.
1.6 Beschreibung des Prüfverfahrens
1.6.1 Material
1.6.1.1 Prüfsubstrat
Ein definierter künstlicher Boden wird als Grundprüfsubstrat eingesetzt.
- Grundsubstrat (in Prozent des Trockengewichts)
- 10 % Sphagnumtorf (so nahe wie möglich bei pH 5,5 bis 6,0; ohne sichtbare Pflanzenreste und fein gemahlen);
- 20 % Kaolinitkreide mit vorzugsweise mehr als 50 % Kaolinit;
- etwa 69 % Industriequarzsand (überwiegend feiner Sand mit mehr als 50 % 0,05 bis 0,2 mm großen Teilchen). Wenn die Prüfsubstanz in Wasser ungenügend dispergierbar ist, werden 10 g pro Prüfgefäß aufbewahrt, die später mit der Prüfsubstanz gemischt werden;
- etwa 1 % Kalziumcarbonat (CaCO1), in Pulverform, chemisch rein, zur Einstellung des pH-Werts auf 6,0 ± 0,5.
- Prüfsubstrat
Das Prüfsubstrat enthält das Grundsubstrat, die Prüfsubstanz und deionisiertes Wasser.
Der Wassergehalt beträgt etwa 25 bis 42 % des Trockengewichts des Grundsubstrats. Der Wassergehalt des Substrats wird bestimmt, indem eine Probe bei 105 °C bis zur Gewichtskonstanz getrocknet wird. Es ist eine wichtige Voraussetzung, dass der künstliche Boden durchnässt ist, aber kein Wasser darauf steht. Um eine gleichmäßige Verteilung der Prüfsubstanz im Substrat zu erzielen, muss sorgfältig gemischt werden. Es muss im Prüfbericht angegeben werden, wie die Prüfsubstanz in das Substrat eingebracht wird. - Kontrollsubstrat
Das Kontrollsubstrat enthält das Grundsubstrat und Wasser. Wird ein Trägerstoff verwendet, so muss eine zusätzliche Kontrolle die gleiche Menge an Trägerstoff enthalten.
1.6.1.2 Prüfgefäße
Glasgefäße mit perforierten Kunststoffdeckeln, -platten oder -folien von ca. 1 Liter Inhalt werden mit einer Menge an feuchtem Prüf- oder Kontrollsubstrat gefüllt, die 500 g Trockengewicht des Substrats entspricht.
1.6.2 Prüfbedingungen
Die Gefäße werden in Klimakammern bei einer Temperatur von 20 °C ± 2 °C und Dauerlicht gehalten. Die Lichtintensität beträgt 400 bis 800 Lux.
Die Versuchszeit beträgt 14 Tage, aber die Mortalität kann wahlweise 7 Tage nach Versuchsbeginn bewertet werden.
1.6.3 Prüfverfahren
Prüfkonzentration
Die Konzentrationen der Prüfsubstanz werden als Gewicht der Substanz pro Trockengewicht des Grundsubstrats (mg/kg) ausgedrückt.
Vorversuch
In einer Vorprüfung wird der Konzentrationsbereich bestimmt, in dem 0 bis 100 % Mortalität auftritt. Der Vorversuch liefert Informationen zu dem in der Hauptprüfung zu verwendenden Konzentrationsbereich.
Die Prüfsubstanz sollte bei folgenden Konzentrationen getestet werden: 1.000; 100; 10; 1; 0,1 mg Substanz/kg Prüfsubstrat (Trockengewicht).
Wird eine vollständige Hauptprüfung durchgeführt, reichen 1 Prüfansatz pro Konzentration und 1 pro unbehandelte Kontrolle mit je 10 Würmern für die Vorprüfung aus.
Hauptprüfung
Die Ergebnisse des Vorversuchs werden eingesetzt, um mindestens 5 Konzentrationen in einer geometrischen Reihe zu wählen, die den Bereich von 0 bis 100 % Mortalität umfassen, und die sich durch einen konstanten Faktor unterscheiden, der 1,8 nicht überschreitet.
Über diese Konzentrationsreihe sollten sich der LC50-Wert und sein Vertrauensbereich so genau wie möglich bestimmen lassen.
In der Hauptprüfung werden mindestens 4 Prüfansätze pro Konzentration und 4 unbehandelte Kontrollen mit je 10 Würmern eingesetzt. Die Ergebnisse dieser Parallelansätze werden als Mittelwert und Standardabweichung angegeben.
Ergeben zwei aufeinander folgende Konzentrationen, die sich um den Faktor 1,8 unterscheiden, 0 und 100 % Mortalität, so reichen diese beiden Werte aus, um den Bereich anzugeben, in dem der LC50-Wert liegt.
Mischung des Grundprüfsubstrats und der Prüfsubstanz
Das Prüfsubstrat sollte möglichst immer ohne andere Trägerstoffe als Wasser angesetzt werden. Unmittelbar vor Prüfbeginn wird die in deionisiertem Wasser oder einem anderen Lösungsmittel emulgierte oder dispergierte Prüfsubstanz mit dem Grundprüfsubstrat gemischt oder aber sie wird mit einem feinen chromatografischen Sprüher oder etwas Ähnlichem gleichmäßig aufgesprüht.
Wenn die Prüfsubstanz wasserunlöslich ist, wird sie in dem kleinstmöglichen Volumen eines geeigneten organischen Lösungsmittels (z.B. Hexan, Aceton oder Chloroform) gelöst. Um die Prüfsubstanz zu lösen, zu dispergieren oder zu emulgieren, dürfen nur leicht flüchtige Lösungsmittel verwendet werden. Das Prüfsubstrat muss vor Gebrauch belüftet werden. Verdunstetes Wasser muss ersetzt werden. Die Kontrolle muss die gleiche Menge jeden Trägerstoffes enthalten.
Ist die Prüfsubstanz in organischen Lösungsmitteln nicht löslich, dispergierbar oder emulgierbar, werden 10 g eines Gemischs von fein gemahlenem Quarzsand und der zur Behandlung von 500 g künstlichem Boden (Trockengewicht) benötigten Menge an Prüfsubstanz mit 490 g Prüfsubstrat (Trockengewicht) gemischt.
Für jeden Prüfansatz wird feuchtes Prüfsubstrat in einer Menge, die 500 g Trockengewicht entspricht, in die einzelnen Glasgefäße gefüllt. Je 10 Würmer, die 24 Stunden lang zur Gewöhnung in einem entsprechend feuchten Grundsubstrat gehalten, dann schnell gewaschen und mit Filterpapier abgetupft wurden, werden auf das Prüfsubstrat gesetzt.
Um ein Austrocknen des Substrats zu vermeiden, werden die Gefäße mit perforierten Kunststoffdeckeln, -platten oder -folien zugedeckt und 14 Tage lang unter Versuchsbedingungen belassen.
Die Auswertung wird 14 Tage (und wahlweise 7 Tage) nach Prüfbeginn durchgeführt. Das Substrat wird auf einer Platte aus Glas oder rostfreiem Stahl ausgebreitet. Die Würmer werden untersucht und die Überlebenden gezählt. Regenwürmer gelten als tot, wenn sie nicht auf einen leichten mechanischen Reiz am Vorderende reagieren.
Anschließend an eine Untersuchung nach 7 Tagen wird das Substrat wieder in das Prüfgefäß eingefüllt und die überlebenden Regenwürmer werden wieder auf dasselbe Prüfsubstrat gesetzt.
1.6.4 Prüforganismen
Als Prüforganismen werden adulte Eisenia foetida (siehe Anlage) (mindestens 2 Monate alt mit Clitellum) von 300 bis 600 mg Feuchtgewicht eingesetzt (zur Anzucht siehe Anlage).
2. Daten
2.1 Verarbeitung und Auswertung der Ergebnisse
Die Konzentrationen der Prüfsubstanz werden zusammen mit dem jeweils entsprechenden Prozentsatz an toten Regenwürmern angegeben.
Wenn die Daten es zulassen, lassen sich der LC50-Wert und der Vertrauensbereich (p = 0,05) nach Standardmethoden bestimmen (Litchfield und Wilcoxon, 1949, oder entsprechende Methode). Die LC50 wird in mg Prüfsubstanz pro kg Trockengewicht des Prüfsubstrats angegeben.
Ist die Konzentrationskurve zu steil, um eine Berechnung der LC50 zuzulassen, dann genüge es, den Wert aufgrund der grafischen Darstellung abzuschätzen.
Ergeben 2 aufeinander folgende Konzentrationen, die sich um den Faktor 1,8 unterscheiden, 0 und 100 % Mortalität, so reichen diese beiden Werte aus, um den Bereich anzugeben, in dem die LC50 liegt.
3. Abschlussbericht
3.1 Prüfbericht
Im Prüfbericht ist, wenn möglich, Folgendes anzugeben:
- die Feststellung, dass die Prüfung in Übereinstimmung mit den oben genannten Qualitätskriterien durchgeführt wurde;
- welche Prüfung durchgeführt wurde (Vorprüfung und/oder Hauptprüfung);
- die genaue Beschreibung der Prüfbedingungen oder die Feststellung, dass die Prüfung entsprechend der angegebenen Methode durchgeführt wurde; jede Abweichung muss angegeben werden;
- die genaue Beschreibung, wie die Prüfsubstanz in das Grundprüfsubstrat eingebracht wurde;
- Angaben zu den Prüforganismen (Art, Alter, Durchschnittsgewicht und Gewichtsbereich, Haltungs- und Anzuchtmethoden, Herkunft);
- das zur Bestimmung der LC50 angewendete Verfahren;
- die Prüfergebnisse einschließlich aller verwendeten Daten;
- die Beschreibung der beobachteten Symptome oder Veränderungen im Verhalten der Versuchstiere;
- die Mortalität in den Kontrollen;
- die LC50 oder die höchste geprüfte Konzentration ohne Mortalität und die niedrigste geprüfte Konzentration mit einer Mortalität von 100 % 14 Tage (wahlweise 7 Tage) nach Prüfbeginn;
- das Auftragen der Konzentrations-Wirkungs-Kurve;
- die Ergebnisse, die mit der Referenzsubstanz erzielt wurden, entweder in Verbindung mit der vorliegenden Prüfung oder aus vorherigen Qualitätskontrollversuchen.
4. Literatur
(1) OECD, Paris, 1981, Test Guideline 207, Beschluss des Rates C(81) 30 final.
(2) Edwards, C. A. and Lofty, J. R., 1977, Biology of Earthworms. Chapman and Hall, London, 331.
(3) Bauche, M. B., 1972, Lombriciens de France, Ecologie et Systematique, Institut National de la Recherche Agronomique, 671 S. .
(4) Litchfield.J. T. and Wilcoxon, F., A simplified method of evaluating doseeffect experiments. J. Pharm. Exp. Therap., 1949, Band 96, 99.
(5) Commission of the European Communities, Development of a standardized Laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983.
(6) Umweltbundesamt/Biologische Bundesanstalt für Land- und Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag "Toxizitätstest am Regenwurm Eisenia foetida in künstlichem Boden", in: Rudolph/Boje: ökotoxikologie, ecomed, Landsberg, 1986.
| Anzucht und Haltung der Würmer vor der Prüfung | Anlage |
Zur Anzucht werden 30 bis 50 adulte Würmer 14 Tage lang in einem Brutkasten mit frischem Substrat gehalten.
Diese Tiere können für weitere Anzuchten verwendet werden.
Die aus den Kokons geschlüpften Würmer werden für die Prüfung eingesetzt, wenn sie geschlechtsreif sind (nach 2 bis 3 Monaten bei den vorgeschriebenen Bedingungen).
Anzucht und Haltungsbedingungen
| Klimakammer: | 20 °C ± 2 °C vorzugsweise mit Dauerlicht (400 bis 800 Lux). |
| Brutkasten: | Geeignete flache Behälter von 10 bis 20 Liter Inhalt. |
| Substrat: | Eisenia foetida kann in verschiedenen tierischen Exkrementen angezogen werden.
Es wird empfohlen, ein Gemisch von 50 Vol. % Torf und 50 Vol. % Kuh- oder Pferdedung zu verwenden.
Der pH-Wert sollte bei 6 bis 7 liegen (er wird mit Kalziumcarbonat eingestellt); die Ionenleitfähigkeit sollte niedrig sein (weniger als 6 mmhos oder 0,5 % Salzkonzentration).
Das Substrat sollte feucht, aber nicht zu nass sein. Neben der oben angegebenen Methode können auch andere bewährte Verfahren eingesetzt werden. |
Anmerkung: Eisenia foetida gibt es in 2 Rassen, die von einigen Taxonomen als 2 verschiedene Arten bezeichnet werden (Bouche, 1972). Morphologisch sind sie ähnlich, doch zeigt Eisenia foetida foetida typische Querstreifen oder Bänder auf den Segmenten, während Eisenia foetida andrei diese nicht aufweist und fleckig rötlich gefärbt ist. Es sollte möglichst Eisenia foetida andrei verwendet werden. Andere Arten können eingesetzt werden, wenn das nötige Verfahren zur Verfügung steht.
 | weiter . |  |
...
X
⍂
↑
↓
