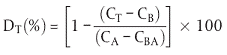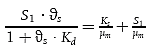umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (28)
 | zurück |
C.9 Biologische Abbaubarkeit 23
Die vollständige Beschreibung dieser Prüfmethode wurde gestrichen.
Die gleichwertige internationale Prüfmethode ist in Teil 0 Tabelle 3 aufgeführt.
| Zahn-Wellens-Test
1. Methode 1.1 Einleitung Zweck des Verfahrens ist die Prüfung der potenziellen vollständigen biologischen Abbaubarkeit wasserlöslicher, nichtflüchtiger organischer Stoffe, indem diese in einem statischen Test relativ hohen Konzentrationen von Mikroorganismen ausgesetzt werden. Eine physikalischchemische Adsorption an suspendierte Feststoffe kann auftreten und muss ggf. bei der Interpretation der Ergebnisse berücksichtigt werden (siehe 3.2). Die Prüfsubstanzen werden in Konzentrationen verwendet, die DOC-Werten von 50 bis 400 mg/l oder CSBWerten von 100 bis 1.000 mg/l entsprechen (DOC = Dissolved Organic Carbon, gelöster organischer Kohlenstoff; CSB = Chemischer Sauerstoffbedarf). Diese verhältnismäßig hohen Konzentrationen ermöglichen zuverlässige Analysen, Verbindungen mit toxischen Eigenschaften können den Abbauprozess verzögern oder hemmen. Bei diesem Verfahren wird die Konzentration des gelösten organischen Kohlenstoffs oder der chemische Sauerstoffbedarf zur Beurteilung der vollständigen biologischen Abbaubarkeit der Prüfsubstanz benutzt. Werden gleichzeitig spezifische Analysemethoden angewandt, kann die biologische Primär-Abbaubarkeit des Stoffes beurteilt werden (Abnahme der chemischen Ausgangsstruktur). Mit diesem Verfahren können nur organische Stoffe geprüft werden, die bei der verwendeten Konzentration
Angaben über die relativen Anteile der wichtigsten Komponenten der Prüfsubstanz sind zur Interpretation der erzielten Ergebnisse insbesondere dann nützlich, wenn niedrige oder marginale Abbauwerte erhalten werden. Informationen über die Toxizität des Stoffes gegenüber Mikroorganismen sind zur Interpretation niedriger Abbauwerte sowie zur Wahl der geeigneten Prüfkonzentration ebenfalls nützlich. 1.2 Definitionen und Einheiten Der nach Ablauf des Tests erzielte Abbaugrad wird als "Biologische Abbaubarkeit im Zahn-Wellens-Test" angegeben:
Der Abbaugrad wird auf ganze Prozentzahlen gerundet. Als prozentualer Abbau wird der Prozentsatz der DOC-(oder CSB)-Verminderung der Prüfsubstanz angegeben. Die Differenz zwischen dem nach 3 Stunden gemessenen und dem berechneten oder vorzugsweise gemessenen Anfangswert stellt eine nützliche Information über die Eliminierung des Stoffes dar (siehe 3.2 "Interpretation der Ergebnisse"). 1.3 Referenzsubstanzen Bei der Untersuchung neuer Stoffe können in einigen Fällen Referenzsubstanzen nützlich sein; spezifische Substanzen können jedoch nicht empfohlen werden. 1.4 Prinzip der Methode Belebtschlamm, mineralische Nährstoffe und die Prüfsubstanz als einzige Kohlenstoffquelle werden in wässriger Lösung in ein Glasgefäß von 1 bis 4 Liter Volumen mit Rührwerk und Belüftungsvorrichtung gegeben. Die Suspension wird bei 20 bis 25 °C bei diffusem Licht oder in einem dunklen Raum bis zu 28 Tage gerührt und belüftet. Der Abbau wird verfolgt, indem die DOC-(oder CSB-)Werte der Lösung nach Filtration täglich oder in anderen geeigneten Zeitabständen gemessen werden. Das Verhältnis zwischen dem zur Zeit der Probenahme eliminierten DOC- (oder CSB-)Wert und dem 3 Stunden nach Beginn des Tests gemessenen Wert wird als Prozentsatz des biologischen Abbaus angegeben und dient als Maß des Abbaugrades zum betreffenden Zeitpunkt. Das Ergebnis wird jeweils gegen die Zeit grafisch aufgetragen und der biologische Abbau als Kurve dargestellt. Wird ein spezifisches Analyseverfahren angewandt, so können Änderungen in der Konzentration der Ausgangsverbindung, die infolge des biologischen Abbaus auftreten, gemessen werden (Biologischer Primärabbau). 1.5 Qualitätskriterien In einem Ringversuch ergab sich eine befriedigende Reproduzierbarkeit des Tests. Die Empfindlichkeit des Verfahrens ist weitgehend abhängig von der Variabilität des Blindansatzes und in geringem Ausmaß von der Genauigkeit der Bestimmung des gelösten organischen Kohlenstoffs sowie der Konzentration der Prüfsubstanz in der Kultursuspension. 1.6 Prüfverfahren 1.6.1 Vorbereitung 1.6.1.1 Reagenzien Wasser: Trinkwasser mit einem Gehalt an organischem Kohlenstoff < 5 mg/l. Die Konzentration der Kalzium- und Magnesiumionen darf insgesamt 2,7 mMol/l nicht übersteigen; sonst ist eine ausreichende Verdünnung mit deionisiertem oder destilliertem Wasser erforderlich.
Dieser Ansatz dient sowohl als Nähr- als auch als Pufferlösung. 1.6.1.2 Geräte Glasgefäße mit 1 bis 4 Liter Volumen (z.B. zylindrische Gefäße). Rührwerk mit Rührelement aus Glas oder Metall an einem geeigneten Stiel (das Rührelement sollte sich 5 bis 10 cm über dem Boden des Gefäßes bewegen). Auch ein magnetisches Rührwerk mit einem 7 bis 10 cm langen Magnetstab kann benutzt werden. Glasrohr von 2 bis 4 mm Innendurchmesser zur Belüftung. Die Rohröffnung sollte sich rund 1 cm über dem Boden des Gefäßes befinden. Zentrifuge (rd. 3 550 g). pH-Messgerät. Gerät zur Messung des gelösten Sauerstoffs. Papierfilter. Membranfiltrationsgerät. Membranfilter, Porengröße 0,45 µm. Die Membranfilter dürfen weder Kohlenstoff freisetzen noch während der Filtration absorbieren. Analysegerät zur Bestimmung des Gehalts an organischem Kohlenstoff und Ausrüstung zur Bestimmung des chemischen Sauerstoffbedarfs. 1.6.1.3 Vorbereitung des Inokulums Belebtschlamm aus einer biologischen Kläranlage wird gewaschen, indem er mit Wasser (der vorgeschriebenen Qualität) wiederholt zentrifugiert oder sedimentiert wird. Der Belebtschlamm muss in einem geeigneten Zustand sein. Er ist in einer einwandfrei arbeitenden Kläranlage erhältlich. Um möglichst viele Bakterienarten oder Stämme zu erhalten, sollten evtl. Inokula aus verschiedenen Quellen gemischt werden (z.B. Schlamm aus verschiedenen Kläranlagen, Bodenextrakte, Flusswasser usw.). Das Gemisch ist nach obiger Beschreibung zu behandeln. Zur Prüfung der Aktivität des Belebtschlamms siehe "Funktionskontrolle" (unter 1.6.2). 1.6.1.4 Zubereitung der Testlösungen In das Testgefäß sind 500 ml Wasser, 2,5 ml/l mineralische Nährlösung und Belebtschlamm in einer Menge von 0,2 bis 1,0 g/l Trockenmasse im Endgemisch zu geben. Man gebe genügend Stammlösung der Prüfsubstanz hinzu, um eine DOC-Konzentration von 50 bis 400 mg/l in der Kultursuspension zu erhalten. Die entsprechenden CSB-Werte sind 100 bis 1.000 mg/l. Dann wird mit Wasser bis zu einem Gesamtvolumen von 1 bis 4 Liter aufgefüllt. Das zu wählende Gesamtvolumen ist abhängig von der Anzahl Proben für die DOC- oder CSB-Bestimmungen und vom für das Analyseverfahren benötigten Probevolumen. In der Regel sind 2 Liter ausreichend. Gleichzeitig mit jeder Testserie ist zumindest eine Kontrolle durchzuführen; der Kontrollansatz (Blindprobe) hierfür enthält nur Belebtschlamm und Mineralnährlösung und wird mit Wasser auf das gleiche Volumen wie die Prüfansätze aufgefüllt. 1.6.2 Durchführung der Prüfung Die Kulturgefäße werden bei diffusem Licht oder in einer Dunkelkammer bei 20 bis 25 °C inkubiert und mit Hilfe eines magnetischen Rührwerks oder eines Schraubenpropellers gerührt. Die Belüftung erfolgt mit Druckluft, die - falls erforderlich - mit einem Wattefilter oder einer Waschflasche zu reinigen ist. Es ist dafür zu sorgen, dass sich der Schlamm nicht absetzt und die Sauerstoffkonzentration nicht unter 2 mg/l sinkt. Der pH-Wert ist in regelmäßigen Abständen zu prüfen (z.B. täglich) und ggf. auf 7 bis 8 einzustellen. Verdunstungsverluste werden vor jeder Probenahme mit deionisiertem oder destilliertem Wasser ausgeglichen. Hierfür ist es zweckmäßig, das Flüssigkeitsniveau am Gefäß vor Beginn des Tests zu markieren. Nach jeder Probenahme wird bei ausgeschalteter Belüftung und Rührung eine neue Marke angebracht. Die ersten Proben werden jeweils drei Stunden nach Beginn des Tests entnommen, um die Absorption der Prüfsubstanz an den Belebtschlamm zu ermitteln. Die Elimination der Prüfsubstanz wird verfolgt, indem täglich oder in anderen regelmäßigen Zeitabständen die DOC- oder CSB-Werte bestimmt werden. Die Proben aus dem Prüfansatz und die Blindproben werden durch ein sorgfältig gewaschenes Papierfilter filtriert. Die ersten 5 ml des Filtrats sind zu verwerfen. Schwer zu filtrierende Suspensionen können zuvor durch Zentrifugation (10 Minuten) vorgereinigt werden. Die DOC- und DSB-Bestimmungen werden mindestens doppelt ausgeführt. Die Ansätze werden bis zu 28 Tage inkubiert. Anmerkung: Proben, die nach dieser Behandlung noch trüb sind, werden durch Membranfilter filtriert. Die Membranfilter dürfen keine organischen Stoffe freisetzen oder adsorbieren. Funktionskontrolle des Belebtschlamms Parallel zu jeder Testserie ist ein Ansatz mit einer Substanz, deren Abbauverhalten bekannt ist, zu prüfen, um die Abbau-Kapazität des Belebtschlamms zu kontrollieren. Diäthylenglykol hat sich hierfür als zweckmäßig erwiesen. Adaptation Werden Analysen in relativ kurzen Zeitabständen (z.B. täglich) durchgeführt, so lässt sich die Adaptation aufgrund der Abbaukurve klar erkennen (siehe Abbildung 2). Der Test sollte deshalb nicht unmittelbar vor einem Wochenende begonnen werden. Erfolgt die Adaptation am Ende der normalen Testdauer, so kann der Test bis zum vollständigen Abbau der Prüfsubstanz verlängert werden. Anmerkung: Ist eine eingehendere Kenntnis über das Verhalten des adaptierten Belebtschlamms erforderlich, so wird dieser nach folgendem Verfahren ein weiteres Mal mit der gleichen Prüfsubstanz inkubiert: Rührwerk und Belüftung werden ausgeschaltet, damit sich der Belebtschlamm absetzen kann. Die überstehende Flüssigkeit wird entfernt, man füllt mit Wasser (Testqualität) auf 2 Liter auf, rührt 15 Minuten lang und lässt den Schlamm absetzen. Die überstehende Flüssigkeit wird wiederum entfernt und der Test mit dem verbleibenden Schlamm und der gleichen Prüfsubstanz wie oben unter 1.6.1.4 und 1.6.2 beschrieben wiederholt. Der Belebtschlamm kann auch durch Zentrifugieren anstatt durch Absetzen gewonnen werden. Der adaptierte Schlamm kann mit frischem Belebtschlamm gemischt werden, so dass wiederum 0,2 bis 1 g Trockengewicht pro Liter in der Kultursuspension erreicht werden, Vorbereitung für die Analyse Die Proben werden in der Regel durch ein sorgfältig gewaschenes Papierfilter filtriert (zum Waschen verwende man entionisiertes Wasser). Trübe Proben werden durch Membranfilter (0,45 μm) filtriert. Die DOC-Konzentration wird in Probefiltraten (die ersten 5 ml werden verworfen) mit dem TOG-Messgerät doppelt bestimmt. Kann das Filtrat nicht am gleichen Tag analysiert werden, so muss es bis zum nächsten Tag im Kühlschrank aufbewahrt werden. Von längeren Lagerungen wird abgeraten. Die CSB-Konzentration der Probefiltrate wird nach dem in der Literaturangabe (2) beschriebenen Verfahren bestimmt. 2. Daten und Auswertung Die DOC- und CSB-Konzentrationen werden in den Proben, wie oben in 1.6.2 beschrieben, mindestens doppelt bestimmt. Der Abbau zum Zeitpunkt T wird nach der unter 1.2 oben angegebenen Formel mit den Definitionen berechnet. Der Abbaugrad wird auf ganze Prozentzahlen aufgerundet. Der nach Ablauf des Tests erreichte Abbau wird als "Biologische Abbaubarkeit im Zahn-Wellens-Test" angegeben. Anmerkung: Wird vor Ablauf der Testzeit ein vollständiger Abbau erreicht und dieses Ergebnis in einer zweiten Analyse am nächsten Tag bestätigt, so kann die Prüfung beendet werden. 3. Schlussbericht 3.1 Prüfbericht Im Prüfbericht ist, wenn möglich, Folgendes anzugeben:
3.2 Interpretation der Ergebnisse Eine fortschreitende Abnahme des DOC (CSB) innerhalb von Tagen oder Wochen weist auf einen biologischen Abbau des Teststoffes hin. Eine physikalischchemische Adsorption kann jedoch in manchen Fällen auch eine Rolle spielen; ein Hinweis darauf besteht, wenn während der ersten drei Stunden eine vollständige oder teilweise DOC-(CSB-)Abnahme festgestellt wird und der Unterschied zwischen der überstehenden Flüssigkeit in den Proben aus dem Kontrollgefäß und dem Testgefäß unerwartet niedrig ist. Soll zwischen vollständigem (oder teilweisem) biologischem Abbau und Adsorption unterschieden werden, sind weitere Tests erforderlich. Hierfür bieten sich mehrere Möglichkeiten an; am besten verwendet man jedoch überstehende Kultursuspension aus dem Prüfansatz als Inokulum in einem Grundstufen-Test (vorzugsweise in einem respirometrischen Test). Prüfsubstanzen, die eine weitgehende, nicht durch Adsorption bedingte Abnahme des DOC-(CSB)Gehalts in diesem Test aufweisen, sind als potenziell biologisch abbaubar zu betrachten. Eine partielle nichtadsorptive Abnahme weist darauf hin, dass der Stoff zumindest teilweise biologisch abbaubar ist. Erfolgt keine oder nur eine geringe DOC-(CSB-)Abnahme, kann dies möglicherweise auf einer Hemmung der Mikroorganismen durch den zu prüfenden Stoff beruhen. Eine Hemmung kann sich auch durch Auflösung und Verlust des Schlammes sowie einer Trübung der überstehenden Kultursuspension zeigen. In solchen Fällen ist die Prüfung mit einer niedrigeren Konzentration des zu prüfenden Stoffes zu wiederholen. Durch spezifische Analysemethoden oder den Einsatz 14C-markierter Prüfsubstanzen lässt sich evtl. eine höhere Empfindlichkeit erreichen. Wird 14C-markierte Prüfsubstanz verwendet, lässt sich durch Nachweis des entstehenden 14CO2 bestätigen, dass ein biologischer Abbau stattgefunden hat. Werden die Ergebnisse auch in Form des biologischen Primär-Abbaus angegeben, so sollten, wenn möglich, Angaben über die Veränderungen der chemischen Struktur gemacht werden, die die mangelnde Wiederauffindung der Ausgangssubstanz begründen. Die Eignung der Analysemethode sowie die damit bestimmten Werte im Nährmedium ohne Zusatz der Prüfsubstanz müssen angegeben werden. 4. Literatur (1) OECD Paris, 1981, Test Guideline 302 B, Beschluss des Rates C(81) 30 final. (2) Anhang V C.9 Abbaubarkeit: Chemischer Sauerstoffbedarf. Richtlinie 84/449/EWG der Kommission (ABl.. L 251 vom 19.09.1984 S. 1).
Abbildung 1 Beispiele von Abbau-Kurven Abbildung 2 Beispiel für eine Adaptation des Schlammes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
C.10 Simulation der aeroben Abwasserbehandlung: C.10-A: Belebtschlamm - C.10-B: Biofilme 14
C.10-A: Belebtschlamm
1. Diese Prüfmethode entspricht der OECD Test Guideline (TG) 303 (2001). In den 1950er Jahren wurde erkannt, dass die neu auf dem Markt eingeführten Tenside in Kläranlagen und Flüssen exzessive Schaumbildung verursachten. Sie wurden bei der aeroben Behandlung nicht vollständig abgebaut und behinderten in einigen Fällen auch den Abbau anderer organischer Substanzen. Im Rahmen zahlreicher Untersuchungen wurde sodann geprüft, wie Tenside aus Abwässern entfernt werden könnten und ob neue industriell hergestellte chemische Stoffe für die Abwasserbehandlung geeignet sind. Dazu wurden Modellanlagen verwendet, die für die beiden wichtigsten Arten der aeroben biologischen Abwasserbehandlung (Belebtschlamm- und Tropfkörperverfahren) repräsentativ sind. Es wäre unpraktisch und sehr kostspielig gewesen, jede neu auf dem Markt eingeführte chemische Substanz auf kommunale Klärwerke zu verteilen und diese zu überwachen, selbst auf lokaler Basis.
Belebtschlammanlagen
2. Es wurden Belebtschlamm-Modellanlagen in Größenordnungen von 300 ml bis ca. 2.000 ml Fassungsvermögen beschrieben. Einige dieser Modellanlagen gewährleisteten realitätsnahe Bedingungen mit Absetztanks und Schlämmen, die in den Belüftungstank zurückgepumpt wurden, während andere ohne Absetzvorrichtungen betrieben wurden, siehe z.B. Swisher (1). Die Größe der Apparatur ist stets ein Kompromiss: Sie muss einerseits groß genug sein, um einen reibungslosen mechanischen Ablauf und Probenahmen in einem Umfang zu gewährleisten, der den Betrieb der Ablage nicht beeinträchtigt, darf jedoch andererseits nicht so groß sein, dass sie zu viel Platz und Materialien in Anspruch nimmt.
3. Zwei Apparaturen, die häufig eingesetzt wurden und sich bewährt haben, sind die Modellanlage vom Typ Husmann (2) und der Poröse Topf (Porous Pot) (3)(4), die als erste für die Untersuchung von Tensiden verwendet wurden; beide Modelle werden in diesem Kapitel näher beschrieben. Auch andere Modellanlagen, z.B. Eckenfelder (5), wurden mit Erfolg eingesetzt. Aufgrund des mit diesem Simulationstest verbundenen relativ hohen Kosten- und Arbeitsaufwands wurde parallel dazu die Möglichkeit einfacherer und kostengünstigerer Screeningtests untersucht, die zurzeit in Kapitel C.4 (A-F) dieses Anhangs (6) beschrieben sind. Die Erfahrung mit zahlreichen Tensiden und anderen chemischen Substanzen hat gezeigt, dass sich Stoffe mit positiven ('pass') Ergebnissen im Screeningtest (auf leichte biologische Abbaubarkeit) auch im Simulationstest zersetzten. Einige der Stoffe mit negativen ('fail') Ergebnissen im Screeningtest reagierten positiv ('pass') im Test auf potenzielle (inhärente) Bioabbaubarkeit (Kapitel C.12 (7) und C.19 (8) dieses Anhangs), doch nur wenige Substanzen dieser letzten Gruppe zersetzten sich im Simulationstest, während Stoffe mit negativen Ergebnissen im Test auf inhärente Abbaubarkeit im Simulationstest nicht abgebaut wurden (9)(10)(11).
4. Für bestimmte Zwecke reichen Simulationstests, die stets unter denselben Prozessbedingungen durchgeführt werden, aus; die Ergebnisse dieser Tests werden als prozentuale Abnahme der Prüfsubstanz oder des gelösten organischen Kohlenstoffs (Dissolved Organic Carbon, DOC) ausgedrückt. Unter der vorliegenden Prüfmethode wird ein solcher Test beschrieben. Im Gegensatz zur vorherigen Version dieses Kapitels, die nur einen einzigen Apparaturtypus beschrieb, bei dem die Behandlung synthetischer Abwässer in gekoppelten Anlagen nach der relativ simplen Methode des Überschussschlammabzugs erfolgte, bietet diese aktuelle Version Variationsmöglichkeiten, d. h. es werden Alternativen für Apparaturtyp, Betriebsmodus, Abwässer und Überschussschlammabzug beschrieben. Der vorliegende Text lehnt sich eng an die ISO-Norm 11733 (12) an, die im Zuge der Ausarbeitung des Textes eingehend geprüft wurde, obgleich die Methode keinem Ringtest unterzogen wurde.
5. Für andere Zwecke muss die Konzentration der Prüfsubstanz im Ablauf genauer bekannt sein, und zur Bestimmung dieser Konzentration ist eine umfassendere Methode erforderlich. Beispielsweise muss die Schlammabzugsrate im Tagesverlauf und während der gesamten Prüfungsdauer präziser kontrolliert werden, und die Modellanlagen müssen bei verschiedenen Abzugsraten betrieben werden. Damit die Methode in jeder Hinsicht umfassend ist, sollten die Tests auch unter zwei oder drei verschiedenen Temperaturbedingungen durchgeführt werden: Eine derartige Methode wird von Birch (13)(14) beschrieben und ist in Anlage 6 zusammengefasst. Der aktuelle Wissensstand reicht jedoch nicht aus, um entscheiden zu können, welches der kinetischen Modelle zur Bestimmung der biologischen Abbaubarkeit chemischer Substanzen bei der Abwasserbehandlung und im Wassermilieu im Allgemeinen geeignet ist. Die Anwendung der Monod-Kinetik (siehe Beispielfall in Anlage 6) ist auf chemische Substanzen begrenzt, die in Konzentrationen von 1 mg/l oder mehr präsent sind, wenngleich auch die Meinung vertreten wird, dass selbst dies zu beweisen ist. Tests bei Konzentrationen, die die Konzentrationen in Abwässern akkurater widerspiegeln, sind in Anlage 7 beschrieben, werden jedoch, ebenso wie die Tests in Anhang 6, nicht als eigenständige Prüfmethoden geführt, sondern lediglich in den Anlagen genannt.
Filtration
6. Sehr viel weniger Arbeit wurde in Modell-Tropfkörper investiert, vielleicht, weil sie aufwändiger und weniger kompakt sind als Modell-Belebtschlammanlagen. Gerike et al entwickelten Tropfkörperanlagen und betrieben sie im Koppelmodus (15). Die Filter waren relativ groß (2 m hoch mit einem Fassungsvermögen von 60 l) und für jeden einzelnen waren 2 l/Std. Abwasser erforderlich. Baumann et al (16) simulierten Tropfkörper, indem 1 m lange Röhren (mit 14 mm Innendurchmesser) mit zuvor für 30 Minuten in Belebtschlammkonzentrat getränkten Polyester-Vliesstreifen ausgekleidet wurden. Die Prüfsubstanz wurde als einzige C-Quelle in einer Mineralsalzlösung in die vertikal angeordnete Röhre gegeben, und die biologische Abbaubarkeit wurde durch Messung des DOC im Ablauf und des CO2 im austretenden Gas bestimmt.
7. Biofilter wurden auf andere Weise simuliert (15): Die Innenwandungen von Drehrohren, in einem kleinen Neigungswinkel zur Horizontalen angeordnet, wurden mit Abwasser (ungefähr 250 ml/Std.) mit und ohne Zusatz von Prüfsubstanz beaufschlagt, und die gesammelten Abläufe wurden auf DOC und/oder die betreffende Prüfsubstanz analysiert.
8. Dieses Verfahren ist ausgelegt, um die Elimination und den Primär- und/oder den vollständigen biologischen Abbau wasserlöslicher organischer Substanzen durch aerobe Mikroorganismen in einem das Belebtschlammverfahren simulierenden kontinuierlich betriebenen Prüfsystem bestimmt werden. Ein leicht biologisch abbaubares organisches Medium und die organische Prüfsubstanz dienen als C-Quellen und Energiequellen für die Mikroorganismen.
9. Zwei kontinuierlich betriebene Prüfsysteme (Belebtschlamm- oder Porous-Pot-Anlagen) werden unter identischen Bedingungen, die je nach Prüfungszweck festgelegt werden, parallel betrieben. In der Regel betragen die mittlere hydraulische Verweilzeit 6 Stunden und das mittlere Schlammalter (Schlammverweilzeit) 6 bis 10 Tage. Überschussschlamm wird nach einer von zwei Methoden abgezogen, und der Zulauf (organisches Medium) von ausschließlich einer der beiden Prüfanlagen wird mit Prüfsubstanz einer Konzentration von üblicherweise 10 mg/l DOC bis 20 mg/l DOC beschickt. Die zweite Anlage fungiert als Kontrollanlage zur Bestimmung der biologischen Abbaubarkeit des organischen Mediums.
10. Anhand häufig gezogener Ablaufproben werden durch spezifische Analyse der DOC (vorzugsweise) oder der chemische Sauerstoffbedarf (CSB) sowie die Prüfsubstanzkonzentration (soweit erforderlich) im Ablauf der mit der Prüfsubstanz beschickten Anlage bestimmt. Es wird davon ausgegangen, dass die Differenz zwischen den DOC- oder CSB-Konzentrationen in den Abläufen der Prüf- und der Kontrollanlage auf die Prüfsubstanz oder ihre organischen Stoffwechselprodukte zurückzuführen ist. Um die Elimination der Prüfsubstanz zu ermitteln, wird diese Differenz mit der durch die zugeführte Prüfsubstanz bedingten DOC- oder CSB-Konzentration im Zulauf verglichen.
11. In der Regel lässt sich biologische Abbaubarkeit durch sorgfältige Prüfung der Konzentrations-Zeit-Kurve der Elimination von der Bioadsorption unterscheiden; dies kann gewöhnlich durch einen Test auf leichte biologische Abbaubarkeit, bei dem ein akklimatisiertes Inokulum aus der mit der Prüfsubstanz beaufschlagten Anlage zum Einsatz kommt, bestätigt werden.
Angaben zur Prüfsubstanz
12. Die Reinheits-, Wasserlöslichkeits-, Flüchtigkeits- und Adsorptionsmerkmale der Prüfsubstanz sollten bekannt sein, um eine akkurate Ergebnisauswertung zu ermöglichen. Normalerweise können flüchtige und nicht lösliche chemische Substanzen nur getestet werden, wenn besondere Vorsichtsmaßnahmen getroffen werden (siehe Anlage 5). Auch die chemische Struktur oder zumindest die empirische Formel sollten bekannt sein, um theoretische Werte berechnen und/oder gemessene Parameterwerte (z.B. für den theoretischen Sauerstoffbedarf (Theoretical Oxygen Demand, ThOD), den gelösten organischen Kohlenstoff (Dissolved organic carbon, DOC) und den chemischen Sauerstoffbedarf (CSB)) überprüfen zu können.
13. Informationen über die Toxizität der Prüfsubstanz für Mikroorganismen (siehe Anlage 4 können für die Wahl geeigneter Testkonzentrationen zweckdienlich und für die korrekte Auswertung niedriger Abbaubarkeitswerte ausschlaggebend sein.
Negative/positive Testergebnisse (Pass/Fail)
14. Bei der ersten Anwendung dieses Simulationstests (Bestätigungstest) zur Bestimmung der primären Bioabbaubarkeit von Tensiden müssen über 80 % der betreffenden chemischen Substanz abgebaut werden, bevor das Tensid in den Verkehr gebracht werden kann. Werden diese 80 % nicht erreicht, kann der vorliegende Simulationstest (Bestätigungstest) durchgeführt werden, und das Tensid darf nur in den Verkehr gebracht werden, wenn über 90 % der betreffenden chemischen Substanz abgebaut wurden. Im Allgemeinen stellt sich die Pass-/Fail-Frage bei chemischen Substanzen nicht, und der Wert der prozentualen Abnahme kann zur approximativen Berechnung der wahrscheinlichen Umweltkonzentration einer chemischen Substanz verwendet werden, die zur Analyse der von chemischen Substanzen ausgehenden Gefahren erforderlich ist. Testergebnisse folgen in der Regel dem Schema 'Alles oder Nichts'. Einige Untersuchungen reiner Chemikalien haben in mehr als drei Viertel aller Fälle eine prozentuale DOC-Abnahme von > 90 % und bei über 90 % der Substanzen, die sich als in signifikantem Maße biologisch abbaubar erwiesen haben, von > 80 % ergeben.
15. Relativ wenige chemische Substanzen (z.B. Tenside) sind in den für diese Prüfung verwendeten Konzentrationen (ungefähr 10 mg C/l) in Abwässern vorhanden. Einige Substanzen manifestieren in diesen Konzentrationen möglicherweise eine Hemmwirkung, bei anderen kann die Abnahmegeschwindigkeit bei niedrigen Konzentrationen unterschiedlich sein. Die Zersetzung könnte mit modifizierten Methoden, bei denen die Prüfsubstanz realitätsnäher in niedrigen Konzentrationen verwendet wird, akkurater bewertet und die so erhobenen Daten könnten zur Berechnung von kinetischen Konstanten verwendet werden. Die hierzu erforderlichen Versuchstechniken sind jedoch noch nicht umfassend validiert, und auch die kinetischen Modelle zur Beschreibung der beim biologischen Abbau stattfindenden Reaktionen liegen noch nicht fest (siehe Anlage 7).
16. Um sicherzustellen, dass das Testverfahren korrekt durchgeführt wird, ist es sinnvoll, gelegentlich parallel zur Untersuchung der Prüfsubstanz auch andere Substanzen zu analysieren, deren Verhalten bekannt ist. Dazu zählen Adipinsäure, 2-Phenylphenol, 1-Naphthol, Diphensäure, 1- Naphthoesäure usw. (9)(10)(11).
Reproduzierbarkeit von Testergebnissen
17. Es gibt wesentlich weniger Studienberichte über Simulationstests als über Tests auf leichte Bioabbaubarkeit. Die Reproduzierbarkeit der Testergebnisse zwischen (Simultan-)Replikaten ist gut (10 % bis 15 %) bei Prüfsubstanzen, die zu mindestens 80 % abgebaut werden, bei weniger gut abgebauten Substanzen ist die Schwankungsbreite jedoch größer. Bei bestimmten grenzwertigen Substanzen wurden innerhalb des neunwöchigen Prüfungszeitraums mitunter auch weit auseinanderliegende Ergebnisse (z.B. 10 %, 90 %) verzeichnet.
18. Bei den mit den beiden Apparaturtypen erzielten Ergebnissen zeigten sich nur geringe Unterschiede, einige chemische Substanzen wurden in Haushaltsabwasser jedoch umfassender und konsistenter abgebaut als in synthetischem Abwasser (OECD).
Beschreibung des Prüfverfahrens
Geräte
Prüfsystem
19. Das Prüfsystem für eine Prüfsubstanz umfasst eine Prüfanlage und eine Kontrollanlage; werden jedoch nur spezifische Analysen durchgeführt (primäre Bioabbaubarkeit), ist nur eine Prüfanlage erforderlich. Eine Kontrollanlage kann für mehrere Prüfanlagen verwendet werden, die entweder mit derselben oder mit unterschiedlichen Prüfsubstanzen beschickt werden. Bei gekoppelten Anlagen (Anlage 3) muss jede Prüfanlage über eine separate Kontrollanlage verfügen. Beim Prüfsystem kann es sich entweder um eine Belebtschlamm-Modellanlage vom Typ Husmann (Anlage 1, Abbildung 1) oder um eine Porous-Pot-Anlage (Anlage 1, Abbildung 2) handeln. In beiden Fällen sind ausreichend große Vorrats-/Sammelgefäße für die Zu- bzw. Abläufe erforderlich, ebenso wie Pumpen zur Dosierung des Zustroms (entweder mit Prüfsubstanzlösung gemischt oder separat).
20. Jede Belebtschlammanlage besteht aus einem Belüftungsgefäß (Belebung) mit einem bekannten Fassungsvermögen von ca. 3 Liter Belebtschlamm und einem Absetzgefäß (Nachklärung) eines Fassungsvermögens von ungefähr 1,5 Litern; durch Regelung der Höhe des Absetzgefäßes können die Füllmengen bis zu einem bestimmten Grad geändert werden. Gefäße anderer Größen sind zulässig, wenn vergleichbare hydraulische Frachten eingehalten werden. Ist es nicht möglich, die Temperatur im Prüfraum im gewünschten Bereich zu halten, wird die Verwendung von wasserummantelten Gefäßen (temperiertes Wasser) empfohlen. Für die kontinuierliche oder intermittente Rückführung von Belebtschlamm aus dem Absetzgefäß ins Belüftungsgefäß wird eine Druckluft- oder Dosierpumpe verwendet.
21. Das Porous-Pot-System besteht aus einem porösen inneren Zylinder mit konischem Boden, der in einem geringfügig größeren, aus undurchlässigem Kunststoff bestehenden formgleichen Gefäß fixiert ist. Als Material für das poröse Gefäß ist poröses Polyethylen einer Porengröße von maximal 90 µm und 2 mm Dicke geeignet. Der Schlamm wird durch die Filtrierwirkung der porösen Wand vom behandelten organischen Medium abgetrennt. Der Ablauf sammelt sich in dem ringförmigen Bereich, von dem aus er in das Sammelgefäß überfließt. Da kein Absetzen erfolgt, gibt es auch keine Schlammrückführung. Das gesamte System kann in einem thermostatisch kontrollierten Wasserbad montiert werden. Poröse Töpfe können in den Anfangsstadien verstopfen und überlaufen. In diesem Fall wird die poröse Auskleidung erneuert; dazu wird zunächst der Schlamm aus dem Topf in einen sauberen Eimer abgeschlaucht und die verstopfte Innenauskleidung wird entfernt. Der undurchlässige äußere Zylinder wird ausgewischt, eine saubere Auskleidung wird eingesetzt und der Schlamm wird in den Topf zurückgeführt. Außerdem werden alle an den Rändern der verstopfen Innenauskleidung anhaftenden Schlammreste sorgfältig abgeschabt und ebenfalls zurück in den Topf transferiert. Verstopfte Töpfe werden zunächst mit einem feinen Wasserstrahl gesäubert, um Schlammreste zu entfernen; anschließend wird das Gerät zunächst in verdünnte Natriumhypochlorit-Lösung, dann in Wasser gesetzt und gründlich mit Wasser abgespült.
22. Die Belüftung des Schlamms in den Belüftungsgefäßen beider Systeme erfordert geeignete Verfahren, z.B. gesinterte Würfel (Sprudelsteine) und Druckluft. Die Luft muss bei Bedarf gesäubert werden, indem sie durch einen geeigneten Filter geleitet und gewaschen wird. Das System muss ausreichend belüftet werden, um aerobe Bedingungen zu gewährleisten und die Schlammflocken während des Prüfungsvorgangs in ständiger Suspension zu halten.
Filtrationsgerät oder Zentrifuge
23. Gerät zur Filtration von Proben mit Membranfiltern einer geeigneten Porenweite (Nennöffnungsdurchmesser 0,45 µm), die lösliche organische Substanzen adsorbieren und ein Minimum an organischem Kohlenstoff freisetzen. Bei Verwendung von Filtern, die organischen Kohlenstoff freisetzen, sind die Filter sorgfältig mit heißem Wasser zu waschen, um den Kohlenstoff zu entfernen. Alternativ kann eine Zentrifuge einer Kapazität von 40.000 m/s2 verwendet werden.
Analysegerät
24. Apparatur zur Bestimmung folgender Größen:
- DOC (gelöster organischer Kohlenstoff) und TOC (gesamter organischer Kohlenstoff) oder CSB (chemischer Sauerstoffbedarf);
- bestimmte chemische Substanz, soweit erforderlich;
- suspendierte Feststoffe, pH-Wert, Sauerstoffkonzentration im Wasser;
- Temperatur, Azidität und Alkalinität;
- Ammonium, Nitrit und Nitrat, wenn der Test unter nitrifizierenden Bedingungen durchgeführt wird.
Wasser
25. Leitungswasser (Trinkwasser) mit einem DOC-Gehalt von weniger als 3 mg/l. Soweit nicht bereits bekannt, die Alkalinität bestimmen.
26. Deionisiertes Wasser mit einem DOC-Gehalt von weniger als 2 mg/l DOC.
Organisches Medium
27. Als organisches Medium kommt synthetisches Abwasser, Haushaltsabwasser oder eine Mischung aus beiden Abwasserarten in Frage. Es hat sich gezeigt (11)(14), dass die alleinige Verwendung von Haushaltsabwasser oft zu einer höheren prozentualem DOC-Abnahme führt und selbst die Abnahme und den biologischen Abbau bestimmter chemischer Substanzen fördert, die bei Verwendung von synthetischem Abwasser (OECD) nicht abgebaut werden. Außerdem wirkt die konstante oder intermittente Zugabe von Haushaltsabwasser auf den Belebtschlamm, einschließlich der entscheidenden Absetzfähigkeit, häufig stabilisierend. Die Verwendung von Haushaltsabwasser wird demnach empfohlen. Bei jeder neuen Charge von organischem Medium die DOC- oder die CSB-Konzentration messen. Die Azidität oder Alkalinität des organischen Mediums sollte bekannt sein. Das organische Medium kann die Zugabe einer geeigneten Pufferlösung (Natriumhydrogencarbonat oder Kaliumdihydrogenphosphat) erfordern, wenn die Azidität oder Alkalinität gering ist, um während des Tests einen pH- Wert von etwa 7,5 ± 0,5 im Belüftungsgefäß zu gewährleisten. Wie viel Pufferlösung zuzugeben ist und wann, muss auf Fallbasis entschieden werden. Werden kontinuierlich oder intermittent Abwassermischungen verwendet, muss der DOC-Wert (oder der CSB-Wert) der Mischung möglichst konstant gehalten werden, z.B. durch Verdünnung mit Wasser.
Synthetisches Abwasser
28. In jedem Liter Leitungswasser Folgendes auflösen: 160 mg Pepton; 110 mg Fleischextrakt; 30 mg Harnstoff; 28 mg wasserfreies Dikaliumhydrogenphosphat (K2HPO4); 7 mg Natriumchlorid (NaCl); 4 mg Calciumchlorid- Dihydrat (CaCl2.2H2O); 2 mg Magnesiumsulfat-Heptahydrat (Mg2SO4.7H20). Dieses synthetische Abwasser (OECD) hat Beispielcharakter und ergibt eine mittlere DOC-Konzentration im Zulauf von etwa 100 mg/l. Alternativ können andere Zusammensetzungen mit ähnlicher DOC-Konzentration verwendet werden, die realitätsnäher sind. Ist ein weniger konzentrierter Zulauf erforderlich, das synthetische Abwasser mit Leitungswasser verdünnen, beispielsweise im Verhältnis 1:1, um eine Konzentration von ungefähr 50 mg/l zu erhalten. Ein derart verdünnter Zulauf fördert das Wachstum nitrifizierender Organismen, und diese Modifikation sollte vorgenommen werden, wenn die Simulation nitrifizierender Kläranlagen untersucht werden soll. Dieses synthetische Abwasser kann aus destilliertem Wasser in konzentrierter Form hergestellt und bis zu einer Woche bei ungefähr 1 °C gelagert werden. Bei Bedarf mit Leitungswasser verdünnen. (Dieses Medium ist eher ungeeignet, weil die Stickstoffkonzentration sehr hoch und der Kohlenstoffgehalt relativ niedrig ist; es gibt jedoch keine besseren Empfehlungen, außer Hinzufügung von mehr Phosphat als Puffer und zusätzlichem Pepton).
Haushaltsabwasser
29. Es sollte frisch abgesetztes Abwasser verwendet werden, das täglich von einer vorwiegend Haushaltsabwässer behandelnden Kläranlage bezogen wird. Es sollte vor der Vorklärung aus der Ablaufrinne des Vorklärbeckens oder aus dem Beschickungswasser der Belebtschlammanlage gezogen werden und weitgehend frei von Grobstoffen sein. Das Abwasser kann nach mehrtägiger, jedoch höchstens siebentägiger Lagerung bei 4 °C verwendet werden, sofern erwiesen ist, dass der gelöste organische Kohlenstoff (DOC) (oder der chemische Sauerstoffbedarf, CSB) während der Lagerung nicht wesentlich (d. h. um weniger als 20 %) abgenommen hat. Um Störungen des Systems zu vermeiden, sollte der DOC (oder der CSB) jedes neuen Ansatzes vor dessen Verwendung auf einen geeigneten konstanten Wert eingestellt werden, z.B. durch Verdünnung mit Leitungswasser.
Belebtschlamm
30. Zur Beimpfung Belebtschlamm aus dem Belüftungsbecken einer ordnungsgemäß betriebenen Kläranlage oder einer Labor-Belebtschlammanlage entnehmen, die vorwiegend Haushaltsabwässer behandeln.
Stammlösungen der Prüfsubstanz
31. Für angemessen lösliche chemische Substanzen in geeigneten Konzentrationen (z.B. 1 bis 5 g/l) in entionisiertem Wasser oder in einer mineralischen Kulturlösung aus synthetischem Abwasser Stammlösungen ansetzen (für nicht lösliche und flüchtige Chemikalien siehe Anlage 5). Den DOC- und den TOC-Wert der Stammlösung bestimmen und die Messungen bei jeder neuen Charge wiederholen. Bei einer Differenz zwischen DOC und TOC von mehr als 20 % die Wasserlöslichkeit der Prüfsubstanz überprüfen. Den DOC oder die durch spezifische Analyse der Stammlösung gemessene Konzentration der Prüfsubstanz mit dem Nennwert vergleichen, um festzustellen, ob die Wiederfindungsrate ausreicht (in der Regel kann mit > 90 % gerechnet werden). Vor allem bei Dispersionen ist festzustellen, ob der DOC als Analyseparameter verwendet werden kann oder nicht oder ob nur ein prüfsubstanzspezifisches Analyseverfahren angewendet werden kann. Bei Dispersionen müssen die Proben zentrifugiert werden. Für jede neue Charge den DOC, den CSB bzw. die Prüfsubstanz durch spezifische Analyse messen.
32. Den pH-Wert der Stammlösung bestimmen. Extremwerte zeigen an, dass die Zugabe der chemischen Substanz den pH-Wert des Belebtschlamms im Prüfsystem beeinflussen kann. In diesem Fall die Stammlösung mit kleinen Mengen anorganischer Säure oder Base neutralisieren, um einen pH-Wert von 7 ± 0,5 zu erhalten, wobei eine Ausfällung der Prüfsubstanz zu vermeiden ist.
33. Das beschriebene Verfahren betrifft Belebtschlammanlagen; es muss für das Porous-Pot-System in bestimmten Punkten angepasst werden.
Vorbereitung des Inokulums
34. Das Prüfsystem zu Testbeginn entweder mit Belebtschlamm oder mit einem Inokulum animpfen, das eine geringe Konzentration an Mikroorganismen enthält. Das Inokulum bis zu seiner Verwendung (innerhalb von 24 Stunden) bei Raumtemperatur unter aeroben Bedingungen aufbewahren. Im ersten Fall (Verwendung von Belebtschlamm) aus dem Belüftungsbecken einer ordnungsgemäß betriebenen biologischen Kläranlage oder einer Laborkläranlage, die vorwiegend mit Haushaltsabwasser betrieben wird, eine Schlammprobe ziehen. Sollen nitrifizierende Bedingungen simuliert werden, den Schlamm aus einer nitrifizierenden Kläranlage beziehen. Die Konzentration der suspendierten Feststoffe bestimmen und den Schlamm bei Bedarf durch Absetzen eindicken, so dass dem Prüfsystem nur eine minimale Schlammmenge zugeführt werden muss. Die Anfangskonzentration der Trockensubstanz sollte ungefähr 2,5 g/l betragen.
35. Im zweiten Fall (Inokulum) 2 bis 10 ml/l Ablauf aus einer biologischen Kläranlage für Haushaltsabwässer verwenden. Um möglichst viele unterschiedliche Bakterienarten zu erhalten, kann es sinnvoll sein, auch Inokula aus diversen anderen Quellen wie Oberflächenwasser zuzuführen. In diesem Fall wird sich der Belebtschlamm im Prüfsystem entwickeln und vermehren.
Zudosierung des organischen Mediums
36. Zulauf- und Ablaufbehälter und Schlauchleitungen aus den Zulauf- und zu den Ablaufgefäßen vor und während des Tests gründlich reinigen, um Mikrobenbewuchs zu entfernen. Die Prüfsysteme in einem temperaturkontrollierten Raum (übliche Temperaturspanne: 20-25 °C) montieren oder wasserummantelte Testgefäße verwenden. Eine ausreichende Menge des benötigten organischen Mediums (Nummern 27-29) zubereiten. Zunächst Belüftungs- und Absetzungsgefäß (Separator) mit organischem Medium füllen und Inokulum zusetzen (Nummern 34, 35). Die Belüftung so einstellen, dass der Schlamm unter aeroben Bedingungen dauerhaft suspendiert ist; anschließend Zulaufdosierung und Schlammrückführung einleiten. Organisches Medium aus den Vorrats- in die Belüftungsgefäße (Nummern 20, 21) der Prüf- und der Kontrollanlage zudosieren, und die jeweiligen Abläufe in entsprechenden Sammelgefäßen auffangen. Um die normale hydraulische Verweilzeit von 6 Std. zu erreichen, organisches Medium in einem Volumen von 0,5 l/Std. zupumpen. Zur Bestätigung durch Messung des Volumenrückgangs in den Vorratsgefäßen die zudosierte Tagesmenge an organischem Medium ermitteln. Zur Bestimmung der Effekte der intermittenten Freisetzung von chemischen Substanzen und der Stoßbelastung (shock loading) des Systems mit diesen Substanzen wären andere Dosierungsmodi erforderlich.
37. Soll das vorbereitete organische Medium für länger als einen Tag verwendet werden, muss es auf ungefähr 4 °C gekühlt oder auf andere Weise haltbar gemacht werden, um Mikrobenwachstum und biologischen Abbau außerhalb der Prüfanlagen zu vermeiden (Nummer 29). Werden synthetische Abwässer verwendet, kann eine konzentrierte Stammlösung (z.B. das Zehnfache der normalen Konzentration; Nummer 28) vorbereitet und bei etwa 4 °C gelagert werden. Diese Stammlösung kann vor ihrer Verwendung mit einer entsprechenden Menge Leitungswasser gründlich durchgemischt oder - alternativ - direkt zugepumpt werden, während die entsprechende Menge Leitungswasser separat zugepumpt wird.
Zudosierung der Prüfsubstanz
38. Eine geeignete Menge Stammlösung der Prüfsubstanz (Nummer 31) in das Vorratsgefäß des Zulaufs geben oder mittels einer separaten Dosierpumpe direkt in das Belüftungsgefäß pumpen. Die normale mittlere Testkonzentration im Zulauf sollte 10 bis 20 mg/l DOC betragen, wobei die Höchstkonzentration von 50 mg/l nicht überschritten werden sollte. Ist die Wasserlöslichkeit der Prüfsubstanz gering oder ist mit toxischen Effekten zu rechnen, ist die Konzentration auf 5 mg/l DOC oder auch weniger zu reduzieren, allerdings nur, wenn eine geeignete spezifische Analysemethode verfügbar ist und angewendet wird (schlecht wasserlösliche dispergierte Prüfsubstanzen können nach besonderen Dosiermethoden zugesetzt werden; siehe Anlage 5).
39. Die Prüfsubstanz zusetzen, sobald sich das System stabilisiert und der gelöste organische Kohlenstoff (DOC) im organischen Medium weitgehend (um etwa 80 %) abgenommen hat. Es muss sichergestellt werden, dass alle Anlagen mit gleicher Wirksamkeit funktionieren, bevor die Prüfsubstanz zugesetzt wird; ist dies nicht der Fall, ist es in der Regel sinnvoll, die einzelnen Schlämme zu mischen und die einzelnen Anlagen erneut mit identischen Schlammmengen zu beschicken. Wird ein Inokulum aus (etwa) 2,5 g/l (Trockengewicht) Belebtschlamm verwendet, so kann die Prüfsubstanz ab Testbeginn zugesetzt werden, denn die direkte Zugabe steigender Mengen von Testbeginn an hat den Vorteil, dass der Belebtschlamm möglicherweise besser an die Prüfsubstanz adaptiert wird. Wie immer die Prüfsubstanz zugegeben wird, empfiehlt es sich, die Dosierrate und/oder die Mengen in den Vorratsgefäßen regelmäßig zu messen.
Handhabung von Belebtschlamm
40. Je nach Qualität und Konzentration des organischen Mediums, Betriebsbedingungen, Art der vorhandenen Mikroorganismen und Einfluss der Prüfsubstanz und unabhängig vom verwendeten Inokulum stabilisiert sich die Konzentration der Belebtschlamm-Feststoffe während der Prüfung in der Regel im Bereich von 1 bis 3 g/l (Trockengewicht).
41. Entweder die in den Belüftungsgefäßen suspendierten Feststoffe mindestens wöchentlich bestimmen, wobei der Überschussschlamm verworfen wird, um die Konzentration zwischen 1 und 3 g/l (Trockengewicht) zu halten, oder das mittlere Schlammalter auf einem konstanten Wert (gewöhnlich innerhalb einer Bandbreite von 6 bis 10 Tagen) halten. Wird beispielsweise eine Schlammverweilzeit (sludge retention time, SRT) von 8 Tagen gewählt, sollte täglich 1/8 der im Belüftungsgefäß befindlichen Belebtschlammmenge abgezogen und verworfen werden. Dieser Vorgang ist täglich oder, vorzugsweise, mithilfe einer intermittent arbeitenden automatischen Pumpe zu wiederholen. Das Halten der Konzentration suspendierter Feststoffe auf einem konstanten Wert oder innerhalb einer engen Bandbreite garantiert keine konstante Schlammverweilzeit; letztere ist die Betriebsvariable, die den Wert der Prüfsubstanzkonzentration im Ablauf bestimmt.
42. Während der gesamten Prüfungsdauer zumindest täglich den an den Wänden des Belüftungs- und des Absetzungsgefäßes (Separator) anhaftenden Schlamm entfernen und resuspendieren. Alle Röhren und Schlauchleitungen regelmäßig kontrollieren und reinigen, um einen Bewuchs mit Biofilm zu vermeiden. Abgesetzten Schlamm aus dem Absetzungsgefäß (Separator) in das Belüftungsgefäß zurückführen, vorzugsweise durch intermittentes Pumpen. Beim Porous-Pot-System gibt es keine Schlammrückführung; es ist jedoch sicherzustellen, dass saubere Innentöpfe eingesetzt werden, bevor das Gefäßvolumen signifikant ansteigt (Nummer 21).
43. Bei Husmann-Anlagen kann es vorkommen, dass sich der Schlamm schlecht absetzt und verlorengeht. Diese Mängel können in Prüf- und Kontrollanlagen mit einer oder mehreren der nachstehend angeführten Maßnahmen zeitgleich behoben werden:
- Regelmäßige, z.B. wöchentliche Zuführung von frischem Schlamm oder Flockungsmittel (z.B. je Gefäß 2 ml einer 50 g/l-FeCl3-Lösung), wobei jedoch sicherzustellen ist, dass es nicht zu einer Reaktion oder Präzipitation der Prüfsubstanz mit FeCl3 kommt;
- Ersetzung der Druckluftpumpe durch eine Peristaltikpumpe, um einen dem zuzuführenden Zulauf in etwa entsprechenden Schlammrücklauf und die Entwicklung eines anaeroben Milieus im abgesetzten Schlamm zu ermöglichen (die Geometrie der Druckluftpumpe begrenzt den Mindestdurchfluss des Rücklaufschlamms auf ungefähr das 12-fache der Zulaufmenge);
- intermittentes Zupumpen von Schlamm aus dem Absetzungsgefäß (Separator) in das Belüftungsgefäß (z.B. für 5 Minuten alle 2,5 Std, um statt 1 Liter/Std. 1,5 Liter/Std. zurückzuführen);
- Verwendung eines nichttoxischen schwach konzentrierten Antischaummittels (z.B. Silikonöl) zur Vermeidung von Verlusten durch Schaumbildung;
- kurze Luftschockstöße durch den Schlamm im Absetzungsgefäß (Separator) (z.B. stündlich 10 Sekunden);
- Intervalldosierung des organischen Medium in das Belüftungsgefäß (z.B. stündlich für jeweils 3 bis 10 Minuten).
Probenahme und Analytik
44. Konzentration an gelöstem Sauerstoff, Temperatur und pH-Wert des Belebtschlamms in den Belüftungsgefäßen in regelmäßigen Zeitabständen messen. Dabei ist sicherzustellen, dass stets ausreichend Sauerstoff vorhanden ist (> 2 mg/l) und die Temperatur innerhalb der erforderlichen Spanne (normalerweise zwischen 20 und 25 °C) liegt. Durch Zudosierung von kleinen Mengen einer anorganischen Base oder Säure ins Belüftungsgefäß oder in den Zulauf oder durch Erhöhung der Pufferkapazität des organischen Mediums (siehe Nummer 27) den pH- Wert auf 7,5 ± 0,5 konstant halten. Kommt es zur Nitrifikation, entsteht Säure, d. h. bei Oxidation von 1 mg N wird das Äquivalent von ungefähr 7 mg CO3- erzeugt. Die Häufigkeit der Messung richtet sich nach dem Messparameter und der Systemstabilität und kann zwischen täglich und wöchentlich variieren.
45. Den DOC- bzw. den CSB-Wert in den Kontroll- und Prüfgefäßzuläufen messen. Die Konzentration der Prüfsubstanz im Zulauf der Prüfanlage durch spezifische Analyse messen oder anhand der Konzentration in der Stammlösung (Nummer 31), der verwendeten Menge und der der Prüfanlage zudosierten Abwassermenge schätzen. Es empfiehlt sich, die Konzentration der Prüfsubstanz zu berechnen, um die Streuung der Konzentrationsdaten zu verringern.
46. Aus (z.B. über 24 Stunden) gesammeltem Ablauf geeignete Proben ziehen und durch eine Membran einer Porengröße von 0,45 pm filtern oder bei 40.000 m/s2 für ungefähr 15 Min. zentrifugieren. Erweist sich das Filtern als schwierig, sollte zentrifugiert werden. Der DOC- bzw. der CSB-Wert sollte mindestens doppelt bestimmt werden, um die vollständige Bioabbaubarkeit zu ermitteln; die primäre Bioabbaubarkeit erforderlichenfalls durch eine prüfsubstanzspezifische Analyse messen.
47. Die Verwendung des CSB-Wertes kann bei geringen Konzentrationen zu analytischen Problemen führen und wird daher nur empfohlen, wenn eine ausreichend hohe Prüfkonzentration (etwa 30 mg/l) verwendet wird. Bei stark adsorbierenden chemischen Substanzen sollte nach einem prüfsubstanzspezifischen Analyseverfahren auch die Menge der adsorbierten chemischen Substanz im Schlamm gemessen werden.
48. Die Probenahmehäufigkeit richtet sich nach der voraussichtlichen Prüfungsdauer. Empfohlen werden Probenahmen dreimal wöchentlich. Sobald die Anlagen ordnungsgemäß funktionieren, sollten nach der Beschickung mit Prüfsubstanz bis zum Erreichen eines Gleichgewichtszustands (steady state) 1 bis maximal 6 Wochen vorgesehen werden. In der Plateau-Phase (Nummer 59), die in der Regel 3 Wochen anhält, sollten wenn möglich mindestens 15 gültige Werte ermittelt werden, um das Prüfungsergebnis auswerten zu können. Die Prüfung kann abgeschlossen werden, wenn ein ausreichender Eliminationsgrad erreicht ist (z.B. > 90 %) und die genannten 15 Werte aus Analysen, die drei Wochen lang an jedem Wochentag durchgeführt wurden, vorliegen. Faustregel: Nach Zugabe der Prüfsubstanz sollte eine Prüfungsdauer von 12 Wochen nicht überschritten werden.
49. Nitrifiziert der Schlamm und sollen die Auswirkungen der Prüfsubstanz auf die Nitrifikation untersucht werden, sind Proben aus dem Ablauf der Prüf- und der Kontrollanlage mindestens einmal wöchentlich auf Ammonium und/oder Nitrit sowie Nitrat zu untersuchen.
50. Alle Analysen sollten zügig durchgeführt werden; dies gilt vor allem für Stickstoffbestimmungen. Müssen Analysen aufgeschoben werden, sind die Proben bei etwa 4 °C in randvollen, dicht verschlossenen Flaschen dunkel zu lagern. Müssen Proben für länger als 48 Stunden gelagert werden, sind sie durch Tiefgefrieren, Ansäuern (z.B. mit 10 ml/l einer 400 g/l-Lösung Schwefelsäure) oder Zugabe einer geeigneten toxischen Substanz (z.B. 20 ml/l einer 10 g/l-Lösung Quecksilber-(II)-Chlorid) haltbar zu machen. Dabei ist sicherzustellen, dass die angewandte Konservierungsmethode die Analyseergebnisse nicht beeinträchtigt.
Koppeln von Prüfanlagen
51. Bei Anlagenkopplung (Anlage 3) täglich dieselbe Menge Belebtschlamm (150 ml - 1.500 ml für Belüftungsgefäße eines Fassungsvermögens von 3 Litern Liquorkultur) zwischen den Belüftungsgefäßen der Prüf- und der Kontrollanlage austauschen. Lagert sich die Prüfsubstanz stark an den Schlamm an, nur den Überstand der Absetzungsgefäße (Separatoren) austauschen. In beiden Fällen wird Berechnung der Prüfungsergebnisse einen Berichtigungsfaktor anwenden (Nummer 55).
Auswertung der Ergebnisse
52. Den Prozentsatz der Elimination der Prüfsubstanz, basierend auf der DOC- bzw. der CSB-Messung, in den vorgegebenen Zeitabständen nach folgender Gleichung berechnen:
| Cs - (E - Eo) | ||
| Dt = |
| x 100 |
| Cs |
Dabei sind:
Dt = der DOC- bzw. CSB-Eliminationsgrad (in %) zum Zeitpunkt t
Cs = der DOC- bzw. CSB-Wert der Prüfsubstanz im Zulauf, vorzugsweise anhand der Stammlösung geschätzt (mg/l)
E = der gemessene DOC- oder CSB-Wert im Ablauf der Prüfanlage zum Zeitpunkt t (mg/l)
Eo = der gemessene DOC- oder CSB-Wert im Ablauf der Kontrollanlage zum Zeitpunkt t (mg/l)
53. Der Grad der Elimination des organischen Mediums in der Kontrollanlage, basierend auf der DOC- bzw. der CSB-Messung, ist eine nützliche Größe für die Beurteilung der Bioabbauaktivität des Belebtschlamms während des Prüfung. Die prozentuale Elimination nach folgender Gleichung berechnen:
| CM - Eo | ||
| DB = |
| x 100 |
| CM |
Dabei sind:
DB = der DOC- bzw. CSB-Eliminationsgrad (in %) des organischen Mediums in der Kontrollanlage zum Zeitpunkt t
CM = der DOC- bzw. CSB-Wert des organischen Mediums im Zulauf der Kontrollanlage (mg/l)
Wahlweise kann der Prozentsatz der Elimination des durch das organische Medium PLUS die Prüfsubstanz bedingten DOC- bzw. CSB-Wertes nach folgender Gleichung berechnet werden:
| CT - E | ||
| DT = |
| x 100 |
| CT |
Dabei sind:
DT = der Eliminationsgrad des DOC bzw. des CSB (in %) im Gesamtzulauf (organisches Medium PLUS Prüfsubstanz) der Prüfanlage
CT = der DOC bzw. CSB im Gesamtzulauf (organisches Medium PLUS Prüfsubstanz) der Prüfanlage oder anhand von Stammlösungen berechneter DOC bzw. CSB (mg/l)
54. Die Abnahme der Prüfsubstanz, soweit nach einer spezifischen Analysemethode gemessen, in den vorgegebenen Zeitabständen nach folgender Gleichung berechnen:
| Si - Se | ||
| DST = |
| x 100 |
| Si |
Dabei sind:
DST = der Primäreliminationsgrad (in %) der Prüfsubstanz zum Zeitpunkt t
Si = die gemessene oder geschätzte Konzentration der Prüfsubstanz im Zulauf der Prüfanlage (mg/l)
Se = die gemessene Konzentration der Prüfsubstanz im Ablauf der Prüfanlage zum Zeitpunkt t (mg/l)
55. Bei gekoppelten Anlagen die durch den Schlammaustausch bedingte Verdünnung der Prüfsubstanz im Belüftungsgefäß durch einen Berichtigungsfaktor kompensieren (siehe Anlage 3). Bei einer mittleren hydraulischen Verweilzeit von 6 Stunden und einem Austausch der Hälfte der Belebtschlammmenge im Belüftungsgefäß müssen die täglich berechneten Eliminationswerte (Dt, Nummer 52) berichtigt werden, um anhand der nachstehenden Gleichung den realen Eliminationsgrad 'Dtc' der Prüfsubstanz zu ermitteln:
| 4Dt - 100 | |
| Dtc = |
|
| 3 |
Angabe der Prüfergebnisse
56. Die prozentuale Elimination Dt (oder Dtc) und Dst, soweit dieser Wert vorliegt, gegen die Zeit auftragen (siehe Anlage 2). Aus der Eliminationskurve der Prüfsubstanz (per se oder als DOC-Wert) lassen sich bestimmte Schlüsse über den Abnahmeprozess ziehen.
Adsorption
57. Manifestiert sich bei der Prüfsubstanz bereits zu Beginn des Tests eine starke DOC-Elimination, so wird die Prüfsubstanz wahrscheinlich durch Adsorption an die Belebtschlammfeststoffe eliminiert. Dies kann durch Bestimmung der adsorbierten Prüfsubstanz anhand eines substanzspezifischen Analysenverfahrens nachgewiesen werden. Die DOC-Elimination adsorptionsfähiger chemischer Substanzen bleibt erfahrungsgemäß nicht während der gesamten Prüfung hoch; sie ist eher zu Beginn der Prüfung hoch und fällt dann allmählich auf ein stabiles Niveau. Könnte die adsorptionsfähige Prüfsubstanz jedoch auf die eine oder andere Weise eine Akklimatisation der Mikrobenpopulation herbeiführen, würde die DOC-Elimination der Prüfsubstanz anschließend zunehmen und einen hohen Plateauwert erreichen.
Latenzphase (Lag-Phase)
58. Wie bei statischen Screeningtests durchlaufen viele Prüfsubstanzen eine Latenzphase, bevor sie vollständig biologisch abgebaut werden. In dieser Lag-Phase akklimatisieren bzw. adaptieren sich die Zersetzungsbakterien, ohne dass die Prüfsubstanz in nennenswertem Maße abnimmt; erst nach dieser Phase setzt das Bakterienwachstum ein. Die Phase endet und die Abbauphase gilt als begonnen, wenn etwa 10 % der anfänglichen Menge Prüfsubstanz abgebaut sind (nach der Adsorption, falls es dazu kommt). Die Lag-Phase ist oft sehr variabel und schwer reproduzierbar.
Plateauphase
59. Die Plateauphase einer Eliminationskurve im kontinuierlichen Test ist definiert als die Phase, in der maximale Zersetzung stattfindet. Sie sollte mindestens 3 Wochen dauern, in denen etwa 15 gültige Messwerte ermittelt werden.
Mittlerer Eliminationsgrad der Prüfsubstanz
60. Diesen Mittelwert anhand der Eliminationswerte (Dt) der Prüfsubstanz in der Plateauphase berechnen. Auf die nächste ganze Zahl (1 %) gerundet, entspricht dieser gerundete Wert dem Eliminationsgrad der Prüfsubstanz. Ferner wird empfohlen, das 95 %-Konfidenzniveau für den Mittelwert zu berechnen.
Elimination des organischen Mediums
61. Die prozentuale Elimination des organischen Mediums in der Kontrollanlage (DB), basierend auf dem DOC- bzw. CSB-Wert, gegen die Zeit auftragen. Dabei ist der mittlere Eliminationsgrad auf dieselbe Weise anzugeben wie für die Prüfsubstanz (Nummer 60).
Hinweis auf den biologischen Abbau
62. Adsorbiert die Prüfsubstanz nicht signifikant an den Belebtschlamm und hat die Eliminationskurve die typische Form einer Bioabbaukurve mit Latenz-, Abbau- und Plateauphasen (Nummern 58, 59), so kann die gemessene Elimination mit Sicherheit dem biologischen Abbau zugeschrieben werden. War die Abnahme im Anfangsstadium hoch, kann der Simulationstest nicht zwischen biologischen und abiotischen Eliminationsprozessen differenzieren. In derartigen Fällen und in anderen Fällen, in denen Zweifel am biologischen Abbau bestehen (z.B. wenn die Prüfsubstanz ausgast (stripping)), die Adsorption der Prüfsubstanzen untersuchen, oder anhand von Parametern, die biologische Prozesse genau angeben, zusätzliche statische Bioabbaubarkeitstests durchführen. Zu derartigen Tests zählen die Sauerstoffaufnahmemethoden (Kapitel C.4 (D, E, F) dieses Anhangs (6)) oder Kohlen-dioxid-Entwicklungstests (Kapitel C.4 C dieses Anhangs (6)) oder die ISO-Headspace-Methode (18), bei der ein zuvor exponiertes Inokulum aus dem Simulationstest verwendet wird. Wurden sowohl die DOC-Abnahme als auch die Prüfsubstanzabnahme gemessen, zeigen große Unterschiede (d. h. wenn erstere geringer ist als letztere) zwischen den Abnahmeprozentwerten die Präsenz intermediärer organischer Produkte in den Abläufen an, die möglicherweise schwerer abzubauen sind als die Ausgangssubstanz.
Gültigkeit der Prüfergebnisse
63. Die Bestimmung des Eliminationsgrades des organischen Mediums (Nummer 53) in der Kontrollanlage liefert Informationen über das normale Abbauverhalten des Inokulums. Der Test kann als gültig angesehen werden, wenn der Grad der DOC- bzw. der CSB-Elimination in der (den) Kontrollanlage(n) nach zwei Wochen > 80 % beträgt und nichts Ungewöhnliches festgestellt wurde.
64. Wurde eine leicht biologisch abbaubare (Referenz-)Substanz verwendet, sollte der Abbaubarkeitsgrad (Dt, Nummer 52) > 90 % betragen.
65. Wurde der Test unter nitrifizierenden Bedingungen durchgeführt, sollte die mittlere Konzentration in den Abläufen < 1 mg/l Ammonium-N und < 2 mg/l Nitrit-N betragen.
66. Sind diese Kriterien (Nummern 63-65) nicht erfüllt, müssen der Test mit einem Inokulum aus anderer Quelle wiederholt, eine Referenzsubstanz getestet und alle Testverfahren überprüft werden.
Prüfbericht
67. Der Prüfbericht muss Folgendes umfassen:
Prüfsubstanz:
- Kenndaten;
- physikalischer Zustand und, soweit relevant, physikalisch-chemische Eigenschaften.
Prüfbedingungen:
- Art des Prüfsystems; etwaige Änderungen bei Prüfungen nicht löslicher und flüchtiger chemischer Substanzen;
- Art des organischen Mediums;
- Anteil (und Art) der Industrieabwässer im kommunalen Abwasser, soweit bekannt;
- Inokulum, Art und Probenahmestelle(n), Konzentration und etwaige Vorbehandlung;
- Prüfsubstanz-Stammlösung: DOC- und TOC-Gehalt; bei Suspension: Art der Aufbereitung; verwendete Testkonzentration; falls außerhalb der Bandbreite von 10-20 mg/l DOC: Begründung; Zugabemethode; Datum der ersten Zugabe; etwaige Änderungen;
- mittleres Schlammalter und mittlere hydraulische Verweilzeit; Methode des Überschussschlammabzugs; Methoden zur Verminderung der Bildung von Blähschlamm, von Schlammverlusten usw.;
- angewandte Analysetechniken;
- Testtemperatur;
- Eigenschaften wie Blähschlammbildung, Schlammvolumenindex (Sludge Volume Index, SVI), suspendierte Stoffe im Ablauf (Mixed Liquor Suspended Solids, MLSS);
- etwaige Abweichungen von Standardverfahren und etwaige Umstände, die die Testergebnisse möglicherweise beeinträchtigt haben.
Prüfergebnisse:
- alle Messdaten (DOC, CSB, spezifische Analysen, pH-Wert, Temperatur, Sauerstoffkonzentration, suspendierte Feststoffe, N-Chemikalien, soweit relevant;
- alle Berechnungswerte für Dt (oder Dtc, DB, DSt in tabellarischer Form und als Eliminationskurven;
- Aussagen zu Latenz- und Plateau-Phasen, Prüfungsdauer, Eliminationsgrad der Prüfsubstanz und des organischen Mediums in der Kontrollanlage sowie statistische Informationen und Angaben zur Bioabbaubarkeit und Gültigkeit des Tests;
- Diskussion der Ergebnisse.
1. Swisher RD (1987). 'Surfactant Biodegradation', 2. Ausgabe. Marcel Dekker Inc. New York, S. 1085 ff.
2. Deutsche Bundesregierung (1962). Verordnung über die Abbaubarkeit von Detergenzien in Wasch- und Reinigungsmitteln. Bundesgesetzblatt, Teil I, Nr. 49: 698-706.
3. Painter HA and King EF (1978a). WRc porous-pot method for assessing biodegradability. Technischer Bericht Nr. 70, Water Research Centre, Medmenham, Vereinigtes Königreich.
4. Painter HA and King EF (19 78b). The effect of phosphate and temperature on growth of activated sludge and on biodegradation of surfactants. Wat. Res. 12: 909-915.
5. Eckenfelder, W.W (19) US EPA.
6. Kapitel C.4 dieses Anhangs, Bestimmung der 'leichten' biologischen Abbaubarkeit.
7. Kapitel C.12 dieses Anhangs, Biologische Abbaubarkeit - Modifizierter SCAS-Test.
8. Kapitel C.19 dieses Anhangs, Schätzung des Adsorptionskoeffizienten (KOC) im Boden und in Klärschlamm mittels der Hochdruck-Flüssigchromatografie (HPLC).
9. Gerike P and Fischer WK (1979). A correlation study of biodegradability determinations with various chemicals in various tests. Ecotox. Env. Saf. 3: 157-173.
10. Gerike P and Fischer WK (1981), as (9), II Additional results and conclusions. Ecotox. Env. Saf. 5: 45-55.
11. Painter HA and Bealing D (1989). Experience and data from the OECD activated sludge simulation test, S. 113-138, In: Laboratory tests for simulation of water treatment processes. CEC Water Pollution Report 18. Eds. Jacobsen BN, Muntau H, Angeletti G.
12. ISO 11733 (1995; überarbeitet 2004). Bestimmung der Elimination und der biologischen Abbaubarkeit organischer Verbindungen in einem wässrigen Medium - Belebtschlamm-Simulationstest.
13. Birch RR (1982). The biodegradability of alcohol ethoxylates. XIII Jornado Com. Espanol. Deterg.: 33-48.
14. Birch RR (1984). Biodegradation of noniomic surfactants. J.A.O.C, S. 61 (2): 340-343.
15. Gerike P, Fischer WK and Holtmann W (1980). Biodegradability determinations in trickling filter units compared with the OECD confirmatory test. Wat.Res. 14: 753-758.
16. Baumann U, Kuhn G and Benz M. (1998). Einfache Versuchsanordnung zur Gewinnung gewässerökologisch relevanter Daten, UWSF - Z. Umweltchem. Ökotox. 10: 214-220.
17. Her Majesty's Stationery Office (1982). Assessment of biodegradability. Methods for the examination of waters and associated materials, S. 91-98 ISBN 011 751661 9.
18. ISO 14593 (1998). Wasserbeschaffenheit - Bestimmung der vollständigen biologischen Abbaubarkeit organischer Substanzen im wässrigen Medium - Verfahren mittels Bestimmung des anorganischen Kohlenstoffs in geschlossenen Flaschen.
| Anlage 1 |
Abbildung 1 Apparatur zur Bestimmung der biologischen Abbaubarkeit
Husmann-Anlage
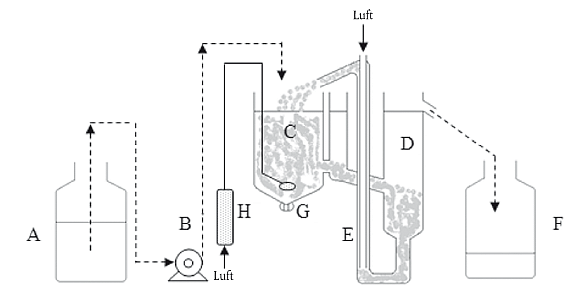
A. Vorratsgefäß
B. Dosierpumpe
C. Belüftungsgefäß (3 l-Volumen)
D. Absetzungsgefäß
E. Druckluftpumpe
F. Sammelgefäß
G. Fritte
H. Luftmengenmesser
Abbildung 2 Apparatur zur Bestimmung der biologischen Abbaubarkeit
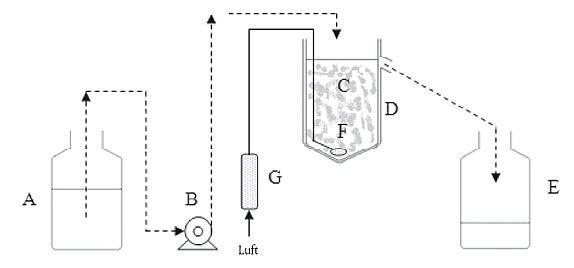
'Porous-Pot'-Anlage
A. Vorratsgefäß
B. Dosierpumpe
C. Poröses Belüftungsgefäß
D. Undurchlässiges Außengefäß
E. Sammelgefäß
F. Diffusor
G. Luftmengenmesser
Abbildung 3 Einzelheiten des 3-Liter-'Porous-Pot'-Belüftungsgefäßes

| Beispiel einer Eliminationskurve | Anlage 2 |

| [Zur Information] | Anlage 3 |
Koppeln von Prüfanlagen
Um die Mikrobenpopulationen in Schlämmen in einer Prüfanlage, die mit Abwasser PLUS Prüfsubstanz beschickt wird, und in einer Kontrollanlage, die nur mit Abwasser beaufschlagt wird, zu egalisieren, wurde der Schlamm täglich ausgetauscht (1). Der Vorgang wurde als 'koppeln' bezeichnet und die Methode ist als Anlagenkopplung bekannt. Die Kopplung wurde ursprünglich mit Husmann-Belebtschlammanlagen, anschließend aber auch mit Porous-Pot-Anlagen durchgeführt (2)(3). Es wurden keine signifikanten Ergebnisunterschiede zwischen nicht gekoppelten und gekoppelten Anlagen, ob Husmann- oder Porous-Pot-Anlagen, festgestellt, so dass der Zeit- und Arbeitsaufwand für das Koppeln der Anlagen mit keinerlei Vorteil verbunden ist.
Beim Schlammaustausch kann der Eindruck einer beträchtlichen Prüfsubstanzabnahme entstehen, da ein Teil der Substanz übertragen wird und die Prüfsubstanzkonzentrationen in den Abläufen der Prüf- und der Kontrollanlagen mehr oder weniger gleich sind. Folglich müssen Berichtigungsfaktoren angewendet werden, die von der ausgetauschten Fraktion und der mittleren hydraulischen Verweilzeit abhängen. Weitere Einzelheiten zur Berechnung wurden veröffentlicht (1).
Der berichtigte DOC- bzw. CSB-Eliminationsgrad wird nach der folgenden allgemeingültigen Formel berechnet:
Dtc = (Dt - 100 ⋅ a ⋅ r/12)/(1 - a ⋅ r/12) %
Dabei sind:
Dtc = der berichtigte DOC- bzw. CSB-Eliminationsgrad (in %)
Dt = die bestimmte DOC- bzw. CSB-Abnahme Eliminationsgrad (in %)
a = die ausgetauschte Fraktion des Volumens der Belebtschlammanlagen
r = die mittlere hydraulische Verweilzeit (in Std.)
Wird beispielsweise die Hälfte des Volumens des Belüftungsgefäßes ausgetauscht (a = 0,5) und beträgt die mittlere hydraulische Verweilzeit 6 Stunden, so ist die Korrekturformel
| 4Dt - 100 | |
| Dtc = |
|
| 3 |
Literatur
1. Fischer W, Gerike P, Holtmann W (1975). Biodegradability Determinations via Unspecific Analyses (Chemical Oxygen Demand, DOC) in Coupled Units of the OECD Confirmatory Test. I The test. Wat. Res. 9: 1131-1135.
2. Painter HA, Bealing DJ (1989). Experience and Data from the OECD Activated Sludge Simulation Test, S. 113-13 8. In: Laboratory Tests for Simulation of Water Treatment Processes CEC Water Pollution Report 18. Eds. Jacobsen BN, Muntau H, Angeletti G.
3. Painter HA, King EF (1978). Water Research Centre Porous Pot Method for Assessing Biodegradability. Technischer Bericht TR70, Water Research Centre, Stevenage, Vereinigtes Königreich.
| Beurteilung der Belebtschlamm-Inhibition | Anlage 4 |
Hemmung durch Prüfsubstanzen
1. Es kann vorkommen, dass eine chemische Substanz (oder ein Abwasser) im Simulationstest nicht abgebaut wird bzw. nicht abnimmt und sogar eine hemmende (inhibierende) Wirkung auf die Schlammmikroorganismen entfaltet. Andere chemische Substanzen werden in niedrigen Konzentrationen biologisch abgebaut, wirken jedoch in höheren Konzentrationen inhibierend (Hormesis). Inhibitionseffekte wurden möglicherweise in einem früheren Stadium festgestellt oder lassen sich im Toxizitätstest bestimmen, bei dem ein Inokulum verwendet wird, das dem im Simulationstest verwendeten Inokulum ähnlich oder identisch ist (1). Zu derartigen Methoden zählen die Prüfung der Atmungshemmung (Kapitel C.11 dieses Anhangs (2) und ISO 8192(3)) oder die Bestimmung der Hemmwirkung der Wasserbestandteile auf das Wachstum der Belebtschlamm-Mikroorganismen (ISO 15522 (4)).
2. Im Simulationstest manifestiert sich eine Hemmung dadurch, dass die Differenz zwischen dem DOC-Gehalt (bzw. dem CSB) des Prüfgefäßablaufs und dem des Kontrollgefäßablaufs größer ist als der mit der Prüfsubstanz zugeführte DOC. Anders ausgedrückt, die prozentuale Abnahme des DOC (und des biochemischen Sauerstoffbedarfs (BSB), des chemischen Sauerstoffbedarfs (CSB), und/oder von NH+4) des organischen Kulturmediums ist geringer, wenn bei Prüfsubstanz zugeführt wird. In diesem Fall sollte der Test mit einer geringeren Prüfsubstanzkonzentration so lange wiederholt werden, bis ein Niveau erreicht ist, bei dem kein Hemmungseffekt mehr auftritt, wobei die Konzentration u. U. so weit verringert werden sollte, bis die Prüfsubstanz biologisch abgebaut ist. Hat die Prüfsubstanz (oder das Abwasser) jedoch in allen getesteten Konzentrationen eine nachteilige Wirkung auf den Prozess, so deutet dies darauf hin, dass die chemische Substanz nur schwer und möglicherweise überhaupt nicht biologisch abbaubar ist; es könnte jedoch sinnvoll sein, den Test mit Belebtschlamm aus einer anderen Quelle zu wiederholen und/oder den Schlamm schrittweise zu akklimatisieren.
3. Umgekehrt sollte die Konzentration der Prüfsubstanz erhöht werden, wenn diese bereits im ersten Simulationsversuch biologisch abgebaut wird und ermittelt werden muss, ob die chemische Substanz einen Inhibitionseffekt entfalten könnte.
4. Bei der Bestimmung von Hemmungsgraden sollte nicht außer Acht gelassen werden, dass sich Belebtschlammpopulationen verändern können und dass die Mikroorganismen mit der Zeit möglicherweise eine Toleranz gegenüber hemmenden Substanzen entwickeln.
5. Berechnung des Hemmungsgrades:
Die gesamten prozentualen Abnahmen (Ro) von BSB, DOC, CSB usw. können für die Prüf- und die Kontrollanlage nach folgender Gleichung berechnet werden:
Ro = 100 (I - E)/I %
Dabei sind:
I = die Zulaufkonzentration von BSB, DOC, CSB usw. in Prüf- oder Kontrollgefäßen (mg/l)
E = die entsprechende Ablaufkonzentrationen (mg/l).
I und E müssen aufgrund des auf die Prüfsubstanz in den Prüfanlagen zurückzuführenden DOC korrigiert werden, um korrekt berechnete Hemmungsprozentsätze zu gewährleisten.
Der auf die Prüfsubstanz zurückzuführende Hemmungsgrad kann nach folgender Gleichung berechnet werden:
% Hemmungsprozentsatz = 100 (Rc - Rt)/Rc
Dabei sind:
Rc = die prozentuale Abnahme in den Kontrollgefäßen
Rt = die prozentuale Abnahme in den Prüfgefäßen
Literatur
1. Reynolds L et al. (1987). Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere 16: 2259.
2. Kapitel C.11 dieses Anhangs, Biologische Abbaubarkeit - Belebtschlamm: Prüfung der Atmungshemmung.
3. ISO 8192 (2007) Wasserbeschaffenheit - Bestimmung der Hemmung des Sauerstoffverbrauchs von Belebtschlamm nach Kohlenstoff- und Ammonium-Oxidation.
4. ISO 15522 (1999) Wasserbeschaffenheit - Bestimmung der Hemmwirkung der Wasserbestandteile auf das Wachstum der Belebtschlamm-Mikroorganismen.
| Schwer wasserlösliche Prüfsubstanzen - flüchtige chemische Substanzen | Anlage 5 |
Schwer wasserlösliche chemische Substanzen
Es wurden offensichtlich nur wenige Berichte über die Verwendung schwer wasserlöslicher oder nicht wasserlöslicher chemischer Substanzen in Tests zur Simulation der Abwasserbehandlung veröffentlicht (1)(2)(3).
Es existiert keine einfache Methode zur Dispergierung der Prüfsubstanz, die für alle nicht wasserlöslichen chemischen Substanzen geeignet wäre. Zwei der vier in ISO 10634 (4) beschriebenen Verfahren scheinen sich zur Dispergierung von Prüfsubstanzen für die Simulationstestung zu eignen; sie sehen den Einsatz von Emulgatoren und/oder Ultraschallenergie vor. Die resultierende Dispersion sollte mindestens 24 Stunden lang stabil sein. Hinreichend stabilisierte Dispersionen in einem konstant gerührten Behälter (Nummer 38) werden anschließend, separat vom Haushalts- oder synthetischen Abwasser, in das Belüftungsgefäß dosiert.
Soweit die Dispersionen stabil sind, wird untersucht, wie die Prüfsubstanz in dispergierter Form bestimmt werden kann. Da der DOC-Gehalt in diesem Fall wahrscheinlich ungeeignet ist, sollte eine spezifische Analysemethode für die Prüfsubstanz entwickelt werden, die sich für Abflüsse, Feststoffe in Abflüssen und Belebtschlämme gleichermaßen eignet. Danach sollte der Verbleib der Prüfsubstanz im simulierten Belebtschlammprozess (Flüssig- und Festphasen) bestimmt werden. Auf diese Weise wird eine 'Massenbilanz' erstellt, anhand deren festgestellt werden könnte, ob die Prüfsubstanz biologisch abgebaut wurde. Dies würde jedoch nur die primäre Bioabbaubarkeit betreffen. Vollständige Bioabbaubarkeit sollte in einem respirometrischen Test auf leichte biologische Abbaubarkeit (Kapitel C.4 dieses Anhangs (5) C, F oder D) nachgewiesen werden, bei dem als Inokulum Schlamm eingesetzt wird, der der Prüfsubstanz im Simulationstest ausgesetzt war.
Flüchtige chemische Substanzen
Die Verwendung flüchtiger chemischer Substanzen in Tests zur Simulation der Abwasserbehandlung ist umstritten und problematisch. Wie schon bei schwer wasserlöslichen Prüfsubstanzen scheint es kaum veröffentlichte Berichte über Simulationstests zu geben, bei denen flüchtige chemische Substanzen zum Einsatz kamen. Ein konventionelles Rührwerk wird durch Abdichten der Belüftungs- und Absetzgefäße, Messung und Kontrollmessung des Luftflusses mittels Luftfluss-messern und Passieren des austretendes Gases durch Filter zum Auffangen flüchtiger organischer Stoffe umgerüstet. In einigen Fällen wird eine Vakuumpumpe verwendet, um das austretende Gas durch eine Kühlfalle oder ein Purge-&-Trap-System für gaschromatographische Analysen mit Tenax- und Silikagel-Filtern zu führen. Die im Filter festgehaltene Prüfsubstanz kann analytisiert werden.
Der Test wird in zwei Phasen durchgeführt. Die Anlagen werden zunächst ohne Schlamm betrieben; synthetisches Abwasser PLUS Prüfsubstanz werden jedoch in das Belüftungsgefäß gepumpt. Es werden Zulauf- und Ablaufproben sowie Proben des austretenden Gases gezogen und einige Tage lang auf Präsenz von Prüfsubstanz analysiert. Aus den so erhobenen Daten kann der Prozentsatz (Rvs) der aus dem System gelösten und entfernten (gestrippten) Prüfsubstanz errechnet werden.
Anschließend wird unter denselben Betriebsbedingungen wie bei der Stripping-Studie der normale biologische Test (mit Schlamm) durchgeführt. DOC bzw. CSB werden ebenfalls gemessen, um sicherzustellen, dass die Anlagen ordnungsgemäß funktionieren. In der ersten Testphase wird die Prüfsubstanz im Zulauf, im Ablauf und in austretenden Gas sporadisch analysiert; nach der Akklimatisation werden diese Analysen häufiger durchgeführt. Auch hier können anhand der Daten im Gleichgewichtszustand (steady state) die aus allen (physikalischen und biologischen) Abbauprozessen resultierende prozentuale Abnahme der Prüfsubstanz in der Flüssigphase (RT) sowie der aus dem System gestrippte Anteil (RV) berechnet werden.
Berechnung:
- Beim nicht biologischen Test kann der Prozentsatz (RVP) der aus dem System gestrippten Prüfsubstanz nach folgender Gleichung berechnet werden:
SVP RVP = ⋅ 100 SIP Dabei sind:
RVP = die prozentuale Abnahme der Prüfsubstanz aufgrund von Verflüchtigung,
SVP = die im Filter aufgefangene Prüfsubstanz, angegeben als äquivalente Konzentration in der Flüssigphase (mg/l),
SIP = die Konzentration der Prüfsubstanz im Zulauf (mg/l). - Beim biologischen Test kann der Prozentsatz (RV) der aus dem System gestrippten Prüfsubstanz nach folgender Gleichung berechnet werden:
SV RV = ⋅ 100 SI Dabei sind:
RV = die prozentuale Abnahme der Prüfsubstanz aufgrund von Verflüchtigung im biologischen Test,
SV = die im biologischen Test im Filter aufgefangene Prüfsubstanz, angegeben als äquivalente Konzentration im flüssigen Zulauf (mg/l),
SI = die Konzentration der Prüfsubstanz im Zulauf (mg/l). - Beim biologischen Test kann die aus allen Abbauprozessen resultierende prozentuale Abnahme der Prüfsubstanz (RT) nach folgender Gleichung berechnet werden:
SE RT = 1 - ⋅ 100 SI Dabei ist:
SE = die Konzentration der Prüfsubstanz im (flüssigen) Ablauf (mg/l). - Die prozentuale Abnahme der Prüfsubstanz aufgrund des biologischen Abbaus PLUS Adsorption (RBA) kann somit nach folgender Gleichung berechnet werden:
RBA = (RT - RV)
Es sollten separate Tests durchgeführt werden, um zu bestimmen, ob die Prüfsubstanz adsorbiert wurde; wenn ja, kann eine weitere Korrektur vorgenommen werden.
- Ein Vergleich zwischen dem Anteil der Prüfsubstanz, der aus dem biologischen Prüfsystem gestrippt wurde (Rv), und dem Anteil, der aus dem nicht biologischen Prüfsystem gestrippt wurde (Rvp), ergibt den Gesamteffekt der biologischen Behandlung auf die Emission der Prüfsubstanz in die Atmosphäre.
Beispiel: Benzol
Schlammverweilzeit = 4 Tage
Synthetisches Abwasser; Verweilzeit = 8 Stunden
SIP = SI = 150 mg/l
SVP = 150 mg/l (SEP = 0)
SV = 22,5 mg/l
SE = 50 μg/l
Daher:
RVP = 100 %, RV = 15 %
RT = 100 % und RBA = 85 %.
Es wurde davon ausgegangen, dass sich Benzol nicht an den Schlamm anlagert.
Literatur
1. Horn JA, Moyer JE, Hale JH (1970). Biological degradation of tertiary butyl alcohol. Proc. 25th Ind. Wastes Conference Purdue Univ.: 939-854.
2. Pitter P, Chudoba J (1990). Biodegradability of organic substances in the aquatic environment. CRC Press. Boston, USA.
3. Stover EL, Kincannon DF (1983). Biological treatability of specific organic compounds found in chemical industry waste waters. J. Wat. Pollut. Control Fed. 55: 97.
4. ISO 10634 (1995) Wasserbeschaffenheit - Anleitung für die Vorbereitung und Behandlung von in Wasser schwer löslichen organischen Verbindungen für die nachfolgende Bestimmung ihrer biologischen Abbaubarkeit in einem wässrigen Medium.
5. Kapitel C.4 dieses Anhangs, Bestimmung der 'leichten' biologischen Abbaubarkeit.
| Auswirkungen der Schlammverweilzeit auf die Behandlungsfähigkeit chemischer Substanzen | Anlage 6 |
1. Die im Haupttext beschriebene Methode dient der Feststellung, ob die getesteten Substanzen (in der Regel Stoffe, die bekanntermaßen inhärent, aber nicht leicht biologisch abbaubar sind) innerhalb der für Kläranlagen geltenden Grenzen biologisch abgebaut werden können. Die Ergebnisse werden als prozentuale Abnahme und prozentualer biologischer Abbau angegeben. Die Betriebsbedingungen der Belebtschlammanlagen und die Wahl des Zulaufs lassen relativ breit gefächerte Prüfsubstanzkonzentrationen im Ablauf zu. Tests werden nur an Schlammfeststoffen in einer einzigen nominalen Konzentration oder bei einer einzigen nominalen Schlammverweilzeit (sludge retention time, SRT) durchgeführt, und die beschriebenen Verfahren für den Überschussschlammabzug können dazu führen, dass der SRT- Wert während des Tests sowohl von einem Tag zum anderen als auch während eines Tages beträchtlich variiert.
2. Bei dieser Variante (1)(2) wird die Schlammverweilzeit (wie dies auch bei Anlagen größeren Maßstabs der Fall ist) während jedes 24-Stunden-Zeitraums innerhalb sehr viel engerer Grenzen kontrolliert, wodurch sich eine konstantere Konzentration in den Abläufen ergibt. Es wird die Verwendung von Haushaltsabwasser empfohlen, da diese Abwasserart konsistentere und höhere Abnahmeprozentwerte ergibt. Darüber hinaus werden die Effekte verschiedener SRT-Werte untersucht, und in einer weiterreichenden Studie können die Effekte verschiedener Temperaturen auf die Ablaufkonzentration bestimmt werden.
3. Es besteht bisher kein allgemeines Einvernehmen darüber, welche kinetischen Modelle zugrunde liegen, wenn chemische Stoffe unter Abwasserbehandlungsbedingungen biologisch abgebaut werden. Auf die erhobenen Daten wurde das Monod-Modell (zur Vorhersage der Wachstumsgeschwindigkeit von Bakterien in Abhängigkeit von der Konzentration der Substrate) gewählt (1)(2), da die Methode nur zur Anwendung auf in großen Mengen produzierte chemische Substanzen bestimmt war, die in Abwasser in Konzentrationen von über 1 mg/l vorkommen. Die Gültigkeit des vereinfachten Modells und die aufgestellten Annahmen wurden anhand einer Reihe von Alkoholethoxylaten von unterschiedlicher primärer Bioabbaubarkeit bestimmt (2)(3).
Anmerkung: Da sich diese Variante eng an den Wortlaut der vorliegenden Prüfmethode (C.10-A) anlehnt, werden im Folgenden nur die Punkte beschrieben, bei denen Abweichungen bestehen.
4. Porous-Pot-Belebtschlammanlagen, die zur Erleichterung des (fast) kontinuierlichen Abzugs von Kultursuspension konzipiert wurden und eine sehr präzise Kontrolle der Schlammverweilzeit (SRT, oder ϑs) gestatten, werden mit verschiedenen Schlammverweilzeiten und - fakultativ - bei verschiedenen Temperaturen als nicht gekoppelte Anlagen betrieben. Die Verweilzeit beträgt in der Regel 2 bis 10 Tage, und die Temperaturen liegen zwischen 5 und 20 °C. (Vorzugsweise häusliches) Abwasser und eine Lösung der Prüfsubstanz werden in Anteilen, die die erforderliche Schlammverweilzeit (3 bis 6 Stunden) und die erforderliche Prüfsubstanzkonzentration im Zulauf gewährleisten, separat in die Anlagen zudosiert. Zu Vergleichszwecken werden zeitgleich Kontrollanlagen ohne Prüfsubstanz betrieben.
5. Es können andere Apparaturtypen verwendet werden, doch muss in diesem Fall unbedingt sichergestellt werden, dass eine gute Kontrolle der Schlammverweilzeit gewährleistet ist. So muss bei der Verwendung von Anlagen mit Klärkasten möglicherweise in Kauf genommen werden, dass Feststoffe über den Anlagenablauf verloren gehen. Ferner sollten besondere Vorkehrungen getroffen werden, um Fehler aufgrund von Schwankungen der Schlammmenge im Klärkasten zu vermeiden.
6. Die Anlagen werden unter allen gewählten Testbedingungen betrieben, und sobald Stabilität erreicht wurde, werden über einen Zeitraum von ungefähr drei Wochen die durchschnittlichen Steady-State-Konzentrationen der Prüfsubstanz in den Abläufen und - fakultativ - die DOC-Werte bestimmt. Zusätzlich zur Bestimmung der prozentualen Abnahme der Prüfsubstanz und der fakultativen Bestimmung des DOC-Wertes wird das Verhältnis zwischen Betriebsbedingungen und Prüfsubstanzkonzentration im Ablauf grafisch dargestellt. Auf diese Weise können kinetische Konstanten berechnet und die Bedingungen vorausgesagt werden, unter denen die Prüfsubstanz behandelt werden kann.
7. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 12 und 13.
Negative/positive Testergebnisse (Pass/Fail)
8. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 14 und 15.
9. Es gelten die Bestimmungen von Kapitel C.10 A Nummer 16.
Reproduzierbarkeit von Testergebnissen
10. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 17 und 18.
Apparatur
11. Als Anlage ist das modifizierte Porous-Pot-System geeignet (siehe Anlage 6.1). Das System besteht aus einem Innengefäß (oder Einsatz) aus porösem Polypropylen mit einer Dicke von 3,2 mm und einer Porengröße von ungefähr 90 µm; das Anschlussstück ist stumpfgeschweißt (dadurch wird die Anlage robuster als das unter Nummer 21 dieses Kapitels C.10 A beschriebene System). Das Innengefäß wird in ein größeres Außengefäß aus undurchlässigem Polyethylen eingesetzt, welches aus zwei Teilen besteht - einer runden Basisplatte mit ausgestanzten Lochöffnungen für zwei Luftleitungen und eine Schlammabzugleitung und einem aufschraubbaren Zylinder mit einem derart angeordneten Ausfluss, dass das Volumen im Topf stets auf 3 Liter gehalten werden kann. Eine der Luftleitungen ist mit einem Lüftungsstein versehen, die andere ist an einem Ende offen und im Topf im rechten Winkel zum Stein angeordnet. Das System erzeugt genügend Turbulenz, um den Inhalt des Topfes vollständig durchzumischen und Konzentrationen an gelöstem Sauerstoff von über 2 mg/l zu gewährleisten.
12. Die Anlagen in angemessener Zahl entweder im Wasserbad oder in konstant temperierten Räumen unter kontrollierten Temperaturbedingungen zwischen 5 und 20 °C (± 1 °C) betreiben. Um die Prüfsubstanzlösung und den abgesetzten Schlamm in den vorgeschriebenen Raten (0-1,0 ml/Min bzw. 0-25 ml/Min) in die Belüftungsgefäße zu dosieren, sind Pumpen erforderlich; eine dritte Pumpe zieht den Überschussschlamm aus den Belüftungsgefäßen ab. Die erforderliche sehr langsame Fließgeschwindigkeit des Überschussschlamms wird erreicht, indem eine Pumpe auf höhere Geschwindigkeit eingestellt und mithilfe einer Zeitschaltuhr intermittent, d. h. 10 Sekunden pro Minute, betrieben wird, wobei eine Pumpenleistung von 3 ml/Min eine Abzugrate von 0,5 ml/Min ergibt.
Filtrationsgerät oder Zentrifuge
13. Es gelten die Bestimmungen von Kapitel C.10 A Nummer 23.
Analysegerät
14. Es gelten die Bestimmungen von Kapitel C.10 A Nummer 24.
Wasser
15. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 25 and 26.
Organisches Medium
16. Es gelten die Bestimmungen von Kapitel C.10 A Nummer 27.
Synthetisches Abwasser
17. Es gelten die Bestimmungen von Kapitel C.10 A Nummer 28.
Haushaltsabwasser
18. Es gelten die Bestimmungen von Kapitel C.10 A Nummer 29.
Belebtschlamm
19. Es gelten die Bestimmungen von Kapitel C.10 A Nummer 30.
Stammlösungen der Prüfsubstanz
20. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 31 und 32.
Aufbereitung des Inokulums
21. Es gelten nur die Bestimmungen von Kapitel C.10 A Nummer 34. - Es ist Belebtschlamm zu verwenden (ungefähr 2,5 g/l).
Anzahl Prüfanlagen
22. Für einen einfachen Test, d. h. einen Test zur Messung der prozentualen Abnahme, ist nur eine einzige Schlammverweilzeit (SRT) erforderlich; um jedoch die zur Berechnung vorläufiger kinetischer Konstanten erforderlichen Daten erheben zu können, werden 4 oder 5 SRT-Werte benötigt. In der Regel werden Verweilzeiten zwischen 2 und 10 Tagen gewählt. In der Praxis bietet es sich an, einen Test mit 4 oder 5 Verweilzeiten gleichzeitig bei ein und derselben Temperatur durchzuführen; bei ausgedehnten Studien werden dieselben SRT-Werte (oder u. U. eine unterschiedliche Wertespanne) und andere Temperaturen (5 bis 20 °C) verwendet. Zur Bestimmung der primären Bioabbaubarkeit (Hauptverwendungszweck) wird in der Regel nur eine Anlage je Bedingungsszenario benötigt. Zur Bestimmung der vollständigen Bioabbaubarkeit ist jedoch für jedes Bedingungsszenario eine Kontrollanlage erforderlich, die mit Abwasser, jedoch nicht mit Prüfsubstanz beschickt wird. Kann davon ausgegangen werden, dass im verwendeten Abwasser Prüfsubstanz präsent ist, müssten auch bei der Bestimmung der primären Bioabbaubarkeit Kontrollanlagen verwendet und die Berechnungen entsprechend korrigiert werden.
Zudosierung des organischen Mediums und der Prüfsubstanz
23. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 36 bis 39; es wird jedoch darauf hingewiesen, dass die Prüfsubstanzlösung separat zudosiert wird und dass verschiedene Schlammabzugsraten verwendet werden. Die Fließgeschwindigkeiten der Zuläufe, der Abläufe und des abgezogenen Überschussschlamms häufig, z.B. zweimal täglich, überprüfen und bei Bedarf auf ± 10 % justieren. Treten bei Verwendung von Haushaltsabwasser Probleme mit den Analysemethoden auf, sollte der Test mit synthetischem Abwasser durchgeführt werden, wobei jedoch sicherzustellen ist, dass unterschiedliche Medien vergleichbare kinetische Daten liefern.
Handhabung von Belebtschlammanlagen
24. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 40 bis 43, die Schlammverweilzeit (SRT) sollte jedoch nur durch 'konstanten' Schlammabzug reguliert werden.
Probnahme und Analyse
25. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 44 bis 50, außer dass die Konzentration der Prüfsubstanz bestimmt werden muss und der DOC-Wert bestimmt werden kann; CSB-Werte sollten nicht verwendet werden.
Auswertung der Ergebnisse
26. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 52 bis 54.
Darstellung der Prüfergebnisse
27. Es gelten die Bestimmungen von Kapitel C.10 A Nummern 56 bis 62.
Berechnung kinetischer Konstanten
28. Es ist realistischer, die mittlere Steady-State-Konzentration der Prüfsubstanz im Ablauf anzugeben und zu beschreiben, wie sich diese unter unterschiedlichen Anlagenbetriebsbedingungen verändert, als die prozentuale primäre Biobaubarkeit anzuführen. Dies kann mithilfe von Gleichung (6) in Anlage 6.2 erfolgen, mit der Werte für KS, μm und ϑSC, die kritische Schlammverweilzeit, berechnet werden können.
(Alternativ können mit einem einfachen Rechnerprogramm Näherungswerte für KS und μm bestimmt werden, um die mithilfe von Gleichung 2 (Anlage 6.2) errechnete theoretische Kurve den erzielten Testwerten anzupassen. Auch wenn keine der Lösungen die einzige richtige sein wird, lässt sich dennoch ein verhältnismäßig akkurater Näherungswert für KS und μm bestimmen.)
Variabilität von Ergebnissen
29. Es ist durchaus gängig, dass für kinetische Parameter bestimmter chemischer Substanzen unterschiedliche Werte erzielt werden. Es wird davon ausgegangen, dass sowohl die Bedingungen, unter denen sich der Schlamm vermehrt hat, als auch die Testbedingungen (wie unter Nummer 5 und für andere Tests beschrieben) großen Einfluss auf die Prüfergebnisse haben. Ein Aspekt dieser Variabilität wurde von Grady et al (4) erörtert, die vorschlugen, die Begriffe 'existierend' (extant) und 'intrinsisch' (intrinsic) auf die beiden die Grenzen des physiologischen Zustands einer Kultur repräsentierenden Extremzustände anzuwenden, die während eines kinetischen Versuchs erreicht werden können. Darf sich der Zustand während des Tests nicht verändern, so spiegeln die Werte der kinetischen Parameter die Bedingungen des Milieus wider, aus dem die Mikroorganismen entnommen wurden; diese Werte gelten als 'existie-rend', d. h. gegenwärtig vorhanden. Am anderen Ende, d. h. wenn die Testbedingungen die vollständige Entwicklung des protein-synthetisierenden Systems und somit eine größtmögliche Wachstumsrate gestatten, gelten die erzielten kinetischen Parameter als jntrinsisch' und werden nur von der Art des Substrats und den Arten von Bakterien in der Kultur beeinflusst. Als Faustregel gilt, dass Existenz-Werte erzielt werden, wenn das Verhältnis von Substratkonzen-tration zu kompetenten (d. h. auf den Abbau spezialisierten) Mikroorganismen (So/Xo) gering, z.B. auf 0,025, gehalten wird, während intrinsische Werte anfallen, wenn dieses Verhältnis größer ist und ein Wert von mindestens 20 vorliegt. In beiden Fällen sollte So dem relevanten Wert von Ks - der Halbsättigungskonstante - entsprechen oder darüber liegen.
30. Die Variabilität und andere Aspekte der Bioabbaugeschwindigkeit waren Gegenstand eines kürzlich stattgefundenen SETAC-Workshops (5). Solche (bereits vorliegenden oder geplanten) Studien dürften einen genaueren Einblick in die in Kläranlagen ablaufenden kinetischen Prozesse geben und somit eine bessere Auswertung existierender Daten ermöglichen, aber auch Anregungen für eine zweckdienlichere Auslegung künftiger Prüfmethoden geben.
1. Birch RR (1982). The biodegradability of alcohol ethoxylates. XIII Jornado Com. Espanol Deterg.: 33-48.
2. Birch RR (1984). Biodegradation of nonionic surfactants. J.A.O.C.S., 61(2): 340-343.
3. Birch RR (1991). Prediction of the fate of detergent chemicals during sewage treatment. J. Chem. Tech. Biotechnol., 50: 411-422.
4. Grady CPL, Smets BF and Barbeau DS (1996). Variability in kinetic parameter estimates: A review of possible causes and a proposed terminology. Wat. Res., 30 (3): 742-748.
5. Biodegradation kinetics: Generation and use of data for regulatory decision making (1997). Workshop at Port Sunlight, UK. Herausgeber: Hales SG, Feitjel T, King H, Fox K, Verstraete W. 4-6. September 1996. SETAC- Europe, Brüssel.
| 'Porous Pot' mit SRT-Kontrolle | Anlage 6.1 |
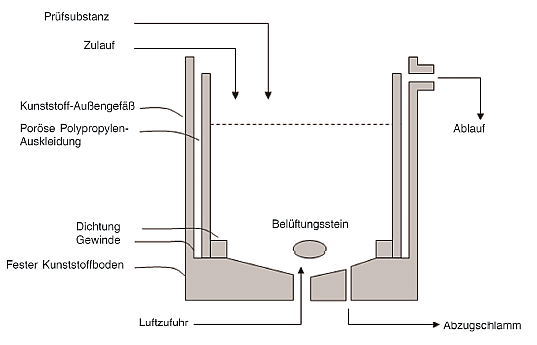
| Berechnung von kinetischen Konstanten | Anlage 6.2 |
1. In der Annahme, dass das mathematische Modell der Monod-Kinetik gilt, und ausgehend von einer Massenbilanz aus aktiven Feststoffen und Substrat im gesamten Belebtschlammsystem (1) können die folgenden Werte für den Gleichgewichtszustand (steady state) berechnet werden:
| 1 | µm ⋅ S1 | |||
|
| = |
| - Kd | [1] |
| ϑs | Ks + S1 |
oder
| KS ⋅ (1 + Kd ⋅ ϑ s) | ||
| S1 = |
| [2] |
| ϑs ⋅ (µm - Kd) - 1 |
Dabei sind:
S1 = die Konzentration des Substrats im Ablauf, (mg/l)
KS = die Halbsättigungskonstante, d. h. die Konzentration, bei der μ = μm/2 (mg/l)
μ = die spezifische Wachstumsrate (d-1)
μm = der Höchstwert von μm (d 1)
Kd = die spezifische Zerfallsrate aktiver Feststoffe (d -1)
ϑS = die mittlere Schlammverweilzeit, SRT (d)
Die Prüfung dieser Gleichung führt zu folgenden Schlussfolgerungen:
- Die Ablaufkonzentration ist unabhängig von der Zulaufkonzentration (S0); folglich verändert sich der Prozentsatz des biologischen Abbaus mit der Zulaufkonzentration S0.
- Der einzige S1 beeinflussende kontrollierbare Parameter der Anlage ist die Schlammverweilzeit ϑS.
- Jeder Zulaufkonzentration S0 entspricht eine kritische Schlammverweilzeit, so dass:
1 µs ⋅ S0 = - Kd [3] ϑSC Ks + S0 - Dabei ist: ϑSC = die kritische Schlammverweilzeit, unterhalb der kompetente (d. h. auf den Abbau spezialisierte) Mikroorga-nismen aus der Anlage ausgewaschen werden.
- Da die anderen Parameter in Gleichung (2) die Wachstumskinetik betreffen, ist davon auszugehen, dass die Temperatur den Substratgehalt des Ablaufs und das kritische Schlammalter beeinflusst, d. h. die für einen bestimmten Behandlungsgrad erforderliche Schlammverweilzeit würde bei abnehmender Temperatur zunehmen.
2. Ausgehend von einer Massenbilanz von Feststoffen im Porous-Pot-System und in der Annahme, dass die Feststoffkonzentration im Anlagenablauf, X2, im Vergleich zur Feststoffkonzentration im Belüftungsgefäß, X1, gering ist, die Schlammverweilzeit wie folgt berechnen:
| V ⋅ X1 | ||
| ϑs = |
| [4] |
| (Q0 - Q1) ⋅ X2 + Q1 ⋅ X1 |
und
| V ⋅ X1 | V | ||
| ϑs = |
| = | |
| Q1 ⋅ X1 | Q1 |
Dabei sind:
V = das Volumen des Belüftungsgefäßes (l)
X1 = die Feststoffkonzentration im Belüftungsgefäß (mg/l)
X2 = die Feststoffkonzentration im Ablauf (mg/l)
Q0 = die Zuflussrate (l/d)
Q1 = die Schlammabzugsrate (l/d)
Folglich kann die Schlammverweilzeit (jeder vorab eingestellte Wert) durch Kontrolle der Schlammabzugsrate, Q1, kontrolliert werden.
Schlussfolgerungen
3. Hauptzweck dieses Tests ist es demnach, die Vorhersage der Ablaufkonzentration und somit der Prüfsubstanzmengen in den Vorflutern zu ermöglichen.
4. Durch Auftragen von S1 gegen ϑS lässt sich die kritische Schlammverweilzeit, ϑSC, in manchen Fällen vorhersagen; siehe beispielsweise Kurve 3 in Abbildung 1. Ist dies nicht möglich, kann ϑSC (zusammen mit Näherungswerten für μm und KS) berechnet werden durch Auftragen von S1 gegen S1 ⋅ϑS.
Die Umstellung von Gleichung (1) ergibt
|
| [5] |
Ist Kd klein, wird 1 + ϑs Kd ~ 1 und [5] wird zu
| Ks | S1 | |||
| S1 ⋅ ϑS = |
| + |
| [6] |
| µm | µm |
Die grafischen Punkte sollten demnach eine Gerade (siehe Abbildung 2) mit Steigung 1/μm und Schnittpunkt KS/μm ergeben; ferner gilt ϑS ~ 1μm.
Abbildung 1 Drei Temperaturen; fünf Schlammverweilzeiten (SRT)

Abbildung 2 Regressionsgerade SRT - S1 vs S1 bei Temperatur T = 5 °C

Legende:
Ablaufkonzentration:
Kurve:
| Tests bei niedrigen (μg/l) Konzentrationsbereichen | Anlage 7 |
1. Zahlreiche chemische Substanzen sind im Wassermilieu, auch in Abwässern, normalerweise in sehr niedrigen Konzentrationen (μg/l) vorhanden.
In derart kleinen Mengen sind sie als primäre Vermehrungssubstrate eher nicht geeignet, sondern werden vielmehr als vermehrungsunfähige Sekundärsubstrate zur gleichen Zeit wie diverse natürlich vorkommende kohlenstoffhaltige Substanzen biologisch abgebaut.
Das in Anlage 6 beschriebene Modell ist für den Abbau derartiger chemischer Stoffe folglich nicht geeignet.
Viele andere Modelle könnten jedoch angewendet werden, und unter den in Abwasserbehandlungssystemen vorherrschenden Bedingungen in vielen Fällen zeitgleich.
Zur Klärung dieser Frage ist jedoch noch größerer Forschungsaufwand erforderlich.
2. Bis dahin kann das im Haupttext beschriebene Verfahren (Kapitel C.10 A) angewendet werden, allerdings nur zur Bestimmung der primären Bioabbaubarkeit mittels angemessen geringer Konzentrationen (< 100 μg/l) und nach einem validierten Analyseverfahren. Die prozentuale biologische Abbaubarkeit kann berechnet werden (siehe Nummer 54 der Prüfmethode), sofern abiotische Prozesse (Adsorption, Flüchtigkeit usw.) berücksichtigt werden. Als Beispiel kann die Studie von Nyholm et al. (1)(2) angeführt werden, bei der die Prüfanlage im 4-Stunden-Takt mit Prüfsubstanz beschickt wurde (Fill-and-Draw-Methode). Für fünf chemische Stoffe, mit denen synthetisches Abwasser im Verhältnis 5 zu 100 μg/l beimpft wurde, wurden Konstanten pseudo-erster Ordnung berichtet. (Für vollständige Bioabbaubarkeit können 14C-markierte Prüfsubstanzen verwendet werden. Da hierfür bislang keine allgemein anerkannten Verfahren vorliegen, geht eine Beschreibung dieser Methode über den Geltungsbereich der vorliegenden Prüfmethode hinaus, wenngleich eine für ISO 14592 (3) vorgeschlagene Methode Leitlinien für die Verwendung 14C-markierter chemischer Stoffe enthält.)
SCAS-Test
3. Später wurde ein einfacherer Zwei-Phasen-Test vorgeschlagen (4)(5)(6); auf die halbkontinuierliche Belebtschlamm- (SCAS)-Methode folgen kinetische Schnelltests an Proben aus den SCAS-Anlagen. Beim SCAS-System sind (im Gegen-satz zur ursprünglichen C.12-Prüfmethode) die Überschussschlamm-Abzugsraten bekannt, und die Anlage wird mit modifiziertem synthetischen Abwasser (OECD) oder Haushaltsabwasser beschickt. Das synthetische Abwasser wurde (wegen veränderlichem pH-Wert und unzulänglicher Schlammsedimentation) durch Zugabe von Phosphatpuffer, He-feextrakt, Eisen-(III)-Chlorid und Spurenelementsalzen modifiziert, und sein CSB wurde durch Erhöhung der Pepton- und Fleischextraktkonzentration auf etwa 750 mg/l angehoben. Die Anlagen wurden im 24-Stunden-Zyklus betrieben, d. h. Belüftung für 23 Stunden, Überschussschlammabzug, Sedimentation, Entfernung des Überstands (über den Ablauf) mit anschließender Zuführung von synthetischem Abwasser PLUS Prüfsubstanz in Höhe von bis zu 100 μg/l (d. h. in ungefähr derselben Konzentration wie beim Schnelltest). Einmal wöchentlich wurden 10 % des gesamten Schlamms durch frischen Schlamm ersetzt, um eine ausgewogene Mikrobenpopulation zu gewährleisten.
4. Die anfängliche Konzentration der Prüfsubstanz und die Konzentration am Ende der Belüftungsphase werden gemessen, und der Test wird fortgesetzt, bis eine konstante Abnahme der Prüfsubstanz erreicht ist; dies kann eine Woche bis mehrere Monate dauern.
Schnelltest
5. Ein Schnelltest (z.B. ein 8-Stunden-Test) wird durchgeführt, um die Konstante der Abbaukinetik (pseudo-)erster Ordnung zu bestimmen, die über die Geschwindigkeit der Zersetzung der Prüfsubstanz in Belebtschlamm aus be-kannten, jedoch unterschiedlichen Quellen und Werdegängen Aufschluss gibt. Während eines Akklimatisationsversuchs (Nummern 3, 4) werden insbesondere aus den SCAS-Reaktoren Schlammproben gezogen, und zwar am Ende einer Belüftungsphase, wenn die Konzentration des organischen Substrats gering ist. Zum Vergleich kann Schlamm auch aus einer parallel laufenden SCAS-Anlage entnommen werden, die nicht mit Prüfsubstanz beschickt wurde. Gemische aus Schlamm und Prüfsubstanz, die in zwei oder mehr Konzentrationen zwischen 1 μg/l und 50 μg/l zugeführt wird, werden ohne Zugabe von synthetischem Abwasser oder einem anderen organischen Substrat belüftet. Die Restprüf-substanz in der Lösung wird während eines Zeitraums von maximal 24 Stunden je nach Abbaubarkeit der chemischen Substanz in regelmäßigen Zeitabständen, z.B. stündlich, bestimmt. Vor den entsprechenden Analysen werden die Proben zentrifugiert.
Berechnungen
6. Zur Berechnung der prozentualen Abnahme der Prüfsubstanz werden Daten aus den SCAS-Anlagen verwendet (Nummer 54). Außerdem kann mittels folgender Gleichung eine Konstante der Durchschnittsgeschwindigkeit, K1, (normiert für die Konzentration suspendierter Feststoffe) berechnet werden:
K1 = 1/t ⋅ ln (Ce/Ci) ⋅ 1 /SS (1/g h)
Dabei sind:
t = der Belüftungszeitraum (23 Stunden)
Ce = die Konzentration am Ende des Belüftungszeitraums (μg/l)
Ci = die Konzentration zu Beginn des Belüftungszeitraums (μg/l)
SS = die Konzentration von Belebtschlammfeststoffen (g/l)
7. Beim Schnelltest wird die logarithmische Konzentration der Restprüfsubstanz (in %) gegenüber der Zeit grafisch dargestellt, und die Steigung des ersten Teils (10-50 % Zersetzung) der Kurve entspricht K1, der Konstanten (pseudo-)erster Ordnung. Für die Konzentration der Schlammfeststoffe wird die Konstante durch Division der Steigung durch die Konzentration der Schlammfeststoffe normiert. Das mitgeteilte Ergebnis muss auch Einzelheiten über die anfänglichen Konzentrationen der Prüfsubstanz und suspendierter Feststoffe, über die Schlammverweilzeit, Eintrag und Quelle des Schlamms und über eine (etwaige) Präexposition gegenüber der Prüfsubstanz enthalten.
Variabilität der Ergebnisse
8. Die Variabilität und andere Aspekte der Bioabbaugeschwindigkeit waren Gegenstand eines kürzlich stattgefundenen SETAC-Workshops (7). Solche (bereits vorliegenden oder geplanten) Studien dürften einen genaueren Einblick in die in Kläranlagen ablaufenden kinetischen Prozesse geben und somit eine bessere Auswertung existierender Daten ermöglichen, aber auch Anregungen für eine zweckdienlichere Auslegung künftiger Prüfmethoden enthalten.
Literatur
1. Nyholm N, Jacobsen BN, Pedersen BM, Poulsen O, Dambourg A and Schultz B (1992). Removal of micropollutants in laboratory activated sludge reactors. Biodegradability. Wat. Res. 26: 339-353.
(2) Jacobsen BN, Nyholm N, Pedersen BM, Poulsen O, and Ostfeldt P (1993). Removal of organic micropollutants in laboratory activated sludge reactors under various operating conditions: Sorption. Wat. Res. 27: 1505-1510.
(3) ISO 14592 (ISO/TC 147/SC5/WG4, N264) (1998). Wasserbeschaffenheit - Bestimmung der aeroben biologischen Abbaubarkeit organischer Verbindungen in geringen Konzentrationen.
(4) Nyholm N, Ingerslev F, Berg UT, Pedersen JP and Frimer-Larsen H (1996). Estimation of kinetic rate constants for biodegradation of chemicals in activated sludge waste water treatment plants using short-term batch experiments and μg/l range spiked concentrations. Chemosphere 33 (5): 851-864.
(5) Berg UT and Nyholm N (1996). Biodegradability simulation Studies in semi-continuous activated sludge reactors with low (μg/l range) and standard (ppm range) chemical concentrations. Chemosphere 33 (4): 711-735.
(6) Danish Environmental Protection Agency. (1996). Activated sludge biodegradability simulation test. Umweltprojekt, Nr. 337. Nyholm, N. Berg, UT. Ingerslev, F. Ministerium für Umwelt und Energie, Kopenhagen.
(7) Biodegradation kinetics: Generation and use of data for regulatory decision making (1997). Workshop in Port Sunlight, VK. Verlag: Hales, SG. Feitjel, T. King, H. Fox, K. and Verstraete, W. 4.-6. September 1996. SETAC- Europe, Brüssel.
C.10-B: Biofilme
1. Simulationstests werden normalerweise an chemischen Substanzen vorgenommen, die sich im Screeningtest als nicht leicht abbaubar erwiesen haben (Kapitel C.4 (A-F) dieses Anhangs (9)), deren potenzielle (oder inhärente) biologische Abbaubarkeit jedoch im Test nachgewiesen wurde. In Ausnahmefällen werden Simulationstests auch an Substanzen vorgenommen, zu denen mehr Informationen benötigt werden (vor allem wenn sie in großen Mengen vorkommen), wobei in der Regel das Belebtschlammverfahren angewandt wird (C.10-A). In bestimmten Fällen sind jedoch spezifische Informationen über das Abbauverhalten einer chemischen Substanz bei biologischer Abwasserbehandlung (durch Biofilmreaktoren wie z.B. Tropfkörper, Tauchkörper, Fließbettreaktoren) erforderlich. Zu diesem Zweck wurden diverse Apparaturen entwickelt.
2. Gerike et al. (1) verwendeten große pilotmaßstäbliche Tropfkörper als gekoppelte Anlagen. Diese Filter nahmen viel Platz in Anspruch und erforderten verhältnismäßig große Mengen an Abwasser oder synthetischem Abwasser. Truesdale et al. (2) beschrieben kleinere Filter (eines Durchmessers von 6 Fuß x 6 Zoll), denen ein tensidfreies natürliches Abwasser zugeführt wurde; allerdings erforderten auch diese Filter immer noch große Wassermengen. Es dauerte 14 Wochen, bis sich ein 'reifer' Biofilm entwickelte, und bis zur Akklimatisierung waren nach der Beschickung mit dem Prüftensid noch weitere 4-8 Wochen erforderlich.
3. Baumann et al. (3) entwickelten einen viel kleineren Filter, bei dem Polyester-'Vlies' verwendet wurde, das zuvor als inerte Aufwuchsfläche (Substratum) für den Biofilm in Belebtschlamm getränkt wurde. Die Prüfsubstanz wurde als die einzige C-Quelle verwendet, und die biologische Abbaubarkeit wurde durch Messung des gelösten organischen Kohlenstoffs (dissolved organic carbon, DOC) im Zu- und Ablauf und anhand des CO2-Gehalts des austretenden Gases bestimmt.
4. Gloyna et al. (4), die Erfinder des Drehrohrreaktors, verfolgten einen ganz anderen Ansatz. Auf der Innenfläche des Drehrohres wurde ein Biofilm gebildet, indem die betreffende Fläche über die Stirnseite des in einem kleinem Winkel zur Horizontalen angeordneten Rohres mit Zulaufwasser überströmt wurde. Der Reaktor wurde zur Bestimmung der biologischen Abbaubarkeit von Tensiden (5), aber auch zur Untersuchung der optimalen Dicke der Biofilmschicht und der Diffusion durch den Film (6) verwendet. Gloyna et al. entwickelten den Reaktor weiter, auch durch Modifizierung, um den CO2-Gehalt des austretenden Gases bestimmen zu können.
5. Der Drehrohrreaktor wurde vom Standing Committee of Analysts (Vereinigtes Königreich) als Standardmethode für die Bestimmung sowohl der biologischen Abbaubarkeit chemischer Substanzen (7) als auch der Reinigungsfähigkeit und Toxizität von Abwässern (8) anerkannt. Die hier beschriebene Methode hat den Vorteil, dass sie einfach, kompakt und reproduzierbar ist und relativ kleine Mengen an organischem Medium benötigt werden.
6. Die Innenfläche eines langsam rotierenden geneigten Rohres wird mit synthetischem Abwasser oder Haushaltsabwasser und Prüfsubstanz (dazugemischt oder separat) überströmt. Auf dieser Innenfläche bildet sich eine Schicht von Mikroorganismen, die denen auf Biofiltermedien vergleichbar sind. Die Prozessbedingungen des Reaktors werden so gewählt, dass eine angemessene Eliminierung der organischen Substanzen und, falls nötig, eine Ammonium-Oxidation erfolgt.
7. Ausfluss aus dem Rohrablauf wird gesammelt und abgesetzt und/oder gefiltert, bevor der DOC- und/oder der Prüfsubstanzgehalt nach einer spezifischen Methode analysiert wird. Zeitgleich werden zu Vergleichszwecken unter denselben Bedingungen Kontrollanlagen ohne Prüfsubstanz betrieben. Dabei wird angenommen, dass die Differenz zwischen den DOC-Konzentrationen im Ablauf der Prüf- und der Kontrollanlage durch die Prüfsubstanz und ihre organischen Stoffwechselprodukte bedingt ist. Zur Berechnung der Elimination der Prüfsubstanz wird diese Differenz mit der Konzentration der zugeführten Prüfsubstanz (als DOC) verglichen.
8. Der biologische Abbau lässt sich in der Regel durch sorgfältige Prüfung der Eliminations-Zeit-Kurve von der Bioadsorption differenzieren. Dies kann gewöhnlich durch einen Test auf leichte Bioabbaubarkeit (Sauerstoffaufnahme oder Kohlendioxidproduktion) bestätigt werden, bei dem ein akklimatisiertes Inokulum verwendet wird, das am Ende des Tests aus den mit der Prüfsubstanz beschickten Reaktoren entnommen wird.
9. Reinheit, Wasserlöslichkeit und Flüchtigkeit sowie die Adsorptionsmerkmale der Prüfsubstanz sollten bekannt sein, um eine akkurate Ergebnisauswertung zu ermöglichen.
10. Normalerweise können flüchtige oder schwer lösliche chemische Substanzen nicht getestet werden, es sei denn, es werden besondere Vorsichtsmaßnahmen getroffen (siehe Kapitel C.10-A, Anlage 5). Die chemische Struktur oder zumindest die empirische Formel sollten ebenfalls bekannt sein, um theoretische Werte berechnen und/oder gemessene Parameterwerte, z.B. für den theoretischen Sauerstoffbedarf (ThOD) oder den DOC, überprüfen zu können.
11. Angaben zur Toxizität der Prüfsubstanz für Mikroorganismen (siehe Kapitel C.10-A, Anlage 4) können für die Wahl geeigneter Testkonzentrationen zweckdienlich und für die korrekte Auswertung niedriger Bioabbaubarkeitswerte ausschlaggebend sein.
Negative/positive Testergebnisse (Pass/Fail)
12. Ursprünglich musste die primäre Bioabbaubarkeit von Tensiden mindestens 80 % betragen, bevor die Substanz in den Verkehr gebracht werden konnte. Wird der Wert von 80 % nicht erreicht, kann der vorliegende Simulations- (Bestätigungs-)Test durchgeführt werden, und das Tensid darf nur in den Verkehr gebracht werden, wenn über 90 % der betreffenden Substanz abgebaut wurden. Im Allgemeinen stellt sich die Pass-/Fail-Frage bei chemischen Substanzen nicht, und der Wert der prozentualen Abnahme kann zur approximativen Berechnung der wahrscheinlichen Umweltkonzentration einer chemischen Substanz verwendet werden, die zur Analyse der von chemischen Substanzen ausgehenden Gefahren erforderlich ist. Einige Untersuchungen reiner Chemikalien haben in mehr als drei Viertel aller Fälle eine prozentuale DOC-Abnahme von > 90 % und bei über 90 % der Substanzen, die sich in nennenswerten Maße als biologisch abbaubar erwiesen haben, von > 80 % ergeben.
13. Um sicherzustellen, dass das Testverfahren korrekt durchgeführt wird, ist es sinnvoll, gelegentlich Referenzsubstanzen zu testen, deren Verhalten bekannt ist. Zu derartigen Substanzen zählen Adipinsäure, 2-Phenylphenol, 1- Naphthol, Diphensäure und 1-Naphthoesäure.
Reproduzierbarkeit von Testergebnissen
14. Die relative Standardabweichung lag nach Feststellung eines britischen Labors bei den Tests selbst bei 3,5 % und zwischen Tests bei 5 % (7).
Beschreibung des Prüfverfahrens
Apparatur
Drehrohrreaktoren
15. Die Apparatur (siehe Anlage 8, Abbildungen 1 und 2) besteht aus einer Reihe von jeweils 30,5 cm langen Acrylrohren mit jeweils 5 cm Innendurchmesser, die innerhalb eines metallenen Stützkastens auf Gummirollen angeordnet sind. Jedes Rohr hat einen ca. 0,5 cm tiefen Flansch, damit es fest auf den Rädern aufsitzt, eine mit grober Stahlwolle aufgeraute Innenfläche und am Stirnende (Zufuhrende) einen 0,5 cm tiefen inneren Randabschluss, um ein Überlaufen der Flüssigkeit zu vermeiden. Die Rohre sind in einem Winkel von ungefähr einem Grad zur Horizontalen angeordnet, um, wenn das Testmedium dem sauberen Rohr zugeführt wird, die erforderliche Kontaktzeit zu gewährleisten. Die Gummirollen werden mithilfe eines Motors mit Geschwindigkeitssteuerung langsam gedreht. Da die Apparatur in einem Raum mit konstanten Temperaturbedingungen aufgestellt wird, ist Temperaturkontrolle gewährleistet.
16. Indem jeder Rohrreaktor in ein geringfügig größeres, gedeckeltes Rohr gesetzt und sichergestellt wird, dass die Anschlüsse gasdicht sind, könnte austretendes CO2 in einer alkalischen Lösung aufgefangen und anschließend gemessen werden (6).
17. Für jedes Rohr wird in einem 20 l-Vorratsgefäß (A) (siehe Abbildung 2) ein 24-Stunden-Vorrat an organischem Medium, gegebenenfalls mit Prüfsubstanz versetzt, bereitgehalten. Bei Bedarf kann die Prüfsubstanz separat dosiert zugeführt werden. Am unteren Ende jedes Vorratsgefäßes befindet sich ein Ausguss, der mit einen geeigneten Schlauch, z.B. aus Silikonkautschuk, über eine Peristaltikpumpe (B) an ein Glas- oder Acryl-Überführungsrohr angeschlossen ist, das an der Stirnseite des geneigten Rohrreaktors 2-4 cm tief in das Rohr eingeführt wird (C). Der Abfluss wird am unteren Ende des Rohres in einem Sammelgefäß aufgefangen (D). Er wird vor der Analyse abgesetzt oder gefiltert.
Filtrationsgerät - Zentrifuge
18. Gerät zur Filtration von Proben mit Membranfiltern einer geeigneten Porenweite (Nennöffnungsdurchmesser 0,45 µm), die lösliche organische Substanzen adsorbieren bzw. ein Minimum an organischem Kohlenstoff freisetzen. Bei Verwendung von Kohlenstoff freisetzenden Filtern sind diese sorgfältig mit heißem Wasser zu waschen, um austretenden organischen Kohlenstoff zu entfernen. Alternativ kann eine Zentrifuge einer Kapazität von 40.000 m/s2 verwendet werden.
19. Analysegerät zur Bestimmung folgender Größen:
- DOC/TOC (gesamter organischer Kohlenstoff) oder CSB (chemischer Sauerstoffbedarf);
- bestimmte chemische Substanz (mittels HPLC, GC usw.), soweit erforderlich;
- pH-Wert, Temperatur, Azidität und Alkalinität;
- Ammonium, Nitrit und Nitrat, wenn die Tests unter nitrifizierenden Bedingungen durchgeführt werden.
Wasser
20. Leitungswasser (Trinkwasser) mit einem DOC-Gehalt von weniger als 3 mg/l.
21. Destilliertes oder deionisiertes Wasser mit einem DOC-Gehalt von weniger als 2 mg/l.
Organisches Medium
22. Als organisches Medium kommt synthetisches Abwasser, Haushaltsabwasser oder eine Mischung aus beiden Abwasserarten in Frage. Es hat sich gezeigt, dass die alleinige Verwendung von Haushaltsabwasser (in Belebtschlammanlagen) oft zu einer höheren prozentualen DOC-Abnahme führt und selbst den biologischen Abbau bestimmter chemischer Substanzen fördert, die bei Verwendung von synthetischem Abwasser (OECD) nicht abgebaut werden. Die Verwendung von Haushaltsabwasser wird demnach empfohlen. Bei jeder neuen Charge von organischem Medium wird die DOC- (oder die CSB-)Konzentration gemessen. Die Azidität oder Alkalinität des organischen Mediums sollte bekannt sein. Das Medium kann die Zugabe einer geeigneten Pufferlösung (Natriumhydrogencarbonat oder Kalium(di)hydrogenphosphat) erfordern, wenn die Azidität oder Alkalinität gering ist, um während des Tests einen pH-Wert von etwa 7,5 ± 0,5 im Reaktor zu gewährleisten. Wie viel Pufferlösung zuzugeben ist und wann, muss auf Fallbasis entschieden werden.
Synthetisches Abwasser
23. In jedem Liter Leitungswasser wird Folgendes aufgelöst: 160 mg Pepton; 110 mg Fleischextrakt; 30 mg Harnstoff; 28 mg wasserfreies Dikaliumhydrogenphosphat (K2HPO4); 7 mg Natriumchlorid (NaCl); 4 mg Calciumchlorid- Dihydrat (CaCl2.2H2O); 2 mg Magnesiumsulfat-Heptahydrat (Mg2SO4.7H20). Dieses synthetische Abwasser (OECD) hat Beispielcharakter und ergibt eine mittlere DOC-Konzentration im Zulauf von etwa 100 mg/l. Alternativ können andere Zusammensetzungen mit ähnlichen DOC-Konzentrationen verwendet werden, die realitätsnäher sind. Dieses synthetische Abwasser kann aus destilliertem Wasser in konzentrierter Form hergestellt und bis zu einer Woche bei ungefähr 1 °C gelagert werden. Bei Bedarf wird es mit Leitungswasser verdünnt. (Dieses Medium ist eher ungeeignet, weil die Stickstoffkonzentration sehr hoch und der Kohlenstoffgehalt relativ niedrig ist; es gibt jedoch keine besseren Empfehlungen, außer dass mehr Phosphat (als Puffer) sowie zusätzliches Pepton hinzugefügt werden könnten).
Haushaltsabwasser
24. Es sollte frisch abgesetztes Abwasser verwendet werden, das täglich von einem vorwiegend Haushaltsabwässer reinigenden Klärwerk bezogen wird. Es sollte aus der Ablaufrinne des Vorklärbeckens oder aus dem Beschickungswasser der Belebtschlammanlage gezogen werden und weitgehend frei von Grobstoffen sein. Das Abwasser kann nach mehrtägiger Lagerung bei 4 °C verwendet werden, sofern erwiesen ist, dass der gelöste organische Kohlenstoff (DOC) (oder der chemische Sauerstoffbedarf, CSB) während der Lagerung nicht wesentlich (d. h. um weniger als 20 %) abgenommen hat. Um Störungen des Systems zu minimieren, sollte der DOC-(oder der CSB-) Wert jedes neuen Ansatzes vor dessen Verwendung auf einen geeigneten konstanten Wert eingestellt werden, z.B. durch Verdünnung mit Leitungswasser.
Schmiermittel
25. Zum Schmieren der Peristaltikpumpenrollen kann Glyzerin oder Olivenöl verwendet werden: Beide Schmiermittel sind für Silikonkautschukschläuche geeignet.
Stammlösungen der Prüfsubstanz
26. Für angemessen lösliche chemische Substanzen werden in geeigneten Konzentrationen (z.B. 1 bis 5 g/l) in entionisiertem Wasser oder in einer mineralischen Kulturlösung aus synthetischem Abwasser Stammlösungen angesetzt. Für nicht lösliche chemische Substanzen siehe Kapitel C.10-A, Anlage 5. Diese Methode ist für flüchtige Substanzen ohne Modifizierung der Drehrohrreaktoren (Nummer 16) nicht geeignet. Der DOC- und der TOC-Gehalt der Stammlösung werden bestimmt und die Messungen für jede neue Charge wiederholt. Bei einer Differenz zwischen DOC und TOC von mehr als 20 % wird die Wasserlöslichkeit der Prüfsubstanz überprüft. Der DOC oder die durch spezifische Analyse der Stammlösung gemessene Konzentration der Prüfsubstanz wird mit dem Nennwert verglichen, um festzustellen, ob die Wiederfindungsrate ausreicht (in der Regel kann mit > 90 % gerechnet werden). Vor allem bei Dispersionen ist festzustellen, ob der DOC-Wert als Analyseparameter verwendet werden kann oder nicht oder ob nur ein prüfsubstanzspezifisches Analyseverfahren angewendet werden kann. Bei Dispersionen müssen die Proben zentrifugiert werden. Bei jeder neuen Charge werden der DOC-Wert, der CSB-Wert bzw. die Prüfsubstanz durch spezifische Analyse gemessen.
27. Der pH-Wert der Stammlösung wird bestimmt. Extremwerte zeigen an, dass die Zugabe der chemischen Substanz den pH-Wert des Belebtschlamms im Prüfsystem beeinflussen kann. In diesem Fall wird die Stammlösung mit kleinen Mengen anorganischer Säure oder Base Trägerstoff neutralisiert, um einen pH-Wert von 7 ± 0,5 zu erhalten, wobei eine Ausfällung der Prüfsubstanz zu vermeiden ist.
Vorbereitung des organischen Mediums für die Zudosierung
28. Alle Zulauf- und Ablaufgefäße und die Schlauchleitungen aus den Zulauf- und zu den Ablaufgefäßen sind vor und während des Tests gründlich zu säubern, um Mikrobenbewuchs zu entfernen.
29. Aus den Feststoffen oder aus der konzentrierten Stammlösung wird durch Verdünnen mit einer angemessenen Menge Leitungswasser täglich frisches synthetisches Abwasser (Nummer 23) vorbereitet. Die erforderliche Menge wird in einem Zylinder dosiert und in ein sauberes Vorratsgefäß gegeben. Bei Bedarf wird dem synthetischen Abwasser vor der Verdünnung auch die Stammlösung der Prüfsubstanz oder der Referenzsubstanz in vorgegebener Menge zugesetzt. Wenn dies praktischer oder zur Vermeidung von Prüfsubstanzverlusten notwendig ist, wird in einem separaten Gefäß eine verdünnte Lösung der Prüfsubstanz gesondert vorbereitet und dem geneigten Rohrreaktor über eine andere Dosierpumpe zugeführt.
30. Alternativ (und vorzugsweise) wird abgesetztes Haushaltsabwasser (Nummer 24) verwendet, das möglichst täglich frisch bezogen wird.
Betrieb der Drehrohrreaktoren
31. Zur Bewertung einer einzelnen Prüfsubstanz sind zwei identische Rohrreaktoren erforderlich, die in einem Raum mit konstanten Temperaturbedingungen von 22 ± 2 °C montiert werden.
32. Die Peristaltikpumpen werden so eingestellt, dass stündlich 250 ± 25 ml organisches Medium (ohne Prüfsubstanz) in die geneigten Rohre dosiert werden, die bei 18 ± 2 rpm rotieren. Die Pumpenrohre werden vor Beginn und regelmäßig während des Tests geschmiert (Nummer 25), um einen reibungslosen Prozessablauf und eine mög-lichst lange Lebensdauer der Rohrinstallation zu gewährleisten.
33. Der Neigungswinkel der Rohre zur Horizontalen wird so eingestellt, dass eine Verweilzeit des Zuflusses im sauberen Rohr von 125 ± 12,5 Sekunden gewährleistet ist. Die Verweilzeit wird durch Versetzung des Zuflusses mit einem nichtbiologischen Markierungsstoff (z.B. NaCl, inerter Farbstoff) geschätzt: Dabei gilt die Zeit, bis die Höchstkonzentration im Abfluss erreicht ist, als mittlere Verweilzeit (ist Biofilm in maximaler Menge vorhanden, kann sich die Verweilzeit auf bis zu 30 Minuten erhöhen).
34. Diese Raten, Geschwindigkeiten und Zeiten haben sich für angemessene DOC- (bzw. CBS-)Abnahmeraten (> 80 %) und die Nitrifikation von Abflüssen bewährt. Die Fließgeschwindigkeit sollte geändert werden, wenn die Abnahme unzulänglich ist oder die Leistung einer bestimmten Kläranlage simuliert werden soll. In letzterem Fall sollte die Zudosierung des organischen Mediums so lange justiert werden, bis die Leistung des Reaktors der Kläranlagenleistung entspricht.
Animpfung
35. Bei Verwendung von synthetischem Abwasser reicht zur Anregung des Wachstums der Mikroorganismen möglicherweise eine aerogene Inokulation aus; andernfalls wird dem Zufluss drei Tage lang 1 ml/l abgesetztes Abwasser zugegeben.
Messungen
36. In regelmäßigen Abständen wird kontrolliert, ob die Dosiermengen und die Rotationsgeschwindigkeiten innerhalb der vorgegebenen Grenzen liegen. Darüber hinaus wird der pH-Wert des Abflusses gemessen, vor allem, wenn mit Nitrifikation gerechnet werden muss.
Probenahme und Analyse
37. Methode, Schema und Häufigkeit der Probenahmen richten sich nach der Zweckbestimmung des Tests. Es werden beispielsweise Momentproben (snap/grab samples) des Zu- und Ablaufs gezogen, oder die Proben werden über einen längeren, z.B. drei- bis sechsstündigen, Zeitraum entnommen. In der ersten Phase (in der noch keine Prüfsubstanz zugegeben wurde) werden zweimal wöchentlich Proben gezogen. Diese werden entweder durch eine Membran gefiltert oder bei etwa 40.000 m/sec2 für ungefähr 15 Minuten zentrifugiert (Nummer 18). Möglicherweise müssen die Proben vor der Membranfiltration sedimentiert und/oder grob gefiltert werden. Der DOC-Wert (bzw. der CSB-Wert) wird mindestens doppelt bestimmt, ebenso wie erforderlichenfalls der BSB-, Ammonium- und Nitrit-/Nitratwert.
38. Alle Analysen sollten nach dem Ziehen und Vorbereiten der Proben so bald wie möglich durchgeführt werden. Müssen Analysen zeitlich verschoben werden, sind die Proben in randvollen, fest verschlossenen Flaschen bei ungefähr 4 °C dunkel zu lagern. Müssen die Proben für länger als 48 Stunden gelagert werden, sollten sie durch Tiefgefrieren, Ansäuern oder Zugabe einer geeigneten toxischen Substanz (z.B. 20 ml/l einer 10 g/l-Lösung Quecksilber(II)-Chlorid) haltbar gemacht werden. Dabei ist sicherzustellen, dass die Konservierungsmethode die Analyseergebnisse nicht beeinträchtigt.
Vorlaufphase (Running-in period)
39. In dieser Phase, die in der Regel etwa zwei Wochen dauert, sechs Wochen jedoch nicht überschreiten sollte, entwickelt sich auf der Grenzfläche ein Biofilm optimaler Dicke. Der DOC- (bzw. der CSB-)Wert nimmt weiter ab (Nummer 44) und erreicht einen Plateauwert. Ist in beiden Rohren ein vergleichbarer Plateauwert erreicht, wird ein Rohr ausgewählt, das für die restliche Prüfungsdauer, während der die Leistungen beider Rohre konsistent bleiben sollten, als Kontrollanlage fungiert.
Zugabe der Prüfsubstanz
40. In dieser Phase wird der zweite Reaktor in vorgegebener Konzentration (in der Regel 10-20 mg C/l) mit Prüfsubstanz beschickt. Der Kontrollanlage wird weiterhin nur organisches Medium zugeführt.
Akklimatisierungsphase
41. Der DOC-Wert (bzw. der CSB-Wert) wird weiterhin zweimal wöchentlich bestimmt; wenn die primäre Bioabbaubarkeit bestimmt werden muss, wird durch spezifische Analyse auch die Prüfsubstanzkonzentration gemessen. Zur Akklimatisierung sollten nach Erstzugabe der Prüfsubstanz eine bis sechs Wochen (unter besonderen Umständen auch länger) eingeplant werden. Sobald die prozentuale Abnahme (Nummern 43-45) ihren Höchststand erreicht hat, werden während der Plateauphase über einen Zeitraum von ungefähr drei Wochen 12-15 gültige Werte ermittelt, um die mittlere Abnahmerate zu bestimmen. Der Test gilt als abgeschlossen, wenn ein ausreichend hoher Eliminationsgrad erreicht ist. Der Test sollte nach Erstzugabe der Prüfsubstanz nicht länger als zwölf Wochen dauern.
Bewuchsablösungen (Sloughing)
42. In relativ regelmäßigen Zeitabständen lösen sich plötzlich ganze Teile überschüssigen Films von den Rohren ab (Sloughing). Um sicherzustellen, dass die Vergleichbarkeit der Ergebnisse nicht beeinträchtigt wird, sollten die Tests mindestens zwei vollständige Wachstums- und Sloughing-Zyklen erfassen.
Auswertung der Ergebnisse
43. Die prozentuale Abnahme (Elimination) der Prüfsubstanz, basierend auf der DOC- bzw. der CSB-Messung, wird in den vorgegebenen Zeitabständen nach folgender Gleichung berechnet:
Dt = 100 [Cs - (E - Eo)]/Cs %
Dabei sind:
Dt = der Prozentsatz der Abnahme des DOC- bzw. des CSB-Wertes zum Zeitpunkt t
Cs = die DOC- bzw. CSB-Konzentration der Prüfsubstanz im Zulauf, vorzugsweise anhand der Stammlösung geschätzt (mg/l)
E = der gemessene DOC- oder CSB-Wert im Ablauf der Prüfanlage zum Zeitpunkt t (mg/l)
Eo = der gemessene DOC- oder CSB-Wert im Ablauf der Kontrollanlage zum Zeitpunkt t (mg/l)
Die Berechnung sollte für die Referenzsubstanz, sofern getestet, wiederholt werden.
Leistung des Kontrollreaktors
44. Der Grad der Elimination des organischen Mediums in den Kontrollreaktoren, bezogen auf den DOC- bzw. den CSB-Wert, ist eine nützliche Größe für die Bestimmung der biologischen Abbauaktivität des Biofilms während der Prüfung. Die prozentuale Elimination wird nach folgender Gleichung berechnet:
DB = 100 (1 - Eo/Cm) %
Dabei ist:
Cm = DOC- bzw. CSB-Wert des organischen Mediums im Zulauf der Kontrollanlage (mg/l)
45. Die Abnahme (DST) der Prüfsubstanz wird, soweit nach einer spezifischen Analysemethode gemessen, in den vorgegebenen Zeitabständen nach folgender Gleichung berechnet:
DST = 100 (1 - Se/Si) %
Dabei sind:
Si = die gemessene oder vorzugsweise geschätzte Konzentration der Prüfsubstanz im Zulauf der Prüfanlage (mg/l)
Se = die gemessene Konzentration der Prüfsubstanz im Ablauf der Prüfanlage zum Zeitpunkt t (mg/l)
Ergibt die Analysemethode bei unverändertem Abwasser einen positiven Wert (Sc mg/l), wird die prozentuale Abnahme (DSC) nach folgender Gleichung berechnet:
DSC = 100 (Si - Se + Sc)/(Si + Sc) %
Darstellung der Prüfergebnisse
46. Die prozentuale Elimination Dt und DST (oder Dsc), soweit dieser Wert vorliegt, wird gegen die Zeit aufgetragen (siehe Kapitel C.10-A, Anlage 2). Die (auf die nächste ganze Zahl gerundete) mittlere Abweichung und die Standardabweichung der in der Plateauphase ermittelten 12-15 Werte für DT (und für DST, falls dieser Wert vorliegt) entsprechen der prozentualen Abnahme der Prüfsubstanz. Vom Verlauf der Eliminationskurve lassen sich bestimmte Schlüsse über die Abnahmeprozesse ziehen.
Adsorption
47. Manifestiert sich zu Prüfungsbeginn bei der Prüfsubstanz eine starke DOC-Elimination, wird die Prüfsubstanz wahrscheinlich durch Anlagerung (Adsorption) an den Biofilm eliminiert. Dieser Vorgang kann möglicherweise durch Bestimmung der Prüfsubstanz nachgewiesen werden, die an Feststoffen, die sich vom Film abgelöst haben, angelagert ist. Die DOC-Elimination adsorptionsfähiger chemischer Substanzen bleibt erfahrungsgemäß nicht während der gesamten Prüfung hoch; in der Regel ist sie zu Beginn der Prüfung hoch und fällt dann allmählich auf ein stabiles Niveau. Könnte die adsorptionsfähige Prüfsubstanz jedoch auf die eine oder andere Weise eine Akklimatisation der Mikrobenpopulation herbeiführen, würde die DOC-Elimination der Prüfsubstanz in der Folge ansteigen und einen hohen Plateauwert erreichen.
Latenzphase (Lag-Phase)
48. Wie bei statischen Screeningtests müssen viele Prüfsubstanzen eine Latenzphase durchlaufen, bevor sie vollständig biologisch abgebaut werden. In dieser Lag-Phase akklimatisieren (bzw. adaptieren) sich die betreffenden Bakterien, ohne dass in nennenswertem Maße Prüfsubstanz abgebaut wird; erst nach dieser Phase setzt das Bakterienwachstum ein. Die Phase endet und die Abbauphase gilt als begonnen, wenn etwa 10 % der anfänglichen Prüfsubstanzmenge abgebaut sind (nach der Adsorption, falls es dazu kommt). Die Lag-Phase ist oft sehr variabel und schwer reproduzierbar.
Plateauphase
49. Die Plateau-Phase einer Eliminationskurve im kontinuierlichen Test ist definiert als die Phase, in der maximale Zersetzung stattfindet. Sie sollte mindestens 3 Wochen dauern, in denen etwa 12-15 gültige Messwerte ermittelt werden.
Mittlerer Eliminationsgrad der Prüfsubstanz
50. Dieser Mittelwert wird anhand der Eliminationswerte Dt (und Dst, falls dieser Wert vorliegt) der Prüfsubstanz in der Plateauphase berechnet. Auf die nächste ganze Zahl (1 %) gerundet entspricht dieser Wert dem Eliminationsgrad der Prüfsubstanz. Ferner wird empfohlen, das 95 %-Konfidenzniveau für den Mittelwert zu berechnen. Auf dieselbe Weise wird der mittlere Eliminationsgrad (DB) des organischen Mediums im Kontrollgefäß berechnet.
Hinweis auf den biologischen Abbau
51. Lagert sich die Prüfsubstanz nicht in nennenswertem Umfang an den Biofilm an und hat die Eliminationskurve die typische Form einer Bioabbaukurve mit Latenz-, Abbau- und Plateauphasen (Nummern 48, 49), so kann die gemessene Elimination mit Sicherheit dem biologischen Abbau zugeschrieben werden. War die Abnahme im Anfangsstadium hoch, kann der Simulationstest nicht zwischen biologischen und abiotischen Eliminationsprozessen differenzieren. In derartigen Fällen und in anderen Fällen, in denen Zweifel am biologischen Abbau bestehen (z.B. wenn die Prüfsubstanz ausgegast wird (stripping)), wird die Adsorption der Prüfsubstanz an Biofilmproben untersucht, oder anhand von Parametern, die biologische Prozesse genau angeben, werden zusätzliche statische Bioabbaubarkeitstests (Screeningtests) durchgeführt. Zu derartigen Tests zählen die Sauerstoffaufnahmemethoden (Kapitel C.4 (D, E und F) dieses Anhangs) (9) oder Kohlendioxid-Entwicklungstests (Kapitel C.4-C dieses Anhangs oder die ISO-Headspace-Methode (10), wobei als Inokulum zuvor exponierter Biofilm aus dem entsprechenden Reaktor verwendet wird.
52. Wurden sowohl die DOC-Abnahme als auch die Prüfsubstanzabnahme gemessen, deuten große Unterschiede (d. h. wenn erstere geringer ist als letztere) zwischen den Abnahmeprozentsätzen auf die Präsenz intermediärer organischer Produkte in den Abläufen hin, die möglicherweise schwerer abzubauen sind und untersucht werden sollten.
Gültigkeit der Prüfergebnisse
53. Der Test kann als gültig angesehen werden, wenn der Grad der DOC-Elimination (bzw. der CSB-Elimination) in den Kontrollanlagen nach zwei Wochen Betrieb > 80 % beträgt und nichts Ungewöhnliches festgestellt wurde.
54. Wurde eine leicht biologisch abbaubare (Referenz-)Substanz getestet, sollten der Abbaubarkeitsgrad > 90 % und die Differenz zwischen Duplikatwerten nicht mehr als 5 % betragen. Sind diese beiden Kriterien nicht erfüllt, sollten die Testverfahren überprüft werden, und/oder es sollte Haushaltsabwasser aus einer anderen Quelle bezogen werden.
55. Gleichermaßen sollten Differenzen zwischen Abbaubarkeitswerten aus eine Prüfsubstanz behandelnden Duplikatanlagen (sofern verwendet) nicht mehr als 5 % betragen. Wenn dieses Kriterium nicht erfüllt ist, die Abnahmewerte jedoch hoch sind, sollten die Analysen für weitere drei Wochen fortgesetzt werden. Sind die Abnahmewerte gering, müssen die Hemmwirkungen der Prüfsubstanz, soweit sie nicht bekannt sind, untersucht werden, und der Test muss mit einer niedrigeren Prüfsubstanzkonzentration wiederholt werden, sofern dies möglich ist.
Prüfbericht
56. Der Prüfbericht muss Folgendes umfassen:
Prüfsubstanz:
- Kenndaten;
- physikalischer Zustand und, soweit relevant, physikalisch-chemische Eigenschaften.
Prüfbedingungen:
- etwaige Modifikationen des Prüfsystems, vor allem bei Prüfungen nicht löslicher und flüchtiger chemischer Substanzen;
- Art des organischen Mediums;
- Anteil (und Art) der Industrieabwässer im kommunalen Abwasser, soweit bekannt;
- Animpfungsmethode;
- Prüfsubstanz-Stammlösung: DOC- und TOC-Gehalt; bei Suspension: Art der Zubereitung; verwendete Testkonzentration; falls außerhalb der Bandbreite von 10-20 mg/l DOC: Begründung; Zugabemethode; Datum der ersten Zugabe; etwaige Änderungen der Konzentration;
- mittlere hydraulische Verweilzeit (ohne Wachstum); Rotationsgeschwindigkeit des Rohres; ungefährer Neigungswinkel (wenn möglich);
- Angaben zur Bewuchsablösung (Sloughing); Dauer und Intensität;
- Testtemperatur und Temperaturspanne;
- angewandte Analysetechniken.
Prüfergebnisse:
- alle Messdaten (DOC, CSB, spezifische Analysen, pH-Wert, Temperatur, N-Chemikalien, soweit relevant);
- alle Berechnungswerte für Dt (oder Dtc), DB, DS in tabellarischer Form und als Eliminationskurven;
- Aussagen zu Latenz- und Plateau-Phasen, Prüfungsdauer, Eliminationsgrad der Prüfsubstanz, der Referenzsubstanz (falls getestet) und des organischen Mediums (in der Kontrollanlage) sowie statistische Informationen und Angaben zur Bioabbaubarkeit und zur Gültigkeit des Tests;
- Diskussion der Ergebnisse.
1. Gerike P, Fischer W, Holtmann W (1980). Biodegradability determinations in trickling filter units compared with the OECD Confirmatory Test. Wat. Res. 14: 753-758.
2. Truesdale GA, Jones K, Vandyke KG (1959). Removal of synthetic detergents in sewage treatment processes: Trials of a new biologically attackable material.Wat. Waste Tr. J. 7: 441-444.
3. Baumann U, Kuhn G and Benz M. (1998). Einfache Versuchsanordnung zur Gewinnung gewässerökologisch relevanter Daten, UWSF - Z. Umweltchem. Ökotox. 10: 214-220.
4. Gloyna EF, Comstock RF, Renn CE (1952). Rotary tubes as experimental trickling filters. Sewage ind. Waste 24: 1355-1357.
5. Kumke GW, Renn CE (1966). LAS removal across an institutional trickling filter. JAOCS 43: 92-94.
6. Tomlinson TG, Snaddon DHM, (1966). Biological oxidation of sewage by films of micro-organisms. Int.J. Air Wat. Pollut. 10: 865-881.
7. Her Majesty's Stationery Office (1982). Methods for the examination of waters and associated materials. Assessment of biodegradability, 1981, London.
8. Her Majesty's Stationery Office (1984). Methods for the examination of waters and associated materials. Methods for assessing the treatability of chemicals and industrial waste waters and their toxicity to sewage treatment processes, 1982, London.
9. Kapitel C.4 dieses Anhangs, Bestimmung der 'leichten' biologischen Abbaubarkeit, A-F.
10. ISO 14593 (1998). Wasserbeschaffenheit - Bestimmung der vollständigen biologischen Abbaubarkeit organischer Substanzen im wässrigen Medium - Verfahren mittels Bestimmung des anorganischen Kohlenstoffs in geschlossenen Flaschen.
| Anlage 8 |
Abbildung 1 Drehrohre

Legende:
Draufsicht:
Draufsicht A/B:
Antriebsrollen:
Umlenkrollen:
Antriebsmotor:
Umsetzungsgetriebe:
Innenflansch:
Neigungsmechanismus:
Kegelradgetriebe:
Abbildung 2 Fließdiagramm

A: Zulaufgefäß
B: Peristaltikpumpe
C: Drehrohr
D: Ablaufsammelgefäß
Begriffsbestimmungen:
a Prüfsubstanz: jede nach dieser Prüfmethode getestete Substanz oder Mischung.
b Chemische Substanzen: 'Es wird darauf hingewiesen, dass der Begriff 'chemische Substanz' in den UNCED-Übereinkommen und Folgedokumenten im Allgemeinen Substanzen, Produkte, Gemische, Aufbereitungen oder jeden anderen Begriff einschließt, der in bestehenden Systemen möglicherweise zur Beschreibung des Prüfgegenstands verwendet wird.'
C.11
Belebtschlamm, Prüfung der Atmungshemmung (Kohlenstoff- und Ammoniumoxidation) 16
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 209 (2010). Sie beschreibt ein Verfahren zur Bestimmung der Auswirkungen einer Chemikalie auf Mikroorganismen (im Wesentlichen Bakterien) in Belebtschlamm durch Messung der Respirationsrate (Kohlenstoff- und/oder Ammoniumoxidation) unter definierten Bedingungen und bei unterschiedlichen Konzentrationen der Prüfchemikalie. Die Prüfmethode beruht auf dem ETAD-Test (ETAD = Ecological and Toxicological Association of the Dyestuffs Manufacturing industry) (1)(2), auf der vorherigen OECD-Prüfrichtlinie 209 (3) und auf der geänderten ISO-Norm 8192 (4). Zweck dieser Methode ist die Schaffung eines schnellen Screening-Verfahrens, mit dem sich die Auswirkungen von Chemikalien auf die im Belebtschlamm der biologischen (aeroben) Stufe von Kläranlagen enthaltenen Mikroorganismen feststellen lassen. Die Testergebnisse können auch als Indikator für geeignete nicht inhibierende Konzentrationen von Prüfchemikalien dienen, welche in Tests zur biologischen Abbaubarkeit (siehe z.B. Kapitel C.4 A-F, C.9, C.10, C.12 und C.29 sowie OECD TG 302C) verwendet werden. In diesem Fall kann der Test als Screening-Test etwa wie ein Vorversuch oder ein Limit-Test (siehe Nummer 39) durchgeführt werden, bei dem nur die Gesamtrespiration berücksichtigt wird. Bei Prüfungen auf leichte biologische Abbaubarkeit (Kapitel C.4 A-F und Kapitel C.29), bei denen die Konzentration des Inokulums erheblich geringer ist als bei der vorliegenden Prüfmethode, sind diese Informationen allerdings mit Vorsicht zu bewerten. Wenn in diesem Respirationstest keine Hemmung festgestellt wird, bedeutet dies nicht zwangsläufig, dass auch bei der Prüfung auf leichte biologische Abbaubarkeit gemäß den Kapiteln C.4 A-F oder C.29 keine Hemmung gegeben wäre.
2. Insgesamt wird die Prüfung der Atmungshemmung seit ihrer erstmaligen Veröffentlichung offenbar erfolgreich durchgeführt; gelegentlich wurde allerdings auch von falschen Ergebnissen berichtet (siehe z.B. (2)(4)(5)). Kurven, die die Respiration in Abhängigkeit von der Konzentration aufzeigen, verlaufen manchmal biphasisch, Darstellungen der Dosis-Wirkungs-Beziehung wurden verzerrt, und EC50-Werte waren außergewöhnlich niedrig (5). In Untersuchungen wurde festgestellt, dass diese Ergebnisse dann ermittelt wurden, wenn der in der Prüfung verwendete Belebtschlamm stark nitrifiziert und wenn die Prüfchemikalie sich stärker auf die Ammoniumoxidation auswirkt als auf die allgemeine heterotrophe Oxidation. Bei diesen falschen Ergebnissen können zusätzliche Prüfungen mit einem spezifischen Nitrifikationshemmer durchgeführt werden. Durch die Messung der Sauerstoffverbrauchsraten mit und ohne diese Hemmstoffe (z.B. N-Allylthioharnstoff (ATU)) können die gesamte und die heterotrophe Sauerstoffverbrauchsrate und die Sauerstoffverbrauchsrate durch Nitrifikation berechnet werden (4)(7)(8). Bei beiden Prozessen kann also die Hemmung durch eine Prüfchemikalie ermittelt werden, und die EC50-Werte können sowohl für die Oxidation von organischem Kohlenstoff (heterotroph) als auch für die Ammoniumoxidation (Nitrifikation) wie gewohnt berechnet werden. In seltenen Fällen kann die hemmende Wirkung von N-Allylthioharnstoff durch die Komplexbildung mit Prüfchemikalien oder Mediumzusätzen, z.B. Cu++-Ionen (6), teilweise oder vollständig aufgehoben werden. Cu++-Ionen sind für Nitrosomonas von entscheidender Bedeutung; in höheren Konzentrationen sind sie allerdings giftig.
3. Die Nitrifikation bei der aeroben Behandlung von Abwässern als unumgänglicher Schritt bei der Abtrennung von Stickstoffverbindungen aus Abwässern durch Denitrifikation in gasförmige Produkte hat in europäischen Ländern besondere Bedeutung erlangt. Inzwischen hat die EU niedrigere Grenzwerte für die Stickstoffkonzentration in behandelten Abwässern festgesetzt, die in aufnehmende Gewässer eingeleitet werden 1.
4. Für die meisten Zwecke reicht es aus, nur die Auswirkungen auf die Mechanismen der Oxidation organischen Kohlenstoffs zu bewerten. Manchmal müssen jedoch die Auswirkungen auf die Nitrifikation allein oder auf die Nitrifikation und die Oxidation organischen Kohlenstoffs getrennt geprüft werden, um die Ergebnisse angemessen interpretieren und die Auswirkungen richtig verstehen zu können.
5. Die Respirationsraten von mit synthetischem Abwasser beschickten Belebtschlammproben werden nach einer Kontaktzeit von drei Stunden in einer geschlossenen Zelle mit einer Sauerstoffelektrode gemessen. Wenn ein realistisches Expositionsszenarium zugrunde gelegt wird, können auch längere Kontaktzeiten angemessen sein. Wenn die Prüfchemikalie rasch abgebaut wird (z.B. abiotisch durch Hydrolyse) oder flüchtig ist und sich keine angemessene Konzentration aufrechterhalten lässt, kann zusätzlich eine kürzere Expositionsdauer (beispielsweise 30 Minuten) gewählt werden. Die Empfindlichkeit der einzelnen Belebtschlammproben ist am Tag der Exposition anhand einer geeigneten Referenzchemikalie zu prüfen. Mit der Prüfung wird gewöhnlich der ECx-Wert (z.B. EC50) der Prüfchemikalie und/oder die höchste geprüfte Konzentration ohne beobachtete Wirkung (NOEC) ermittelt.
6. Die Hemmung der Sauerstoffaufnahme durch Mikroorganismen, die organischen Kohlenstoff oxidieren, kann getrennt von derjenigen durch Ammonium oxidierende Mikroorganismen bestimmt werden; dazu ist die Sauerstoffverbrauchsrate mit und ohne N-Allylthioharnstoff zu messen; N-Allylthioharnstoff ist ein spezifischer Hemmstoff, der der Oxidation von Ammonium zu Nitrit durch Nitritbakterien (Stufe 1) entgegenwirkt. In diesem Fall wird die prozentuale Hemmung der Sauerstoffverbrauchsrate durch einen Vergleich der Sauerstoffverbrauchsrate in Gegenwart der Prüfchemikalie mit der mittleren Sauerstoffverbrauchsrate der entsprechenden Kontrollen ohne Prüfchemikalie berechnet, beides jeweils mit und ohne den spezifischen Inhibitor N-Allylthioharnstoff.
7. Ein etwaiger Sauerstoffverbrauch aufgrund abiotischer Prozesse kann nachgewiesen werden, indem die jeweilige Verbrauchsrate in Mischungen aus Prüfchemikalie, synthetischem Abwassermedium und Wasser, aber ohne Belebtschlamm, ermittelt wird.
Informationen zur Prüfchemikalie
8. Die Kenndaten (vorzugsweise die CAS-Nummer), die Bezeichnung (IUPAC), die Reinheit, die Wasserlöslichkeit, der Dampfdruck, die Flüchtigkeit und das Adsorptionsverhalten der Prüfchemikalie müssen bekannt sein, damit die Ergebnisse richtig interpretiert werden können. Im Allgemeinen können flüchtige Chemikalien nur dann angemessen geprüft werden, wenn spezielle Vorkehrungen getroffen wurden (siehe Nummer 21).
9. Die Prüfmethode kann bei wasserlöslichen, schlecht löslichen und flüchtigen Chemikalien angewendet werden. Bei Chemikalien mit eingeschränkter Löslichkeit ist es jedoch unter Umständen nicht immer möglich, EC50-Werte zu ermitteln. Gültige Ergebnisse für flüchtige Chemikalien lassen sich manchmal nur dann erzielen, wenn die Prüfchemikalie am Ende der Expositionsdauer immer noch größtenteils (d. h. > 80 %) im Reaktionsgemisch enthalten ist. Bei Unsicherheiten hinsichtlich der Stabilität oder der Flüchtigkeit der Prüfchemikalie sollten zusätzliche Analysedaten vorgelegt werden, um die ECx-Konzentration genauer zu bestimmen.
10. Referenzchemikalien müssen regelmäßig geprüft werden, um die Zuverlässigkeit der Prüfmethode und der Prüfbedingungen sicherzustellen und um am Expositionstag die Empfindlichkeit der einzelnen Belebtschlammproben zu prüfen, die als Inokulum verwendet werden. Als Referenz-Hemmstoff wird 3,5- Dichlorphenol (3,5-DCP) empfohlen; diese Chemikalie ist ein bekannter Inhibitor der Respiration und wird in zahlreichen Inhibitions- und Toxizitätstests verwendet (4). In Verbindung mit der Hemmung der Gesamtrespiration kann als Referenzchemikalie auch Kupfer-(II)-sulfat-Pentahydrat verwendet werden (9). N-Methylanilin ist als spezifische Referenzchemikalie zur Nitritifikationshemmung geeignet (4).
Validitätskriterien und Reproduzierbarkeit
11. Die Sauerstoffverbrauchsrate der Blindkontrollen (ohne Prüfchemikalie und ohne Referenzchemikalien) muss pro Stunde mindestens 20 mg Sauerstoff pro Gramm Belebtschlamm (Trockenmasse der suspendierten Feststoffe) betragen. Bei geringerer Sauerstoffverbrauchsrate ist der Test mit gewaschenem Belebtschlamm oder mit Schlamm anderer Herkunft zu wiederholen. Der Variationskoeffizient der Sauerstoffverbrauchsrate der Kontrollreplikate darf am Ende des definitiven Tests höchstens bei 30 % liegen.
12. 2004 hat die ISO einen internationalen Ringtest mit Belebtschlamm aus häuslichen Abwässern organisiert (4); in diesem Test wurde für 3,5-DCP ein EC50-Wert im Bereich von 2 bis 25 mg/l für die Gesamtrespiration, von 5 bis 40 mg/l für die heterotrophe Respiration und von 0,1 bis 10 mg/l für die Nitrifikationsrespiration ermittelt. Wenn der EC50-Wert für 3,5-DCP nicht im erwarteten Bereich liegt, ist der Test mit Belebtschlamm anderer Herkunft zu wiederholen. Der EC50-Wert für Kupfer-(II)-sulfat-Pentahydrat muss für die Gesamtrespiration bei 53 bis 155 mg/l liegen (9).
Prüfgefäße und Apparatur
13. Für die Prüfung sind gewöhnliche Laborausrüstung sowie folgende Materialien zu verwenden:
- Prüfgefäße - z.B. 1.000-ml-Bechergläser für jeweils 500 ml Reaktionsgemisch (siehe Nummer 5 in Abb. 1);
- Zellen und Zubehör zur Messung der Konzentration des gelösten Sauerstoffs, eine geeignete Sauerstoffelektrode, eine geschlossene Zelle zur Aufnahme der Probe ohne Kopfraum (headspace) und ein Aufzeichnungsgerät (z.B. Nummern 7, 8, 9 in Abb. 1, Anlage 2). Alternativ kann eine BSB-Flasche mit geeigneter Übergangstülle zur Abdichtung der Sauerstoffelektrode zum Flaschenhals verwendet werden (siehe Abb. 2 in Anlage 3). Um zu vermeiden, dass beim Einsetzen der Sauerstoffelektrode Flüssigkeit austritt, sollte zunächst ein Trichter oder ein Glasröhrchen durch die Tülle geschoben werden; statt dessen können auch Gefäße mit gebördeltem Rand verwendet werden. In beiden Fällen sind ein Magnetrührer oder ein alternatives Rührverfahren zu verwenden (z.B. eine selbstrührende Sonde);
- Magnetrührer und Rührfisch mit einem Überzug aus inertem Material zur Verwendung in der Messkammer und/oder in den Prüfgefäßen;
- Belüftungseinrichtung: Erforderlichenfalls muss Druckluft durch einen geeigneten Filter geleitet werden, um Staub und Öl abzutrennen und durch Waschflaschen mit Wasser zur Luftbefeuchtung. Die Gefäße sind mit Pasteur-Pipetten oder sonstigen Belüftungseinrichtungen zu belüften, die keine Chemikalien adsorbieren. Mit einer Schüttelmaschine mit Rundschüttelbewegung mit einer Drehzahl zwischen 150 und 250 min- 1 und mit Flaschen mit einem Volumen von z.B. 2.000 ml kann der Sauerstoffbedarf des Schlamms gedeckt werden; außerdem können mit dieser Schüttelmaschine Probleme bei Chemikalien überwunden werden, die übermäßig schäumen, die flüchtig sind und daher verlorengehen können oder schwierig zu dispergieren sind, wenn die Belüftung durch Drucklufteinspeisung (Air Sparging) erfolgt. Das Prüfsystem umfasst gewöhnlich eine Reihe kontinuierlich belüfteter und nacheinander (z.B. in Intervallen von 10 bis 15 Minuten) angesetzter Bechergläser, die dann der Reihe nach analysiert werden. Wahlweise können auch validierte Geräte verwendet werden, die für eine gleichzeitige Belüftung und Messung der Sauerstoffverbrauchsrate der Mischungen ausgelegt sind;
- pH-Messgerät;
- Zentrifuge, normale Tischzentrifuge zur Zentrifugierung von Schlämmen mit 10.000 m/s2.
Reagenzien
14. Für die Prüfungen sind grundsätzlich Reagenzien in Analysequalität zu verwenden.
Wasser
15. Wenn nicht ausdrücklich chlorfreies Leitungswasser vorgeschrieben ist, muss destilliertes oder entionisiertes Wasser mit weniger als 1 mg/l gelöstem organischem Kohlenstoff (DOC) verwendet werden.
Versorgung mit synthetischem Abwasser
16. Das Medium ist so zuzubereiten, dass die folgenden Bestandteile in den jeweils genannten Anteilen enthalten sind:
| - Pepton | 16 g |
| - Fleischextrakt (oder ein vergleichbarer Pflanzenextrakt) | 11 g |
| - Harnstoff | 3 g |
| - Natriumchlorid (NaCl) | 0,7 g |
| - Calciumchlorid-Dihydrat (CaCl2, 2H2O) | 0,4 g |
| - Magnesiumsulfat-Heptahydrat (MgSO4, 7H2O) | 0,2 g |
| - wasserfreies Kaliummonohydrogenphosphat (K2HPO4) | 2,8 g |
| - destilliertes oder entionisiertes Wasser q.s.p. 1 Liter |
17. Der pH-Wert dieser Lösung muss bei 7,5 ± 0,5 liegen. Wenn das hergestellte Medium nicht sofort verwendet wird, kann es bei 0 bis 4 °C im Dunkeln höchstens eine Woche gelagert werden; alternativ kann die Lagerung auch unter anderen Bedingungen erfolgen, bei denen sich die Zusammensetzung nicht verändert. Dieses synthetische Abwasser hat die hundertfache Konzentration des im technischen Bericht der OECD vom 11. Juni 1976 'Vorgeschlagenes Verfahren zur Bestimmung der biologischen Abbaubarkeit von Tensiden in synthetischen Detergenzien' beschriebenen Abwassers und enthält außerdem Dikaliumhydrogenphosphat.
18. Alternativ können die Bestandteile des Mediums vor der Lagerung getrennt sterilisiert werden, oder das Pepton und der Fleischextrakt werden erst kurz vor der Durchführung der Prüfung hinzugegeben. Vor der Verwendung ist das Medium gründlich zu mischen und der pH-Wert erforderlichenfalls auf 7,5 ± 0,5 einzustellen.
Prüfchemikalie
19. Eine Stammlösung ist für leicht wasserlösliche Prüfstoffe nur bis zur maximalen Wasserlöslichkeit herzustellen. (Ausfällungen sind nicht annehmbar.) In Wasser schlecht lösliche Stoffe, Gemische mit Bestandteilen mit unterschiedlicher Wasserlöslichkeit und adsorptive Stoffe sind direkt in die Prüfgefäße einzuwiegen. In diesen Fällen kann die Verwendung von Stammlösungen eine Alternative sein, wenn gelöste Konzentrationen der Prüfchemikalien in den Prüfgefäßen analytisch bestimmt werden (bevor der Belebtschlamm hinzugegeben wird). Wenn WAFs (Water-Accommodated Fractions) hergestellt werden, ist auch eine analytische Bestimmung der aufgelösten Konzentrationen der Prüfchemikalien in den Prüfgefäßen von wesentlicher Bedeutung. Organische Lösungsmittel, Dispergiermittel/Emulgatoren zur Verbesserung der Löslichkeit sind zu vermeiden. Stammlösungen können einer Ultraschallbehandlung unterzogen werden, und Suspensionen können vorgerührt werden (z.B. über Nacht), wenn geeignete Informationen über die Stabilität der jeweiligen Prüfchemikalie unter den betreffenden Bedingungen verfügbar sind.
20. Die Prüfchemikalie kann den pH-Wert im Prüfsystem beeinträchtigen. Der pH-Wert der mit der Prüfchemikalie behandelten Mischungen ist vor der Herstellung des Versuchsaufbaus in einem Vorversuch zu bestimmen, um zu prüfen, ob der pH-Wert vor der eigentlichen Prüfung sowie nochmals am Tag der eigentlichen Prüfung eingestellt werden muss. Lösungen/Suspensionen der Prüfchemikalie in Wasser sind erforderlichenfalls vor Hinzugabe des Inokulums zu neutralisieren. Da die Neutralisierung jedoch die chemischen Eigenschaften der Chemikalie ändern kann, könnten je nach Zweck der Untersuchung weitere Prüfungen durchgeführt werden, um die Auswirkungen der Prüfchemikalie auf den Schlamm ohne Einstellung des pH-Wertes zu ermitteln.
21. Infolge von Stoffverlusten während der Expositionsdauer können die toxischen Wirkungen flüchtiger Chemikalien insbesondere bei Prüfungen, bei denen Luft durch das System geperlt wird, unterschiedlich stark ausgeprägt sein. Bei den betreffenden Stoffen ist Vorsicht geboten; in diesen Fällen sind stoffspezifische Analysen von Kontrollmischungen vorzunehmen, in denen der jeweilige Stoff enthalten ist, und die Belüftung ist entsprechend zu modifizieren.
Referenzchemikalie
22. Wenn 3,5-Dichlorphenol als Referenzchemikalie verwendet wird, ist eine Lösung aus 1,00 g 3,5-Dichlorphenol auf 1.000 ml Wasser herzustellen (15). Die Auflösung ist durch warmes Wasser und/oder eine Ultraschallbehandlung zu beschleunigen; nach dem Abkühlen auf Raumtemperatur ist die Lösung auf das vorgesehene Volumen aufzufüllen. Es muss allerdings sichergestellt werden, dass sich die Struktur der Referenzchemikalie nicht geändert hat. Der pH-Wert der Lösung wird geprüft und gegebenenfalls mit NaOH oder H2SO4 auf 7-8 eingestellt.
23. Wenn Kupfer-(II)-sulfat-Pentahydrat als Referenzchemikalie vorgesehen ist, sind Konzentrationen von 58 mg/l, 100 mg/l und 180 mg/l (Faktor 1,8) zu verwenden. Der Stoff wird unmittelbar in die Prüfgefäße eingewogen (29 - 50 - 90 mg bei einem Gesamtvolumen von 500 ml). Anschließend wird der Stoff in 234 ml autoklaviertem Leitungswasser aufgelöst. Kupfer-(II)-sulfat-Pentahydrat ist leicht löslich. Nach Beginn der Prüfung werden 16 ml synthetisches Abwasser und 250 ml Belebtschlamm hinzugegeben.
Spezifischer Nitrifikationshemmer
24. Es wird eine Stammlösung mit 2,32 g N-Allylthioharnstoff (ATU) pro Liter hergestellt. Die Hinzugabe von 2,5 ml dieser Stammlösung zu einem Inkubationsgemisch mit einem Endvolumen von 500 ml führt zu einer Endkonzentration von 11,6 mg ATU/l (10- 4mol/l); diese Konzentration ist erfahrungsgemäß hinreichend (4), um eine vollständige Hemmung der Nitrifikation in einem nitrifizierenden Belebtschlamm mit 1,5 g/l suspendierten Stoffen zu bewirken.
Abiotische Kontrolle
25. Unter gewissen seltenen Bedingungen kann eine Prüfchemikalie mit starker Reduktionswirkung einen messbaren abiotischen Sauerstoffverbrauch verursachen. In diesen Fällen sind abiotische Kontrollen erforderlich, um zwischen der abiotischen Sauerstoffaufnahme durch die Prüfchemikalie und dem Sauerstoffverbrauch durch Mikroorganismen unterscheiden zu können. Abiotische Kontrollen können hergestellt werden, indem bei den Prüfmischungen auf das Inokulum verzichtet wird. Ebenso können abiotische Kontrollen ohne Inokulum verwendet werden, wenn unterstützende analytische Messungen vorgenommen werden, um die erzielte Konzentration in der Expositionsphase der Prüfung zu bestimmen (z.B. bei Verwendung von Stammlösungen von schlecht wasserlöslichen Chemikalien oder Gemischen mit Bestandteilen mit unterschiedlicher Wasserlöslichkeit). In speziellen Fällen kann die Herstellung einer abiotischen Kontrolle mit einem sterilisierten Inokulum (z.B. durch Autoklavieren oder durch Hinzugabe sterilisierender Giftstoffe) erforderlich sein. Manche Chemikalien können Sauerstoff nur dann erzeugen oder verbrauchen, wenn die Oberfläche hinreichend groß für eine Reaktion ist, selbst dann, wenn die Chemikalien dazu normalerweise eine erhebliche höhere Temperatur oder einen erheblich höheren Druck benötigen. In diesem Zusammenhang ist bei Peroxiden besondere Aufmerksamkeit geboten. Ein sterilisiertes Inokulum besitzt eine große Oberfläche.
Inokulum
26. Im Allgemeinen wird Belebtschlamm am Auslass des Belebungsbeckens, oder in der Nähe des Auslasses des Beckens, einer ordnungsgemäß betriebenen Kläranlage entnommen, in der hauptsächlich häusliche Abwässer aufbereitet werden. Je nach Zweck des Tests können auch sonstige geeignete Typen von Belebtschlamm oder Belebtschlamm sonstiger Herkunft (z.B. im Labor gezüchteter Schlamm) mit geeigneten Konzentrationen an suspendierten Stoffen (2-4 g/l) verwendet werden. Schlämme aus unterschiedlichen Behandlungsanlagen könnten jedoch unterschiedliche Eigenschaften aufweisen und unterschiedlich empfindlich sein.
27. Der Schlamm kann wie entnommen verwendet werden; grobe Teilchen sind jedoch durch kurzzeitiges Absetzen (etwa 5-15 Minuten) und Dekantieren der oberen Schicht der feineren Feststoffe oder durch Sieben (z.B. mit einer Maschenweite von 1 mm2) abzutrennen. Alternativ kann der Schlamm in einem Mischer mindestens etwa 15 Sekunden homogenisiert werden; dabei sind jedoch die Scherkräfte und die Temperaturänderung zu beachten, die bei längerer Mischdauer auftreten können.
28. Häufig muss der Schlamm gewaschen werden (z.B. bei geringer endogener Respirationsrate). Zunächst ist der Schlamm zu zentrifugieren, bis ein klarer Überstand entsteht und sich aus den Feststoffen des Abwassers ein Pellet bildet (z.B. nach 10 Minuten mit etwa 10.000 m/s2). Die überstehende Flüssigkeit wird entfernt und der Schlamm in chlorfreiem Leitungswasser unter Schütteln resuspendiert; anschließend ist das Waschwasser durch Zentrifugieren abzutrennen und ebenfalls zu entfernen. Erforderlichenfalls ist der Wasch- und Zentrifugiervorgang zu wiederholen. Die Trockenmasse eines bekannten Volumens des resuspendierten Schlamms wird ermittelt, und der Schlamm wird unter Abtrennen der Flüssigkeit konzentriert oder in chlorfreiem Leitungswasser weiter verdünnt, bis er die erforderliche Feststoffkonzentration von 3 g/l aufweist. Der Belebtschlamm ist bei der Testtemperatur kontinuierlich zu belüften (z.B. mit 2 l/Minute) und möglichst am Tag der Entnahme zu verwenden. Wenn dies nicht möglich ist, muss dem Schlamm das synthetische Abwasser (50 ml synthetisches Abwasser/l Belebtschlamm) zwei weitere Tage lang täglich zugeführt werden. Anschließend wird der Schlamm für die Prüfung verwendet, und die Ergebnisse sind als gültig anzunehmen, sofern keine signifikante Änderung der Aktivität des Schlamms zu verzeichnen ist; dies ist anhand der endogenen heterotrophen Respirationsrate und der Respirationsrate durch Nitrifikation zu beurteilen.
29. Schwierigkeiten können sich ergeben, wenn es bei der Inkubation zu derartiger Schaumbildung kommt, dass der Schaum und die mit dem Schaum verbundenen Feststoffe des Schlamms aus den Belüftungsgefäßen herausgedrückt werden. Gelegentlich ist ein Schäumen einfach auf das Vorhandensein des synthetischen Abwassers zurückzuführen, aber wenn die Prüfchemikalie aus einem Tensid besteht oder ein Tensid enthält, ist mit Schaumbildung zu rechnen. Der Verlust von Schlamm-Feststoffen aus den Prüfmischungen hat eine künstliche Reduzierung der Respirationsrate zur Folge, die fälschlicherweise als Ergebnis einer Hemmung ausgelegt werden könnte. Außerdem bewirkt die Belüftung der Tensidlösung eine Konzentration der Tenside in der Schaumschicht; der Verlust des Schaums aus dem Prüfsystem reduziert die Expositionskonzentrationen. Die Schaumbildung kann durch einfache mechanische Methoden (z.B. durch gelegentliches manuelles Rühren mit einem Glasstab) oder durch Zugabe eines tensidfreien Silikon-Antischaummittels und/oder durch Belüftung mit einem Schüttelkolben kontrolliert werden. Wenn das Problem auf das Vorhandensein des synthetischen Abwassers zurückzuführen ist, muss die Zusammensetzung des Abwassers geändert werden, indem ein Antischaum-Reagenz zugesetzt wird (z.B. 50 µl/l). Ist die Schaumbildung auf die Prüfchemikalie zurückzuführen, muss die für eine Reduzierung der Schaumbildung erforderliche Menge bei der maximalen Prüfkonzentration ermittelt werden; anschließend sind alle Prüfgefäße in identischer Weise zu behandeln (einschließlich der Prüfgefäße wie Blindkontrollen und Referenzgefäße ohne Schaum). Wenn Antischaummittel verwendet werden, darf es nicht zu Wechselwirkungen mit dem Inokulum und/oder mit der Prüfchemikalie kommen.
30. Die Hemmung kann für drei Arten von Sauerstoffverbrauch bestimmt werden: den Gesamtverbrauch, den heterotrophen Sauerstoffverbrauch und den Verbrauch durch Nitrifikation. Im Allgemeinen ist die Messung der Hemmung des Gesamtsauerstoffverbrauchs ausreichend. Die Auswirkungen auf den heterotrophen Sauerstoffverbrauch durch die Oxidation organischen Kohlenstoffs einerseits und auf die Ammoniumoxidation andererseits müssen aber bestimmt werden, wenn für eine bestimmte Chemikalie eine getrennte Bewertung dieser beiden Endpunkte erforderlich ist oder wenn (optional) atypische Dosis-Wirkungs-Kurven der Hemmung des Gesamtsauerstoffverbrauchs erklärt werden sollen.
Prüfbedingungen
31. Die Prüfung ist bei einer Temperatur von 20 ± 2 °C vorzunehmen.
Prüfmischungen
32. Prüfmischungen (FT wie in Tabelle 1), die Wasser, synthetisches Abwasser und die Prüfchemikalie enthalten, sind mit verschiedenen nominalen Konzentrationen der Prüfchemikalie herzustellen (siehe Tabelle 1 für Beispiele von Volumina der Bestandteile). Erforderlichenfalls ist der pH-Wert auf 7,5 ± 0,5 einzustellen; die Mischungen werden mit Wasser verdünnt, und anschließend wird das Inokulum hinzugegeben, um in den Gefäßen gleiche Endvolumina herzustellen und mit der Belüftung beginnen zu können.
Referenzmischungen
33. Diese Mischungen (FR) sind mit der Referenzchemikalie (z.B. mit 3,5-Dichlorphenol) anstelle der Prüfchemikalie auf die gleiche Weise herzustellen wie die Prüfmischungen.
Blindkontrollen
34. Bei Tests, bei denen die Prüfgefäße nacheinander in regelmäßigen Abständen vorbereitet werden, sind zu Beginn und am Ende der Expositionsdauer Blindkontrollen (FB) vorzunehmen. Wenn Prüfungen mit Geräten vorgenommen werden, die gleichzeitige Messungen des Sauerstoffverbrauchs zulassen, sind für jede Gruppe gleichzeitiger Analysen mindestens zwei Blindkontrollen einzubeziehen. Blindkontrollen enthalten jeweils gleiche Volumina des Belebtschlamms und des synthetischen Mediums, jedoch weder die Prüfchemikalie noch die Referenzchemikalie. Sie sind mit Wasser auf das gleiche Volumen wie die Prüf- und die Referenzmischungen zu verdünnen.
Abiotische Kontrolle
35. Wenn erforderlich (beispielsweise wenn von einer Prüfchemikalie bekannt oder anzunehmen ist, dass sie stark reduzierende Eigenschaften hat), muss ein Gemisch FA hergestellt werden, um den abiotischen Sauerstoffverbrauch zu messen. Das Gemisch muss die gleichen Mengen der Prüfchemikalie und des synthetischen Abwassers enthalten und das gleiche Volumen wie die Prüfmischungen haben, darf aber keinen Belebtschlamm enthalten.
Allgemeines Verfahren und Messungen
36. Prüfmischungen, Referenzmischungen, die Blindkontrollen und die abiotischen Kontrollen werden bei der Testtemperatur inkubiert und zwangsbelüftet (0,5 bis 1 l/min), um die Konzentration des gelösten Sauerstoffs über 60-70 % zu halten und die Suspendierung der Schlammflocken aufrechtzuerhalten. Um die Schlammflocken in Suspension zu halten, müssen die Kulturen zudem gerührt werden. Die Inkubation gilt als begonnen, wenn das Belebtschlamm-Inokulum mit den anderen Bestandteilen des endgültigen Gemischs in Kontakt kommt. Am Ende der Inkubation werden die Proben nach Ablauf der vorgesehenen Expositionsdauer von gewöhnlich drei Stunden entnommen, um in einer für diesen Zweck entwickelten Zelle (Abbildung 2 in Anlage 3) oder in einer vollständig gefüllten BSB-Flasche die Geschwindigkeit der Abnahme der Konzentration des gelösten Sauerstoffs zu messen. Auf welche Weise die Inkubationen beginnen, hängt auch von der Kapazität der Ausrüstung ab, mit der die Sauerstoffverbrauchsraten gemessen werden. Wenn die Ausrüstung beispielsweise nur eine einzelne Sauerstoffsonde enthält, werden die Messungen getrennt vorgenommen. In diesem Fall werden die für die Prüfung in synthetischem Abwasser benötigten Mischungen ohne Zugabe des Inokulums hergestellt, und die jeweils benötigten Anteile Schlamm werden in alle Gefäße der jeweiligen Reihe gegeben. Die Inkubation der Proben wird nacheinander in angemessenen Intervallen (z.B. 10 bis 15 Minuten) gestartet. Das Messsystem kann auch mehrere Sonden enthalten, was die Durchführung mehrerer gleichzeitiger Messungen erleichtert; in diesem Fall kann das Inokulum den Gefäßen der betreffenden Gruppen gleichzeitig hinzugegeben werden.
37. Die Belebtschlamm-Konzentration liegt bei allen Prüf-, Referenz- und Blindmischungen (nicht aber bei der abiotischen Kontrolle) bei nominal 1,5 g/l suspendierte Feststoffe. Der Sauerstoffverbrauch ist nach dreistündiger Exposition zu messen. Gegebenenfalls sind zusätzliche Messungen nach 30-minütiger Exposition vorzunehmen, wie unter Nummer 5 beschrieben.
Nitrifikationspotenzial des Schlamms
38. Um festzustellen, ob der Schlamm nitrifiziert und in welchem Maß diese Nitrifikation gegebenenfalls erfolgt, werden Mischungen (FB) wie die Mischungen für die Blindkontrollen und die zusätzlichen 'Kontrollen' (FN) hergestellt, die jedoch außerdem N-Allylthioharnstoff in einer Konzentration von 11,6 mg/l enthalten. Die Mischungen sind zu belüften und 3 Stunden bei 20 ± 2 °C zu inkubieren. Anschließend wird der Sauerstoffverbrauch gemessen, und die Sauerstoffverbrauchsrate durch Nitrifikation wird berechnet.
Prüfprotokolle
Vorversuch
39. Erforderlichenfalls wird mit einem Vorversuch der Konzentrationsbereich der Prüfchemikalie ermittelt, der in einem definitiven Test zur Bestimmung der Hemmung des Sauerstoffverbrauchs benötigt wird. Alternativ kann durch die Tatsache, dass in einem Vorversuch keine Hemmung des Sauerstoffverbrauchs durch die Prüfchemikalie festgestellt wurde, belegt werden, dass ein definitiver Test nicht erforderlich ist. In diesem Fall sollten drei Proben mit der höchsten geprüften Konzentration (in der Regel 1.000 mg/l, jedoch abhängig von den Datenanforderungen) im Vorversuch enthalten sein.
Tabelle 1: Beispiele für Mischungen für den Vorversuch
| Reagenz | Ausgangskonzentration | ||||
| Stammlösung der Prüfchemikalie Stammlösung des synthetischen Mediums Stammlösung mit Belebtschlamm | 10 g/l Siehe Nummer 16 3 g/l suspendierte Feststoffe | ||||
| Bestandteile von Mischungen | Dosierung in Prüfgefäße a | ||||
| FT1 | FT2 | FT3-5 | FB1-2 | FA | |
| Stammlösung der Prüfchemikalie (ml) (Nummern 19 bis 21) | 0,5 | 5 | 50 | 0 | 0 |
| Stammlösung des synthetischen Mediums (ml) (Nummer 16) | 16 | 16 | 16 | 16 | 16 |
| Belebtschlamm-Suspension (ml) (Nummern 26 bis 29) | 250 | 250 | 250 | 250 | 0 |
| Wasser (Nummer 15) | 233,5 | 229 | 184 | 234 | 434 |
| Gesamtvolumen der Mischungen (ml) | 500 | 500 | 500 | 500 | 500 |
| Konzentrationen in der Mischung | |||||
| Prüfsuspension (mg/l) Belebtschlamm (suspendierte Feststoffe) (mg/l) | 10
1.500 | 100
1.500 | 1.000
0 | 0
1500 | 1000
0 |
| a) Auf dieselbe Weise ist mit der Referenzchemikalie zu verfahren (Gefäße FR1-3). | |||||
40. Die Prüfung ist unter Verwendung von mindestens drei Konzentrationen der Prüfchemikalie (z.B. 10 mg/l, 100 mg/l und 1.000 mg/l) und mit einer Blindkontrolle sowie erforderlichenfalls mit mindestens drei abiotischen Kontrollen mit den höchsten Konzentrationen der Prüfchemikalie vorzunehmen (siehe z.B. Tabelle 1). Im Idealfall hat die niedrigste Konzentration keine Auswirkungen auf den Sauerstoffverbrauch. Die Sauerstoffverbrauchsrate und gegebenenfalls die Nitrifikationsrate sind zu berechnen; anschließend wird die prozentuale Hemmung berechnet. Je nach Zweck der Prüfung ist es auch möglich, nur die Toxizität einer Grenzkonzentration (z.B. 1.000 mg/l) zu bestimmen. Wenn bei diesen Konzentrationen keine statistisch signifikante toxische Wirkung auftritt, brauchen keine weiteren Prüfungen mit höheren oder niedrigeren Konzentrationen mehr vorgenommen zu werden. Schlecht wasserlösliche Stoffe, Mischungen mit Bestandteilen mit unterschiedlicher Wasserlöslichkeit und adsorptive Stoffe sind direkt in die Prüfgefäße einzuwiegen. In diesem Fall ist das für die Stammlösung mit dem Prüfstoff vorgesehene Volumen durch Verdünnungswasser zu ersetzen.
Definitiver Test
Hemmung des Gesamtsauerstoffverbrauchs
41. Die Prüfung wird mit einer Reihe von Konzentrationen durchgeführt, die im Vorversuch ermittelt wurden. Um sowohl eine NOEC als auch einen ECx-Wert (z.B. EC50) zu erhalten, sind meist sechs Kontrollen und fünf Prüfkonzentrationen in einer geometrischen Reihe mit je fünf Replikaten zu empfehlen. Die abiotische Kontrolle braucht nicht wiederholt zu werden, wenn im Vorversuch kein Sauerstoffverbrauch festgestellt wurde; wenn jedoch ein signifikanter Sauerstoffverbrauch zu verzeichnen ist, sind für jede Konzentration der Prüfchemikalie abiotische Kontrollen einzubeziehen. Die Empfindlichkeit des Schlamms ist mithilfe der Referenzchemikalie 3,5-Dichlorphenol zu prüfen. Da diese Empfindlichkeit erfahrungsgemäß schwankt, muss sie bei jeder Testreihe geprüft werden. In jedem Fall werden nach drei Stunden sowie erforderlichenfalls zusätzlich bereits nach 30 Minuten Proben aus den Prüfgefäßen entnommen, um den Sauerstoffverbrauch in der Zelle mit der Sauerstoffelektrode zu messen. Aus den erfassten Daten werden die spezifischen Respirationsraten der Kontroll- und der Prüfmischungen berechnet. Die prozentuale Hemmung ist mit der nachstehenden Gleichung 7 zu ermitteln.
Unterscheidung zwischen der Hemmung der heterotrophen Respiration und der Nitrifikation
42. Die Verwendung des spezifischen Nitrifikationshemmers ATU ermöglicht die unmittelbare Beurteilung der hemmenden Wirkung von Prüfchemikalien auf die heterotrophe Oxidation. Die Auswirkungen auf die Nitrifikationsrate können durch Subtraktion der Sauerstoffverbrauchsrate mit ATU von der Gesamtverbrauchsrate (ohne ATU) berechnet werden. Zwei Reihen von Reaktionsmischungen sind nach den Prüfprotokollen zur Ermittlung des ECx-Wertes bzw. der NOEC herzustellen, wie unter Nummer 41 beschrieben; außerdem ist jedem Gemisch in einer der beiden Reihen ATU in einer Endkonzentration von 11,6 mg/l zuzugeben. (Von dieser Konzentration ist belegt, dass die Nitrifikation in Schlamm mit Konzentrationen suspendierter Feststoffe von bis zu 3.000 mg/l vollständig gehemmt wird (4).) Am Ende des Expositionszeitraums werden die Sauerstoffverbrauchsraten gemessen; diese direkten Werte geben nur Aufschluss über die heterotrophe Respiration. Die Differenz zwischen diesen Werten und den entsprechenden Gesamtrespirationsraten entspricht der Nitrifikation. Anschließend werden die unterschiedlichen Grade der Hemmung berechnet.
Messungen
43. Nach den jeweiligen Expositionszeiten wird eine Probe aus dem ersten Belüftungsgefäß in die Zelle mit der Sauerstoffelektrode gegeben (siehe Abb. 1 in Anlage 2) und umgehend die Konzentration des gelösten Sauerstoffs gemessen. Wenn ein System mit mehreren Elektroden verfügbar ist, können die Messungen gleichzeitig vorgenommen werden. Das Rühren (mit einem beschichteten Magnetrührstäbchen) erfolgt mit der gleichen Geschwindigkeit wie beim Kalibrieren der Elektrode. Dadurch wird sichergestellt, dass die Sonde mit minimaler Verzögerung auf Änderungen der Sauerstoffkonzentrationen reagiert und dass im Messgefäß regelmäßige und reproduzierbare Sauerstoffmessungen vorgenommen werden können. In der Regel ist das selbstrührende Sondensystem einiger Sauerstoffelektroden ausreichend. Zwischen den Messungen ist die Zelle mit Wasser zu spülen. Alternativ kann die Probe auch in eine BSB-Flasche (Abb. 2 in Anlage 3) mit einem Magnetrührer gegeben werden. Anschließend ist eine Sauerstoffsonde mit Dichttülle in den Hals des Gefäßes einzuführen und der Magnetrührer zu starten. In beiden Fällen wird die Konzentration des gelösten Sauerstoffs über einen Zeitraum von gewöhnlich 5 bis 10 Minuten bzw. bis zum Absinken der Sauerstoffkonzentration auf weniger als 2 mg/l kontinuierlich gemessen und aufgezeichnet. Danach wird die Elektrode herausgenommen und das Gemisch wieder in das Belüftungsgefäß gegeben; die Mischung ist weiter zu belüften und zu rühren, wenn eine Messung nach längeren Expositionszeiten erforderlich ist.
Überprüfung der Konzentration der Prüfchemikalie
44. Für bestimmte Zwecke muss unter Umständen die Konzentration der Prüfchemikalie in den Prüfgefäßen gemessen werden. Bei der Verwendung von Stammlösungen mit
- schlecht wasserlöslichen Stoffen,
- Gemischen mit Bestandteilen mit unterschiedlicher Wasserlöslichkeit oder
- Stoffen mit guter Wasserlöslichkeit, deren Konzentration in der Stammlösung jedoch an der Grenze zur maximalen Wasserlöslichkeit liegt,
ist die gelöste Fraktion nicht bekannt, und die tatsächliche Konzentration der in die Prüfgefäße überführten Prüfchemikalie ist demnach unbekannt. Um die Exposition zu beschreiben, müssen die Konzentrationen der Prüfchemikalie in den Prüfgefäßen analysiert werden. Zur Vereinfachung des Verfahrens sollte diese Analyse vor Zugabe des Inokulums erfolgen. Da ausschließlich gelöste Fraktionen in die Prüfgefäße gegeben werden, können die gemessenen Konzentrationen sehr gering sein.
45. Um zeitaufwendige und teure Analysen zu vermeiden, sollte die Prüfchemikalie einfach direkt in die Prüfgefäße eingewogen und bei den anschließenden Berechnungen die anfänglich gewogene nominale Konzentration zugrunde gelegt werden. Eine Unterscheidung zwischen gelöster, nicht gelöster und adsorbierter Fraktion der Prüfchemikalie braucht nicht vorgenommen zu werden, da alle diese Fraktionen auch unter realen Bedingungen in Kläranlagen auftreten und je nach Zusammensetzung des Abwassers sehr unterschiedlich sein können. Ziel der Prüfmethode ist die realistische Abschätzung einer nicht hemmenden Konzentration; die Methode ist nicht geeignet, um im Einzelnen zu untersuchen, welche Fraktionen zur Hemmung der Mikroorganismen im Belebtschlamm beitragen. Auch adsorptive Stoffe sind direkt in die Prüfgefäße einzuwiegen; um Verluste durch Adsorption zu minimieren, werden die Gefäße silanisiert.
Berechnung der Sauerstoffverbrauchsraten
46. Die Sauerstoffverbrauchsraten sind aus dem Mittelwert der gemessenen Werte zu berechnen - z.B. aus dem linearen Abschnitt der Kurven der Sauerstoffkonzentration in Abhängigkeit von der Zeit. Die Berechnungen werden auf Sauerstoffkonzentrationen von 2,0 mg/l bis 7,0 mg/l beschränkt, da höhere und niedrigere Konzentrationen selbst Auswirkungen auf die Sauerstoffverbrauchsraten haben könnten. Die Berücksichtigung von Konzentrationsbereichen ober- oder unterhalb dieser Werte ist manchmal nicht zu vermeiden und erforderlich, wenn die Respiration stark beeinträchtigt und entsprechend gering ist oder wenn bei einem bestimmten Belebtschlamm eine sehr hohe Respiration zu verzeichnen ist. Dies ist annehmbar, wenn die betreffenden Bereiche der Verbrauchskurve gerade verlaufen und wenn sich ihre Steigung unter- bzw. oberhalb der O2-Grenzwerte 2,0 mg/l oder 7,0 mg/l nicht ändert. Gekrümmte Kurvenabschnitte sind ein Beleg dafür, dass sich das Messsystem noch stabilisiert oder dass sich die Verbrauchsrate ändert. Die Sauerstoffverbrauchsrate darf nicht anhand dieser Abschnitte berechnet werden. Die Sauerstoffverbrauchsrate ist in Milligramm pro Liter und Stunde (mg/lh) oder in Milligramm pro Gramm getrockneter Schlamm und Stunde (mg/gh) anzugeben. Die Sauerstoffverbrauchsrate R, in mg/lh, kann nach der Gleichung 1 berechnet oder interpoliert werden ausgehend vom linearen Abschnitt der Kurve des aufgezeichneten Sauerstoffrückgangs:
R = (Q1 - Q2)/Δt × 60 (1)
Dabei sind:
Q1 = Sauerstoffkonzentration am Anfang des ausgewählten Abschnitts der linearen Phase (mg/l);
Q2 = Sauerstoffkonzentration am Ende des ausgewählten Abschnitts der linearen Phase (mg/l);
Δt = Zeitabstand zwischen diesen beiden Messungen (min.).
47. Die spezifische Respirationsrate (Rs) wird als die Menge an Sauerstoff ausgedrückt, die pro Gramm Trockenmasse des Schlamms und pro Stunde (mg/gh) verbraucht wird; sie ist mit Gleichung 2 zu berechnen:
|
Rs = R/SS | (2) |
Dabei ist SS die Konzentration der suspendierten Feststoffe im Prüfgemisch (g/l).
48. Die verschiedenen kombinierbaren Indizes von R sind:
S = spezifische Rate
T = Gesamtrespirationsrate
N = auf Nitrifikationsrespiration zurückzuführende Rate H = auf heterotrophe Respiration zurückzuführende Rate
A = auf abiotische Prozesse zurückzuführende Rate
B = auf Blindkontrollen basierende Rate (Mittelwert)
Berechnung der Sauerstoffverbrauchsrate aufgrund von Nitrifikation
49. Die Beziehung zwischen der Gesamtrespiration (RT), der Nitrifikationsrespiration (RN) und der heterotrophen Respiration (RH) wird mit Gleichung 3 beschrieben:
|
RN = RT - RH |
(3) |
Dabei sind:
RN = Sauerstoffverbrauchsrate aufgrund von Nitrifikation (mg/lh);
RT = gemessene Rate des Sauerstoffverbrauchs der Blindkontrolle (ohne ATU; FB) (mg/lh).
RH = gemessene Rate des Sauerstoffverbrauchs der Blindkontrolle mit ATU (FN) (mg/lh).
50. Diese Beziehung gilt für Blindwerte (RNB, RTB, RHB), abiotische Kontrollen (RNA, RTA, RHA) und Assays mit Prüfchemikalien (RNS, RTS, RHS) (mg/gh). Spezifische Respirationsraten werden wie folgt berechnet:
| RNS = RN/SS | (4) |
| RTS = RT/SS | (5) |
| RHS = RH/SS | (6) |
51. Wenn RN in einem Vorversuch nicht signifikant ist (z.B. < 5 % der RT bei Blindkontrollen), kann davon ausgegangen werden, dass der heterotrophe Sauerstoffverbrauch dem Gesamtverbrauch entspricht und dass keine Nitrifikation stattfindet. Wenn in den Prüfungen die Auswirkungen auf heterotrophe und nitrifizierende Mikroorganismen berücksichtigt werden sollen, wird Belebtschlamm anderer Herkunft benötigt. Der definitive Test ist durchzuführen, wenn bei unterschiedlichen Konzentrationen der Prüfchemikalie Anzeichen für eine Hemmung des Sauerstoffverbrauchs festgestellt werden.
Berechnung der prozentualen Hemmung
52. Die prozentuale Hemmung des Gesamtsauerstoffverbrauchs, IT, bei den einzelnen Konzentrationen der Prüfchemikalie wird mit Gleichung 7 ermittelt:
|
IT = [1 - (RT - RTA)/RTB] × 100 % | (7) |
53. Analog dazu wird die prozentuale Hemmung des heterotrophen Sauerstoffverbrauchs, IH, bei den einzelnen Konzentrationen der Prüfchemikalie mit Gleichung 8 ermittelt:
|
IH = [1 - (RH - RHA)/RHB] × 100 % | (8) |
54. Die Hemmung des Sauerstoffverbrauchs durch Nitrifikation, IN, wird für die einzelnen Konzentrationen schließlich mit Gleichung 9 berechnet:
|
IN = [1 - (RT - RH)/(RTB - RHB)] × 100 % | (9) |
55. Die prozentuale Hemmung des Sauerstoffverbrauchs ist bezogen auf den Logarithmus der Konzentration der Prüfchemikalie grafisch darzustellen (Hemmkurve siehe Abb. 3 in Anlage 4). Die Hemmkurven werden für jede Belüftungsperiode von jeweils 3 Stunden bzw. zusätzlich nach 30 Minuten grafisch dargestellt. Anschließend ist aus der Grafik die Konzentration der Prüfchemikalie zu berechnen oder zu interpolieren, bei der der Sauerstoffverbrauch um 50 % gehemmt wird (EC50). Wenn geeignete Daten verfügbar sind, können die 95- %-Konfidenzintervalle der EC50-Werte, die Steigung der Kurve und geeignete Werte für den Beginn der Hemmung (z.B. EC10 oder EC20) sowie das Ende des Inhibitionsbereichs (etwa EC80 oder EC90) berechnet oder interpoliert werden.
56. Angesichts der häufig beobachteten Variabilität der Ergebnisse kann es in vielen Fällen ausreichen, die Ergebnisse zusätzlich nach der Größenordnung anzugeben, z.B.:
EC50 < 1 mg/l
EC50 1 mg/l bis 10 mg/l
EC50 10 mg/l bis 100 mg/l
EC50 > 100 mg/l
Interpretation der Ergebnisse
ECx
57. ECx-Werte einschließlich der entsprechenden oberen und unteren 95- %-Konfidenzgrenzen für die einzelnen Parameter werden mit geeigneten statistischen Methoden berechnet (z.B. Probit-Analysen, Logit- oder Weibull- Modell, Trimmed Spearman-Karber-Methode oder einfache Interpolation) (11). Ein ECx-Wert wird ermittelt, indem der x % des Mittelwerts der Kontrollen entsprechende Wert in die gefundene Gleichung eingesetzt wird. Um den EC50-Wert oder einen sonstigen ECx-Wert zu ermitteln, sind die Mittelwerte der Vorbehandlung (x) einer Regressionsanalyse zu unterziehen.
Schätzung der NOEC
58. Wenn mit einer statistischen Analyse die NOEC bestimmt werden soll, werden Statistiken für die einzelnen Gefäße benötigt. (Die Gefäße werden jeweils als Replikate betrachtet.) Es sind geeignete statistische Methoden anzuwenden; maßgeblich ist das OECD-Dokument ,Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application' (11). Im Allgemeinen werden schädliche Wirkungen der Prüfchemikalie im Vergleich mit der Kontrolle einer einseitigen (kleineren) Hypothesenprüfung mit p ≤ 0,05 unterzogen.
Prüfbericht
59. Das Prüfprotokoll enthält die folgenden Informationen:
Prüfchemikalie:
- allgemeine Bezeichnung, chemische Bezeichnung, CAS-Nummer, Reinheit;
- physikalisch-chemische Eigenschaften der Prüfchemikalie (z.B. log Kow, Wasserlöslichkeit, Dampfdruck, Henry-Konstante (H) und mögliche Informationen zum Verbleib der Prüfchemikalie (z.B. Adsorption an den Belebtschlamm));
Prüfsystem
- Herkunft, Betriebsbedingungen der Kläranlage und eingeleitete Abwässer, Konzentration, Vorbehandlung und Versorgung des Belebtschlamms;
Prüfbedingungen
- Testtemperatur, pH-Wert während der Prüfung und Dauer der Expositionsphase(n);
Ergebnisse
- Spezifischer Sauerstoffverbrauch der Kontrollen (mg O2/(g Schlamm × h);
- alle gemessenen Daten, die Hemmungskurve(n) und die Methode zur Berechnung von EC50;
- EC50 und nach Möglichkeit die 95- %-Konfidenzgrenzen sowie möglichst EC20 und EC80; wenn möglich, die NOEC und die angewandten statistischen Methoden, wenn EC50 nicht bestimmt werden kann;
- Ergebnisse für die Gesamthemmung sowie gegebenenfalls für die Hemmung der heterotrophen und der Nitrifikationsrespiration;
- der abiotische Sauerstoffverbrauch der physikalisch-chemischen Kontrolle (soweit verwendet);
- Bezeichnung der Referenzchemikalie und Ergebnisse mit dieser Chemikalie;
- sämtliche Beobachtungen und Abweichungen vom Standardverfahren, die Einfluss auf die Ergebnisse gehabt haben könnten.
(1) Brown, D., Hitz, H.R., und Schäfer, L. (1981). The assessment of the possible inhibitory effect of dyestuffs on aerobic wastewater bacteria, Experience with a screening test. Chemosphere 10 (3): 245-261.
(2) King, E. F. und Painter H. A. (1986). Inhibition of respiration of activated sludge; variability and reproducibility of results. Toxicity Assessment 1(1): 27-39.
(3) OECD (1984), Activated sludge, Respiration inhibition test, Test Guideline No. 209, Guidelines for the testing of chemicals, OECD, Paris.
(4) ISO (2007). ISO 8192, Wasserbeschaffenheit - Bestimmung der Hemmung des Sauerstoffverbrauchs von Belebtschlamm nach Kohlenstoff- und Ammonium-Oxidation; Internationale Organisation für Normung.
(5) Bealing, D. J. (2003). Dokument ISO/TC147/WGI/N.183, ISO.
(6) Painter, H A, Jones K (1963). The use of the widebore droppingmercury electrode for the determination of the rates of oxygen uptake and oxidation of ammonia by microorgranisms. Journal of Applied Bacteriology 26 (3): 471-483.
(7) Painter, H. A. (1986). Testing the toxicity of chemicals by the inhibition of respiration of activated sludge. Toxicity Assessment 1:515-524.
(8) Robra, B. (1976). Wasser/Abwasser 117, 80.
(9) Fiebig, S., und Noack, U. (2004). The use of copper(II)sulphate pentahydrate as reference substance in the activated sludge respiration inhibition test - acc. to the OECD guideline 209. Fresenius Environmental Bulletin 13 No. 12b: 1556-1557.
(10) ISO (1995). ISO 10634, Wasserbeschaffenheit - Anleitung für die Vorbereitung und Behandlung von in Wasser schwer löslichen organischen Verbindungen für die nachfolgende Bestimmung ihrer biologischen Abbaubarkeit in einem wässrigen Medium.
(11) OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: a guidance to application, Series on testing and assessment No. 54, ENV/JM/MONO(2006)18, OECD, Paris.
________
1) Richtlinie 91/271/EWG des Rates vom 21. Mai 1991 über die Behandlung von kommunalem Abwasser; ABl. L 135 vom 30.05.1991 S. 40-52.
| Begriffsbestimmungen | Anlage 1 |
Bei dieser Prüfmethode werden die folgenden Begriffsbestimmungen zugrunde gelegt:
Chemikalie: ein Stoff oder eine Mischung.
ECx (Konzentration mit einer Wirkung von x %): Konzentration, bei der innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle eine Wirkung von x % auf die Testorganismen zu verzeichnen ist. Der EC50-Wert beispielsweise ist die Konzentration, bei der bei 50 % einer exponierten Population während einer bestimmten Expositionsdauer von einer Wirkung auf einen Endpunkt der Prüfung ausgegangen wird.
NOEC (höchste geprüfte Konzentration ohne beobachtete Wirkung): Die Konzentration der Prüfchemikalie, bei der keine Wirkung beobachtet wird. Bei diesem Test hat die der NOEC entsprechende Konzentration innerhalb einer bestimmten Expositionsdauer im Vergleich zur Kontrolle keine statistisch signifikante Wirkung (p < 0,05).
Prüfchemikalie: ein beliebiger Stoff oder eine Mischung, der bzw. die nach dieser Methode geprüft wird.
| Anlage 2 |
Abb. 1 Messgeräte (Beispiele)
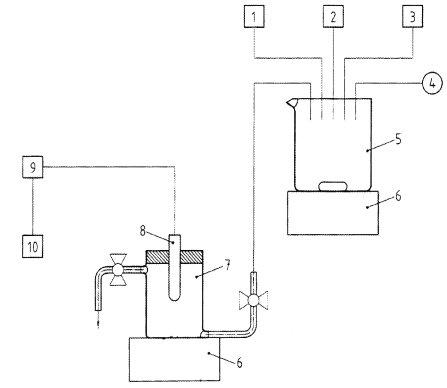
Legende
1 Belebtschlamm
2 Synthetisches Medium
3 Prüfchemikalie
4 Luft
5 Mischgefäß
6 Magnetrührer
7 Sauerstoffmesszelle
8 Sauerstoffelektrode
9 Sauerstoffmessgerät
10 Aufzeichnungsgerät
| Anlage 3 |
Abb. 2 Messgerät (Beispiel) mit einer BSB-Flasche
Legende
1 Prüfgefäß
2 Sauerstoffelektrode
3 Sauerstoffmessgerät
| Anlage 4 |
Abb. 3 Hemmkurven (Beispiel)
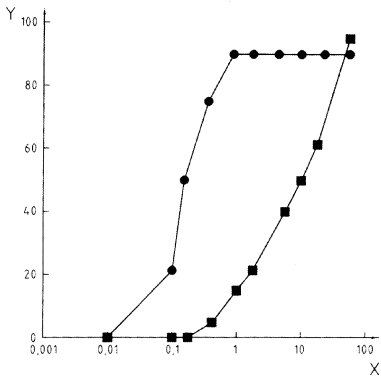
Legende
X Konzentration von 3,5-Dichlorphenol (mg/l)
Y Hemmung (%)
![]() Hemmung der heterotrophen Respiration mit einem nitrifizierenden Schlamm
Hemmung der heterotrophen Respiration mit einem nitrifizierenden Schlamm
• Hemmung der Nitrifikation mit einem nitrifizierenden Schlamm
 | weiter . |  |
...
X
⍂
↑
↓