

umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (44)
 | zurück |  |
C.48 Kurzzeit-Reproduktionstest an Fischen 17
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie 229 (2012). Die Entwicklung und Validierung eines Fischtests, mit dem endokrin aktive Chemikalien nachgewiesen werden können, geht auf die Befürchtung zurück, dass in der Umwelt vorhandene Chemikalien aufgrund ihrer Interaktion mit dem endokrinen System die Gesundheit von Mensch und Natur gefährden. 1998 hat die OECD vorrangig mit der Änderung bestehender und der Entwicklung neuer Leitlinien für Screening-Tests und die Untersuchung potenziell endokriner Disruptoren begonnen. Ein Teil dieser Arbeit bestand in der Entwicklung einer Prüfrichtlinie für das Screening von Chemikalien mit Wirkung auf das endokrine System von Fischen. Der Kurzzeit-Reproduktionstest an Fischen wurde im Rahmen laborübergreifender Untersuchungen an ausgewählten Chemikalien umfassend validiert, um die Relevanz und die Zuverlässigkeit des Tests für den Nachweis von Chemikalien mit Auswirkung auf die Reproduktion von Fischen durch verschiedene Mechanismen, einschließlich endokriner Modalitäten, zu demonstrieren (1) (2) (3) (4) (5). Alle Endpunkte der OECD-Prüfrichtlinie wurden an Dickkopfelritzen und eine Teilmenge der Endpunkte an Japanischen Reiskärpflingen (d. h. Vitellogenin und sekundäre Geschlechtsmerkmale) und Zebrabärblingen (d. h. Vitellogenin) validiert. Die Validierungsarbeit wurde einem Peer-Review durch eine Gruppe von Experten, die von den nationalen Koordinatoren des OECD Prüfrichtlinien-Programms ernannt wurden (6), und eine unabhängige Gruppe von Experten, die von der US-Umweltschutzbehörde (US-EPA) beauftragt wurde (29), unterzogen. Der Test ist nicht dafür vorgesehen, spezifische endokrinschädigende Wirkmechanismen zu identifizieren, denn die getesteten Fische besitzen eine intakte Hypothalamus-Hypophysen-Gonaden-Achse (HHG- Achse), die auf unterschiedlichen Ebenen auf Chemikalien, die auf die HHG-Achse einwirken, reagieren kann.
2. Die vorliegende Prüfmethode entspricht einem In-vivo-Screening-Assay, bei dem geschlechtsreife männliche und weibliche Fische gemeinsam gehalten und für einen begrenzten Teil ihres Lebenszyklus (21 Tage) einer Chemikalie ausgesetzt werden. Nach dieser21-tägigen Exposition werden bei männlichen und weiblichen Fischen zwei Biomarker-Endpunkte als Indikatoren einer endokrinen Wirkung der Prüfchemikalie gemessen; diese Endpunkte sind Vitellogenin und sekundäre Geschlechtsmerkmale. Vitellogenin wird bei Dickkopfelritzen, bei Japanischen Reiskärpflingen und bei Zebrabärblingen, die sekundären Geschlechtsmerkmale werden bei Dickkopfelritzen und Japanischen Reiskärpflingen gemessen. Darüber hinaus wird die quantitative Fruchtbarkeit während der Prüfung täglich überwacht. Ferner werden Gonaden konserviert. Anhand der Histopathologie kann die Reproduktionsleistung der Versuchstiere bewertet und der evidenzbasierten Bewertung anderer Endpunkte hinzugefügt werden.
3. Dieser Bioassay dient dem In-vivo-Screening der Reproduktion und seine Anwendung ist im Zusammenhang mit dem OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals (30) zu sehen. In diesem konzeptionellen Rahmen wird der Kurzzeit-Reproduktionstest an Fischen auf Stufe 3 als In-vivo-Test vorgeschlagen, um Daten über ausgewählte endokrine Mechanismen/Wirkungspfade zu erhalten.
Ausgangsüberlegungen und Begrenzungen
4. Vitellogenin (VTG) wird gewöhnlich von der Leber weiblicher oviparer Vertebraten in Reaktion auf im Blutkreislauf zirkulierendes endogenes Östrogen produziert. VTG ist ein Vorläufer von Eidotterproteinen und wandert, einmal in der Leber produziert, über die Blutbahn zum Eierstock, wo es aufgenommen und von sich entwickelnden Eiern modifiziert wird. Vitellogenin ist im Plasma noch nicht geschlechtsreifer weiblicher und männlicher Fische kaum nachweisbar, da sich bei diesen noch nicht genügend zirkulierendes Östrogen gebildet hat. Die Leber kann Vitellogenin jedoch in Reaktion auf eine exogene Östrogenstimulation synthetisieren und absondern.
5. Die Messung der VTG-Konzentration ermöglicht den Nachweis von Chemikalien mit unterschiedlichen östrogenen Wirkungsweisen. Östrogen-wirksame Chemikalien können durch Messung der VTG-Induktion bei männlichen Fischen nachgewiesen werden, was in wissenschaftlichen Veröffentlichungen mit Peer Review umfassend dokumentiert wurde (z.B. (7)). VTG-Induktion wurde auch nach Exposition gegenüber aromatisierbaren Androgenen nachgewiesen (8) (9). Eine Reduktion des im Körper weiblicher Tiere zirkulierenden Östrogens, beispielsweise durch Hemmung der Aromatase, die endogenes Androgen in das natürliche Östrogen 172-¦stradiol umwandelt, bewirkt eine Verringerung der VTG-Konzentration, die zum Nachweis von Chemikalien mit aromatasehemmenden Eigenschaften verwendet wird (10) (11). Die biologische Relevanz der VTG-Reaktion nach einer Östrogen-/Aromatasehemmung ist erwiesen und wurde umfassend dokumentiert. Die VTG-Produktion bei weiblichen Tieren kann aber auch durch allgemeine Toxizität und nichtendokrine toxische Wirkungsweisen (z.B. durch Hepatotoxizität) beeinflusst werden.
6. Für Routinemessungen haben sich verschiedene standardisierte Verfahren bewährt, so der artspezifische ELISA (Enzyme-Linked Immunosorbent Assay), bei dem das in kleinen Blut- oder Leberproben einzelner Fische produzierte VTG immundiagnostisch quantifiziert wird (12) (13) (14) (15) (16) (17) (18). Die VTG-Messungen werden an Blutproben und/oder Kopf-/Schwanz-Homogenaten von Dickkopfelritzen und Zebrabärblingen sowie an Leberproben Japanischer Reiskärpflinge vorgenommen. Bei Japanischen Reiskärpflingen besteht eine ausgeprägte Korrelation zwischen dem im Blut und in der Leber gemessenen VTG (19). Anlage 6 enthält Empfehlungen für Verfahren zur Entnahme von Proben für VTG-Analysen. Kits für Vitellogenin-Messungen sind allgemein erhältlich; sie sollten auf einem validierten artspezifischen ELISA beruhen.
7. Sekundäre Geschlechtsmerkmale männlicher Fische bestimmter Arten sind äußerlich sichtbar und quantifizierbar und reagieren auf zirkulierende Mengen endogen wirkender Androgene. Dies gilt für Dickkopfelritzen und für Japanische Reiskärpflinge, nicht aber für Zebrabärblinge, die keine quantifizierbaren sekundären Geschlechtsmerkmale besitzen. Weibliche Tiere behalten die Fähigkeit bei, sekundäre männliche Geschlechtsmerkmale zu entwickeln, wenn sie in Wasser androgen wirksamen Chemikalien ausgesetzt werden. In der Fachliteratur wird auf mehrere Studien hingewiesen, die diese Art von Reaktion bei Dickkopfelritzen (20) und Japanischen Reiskärpflingen (21) belegen. Ein Rückgang sekundärer Geschlechtsmerkmale bei männlichen Fischen sollte aufgrund der geringen statistischen Aussagekraft mit Vorsicht interpretiert werden; jede Wertung sollte sich auf Expertenurteile und die Beweiskraft der Daten stützen. Zebrabärblinge sind für diesen Test nur begrenzt geeignet, da quantifizierbare sekundäre Geschlechtsmerkmale fehlen, die auf androgen wirksame Chemikalien reagieren könnten.
8. Bei Dickkopfelritzen ist die Zahl der Laichknoten ("Nuptialtuberkel") am Maul weiblicher Fische Hauptindikator einer exogenen Androgenexposition. Wichtigster Marker einer exogenen Exposition gegenüber androgen wirkenden Chemikalien bei weiblichen Japanischen Reiskärpflingen ist die Zahl der Papillenprozesse. Die Anlagen 5A und 5B enthalten Empfehlungen für Verfahren zur Bewertung von Geschlechtsmerkmalen bei Dickkopfelritzen bzw. Japanischen Reiskärpflingen.
9. Der 21-Tage-Test an Fischen umfasst die Bewertung der quantitativen Eiproduktion und die Konservierung der Gonaden für die optionale histopathologische Untersuchung. Einige Regulierungsbehörden fordern diesen Endpunkt eventuell für eine vollständigere Bewertung der Reproduktionsleistung der Versuchstiere oder in Fällen, in denen Vitellogenin und die sekundären Geschlechtsmerkmale nicht auf die Exposition gegenüber der Chemikalie reagiert haben. Obwohl einige Endpunkte stark diagnostisch sind (z.B. VTG-Induktion bei männlichen Tieren und Tuberkelbildung bei weiblichen Tieren), sind nicht alle Endpunkte (z.B. Fruchtbarkeit und Histopathologie der Gonaden) in dem Test auf die Identifizierung spezifischer zellularer Wirkmechanismen ausgerichtet. Vielmehr erlaubt die Reihe der Beobachtungen insgesamt Rückschlüsse auf mögliche endokrine Störungen und bildet somit eine Leitlinie für weitere Tests. Obwohl die Fruchtbarkeit nicht endokrinspezifisch ist, ist sie aufgrund ihrer nachgewiesenen Empfindlichkeit bei bekannten Chemikalien mit endokriner Wirkung (5) ein wichtiger zu berücksichtigender Endpunkt; wenn die Fruchtbarkeit und andere Endpunkte nicht betroffen sind, kann leichter geschlossen werden, dass eine Verbindung wahrscheinlich keine endokrine Wirkung hat. Ist die Fruchtbarkeit allerdings betroffen, stellt dies in Rückschlüssen bei evidenzbasierten Bewertungen einen erheblichen Beitrag dar. Diese Prüfmethode enthält auch eine Leitlinie für die Auswertung der Daten und die Akzeptanz der Testergebnisse.
10. Definitionen der in dieser Prüfmethode verwendeten Begriffe sind Anlage 1 zu entnehmen.
11. Beim Assay werden geschlechtsreife männliche und weibliche Fische in Prüfgefäßen gemeinsam einer Prüfchemikalie ausgesetzt. Da die Tiere ausgewachsen und geschlechtsreif sind, kann leicht zwischen den Geschlechtern unterschieden und folglich eine geschlechtsspezifische Analyse der einzelnen Endpunkte vorgenommen werden, und die Sensitivität gegenüber exogenen Chemikalien ist gewährleistet. Bei Testende wird das Geschlecht der Fische durch makroskopische Untersuchung der Gonaden nach bauchseitiger Öffnung des Abdomens mit einer Schere bestimmt. Anlage 2 fasst die wichtigsten Bedingungen des Bioassays zusammen. Der Test wird gewöhnlich mit einer Auswahl an Fischen aus einer Laichpopulation begonnen; seneszente Tiere sollten nicht verwendet werden. Der Abschnitt über die Auswahl der Fische enthält Hinweise zum Alter und zur Geschlechtsreife der Fische. Der Test wird mit drei Konzentrationen der Prüfchemikalie und einer Wasserkontrolle sowie erforderlichenfalls einer Lösungsmittelkontrolle durchgeführt. Bei Zebrabärblingen werden je Konzentration zwei Gefäße oder Replikate verwendet (jedes Gefäß mit fünf männlichen und fünf weiblichen Fischen). Bei Dickkopfelritzen werden je Konzentration vier Gefäße oder Replikate verwendet (jedes Gefäß mit zwei männlichen und vier weiblichen Fischen). Damit soll dem Territorialverhalten männlicher Dickkopfelritzen Rechnung getragen und gleichzeitig hinreichende Aussagekraft gewährleistet werden. Bei Japanischen Reiskärpflingen werden je Konzentration vier Gefäße oder Replikate verwendet (jedes Gefäß mit drei männlichen und drei weiblichen Fischen). Die Exposition erfolgt über einen Zeitraum von 21 Tagen; die Fische werden an Tag 21 nach Beginn der Exposition beprobt. Die quantitative Fruchtbarkeit wird täglich überwacht.
12. Am Tag der Beprobung (Tag 21) sind alle Tiere möglichst schmerzfrei zu töten. Bei Dickkopfelritzen und Japanischen Reiskärpflingen werden sekundäre Geschlechtsmerkmale gemessen (siehe Anlagen 5A und 5B). Zur Bestimmung der VTG-Konzentration werden von Zebrabärblingen und Dickkopfelritzen Blutproben entnommen; alternativ kann die VTG-Konzentration bei Zebrabärblingen auch anhand von Kopf- und Schwanzproben ermittelt werden (Anlage 6). Bei Japanischen Reiskärpflingen werden zur VTG-Analyse Leberproben entnommen (Anlage 6). Gonaden werden entweder im Ganzen oder seziert für die potenzielle histopathologische Bewertung konserviert (22).
13. Die Testergebnisse sind gültig, wenn folgende Bedingungen erfüllt sind:
Apparatur
14. Übliche Laborausrüstung und insbesondere die folgenden Geräte:
Wasser
15. Als Testwasser kann jedes beliebige Wasser verwendet werden, in dem die Testspezies über einen längeren Zeitraum überleben und wachsen können. Während der gesamten Testdauer sollte eine konstante Wasserqualität gewährleistet sein. Der pH-Wert des Wassers sollte im Bereich 6,5 bis 8,5 liegen und im Test um nicht mehr als ± 0,5 pH-Einheiten schwanken. Um sicherzustellen, dass das Verdünnungswasser das Testergebnis nicht übermäßig stark beeinflusst (beispielsweise durch Komplexierung der Prüfchemikalie), sind regelmäßig Proben zu analysieren. Das Wasser ist auf Schwermetalle (z.B. Cu, Pb, Zn, Hg, Cd und Ni), dominante Anionen und Kationen (z.B. Ca2+, Mg2+, Na+, K+, Cl- und SO42-), Pestizide (z.B. den Gesamtgehalt an phosphororganischen und chlororganischen Pestiziden), den gesamten organischen Kohlenstoff und suspendierte Feststoffe zu untersuchen (beispielsweise alle drei Monate, wenn bekannt ist, dass das Wasser qualitativ gesehen relativ konstant ist). Ist die Wasserqualität nachweislich mindestens ein Jahr lang konstant geblieben, so können die Analysen seltener durchgeführt und die Abstände zwischen den Analysen verlängert werden (beispielsweise auf sechs Monate). Einige chemische Merkmale akzeptablen Verdünnungswassers sind in Anlage 3 aufgeführt.
Prüflösungen
16. Die Prüflösungen werden durch Verdünnung einer Stammlösung in den gewünschten Konzentrationen zubereitet. Die Stammlösung sollte möglichst durch einfaches mechanisches Vermischen oder Schütteln (z.B. durch Rühren oder mit Ultraschall) der Prüfchemikalie in Verdünnungswasser hergestellt werden. Zur Herstellung einer Stammlösung in geeigneter Konzentration können Sättigungssäulen (Löslichkeitssäulen) verwendet werden. Die Verwendung von Lösungsmittelträgern wird nicht empfohlen. Ist jedoch ein Lösungsmittel erforderlich, so sollte zeitgleich in derselben Lösungsmittelkonzentration wie bei der chemischen Behandlung eine Lösungsmittelkontrolle verwendet werden. Bei schwierig zu prüfenden Chemikalien sollte das OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures herangezogen werden (23). Welches Lösungsmittel zu verwenden ist, hängt von den chemischen Eigenschaften des Stoffs oder Gemischs ab. Der OECD-Leitfaden empfiehlt höchstens 100 µl/l; dieser Wert sollte eingehalten werden. In einer kÌrzlich durchgeführten Untersuchung (24) wurde jedoch auf weitere Bedenken hinsichtlich der Verwendung von Lösungsmitteln in Tests zur Prüfung endokriner Wirkungen verwiesen. Daher sollte die Lösungsmittelkonzentration (wenn überhaupt ein Lösungsmittel verwendet werden muss) so weit wie technisch möglich minimiert werden (je nach physikalisch-chemischen Eigenschaften der Prüfchemikalie).
17. Für die Prüfung ist ein Durchflusssystem zu verwenden. Ein solches System gibt kontinuierlich eine Stammlösung der Prüfchemikalie ab und verdünnt diese (z.B. mit einer Dosierpumpe, einem Proportionalverdünner oder einer Sättigungsvorrichtung), damit unterschiedliche Konzentrationen in die Prüfkammern gelangen. Die Durchflussraten von Stammlösungen und Verdünnungswasser sind während der Prüfung regelmäßig - vorzugsweise täglich - zu kontrollieren und dürfen während der Prüfung um höchstens 10 % schwanken. Insbesondere sind Kunststoffleitungen aus minderwertigem Material oder sonstige Materialien zu vermeiden, die biologisch aktive Chemikalien enthalten könnten. Bei der Auswahl des Materials für das Durchflusssystem ist eine mögliche Adsorption der Prüfchemikalie an das Material zu berücksichtigen.
Halten der Fische
18. Die zu prüfenden Fische sollten aus einer Laborpopulation stammen, vorzugsweise aus einem einzelnen Bestand, der mindestens zwei Wochen vor dem Test bei ähnlicher Wasserqualität und ähnlichen Lichtverhältnissen wie im Test akklimatisiert wurde. Besatz(verhältnis) und Besatzdichte (Definitionen siehe Anlage 1) müssen der jeweils verwendeten Art entsprechen (siehe Anlage 2).
19. Nach einer 48-stündigen Akklimatisierung werden die Mortalitäten erfasst; dabei gelten die folgenden Kriterien:
20. Während der Akklimatisierung, der Präexposition und der eigentlichen Exposition sollten die Fische nicht gegen Krankheiten behandelt werden.
Präexposition und Auswahl der Fische
21. Eine ein- bis zweiwöchige Präexposition wird empfohlen; dabei werden die Fische in prüfgefäßähnliche Becken gesetzt. Während der gesamten Haltungsdauer und während der Exposition werden die Fische ad libitum gefüttert. Die Expositionsphase beginnt mit sexuell dimorphen adulten, aktiv laichenden Fischen aus einer Laborpopulation geschlechtsreifer Tiere (z.B. mit deutlichen sekundären Geschlechtsmerkmalen bei Dickkopfelritzen und bei Japanischen Reiskärpflingen). Als Faustregel (nur im Kontext der Beobachtung des tatsächlichen Reproduktionsstatus einer bestimmten Charge von Fischen anzuwenden) gilt, dass Dickkopfelritzen ca. 20 (± 2) Wochen alt sein sollten, vorausgesetzt, sie wurden während ihrer gesamten Lebensdauer bei einer Temperatur von 25 ± 21 °C gehalten. Unter denselben Bedingungen sollten Japanische Reiskärpflinge etwa 16 (± 2) Wochen alt sein. Zebrabärblinge sollten etwa 16 (± 2) Wochen alt sein, sofern sie während ihres gesamten Lebens bei 26 ± 21 °C gehalten wurden. Die Eiproduktion sollte während der Präexpositionsphase täglich bewertet werden. Es wird empfohlen, das Laichen in allen Replikatgefäßen vor der Einleitung der Expositionsphase des Tests zu beobachten. In dieser Phase kann nicht festgelegt werden, wie viele Eier pro Tag produziert werden sollten, doch im Allgemeinen werden bei jeder Tierart durchschnittlich > 10 Eier/Weibchen/Tag beobachtet. Um eine ausgewogene Verteilung der Replikate sicherzustellen, sollten sie den verschiedenen Versuchsebenen nach einem randomisierten Blockkonzept entsprechend der Eiproduktion zugeordnet werden.
22. Für den Test sind drei Konzentrationen der Prüfchemikalie, eine Kontrolle (Wasser) und erforderlichenfalls eine Lösungsmittelkontrolle zu verwenden. Die Daten können analysiert werden, um statistisch signifikante Unterschiede zwischen Behandlungs- und Kontrollreaktion festzustellen. Diese Analysen dienen eher der Feststellung, ob die Chemikalie in weiteren Langzeittests auf unerwünschte Wirkungen (nämlich Überleben, Entwicklung, Wachstum und Reproduktion) untersucht werden muss, als der Verwendung für Risikobewertungen (25).
23. Bei den Zebrabärblingen werden an Tag 21 der Prüfung männliche und weibliche Tiere aus jeder Konzentrationsgruppe (jedes der beiden Replikate enthält fünf männliche und fünf weibliche Fische) und aus der/den Kontrollgruppe(n) für die Untersuchung auf Vitellogenin beprobt. Bei den Japanischen Reiskärpflingen werden an Tag 21 der Prüfung männliche und weibliche Tiere aus jeder Konzentrationsgruppe (jedes der beiden Replikate enthält drei männliche und drei weibliche Fische) und aus der/den Kontrollgruppe(n) für die Untersuchung auf Vitellogenin und sekundäre Geschlechtsmerkmale beprobt. Bei den Dickkopfelritzen werden an Tag 21 der Exposition männliche und weibliche Tiere (jedes der vier Replikate enthält zwei männliche und vier weibliche Fische) und aus der/den Kontrollgruppe(n) für die Untersuchung auf Vitellogenin und sekundäre Geschlechtsmerkmale beprobt. Die Fruchtbarkeit muss quantitativ bewertet werden, und die Gonadengewebe sollten erforderlichenfalls im Ganzen fixiert oder für eine potenzielle histopathologische Bewertung seziert werden.
Auswahl der Prüfkonzentrationen
24. Für die Zwecke dieser Prüfung sollte die höchste Prüfkonzentration auf die in einem Vorversuch bestimmte oder aus anderen Toxizitätsdaten hervorgehende höchste noch verträgliche Konzentration (Maximum Tolerated Concentration, MTC) oder auf 10 mg/l oder auf den Höchstwert der Wasserlöslichkeit festgesetzt werden, je nachdem, welcher Wert der niedrigere ist. Der MTC-Wert gilt als die höchste Prüfkonzentration der Chemikalie, bei der die Mortalität weniger als 10 % beträgt. Dieser Ansatz geht davon aus, dass empirische Daten zur akuten Toxizität oder sonstige Toxizitätsdaten vorliegen, anhand deren der MTC-Wert bestimmt werden kann. Die Schätzung des MTC-Wertes kann ungenau sein und setzt in der Regel Fachkenntnis voraus.
25. Benötigt werden drei Testkonzentrationen mit einem konstanten Abstandsfaktor von maximal 10 und eine Verdünnungswasserkontrolle (sowie bei Bedarf eine Lösungsmittelkontrolle). Empfohlen werden Abstandsfaktoren zwischen 3,2 und 10.
Auswahl und Wiegen der Testfische
26. Wichtig ist, dass die Gewichtsunterschiede der Fische zu Beginn der Prüfung möglichst gering sind. Für geeignete Größenbereiche für die empfohlenen Tierarten siehe Anlage 2. Bei der gesamten Charge der in dieser Prüfung verwendeten Fische sollte bei männlichen und weiblichen Tieren das individuelle Gewicht möglichst im Bereich von ± 20 % des arithmetischen Mittelgewichts der Fische gleichen Geschlechts liegen. Um das Mittelgewicht zu bestimmen, wird empfohlen, vor der Prüfung eine Teilprobe des Fischbestands zu wiegen.
Expositionsbedingungen
Dauer
27. Der Test dauert 21 Tage nach vorheriger Präexposition. Es wird eine ein- bis zweiwöchige Präexposition empfohlen.
Fütterung
28. Die Fische werden ad libitum so oft mit geeignetem Futter (Anlage 2) versorgt, wie es für eine normale Entwicklung der Tiere nötig ist. Dabei ist darauf zu achten, dass es nicht zu einer Vermehrung von Mikroorganismen und nicht zu einer Eintrübung des Wassers kommt. Im Allgemeinen kann die Tagesration auf zwei oder drei gleiche Portionen verteilt werden, die in mindestens dreistündigem Abstand zu verabreichen sind. Insbesondere an Wochenenden kann eine einzige, größere Ration gegeben werden. 12 Stunden vor der Probenahme/Sektion sollten die Fische nicht mehr gefüttert werden.
29. Das Fischfutter ist auf Verunreinigungen wie chlororganische Pestizide, polyzyklische aromatische Kohlenwasserstoffe (PAK) und polychlorierte Biphenyle (PCB) zu untersuchen. Futter mit erhöhtem Gehalt an Phytoöstrogenen, die die Testreaktion auf bekannte Östrogenagonisten (z.B. 17-b-Östradiol) beeinträchtigen würden, darf nicht verwendet werden.
30. Nicht aufgenommenes Futter und Fäkalien sind mindestens zweimal wöchentlich aus den Prüfgefäßen zu entfernen (etwa durch vorsichtiges Absaugen vom Beckenboden).
Licht und Temperatur
31. Fotoperiode und Wassertemperatur sind der Testspezies anzupassen (siehe Anlage 2).
Häufigkeit der Analysen und Messungen
32. Vor Beginn der Exposition ist zu überprüfen, ob die Chemikalienbeschickung einwandfrei funktioniert. Es dürfen ausschließlich anerkannte Analysemethoden angewandt werden, und die Stabilität der Chemikalie im Prüfsystem muss hinreichend bekannt sein. Während des Tests sind die Konzentrationen der Prüfchemikalie in regelmäßigen Zeitabständen wie folgt zu bestimmen: Die Zuflussmengen der Verdünnungslösung und der Stammlösung der Prüfchemikalie sind regelmäßig - vorzugsweise täglich, jedoch mindestens zweimal wöchentlich - zu kontrollieren und sollten während des gesamten Tests um maximal 10 % schwanken. Die tatsächlichen Konzentrationen der Prüfchemikalie sollten zu Beginn des Tests in allen Gefäßen und danach wöchentlich gemessen werden.
33. Die Ergebnisse sollten auf gemessenen Konzentrationen basieren. Wurde die Konzentration der Chemikalienlösung während der gesamten Prüfung jedoch zufriedenstellend innerhalb der nominellen Konzentration (± 20 %) gehalten, so können sich die Ergebnisse auf die nominalen oder die gemessenen Werte beziehen.
34. Unter Umständen müssen die Proben gefiltert (z.B. mit Filtern einer Porengröße von 0,45 µm) oder zentrifugiert werden. Erforderlichenfalls ist Zentrifugierung vorzuziehen. Prüfchemikalien, die sich nachweislich nicht an Filter adsorbieren, können auch filtriert werden.
35. Während der Prüfung sollten bei allen Prüfgefäßen mindestens einmal wöchentlich der gelöste Sauerstoff, die Temperatur und der pH-Wert gemessen werden. Die Gesamthärte und die Gesamtalkalität sollten in den Kontrollen und in einem Gefäß mit höchster Testkonzentration ebenfalls mindestens einmal wöchentlich gemessen werden. Es wird empfohlen, dass die Temperatur in mindestens einem Prüfgefäß kontinuierlich überwacht wird.
Beobachtungen
36. Im Laufe oder am Ende des Tests sind verschiedene allgemeine Reaktionen (z.B. Überleben) sowie biologische Reaktionen (z.B. VTG-Gehalt) zu bestimmen. Die Fruchtbarkeit muss täglich quantitativ überwacht werden. Die Messung und Auswertung dieser Endpunkte und die Verwendbarkeit der Ergebnisse werden im Folgenden erläutert.
Überleben
37. Die Fische sind während des Tests täglich zu kontrollieren; Todesfälle sind zu protokollieren und tote Fische so bald wie möglich zu entfernen. Tote Fische dürfen weder in Kontroll- noch in Prüfgefäße eingesetzt werden. Das Geschlecht der im Test gestorbenen Fische wird durch makroskopische Gonadenuntersuchung bestimmt.
Verhalten und Aussehen
38. Jegliches anomale Verhalten (gemessen an den Kontrollen) ist zu protokollieren. Dies gilt für Anzeichen allgemeiner Toxizität ebenso wie für Hyperventilation, unkoordinierte Schwimmbewegungen, Gleichgewichtsverluste und atypische Apathie oder ungewöhnliches Fressverhalten. Zudem sind äußerliche Auffälligkeiten (z.B. Blutungen oder Verfärbungen) aufzuzeichnen. Derartige Anzeichen einer toxischen Wirkung sind bei der Datenauswertung insoweit sorgfältig zu berücksichtigen, als sie auf Konzentrationen hinweisen können, bei denen die Biomarker endokriner Wirkungen keine zuverlässigen Rückschlüsse gestatten. Diese Verhaltensauffälligkeiten können auch wertvolle qualitative Informationen liefern, an denen sich künftige Fischtests orientieren können. Bei Dickkopfelritzen wurde unter Einwirkung von Androgenen beispielsweise aggressives Territorialverhalten bei normalen Männchen oder maskulinisierten Weibchen beobachtet. Bei Zebrabärblingen hemmen Östrogene oder Anti-Androgene das typische Paarungs- und Laichverhalten bei einsetzender Morgendämmerung.
39. Da sich verschiedene äußere Merkmale (in erster Linie die Farbe) beim Hantieren der Fische rasch verändern können, sind qualitative Beobachtungen vor der Entnahme von Fischen aus dem Prüfsystem wichtig. Bisherige Erfahrungen mit Dickkopfelritzen führen zu dem Schluss, dass einige endokrin wirkende Chemikalien anfangs zu Veränderungen der folgenden äußeren Merkmale führen: Körperfarbe (hell oder dunkel), Farbmusterung (Auftreten vertikaler Streifen) und Körperform (im Kopf- oder Schwanzbereich). Daher muss im Laufe und am Ende des Tests das äußere Erscheinungsbild der Fische kontrolliert werden.
Fruchtbarkeit
40. Die Laichmengen sollten täglich für jedes Replikat protokolliert werden. Die Eiproduktion sollte als Anzahl Eier pro überlebendem weiblichen Tier pro Tag auf für jedes Replikat protokolliert werden. Die Eier werden täglich aus den Prüfkammern genommen. Die Laichsubstrate sollten für Dickkopfelritzen und Zebrabärblinge so in die Prüfkammern gelegt werden, dass die Fische unter normalen Bedingungen laichen können. Anlage 4 enthält weitere Informationen zu den empfohlenen Laichsubstraten für Zebrabärblinge (Anlage 4A) und Dickkopfelritzen (Anlage 4B). Bei Reiskärpflingen wird die Bereitstellung eines Laichsubstrats nicht als notwendig erachtet.
Schmerzfreies Töten
41. An Tag 21, d. h. bei Ablauf der Expositionsdauer, sind die Fische mit angemessenen Mengen Tricain (Tricainmethansulfonat, Metacain, MS-222 (CAS 886-86-2), 100-500 mg/l gepuffert mit 300 mg/l NaHCO3 (Natriumbicarbonat, CAS 144-55-8) zu töten, um Schleimhautreizungen zu begrenzen. Anschließend wird zur VTG-Bestimmung Blut oder Gewebe entnommen, wie im Abschnitt über Vitellogenin beschrieben.
Untersuchung sekundärer Geschlechtsmerkmale
42. Manche endokrin wirkende Chemikalien können Veränderungen spezifischer sekundärer Geschlechtsmerkmale (Anzahl Laichknoten ("Nuptialtuberkel") bei männlichen Dickkopfelritzen oder bei männlichen Japanischen Reiskärpflingen) zur Folge haben. Insbesondere Chemikalien mit bestimmten Wirkungsweisen können bei Tieren des jeweils anderen Geschlechts zu Anomalien der sekundären Geschlechtsmerkmale führen. So können Androgenrezeptor-Agonisten wie Trenbolon, Methyltestosteron und Dihydrotestosteron bewirken, dass weibliche Dickkopfelritzen ausgeprägten Laichausschlag ("Nuptialtuberkel") entwickeln oder dass bei weiblichen Japanischen Reiskärpflingen Papillenprozesse auftreten (11) (20) (21). Außerdem wurde berichtet, dass Östrogenrezeptor-Agonisten dazu führen können, dass sich die Zahl der Laichknoten und die Größe des dorsalen Nackenaufwuchses bei adulten männlichen Dickkopfelritzen verringern (26) (27). Diese wesentlichen morphologischen Beobachtungen können auch eine qualitativ und quantitativ wertvolle Informationsgrundlage für potenzielle künftige Fischtests liefern. Anzahl und Größe der Laichknoten bei Dickkopfelritzen und Papillenprozesse bei Japanischen Reiskärpflingen können entweder direkt oder - bequemer - an konservierten Exemplaren gezählt werden. Die Anlagen 5A und 5B enthalten Empfehlungen für Verfahren zur Beurteilung sekundärer Geschlechtsmerkmale bei Dickkopfelritzen bzw. Japanischen Reiskärpflingen.
Vitellogenin (VTG)
43. Das für die VTG-Bestimmung erforderliche Blut wird mit einem heparinisierten Mikrohämatokrit-Kapillarröhrchen aus der Schwanzarterie/-vene oder alternativ durch Herzpunktion mit einer Spritze entnommen. Je nach Größe der Fische werden bei Dickkopfelritzen 5-60 µl und bei Zebrabärblingen 5-15 µl Blut (jeweils pro Fisch) benÆtigt. Das Plasma wird durch Zentrifugieren vom Blut getrennt und mit Proteasehemmern bis zur Vitellogenin-Analyse bei - 80 1 °C aufbewahrt. Alternativ kann bei Japanischen Reiskärpflingen die Leber verwendet werden. Bei Zebrabärblingen kommen Kopf-/Schwanz-Homogenate als Gewebematerial für die VTG-Analyse in Betracht (Anlage 6). Die VTG-Messung sollte nach einer validierten homologen ELISA-Methode mit homologem VTG-Standard und homologen Antikörpern erfolgen. Empfohlen werden Methoden, mit denen kleinste VTG-Gehalte (wenige ng/ml Plasma oder ng/mg Gewebe, die der Hintergrundkonzentration bei nicht exponierten männlichen Fischen entsprechen) ermittelt werden können.
44. Die Qualitätskontrolle der VTG-Analyse erfolgt anhand von Standards, Blindproben und zumindest Doppelanalysen. Für jede ELISA-Methode ist ein Test auf Matrixeffekte (Effekte der Probenverdünnung) vorzunehmen, um den Mindestverdünnungsfaktor zu ermitteln. Alle für VTG-Analysen verwendeten ELISA-Platten müssen zumindest auch folgende Proben für die Qualitätskontrolle enthalten: sechs Kalibrierstandards für den gesamten Bereich der erwarteten VTG-Konzentrationen und eine nicht spezifische Binding-Assay-Blindprobe (doppelt zu analysieren). Die Absorption dieser Blindproben sollte weniger als 5 % der maximalen Absorption des Kalibrierstandards betragen. Von jeder Verdünnung sind mindestens zwei Aliquoten (Muldenduplikate) zu analysieren. Duplikatmulden mit über 20 % Differenz sollten ein zweites Mal analysiert werden.
45. Der Korrelationskoeffizient (R2) für Kalibrierkurven sollte größer als 0,99 sein. Eine hohe Korrelation reicht jedoch nicht aus, um in allen Bereichen Konzentrationen adäquat vorabzuschätzen. Neben der Notwendigkeit einer hinreichend hohen Korrelation für die Kalibrierkurve sollten alle aus der Kalibrierkurve errechneten Konzentrationen der einzelnen Standards im Bereich von 70-120 % der jeweiligen nominellen Konzentration liegen. Wenn die nominellen Konzentrationen tendenziell von der Regressionsgeraden abweichen (beispielsweise bei niedrigeren Konzentrationen), muss die Kalibrierkurve möglicherweise in niedrige und hohe Bereiche aufgeteilt oder ein nicht lineares Modell für die Absorptionsdaten verwendet werden. Bei geteilten Kurven muss der Korrelationskoeffizient R2 bei beiden Segmenten > 0,99 sein.
46. Als Nachweisgrenze wird die Konzentration des niedrigsten Analysestandards bezeichnet; die Quantifizierungsgrenze ist die Konzentration des niedrigsten Analysestandards multipliziert mit dem niedrigsten Verdünnungsfaktor.
47. An den Tagen, an denen VTG-Analysen stattfinden, ist eine mit einem Inter-Assay-Referenzstandard hergestellte Anreicherungsprobe zu analysieren (Anlage 7). Das Verhältnis der erwarteten zur gemessenen Konzentration ist zusammen mit den Ergebnissen der an diesem Tag durchgeführten Testreihen aufzuzeichnen.
Histopathologische Bewertung der Gonaden
48. Zur Untersuchung des Zielorgans auf der HPG-Achse nach der Exposition gegenüber der Chemikalie kann von einigen Regulierungsbehörden die histopathologische Bewertung der Gonaden gefordert werden. Hierzu werden die Gonaden entweder im Ganzen oder seziert fixiert. Ist die Histopathologie erforderlich, wird bei der Untersuchung der endokrinen Wirkung der Prüfchemikalie nach spezifischen endokrinbezogenen Reaktionen an den Gonaden gesucht. Zu diesen diagnostischen Wirkungen gehören im Wesentlichen das Auftreten von testikulären Oozyten, Leydig-Zell-Hyperplasie, verminderte Dotterbildung, vermehrte Spermatogonien und perifollikuläre Hyperplasie. Andere Läsionen der Gonaden wie z.B. Atresie, testikuläre Degeneration und Veränderungen der Reifestufen können verschiedene Ursachen haben. Im Leitfaden zur Histopathologie von Fischgonaden werden Verfahren angegeben, die beim Sezieren, Fixieren und Schneiden sowie bei der histopathologischen Bewertung der Gonaden angewandt werden (22).
Auswertung von Biomarkerreaktionen durch Varianzanalyse (ANOVA)
49. Um die potenzielle Aktivität einer Chemikalie zu ermitteln, werden die Wirkungen in den Prüf- und in den Kontrollgefäßen mittels Varianzanalyse (ANOVA) verglichen. Wird eine Lösungsmittelkontrolle verwendet, sollten Verdünnungswasser und Lösungsmittelkontrollen zur Bestimmung des jeweiligen Endpunkts nach geeigneten Methoden statistisch analysiert werden. Für Leitlinien zur Verwendung der Daten über Verdünnungswasser und Lösungsmittelkontrollen für die anschließende statistische Analyse siehe OECD 2006c (28). Alle Daten zu biologischen Reaktionen sind nach Geschlechtern zu analysieren und aufzuzeichnen. Sind die Voraussetzungen für parametrische Methoden nicht erfüllt, d. h. keine Normalverteilung (z.B. Shapiro-Wilk-Test) oder heterogene Varianz (Bartlett-Test oder Levene-Test), sollte vor der ANOVA eine Datentransformation zur Varianzhomogenisierung in Betracht gezogen oder eine gewichtete ANOVA durchgeführt werden. Bei nicht monotonen Dosis-Wirkungs-Beziehungen kann der (parametrische) Dunnett-Test (Paarvergleiche) oder ein (nicht parametrischer) Mann-Whitney-Test mit Anpassung nach Bonferroni durchgeführt werden. Andere statistische Tests kommen ebenfalls in Betracht (z.B. ein Jonckheere-Terpstra- oder ein Williams-Test), wenn die Dosis-Wirkungs-Beziehung annähernd monoton ist. Das statistische Flussdiagramm in Anlage 8 soll die Auswahl des jeweils am besten geeigneten statistischen Tests erleichtern. Für weitere Informationen siehe OECD-Dokument Current Approaches to Statistical Analysis of Ecotoxicity Data (28).
Testergebnisse
50. Die Versuchsdaten sollten Folgendes umfassen:
Prüfinstitut:
Prüfchemikalie:
Lösungsmittel:
Versuchstiere:
Prüfbedingungen:
Ergebnisse
Leitlinien für die Auswertung und Akzeptanz der Testergebnisse
51. Dieser Abschnitt enthält Empfehlungen für die Auswertung der Testergebnisse für die gemessenen Endpunkte. Die Ergebnisse sind mit Vorsicht zu interpretieren, wenn die Prüfchemikalie eindeutig toxisch wirkt oder den Allgemeinzustand der Versuchstiere verschlechtert.
52. Bei der Festlegung der Bandbreite der Prüfchemikalienkonzentrationen ist darauf zu achten, dass die für eine aussagekräftige Datenauswertung höchste noch verträgliche Konzentration nicht überschritten wird. Wichtig ist dabei, dass bei mindestens einer Konzentration keine Anzeichen einer toxischen Wirkung festgestellt werden. Krankheitssymptome und Anzeichen toxischer Wirkungen sind gründlich zu untersuchen und aufzuzeichnen. Beispielsweise kann die VTG-Produktion bei weiblichen Tieren auch durch allgemeine Toxizität und nichtendokrine toxische Wirkungsweisen (z.B. durch Hepatotoxizität) beeinträchtigt werden. Die Wirkungsauswertung lässt sich jedoch durch andere Konzentrationen untermauern, die nicht durch systemische Toxizität beeinträchtigt werden.
53. Um Testergebnisse als gültig anerkennen zu können, müssen bestimmte Aspekte berücksichtigt werden. Als Faustregel gilt, dass sich die VTG-Konzentrationen in Kontrollgruppen männlicher und weiblicher Fische bei Dickkopfelritzen und bei Zebrabärblingen in etwa um mindestens drei Größenordnungen und bei Japanischen Reiskärpflingen in etwa um mindestens eine Größenordnung unterscheiden müssen. Für Beispiele für den Konzentrationsbereich bei Kontroll- und Behandlungsgruppen siehe Validierungsberichte (1) (2) (3) (4). Hohe VTG-Konzentrationen bei männlichen Kontrollfischen könnten die Aussagekraft der Prüfung und ihre Fähigkeit zum Nachweis schwacher Östrogen-Agonisten beeinträchtigen. Und niedrige VTG-Konzentrationen bei weiblichen Kontrollfischen könnten die Aussagekraft der Prüfung und ihre Fähigkeit zum Nachweis von Aromatasehemmern und Östrogen-Antagonisten beeinträchtigen. Diese Leitlinie beruht auf diesen Validierungsstudien.
54. Bei der Quantifizierung der Eiproduktion können starke Schwankungen auftreten [der Variationskoeffizient kann zwischen 20 und 60 % schwanken], was die Fähigkeit der Prüfung zum Nachweis einer erheblichen Verringerung der Eiproduktion um weniger als 70 %, wenn sich der Variationskoeffizient 50 % oder mehr nähert, beeinträchtigt. Ist der Variationskoeffizient auf niedrigere Werte (ca. 20-30 %) begrenzt, hat die Prüfung eine akzeptable Aussagekraft (80 %) für den Nachweis einer Verringerung der Eiproduktion um 40-50 %. Der für Dickkopfelritzen verwendete Versuchsplan, der vier Replikate je Behandlungsstufe umfasst, sollte eine bessere Aussagekraft für den Endpunkt "Fruchtbarkeit" gewährleisten als ein Versuchsplan mit nur zwei Replikaten.
55. Führt ein Labor die Prüfung zum ersten Mal durch oder wurden wesentliche Änderungen vorgenommen (beispielsweise Änderungen des Fischstammes oder der Bezugsquelle), sollte eine technische Eignungsprüfung durchgeführt werden. Nach Möglichkeit sollten Chemikalien verwendet werden, die ein breites Spektrum an Wirkungsweisen oder Wirkungen auf mehrere Test-Endpunkte abdecken. Die Labors werden aufgefordert, für männliche und weibliche Tiere eigene historische Kontrolldaten zu sammeln und eine positive Kontrollchemikalie (z.B. 172-¦stradiol in einer Konzentration von 100 ng/l oder einen bekannten schwachen Agonisten) auf östrogene Wirkung mit erhöhter VTG-Konzentration in männlichen Fischen, eine positive Kontrollchemikalie (z.B. Fadrozol oder Prochloraz in einer Konzentration von 300 µg/l) auf Aromatosehemmung mit reduzierter VTG-Konzentration in weiblichen Fischen und eine positive Kontrollchemikalie (z.B. 172-Trenbolon in einer Konzentration von 5 µg/l) auf androgene Wirkung und resultierender Induktion sekundärer Geschlechtsmerkmale bei weiblichen Dickkopfelritzen und weiblichen Japanischen Reiskärpflingen zu prüfen. Diese Daten können insgesamt mit verfügbaren Daten aus den Validierungsstudien (1) (2) (3) verglichen werden, um die Eignung des jeweiligen Labors sicherzustellen.
56. Grundsätzlich gelten VTG-Messungen als positiv, wenn eine statistisch signifikante (p < 0,05) Erhöhung der VTG-Konzentration in männlichen Fischen oder eine statistisch signifikante (p < 0,05) Reduzierung bei weiblichen Fischen zumindest bei der höchsten geprüften Dosis im Vergleich zur Kontrollgruppe festgestellt wird und keine Anzeichen einer allgemeinen Toxizität vorliegen. Ein positives Ergebnis wird auch durch Nachweis einer biologisch plausiblen Beziehung zwischen der Dosis und der Wirkungskurve bestätigt. Wie bereits erläutert, muss eine Reduzierung der VTG-Konzentration nicht unbedingt endokrinen Ursprungs sein. Ein positives Ergebnis sollte jedoch grundsätzlich als In-vivo-Nachweis einer endokrinen Wirkung ausgelegt werden und zur Klärung weitere Untersuchungen nach sich ziehen.
57. Die Regulierungsbehörden können eine Histopathologie der Gonaden verlangen, um die Reproduktionsfähigkeit der Versuchstiere zu bestimmen und eine evidenzbasierte Bewertung der Testergebnisse zu ermöglichen. Eine solche Histopathologie der Gonaden muss u. U. nicht durchgeführt werden, wenn entweder VTG oder die sekundären Geschlechtsmerkmale positiv sind (d. h. VTG-Zunahme oder -Abnahme oder Induktion sekundärer Geschlechtsmerkmale).
(1) OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 60.
(2) OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 61, Paris.
(3) OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 78, Paris.
(4) Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php? page="projects" (accessed 18/09/08).
(5) US EPA (2007). Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report.15. Dezember2007. US Environmental Protection Agency, Washington, DC. 104 ff.
(6) OECD (2008). Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 94, Paris.
(7) Sumpter J.P. und S. Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives; 103 Suppl 7:173-8 Review.
(8) Pawlowski S., et al. (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91.
(9) Andersen L., et al. (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52.
(10) Ankley G.T., et al. (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences; 67(1):121-30.
(11) Panter G.H., et al. (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21.
(12) Parks L.G., et al. (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113-25.
(13) Panter G.H., et al. (1999). Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG-Forschungsbericht AQ001. CEFIC, Brüssel, Belgien.
(14) Fenske M., et al. (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217-232.
(15) Holbech H., et al. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119-131
(16) Rose J., et al. (2002). Vitellogenin induction by 17b-estradiol and 17a-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C 131: 531-539.
(17) Brion F., et al. (2002). Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; Vol. 21: 1699-1708.
(18) Yokota H., et al. (2001). Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87-98.
(19) Tatarazako N., et al. (2004). Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301-308.
(20) Ankley G.T., et al. (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
(21) Seki M, et al. (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774-81.
(22) OECD (2010). Guidance Document on Fish Gonadal Histopathology. OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 123, Paris.
(23) OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
(24) Hutchinson T.H., et al. (2006a). Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; 69-92.
(25) Hutchinson T.H., et al. (2006b). Screening and testing for endocrine disruption in fish-biomarkers as "signposts," not "traffic lights," in risk assessment. Environmental Health Perspectives; 114 Suppl 1:106-14.
(26) Miles-Richardson S.R., et al. (1999). Effects of waterborne exposure to 172 -estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129-145.
(27) Martinovic D., et al. (2008). Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478-488.
(28) OECD (2006c), Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application, OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 54, OECD, Paris.
(29) US EPA (2008), Peer-Review Results for the Fish Short-Term Reproduction Assay, dated 30 January 2008, US Environmental Protection Agency, Washington DC. 110 S.
(30) OECD (2012), OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters, OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 150, OECD, Paris.
| Abkürzungen und Definitionen | Anlage 1 |
Abkürzungen und Definitionen
Besatz: Verhältnis des Nassgewichts der Fische zum Wasservolumen.
Besatzdichte: Anzahl Fische je Wasservolumen.
Chemikalie: Stoff oder Gemisch.
ELISA: Enzyme-Linked Immunosorbent Assay.
HPG-Achse: Hypothalamus-Hypophysen-Gonaden-Achse.
MTC: Maximum Tolerated Concentration, höchste noch verträgliche Konzentration, etwa 10 % des LC50-Werts.
Prüfchemikalie: Stoff oder Gemisch, der bzw. das nach dieser Prüfmethode getestet wird.
VK: Variationskoeffizient.
VTG: Vitellogenin ist ein Phospholipoglycoprotein-Vorläufer für Eidotterprotein, das in der Regel bei geschlechtlich aktiven weiblichen Tieren aller eierlegenden Arten vorkommt.
| Versuchsbedingungen für den Fisch-Screening-Test zur Bestimmung endokriner Wirkungen | Anlage 2 |
| 1. Empfohlene Arten | Dickkopfelritze (Pimephales promelas) | Japanischer Reiskärpfling (Oryzias latipes) | Zebrabärbling (Danio rerio) |
| 2. Testtyp | Durchflusssystem | Durchflusssystem | Durchflusssystem |
| 3. Wassertemperatur | 25 ± 2°C | 25 ± 2°C | 26 ± 2°C |
| 4. Beleuchtung | Leuchtstofflampen (breites Spektrum) | Leuchtstofflampen (breites Spektrum) | Leuchtstofflampen (breites Spektrum) |
| 5. Lichtintensität | 10-20 µE/m2/s, 540-1.000 lx oder 50-100 ft-c (Laborqualität) | 10-20 µE/m2/s, 540-1.000 lx oder 50-100 ft-c (Laborqualität) | 10-20 µE/m2/s, 540-1.000 lx oder 50-100 ft-c (Laborqualität) |
| 6. Fotoperiode (Morgen-/ Abenddämmerungsphasen optional; nicht unbedingt erforderlich) | 16 Std. Licht, 8 Std. Dunkelheit | 12-16 Std. Licht, 12-8 Std. Dunkelheit | 12-16 Std. Licht, 12-8 Std. Dunkelheit |
| 7. Besatz | < 5 g/l | < 5 g/l | < 5 g/l |
| 8. Größe der Prüfkammern | 10 l (mind.) | 2 l (mind.) | 5 l (mind.) |
| 9. Volumen der Testlösung | 8 l (mind.) | 1,5 l (mind.) | 4 l (mind.) |
| 10. Erneuerung der Testlösungen | Mindestens 6-mal täglich | Mindestens 5-mal täglich | Mindestens 5-mal täglich |
| 11. Alter der Testorganismen | Siehe Nummer 21 | Siehe Nummer 21 | Siehe Nummer 21 |
| 12. Ungefähres Nassgewicht der adulten Fische (g) | Weibchen: 1,5 ± 20 % Männchen: 2,5 ± 20 % | Weibchen: 0,35 ± 20 % Männchen: 0,35 ± 20 % | Weibchen: 0,65 ± 20 % Männchen: 0,4 ± 20 % |
| 13. Anzahl Fische pro Prüfgefäß | 6 (2 Männchen, 4 Weibchen) | 6 (3 Männchen, 3 Weibchen) | 10 (5 Männchen, 5 Weibchen) |
| 14. Anzahl der Behandlungen | = 3 (sowie entsprechende Kontrollen) | = 3 (sowie entsprechende Kontrollen) | = 3 (sowie entsprechende Kontrollen) |
| 15. Anzahl Gefäße je Behandlung | Mindestens 4 | Mindestens 4 | Mindestens 2 |
| 16. Anzahl der Fische je Testkonzentration | 16 adulte Weibchen und 8 Männchen (4 Weibchen und 2 Männchen pro Replikatgefäß) | 12 adulte Weibchen und 12 Männchen (3 Weibchen und 3 Männchen pro Replikatgefäß) | 10 adulte Weibchen und 10 Männchen (5 Weibchen und 5 Männchen pro Replikatgefäß) |
| 17. Fütterungsregime | Lebende oder tiefgefrorene adulte Salinenkrebse oder Salinenkrebs-Nauplien zwei- bis dreimal täglich (ad libitum), handelsübliches Futter oder beides in Kombination | Salinenkrebs-Nauplien zwei- bis dreimal täglich (ad libitum), handelsübliches Futter oder beides in Kombination | Salinenkrebs-Nauplien zwei- bis dreimal täglich (ad libitum), handelsübliches Futter oder beides in Kombination |
| 18. Belüftung | Keine, es sei denn, der Gehalt an gelöstem Sauerstoff fällt unter eine Luftsättigung von 60 % | Keine, es sei denn, der Gehalt an gelöstem Sauerstoff fällt unter eine Luftsättigung von 60 % | Keine, es sei denn, der Gehalt an gelöstem Sauerstoff fällt unter eine Luftsättigung von 60 % |
| 19. Verdünnungswasser | Sauberes Oberflächen- oder Brunnenwasser oder rekonstituiertes Wasser oder entchlortes Leitungswasser | Sauberes Oberflächen- oder Brunnenwasser oder rekonstituiertes Wasser oder entchlortes Leitungswasser | Sauberes Oberflächen- oder Brunnenwasser oder rekonstituiertes Wasser oder entchlortes Leitungswasser |
| 20. Präexposition | möglichst 7-14 Tage | möglichst 7-14 Tage | möglichst 7-14 Tage |
| 21. Expositionsdauer | 21 Tage | 21 Tage | 21 Tage |
| 22. Biologische Endpunkte |
|
|
|
| 23. Akzeptanz des Tests | Gelöster Sauerstoff ≥ 60 % Sättigung; mittlere Temperatur 25 ± 2°C; 90 %ige Überlebensrate der Fische in den Kontrollen; gemessene Testkonzentrationen innerhalb von 20 % der mittleren Messwerte je Behandlungsstufe. | Gelöster Sauerstoff ≥ 60 % Sättigung; mittlere Temperatur 25 ± 2°C; 90 %ige Überlebensrate der Fische in den Kontrollen; gemessene Testkonzentrationen innerhalb von 20 % der mittleren Messwerte je Behandlungsstufe. | Gelöster Sauerstoff ≥ 60 % Sättigung; mittlere Temperatur 26 ± 2°C; 90 %ige Überlebensrate der Fische in den Kontrollen; gemessene Testkonzentrationen innerhalb von 20 % der mittleren Messwerte je Behandlungsstufe. |
| Chemische Merkmale eines geeigneten Verdünnungswassers | Anlage 3 |
| Bestandteil | Konzentrationen |
| Partikel | < 20 mg/l |
| Gesamtgehalt an organischem Kohlenstoff | < 2 mg/l |
| Nichtionisierter Ammoniak | < 1 µg/l |
| Restchlor | < 10 µg/l |
| Gesamtgehalt an phosphororganischen Pestiziden | < 50 ng/l |
| Gesamtgehalt an chlororganischen Pestiziden plus polychlorierten Biphenylen | < 50 ng/l |
| Gesamtgehalt an organischem Chlor | < 25 ng/l |
| Laichsubstrat für Zebrabärblinge | Anlage 4A |
Laichschale: beliebige Instrumentenschale aus Glas, beispielsweise 22 x 15 x 5,5 cm (L x B x T), abgedeckt mit abnehmbarem Maschendrahtgitter aus Edelstahl (Maschenweite 2 mm); das Gitter sollte die Schale unterhalb des Randes komplett abdecken.
Auf dem Gitter das Laichsubstrat fixieren. Dabei eine Struktur gewährleisten, in die sich die Fische zurückziehen können. Geeignet sind beispielsweise Aquarienpflanzen aus grünem Kunststoff. (Hinweis: Eine mögliche Adsorption der Prüfchemikalie an das Kunststoffmaterial muss in diesem Fall berücksichtigt werden.) Das Kunststoffmaterial in einer ausreichenden Menge warmen Wassers waschen, um sicherzustellen, dass etwa vorhandene Chemikalien ausgetrieben werden und nicht in das Testwasser gelangen. Bei Verwendung von Materialien aus Glas ist sicherzustellen, dass die Fische weder verletzt noch bei heftigen Schwimmbewegungen eingeengt werden.
Der Abstand zwischen der Schale und den Glasscheiben muss mindestens 3 cm betragen, damit die Laichablage nicht außerhalb der Schale erfolgt. Die in die Schale abgelegten Eier fallen durch das Gitter und können 45-60 Minuten nach Einschalten der Beleuchtung entnommen werden. Die transparenten Eier haften nicht aneinander an und können bei transversaler Beleuchtung leicht gezählt werden. Bei fünf Weibchen pro Gefäß gelten bis zu 20 Eier/Tag als wenig, bis zu 100 Eier/Tag als mittel und über 100 Eier/Tag als viel. Die Laichschale herausnehmen, die Eier einsammeln und die Laichschale wieder in das Prüfgefäß stellen - entweder so spät wie möglich am Abend oder sehr früh am Morgen. Bis zum erneuten Einstellen darf höchstens eine Stunde vergehen, da der vom Laichsubstrat ausgehende Reiz dazu führen kann, dass es zu ungewöhnlichen Zeitpunkten zu Paarung und Laichablage kommt. Wird die Laichschale dennoch später in das Prüfbecken gestellt, so sollte dies frühestens 9 Stunden nach dem Einschalten der Beleuchtung geschehen. Zu diesem späten Tageszeitpunkt erfolgt keine Laichablage mehr.
| Laichsubstrat für Dickkopfelritzen | Anlage 4B |
Zwei oder drei kombinierte Platten und Schalen aus Kunststoff/Keramik/Glas oder Edelstahl als Laichunterlage in die Prüfkammern (z.B. 80 mm lange graue halbrunde Rinnen, aufgesetzte auf eine gebördelte, 130 mm lange Schale) stellen (siehe Abbildung). Gut akklimatisierte PVC- oder Keramikkacheln haben sich als Laichunterlage bewährt (Thorpe et al., 2007).
Die Platten anrauen, um die Haftung zu verbessern. Wenn nicht erwiesen ist, dass die Eier zuverlässig an der Laichunterlage haften, die Schalen außerdem mit einem Gitter abdecken, damit die Fische nicht an herabgefallene Eier gelangen.

Die Unterlage soll alle Eier aufnehmen können, die nicht an der Plattenoberfläche haften bleiben und folglich auf den Boden des Beckens fallen (sowie alle Eier, die direkt auf der flachen Kunststoffunterlage abgelegt werden). Alle Laichunterlagen sind vor Gebrauch mindestens 12 Stunden mit Verdünnungswasser zu spülen, um etwa vorhandene Schadstoffe auszutreiben.
Thorpe, K.L., Benstead, R., Hutchinson, T.H., Tyler, C.R., 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90-98.
| Bewertung der sekundären Geschlechtsmerkmale bei Dickkopfelritzen zum Nachweis bestimmter Chemikalien mit endokriner Wirkung | Anlage 5A |
Überblick
Für Tests zum Nachweis endokriner Disruptoren potenziell wichtige äußere Merkmale bei adulten Dickkopfelritzen sind die Körperfarbe (hell/dunkel), die Farbmusterung (Vorhandensein oder Nichtvorhandensein senkrechter Streifen), die Körperform (Kopf- und Rumpfform, abdominale Distension) sowie spezifische sekundäre Geschlechtsmerkmale (Zahl und Größe der Laichknoten (Nuptialtuberkel), Größe des dorsalen Nackenaufwuchses und des Ovipositors).
Laichausschlag (Nuptialtuberkel) tritt am Kopf (dorsaler Aufwuchs) paarungsbereiter männlicher Dickkopfelritzen auf, gewöhnlich beidseitig symmetrisch (Jensen et al. 2001). Bei weiblichen Kontrollfischen sowie juvenilen männlichen und weiblichen Fischen zeigen sich keine Tuberkel (Jensen et al. 2001). Um die Augen und zwischen den Nasenöffnungen männlicher Tiere können sich bis zu acht Tuberkel bilden. Die meisten und größten Tuberkel finden sich in zwei parallelen Reihen unmittelbar unter den Nasenöffnungen und über dem Maul. Bei vielen Fischen befinden sich Tuberkelgruppierungen auch unterhalb des Unterkiefers; die in unmittelbarer Nähe des Mauls befindlichen Tuberkel treten gewöhnlich als einzelnes Paar auf; ventral können sich Gruppen von bis zu vier Tuberkeln entwickeln. In der Regel bilden sich selten mehr als 30 Tuberkel (typischerweise 18-28; Jensen et al. 2001). Zumeist (quantitativ gesehen) entwickeln sich Nuptialtuberkel als einzelne, verhältnismäßig runde Ausstülpungen, deren Höhe in etwa ihrem Radius entspricht. Die meisten paarungsbereiten Männchen weisen zumindest auch einige Tuberkel auf, die derart groß und auffällig sind, dass sie als Einzelstrukturen kaum noch erkennbar sind.
Einige Arten endokrin wirkender Chemikalien können beim jeweils anderen Geschlecht zu anomalen sekundären Geschlechtsmerkmalen führen. So können Androgenrezeptor-Agonisten wie 17±-Methyltestosteron oder 172-Trenbolon bewirken, dass sich bei weiblichen Dickkopfelritzen Nuptialtuberkel bilden (Smith 1974; Ankley et al. 2001; 2003), während Östrogenrezeptor-Agonisten bei männlichen Tieren zu einer Verringerung der Anzahl oder Größe der Tuberkel führen können (Miles-Richardson et al. 1999; Harries et al. 2000).
Laichausschlag bei Dickkopfelritzen wird nachstehend nach Verfahren charakterisiert, wie sie im Labor der US-amerikanischen Umweltschutzbehörde (Environmental Protection Agency) in Duluth, MN, üblich sind. Spezifische Produkte und/oder Geräte können durch verfügbare vergleichbare Materialien ersetzt werden.
Eine Sichtprüfung erfolgt am besten unter einem beleuchteten Vergrößerungsglas oder einem beleuchteten Stereomikroskop mit Dreifach-Vergrößerung. Die Fische dorsal mit der vorderen Körperhälfte nach vorne zeigend (d. h. Kopf zum Betrachter hin) untersuchen.
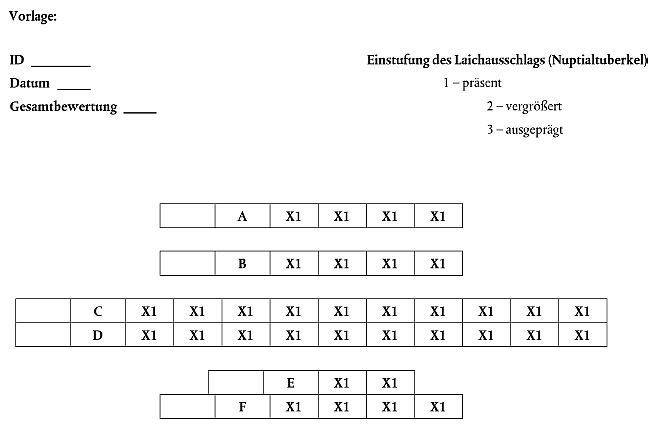
Zählen und Einstufen der Laichknoten (Nuptialtuberkel)
Zur Bewertung der Ausprägung des Laichausschlags bei adulten Dickkopfelritzen wurden sechs Areale identifiziert. Zur Darstellung der Region und der Zahl vorhandener Tuberkel wurde eine Vorlage (Formular) entwickelt (siehe Ende dieser Anlage). Die Zahl der Tuberkel aufzeichnen, und die Tuberkel der Größe nach wie folgt einstufen: 0 - keine Tuberkel, 1 - präsent, 2 - vergrößert und 3 - ausgeprägt (Abb. 1).
Bewertung 0 bedeutet, dass keine Tuberkel vorhanden sind. Bewertung 1 - Tuberkel präsent - betrifft jeden Knoten, bei dem eine einzelne Ausstülpung in etwa dem Radius des Knotens entspricht. Bewertung 2 - vergrößerter Tuberkel - betrifft Knoten mit sternförmig ausgebildetem Gewebe, das sich in der Regel durch eine große Grundfläche mit von der Mitte ausgehenden Rillen oder Furchen auszeichnet. Nach oben sind die Tuberkel häufig stärker gezackt, können aber auch abgerundet sein. Bewertung 3 - ausgeprägter Laichausschlag - bedeutet in der Regel, dass das Areal verhältnismäßig groß und abgerundet und weniger strukturiert ist. Manchmal verschmelzen diese Tuberkel entlang einer oder mehrerer Regionen (B, C und D; s. u.). Farbe und Form sind ähnlich wie bei Bewertung 2, was manchmal die Unterscheidung erschwert. Eine Einstufung nach diesem System ergibt bei normalen männlichen Kontrollexemplaren mit 18-20 Tuberkeln einen Gesamtwert von < 50 Tuberkeln (Jensen et al. 2001).

Die tatsächliche Anzahl Tuberkel kann bei bestimmten Fischen größer sein als es das Formularfeld für das einzustufende Ausschlagareal zulässt. In diesem Fall können rechts oder links neben dem betreffenden Feld zusätzliche Einstufungen angegeben werden. Die Vorlage muss daher nicht unbedingt Symmetrie aufzeigen. Eine weitere Methode zur Veranschaulichung paarweise auftretender oder vertikal auf der horizontalen Ebene des Mauls verbundener Tuberkel besteht in der doppelten Markierung zweier Einstufungen innerhalb eines einzigen Feldes.
Darzustellende Tuberkelregionen:
A - Augenregion: Dorsal bis ventral um den vorderen Augenrand; in der Regel viele Tuberkel bei geschlechtsreifen männlichen Kontrollexemplaren; bei weiblichen Kontrollexemplaren nicht präsent; in der Regel paarweises Auftreten (jeweils ein Tuberkel in der Nähe des Auges) bzw. Einzelvorkommen bei androgen-exponierten weiblichen Tieren.
B - Nasenregion zwischen Nasengruben (Sensorkanalporen): bei männlichen Kontrollexemplaren in der Regel paarweises Auftreten in stärkerer Ausprägung (2 - vergrößert - oder 3 - stark ausgeprägt); bei weiblichen Kontrollexemplaren nicht präsent, jedoch vereinzeltes Vorkommen bei androgen-exponierten weiblichen Tieren.
C - Nasenregion unmittelbar vor den Nasengruben, parallel zum Maul: in der Regel vergrößert oder stark ausgeprägt bei geschlechtsreifen männlichen Kontrollexemplaren; bei weniger entwickelten männlichen Tieren oder androgen-exponierten weiblichen Tieren präsent oder vergrößert.
D - Maulregion (entlang der Maullinie): bei männlichen Kontrollexemplaren in der Regel ausgeprägt; bei weiblichen Kontrollexemplaren nicht präsent; bei androgen-exponierten weiblichen Tieren können jedoch Tuberkel vorkommen.
E - Unterkieferregion (nahe am Maul): gewöhnlich klein und gepaart; bei männlichen Kontroll- oder exponierten Fischen unterschiedlich ausgeprägt.
F - Rumpfregion (ventral zu E): in der Regel klein und gepaart; bei männlichen Kontrollexemplaren und androgen-exponierten weiblichen Tieren präsent.
(1) Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290.
(2) Ankley, G.T., Jensen, K.M., Makynen, E.A., Kahl, M.D., Korte, J.J., Hornung, M.W., Henry, T.R., Denny, J.S., Leino, R.L., Wilson, V.S., Cardon, M.C., Hartig, P.C., Gray, E.L. 2003. Effects of the androgenic growth promoter 17-2 trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350-1360.
(3) Harries JE, Runnalls T, Hill E, Harris CA, Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011.
(4) Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127-141.
(5) Kahl, M.D., Jensen, K.M., Korte, J.J., Ankley, G.T. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523.
(6) Miles-Richardson, S.R., Kramer, V.J., Fitzgerald, S.D., Render, J.A., Yamini, B., Barbee, S.J., Giesy, J.P. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129-145.
(7) Smith, R.J.F. 1974. Effects of 17α-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031-1038.
| Bewertung der sekundären Geschlechtsmerkmale bei japanischen Reiskärpflingen zum Nachweis bestimmter Chemikalien mit endokriner Wirkung | Anlage 5B |
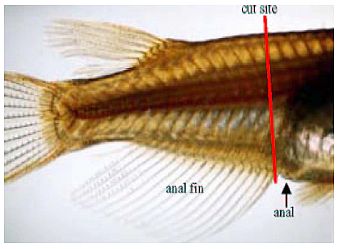
Im Folgenden wird die Messung von Papillenprozessen * als sekundäre Geschlechtsmerkmale Japanischer Reiskärpflinge (Oryzias latipes) beschrieben.
(1) Nach Ausräumung der Leber (Anlage 6) den Fisch in ein konisches Rohr mit etwa 10 ml 10 %igem neutral gepuffertem Formalin legen (Kopf nach oben, Schwanz nach unten). Wenn die Gonaden in einer anderen Lösung als 10 %igem neutral gepuffertem Formalin fixiert werden, den Körper zwischen dem vorderen Bereich der Afterflosse und dem After mit einer Rasierklinge transversal durchtrennen, ohne die Genitalpapillen und die eigentlichen Gonaden zu beschädigen (Abb. 3). Den Fisch mit der kranialen Seite in die Fixierlösung legen, um die Gonaden zu konservieren; die Schwanzseite in die 10 %ige neutral gepufferte Formalinlösung legen (s. o.).
(2) Nach Einlegen des Fisches in 10 %iges neutral gepuffertes Formalin den vorderen Bereich der Afterflosse mit einer Pinzette fassen und für etwa 30 Sekunden spreizen, um die Afterflosse offen zu halten. Beim Greifen mit einer Pinzette einige Flossenstrahlen im vorderen Bereich vorsichtig mitfassen, um Kratzer auf den Papillen zu vermeiden.
(3) Nach dem Spreizen der Afterflosse für etwa 30 Sekunden den Fisch bis zur Messung der Papillenprozesse in 10 %igem neutral gepuffertem Formalin bei Raumtemperatur aufbewahren. (Die Messung frühestens nach 24-stündiger Fixierung vornehmen).
Messung
(1) Nach Fixieren des Fischkörpers in 10 %iger neutral gepufferter Formalinlösung für mindestens 24 Stunden die Körper aus dem konischen Rohr nehmen; das Formalin mit Filterpapier (oder Papiertüchern) abtupfen.
(2) Den Fisch mit der Bauchseite nach oben legen. Die Afterflosse mit einer kleinen Sezierschere vorsichtig abtrennen (vorzugsweise mit etwas Pterygiophorgewebe).
(3) Den vorderen Teil der abgetrennten Afterflosse mit einer Pinzette aufnehmen und mit einigen Tropfen Wasser auf einem Glasträger fixieren. Die Afterflosse mit einem Deckglas abdecken. Beim Fassen mit der Pinzette darauf achten, dass die Papillen nicht zerkratzt werden.
(4) Die verbundenen Flossenplatten mit Papillenprozessen mit Hilfe des Zählers unter einem Biomikroskop (aufrechtes oder Inversmikroskop) zählen. Papillenprozesse liegen vor, wenn am hinteren Rand der verbundenen Platte kleine Papillenbildungen zu erkennen sind. Die Zahl der verbundenen Platten mit Papillenprozessen für jeden einzelnen Flossenstrahl auf dem Arbeitsblatt vermerken (z.B. erster Flossenstrahl: 0, zweiter Flossenstrahl: 10, dritter Flossenstrahl: 12 usw.); die Summe dieser Zahlen, aufgeschlüsselt nach Fischen, in den Excel-Kalkulationsbogen eingetragen. Falls erforderlich, die Afterflosse fotografieren und die Zahl der verbundenen Flossenplatten mit Papillenprozessen auf dem Foto ermitteln.
(5) Nach der Messung die Afterflosse zur Konservierung und Aufbewahrung in das unter Nummer 1 beschriebene konische Rohr legen.
Abb. 1 Schaubild zur Veranschaulichung der an Form und Größe der Afterflosse erkennbaren Geschlechtsunterschiede; A - männlich; B - weiblich. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.
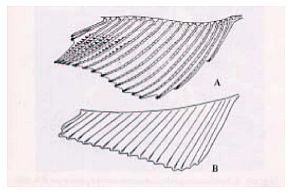
Abb. 2 A - Prozesse auf verbundenen Afterflossenplatten. J.P. - verbundene Platte; A.S. - axialer Bereich; P - Prozess. B - Distales Ende des Flossenstrahls; Actinotrichien (Act.) an der Spitze; Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.
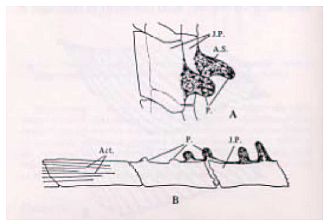
Abb. 3 Foto eines Fischkörpers mit Schnittstelle bei Fixierung der Gonaden in einer anderen Fixierlösung als 10 %iges neutral gepuffertes Formalin. In diesem Fall wird der restliche Körper zwischen der vorderen Region der Afterflosse und dem After mit einer Rasierklinge (rote Linie) abgetrennt; die Kopfseite des Fisches wird in die Fixierlösung für Gonaden, die Schwanzseite in 10 %iges neutral gepuffertes Formalin gelegt.
_____
*) Zu Papillenprozessen kommt es in der Regel nur bei adulten männlichen Tieren; betroffen sind Flossenstrahlen ab dem zweiten bis zum siebten oder achten Strahl, gezählt ab dem hinteren Ende der Afterflosse (Abb. 1 und 2). Am ersten Flossenstrahl (gezählt ab dem hinteren Ende der Afterflosse) kommen die Papillenprozesse selten vor. Das nachstehend beschriebene Standardarbeitsverfahren (SOP) umfasst die Messung von Papillenprozessen am ersten Flossenstrahl (bei diesem SOP ab dem hinteren Ende der Afterflosse gezählt).
| Empfohlene Verfahren für die Entnahme von Proben für die Vitellogenin-Analyse | Anlage 6 |
Es ist darauf zu achten, dass es nicht zu Kreuzkontaminationen zwischen den VTG-Proben männlicher und weiblicher Tiere kommt.
Verfahren 1A: Dickkopfelritze, Blutentnahme aus der Schwanzvene/-arterie
Nach der Betäubung den Schwanzansatz mit einem Skalpell teilweise durchtrennen und mit einem heparinisierten Mikrohämatokrit-Kapillarröhrchen aus der Schwanzvene/-arterie Blut entnehmen. Nach der Blutentnahme das Plasma schnell durch 3-minütige Zentrifugierung mit 15.000 g (bzw. alternativ 10 min. mit 15.000 g bei einer Temperatur von 4 °C) isolieren. Soweit erwünscht, kann nach der Zentrifugierung der Hämatokritwert (in %) ermittelt werden. Anschließend das Plasma aus dem Mikrohämatokrit-Röhrchen entnehmen und in einem Zentrifugenröhrchen mit 0,13 Einheiten Aprotinin (einem Protease-Inhibitor) bei - 80 °C aufbewahren, bis die VTG-Konzentration bestimmt werden kann. Je nach (geschlechtsabhängiger) Größe der Dickkopfelritze können pro Fisch in der Regel 5-60 µl Plasma entnommen werden (Jensen et al. 2001).
Verfahren 1B: Dickkopfelritze, Blutentnahme aus dem Herzen
Alternativ kann Blut auch durch Herzpunktion mittels heparinisierter Spritze (1.000 Einheiten Heparin pro ml) entnommen werden. Das Blut anschließend in Eppendorf-Röhrchen (auf Eis) geben und zentrifugieren (5 min, 7.000 g, Raumtemperatur). Das Plasma in saubere Eppendorf-Röhrchen füllen (in Aliquoten, wenn das Plasmavolumen dies zulässt), umgehend auf -80 oC einfrieren und bis zur Analyse aufbewahren (Panter et al., 1998).
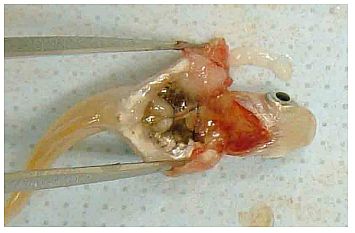
Verfahren 2A: Japanische Reiskärpflinge, Exzision der Leber
Entnahme der Prüffische aus dem Prüfbecken
(1) Testfische mit dem kleinen Löffelsieb aus dem Prüfbecken nehmen. Dabei darauf achten, dass die Fische nicht in andere Becken fallen.
(2) Die Fische grundsätzlich in nachstehender Reihenfolge entnehmen: Kontrolle, (gegebenenfalls) Lösungsmittelkontrolle, niedrigste Konzentration, mittlere Konzentration, höchste Konzentration und Positivkontrolle. Außerdem aus einem Prüfbecken zunächst alle männlichen Tiere entnehmen, dann die weiblichen.
(3) Anhand der äußerlichen (sekundären) Geschlechtsmerkmale (z.B. Form der Afterflosse) das Geschlecht der Fische bestimmen.
(4) Die Prüffische in ein Transportbehältnis setzen und zur Exzision der Leber an einen Arbeitsplatz bringen. Die Beschriftung des Prüfbeckens und des Transportbehältnisses auf Richtigkeit überprüfen, um sicherzustellen, dass die Zahl der aus dem Prüfbecken entnommenen Fische mit der Zahl der noch darin verbliebenen Fische übereinstimmt.
(5) Kann das Geschlecht anhand der äußerlichen Merkmale nicht bestimmt werden, alle Fische aus dem Prüfbecken entnehmen. In diesem Fall das Geschlecht durch Sichtprüfung der Gonaden oder der sekundären Geschlechtsmerkmale unter einem Stereomikroskop bestimmen.
Exzision der Leber
(1) Die Prüffische aus dem Transportbehältnis nehmen und mit dem kleinen Löffelsieb in die Betäubungslösung setzen.
(2) Nach dem Betäuben den Prüffisch mit einer (handelsüblichen) Pinzette auf Filterpapier (oder ein Papiertuch) legen. Dabei die Pinzette beidseitig am Kopf ansetzen, damit der Schwanz nicht bricht.
(3) Die Oberfläche des Fisches mit Filterpapier (oder einem Papiertuch) trockentupfen.
(4) Den Fisch mit der Bauchseite nach oben legen. Mit einer kleinen Sezierschere zwischen ventralem Halsbereich und Bauchmitte einen kleinen transversalen Einschnitt vornehmen.
(5) Die Sezierschere in diesen kleinen Einschnitt einführen und den Bauch auf einer kaudal zum Kiemenbogen angesetzten Schnittlinie entlang der Bauchmittellinie bis hin zur kranialen Seite des Afters öffnen. Um Leber und Gonaden nicht zu beschädigen, die Sezierschere nicht zu tief einführen.
(6) Unter dem Stereomikroskop folgende Schritte vornehmen:
(7) Den Fisch mit der Bauchseite nach oben auf das Papiertuch (oder eine gläserne Petrischale oder einen Glasträger) legen.
(8) Die Wände der Bauchhöhle mit Präzisionspinzetten spreizen und die inneren Organe freilegen. Falls erforderlich, kann dazu eine Seite der Bauchhöhle entfernt werden.
(9) Den anhaftenden Teil der Leber und der Gallenblase mit einer weiteren Präzisionspinzette freilegen. Den Gallengang fassen und die Gallenblase abtrennen. Dabei darauf achten, dass letztere nicht beschädigt wird.
(10) Die Speiseröhre fassen, und auf die gleiche Weise den Magen-Darm-Trakt von der Leber abtrennen. Darauf achten, dass kein Magen-Darm-Inhalt austritt. Den Magen-Darm-Trakt schwanzseitig vom After trennen und aus der Bauchhöhe nehmen.
(11) Fett und sonstiges Gewebe um die Leber entfernen. Die Leber darf dabei nicht beschädigt werden.
(12) Den Leberausgang mit der Präzisionspinzette fassen und die Leber aus der Bauchhöhle entnehmen.
(13) Die Leber auf den Glasträger legen. Mit der Präzisionspinzette erforderlichenfalls Fett und sonstiges externes Gewebe (z.B. Bauchfell) von der Leberoberfläche entfernen.
(14) Das Gewicht der Leber mit einem 1,5-ml-Mikroröhrchen (Leergewicht) und einer elektronischen Analysewaage bestimmen. Den Messwert in das Arbeitsblatt eintragen (auf 0,1 mg genau). Mit den Angaben auf dem Etikett des Mikroröhrchens abgleichen.
(15) Das Mikroröhrchen mit der Leber verschließen und in ein Kühlgestell (oder ein Eis-Rack) setzen.
(16) Nach Exzision einer Leber die Sezierinstrumente reinigen oder wechseln.
(17) Die Lebern aller Fische im Transportbehältnis entnehmen, wie oben beschrieben.
(18) Nach Exzision der Lebern aller Fische im Transportbehältnis (d. h. aller männlichen oder allen weiblichen Tieren in einem Prüfbecken) die Leberproben in ein etikettiertes Reagenzglasgestell setzen und in einen Gefrierschrank stellen. Sind die Lebern kurz nach der Exzision einer Vorbehandlung zu unterziehen, die Proben in einem Kühlgestell (oder Eis-Rack) zum nächsten Arbeitsplatz bringen.
Nach Exzision der Lebern steht der Fischkörper zur Histologie der Gonaden und Messung der sekundären Geschlechtsmerkmale zu Verfügung.
Leberproben
Die von den Prüffischen entnommenen Leberproben bei ≤ - 70 °C lagern, sofern sie nicht kurz nach der Exzision vorbehandelt werden sollen.
Abb. 1 Unmittelbar vor den Brustflossen einen Schereneinschnitt vornehmen.
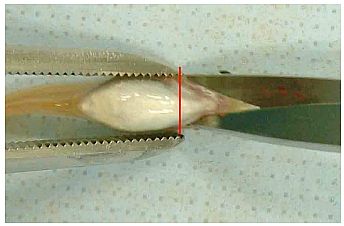
Abb. 2 Auf der Bauchmittellinie bis zu einem Punkt etwa 2 mm kranial vor dem After einen Scherenschnitt durchführen.
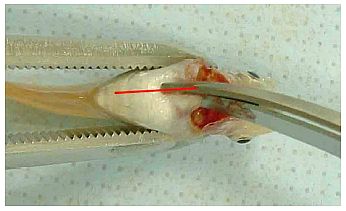
Abb. 3 Die Bauchwände mit einer Pinzette spreizen, um die Leber und die anderen inneren Organe freizulegen.
(Alternativ können die Bauchwände seitlich festgesteckt werden).
Der Pfeil zeigt auf die Leber.
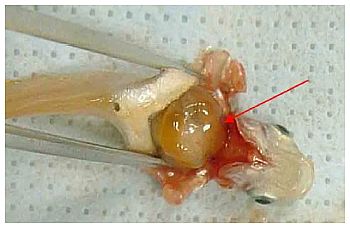
Abb. 4 Die Leber grob sezieren und mit einer Pinzette entnehmen.
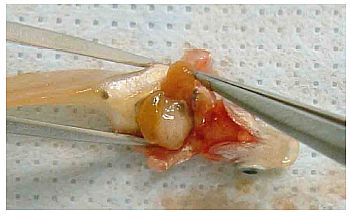
Abb. 5 Darm mit der Pinzette vorsichtig herausziehen.
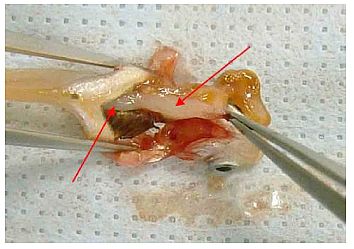
Abb. 6 Beide Darmenden und etwaiges mesenteriales Gewebe mit einer Schere durchtrennen.
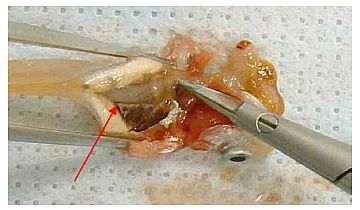
Abb. 7 (Weibchen) Das Verfahren ist bei männlichen und weiblichen Fischen dasselbe.
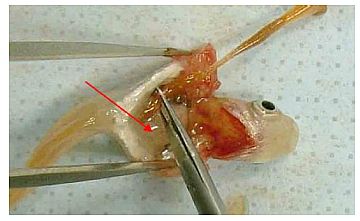
Abb. 8 Verfahren abgeschlossen.
Verfahren 2B: Japanische Reiskärpflinge (Oryzias latipes), Vorbehandlung der Leber für die Vitellogenin-Analyse
Die Flasche mit dem Homogenatpuffer aus dem ELISA-Kit nehmen und mit zerstoßenem Eis kühlen (Temperatur der Lösung: ≤ 4 °C). Wird Homogenatpuffer aus dem EnBio-ELISA verwendet, die Lösung zunächst bei Raumtemperatur auftauen und die Flasche anschließend auf zerstoßenem Eis kühlen.
Das Volumen des Homogenatpuffers für die Leber richtet sich nach dem Lebergewicht (pro mg Leber je 50 µl Homogenatpuffer.) Wiegt die Leber beispielsweise 4,5 mg, so betr´gt das Volumen des Homogenatpuffers 225 µl. Die Volumina der Homogenatpuffer für sämtliche Lebern in einer Liste erfassen.
Vorbereitung der Lebern zur Vorbehandlung
(1) Das 1,5-ml-Mikroröhrchen mit der Leber erst unmittelbar vor der Vorbehandlung aus dem Gefrierschrank nehmen.
(2) Um Vitellogenin-Kontaminationen zu vermeiden, die Lebern männlicher Fische vor den Lebern der weiblichen Fische vorbehandeln. Die Vorbehandlung der Testgruppen sollte zudem in der folgenden Reihenfolge ablaufen: Kontrolle, (gegebenenfalls) Lösungsmittelkontrolle, niedrigste Konzentration, mittlere Konzentration, höchste Konzentration und Positivkontrolle.
(3) Aus dem Gefrierschrank immer nur so viel 1,5-ml-Mikroröhrchen mit Leberproben entnehmen, wie auch gleichzeitig zentrifugiert werden können.
(4) Die 1,5-ml-Mikroröhrchen mit den Leberproben in der Reihenfolge der Nummern der Proben aus dem Eis-Rack anordnen. (Die Lebern brauchen nicht aufgetaut zu werden).
Vorbehandlung
1) Zugabe des Homogenatpuffers
Nachdem anhand der Liste geprüft wurde, welches Volumen des Homogenatpuffers jeweils für ein Leberpräparat zu verwenden ist, die Mikropipette (Volumenbereich: 100-1.000 µl) auf das entsprechende Volumen einstellen. Eine saubere Spitze aufsetzen.
Homogenatpuffer aus der Reagenzflasche entnehmen und in die 1,5-ml-Mikroröhrchen mit Leber geben.
Homogenatpuffer allen leberhaltigen 1,5-ml-Mikroröhrchen wie oben beschrieben zugeben. Die Spitze der Mikropipette braucht nicht gewechselt zu werden. Ist die Spitze jedoch verunreinigt oder wird vermutet, dass sie verunreinigt ist, muss sie jedoch ausgewechselt werden.
2) Homogenisieren der Leber
3) Zentrifugen des suspendierten Leberhomogenats
4) Entnahme des Überstands
Lagerung der Probe
Die 0,5-ml-Mikroröhrchen mit dem Überstand des Leberhomogenats bis zur Durchführung des ELISA bei ≤ - 70 °C lagern.
Verfahren 3A: Zebrabärblinge, Blutentnahme aus der Schwanzvene/-arterie
Unmittelbar nach der Betäubung den Schwanzansatz mit einem Skalpell teilweise durchtrennen und mit einem heparinisierten Mikrohämatokrit-Kapillarröhrchen aus der Schwanzvene/-arterie Blut entnehmen. Die Blutvolumen betragen je nach Größe der Fische 5 bis 15 µl. In das Mikrokapillarrohr die gleiche Menge Aprotininpuffer (6 µg/ml in PBS) geben, und das Plasma durch Zentrifugieren (5 Minuten bei 600 g) vom Blut trennen. Das Plasma in den TestrÆhrchen auffangen und bis zur Bestimmung der VTG-Konzentration oder anderer relevanter Proteine bei -20 oC lagern.
Verfahren 3B: Zebrabärblinge, Blutentnahme durch Herzpunktion
Um eine Koagulierung des Bluts und einen Proteinabbau zu vermeiden, die Proben mit heparinisierter (1.000 Einheiten/ml) phosphatgepufferter Salzlösung (PBS) und dem Proteasehemmer Aprotinin (2 TIU/ml) entnehmen. Als Pufferbestandteile werden Heparin-Ammoniumsalz und lyophilisiertes Aprotinin, für die Blutentnahme Spritzen (1 ml) mit fixierter dünner Nadel (z.B. Braun Omnikan-F) empfohlen. Die Spritze muss mit der Pufferlösung vorgefüllt sein (ca. 100 µl), damit die geringen Blutvolumina der einzelnen Fische vollständig eluiert werden können. Die Blutproben durch Herzpunktion entnehmen. Dazu die Fische zunächst mit MS-222 (100 mg/l) betäuben. Bei angemessener Betäubung ist der Herzschlag der Zebrabärblinge wahrnehmbar. Beim Punktieren des Herzens den Spritzenkolben unter leichter Spannung halten. Die zu entnehmendem Blutvolumina liegen zwischen 20 und 40 µl. Nach der Herzpunktion das Blut-/Puffer-Gemisch in die Teströhrchen geben. Das Plasma durch Zentrifugieren (20 min mit 5.000 g) vom Blut trennen und bis zur Analyse bei -80 oC lagern.
Verfahren 3C: Standardarbeitsverfahren (SOP): Zebrabärblinge, Homogenisierung von Kopf- und Schwanzgewebe
1. Die Fische betäuben und töten, wie für den Test beschrieben.
2. Kopf und Schwanz der Fische abtrennen, siehe Abbildung 1.
Wichtig: Alle Sezierinstrumente und das Sezierbrett sind nach jedem Fisch abzuspülen und ordnungsgemäß zu reinigen (z.B. mit 96 %igem Ethanol), um "VTG-Kontaminationen" nicht induzierter Männchen durch weibliche Fische oder induzierte Männchen zu vermeiden.
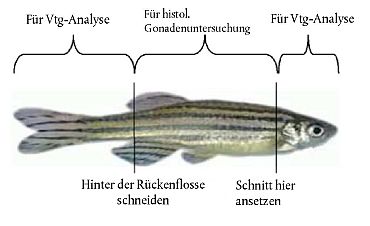
3. Das Gewicht der gepoolten Kopf- und Schwanzteile auf 1 mg genau abmessen.
4. Nach dem Wiegen die Teile in geeignete Röhrchen (z.B. 1,5 ml Eppendorf) geben und bei -80 oC bis zur Homogenisierung einfrieren oder unmittelbar mit zwei Kunststoff-Pistillen auf Eis homogenisieren. (Alternativ können auch andere Methoden angewendet werden, sofern sie auf Eis durchgeführt werden und eine homogene Masse entsteht.) Wichtig: Die Röhrchen sind ordnungsgemäß zu nummerieren, damit die Kopf- und Schwanzteile für die histologische Gonadenuntersuchung dem jeweiligen Rumpf zugeordnet werden können.
5. Nach Herstellung einer homogenen Masse das Vierfache des Gewebegewichts des eisgekühlten Homogenisierungspuffers * hinzugeben. Mit den Pistillen weiterarbeiten, bis eine homogene Mischung entsteht. Wichtiger Hinweis: Für jeden Fisch ist ein frisches Pistill zu verwenden.
6. Die Proben bis zur Zentrifugierung (4 °C, 50.000 g, 30 Minuten) auf Eis legen.
7. Mit einer Pipette 20 µl-Portionen des Überstands in mindestens zwei Röhrchen geben; dabei die Spitze der Pipette durch die oberflächige Fettschicht führen und den Überstand vorsichtig ansaugen, ohne jedoch Fett- oder Pelletfraktionen mitaufzunehmen.
8. Die Röhrchen bis zur Verwendung bei - 80 °C lagern.
_____
*) Homogenisierungspuffer:
HINWEIS: Der Homogenisierungspuffer ist am Tag der Herstellung zu verbrauchen. Während der Verwendung muss die Pufferlösung auf Eis liegen.
| Vitellogenin-angereicherte Proben und Inter-Assay-Referenzstandard | Anlage 7 |
An jedem Tag, an dem VTG-Bestimmungen vorgenommen werden, ist eine nach einem Inter-Assay-Referenzstandard hergestellte Anreicherungsprobe zu analysieren. Das für den Inter-Assay-Referenzstandard verwendete VTG muss aus einer anderen Charge als das VTG stammen, das zur Herstellung der Kalibrierstandards für den durchzuführenden Assay verwendet wurde.
Die Anreicherungsprobe wird hergestellt, indem eine bekannte Menge des Inter-Assay-Standards einer Plasmaprobe männlicher Kontrollfische zugegeben wird. Die Probe anreichern, bis eine VTG-Konzentration erreicht wird, die 10- bis 100-mal höher ist als die bei männlichen Kontrollfischen erwartete VTG-Konzentration. Die so angereicherte Probe kann von einem einzelnen Fisch oder von mehreren Fischen stammen.
In mindestens zwei Mulden eine Teilprobe nicht angereicherten Plasmas männlicher Kontrolltiere analysieren. Die angereicherte Probe auch in mindestens zwei Duplikatmulden analysieren. Die mittlere VTG-Menge in den beiden nicht angereicherten Plasmaproben männlicher Kontrollfische der berechneten VTG-Menge hinzurechnen, die zur Anreicherung der Proben zugegeben wurde, um die erwartete Konzentration zu bestimmen. Das Verhältnis dieser erwarteten zur gemessenen Konzentration zusammen mit den Ergebnissen der an dem betreffenden Tag durchgeführten Assays protokollieren.
| Flussdiagramm als Entscheidungshilfe für die statistische Analyse | Anlage 8 |
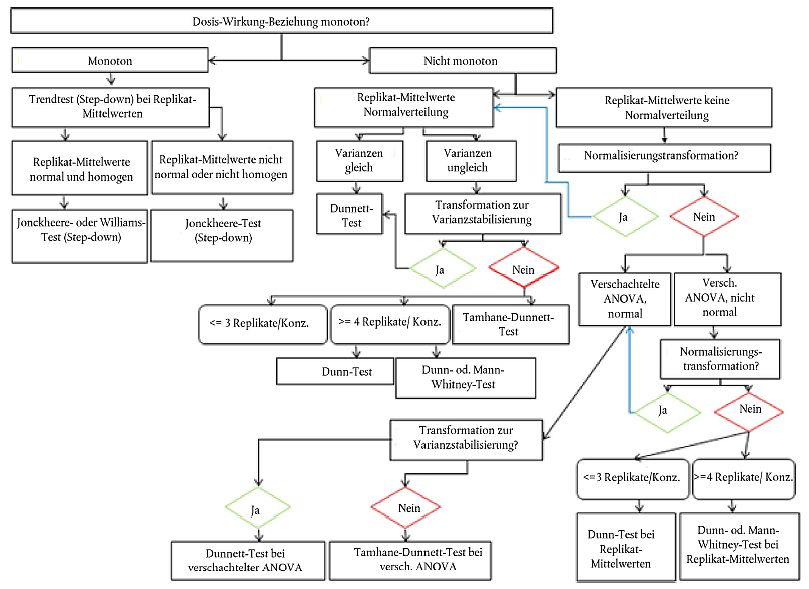
C.49 Prüfung auf akute Toxizität an Fischembryonen (FET) 17
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie 236 (2013). Darin wird der Fischembryonentest auf akute Toxizität (FET) an Zebrabärblingen (Danio rerio) beschrieben. Mit diesem Test soll die akute Toxizität von Chemikalien bei Fischen im Embryonalstadium bestimmt werden. Der FET-Test basiert auf Studien und Validierungen, die an Zebrabärblingen durchgeführt wurden (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14). Er wurde erfolgreich an einem breiten Spektrum von Chemikalien mit verschiedener Wirkungsweise, Löslichkeit, Flüchtigkeit und Hydrophobie getestet (15 und 16).
2. Die in dieser Prüfmethode verwendeten Begriffe sind in Anlage 1 definiert.
3. Frisch befruchtete Eier von Zebrabärblingen werden der Prüfchemikalie über einen Zeitraum von 96 Stunden ausgesetzt. In Abständen von 24 Stunden werden bis zu vier apikale Beobachtungen als Letalitätsindikatoren protokolliert (6): i) Koagulation der befruchteten Eier, ii) fehlende Somitenbildung, iii) fehlende Abtrennung der Schwanzknospe vom Dottersack und iv) fehlender Herzschlag. Am Ende des Expositionszeitraums wird die akute Toxizität basierend auf einem positiven Ergebnis bei einer der vier protokollierten apikalen Beobachtungen bestimmt und die LC50 berechnet.
4. Zu nützlichen Informationen über stoffspezifische Eigenschaften zählen Strukturformel, Molekulargewicht, Reinheit, Stabilität in Wasser, die Lichtbeständigkeit, pKa und Kow, Wasserlöslichkeit und Dampfdruck sowie die Ergebnisse einer Prüfung auf leichte biologische Abbaubarkeit (Kapitel C.4 (17) oder Kapitel C.29 (18)). Aus der Wasserlöslichkeit und dem Dampfdruck kann die Henry-Konstante berechnet werden, der zu entnehmen ist, ob erhebliche Verluste der Prüfchemikalie aufgrund von Verdampfung zu erwarten sind. Die Konzentration des Stoffs in den Prüflösungen sollte nach einer zuverlässigen Analysemethode mit bekannter und dokumentierter Genauigkeit und Nachweisgrenze bestimmt werden.
5. Wird die Prüfmethode zur Prüfung eines Gemischs angewandt, sollte die Zusammensetzung des Gemischs so genau wie möglich charakterisiert werden, z.B. durch Angabe der chemischen Identität, des quantitativen Vorkommens und der stoffspezifischen Eigenschaften der Komponenten (siehe Nummer 4). Bevor die Prüfmethode zur gesetzlich vorgeschriebenen Prüfung eines Gemischs angewendet wird, sollte geprüft werden, ob sie für solche Zwecke geeignete Ergebnisse liefert.
6. Was durch Metabolisierung aktivierbare Stoffe betrifft, so gibt es Anhaltspunkte dafür, dass Embryonen von Zebrabärblingen Biotransformationsfähigkeiten besitzen (19) (20) (21) (22). Jedoch ist die metabolische Kapazität embryonaler Fische nicht immer mit derjenigen von Jungfischen oder adulten Fischen vergleichbar. So wurden beispielsweise die protoxischen Eigenschaften von Allylalkohol (9) im FET-Test nicht erkannt. Liegen daher Anzeichen vor, dass Metaboliten oder andere relevante Transformationsprodukte toxischer als die Ausgangsverbindung sind, empfiehlt es sich ferner, den Test mit diesen Metaboliten/Transformationsprodukten durchzuführen und diese Ergebnisse bei den Schlussfolgerungen zur Toxizität der Prüfchemikalie ebenfalls zu berücksichtigen oder alternativ einen anderen Test durchzuführen, bei dem die Metabolisierung stärker berücksichtigt wird.
7. Bei Stoffen mit einem Molekulargewicht ≥ 3 kDa und einer sehr massigen Molekularstruktur sowie Stoffen, die zu einem verzögerten Schlüpfen führen, wodurch die Exposition nach dem Schlüpfen verhindert oder verringert werden kann, wird aufgrund der beschränkten Bioverfügbarkeit des Stoffs nicht von einer Empfindlichkeit der Embryonen ausgegangen. In solchen Fällen sind andere Toxizitätstests u. U. besser geeignet.
8. Die Testergebnisse sind gültig, wenn folgende Kriterien erfüllt sind:
9. Anlage 2 enthält einen Überblick über die empfohlenen Haltungs- und Prüfbedingungen.
Apparatur
10. Die folgende Ausrüstung wird benötigt:
Prüfkammern
11. Es sollten Prüfkammern aus Glas oder Polystyrol verwendet werden (z.B. 24-Well-Platten mit einem Fassungsvermögen von 2,5-5 ml pro Well). Falls eine Adsorption an Polystyrol vermutet wird (z.B. bei unpolaren, planaren Stoffen mit hohem KOW-Wert), sollten inerte Materialien (Glas) verwendet werden, um die adsorptionsbedingten Verluste gering zu halten (26). Die Prüfkammern sollten nach dem Zufallsprinzip in den Inkubator gestellt werden.
Wasser und Prüfbedingungen
12. Es wird empfohlen, das Haltungswasser zu verdünnen, um die für verschiedenste Oberflächengewässer typischen Wasserhärtewerte zu erreichen. Das Verdünnungswasser sollte aus rekonstituiertem Wasser zubereitet werden (27). Der resultierende Härtegrad sollte 100-300 mg/l CaCO3 entsprechen, um eine übermäßige Ausfällung von Calciumcarbonat zu verhindern. Es kann auch anderes gut charakterisiertes Oberflächen- oder Brunnenwasser verwendet werden. Das rekonstituierte Wasser kann durch Verdünnung mit entionisiertem Wasser bis zu einem Verhältnis von 1:5 zum Erreichen einer Mindesthärte von 30-35 mg/l CaCO3. an Haltungswasser mit geringer Härte angepasst werden. Vor Zugabe der Prüfchemikalie wird das Wasser bis zur Sauerstoffsättigung belüftet. Während der gesamten Prüfung sollte die Temperatur in den Wells bei 26 ± 11 °C gehalten werden. Der pH-Wert sollte im Bereich zwischen 6,5 und 8,5 liegen und während der Prüfung um höchstens 1,5 Einheiten schwanken. Wird davon ausgegangen, dass der pH-Wert nicht in diesem Bereich bleibt, sollte der pH-Wert vor Durchführung der Prüfung angepasst werden. Der pH-Wert ist so anzupassen, dass die Konzentration der Stammlösung nicht in erheblichem Maß verändert und keine chemische Reaktion oder Ausfällung der Prüfchemikalie verursacht wird. Es wird empfohlen, zur Korrektur des pH-Werts in den Lösungen mit der Prüfchemikalie Chlorwasserstoff (HCl) und Natriumhydroxid (NaOH) zu verwenden.
Prüflösungen
13. Die Prüflösungen mit den gewünschten Konzentrationen können z.B. durch Verdünnung einer Stammlösung zubereitet werden. Die Stammlösungen sollten vorzugsweise durch einfaches Mischen oder Einrühren der Prüfchemikalie in das Verdünnungswasser mit mechanischen Mitteln (z.B. Rührwerk und/oder Ultraschall) hergestellt werden. Ist die Prüfchemikalie nur schwer in Wasser löslich, sollten die im OECD Guidance Document No. 23 on aquatic toxicity testing of difficult substances and mixtures beschriebenen Verfahren angewandt werden (28). Die Verwendung von Lösungsmitteln sollte vermieden werden, kann jedoch in einigen Fällen notwendig sein, um eine Stammlösung mit geeigneter Konzentration herzustellen. Wird für die Zubereitung der Stammlösung dennoch ein Lösungsmittel verwendet, so sollte die Endkonzentration 100 µl/l nicht überschreiten und in allen Prüfgefäßen gleich sein. Bei Verwendung eines Lösungsmittels ist eine zusätzliche Lösungsmittelkontrolle erforderlich.
Haltung der Zuchtfische
14. Für die Eiproduktion wird ein Zuchtbestand von nicht exponierten Wildtyp-Zebrabärblingen mit hinreichend dokumentierter Befruchtungsrate der Eier verwendet. Die Fische dürfen keine makroskopisch erkennbaren Infektions- und Krankheitssymptome aufweisen und zwei Monate vor dem Laichen keiner (akuten oder prophylaktischen) pharmazeutischen Behandlung unterzogen worden sein. Die Zuchtfische werden in Aquarien mit einer empfohlenen Besatzkapazität von 1 Liter Wasser pro Fisch und einer festgelegten Fotoperiode von 12-16 Stunden gehalten (29) (30) (31) (32) (33). Die Filtrationsraten sind optimal einzustellen; zu hohe Filtrationsraten, die zu einer starken Störung des Wassers führen, sind zu vermeiden. Hinweise zur Fütterung sind Anlage 2 zu entnehmen. Überfütterung ist zu vermeiden, und die Wasserqualität und die Sauberkeit der Aquarien sollten regelmäßig kontrolliert und erforderlichenfalls in den anfänglichen Zustand zurückversetzt werden.
Leistungstests
15. Um die Empfindlichkeit des verwendeten Fischstamms zu prüfen, sollte vorzugsweise zweimal pro Jahr ein Test mit 3,4-Dichloranilin als Referenzchemikalie (in den Validierungsstudien (1) (2) verwendet) in einem vollständigen Konzentrations-Wirkungs-Bereich durchgeführt werden. Alle Labors, die diese Prüfmethode erstmals anwenden, müssen die Referenzchemikalie verwenden. Labors können diese Chemikalie verwenden, um ihre technische Kompetenz zur Durchführung des Tests nachzuweisen, bevor sie Daten für regulatorische Zwecke einreichen.
Eiproduktion
16. Die Zebrabärblingseier können mithilfe von Laichgruppen (in einzelnen Laichbecken) oder durch Massenlaichen (in Haltungsbecken) produziert werden. Im Fall von Laichgruppen werden die Männchen und Weibchen (z.B. im Verhältnis 2:1) einer Zuchtgruppe am Tag vor der Prüfung einige Stunden vor Einbruch der Dunkelheit in Laichbecken eingesetzt. Da es gelegentlich vorkommen kann, dass Laichgruppen von Zebrabärblingen nicht laichen, wird die parallele Verwendung von mindestens drei Laichbecken empfohlen. Um eine genetische Verzerrung zu vermeiden, werden Eier von mindestens drei Zuchtgruppen entnommen, gemischt und randomisiert ausgewählt.
17. Für das Entnehmen der Eier werden am Tag vor der Prüfung vor Einbruch der Dunkelheit oder am Tag der Prüfung vor Beginn der Lichtphase Laichschalen in die Laich- oder Haltungsbecken gelegt. Damit die Eier nicht von adulten Zebrabärblingen gefressen werden, sind die Laichschalen mit einem inertem Drahtgitter mit geeigneter Maschenweite (ca. 2 ± 0,5 mm) abzudecken. Künstliche Pflanzen aus inertem Material (z.B. Kunststoff oder Glas) können als Laichstimulans an dem Gitter befestigt werden, falls dies für notwendig gehalten wird (3) (4) (5) (23) (35). Es sollten verwitterte Kunststoffmaterialien, die nicht auslaugen (z.B. Phthalate), verwendet werden. Paarung, Laichen und Befruchtung finden innerhalb von 30 Minuten nach Beginn der Lichtphase statt, und die Laichschalen mit den gesammelten Eiern können vorsichtig entnommen werden. Es wird empfohlen, die Eier nach dem Entnehmen aus den Laichschalen mit rekonstituiertem Wasser zu spülen.
Differenzierung der Eier
18. Die befruchteten Eier durchlaufen nach 15 Minuten bei 261 °C die erste Furchung. Bei den nachfolgenden synchronen Furchungen werden 4-, 8-, 16- und 32-zellige Blastomeren gebildet (siehe Anlage 3) (35). Nach diesen Phasen können die befruchteten Eier anhand der Entwicklung einer Blastula eindeutig identifiziert werden.
Expositionsbedingungen
19. 20 Embryonen pro Konzentration (ein Embryo pro Mulde) werden der Prüfchemikalie ausgesetzt. Die Exposition sollte so sein, dass ± 20 % der nominalen Chemikalienkonzentration während der Prüfung erhalten bleiben. Ist dies in einem statischen System nicht möglich, sollte ein handhabbares semistatisches Erneuerungsintervall angewendet werden (z.B. Erneuerung alle 24 Stunden). In diesen Fällen müssen die Expositionskonzentrationen mindestens bei der höchsten und bei der niedrigsten Prüfkonzentrationen am Anfang und am Ende jedes Expositionsintervalls überprüft werden (siehe Nummer 36). Wenn eine Expositionskonzentration von ± 20 % der nominalen Konzentrationen nicht gehalten werden kann, müssen alle Konzentrationen am Anfang und am Ende jedes Expositionsintervalls überprüft werden (siehe Nummer 36). Bei der Erneuerung sollte darauf geachtet werden, dass die Embryonen noch von einer geringen Menge der alten Prüflösungen bedeckt sind, damit sie nicht austrocknen. Der Versuchsplan kann entsprechend den Prüfanforderungen der spezifischen Stoffe angepasst werden (z.B. Durchfluss- (24) oder passive Dosierungssysteme (25) bei leicht abbaubaren oder hoch adsorptiven Stoffen (29) oder sonstige Systeme bei flüchtigen Stoffen (36) (37)). In jedem Fall sollte darauf geachtet werden, möglichst wenig Stress für die Embryonen zu verursachen. Die Prüfkammern sollten vor Durchführung des Tests mindestens 24 Stunden den Prüflösungen ausgesetzt werden. Anlage 2 enthält eine Übersicht über die Prüfbedingungen.
Prüfkonzentrationen
20. Normalerweise sind fünf Konzentrationen der Prüfchemikalie mit einem konstanten Abstandsfaktor von maximal 2,2 erforderlich, um die statistischen Anforderungen zu erfüllen. Die Verwendung von weniger als fünf Konzentrationen muss begründet werden. Die höchste geprüfte Konzentration sollte vorzugsweise zu 100 % Letalität führen, und die niedrigste geprüfte Konzentration sollte keine zu beobachtende Wirkung haben, wie unter Nummer 28 definiert. Der geeignete Konzentrationsbereich kann im Rahmen eines Tests zur Bestimmung des Konzentrationsbereichs vor der endgültigen Prüfung bestimmt werden. Für die Dosisfindung werden in der Regel zehn Embryonen pro Konzentration verwendet. Die folgenden Anweisungen beziehen sich auf die Durchführung des Tests in 24-Well-Platten. Werden andere Prüfkammern (z.B. kleine Petrischalen) verwendet oder mehr Konzentrationen getestet, müssen die Anweisungen entsprechend angepasst werden.
21. Details und visuelle Anweisungen für die Verteilung der Konzentrationen auf die 24-Well-Platten sind unter Nummer 27 und in Abbildung 1 in Anlage 4 zu finden.
Kontrollen
22. Kontrollen mit Verdünnungswasser sind sowohl als Negativkontrolle als auch als Kontrolle innerhalb einer Platte erforderlich. Falls in der Plattenkontrolle mehr als ein toter Embryo vorgefunden wird, ist die Platte zu verwerfen, sodass sich die Anzahl der Konzentrationen, die zum Ableiten der LC50 verwendet wird, verringert. Wird eine komplette Platte verworfen, sind die beobachteten Wirkungen u. U. schwerer zu bewerten und zu unterscheiden, insbesondere, wenn es sich bei der verworfenen Platte um die Lösungsmittelkontrollplatte oder eine Platte handelt, bei der auch behandelte Embryonen betroffen sind. Im ersten Fall muss die Prüfung wiederholt werden. Im zweiten Fall kann der Wegfall einer kompletten Behandlungsgruppe aufgrund der Mortalität innerhalb der internen Kontrolle die Fähigkeit zur Bewertung der Wirkungen und zur Bestimmung der LC50-Werte beeinträchtigen.
23. Bei jeder geprüften Charge von Eiern wird eine Positivkontrolle bei einer festgelegten Konzentration von 4 mg/l 3,4-Dichloranilin durchgeführt.
24. Wird ein Lösungsmittel verwendet, wird eine zusätzliche Gruppe von 20 Embryonen dem Lösungsmittel auf einer separaten 24-Well-Platte ausgesetzt und dient somit als Lösungsmittelkontrolle. Damit der Test als akzeptabel gilt, sollte nachgewiesen werden, dass das Lösungsmittel weder signifikante Auswirkungen auf Schlüpfzeitpunkt oder Überlebensrate hat noch sich nachteilig auf die Embryonen auswirkt (siehe Nummer 8 Buchstabe c).
Beginn der Exposition und Dauer der Prüfung
25. Die Prüfung beginnt sobald wie möglich nach der Befruchtung der Eier und endet nach 96 Stunden Exposition. Die Embryonen sollten vor Beginn des Blastula-Stadiums oder spätestens im 16-Zellen-Stadium in die Prüflösungen eingetaucht werden. Um die Exposition baldmöglichst zu beginnen, wird mindestens die doppelte Anzahl der pro Behandlungsgruppe benötigten Eier randomisiert ausgewählt und spätestens 90 Minuten nach der Befruchtung in die jeweiligen Konzentrationen und Kontrollen gelegt (z.B. in 100 ml-Kristallisierschalen; die Eier sollten vollständig bedeckt sein).
26. Lebensfähige befruchtete Eier sollten von unbefruchteten Eiern getrennt und innerhalb von 180 Minuten nach der Befruchtung in 24-Well-Platten umgesetzt werden, die 24 Stunden lang vorkonditioniert und mit 2 ml/Well frisch zubereiteten Prüflösungen wieder befüllt wurden. Befruchtete Eier, die eine Spaltung durchlaufen und keine offensichtlichen Unregelmäßigkeiten während der Spaltung (z.B. Asymmetrie, Vesikelbildung) oder Verletzungen des Chorions zeigen, werden unter einem Stereomikroskop (vorzugsweise ≥ 30-fache Vergrößerung) ausgewählt. Siehe Abbildungen 1 und 3 in Anlage 3 und Abbildung 2 in Anlage 4 bezüglich Entnahme und Trennung der Eier.
Verteilung der Eier auf die 24-Well-Platten
27. Die Eier werden wie folgt auf die Well-Platten verteilt (siehe auch Abbildung 1 in Anlage 4):
Beobachtungen
28. An jedem geprüften Embryo werden folgende apikale Beobachtungen durchgeführt: Koagulation der Embryonen, fehlende Somitenbildung, fehlende Abtrennung des Schwanzes und fehlender Herzschlag (Tabelle 1). Anhand dieser Beobachtungen wird die Letalität bestimmt: Ein positiver Befund bei einer dieser Beobachtungen bedeutet, dass der Zebrabärblingsembryo tot ist. Darüber hinaus wird das Schlüpfen in den Behandlungs- und Kontrollgruppen nach 48 Stunden täglich protokolliert. Die Beobachtungen werden alle 24 Stunden bis zum Ende der Prüfung protokolliert.
Tabelle 1 Apikale Beobachtungen der akuten Toxizität in Zebrabärblingsembryonen 24 bis 96 Stunden nach der Befruchtung
| Expositionszeiten | ||||
| 24 Std. | 48 Std. | 72 Std. | 96 Std. | |
| Koagulierte Embryonen | + | + | + | + |
| Fehlende Somitenbildung | + | + | + | + |
| Fehlende Abtrennung des Schwanzes | + | + | + | + |
| Fehlender Herzschlag | + | + | + | |
29. Koagulation des Embryos: Die koagulierten Embryonen sind milchig weiß und erscheinen unter dem Mikroskop dunkel (siehe Abbildung 1 in Anlage 5). Die Anzahl der koagulierten Embryonen wird nach 24, 48, 72 und 96 Stunden bestimmt.
30. Fehlende Somitenbildung: Bei 26 ± 11 °C haben sich bei einem sich normal entwickelnden Zebrabärblingsembryo nach 24 Stunden ungefähr 20 Somiten (siehe Abbildung 2 in Anlage 5) entwickelt. Ein normal entwickelter Embryo zeigt spontane Bewegungen (Kontraktionen von Seite zu Seite). Spontane Bewegungen deuten auf die Bildung von Somiten hin. Das Fehlen von Somiten wird nach 24, 48, 72 und 96 Stunden protokolliert. Eine fehlende Somitenbildung nach 24 Stunden könnte auf eine allgemeine Entwicklungsverzögerung zurückzuführen sein. Die Somitenbildung sollte sich spätestens nach 48 Stunden zeigen. Ist dies nicht der Fall, werden die Embryonen als tot betrachtet.
31. Fehlende Abtrennung des Schwanzes: Bei einem sich normal entwickelnden Zebrabärblingsembryo wird die Abtrennung des Schwanzes (siehe Abbildung 3 in Anlage 5) vom Dotter nach der hinteren Verlängerung des Embryokörpers beobachtet. Die fehlende Abtrennung des Schwanzes wird nach 24, 48, 72 und 96 Stunden protokolliert.
32. Fehlender Herzschlag: Bei einem sich normal entwickelnden Zebrabärblingsembryo ist bei 26 ± 11 °C der Herzschlag nach 48 Stunden erkennbar (siehe Abbildung 4 in Anlage 5). Dieser Endpunkt ist besonders sorgfältig zu protokollieren, denn ein unregelmäßiger Herzschlag ist nicht als letal zu protokollieren. Darüber hinaus wird ein sichtbarer Herzschlag ohne Zirkulation in der Aorta abdominalis als nicht-letal betrachtet. Zur Protokollierung dieses Endpunkts sollten Embryonen, die keinen Herzschlag zeigen, mindestens eine Minute bei einer mindestens 80-fachen Vergrößerung beobachtet werden. Ein fehlender Herzschlag wird nach 48, 72 und 96 Stunden protokolliert.
33. Die Schlupfraten aller Behandlungs- und Kontrollgruppen sollten nach 48 Stunden protokolliert und berichtet werden. Das Schlüpfen ist zwar kein für die Berechnung des LC50-Werts verwendeter Endpunkt, gewährleistet aber die Exposition des Embryos ohne die potenzielle Barriere in Form des Chorions und kann daher die Interpretation der Daten vereinfachen.
34. Ausführliche Beschreibungen der normalen Entwicklung (35) und Beispiele einer anomalen Entwicklung von Zebrabärblingsembryonen sind den Anlagen 3 und 5 zu entnehmen.
Analytische Messungen
35. Am Anfang und am Ende der Prüfung werden pH-Wert, Gesamthärte und Leitfähigkeit in der bzw. den Kontrollen und in der höchsten Prüfchemikalienkonzentration gemessen. Bei semistatischen Erneuerungssystemen sollte der pH-Wert vor und nach der Erneuerung des Wassers gemessen werden. Die Konzentration an gelöstem Sauerstoff wird am Ende der Prüfung in den Negativkontrollen und in der höchsten Prüfkonzentration mit lebensfähigen Embryonen gemessen, wobei dies mit den Validitätskriterien der Prüfung im Einklang stehen sollte (siehe Nummer 8 Buchstabe f). Wird befürchtet, dass die Temperatur innerhalb der 24-Well-Platten schwanken könnte, so wird die Temperatur in drei randomisiert ausgewählten Gefäßen gemessen. Die Temperatur sollte während der Prüfung vorzugsweise kontinuierlich oder mindestens täglich protokolliert werden.
36. In einem statischen System sollte die Konzentration der Prüfchemikalie mindestens bei den höchsten und niedrigsten Prüfkonzentrationen, jedoch vorzugsweise in allen Behandlungsgruppen am Anfang und Ende der Prüfung gemessen werden. Für semistatische (Erneuerungs-)Tests, bei denen davon ausgegangen wird, dass die Konzentration der Prüfchemikalie innerhalb von ± 20 % der Nominalwerte bleibt, wird empfohlen, mindestens die höchsten und niedrigsten Prüfkonzentrationen nach der frischen Zubereitung und unmittelbar vor der Erneuerung zu analysieren. Bei Prüfungen, bei denen nicht davon ausgegangen wird, dass die die Konzentration der Prüfchemikalie innerhalb von ± 20 % der Nominalwerte bleibt, müssen alle Prüfkonzentrationen nach der frischen Zubereitung und unmittelbar vor der Erneuerung analysiert werden. Reicht das Volumen für die Analyse nicht aus, kann das Mischen der Prüflösungen oder die Verwendung von Surrogatkammern aus dem gleichem Material und mit dem gleichen Volumen/Oberflächen-Verhältnis wie 24-Well-Platten hilfreich sein. Die Ergebnisse sollten unbedingt auf gemessenen Konzentrationen basieren. Wenn die Konzentrationen nicht innerhalb von 80 bis 120 % der nominalen Konzentration bleiben, sollten die Konzentrationen, die eine Wirkung hervorrufen, relativ zum geometrischen Mittel der gemessenen Konzentrationen ausgedrückt werden; nähere Informationen sind Kapitel 5 des OECD Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures zu entnehmen (28).
Limit-Test
37. Nach den in dieser Prüfmethode beschriebenen Verfahren kann ein Limit-Test bei einer Konzentration der Prüfchemikalie von 100 mg/l oder an der Grenze ihrer Löslichkeit im Prüfmedium (je nachdem, welcher Wert niedriger ist) durchgeführt werden, um nachzuweisen, dass die LC50 über dieser Konzentration liegt. Der Limit-Test sollte an jeweils 20 Embryonen in der Behandlungsgruppe, in der Positivkontrolle und gegebenenfalls in der Lösungsmittelkontrolle sowie an 24 Embryonen in der Negativkontrolle durchgeführt werden. Wenn der Letalitätsprozentsatz bei der geprüften Konzentration die Mortalität in der Negativkontrolle (oder Lösungsmittelkontrolle) um 10 % überschreitet, sollte eine vollständige Prüfung durchgeführt werden. Alle beobachteten Wirkungen sollten protokolliert werden. Übersteigt die Mortalität in der Negativkontrolle (oder Lösungsmittelkontrolle) 10 %, so ist die Prüfung ungültig und sollte wiederholt werden.
Auswertung der Ergebnisse
38. Bei dieser Prüfung werden die einzelnen Wells für die statistische Analyse als unabhängige Replikate betrachtet. Die Prozentsätze der Embryonen, bei denen mindestens eine der apikalen Beobachtungen nach 48 und/oder 96 Stunden positiv ist, werden gegen die Prüfkonzentrationen aufgetragen. Zur Berechnung der Steigungen der Kurve, der LC50-Werte und der Konfidenzgrenzen (95 %) sollten geeignete statistische Methoden angewandt (38) und das OECD Guidance Document on Current Approaches in the Statistical Analysis of Ecotoxicity Data konsultiert werden (39).
Prüfbericht
39. Der Prüfbericht sollte folgende Angaben enthalten:
Prüfchemikalie:
Einkomponentiger Stoff:
Mehrkomponentiger Stoff, UVCB-Stoffe und Gemische:
Prüforganismen:
Prüfbedingungen:
Ergebnisse:
Eine eventuelle Abweichung von der Prüfmethode und entsprechende Erläuterungen.
Diskussion und Interpretation der Ergebnisse.
(1) OECD (2011) Validation Report (Phase 1) for the Zebrafish Embryo Toxicity Test: Part I and Part II. Series on Testing and Assessment No. 157, OECD, Paris.
(2) OECD (2012) Validation Report (Phase 2) for the Zebrafish Embryo Toxicity Test: Part I and Part II (Annexes). Series on Testing and Assessment No. 179, OECD, Paris.
(3) Braunbeck, T., Böttcher, M., Hollert, H., Kosmehl, T., Lammer, E., Leist, E., Rudolf, M. und Seitz, N. (2005) Towards an alternative for the acute fish LC50 test in chemical assessment: The fish embryo toxicity test goes multi-species-an update. ALTEX 22: 87-102.
(4) ISO (2007) Internationale Norm, Wasserbeschaffenheit - Bestimmung der akuten Toxizität von Abwasser auf Zebrafisch-Eier (Danio rerio). ISO 15088:2007(E) International Organization for Standardization.
(5) Nagel, R. (2002) DarT: The embryo test with the zebrafish (Danio rerio) - a general model in ecotoxicology and toxicology. ALTEX 19: 38-48.
(6) Schulte, C. und Nagel, R. (1994) Testing acute toxicity in embryo of zebrafish, Brachydanio rerio as alternative to the acute fish test - preliminary results. ATLA 22, 12-19.
(7) Bachmann, J. (2002) Development and validation of a teratogenicity screening test with embryos of the zebrafish (Danio rerio). Doktorarbeit, Technische Universität Dresden, Deutschland.
(8) Lange, M., Gebauer, W., Markl, J. und Nagel, R. (1995) Comparison of testing acute toxicity on embryo of zebrafish (Brachydanio rerio), and RTG-2 cytotoxicity as possible alternatives to the acute fish test. Chemosphere 30/11: 2087-2102.
(9) Knöbel, M., Busser, F.J.M., Rico-Rico, A., Kramer, N.I., Hermens, J.L.M., Hafner, C., Tanneberger, K., Schirmer, K., Scholz, S. (2012). Predicting adult fish acute lethality with the zebrafish embryo: relevance of test duration, endpoints, compound properties, and exposure concentration analysis. Environ. Sci. Technol. 46, 9690-9700.
(10) Kammann, U., Vobach, M. und Wosniok, W. (2006) Toxic effects of brominated indoles and phenols on zebrafish embryos. Arch. Environ. Contam. Toxicol., 51: 97-102.
(11) Groth, G., Kronauer, K. und Freundt, K.J. (1994) Effects of N,N-diemethylformamide and its degradation products in zebrafish embryos. Toxicol. In Vitro 8: 401-406.
(12) Groth, G., Schreeb, K., Herdt, V. und Freundt, K.J. (1993) Toxicity studies in fertilized zebrafish fish eggs treated with N-methylamine, N,N-dimethylamine, 2-aminoethanol, isopropylamine, aniline, N-methylaniline, N,N-dimethylaniline, quinone, chloroacetaldehyde, or cyclohexanol. Bull. Environ. Contam. Toxicol. 50: 878-882.
(13) Nguyen, L.T. und Janssen, C.R. (2001) Comparative sensitivity of embryo-larval toxicity assays with African catfish (Clarias gariepinus) and zebra fish (Danio rerio). Environ. Toxicol. 16: 566-571.
(14) Cheng, S.H., Wai, A.W.K., So, C.H. und Wu, R.S.S. (2000) Cellular and molecular basis of cadmium-induced deformities in zebrafish embryos. Environ. Toxicol. Chem. 19: 3024-3031.
(15) Belanger, S. E., Rawlings J. M. und Carr G. J. (2013). Use of Fish Embryo Toxicity Tests for the Prediction of Acute Fish Toxicity to Chemicals. Environmental Toxicology and Chemistry 32: 1768-1783.
(16) Lammer, E., Carr, G. J., Wendler, K., Rawlings, J. M., Belanger, S. E., Braunbeck, T. (2009) Is the fish embryo toxicity test (FET) with the zebrafish (Danio rerio) a potential alternative for the fish acute toxicity test? Comp. Biochem. Physiol. C Toxicol. Pharmacol.: 149 (2), 196-209
(17) Kapitel C.4: Biologische Abbaubarkeit - Bestimmung der "leichten" biologischen Abbaubarkeit.
(18) Kapitel C.29: Leichte biologische Abbaubarkeit, Bestimmung von CO2 in geschlossenen Flaschen (Head-Space-Test).
(19) Weigt, S., Huebler, N., Strecker, R., Braunbeck, T., Broschard, T.H. (2011) Zebrafish (Danio rerio) embryos as a model for testing proteratogens. Toxicology 281: 25-36.
(20) Weigt, S., Huebler, N., Strecker, R., Braunbeck, T., Broschard, T.H. (2012) Developmental effects of coumarin and the anticoagulant coumarin derivative warfarin on zebrafish (Danio rerio) embryos. Reprod. Toxicol. 33: 133-141.
(21) Incardona, J.P, Linbo, T.L., Scholz, N.L. (2011) Cardiac toxicity of 5-ring polycyclic aromatic hydrocarbons is differentially dependent on the aryl hydrocarbon receptor2 isoform during zebrafish development. Toxicol. Appl. Pharmacol. 257: 242-249.
(22) Kubota, A., Stegeman, J.J., Woodin, B.R., Iwanaga, T., Harano, R., Peterson, R.E., Hiraga, T., Teraoka, H. (2011) Role of zebrafish cytochrome P450 CYP1C genes in the reduced mesencephalic vein blood flow caused by activation of AHR2. Toxicol. Appl. Pharmacol. 253: 244-252.
(23) Kapitel C.48: Kurzzeit-Reproduktionstest an Fischen. Siehe Anlage 4a.
(24) Lammer, E., Kamp, H.G., Hisgen, V., Koch, M., Reinhard, D., Salinas, E.R., Wendlar, K., Zok, S., Braunbeck, T. (2009) Development of a flow-through system for the fish embryo toxicity test (FET) with zebrafish (Danio rerio). Toxicol. in Vitro 23: 1436-1442.
(25) Brown, R.S., Akhtar, P., Åkerman, J., Hampel, L., Kozin, I.S., Villerius, L.A., Klamer, H.J.C., (2001) Partition controlled delivery of hydrophobic substances in toxicity tests using poly(dimethylsiloxane) (PDMS) lms. Environ. Sci. Technol. 35, 4097-4102.
(26) Schreiber, R., Altenburger, R., Paschke, A., Küster, E. (2008) How to deal with lipophilic and volatile organic substances in microtiter plate assays. Environ. Toxicol. Chem. 27, 1676-1682.
(27) ISO (1996) Internationale Norm. Wasserbeschaffenheit - Bestimmung der akuten letalen Toxizität von Substanzen gegenüber einem Süßwasserfisch [Brachydanio rerio Hamilton-Buchanan (Teleostei, Cyprinidae)] ISO 7346-3: Durchflussverfahren. Verfügbar unter: [http://www.iso.org].
(28) OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Series on Testing and Assessment No. 23, OECD, Paris.
(29) Laale, H.W. (1977) The biology and use of zebrafish, Brachydanio rerio, in fisheries research. A literature review. J. Fish Biol. 10: 121-173.
(30) Westerfield, M. (2007) The zebrafish book: A guide for the laboratory use of zebrafish (Brachydanio rerio). 5th edition. Eugene, University of Oregon Press, Institute of Neuroscience, USA.
(31) Canadian Council on Animal Care (2005) Guidelines on: the Care and Use of Fish in Research, Teaching and Testing, ISBN: 0-919087-43-4 http://www.ccac.ca/Documents/Standards/Guidelines/Fish.pdf
(32) Europäische Kommission (2007) Empfehlung 2007/526/EG der Kommission vom 18. Juni 2007 mit Leitlinien für die Unterbringung und Pflege von Tieren, die für Versuche und andere wissenschaftliche Zwecke verwendet werden (Bekannt gegeben unter Aktenzeichen K(2007) 2525) [http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2007:197:0001:0089:DE:PDF]
(33) Europäische Union (2010) Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere. Amtsblatt der Europäischen Union, ABl. Nr. L 276 vom 20.10.2010 S. 33-79
http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:DE:PDF
(34) Nagel, R. (1986) Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio, Ham.-Buch.). J. Appl. Ichthyol. 2: 173-181.
(35) Kimmel, C.B., Ballard, W.W., Kimmel, S.R., Ullmann, B. und Schilling, T.F. (1995) Stages of embryonic development of the zebrafish. Dev. Dyn. 203: 253-310.
(36) Kapitel C.2: Daphnia sp.-Test auf akute Schwimmunfähigkeit.
(37) Weil, M., Scholz, S., Zimmer, M., Sacher, F., Duis, K. (2009) Gene expression analysis in zebrafish embryos: a potential approach to predict effect conentrations in the fish early life stage test. Environ. Toxicol. Chem. 28: 1970-1978
(38) ISO (2006) Internationale Norm. Wasserbeschaffenheit - Anleitung für die statistische Auswertung von Ökotoxizitätsdaten. ISO TS 20281. Verfügbar unter: [http://www.iso.org].
(39) OECD (2006) Guidance Document on Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application. Series on Testing and Assessment, No. 54. OECD, Paris.
(40) Braunbeck, T., Lammer, E., 2006. Detailed review paper "Fish embryo toxicity assays" . UBA-Bericht (Vertragsnummer 20385422), Deutsches Umweltbundesamt, Berlin. 298 ff.
| Definitionen | Anlage 1 |
Definitionen
Apikaler Endpunkt: Auslösen einer Wirkung auf Populationsebene.
Blastula: Zellbildung um den animalen Pol, die einen bestimmten Teil des Dotters abdeckt.
Chemikalie: Stoff oder Gemisch.
Durchflussprüfung: Prüfung mit einem kontinuierlichen Fluss der Prüflösungen durch das Prüfsystem während des Expositionszeitraums.
Epibolie: eine massive Proliferation von überwiegend epidermalen Zellen in der Gastrulationsphase des Embryos und deren Bewegung von der dorsalen zur ventralen Seite, wodurch die Schichten entodermaler Zellen in einem invaginationsähnlichen Prozess internalisiert werden und der Dotter in den Embryo integriert wird.
Haltungswasser: Wasser, in dem die adulten Fische gehalten werden.
Kontrolle innerhalb einer Platte: interne Kontrolle bestehend aus vier mit Verdünnungswasser befüllten Wells pro 24-Wells-Platte, um eine potenzielle Kontaminierung der Platten durch den Hersteller oder durch den Wissenschaftler während des Verfahrens sowie etwaige Wirkungen der Platte, die das Testergebnis möglicherweise beeinflussen (z.B. Temperaturgefälle), festzustellen.
IUPAC: International Union of Pure and Applied Chemistry - Internationale Union für reine und angewandte Chemie.
Mediane letale Konzentration (LC50): Konzentration einer Prüfchemikalie, die schätzungsweise auf 50 % der Prüforganismen während der Prüfdauer letal wirkt.
Prüfchemikalie: Stoff oder Gemisch, der bzw. das nach dieser Prüfmethode getestet wird.
Semistatische Erneuerungsprüfung: Prüfung mit regelmäßiger Erneuerung der Prüflösungen nach festgelegten Zeiträumen (z.B. alle 24 Stunden).
SMILES: Simplified Molecular Input Line Entry Specification.
Somit: In einem sich entwickelnden Wirbeltierembryo sind Somiten lateral zum Neuralrohr verteilte Mesodermmassen, die schließlich Dermis (Dermatom), Skelettmuskel (Myotom) und Wirbelsäule (Sklerotom) bilden.
Statische Prüfung: Prüfung, bei der die Prüflösungen während der Prüfdauer unverändert bleiben.
UVCB-Stoffe: Stoffe mit unbekannter oder schwankender Zusammensetzung, komplexe Reaktionsprodukte oder biologische Materialien.
| Versuchsbedingungen für den Fisch-Screening-Test zur Bestimmung endokriner Wirkungen | Anlage 2 |
| Zebrabärbling (Danio rerio) | ||
| Herkunft der Art | Indien, Myanmar, Malakka, Sumatra | |
| Sexualdimorphismus | Weibchen: vorgewölbter Bauch beim Tragen von Eiern
Männchen: schlanker, orangefarben mit blauen Längsstreifen (insbesondere an der Afterflosse sichtbar) | |
| Fütterungsregime | Trockenflocken (max. 3 % des Fischgewichts pro Tag) 3 bis 5-mal täglich; zusätzlich Salinenkrebse (Artemia), Nauplien und/oder kleine Daphnien in geeigneter Größe aus unkontaminierter Quelle. Es sollte möglichst Lebendfutter verwendet werden, da es für eine bessere Ausgestaltung des Lebensumfelds sorgt. Um eine optimale Wasserqualität sicherzustellen, sollten überschüssiges Futter und Exkremente ungefähr eine Stunde nach der Fütterung entfernt werden. | |
| Ungefähres Gewicht der adulten Fische | Weibchen: 0,65 ± 0,13 g Männchen: 0,5 ± 0,1 g | |
| Haltung der Elternfische | Beleuchtung | Leuchtstofflampen (breites Spektrum); 10-20 µE/m2/s, 540-1 080 lux oder 50-100 ft-c (Laborqualität); Fotoperiode von 12 bis 16 Stunden |
| Wassertemperatur | 26 ± 1 °C | |
| Wasserqualität | O2 ≥ 80 % Sättigung, Härte: z.B. ~30-300 mg/l CaCO3, NO3 -: ≤ 48 mg/l, NH4+ und NO2 -: < 0,001 mg/l, Restchlor < 10 µg/l, Gesamtgehalt an organischem Chlor < 25 ng/l, pH = 6,5-8,5 | |
| Weitere Wasserqualitätskriterien | Partikel < 20 mg/l, Gesamtgehalt an organischem Kohlenstoff < 2 mg/l, Gesamtgehalt an phosphororganischen Pestiziden < 50 ng/l, Gesamtgehalt an chlororganischen Pestiziden plus polychlorierten Biphenylen < 50 ng/l | |
| Beckengröße für die Haltung | z.B. 180 l, 1 Fisch/l | |
| Wasserreinigung | Permanent (mit Aktivkohlefilter); andere Möglichkeiten sind Kombinationen mit semistatischem Erneuerungssystem oder Durchflusssystem mit kontinuierlichem Wasseraustausch | |
| Für die Zucht empfohlenes Verhältnis Männchen/Weibchen | 2:1 (oder Massenlaichen) | |
| Laichbecken | z.B. 4 l-Becken mit Stahlgitterboden und künstlichen Pflanzen als Laichstimulans; externe Wärmematten oder Massenlaichen in den Haltungsbecken | |
| Struktur und Aussehen der Eier | Stabiles Chorion (d. h. hochtransparent, nicht klebrig, Durchmesser ~ 0,8-1,5 mm) | |
| Laichrate | Ein geschlechtsreifes Weibchen legt mindestens 50-80 Eier pro Tag. Je nach Stamm können die Laichraten erheblich höher sein. Die Befruchtungsrate sollte ≥ 70 % betragen. Bei Fischen, die zum ersten Mal laichen, können die Befruchtungsraten bei den ersten Laichen geringer sein. | |
| Prüfungstyp | Statisch, semistatische Erneuerung, Durchfluss, 26 ± 1°C, 24 Stunden konditionierte Prüfkammern (z.B. 24-Well-Platten, 2,5-5 ml pro Mulde) | |
| Normale Entwicklung von Zebrabärblingen bei 26 °C | Anlage 3 |
Abb. 1: Ausgewählte Stufen der frühen Entwicklung von Zebrabärblingen (Danio rerio): 0,2-1,75 Stunden nach der Befruchtung (aus Kimmel et al., 1995 (35)). Anhand des zeitlichen Ablaufs einer normalen Entwicklung kann die Befruchtung und Lebensfähigkeit der Eier beurteilt werden (siehe Nummer 26: Auswahl der befruchteten Eier).
Abb. 2: Ausgewählte Stufen der späten Entwicklung von Zebrabärblingen (Danio rerio) (entchorionierter Embryo zur besseren Veranschaulichung): 22-48 Stunden nach der Befruchtung (aus Kimmel et al., 1995 (35)).
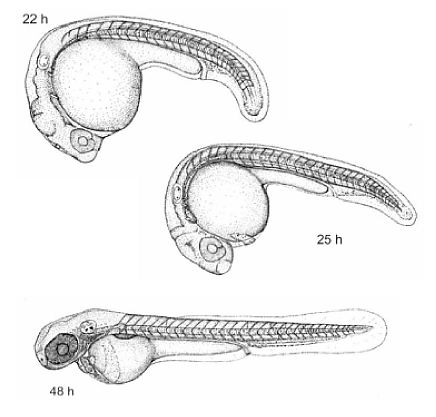
Abb. 3: Normale Entwicklung von Zebrabärblingsembryonen (Danio rerio): (1) 0,75 Stunden, 2-Zellen- Stadium; (2) 1 Stunde, 4-Zellen-Stadium; (3) 1,2 Stunden, 8-Zellen-Stadium; (4) 1,5 Stunden, 16-Zellen-Stadium; (5) 4,7 Stunden, beginnende Epibolie; (6) 5,3 Stunden, ca. 50 % Epibolie (aus Braunbeck & Lammer 2006 (40)).
| Anlage 4 |
Abb. 1 Einteilung von 24-Well-Platten

1-5 = fünf Prüfkonzentrationen/Chemikalie;
nC = Negativkontrolle (Verdünnungswasser);
iC = Kontrolle innerhalb einer Platte (Verdünnungswasser);
pC = Positivkontrolle (3,4-DCA 4mg/l);
sC = Lösungsmittelkontrolle
Abb. 2 Schema der Toxizitätsprüfung an Embryonen von Zebrabärblingen (von links nach rechts): Produktion der Eier, Entnehmen der Eier, Präexposition unmittelbar nach der Befruchtung in Glasgefäßen, Auswahl der befruchteten Eier unter einem Invers- oder Stereomikroskop und Verteilung der befruchteten Eier auf die 24-Well-Platten mit den Prüfkonzentrationen bzw. Kontrollen, n = Anzahl der erforderlichen Eier pro Prüfkonzentration/Kontrolle (hier 20), hpf = Stunden nach Befruchtung.
| Atlas der letalen Endpunkte für die Prüfung auf akute Toxizität an Embryonen von Zebrabärblingen | Anlage 5 |
Die folgenden apikalen Endpunkte deuten auf akute Toxizität und somit den Tod der Embryonen hin: Koagulation des Embryos, fehlende Abtrennung des Schwanzes, fehlende Somitenbildung und fehlender Herzschlag. Die folgenden mikroskopischen Aufnahmen wurden zur Veranschaulichung dieser Endpunkte ausgewählt.
Abb. 1 Koagulation des Embryos:
Unter Hellfeldbeleuchtung weisen koagulierte Zebrabärblingsembryonen verschiedene nichttransparente Einschlüsse auf.
Abb. 2 Fehlende Somitenbildung:
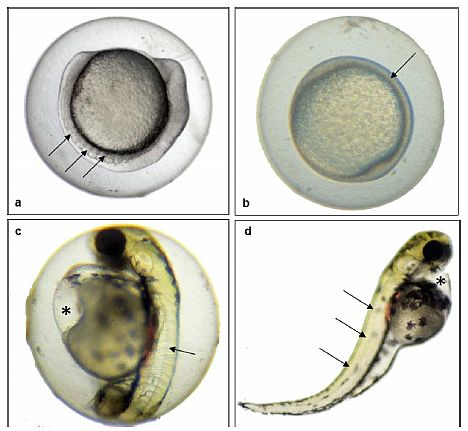
Obwohl es um ca. 10 Stunden entwicklungsverzögert ist, zeigt der 24 Stunden alte Zebrabärblingsembryo in a) gut entwickelte Somiten (→), während der Embryo in b) keine Anzeichen einer Somitenbildung aufweist (→). Obwohl es ein ausgeprägtes Dottersacködem aufweist (*), zeigt der 48 Stunden alte Zebrabärblingsembryo in c) eine deutliche Somitenbildung (→), während der 96 Stunden alte Zebrabärblingsembryo in d) keine Anzeichen einer Somitenbildung zeigt (→). Ferner sind die Wirbelsäulenverkrümmung (Skoliose) und das perikardiale Ödem * in dem Embryo in d) zu beachten
Abb. 3 Fehlende Abtrennung der Schwanzknospe in der Seitenansicht
(a: →; 96 Stunden alter Zebrabärblingsembryp). Zu beachten ist auch die fehlende Augenknospe *
Abb. 4 Fehlender Herzschlag
Fehlender Herzschlag ist definitionsgemäß in einer mikroskopischen Aufnahme schwer darzustellen. Ein fehlender Herzschlag wird durch Nichtzucken des Herzens angezeigt (Doppelpfeil). Die Unbeweglichkeit der Blutzellen, z.B.in der Aorta abdominalis (→ im Insert), ist kein Hinweis auf einen fehlenden Herzschlag. Zu beachten ist auch die fehlende Somitenbildung bei diesem Embryo *, Muskelgewebe erscheinen homogen statt segmental). Die Beobachtungszeit zur Protokollierung eines fehlenden Herzschlags sollte mindestens eine Minute bei einer mindestens 80-fachen Vergrößerung betragen.
C.50 Sedimentfreier Myriophyllum spicatum-Toxizitätstest 17
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie 238 (2014). Sie dient zur Beurteilung der Toxizität von Chemikalien bei Myriophyllum spicatum, einer submersen zweikeimblättrigen Wasserpflanzenart, die der Familie der Tausendblattgewächse angehört. Sie basiert auf einer vorhandenen Prüfmethode nach ASTM (1), die in ein sedimentfreies Testsystem abgeändert wurde (2), um die intrinsische Ökotoxizität von Prüfchemikalien zu schätzen (unabhängig vom Verhalten der Prüfchemikalie in Bezug auf die Verteilung zwischen Wasser und Sediment). Ein sedimentfreies Testsystem weist eine geringe analytische Komplexität auf (nur in der Wasserphase). Die Ergebnisse können parallel zu denjenigen aus dem Lemna sp.-Test (3) analysiert oder hiermit verglichen werden; ferner können dank der erforderlichen sterilen Bedingungen die Wirkungen von Mikroorganismen und Algen (Aufnahme/Abbau der Chemikalie usw.) möglichst gering gehalten werden. Diese Prüfung stellt keinen Ersatz für andere aquatische Toxizitätstests dar, sondern sollte als Ergänzung solcher Tests verwendet werden, sodass eine umfassendere Gefahren- und Risikobewertung im Hinblick auf Wasserpflanzen möglich ist. Die Prüfmethode wurde in einem Ringtest validiert (4).
2. Die Durchführung von Tests sowohl mit Erneuerung der Testlösung (semistatisch) als auch ohne Erneuerung der Testlösung (statisch) wird detailliert beschrieben. Abhängig von den Zielsetzungen der Tests sowie von rechtlichen Anforderungen wird der Einsatz von semistatischen Methoden empfohlen, z.B. für Stoffe, die durch Verflüchtigung, Adsorption, Photoabbau, Hydrolyse, Ausfällung oder biologischen Abbau rasch verloren gehen. Weitere Informationen sind Quelle (5) zu entnehmen. Diese Methode gilt für Stoffe, bei denen die Prüfmethode validiert wurde (siehe Ringtest-Bericht (4)), oder für Formulierungen oder bekannte Gemische; wird ein Gemisch geprüft, sollten dessen Komponenten soweit wie möglich identifiziert und quantifiziert werden. Die sedimentfreie Myriophyllum spicatum-Prüfmethode ergänzt den Myriophyllum spicatum-Toxizitätstest im Wassersediment (6). Bevor die Prüfmethode für die Prüfung eines Gemischs zu gesetzgeberischen Zwecken eingesetzt wird, sollte geprüft werden, ob, und falls ja, warum, sie für diesen Zweck geeignete Ergebnisse liefert. Solche Erwägungen entfallen, wenn die Prüfung des Gemischs von Rechts wegen vorgeschrieben ist.
3. Kontinuierlich wachsende Pflanzenkulturen von Myriophyllum spicatum (nur in modifiziertem Andrews-Medium, siehe Anlage 2) lässt man als Monokulturen in verschiedenen Konzentrationen der Prüfchemikalie über einen Zeitraum von 14 Tagen in einem sedimentfreien Testsystem wachsen. Ziel der Prüfung ist es, die durch die Chemikalie bedingten Auswirkungen auf das Pflanzenwachstum während dieses Zeitraums basierend auf der Auswertung ausgewählter Messvariablen zu quantifizieren. Die Messvariablen sind das Wachstum der Sprosslänge, der Seitenäste und der Wurzeln, die Entwicklung der Frisch- und Trockenmasse und die Zunahme der Wirtel. Darüber hinaus werden markante qualitative Veränderungen der Testorganismen berücksichtigt, wie z.B. Deformation oder Chlorose oder Nekrose, was sich als Gelbfärbung oder weißbraune Verfärbung zeigt. Um die durch die Chemikalie bedingten Auswirkungen zu quantifizieren, wird das Wachstum in den Testlösungen mit dem Wachstum der Kontrollpflanzen verglichen. Ferner wird die Konzentration, die eine festgelegte Wachstumshemmung von x % hervorruft, bestimmt und als ECx ausgedrückt; "x" kann ein beliebiger Wert je nach regulatorischen Anforderungen sein, z.B. EC10, EC20, EC50. Es ist zu beachten, dass Schätzungen der EC10- und EC20-Werte nur in Tests zuverlässig und angemessen sind, bei denen die für die Kontrollpflanzen bestimmten Variationskoeffizienten unter dem zu schätzenden Wirkungsniveau liegen, d. h. die Variationskoeffizienten sollten für die zuverlässige Schätzung eines EC20-Werts < 20 % sein.
4. Sowohl die durchschnittliche Wachstumsrate (geschätzt aus Bewertungen der Hauptsprosslänge und drei weiteren Messvariablen) als auch der Zuwachs (geschätzt aus der Zunahme der Hauptsprosslänge und drei weiteren Messvariablen) der unbehandelten und behandelten Pflanzen sollten bestimmt werden. Anhand der spezifischen Wachstumsrate (r) und des Zuwachses (y) werden anschließend ErCx (z.B. ErC10, ErC20, ErC50) bzw. EyCx (z.B. EyC10, EyC20, EyC50) bestimmt.
5. Außerdem können die niedrigste Konzentration mit beobachteter Wirkung (LOEC) und die höchste geprüfte Konzentration ohne beobachtete Wirkung (NOEC) statistisch bestimmt werden.
6. Es sollte eine Analysemethode mit geeigneter Empfindlichkeit für die Quantifizierung der im Prüfmedium enthaltenen Prüfchemikalie verfügbar sein. Zur Festlegung der Testbedingungen hilfreiche Informationen zur Prüfchemikalie sind die Strukturformel, die Reinheit und Verunreinigungen, die Wasserlöslichkeit, die Stabilität in Wasser, die Lichtbeständigkeit, die Säuredissoziationskonstante (pKa), der Octanol/Wasser-Verteilungskoeffizient (Kow), der Dampfdruck und die biologische Abbaubarkeit. Aus der Wasserlöslichkeit und dem Dampfdruck kann die Henry-Konstante berechnet werden, aus der zu entnehmen ist, ob während der Testdauer erhebliche Verluste der Prüfchemikalie zu erwarten sind. Die Konstante gibt Aufschluss darüber, ob bestimmte Maßnahmen zur Überwachung dieser Verluste durchgeführt werden sollten. Wenn zur Löslichkeit und zur Stabilität der Prüfchemikalie keine zuverlässigen Informationen vorliegen, sollten diese Merkmale unter den Testbedingungen (Nährmedium, Temperatur und Beleuchtung) untersucht werden.
7. Der Einhaltung des pH-Werts des Prüfmediums kommt besondere Bedeutung zu, z.B. beim Testen von Metallen oder hydrolytisch instabilen Stoffen. Weitere Hinweise zur Prüfung von Chemikalien mit physikalisch-chemischen Merkmalen, welche die Durchführung des Tests erschweren, sind dem OECD Guidance Document (5) zu entnehmen.
8. Die Testergebnisse sind gültig, wenn die Zeit bis zur Verdopplung der Hauptsprosslänge in der Kontrolle weniger als 14 Tage beträgt. Für die Medien und Testbedingungen gemäß dieser Prüfmethode kann dieses Kriterium mit dem Prüfprotokoll eines statischen oder semistatischen Tests erfüllt werden.
9. Der mittlere Variationskoeffizient für den Zuwachs basierend auf Messungen der Sprossfrischmasse (d. h. von Testbeginn bis Testende) und den zusätzlichen Messvariablen (siehe Nummer 37) bei den Kontrollkulturen beträgt maximal 35 % zwischen Replikaten.
10. Mehr als 50 % der Replikate der Kontrollgruppe werden über den Expositionszeitraum von 14 Tagen steril gehalten, was bedeutet, dass sie sichtbar frei von Verunreinigung durch andere Organismen wie z.B. Algen, Pilze und Bakterien sind (klare Lösung). Hinweis: Leitlinien für die Bewertung der Sterilität sind dem Ringtest-Bericht zu entnehmen (4).
11. Um das Prüfverfahren zu testen, können Referenzchemikalien, wie z.B. das im Ringtest (4) verwendete 3,5-Dichlorphenol, geprüft werden; auf der Grundlage der Daten aus dem Ringtest liegen die mittleren EC50-Werte von 3,5-DCP für die verschiedenen Reaktionsvariablen (siehe Nummern 37-41 dieser Prüfmethode) zwischen 3,2 mg/l und 6,9 mg/l (siehe Ringtest-Bericht bezüglich des Konfidenzintervalls für diese Werte). Die Referenzchemikalien sollten mindestens zweimal jährlich bzw. - wenn die Tests seltener durchgeführt werden - gleichzeitig mit der Bestimmung der Toxizität einer Prüfchemikalie getestet werden.
Apparatur
12. Sämtliche Geräte, die mit dem Prüfmedium in Berührung kommen, müssen aus Glas oder einem sonstigen chemisch inerten Material bestehen. Die zur Kultivierung und für die Tests verwendeten Glasgeräte müssen steril sein und von chemischen Verunreinigungen befreit werden, die in das Prüfmedium gelangen könnten. Die Prüfgefäße müssen so lang sein, dass die Sprosse in den Kontrollgefäßen in der Wasserphase wachsen können, ohne die Oberfläche des Prüfmediums am Ende der Testdauer zu erreichen. Empfohlen werden dickwandige Teströhrchen aus Borosilikatglas ohne Lippe mit einem Innendurchmesser von ca. 20 mm und einer Länge von ungefähr 250 mm mit Aluminiumkappen.
13. Da das modifizierte Andrews-Medium Saccharose enthält (die das Wachstum von Pilzen und Bakterien anregt), müssen die Testlösungen unter sterilen Bedingungen zubereitet werden. Alle Flüssigkeiten und Geräte werden vor dem Gebrauch sterilisiert. Die Sterilisation wird durch Behandlung mit erhitzter Luft (2101 °C) über einen Zeitraum von 4 Stunden oder durch 20-minütiges Autoklavieren bei 1211 °C durchgeführt. Darüber hinaus werden alle Flaschen, Gefäße, Schalen usw. sowie sonstige Geräte unmittelbar vor der Verwendung einer Flammbehandlung auf einem sterilen Arbeitstisch unterzogen.
14. Kulturen und Prüfgefäße dürfen nicht zusammen gelagert werden. Daher werden am besten getrennte Wachstumskammern bzw. getrennte Inkubatoren verwendet oder getrennte Räume genutzt. Beleuchtung und Temperatur sollten zu regeln sein, und für Beleuchtung und Temperatur müssen gleichbleibende Werte aufrechterhalten werden können.
Testorganismus
15. Myriophyllum spicatum - eine submerse zweikeimblättrige Wasserpflanze - gehört zur Familie der Tausendblattgewächse. Zwischen Juni und August ragen unscheinbare rosaweiße Blüten aus dem Wasser hervor. Die Pflanzen sind im Boden mit einem System aus robusten Rhizomen verwurzelt. Sie sind auf der gesamten Nordhalbkugel in eutrophischen, jedoch unverschmutzten und kalkhaltigeren Stillgewässern mit schlammigem Untergrund anzutreffen. Myriophyllum spicatum bevorzugt Süßwasser, ist aber auch in Brackwasser zu finden.
16. Für den sedimentfreien Toxizitätstest sind sterile Pflanzen erforderlich. Wenn das Prüflabor nicht über reguläre Myriophyllum spicatum-Kulturen verfügt, kann steriles Pflanzenmaterial bei anderen Labors bezogen werden oder (unsteriles) Pflanzenmaterial aus der Natur entnommen oder von einem kommerziellen Lieferanten geliefert werden; stammen die Pflanzen aus der Natur, sollte eine taxonomische Überprüfung der Spezies ins Auge gefasst werden. Bei Entnahme aus der Natur oder im Falle der Lieferung durch einen kommerziellen Lieferanten sollten die Pflanzen sterilisiert (1) und mindestens acht Wochen vor der Verwendung in dem Medium kultiviert werden, das auch für die Tests verwendet wird. Orte in der freien Natur, aus denen die Ausgangskulturen entnommen werden, dürfen keinen offensichtlichen Quellen von Verunreinigungen ausgesetzt sein. Bei der Entnahme von Myriophyllum spicatum aus der Natur, insbesondere in Regionen, wo es zu Hybridisierungen mit anderen Myriophyllum-Arten kommen könnte, sollte unbedingt sichergestellt werden, dass die richtige Art entnommen wird. Wenn die Kulturen aus einem anderen Labor bezogen werden, sollten sie mindestens drei Wochen unter ähnlichen Bedingungen kultiviert werden. Die Herkunft des Pflanzenmaterials und die Arten, die für die Tests verwendet werden, sind systematisch zu protokollieren.
17. Qualität und Einheitlichkeit der für die Tests verwendeten Pflanzen haben erhebliche Auswirkungen auf das Ergebnis der Tests; entsprechend sorgfältig müssen die Pflanzen ausgewählt werden. Nach Möglichkeit sollten junge, rasch wachsende Pflanzen ohne sichtbare Läsionen oder Verfärbungen (Chlorose) verwendet werden. Anlage 4 enthält nähere Informationen über die Vorbereitung des Testorganismus.
Kultivierung
18. Um den Kultivierungsaufwand zu reduzieren (z.B. wenn über einen bestimmten Zeitraum keine Tests mit Myriophyllum vorgesehen sind), können die Kulturen bei verringerter Beleuchtung und niedrigerer Temperatur (50 µE m-2 s-1, 20 ± 21 °C) gelagert werden. Nähere Informationen zur Kultivierung sind Anlage 3 zu entnehmen.
19. Mindestens 14-21 Tage vor Durchführung der Prüfung wird eine hinreichende Anzahl an Testorganismen keimfrei in ein frisches steriles Medium überführt und 14-21 Tage unter Testbedingungen als Vorkultur kultiviert. Anlage 4 enthält nähere Informationen über die Herstellung einer Vorkultur.
Prüfmedium
20. Für Myriophyllum spicatum in einem sedimentfreien Testsystem, wie in Anlage 2 beschrieben, wird nur ein Nährmedium empfohlen. Für die Kultivierung und Prüfung mit Myriophyllum spicatum wird ein modifiziertes Andrews-Medium empfohlen, wie in (1) beschrieben. Das modifizierte Andrews-Medium wird aus fünf separat zubereiteten Stamm-Nährlösungen mit Zugabe von 3 % Saccharose hergestellt. Anlage 2 enthält nähere Informationen über die Zubereitung des Mediums.
21. Für die Herstellung der Testlösungen (gegebenenfalls durch Verdünnung) wird ein 10-fach konzentriertes modifiziertes Andrews-Medium benötigt. Die Zusammensetzung dieses Mediums ist Anlage 2 zu entnehmen.
Testlösungen
22. Die Testlösungen werden gewöhnlich durch Verdünnung einer Stammlösung hergestellt. Zum Herstellen von Stammlösungen der Prüfchemikalie wird die Chemikalie im Allgemeinen in entmineralisiertem (d. h. entionisiertem oder destilliertem Wasser) gelöst. Die Zugabe der Nährstoffe wird durch Verwendung des 10-fach konzentrierten modifizierten Andrews-Mediums erreicht.
23. Die Stammlösungen der Prüfchemikalie können durch 20-minütiges Autoklavieren bei 1211 °C oder durch sterile Filtration sterilisiert werden, vorausgesetzt, dass die Prüfchemikalie durch die verwendete Sterilisationsmethode nicht denaturiert wird. Die Testlösungen können auch in sterilem entmineralisiertem Wasser oder Medium unter sterilen Bedingungen zubereitet werden. Bei der Auswahl der Sterilisationsmethode für die Stammlösungen der Prüfchemikalie sollten die thermische Stabilität und die Adsorption an verschiedenen Oberflächen berücksichtigt werden. Daher wird empfohlen, die Stammlösungen unter sterilen Bedingungen, d. h. unter Verwendung von sterilem Material für die Lösung der Prüfchemikalie unter sterilen Bedingungen (z.B. Flammsterilisation, Laminar-Flow-Hauben usw.) in sterilem Wasser, zuzubereiten. Diese Methode für die Zubereitung von sterilen Stammlösungen gilt sowohl für Stoffe als auch für Gemische.
24. Die höchste getestete Konzentration der Prüfchemikalie sollte in der Regel die Wasserlöslichkeit der Chemikalie bei den jeweiligen Testbedingungen nicht überschreiten. Bei Prüfchemikalien mit geringer Wasserlöslichkeit muss unter Umständen mit einem organischen Lösungsmittel oder einem Dispergiermittel eine konzentrierte Stammlösung oder eine Dispersion der Chemikalie hergestellt werden, damit die exakten Mengen der Prüfchemikalie zum Prüfmedium leichter hinzugegeben werden können und die Dispergierung und die Auflösung der Chemikalie begünstigt wird. Die Verwendung dieser Materialien sollte unbedingt vermieden werden. Durch die Verwendung von Lösungs- oder Dispergiermitteln sollte keine Phytotoxizität entstehen. Häufig verwendete Lösungsmittel, die bei Konzentrationen bis zu 100 µl/l keine phytotoxische Wirkung haben, sind z.B. Aceton und Dimethylformamid. Wenn ein Lösungsmittel oder ein Dispergiermittel verwendet wird, muss die Endkonzentration protokolliert und auf ein Minimum (≤ 100 µl/l) beschr´nkt werden; alle behandelten Proben und die Kontrollproben müssen das Lösungsmittel bzw. das Dispergiermittel in derselben Konzentration enthalten. Weitere Informationen zur Verwendung von Dispergiermitteln sind Quelle (5) zu entnehmen.
Test- und Kontrollgruppen
25. Die vorherige Kenntnis der Toxizität der Prüfchemikalie für Myriophyllum spicatum aufgrund eines Tests zur Bestimmung des Konzentrationsbereichs erleichtert die Auswahl geeigneter Testkonzentrationen. Beim definitiven Toxizitätstest werden in der Regel fünf (wie im Lemna-Wachstumsinhibitionstest, Kapitel C.26 dieses Anhangs) bis sieben Testkonzentrationen in einer geometrischen Reihe angeordnet; sie sollten so gewählt werden, dass die NOEC- und EC50-Werte im Konzentrationsbereich liegen (siehe unten). Die Testkonzentrationen sollten sich um einen Faktor von höchstens 3,2 unterscheiden; bei einer schwachen Steigung der Konzentrations-Wirkungs-Kurve kommen jedoch auch höhere Werte in Betracht. Die Verwendung von weniger als fünf Konzentrationen muss begründet werden. Für jede Testkonzentration sind mindestens fünf Replikate zu verwenden.
26. Beim Festlegen des Testkonzentrationsbereichs (zur Dosisfindung und/oder für den definitiven Toxizitätstest) sind folgende Punkte zu berücksichtigen:
Um ein angemessenes Konfidenzintervall sicherzustellen, müssen bei der Bestimmung eines ECx-Wertes die Testkonzentrationen so gewählt werden, dass der ECx-Wert darin eingeschlossen ist. Bei der Ermittlung von EC50 beispielsweise muss die höchste Testkonzentration größer als der EC50-Wert sein. Wenn der EC50-Wert außerhalb des Testkonzentrationsbereichs liegt, sind die entsprechenden Konfidenzintervalle groß, und das verwendete statistische Modell ist eventuell nicht geeignet.
Wenn die LOEC- oder NOEC-Werte bestimmt werden sollen, muss die niedrigste Testkonzentration so gering sein, dass das Wachstum nicht signifikant kleiner als das Wachstum der Kontrollgruppe ist. Außerdem muss die höchste Testkonzentration so hoch sein, dass das Wachstum signifikant geringer ist als das Wachstum der Kontrollgruppe. Andernfalls muss der Test mit einem anderen Konzentrationsbereich wiederholt werden (wenn die höchste Konzentration nicht an der Löslichkeitsgrenze bzw. bei der höchstens erforderlichen Grenzkonzentration [z.B. 100 mg/l] liegt).
27. Die Tests beinhalten jeweils Kontrollen, bei denen das gleiche Nährmedium, der gleiche Testorganismus (Wahl des Pflanzenmaterials so homogen wie möglich, frische Seitenäste aus Vorkulturen, gekürzt auf 2,5 cm ab Stängel) und die gleichen Umgebungsbedingungen und Verfahren wie in den Prüfgefäßen gegeben sind und nur die Prüfchemikalie fehlt. Wenn ein zusätzliches Lösungs- oder Dispergiermittel verwendet wird, muss eine zusätzliche Kontrolle mit der gleichen Konzentration des Lösungs-/Dispergiermittels wie in den Prüfansätzen getestet werden. Die Anzahl der Kontrollgefäße zur Durchführung von Replikaten (sowie gegebenenfalls der Lösungsmittelgefäße) muss mindestens zehn betragen.
28. Wenn die NOEC nicht bestimmt werden muss, kann das Prüfprotokoll geändert werden, indem die Anzahl der Konzentrationen erhöht und die Anzahl der Replikate je Konzentration verringert wird. Allerdings sollten in jedem Fall mindestens zehn Kontrollreplikate verwendet werden.
Exposition
29. Frische Seitenäste aus der Vorkultur, die auf 2,5 cm ab Stängel gekürzt wurden, werden den Prüfgefäßen randomisiert unter keimfreien Bedingungen zugeordnet; jedes Gefäß sollte einen 2,5 cm langen Seitenast mit einem Apikalmeristem an einem Ende enthalten. Das gewählte Pflanzenmaterial sollte in allen Prüfgefäßen die gleiche Qualität aufweisen.
30. Die Prüfgefäße müssen randomisiert im Inkubator angeordnet werden, um die Auswirkungen räumlich unterschiedlicher Lichtintensitäten und Temperaturen zu minimieren. Außerdem sind die Gefäße blockweise anzuordnen oder zufällig umzustellen (oder häufiger umzustellen), wenn die Messungen vorgenommen werden.
31. Wenn aufgrund eines Tests zur vorläufigen Charakterisierung der Stabilität anzunehmen ist, dass die Prüfchemikalienkonzentration nicht über die gesamte Testdauer (14 Tage) aufrechterhalten werden kann (d. h. wenn die gemessene Konzentration unter 80 % der gemessenen Ausgangskonzentration fällt), wird ein semistatischer Test empfohlen. In diesem Fall sollten die Pflanzen während des Tests mindestens einmal (z.B. an Tag 7) in frisch hergestellte Test- und Kontrolllösungen gegeben werden. Wie häufig eine Exposition gegenüber dem frischen Medium erfolgt, hängt von der Stabilität der Prüfchemikalie ab. Bei sehr instabilen oder flüchtigen Chemikalien ist unter Umständen eine häufigere Exposition erforderlich, um die Konzentrationen annähernd konstant zu halten.
32. Das Expositionsszenario beim Besprühen wird in dieser Prüfmethode nicht berücksichtigt.
Prüfbedingungen
33. Durch fluoreszierende Beleuchtung mit warmem und/oder kaltweißem Licht wird eine Bestrahlungsstärke hergestellt, die bei Messung unter photosynthetisch aktiver Strahlung (400-700 nm) an Punkten jeweils in demselben Abstand von der Lichtquelle wie der Boden der Prüfgefäße bei ca. 100-150 µE m-2 s-1 liegt (entsprechend etwa 6.000-9.000 lx). Es wird ein Hell-/Dunkel-Zyklus von 16 Stunden Licht und 8 Stunden Dunkelheit verwendet. Dabei ist zu beachten, dass die Messwerte von der Methode zur Feststellung und zur Messung der Lichtintensität (insbesondere vom Sensortyp) abhängen. Kugelförmige Sensoren (die auf Licht aus allen Winkeln über und unter der Messebene reagieren) sowie "Kosinus" -Sensoren (die auf Licht aus allen Winkeln über der Messebene ansprechen) sind gegenüber unidirektionalen Sensoren zu bevorzugen, da diese Sensoren bei Mehrpunkt-Lichtquellen des hier beschriebenen Typs höhere Messwerte ergeben.
34. Die Temperatur der Prüfgefäße beträgt 23 ± 21 °C. Erhöhte Sorgfalt ist bei der Beurteilung von Verschiebungen des pH-Wertes in Sonderfällen geboten (z.B. beim Testen instabiler Chemikalien oder beim Testen von Metallen). Der pH-Wert sollte im Bereich von 6-9 bleiben. Weitere Informationen in diesem Zusammenhang sind Quelle (5) zu entnehmen.
Dauer
35. Die Prüfung wird 14 Tage nach Einsetzen der Pflanzen in die Prüfgefäße beendet.
Messungen und analytische Bestimmungen
36. Bei Beginn der Prüfung beträgt die Hauptsprosslänge des Testorganismus 2,5 cm (siehe Nummer 29). Sie wird mit einem Lineal (siehe Anlage 4) oder durch Fotografie und Bildanalyse gemessen. Die Hauptsprosslänge des normal oder anomal aussehenden Testorganismus ist am Anfang der Prüfung, mindestens einmal während der 14-tägigen Expositionsdauer und am Ende der Prüfung zu bestimmen. Hinweis: Ist eine Bildanalyse nicht möglich, kann alternativ, sofern der Arbeitstisch vor der Zugabe der Pflanzen in die Prüfgefäße sterilisiert wird, ein steriles Lineal zum Messen der Hauptsprosslänge am Anfang und Ende der Prüfung verwendet werden. Änderungen in der Entwicklung der Pflanzen, z.B. Deformation der Sprosse, Änderungen des Aussehens, Anzeichen für eine Nekrose, Chlorose, Aufwölbungen oder der Verlust der Schwimmfähigkeit sowie Veränderungen der Wurzellänge oder der sonstigen Beschaffenheit der Wurzeln, sind zu protokollieren. Wesentliche Merkmale des Prüfmediums (z.B. Vorliegen nicht gelösten Materials oder Algen-, Pilz- oder Bakterienwachstum im Prüfgefäß) werden ebenfalls vermerkt.
37. Ergänzend zur Ermittlung der Hauptsprosslänge während der Prüfung sind auch die Auswirkungen der Prüfchemikalie auf drei (oder mehrere) der folgenden Messvariablen zu bewerten:
Hinweis 1: Die Beobachtungen während des Dosisfindungstests könnten bei der Auswahl der relevanten zusätzlichen Messungen aus den sechs oben genannten Messvariablen helfen.
Hinweis 2: Die Frisch- und Trockenmasse (Parameter iv und v) sollten unbedingt bestimmt werden.
Hinweis 3: Aufgrund der Tatsache, dass sich Saccharose und Licht (Exposition der Wurzeln gegenüber Licht während des Tests) auf Auxin (Pflanzenwachstumshormon)-Träger auswirken können und einige Chemikalien eine auxinähnliche Wirkungsweise haben, ist fraglich, ob die wurzelbezogenen Endpunkte (Parameter iii) einbezogen werden sollten.
Hinweis 4: Die Ringtest-Ergebnisse zeigen hohe Variationskoeffizienten (> 60 %) für die Gesamtseitenastlänge (Parameter i). Die Gesamtseitenastlänge liegt in jedem Fall innerhalb der Messung der Gesamtsprosslänge (Parameter ii), die akzeptablere Variationskoeffizienten < 30 % zeigt.
Hinweis 5: Auf der Grundlage der vorstehenden Erwägungen ergeben sich die folgenden empfohlenen Hauptendpunkte: Gesamtsprosslänge, Frisch- und Trockenmasse (Parameter ii, iv und v); Parameter vi (Anzahl der Wirteln) bleibt dem Ermessen des Versuchsleiters überlassen.
38. Hauptsprosslänge und Anzahl der Wirteln haben jeweils den Vorteil, dass sie am Anfang, während und am Ende der Prüfung für jedes Prüf- und Kontrollgefäß durch Fotografie und Bildanalyse bestimmt werden können, obwohl auch ein (steriles) Lineal verwendet werden kann.
39. Gesamtseitenastlänge, Gesamtwurzellänge (als Summe aller Seitenäste oder Wurzeln) und Gesamtsprosslänge (als Summe aus Hauptsprosslänge und Gesamtseitenastlänge) kann am Ende der Exposition mit einem Lineal gemessen werden.
40. Die Trocken- und/oder Frischmasse werden am Anfang der Prüfung an einer Probe der Vorkultur ermittelt, die typisch für das am Anfang der Prüfung verwendete Material ist; eine weitere Feststellung erfolgt am Ende der Prüfung anhand des Pflanzenmaterials jeweils aus den Prüfgefäßen und aus den Kontrollgefäßen.
41. Gesamtseitenastlänge, Gesamtsprosslänge, Gesamtwurzellänge, Frischmasse, Trockenmasse und Anzahl der Wirten können wie folgt bestimmt werden:
Häufigkeit der Messungen und der analytischen Bestimmungen
42. Bei statischen Tests wird jeweils am Anfang und am Ende der Prüfung der pH-Wert der behandelten Lösungen gemessen. Bei semistatischen Tests wird für alle Chargen der "frischen" Testlösung jeweils vor den Erneuerungen der pH-Wert ermittelt; außerdem ist der pH-Wert der "verbrauchten" Lösungen zu bestimmen.
43. Die Lichtintensität wird in der Wachstumskammer, im Inkubator oder im jeweiligen Raum in dem Abstand von der Lichtquelle gemessen, der auch bei den Testorganismen gegeben ist. Während der Prüfung wird mindestens eine Messung vorgenommen. Die Temperatur des Mediums in einem Surrogatgefäß unter den gleichen Bedingungen wie in der Wachstumskammer bzw. im Inkubator oder im jeweiligen Raum ist mindestens täglich (oder kontinuierlich mit einem Datenlogger) zu protokollieren.
44. Während der Prüfung wird die Konzentration der Prüfchemikalie(n) in geeigneten Intervallen bestimmt. Bei statischen Tests ist die Konzentration mindestens am Anfang und am Ende der Prüfung zu ermitteln.
45. Bei semistatischen Tests, bei denen davon ausgegangen wird, dass die Konzentrationen der Prüfchemikalie(n) nicht im Bereich von ± 20 % der Nominalkonzentration aufrechterhalten werden können, müssen alle frisch hergestellten Testlösungen sowie alle Lösungen jeweils nach der Erneuerung analysiert werden. Bei Tests, bei denen die gemessenen Ausgangskonzentrationen der Prüfchemikalie(n) zwar nicht ± 20 % der Nominalkonzentration betragen, für die aber hinreichend nachgewiesen werden kann, dass die Ausgangskonzentrationen wiederholbar und stabil sind (d. h. dass die Konzentrationen im Bereich von 80-120 % der Ausgangskonzentration liegen), sind chemische Bestimmungen nur bei der höchsten und der niedrigsten Konzentration erforderlich. In jedem Fall brauchen die Prüfchemikalienkonzentrationen für alle Testkonzentrationen vor der Erneuerung jeweils nur bei einem einzigen Replikat (bzw. bei Gefäßen mit zusammengefassten Replikaten jeweils bei nur einem Gefäß) erneut bestimmt zu werden.
46. Wenn nachgewiesen wird, dass die Testkonzentration während des Tests zufriedenstellend in Höhe von ± 20 % der Nominalkonzentration oder der gemessenen Ausgangskonzentration aufrechterhalten werden konnte, können die Ergebnisse auch ausgehend von den Nominalwerten bzw. von den gemessenen Ausgangswerten analysiert werden. Beträgt die Abweichung von der Nominalkonzentration oder von der gemessenen Ausgangskonzentration mehr als ± 20 %, sollte bei der Analyse der Ergebnisse vom geometrischen Mittel der Konzentration während der Expositionsdauer oder von Modellen ausgegangen werden, die den Rückgang der Prüfchemikalienkonzentration beschreiben (5).
Limit-Test
47. Unter bestimmten Umständen, z.B. wenn ein Vorversuch darauf hindeutet, dass die Prüfchemikalie bei Konzentrationen bis zu 100 mg/l bzw. bis zur Grenze der Löslichkeit im Prüfmedium oder im Falle einer Formulierung bis zur Dispersibilitätsgrenze keine toxische Wirkung hat, kann ein Limit-Test durchgeführt werden, in dem die Reaktionen einer Kontrollgruppe und einer Behandlungsgruppe (100 mg/l bzw. eine mit der Löslichkeitsgrenze identische Konzentration) verglichen werden. Es wird nachdrücklich empfohlen, diese Tests durch Analysen der Expositionskonzentration zu verifizieren. Für einen Limit-Test gelten alle oben beschriebenen Testbedingungen und Validitätskriterien; allerdings sollte die Anzahl der behandelten Replikate mindestens doppelt so hoch sein. Das Wachstum der Kontrollgruppe und der Behandlungsgruppe kann mit einem statistischen Test zum Vergleich der Mittelwerte analysiert werden (z.B. mit einem Student-t-Test).
Reaktionsvariablen
48. Mit der Prüfung sollen die Wirkungen einer Prüfchemikalie auf das vegetative Wachstum von Myriophyllum spicatum bestimmt werden. In dieser Prüfmethode werden zwei Reaktionsvariablen beschrieben.
49. Die Toxizitätsschätzungen sollten auf der Hauptsprosslänge und drei zusätzlichen Messvariablen (d. h. vorzugsweise Gesamtsprosslänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln, siehe Nummer 37 und Hinweise 2, 4 und 5 unter dieser Nummer) beruhen, da sich manche Chemikalien erheblich stärker auf andere Messvariablen auswirken können als die Hauptsprosslänge. Diese Auswirkungen würden nicht festgestellt werden, wenn ausschließlich die Hauptsprosslänge berechnet würde.
Durchschnittliche spezifische Wachstumsrate
50. Die durchschnittliche spezifische Wachstumsrate in einem bestimmten Zeitraum wird als logarithmische Zunahme der Wachstumsvariablen, d. h. Hauptsprosslänge und drei weitere Messvariablen (Gesamtsprosslänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln) für die einzelnen Replikate der Kontrollen und Behandlungsgruppen mit der nachstehenden Formel berechnet:
| ln (Nj) - ln (Ni) | |
| µi-j = |
|
| t |
Dabei sind:
µi-j: durchschnittliche spezifische Wachstumsrate vom Zeitpunkt i bis zum Zeitpunkt j
Ni: Messvariable im Prüfgefäß bzw. im Kontrollgefäß zum Zeitpunkt i
Nj: Messvariable im Prüfgefäß bzw. im Kontrollgefäß zum Zeitpunkt j
t: Zeitraum vom Zeitpunkt i bis zum Zeitpunkt j
Für jede Behandlungsgruppe und für jede Kontrollgruppe sind die mittlere Wachstumsrate und die Varianzschätzungen zu berechnen.
51. Die durchschnittliche spezifische Wachstumsrate wird für die gesamte Testdauer berechnet. (In der vorstehenden Formel bezeichnet "i" den Beginn der Prüfung und "j" das Ende der Prüfung.) Für alle Konzentrationen der Testlösungen und der Kontrolllösungen sind ein Mittelwert für die durchschnittliche spezifische Wachstumsrate zu berechnen und die entsprechenden Varianzschätzungen vorzunehmen. Außerdem muss die abschnittsbezogene Wachstumsrate bestimmt werden, um die Auswirkungen der Prüfchemikalie während der Expositionsdauer beurteilen zu können (z.B. durch Prüfung der logarithmisch transformierten Wachstumskurven).
52. Die Hemmung der Wachstumsrate in Prozent (Ir) kann anschließend für jede Testkonzentration (Behandlungsgruppe) nach der folgenden Formel berechnet werden:
| (µC - µT) | ||
| µIr = |
| x 100 |
| µC |
Dabei sind:
% Ir: Hemmung der durchschnittlichen spezifischen Wachstumsrate in Prozent
µC: Mittelwert für µ in der Kontrollgruppe
µT: Mittelwert für µ in der Behandlungsgruppe
Zellertrag
53. Die Auswirkungen auf den Zellertrag werden ausgehend von der Messvariablen "Hauptsprosslänge" und drei weiteren Messvariablen (d. h. vorzugsweise Gesamtsprosslänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln) der jeweiligen Prüfgefäße am Anfang und am Ende der Prüfung bestimmt. Für die Frisch- oder Trockenmasse wird die Ausgangsbiomasse anhand einer Probe von Testorganismen aus derselben Charge bestimmt, aus der die Prüfgefäße beimpft wurden. Für jede Testkonzentration und Kontrolllösung ist ein mittlerer Zellertrag zu berechnen; die Varianzen sind jeweils zu schätzen. Die mittlere prozentuale Hemmung des Zellertrags (% Iy) kann für jede Behandlungsgruppe wie folgt berechnet werden:
%Iy = (bC - bT) / bC
Dabei sind:
% Iy: Verringerung des Zellertrags in Prozent
bC: Biomasse am Ende der Prüfung abzüglich der Biomasse am Anfang der Prüfung (Kontrollgruppe)
bT: Biomasse am Ende der Prüfung abzüglich der Biomasse am Anfang der Prüfung (Behandlungsgruppe)
Verdopplungszeit
54. Um die Dauer bis zur Verdopplung der Hauptsprosslänge (Td) zu bestimmen und um sicherzustellen, dass dieses Validitätskriterium erfüllt wird (siehe Nummer 8), sind die Daten der Kontrollgefäße in die folgende Gleichung einzusetzen:
Td = ln 2/µ
Dabei steht µ für die durchschnittliche spezifische Wachstumsrate, die wie unter den Nummern 50-52 beschrieben bestimmt wurde.
Darstellung der Konzentrations-Wirkungs-Kurven
55. Die Konzentrations-Wirkungs-Kurven der mittleren Hemmung der Reaktionsvariablen in Prozent (Ir oder Iy berechnet gemäß der Anweisung unter Nummer 53) und die logarithmische Konzentration der Prüfchemikalie werden grafisch dargestellt.
ECx-Schätzung
56. Schätzungen der ECx-Werte sollten sowohl auf der durchschnittlichen spezifischen Wachstumsrate (ErCx) als auch auf dem Zellertrag (EyCx) beruhen, und beide Werte sollten ihrerseits von der Hauptsprosslänge und eventuell weiteren Messvariablen (d. h. vorzugsweise Gesamtsprosslänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln) ausgehen, weil sich manche Chemikalien unterschiedlich auf die Hauptsprosslänge und sonstige Messvariablen auswirken. Die gewünschten Toxizitätsparameter bestehen entsprechend aus vier ECx-Werten für alle berechneten Hemmkonzentrationen x: ErCx (Hauptsprosslänge), ErCx (d. h. vorzugsweise Gesamtsprosslänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln), EyCx (Hauptsprosslänge) und EyCx (d. h. vorzugsweise Gesamtsprosslänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln).
57. Es wird darauf hingewiesen, dass die mit diesen beiden Reaktionsvariablen berechneten ECx-Werte nicht vergleichbar sind; der entsprechende Unterschied muss bei der Verwendung der Testergebnisse berücksichtigt werden. Die mit der durchschnittlichen spezifischen Wachstumsrate (ErCx) berechneten Werte für ECx werden im Allgemeinen höher sein als die anhand des Zellertrags (EyCx) ermittelten Werte, wenn die für diese Prüfmethode vorgesehenen Bedingungen eingehalten werden; dies ist auf die unterschiedliche mathematische Grundlage der beiden Berechnungsverfahren zurückzuführen. Die auftretenden Unterschiede sollten jedoch nicht als Anzeichen für eine unterschiedliche Empfindlichkeit der beiden Reaktionsvariablen betrachtet werden; die Werte sind einfach mathematisch verschieden.
Statistische Verfahren
58. Ziel ist die Ermittlung einer quantitativen Konzentrations-Wirkungs-Beziehung durch Regressionsanalyse. Im Anschluss an eine linearisierte Transformation der Reaktionsdaten (z.B. nach dem Probit-, Logit- oder Weibull-Modell) (7) kann eine gewichtete lineare Regression vorgenommen werden; nicht-lineare Regressionsverfahren, mit denen die unvermeidlichen Unregelmäßigkeiten der Daten und Abweichungen von gleichförmigen Verteilungen besser verarbeitet werden können, werden jedoch bevorzugt. Im Bereich von Null bzw. der vollständigen Hemmung können diese Unregelmäßigkeiten durch die Transformation vergrößert werden und die Analyse beeinträchtigen (7). Es wird darauf hingewiesen, dass Standard-Analysemethoden mit Probit-, Logit- oder Weibull-Transformationen für quantale Daten (z.B. Mortalität oder Überlebensrate) vorgesehen sind und zur Verwendung in Verbindung mit Wachstums- oder Zellertragsdaten entsprechend modifiziert werden müssen. Spezifische Verfahren zur Bestimmung von ECx-Werten aus kontinuierlichen Daten sind den Quellen (8), (9) und (10) zu entnehmen.
59. Für jede zu analysierende Reaktionsvariable sind aufgrund der Konzentrations-Wirkungs-Beziehung ECx-Werte zu ermitteln. Nach Möglichkeit sollten für jeden ECx-Wert die 95 %-Konfidenzintervalle bestimmt werden. Die Qualität der Übereinstimmung der Reaktionsdaten mit dem Regressionsmodell sollte grafisch oder statistisch bewertet werden. Die Regressionsanalyse wird mit den Reaktionen der einzelnen Replikate (und nicht mit den Mittelwerten der Behandlungsgruppe) durchgeführt.
60. Schätzwerte für EC50 und für die Konfidenzintervalle können auch durch lineare Interpolation mit einem Bootstrapping-Algorithmus (10) erzielt werden, wenn die verfügbaren Regressionsmodelle/-methoden für die betreffenden Daten nicht geeignet sind.
61. Für eine Schätzung der LOEC-Werte und entsprechend auch der NOEC-Werte müssen die Mittelwerte der behandelten Lösungen durch Varianzanalyseverfahren (ANOVA) verglichen werden. Der Mittelwert der einzelnen Konzentrationen ist dann mit einer geeigneten Methode zur Durchführung von Mehrfachvergleichen bzw. zur Durchführung von Trendtests mit dem Mittelwert der Kontrollgruppe zu vergleichen. Dunnett- und Williams-Tests können hilfreich sein (12) (13) (14) (15) (16). Die ANOVA-Annahme der Varianzhomogenität muss einer Überprüfung unterzogen werden. Die entsprechende Bewertung kann anhand einer grafischen Darstellung oder aufgrund eines formalen Tests vorgenommen werden (15). Geeignet sind Levene- und Bartlett-Tests. Wenn die Annahme der Varianzhomogenität nicht erfüllt ist, kann gelegentlich eine Korrektur durch logarithmische Datentransformation erfolgen. Bei außerordentlicher Varianzheterogenität, die durch Transformation nicht korrigiert werden kann, sollten Analysen durch Methoden wie z.B. Jonckheere-Trendtests (Step-Down) erwogen werden. Weitere Hinweise zur Bestimmung von NOEC-Werten sind Quelle (10) zu entnehmen.
62. Aufgrund neuer Forschungsergebnisse wird empfohlen, das Konzept der NOEC aufzugeben und durch Punktschätzungen von ECx-Werten zu ersetzen, die durch Regression ermittelt wurden. Für diesen Myriophyllum-Test wurde noch kein geeigneter Wert für x definiert. Ein Bereich von 10 bis 20 % scheint jedoch geeignet (abhängig von der ausgewählten Reaktionsvariablen); vorzugsweise sollten sowohl EC10 und EC20 als auch deren Konfidenzgrenzen protokolliert werden.
Berichterstattung
63. Der Prüfbericht muss folgende Informationen enthalten:
Prüfchemikalie
Einkomponentiger Stoff:
Mehrkomponentiger Stoff, UVCB-Stoffe und Gemische:
Testspezies
Prüfbedingungen
Ergebnisse
(1) ASTM Designation E 1913-04, Standard Guide for Conducting Static, Axenic, 14-Day Phytotoxicity Tests in Test Tubes with the Submersed Aquatic Macrophyte, Myriophyllum sibiricum Komarov.
(2) Maletzki, D. et al. (2010), Myriophyllum spicatum als ökotoxikologischer Testorganismus: Methodenentwicklung eines sedimentfreien Testsystems und erste Ergebnisse mit 3,5-Dichlorphenol, Umweltwiss Schadst Forsch, Nr. 22, 702-710.
(3) Kapitel C.26 dieses Anhangs: Lemna sp. - Wachstumsinhibitionstest.
(4) OECD (2014), Myriophyllum spicatum Toxicity Test: Results of an inter-laboratory ring test using a sediment-free test system, OECD Environment, Health and Safety Publications (EHS), Series Testing and Assessment, No. 205, OECD Publishing, Paris.
(5) OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 23, OECD Publishing, Paris.
(6) Kapitel C.51 dieses Anhangs: Myriophyllum spicatum-Toxizitätstest im Wassersediment
(7) Christensen, E.R., N. Nyholm (1984), Ecotoxicological Assays with Algae: Weibull Dose-Response Curves, Environmental Science & Technology, Vol. 18/9, 713-718.
(8) Nyholm, N. et al. (1992), Statistical treatment of data from microbial toxicity tests, Environmental Toxicology and Chemistry, Vol. 11/2, 157-167.
(9) Bruce, R.D., D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environmental Toxicology and Chemistry, Vol. 11/10, 1485-1494.
(10) OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application, OECD Environmental Health and Safety Publications (EHS), Series on Testing and Assessment No. 54, OECD, Paris.
(11) Norberg-King, T.J. (1988), An interpolation estimate for chronic toxicity: The ICp approach, National Effluent Toxicity Assessment center Technical Report 05-88, US EPA, Duluth, MN.
(12) Dunnett, C.W. (1955), A multiple comparisons procedure for comparing several treatments with a control, Journal of the American Statistical Association, Vol. 50/272, 1096-1121.
(13) Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, Vol. 20/3, 482-491.
(14) Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics, Vol. 27/1, 103-117.
(15) Williams, D.A. (1972), The comparison of several dose levels with a zero dose control, Biometrics, Vol. 28/2, 519-531.
(16) Brain, P., R. Cousens (1989), An equation to describe dose-responses where there is stimulation of growth at low doses, Weed Research, Vol. 29/2, 93-96.
| Definitionen | Anlage 1 |
Definitionen
Biomasse ist die Frisch- und/oder Trockenmasse des in einer Population enthaltenen lebenden Materials. In diesem Test entspricht die Biomasse der Summe aus Hauptspross, allen Seitenästen und allen Wurzeln.
Chemikalie ist ein Stoff oder Gemisch.
Chlorose ist eine Farbveränderung von grün nach gelb des Testorganismus, insbesondere der Wirteln.
ECx ist die Konzentration der im Prüfmedium aufgelösten Prüfchemikalie, bei der sich binnen einer festgelegten Expositionsdauer eine Reduzierung des Wachstums von Myriophyllum spicatum um x % (z.B. 50 %) ergibt. (Die Expositionsdauer ist ausdrücklich zu nennen, wenn die Dauer von der vollständigen oder normalen Testdauer abweicht.) Um einen von der Wachstumsrate bzw. vom Zellertrag abgeleiteten EC-Wert eindeutig zu kennzeichnen, wird die Bezeichnung "ErC" für die Wachstumsrate und "EyC" für den Zellertrag jeweils gefolgt von der verwendeten Messvariablen (z.B. ErC (Hauptsprosslänge) verwendet.
Endpunkt des Tests beschreibt den allgemeinen Faktor, der als Testziel durch die Prüfchemikalie gegenüber der Kontrollprobe verändert wird; bei dieser Prüfmethode ist der Endpunkt des Tests die Wachstumshemmung; diese kann durch verschiedene Reaktionsvariablen ausgedrückt werden, die jeweils auf mindestens einer Messvariablen beruhen.
Lowest Observed Effect Concentration (LOEC) ist die niedrigste geprüfte Konzentration, bei der beobachtet wurde, dass die Chemikalie binnen einer bestimmten Expositionsdauer gegenüber der Kontrollprobe eine statistisch signifikante Wachstumsreduzierung bewirkt (bei p < 0,05). Alle Testkonzentrationen oberhalb der LOEC müssen jedoch eine schädigende Wirkung haben, die gleich den bei der LOEC beobachteten Wirkungen oder größer als diese ist. Können diese beiden Bedingungen nicht erfüllt werden, muss ausführlich erklärt werden, wie die LOEC (und damit auch die NOEC) ausgewählt wurde.
Messvariablen sind alle Variablentypen, die gemessen werden, um mit mindestens einer Reaktionsvariablen den Endpunkt des Tests zu beschreiben. Bei dieser Prüfmethode bilden Hauptsprosslänge, Gesamtseitenastlänge, Gesamtsprosslänge, Gesamtwurzellänge, Frischmasse, Trockenmasse und Anzahl der Wirteln die Messvariablen.
Monokultur ist eine Kultur mit einer Pflanzenart.
Nekrose ist abgestorbenes (d. h. weißes oder dunkelbraunes) Gewebe des Testorganismus.
No Observed Effect Concentration (NOEC) ist die Testkonzentration unmittelbar unterhalb der LOEC.
Prüfchemikalie bezeichnet einen Stoff oder ein Gemisch, der bzw. das nach dieser Methode geprüft wird.
Prüfmedium ist das gesamte synthetische Nährmedium, in dem die zu prüfenden Pflanzen wachsen, wenn sie der Prüfchemikalie ausgesetzt werden; die Prüfchemikalie wird im Allgemeinen im Prüfmedium aufgelöst.
Reaktionsvariable ist eine Variable für die geschätzte Toxizität, abgeleitet aus beliebigen gemessenen Variablen zur Beschreibung der Biomasse durch verschiedene Berechnungsmethoden. Bei dieser Prüfmethode sind die Wachstumsrate und der Zellertrag die Reaktionsvariablen, die aus Messvariablen wie z.B. Hauptsprosslänge, Gesamtsprosslänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln abgeleitet werden.
Semistatischer (Erneuerungs-)Test ist ein Test, bei dem die Testlösung während der Testdauer regelmäßig in bestimmten Intervallen erneuert wird.
Statischer Test ist eine Prüfmethode, bei der die Testlösung während der Testdauer nicht erneuert wird.
UVCB-Stoffe sind Stoffe mit unbekannter oder schwankender Zusammensetzung, komplexe Reaktionsprodukte oder biologische Materialien.
Wachstum ist eine Zunahme der Messvariablen, z.B. Hauptsprosslänge, Gesamtseitenastlänge, Gesamtsprosslänge, Gesamtwurzellänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln während der Testdauer.
Wachstumsrate (durchschnittliche spezifische Wachstumsrate) ist die logarithmische Zunahme der Messvariablen während der Expositionsdauer. Hinweis: Die auf die Wachstumsrate bezogenen Reaktionsvariablen sind unabhängig von der Testdauer, solange das Wachstumsmuster der nicht exponierten Kontrollorganismen exponential ist.
Zellertrag ist der Wert einer Messvariablen zur Beschreibung der Biomasse am Ende der Expositionsdauer abzüglich der Messvariablen am Anfang der Expositionsdauer. Hinweis: Im Falle eines exponentialen Wachstumsmusters der nicht exponierten Organismen verringern sich die auf den Zellertrag bezogenen Reaktionsvariablen mit der Testdauer.
| Modifiziertes Andrews-Medium für Stamm- und Vorkultur | Anlage 2 |
Das modifizierte Andrews-Medium, das für die Stamm- und Vorkultur benötigt wird, wird aus fünf separat zubereiteten Stamm-Nährlösungen unter Zugabe von 3 % Saccharose hergestellt.
Tabelle 1 Zusammensetzung der Andrews-Nährlösung: (ASTM Designation E 1913-04)
| Herstellung der Stamm-Nährlösungen | Herstellung der Nährlösung | ||
| Stammlösung | Chemikalie | Ausgangsgewicht pro 1 000 ml | ml pro 5 l Nährlösung |
| 1 | KCl | 74,6 mg | 50 |
| KNO3 | 8,08 g | ||
| Ca(NO3)2 x 4 H2O | 18,88 g | ||
| 2 | MgSO4 x 7 H2O | 9,86 g | 50 |
| 3 | Siehe nachstehende Stammlösung 3.1 | 50 | |
| 4 | KH2PO4 | 2,72 g | 50 |
| 5 | FeSO4 x 7 H2O | 0,278 g | 50 |
| Na2EDTA x 2 H2O | 0,372 g | ||
Stammlösungen können 6 Monate lang in einem Kühlschrank aufbewahrt werden (bei 5-10°C). Nur die Stammlösung Nr. 5 besitzt eine verringerte Haltbarkeit (zwei Monate).
Tabelle 2 Herstellung der Stammlösung 3.1 für die Zubereitung der Stammlösung 3
| Chemikalie | Ausgangsgewicht g/100 ml |
| MnSO4 x 4 H2O | 0,223 |
| ZnSO4 x 7 H2O | 0,115 |
| H3BO3 | 0,155 |
| CuSO4 x 5 H2O | 0,0125 |
| (NH4)6Mo7O24 x 4 H2O | 0,0037 |
Nach der Herstellung der Stammlösung 3.1 (Tabelle 2) wird diese in ca. 11 ml-Aliquoten (bei mindestens -18 °C) eingefroren. Die eingefrorenen Partien sind fünf Jahre haltbar.
Zur Herstellung der Stammlösung 3 wird die Stammlösung 3.1 aufgetaut, 10 ml davon in einen 1 l-Messkolben gefüllt und Reinstwasser bis zur Marke zugegeben.
Um modifiziertes Andrews-Medium zu erhalten, werden ca. 2500 ml Reinstwasser in einen 5 l-Messkolben gefüllt. Nach dem Hinzugeben von 50 ml jeder Stammlösung werden 90 % des Messkolbens mit Reinstwasser befüllt und der pH-Wert auf 5,8 eingestellt.
Anschließend werden 150 g gelöste Saccharose (3 % pro 5 l) hinzugegeben und der Messkolben bis zur Marke mit Reinstwasser befüllt. Schließlich wird die Nährlösung in 1 l-Schott-Flaschen gefüllt und 20 Minuten bei 121 °C autoklaviert.
Die somit gewonnene Nährlösung kann drei Monate lang in einem Kühlschrank (bei 5-10 °C) steril gehalten werden.
Modifiziertes Andrews-Medium für sedimentfreien Toxizitätstest
Aus den fünf Stamm-Nährlösungen, die bereits in den Tabellen 1 und 2 genannt wurden, wird ein 10-fach konzentriertes, modifiziertes Andrews-Medium, das für die Herstellung der Testlösungen benötigt wird, unter Zugabe von 30 % Saccharose zubereitet. Hierzu werden ca. 100 ml Reinstwasser in einen 1 l-Messkolben gefüllt. Nach der Zugabe von 100 ml von jeder der Stammlösungen wird der pH-Wert auf 5,8 eingestellt. Anschließend werden 30 % gelöste Saccharose (300 g pro 1.000 ml) hinzugegeben und der Messkolben bis zur Marke mit Reinstwasser befüllt.
Schließlich wird die Nährlösung in 0,5 l-Schott-Flaschen gefüllt und 20 Minuten bei 121 °C autoklaviert.
Die somit gewonnene 10-fach konzentrierte, modifizierte Nährlösung kann drei Monate lang in einem Kühlschrank (bei 5-10 °C) steril gehalten werden.
| Haltung der Stammkultur | Anlage 3 |
In der vorliegenden Anlage 3 wird die Stammkultur von Myriophyllum spicatum L 1, einer submersen zweikeimblättrigen Wasserpflanzenart, die der Familie der Tausendblattgewächse angehört, beschrieben.
Zwischen Juni und August ragen unscheinbare rosaweiße Blüten aus dem Wasser hervor.
Die Pflanzen sind im Boden mit einem System aus robusten Rhizomen verwurzelt und auf der gesamten Nordhalbkugel in eutrophischen, jedoch unverschmutzten und kalkhaltigeren Stillgewässern mit schlammigem Untergrund anzutreffen.
Myriophyllum spicatum bevorzugt Süßwasser, ist aber auch in Brackwasser zu finden.
Für eine sedimentfreie Stammkultur unter Laborbedingungen sind sterile Pflanzen erforderlich. Sterile Pflanzen können vom Ökotoxikologielabor des deutschen Umweltbundesamts bezogen werden.
Alternativ können Testorganismen aus nichtsterilen Pflanzen gemäß ASTM Designation E 1913-04 zubereitet werden. Das Verfahren für die Kultivierung von aus der Natur entnommenem Myriophyllum sibiricum ist wie folgt (Auszug aus dem ASTM Standard Guide):
"Wenn aus der Natur entnommene, nichtsterile Pflanzen als Ausgangsmaterial verwendet werden sollen, werden M. sibiricum-Stängel im Herbst gesammelt. Die Stängel werden in ein 20 l-Aquarium mit 5 cm sterilem Sediment gelegt, das mit Quarzsand oder beispielsweise Turface® und 18 l Reagenzwasser bedeckt ist. Das Aquarium wird belüftet und es wird eine Temperatur von 15 °C und eine Flussrate von 200-300 µmol m-2 s-1 während 16 Stunden pro Tag eingehalten. Die Pflanzenkultur im Aquarium kann als Reservequelle für Pflanzen gehalten werden, falls die sterilen Pflanzenkulturen durch eine mechanische Funktionsstörung im Wachstumsschrank, durch Verunreinigung oder aus anderem Grund zerstört werden. Die im Aquarium gewachsenen Pflanzen sind nicht steril und sterile Kulturen können nicht in einem Batch-Kultursystem gehalten werden. Zum Sterilisieren der Kultur werden die Pflanzen aus dem Aquarium entnommen und ca. 0,5 Stunden unter fließendem entionisiertem Wasser abgespült. Die Pflanzen werden dann höchstens 20 Minuten unter keimfreien Bedingungen in einer Laminar-Airflow-Kabine in einer 3 %igen (w/v) Natriumhypochloridlösung mit 0,01 % eines geeigneten Tensids (bis das Pflanzengewebe größtenteils gebleicht und lediglich die wachsende Spitze noch grün ist) desinfiziert. Das Desinfektionsmittel und das Pflanzenmaterial werden verrührt. Segmente mit mehreren Knoten werden in sterile Kulturröhrchen mit 45 ml sterilisiertem, modifiziertem Andrews-Medium umgesetzt, die mit einfachen Kulturröhrchenverschlüssen versehen werden. In jede Prüfkammer wird nur ein Pflanzensegment gelegt. Der Verschluss wird mit Labor-Dichtfolie am Kulturröhrchen befestigt. Nach der Herstellung einer sterilen Kultur sollten Pflanzensegmente, die mehrere Knoten enthalten, alle 10-12 Tage in neue Prüfkammern mit frischem flüssigem Nährmedium umgesetzt werden. Wie durch Kultivierung auf Agarplatten nachgewiesen, müssen die Pflanzen steril sein und acht Wochen steril bleiben, bevor die Prüfung gestartet werden kann."
Da das modifizierte Andrews-Medium Saccharose enthält (die das Wachstum von Pilzen und Bakterien anregt), müssen bei sämtlichen Materialien, Lösungen und Kultivierungsvorgängen sterile Bedingungen gegeben sein. Alle Flüssigkeiten und Geräte werden vor dem Gebrauch sterilisiert. Die Sterilisation wird durch Behandlung mit erhitzter Luft (210 °C) über einen Zeitraum von 4 Stunden oder durch 20-minütiges Autoklavieren bei 121 °C durchgeführt. Darüber hinaus werden alle Flaschen, Gefäße, Schalen usw. sowie sonstige Geräte unmittelbar vor der Verwendung einer Flammbehandlung auf einem sterilen Arbeitstisch unterzogen.
Die Stammkulturen können über längere Zeiträume bei verringerter Beleuchtung und niedrigeren Temperaturen (50 µE m-2 s-1, 20 ± 2 °C) gebrauchsfähig gelagert werden. Das Myriophyllum-Nährmedium sollte identisch mit dem für die Tests verwendeten Nährmedium sein; für Stammkulturen können jedoch auch andere nährstoffreiche Medien verwendet werden.
Die Pflanzensegmente werden axenisch auf mehrere 500 ml-Erlenmeyer- und/oder 2.000 ml-Fernbach-Kolben, die jeweils mit ca. 450 bzw. 1.000 ml modifiziertem Andrews-Medium befüllt sind, verteilt. Dann werden die Kolben axenisch mit einem Cellulosestopfen verschlossen.
Darüber hinaus müssen die Geräte unmittelbar vor dem Gebrauch unbedingt einer sorgfältigen Flammbehandlung auf einem sterilen Arbeitstisch unterzogen werden. Je nach Anzahl und Größe werden die Pflanzen ungefähr alle drei Wochen in frische Nährlösung umgesetzt.
Für diese erneuerte Kultur können Spitzen sowie Segmente aus der Stängelmitte verwendet werden. Anzahl und Größe der umgesetzten Pflanzen (oder Pflanzensegmente) sind davon abhängig, wie viele Pflanzen benötigt werden. Beispielsweise können fünf Sprosssegmente in einen Fernbach-Kolben und drei Sprosssegmente in einen Erlenmeyer-Kolben, jeweils mit einer Länge von 5 cm, umgesetzt werden. Verwurzelte, blühende, abgestorbene oder anderweitig auffällige Teile sollten verworfen werden.
Abbildung 1 Schneiden der Pflanzen für die Stamm- und Vorkultur nach 3 Wochen Kultivierung.

Die Pflanzen werden in 500 ml-Erlenmeyer- und 2.000 ml-Fernbach-Kolben in einem Kühlinkubator bei 20 ± 2 °C mit kontinuierlicher Beleuchtung bei 100-150 µE m- 2 s-1 oder 6.000-9.000 Lux (abgestrahlt durch die Kammerbeleuchtung mit der Farbtemperatur "warmweiß") kultiviert.
Abbildung 2 Kultivierung der Pflanzen in einem Kühlinkubator mit Kammerbeleuchtung.

Bei den Prüfungen werden chemisch reine (mit Säure gereinigte) und sterile gläserne Kulturgefäße verwendet, die keimfrei zu handhaben sind. Ist die Stammkultur z.B. durch Algen, Pilze und/oder Bakterien verunreinigt, sollte eine neue Kultur zubereitet oder eine Stammkultur aus einem anderen Labor für die Erneuerung der einen Kultur verwendet werden.
_____
1) Carl von Linné (* 23. Mai 1707 in Råshult /Älmhult; 10. Januar 1778 in Uppsala)
| Haltung der Vorkultur und Vorbereitung des Testorganismus für den Test | Anlage 4 |
Zur Herstellung der Vorkultur werden die Sprosse der Stammkultur in Segmente mit jeweils zwei Wirteln geschnitten; die Segmente werden in Fernbach-Kolben, die mit modifiziertem Andrews-Medium (mit 3 % Saccharose) befüllt sind, eingesetzt.
Jeder Kolben kann bis zu 50 Sprosssegmente enthalten.
Allerdings muss darauf geachtet werden, dass die Segmente vital sind und weder Wurzeln noch Seitenäste oder Astknospen aufweisen (siehe Abbildung 1 in Anlage 3).
Die Vorkulturorganismen werden 14-21 Tage unter sterilen Bedingungen in einer Klimakammer mit einem Hell-/Dunkel-Zyklus von 16 Stunden Licht und 8 Stunden Dunkelheit kultiviert. Die Lichtintensität liegt im Bereich von 100-150 µE m-2 s-1. Die Temperatur der Prüfgefäße beträgt 23 ± 2 °C.
Da das modifizierte Andrews-Medium Saccharose enthält (die das Wachstum von Algen, Pilzen und Bakterien anregt), sollten die Zubereitung der Prüfchemikalienlösungen und die Kultivierung unter sterilen Bedingungen erfolgen. Alle Flüssigkeiten und Geräte werden vor dem Gebrauch sterilisiert. Die Sterilisation wird durch Behandlung mit erhitzter Luft (210 °C) über einen Zeitraum von 4 Stunden oder durch 20-minütiges Autoklavieren bei 121 °C durchgeführt. Darüber hinaus werden alle Flaschen, Gefäße, Schalen usw. sowie sonstige Geräte unmittelbar vor der Verwendung einer Flammbehandlung auf einem sterilen Arbeitstisch unterzogen.
Die Sprosse werden axenisch aus den Vorkulturkolben entfernt, wobei möglichst homogenes Material ausgesucht wird. Für jede Prüfung werden mindestens 60 Testorganismen benötigt (Prüfung mit acht Prüfchemikalienkonzentrationen). Für die Prüfung werden frische Seitenäste aus den Vorkulturen entnommen, auf 2,5 cm ab Stängel gekürzt (mit Lineal gemessen) und in ein Becherglas mit sterilem modifiziertem Andrews-Medium eingesetzt. Diese frischen Seitenäste können für den sedimentfreien Myriophyllum spicatum-Toxizitätstest verwendet werden.
Abbildung 2 Schneiden der Pflanzen aus der Vorkultur für den sedimentfreien Myriophyllum spicatum-Toxizitätstest.

C.51 Myriophyllum spicatum-Toxizitätstest im Wassersediment 17
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 239 (2014). Es sind Prüfmethoden für Lemna-Arten (schwebende, einkeimblättrige Wasserpflanze) (1) und Algenarten (2) verfügbar. Diese Methoden werden routinemäßig für die Gewinnung von Daten in Bezug auf die Gefährdung von Nichtziel-Wasserpflanzenarten durch Prüfchemikalien, insbesondere herbizidaktive Chemikalien, verwendet. Jedoch sind in einigen Fällen eventuell Daten für weitere Wasserpflanzenarten erforderlich. In neueren Leitlinien, die im Rahmen des Workshops "Aquatic Macrophyte Risk Assessment for Pesticides" (AMRAP) der Society of Environmental Toxicology and Chemistry (SETAC) veröffentlicht wurden, wird darauf hingewiesen, dass u. U. Daten für eine bewurzelte Wasserpflanzenart für Prüfchemikalien benötigt werden, sofern Lemna und Algen bekanntermaßen unempfindlich gegenüber der Wirkungsweise sind oder wenn eine Verteilung im Sediment befürchtet wird, was zu einer Exposition durch Aufnahme über die Wurzel führt (3). Auf der Grundlage der gegenwärtigen Erkenntnisse und Erfahrung wurde Myriophyllum spp. als bevorzugte Art für solche Fälle ausgewählt, in denen Daten für eine submerse, bewurzelte zweikeimblättrige Art benötigt werden (4) (5) (6). Diese Prüfung stellt keinen Ersatz für andere aquatische Toxizitätstests dar, sondern sollte als Ergänzung solcher Tests verwendet werden, sodass eine umfassendere Gefahren- und Risikobewertung im Hinblick auf Wasserpflanzen möglich ist. Der Myriophyllum spicatum-Toxizitätstest im Wassersediment ergänzt den sedimentfreien Myriophyllum spicatum-Toxizitätstest (7).
2. In diesem Dokument wird eine Prüfmethode beschrieben, mit der die Wirkungen einer Prüfchemikalie auf die bewurzelte Wasserpflanzenart Myriophyllum spicatum, die in einem Wassersedimentsystem wächst, bewertet werden können. Die Prüfmethode basiert teilweise auf vorhandenen Methoden (1) (2) (8) und berücksichtigt die aktuellen Forschungsarbeiten zur Risikobewertung für Wasserpflanzen (3). Die Methode im Wassersediment wurde durch einen internationalen Ringtest validiert, der unter statischen Bedingungen an Myriophyllum-Arten durchgeführt wurde, die der Prüfchemikalie durch Applikationen über die Wassersäule ausgesetzt wurden (9). Jedoch lässt sich das Testsystem problemlos anpassen, um die Exposition über gespiktes Sediment oder über die Wasserphase in semistatischen oder auf Impulsdosierung basierenden Szenarios zu ermöglichen, obwohl diese Szenarios keinem formalen Ringtest unterzogen wurden. Darüber hinaus kann die allgemeine Methode für andere bewurzelte, submerse oder emerse Arten, einschließlich anderer Myriophyllum-Arten (z.B. Myriophyllum aquaticum und Glyceria maxima), verwendet werden (10). Bei solchen alternativen Arten sind u. U. Änderungen der Prüfbedingungen, des Versuchsplans und der Dauer notwendig. Insbesondere sind weitere Arbeiten erforderlich, um geeignete Verfahren für Myriophyllum aquaticum zu definieren. Auf diese Optionen wird in dieser Prüfmethode, in der der Standardansatz für die Exposition von Myriophyllum spicatum in einem statischen System über die Wasserphase beschrieben wird, nicht näher eingegangen.
3. Diese Prüfmethode gilt für Stoffe, bei denen die Prüfmethode validiert wurde (siehe Ringtest-Bericht (9)), oder für Formulierungen oder bekannte Gemische. Ein Myriophyllum-Test kann durchgeführt werden, um eine Anforderung hinsichtlich Tier-1-Daten, die durch eine potenzielle Verteilung der Prüfchemikalie im Sediment oder Probleme mit Wirkungsweise/Selektivität ausgelöst wurde, zu erfüllen. Ebenso ist möglicherweise ein laborbasierter Myriophyllum-Test im Rahmen einer höherstufigen Strategie erforderlich, um Bedenken wegen des Risikos für Wasserpflanzen auszuräumen. Der Expositionspfad (d. h. über Wasser oder Sediment) wird durch den spezifischen Grund für die Durchführung eines Tests bestimmt. Bevor diese Prüfmethode für die Prüfung eines Gemischs zu gesetzgeberischen Zwecken eingesetzt wird, sollte geprüft werden, ob, und falls ja, warum, sie für diesen Zweck geeignete Ergebnisse liefert. Solche Erwägungen entfallen, wenn die Prüfung des Gemischs von Rechts wegen vorgeschrieben ist.
4. Der Test wird zur Bewertung der durch die Chemikalie bedingten Auswirkungen auf das vegetative Wachstum von Myriophyllum-Pflanzen, die in standardisierten Medien (Wasser, Sediment und Nährstoffe) wachsen, verwendet. Zu diesem Zweck werden Sprossspitzen von gesunden, nicht blühenden Pflanzen in standardisiertes, künstliches Sediment, das mit zusätzlichen Nährstoffen angereichert wird, um ein angemessenes Pflanzenwachstum sicherzustellen, eingesetzt und in Smart & Barko-Medium gehalten (Anlage 1). Nach einem Etablierungszeitraum, in dem sich Wurzeln bilden können, werden die Pflanzen einer Reihe von Testkonzentrationen, die der Wassersäule zugesetzt werden, ausgesetzt. Alternativ kann die Exposition über das Sediment durch Dotierung des künstlichen Sediments mit der Prüfchemikalie und Einsetzen der Pflanzen in dieses gespikte Sediment simuliert werden. In beiden Fällen werden die Pflanzen anschließend 14 Tage unter kontrollierten Umgebungsbedingungen gehalten. Die Auswirkungen auf das Wachstum werden anhand von quantitativen Bewertungen der Sprosslänge, der Frischmasse und der Trockenmasse sowie qualitativen Beobachtungen von Symptomen wie z.B. Chlorose, Nekrose oder Fehlwachstum ermittelt.
5. Um die durch die Chemikalie bedingten Wirkungen zu quantifizieren, wird das Wachstum in den Testlösungen mit dem Wachstum der Kontrollpflanzen verglichen. Ferner wird die Konzentration, die eine festgelegte Wachstumshemmung von x % hervorruft, bestimmt und als ECx ausgedrückt; "x" kann ein beliebiger Wert je nach regulatorischen Anforderungen sein, z.B. EC10, EC20 und EC50. Es ist zu beachten, dass Schätzungen der EC10- und EC20-Werte nur in Tests zuverlässig und angemessen sind, bei denen die für die Kontrollpflanzen bestimmten Variationskoeffizienten unter dem zu schätzenden Wirkungsniveau liegen, d. h. die Variationskoeffizienten sollten für die zuverlässige Schätzung eines EC20-Werts < 20 % sein.
6. Sowohl die durchschnittliche Wachstumsrate (geschätzt aus Bewertungen der Sprosslänge, der Sprossfrischmasse und der Sprosstrockenmasse) als auch der Zellertrag (geschätzt aus der Zunahme der Sprosslänge, der Sprossfrischmasse und der Sprosstrockenmasse) der unbehandelten und behandelten Pflanzen sollten bestimmt werden. Anhand der spezifischen Wachstumsrate (r) und des Zellertrags (y) werden anschließend ErCx (z.B. ErC10, ErC20, ErC50) bzw. EyCx (z.B.EyC10, EyC20, EyC50) bestimmt.
7. Falls erforderlich, können die niedrigste Konzentration mit beobachteter Wirkung (LOEC) und die höchste geprüfte Konzentration ohne beobachtete Wirkung (NOEC) statistisch anhand von Schätzungen der durchschnittlichen spezifischen Wachstumsraten und des Zellertrags bestimmt werden.
8. Es sollte eine Analysemethode mit geeigneter Empfindlichkeit für die Quantifizierung der im Prüfmedium enthaltenen Chemikalien verfügbar sein.
9. Zur Festlegung der Testbedingungen hilfreiche Informationen zur Prüfchemikalie sind die Strukturformel, die Zusammensetzung im Falle von mehrkomponentigen Stoffen, UVCB-Stoffen, Gemischen oder Formulierungen, die Reinheit, die Wasserlöslichkeit, die Stabilität in Wasser, die Lichtbeständigkeit, die Säuredissoziationskonstante (pKa), der Octanol/Wasser-Verteilungskoeffizient (Kow), falls verfügbar Kd für Sedimente, der Dampfdruck und die biologische Abbaubarkeit. Aus der Wasserlöslichkeit und dem Dampfdruck kann die Henry-Konstante berechnet werden, aus der zu entnehmen ist, ob während der Testdauer erhebliche Verluste der Prüfchemikalie zu erwarten sind. Wenn Verluste der Prüfchemikalien wahrscheinlich sind, sollten die Verluste quantifiziert und die nachfolgenden Schritte zur Eindämmung solcher Verluste dokumentiert werden. Wenn zur Löslichkeit und zur Stabilität der Prüfchemikalie(n) keine zuverlässigen Informationen vorliegen, sollten diese Merkmale unter den Testbedingungen (Nährmedium, Temperatur und Beleuchtung) untersucht werden. Hinweis: Bei der Prüfung von lichtabhängigen peroxidierenden Herbiziden sollte die verwendete Laborbeleuchtung das gleiche UV-Licht enthalten, das auch in natürlichem Sonnenlicht zu finden ist.
10. Der pH-Wert sollte gemessen und gegebenenfalls im Prüfmedium angepasst werden. Der Einhaltung des pH-Wertes des Prüfmediums kommt besondere Bedeutung zu, z.B. beim Testen von Metallen oder hydrolytisch instabilen Chemikalien. Weitere Hinweise zur Prüfung von Chemikalien mit physikalisch-chemischen Merkmalen, welche die Durchführung des Tests erschweren, sind dem OECD Guidance Document (11) zu entnehmen.
11. Die Testergebnisse sind gültig, wenn die mittlere Gesamtsprosslänge und die mittlere Gesamtsprossfrischmasse der Kontrollpflanzen sich während der Expositionsphase des Tests mindestens verdoppeln. Darüber hinaus dürfen die Kontrollpflanzen keine sichtbaren Anzeichen von Chlorose zeigen und sollten optisch frei von Verunreinigung durch andere Organismen wie z.B. Algen und/oder bakterielle Filme auf den Pflanzen, auf der Sedimentoberfläche und im Prüfmedium sein.
12. Der mittlere Variationskoeffizient für den Zellertrag basierend auf Messungen der Sprossfrischmasse (d. h. von Testbeginn bis Testende) bei den Kontrollkulturen beträgt maximal 35 % zwischen Replikaten.
13. Um das Prüfverfahren im Zeitverlauf zu testen, sollten Referenzchemikalien wie z.B. das im Ringtest (9) verwendete 3,5-Dichlorphenol in regelmäßigen Abständen geprüft werden. Die Daten aus dem Ringtest deuten darauf hin, dass die mittleren EC50-Werte von 3,5-Dichlorphenol für die verschiedenen Reaktionsvariablen zwischen 4,7 mg/l und 6,1 mg/l liegen (siehe Ringtest-Bericht bezüglich des Konfidenzintervalls für diese Werte). Die Referenzchemikalien sollten mindestens zweimal jährlich bzw. - wenn die Tests seltener durchgeführt werden - gleichzeitig mit den definitiven Toxizitätstests getestet werden. Eine Leitlinie für die erwarteten EC50-Werte von 3,5-Dichlorphenol ist dem statistischen Bericht des internationalen Ringtests (9) zu entnehmen.
Apparatur
14. Der Test sollte unter kontrollierten Umgebungsbedingungen durchgeführt werden, d. h. in einer Wachstumskammer, einem Wachstumsraum oder einem Labor mit regelbarer Tageslänge, Beleuchtung und Temperatur (siehe Abschnitt "Prüfbedingungen" Nrn. 56-58). Die Stammkulturen sollten getrennt von den Prüfgefäßen gehalten werden.
15. Der Versuch sollte unter Verwendung von Prüfgefäßen aus Glas wie z.B. Aquarien oder Kolben durchgeführt werden; in der Regel werden 2 l-Glaskolben (ca. 24 cm Höhe und 11 cm Durchmesser) verwendet. Jedoch können andere (d. h. größere) Gefäße geeignet sein, sofern eine ausreichende Wassertiefe vorhanden ist, um ein unbegrenztes Wachstum zu ermöglichen und die Pflanzen während der Testdauer unter Wasser zu halten.
16. Pflanztöpfe aus Kunststoff oder Glas (ca. 9 cm Durchmesser, 8 cm Höhe und 500 ml Volumen) können als Behältnisse für das Einsetzen der Pflanzen in das Sediment verwendet werden. Alternativ können Glaskolben verwendet werden, die in einigen Fällen auch bevorzugt werden (z.B. Prüfen von hydrophoben Chemikalien oder Chemikalien mit hohem Kow-Wert).
17. Neben der Wahl der Prüfgefäße und des bevorzugten Versuchsplans (siehe unten) muss die Wahl der Topf-/Kolbengröße ebenfalls berücksichtigt werden. Bei Verwendung von Versuchsplan A (ein Spross pro Topf und drei Töpfe pro Gefäß) werden möglicherweise kleinere Töpfe oder größere Gefäße benötigt. Bei Verwendung von Versuchsplan B (drei Sprosse pro Topf und ein Topf pro Gefäß) sollten die angegebenen Topf- und Gefäßgrößen angemessen sein. In allen Fällen sollte die Überstandswassertiefe mindestens 12 cm über der Sedimentoberfläche betragen. Das Verhältnis zwischen Sediment- und Wasseroberfläche sowie das Verhältnis zwischen Sediment- und Wasservolumen sollten protokolliert werden.
Testorganismus
18. Die in dieser Prüfmethode beschriebenen allgemeinen Ansätze können zum Prüfen verschiedener Wasserpflanzenarten verwendet werden. Jedoch sind die in dieser Prüfmethode angegebenen Bedingungen auf die Prüfung des Myriophyllum spicatum zugeschnitten. Diese Art gehört der Familie der Tausendblattgewächse (Haloragaceae) an.
19. Myriophyllum spicatum (Ähriges Tausendblatt) ist eine submerse, bewurzelte Art, die ein breites Spektrum an Bedingungen toleriert und in stehenden und fließenden Gewässern anzutreffen ist. M. spicatum ist eine mehrjährige Pflanze, die im Winter bis auf die Wurzeln zurückgeht. Die Pflanzen blühen in der Regel und setzen frei Samen ab. Jedoch ist die vegetative Vermehrung von Achselknospen oder Stängelfragmenten, die sich auf natürliche Weise oder nach Störung ablösen, oftmals die primäre Kolonisierungsmethode.
Kultivierung des Testorganismus
20. Die Pflanzen können aus natürlichen Populationen gewonnen oder über Lieferanten von Wasserpflanzen bezogen werden. In beiden Fällen sollte die Herkunft der Pflanzen dokumentiert und die Art überprüft werden. Bei der Entnahme von Myriophyllum spicatum aus der Natur, insbesondere in Regionen, wo es zu Hybridisierungen mit anderen Myriophyllum-Arten kommen könnte, sollte unbedingt sichergestellt werden, dass die richtige Art entnommen wird. Im Zweifelsfall wird die Verwendung von überprüften Laborkulturen aus bekannten Quellen empfohlen. Pflanzen, die chemischen Verunreinigungen ausgesetzt waren oder an bekanntermaßen verunreinigten Orten entnommen wurden, sollten in diesem Test nicht verwendet werden.
21. In Regionen, in denen M. spicatum in den Wintermonaten schwer zu beschaffen ist, kann die langfristige Haltung von Stammkulturen unter Treibhaus- oder Laborbedingungen notwendig sein. Die Stammkulturen sollten unter ähnlichen Bedingungen wie die Prüfbedingungen gehalten werden, obwohl Bestrahlungsstärke und Temperatur verringert werden können, um den Kultivierungsaufwand zu reduzieren (z.B. wenn über einen bestimmten Zeitraum keine Tests mit Myriophyllum vorgesehen sind). Um Raum für die Ausbreitung zu schaffen, sollten größere Aquarien und Pflanztöpfe als bei den Prüfungen verwendet werden. Die Zusammensetzung des Sediments und der Wassermedien wäre identisch mit derjenigen bei den Prüfungen, obwohl alternative Methode der Sedimentdüngung angewandt werden können (z.B. Verwendung von kommerziellen Langzeitdüngerformulierungen).
22. Die Stammpflanzen sollten frei von sichtbaren Verunreinigung durch andere Organismen, einschließlich Schnecken, Fadenalgen, Pilzen und Insekten, z.B. Eier oder Larven des Schmetterlings Paraponyx stratiotata sowie Larven oder adulte Tiere des Zünslers Eubrychius velutus, sein. Zum Beseitigen einer sichtbaren Verunreinigung muss das Pflanzenmaterial eventuell in Frischwasser gespült werden. Darüber hinaus sollte die Verunreinigung durch einzellige Algen und Bakterien auf ein Minimum reduziert werden, obwohl eine vollständige Sterilität des Pflanzenmaterials nicht notwendig ist. Die Stammkulturen sollten überwacht und gegebenenfalls umgesetzt werden, um eine Verunreinigung durch Algen und Bakterien zu vermeiden. Die Belüftung der Stammkulturen kann von Vorteil sein, falls eine Verunreinigung durch Algen oder Bakterien zum Problem werden sollte.
23. In allen Fällen werden die Pflanzen unter ähnlichen, jedoch nicht unbedingt identischen Bedingungen wie die Prüfbedingungen über einen angemessenen Zeitraum (d. h. > 2 Wochen) vor ihrer Verwendung in dem Test kultiviert/akklimatisiert.
24. Blühende Stammkulturen sollten in einem Test nicht verwendet werden, da die vegetativen Wachstumsraten während und nach der Blüte allgemein sinken.
Sediment
25. Für diesen Test wird das folgende formulierte Sediment, das auf dem in Kapitel C.28 dieses Anhangs (8) verwendeten künstlichen Sediment basiert, empfohlen. Das Sediment wird wie für Prüfmethode C.28 beschrieben zubereitet, außer dass die nachfolgend beschriebenen Nährstoffe zugegeben werden:
26. Die Herkunft von Torf, Kaolin-Ton und Sand sollte bekannt sein und dokumentiert werden. Ist die Herkunft unbekannt oder bedenklich, sollten die betreffenden Komponenten auf Nichtvorhandensein von chemischen Verunreinigungen (z.B. Schwermetalle, chlororganische Verbindungen, phosphororganische Verbindungen) überprüft werden.
27. Die trockenen Komponenten des Sediments sollten homogen gemischt werden, bevor die wässrige Nährlösung unter das Sediment gemischt wird. Das feuchte Sediment sollte mindestens zwei Tage vor der Verwendung vorbereitet werden, damit der Torf gut durchweichen kann und um zu verhindern, dass hydrophobe Torfpartikel an die Oberfläche treiben, wenn das Sediment mit den Medien überdeckt wird. Vor der Verwendung kann das feuchte Sediment im Dunkeln gelagert werden.
28. Für den Test wird das Sediment in Behältnisse von geeigneter Größe umgesetzt, wie z.B. Pflanztöpfe mit einem Durchmesser, der in die Glasgefäße passt (die Sedimentoberfläche sollte mindestens ca. 70 % der Gefäßoberfläche abdecken). In Fällen, in denen der Boden des Behältnisses Löcher aufweist, kann durch Abdecken des Bodens mit Filterpapier das Sediment im Behältnis zurückgehalten werden. Die Töpfe werden so mit dem Sediment befüllt, dass die Sedimentoberfläche eben ist, bevor sie mit einer dünnen Schicht (~ 2-3 mm) eines inerten Materials wie z.B. Sand, feinem Gartensand (oder gemahlenen Korallen) abgedeckt wird, um das Sediment an Ort und Stelle zu halten.
Prüfmedium
29. Für die Kultivierung und Prüfung von Myriophyllum spicatum wird Smart & Barko-Medium (12) empfohlen. Die Zubereitung dieses Mediums wird in Anlage 1 beschrieben. Der pH-Wert der Medien (Wasserphase) sollte zu Beginn der Prüfung für ein optimales Pflanzenwachstum zwischen 7,5 und 8,0 liegen.
Versuchsplan
30. Die Prüfung sollte mindestens sechs Replikat-Prüfgefäße für die unbehandelte Kontrolle und jeweils mindestens vier Replikat-Prüfgefäße für mindestens fünf Konzentrationsstufen umfassen.
31. Wenn die NOEC nicht bestimmt werden muss, kann das Prüfprotokoll geändert werden, indem die Anzahl der Konzentrationen erhöht und die Anzahl der Replikate verringert wird.
32. Jedes Prüfgefäß entspricht einem Replikat mit drei Sprossen. Für die Kultivierung der drei Sprosse in jedem Prüfgefäß gibt es zwei Optionen:
33. Die einzelnen Prüfgefäße sollten den Behandlungsgruppen randomisiert zugeordnet werden. Die Prüfgefäße müssen randomisiert im Prüfraum angeordnet werden, um die Auswirkungen räumlich unterschiedlicher Lichtintensitäten und Temperaturen zu minimieren.
Prüfchemikalienkonzentrationen und Kontrollgruppen
34. Die Konzentrationen sollten normalerweise einer geometrischen Reihe folgen; die Testkonzentrationen sollten sich um einen Faktor von höchstens 3,2 unterscheiden. Die vorherige Kenntnis der Toxizität der Prüfchemikalie aufgrund eines Dosisfindungsversuchs erleichtert die Auswahl geeigneter Testkonzentrationen.
35. Um ein angemessenes Konfidenzintervall sicherzustellen, müssen bei der Bestimmung eines ECx-Wertes die Testkonzentrationen so gewählt werden, dass der ECx-Wert eingeschlossen ist. Bei der Ermittlung von EC50 beispielsweise muss die höchste Testkonzentration größer als der EC50-Wert sein. Wenn der EC50-Wert außerhalb des Testkonzentrationsbereichs liegt, sind die entsprechenden Konfidenzintervalle groß, und das verwendete statistische Modell ist eventuell nicht geeignet. Die Verwendung weiterer Testkonzentrationen führt zu einem engeren Konfidenzintervall um den resultierenden ECx-Wert.
36. Zur Bestimmung der LOEC/NOEC-Werte (optionaler Endpunkt) sollte die niedrigste Testkonzentration so gering sein, dass das Wachstum nicht stark von dem Wachstum bei den Kontrollpflanzen abweicht. Außerdem muss die höchste Testkonzentration so hoch sein, dass das Wachstum signifikant geringer ist als das Wachstum der Kontrollgruppe. Bei Verwendung von mehr Replikaten steigt die statistische Aussagekraft des NOEC/ANOVA-Plans.
Limit-Test
37. Wenn ein Dosisfindungstest darauf hindeutet, dass die Prüfchemikalie bei Konzentrationen bis zu 100 mg/l bzw. bis zur Grenze der Löslichkeit im Prüfmedium oder im Falle einer Formulierung bis zur Dispersibilitätsgrenze keine schädigende Wirkung hat, kann ein Limit-Test durchgeführt werden, in dem die Reaktionen einer Kontrollgruppe und einer Behandlungsgruppe (100 mg/l bzw. eine mit der Löslichkeitsgrenze identische Konzentration oder 1.000 mg/kg Trockensediment) verglichen werden. Dieser Test sollte den allgemeinen Grundsätzen eines standardmäßigen Dosis-Wirkungs-Tests folgen, jedoch mit der Ausnahme, dass eine Erhöhung der Mindestanzahl an Replikaten auf sechs Prüfgefäße pro Kontrolle und Konzentration empfohlen wird. Das Wachstum der Kontrollgruppe und der Behandlungsgruppe kann mit einem statistischen Test zum Vergleich der Mittelwerte analysiert werden (z.B. mit einem Student-t-Test).
Testlösungen
38. Die Testlösungen werden gewöhnlich durch Verdünnung einer Stammlösung hergestellt, die durch Lösung oder Dispergierung der Prüfchemikalie in Smart & Barko-Medium unter Verwendung von entmineralisiertem (d. h. destilliertem oder entionisiertem) Wasser hergestellt wird (siehe Anlage 1).
39. Die höchste Testkonzentration sollte in der Regel die Wasserlöslichkeit der Prüfchemikalie oder im Falle von Formulierungen die Dispersibilität bei den jeweiligen Testbedingungen nicht überschreiten.
40. Bei Prüfchemikalien mit geringerer Wasserlöslichkeit muss unter Umständen mit einem organischen Lösungsmittel oder einem Dispergiermittel eine konzentrierte Stammlösung oder eine Dispersion der Chemikalie hergestellt werden, damit die exakten Mengen der Prüfchemikalie zum Prüfmedium leichter hinzugegeben werden können und die Dispergierung und die Auflösung der Chemikalie begünstigt wird. Die Verwendung solcher Lösungs- oder Dispergiermittel sollte unbedingt vermieden werden. Durch die Verwendung von Lösungs- oder Dispergiermitteln sollte keine Phytotoxizität entstehen. Häufig verwendete Lösungsmittel, die bei Konzentrationen bis zu 100 µl/l keine phytotoxische Wirkung haben, sind z.B. Aceton und Dimethylformamid. Wenn ein LÆsungsmittel oder ein Dispergiermittel verwendet wird, muss die Endkonzentration protokolliert und auf ein Minimum (≤ 100 µl/l) beschr´nkt werden. Unter diesen Umständen müssen alle behandelten Proben und die Kontrollproben das Lösungsmittel bzw. das Dispergiermittel in derselben Konzentration enthalten. Unbehandelte Kontrollreplikate, die kein Lösungs- oder Dispergiermittel enthalten, werden ebenfalls in den Versuchsplan eingeschlossen. Weitere Informationen zur Verwendung von Dispergiermitteln sind einem OECD Guidance Document (11) zu entnehmen.
41. Das Testverfahren variiert je nach Applikationsweg der Prüfchemikalie (d. h. über die Wasser- oder Sedimentphase). Das wahrscheinliche Verhalten der Prüfchemikalie in einem Wasser-Sediment-System sollte bei der Wahl der in der Prüfung verwendeten Expositionscharakteristik (d. h. statisch oder statisch mit Erneuerung, gespiktes Wasser oder gespiktes Sediment) berücksichtigt werden. Bei Chemikalien, die sich voraussichtlich stark im Sediment verteilen, sind in einigen Fällen Prüfungen mit gespiktem Sediment vorzuziehen.
Etablierungsphase
42. Von den Kulturpflanzen werden gesunde Sprossspitzen, d. h. ohne Seitensprosse, abgeschnitten, sodass man eine Sprosslänge von 6 cm (± 1 cm) erhält. Bei Versuchsplan A (ein Spross pro Topf und drei Töpfe pro Gefäß) werden einzelne Sprossspitzen in jeden Topf eingepflanzt. Bei Versuchsplan B (drei Sprosse pro Topf und ein Topf pro Gefäß) werden vier bis fünf Sprossspitzen in jeden Topf mit Sediment eingepflanzt.
43. In beiden Fällen sollten zusätzliche Töpfe bepflanzt werden, damit zu Beginn der Prüfung einheitliche Pflanzen ausgewählt werden können und damit Ersatzpflanzen vorhanden sind, an denen das Wurzelwachstum unmittelbar vor der Behandlung überprüft werden kann. Diese Ersatzpflanzen sollten zudem für Biomasse- und Längenmessungen an Sprossen an Tag 0 verwendet werden.
44. Die Sprosse werden so eingesetzt, dass sich ca. 3 cm, wobei mindestens zwei Knoten abgedeckt sind, unter der Sedimentoberfläche befinden.
45. Die Töpfe werden dann unter den gleichen Expositionsbedingungen wie in der Expositionsphase in die Prüfgefäße umgesetzt und sieben Tage in Smart & Barko-Medium gehalten, um Wurzelbildung hervorzurufen.
46. Nach dieser Zeit sollten mehrere Pflanzen in Ersatztöpfen entfernt werden, um das Wurzelwachstum zu überprüfen. Ist kein Wurzelwachstum erkennbar (d. h. sind keine Wurzelspitzen sichtbar), sollte die Etablierungsphase verlängert werden, bis Wurzelwachstum festzustellen ist. Mit diesem Schritt soll sichergestellt werden, dass die Pflanzen zum Zeitpunkt des Testbeginns aktiv wachsen.
Auswahl von einheitlichem Pflanzenmaterial
47. Bei Versuchsplan A (ein Spross pro Topf und drei Töpfe pro Gefäß) werden die Töpfe vor Testbeginn nach Einheitlichkeit ausgesucht. Bei Versuchsplan B (drei Sprosse pro Topf und ein Topf pro Gefäß) werden überschüssige Pflanzen entfernt, sodass drei Pflanzen, die in Größe und Aussehen einheitlich sind, übrig bleiben.
Exposition über die Wasserphase
48. Die nach Einheitlichkeit ausgesuchten Töpfe werden entsprechend den Anforderungen des Versuchsplans in die Prüfgefäße gestellt. Anschließend wird den Prüfgefäßen Smart & Barko-Medium hinzugegeben. Dabei ist darauf zu achten, dass das Sediment nicht gestört wird. Zu diesem Zweck können die Medien mithilfe eines Trichters hinzugegeben werden oder unter Zuhilfenahme einer Kunststoffscheibe, mit der das Sediment während des Einfüllens des Mediums in die Prüfgefäße abgedeckt wird, sofern die Scheibe unmittelbar danach wieder entfernt wird. Alternativ können die Pflanztöpfe nach Zugabe der Medien in die Prüfgefäße gestellt werden. In beiden Fällen können am Anfang der Expositionsphase gegebenenfalls frische Medien verwendet werden, um die potenzielle Algen- und Bakterienbildung auf ein Minimum zu beschränken und die Vorbereitung einzelner Testlösungschargen für die Replikate zu ermöglichen
49. Die Sprosslänge über dem Sediment wird entweder vor oder nach Zugabe des Mediums gemessen.
50. Die jeweiligen Mengen der Prüfchemikalie können dem Prüfmedium hinzugefügt werden, bevor dieses in die Prüfgefäße gegeben wird. Alternativ kann die Prüfchemikalie nach dem Hinzugeben in die Prüfgefäße in das Medium gegeben werden. In diesem Fall sollte sichergestellt werden, dass die Prüfchemikalie innerhalb des Testsystems ohne Störung des Sediments homogen verteilt wird.
51. In allen Fällen wird das Aussehen (z.B. klar, trüb usw.) der Prüfmedien am Anfang der Prüfung protokolliert.
Exposition über das Sediment
52. Gespikte Sedimente der gewählten Konzentration werden durch Zugabe einer Lösung der Prüfchemikalie direkt in frisches Sediment hergestellt. Eine Stammlösung der in entionisiertem Wasser gelösten Prüfchemikalie wird mittels Walzwerk, Mischwerk oder Mischen von Hand mit dem formulierten Sediment gemischt. Falls in Wasser schlecht löslich, kann die Prüfchemikalie in einer möglichst geringen Menge eines geeigneten organischen Lösungsmittels (z.B. Hexan, Aceton oder Chloroform) gelöst werden. Diese Lösung wird dann für ein Prüfgefäß mit ca. 10 g feinem Quarzsand gemischt. Anschließend lässt man das Lösungsmittel verdampfen. Der Sand wird dann mit einer geeigneten Menge an Sediment pro Prüfgefäß gemischt. Zum Lösen, Dispergieren oder Emulgieren der Prüfchemikalie dürfen nur leicht flüchtige Mittel verwendet werden. Es ist zu beachten, dass das Volumen/Gewicht des mit der Prüfchemikalie gespikten Sands bei der endgültigen Herstellung des Sediments berücksichtigt werden muss (d. h. dass das Sediment mit weniger Sand hergestellt werden sollte). Die Prüfchemikalie sollte mit dem Sediment gut durchmischt werden, um eine homogene Verteilung im Sediment zu gewährleisten.
53. Das gespikte Sediment wird in die Töpfe gefüllt (wie oben beschrieben). Die nach Einheitlichkeit und adäquatem Wurzelsystem ausgewählten Pflanzen werden aus den während der Etablierungsphase verwendeten Töpfen genommen und wie oben beschrieben in das gespikte Sediment umgesetzt.
54. Die Töpfe werden entsprechend den Anforderungen des Versuchsplans in die Prüfgefäße gestellt. Anschließend wird Smart & Barko-Medium vorsichtig hinzugegeben (z.B. mithilfe eines Trichters), um eine Störung des Sediments zu vermeiden. Die Sprosslänge über dem Sediment wird entweder vor oder nach dem Hinzugeben der Medien gemessen.
Erhaltung der Wasserpegel während der Testdauer
55. Das endgültige Wasservolumen muss protokolliert und der Wasserpegel an jedem Prüfgefäß markiert werden. Wenn mehr als 10 % Wasser während der Prüfung verdampfen, sollte der Wasserpegel mit destilliertem Wasser aufgefüllt werden. Die Prüfgefäße können gegebenenfalls mit einer transparenten Abdeckung wie z.B. transparenten Kunststoffdeckeln locker bedeckt werden, um die Verdampfung und Verunreinigung mit Algensporen auf ein Minimum zu beschränken.
Prüfbedingungen
56. Durch fluoreszierende Beleuchtung mit warmem und/oder kaltweißem Licht wird eine Bestrahlungsstärke hergestellt, die bei Messung unter photosynthetisch aktiver Strahlung (400-700 nm) an der Wasseroberfläche bei ca. 140 (± 20) µE·m-2 s-1 liegt. Dabei wird ein Hell-/Dunkel-Zyklus von 16 Stunden Licht und 8 Stunden Dunkelheit verwendet. Abweichungen von der gewählten Bestrahlungsstärke dürfen im Testbereich höchstens ± 15 % betragen.
57. Die Temperatur der Prüfgefäße beträgt 20 ± 2 °C.
58. Der pH-Wert des Kontrollmediums darf während des Tests höchstens um 1,5 Einheiten ansteigen. Auch bei Abweichungen von mehr als 1,5 Einheiten sind Testergebnisse dann nicht ungültig, wenn nachgewiesen werden kann, dass die oben angegebenen Validitätskriterien erfüllt sind.
Testdauer
59. Die Expositionsdauer beträgt 14 Tage.
Messungen und analytische Bestimmungen
60. Nach der Etablierungsphase und unmittelbar vor der Behandlung (d. h. an Tag 0) werden Ersatzpflanzen aus fünf randomisiert ausgewählten Töpfen bei dem Versuchsplan mit drei Pflanzen je Topf oder 15 Töpfen bei dem Versuchsplan mit einer Pflanze je Topf entnommen, um die Sprosslänge und die Frisch- und Trockenmasse wie nachfolgend beschrieben zu bewerten.
61. Bei Pflanzen, die in der Expositionsphase transferiert werden, werden die in Tabelle 1 angegebenen Bewertungen wie folgt vorgenommen:
62. Die Sprosslänge wird mit einem Lineal gemessen. Falls Seitensprosse vorhanden sind, sollten deren Anzahl bestimmt und deren Länge gemessen werden.
63. Die optischen Bewertungen der Pflanzengesundheit werden durch Protokollierung des Aussehens der Pflanzen und des allgemeinen Zustands des Prüfmediums durchgeführt. Folgende Beobachtungen sind zu protokollieren:
64. Die Bewertungen der Frischmasse werden am Testanfang und -ende durchgeführt, indem der Spross auf Sedimenthöhe abgeschnitten und dann vor dem Wiegen trockengetupft wird. Sedimentpartikel, die unten an der Sprosse haften könnten, sind vorsichtig zu entfernen. Das Sprossmaterial wird dann in einen Trocknungsofen bei 601 °C gelegt und auf ein konstantes Gewicht getrocknet, bevor es erneut gewogen und die Trockenmasse protokolliert wird.
65. Eine Übersicht über die biologischen Bewertungen, die während der Testdauer mindestens durchgeführt werden müssen, ist Tabelle 1 zu entnehmen.
Tabelle 1 Bewertungsplan
| Tag nach Behandlung (DAT) | Myriophyllum spicatum | |||
| Sprosslänge, Seitensprosslänge und -anzahl | Optische Bewertung der Sprosse | Sprossfrisch- und -trockenmasse
Optische Bewertung der Wurzeln | pH O2 | |
| 0 | A | A | A | A |
| 4 | - | - | - | - |
| 7 | - | A | - | A |
| 14 | A | A | A | A |
| A: Bewertungen erforderlich
- : keine Bewertungen erforderlich | ||||
Häufigkeit der Messungen und der analytischen Bestimmungen
66. Die Temperatur des Mediums in einem in der Wachstumskammer bzw. im Inkubator oder im jeweiligen Raum unter denselben Bedingungen gehaltenen Zusatzgefäß ist mindestens täglich (oder kontinuierlich mit einem Datenlogger) zu protokollieren.
67. In allen Replikatgefäßen sind der pH-Wert und die Konzentration an gelöstem Sauerstoff im Prüfmedium am Anfang der Prüfung, mindestens einmal während der Prüfung und am Ende der Prüfung zu messen. Die Messungen sollten jeweils zur selben Tageszeit erfolgen. Wenn bei der Zubereitung aller Replikate bei jeder Testkonzentration Bulklösungen verwendet werden, ist eine einzige Messung jeder Bulklösung an Tag 0 akzeptabel.
68. Die Lichtintensität sollte in der Wachstumskammer, im Inkubator oder im jeweiligen Raum an Punkten gemessen werden, die dem Niveau der Wasseroberfläche entsprechen. Die Messungen sollten mindestens am Anfang der Prüfung oder während der Prüfung vorgenommen werden. Dabei ist zu beachten, dass die Messwerte von der Methode zur Feststellung und zur Messung der Lichtintensität (insbesondere vom Sensortyp) abhängen. Kugelförmige Sensoren (die auf Licht aus allen Winkeln über und unter der Messebene reagieren) sowie "Kosinus" -Sensoren (die auf Licht aus allen Winkeln über der Messebene ansprechen) sind gegenüber unidirektionalen Sensoren zu bevorzugen, da diese Sensoren bei Mehrpunkt-Lichtquellen des hier beschriebenen Typs höhere Messwerte ergeben.
Analytische Messungen der Prüfchemikalie
69. Die korrekte Applikation der Prüfchemikalie sollte durch analytische Messungen der Prüfchemikalienkonzentrationen unterstützt werden.
70. Unmittelbar nach Beginn der Prüfung (d. h. am Tag der Applikation bei stabilen Prüfchemikalien oder eine Stunde nach Applikation bei instabilen Chemikalien) und am Ende der Prüfung sollten Wasserproben für die Analyse der Prüfchemikalie bei allen Testkonzentrationen entnommen werden.
71. Die Konzentrationen im Sediment und Porenwasser sollten am Anfang und am Ende der Prüfung mindestens bei der höchsten Testkonzentration bestimmt werden, außer wenn die Prüfchemikalien bekanntermaßen in Wasser stabil sind (> 80 % des Nominalwerts). Die Messungen im Sediment und Porenwasser sind u. U. nicht notwendig, wenn die Verteilung der Prüfchemikalie zwischen Wasser und Sediment in einem Wasser/Sediment-Versuch unter vergleichbaren Bedingungen (d. h. Sediment/Wasser-Verhältnis, Applikationsmethode, Sedimenttyp) eindeutig bestimmt wurde.
72. Durch die Entnahme von Sedimentproben am Anfang der Prüfung wird das Testsystem wahrscheinlich gestört. Somit können zusätzliche behandelte Prüfgefäße notwendig sein, um analytische Messungen am Anfang und am Ende der Prüfung zu ermöglichen. Wenn Zwischenbewertungen als erforderlich angesehen werden, d. h. an Tag 7, und bei den Analysen größere Sedimentmengen benötigt werden, die nicht ohne Weiteres aus dem Testsystem entnommen werden können, sollten die analytischen Messungen ebenfalls anhand von zusätzlichen Prüfgefäßen durchgeführt werden, die auf dieselbe Weise behandelt wurden wie die für die biologischen Bewertungen verwendeten Prüfgefäße.
73. Zum Trennen des Porenwassers wird eine Zentrifugierung, z.B. bei 10.000 g und 41 °Cfür 30 Minuten, empfohlen. Wenn sich die Prüfchemikalie jedoch nachweislich nicht an Filter adsorbiert, ist auch eine Filtration akzeptabel. Bei zu kleinen Probenvolumina kann es vorkommen, dass sich die Konzentrationen im Porenwasser nicht analysieren lassen.
74. Bei semistatischen Prüfungen (d. h. Exposition über die Wasserphase), bei denen nichtdavon ausgegangen wird, dass die Konzentration der Prüfchemikalie(n) während der Testdauer ohne Erneuerung der Testlösungen innerhalb von ± 20 % der Nominalkonzentration konstant bleibt, sollten bei jeder Erneuerung gebrauchte und frisch zubereitete Testlösungen für Analysen der Prüfchemikalienkonzentration entnommen werden.
75. In Fällen, in denen die gemessene Ausgangskonzentration der Prüfchemikalie zwar nicht innerhalb von ± 20 % der Nominalkonzentration liegt, für die aber hinreichend nachgewiesen werden kann, dass die Ausgangskonzentrationen wiederholbar und stabil sind (d. h. dass die Konzentrationen im Bereich von 80-120 % der Ausgangskonzentration liegen), sind chemische Bestimmungen nur bei der höchsten und der niedrigsten Konzentration erforderlich.
76. In allen Fällen braucht die Bestimmung der Prüfchemikalienkonzentrationen nur an einem Replikatgefäß bei jeder Testkonzentration vorgenommen zu werden. Alternativ können die Testlösungen aller Replikate für jede Konzentration für Analysen zusammengefasst werden.
77. Wenn nachgewiesen wird, dass die Prüfchemikalienkonzentration während des Tests zufriedenstellend innerhalb von ± 20 % der Nominalkonzentration oder der gemessenen Ausgangskonzentration aufrechterhalten werden konnte, kann die Analyse der Ergebnisse und die anschließende Ableitung der Endpunkte auch ausgehend von den Nominalwerten bzw. von den gemessenen Ausgangswerten erfolgen.
78. In diesen Fällen sollten die Wirkungskonzentrationen auf den nominalen oder gemessenen Wasserkonzentrationen am Anfang der Prüfung basieren.
79. Wird jedoch nachgewiesen, dass die Konzentration während der Prüfung abgenommen hat (d. h. nicht innerhalb von ± 20 % der Nominalkonzentration oder der gemessenen Ausgangskonzentration in der behandelten Kammer aufrechterhalten werden konnte), sollte bei der Analyse der Ergebnisse vom geometrischen Mittel der Konzentration während der Expositionsdauer oder von Modellen ausgegangen werden, die den Rückgang der Prüfchemikalienkonzentration in der behandelten Kammer beschreiben (11).
80. In Fällen, in denen ein Lösungs-/Dispergiermittel erforderlich ist, können die Daten aus Lösungsmittel- und unbehandelten Kontrollen für statistische Analysen zusammengefasst werden, sofern die Reaktionen der Lösungsmittel- und unbehandelten Kontrollen nicht statistisch signifikant unterschiedlich sind.
Reaktionsvariablen
81. Mit der Prüfung sollen die Wirkungen der Prüfchemikalie auf das vegetative Wachstum der Testspezies unter Verwendung von zwei Reaktionsvariablen, der durchschnittlichen spezifischen Wachstumsrate und des Zellertrags, bestimmt werden:
Durchschnittliche spezifische Wachstumsrate
82. Diese Reaktionsvariable wird auf der Grundlage von Veränderungen der Logarithmen der Hauptsprosslänge, der Gesamtsprossfrischmasse und der Gesamtsprosstrockenmasse im Zeitablauf in den Kontrollen und einzelnen Behandlungsgruppen berechnet. Diese Variable wird für jedes Replikat jeder Kontroll- und Behandlungsgruppe berechnet. Die mittlere Länge und das mittlere Gewicht der drei Pflanzen pro Prüfgefäß (Replikat) und anschließend die Wachstumsrate für jedes Replikat sollten anhand der folgenden Formel berechnet werden:
| Ln (Nj) - ln (Ni) | |
| µi-j = |
|
| t |
Dabei sind:
µi-: durchschnittliche spezifische Wachstumsrate vom Zeitpunkt i bis zum Zeitpunkt j
Ni: Messvariable im Prüfgefäß bzw. im Kontrollgefäß zum Zeitpunkt i
Nj: Messvariable im Prüfgefäß bzw. im Kontrollgefäß zum Zeitpunkt j
t: Zeitraum vom Zeitpunkt i bis zum Zeitpunkt j
83. Anhand der Reaktionen der Replikate sind für jede Behandlungsgruppe und für jede Kontrollgruppe die mittlere Wachstumsrate und die Varianzschätzungen zu berechnen.
84. Die durchschnittliche spezifische Wachstumsrate wird für die gesamte Testdauer berechnet. (In der vorstehenden Formel bezeichnet "i"den Beginn der Prüfung und "j" das Ende der Prüfung.) Für alle Konzentrationen der Testlösungen und der Kontrolllösungen sind ein Mittelwert für die durchschnittliche spezifische Wachstumsrate zu berechnen und die entsprechenden Varianzschätzungen vorzunehmen.
85. Die Hemmung der Wachstumsrate in Prozent (Ir) kann anschließend für jede Testkonzentration (Behandlungsgruppe) nach der folgenden Formel berechnet werden:
| (µC - µT) | ||
| %Ir = |
| x 100 |
| µC |
Dabei sind:
% Ir: Hemmung der durchschnittlichen spezifischen Wachstumsrate in Prozent
µC: Mittelwert für µ in der Kontrollgruppe
µT: Mittelwert für µ in der Behandlungsgruppe
Zellertrag
86. Diese Reaktionsvariable wird auf der Grundlage von Veränderungen der Gesamtsprosslänge, der Gesamtsprossfrischmasse und der Gesamtsprosstrockenmasse im Zeitablauf in den Kontrollen und einzelnen Behandlungsgruppen berechnet. Die mittlere prozentuale Hemmung des Zellertrags (% Iy) kann für jede Behandlungsgruppe wie folgt berechnet werden:
%Iy = (bC - bT) / bC
Dabei sind:
% Iy: Verringerung des Zellertrags in Prozent
bC: Biomasse am Ende des Tests abzüglich der Biomasse am Anfang des Tests (Kontrollgruppe)
bT: Biomasse am Ende des Tests abzüglich der Biomasse am Anfang des Tests (Behandlungsgruppe)
Darstellung der Konzentrations-Wirkungs-Kurven
87. Die Konzentrations-Wirkungs-Kurven der mittleren Hemmung der Reaktionsvariablen in Prozent (Ir oder Iy, wie oben beschrieben berechnet) und die logarithmische Konzentration der Prüfchemikalie werden grafisch dargestellt.
ECx-Schätzung
88. Schätzungen der ECx-Werte (z.B. EC50) sollten sowohl auf der durchschnittlichen spezifischen Wachstumsrate (ErCx) als auch auf dem Zellertrag (EyCx) beruhen, und beide Werte sollten ihrerseits von der Gesamtsprossfrischmasse, Gesamtsprosstrockenmasse und der Gesamtsprosslänge ausgehen.
89. Es wird darauf hingewiesen, dass die mit diesen beiden Reaktionsvariablen berechneten ECx-Werte nicht vergleichbar sind; der entsprechende Unterschied muss bei der Verwendung der Testergebnisse berücksichtigt werden. Die mit der durchschnittlichen spezifischen Wachstumsrate (ErCx) berechneten Werte für ECx werden im Allgemeinen höher sein als die anhand des Zellertrags (EyCx) ermittelten Werte, wenn die für diese Prüfmethode vorgesehenen Bedingungen eingehalten werden; dies ist auf die unterschiedliche mathematische Grundlage der beiden Berechnungsverfahren zurückzuführen. Die auftretenden Unterschiede sollten jedoch nicht als Anzeichen für eine unterschiedliche Empfindlichkeit der beiden Reaktionsvariablen betrachtet werden; die Werte sind einfach mathematisch verschieden.
Statistische Verfahren
90. Ziel ist die Ermittlung einer quantitativen Konzentrations-Wirkungs-Beziehung durch Regressionsanalyse. Im Anschluss an eine linearisierte Transformation der Reaktionsdaten (z.B. in Einheiten nach dem Probit-, Logit- oder Weibull-Modell) (13) kann eine gewichtete lineare Regression vorgenommen werden; nicht-lineare Regressionsverfahren, mit denen die unvermeidlichen Unregelmäßigkeiten der Daten und Abweichungen von gleichförmigen Verteilungen besser verarbeitet werden können, werden jedoch bevorzugt. Im Bereich von Null bzw. der vollständigen Hemmung können diese Unregelmäßigkeiten durch die Transformation vergrößert werden und die Analyse beeinträchtigen (13). Es wird darauf hingewiesen, dass Standard-Analysemethoden mit Probit-, Logit- oder Weibull-Transformationen für quantale Daten (z.B. Mortalität oder Überlebensraten) vorgesehen sind und zur Verwendung in Verbindung mit Wachstums- oder Zellertragsdaten entsprechend modifiziert werden sollten. Spezifische Verfahren zur Bestimmung von ECx-Werten aus kontinuierlichen Daten sind den Quellen (14) (15) (16) (17) zu entnehmen.
91. Für jede zu analysierende Reaktionsvariable sind aufgrund der Konzentrations-Wirkungs-Beziehung ECx-Werte zu ermitteln. Die 95 %-Konfidenzgrenzen sollten für jeden ermittelten Wert bestimmt werden. Die Qualität der Übereinstimmung der Reaktionsdaten mit dem Regressionsmodell sollte grafisch oder statistisch bewertet werden. Die Regressionsanalyse wird mit den Reaktionen der einzelnen Replikate (und nicht mit den Mittelwerten der Behandlungsgruppe) durchgeführt.
92. Schätzwerte für EC50 und für die Konfidenzintervalle können auch durch lineare Interpolation mit einem Bootstrapping-Algorithmus (18) erzielt werden, wenn die verfügbaren Regressionsmodelle/-methoden für die betreffenden Daten nicht geeignet sind.
93. Für eine Schätzung der LOEC-Werte und entsprechend auch der NOEC-Werte müssen die Mittelwerte der behandelten Lösungen durch Varianzanalyseverfahren (ANOVA) verglichen werden. Der Mittelwert der einzelnen Konzentrationen ist dann anhand einer geeigneten Prüfmethode mit dem Mittelwert der Kontrollgruppe zu vergleichen (z.B. Dunnett-Test, Williams-Test) (19) (20) (21) (22). Die ANOVA-Annahme der Normalverteilung (NV) und der Varianzhomogenität (VH) muss einer Überprüfung unterzogen werden. Diese Überprüfung sollte durch einen Shapiro-Wilks-Test (NV) oder Levene-Test (VH) durchgeführt werden. Wenn die Annahme der Normalverteilung und der Varianzhomogenität nicht erfüllt ist, kann gelegentlich eine Korrektur durch logarithmische Datentransformation erfolgen. Bei außerordentlicher Varianzheterogenität und/oder Abweichung von der Normalverteilung, die durch Transformation nicht korrigiert werden kann, sollten Analysen durch Methoden wie z.B. Bonferroni-Welch-t-Test, Jonckheere-Terpstra-Test (Step-Down) und Bonferroni-Median-Test erwogen werden. Weitere Hinweise zur Bestimmung von NOEC-Werten sind Quelle (16) zu entnehmen.
94. Der Prüfbericht muss folgende Informationen enthalten:
Prüfchemikalie
Einkomponentiger Stoff:
Mehrkomponentiger Stoff, UVCB-Stoffe und Gemische:
Testspezies
Prüfbedingungen
Ergebnisse
(1) Kapitel C.26 dieses Anhangs: Lemna sp. - Wachstumsinhibitionstest.
(2) Kapitel C.3 dieses Anhangs: Süßwasseralgen und Cyanobakterien: Wachstumsinhibitionstest.
(3) Maltby, L. et al. (2010), Aquatic Macrophyte Risk Assessment for Pesticides, Guidance from the AMRAP Workshop in Wageningen (NL), 14.-16. Januar2008.
(4) Arts, G.H.P. et al. (2008), Sensitivity of submersed freshwater macrophytes and endpoints in laboratory toxicity tests, Environmental Pollution, Vol. 153, 199-206.
(5) ISO 16191:2013 Wasserbeschaffenheit - Bestimmung der toxischen Wirkung von Sedimenten auf das Wachstumsverhalten von Myriophyllum aquaticum.
(6) Knauer, K. et al. (2006), Methods for assessing the toxicity of herbicides to submersed aquatic plants, Pest Management Science, Vol. 62/8, 715-722.
(7) Kapitel C.50 dieses Anhangs: Sedimentfreier Myriophyllum spicatum-Toxizitätstest.
(8) Kapitel C.28 dieses Anhangs: Chironomiden-Toxizitätstest in Sediment-Wasser-Systemen mit gespiktem Wasser.
(9) Ratte, M., H. Ratte (2014), Myriophyllum Toxicity Test: Result of a ring test using M. aquaticum and M. spicatum grown in a water-sediment system, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 206, OECD Publishing, Paris.
(10) Davies, J. et al. (2003), Herbicide risk assessment for non-target aquatic plants: sulfosulfuron - a case study, Pest Management Science, Vol. 59/2, 231 - 237.
(11) OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, OECD Environment, Health and Safety Publications (EHS), Series on Testing and Assessment, No. 23, OECD Publishing, Paris.
(12) Smart, R.M., J.W. Barko (1985), Laboratory culture of submersed freshwater macrophytes on natural sediments, Aquatic Botany, Vol. 21/3, 251-263.
(13) Christensen, E.R., N. Nyholm (1984), Ecotoxicological Assays with Algae: Weibull Dose-Response Curves, Environmental Science Technology, Vol. 18/9, 713-718.
(14) Nyholm, N. et al. (1992), Statistical treatment of data from microbial toxicity tests, Environmental Toxicology and Chemistry, Vol. 11/2, 157-167.
(15) Bruce, R.D., D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environmental Toxicology and Chemistry, Vol. 11/10, 1485-1494.
(16) OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application, OECD Environmental Health and Safety Publications (EHS), Series on Testing and Assessment No. 54, OECD, Paris.
(17) Brain, P., R. Cousens (1989), An equation to describe dose-responses where there is stimulation of growth at low doses, Weed Research, Vol. 29/2, 93-96.
(18) Norberg-King, T.J. (1988), An interpolation estimate for chronic toxicity: The ICp approach, National Effluent Toxicity Assessment center Technical Report 05-88. US EPA, Duluth, MN.
(19) Dunnett, C.W. (1955), A multiple comparisons procedure for comparing several treatments with a control, Journal of the American Statistical Association, Vol. 50/272, 1096-1121.
(20) Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, Vol. 20/3, 482-491.
(21) Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics, Vol. 27/1, 103-117.
(22) Williams, D.A. (1972), The comparison of several dose levels with a zero dose control, Biometrics, Vol. 28/2, 519-531.
| Zusammensetzung des Smart & Barko-Mediums | Anlage 1 |
| Komponente | Reagenzmenge, die Wasser zugesetzt wir * (mg/l) |
| CaCl2 · 2 H2O | 91,7 |
| MgSO4 *7 H2O | 69,0 |
| NaHCO3 | 58,4 |
| KHCO3 | 15,4 |
| pH (Luftgleichgewicht) | 7,9 |
| *) entmineralisiertes (d. h. destilliertes oder entionisiertes) Wasser | |
| Definitionen | Anlage 2 |
Definitionen
Biomasse ist die Frisch- und/oder Trockenmasse des in einer Population enthaltenen lebenden Materials. In diesem Test entspricht die Biomasse der Summe aus Hauptspross, allen Seitenästen und allen Wurzeln.
Chemikalie ist ein Stoff oder Gemisch.
Chlorose ist eine Farbveränderung von grün nach gelb des Testorganismus, insbesondere der Wirteln.
ECx ist die Konzentration der im Prüfmedium aufgelösten Prüfchemikalie, bei der sich binnen einer festgelegten Expositionsdauer eine Reduzierung des Wachstums von Myriophyllum spicatum um x % (z.B. 50 %) ergibt. (Die Expositionsdauer ist ausdrücklich zu nennen, wenn die Dauer von der vollständigen oder normalen Testdauer abweicht.) Um einen von der Wachstumsrate bzw. vom Zellertrag abgeleiteten EC-Wert eindeutig zu kennzeichnen, wird die Bezeichnung "ErC" für die Wachstumsrate und "EyC" für den Zellertrag jeweils gefolgt von der verwendeten Messvariablen (z.B. ErC (Hauptsprosslänge) verwendet.
Endpunkt des Tests beschreibt den allgemeinen Faktor, der als Testziel durch die Prüfchemikalie gegenüber der Kontrollprobe verändert wird; bei dieser Prüfmethode ist der Endpunkt des Tests die Wachstumshemmung; diese kann durch verschiedene Reaktionsvariablen ausgedrückt werden, die jeweils auf mindestens einer Messvariablen beruhen.
Lowest Observed Effect Concentration (LOEC) ist die niedrigste geprüfte Konzentration, bei der beobachtet wurde, dass die Chemikalie binnen einer bestimmten Expositionsdauer gegenüber der Kontrollprobe eine statistisch signifikante Wachstumsreduzierung bewirkt (bei p < 0,05); Alle Testkonzentrationen oberhalb der LOEC müssen jedoch eine schädigende Wirkung haben, die gleich den bei der LOEC beobachteten Wirkungen oder größer als diese ist. Können diese beiden Bedingungen nicht erfüllt werden, muss ausführlich erklärt werden, wie die LOEC (und damit auch die NOEC) ausgewählt wurde.
Messvariablen sind alle Variablentypen, die gemessen werden, um mit mindestens einer Reaktionsvariablen den Endpunkt des Tests zu beschreiben. Bei dieser Prüfmethode bilden Hauptsprosslänge, Gesamtseitenastlänge, Gesamtsprosslänge, Gesamtwurzellänge, Frischmasse, Trockenmasse und Anzahl der Wirteln die Messvariablen.
Monokultur ist eine Kultur mit einer Pflanzenart.
Nekrose ist abgestorbenes (d. h. weißes oder dunkelbraunes) Gewebe des Testorganismus.
No Observed Effect Concentration (NOEC) ist die Testkonzentration unmittelbar unterhalb der LOEC.
Prüfchemikalie bezeichnet einen Stoff oder ein Gemisch, der bzw. das nach dieser Methode geprüft wird.
Prüfmedium ist das gesamte synthetische Nährmedium, in dem die zu prüfenden Pflanzen wachsen, wenn sie der Prüfchemikalie ausgesetzt werden; die Prüfchemikalie wird im Allgemeinen im Prüfmedium aufgelöst.
Reaktionsvariable ist eine Variable für die geschätzte Toxizität, abgeleitet aus beliebigen gemessenen Variablen zur Beschreibung der Biomasse durch verschiedene Berechnungsmethoden. Bei dieser Prüfmethode sind die Wachstumsrate und der Zellertrag die Reaktionsvariablen, die aus Messvariablen wie z.B. Hauptsprosslänge, Gesamtsprosslänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln abgeleitet werden.
Semistatischer (Erneuerungs-)Test ist ein Test, bei dem die Testlösung während der Testdauer regelmäßig in bestimmten Intervallen erneuert wird.
Statischer Test ist eine Prüfmethode, bei der die Testlösung während der Testdauer nicht erneuert wird.
UVCB-Stoffe sind Stoffe mit unbekannter oder schwankender Zusammensetzung, komplexe Reaktionsprodukte oder biologische Materialien.
Wachstum ist eine Zunahme der Messvariablen, z.B. Hauptsprosslänge, Gesamtseitenastlänge, Gesamtsprosslänge, Gesamtwurzellänge, Frischmasse, Trockenmasse oder Anzahl der Wirteln während der Testdauer.
Wachstumsrate (durchschnittliche spezifische Wachstumsrate) ist die logarithmische Zunahme der Messvariablen während der Expositionsdauer. Hinweis: Die auf die Wachstumsrate bezogenen Reaktionsvariablen sind unabhängig von der Testdauer, solange das Wachstumsmuster der nicht exponierten Kontrollorganismen exponential ist.
Zellertrag ist der Wert einer Messvariablen zur Beschreibung der Biomasse am Ende der Expositionsdauer abzüglich der Messvariablen am Anfang der Expositionsdauer. Hinweis: Im Falle eines exponentialen Wachstumsmusters der nicht exponierten Organismen verringern sich die auf den Zellertrag bezogenen Reaktionsvariablen mit der Testdauer.
C.52 Medaka erweiterte 1-Generationen-Reproduktionstest (MEOGRT) 24
Archivdatei => C.52 (PDF-Format)
Die vollständige Beschreibung dieser Prüfmethode wurde gestrichen.
Die gleichwertige internationale Prüfmethode ist in Teil 0 Tabelle 3 aufgeführt.
---
weiter zur => C.53 The Larval Amphibian Growth and Developmen Assay (LAGDA)(PDF-Format)
 | ENDE |  |