umwelt-online: Verordnung (EG) Nr. 440/2008 zur Festlegung von Prüfmethoden gemäß der VO (EG) Nr. 1907/2006 zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) (7)
 | zurück |
B.2 Akute Inhalationstoxizität 14
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie 403 (2009) (1). Die ursprüngliche Prüfrichtlinie 403 (TG 403) zur akuten Inhalation wurde 1981 angenommen. Diese überarbeitete Prüfmethode B.2 (die der überarbeiteten TG 403 entspricht) ist dazu ausgelegt, mehr Flexibilität zu bieten, die Verwendung von Versuchstieren zu reduzieren und die Regulierungsanforderungen zu erfüllen. Die überarbeitete Prüfmethode umfasst zwei Arten von Versuchen: ein traditionelles LC50-Protokoll und ein Konzentration-x-Zeit-Protokoll (c x t). Die Hauptmerkmale dieser Prüfmethode sind die Möglichkeit, eine Konzentrations-Wirkungs-Beziehung aufzustellen, die von nichtletalen zu letalen Ergebnissen reicht, um eine mittlere letale Konzentration (LC50), eine nichtletale Schwellenkonzentration (z.B. LC01) und die Steigung der Kurve zu bestimmen und eine eventuelle geschlechts-spezifische Empfindlichkeit festzustellen. Das c-x-t-Protokoll sollte angewendet werden, wenn wegen einer spezifischen Regelung oder aus wissenschaftlicher Notwendigkeit eine Prüfung von Tieren über unterschiedliche Zeiträume erforderlich ist, z.B. für Zwecke der Notfallplanung [z.B. zur Ableitung von Störfallbeurteilungswerten (Acute Exposure Guideline Levels - AEGL, Emergency Response Planning Guidelines - ERPG oder Acute Exposure Threshold Levels - AETL)] oder für die Flächennutzungsplanung.
2. Eine Anleitung für die Durchführung und Auswertung dieser Prüfmethoden ist im Guidance Document on Acute Inhalation Toxicity Testing (GD 39 (2)) enthalten.
3. Die im Zusammenhang mit dieser Prüfmethode verwendeten Begriffe werden am Ende dieses Kapitels und im GD 39 (2) definiert.
4. Diese Prüfmethode ermöglicht die Charakterisierung von Prüfsubstanzen und eine quantitative Risikobewertung und sie erlaubt die Einstufung von Prüfsubstanzen nach der Verordnung (EG) Nr. 1272/2008 (3). Das GD 39 (2) enthält Hinweise zur Auswahl der geeigneten Prüfmethode für akute Prüfungen. Wenn nur Informationen über die Einstufung und Kennzeichnung benötigt werden, wird im Allgemeinen Kapitel B.52 dieses Anhangs (4) empfohlen [siehe GD 39 (2)]. Diese Prüfmethode B.2 ist nicht speziell für die Prüfung von Spezialmaterialien wie schwer löslichen isometrischen oder Fasermaterialien oder hergestellten Nanomaterialien bestimmt.
5. Bevor Versuche nach dieser Prüfmethode in Betracht gezogen werden, sollte das Prüflabor alle verfügbaren Informationen über die Prüfsubstanz, einschließlich bereits vorliegender Studien (z.B. Kapitel B.52 dieses Anhangs (4)), deren Ergebnisse darauf hindeuten, dass auf weitere Versuche verzichtet werden kann, auswerten, damit möglichst wenig Tiere verwendet werden. Für die Auswahl der in Bezug auf Art, Stamm und Geschlecht am besten geeigneten Tiere sowie der geeigneten Expositionsart und Prüfkonzentrationen sollten u. a. Informationen wie die Identität, die chemische Struktur und die physikalisch-chemischen Eigenschaften der Prüfsubstanz, Ergebnisse jeglicher In-vitro- oder In-vivo-Toxizitätsprüfungen, vorgesehene Verwendungen und die Möglichkeit der Exposition des Menschen, (Q)SAR-Daten und toxikologische Daten über strukturverwandte Substanzen herangezogen werden [siehe GD 39 (2)].
6. Die Prüfung hautätzender und/oder reizender Prüfsubstanzen in Konzentrationen, die voraussichtlich starke Schmerzen und/oder Qualen verursachen, sollte soweit wie möglich vermieden werden. Die hautätzenden/reizenden Eigenschaften sollten von Fachleuten auf der Grundlage von Erfahrungswerten bei Mensch und Tier (z.B. Studien mit wiederholter Verabreichung in nicht hautätzenden/reizenden Konzentrationen), vorliegenden In- vitro-Daten (z.B. aus den Kapiteln B.40 (5), B.40bis (6) dieses Anhangs oder OECD TG 435 (7)), den pH- Werten sowie Informationen über ähnliche Substanzen oder anderen sachdienlichen Daten beurteilt werden, damit untersucht werden kann, ob auf weitere Versuche verzichtet werden kann. Bei spezifischen Regulierungsanforderungen (z.B. für Zwecke der Notfallplanung) kann diese Prüfmethode verwendet werden, um Tiere diesen Stoffen auszusetzen, weil die Methode dem Studienleiter oder Hauptprüfer die Kontrolle über die Auswahl der Zielkonzentrationen gibt. Die Zielkonzentrationen sollten jedoch keine schwerwiegenden reizenden/hautätzenden Wirkungen hervorrufen; sie sollten aber ausreichen, um die Konzentrations-Wirkungs-Kurve so zu erweitern, dass das regulatorische und wissenschaftliche Ziel der Prüfung erreicht wird. Diese Konzentrationen sollten von Fall zu Fall ausgewählt werden; die Wahl der Konzentration ist zu begründen [siehe GD 39 (2)].
7. Diese überarbeitete Prüfmethode B.2 wurde entwickelt, um ausreichende Informationen über die akute Toxizität einer Prüfsubstanz zu gewinnen, damit sie eingestuft werden kann, und um Letalitätsdaten (z.B. LC50, LC01 und Steigung) für eines oder beide Geschlechter zu erhalten, die für quantitative Risikobewertungen benötigt werden. Die Prüfmethode umfasst zwei Methoden. Bei der ersten Methode handelt es sich um ein traditionelles Protokoll, bei dem Gruppen von Tieren für eine im Voraus festgelegte Dauer von üblicherweise 4 Stunden einer Grenzkonzentration (Limit-Test) oder schrittweise einer Reihe von Konzentrationen ausgesetzt werden. Für spezifische Regulierungszwecke sind andere Expositionszeiten möglich. Die zweite Methode ist ein Protokoll (c x t), bei dem Gruppen von Tieren über mehrere unterschiedliche Zeiträume einer Konzentration (Grenzkonzentration) oder einer Reihe unterschiedlicher Konzentrationen ausgesetzt werden.
8. Moribunde Tiere oder Tiere, die offensichtlich unter Schmerzen leiden oder Anzeichen von schwerem und anhaltendem Leiden zeigen, sollten auf humane Weise getötet werden und sind bei der Auswertung der Testergebnisse auf die gleiche Weise zu werten wie während des Tests gestorbene Tiere. Kriterien für die Entscheidung, moribunde oder schwer leidende Tiere zu töten, sowie Hinweise zur Erkennung des absehbaren oder bevorstehenden Todes sind Gegenstand des OECD Guidance Document No. 19 on Humane Endpoints (8).
Auswahl von Versuchstierarten
9. Es sind junge, gesunde, adulte Tiere aus üblicherweise eingesetzten Laborstämmen zu verwenden. Bevorzugtes Versuchstier ist die Ratte. Die Verwendung anderer Tierarten ist zu begründen.
Vorbereitung der Tiere
10. Die weiblichen Tiere dürfen weder bereits geworfen haben noch momentan trächtig sein. Am Tag der Exposition sollten die jungen, adulten Tiere 8 bis 12 Wochen alt sein; ihr Körpergewicht sollte innerhalb von ± 20 % des mittleren Gewichts für jedes Geschlecht aller zuvor exponierten Tiere desselben Alters liegen. Die Tiere werden nach Zufallskriterien ausgewählt, zur individuellen Identifizierung markiert und vor Beginn der Prüfung für einen Zeitraum von mindestens fünf Tagen in ihren Käfigen an die Laborbedingungen gewöhnt. Die Tiere sollten auch für einen kurzen Zeitraum vor der Prüfung an die Versuchsapparatur gewöhnt werden, da dies den Stress durch die Umsetzung in eine neue Umgebung verringert.
11. Die Temperatur in dem Raum, in dem die Versuchstiere gehalten werden, sollte 22 ± 3 °C betragen. Die relative Luftfeuchtigkeit sollte im Idealfall zwischen 30 und 70 % liegen; bei Verwendung von Wasser als Vehikel könnte dies jedoch unmöglich sein. Die Tiere sollten vor und nach den Expositionen im Allgemeinen nach Geschlecht und Konzentration in Käfigen gruppiert werden, wobei aber die Anzahl der Tiere pro Käfig noch eine genaue Beobachtung der einzelnen Tiere ermöglichen muss und Verluste aufgrund von Kannibalismus oder Kämpfen minimiert werden sollten. Wenn die Tiere der Prüfsubstanz nur mit der Nase ausgesetzt werden sollen, müssen sie möglicherweise an die Restrainer gewöhnt werden. Die Restrainer sollten die Tiere weder körperlich noch in Bezug auf Wärme oder Fixierung übermäßig beeinträchtigen. Die Fixierung kann physiologische Endpunkte wie Körpertemperatur (Hyperthermie) und/oder das Atemminutenvolumen beeinflussen. Wenn generische Daten zeigen, dass keine derartigen Veränderungen in nennenswertem Ausmaß vorkommen, ist eine Eingewöhnung an die Restrainer nicht erforderlich. Bei der Ganzkörperexposition gegen ein Aerosol sollten die Tiere während der Exposition einzeln untergebracht sein, damit sie die Prüfsubstanz nicht durch das Fell ihrer Käfiggenossen filtriert einatmen. Außer während der Exposition kann herkömmliches und zertifiziertes Labortierfutter verwendet werden bei uneingeschränkter Versorgung mit Trinkwasser. Die Beleuchtung sollte künstlich sein und die Hell- und Dunkelphasen sollten sich im Abstand von 12 Stunden abwechseln.
12. Bei der Auswahl einer Inhalationskammer sind die Art der Prüfsubstanz und das Ziel der Prüfung zu berücksichtigen. Das bevorzugte Verfahren ist die 'Nose-only'-Exposition (dieser Begriff umfasst 'nur Kopf', 'nur Nase' oder 'nur Schnauze'). Für die Untersuchung von Flüssigkeits- oder Feststoffaerosolen und für Dämpfe, die zu Aerosolen kondensieren können, wird im Allgemeinen die 'Nose-only'-Exposition bevorzugt. Besondere Ziele der Untersuchung können möglicherweise mit einer Ganzkörperexposition besser erreicht werden, doch dies sollte im Prüfbericht begründet werden. Um bei Verwendung einer Ganzkörperkammer die Stabilität der Atmosphäre sicherzustellen, sollte das Gesamtvolumen der Versuchstiere 5 % des Volumens der Kammer nicht übersteigen. Die Prinzipien der 'Nose-only'- und der Ganzkörperexposition sowie ihre jeweiligen Vor- und Nachteile sind in GD 39 (2) beschrieben.
Verabreichung der Konzentrationen
13. 'Nose-only'-Expositionen können bei Ratten bis zu 6 Stunden dauern. Bei Mäusen sollten 'Nose-only'-Expositionen im Allgemeinen 4 Stunden nicht überschreiten. Wenn Studien mit längerer Expositionsdauer erforderlich sind, ist dies zu begründen [siehe GD 39 (2)]. Bei Ganzkörperexpositionen gegen Aerosole sollten die Tiere einzeln untergebracht sein, um eine Aufnahme der Prüfsubstanz durch das Putzen von Käfiggenossen zu verhindern. Während der Exposition sollte kein Futter verabreicht werden. Wasser kann während einer Ganzkörperexposition angeboten werden.
14. Die Tiere werden der Prüfsubstanz in Form von Gas, Dampf, Aerosol oder einer Kombination dieser Formen ausgesetzt. Der zu prüfende Aggregatzustand hängt von den physikalisch-chemischen Eigenschaften der Prüfsubstanz, der gewählten Konzentration und/oder der physikalischen Form ab, in der die Prüfsubstanz bei der Handhabung und Verwendung am wahrscheinlichsten vorliegt. Hygroskopische und chemisch reaktive Prüfsubstanzen sollten bei geringer Luftfeuchtigkeit geprüft werden. Dabei ist darauf zu achten, dass keine explosionsfähigen Konzentrationen erzeugt werden.
15. Bei allen Aerosolen und bei Dämpfen, die zu Aerosolen kondensieren können, sollte die Partikelgröße bestimmt werden. Damit alle relevanten Regionen der Atemwege der Prüfsubstanz ausgesetzt werden, werden mittlere aerodynamische Massendurchmesser (Mass Median Aerodynamic Diameter - MMAD) von 1 bis 4 pm mit einer geometrischen Standardabweichung (σg) von 1,5 bis 3,0 empfohlen (2) (9) (10). Wenngleich nach Möglichkeit versucht werden sollte, diese Werte zu erreichen, ist Fachwissen erforderlich, falls sie nicht erzielt werden können. Metalldämpfe können z.B. unter diesen Werten liegen, und geladene Partikel, Fasern und hygroskopische Stoffe (die sich in der feuchten Umgebung der Atemwege ausdehnen) können diese Werte überschreiten.
Vorbereitung der Prüfsubstanz in einem Vehikel
16. Um die gewünschte Konzentration und Partikelgröße der Prüfsubstanz in der Atmosphäre herzustellen, kann ein Vehikel verwendet werden. Hierbei ist in der Regel Wasser zu bevorzugen. Partikel können durch mechanische Prozesse auf die erforderliche Partikelgrößenverteilung gebracht werden. Dabei ist darauf zu achten, dass die Prüfsubstanz nicht zersetzt oder verändert wird. Wenn angenommen wird, dass die Zusammensetzung der Prüfsubstanz durch mechanische Prozesse verändert wurde (z.B. hohe Temperaturen aufgrund von Reibung durch übermäßiges Mahlen), sollte die Zusammensetzung der Prüfsubstanz analytisch überprüft werden. Es ist darauf zu achten, dass die Prüfsubstanz nicht kontaminiert wird. Nicht brüchige Granulate, die speziell so formuliert sind, dass sie nicht eingeatmet werden können, brauchen nicht geprüft zu werden. Mit einem Abriebtest sollte nachgewiesen werden, dass beim Umgang mit dem Granulat keine lungengängigen Partikel entstehen. Entstehen bei einem Abriebtest lungengängige Partikel, so sollte eine Inhalationstoxizitätsprüfung durchgeführt werden.
17. Eine gleichzeitige negative (Luft-)Kontrollgruppe ist nicht erforderlich. Wenn zur Erzeugung der Prüfatmosphäre ein anderes Vehikel als Wasser verwendet wird, sollte nur dann eine Vehikelkontrollgruppe verwendet werden, wenn keine historischen Daten über Inhalationstoxizität vorliegen. Ergibt eine Toxizitätsstudie einer in einem Vehikel formulierten Prüfsubstanz, dass keine Toxizität vorliegt, ist das Vehikel folglich in der geprüften Konzentration nicht toxisch. Daher ist keine Vehikelkontrolle erforderlich.
Überwachung der Expositionsbedingungen
Luftstrom in der Inhalationskammer
18. Der Luftstrom durch die Kammer sollte während jeder Exposition sorgfältig geregelt, kontinuierlich überwacht und mindestens stündlich protokolliert werden. Die Überwachung der Konzentration (oder Stabilität) der Prüfatmosphäre ist eine integrale Messung aller dynamischen Parameter und gibt indirekt die Möglichkeit, alle relevanten dynamischen Parameter der Erzeugung der Prüfatmosphäre zu messen. Es sollte besonders darauf geachtet werden, das erneute Einatmen in 'Nose-only'-Expositionskammern zu vermeiden, wenn die Luftströmung durch das Expositionssystem nicht ausreicht, um eine dynamische Strömung der Prüfsubstanzatmosphäre zu erreichen. Es gibt festgelegte Methoden, mit denen nachgewiesen werden kann, dass es unter den gewählten Bedingungen nicht zu erneutem Einatmen kommt (2) (11). Die Sauerstoffkonzentration sollte mindestens 19 % betragen, und die Kohlendioxidkonzentration sollte 1 % nicht überschreiten. Gibt es Grund zu der Annahme, dass diese Werte nicht eingehalten werden können, sind die Sauerstoff- und die Kohlendioxidkonzentrationen zu messen.
Temperatur und relative Luftfeuchtigkeit in der Inhalationskammer
19. Die Temperatur in der Inhalationskammer sollte 22 ± 3 °C betragen. Sowohl bei der 'Nose-only'- als auch bei der Ganzkörperexposition sollte die relative Luftfeuchtigkeit im Atembereich der Tiere für Zeiträume von bis zu 4 Stunden mindestens dreimal und für kürzere Zeiträume stündlich überwacht und dokumentiert werden. Die relative Luftfeuchtigkeit sollte im Idealfall zwischen 30 und 70 % liegen, was jedoch möglicherweise nicht erreichbar ist (z.B. bei der Prüfung von wasserbasierten Mischungen) oder wegen chemischer Interferenz mit der Prüfmethode nicht gemessen werden kann.
Prüfsubstanz: nominale Konzentration
20. Die nominale Konzentration in der Expositionskammer sollte möglichst berechnet und protokolliert werden. Die nominale Konzentration ist die Masse der erzeugten Prüfsubstanz dividiert durch das Gesamtvolumen der durch das Kammersystem geleiteten Luft. Sie wird nicht zur Beschreibung der Exposition der Tiere verwendet; vielmehr gibt ein Vergleich der nominalen Konzentration und der tatsächlichen Konzentration Aufschluss über die Effizienz des Prüfsystems bei der Erzeugung der Prüfkonzentration und kann daher für die Aufdeckung von Problemen bei dieser Erzeugung verwendet werden.
Prüfsubstanz: tatsächliche Konzentration
21. Die tatsächliche Konzentration ist die Konzentration der Prüfsubstanz im Atembereich der Tiere in einer Inhalationskammer. Die tatsächlichen Konzentrationen können durch spezifische Methoden (z.B. direkte Probenahme, adsorptive Methoden oder chemische Reaktionsverfahren mit anschließender analytischer Charakterisierung) oder durch unspezifische Methoden wie Gravimetrie bestimmt werden. Die gravimetrische Methode ist lediglich für Aerosole mit nur einem Bestandteil in Pulverform oder Aerosole von Flüssigkeiten mit geringer Flüchtigkeit akzeptabel und sollte sich auf geeignete, vor der Studie zu erstellende und für die Prüfsubstanz spezifische Beschreibungen stützen. Die Konzentration von Aerosolen mit mehreren Bestandteilen in Pulverform kann ebenfalls gravimetrisch bestimmt werden. Hierzu muss jedoch mit Analysedaten belegt werden, dass die Schwebstoffe eine ähnliche Zusammensetzung haben wie das Ausgangsmaterial. Liegen diese Angaben nicht vor, muss die Prüfsubstanz (im Idealfall im Schwebezustand) möglicherweise im Verlauf der Studie in regelmäßigen Abständen neu analysiert werden. Bei aerosolisierten Agenzien, die verdunsten oder sublimieren können, sollte gezeigt werden, dass alle Phasen von der gewählten Methode erfasst wurden. Im Prüfbericht sollten die Zielkonzentration sowie die nominale und die tatsächliche Konzentration angegeben werden, aber nur die tatsächlichen Konzentrationen werden für statistische Analysen zur Berechnung letaler Konzentrationswerte verwendet.
22. Es sollte möglichst eine Partie der Prüfsubstanz verwendet werden; die Probe sollte unter Bedingungen aufbewahrt werden, die ihre Reinheit, Homogenität und Stabilität gewährleisten. Die Prüfsubstanz sollte vor Beginn der Studie mit Angaben zur Reinheit und, falls technisch machbar, zur Identität sowie zu den Mengen identifizierter Schadstoffe und Verunreinigungen beschrieben werden. Hierzu können unter anderem die folgenden Daten verwendet werden: Retentionszeit und relative Peakfläche, durch Massenspektrometrie oder Gaschromatographie bestimmtes Molekulargewicht oder andere Werte. Das Prüflabor ist zwar nicht für die Identität der Probe verantwortlich, doch es kann ratsam sein, dass es die Beschreibung des Auftraggebers zumindest in gewissen Grenzen (z.B. Farbe, physikalische Beschaffenheit usw.) überprüft.
23. Die Expositionsatmosphäre ist so konstant wie möglich zu halten und je nach Analysemethode kontinuierlich und/oder intermittierend zu überwachen. Bei der intermittierenden Probenahme sollten in einer vierstündigen Studie mindestens zweimal Proben der Atmosphäre in der Kammer genommen werden. Ist dies wegen begrenzter Luftdurchflussraten oder niedriger Konzentrationen nicht möglich, kann während der gesamten Expositionszeit eine einzige Probe genommen werden. Weichen die einzelnen Proben stark voneinander ab, sollten bei den nächsten geprüften Konzentrationen vier Proben je Exposition gezogen werden. Die einzelnen Proben der Konzentration in der Kammer sollten bei Gasen und Dämpfen nicht mehr als ± 10 % und bei Flüssig- oder Feststoffaerosolen nicht mehr als ± 20 % von der mittleren Kammerkonzentration abweichen. Die Zeit bis zum Erreichen eines Gleichgewichts in der Kammer (t95) ist zu berechnen und zu dokumentieren. Die Expositionsdauer erstreckt sich über den Zeitraum, in dem die Prüfsubstanz erzeugt wird; dazu gehört die zur Erreichung von t95 erforderliche Zeit. GD 39 (2) enthält Hinweise zur Einschätzung von t95.
24. Bei sehr komplexen Mischungen aus Gasen/Dämpfen und Aerosolen (z.B. Verbrennungsatmosphären und Prüfsubstanzen, die aus hierzu bestimmten Endverbraucherprodukten/-geräten gesprüht werden), kann sich jede Phase in einer Inhalationskammer anders verhalten, so dass mindestens eine Indikatorsubstanz (Analyt), normalerweise der wichtigste Wirkstoff in der Mischung, von jeder Phase (Gas/Dampf und Aerosol) ausgewählt werden sollte. Wenn die Prüfsubstanz eine Mischung ist, sollte die Analysekonzentration für die Mischung und nicht nur für den Wirkstoff oder den Bestandteil (Analyt) dokumentiert werden. Weitere Informationen zu tatsächlichen Konzentrationen sind in GD 39 (2) zu finden.
Prüfsubstanz: Partikelgrößenverteilung
25. Die Partikelgrößenverteilung von Aerosolen sollte während jeder 4-stündigen Exposition mindestens zweimal mit einem Kaskaden-Impaktor oder einem anderen Messgerät wie einem APS bestimmt werden. Kann nachgewiesen werden, dass die mit einem Kaskaden-Impaktor und einem alternativen Messgerät erzielten Ergebnisse gleichwertig sind, so kann das alternative Instrument während der gesamten Studie verwendet werden. Parallel zum Hauptinstrument ist ein zweites Gerät wie ein Gravimetriefilter oder eine Gaswaschflasche zu verwenden, um den Abscheidegrad des Hauptinstruments zu bestätigen. Die durch die Partikelgrößenanalyse bestimmte Massenkonzentration sollte innerhalb vertretbarer Grenzen um die durch die Filteranalyse bestimmte Massenkonzentration liegen [siehe DG 39 (2)]. Wenn die Gleichwertigkeit zu Beginn der Studie nachgewiesen werden kann, kann auf weitere bestätigende Messungen verzichtet werden. Aus Tierschutzgründen sollten Vorkehrungen getroffen werden, um unklare Daten zu minimieren, die dazu führen könnten, dass eine Exposition wiederholt werden muss. Wenn die Möglichkeit besteht, dass Dampfkondensation zur Bildung eines Aerosols führen kann, oder wenn in einer Dampfatmosphäre mit dem Potenzial für gemischte Phasen Partikel nachgewiesen werden, sollte eine Partikelgrößenbestimmung für Dämpfe vorgenommen werden (siehe Nummer 15).
26. Nachstehend werden zwei Prüfungsarten beschrieben: das traditionelle Protokoll und das C-x-t-Protokoll. Beide Protokolle können eine Vorstudie, eine Hauptstudie und/oder einen Limit-Test (traditionelles Protokoll) bzw. eine Prüfung bei einer Grenzkonzentration (c x t) umfassen. Wenn bekannt ist, dass ein Geschlecht empfindlicher reagiert, kann der Studienleiter entscheiden, diese Prüfungen nur unter Verwendung dieses Geschlechts durchzuführen. Wenn für eine 'Nose-only'-Exposition andere Nagetierarten als Ratten verwendet werden, kann die maximale Expositionsdauer angepasst werden, um artenspezifisches Leiden zu minimieren. Damit möglichst wenig Tiere verwendet werden, sollten vor Beginn der Prüfung alle verfügbaren Daten ausgewertet werden. Mit Ergebnissen der Methode gemäß Kapitel B.52 dieses Anhangs (4) kann möglicherweise die Notwendigkeit einer Vorstudie ausgeräumt und gezeigt werden, ob ein Geschlecht empfindlicher reagiert als das andere [siehe GD 39 (2)].
Allgemeine Überlegungen: traditionelles Protokoll
27. In einer traditionellen Studie werden Gruppen von Tieren einer Prüfsubstanz für einen festgelegten Zeitraum (im Allgemeinen 4 Stunden) entweder in einer 'Nose-only'- oder einer Ganzkörperexpositionskammer ausgesetzt. Die Tiere werden entweder einer Grenzkonzentration (Limit-Test) oder schrittweise mindestens drei Konzentrationen (Hauptstudie) ausgesetzt. Wenn nicht bereits Informationen über die Prüfsubstanz vorliegen, wie z.B. aus einer zuvor durchgeführten Prüfung nach Kapitel B.52, kann vor der Hauptstudie eine Vorstudie durchgeführt werden [siehe GD 39 (2)].
Vorstudie: traditionelles Protokoll
28. Eine Vorstudie dient dazu, die Wirkstärke der Prüfsubstanz einzuschätzen, geschlechtsspezifische Unterschiede bei der Empfindlichkeit festzustellen und die Festlegung der Expositionskonzentrationen für die Hauptstudie oder den Limit-Test zu erleichtern. Die Auswahl der Konzentrationen für die Vorstudie sollte sich auf alle verfügbaren Informationen, einschließlich verfügbarer (Q)SAR-Daten und Daten für ähnliche Chemikalien stützen. Jeder Konzentration der Prüfsubstanz sollten höchstens drei männliche und drei weibliche Tiere ausgesetzt werden (drei Tiere je Geschlecht können erforderlich sein, um einen geschlechtsspezifischen Unterschied festzustellen). Es ist möglich, dass in einer Vorstudie nur eine einzige Konzentration geprüft wird, erforderlichenfalls können aber auch mehr Konzentrationen geprüft werden. In einer Vorstudie sollten nicht so viele Tiere und Konzentrationen untersucht werden, dass sie quasi einer Hauptstudie gleichkommt. Statt einer Vorstudie kann auf die Ergebnisse einer zuvor durchgeführten Prüfung gemäß Kapitel B.52 (4) zurückgegriffen werden [siehe GD 39 (2)].
Limit-Test: traditionelles Protokoll
29. Ein Limit-Test wird verwendet, wenn bekannt oder zu erwarten ist, dass die Prüfsubstanz praktisch nicht toxisch ist, d. h. nur über der regulatorisch festgelegten Grenzkonzentration eine toxische Wirkung hervorruft. Beim Limit-Test wird eine einzige Gruppe von drei männlichen und drei weiblichen Tieren der Prüfsubstanz bei einer Grenzkonzentration ausgesetzt. Informationen über die Toxizität der Prüfsubstanz können aus Kenntnissen über ähnliche geprüfte Stoffe gewonnen werden, wobei Art und prozentualer Anteil der Komponenten zu berücksichtigen sind, deren toxikologische Relevanz bekannt ist. In den Fällen, in denen nur wenige oder keine Informationen über die Toxizität der Prüfsubstanz vorliegen oder in denen von einer Toxizität der Prüfsubstanz ausgegangen wird, sollte der Haupttest durchgeführt werden.
30. Die Wahl der Grenzkonzentrationen hängt im Allgemeinen von den Regulierungsanforderungen ab. Wird die Verordnung (EG) Nr. 1272/2008 zugrunde gelegt, so betragen die Grenzkonzentrationen für Gase, Dämpfe und Aerosole 20.000 ppm, 20 mg/l bzw. 5 mg/l (oder die höchste erreichbare Konzentration) (3). Bei bestimmten Prüfsubstanzen, insbesondere bei Dämpfen und Aerosolen, kann es technisch schwierig sein, Grenzkonzentrationen zu erzeugen. Bei der Prüfung von Aerosolen sollte das Hauptziel darin bestehen, eine lungengängige Partikelgröße (d. h. ein MMAD von 1-4 µm) zu erreichen. Dies ist bei den meisten Prüfsubstanzen bei einer Konzentration von 2 mg/l der Fall. Aerosole sollten nur dann bei mehr als 2 mg/l geprüft werden, wenn eine lungengängige Partikelgröße erreicht werden kann [siehe DG 39 (2)]. Die Verordnung (EG) Nr. 1272/2008 rät aus Tierschutzgründen von der Prüfung über einer Grenzkonzentration ab (3). Die Grenzkonzentration sollte nur in Betracht gezogen werden, wenn eine hohe Wahrscheinlichkeit besteht, dass die Ergebnisse einer solchen Prüfung von unmittelbarer Relevanz für den Schutz der menschlichen Gesundheit sind (3); dies ist im Prüfbericht zu begründen. Bei potenziell explosiven Prüfsubstanzen ist darauf zu achten, dass keine explosionsfördernden Bedingungen geschaffen werden. Um eine unnötige Verwendung von Versuchstieren zu vermeiden und sicherzustellen, dass die Kammerbedingungen für einen Limit-Test erreicht werden können, sollte vor dem Limit-Test ein Probedurchlauf ohne Tiere vorgenommen werden.
31. Werden bei der Grenzkonzentration Mortalität oder Siechtum beobachtet, können die Ergebnisse der Prüfung bei dieser Konzentration als Vorstudie für weitere Prüfungen bei anderen Konzentrationen dienen (siehe Hauptstudie). Wenn eine Grenzkonzentration wegen der physikalischen oder chemischen Eigenschaften einer Prüfsubstanz nicht erreicht werden kann, sollte die höchste erreichbare Konzentration geprüft werden. Wenn bei der höchsten erreichbaren Konzentration eine Letalität von weniger als 50 % auftritt, sind keine weiteren Prüfungen erforderlich. Konnte die Grenzkonzentration nicht erreicht werden, sollte der Prüfbericht eine Erklärung und entsprechende Daten enthalten. Wenn die höchste erreichbare Konzentration eines Dampfs keine Toxizität hervorruft, muss die Prüfsubstanz möglicherweise als Flüssigkeitsaerosol angewendet werden.
Hauptstudie: traditionelles Protokoll
32. Eine Hauptstudie wird normalerweise mit fünf männlichen und fünf weiblichen Tieren (oder, falls bekannt, fünf Tieren des empfindlicheren Geschlechts) je Konzentrationsstufe mit mindestens drei Konzentrationsstufen durchgeführt. Für eine robuste statistische Analyse sollten ausreichend hohe Konzentrationsstufen verwendet werden. Der Zeitabstand zwischen den einzelnen Expositionsgruppen richtet sich nach Einsetzen, Dauer und Schweregrad der toxischen Zeichen. Die Tiere sollten erst dann der nächsten Konzentrationsstufe ausgesetzt werden, wenn mit angemessener Gewissheit vom Überleben der zuvor getesteten Tiere ausgegangen werden kann. Dies gibt dem Studienleiter die Möglichkeit, die Zielkonzentration für die nächste Expositionsgruppe anzupassen. Wegen der Abhängigkeit von hochentwickelter Technologie ist dies in Inhalationsstudien nicht immer praktikabel. Deshalb sollte die Exposition von Tieren gegen die nächste Konzentrationsstufe auf Erfahrungswerten und wissenschaftlichem Sachverstand beruhen. Bei der Prüfung von Mischungen ist das GD 39 (2) zu konsultieren.
Konzentration-x-Zeit-Protokoll (C x T)
Allgemeine Überlegungen: C-x-t-Prokokoll
33. Bei der Bewertung der Inhalationstoxizität kann als Alternative zu einem traditionellen Protokoll eine schrittweise C-x-t-Studie in Betracht gezogen werden (12) (13) (14). Bei dieser Methode werden die Tiere der Prüfsubstanz in unterschiedlichen Konzentrationsstufen und für unterschiedliche Zeiträume ausgesetzt. Für alle Prüfungen werden 'Nose-only'-Kammern verwendet (Ganzkörperkammern sind bei diesem Protokoll nicht praktikabel). Ein Fließdiagramm in Anlage 1 veranschaulicht dieses Protokoll. Eine Simulationsanalyse hat gezeigt, dass sowohl das traditionelle Protokoll und als auch das C-x-t-Protokoll robuste LC50-Werte ergeben können, aber das C-x-t-Protokoll bei robusten LC01- und LC10-Werten im Allgemeinen überlegen ist (15).
34. Einer Simulationsanalyse zufolge ist die Verwendung von zwei Tieren je C-x-t-Intervall (ein Tier je Geschlecht bei Verwendung beider Geschlechter oder zwei Tiere des empfindlicheren Geschlechts) im Allgemeinen ausreichend, wenn in einer Hauptstudie 4 Konzentrationen und 5 Expositionszeiträume geprüft werden. Unter bestimmten Umständen kann der Studienleiter beschließen, je zwei Ratten beider Geschlechter je C-x-t-Intervall zu verwenden (15). Die Verwendung von zwei Tieren je Geschlecht je Konzentration und Zeitpunkt kann Verzerrungen und Schwankungen der Schätzungen verringern, die Quote der zutreffenden Schätzungen erhöhen und die Abdeckung des Konfidenzintervalls verbessern. Wenn die Daten jedoch keine ausreichende Annäherung für eine Schätzung erlauben (bei Verwendung von je einem Tier beider Geschlechter oder von zwei Tieren des empfindlicheren Geschlechts), kann auch eine fünfte Expositionskonzentration ausreichen. Das GD 39 (2) enthält weitere Hinweise zur Zahl der Tiere und zu den Konzentrationen, die in einer C-x-t-Studie zu verwenden sind.
Vorstudie: C-x-t-Protokoll
35. Eine Vorstudie dient dazu, die Wirkstärke der Prüfsubstanz einzuschätzen und die Festlegung der Expositionskonzentrationen für die Hauptstudie zu erleichtern. Um eine geeignete Ausgangskonzentration für die Hauptstudie festzulegen und möglichst wenig Tiere zu verwenden, kann eine Vorstudie mit bis zu drei Tieren/Geschlecht/Konzentration [Einzelheiten siehe Anlage III von GD 39 (2)] erforderlich sein. Zur Feststellung eines geschlechtsspezifischen Unterschieds müssen gegebenenfalls drei Tiere je Geschlecht verwendet werden. Diese Tiere sind für einen einzigen Zeitraum, im Allgemeinen 240 Minuten, zu exponieren. Die Erzeugung geeigneter Prüfatmosphären ist in technischen Vorversuchen ohne Tiere zu erproben. Wenn Mortalitätsdaten aus einer Studie nach B.52 (4) vorliegen, braucht normalerweise keine Vorstudie durchgeführt zu werden. Bei der Festlegung der anfänglichen Zielkonzentration einer Studie nach B.2 sollte der Studienleiter die in allen verfügbaren B.52-Studien (4) beobachteten Mortalitätsmuster für beide Geschlechter und für alle geprüften Konzentrationen berücksichtigen [siehe GD 39 (2)].
Ausgangskonzentration: C-x-t-Protokoll
36. Die Ausgangskonzentration (Exposition I) (Anlage 1) ist entweder eine Grenzkonzentration oder eine vom Studienleiter auf Basis der Vorstudie gewählte Konzentration. Gruppen von je einem Tier beider Geschlechter werden dieser Konzentration für unterschiedliche Zeiträume ausgesetzt (z.B. 15, 30, 60, 120 oder 240 Minuten), so dass insgesamt 10 Tiere verwendet werden (Exposition I) (Anlage 1).
37. Die Wahl der Grenzkonzentrationen hängt im Allgemeinen von den Regulierungsanforderungen ab. Wird die Verordnung (EG) Nr. 1272/2008 zugrunde gelegt, so betragen die Grenzkonzentrationen für Gase, Dämpfe und Aerosole 20.000 ppm, 20 mg/l bzw. 5 mg/l (oder die höchste erreichbare Konzentration) (3). Bei bestimmten Prüfsubstanzen, insbesondere bei Dämpfen und Aerosolen, kann es technisch schwierig sein, Grenzkonzentrationen zu erzeugen. Bei der Prüfung von Aerosolen sollte eine lungengängige Partikelgröße (d. h. ein MMAD von 1-4 µm) bei einer Grenzkonzentration von 2 mg/l erreicht werden. Dies ist bei den meisten Prüfsubstanzen möglich. Aerosole sollten nur dann bei mehr als 2 mg/l geprüft werden, wenn eine lungengängige Partikelgröße erreicht werden kann [siehe DG 39 (2)]. Die Verordnung (EG) Nr. 1272/2008 rät aus Tierschutzgründen von der Prüfung über einer Grenzkonzentration ab (3). Prüfungen über der Grenzkonzentration sollten nur in Betracht gezogen werden, wenn eine hohe Wahrscheinlichkeit besteht, dass die Ergebnisse einer solchen Prüfung von unmittelbarer Relevanz für den Schutz der menschlichen Gesundheit sind (3); dies ist im Prüfbericht zu begründen. Bei potenziell explosiven Prüfsubstanzen ist darauf zu achten, dass keine explosionsfördernden Bedingungen geschaffen werden. Vor der Prüfung bei der Ausgangskonzentration sollte ein Probedurchlauf ohne Tiere vorgenommen werden, um eine unnötige Verwendung von Versuchstieren zu vermeiden und sicherzustellen, dass die Kammerbedingungen für diese Konzentration erreicht werden können.
38. Werden bei der Ausgangskonzentration Mortalität oder Siechtum beobachtet, können die Ergebnisse dieser Konzentration als Ausgangspunkt für weitere Prüfungen bei anderen Konzentrationen dienen (siehe Hauptstudie). Wenn eine Grenzkonzentration wegen der physikalischen oder chemischen Eigenschaften einer Prüfsubstanz nicht erreicht werden kann, sollte die höchste erreichbare Konzentration geprüft werden. Wenn bei der höchsten erreichbaren Konzentration eine Letalität von weniger als 50 % auftritt, sind keine weiteren Prüfungen erforderlich. Konnte die Grenzkonzentration nicht erreicht werden, sollte der Prüfbericht eine Erklärung und entsprechende Daten enthalten. Wenn die höchste erreichbare Konzentration eines Dampfs keine Toxizität hervorruft, muss die Prüfsubstanz möglicherweise als Flüssigkeitsaerosol angewendet werden.
Hauptstudie: C-x-t-Protokoll
39. Die in der Hauptstudie geprüfte Ausgangskonzentration (Exposition I) (Anlage 1) ist entweder eine Grenzkonzentration oder eine vom Studienleiter auf Basis der Vorstudie gewählte Konzentration. Wenn während oder nach der Exposition I Mortalität beobachtet wurde, gilt die Mindestexposition (c x t), die zu Mortalität führt, als Anhaltspunkt für die Festlegung der Expositionskonzentration und -dauer für die Exposition II. Jede folgende Exposition hängt von der vorhergehenden Exposition ab (siehe Anlage 1).
40. Bei vielen Prüfsubstanzen sind die bei der Ausgangskonzentration erzielten Ergebnisse zusammen mit drei zusätzlichen Expositionen mit einem kleineren Zeitraster (das ist der geometrische Abstand von Expositionsperioden, der angegeben wird durch den Faktor zwischen aufeinanderfolgenden Perioden, im Allgemeinen
√2) ausreichend, um die C-x-t-Mortalitätsbeziehung festzulegen (15), aber es kann hilfreich sein, eine fünfte Expositionskonzentration zu verwenden [siehe Anlage 1 und GD 39 (2)]. Anlage 1 enthält Hinweise zur mathematischen Aufbereitung der Ergebnisse für das C-x-t-Protokoll.
41. Die Tiere sollten während der Exposition häufig auf klinische Zeichen beobachtet werden. Nach der Exposition sollten klinische Beobachtungen mindestens zweimal am Tag der Exposition oder, falls es aufgrund der Reaktion der Tiere auf die Behandlung angezeigt erscheint, häufiger und danach für einen Zeitraum von insgesamt 14 Tagen mindestens einmal täglich vorgenommen werden. Die Länge des Beobachtungszeitraums ist nicht festgelegt; sie sollte nach Art und Zeitpunkt des Einsetzens klinischer Zeichen und der Länge der Erholungsphase bestimmt werden. Der Zeitpunkt, zu dem die Toxizitätszeichen auftreten und wieder abklingen, ist von Bedeutung, insbesondere dann, wenn Anzeichen für ein verzögertes Auftreten von Toxizitätszeichen erkennbar sind. Sämtliche Beobachtungen werden systematisch in Einzelprotokollen dokumentiert, die für jedes Tier geführt werden. Tiere, bei denen ein moribunder Zustand festgestellt wird, sowie Tiere, die starke Schmerzen haben oder anhaltende Anzeichen von schwerem Leiden zeigen, sollten aus Tierschutzgründen auf humane Weise getötet werden. Bei den Untersuchungen auf klinische Toxizitätszeichen ist darauf zu achten, dass ein anfänglich schlechtes Aussehen und vorübergehende Atemveränderungen, die auf das Expositionsverfahren zurückzuführen sind, nicht mit einer durch die Prüfsubstanz bedingten Toxizität verwechselt werden, die eine vorzeitige Tötung der Tiere erfordern würde. Die im Guidance Document on Humane Endpoints (GD 19) zusammengefassten Prinzipien und Kriterien sind zu berücksichtigen (7). Wenn Tiere aus humanen Gründen getötet werden oder ihr Tod festgestellt wird, sollte der Todeszeitpunkt so genau wie möglich registriert werden.
42. Bei den Beobachtungen ist auf Veränderungen von Haut, Fell, Augen und Schleimhäuten sowie Atmung, Kreislauf, autonomes und zentrales Nervensystem, Somatomotorik und Verhaltensmuster zu achten. Soweit möglich, ist auf Differenzierungen zwischen lokalen und systemischen Wirkungen zu achten. Besonderes Augenmerk ist auf Tremor, Konvulsionen, Salivation, Diarrhö, Lethargie, Schlaf und Koma zu richten. Die Messung der Rektaltemperatur kann zusätzliche Belege für mit der Behandlung oder Unterbringung zusammenhängende Reflex- Bradypnoe oder Hypo-/Hyperthermie liefern.
43. Das Körpergewicht der einzelnen Tiere sollte einmal während der Eingewöhnungszeit, am Tag der Exposition vor der Exposition (Tag 0) und mindestens an den Tagen 1, 3 und 7 (und danach wöchentlich) sowie zum Zeitpunkt des Todes oder der Tötung, falls später als Tag 1, dokumentiert werden. Das Körpergewicht gilt als kritischer Indikator für Toxizität; Tiere, die gegenüber ihrem Gewicht vor der Prüfung eine dauerhafte Abnahme um ≥ 20 % aufweisen, sollten sorgfältig überwacht werden. Die überlebenden Tiere werden gewogen und am Ende der Post-Expositionsphase auf humane Weise getötet.
44. Alle Versuchstiere (einschließlich der Tiere, die während des Tests sterben oder aus Tierschutzgründen getötet und aus der Studie genommen werden) sind auf makroskopische Veränderungen zu untersuchen. Kann die Nekropsie nicht unmittelbar nach Auffinden eines toten Tieres erfolgen, sollte der Körper auf eine Temperatur gekühlt (nicht eingefroren) werden, die tief genug ist, um die Autolyse zu minimieren. Die Nekropsie ist baldmöglichst, in der Regel innerhalb von einem oder zwei Tagen durchzuführen. Alle makroskopischen Veränderungen sollten für jedes Tier protokolliert werden, wobei besonders auf Veränderungen der Atemwege zu achten ist.
45. Es kann in Betracht gezogen werden, von vorneherein zusätzliche Untersuchungen in die Studienauslegung aufzunehmen, die die Aussagekraft der Studie erhöhen, z.B. die Messung des Lungengewichts überlebender Ratten und/oder den Nachweis einer Reizwirkung durch mikroskopische Untersuchung der Atemwege. Untersucht werden können auch diejenigen Organe, die bei 24 Stunden oder länger überlebenden Tieren makroskopische Befunde aufweisen, sowie Organe, die bekanntermaßen oder vermutlich betroffen sind. Eine mikroskopische Untersuchung des gesamten Atemtrakts kann nützliche Informationen über Prüfsubstanzen liefern, die mit Wasser reagieren, z.B. Säuren und hygroskopische Prüfsubstanzen.
46. Das Körpergewicht der einzelnen Tiere und Sektionsbefunde sollten angegeben werden. Die Daten der klinischen Beobachtung sollten in tabellarischer Form zusammengefasst werden. Daraus müssen für jede Prüfgruppe die Anzahl der verwendeten Tiere, die Anzahl der Tiere mit spezifischen Toxizitätszeichen, die Anzahl der Tiere, die während der Prüfung tot aufgefunden oder vorzeitig getötet wurden, der Todeszeitpunkt der einzelnen Tiere, eine Beschreibung und der zeitliche Verlauf der toxischen Wirkungen und deren Reversibilität sowie die Sektionsbefunde ersichtlich sein.
47. Der Prüfbericht sollte, soweit zutreffend, die folgenden Informationen enthalten:
Versuchstiere und Tierhaltung
- Beschreibung der Haltungsbedingungen mit Angaben zu Anzahl (oder Veränderung der Anzahl) der Tiere je Käfig, Einstreu, Umgebungstemperatur und relativer Luftfeuchtigkeit, Photoperiode und Futter,
- Art/Stamm und Begründung für die Verwendung einer anderen Art als der Ratte,
- Anzahl, Alter und Geschlecht der Tiere,
- Randomisierungsmethode,
- Angaben über Futter- und Wasserqualität (einschließlich Art/Herkunft des Futters, Wasserquelle),
- Beschreibung etwaiger Vorbereitung vor der Prüfung, einschließlich Ernährung, Quarantäne und Behandlung von Krankheiten.
- physikalische Beschaffenheit, Reinheit und, wenn maßgeblich, physikalisch-chemische Eigenschaften (einschließlich Isomerisierung),
- Angaben zur Identifikation und CAS-Nummer (Chemical Abstract Services), falls bekannt.
- Begründung für die Verwendung eines Vehikels sowie für die Wahl des Vehikels (falls nicht Wasser),
- historische oder parallel erzeugte Daten, die belegen, dass das Vehikel keinen Einfluss auf das Ergebnis der Studie hat.
- Beschreibung der Inhalationskammer mit Angabe von Abmessungen und Volumen,
- Herkunft und Beschreibung der für die Exposition der Tiere sowie für die Erzeugung der Atmosphäre verwendeten Ausrüstung,
- Ausrüstung für die Messung von Temperatur, Luftfeuchtigkeit, Partikelgröße und tatsächlicher Konzentration,
- Herkunft der Luft und Behandlung der eingeleiteten/entzogenen Luft sowie Klimatisierungssystem,
- für die Kalibrierung der Ausrüstung verwendete Methoden, um eine homogene Prüfatmosphäre sicherzustellen,
- Druckunterschied (positiv oder negativ),
- Expositions-Öffnungen je Kammer ('Nose-only'-Exposition); Anordnung der Tiere im System (Ganzkörperexposition),
- zeitliche Homogenität/Stabilität der Prüfatmosphäre,
- Lage von Temperatur- und Feuchtigkeitssensoren und Ort der Probenahme der Prüfatmosphäre in der Kammer,
- Luftdurchflussraten, Luftdurchflussrate/Expositions-Öffnung ('Nose-only'-Exposition) oder Anzahl der Tiere je Kammer (Ganzkörperexposition),
- Angaben zur Ausrüstung für die Messung des Sauerstoff- und Kohlendioxidgehalts, falls zutreffend,
- bis zum Erreichen des Gleichgewichts in der Inhalationskammer benötigte Zeit (t95),
- Zahl der Volumenänderungen pro Stunde,
- Messgeräte (falls zutreffend).
- Begründung für die Wahl der Zielkonzentration in der Hauptstudie,
- nominale Konzentrationen (Gesamtmasse der in die Inhalationskammer eingeleiteten Prüfsubstanz dividiert durch das Volumen der durch die Kammer geleiteten Luft),
- im Atembereich der Tiere ermittelte tatsächliche Konzentrationen der Prüfsubstanz; bei Gemischen mit heterogenen physikalischen Formen (Gase, Dämpfe, Aerosole) kann jede Form getrennt analysiert werden,
- alle Luftkonzentrationen sollten in Masseneinheiten angegeben werden (z.B. mg/l, mg/m3 usw.), Volumeneinheiten können in Klammern ebenfalls angegeben werden (z.B. ppm, ppb usw.),
- Partikelgrößenverteilung, mittlerer aerodynamischer Massendurchmesser (MMAD) und geometrische Standardabweichung (σg), einschließlich der Berechnungsmethoden. Einzelne Partikelgrößenanalysen sind zu protokollieren.
- Angaben zur Vorbereitung der Prüfsubstanz, einschließlich Angaben zu den Verfahren zur Reduzierung der Partikelgröße von Feststoffen oder zur Herstellung von Lösungen der Prüfsubstanz. Wenn die Zusammensetzung der Prüfsubstanz durch mechanische Prozesse verändert worden sein kann, sind die Ergebnisse der Analysen zur Überprüfung der Zusammensetzung der Prüfsubstanz beizufügen,
- eine Beschreibung (möglichst mit Diagramm) der Ausrüstung, die zur Erzeugung der Prüfatmosphäre und zur Exposition der Tiere gegen die Prüfatmosphäre verwendet wurde,
- Angaben zur verwendeten chemischen Analysemethode und zur Validierung der Methode (einschließlich der Effizienz der Wiederfindung der Prüfsubstanz im Medium),
- Begründung für die Wahl der Prüfkonzentrationen.
- tabellarische Darstellung von Temperatur, Luftfeuchtigkeit und Luftstrom in der Kammer,
- tabellarische Darstellung von Daten zur nominalen und tatsächlichen Konzentration in der Kammer,
- tabellarische Darstellung der Partikelgrößendaten einschließlich Daten zur analytischen Probenahme, Partikelgrößenverteilung und Berechnung des MMAD und der σg,
- tabellarische Darstellung der erhobenen Daten und der Konzentration für jedes einzelne Tier (d. h. Tiere, die Anzeichen für Toxizität zeigen, einschließlich Mortalität sowie Art, Schweregrad, Zeitpunkt des Einsetzens und Dauer der Wirkungen),
- während der Prüfung erfasstes Körpergewicht der einzelnen Tiere, Datum und Zeitpunkt des Todes, falls vor geplanter Tötung; zeitlicher Verlauf des Einsetzens von Toxizitätsanzeichen sowie Angabe, ob diese reversibel waren, für jedes einzelne Tier,
- Sektionsbefunde und histopathologische Ergebnisse für jedes einzelne Tier, falls vorhanden,
- Letalitätsschätzungen (z.B. LC50, LD01), einschließlich Konfidenzintervalle von 95 %, und Steigung (falls von der Bewertungsmethode vorgesehen),
- statistische Beziehung, einschließlich Schätzung des Exponenten n (c-x-t-Protokoll). Die verwendete Statistiksoftware ist anzugeben.
Diskussion und Auswertung der Ergebnisse
- Besondere Aufmerksamkeit sollte der Beschreibung der Methoden gelten, die verwendet wurden, um die Kriterien dieser Prüfmethode zu erfüllen, z.B. die Grenzkonzentration oder die Partikelgröße.
- Die Lungengängigkeit von Partikeln vor dem Hintergrund der Gesamtbefunde sollte behandelt werden, insbesondere, wenn die Partikelgrößenkriterien nicht erfüllt werden konnten.
- Falls Tiere, die unter Schmerzen litten oder Zeichen für schweres und anhaltendes Leiden aufwiesen, auf humane Weise getötet werden mussten, ist eine Erklärung auf der Grundlage der Kriterien im OECD Guidance Document on Humane Endpoints (8) zu geben.
- Wenn eine Prüfung nach Kapitel B.52 dieses Anhang (4) zugunsten dieser Prüfmethode B.2 abgebrochen wurde, ist dies zu begründen.
- Die Kohärenz der Methoden zur Bestimmung der nominalen und der tatsächlichen Konzentration sowie die Beziehung der tatsächlichen Konzentration zur nominalen Konzentration sind in die Gesamtbewertung der Studie aufzunehmen.
- Die wahrscheinliche Todesursache und die vorherrschende Wirkungsweise (systemisch oder lokal) sollten behandelt werden.
1. OECD (2009). Acute Inhalation Toxicity Testing. OECD Guideline for Testing of Chemicals No. 403, OECD, Paris. Abrufbar unter: [http://www.oecd.org/env/testguidelines]
2. OECD (2009). Guidance Document on Acute Inhalation Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment No. 39, OECD, Paris. Abrufbar unter: [http://www.oecd.org/ env/testguidelines]
3. Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen, zur Änderung und Aufhebung der Richtlinien 67/548/EWG und 1999/45/EG und zur Änderung der Verordnung (EG) Nr. 1907/2006 (ABl. Nr. L 353 vom 31.12.2008 S. 1).
4. Kapitel B.52 dieses Anhangs, Akute Inhalationstoxizität - akut toxische Klassenmethode.
5. Kapitel B.40 dieses Anhangs, In-vitro-Prüfung auf hautätzende Wirkung: TER-Test (transcutaneous electrical resistance test)
6. Kapitel B.40bis dieses Anhangs, In-vitro-Prüfung auf hautätzende Wirkung: Test mit menschlichem Hautmodell)
7. OECD (2005), In Vitro Membrane Barrier Test Method For Skin Corrosion. OECD Guideline for Testing of Chemicals No. 435, OECD, Paris. Abrufbar unter: [http://www.oecd.org/env/testguidelines]
8. OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment No. 19, OECD, Paris. Abrufbar unter: [http://www.oecd.org/env/testguidelines]
9. SOT (1992). Technical Committee of the Inhalation Specialty Section, Society of Toxicology (SOT). Recommendations for the Conduct of Acute Inhalation Limit Tests. Fund. Appl. Toxicol. 18: 321-327.
10. Phalen RF (2009). Inhalation Studies: Foundations and Techniques. (2nd Edition) Informa Healthcare, New York.
11. Pauluhn J and Thiel A (2007). A Simple Approach to Validation of Directed-Flow Nose-Only Inhalation Chambers. J. Appl. Toxicol. 27: 160-167.
12. Zwart JHE, Arts JM, ten Berge WF, Appelman LM (1992). Alternative Acute Inhalation Toxicity Testing by Determination of the Concentration-Time-Mortality Relationship: Experimental Comparison with Standard LC50 Testing. Reg. Toxicol. Pharmacol. 15: 278-290.
13. Zwart JHE, Arts JM, Klokman-Houweling ED, Schoen ED (1990). Determination of Concentration-Time-Mortality Relationships to Replace LC50 Values. Inhal. Toxicol. 2: 105-117.
14. Ten Berge WF and Zwart A (1989). More Efficient Use of Animals in Acute Inhalation Toxicity Testing. J. Haz. Mat. 21: 65-71.
15. OECD (2009). Performance Assessment: Comparison of 403 and C x t Protocols via Simulation and for Selected Real Data Sets. Environmental Health and Safety Monograph Series on Testing and Assessment No. 104, OECD, Paris. Abrufbar unter: [http://www.oecd.org/env/testguidelines]
16. Finney DJ (1977). Probit Analysis, 3rd ed. Cambridge University Press, London/New York.
Prüfsubstanz: jeder Stoff oder jedes Gemisch, der/das mit dieser Prüfmethode getestet wird.
| C-x-t-Protokoll | Anlage 1 |
1. Bei der Bewertung der Inhalationstoxizität kann als Alternative zu einem traditionellen Protokoll eine schrittweise Konzentrations-x-Zeit-Studie (c x t) in Betracht gezogen werden (12) (13) (14). Sie sollte vorzugsweise dann angewendet werden, wenn wegen einer spezifischen Regelung oder aus wissenschaftlicher Notwendigkeit eine Prüfung von Tieren über unterschiedliche Zeiträume erforderlich ist, z.B. für Zwecke der Notfallplanung oder für die Flächennutzungsplanung.
Diese Methode beginnt normalerweise mit der Prüfung der Prüfsubstanz in einer Grenzkonzentration (Exposition I), bei der die Tiere der Prüfsubstanz für fünf Zeiträume ausgesetzt werden (z.B. 15, 30, 60, 120 und 240 Minuten), so dass innerhalb einer Exposition Ergebnisse für mehrere Zeiträume erzielt werden (siehe Abbildung 1). Wird die Verordnung (EG) Nr. 1272/2008 zugrunde gelegt, so betragen die Grenzkonzentrationen für Gase, Dämpfe und Aerosole 20.000 ppm, 20 mg/l bzw. 5 mg/l. Diese Werte dürfen nur überschritten werden, wenn eine regulatorische oder wissenschaftliche Notwendigkeit für die Prüfung mit diesen höheren Werten besteht (siehe Nummer 37 im Haupttext von Kapitel B.2).
2. Liegen nur wenig oder keine Informationen über die Toxizität einer Prüfsubstanz vor, sollte eine Vorstudie durchgeführt werden, bei der Gruppen von höchstens drei Tieren beider Geschlechter den vom Studienleiter festgelegten Zielkonzentrationen im Allgemeinen für 240 Minuten ausgesetzt werden.
3. Wenn bei der Exposition I eine Grenzkonzentration geprüft wird und die Mortalität bei unter 50 % liegt, sind keine weiteren Prüfungen erforderlich. Besteht eine regulatorische oder wissenschaftliche Notwendigkeit zur Festlegung der Konzentrations-/Zeit-/Wirkungs-Beziehung bei höheren Werten als der angegebenen Grenzkonzentration, sollte die nächste Exposition auf einem höheren Niveau, z.B. dem Doppelten der Grenzkonzentration, durchgeführt werden (d. h. 2L in Abbildung 1).
4. Wenn bei der Grenzkonzentration Toxizität beobachtet wird, sind zusätzliche Prüfungen (Hauptstudie) erforderlich. Diese zusätzlichen Expositionen werden entweder bei niedrigeren Konzentrationen (in Abbildung 1: Expositionen II, III oder IV') oder bei höheren Konzentrationen von kürzerer Dauer (in Abbildung 1: Exposition IV) durchgeführt, wobei angepasste Zeiträume mit geringerem Abstand verwendet werden.
5. Die Prüfung (Ausgangskonzentration und zusätzliche Konzentrationen) wird mit je einem Tier beider Geschlechter je Konzentration/Zeitpunkt oder zwei Tieren des empfindlicheren Geschlechts je Konzentration/Zeitpunkt durchgeführt. Unter bestimmten Umständen kann der Studienleiter entscheiden, je zwei Ratten beider Geschlechter je Konzentration/Zeitpunkt (oder vier Tiere des empfindlicheren Geschlechts je Konzentration/Zeitpunkt) zu verwenden (15). Die Verwendung von zwei Tieren je Geschlecht je Konzentration/Zeitpunkt verringert im Allgemeinen Verzerrungen und Schwankungen der Schätzungen, erhöht die Quote der zutreffenden Schätzungen und verbessert die Abdeckung des Konfidenzintervalls gegenüber dem hier beschriebenen Protokoll. GD 39 (2) enthält nähere Hinweise.
6. Im Idealfall wird jede Exposition innerhalb eines Tages durchgeführt. Bei dieser Vorgehensweise kann die nächste Exposition auf einen Zeitpunkt gelegt werden, an dem mit angemessener Gewissheit vom Überleben der Tiere ausgegangen werden kann. Außerdem kann der Studienleiter die Zielkonzentration und Dauer der nächsten Exposition anpassen. Es empfiehlt sich, jede Exposition mit der Gruppe zu beginnen, die am längsten exponiert sein wird, z.B. die 240-Minuten-Gruppe, gefolgt von der 120-Minuten-Gruppe usw. Wenn beispielsweise Tiere in der 240- Minuten-Gruppe nach 90 Minuten sterben oder deutliche Toxizitätszeichen aufweisen (wie extreme Veränderungen der Atmung, z.B. Atemnot), wäre es nicht sinnvoll, eine Gruppe für 120 Minuten der Prüfsubstanz auszusetzen, da die Mortalität wahrscheinlich 100 % betragen würde. Der Studienleiter sollte dann für diese Konzentration eine kürzere Expositionsdauer festlegen (z.B. 90, 65, 45, 33 und 25 Minuten).
7. Die Konzentration in der Kammer sollte häufig gemessen werden, um für jede Expositionsdauer die zeitgewichtete Durchschnittskonzentration zu bestimmen. Soweit möglich, sollte bei jedem Tier der Todeszeitpunkt (nicht die Expositionsdauer) für die statistische Analyse verwendet werden.
8. Die Ergebnisse der ersten vier Expositionen sollten auf Datenlücken in der Konzentrations-Zeit-Kurve geprüft werden (siehe Abbildung 1). Wenn eine unzureichende Annäherung gegeben ist, kann eine zusätzliche Exposition (fünfte Konzentration) durchgeführt werden. Konzentration und Expositionsdauer der fünften Exposition sollten so gewählt werden, dass diese Lücke geschlossen wird.
9. Die Konzentrations-Zeit-Wirkungsbeziehung wird durch statistische Analyse unter Einbeziehung aller Expositionen (einschließlich der Exposition I) berechnet (16). Soweit möglich, sollten für jedes c-x-t-Intervall die zeitgewichtete Durchschnittskonzentration und die Expositionsdauer bis zum Tod (falls der Tod während der Exposition eintritt) verwendet werden.
Abbildung 1 Hypothetische Darstellung einer Konzentrations-Zeit-Mortalitäts-Beziehung bei Ratten
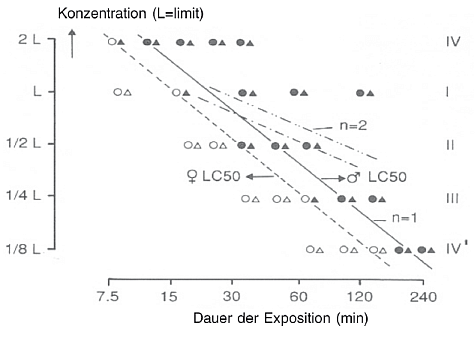
Offene Symbole = überlebende Tiere; geschlossene Symbole = tote Tiere
Dreiecke = Weibchen; Kreise = Männchen
Durchgezogene Linie = LC50 -Werte (Bereich 7,5-240 min) für männliche Tiere mit n = 1
Gestrichelte Linie = LC50-Werte (Bereich 7,5-240 min) für weibliche Tiere mit n = 1
Gestrichelt-gepunktete Linien = hypothetische LC 50 -Werte für männliche und weibliche Tiere, falls n = 2 war (12).
Glossar
Konzentration:
Dauer der Exposition:
10. Beispiel für das schrittweise Verfahren:
Exposition I - Prüfung bei der Grenzkonzentration (siehe Abbildung 1)
- 1 Tier/Geschlecht je Konzentration/Zeitpunkt; 10 Tiere insgesamt a
- Zielkonzentration b = Grenzkonzentration
- Exposition von fünf Gruppen von Tieren bei dieser Zielkonzentration für eine Dauer von 15, 30, 60, 120 bzw. 240 Minuten
↓
Exposition II c - Hauptstudie
- 1 Tier/Geschlecht je Konzentration/Zeitpunkt; 10 Tiere insgesamt
- Exposition von fünf Gruppen von Tieren bei niedrigerer Konzentration d) (1/2L) mit etwas längerer Expositionsdauer (Abstand Faktor √2; siehe Abbildung 1).
↓
Exposition III - Hauptstudie
- 1 Tier/Geschlecht je Konzentration/Zeitpunkt; 10 Tiere insgesamt
- Exposition von fünf Gruppen von Tieren bei niedrigerer Konzentration d (1/4L) mit etwas längerer Expositionsdauer (Abstand Faktor √2; siehe Abbildung 1).
↓
Exposition IV' - Hauptstudie
- 1 Tier/Geschlecht je Konzentration/Zeitpunkt; 10 Tiere insgesamt
- Exposition von fünf Gruppen von Tieren bei niedrigerer Konzentration d (1/8L) mit etwas längerer Expositionsdauer (Abstand Faktor √2; siehe Abbildung 1).
↓ oder
Exposition IV - Hauptstudie
- 1 Tier/Geschlecht je Konzentration/Zeitpunkt; 10 Tiere insgesamt
- Exposition von fünf Gruppen von Tieren bei höherer Konzentration e (2L) mit etwas kürzerer Expositionsdauer (Abstand Faktor √2; siehe Abbildung 1).
Mathematische Aufbereitung der Ergebnisse für das c-x-t-Protokoll
11. Ein c-x-t-Verfahren mit 4 oder 5 Expositionskonzentrationen und fünf Expositionszeiträumen ergibt 20 bzw. 25 Datenpunkte. Anhand dieser Datenpunkte kann die c-x-t-Beziehung durch statistische Analyse berechnet werden (16):
Gleichung 1
Probit(P) = b0 + b1ln C + b2ln t
dabei ist: C = Konzentration; t = Expositionsdauer oder
Gleichung 2
Response = ƒ(Cnt)
dabei ist: n = b1/b2:
Mit der Gleichung 1 kann der LC50-Wert für einen bestimmten Zeitraum (z.B. 4 Stunden, 1 Stunde, 30 Minuten oder jeden Zeitraum innerhalb des geprüften Zeitbereichs) unter Verwendung von P = 5 (50 % Response) berechnet werden. Die Habersche Regel gilt nur, wenn n = 1. Der LC01-Wert kann unter Verwendung von P = 2,67 berechnet werden.
____
a) Liegen keine Informationen über geschlechtsspezifische Empfindlichkeit vor, sind Ratten beider Geschlechter zu verwenden, d. h. 1 Tier/Geschlecht je Konzentration. Auf der Grundlage der vorhandenen Informationen, oder falls sich im Laufe der Exposition zeigt, dass ein Geschlecht empfindlicher ist, werden während der weiteren Prüfung auf jeder Konzentrationsstufe 10 Tiere des empfindlichen Geschlechts (2 Tiere je Konzentration/Zeitpunkt) verwendet.
b) Wird die Verordnung (EG) Nr. 1272/2008 zugrunde gelegt, so betragen die Grenzkonzentrationen für Gase, Dämpfe und Aerosole 20.000 ppm, 20 mg/l bzw. 5 mg/l. Wenn mit Toxizität gerechnet wird oder die Ergebnisse der Vorstudie darauf hindeuten, sollten niedrigere Ausgangskonzentrationen gewählt werden. Bei regulatorischer oder wissenschaftlicher Notwendigkeit können höhere Konzentrationen verwendet werden.
c) Im Idealfall sollten die Tiere erst dann der nächsten Konzentrationsstufe ausgesetzt werden, wenn mit angemessener Gewissheit vom Überleben der zuvor getesteten Tiere ausgegangen werden kann. Dies gibt dem Studienleiter die Möglichkeit, Zielkonzentration und Dauer für die nächste Exposition anzupassen.
d) Die kleinste Dosis (Konzentration x Zeit), die während der Prüfung bei der Ausgangskonzentration (Exposition I) zu einem Todesfall geführt hat, dient als Anhaltspunkt für die Festlegung der nächsten Kombination von Konzentration und Expositionsdauer. Normalerweise wird die Konzentration halbiert (1/2L), und die Tiere werden für eine neue, feiner unterteilte Zeitspanne exponiert, wobei die Expositionszeiten eine geometrische Folge mit dem Faktor 1,4 (√2, siehe Literaturangabe 11) bilden, in deren Mitte diejenige Zeitdauer liegt, die der kleinsten letalen Dosisstufe (Zeit x Konzentration) entspricht, die bei der ersten Exposition beobachtet wurde. In dieser Abbildung 1 wurde bei der Exposition I nach 15 Minuten der erste Todesfall beobachtet. Die Zeiträume der Exposition II liegen daher um 30 Minuten und betragen 15, 21, 30, 42 und 60 Minuten. Es wird dringend empfohlen, die Daten nach den ersten beiden Expositionen wie in der obigen Abbildung grafisch darzustellen und zu prüfen, ob die Beziehung zwischen Konzentration und Zeit einen Winkel von 45° (n = 1) aufweist oder ob die Konzentrations-Zeit-Wirkungsbeziehung weniger steil (z.B. n = 2) oder steiler (z.B. n = 0,8) ist. In den letztgenannten Fällen wird dringend empfohlen, die nächsten Konzentrationen und Expositionszeiträume entsprechend anzupassen.
e) In bestimmten Fällen muss möglicherweise die Konzentration erhöht (2L) und eine neue, noch feiner unterteilte Zeitspanne festgelegt werden, wobei die Expositionszeiten eine geometrische Folge mit dem Faktor 1,4 (√2) bilden, in deren Mitte diejenige Zeitdauer liegt, die der kleinsten letalen Dosis entspricht, die bei der ersten Exposition beobachtet wurde. Die Mindestexpositionsdauer sollte möglichst mehr als 5 Minuten betragen; die Höchstexpositionsdauer sollte 8 Stunden nicht überschreiten.
B.3 Akute Toxizität (dermal) 23
Die vollständige Beschreibung dieser Prüfmethode wurde gestrichen.
Die gleichwertige internationale Prüfmethode ist in Teil 0 Tabelle 2 aufgeführt.
1.1 Einleitung
Siehe allgemeine Einleitung zu Teil B (Punkt A).
1.2 Definitionen
Siehe allgemeine Einleitung zu Teil B (Punkt B).
1.3 Bezugssubstanzen
Keine.
1.4 Prinzip der Methode
Die Prüfsubstanz wird in abgestuften Dosierungen mehreren Versuchstiergruppen auf die Haut aufgetragen, und zwar eine Dosierung je Gruppe. Anschließend werden die beobachteten Vergiftungserscheinungen und Todesfälle registriert. Tiere, die während des Versuchs sterben, sowie die bei Versuchsende überlebenden Tiere werden seziert.
Tiere mit starken und anhaltenden Anzeichen von Leiden und Schmerzen können vorzeitig getötet werden; Substanzen, von denen bekannt ist, dass sie auf diesem Wege aufgrund ihrer ätzenden oder reizenden Wirkungen ausgeprägte Schmerzen und Leiden verursachen, brauchen nicht geprüft zu werden.
1.5 Qualitätskriterien
Keine.
1.6 Beschreibung der Methode
1.6.1 Vorbereitung
Vor der Untersuchung werden die Tiere für einen Zeitraum von mindestens 5 Tagen unter experimentellen Haltungs- und Fütterungsbedingungen in geeigneten Käfigen eingewöhnt. Vor Versuchsbeginn werden gesunde, junge erwachsene Tiere randomisiert und den einzelnen Behandlungsgruppen zugeordnet. Etwa 24 Stunden vor Versuchsbeginn wird das Fell der Versuchstiere auf dem Rücken durch Scheren oder Rasieren entfernt. Beim Scheren oder Abrasieren des Fells ist darauf zu achten, dass die Haut nicht verletzt wird, da dies zu einer Veränderung der Durchlässigkeit führen könnte. Mindestens 10 % der Körperoberfläche wird für die Applikation der Prüfsubstanz vorbereitet. Werden feste Stoffe verwendet, die gegebenenfalls pulverisiert werden können, sollte die Prüfsubstanz ausreichend mit Wasser oder ggf. einem geeigneten Vehikel angefeuchtet werden, um einen guten Kontakt mit der Haut sicherzustellen. Bei der Verwendung eines Vehikels ist dessen Einfluss auf das Eindringen der Prüfsubstanz in die Haut zu berücksichtigen. Flüssige Prüfsubstanzen werden im Allgemeinen unverdünnt angewendet.
1.6.2 Prüfbedingungen
1.6.2.1 Versuchstiere
Es können erwachsene Ratten oder Kaninchen verwendet werden. Auch andere Tierarten können verwendet werden, jedoch muss ihre Verwendung begründet werden. Es sollen bekannte Versuchstierstämme verwendet werden. Für jedes Geschlecht sollte die Schwankung des Körpergewichts der Tiere des jeweiligen Versuchs bei Versuchsbeginn nicht mehr als ± 20 % vom entsprechenden Mittelwert betragen.
1.6.2.2 Anzahl und Geschlecht
Mindestens 5 Tiere sind für jede Konzentration zu verwenden. Sie sollten alle vom gleichen Geschlecht sein. Wenn weibliche Tiere benutzt werden, dürfen diese weder geworfen haben noch trächtig sein. Wenn es Hinweise darauf gibt, dass ein Geschlecht deutlich empfindlicher reagiert, sollten Tiere dieses Geschlechts verwendet werden.
Anmerkung: Bei Prüfungen der akuten Toxizität an Tieren, die einer höheren Ordnung angehören als Nagetiere, sollte die Verwendung einer geringeren Anzahl an Tieren in Betracht gezogen werden. Die Dosierungen sollten sorgfältig ausgewählt und großer Wert darauf gelegt werden, mäßig toxische Dosierungen nicht zu überschreiten. Bei solchen Versuchen sollte die Verabreichung der Prüfsubstanz in letalen Dosen vermieden werden.
1.6.2.3 Dosierungen
Die Dosisgruppen (mindestens 3) sollten ausreichen, um nach entsprechenden Abstufungen Versuchsgruppen mit unterschiedlichen toxischen Wirkungen und Mortalitätsraten zu erhalten. Bei der Festlegung der Dosierungen sollte eine mögliche reizende oder ätzende Wirkung berücksichtigt werden. Die erhaltenen Daten sollten ausreichen, um eine Dosis-Wirkungs-Kurve aufzuzeigen und - soweit möglich - eine annehmbare Bestimmung der LD50 erlauben.
1.6.2.4 Limit-Test
Es kann ein Limit-Test mit einer einzigen Dosierung von mindestens 2.000 mg/kg Körpergewicht an einer Gruppe von 5 männlichen und 5 weiblichen Tieren unter Verwendung der oben beschriebenen Verfahren durchgeführt werden. Wenn substanzbedingte Todesfälle festgestellt werden, sollte ein vollständiger Test erwogen werden.
1.6.2.5 Beobachtungszeitraum
Der Beobachtungszeitraum sollte mindestens 14 Tage betragen. Die Dauer der Beobachtung soll jedoch nicht starr festgelegt werden. Sie soll von der Art des Vergiftungsbildes, dem zeitlichen Auftreten der Symptome und der Dauer der Erholungsphase abhängig gemacht werden. Die Beobachtungszeit ist zu verlängern, falls es sich als notwendig erweist. Der Zeitpunkt, zu dem Vergiftungserscheinungen auftreten und wieder abklingen, ihre Dauer sowie der Zeitpunkt des Todes sind von Bedeutung, vor allem dann, wenn Anzeichen für eine verzögerte Mortalität erkennbar sind.
1.6.3 Versuchsdurchführung
Die Tiere sollen einzeln in Käfigen gehalten werden. Die Prüfsubstanz ist einheitlich auf einen Bereich aufzutragen, der etwa 10 % der Körperoberfläche entspricht. Bei hochtoxischen Substanzen kann die behandelte Oberfläche kleiner sein; es sollte jedoch ein möglichst großer Bereich mit einer möglichst dünnen und einheitlichen Schicht behandelt werden.
Die Prüfsubstanz muss während einer Expositionszeit von 24 Stunden mittels eines porösen Mullverbandes und eines nicht reizenden Pflasters Kontakt mit der Haut haben. Die Versuchsfläche ist außerdem auf geeignete Art abzudecken, um den Mullverband und die Prüfsubstanz zu fixieren und sicherzustellen, dass die Tiere die Prüfsubstanz nicht oral aufnehmen können. Es können auch Mittel zur Einschränkung der Bewegungsfreiheit angewendet werden, damit die Tiere die Prüfsubstanz nicht oral aufnehmen können; eine vollständige Immobilisierung ist jedoch nicht zu empfehlen.
Nach Ablauf der Expositionszeit werden die Reste der Prüfsubstanz entfernt, soweit möglich unter Verwendung von Wasser oder mit einem anderen geeigneten Hautreinigungsverfahren.
Die Beobachtungen sind systematisch aufzuzeichnen. Für jedes Tier sind individuelle Aufzeichnungen anzufertigen. Am ersten Tag sind die Tiere häufig zu beobachten. Mindestens einmal pro Werktag sollte eine sorgfältige klinische Untersuchung erfolgen. Andere tägliche Beobachtungen und entsprechende Vorkehrungen sollen dem Ziel dienen, den Verlust an Tieren für die Studie weitestgehend einzuschränken, z.B. durch Autopsie oder Kühlung tot aufgefundener Tiere und durch Isolierung oder Tötung schwacher oder sterbender Tiere.
Die Beobachtungen beinhalten Veränderungen von Fell, behandelter Haut, Augen, Schleimhäuten, Atmung und Kreislauf, autonomem und zentralem Nervensystem sowie an der Somatomotorik und am Verhaltensmuster. Besonderes Augenmerk ist auf Tremor, Konvulsionen, Salivation, Diarrhö, Lethargie, Schlaf und Koma zu richten. Der Zeitpunkt des Todes ist so genau wie möglich festzuhalten. Die während des Versuchs gestorbenen und die bis zum Abschluss des Versuchs überlebenden Tiere werden seziert. Alle pathologischen Veränderungen sind zu protokollieren. Falls erforderlich, sollten Gewebe für eine histopathologische Untersuchung entnommen werden.
Bewertung der Toxizität beim jeweils anderen Geschlecht
Nach Beendigung des Versuchs mit Tieren eines bestimmten Geschlechts wird die Prüfsubstanz mindestens einer Gruppe von 5 Tieren des jeweils anderen Geschlechts verabreicht, um festzustellen, ob Tiere dieses Geschlechts nicht deutlich empfindlicher auf die Substanz reagieren. Unter bestimmten Bedingungen kann die Verwendung einer geringeren Anzahl von Tieren gerechtfertigt sein. Wenn ausreichend Hinweise dafür vorliegen, dass die Tiere des geprüften Geschlechts deutlich empfindlicher reagieren, kann auf eine Prüfung der Tiere des jeweils anderen Geschlechts verzichtet werden.
2. Daten
Die Daten sind in tabellarischer Form zusammenzufassen. Daraus müssen für jede Versuchsgruppe die Zahl der Tiere zu Beginn des Versuchs, der Zeitpunkt des Todes der einzelnen Tiere, die Zahl der Tiere mit weiteren Anzeichen der Giftwirkung, die Beschreibung der toxischen Wirkungen und die Sektionsbefunde hervorgehen. Die Bestimmung des Gewichts der einzelnen Tiere erfolgt unmittelbar vor Verabreichung der Prüfsubstanz, danach in wöchentlichen Abständen und zum Zeitpunkt des Todes. Gewichtsveränderungen sind zu bestimmen und aufzuzeichnen, sofern die Tiere länger als einen Tag überleben. Tiere, die aufgrund substanzbedingter Leiden und Schmerzen vorzeitig getötet werden, werden als substanzbedingte Todesfälle registriert. Die LD50 ist mit einer anerkannten Methode zu berechnen.
Die Auswertung sollte auch - soweit vorhanden - die Beziehung zwischen Verabreichungsdosis sowie Auftreten und Schweregrad aller Abnormitäten einschließlich Verhaltensänderungen, klinischer Symptome, schwerer Schäden, Körpergewichtsveränderungen, Mortalität und sonstiger toxikologischer Wirkungen umfassen.
3. Abschlussbericht
3.1 Prüfbericht
Im Prüfbericht ist, wenn möglich, Folgendes anzugeben:
- Tierart, Stamm, Herkunft, Haltungsbedingungen, Futter, usw.;
- Versuchsbedingungen (einschließlich des Hautreinigungsverfahrens und der Art des Verbandes: okklusiv oder semiokklusiv);
- Dosierungen (ggf. mit Vehikel, falls verwendet, und Konzentrationen);
- Geschlecht der behandelten Tiere;
- Auflistung der Daten nach Geschlecht und Dosierung (Zahl der während des Versuchs gestorbenen oder getöteten Tiere, Zahl der Tiere mit Vergiftungserscheinungen, Zahl der exponierten Tiere);
- Zeitpunkt des Todes nach Auftragen der Prüfsubstanz, Gründe und Kriterien für das vorzeitige Töten der Tiere;
- sämtliche Beobachtungen;
- LD50-Wert für das Geschlecht, das einem vollständigen Versuch unterzogen wurde, Bestimmung nach 14 Tagen (unter Angabe der Berechnungsmethode);
- 95 %-Vertrauensbereich für die LD50 (soweit möglich);
- Dosis/Mortalitätskurve und Slope-Faktor (falls durch die Bestimmungsmethode möglich);
- Sektionsbefunde;
- ggf. histopathologische Befunde;
- ggf. Ergebnisse aus Versuchen mit Tieren des jeweils anderen Geschlechts;
- Diskussion der Ergebnisse (besondere Beachtung sollte dem Einfluss geschenkt werden, der das vorzeitige Töten von Tieren während des Versuchs auf den errechneten LD50-Wert haben kann);
- Interpretation der Ergebnisse.
3.2 Bewertung und Interpretation
Siehe allgemeine Einleitung zu Teil B (Punkt D).
4. Literatur
Siehe allgemeine Einleitung zu Teil B (Punkt E).
B.4 Akute Hautreizung/verätzung
1. Diese Prüfmethode entspricht der OECD-Prüfrichtlinie (TG) 404 (2015). Die OECD-Richtlinien für die Prüfung von Chemikalien werden regelmäßig überprüft, um sicherzustellen, dass sie auf den besten verfügbaren wissenschaftlichen Erkenntnissen beruhen. Bei der Prüfung der OECD TG 404 wurde besonderes Augenmerk auf mögliche Verbesserungen im Hinblick auf Belange des Tierschutzes und auf die Auswertung aller bereits vorhandenen Angaben über die Chemikalie gelegt, um unnötige Versuche an Labortieren zu vermeiden. Die aktualisierte Fassung der OECD TG 404 (1981 ursprünglich angenommen und 1992, 2002 und 2015 geändert) enthält Verweise auf das IATA-Leitliniendokument (Integrated Approaches to Testing and Assessment = integrierte Prüfungs- und Bewertungsansätze) zu Hautreizungen/-verätzungen (1), in dem ein modularer Ansatz für Prüfungen auf Hautreizungen und -verätzungen vorgeschlagen wird. Die IATA beschreiben mehrere Module, in denen Informationsquellen und Analyseinstrumente zu Gruppen zusammengefasst werden. Sie enthalten i) Leitlinien dazu, wie vorhandene Daten aus Versuchen und aus anderen Quellen integriert und verwendet werden können, um das Hautreizungs- und das Hautverätzungspotenzial von Chemikalien zu bewerten, und ii) einen Vorschlag zur Durchführung ggf. erforderlicher weiterer Versuche (1). Zudem wird in dieser Leitlinie empfohlen, beim Invivo-Vorversuch erforderlichenfalls die drei Mullläppchen, mit denen die Prüfchemikalie aufgetragen wird, nacheinander und nicht gleichzeitig am Körper des Tieres zu fixieren.
2. Definitionen der Begriffe Hautreizung und Hautverätzung sind der Anlage zu dieser Prüfmethode zu entnehmen.
Ausgangsüberlegungen
3. Im Interesse wissenschaftlicher Verlässlichkeit und des Tierschutzes sollten Invivo-Prüfungen erst dann in Erwägung gezogen werden, wenn alle für das Hautverätzungs-/-reizungspotenzial der Prüfchemikalie verfügbaren einschlägigen Daten auf Basis ihrer Beweiskraft (weightof-evidence, WoE) ausgewertet worden sind, wie in den integrierten Prüfungs- und Bewertungsansätzen für Hautverätzungen und -reizungen (d. h. in den drei Teilen dieses Leitliniendokuments und in den betreffenden Modulen) beschrieben (1). In Teil 1 werden vorhandene Daten in sieben Modulen unter Berücksichtigung von Humandaten, Invivo-Daten, Invitro-Daten und Daten zu physikalisch-chemischen Eigenschaften (pH-Wert, insbesondere starke Azidität oder Alkalität, usw.) sowie von Daten behandelt, die nicht auf der Verwendung von Prüfmethoden beruhen. In Teil 2 wird die Durchführung einer WoE-Analyse beschrieben. Wenn diese WoE-Analyse noch nicht zu einem schlüssigen Ergebnis führt, sollten weitere Prüfungen durchgeführt werden, wie in Teil 3 beschrieben. Dabei sollte mit In- vitro-Methoden begonnen werden. Invivo-Prüfungen sollten erst als letzte Möglichkeit in Betracht gezogen werden. Diese Analyse soll somit dazu führen, dass weniger Invivo-Prüfungen zum Hautverätzungs-/-reizungspotenzial von Prüfchemikalien durchgeführt werden, wenn aus anderen Studien zu diesen beiden Endpunkten bereits ausreichende Belege verfügbar sind.
Prinzip der in-vivo-Prüfung
4. Die Prüfchemikalie wird in einmaliger Dosierung auf die Haut eines Versuchstiers aufgetragen; nicht behandelte Hautareale dienen als Kontrolle. Der Grad der Reizung/Verätzung wird in zuvor festgelegten Zeitabständen bestimmt und bewertet und anschließend beschrieben, um eine umfassende Beurteilung der Wirkung vornehmen zu können. Die Beobachtungsdauer sollte ausreichend sein, um die Reversibilität bzw. Irreversibilität der Wirkungen vollständig zu erfassen,
5. Tiere mit starken und anhaltenden Anzeichen von Leiden und/oder Schmerzen sollten jederzeit während des Versuchs human getötet werden, wobei die Prüfchemikalie entsprechend einzustufen ist. Kriterien für die Entscheidung über die humane Tötung moribunder Tiere mit starken Leidensanzeichen sind Gegenstand eines gesonderten Leitfadens (2).
Vorbereitung der in-vivo-Prüfung
Auswahl von Versuchstierarten
6. Das bevorzugte Labortier ist das Albino-Kaninchen. Für diese Prüfung sind gesunde junge geschlechtsreife Kaninchen zu verwenden. Die Verwendung anderer Spezies ist zu begründen.
Vorbereitung der Versuchstiere
7. Etwa 24 Stunden vor dem Versuch wird das Fell auf dem Rücken der Versuchstiere gründlich geschoren. Dabei ist darauf zu achten, dass die Haut nicht verletzt wird. Es sind nur Tiere mit gesunder, unverletzter Haut zu verwenden.
8. Einige Kaninchenrassen haben Stellen mit dichtem Fellbewuchs, die zu bestimmten Zeiten im Jahr deutlicher hervortreten. An diesen Stellen sollte keine Prüfung durchgeführt werden.
Haltungs- und Fütterungsbedingungen
9. Die Tiere sollten einzeln gehalten werden. Die Temperatur im Versuchstierraum sollte für Kaninchen 20 °C (± 3 °C) betragen. Obwohl die relative Luftfeuchtigkeit mindestens 30 % betragen und außer bei der Reinigung vorzugsweise nicht über 70 % liegen sollte, ist ein Wert von 50-60 % anzustreben. Für die Beleuchtung ist Kunstlicht zu verwenden und so zu schalten, dass sich 12 Stunden Licht mit 12 Stunden Dunkelheit abwechseln. An die Versuchstiere kann herkömmliches Laborfutter verfüttert werden, wobei eine unbegrenzte Trinkwasserversorgung zu gewährleisten ist.
Applikation der Prüfchemikalie
10. Die Prüfchemikalie sollte auf eine kleine Hautfläche (etwa 6 cm2) aufgetragen und mit einem Mullläppchen abgedeckt werden, das mit einem nicht reizenden Pflaster fixiert wird. Wenn eine direkte Applikation nicht möglich ist (z.B. bei Flüssigkeiten oder bestimmten Pasten), sollte die Prüfchemikalie zunächst auf das Mullläppchen gegeben werden, das anschließend auf der Haut fixiert wird. Für die Dauer der Exposition sollte das Läppchen mit einem geeigneten Semi-Okklusiv-Verband lose auf der Haut gehalten werden. Wird die Prüfchemikalie auf ein Läppchen aufgebracht, so ist dieses so auf der Haut zu fixieren, dass ein guter Hautkontakt und die gleichmäßige Verteilung der Prüfchemikalie auf der Haut gewährleistet sind. Es ist dafür zu sorgen, dass das Tier nicht an das Mullläppchen gelangt und die Prüfchemikalie nicht oral aufnehmen oder inhalieren kann.
11. Flüssige Prüfchemikalien werden gewöhnlich unverdünnt verwendet. Wird der Versuch mit Feststoffen durchgeführt (die im Bedarfsfall pulverisiert werden können), sollte die Prüfchemikalie mit gerade so viel Wasser (bzw. gegebenenfalls mit einem anderen geeigneten Vehikel) angefeuchtet werden, dass ein guter Kontakt mit der Haut sichergestellt ist. Bei Verwendung eines anderen Vehikels als Wasser sollte dessen möglicher Einfluss auf eine Reizung der Haut durch die Prüfchemikalie minimal sein.
12. Nach Ablauf der Expositionszeit, die in der Regel 4 Stunden beträgt, wird die restliche Prüfchemikalie möglichst mit Wasser oder einem geeigneten Lösungsmittel entfernt, ohne die bestehende Reaktion oder die Integrität der Epidermis zu beeinträchtigen.
Dosierung
13. Bei Flüssigkeiten werden 0,5 ml und bei Feststoffen oder Pasten 0,5 g auf die vorbereitete Hautstelle aufgetragen.
Vorversuch (Invivo-Prüfung auf Hautreizung/-verätzung an einem Tier)
14. Wenn eine Prüfchemikalie aufgrund einer WoE-Analyse oder früherer Invitro-Prüfungen entweder als ätzend oder reizend oder als nicht klassifiziert eingestuft wurde, sind weitere Invivo-Prüfungen im Allgemeinen nicht erforderlich. Erscheint allerdings die Ermittlung zusätzlicher Daten gerechtfertigt, wird die Invivo-Prüfung zunächst mit nur einem Versuchstier wie im Folgenden beschrieben durchgeführt. Dem Tier werden dann bis zu drei Mullläppchen nacheinander appliziert. Das erste Läppchen wird nach drei Minuten entfernt. Wird keine schwere Hautreaktion festgestellt, wird ein zweites Läppchen an einer anderen Stelle appliziert, das nach einer Stunde entfernt wird. Lassen die Beobachtungen zu diesem Zeitpunkt den Schluss zu, dass eine Exposition für die Dauer von vier Stunden ethisch verantwortbar ist, wird ein drittes Läppchen appliziert und nach vier Stunden entfernt. Anschließend wird die Reaktion bewertet.
15. Der Versuch wird sofort abgebrochen, falls nach einer der drei sequenziellen Expositionen eine ätzende Wirkung beobachtet wird. Ist nach der Entfernung des letzten Läppchens keine Verätzung feststellbar, wird das Tier 14 Tage lang beobachtet, sofern nicht vor Ablauf dieser Zeit Verätzungen auftreten.
16. Geht man davon aus, dass die Prüfchemikalie zwar keine hautätzende Wirkung hat, aber Hautreizungen hervorrufen kann, sollte nur ein Tier verwendet werden, dem ein einziges Läppchen für die Dauer von vier Stunden appliziert wird.
Bestätigungsprüfung (Invivo-Prüfung auf hautreizende Wirkungen an zusätzlichen Tieren)
17. Wird im Vorversuch keine ätzende Wirkung beobachtet, sollte die Reizungsreaktion bzw. die negative Reaktion an bis zu zwei weiteren Tieren mit jeweils einem Läppchen bei einer Expositionsdauer von vier Stunden bestätigt werden. Ergibt der Vorversuch eine Reizungswirkung, kann die Bestätigungsprüfung als sequenzieller Versuch bzw. durch gleichzeitige Exposition von zwei weiteren Tieren durchgeführt werden. Findet ausnahmsweise kein Vorversuch statt, können zwei bzw. drei Tiere mit einem Läppchen behandelt werden, das nach vier Stunden entfernt wird. Bei Verwendung von zwei Versuchstieren, die beide die gleiche Reaktion zeigen, erübrigen sich weitere Untersuchungen. Andernfalls wird auch das dritte Tier geprüft. Unklare Reaktionen könnten möglicherweise bewertet werden, indem Versuche mit weiteren Tieren durchgeführt werden.
Beobachtungszeitraum
18. Der Beobachtungszeitraum sollte so bemessen sein, dass die Reversibilität der festgestellten Wirkungen vollständig bewertet werden kann. Allerdings sollte der Versuch abgebrochen werden, sobald das betreffende Tier starke und anhaltende Anzeichen von Leiden und Schmerzen zeigt. Um feststellen zu können, ob die Wirkungen reversibel sind, sollten die Tiere für die Dauer von bis zu 14 Tagen nach Entfernung der Läppchen beobachtet werden. Bilden sich die Schäden vor Ablauf dieser 14 Tage zurück, sollte der Versuch zum betreffenden Zeitpunkt beendet werden.
Klinische Beobachtungen und Bewertung von Hautreaktionen
19. Die Tiere sind auf Anzeichen von Hautrötungen und Ödemen zu untersuchen, wobei die Reaktion 60 Minuten sowie 24, 48 und 72 Stunden nach Entfernen des Läppchens bewertet wird. Beim Vorversuch an einem Tier wird die behandelte Stelle auch unmittelbar nach Entfernen des Läppchens untersucht. Die Hautreaktionen werden bewertet und anhand der Punkteskala in der unten stehenden Tabelle dokumentiert. Bei Hautschädigungen, die nach 72 Stunden weder als Reizung noch als Verätzung eingestuft werden können, ist unter Umständen die Beobachtung bis zum 14. Tag erforderlich, um Aussagen zur Reversibilität der Wirkungen treffen zu können. Neben Hautreizungen sollten alle lokal begrenzten toxischen Wirkungen (z.B. Entfettung der Haut) und alle negativen systemischen Wirkungen (z.B. klinische Anzeichen für Toxizität und Veränderungen des Körpergewichts) vollständig beschrieben und dokumentiert werden. Unklare Reaktionen sollen gegebenenfalls durch eine histopathologische Untersuchung abgeklärt werden.
20. Die Bewertung von Hautreaktionen ist zwangsläufig subjektiv. Um die Einstufung von Hautreaktionen stärker zu vereinheitlichen und den Prüflabors und allen an den Versuchen und an der Auswertung der Versuchsergebnisse Beteiligten die Arbeit zu erleichtern, müssen die Prüfer im Umgang mit der Bewertungsskala (siehe unten stehende Tabelle) entsprechend geschult werden. Dabei könnte sich ein Leitfaden mit Abbildungen zur Bewertung von Hautreizungen und anderen Schädigungen als hilfreich erweisen (3).
Daten und Berichterstattung
21. Die Untersuchungsergebnisse sollten im Abschlussbericht in Tabellenform dargestellt werden und alle in Nummer 24 genannten Punkte umfassen.
Auswertung der Ergebnisse
22. Die Bewertung der Hautreizung sollte anhand der Art und des Schweregrads der Schädigung und deren Reversibilität bzw. Irreversibilität vorgenommen werden. Die einzelnen ermittelten Schweregrade stellen keinen allein gültigen Maßstab für die reizenden Eigenschaften eines Stoffs dar, denn es werden auch andere Effekte der Prüfchemikalie beurteilt. Vielmehr sollten diese einzelnen Graduierungswerte als Referenzwerte betrachtet werden, die zusammen mit allen anderen Ergebnissen der Studie zu beurteilen sind.
23. Bei der Bewertung von hautreizenden Reaktionen spielt auch die Reversibilität der Hautschädigung eine Rolle. Treten Reaktionen wie (begrenzter) Haarausfall, Hyperkeratose, Hyperplasie und Schuppung bis zum Ende des 14-tägigen Beobachtungszeitraums auf, ist die Prüfchemikalie als hautreizende Chemikalie zu betrachten.
Prüfbericht
24. Der Prüfbericht muss die folgenden Angaben enthalten:
Begründung für die Invivo-Prüfung:
- WoE-Analyse von Daten aus früheren Versuchen unter Einbeziehung von Ergebnissen aus der sequenziellen Prüfstrategie;
- Beschreibung aller einschlägigen Daten aus früheren Versuchen;
- Daten, die in den einzelnen Stufen der Prüfstrategie erhoben wurden;
- Beschreibung der durchgeführten Invitro-Prüfungen mit Einzelheiten zu den angewendeten Verfahren sowie zu den Ergebnissen für Prüf-/Referenzstoffe;
- WoE-Analyse als Grundlage für die Durchführung einer Invivo-Studie.
- Einkomponentiger Stoff: chemische Bezeichnung, wie z.B. IUPAC- oder CAS-Bezeichnung, CAS-Nummer, SMILES- oder InChI-Code, Strukturformel, Reinheit, chemische Zusammensetzung von Verunreinigungen, soweit zutreffend und praktisch durchführbar, usw.
- Mehrkomponentiger Stoff: Gemische und Stoffe mit unbekannter oder schwankender Zusammensetzung, komplexe Reaktionsprodukte oder biologische Materialien (UVCB): so weit wie möglich charakterisiert durch die chemische Zusammensetzung (siehe oben), das quantitative Vorkommen und die relevanten physikalisch-chemischen Eigenschaften der einzelnen Komponenten;
- physikalisches Erscheinungsbild, Wasserlöslichkeit und weitere relevante physikalisch-chemische Eigenschaften;
- Herkunft, Chargennummer, sofern vorhanden;
- Behandlung der Prüfchemikalien/Kontrollstoffe vor der Prüfung, sofern relevant (z.B. Erwärmen, Mahlen);
- Stabilität der Prüfchemikalie, letztes Verwendungsdatum oder Datum für erneute Analyse, soweit bekannt;
- Lagerungsbedingungen.
- Angaben zur Identität, (gegebenenfalls) Konzentration; Einsatzvolumen;
- Begründung der Auswahl des Vehikels.
- verwendete Spezies/Rasse, Begründung für den Verzicht auf die Verwendung von Albino- Kaninchen und die Nutzung anderer Tiere;
- Anzahl der Versuchstiere pro Geschlecht;
- Gewicht der einzelnen Tiere bei Versuchsbeginn und -ende;
- Alter der Tiere bei Beginn der Studie;
- Herkunft der Tiere, Haltungsbedingungen, Futter usw.
- Methode der Vorbereitung der Applikationsstelle;
- Angaben zur Art der verwendeten Läppchen sowie zur Patching-Technik;
- Angaben zur Herstellung, Applikation und Entfernung der Prüfchemikalie.
- Tabellarische Erfassung der Bewertung des Schweregrades von Hautreizungs-/-verätzungsreaktionen zu allen Messzeitpunkten für jedes einzelne Versuchstier;
- Beschreibungen aller beobachteten Schädigungen;
- ausführliche Beschreibung von Art und Schwere der festgestellten Hautreizung bzw. -verätzung sowie Angaben zu eventuellen histopathologischen Befunden;
- Beschreibung anderer lokal begrenzter negativer (z.B. Entfettung der Haut) und systemischer Wirkungen neben den Hautreizungen bzw. -verätzungen.
Diskussion der Ergebnisse
(1) OECD (2014). Guidance document on Integrated Approaches to Testing and Assessment for Skin Irritation/Corrosion, Environmental Health and Safety Publications, Series on Testing and Assessment, (No 203), Organisation für wirtschaftliche Zusammenarbeit und Entwicklung, Paris.
(2) OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998.
(3) OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Publications, Series on Testing and Assessment (No 19), Organisation für wirtschaftliche Zusammenarbeit und Entwicklung, Paris.
Tabelle Bewertung von Hautreaktionen
| Kein Erythem... | 0 |
| Sehr leichtes Erythem (kaum wahrnehmbar)... | 1 |
| Klar abgegrenztes Erythem... | 2 |
| Mäßiges bis ausgeprägtes Erythem... | 3 |
| Ausgeprägtes Erythem (dunkelrot) bis hin zur Schorfbildung, so dass eine Bewertung nicht möglich ist... | 4 |
| Höchstmögliche Punktzahl: 4 | |
| Kein Ödem... | 0 |
| Sehr leichtes Ödem (kaum wahrnehmbar)... | 1 |
| Leichtes Ödem (Ränder des betroffenen Areals durch deutliche Schwellung klar abgegrenzt)... | 2 |
| Mäßiges Ödem (Schwellung etwa 1 mm)... | 3 |
| Ausgeprägtes Ödem (Schwellung mehr als 1 mm und über den Expositionsbereich hinaus)... | 4 |
| Höchstmögliche Punktzahl: 4 | |
| Zur Klärung unklarer Reaktionen kann eine histopathologische Untersuchung erfolgen. | |
| Begriffsbestimmungen | Anlage |
| Chemikalie: | Ein Stoff oder Gemisch. |
| Hautreizung: | Das Auslösen einer reversiblen Hautschädigung nach Applikation einer Prüfchemikalie für die Dauer von bis zu 4 Stunden. |
| Hautverätzung: | Das Auslösen einer irreversiblen Hautschädigung, d. h. einer sichtbaren, bis in das Corium reichenden Nekrose der Epidermis nach Applikation einer Prüfchemikalie für die Dauer von bis zu 4 Stunden. Verätzungsreaktionen sind gekennzeichnet durch Geschwüre, Blutungen, blutige Verschorfungen und am Ende des Beobachtungszeitraums von 14 Tagen durch eine auf ein Ausbleichen der Haut zurückzuführende Verfärbung, komplett haarlose Bereiche und Narben. Bei der Beurteilung fragwürdiger Schädigungen ist die Histopathologie mit zu berücksichtigen. |
| Prüfchemikalie: | Ein beliebiger Stoff oder eine beliebige Mischung, der/die nach dieser Methode geprüft wird. |
 | weiter . |  |
...
X
⍂
↑
↓
